Производные сахаринкарбоновой кислоты и гербицидное средство на их основе - RU2154640C2
Код документа: RU2154640C2
Чертежи


Описание
Настоящее изобретение относится к новым гетероциклическим соединениям с гербицидной активностью, в частности к производным сахаринкарбоновой кислоты и гербицидному средству на их основе.
Известны производные сахарина, обладающие гербицидной активностью (см. патент США N 4683233, МКИ: A 01 N 43/40, 28.07.1987 г.).
Задачей изобретения является расширение ассортимента производных сахарина, обладающих гербицидной активностью.
Поставленная
задача решается предлагаемыми производными сахаринкарбоновой кислоты общей формулы (I):

в которой
L, M - водород, алкил с 1-4 атомами углерода, алкоксил с 1-4 атомами углерода, алкилтиогруппа с 1-4 атомами углерода, хлор, метилсульфонил,
Z - водород, алкил с 1-4 атомами углерода, бензил или фенил,
R - водород, алкил с 1-6 атомами углерода;
при условии, что Z не означает метил, фенил или водород, если L и М означают водород, и что 5-карбокси-7-метилсахарин и 5-карбокси-4-хлорсахарин исключены.
Производные сахаринкарбоновой кислоты общей формулы (I) проявляют гербицидную активность и
поэтому они могут представлять
собой активное вещество гербицидного средства, которое наряду с эффективным количеством активного вещества содержит еще обычные инертные носители. Данное гербицидное
средство, являющееся
дополнительным объектом настоящего изобретения, содержит в качестве активного вещества соединение общей формулы (1a)

в которой
R - водород или алкил с 1-6 атомами углерода,
L и М - водород или алкил с 1-4 атомами углерода,
Z - алкил с 1-4 атомами углерода, в эффективном количестве.
Новые производные сахаринкарбоновой кислоты общей формулы (I) можно получать за счет того, что соответствующие бром- или иодзамещенные
производные
сахарина общей формулы (II):

в которой L, М и Z имеют вышеуказанное значение, или соединения формулы (III):

где L и M имеют вышеуказанное значение, a Z' имеет значение радикала Z за исключением водорода, подвергают взаимодействию с монооксидом углерода и водой соответственно, со спиртом, содержащим от одного до шести атомов углерода, в присутствии катализатора на основе переходного металла, такого как палладий, никель, кобальт или родий, и основания при повышенном давлении.
Вышеуказанный способ протекает по следующей схеме:


Катализаторы на основе никеля, кобальта, родия и в особенности палладия могут быть в виде металлов или в форме обычных солей как в виде галоидных соединений, например хлорид палладия-(II), тригидрат хлорида родия-(III); ацетатов, например ацетат палладия-(II); цианидов и т.д., в известных степенях валентности. Далее, они могут быть в виде металлических комплексов с третичными фосфинами, алкилкарбонилов металлов, карбонилов металлов, например как дикобальтоктакарбонил, тетракарбонил никеля; комплексов карбонилов металлов с третичными фосфинами, например как бис-(трифенилфосфин)никельдикарбонил; или закомплексованных с третичными фосфинами солей переходных металлов. Указанная последней форма выполнения в особенности предпочтительна при использовании палладия в качестве катализатора. При этом род фосфиновых лигандов может изменяться в широких пределах. Например, они могут соответствовать следующим формулам:


причем n означает цифры 1, 2, 3 или 4, а остатки R1 R2, R3 и R4 означают низкомолекулярный алкил, например алкил, содержащий от одного до шести атомов углерода, арил, алкиларил, содержащий от одного до четырех атомов углерода в алкильной части, например бензил, фенетил или арилокси-остаток. Арилом, например, является нафтил, антрил и предпочтительно возможно замещенный фенил, причем в отношении заместителей нужно обращать внимание только на их инертность в реакции карбонилирования, в остальном они могут изменяться в широком диапазоне и охватывают все инертные углеродорганические остатки, как алкильные остатки, содержащие от одного до шести атомов углерода, например метил; карбоксильные остатки, как карбоксильная группа, карбоксильная группа, водород которой заменен на металл (где металлом является, например, щелочной металл, щелочноземельный металл) или на ион аммония; или связанные через кислород углеродорганические остатки, как алкоксильные остатки, содержащие от одного до шести атомов углерода.
Фосфиновые комплексы можно получать само по себе известным образом, например как описывается в цитированных вначале документах. Например, исходят из обычных, имеющихся в продаже солей металлов, как хлорид палладия-(II) или ацетат палладия-(II), и добавляют фосфин, например трифенилфосфин, три-(н-бутил)фосфин, дифенилметилфосфин, 1,2-бис(дифенилфосфин)этан. В качестве примера следует указать следующие катализаторы: 1,3- бис(диизопропилфосфин)пропан, три-(п-анизил)фосфин, три-(о- толил)фосфин, 1, 2-бис(дифенилфосфин)бутан, трифенилфосфит. Катализатор также может быть связан с полимерным носителем.
Качество фосфина в расчете на переходный металл обычно составляет от 0 до 20, в особенности от 0,1 до 10 моль- эквивалентов, особенно предпочтительно от 1 до 5 моль-эквивалентов.
Количество переходного металла является некритическим. Естественно, по причине стоимости используют предпочтительнее незначительные количества, например от 0,1 до 10 мол.%, в особенности от 1 до 5 мол.%, в расчете на исходное соединение формулы (II), соответственно (III).
Для получения сахаринкарбоновых кислот, то есть R означает водород, осуществляют взаимодействие с монооксидом углерода и, по меньшей мере, с эквимолярными количествами воды в расчете на исходные вещества формулы (II), соответственно формулы (III). Для получения сложных эфиров, то есть R означает алкоксил с 1 - 4 атомами углерода, предпочтительно используют, по меньшей мере, эквимолярные количества соответствующего спирта. Реагент вода, соответственно спирт с 1-4 атомами углерода, одновременно также может служить в качестве растворителя, то есть максимальное количество является некритическим.
В зависимости от рода исходных веществ и используемых катализаторов, однако, также может оказаться предпочтительным использование вместо реагента другого инертного растворителя или применяемого для карбоксилирования основания в качестве растворителя. В этом случае реагент, как вода, соответственно спирт, обычно используют в количествах от 1 до 10, в особенности от 1 до 5 моль-эквивалентов, в расчете на соединения формулы (II), соответственно формулы (III).
В качестве инертных растворителей для реакций карбоксилирования используют обычные растворители, как углеводороды, такие как, например, толуол, ксилол, гексан, пентан, циклогексан; простые эфиры, такие как, например, метил- трет. -бутиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан; замещенные амиды, такие как, например, диметилформамид; полностью замещенные мочевины, такие как, например, тетраалкилмочевины, содержащие от одного до четырех атомов углерода в алкильной части, или нитрилы, такие как, например, бензонитрил или ацетонитрил.
В предпочтительном варианте осуществления способа один из реагентов, в особенности основание, используют в избытке, так что не требуется никакого дополнительного растворителя.
Пригодными для осуществления способа основаниями являются все инертные основания, которые могут связывать выделяющийся при взаимодействии иодоводород, соответственно бромоводород. Например, здесь следует назвать третичные амины, как триэтиламин, циклические амины, как N-метил-пиперидин или N, N-диметилпиперазин, пиридин, амиды, как N, N-диметилформамид, гидроксиды, карбонаты или гидрокарбонаты щелочных или щелочноземельных металлов, а также тетраалкилзамещенные производные мочевины, как тетраалкилмочевина, содержащая от одного до четырех атомов углерода в алкильной части, например тетраметилмочевина.
Количество основания не является критическим; его обычно используют в пределах от 1 до 10, в особенности от 1 до 5 моль. При одновременном применении основания в качестве растворителя его количество, как правило, соразмеряют так, чтобы реагенты были растворены, причем из практических соображений избегают излишне больших избытков, чтобы снизить расходы, иметь возможность использовать небольшие реакционные сосуды и обеспечить реагентам максимальный контакт.
Во время взаимодействия давление монооксида углерода устанавливают таким образом, чтобы всегда имелся избыток монооксида углерода в расчете на соединение формулы (II), соответственно соединение формулы (III). Предпочтительно давление монооксида углерода при комнатной температуре составляет от 1 до 250 бар, в особенности от 5 до 150 бар.
Карбонилирование, как правило, осуществляют при температурах от 20 до 250oC, в особенности в диапазоне от 30oC до 150oC, непрерывно или периодически. При периодическом осуществлении способа с целью поддерживания постоянного давления в реакционную смесь непрерывно нагнетают монооксид углерода.
Из образующейся реакционной смеси продукты выделяют обычным образом, например путем перегонки.
Необходимые для взаимодействия исходные вещества формулы (II), соответственно (III) известны или их можно получать само по себе известным образом. Их можно получать либо путем окисления с помощью перманганата иодзамещенных 2-метилбензолсульфонамидов, либо из аминосахаридов с помощью реакции Зандмейера. Аминосахариды получают известными способами путем восстановления нитросахаридов, которые со своей стороны либо известны, либо их синтезируют известным из литературы образом, исходя из пригодных нитробензольных производных или бензолсульфонамидов. Сверх того, их можно получать согласно методикам нижепредставленных примеров 1 - 12.
Предлагаемое гербицидное средство может представлять собой любой стандартный препарат в форме концентрата или в форме непосредственно наносимых путем распыления водных растворов, порошков, суспензий, также с высокой процентной концентрацией активных веществ водных, масляных или прочих суспензий или дисперсий, эмульсий, масляных дисперсий, паст, препаратов для опыливания, препаратов для внесения в почву или гранулятов путем опрыскивания, отуманивания, опыливания, разбрасывания или поливки. При выборе формы препарата руководствуются целями применения; эти формы в каждом случае должны обеспечивать по возможности мельчайшее распределение предлагаемых согласно изобретению активных веществ.
В качестве инертных носителей для получения наносимых непосредственно путем распыления растворов, эмульсий, паст или масляных дисперсий используют: фракции минеральных масел с температурой кипения от средней до высокой, как керосин или дизельное масло, далее, масла каменноугольных смол, а также масла растительного или животного происхождения, алифатические, циклические и ароматические углеводороды, например такие как парафины, тетрагидронафталин, алкилированные нафталины или их производные, алкилированные бензолы и их производные, спирты, как метанол, этанол, пропанол, бутанол и циклогексанол, кетоны, как циклогексанон, или сильно полярные растворители, такие как, например, амины, как N-метилпирролидон, или вода.
Водные препараты можно получать из эмульсионных концентратов, суспензий, паст, смачивающихся порошков или диспергируемых в воде гранулятов путем добавления воды. Для получения эмульсий, паст или масляных дисперсий субстраты, сами по себе или растворенные в масле или в растворителе, вместе со смачивателями, прилипателями, диспергаторами или эмульгаторами можно гомогенизировать в воде. Однако также можно получать состоящие из активных веществ, смачивателей, прилипателей, диспергаторов или эмульгаторов и возможно растворителей или масел концентраты, которые пригодны для разбавления водой.
В качестве поверхностно-активных веществ используют соли щелочных металлов, щелочноземельных металлов и аммониевые соли ароматических сульфокислот, таких как, например, лигнинсульфокислота, фенолсульфокислота, нафталинсульфокислота и дибутилнафталинсульфокислота, а также жирных кислот, алкил- и алкиларилсульфонаты, алкилсульфаты, сульфаты простых лауриловых эфиров и сульфаты жирных спиртов, а также соли сульфатированных гекса-, гепта- и октадеканолов, также, как простые гликолевые эфиры жирных спиртов, продукты конденсации сульфированного нафталина и его производных с формальдегидом, продукты конденсации нафталина, соответственно нафталинсульфокислот с фенолом и формальдегидом, полиоксиэтиленоктилфенольные простые эфиры, этоксилированный изооктил-, октил- или нонилфенол, алкилфенилтрибутилфенилполигликолевые простые эфиры, алкиларилполи(простой эфир) спирты, изотридециловый спирт, конденсаты жирных спиртов с этиленоксидом, этоксилированное касторовое масло, простые полиоксиэтиленалкиловые эфиры или простые полиоксипропиленалкиловые эфиры, ацетат простого гликолевого эфира лаурилового спирта, сложные сорбитовые эфиры, лигнинсульфитные щелоки или метилцеллюлозу.
Порошки, препараты для внесения в почву и для опыливания можно получать путем смешения или совместного размалывания активных веществ с твердым носителем.
Грануляты, например грануляты в оболочке, импрегнированные грануляты и гомогенные грануляты, можно получать путем связывания активных веществ с твердыми носителями. Твердыми носителями являются минеральные земли, такие, как, например, кремневые кислоты, силикагели, силикаты, тальк, каолин, известняк, известь, мел, болюс, лесс, глина, доломит, диатомовые земли, сульфат кальция и сульфат магния, оксид магния, размолотые синтетические материалы, удобрения, как сульфат аммония, фосфат аммония, нитрат аммония, мочевины, и растительные продукты, как мука зерновых культур, порошок из древесной коры, древесная мука и мука из ореховой скорлупы, целлюлозный порошок или другие твердые носители.
Предлагаемое средство содержит в общем от 0,01 до 95 мас.%, предпочтительно от 0,5 до 90 мас.%, активного вещества. При этом используют активные вещества с чистотой от 90 % до 100 %, предпочтительно от 95 % до 100% (согласно ЯМР-спектру).
В качестве примеров предлагаемого средства приводятся следующие препараты.
Препарат А
20 масс. частей соединения примера N 22
растворяют в смеси, состоящей из 80 масс. частей алкилированного бензола, 10 масс. частей продукта присоединения
от 8 до 10 молей этиленоксида к одному молю N-моноэтаноламида олеиновой кислоты, 5
масс. частей додецилбензолсульфоната кальция и 5 масс. частей продукта присоединения 40 молей этиленоксида к одному
молю касторового масла.
Путем выливания и тонкого диспергирования раствора в 100 000 масс. частях воды можно получать водную дисперсию, которая содержит 0,02 мас.% активного вещества.
Препарат Б
20 масс. частей соединения примера N 22
растворяют в смеси, состоящей из 40 масс. частей циклогексанона, 30 масс. частей изобутанола, 20 масс. частей
продукта присоединения 7 молей этиленоксида к одному молю изооктилфенола и 10 масс.
частей продукта присоединения 40 молей этиленоксида к одному молю касторового масла. Путем выливания и тонкого
диспергирования раствора в 100 000 масс. частях воды можно получать водную дисперсию,
которая содержит 0,02 мас.% активного вещества.
Препарат В
20 масс. частей активного
вещества примера N 22 растворяют в смеси, состоящей из 25 масс. частей циклогексанона, 65
масс. частей фракции минерального масла с температурой кипения от 210 до 280oC и 10 масс. частей
продукта присоединения 40 молей этиленоксида к одному молю касторового масла.
Путем выливания и тонкого диспергирования раствора в 100 000 масс. частях воды можно получать водную дисперсию, которая содержит 0,02 мас.% активного вещества.
Препарат Г
20 масс. частей активного вещества примера N 22 тщательно смешивают с тремя масс. частями
диизобутилнафталин-а- сульфоната натрия, семнадцатью масс. частями лигнинсульфоната натрия из
отработанного сульфитного щелока и шестьюдесятью масс. частями порошкообразного силикагеля и размалывают в
молотковой дробилке.
Путем тонкого диспергирования смеси в 20 000 масс. частях воды можно получать бульон для опрыскивания, который содержит 0,1 мас.% активного вещества.
Препарат Д
3 масс. части активного вещества примера N 20 смешивают с 97
масс. частями высокодиспергированного каолина. Таким образом получают препарат для опыливания, который
содержит 3 мас.% активного вещества.
Препарат Е
20 масс. частей
активного вещества примера N 22 тщательно смешивают с двумя масс. частями додецилбензолсульфоната кальция, 8
масс. частями простого полигликолевого эфира жирного спирта, 2 масс. частями натриевой
соли продукта конденсации фенола с мочевиной и формальдегидом и 68 масс. частями парафинового минерального масла.
Получают стабильную масляную дисперсию.
В зависимости от цели борьбы с нежелательной растительностью, времени года, вида растений и стадии роста растений норма расхода активного вещества составляет от 0,001 до 3,0 кг активного вещества на гектар.
Нижеследующие примеры поясняют получение исходных веществ.
Пример 1
2-метил-6-ацетаминобензойная кислота:

К раствору 24,8 г (0,62 моль) гидроксида натрия в 500 мл воды добавляют 90,6 г (0,6 моль) 6-метилантраниловой кислоты и затем прикапывают 63,4 г (0,62 моль) ацетангидрида. После дополнительного перемешивания в течение одного часа подкисляют с помощью концентрированной соляной кислоты до pH-значения, равного трем, при охлаждении выпавший осадок отсасывают, промывают водой и высушивают при 50oC в вакууме. Выход составляет 107 г (0,55 моль; 92 % от теоретически рассчитанного количества). Температура плавления составляет от 189 до 190oC.
Пример 2
2-метил-3-нитро-6-ацетаминобензойная кислота:

При -5oC в 271 мл 98%-ной азотной кислоты порциями вносят 106 г (0,55 моль) полученной согласно примеру 1 2-метил-6- ацетаминобензойной кислоты. После дополнительного перемешивания в течение одного часа при 10oC реакционную смесь выливают в смесь 540 г льда с 270 мл воды. Выпавший осадок отсасывают, промывают водой и высушивают при 50oC в вакууме. Выход составляет 75,6 г (0,317 моль; 58% от теоретически рассчитанного количества). Температура плавления составляет от 190 до 191oC.
После продолжительного стояния из фильтрата осаждается содержащий в положении 3 нитрогруппу изомер; его выход составляет 21,3 г (0,089 моль; 16 % от теоретически рассчитанного количества); температура плавления составляет от 180 до 182oC.
Пример 3
2-метил-3-нитро-6-аминобензойная кислота:

К 450 мл 2 н. раствора гидроксида натрия добавляют 75,6 г (0,317 моль) 2-метил-3-нитро-6-ацетаминобензойной кислоты. Затем реакционную смесь нагревают до 95oC и в течение одного часа перемешивают при этой температуре. После охлаждения до 10oC реакционную смесь подкисляют путем добавления 425 мл 2 н. соляной кислоты, выпавший осадок отсасывают, промывают водой и высушивают при 50oC в вакууме. Выход составляет 50,7 г (0,258 моль; 82% от теоретически рассчитанного количества); температура плавления составляет от 183 до 184oC.
Пример 4
Сложный метиловый эфир 2-метил-3-нитро-6-аминобензойной
кислоты:

49,7 г (0,253 моль) 2-Метил-3-нитро-6-аминобензойной кислоты растворяют в 380 мл ацетона и добавляют 43 г (0,51 моль) гидрокарбоната натрия. Затем реакционную смесь кипятят вплоть до прекращения выделения диоксида углерода. К таким образом полученной суспензии 2-метил-3-нитро-6-аминобензоата натрия затем в течение двух часов и при температуре кипения ацетона прикалывают 35,3 г (0,28 моль) диметилсульфата, после чего кипятят с обратным холодильником еще три часа и после этого охлаждают. После выливания реакционной смеси в 1,8 л воды проводят экстракцию метиленхлоридом. После высушивания органической фазы ее концентрируют. Полученное твердое вещество имеет достаточную степень чистоты для последующего превращения (ЯМР-спектр). Выход составляет 50 г (0,238 моль; 94 % от теоретически рассчитанного количества); температура плавления составляет от 92 до 94oC.
Пример 5
Хлорангидрид 2-метоксикарбонил-3-метил-4-нитро- бензолсульфокислоты:

При нагревании 58,5 г (0,278 моль) метилового эфира 2-метил-3-нитро-6-амино-бензойной кислоты растворяют в 280 мл ледяной уксусной кислоты и этот раствор при температуре от 15 до 20oC выливают в 85 мл концентрированной соляной кислоты. Затем при температуре от 5 до 10oC прикапывают раствор 19,3 г (0,28 моль) нитрита натрия в 60 мл воды и дополнительно перемешивают в течение тридцати минут при 5oC. Затем этот раствор соли диазония прикапывают к раствору 374 г диоксида серы в 750 мл ледяной уксусной кислоты, который содержит 14 г хлорида меди-(II) (в виде раствора в 30 мл воды). По окончании выделения азота дополнительно перемешивают еще в течение пятнадцати минут и после этого выливают в 1,4 л воды со льдом. Хлорангидрид сульфокислоты отделяют путем экстракции с помощью 1,2 л метиленхлорида. После высушивания и концентрирования органической фазы получают 73 г (0,25 моль; 90% от теоретически рассчитанного количества) масла, которое согласно ЯМР-спектру (в дейтерохлороформе) представляет собой хлорангидрид 2-метоксикарбонил-3-метил-4- нитро-бензол-сульфокислоты высокой степени чистоты.
Пример 6
4-метил-5-нитросахарин (4-метил-5-нитро-1,1,3- триоксо-2,3-дигидро-1-λ6бенз-[d]изотиазол (согласно номенклатуре Бейльштейна))

К 104 мл 25 %-ного раствора аммиака добавляют 100 мл воды и затем при температуре 10oC прикапывают раствор 48,7 г (0,166 моль) хлорангидрида 2-метоксикарбонил-3-метил-4-нитро- бензолсульфокислоты в 70 мл тетрагидрофурана. После перемешивания в течение трех часов при температуре 25oC реакционную смесь концентрируют в ротационном испарителе, чтобы удалить воду и тетрагидрофуран. Полученный остаток перемешивают с этилацетатом, отсасывают и промывают этилацетатом. После высушивания в вакууме получают 34 г (0,131 моль; 79% от теоретически рассчитанного количества) твердого вещества белого цвета с температурой плавления 312oC (разложение).
Пример 7
2,
4-Диметил-5-нитросахарин:
Это вещество можно получать путем последующего метилирования
полученного согласно примеру 6 сахарина с помощью диметилсульфата в присутствии гидроксида натрия.
Пример 8
3-метил-4-нитро-2-(N'-метил)карбоксамидо-N- метилбензолсульфонамид:

50 мл воды приливают к 50 мл 40%-ного раствора метиламина и при температуре 10oC прикапывают раствор 24,3 г (83 ммоль) хлорангидрида 2-метоксикарбонил-3-метил-4-нитро- бензолсульфокислоты в 35 мл тетрагидрофурана. После перемешивания в течение одного часа при температуре 25oC все летучие компоненты удаляют в ротационном испарителе, остаток экстрагируют этилацетатом, органическую фазу промывают водой, сушат и выпаривают. Полученный остаток кристаллизуется после более продолжительного стояния. Выход составляет 10,3 г (40 ммоль; 48% от теоретически рассчитанного количества); температура плавления составляет от 125 до 126oC, после перекристаллизации из этилацетата температура плавления составляет от 144 до 145oС.
Пример 9
4-метил-5-амино-1,1,
3-триоксо-2,3-дигидро-1-λ6бенз[d]изотиазол (согласно номенклатуре Бейльштейна):
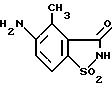
При температуре 45oC 33,6 г (0,13 моль) 4-метил-5-нитро- 1,1,3-триоксо-2,3-дигидро -1-λ6 бенз[d]изотиазола растворяют в 1,2 л воды и добавляют 5 г 10%-ного палладия-на-активном угле. Затем при интенсивном перемешивании пропускают газообразный водород (гидрирование без создания давления). В течение четырех с половиной часов поглощаются девять литров водорода. После охлаждения до 25oC катализатор отфильтровывают, фильтрат концентрируют в ротационном испарителе до объема 200 мл и после этого подкисляют до pH-значения, равного 1. Выпавший осадок отсасывают, промывают водой и высушивают при 50oC в вакууме. Получают 23,4 г (0,11 моль; 85% от теоретически рассчитанного количества) твердого вещества белого цвета с температурой плавления от 272 до 273oC.
Пример 10
4-метил-5-иод-1,1,3-триоксо-2,3-дигидро
-1-λ6 бенз[d]изотиазол (согласно номенклатуре
Бейльштейна):

К смеси из 205 мл ледяной уксусной кислоты, 160 мл воды и 40 мл концентрированной соляной кислоты при перемешивании и при температуре от 15 до 20oC добавляют 23,4 г (0,11 моль) 4-метил-5- амино-1,1, 3-триоксо-2,3-дигидро-1-λ6 бенз[d]изотиазола. К образовавшейся суспензии при температуре от 5 до 10oC прикапывают 7,9 г (0,115 моль) нитрита натрия и дополнительно перемешивают в течение тридцати минут при температуре 5oC. Находящуюся в виде суспензии соль диазония затем порциями прикапывают к нагретому до 50oC раствору 19,1 г (0,115 моль) иодида калия в 170 мл воды, причем выделяется азот. После охлаждения до комнатной температуры путем отсасывания выделяют выпавший в осадок продукт, промывают его водой и высушивают в вакууме при температуре 50oC. Получают 32,5 г (0,1 моль; 91% от теоретически рассчитанного количества) твердого вещества с температурой плавления от 257 до 258oC. Анализ методом сожжения показывает содержание иода, равное 38,5% (теоретически рассчитано 39,3%).
Продукт имеет достаточную степень чистоты для последующих превращений.
Пример 11
4-амино-3-метил-2-(N'-метил)карбоксамидо-N- метилбензолсульфонамид:

Согласно описанной в примере 9 методике полученный в примере 8 3-метил-4-нитро-2-(N'-метил)карбоксамидо-N-метил- бензолсульфонамид гидрируют без создания давления. Получают производное анилина вышеуказанной структуры с выходом 93% и температурой плавления от 217 до 218oC.
Пример 12
3-метил-4-иод-2-(N'-метил)карбоксамидо-N- метилбензолсульфонамид:

Согласно описанной в примере 10 методике диазотируют вышеполученное соединение и путем введения во взаимодействие с иодидом калия превращают в производное иодбензола вышеуказанной структуры с выходом 95% от теоретически рассчитанного количества и температурой плавления от 60 до 62oC.
Нижеследующие примеры поясняют получение целевых продуктов общей формулы (I)
Пример 13
4-метил-1,1,3-триоксо-2,3-дигидро-1-λ6бенз[d] изотиазол-5- карбоновая
кислота:

6,4 г (0,02 моль) 4-метил-5-иод-1,1,3-триоксо-2,3-дигидро- -1-λ6 бенз[d] изотиазола растворяют в смеси из 70 мл тетраметилмочевины и 30 мл воды и смешивают с 0,7 г бис(трифенилфосфин)палладийдихлорида. Смесь в автоклаве емкостью 300 мл нагревают до 100o C и перемешивают в течение тридцати шести часов при давлении монооксида углерода, равном 100 бар.
Реакционную смесь фильтруют, воду и тетрагидрофуран удаляют путем отгонки в высоком вакууме. Остаток обрабатывают метил-трет.- бутиловым эфиром, экстрагируют раствором гидрокарбоната натрия и после подкисления с помощью соляной кислоты снова экстрагируют метил-трет. -бутиловым эфиром. После концентрирования получают 2,8 г 4-метил-1,1,3-триоксо-2,3-дигидро-1-λ6бенз[d] изотиазол-5- карбоновой кислоты (58% от теоретически рассчитанного количества).
1H-ЯМР (дейтерированный диметилсульфоксид, 400,1 МГц): 2,85 (с, 3H); 8,05 (д, 1H); 8,2 (д, 1H).
13C-ЯМР (дейтерированный диметилсульфоксид, 100,6 МГц): 167,4 (CO); 161,3 (CO); 161,3 (CO); 141,6 (четвертичный углерод); 138,7 (четвертичный углерод); 135,6 (CH); 125,4 (четвертичный углерод) 118,5 (CH); 15,4 (CH3).
Пример
14
4-N-диметил-1,1,3-триоксо-2,3-дигидро


7,3 г (0,02 моль) 3-метил-4-иод-2-(N'-метил)карбоксамидо-N- метилбензолсульфонамида вместе с 0,69 г бис(трифенилфосфин)палладийдихлорида, 30 мл воды и 70 мл тетраметилмочевины вносят в автоклав емкостью 300 мл. Смесь нагревают до температуры 100oC и перемешивают в течение тридцати шести часов при давлении монооксида углерода, равном 100 бар.
После переработки как описано в примере 13 получают 4,1 г целевого соединения (0,014 моль; 72% от теоретически рассчитанного количества).
1H-ЯМР (дейтерированный диметилсульфоксид, 400,1 МГц): 2,9 (с, 3H); 3,15 (с, 3H); 8,2 (2д, 2H); 14,0 (с, 1H).
13C-ЯМР (дейтерированный диметилсульфоксид, 100,6 МГц): 167,3 (CO); 158,6 (CO); 139,7 (четвертичный углерод); 139,1 (четвертичный углерод); 138,9 (четвертичный углерод); 135,5 (CH); 124,6 (четвертичный углерод); 119,0 (CH); 22,9 (CH3); 15,6 (CH3).
Аналогичным образом можно получать представленные в таблице 1 сахаринкарбоновые кислоты.
Нижеследующий пример иллюстрирует гербицидную активность соединений общей формулы (Ia).
Пример 15
Послевсходовая обработка
Нижеуказанные тест-растения выращивают до высоты от трех до
пятнадцати
сантиметров и потом обрабатывают нижеуказанными активными веществами, суспендированными или эмульгированными в воде. Растения выдерживают при температурах в пределах от 20oC до
35oC. Послевсходовая обработка ведется при норме расхода 3,0 кг активного вещества на гектар. По истечении 4 недель оценивают реакцию растений на обработку.
Оценку гербицидной активности проводят по шкале, включающей цифры от 0 до 100. При этом цифра 100 означает, что не происходит никакого увеличения роста растений, соответственно наблюдают полное разрушение, по меньшей мере, надземных частей, а цифра 0 указывает на отсутствие какого-либо повреждения или на нормальное развитие растений.
Растения, активные вещества и результаты опыта сведены в таблице 2.
Реферат
Изобретение относится к новым производным сахаринкарбоновой кислоты общей формулы I, в которой L, М означают водород, алкил с 1-4 атомами углерода, алкоксил с 1-4 атомами углерода, алкилтиогруппу с 1-4 атомами углерода, хлор, метилсульфонил, Z означает водород, алкил с 1-4 атомами углерода, бензил или фенил, R означает водород, алкил с 1-6 атомами углерода, при условии, что Z не означает метил, фенил или водород и 5-карбокси-7-метилсахарин и 5-карбокси-4-хлорсахарин исключены. Гербицидное средство в качестве активного вещества содержит соединение общей формулы I, в которой R означает водород или алкил с 1-6 атомами углерода, L и М означают водород или алкил с 1-4 атомами углерода, Z означает алкил с 1-4 атомами углерода в эффективном количестве. 2 с. п. ф-лы, 2 табл.

Формула

в которой L, M - водород, алкил с 1-4 атомами углерода, алкоксил с 1-4 атомами углерода, алкилтиогруппа с 1-4 атомами углерода, хлор, метилсульфонол,
Z - водород, алкил, с 1-4 атомами углерода, бензил или фенил,
R - водород, алкил, с 1-6 атомами углерода,
при условии, что Z не означает метил, фенил или водород, если L и M означают водород, и что 5-карбокси-7-метилсахарин и 5-карбокси-4-хлорсахарин исключены.

в которой R - водород или алкил с 1-6 атомами углерода;
L и M - водород или алкил с 1-4 атомами углерода
Z - алкил с 1-4 атомами углерода,
в эффективном количестве.

Комментарии