Производные изоксазола, промежуточные соединения, гербицидная композиция, способ подавления сорняков - RU2060663C1
Код документа: RU2060663C1
Чертежи


Описание
Изобретение относится к химическим средствам защиты растений, конкретно к гербицидной композиции и способу подавления сорных растений с использованием композиции.
Уже известно использование замещенных производных изоксазола, в частности 4-бензоил-5-метилизоксазола в качестве биологически активных соединений. Однако известные соединения проявляют недостаточное биологическое действие.
Целью изобретения является усиление гербицидного действия.
Цель достигается использованием гербицидной композиции, включающей производное изоксазола общей
формулы (1)

(1) где R1 -С1-С4 алкил, фенил, незамещенный или замещенный хлором, фтором, нитро, метокси, С3-С5-циклоалкил, циклопропил, замещенный метилом или этоксикарбонилом, аминогруппа, 1-этоксикарбонил-1-метилэтил, R2 -С1-С4 алкил, галоген, нитро, циано, трифторметил, пектафторэтил, С1-С2 алкокси, С1-С2 алкилсульфонил, метилтио, метилэтокси, метоксикарбонил, 1-метилэтоксикарбонил, n составляет 1-3, в количестве 0,05-90 мас. оптимальное целевые добавки, а также способом подавления сорных растений путем довсходовой и послевсходовой обработки сорных растений указанной выше композиции при дозе расхода активного вещества формулы (1) 62-4000 г/га.
В настоящем изобретении были использованы следующие соединения формулы (I).
Соединения формулы (I), их температуры плавления и ЯМР-спектры указаны ниже:
1. 5-метил-4-(2-нитро-4-трифторметилбензоил)-изоксазол, tпл. 85-86оС.
2. 5-метил-4-(2-нитробензоил)-изоксазол, tпл. 104,5-105,5оС.
3. 4-(2-нитро-4-трифторметилбензоил)-5-фенилизоксазол, tпл. 149,5-150,5оС.
4. 4-(2,4-динитробензоил-5-метилизоксазол, tпл. 133-135оС.
5. 5-(4-хлорфенил)-4-(2-нитро-4-трифторметилбензоил)-изоксазол, tпл. 159-160оС.
6. 4-(2-хлорбензоил)-5-метилизоксазол. Спектр ЯМР: 2,62 (3Н, С) 7,4 (2Н, М), 7,49 (2Н, М), 8,29 (1Н, С)
7. 5-метил-4-(2-нитро-4-метилсульфонилбензоил)-изоксазол,
tпл. 159-160оС.
8. 5-(1-метилэтил)-4-(2-нитро-4-трифторметилбензоил)-изоксазол, tпл. 138-139оС.
9. 4-(4-хлорбензоил)-5-метилизоксазол, tпл. 65-66оС.
10. 4-(4-метилбензоил)-5-метилизоксазол, tпл. 67оС.
11. 5-(4-фторфенил)-4-(2-нитро-4-фторметилбензоил)-изоксазол, tпл.= 150-151оС.
12. 5-этил-4-(2-нитро-4-трифторметилбензоил)-изоксазол, tпл. 86-87оС.
13. 4-(4-хлор-2-нитробензоил)-5-метилизоксазол, tпл. 98-99оС.
14. 4-(2-нитро-4-трифторметилбензоил)-5-пропилизоксазол, tпл. 102-103оС.
15. 5-циклопропил-4-(2-нитро-4-трифторметилбензоил)-изоксазол, tпл.= 124,5-125оС.
16. 4-(2, 3-дихлор-4-метилсульфонилбензоил)-5-метилизоксазол, tпл. 120-129оС.
17. 5-(1,1-диметилэтил)-4-(2-нитро-4-трифторметилбензоил)-изоксазол, tпл. 169-170оС.
18. 4-(4-метоксибензоил)-5-метилизоксазол, tпл. 78-79оС.
19. 5-метил-4-(4-метил-2-нитробензоил)-изоксазол, tпл. 69-70оС.
20. 4-(2,3-дихлор-4-метилсульфонилбензоил)-5-(1-метилэтил)-изоксазол, tпл.104-106оС.
21. 5-циклопропил-4-(2, 3-дихлор-4-метилсульфонилбензоил)-изоксазол, tпл. 127,6-128,8оС.
22. 4-(2-нитро-4-трифторметилбензоил)-5-фенилметилизоксазол, tпл. 86,5-87,5о С.
23. 4-(2-хлор-4-трифторметилбензоил)-5-циклопропилизоксазол, tпл. 39-40оС.
24. 5-метил-4-(2-нитро-4-пентафторэтилбензоил)-изоксазол, tпл. 128-129оС.
25. 5-циклопропил-3-[4-(1,1-диметилэтил)-2-нитробензоил]-изоксазол, tпл. 87-89оС.
26. 4-[4-(1, 1-диметилэтил)-2-нитробензоил-] 5-метилизоксазол, tпл. 124,8-125оС.
27. 5-циклопентил-4-(2-нитро-4-трифторметилбензоил)-изоксазол, tпл.= 136,8оС.
28. 4-(2,4-дихлорбензоил)-5-метилизоксазол. Спектр ЯМР: 2,6 (3Н, С), 7,3 (2Н, М), 7,4 (1Н, С), 8,2 (1Н, С).
29. 4-(2-хлор-4-метилсульфонилбензоил)-5-метилизоксазол, tпл. 113,8оС.
30. 4-(2-хлор-4-трифторметилбензоил)-5-метилизоксазол, tпл. 52,1оС.
31. 5-метил-4-(2-трифторметилбензоил)-изоксазол. Спектр ЯМР: 2,5 (3Н, С), 7,4 (1Н, М), 7,6 (2Н, М), 7,7 (1Н, М), 8,15 (1Н, С).
32. 5-метил-4-(2, 4-трифторметилбензоил)-изоксазол. Спектр ЯМР: 2,6 (3Н, С), 7,5 (1Н), 7,9 (1Н, о), 8,0 (1Н, С), 8,1 (1Н, С).
33. 4-(2-хлор-4-метилсульфонилбензоил)-5-циклопропил-изоксазол, tпл. 115-117оС.
34. 5-циклопропил-4-(2-трифторметилбензоил)-изоксазол. Спектр ЯМР: 1,2 (2Н, М), 1, 3 (2Н, М), 2,55 (1Н, М), 7,5 (1Н, М), 7,7 (2Н, М), 7,8 (1Н, М), 8,15 (1Н, С).
35. 5-циклопропил-4-(2,4-дихлорбензоил)-изоксазол. Спектр ЯМР: 1,15 (М, 2Н), 1,25 (2Н, М), 2,6 (1Н, М), 7,3 (2Н, С), 7,4 (1Н, С), 8,1 (Н1, С).
36. 4-[2, 3-дихлор-4-(метилтио)-бензоил] -5-метилизоксазол, tпл. 126-128оС.
37. 5-циклопропил-4-(2,4-бис-трифторметилбензоил)-изоксазол, tпл. 74-75о С.
38. 4-(4-хлор-2-трифторметилбензоил)-5-метилизоксазол, tпл. 89-89,5оС.
39. 4-(4-циано-2-нитробензоил)-5-метилизоксазол, tпл. 155-156оС.
40. 5-амино-4-(2-нитро-4-трифторметилбензоил)-изоксазол, tпл. 165-166оС.
41. 4-(4-хлор-2-трифторметилбензоил)-5-циклопропил-изоксазол. Спектр ЯМР: 1,2 (2Н, М), 1,4 (2Н, М), 2,6 (3Н, М), 7,4 (1Н, о), 7,7 (1Н, о), 7,8 (С, 1Н), 8,1 (1Н, С).
42. 5-(1-метилэтил)-4-(2-нитро-4-пентафторэтилбензоил)-изоксазол, tпл. 139-140,5оС.
43. 4-(2-хлор-4-метилсульфонилбензоил)-5-(1-метилэтил)-изоксазол, tпл. 126-127оС.
44. 5-циклопропил-4-(4-фтор-2-нитробензоил)-изоксазол, tпл. 113,8-114,2оС.
45. 5-циклопропил-4-(2-нитро-4-пентафторэтилбензол)-изоксазол, tпл.= 108,6-110оС.
46. 4-(2,3-дихлор-4-метилсульфонилбензоил)-5-метилизоксазол, tпл. 125-126, 4оС.
47. 5-циклобутил-4-(2-нитро-4-трифторметилбензоил)-изоксазол, tпл.= 147-148оС.
48. 4-(4-фтор-2-нитробензоил)-5-метилизоксазол, tпл. 85-87оС.
49. 5-(1-метилциклопропил)-4-(2-нитро-4-трифторметилбензоил)-изоксазол, tпл.=150-152оС.
50. 5-(4-нитрофенил)-4-(2-нитро-4-трифторметилбензоил)-изоксазол, tпл. 170-171оС.
51. 5-(4-метоксифенил)-4-(2-нитро-4-трифторметилбензоил)-изоксазол, tпл. 154-155оС.
52. 4-(2-хлор-3-этокси-4-метилсульфонилбензоил)-5-метилизоксазол, tпл. 104-106оС.
53. 4-(3-цианобензоил)-5-метилизоксазол, tпл. 93,8-94,4оС.
54. 5-(циклопропил-4-(4-метилсульфонил-2-трифторметилбензоил)-изоксазол, tпл. 145,6-146,6оС.
55. 5-циклопропил-4(2-нитро-4-метилсульфонилбензоил)-изоксазол, tпл. 154,6-155,2оС.
56. 4-(2-хлор-3-этокси-4-метилсульфонилбензоил)-5-циклопропилизоксазол, tпл.=119-120,2оС.
57. 4-(2-хлор-3-этокси-4-этилсульфонилбензоил)-5-метилизоксазол, tпл. 108,4-109оС.
58. 4-(2-хлор-3-этокси-4-метилсульфонилбензоил)-5-(1-метилэтил)-изоксазол, tпл. 82,5-84,3оС.
59. 4-(2-хлор-3-этокси-4-этилсульфонилбензоил)-5-циклопропилизоксазол, tпл.=127,4-128,2оС.
60. 5-(1-этоксикарбонилциклопропил)-4-(2-нитро-4-трифторметилбензоил)-изоксазол. Спектр ЯМР: 1,1 (Т, 3Н), 7,6 (1Н, о), 1,4 (2Н, м), 8,0 (1Н, о), 1,6 (2Н, м), 8,1 (1Н, с), 4,0 (1Н, д), 8,4 (1Н, с).
61. 4-(3-метоксикарбонил2-метил-4-метилсульфонилбензоил)-5-метилизоксазол, tпл. 54-57оС.
62. 5-(2-метилциклопропил)-4-(2-нитро-4-трифторметилбензоил)-изоксазол, tпл.=106-107,5оС.
63. 4-(2-хлор-3-(1-метилэтокси)-4-метилсульфонилбензоил)-5-метилизоксазол, tпл.119-120,2оС.
64. 5-метил-4-/3-метил-3-(1-метилэтоксикарбонил)-4-метилсульфонилбензоил)/-изокс азолtпл. 131-135оС.
65. 5-циклопропил-4-/2-метил-3-/1-метилэтоксикарбонил)-4-метилсульфонилбен- зоил)-изоксазол, tпл. 164-166оС.
66. 5-(1-этоксикарбонил-1-метилэтил)-4-(2-нитро-4-фторметилбензоил)-изоксазол, tпл. 108-109оС.
67. 5-циклопропил-4-(2,3,4-трихлорбензоил)-изоксазол, tпл. 105-107оС.
Соединение I получают по способу, указанному в примере 1.
П р и м е р 1. Смесь неочищенного 2-этоксиметилен-1-(2-нитро-4-трифтормет-илфенил)-бутан-1,3-диона (13,25 г) и гидрохлорида гидроксиламина (3,7 г) в этаноле (80 мл) перемешивали 5 ч. Раствор выпаривали почти досуха, и полученный остаток разбавляли этилацетатом (100 мл). Раствор промывали водой (три раза по 40 мл), сушили (безводным сульфатом натрия) и фильтровали. Фильтрат выпаривали досуха. Остаток растирали со смесью эфира и уайт-спирита (точка кипения 60-80оС) в отношении 1:1, полученное твердое вещество цвета буйволовой кожи отфильтровали. Твердое вещество растворяли в дихлорметане (100 мл) и фильтровали через двуокись кремния. Двуокись кремния промывали дихлорметаном (200 мл), объединенные фильтраты выпаривали досуха и получали 4-(2-нитро-4-трифторметилбензоил)-5-метилизоксазол (4,5 г) в виде не совсем белого твердого вещества. Точка плавления 85-86оС.
Способом, аналогичным описанному выше, получали также соединения 5, 8, 11, 12, 14, 115, 17, 22, 24, 27, 39, 40, 42, 45, 60, 62, 66.
Соединение 2 получают по способу, указанному в примере 2.
П р и м е р 2. Соединение 2. Триэтиламин (1,9 г) добавляли к смеси 2-этоксиметилен-1-(2-нитрофенил)-бутан-1,3-диона (4,9 г) и гидрохлорида гидроксиамина (1,3 г) в ацетонитриле (100 мл) при перемешивании. Смесь перемешивали в течение 2 ч и оставляли на ночь. Смесь выпаривали почти досуха и добавляли воду (100 мл). Смесь экстрагировали этилацетатом (два раза по 75 мл), сушили (безводным сульфатом магния) и фильтровали. Фильтрат выпаривали досуха и получали 4-(2-нитробензоил)-5-метилизоксазол (2,4 г) в виде коричневого твердого вещества, точка плавления 104,5-105,5оС.
Способом, аналогичным описанному, получают также соединения 3, 4, 6, 7, 13, 16, 19-21, 23, 25-38, 41, 43, 44, 47-67.
В примерах 3, 4, 5 описаны способы получения соединений 46, 9, 18.
П р и м е р 3. 3-хлорнадбензойную кислоту (85% 0,99 г) по частям добавляли к перемешиваемому раствору 4-(2,3-дихлор-4-(метилтио)-бензоил)-5-метилизоксазола (1,5 г) в дихлорэтане (50 мл), поддерживая температуру ниже -20оС. Смесь перемешивали при -20оС 1 ч. Добавляли дихлорметан (50 мл), и твердое вещество удаляли фильтрацией. Фильтрат выпаривали досуха, и остаток хроматографировали на кремнеземе, элюированном смесью этилацетатциклогексан в отношении 1: 5 и получали 4-(2,3-дихлор-4-метилсульфинилбензоил)-5-метили-зоксазол (0,8 г) в виде твердого белого вещества, точка плавления 125-126,4оС.
П р и м е р 4. Смесь хлористого алюминия (16 г) и хлористого 5-метилизоксазол-4-карбонила (5,0 г) в сухом хлорбензоле (50 мл) перемешивали в атмосфере азота 16 ч. Смесь нагревали до 80оС за 1,5 ч. Охлажденную смесь резко охлаждали избытком льда и экстрагировали этилацетатом (три раза по 200 мл). Объединенные органические слои промывали водой (три раза по 500 мл) сушили, (безводным сульфатом магния) и фильтровали. Фильтрат выпаривали досуха, остаток очищали хроматографией на кремнеземе, элюированном смесью этилацетатциклогексан в отношении 1:20 и получали 4-(4-хлорбензоил)-5-метилизоксазол (5,2 г) в виде желтого твердого вещества, точка плавления 65-66оС.
Аналогичным образом получают следующее соединение: 4-(4-метилбензоил)-5-метилизоксазол.
Спектр ЯМР (СЛСl3): 2,36 (3Н, с), 2,59 (3Н, с), 7,2-7,7 (4Н, м), 8,36 (1Н, с), начиная с толуола.
П р и м е р 5. Смесь хлористого алюминия (10 г) и хлористого 5-метилизоксазол-4-карбонила (2,7 г) в метоксибензоле (50 мл) перемешивали при комнатной температуре 16 ч. Реакцию прекращали избытком льда и экстрагировали эфиром (три раза по 200 мл). Объединенные органические слои промывали водой (три раза по 500 мл), сушили (безводным сульфатом магния) и фильтровали. Фильтрат выпаривали досуха. Остаток очищали хроматографией на кремнеземе, элюированном смесью метилацетат-цик- логексан в отношении 1:10 с последующей высоко производительной жидкостной хроматографией на двуокиси кремния, элюированной смесью этилацетатгексан в отношении 1:20 и получали 4-(4-метоксибензоил)-5-метилизоксазол (0,35 г) в виде белого твердого вещества, точка плавления 78-79оС.
Настоящее изобретение предусматривает использование композиций, пригодных для гербицидного использования, содержащих одно производное изоксазола общей формулы (I) в сочетании и с предпочтительно гомогенно диспергированных в одном или более совместимых гербицидно приемлемых разбавителях или носителях, и/или поверхностно-активных веществ того типа, которые обычно приемлемы в данной области, и пригодны для использования в гербицидных композициях с соединениями общей формулы (III). Использованный выше термин гомогенно диспергированные включает композиции, в которых соединения общей формулы (III) растворены в других компонентах. Термин гербицидные композиции использован в широком смысле и включает не только композиции, готовые к употреблению в качестве гербицидов, но также и концентраты, которые должны быть разбавлены перед употреблением. Предпочтительно композиции содержат от 0,05 до 90 мас. одного или более соединений общей формулы (III).
Гербицидные композиции могут содержать как разбавитель или носитель, так и поверхностно-активное вещество (т. е. смачивающее средство, диспергирующее или эмульгирующее средство). Поверхностно-активные вещества, которые могут присутствовать в гербицидных композициях согласно настоящему изобретению, могут быть ионоактивными или неионогенными типами, например, сульфорицинолеаты, производные четвертичного аммония, продукты, основанные на конденсатах окиси этилена с алкил- и полиарилфенолами, т. е. нонил- или октилфенолами, или сложными эфирами карбоновых кислот ангидросорбитов, которые становятся растворимыми при этерификации свободных оксигрупп конденсацией с окисью этилена, сложных эфиров серной кислоты соли щелочного и щелочно-земельного металла и сульфоновых кислот, такие как дионил- и диоксил-натрий-сульфосукцинаты и соли щелочного и щелочно-земельного металла производных высокомолекулярных сульфокислот, такие как лигносульфонаты натрия и кальция и алкилбензолсульфонаты натрия и калия.
Примерами подходящих твердых разбавителей или носителей являются алюмосиликаты, тальк, окись магния, кизельгур, трикальцийфосфат, порошкообразное пробковое вещество, адсорбированная газовая сажа и глины, такие как каолин и бентонит. Твердые композиции, которые могут иметь форму дустов, гранул или смачивающихся порошков, предпочтительно получают помолом соединений общей формулы (III) с твердыми разбавителями или пропиткой твердых разбавителей или носителей растворами соединений общей формулы (III) в летучих растворителях, испарением растворителей и, если необходимо, помолом продуктов для получения порошков. Гранулированные формы препаратов могут быть получены абсорбцией соединений общей формулы (III) (растворенных в подходящих растворителях, которые могут быть, если желают, летучими) в твердые разбавители или носители в гранулированной форме и, если, желают, выпариванием растворителя или гранулированием композиций в порошкообразной форме, полученных как описано выше. Твердые гербицидные композиции, в частности смачивающиеся порошки и гранулы могут содержать смачивающие или диспергирующие средства (например, описанных выше типов), которые могут, будучи твердыми веществами, также служить в качестве разбавителей или носителей.
Жидкие композиции согласно изобретению могут иметь форму водных, органических или смешанных водно-органических растворов, суспензий и эмульсий, которые могут содержать поверхностно-активное вещество. Подходящие жидкие разбавители для введения в жидкие композиции включают воду, гликоли, тетрагидрофурфуриловый спирт, ацетофенон, циклогексанон, изофорон, толуол, ксилол, минеральное, животное и растительное масла и легкие ароматические и нафтеновые фракции нефти (или смеси этих разбавителей). Поверхностно-актив- ные вещества, которые могут присутствовать в жидких композициях, могут быть ионогенного или неионоактивного типа (например, описанного выше) и, будучи жидкостями, могут также служить в качестве разбавителей или носителей.
П р и м е р 6. Смачивающийся порошок был приготовлен из, мас. Активный ингре- диент (соединение I) 50 Этилан ВСР (кон- денсат нонилфено- ла и этиленоксида, содержащий 9 моль
этиленоксида на моль фенола) 5 Аэросил (тонкодис- персная двуокись кремния с микрон- ными размерами частиц) 5 Целит РF (носитель из синтетического си- ликата магния) 40
П р и м е р 7. Водный
суспензионный концентрат получали из: Активный ингредиент (соединение I) 50 мас./об. Этилан ВСР 1,0 мас./об. Сопропон Т36 (нат- риевая соль поликар- боновой кислоты) 0,2 мас. Этиленгликоль 5,0 мас.
/об. Родигель 23 (загус- титель из полисаха- ридной ксаноновой смолы) 0,15 мас./об. Дистиллированная вода до 100 об.
П р и м е р 8. Соответствующие количества испытываемых соединений растворили в ацетоне для получения растворов, эквивалентных дозам применения 1000, 2000 или 4000 г испытываемого соединения на гектар (г-га). Эти растворы наносили из стандартного лабораторного распылителя гербицидов, используя нагнетаемую горизонтально струю при перемещении со скоростью 2,9 км/ч и привнося эквивалент 540 л распыляемой жидкости на гектар.
Прием обработки: применение в предвсходовый период.
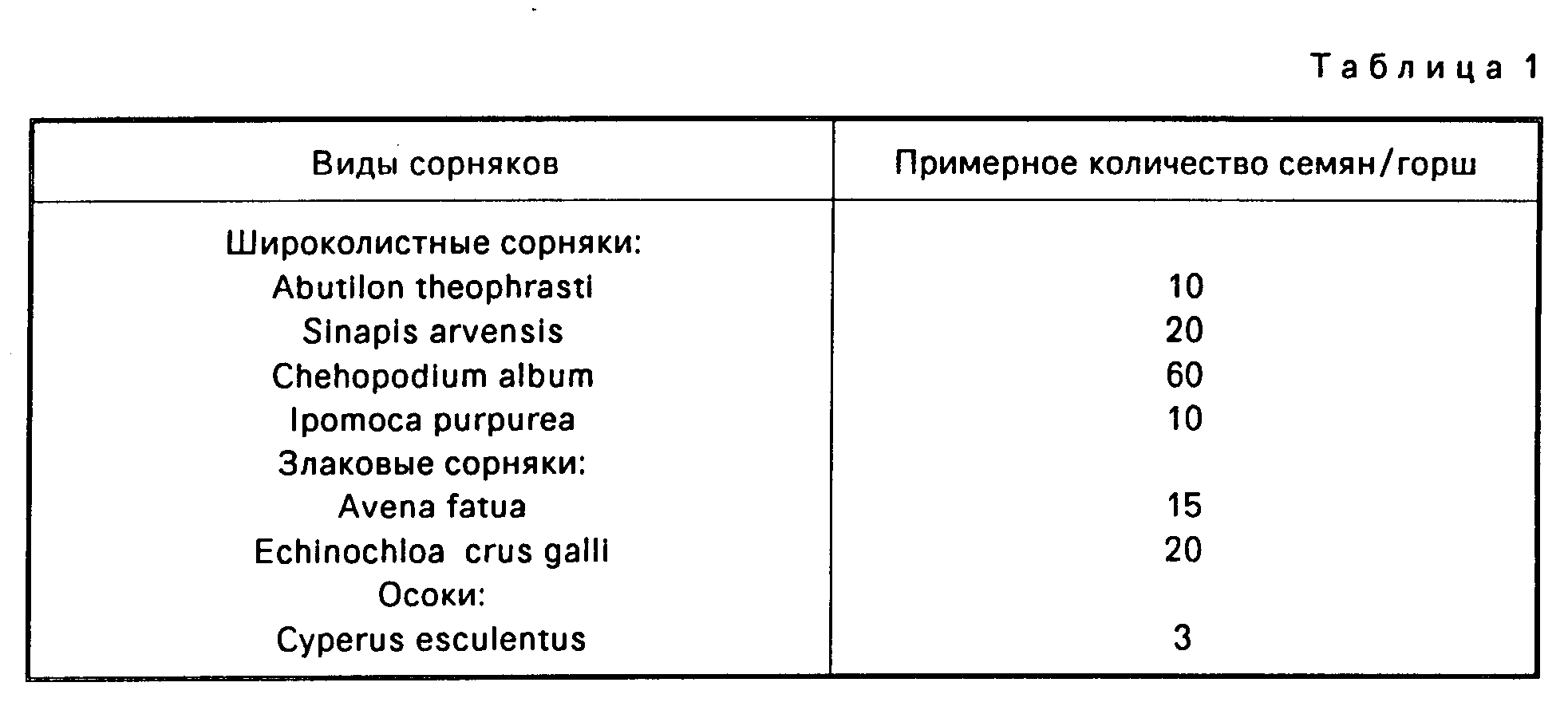
Семена сорняков высевали на поверхности горшочного компоста в пластмассовых горшках, глубиной 75 мм. Количества семян на порошок представлены в табл. 1.
Соединения наносят на непокрытые почвой семена, соблюдая вышеуказанные условия, и семена засыпали 25 мл просеянного песка после опрыскивания. Отдельный горшок каждого вида семян сорняков резервировали от обработки, и необработанные контрольные горшки опрыскивали только ацетоном. После обработки горшки хранили в теплице и поливали дождеванием. Визуальную оценку активности в борьбе с сорняками приводили через 17-20 дней после опрыскивания. Результаты выражены в процентах роста или гибели сорняков в сравнении с растениями в контрольных горшках.
Приемы обработки: применение в послевсходовый период.
Семена сорных видов растений проращивали и затем пересаживали в стадии рассады в горшечный компост в пластиковые горшки глубиной 75 мм за исключением Avena fatua, которую высевали непосредственно в экспериментальные горшки и не пересаживали. Затем растения выращивали в теплице до того времени, когда растения были готовы к опрыскиванию, испытываемыми соединениями. Число растений на горшок и рост растений при опрыскивании, представлены в табл. 2.
Испытываемые соединения наносили на растения как описано выше. Отдельный горшок каждого вида сорняков резервировали от обработки и предназначали для контроля, которые опрыскивали только ацетоном. После опрыскивания горшки поливали дождеванием спустя 24 ч после опрыскивания. Визуальную оценку регулирования роста сорняков проводили через 17-20 дней после опрыскивания. Результаты выражены в процентах снижения роста или гибели сорняков в сравнении с растениями в контрольных горшках.
Будучи применены в довсходовый период в количестве 4000 г/га, соединения 1, 2, 4, 5, 6, 7, 8, 9, 11, 12, 13, 15, 16, 19, 22, 27, 28, 29, 30, 31, 32, 35, 39, 40, 42 и 49 дали по меньшей мере 90%-ное снижение одного или более видов сорных растений.
Будучи применены в послевсходовой период в количестве 4000 г/га, соединения 1, 2, 4, 7, 8, 9, 10, 11, 12, 13, 15, 16, 19, 22, 28, 29, 30, 31, 32, 35, 39, 40, 42, 44, 49 и 53 дали по меньшей мере 70%-ное снижение роста одного или более видов сорных растений.
При применении в количестве 2000 г/га в довсходовом периоде соединения 3, 14, 18, 20, 21, 23, 24, 25, 33, 34, 36, 37, 38, 41, 43, 45, 46, 47, 48, 51 и 52 дали по меньшей мере 90%-ное снижение роста одного или более видов сорных растений.
При применении в послевсходовом периоде в количестве 2000 г-га соединения 3, 14, 17, 18, 20, 21, 23, 25, 26, 33, 34, 36, 37, 38, 41, 43, 45, 46, 48, 50 и 52 дали по меньшей мере 70%-ное снижение роста одного или более видов сорных растений.
При применении в довсходовом периоде в количестве 1000 г/га соединения 54, 55, 56, 57, 58, 59, 60, 61, 63, 64, 65, 66 и 67 дают по меньшей мере 80% -ное снижение роста одного или более видов сорных растений.
При применении в послевсходовом периоде в количестве 1000 г/га соединения 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65 и 67 дают по меньшей мере 70%-ное снижение роста одного или более видов сорных растений.
В табл. 3 в условиях эксперимента указаны сведения о гербицидном действии для заявленных и известного соединения А-(4-бензоил-5-метилизоксазола).
Реферат
Использование: сельское хозяйство, химический способ защиты растений от сорняков. Сущность изобретения: гербицидная композиция включает производные изоксазола в количестве 0,05-90 мас.%, целевые добавки - остальное. Указанной композицией осуществляют довсходовую и послевсходовую обработку сорняков при дозе расхода производного изоксазола, равного 62-4000 г/га. 4 с. и 6 з. п. ф-лы, 3 табл.
Формула
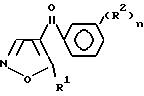
где R1 алкильная группа с прямой или разветвленной цепью, содержащая до шести углеродных атомов, циклоалкильная группа, содержащая три - шесть углеродных атомов, необязательно замещенная метилом или этоксикарбонилом, фенил, незамещенный или замещенный галогеном, нитро- или метоксигруппой, 1-этоксикарбонил-1-метилэтил или амино;
R2 C1 C6-алкил, галоген, нитро-, циано, гало- C1 C6-алкил, C1 C2-алкилсульфинил, C1 - C2-алкилтио, C1 C2-алкилсульфонил, C1 - C2-алкил-C1
C2 -алкокси или C1 - C4-алкоксикарбонил;
n целое число от 1 до 3.

где заместители R1 и R2 имеют указанные значения;
X алкокси или N, N-диалкиламино.

Комментарии