Способ получения 3-трифторметильных халконов - RU2502720C2
Код документа: RU2502720C2
Описание
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к способу получения 3-трифторметильных халконов и трифторацетильных промежуточных соединений. Данное изобретение также относится к новым трифторацетильным и галосоединениям, применимых в качестве исходных веществ и промежуточных соединений для ранее описанного способа.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение обеспечивает способ получения соединения Формулы 1

где
Z представляет собой необязательно замещенный фенил; и
Q представляет собой фенил или 1-нафталенил, каждый необязательно замещенный;
включающий этап дистилляции воды из смеси, содержащей соединение Формулы 2

соединение Формулы 3

основание, содержащее, по меньшей мере, одно соединение, выбранное из группы содержащей
гидроксиды щелочноземельного металла Формулы 4

где M представляет собой Ca, Sr или Ba,
карбонаты щелочного металла Формулы 4a
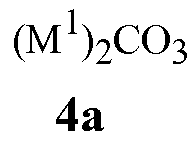
где M1 представляет собой Li, Na или K,
1,5-диазабицикло[4,3,0]нон-5-ен и 1,8-диазабицикло[5,4,0]ундец-7-ен,
и апротонный растворитель, способный формировать низкокипящий азеотроп с водой.
Данное изобретение также обеспечивает способ получения соединения Формулы 2, где Z представляет собой необязательно замещенный фенил, включающий
(1) образование реакционной смеси, содержащей реактив Гриньяра, полученный из соединения Формулы 5

где X представляет собой Cl, Br или I,
путем контактирования соединения Формулы 5 с
(a) металлическим магнием, или
(b) галогенидом алкилмагния
в присутствии эфирного растворителя; и затем
(2) контактирование реакционной смеси с соединением Формулы 6

где
Y представляет собой OR11 или NR12R13;
R11 представляет собой C1-C5 алкил; и
R12 и R13 представляют собой независимо C1-C2 алкил; или R12 и R13 взяты вместе как -CH2CH2OCH2CH2-.
Данное изобретение также обеспечивает способ получения соединения Формулы 2, где Z представляет собой фенил, необязательно замещенный до 5 заместителями, независимо выбранными из R2; и каждый R2 представляет собой независимо F, Cl, Br, C1-C6 алкил, C1-C6 фторалкил, C1-C6 алкокси, C1-C6 фторалкокси, C1-C6 алкилтио или C1-C6 фторалкилтио, включающий
(1) образование реакционной смеси, содержащей реактив Гриньяра, полученный из соединения Формулы 5

где X представляет собой I,
контактированием соединения Формулы 5 с
(a) металлическим магнием, или
(b) галогенидом алкилмагния
в присутствии эфирного растворителя; и затем
(2) контактирование реакционной смеси с соединением Формулы 6

где
Y представляет собой OR11 или NR12R13;
R11 представляет собой C1-C5 алкил; и
R12 и R13 представляют собой независимо C1-C2 алкил; или R12 и R13 взяты вместе как -CH2CH2OCH2CH2-.
Данное изобретение также относится к раскрытому выше способу получения соединения Формулы 1 из соединения Формулы 2 и соединения Формулы 3, где способ дополнительно отличается тем, что получают соединение Формулы 2 из соединений Формулы 5 и 6 с помощью способа, раскрытого выше.
Изобретение также относится к способу получения соединения Формулы 7
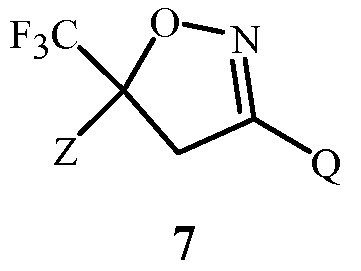
где
Z представляет собой необязательно замещенный фенил; и
Q представляет собой фенил или 1-нафталенил, каждый необязательно замещенный;
применяя соединение Формулы 1. Способ отличается этапами, на которых (a) получают соединение Формулы 1 с помощью способа, раскрытого выше, или (b) применяют в качестве указанного соединения Формулы 1 соединение Формулы 1, полученное с помощью способа, раскрытого выше.
Данное изобретение также относится к новым соединениям Формулы 2 и 5, применимых в качестве исходных веществ для ранее описанных способов.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Применяемые здесь выражения “включает”, “включающий”, “содержит”, “содержащий”, “имеет” “имеющий”, “вмещает” или “вмещающий”, или любой другой их вариант, предназначены, чтобы рассматривать не исключительное включение. Например, композиция, смесь, процесс, способ, изделие или прибор, который включает перечень элементов, не обязательно ограничивается только теми элементами, а может включать и другие элементы, явно не перечисленные или свойственные такой композиции, смеси, процессу, способу, изделию или прибору. Кроме того, если прямо не указано иное, “или” относится к включающему или и не исключающему или. Например, условия A или B удовлетворяет одному из следующего: A верно (или присутствует) и B ложно (или не присутствует), A ложно (или не присутствует) и B верно (или присутствует), и A, и B верно (или присутствует).
Также, формы единственного числа предыдущего элемента или компонента изобретения предназначены, чтобы быть не ограничивающими относительно числа примеров (т.е., событий) элемента или компонента. Поэтому форму единственного числа следует читать, как включает один или, по меньшей мере, один, и единственная форма слова элемента или компонента также включает множественную, если явно не подразумевается единственное число.
В вышеизложенных перечислениях выражение “алкил”, применяемое или самостоятельно или в соединении слов, таких как “алкилтио” или “галоалкил”, включает неразветвленный или разветвленный алкил, такой как метил, этил, н-пропил, i-пропил или различные бутил, пентил или гексил изомеры.
“Алкокси” включает, например, метокси, этокси, н-пропилокси, изопропилокси и различные изомеры бутокси, пентокси и гексилокси. “Алкилтио” включает разветвленные или неразветвленные алкилтио части, такие как метилтио, этилтио, и различные изомеры пропилтио, бутилтио, пентилтио и гексилтио. “Алкилсульфинил” включает оба энантиомера алкилсульфинильной группы. Примеры “алкилсульфинила” включают CH3S(O)-, CH3CH2S(O)-, CH3CH2CH2S(O)-, (CH3)2CHS(O)- и различные бутилсульфинил, пентилсульфинил и гексилсульфинил изомеры. Примеры “алкилсульфонила” включают CH3S(O)2-, CH3CH2S(O)2-, CH3CH2CH2S(O)2-, (CH3)2CHS(O)2-, и различные бутилсульфонил, пентилсульфонил и гексилсульфонил изомеры. “Алкиламино”, “диалкиламино” и подобное определяется аналогично вышеизложенным примерам.
“Циклоалкил” включает, например, циклопропил, циклобутил, циклопентил и циклогексил. Выражение “алкилциклоалкил” обозначает алкильный заместитель в циклоалкильной части и включает, например, этилциклопропил, изопропилциклобутил, 3-метилциклопентил и 4-метилциклогексил. Выражение “циклоалкилалкил” обозначает циклоалкильный заместитель в алкильной части. Примеры “циклоалкилалкила” включают циклопропилметил, циклопентилэтил, и другие циклоалкильные части, связанные с неразветвленными или разветвленными алкильными группами.
Выражение “галоген”, или самостоятельно или в соединении слов, таких как “галоалкил”, или когда применяют в описаниях таких как “алкил, замещенный галогеном”, включает фтор, хлор, бром или йод. Дополнительно, когда применяют в соединении слов, таких как “галоалкил”, или когда применяют в описаниях, таких как “алкил, замещенный галогеном”, причем указанный алкил может быть частично или полностью замещенный атомами галогенов, которые могут быть одинаковыми или разными. Подобным образом “фторалкил” обозначает указанный алкил, который может быть частично или полностью замещенный атомами фтора. Примеры “галоалкила” или “алкила, замещенного галогеном” включают F3C-, ClCH2-, CF3CH2- и CF3CCl2-. Выражения “галоциклоалкил”, “галоалкокси”, “галоалкилтио”, “галоалкилсульфинил”, “галоалкилсульфонил” и подобное, определяются аналогично выражению “галоалкил”. Примеры “галоалкокси” включают CF3O-, CCl3CH2O-, HCF2CH2CH2O- и CF3CH2O-. Примеры “галоалкилтио” включают CCl3S-, CF3S-, CCl3CH2S- и ClCH2CH2CH2S-. Примеры “галоалкилсульфинила” включают CF3S(O)-, CCl3S(O)-, CF3CH2S(O)- и CF3CF2S(O)-. Примеры “галоалкилсульфонила” включают CF3S(O)2-, CCl3S(O)2-, CF3CH2S(O)2- и CF3CF2S(O)2-. Выражение “галодиалкиламино” обозначает диалкиламино, где, по меньшей мере, один из амино компонентов является замещенным, по меньшей мере, одним галогеном. Примеры “галодиалкиламино” включают CH2ClCH2N(CH3)- и (CF3CH2)2N-.
“Алкилкарбонил” обозначает неразветвленные или разветвленные алкильные части, связанные с C(=O) частью. Примеры “алкилкарбонила” включают CH3C(=O)-, CH3CH2CH2C(=O)- и (CH3)2CHC(=O)-. Примеры “алкоксикарбонила” включают CH3OC(=O)-, CH3CH2OC(=O)-, CH3CH2CH2OC(=O)-, (CH3)2CHOC(=O)- и различные бутокси- или пентоксикарбонильные изомеры.
В данном открытии и формуле изобретения, радикалы “SO2” и S(O)2” обозначают сульфонил, “-CN” обозначает циано, “-NO2” обозначает нитро и “-OH” обозначает гидрокси.
Общее число углеродных атомов в группе заместителя указывается с помощью приставки “Ci-Cj”, где i и j равно числам от 1 до 9. Например, C1-C4 алкилсульфонил обозначает метилсульфонил - бутилсульфонил, включая возможные изомеры. C2 алкоксикарбонил обозначает CH3OC(O)-; C3 алкоксикарбонил обозначает CH3CH2C(O)-; и C4 алкоксикарбонил включает (CH3)2CHC(O)- и CH3CH2CH2C(O)-.
Когда соединение замещено заместителем, содержащим индекс, который показывает, что число указанных заместителей может превышать 1, указанные заместители (когда они превышают 1) независимо выбраны из группы определенных заместителей, например, для (Rv)r в U-1 Приложении 1, r равно 1, 2, 3, 4 или 5. Когда группа включает заместитель, который может быть водородом (например, -NR4R5 в определении R3, где R4 или R5 могут быть водородом в Варианте осуществления 2), тогда, когда данный заместитель взят как водород, очевидно, что это эквивалентно тому, когда указанная группа является незамещенной. Когда переменная группа, как показано, является необязательно присоединенной в положение, например (Rv)r в U-41 Приложении 1, где r может быть 0, тогда водород может быть при положении, даже если не упомянут в определении переменной группы. Когда одно или больше положений в группе указаны как “не замещенные” или “незамещенные”, тогда атомы водорода присоединяются, чтобы занять любую свободную валентность.
Выражения “гетероциклическое кольцо” или “гетероцикл” обозначает кольцо или кольцо, в котором, по меньшей мере, один атом, формирующий основу кольца, не является углеродом, например, азот, кислород или сера. Типично гетероциклическое кольцо включает не более чем 4 азота, не более чем 2 кислорода и не более чем 2 серы. Выражение “член кольца” относится к атому или другой части (например, C(=O), C(=S), S(O) или S(O)2), формирующей основу кольца. Если не указано иное, то, гетероциклическое кольцо может быть насыщенным, частично ненасыщенным или полностью ненасыщенным кольцом, и, кроме того, ненасыщенное гетероциклическое кольцо может быть частично ненасыщенным или полностью ненасыщенным. Поэтому перечисление “гетероциклическое кольцо” не указывая, насыщенное ли оно или ненасыщенное, является синонимом перечислению “насыщенное или ненасыщенное гетероциклическое кольцо”. Когда полностью ненасыщенное гетероциклическое кольцо удовлетворяет правилу Хюккеля, тогда указанное кольцо также называется “гетероароматическое кольцо” или “ароматическое гетероциклическое кольцо”. “Ароматическое” указывает на то, что каждый из атомов кольца находится в основном в одной и той же плоскости и имеет p-орбиталь, перпендикулярную плоскости кольца, и что (4n + 2) ¶ электрона, где n является положительным целым числом, связаны с кольцом, подчиняясь правилу Хюккеля. Если не указано иное, гетероциклические кольца и системы колец могут быть присоединены через любой доступный углерод или азот замещением водорода на указанный углерод или азот.
Выражение “необязательно замещенный” в сочетании с фенилом или 1-нафталенилом в определениях Z и Q относится к группам, которые являются незамещенными, или имеют, по меньшей мере, один не водородный заместитель. Поскольку Z и Q являются периферийными для частей молекул, подвергающихся реакции в данных способах, очень широкий диапазон обоих значений и типа заместителей совместим с данными способами. Применяемые здесь последующие определения следует применять, если не указано иное. Выражение “необязательно замещенный” применяют взаимозаменяемо с фразой “замещенный или незамещенный” или с выражением “(не)замещенный”. Если не указано иное, необязательно замещенная группа может иметь заместитель в каждом положении группы, которое может замещаться, и каждый заместитель является независимым от другого.
Когда R3 или Q1 представляет собой 5- или 6-членное азотсодержащее гетероциклическое кольцо, оно может быть присоединено к остатку Формулы 1 через любой доступный углеродный или азотный атом кольца, если не описано иное. Как отмечено в Варианте осуществления 1B, R3 или Q1 может быть (среди прочих) фенилом, необязательно замещенным одним или более заместителем, выбранными из группы заместителей, как определено в Варианте осуществления 1B. Примером фенила, необязательно замещенного от одного до пяти заместителями, является кольцо, проиллюстрированное как U-1 в Приложении 1, где Rv является таковым, как определено в Варианте осуществления 1B для R3 или Q1, и r равно целому числу от 0 до 5.
Как отмечено выше, R3 или Q1 может быть (среди прочих) 5- или 6-членным гетероциклическим кольцом, которое может быть насыщенным или ненасыщенным, необязательно замещенным одним или более заместителем, выбранными из группы заместителей, как определено в Варианте осуществления 2. Примеры 5- или 6-членного ненасыщенного ароматического гетероциклического кольца, необязательно замещенного от одного или более заместителями, включают кольца U-2 - U-61, проиллюстрированные в Приложении 1, где Rv представляет собой любой заместитель, как определено в Варианте осуществления 2 для R3 или Q1, и r равно целому числу от 0 до 4, ограниченный числом доступных положений в каждой U группе. Поскольку U-29, U-30, U-36, U-37, U-38, U-39, U-40, U-41, U-42 и U-43 имеют только одно доступное положение, для этих U групп r ограничено целыми числами 0 или 1, и r, равное 0, обозначает, что U группа является незамещенной и водород присутствует в положении обозначенном (Rv)r.
ПРИЛОЖЕНИЕ 1

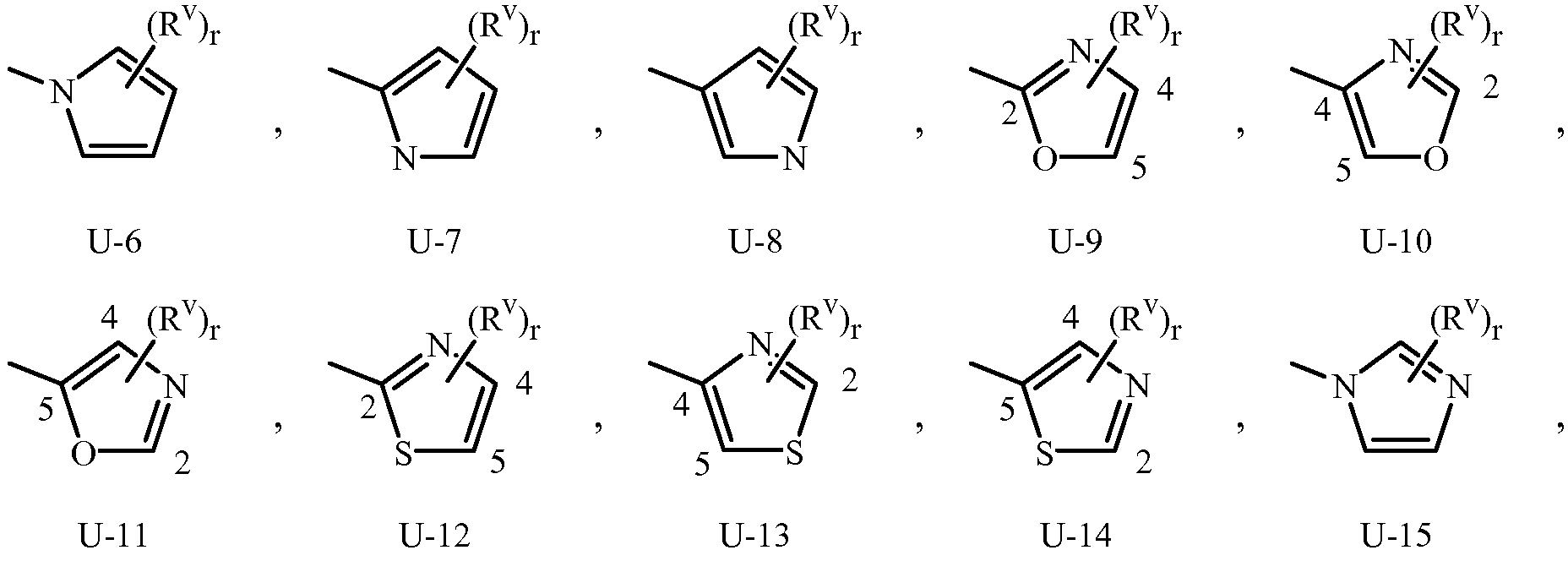



Нужно отметить, что когда R3 или Q1 являются 5- или 6-членным насыщенным или ненасыщенным неароматическим гетероциклическим кольцом, необязательно замещенным одним или более заместителем, выбранными из группы заместителей как определено в Варианте осуществления 2 для R3 или Q1, один или два углерода кольца гетероцикла могут необязательно быть в окисленной форме карбонильной части.
Примеры 5- или 6-членных насыщенного или неароматического ненасыщенного гетероциклического кольца включают кольца G-1 - G-35, как проиллюстрировано в Приложении 2. Нужно отметить, что когда точка присоединения на G группе проиллюстрирована как плавающая, G группа может быть присоединена к остатку Формулы 1 через любой доступный углерод или азот G группы посредством замещения атома водорода. Необязательные заместители, соответствующие Rv, могут быть присоединены к любому доступному углероду или азоту посредством замещения атома водорода. Для данных G колец, r типично равно целому числу от 0 до 4, ограниченное числом доступных положений на каждой G группе.
Нужно отметить, что когда R3 или Q1 включают кольцо, выбранное G-28 - G-35, G2 выбрано из O, S или N. Нужно отметить, что когда G2 является N, атом азота может завершить свою валентность замещением либо H, либо заместителями, соответствующими Rv, как определено в Варианте осуществления 1B.
ПРИЛОЖЕНИЕ 2

Нужно отметить, что когда Rv является H, когда присоединяется к атому, это равносильно тому, если указанный атом является незамещенным. Атомы азота, которые требуют замещения, чтобы заполнить их валентность, замещаются H или Rv. Нужно отметить, что когда точка присоединения между (Rv)r и U группой проиллюстрирована как плавающая, (Rv)r может присоединяться к любому доступному атому углерода или атому азота U группы. Нужно отметить, что когда точка присоединения на U группе проиллюстрирована как плавающая, U группа может быть присоединена к остатку Формулы 1 через любой доступный углерод или азот U группы посредством замещения атома водорода. Нужно отметить, что некоторые U группы могут быть замещены только менее чем 4 Rv группами (например, U-2 - U-5, U-7 - U-48 и U-52 - U-61).
Разнообразные синтетические способы известные в данной области техники для обеспечения получения ароматических и неароматических гетероциклических колец; для обширных обзоров см. Т.8 изаний Comprehensive Heterocyclic Chemistry, A. R. Katritzky and C. W. Rees editors-in-chief, Pergamon Press, Oxford, 1984 и Т.12 изданий Comprehensive Heterocyclic Chemistry II, A. R. Katritzky, C. W. Rees and E. F. V. Scriven editors-in-chief, Pergamon Press, Oxford, 1996.
В некоторых случаях здесь соотношения изложены как одиночные числа, которые сравнимы с числом 1; например, соотношение 4 обозначает 4:1.
В контексте данного изобретения, “декантатор” относится к устройству, способному раздельно удалять верхнюю (т.е., меньшей плотности) жидкую фазу и/или нижнюю (т.е., большей плотности) жидкую фазу из жидкости (например, азеотропный конденсат), содержащей две жидкие фазы. Ловушка Дина-Старка является примером одного типа декантатора.
Варианты осуществления данного изобретения включают:
Вариант осуществления 1. Способ, описанный в кратком описании изобретения, получения соединения Формулы 1, включающий этап, на котором дистиллируют воду из смеси, содержащей соединение Формулы 2, соединение Формулы 3, основание и апротонный растворитель, способный формировать низкокипящий азеотроп с водой.
Вариант осуществления 1A. Способ варианта осуществления 1, где основание представляет собой гидроксид щелочноземельного металла Формулы 4, и смесь дополнительно включает полярный апротонный растворитель.
Вариант осуществления 1B. Способ варианта осуществления 1, где основание включает карбонат щелочного металла Формулы 4a.
Вариант осуществления 1C. Способ варианта осуществления 1, где основание включает 1,5-диазабицикло[4,3,0]нон-5-ен, 1,8-диазабицикло[5,4,0]ундец-7-ен или их смесь.
Вариант осуществления 1D. Способ, описанный в кратком описании изобретения, получения соединения Формулы 7, применяя соединение Формулы 1, способ отличается тем, что получают соединение Формулы 1 способом варианта осуществления 1.
Вариант осуществления 1E. Способ, описанный в кратком описании изобретения, получения соединения Формулы 7, применяя соединение Формулы 1, способ отличается тем, что получают соединение Формулы 1 способом варианта осуществления 1A.
Вариант осуществления 1F. Способ, описанный в кратком описании изобретения, получения соединения Формулы 7, применяя соединение Формулы 1, способ отличается тем, что получают соединение Формулы 1 способом варианта осуществления 1B.
Вариант осуществления 1G. Способ, описанный в кратком описании изобретения, получения соединения Формулы 7, применяя соединение Формулы 1, способ отличается тем, что получают соединение Формулы 1 способом варианта осуществления 1C.
Вариант осуществления 2. Способ любого одного из вариантов осуществления 1-1G, где
Q представляет собой фенил или 1-нафталенил, каждый необязательно замещенный до 4 заместителями, независимо выбранными из R3;
каждый R3 представляет собой независимо галоген, C1-C6 алкил, C1-C6 галоалкил, C2-C6 алкенил, C2-C6 галоалкенил, C2-C6 алкинил, C3-C6 галоалкинил, C3-C6 циклоалкил, C3-C6 галоциклоалкил, C1-C6 алкокси, C1-C6 галоалкокси, C1-C6 алкилтио, C2-C7 алкилкарбонил, C2-C7 галоалкилкарбонил, C1-C6 галоалкилтио, C1-C6 алкилсульфинил, C1-C6 галоалкилсульфинил, C1-C6 алкилсульфонил, C1-C6 галоалкилсульфонил, -N(R4)R5, -C(=W)N(R4)R5, -C(=W)OR5, -CN, -OR11 или -NO2; или фенильное кольцо или 5- или 6-членное насыщенное или ненасыщенное гетероциклическое кольцо, каждое кольцо необязательно замещено одним или более заместителем, независимо выбранным из галогена, C1-C6 алкила, C1-C6 галоалкила, C3-C6 циклоалкила, C3-C6 галоциклоалкила, C1-C6 алкокси, C1-C6 галоалкокси, C1-C6 алкилтио, C1-C6 галоалкилтио, C1-C6 алкилсульфинила, C1-C6 галоалкилсульфинила, C1-C6 алкилсульфонила, C1-C6 галоалкилсульфонила, -CN, -NO2, -N(R4)R5, -C(=W)N(R4)R5, -C(=O)OR5 и R7;
каждый R4 представляет собой независимо H, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, C4-C7 алкилциклоалкил, C4-C7 циклоалкилалкил, C2-C7 алкилкарбонил или C2-C7 алкоксикарбонил;
каждый R5 представляет собой независимо H; или C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, C4-C7 алкилциклоалкил или C4-C7 циклоалкилалкил, каждый необязательно замещенный одним или более заместителем, независимо выбранным из R6;
каждый R6 представляет собой независимо галоген, C1-C6 алкил, C1-C6 алкокси, C1-C6 алкилтио, C1-C6 алкилсульфинил, C1-C6 алкилсульфонил, C1-C6 алкиламино, C2-C8 диалкиламино, C3-C6 циклоалкиламино, C2-C7 алкилкарбонил, C2-C7 алкоксикарбонил, C2-C7 алкиламинокарбонил, C3-C9 диалкиламинокарбонил, C2-C7 галоалкилкарбонил, C2-C7 галоалкоксикарбонил, C2-C7 галоалкиламинокарбонил, C3-C9 галодиалкиламинокарбонил, -OH, -NH2, -CN или -NO2; или Q1;
каждый R7представляет собой независимо фенильное кольцо или пиридинильное кольцо, каждое кольцо необязательно замещенное одним или более заместителем, независимо выбранным из R8;
каждый R8 представляет собой независимо галоген, C1-C6 алкил, C1-C6 галоалкил, C1-C6 алкокси, C1-C6 галоалкокси, C1-C6 алкилтио, C1-C6 галоалкилтио, C1-C6 алкилсульфинил, C1-C6 галоалкилсульфинил, C1-C6 алкилсульфонил, C1-C6 галоалкилсульфонил, C1-C6 алкиламино, C2-C6 диалкиламино, C2-C4 алкилкарбонил, C2-C4 алкоксикарбонил, C2-C7 алкиламинокарбонил, C3-C7 диалкиламинокарбонил, -OH, -NH2, -C(=O)OH, -CN или -NO2;
каждый Q1представляет собой независимо фенильное кольцо или 5- или 6-членное насыщенное или ненасыщенное гетероциклическое кольцо, каждое кольцо необязательно замещено одним или более заместителем, независимо выбранным из галогена, C1-C6 алкила, C1-C6 галоалкила, C3-C6 циклоалкила, C3-C6 галоциклоалкила, C1-C6 алкокси, C1-C6 галоалкокси, C1-C6 алкилтио, C1-C6 галоалкилтио, C1-C6 алкилсульфинила, C1-C6 галоалкилсульфинила, C1-C6 алкилсульфонила, C1-C6 галоалкилсульфонила, C1-C6 алкиламино, C2-C6 диалкиламино, -CN, -NO2, -C(=W)N(R9)R10 и -C(=O)OR10;
каждый R9 представляет собой независимо H, C1-C6 алкил, C1-C6 галоалкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, C4-C7 алкилциклоалкил, C4-C7 циклоалкилалкил, C2-C7 алкилкарбонил или C2-C7 алкоксикарбонил;
каждый R10 представляет собой независимо H; или C1-C6 алкил, C1-C6 галоалкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, C4-C7 алкилциклоалкил или C4-C7 циклоалкилалкил;
каждый R11 представляет собой независимо H; или C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, C4-C7 алкилциклоалкил, C4-C7 циклоалкилалкил, C2-C7 алкилкарбонил, C2-C7 алкоксикарбонил, C1-C6 алкилсульфонил или C1-C6 галоалкилсульфонил; и
каждый W представляет собой независимо O или S.
Вариант осуществления 2A. Способ варианта осуществления 2, где Q представляет собой фенил, необязательно замещенный до 4 заместителями, независимо выбранными из R3.
Вариант осуществления 2B. Способ варианта осуществления 2, где Q представляет собой 1-нафталенил, необязательно замещенный до 4 заместителями, независимо выбранными из R3.
Вариант осуществления 2C. Способ варианта осуществления 2, где каждый R3 представляет собой независимо галоген, C1-C6 алкил, C1-C6 галоалкил, -C(W)N(R4)R5, -C(W)OR5 или -CN; или фенильное кольцо или 5- или 6-членное насыщенное или ненасыщенное гетероциклическое кольцо, каждое кольцо необязательно замещено заместителями, независимо выбранными из галогена, C1-C6 алкила, C1-C6 галоалкила, -CN, -C(W)N(R4)R5 и -C(O)OR5.
Вариант осуществления 2D. Способ варианта осуществления 2, где каждый R4представляет собой независимо H или C1-C6 алкил.
Вариант осуществления 2E. Способ варианта осуществления 2, где каждый R5 представляет собой независимо H; или C1-C6 алкил, необязательно замещенный заместителями, независимо выбранными из R6.
Вариант осуществления 2F. Способ варианта осуществления 2, где каждый R6 представляет собой независимо галоген, C1-C6 алкил, C1-C6 алкокси, C1-C6 алкилтио, C2-C7 алкоксикарбонил, C2-C7 алкиламинокарбонил, C3-C9 диалкиламинокарбонил, C2-C7 галоалкиламинокарбонил, C3-C9 галодиалкиламинокарбонил или -CN; или Q1.
Вариант осуществления 2G. Способ варианта осуществления 2, где каждый Q1 представляет собой независимо пиридинильное кольцо, необязательно замещенное до 4 галогенами.
Вариант осуществления 2H. Способ варианта осуществления 2B, где
Q представляет собой

R3 представляет собой C(O)N(R4)R5 или C(O)OR5.
Вариант осуществления 2I. Способ варианта осуществления 2H, где
R4 представляет собой H, C2-C7 алкилкарбонил или C2-C7 алкоксикарбонил.
Вариант осуществления 2J. Способ варианта осуществления 2I, где R4 представляет собой H.
Вариант осуществления 2K. Способ любого одного из вариантов осуществления 2H-2J, где
R3 представляет собой C(O)N(R4)R5 или C(O)OR5a;
R5 представляет собой C1-C6 алкил или C1-C6 галоалкил, каждый замещенный одним заместителем, независимо выбранным из гидрокси, C1-C6 алкокси, C1-C6 алкилтио, C1-C6 алкилсульфинила, C1-C6 алкилсульфонила, C2-C7 алкиламинокарбонила, C3-C9 диалкиламинокарбонила, C2-C7 галоалкиламинокарбонила и C3-C9 галодиалкиламинокарбонила; и
R5a представляет собой C1-C6 алкил, C2-C6 алкенил или C2-C6 алкинил, каждый необязательно замещенный одним или более заместителем, независимо выбранным из галогена, C1-C2 алкокси и фенила, необязательно замещенного до 5 заместителями, выбранными из галогена и C1-C3 алкила.
Вариант осуществления 2L. Способ любого одного из вариантов осуществления 2H-2K, где
R5a представляет собой C1-C6 алкил, необязательно замещенный фенилом.
Вариант осуществления 2M. Способ любого одного из вариантов осуществления 2H-2L, где
R3 представляет собой C(O)N(R4)R5.
Вариант осуществления 2N. Способ любого одного из вариантов осуществления 2H-2J, где
R3 представляет собой C(O)OR5.
Вариант осуществления 2O. Способ любого одного из вариантов осуществления 2K-2L, где
R3 представляет собой C(O)OR5a.
Вариант осуществления 3. Способ любого одного из вариантов осуществления 1-2O, где
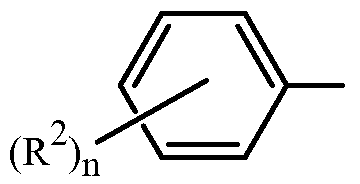
Z представляет собой фенил, необязательно замещенный до 5 заместителями, независимо выбранными из R2 (т.е.,
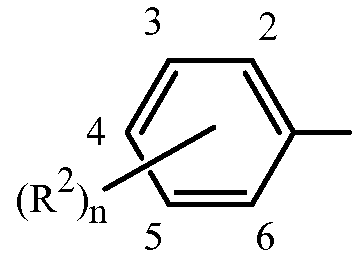
где n равно 0, 1, 2, 3, 4 или 5); и
каждый R2 представляет собой независимо галоген, C1-C6 алкил, C1-C6 галоалкил, C1-C6 алкокси, C1-C6 галоалкокси, C1-C6 алкилтио, C1-C6 галоалкилтио, C1-C6 алкиламино, C2-C6 диалкиламино, -CN или -NO2.
Вариант осуществления 3A. Способ варианта осуществления 3, где Z представляет собой фенильное кольцо, замещенное до 3 заместителями, независимо выбранными из R2, указанные заместители присоединены в положения 3, 4 или 5 фенильного кольца.
Вариант осуществления 3B. Способ варианта осуществления 3 или 3A, где каждый R2 представляет собой независимо F, Cl, Br, C1-C6 алкил, C1-C6 фторалкил, C1-C6 алкокси, C1-C6 фторалкокси, C1-C6 алкилтио или C1-C6 фторалкилтио.
Вариант осуществления 3C. Способ варианта осуществления 3 или 3A, где каждый R2 представляет собой независимо галоген, C1-C6 алкил, C1-C6 галоалкил или -CN.
Вариант осуществления 3D. Способ варианта осуществления 3C, где каждый R2 представляет собой независимо галоген или C1-C6 галоалкил.
Вариант осуществления 3E. Способ варианта осуществления 3D, где каждый R2 представляет собой независимо галоген или CF3.
Вариант осуществления 3F. Способ варианта осуществления 3E, где каждый R2 представляет собой независимо F, Cl или CF3.
Вариант осуществления 3G. Способ варианта осуществления 3A, где Z представляет собой

R2a представляет собой галоген, C1-C2 галоалкил или C1-C2 галоалкокси; R2b представляет собой H, галоген или циано; и R2c представляет собой H, галоген или CF3.
Вариант осуществления 3H. Способ варианта осуществления 3G, где R2a представляет собой CF3 или галоген; и R2c представляет собой H, CF3 или галоген.
Вариант осуществления 3I. Способ варианта осуществления 3H, где R2a представляет собой CF3.
Вариант осуществления 3J. Способ любого одного из вариантов осуществления 3G-3I, где R2b представляет собой H.
Вариант осуществления 3K. Способ любого одного из вариантов осуществления 3G-3J, где R2c представляет собой CF3 или галоген.
Вариант осуществления 3L. Способ варианта осуществления 3K, где R2c представляет собой CF3, F, Cl или Br.
Вариант осуществления 3M. Способ варианта осуществления 3L, где R2c представляет собой F, Cl или Br.
Вариант осуществления 3N. Способ варианта осуществления 3L, где R2c представляет собой CF3, Cl или Br.
Вариант осуществления 3O. Способ варианта осуществления 3N, где R2c представляет собой Cl или Br.
Вариант осуществления 3P. Способ варианта осуществления 3O, где R2b представляет собой H и R2c представляет собой Cl.
Вариант осуществления 3Q. Способ варианта осуществления 3O, где R2b представляет собой H и R2c представляет собой Br.
Вариант осуществления 4. Способ получения соединения Формулы 2, описанный в кратком описании изобретения, содержит этапы, на которых (1) формируют реакционную смесь, содержащую реактив Гриньяра, полученный из соединения Формулы 5 контактированием соединения Формулы 5 с (a) металлическим магнием, или (b) галогенидом алкилмагния в присутствии эфирного растворителя; и затем (2) контактированием реакционной смеси с соединением Формулы 6.
Вариант осуществления 4A. Способ любого одного из вариантов осуществления 1-2O и 3-3Q дополнительно отличается тем, что получают соединение Формулы 2 способом варианта осуществления 4.
Вариант осуществления 4B. Способ варианта осуществления 4 или 4A, где X представляет собой Cl или I.
Вариант осуществления 4C. Способ варианта осуществления 4 или 4A, где X представляет собой Br или I.
Вариант осуществления 4D. Способ варианта осуществления 4 или 4A, где X представляет собой Cl или Br.
Вариант осуществления 4E. Способ варианта осуществления 4 или 4A, где X представляет собой Cl.
Вариант осуществления 4F. Способ варианта осуществления 4 или 4A, где X представляет собой Br.
Вариант осуществления 4G. Способ варианта осуществления 4 или 4A, где X представляет собой I.
Вариант осуществления 4H. Способ любого одного из вариантов осуществления 4-4G, где
Z представляет собой фенил, необязательно замещенный до 5 заместителями, независимо выбранными из R2 (т.е.

где n равно 0, 1, 2, 3, 4 или 5); и
каждый R2 представляет собой независимо F, Cl, Br, C1-C6 алкил, C1-C6 фторалкил, C1-C6 алкокси, C1-C6 фторалкокси, C1-C6 алкилтио или C1-C6 фторалкилтио;
при условии, что когда X представляет собой Cl, тогда каждый R2 представляет собой независимо F, Cl, C1-C6 алкил, C1-C6 фторалкил, C1-C6 алкокси, C1-C6 фторалкокси, C1-C6 алкилтио или C1-C6 фторалкилтио.
Вариант осуществления 4I. Способ варианта осуществления 4H, при котором, когда X представляет собой Br, тогда каждый R2 представляет собой независимо F, Cl, C1-C6 алкил, C1-C6 фторалкил, C1-C6 алкокси, C1-C6 фторалкокси, C1-C6 алкилтио или C1-C6 фторалкилтио; и когда X представляет собой Cl, тогда каждый R2 представляет собой независимо F, C1-C6 алкил, C1-C6 фторалкил, C1-C6 алкокси, C1-C6 фторалкокси, C1-C6 алкилтио или C1-C6 фторалкилтио.
Вариант осуществления 4J. Способ любого одного из вариантов осуществления 3, 4H и 4I, где Z представляет собой фенильное кольцо, замещенное до 3 заместителями, независимо выбранными из R2, причем указанные заместители присоединены в 3, 4 или 5 положения фенильного кольца.
Вариант осуществления 4K. Способ любого одного из вариантов осуществления 4H, 4I и 4J, где каждый R2 представляет собой независимо F, Cl, Br, C1-C6 алкил или C1-C6 фторалкил.
Вариант осуществления 4L. Способ варианта осуществления 4K, где каждый R2 представляет собой независимо F, Cl, Br или C1-C6 фторалкил.
Вариант осуществления 4M. Способ варианта осуществления 4L, где каждый R2 представляет собой независимо F, Cl, Br или CF3.
Вариант осуществления 4N. Способ любого одного из вариантов осуществления 4H-4M, где Z представляет собой фенильное кольцо, замещенное 2 заместителями, независимо выбранными из R2, причем указанные заместители присоединены в 3 и 5 положения фенильного кольца.
Вариант осуществления 4O. Способ варианта осуществления 4N, где каждый R2 представляет собой независимо F, Cl, Br или CF3.
Вариант осуществления 4P. Способ варианта осуществления 4O, где, по меньшей мере, один R2 представляет собой CF3.
Вариант осуществления 4Q. Способ варианта осуществления 4P, где один R2 представляет собой CF3 и другой R2 представляет собой Cl или Br.
Вариант осуществления 4R. Способ варианта осуществления 4Q, где один R2 представляет собой CF3 и другой R2 представляет собой Cl.
Вариант осуществления 4S. Способ варианта осуществления 3A или 3H, где Z представляет собой

R2a представляет собой F, Cl, Br, C1-C2 фторалкил или C1-C2 фторалкокси; R2b представляет собой H, F, Cl или Br; и R2c представляет собой H, F, Cl, Br или CF3.
Вариант осуществления 4T. Способ варианта осуществления 4S, где R2a представляет собой CF3, F, Cl или Br; и R2c представляет собой H, CF3, F, Cl или Br.
Вариант осуществления 4U. Способ варианта осуществления 4T, где R2a представляет собой CF3.
Вариант осуществления 4V. Способ любого одного из вариантов осуществления 4S-4U, где R2b представляет собой H.
Вариант осуществления 4W. Способ любого одного из вариантов осуществления 4S-4V, где R2c представляет собой CF3, F, Cl или Br.
Вариант осуществления 4X. Способ варианта осуществления 4W, где R2c представляет собой F, Cl или Br.
Вариант осуществления 4Y. Способ варианта осуществления 4W, где R2c представляет собой CF3, Cl или Br.
Вариант осуществления 4Z. Способ варианта осуществления 4Y, где R2c представляет собой Cl или Br.
Вариант осуществления 4ZA. Способ варианта осуществления 4Z, где R2b представляет собой H и R2c представляет собой Cl.
Вариант осуществления 4ZB. Способ варианта осуществления 4Z, где R2b представляет собой H и R2c представляет собой Br.
Вариант осуществления 4ZC. Способ любого одного из вариантов осуществления 4S-4ZB, где X представляет собой I.
Вариант осуществления 5. Соединение Формулы 2, как описано в кратком описании изобретения, где
Z представляет собой

R2a представляет собой CF3; R2b представляет собой H или галоген; и R2c представляет собой галоген.
Вариант осуществления 5A. Соединение варианта осуществления 5, где R2b представляет собой H.
Вариант осуществления 5B. Соединение варианта осуществления 5 или 5A, где R2c представляет собой F, Cl или Br.
Вариант осуществления 5C. Соединение варианта осуществления 5B, где R2c представляет собой Cl или Br.
Вариант осуществления 5D. Соединение варианта осуществления 5C, выбранное из группы, содержащей:
1-[3-хлор-5-(трифторметил)]-2,2,2-трифторэтанон; и
1-[3-бром-5-(трифторметил)]-2,2,2-трифторэтанон.
Вариант осуществления 5E. Соединение Формулы 5, как описано в кратком описании изобретения, представляет собой 1-хлор-3-йод-5-(трифторметил)бензол.
Вариант осуществления 6. Способ варианта осуществления 1A или 1E, где M представляет собой Ca (т.е., гидроксид щелочноземельного металла представляет собой гидроксид кальция).
Вариант осуществления 6A. Способ варианта осуществления 1A, 1E или 6, где молярное отношение гидроксида щелочноземельного металла к соединению Формулы 2 равно, по меньшей мере, приблизительно 0,1.
Вариант осуществления 6A1. Способ варианта осуществления 6A, где молярное отношение гидроксида щелочноземельного металла к соединению Формулы 2 равно, по меньшей мере, приблизительно 0,5.
Вариант осуществления 6B. Способ варианта осуществления 6A1, где молярное отношение гидроксида щелочноземельного металла к соединению Формулы 2 равно, по меньшей мере, приблизительно 0,8.
Вариант осуществления 6C. Способ любого одного из вариантов осуществления 1A, 1E или 6-6B, где молярное отношение гидроксида щелочноземельного металла к соединению Формулы 2 равно не более чем приблизительно 1.
Вариант осуществления 6D. Способ варианта осуществления 1B или 1F, где M1 представляет собой K (т.е. карбонат щелочного металла представляет собой карбонат калия).
Вариант осуществления 6E. Способ варианта осуществления 1B, 1F или 6D, где молярное отношение карбоната щелочного металла к соединению Формулы 2 равно, по меньшей мере, приблизительно 0,01.
Вариант осуществления 6F. Способ варианта осуществления 6E, где молярное отношение карбоната щелочного металла к соединению Формулы 2 равно, по меньшей мере, приблизительно 0,03.
Вариант осуществления 6G. Способ любого одного из вариантов осуществления 1B, 1F или 6D-6F, где молярное отношение карбоната щелочного металла к соединению Формулы 2 равно не более чем приблизительно 0,2.
Вариант осуществления 6H. Способ варианта осуществления 1C или 1G, где молярное отношение 1,5-диазабицикло[4,3,0]нон-5-ена, 1,8-диазабицикло[5,4,0]ундец-7-ена или их смеси к соединению Формулы 2 равно, по меньшей мере, приблизительно 0,01.
Вариант осуществления 6I. Способ варианта осуществления 6H, где молярное отношение 1,5-диазабицикло[4,3,0]нон-5-ена, 1,8-диазабицикло[5,4,0]ундец-7-ена или их смеси к соединению Формулы 2 равно, по меньшей мере, приблизительно 0,03.
Вариант осуществления 6J. Способ любого одного из вариантов осуществления 1C, 1G, 6H или 6I, где молярное отношение 1,5-диазабицикло[4,3,0]нон-5-ена, 1,8-диазабицикло-[5,4,0]ундец-7-ена или их смеси к соединению Формулы 2 равно не более чем приблизительно 0,2.
Вариант осуществления 7. Способ варианта осуществления 1A или 1E, где полярный апротонный растворитель включает амид или сульфоксид (включая их смеси).
Вариант осуществления 7A. Способ варианта осуществления 7, где полярный апротонный растворитель включает один или более N,N-диметилформамид, N,N-диметилацетамид, N-метилпирролидинон и метилсульфоксид.
Вариант осуществления 7B. Способ варианта осуществления 7, где полярный апротонный растворитель включает амид.
Вариант осуществления 7C. Способ варианта осуществления 7B, где полярный апротонный растворитель включает один или более N,N-диметилформамид, N,N-диметилацетамид, N-метилпирролидинон.
Вариант осуществления 7D. Способ варианта осуществления 7C, где полярный апротонный растворитель включает N,N-диметилформамид.
Вариант осуществления 8. Способ варианта осуществления 1A или 1E, где апротонный растворитель, способный формировать низкокипящий азеотроп с водой, включает эфир.
Вариант осуществления 8A. Способ варианта осуществления 8, где апротонный растворитель, способный формировать низкокипящий азеотроп с водой, включает трет-бутилметиловый эфир.
Вариант осуществления 8B. Способ любого одного из вариантов осуществления 1B, 1C, 1F, 1G или 6D - 6J, где апротонный растворитель, способный формировать низкокипящий азеотроп с водой, включает ацетонитрил.
Вариант осуществления 8C. Способ варианта осуществления 8A, где полярный апротонный растворитель включает N,N-диметилформамид.
Вариант осуществления 8D. Способ варианта осуществления 8C, где трет-бутилметиловый эфир и N,N-диметилформамид находятся в весовом соотношении в диапазоне от приблизительно 0,5 до приблизительно 2.
Вариант осуществления 9. Способ варианта осуществления 1A или 1E, где смесь находится при температуре, по меньшей мере, приблизительно 65°C.
Вариант осуществления 9A. Способ варианта осуществления 9, где смесь находится при температуре, по меньшей мере, приблизительно 70°C.
Вариант осуществления 9B. Способ варианта осуществления 9A, где смесь находится при температуре, по меньшей мере, приблизительно 75°C.
Вариант осуществления 9C. Способ варианта осуществления 1B, 1C, 1F или 1G, где смесь находится при температуре, по меньшей мере, приблизительно 65°C.
Вариант осуществления 9D. Способ варианта осуществления 9C, где смесь находится при температуре, по меньшей мере, приблизительно 80°C.
Вариант осуществления 9E. Способ варианта осуществления 9D, где смесь находится при температуре, по меньшей мере, приблизительно 85°C.
Вариант осуществления 9F. Способ любого одного из вариантов осуществления 9- 9E, где смесь находится при температуре не более чем приблизительно 110°C.
Вариант осуществления 9G. Способ варианта осуществления 9F, где смесь находится при температуре не более чем приблизительно 100°C.
Вариант осуществления 9H. Способ варианта осуществления 9G, где смесь находится при температуре не более чем приблизительно 90°C.
Вариант осуществления 10. Способ варианта осуществления 4 или 4A, где соединение Формулы 5 контактирует с металлическим магнием.
Вариант осуществления 10A. Способ варианта осуществления 10, где молярное отношение металлического магния к соединению Формулы 5 равно, по меньшей мере, приблизительно 1.
Вариант осуществления 10B. Способ варианта осуществления 10A, где молярное отношение металлического магния к соединению Формулы 5 равно, по меньшей мере, приблизительно 1,02.
Вариант осуществления 10C. Способ варианта осуществления 10B, где молярное отношение металлического магния к соединению Формулы 5 равно, по меньшей мере, приблизительно 1,05.
Вариант осуществления 10D. Способ любого одного из вариантов осуществления 10-10C, где молярное отношение металлического магния к соединению Формулы 5 равно не более чем приблизительно 1,2.
Вариант осуществления 10E. Способ варианта осуществления 10D, где молярное отношение металлического магния к соединению Формулы 5 равно не более чем приблизительно 1,1.
Вариант осуществления 10F. Способ варианта осуществления 4 или 4A, где соединение Формулы 5 контактирует с галогенидом алкилмагния.
Вариант осуществления 10G. Способ варианта осуществления 10F, где галогенид алкилмагния представляет собой галогенид C1-C4 алкилмагния.
Вариант осуществления 10H. Способ варианта осуществления 10F или 10G, где галогенид алкилмагния представляет собой галогенид вторичного алкилмагния.
Вариант осуществления 10I. Способ варианта осуществления 10H, где галогенид алкилмагния представляет собой галогенид изопропилмагния.
Вариант осуществления 10J. Способ варианта осуществления 10I, где галогенид алкилмагния представляет собой хлорид изопропилмагния.
Вариант осуществления 10K. Способ любого одного из вариантов осуществления 10F-10J, где молярное отношение галогенида алкилмагния к соединению Формулы 5 равно, по меньшей мере, приблизительно 1.
Вариант осуществления 10L. Способ варианта осуществления 10K, где молярное отношение галогенида алкилмагния к соединению Формулы 5 равно, по меньшей мере, приблизительно 1,05.
Вариант осуществления 10M. Способ любого одного из вариантов осуществления 10F-10L, где молярное отношение галогенида алкилмагния к соединению Формулы 5 равно не более чем приблизительно 1,2.
Вариант осуществления 10N. Способ варианта осуществления 10M, где молярное отношение галогенида алкилмагния к соединению Формулы 5 равно не более чем приблизительно 1,15.
Вариант осуществления 10O. Способ варианта осуществления 4 или 4A, где соединение Формулы 6 представляет собой метилтрифторацетат или этилтрифторацетат.
Вариант осуществления 11. Способ варианта осуществления 4 или 4A, где эфирный растворитель включает один или более этиловый эфир, 1,4-диоксан, тетрагидрофуран и 1,2-диметоксиэтан.
Вариант осуществления 11A. Способ варианта осуществления 11, где эфирный растворитель включает этиловый эфир или тетрагидрофуран.
Вариант осуществления 11B. Способ варианта осуществления 11A, где эфирный растворитель включает тетрагидрофуран.
Вариант осуществления 11C. Способ любого одного из вариантов осуществления 4, 4A или 11-11B, где соединение Формулы 5 приводят в контакт с (a) металлическим магнием, или (b) галогенидом алкилмагния в присутствии ароматического углеводородного растворителя с добавлением эфирного растворителя.
Вариант осуществления 11D. Способ варианта осуществления 11C, где ароматический углеводородный растворитель включает один или более бензол, толуол и ксилол.
Вариант осуществления 11E. Способ варианта осуществления 11D, где ароматический углеводородный растворитель включает толуол.
Варианты осуществления данного изобретения, включая Варианты осуществления 1-11E, изложенные выше, также как любые другие варианты осуществления, описанные здесь, могут сочетаться любым способом, и описания переменных в вариантах осуществления принадлежит не только к вышеописанным способам получения соединений Формулы 1, 2 и 7, но также к исходным соединениям и промежуточным соединениям, применимым для получения соединений Формулы 1, 2 и 7 с помощью данных способов.
Иллюстрация сочетаний Вариантов осуществления 1-11E:
Вариант осуществления A. Способ, описанный в кратком описании изобретения, получения соединения Формулы 1, включающий этап, на котором дистиллируют воду из смеси, содержащей соединение Формулы 2, соединение Формулы 3, основание, и апротонный растворитель, способный формировать низкокипящий азеотроп с водой, где
Z представляет собой фенил, необязательно замещенный до 5 заместителями, независимо выбранными из R2;
Q представляет собой фенил или 1-нафталенил, каждый необязательно замещенный до 4 заместителями, независимо выбранными из R3;
каждый R2 представляет собой независимо галоген, C1-C6 алкил, C1-C6 галоалкил, C1-C6 алкокси, C1-C6 галоалкокси, C1-C6 алкилтио, C1-C6 галоалкилтио, C1-C6 алкиламино, C2-C6 диалкиламино, -CN или -NO2;
каждый R3 представляет собой независимо галоген, C1-C6 алкил, C1-C6 галоалкил, C2-C6 алкенил, C2-C6 галоалкенил, C2-C6 алкинил, C3-C6 галоалкинил, C3-C6 циклоалкил, C3-C6 галоциклоалкил, C1-C6 алкокси, C1-C6 галоалкокси, C1-C6 алкилтио, C2-C7 алкилкарбонил, C2-C7 галоалкилкарбонил, C1-C6 галоалкилтио, C1-C6 алкилсульфинил, C1-C6 галоалкилсульфинил, C1-C6 алкилсульфонил, C1-C6 галоалкилсульфонил, -N(R4)R5, -C(=W)N(R4)R5, -C(=W)OR5, -CN, -OR11 или -NO2; или фенильное кольцо или 5- или 6-членное насыщенное или ненасыщенное гетероциклическое кольцо, каждое кольцо необязательно замещено одним или более заместителем, независимо выбранным из галогена, C1-C6 алкила, C1-C6 галоалкила, C3-C6 циклоалкила, C3-C6 галоциклоалкила, C1-C6 алкокси, C1-C6 галоалкокси, C1-C6 алкилтио, C1-C6 галоалкилтио, C1-C6 алкилсульфинила, C1-C6 галоалкилсульфинила, C1-C6 алкилсульфонила, C1-C6 галоалкилсульфонила, -CN, -NO2, -N(R4)R5, -C(=W)N(R4)R5, -C(=O)OR5 и R7;
каждый R4 представляет собой независимо H, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, C4-C7 алкилциклоалкил, C4-C7 циклоалкилалкил, C2-C7 алкилкарбонил или C2-C7 алкоксикарбонил;
каждый R5 представляет собой независимо H; или C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, C4-C7 алкилциклоалкил или C4-C7 циклоалкилалкил, каждый необязательно замещенный одним или более заместителем, независимо выбранным из R6;
каждый R6 представляет собой независимо галоген, C1-C6 алкил, C1-C6 алкокси, C1-C6 алкилтио, C1-C6 алкилсульфинил, C1-C6 алкилсульфонил, C1-C6 алкиламино, C2-C8 диалкиламино, C3-C6 циклоалкиламино, C2-C7 алкилкарбонил, C2-C7 алкоксикарбонил, C2-C7 алкиламинокарбонил, C3-C9 диалкиламинокарбонил, C2-C7 галоалкилкарбонил, C2-C7 галоалкоксикарбонил, C2-C7 галоалкиламинокарбонил, C3-C9 галодиалкиламинокарбонил, -OH, -NH2, -CN или -NO2; или Q1;
каждый R7 представляет собой независимо фенильное кольцо или пиридинильное кольцо, каждое кольцо необязательно замещено одним или более заместителем, независимо выбранным из R8;
каждый R8 представляет собой независимо галоген, C1-C6 алкил, C1-C6 галоалкил, C1-C6 алкокси, C1-C6 галоалкокси, C1-C6 алкилтио, C1-C6 галоалкилтио, C1-C6 алкилсульфинил, C1-C6 галоалкилсульфинил, C1-C6 алкилсульфонил, C1-C6 галоалкилсульфонил, C1-C6 алкиламино, C2-C6 диалкиламино, C2-C4 алкилкарбонил, C2-C4 алкоксикарбонил, C2-C7 алкиламинокарбонил, C3-C7 диалкиламинокарбонил, -OH, -NH2, -C(=O)OH, -CN или -NO2;
каждый Q1 представляет собой независимо фенильное кольцо, или 5- или 6-членное насыщенное или ненасыщенное гетероциклическое кольцо, каждое кольцо необязательно замещено одним или более заместителем, независимо выбранным из галогена, C1-C6 алкила, C1-C6 галоалкила, C3-C6 циклоалкила, C3-C6 галоциклоалкила, C1-C6 алкокси, C1-C6 галоалкокси, C1-C6 алкилтио, C1-C6 галоалкилтио, C1-C6 алкилсульфинила, C1-C6 галоалкилсульфинила, C1-C6 алкилсульфонила, C1-C6 галоалкилсульфонила, C1-C6 алкиламино, C2-C6 диалкиламино, -CN, -NO2, -C(=W)N(R9)R10 и -C(=O)OR10;
каждый R9 представляет собой независимо H, C1-C6 алкил, C1-C6 галоалкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, C4-C7 алкилциклоалкил, C4-C7 циклоалкилалкил, C2-C7 алкилкарбонил или C2-C7 алкоксикарбонил;
каждый R10 представляет собой независимо H; или C1-C6 алкил, C1-C6 галоалкил, C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, C4-C7 алкилциклоалкил или C4-C7 циклоалкилалкил;
каждый R11 представляет собой независимо H; или C2-C6 алкенил, C2-C6 алкинил, C3-C6 циклоалкил, C4-C7 алкилциклоалкил, C4-C7 циклоалкилалкил, C2-C7 алкилкарбонил, C2-C7 алкоксикарбонил, C1-C6 алкилсульфонил или C1-C6 галоалкилсульфонил; и
каждый W представляет собой независимо O или S.
Вариант осуществления A1. Способ варианта осуществления A, где основание представляет собой гидроксид щелочноземельного металла Формулы 4, и смесь дополнительно включает полярный апротонный растворитель.
Вариант осуществления A2. Способ варианта осуществления A или A1, где Q представляет собой фенил, необязательно замещенный до 4 заместителями, независимо выбранными из R3.
Вариант осуществления A3. Способ варианта осуществления A или A1, где Q представляет собой 1-нафталенил, необязательно замещенный до 4 заместителями, независимо выбранными из R3.
Вариант осуществления A4. Способ варианта осуществления A, A1 или A2, где
каждый R2 представляет собой независимо галоген или C1-C6 галоалкил;
каждый R3 представляет собой независимо галоген, C1-C6 алкил, C1-C6 галоалкил, -C(W)N(R4)R5, -C(W)OR5 или -CN; или фенильное кольцо или 5- или 6-членное гетероциклическое кольцо, каждое кольцо необязательно замещено одним или более заместителем, независимо выбранным из галогена, C1-C6 алкила, C1-C6 галоалкила, -CN, -C(W)N(R4)R5 и -C(O)OR5;
каждый R4 представляет собой независимо H или C1-C6 алкил;
каждый R5 представляет собой независимо H; или C1-C6 алкил, необязательно замещенный одним или более заместителем, независимо выбранным из R6;
каждый R6 представляет собой независимо галоген, C1-C6 алкил, C1-C6 алкокси, C1-C6 алкилтио, C2-C7 алкоксикарбонил, C2-C7 алкиламинокарбонил, C3-C9 диалкиламинокарбонил, C2-C7 галоалкиламинокарбонил, C3-C9 галодиалкиламинокарбонил или -CN; или Q1; и
каждый Q1 представляет собой независимо пиридинильное кольцо, необязательно замещенное до 4 галогенами.
Вариант осуществления A5. Способ варианта осуществления A3, где
Z представляет собой


R2a представляет собой галоген, C1-C2 галоалкил или C1-C2 галоалкокси;
R2b представляет собой H, галоген или циано;
R2c представляет собой H, галоген или CF3;
R3 представляет собой C(O)N(R4)R5 или C(O)OR5a;
R4 представляет собой H, C2-C7 алкилкарбонил или C2-C7 алкоксикарбонил; и
R5 представляет собой C1-C6 алкил или C1-C6 галоалкил, каждый замещенный одним заместителем, независимо выбранным из гидрокси, C1-C6 алкокси, C1-C6 алкилтио, C1-C6 алкилсульфинила, C1-C6 алкилсульфонила, C2-C7 алкиламинокарбонила, C3-C9 диалкиламинокарбонила, C2-C7 галоалкиламинокарбонила и C3-C9 галодиалкиламинокарбонила; и
R5a представляет собой C1-C6 алкил, C2-C6 алкенил или C2-C6 алкинил, каждый необязательно замещенный одним или более заместителем, независимо выбранным из галогена, C1-C2 алкокси и фенила, необязательно замещенный до 5 заместителями, выбранными из галогена и C1-C3 алкила.
Вариант осуществления A6. Способ варианта осуществления A5, где R3 представляет собой C(O)N(R4)R5.
Вариант осуществления A7. Способ варианта осуществления A5, где R3 представляет собой C(O)OR5a.
Вариант осуществления B. Способ получения соединение Формулы 1, описанный в кратком описании изобретения, включающий этап, на котором дистиллирую воду из смеси, содержащей соединение Формулы 2, соединение Формулы 3, основание, и апротонный растворитель, способный формировать низкокипящий азеотроп с водой, где Z представляет собой фенил, необязательно замещенный до 5 заместителями, независимо выбранными из R2 (т.е.

где n равно 0, 1, 2, 3, 4 или 5); и
каждый R2 представляет собой независимо F, Cl, Br, C1-C6 алкил, C1-C6 фторалкил, C1-C6 алкокси, C1-C6 фторалкокси, C1-C6 алкилтио или C1-C6 фторалкилтио;
дополнительно включает получение соединения Формулы 2 с помощью этапов, на которых
(1) формируют реакционную смесь, содержащую реактив Гриньяра, полученный из соединения Формулы 5

где X представляет собой Cl, Br или I,
контактированием соединения Формулы 5 с
(a) металлическим магнием, или
(b) галогенидом алкилмагния
в присутствии эфирного растворителя; и затем
(2) контактирует реакционная смесь с соединением Формулы 6

где
Y представляет собой OR11 или NR12R13;
R11 представляет собой C1-C5 алкил; и
R12 и R13 представляет собой независимо C1-C2 алкил; или R12 и R13 взяты вместе, как -CH2CH2OCH2CH2-.
Вариант осуществления B1. Способ варианта осуществления B, где основание представляет собой гидроксид щелочноземельного металла Формулы 4, и смесь дополнительно включает полярный апротонный растворитель.
Вариант осуществления B2. Способ варианта осуществления B или B1, где Z представляет собой

R2a представляет собой F, Cl, Br, C1-C2 фторалкил или C1-C2 фторалкокси;
R2b представляет собой H, F, Cl или Br; и
R2c представляет собой H, F, Cl, Br или CF3.
Вариант осуществления C. Способ получения соединения Формулы 2, описанный в кратком описании изобретения, включающий этапы, на которых (1) формируют реакционную смесь, содержащую реактив Гриньяра, полученный из соединения Формулы 5, контактированием соединения Формулы 5 с (a) металлическим магнием, или (b) галогенидом алкилмагния в присутствии эфирного растворителя; и затем (2) контактирует реакционная смесь с соединением Формулы 6, где
X представляет собой I;
Z представляет собой фенил, необязательно замещенный до 5 заместителями, независимо выбранными из R2 (т.е.
где n равно 0, 1, 2, 3, 4 или 5); и
каждый R2 представляет собой независимо F, Cl, Br, C1-C6 алкил, C1-C6 фторалкил, C1-C6 алкокси, C1-C6 фторалкокси, C1-C6 алкилтио или C1-C6 фторалкилтио.
Вариант осуществления C1. Способ варианта осуществления C, где Z представляет собой

R2a представляет собой F, Cl, Br, C1-C2 фторалкил или C1-C2 фторалкокси;
R2b представляет собой H, F, Cl или Br; и
R2c представляет собой H, F, Cl, Br или CF3.
Вариант осуществления D. Способ получения соединения Формулы 7

где
Z представляет собой необязательно замещенный фенил; и
Q представляет собой фенил или 1-нафталенил, каждый необязательно замещенный;
применением соединения Формулы 1

отличающимся тем, что: получают указанное соединение Формулы 1 способом получения соединения Формулы 1, описанным в кратком описании изобретения, содержащим этап, на котором дистиллирую воду из смеси, содержащей соединение Формулы 2, соединение Формулы 3, основание, и апротонный растворитель, способный формировать низкокипящий азеотроп с водой.
Вариант осуществления D1. Способ варианта осуществления D, где основание представляет собой гидроксид щелочноземельного металла Формулы 4, и смесь дополнительно включает полярный апротонный растворитель.
Вариант осуществления D2. Способ варианта осуществления D или D1, где
Z представляет собой


R2a представляет собой галоген, C1-C2 галоалкил или C1-C2 галоалкокси;
R2b представляет собой H, галоген или циано;
R2c представляет собой H, галоген или CF3;
R4 представляет собой H, C2-C7 алкилкарбонил или C2-C7 алкоксикарбонил; и
R5 представляет собой C1-C6 алкил или C1-C6 галоалкил, каждый замещенный одним заместителем, независимо выбранным из гидрокси, C1-C6 алкокси, C1-C6 алкилтио, C1-C6 алкилсульфинила, C1-C6 алкилсульфонила, C2-C7 алкиламинокарбонила, C3-C9 диалкиламинокарбонила, C2-C7 галоалкиламинокарбонила и C3-C9 галодиалкиламинокарбонила.
Вариант осуществления E. Способ получения соединения Формулы 7

где
Z представляет собой необязательно замещенный фенил; и
Q представляет собой фенил или 1-нафталенил, каждый необязательно замещенный;
применением соединения Формулы 1

отличающимся тем, что: применяют как указанное соединение Формулы 1 соединение Формулы 1, полученное способом, описанным в кратком описании изобретения для получения соединение Формулы 1, содержащим этап, на котором дистиллирую воду из смеси, содержащей соединение Формулы 2, соединение Формулы 3, основание, и апротонный растворитель, способный формировать низкокипящий азеотроп с водой.
Вариант осуществления E1. Способ варианта осуществления E, где основание представляет собой гидроксид щелочноземельного металла Формулы 4, и смесь дополнительно включает полярный апротонный растворитель.
Вариант осуществления E2. Способ варианта осуществления E или E1, где
Z представляет собой


R2a представляет собой галоген, C1-C2 галоалкил или C1-C2 галоалкокси;
R2b представляет собой H, галоген или циано;
R2c представляет собой H, галоген или CF3;
R4 представляет собой H, C2-C7 алкилкарбонил или C2-C7 алкоксикарбонил; и
R5 представляет собой C1-C6 алкил или C1-C6 галоалкил, каждый замещенный одним заместителем, независимо выбранным из гидрокси, C1-C6 алкокси, C1-C6 алкилтио, C1-C6 алкилсульфинила, C1-C6 алкилсульфонила, C2-C7 алкиламинокарбонила, C3-C9 диалкиламинокарбонила, C2-C7 галоалкиламинокарбонила и C3-C9 галодиалкиламинокарбонила.
В последующих Схемах 1-10 определения Z, Q, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13 и W в соединениях Формулы 1-7 и 11-15 являются, как определено выше в кратком описании изобретения, и описании Вариантов осуществления, если не указано иное. Формула 1a представляет собой подмножество Формулы 1. Формула 5A представляет собой подмножество Формулы 5. Формулы 7a, 7b, 7c, 7d, 7e и 7f представляют собой подмножества Формулы 7. Формула 13a представляет собой подмножество Формулы 13.
В способе изобретения, проиллюстрированном в Схеме 1, соединение Формулы 1 получают с помощью этапа, на котором дистиллируют воду из смеси, содержащей соединение Формулы 2, соединение Формулы 3, основание гидроксида щелочноземельного металла Формулы 4, полярный апротонный растворитель, и апротонный растворитель, способный формировать низкокипящий азеотроп с водой.
Схема 1

где M представляет собой Ca, Sr или Ba.
Первый этап данной реакции включает альдольную конденсацию, которая формирует соединение Формулы 11. Соединение Формулы 11 является не выделенным, но взамен при условиях реакции превращается в соединение Формулы 1.
Стехиометрия данной реакции включает в себя эквимолярные количества соединений Формулы 2 и Формулы 3, и применение эквимолярных количеств, как правило, является более рентабельно. Тем не менее, небольшие молярные избытки одного из реагентов не опасны для реакции, и если один из реагентов является намного менее дорогим или более препаративно доступным, с применением его небольшого избытка (например, 1,05 молярных эквивалентов), может быть желательным обеспечить полное превращение более дорогого или менее препаративно доступного реагента.
Гидроксиды щелочноземельного металла Формулы 4 и соединения, способные формировать указанные гидроксиды щелочноземельного металла при контакте с водой, как было открыто, является чрезвычайно эффективным для обеспечения высоких выходов соединений Формулы 1. Данные основания гидроксида щелочноземельного металла включают гидроксиды кальция, стронция или бария, гидроксид кальция предпочтителен благодаря своей низкой стоимости. Гидроксиды щелочноземельного металла Формулы 4 могут быть сформированы in situ из соединений, способных формировать гидроксиды щелочноземельного металла при контакте с водой (определенных здесь как “предшественники гидроксида щелочноземельного металла”), такие как гидриды щелочноземельного металла. Предшественники гидроксида щелочноземельного металла могут реагировать с водой, присутствующей в реакционной смеси, включая воду, которая формируется в результате реакции, для формирования соответствующих гидроксидов щелочноземельных металлов. Гидриды щелочноземельного металла являются предпочтительными в качестве предшественников, поскольку их реакция для формирования гидроксидов щелочноземельного металла удаляет воду, формирующуюся в результате реакции, избегая дистилляции. Гидрид кальция является особенно предпочтительным в качестве предшественника гидроксида щелочноземельного металла вследствие его коммерческой доступности и относительно низкой стоимости. Хотя гидрид кальция является преимущественным для прямого удаления воды, добавление гидроксида кальция для формирования реакционной смеси является предпочтительным для способа Схемы 1, в котором воду удаляют при помощи азеотропной дистилляции, так как гидроксид кальция не формирует газообразный водород и является легче для того, чтобы увеличить масштаб, и, по существу, безопаснее при применении, чем гидрид металла в большом масштабе.
Гидроксид щелочноземельного металла добавляют для формирования реакционной смеси так, чтобы молярное отношение гидроксида щелочноземельного метала к соединению Формулы 3 находилось типично в диапазоне от приблизительно 0,1 до приблизительно 1. Типично соотношение в диапазоне от приблизительно 0,5 до приблизительно 1 обеспечивает высокую скорость реакции и высокие выходы продукта.
В данном способе реакционная смесь включает и полярный апротонный растворитель, и апротонный растворитель, способный формировать низкокипящий азеотроп с водой. Полярный апротонный растворитель может содержать смесь соединений полярного апротонного растворителя, но типично является одним соединением полярного апротонного растворителя. Как обычно понимают в данной области техники, апротонный растворитель обозначает жидкое соединение, которое не имеет -OH или -NH части в своей молекулярной структуре. Также как обычно понимают в данной области техники, полярный растворитель обозначает жидкое соединение, которое имеет диэлектрическую постоянную больше чем 15. Для данного способа полярные апротонные растворители специфического примечания являются достаточно полярными для смешивания с водой во всех пропорциях при комнатной температуре (например, приблизительно 20-25°C). Полярный апротонный растворитель более предпочтительно имеет точку кипения выше, чем точка кипения низкокипящего азеотропа, так что полярный апротонный растворитель не удаляется из реакционной смеси. Данные свойства лучше всего обеспечиваются амидным и сульфоксидным растворителями, которые являются коммерчески доступными при относительно низкой стоимости. Под амидными растворителями подразумевают соединения растворителя, содержащие карбоксамидную молекулярную часть. Общими примерами амидных растворителей являются N,N-диметилформамид, N,N-диметилацетамид и N-метилпирролидинон. Сульфоксидные растворители содержат сульфоксидную молекулярную часть; общие примеры включают диметилсульфоксид (также известный, как метилсульфоксид) и сульфолан. N,N-Диметилформамид является более предпочтительным, поскольку он обеспечивает прекрасные результаты, имеет точку кипения значительно выше, чем вода, но все еще может легко удалятся дистилляцией, и является коммерчески доступным при относительно низкой стоимости.
В данном способе включение апротонного растворителя, способного формировать низкокипящий азеотроп с водой, способствует удалению дистилляцией воды, которая образуется как побочный продукт. Апротонный растворитель обычно является одним соединением растворителя, но может также быть смесью соединений растворителя (например, изомеры ксилола). Под низкокипящим азеотропом подразумевается азеотроп, имеющий точку кипения ниже, чем и точка кипения воды, и точка кипения апротонного растворителя. По определению, низкокипящие азеотропы, содержащие воду, имеют нормальные точки кипения ниже, чем 100°C (т.е. нормальная точка кипения воды). Таким образом, точка кипения низкокипящего азеотропа будет значительно ниже, чем точки кипения соединений Формулы 1, 2 и 3, и данные соединения будут оставаться в реакционной смеси в течение дистилляции. Как уже упоминалось, предпочтительно, когда полярный апротонный растворитель и апротонный растворитель, способный формировать низкокипящий азеотроп, выбирают так, чтобы полярный апротонный растворитель имел точку кипения выше, чем азеотроп так, чтобы полярный апротонный растворитель не удалялся в течение дистилляции. Апротонные растворители, формирующие азеотропы с водой, как хорошо известно в данной области техники, и краткое руководство были опубликованы, представляя их точки кипения (см., например, Azeotropic Data, Number 6 в the Advances in Chemistry Series, American Chemical Society, Washington, D.C., 1952, в частности, страницы 6-12). Примеры подходящих апротонных растворителей, формирующих низкокипящие азеотропы с водой, включают эфиры, такие как этилацетат, ароматические углеводороды, такие как бензол и толуол, и эфиры, такие как трет-бутилметиловый эфир, тетрагидрофуран и 1,4-диоксан. Предпочтительно, азеотроп, сформированный апротонным растворителем и водой, включает большее процентное содержание воды, чем растворимо в апротонном растворителе при комнатной температуре (например, 15-35°C), таким образом, облегчая крупномасштабное отделение воды от конденсированного азеотропа в декантаторной ловушке, и повторное применение обезвоженного апротонного растворителя до середины дистилляционной колонны. Поэтому не смешивающиеся с водой апротонные растворители, такие как этилацетат, бензол, толуол и трет-бутилметиловый эфир, являются предпочтительнее, чем тетрагидрофуран и 1,4-диоксан, которые смешиваются с водой.
Трет-бутилметиловый эфир, как было открыто, является, в частности, применимым в качестве апротонного растворителя в данном способе. Трет-бутилметиловый эфир формирует азеотроп с водой, кипящий при 52,6°C, и содержащий 4% воды и 96% трет-бутилметилового эфира, и поэтому способен быстро перемещать воду дистилляцией из реакционной смеси. Кроме того, вода является растворимой в трет-бутилметиловом эфире до степени только приблизительно 1%. Поэтому в крупномасштабных получениях, где количество трет-бутилметилового эфира в декантаторной ловушке не достаточно для того, чтобы растворить всю воду, образовавшуюся в результате реакции, конденсат в ловушке будет разделяться на верхний слой, включающий трет-бутилметиловый эфир, содержащий только приблизительно 1% воды, который может быть возвращен к середине дистилляционной колонны, и нижний слой, содержащий преимущественно воду, которая может быть удалена. Кроме того, относительно низкие точки кипения трет-бутилметилового эфира и его азеотропа с водой обеспечивают выбор широкого диапазона температур реакции с помощью регулирования пропорции трет-бутилметилового эфира, совмещенного с полярным апротонным растворителем, имеющим точку кипения выше 100°C, значительно выше 120°C (например, N,N-диметилформамид). Например, реакционные смеси, содержащие значительно больше трет-бутилметилового эфира, чем N,N-диметилформамида (DMF), могут кипеть при температурах резервуара не намного выше 55°C, в то время как реакционные смеси, содержащие немного меньше трет-бутилметилового эфира относительно DMF, могут кипеть при температурах резервуара выше 100°C. Типично, трет-бутилметиловый эфир и N,N-диметилформамид находятся в весовом соотношении в диапазоне от приблизительно 0,5 до приблизительно 2.
Реакция способа Схемы 1 может быть проведена в широком диапазоне температур. Типично температура реакции равна, по меньшей мере, приблизительно 65°C. Хотя реакция продолжается при более низких температурах, скорости являются ниже, и азеотропы протонный растворитель-вода, кипящие ниже 50°C, типично содержат относительно мало воды (например, дихлорметан формирует азеотроп, содержащий 1,5% воды), что замедляет удаление воды. Более типично, температура реакции равна, по меньшей мере, приблизительно 70°C и наиболее типично, по меньшей мере, приблизительно 75°C. Хотя высокие температуры повышают скорость реакции, они могут также вызывать побочные реакции, уменьшая чистоту и выход продукта. Поэтому типично температура реакции является не более чем приблизительно 110°C, более типично не более чем приблизительно 100°C, и наиболее типично не более чем приблизительно 90°C.
Соединения Формулы 2 и 3, гидроксид щелочноземельного металла Формулы 4 (или предшественник, такой как гидрид щелочноземельного металла), полярный апротонный растворитель и апротонный растворитель, способный формировать низкокипящий азеотроп, могут быть соединены в любом подходящем порядке, чтобы сформировать реакционную смесь.
Ход реакции может контролироваться с помощью общепринятых способов, таких как тонкослойная хроматография, HPLC (ВЖХ - высокоэффективная жидкостная хроматография) и1H ЯМР (ядерный магнитный резонанс) анализов аликвот. После завершения реакции, смесь типично охлаждают до комнатной температуры, и продукт отделяют с помощью общепринятых способов, таких как фильтрация, экстракция, дистилляция и кристаллизация. Например, гидроксиды щелочного металла и другие твердые вещества, могут быть обычно удалены фильтрацией. Вода может быть добавлена к фильтрату вслед за сильной кислотой (такой как хлороводородная кислота), чтобы нейтрализовать любое оставшееся основание и помочь удалить полярные растворители, такие как DMF. Отделяют органическую фазу, далее промывают водой, чтобы удалить полярные растворители, такие как DMF, сушат над осушителями, такими как сульфат магния или молекулярные сита, и затем испаряют растворитель, оставляя продукт, часто в виде кристаллического твердого вещества, которое может быть перекристаллизовано из растворителей, таких как гексаны.
Для крупномасштабных получений, в которых сушка с осушителями является непрактичной, отделенная органическая фаза может быть высушена и сконцентрирована удалением дистилляцией и воды, и апротонного растворителя, способного формировать азеотроп с водой (впоследствии называется здесь как “Реакционный Азеотропный Растворитель”). Остаток затем может быть разбавлен неполярным растворителем, имеющим точку кипения выше, чем Реакционный Азеотропный Растворитель (например, фракция гексанов, имеющая нормальную точку кипения 65-70°C, когда Реакционный Азеотропный Растворитель представляет собой трет-бутилметиловый эфир) и дистилляцию продолжили для удаления остатка Реакционного Азеотропного Растворителя и необязательно некоторого количества неполярного растворителя. Часто охлаждение смеси, содержащей продукт и неполярный растворитель, приводит к кристаллизации продукта. Альтернативно неполярный растворитель может быть удален дополнительной дистилляцией или испарением, для очистки продукта.
Вместо выделения продукта, перемещение продукта в растворитель, применимый для дальнейшей реакции (например, способ Схемы 6), может быть более подходящим. После удаления дистилляцией и воды, и Реакционного Азеотропного Растворителя, остаток может быть разбавлен растворителем, применимым в дальнейшей реакции (называется здесь как “Замена Реакционного Растворителя”). Малые количества остатка Реакционного Азеотропого Растворителя могут быть допустимы в дальнейшей реакции. Альтернативно, если Замена Реакционного Растворителя имеет точку кипения выше, чем Реакционный Азеотропный Растворитель (например, тетрагидрофуран в качестве Замены Реакционного Растворителя, когда Реакционный Азеотропный Растворитель представляет собой трет-бутилметиловый эфир), остаток Реакционного Азеотропного Растворителя может быть легко удален дистилляцией.
Способ Схемы 1 типично обеспечивает соединение Формулы 1 в виде смеси E и Z геометрических изомеров (обозначается волнистой линией в Формуле 1), в которой один изомер может преобладать. Способы очистки, такие как перекристаллизация, часто обеспечивают очищенные продукты, содержащие по большей части или исключительно один геометрический изомер.
В альтернативном способе получения соединений Формулы 1, соединения Формулы 2 и 3 приводят в контакт с гидридом щелочноземельного металла, таким как гидрид кальция, в присутствии полярного апротонного растворителя, такого как DMF, избегая необходимости включать апротонный растворитель, способный формировать низкокипящий азеотроп с водой, или дистилляцию воды из смеси. В данном способе гидрид щелочноземельного металла служит в качестве и источника основания, чтобы катализировать конденсацию, и осушающего агента, чтобы удалять воду, которая образуется как побочный продукт. Поскольку гидрид щелочного металла служит в качестве основного осушающего агента, стехиометрия требует молярного соотношения, по меньшей мере, 0,5 по отношению к соединениям Формулы 2 и 3. Типично соотношение приблизительно 1,3 обеспечивает большую скорость реакции и высокие выходы продукта. Гидриды щелочноземельного металла, как правило, имеют маленькую растворимость в инертных к ним растворителях, поэтому маленький размер частиц улучшает перенос массы и готовность данных реагентов реагировать (например, с водой). Хотя, типичное молярное соотношение гидрида щелочного металла к соединению Формулы 3 не более чем приблизительно 2, требуется для лучших результатов (т.е. высокое превращение и выходы продукта), большой размер частиц гидридов щелочноземельного металла может требовать молярного соотношение гидрида к соединению Формулы 3 более чем 2 для лучших результатов. Данный процесс типично проводят при температуре, по меньшей мере, приблизительно 45°C, более типично, по меньшей мере, приблизительно 55°C, и типично не более чем приблизительно 100°C, более типично не более чем приблизительно 80°C.
В способе изобретения, проиллюстрированном в Схеме 1a, соединение Формулы 1 получают с помощью этапа, на котором дистиллируют воду из смеси, содержащей соединение Формулы 2, соединение Формулы 3, основание карбоната щелочного металла Формулы 4a, и апротонный растворитель, способный формировать низкокипящий азеотроп с водой.
Схема 1a

где M1 представляет собой Li, Na или K.
Первый этап данной реакции включает альдольную конденсацию, которая формирует соединение Формулы 11. Соединение Формулы 11 является не выделенным, но взамен при реакционных условиях превращается в соединение Формулы 1.
Стехиометрия данной реакции включает в себя эквимолярные количества соединений Формулы 2 и Формулы 3, как описано в Схеме 1.
Карбонаты щелочного металла Формулы 4a, как было обнаружено, являются чрезвычайно эффективными для обеспечения высоких выходов соединений Формулы 1. Данные основания карбоната щелочного металла включают карбонат лития, натрия или калия, карбонат калия предпочтителен благодаря своей низкой стоимости.
Карбонат щелочного металла добавляют для формирования реакционной смеси таким образом, чтобы молярное отношение карбоната щелочного металла к соединению Формулы 3 было типично в диапазоне от приблизительно 0,01 до приблизительно 0,2. Типичное соотношение в диапазоне от приблизительно 0,03 до приблизительно 0,05 обеспечивает полное превращение соединений Формулы 3 в соединения Формулы 1. Карбонат щелочного металла может быть добавлен в реакционную смесь маленькими порциями так, чтобы можно было контролировать скорость реакции, и скорость образования воды в реакционном сосуде может быть сопоставима со скоростью удаления воды дистилляцией азеотропа растворитель/вода.
В способе Схемы 1a, ацетонитрил, как было открыто, является чрезвычайно полезен в качестве апротонного растворителя в данном способе. Ацетонитрил формирует водный азеотроп, кипящий при 76,5°C и содержащий приблизительно 16,3% воды и приблизительно 83,7% ацетонитрила по весу, и поэтому является способным быстро перемещать воду из реакционной смеси при помощи дистилляции.
Реакция способа Схемы 1a может быть проведена в широком диапазоне температур. Типично температура реакции равна, по меньшей мере, приблизительно 65°C. Хотя реакция продолжается при температурах ниже, скорости становятся меньше, и азеотропы апротонный растворитель-вода, кипящие ниже 50°C, типично содержат относительно мало воды (например, дихлорметан формирует азеотроп, содержащий 1,5% воды), что замедляет удаление воды. Более типично температура реакции равна, по меньшей мере, приблизительно 80°C и более типично, по меньшей мере, приблизительно 85°C. Хотя высокие температуры повышают скорость реакции, они могут также приводить к побочным реакциям, понижая чистоту и выход продукта. Поэтому типично температура реакции составляет не более чем приблизительно 110°C, более типично не более чем приблизительно 100°C, и более типично не более чем приблизительно 90°C.
В способе изобретения, проиллюстрированном в Схеме 1b, соединение Формулы 1 получают с помощью этапа, на котором дистиллируют воду из смеси, содержащей соединение Формулы 2, соединение Формулы 3, основание, выбранное из 1,5-диазабицикло[4,3,0]нон-5-ена, 1,8-диазабицикло[5,4,0]ундец-7-ена, и их смесей, и апротонный растворитель, способный формировать низкокипящий азеотроп с водой.
Схема 1b

где основание представляет собой 1,5-диазабицикло[4,3,0]нон-5-ен, 1,8-диазабицикло[5,4,0]ундец-7-ен или их смесь.
Первый этап данной реакции включает альдольную конденсацию, которая формирует соединение Формулы 11. Соединение Формулы 11 является не выделенным, но взамен при реакционных условиях превращается в соединение Формулы 1.
Стехиометрия данной реакции включает в себя эквимолярные количества соединений Формулы 2 и Формулы 3, как описано Схемой 1.
1,5-Диазабицикло[4,3,0]нон-5-ен, 1,8-диазабицикло[5,4,0]ундец-7-ен или их смеси, как было открыто, является чрезвычайно эффективным для обеспечения высоких выходов соединений Формулы 1. И 1,5-диазабицикло[4,3,0]нон-5-ен, и 1,8-диазабицикло-[5,4,0]ундец-7-ен являются жидкостями при 25°C. В большом (т.е. коммерческом) масштабе, жидкости могут быть добавлены в реакционную смесь более точно и с меньшими материальными потерями, чем твердые вещества.
1,5-Диазабицикло[4,3,0]нон-5-ен, 1,8-диазабицикло[5,4,0]ундец-7-ен или их смесь добавляют, чтобы сформировать реакционную смесь так чтобы молярное отношение 1,5-диазабицикло[4,3,0]нон-5-ена, 1,8-диазабицикло[5,4,0]ундец-7-ена или их смеси к соединению Формулы 3 находилось типично в диапазоне от приблизительно 0,01 до приблизительно 0,2. Типично, соотношение в диапазоне от приблизительно 0,03 до приблизительно 0,05 обеспечивает большую скорость реакции и высокие выходы продукта. 1,5-Диазабицикло[4,3,0]нон-5-ен, 1,8-диазабицикло[5,4,0]ундец-7-ен или их смесь могут быть добавлены в реакционную смесь маленькими порциями так, чтобы скоростью реакции можно было управлять, и скорость образования воды в реакционном сосуде может быть сопоставима со скоростью удаления воды дистилляцией азеотропом растворитель/вода.
В способе Схемы 1b, ацетонитрил, как было открыто, является чрезвычайно полезным в качестве апротонного растворителя в настоящем способе. Ацетонитрил формирует водный азеотроп, кипящий при 76,5°C и содержащий 16,3% воды и 83,7% ацетонитрила по весу, и поэтому является способным быстро перемещать воду дистилляцией из реакционной смеси.
Реакция способа Схемы 1b может быть проведена в широком диапазоне температур. Типично температура реакции равна, по меньшей мере, приблизительно 65°C. Хотя реакция продолжается при температурах ниже, скорости становятся меньше, и азеотропы апротонный растворитель-вода, кипящие ниже 50°C, типично содержат относительно мало воды (например, дихлорметан формирует азеотроп, содержащий 1,5% воды), что замедляет удаление воды. Более типично температура реакции равна, по меньшей мере, приблизительно 80°C и более типично, по меньшей мере, приблизительно 85°C. Хотя высокие температуры повышают скорость реакции, они могут также приводить к побочным реакциям, понижая чистоту и выход продукта. Поэтому типично температура реакции равна не более чем приблизительно 110°C, более типично не более чем приблизительно 100°C, и наиболее типично не более чем приблизительно 90°C.
Что касается способов Схем 1, 1a и 1b, и вышеописанного альтернативного способа получения соединений Формулы 1 в их самых широких определениях, Z в Формулах 1 и 2 представляет собой необязательно замещенный фенил, и Q в Формулах 1 и 3 представляет собой фенил или 1-нафталенил, каждый необязательно замещенный. Q и Z являются придатками, прямо не участвующими в альдольной конденсации и дегидратации, обеспечивая соединения Формулы 1. Реакционные условия данных способов являются относительно мягкими и, таким образом, обеспечивают широкий диапазон необязательных заместителей в фениле и 1-нафталениле. Только функциональности, наиболее реакционно-способные к гидроксидным основаниям, являются восприимчивыми к тому, чтобы быть затронутыми. Поэтому, определенные заместители в фенильной и 1-нафталенильной частях Q и Z, описанные в Вариантах осуществления (например, 1-1G, 2-2O, A-A7) и где-либо в данном открытии, следует рассматривать только как иллюстративные, поскольку область полезности данных способов является более общей.
В способе данного изобретения, проиллюстрированного в Схеме 2, соединение Формулы 2 получают из соответствующего соединения Формулы 5, когда формируют промежуточное соединение реактива Гриньяра (описанного как Формула 12), и затем вводят в реакцию Реактив Гриньяра с соединением Формулы 6.
Схема 2

В одном варианте осуществления данного способа, соединение Формулы 5 приводят в контакт с металлическим магнием в присутствии эфирного растворителя, чтобы получить реактив Гриньяра. В контексте данного открытия и формулы изобретения, эфирный растворитель включает одно или более органических соединений, включающих атомы, выбранные из водорода, углерода и кислорода, и имеющие, по меньшей мере, одну эфирную связь (т.е. C-O-C), но без другой функциональности. Общие примеры эфиров включают диэтиловый эфир, тетрагидрофуран, 1,4-диоксан и 1,2-диметоксиэтан, но другие эфиры, такие как бутилдиглим (1,1'-[оксибис(2,1-этандиилокси)]бисбутан) также применяют для получения, и применяют реактивы Гриньяра. Типично в данном варианте осуществления эфирный растворитель включает диэтиловый эфир или тетрагидрофуран. Более типично эфирный растворитель включает тетрагидрофуран. Когда реактив Гриньяра получают, применяя металлический магний, X1 в Схеме 2 является таким же, как X, если не добавляют другие анионные частички в реакционную смесь. Для получения реактивов Гриньяра из металлического магния, металл находится типично в форме стружки, опилок или порошка, чтобы обеспечить большую площадь поверхности реакции. Типично металлический магний приводят в контакт с соединением Формулы 5 при температуре, по меньшей мере, приблизительно 0°C, более типично, по меньшей мере, приблизительно 20°C, и наиболее типично, по меньшей мере, приблизительно 25°C. Типично температура равна не более чем приблизительно 65°C, более типично не более чем приблизительно 40°C, и наиболее типично не более чем приблизительно 35°C. Поскольку стехиометрия требует, по меньшей мере, эквимолярного количества металлического магния относительно к соединению Формулы 5 для полного превращения, молярное отношение металлического магния к соединению Формулы 5 равно типично, по меньшей мере, приблизительно 1, более типично, по меньшей мере, приблизительно 1,02 и наиболее типично, по меньшей мере, приблизительно 1,05. Хотя большие избытки металлического магния могут применяться, они дают преимущества и повышают твердые остатки. Типично молярное отношение металлического магния к соединению Формулы 5 равно не более чем приблизительно 1,2, и более типично не более чем приблизительно 1,1.
Альтернативно в другом варианте осуществления данного способа, реактив Гриньяра получают контактированием соединения Формулы 5 с галогенидом алкилмагния. Для примера данного способа формирования реактивов Гриньяра см J. L. Leazer и R. Cvetovich, Org. Syn. 2005, 82, 115-119. Галогенид алкилмагния является типично галогенидом вторичного алкилмагния, который является более реакционноспособным, чем основной галогенид алкилмагния. Типично галогенид алкилмагния представляет собой C1-C4 галогенид алкилмагния. Следует отметить галогенид алкилмагния, который является галогенидом изопропилмагния, особенно хлоридом изопропилмагния. В данном варианте осуществления данного способа, X1 в Схеме 2 представляет смесь анионов, обеспечивая и X в соединении Формулы 5, и галоид галогенида алкилмагния. Например, если X является I и галогенид алкилмагния является хлоридом изопропилмагния, тогда X1 представляет смесь Cl и I (присутствующих в виде анионов). В данном варианте осуществления, соединение Формулы 5 контактирует с галогенидом алкилмагния в присутствии эфирного растворителя. Типично соединение Формулы 5 контактирует с галогенидом алкилмагния при температуре, по меньшей мере, -30°C, более типично, по меньшей мере, -20°C и наиболее типично, по меньшей мере, приблизительно -10°C. Типично температура равна не более чем приблизительно 40°C, более типично не более чем приблизительно 20°C, и наиболее типично не более чем приблизительно 10°C. Типично в данном варианте осуществления, эфирный растворитель включает диэтиловый эфир, тетрагидрофуран или их смесь, и более типично эфирный растворитель включает тетрагидрофуран. Поскольку стехиометрия требует, по меньшей мере, эквимолярное количество галогенида алкилмагния относительно к соединению Формулы 5 для полного превращения, молярное отношение галогенида алкилмагния к соединению Формулы 5 равно типично, по меньшей мере, приблизительно 1, и более типично, по меньшей мере, приблизительно 1,05. Хотя большие избытки галогенида алкилмагния могут применяться, они могут впоследствии реагировать с соединением Формулы 6, таким образом, больше требуется соединения Формулы 6 и больше получается побочного продукта. Типично молярное отношение галогенида алкилмагния к соединению Формулы 5 равно не более чем приблизительно 1,2, и более типично не более чем приблизительно 1,15. Тем не менее, больше количеств галогенида алкилмагния может быть желательно, чтобы компенсировать примеси воды в реакционном растворителе.
Как хорошо известно в данной области техники, реактивы Гриньяра реагируют очень быстро с растворителями, содержащими гидроксильные группы, включая воду, и таким образом, растворители для получения и применения реактивов Гриньяра должны содержать настолько мало примеси воды, насколько можно, т.е. быть безводными. Также поскольку реактивы Гриньяра реагируют с кислородом, реакционные смеси предпочтительно защищают от кислорода, например, покрывают газом азотом или аргоном.
Для обоих вариантов осуществления данного способа, и особенно варианта осуществления формирования реактива Гриньяра с применением галогенида алкилмагния, способ может проводиться в присутствии ароматического углеводородного растворителя с добавлением эфирного растворителя. Выражение “ароматический углеводородный растворитель” в данном способе обозначает растворитель, содержащий один или более ароматических углеводородных соединений. Ароматические углеводородные соединения содержат только атомы углерода и водород, и для ароматичности содержат, по меньшей мере, одно бензольное кольцо, которое может быть замещенным углеводородными частями, такими как алкильные группы. Ароматические углеводородные растворители, как правило, включают один или более бензол, толуол и ксилол (который типично присутствует как смесь изомеров). Поскольку ароматические углеводородные растворители являются более высококипящими, чем обычные эфирные растворители, такие как диэтиловый эфир и тетрагидрофуран, включение ароматических углеводородных растворителей в реакционную смесь, формирующую реактив Гриньяра, улучшает запас надежности в крупномасштабном производстве. Образование реактивов Гриньяра, как правило, является экзотермичным, и в случае потери охлаждения и дальнейшей потери низкокипящего эфирного растворителя, присутствие более высококипящего ароматического углеводородного растворителя уменьшит реакцию. Для данного способа толуол является чрезвычайно предпочтительным в качестве ароматического углеводородного растворителя вследствие своей низкой стоимости, относительно низкой токсичности, низкой точке замерзания и умеренно высокой точке кипения.
В соответствии с данным способом, реакционную смесь, содержащую реактив Гриньяра, сформированный из соединения Формулы 5, затем контактирует с соединением Формулы 6, чтобы получить соединение Формулы 2. Соединение Формулы 6 типично контактирует с реакционной смесью, содержащей реактив Гриньяра при температуре, по меньшей мере, приблизительно -80°C, более типично, по меньшей мере, приблизительно -25°C, и наиболее типично, по меньшей мере, приблизительно -5°C. Температура равна типично не более чем приблизительно 0°C. Типично соединение Формулы 6 добавляют в реакционную смесь, содержащую реактив Гриньяра в растворе, и применяют избыток соединения Формулы 6 относительно реактива Гриньяра, полученного из соединения Формулы 5. Альтернативно, реакционная смесь, содержащая реактив Гриньяра, полученный из соединения Формулы 5, может быть добавлена в избыток соединения Формулы 6. Когда реактив Гриньяра получают из металлического магния, молярное отношение соединения Формулы 6 относительно соединения Формулы 5 равно типично, по меньшей мере, приблизительно 1,05 и более типично, по меньшей мере, приблизительно 1,1, и типично не более чем приблизительно 1,3 и более типично не более чем приблизительно 1,2. Когда реактив Гриньяра получают из галогенида алкилмагния, количество галогенида алкилмагния, который применяют, является более важным, чем количество соединения Формулы 5 относительно соединения Формулы 6, поэтому избыток галогенида алкилмагния может также реагировать с соединением Формулы 6. В данном варианте осуществления соотношение соединения Формулы 6 к галогениду алкилмагния, который применяют, равно типично, по меньшей мере, приблизительно 1,05 и более типично, по меньшей мере, приблизительно 1,1, и типично не более чем приблизительно 1,3 и более типично не более чем приблизительно 1,2.
Реакционную смесь типично обрабатывают добавлением водной минеральной кислоты, такой как хлороводородная кислота, и экстрагируют продукт в умеренно полярный, несмешивающийся с водой органический растворитель, такой как диэтиловый эфир, дихлорметан или толуол. Обычно соединение Формулы 2 получают в смеси с его гидратным производным и его алкилгеми-кетальным производным (из алканольного побочного продукта, который формируется из соединения Формулы 6, когда Y представляет собой OR11). Любой или оба из данных производных соединения Формулы 2 могут быть легко превращены в соединение Формулы 2 при обрабатывании (т.е. контактировании) сильной кислотой, такой как органическая сульфоновая кислота, например, п-толуолсульфоновая кислота, в присутствии апротонного органического растворителя, и удалении воды и/или алканола, образованного дистилляцией. Предпочтительно апротонный органический растворитель является несмешивающимся с водой. Типично апротонный органический растворитель включает один или более растворителей, выбранных из углеводородов, таких как гептан или толуол, и галогенированных углеводородов, таких как 1,2-дихлорэтан. В течение дистилляции, реакционную смесь в сосуде типично нагревают до, по меньшей мере, приблизительно 45°C, более типично, по меньшей мере, приблизительно 80°C, типично не более чем приблизительно 120°C, более типично не более чем приблизительно 110°C, и более типично не более чем приблизительно 100°C. Растворители, такие как гептан, толуол и 1,2-дихлорэтан и их азеотропы с водой и алканолами, имеют нормальные точки кипения, обеспечивая данные реакционные температуры. Растворители, такие как толуол, которые формируют низкокипящие азеотропы с водой и алканолами, являются предпочтительными. После удаления воды и алканолов, дистилляция может быть продолжена, чтобы удалить растворитель, и продолжается при пониженном давлении, чтобы отделить соединение продукта Формулы 2.
Способ Схемы 2 является особенно применимым, когда X является I (т.е. йод), поэтому это способствует получению соединений Формулы 2, где Z представляет собой фенильное кольцо, необязательно замещенное до 5 заместителями, выбранными из не только F, алкила, фторалкила, алкокси, фторалкокси, алкилтио и фторалкилтио, но также Cl и Br, которые могут быть более пригодными, чтобы реагировать с металлическим магнием или галогенидами алкилмагния, если X является Cl или Br. Хотя реактивы Гриньяра чаще получают из хлор- или бромфенильных соединений, йодфенильные соединения (т.е. X является I), как обнаружено, хорошо работают при образовании реактивов Гриньяра, и, более того, когда X является I, фенильное кольцо может быть замещенным галогенами в других положениях, особенно в 3- и 5-положениях (относительно X), который является особенно применимым, чтобы формировать инсектицидные 4,5-дигидроизоксазольные соединения.
Известным является способ Схемы 2, где X является I, и Z представляет собой фенил, замещенный в 3- и 5-положениях относительно X заместителями, независимо выбранными из F, Cl, Br и CF3, особенно где один заместитель является CF3 и другой заместитель представляет собой CF3, Cl или Br, более особенно, где один заместитель представляет собой CF3 и другой заместитель представляет собой Cl или Br, и наиболее особенно, где один заместитель представляет собой CF3 и другой заместитель является Cl.
Соединения Формулы 5 и 6 могут быть получены широким множеством способов, известных в данной области техники. Многие из данных соединений являются известными, и значительное число является коммерчески доступным. Вышеупомянутый вариант осуществления способа Схемы 2 включает в себя соединения Формулы 5, где X представляет собой I (например, 1-хлор-3-йод-5-(трифторметил)бензол). Данные соединения могут быть получены способом, проиллюстрированным в Схеме 3. В данном способе соединение Формулы 13 диазотируют, чтобы получить промежуточное соединение соли диазония, которое затем восстанавливают, чтобы получить соединение Формулы 5a (т.е. Формулы 5, где X является I).
Схема 3

где Ra представляют собой заместители, такие как R2, как определено в Варианте осуществления 3H.
В данном способе, соединение Формулы 13 контактирует с натрий нитритом в присутствии минеральной кислоты, такой как хлороводородная кислота или серная кислота. Обычно для лучших результатов два или более молярных эквивалентов минеральной кислоты требуется относительно числа молей соединения Формулы 5a, которое применяют в реакции. Реакцию типично проводят в подходящем растворителе, таком как водная хлороводородная кислота или уксусная кислота. Температуру в диапазоне от приблизительно -5 до приблизительно 5°C обычно применяют для получение соли диазония. Соль диазония соединения Формулы 13 затем приводят в контакт с восстанавливающим агентом, таким как гипофосфорная кислота, или этанолом, чтобы обеспечить соединение Формулы 5a. Реакцию восстановления обычно проводят в таком же растворителе как применяют для получения соли диазония при температуре от приблизительно 5 до приблизительно 20°C. Продукт Формулы 5a может быть отделен стандартными процедурами, такими как кристаллизация, экстракция, и дистилляция. Данный общий способ диазотирования и восстановления анилинов является хорошо известным, и был рассмотрен; см., например, N. Kornblum, Org. Reactions 1944, 2, 262-340.
2-Хлор-6-йод-4-(трифторметил)бензоламин, 4-хлор-2-йод-6-(трифторметил)бензоламин и 2-хлор-4-йод-6-(трифторметил)бензоламин являются особенно важными в качестве соединений Формулы 13 для получения 1-хлор-3-йод-5-(трифторметил)бензола в качестве соединения Формулы 5a данным способом.
Соединения Формулы 13 могут быть получены из соединений Формулы 14 йодированием, как показано в Схеме 4.
Схема 4

где Ra являются заместители, такие как R2, как определено в Варианте осуществления 3H.
В данном способе соединение Формулы 14 контактирует с реагентом йодирования, таким как монохлорид йода, в подходящем растворителе, таком как вода или уксусная кислота. Необязательно хлороводородная кислота может быть включена в реакционную смесь для того, чтобы повысить растворимость соединения Формулы 14 и монохлорида йода в реакционной среде. Обычно только приблизительно один молярный эквивалент монохлорида йода требуется, чтобы полностью превратить соединение Формулы 14 в соединение Формулы 13. Большие молярные избытки монохлорида йода могут применяться, чтобы сократить время реакции, но повышают стоимость способа. Реакция может проводиться в температурном диапазоне от приблизительно 0 до приблизительно 100°C, типично при температуре приблизительно 50°C. Продукт Формулы 13 может быть отделен общепринятыми способами, такими как фильтрация, экстракция и дистилляция.
Как проиллюстрировано в Схеме 5, соединения Формулы 13a, содержащие, по меньшей мере, одну часть хлора или брома, могут также быть получены при введении в контакт соответствующих соединений Формулы 13 с подходящим агентом хлорирования или бромирования, таким как хлор, хлороводородная кислота/пероксид водорода, или бромоводородная кислота/пероксид водорода.
Схема 5

где Ra являются заместителями, такими как R2, как определено в Варианте осуществления 3H; по меньшей мере, один Rb представляет собой Cl (из хлорирования) или Br (из бромирования) и другие примеры Rb являются Ra заместители Формулы 13; и p = n + число атомов хлора или брома полученные путем хлорирования или бромирования, соответственно.
Реакцию проводят в растворителе, таком как вода или уксусная кислота. Температурный диапазон может быть от 0 до 100°C с температурным диапазоном между 25 и 50°C, который является предпочтительным.
В другом аспекте данного изобретения, соединения Формулы 1, полученные способом Схемы 1, являются применимыми для получения соединений Формулы 7.

Множество путей являются возможными для получения соединений Формулы 7 из соединений Формулы 1. В одном способе как показано в Схеме 6, соединение Формулы 1 контактирует с гидроксиламином и основаним, чтобы получить 5-(трифторметил)-4,5-дигидроизоксазол соединение Формулы 7.
Схема 6

Гидроксиламин может образовываться из соли минеральной кислоты, такой как сульфат гидроксиламина или хлорид гидроксиламина, при обработке основанием в подходящем растворителе, или может быть получен коммерчески в виде 50% водного раствора. В данном способе перед введением в контакт с еноном Формулы 1, гидроксиламин или его соль минеральной кислоты типично приводят в контакт с основанием. Когда применяют соль минеральной кислоты и гидроксиламина, основание контактирует в количестве в избытке количества требуемого для превращения гидроксиламиновой соли минеральной кислоты в гидроксиламин. Основание не расходуется в реакции Схемы 6, и показывает, что действует как катализатор желаемой циклизации. Депротонирование гидроксиламина основанием перед контактированием с еноном Формулы 1 необходимо для того, чтобы получить хорошие выходы, поскольку в отсутствии основания реакция гидроксиламина с енонами может давать продукты, отличные от соединений Формулы 1. Таким образом, хотя часто приблизительно один молярный эквивалент основания (в дополнение к любому основанию, которое применяют для того, чтобы превратить гидроксиламиновую соль минеральной кислоты в гидроксиламин) применяют относительно гидроксиламина, меньше чем один молярный эквивалент основания может давать превосходные результаты. Более чем один молярный эквивалент (например, до приблизительно 5 молярных эквивалентов) основания относительно гидроксиламина могут применять, при условии, что избыток основания не реагирует с еноном Формулы 1 или изоксазолом Формулы 7.
Можно применять молярный избыток от одного до трех эквивалентов гидроксиламина относительно енона Формулы 1. Чтобы обеспечить рентабельность, полное и быстрое превращение енона Формулы 1 в изоксазол Формулы 7, способом, подходящим для крупномасштабного производства, наиболее подходящим, как правило, является соотношение между приблизительно одним и приблизительно двумя молярными эквивалентами гидроксиламина относительно енона Формулы 1.
Пригодные основания могут включать, но не ограничиваются, алкоксиды щелочного металла, такие как метоксид натрия, карбонаты щелочного металла, такие как карбонат натрия или карбонат калия, гидроксиды щелочного металла, такие как гидроксид натрия и гидроксид калия, и органические основания. Предпочтительными органическими основаниями являются аминные основания имеющие, по меньшей мере, одну пару свободных электронов, доступных для протонирования, такие как пиридин, триэтиламин или N,N-диизопропилэтиламин. Можно применять более слабые основания, такие как пиридин, но более сильные основания, которые эффективно депротонируют гидроксиламин, такие как алкоксид щелочного металла или гидроксид щелочного металла, типично обеспечивают результаты лучше. Поэтому вода является особенно применимым растворителем для депротонирования гидроксиламина, также как получения гидроксиламина из его солей, основания совместимые с водой являются особо значимыми. Примерами сильных оснований, которые являются растворимыми и совместимыми с водой, являются гидроксиды щелочного металла. Гидроксид натрия является предпочтительным, вследствие того, что он является не дорогим и хорошо работает при депротонировании гидроксиламина, в связи с этим получают натриевую соль гидроксиламина в водном растворе. Алкоксиды щелочного металла часто применяют в растворе в низшем алканоле, часто алканоле, соответствующем алкоксиду.
Способ Схемы 6 проводят в присутствии подходящего растворителя. Для наилучших результатов растворитель должен быть инертным к основанию и гидроксиламину, и должен быть способным растворять енон Формулы 1. Подходящие органические растворители включают спирты, эфиры, нитрилы или ароматические углеводороды. Смешивающиеся с водой растворители, такие как спирты (например, метанол, изопропанол), эфиры (например, тетрагидрофуран) или нитрилы (например, ацетонитрил) хорошо работают с гидроксидными основаниями щелочного металла. Растворители, которые являются ненуклеофильными (например, эфиры и нитрилы), часто обеспечивают наилучшие результаты. Особенно когда применяют один растворитель, более предпочтительным растворителем является тетрагидрофуран и ацетонитрил.
Альтернативно более желаемо проводить реакцию, применяя смесь двух растворителей, которая формируется, когда приводят в контакт раствор енона Формулы 1 в растворителе, таком как тетрагидрофуран или ацетонитрил, с раствором гидроксиламина и основания, такого как гидроксид натрия во втором растворителе, который действует как дополнительный растворитель в смеси растворителя. Вода является чрезвычайно применимой в качестве дополнительного растворителя, поскольку гидроксиламиновые соли минеральной кислоты и гидроксидные основания щелочного металла, такие как гидроксид натрия, являются чрезвычайно растворимыми в воде. Быстрому образованию гидроксиламина из его соли минеральной кислоты и дальнейшему депротонированию гидроксиламина способствует вода, и растворимость и стабильность депротонированых частиц в воде являются особенно желаемыми. В крупномасштабном производстве, растворы, а не суспензии, являются предпочтительными, поскольку они легче в обращении и перемещении в производственном оборудовании. Когда вода является со-растворителем, другой растворитель типично является смешивающимся с водой растворителем, таким как тетрагидрофуран или ацетонитрил.
Другие высоко полярные, гидроксильные растворители, такие как низшие алканолы (например, метанол, этанол), также являются чрезвычайно применимыми в качестве дополнительных растворителей, поскольку подобно воде они легко растворяют гидроксиламиновые соли минеральной кислоты и гидроксиды щелочного металла. Низшие алканолы могут давать результаты лучше, чем вода в качестве дополнительного растворителя, когда другие растворители являются не смешиваемыми с водой, например, трет-бутилметиловый эфир. Когда низший алканол применяют в качестве дополнительного растворителя, особенно с другим растворителем, который является не смешиваемым с водой, добавляемое основание часто является алкоксидом щелочного металла вместо гидроксида щелочного металла.
Пока основание присутствует при депротонировании гидроксиламина, гидроксиламин, основание и енон Формулы 1 могут контактировать множеством путей в способе Схемы 6. Например, смесь, получаемая из гидроксиламина и основания (типично в растворителе, таком как вода), может быть добавлена в енон Формулы 1 (типично в растворителе, таком как тетрагидрофуран или ацетонитрил). Альтернативно гидроксиламин и основание могут быть одновременно добавлены отдельно к енону Формулы 1. В другом варианте осуществления, енон Формулы 1 (типично в растворителе, таком как тетрагидрофуран или ацетонитрил) может быть добавлен в смесь, полученную из гидроксиламина и основания (типично в растворителе, таком как вода). В данном примере вариантов осуществления другие сочетания растворителей могут применяться; например, метанол с трет-бутилметиловым эфиром вместо воды с тетрагидрофураном или ацетонитрилом.
Способ Схемы 6 может проводиться при температуре реакции между приблизительно 0 и 150°C, или более легко между 20 и 40°C. Продукт Формулы 7 отделяют обычными способами, известными специалистам данной области техники, включая экстракцию и кристаллизацию.
Соединения Формулы 7a, 7b и 7c являются подмножествами соединений Формулы 7, которые являются особо значимыми в качестве инсектицидов.


где R2, R3, R4, R5 и Rv являются таковыми, как определено в кратком описании изобретения, Демонстрации 1 и Вариантах осуществления, и n равно целому числу от 0-5.
Поэтому для получения соединений Формулы 7a, 7b и 7c особо значимыми являются варианты осуществления способа Схемы 6, показанного в Схеме 7, где соединение Формулы 1 получают способом Схемы 1.
Схема 7

где Q представляет собой


Соединения Формулы 7 могут часто быть получены из других соединений Формулы 7 при помощи модификации заместителей. Например, соединения Формулы 7a могут быть получены посредством аминокарбонилирования соединений Формулы 7d с соответствующими замещенными аминными соединениями Формулы 15, как показано в Схеме 8.
Схема 8

Данную реакцию типично проводят с арилбромидом Формулы 7d в присутствии палладиевого катализатора в атмосфере CO. Палладиевые катализаторы, которые применяют для данного способа, типично включают палладий в формальной степени окисления или 0 (т.е. Pd(0)) или 2 (т.е. Pd(II)). Широкое множество таких палладий-содержащих соединений и комплексов являются применимыми в качестве катализаторов для данного способа. Примеры палладий-содержащих соединений и комплексов, применимых в качестве катализаторов в способе Схемы 8, включают PdCl2(PPh3)2 (дихлорид бис(трифенилфосфин)палладия(II)), Pd(PPh3)4 (тетракис(трифенилфосфин)палладий(0)), Pd(C5H7O2)2 (палладий(II) ацетилацетонат), Pd2(dba)3 (трис(дибензилиденацетон)дипалладий(0)) и [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II). Способ Схемы 8, как правило, проводят в жидкой фазе, и поэтому является более эффективным, поскольку палладиевый катализатор предпочтительно имеет хорошую растворимость в жидкой фазе. Применимые растворители включают, например, эфиры, такие как 1,2-диметоксиэтан, амиды, такие как N,N-диметилацетамид, и негалогенированные ароматические углеводороды, такие как толуол.
Способ Схемы 8 может быть проведен в широком диапазоне температур, в пределах от приблизительно 25 до приблизительно 150°C. Следует отметить температуры от приблизительно 60 до приблизительно 110°C, которые типично обеспечивают высокую скорость реакций и высокие выходы продукта. Общие способы и процедуры аминокарбонилирования с арилбромидом и амином хорошо известны в литературе; см., например, H. Horino et al., Synthesis 1989, 715; и J. J. Li, G. W. Gribble, editors, Palladium in Heterocyclic Chemistry: A Guide for the Synthetic Chemist, 2000.
Соединения Формулы 7d могут быть получены способом Схемы 6 из соединений Формулы 1, которые получают способом Схемы 1 в соответствии с данным изобретением.
Соединения Формулы 7a могут также быть получены сочетанием соединения карбоновой кислоты Формулы 7e с соответствующими замещенным аминным соединением Формулы 15, как показано в Схеме 9.
Схема 9

Данную реакцию, как правило, проводят в присутствии дегидратирующего сочетающего реагента, такого как дициклогексилкарбодиимид, 1-(3-диметиламинопропил)-3-этилкарбодиимид, циклический ангидрид 1-пропанфосфоновой кислоты или карбонилдиимидазол, в присутствии основания, такого как триэтиламин, пиридин, 4-(диметиламино)пиридин или N,N-диизопропилэтиламин в безводном апротонном растворителе, таком как дихлорметан или тетрагидрофуран при температуре типично между приблизительно 20 и приблизительно 70°C.
Соединения Формулы 7e могут быть получены способом Схемы 6 из соединений Формулы 1, которые получают способом Схемы 1 в соответствии с данным изобретением. Альтернативно соединения Формулы 7e могут быть получены гидролизом эфирного соединения Формулы 7f, как показано в Схеме 10.
Схема 10

где R5a представляет собой, например, метил или этил.
В данном способе, эфир Формулы 7f превращается в соответствующую карбоновую кислоту Формулы 7e с помощью общих процедур, хорошо известных в данной области техники. Например, обработка метилового или этилового эфира Формулы 7f с водным гидроксидом лития в тетрагидрофуране, с последующим подкислением выходов соответствующей карбоновой кислоты Формулы 7e.
Соединения Формулы 7f могут быть получены способом Схемы 6 из соединений Формулы 1, которые получают способом Схемы 1 в соответствии с данным изобретением.
Без дополнительного уточнения предполагается, что специалист в данной области техники, применяя предыдущее описание, может применять данное изобретение в его полном объеме. Последующие Примеры, поэтому, должны толковаться только как иллюстративные, а не ограничивающие открытие любым способом как бы то ни было. Этапы в последующих Примерах иллюстрируют процедуру каждого этапа полного синтетического превращения, и исходные вещества каждого этапа могут не быть обязательно получены отдельным препаративным путем тех процедуры, что описаны в других Примерах или Этапах. Процентные содержания представлены по весу, за исключением хроматографических смесей растворителей или когда не указано иное. Части и процентные содержания хроматографических смесей растворителей являются по объему, если не указано иное. 1H ЯМР спектр представляется в ppm (миллионных долях) сдвига от тетраметилсилана; “s” обозначает синглет, “d” обозначает дублет, “t” обозначает триплет, “q” обозначает квартет, “m” обозначает мультиплет, “dd” обозначает дублет дублетов, “dt” обозначает дублет триплетов и “br” обозначает широкий.
ПРИМЕР 1
Получение метил-4-[5-(3,5-дихлорфенил)-4,5-дигидро-5-(трифторметил)-3-изоксазолил]-1-нафталинкарбоксилат)а
Этап A: Получение метил(4-[3-(3,5-дихлорфенил)-4,4,4-трифтор-1-оксо-2-бутен-1-ил]-1-нафталинкарбоксилата
Смесь метил-4-ацетил-1-нафталинкарбоксилата (5,36 г, 23,4 ммоль), 1-(3,5-дихлорфенил)-2,2,2-трифторэтанона (5,68 г, 23,4 ммоль), гидроксида кальция (0,172 г, 2,3 ммоль), N,N-диметилформамида (16 мл), и трет-бутилметилового эфира (32 мл) помещают в реакционный сосуд, оборудованный термометром. Реакционный сосуд присоединяют к колонне Олдершоу с десятью тарелками, выход которой конденсируют и подают на декантатор, изначально заполненный трет-бутилметиловым эфиром. В приборе поддерживают атмосферу азота. Верхнюю часть декантатора присоединяют, чтобы возвращать конденсат, к пятой тарелке колонны Олдершоу. Данная установка обеспечит то, что мокрый (содержащий растворенную воду) трет-бутилметиловый эфир из декантатора не вернется в реакционный сосуд. Сливной кран в нижней части декантатора позволяет удалять трет-бутилметиловый эфир в дополнение к воде из декантатора. Реакционную смесь нагревают до дистиллирования азеотропа трет-бутилметиловый эфир/вода. Поскольку ловушка декантатора содержит достаточное количество трет-бутилметилового эфира, чтобы растворить всю воду, образующуюся в реакции, конденсат в ловушке не разделяется на слои, содержащие преимущественно воду и преимущественно трет-бутилметиловый эфир. Поскольку реакционная смесь изначально содержала, главным образом, трет-бутилметиловый эфир, смесь кипит при температуре, не значительно превышающей нормальную точку кипения трет-бутилметилового эфира (например, приблизительно 65-70°C). Возникшая реакция продолжается относительно медленно при данной температуре, поэтому конденсат постепенно сливают из ловушки декантатора, чтобы удалить трет-бутилметиловый эфир. Поскольку концентрация трет-бутилметилового эфира уменьшается в реакционной смеси, температуру кипения смеси повышают. Трет-бутилметиловый эфир удаляют путем гранулирования в декантаторе, пока температура кипения реакционной смеси повысится приблизительно от 75 до 80°C. Для того чтобы поддерживать данный температурный диапазон, добавляют трет-бутилметиловый эфир, поскольку требуется компенсировать потерю растворителя из прибора. Общее время от начала нагревания реакционной смеси до остановки дистилляции, не включающее период выключения на ночь, составляет приблизительно 15 ч. В течение данного периода времени добавляют дополнительную порцию гидроксида кальция (1,34 г, 18,1 ммоль), чтобы повысить скорость реакции.
Чтобы отделить продукт, смесь охлаждают до комнатной температуры и фильтруют. Собранное твердое вещество промывают трет-бутилметиловым эфиром (10 мл). Воду (100 мл) добавляют, и водный слой подкисляют хлороводородной кислотой. Органическую фазу промывают водой (100 мл), сушат и испаряют, чтобы получить продукт в виде желтого твердого вещества (10,1 г, 95% выход), плавящийся при 91-91,5°C (после перекристаллизации из гексанов). Следующий спектр относится к продукту, перекристаллизованному из гексанов.
ИК (нуйол) 1723, 1670, 1560, 1280, 1257, 1230, 1186, 1171, 1132, 1098, 1022, 804 см-1.
1H ЯМР (CDCl3) 8,78-8,76 (м, 1H), 8,32-8,30 (м, 1H) 8,02 (д, J=7,6 Гц, 1H) 7,65-7,62 (м, 3H), 7,34 (с, 1H), 7,07-7,06 (м, 1H), 6,94 (д, J=1,7 Гц, 2H), 4,03 (с, 3H).
Этап B: Получение метил-4-[5-(3,5-дихлорфенил)-4,5-дигидро-5-(трифторметил)-3-изоксазолил]-1-нафталинкарбоксилата
Гидроксид натрия (50%, 3,50 г, 43,7 ммоль) добавляют к раствору сульфата гидроксиламина (1,8 г, 11,0 ммоль) в воде (22 мл). Когда смесь охлаждают до комнатной температуры, порцию смеси (~50%) добавляют по каплям в течение 4 минут к метил-4-[3-(3,5-дихлорфенил)-4,4,4-трифтор-1-оксо-2-бутен-1-ил]-1-нафталинкарбоксилату (т.е. продукт Этапа A) (5,00 г, 11,0 ммоль) в тетрагидрофуране (55 мл) при комнатной температуре. После 30 минут добавляют дополнительную порцию (~10%) водной смеси. Смесь перемешивают дополнительно 15 минут. Смесь разделяют между хлороводородной кислотой (1 Н, 50 мл) и трет-бутилметиловым эфиром (50 мл). Органическую фазу испаряют, и полученное твердое вещество перемешивают в горячем метаноле. Смесь охлаждают и фильтруют, чтобы получить продукт в виде белого твердого вещества (4,50 г, 87%), плавящийся при 137,3-138°C (после перекристаллизации из метанола). Следующий спектр относится к продукту, перекристаллизованному из метанола.
ИК (нуйол) 1716, 1569, 1518, 1433, 1332, 1309, 1288, 1251, 1192, 1167, 1139, 1114, 1102, 1027, 1006, 910, 867, 855 см-1.
1H ЯМР (CDCl3) 8,89-8,87 (м, 1H), 8,80-8,78 (м, 1H), 8,10 (д, J=7,6 Гц, 1H), 7,69-7,66 (м, 2H), 7,56-7,53 (м, 3H), 7,46 (т, J=2 Гц, 1H), 4,27 (1/2ABq, J=17 Гц, 1H), 4,03 (с, 3H), 3,91 (1/2ABq, J=17 Гц, 1H).
ПРИМЕР 2
Получение метил-4-[5-[3,5-бис(трифторметил)фенил]-4,5-дигидро-5-(трифторметил)-3-изоксазолил]-1-нафталинкарбоксилата
Этап A: Получение метил-4-[3-[3,5-бис(трифторметил)фенил]-4,4,4-трифтор-1-оксо-2-бутен-1-ил]-1-нафталинкарбоксилата
Смесь метил-4-ацетил-1-нафталинкарбоксилата (5,36 г, 23,5 ммоль), 1-[3,5-бис(трифторметил)фенил]-2,2,2-трифторэтанона (7,28 г, 23,5 ммоль), гидроксида кальция (1,40 г, 18,9 ммоль), N,N-диметилформамида (16 мл) и трет-бутилметилового эфира (32 мл) кипятят с обеспечением прибора, содержащего 10-и тарелочную колонну Одершоу, и декантатор, описанный в Пример 1, Этапа A, для удаления азеотропа трет-бутилметиловый эфир/вода. Поскольку ловушка декантатора содержит достаточное количество трет-бутилметилового эфира, чтобы растворить всю воду, образующуюся в реакции, конденсат в ловушке не разделяется на слои, содержащие преимущественно воду и преимущественно трет-бутилметиловый эфир. Трет-бутилметиловый эфир удаляют, постепенно гранулируя ловушку декантатора, пока температура сосуда достигнет 85°C. Чтобы поддерживать данную температуру добавляют трет-бутилметиловый эфир, поскольку требуется компенсировать потерю растворителя из прибора. Общее время от начала нагревания реакционной смеси до остановки дистилляции, не включающее период выключения на ночь, составляет приблизительно 10 часов. В течение данного периода времени дополнительный гидроксид кальция не добавляют в реакционную смесь.
Чтобы отделить продукт, смесь охлаждают до комнатной температуры и фильтруют. Твердое вещество промывают трет-бутилметиловым эфиром, и фильтрат промывают водой (30 мл), и разбавляют трет-бутиловым эфиром. Смесь испаряют, чтобы получить продукт в виде желтого твердого вещества (12,1 г, 99%), плавящийся при 91,5-92°C (после перекристаллизации из гексанов). Следующий спектр относится к продукту перекристаллизованному из гексанов.
ИК (нуйол) 1720, 1685, 1515, 1441, 1405, 1345, 1280, 1261, 1187, 1171, 1147, 1129, 1097, 1024, 899, 856 см-1.
1H ЯМР (CDCl3) 8,74-8,72 (м, 1H), 8,23-8,21 (м, 1H) 7,99 (д, J=7,3 Гц, 1H), 7,67 (д, J=7,6 Гц, 1H), 7,64-7,57 (м, 3H), 7,51 (с, 2H), 7,47 (д, J=1,4 Гц, 1H), 4,04 (с, 3H).
Этап B: Получение метил 4-[5-[3,5-бис(трифторметил)фенил]-4,5-дигидро-5-(трифторметил)-3-изоксазолил]-1-нафталинкарбоксилат
Гидроксид натрия (50%, 1,53 г, 38,2 ммоль) добавляют к сульфату гидроксиламина (1,57 г, 9,57 ммоль) в воде (18 мл). Порцию раствора (~51%, ~9,8 ммоль гидроксиламина) добавляют по каплям к метил-4-[3-[3,5-бис(трифторметил)фенил]-4,4,4-трифтор-1-оксо-2-бутен-1-ил]-1-нафталинкарбоксилату (т.е. продукту Этапа A) (5,00 г, 9,61 ммоль) в тетрагидрофуране (45 мл). После ~45 минут смесь выливают в хлороводородную кислоту (1 Н, 100 мл) и экстрагируют эфиром (3×80 мл).
Объединенные органические экстракты промывают водой (80 мл), сушат и испаряют. Вещество перемешивают в горячем метаноле, затем охлаждают до комнатной температуры, собирают при фильтрации и сушат в вакууме, чтобы получить продукт в виде белого твердого вещества (4,14 г, 80% выход), плавящийся при 130-131°C (после перекристаллизации из метанола). Следующий спектр относится к продукту перекристаллизованному из метанола.
ИК (нуйол) 1722, 1515, 1437, 1330, 1284, 1208, 1193, 1174, 1128, 1106, 1025, 1009, 916, 903, 859, 842 см-1.
1H ЯМР (CDCl3) 8,89-8,87 (м, 1H), 8,82-8,79 (м, 1H), 8,14-8,09 (м, 3H), 8,0 (с, 1H), 7,70-7,67 (м, 2H), 7,56 (д, J=7,6 Гц, 1H), 4,39 (½ ABq, J=17,3 Гц, 1H), 4,03 (с, 3H), 3,96 (½ ABq, J=17,6 Гц, 1H).
ПРИМЕР 3
Альтернативное получение метил-4-[3-(3,5-дихлорфенил)-4,4,4-трифтор-1-оксо-2-бутен-1-ил]-1-нафталинкарбоксилата
Раствор 1-(3,5-дихлорфенил)-2,2,2-трифторэтанона (1,42 г, 5,84 ммоль) в N,N-диметилформамиде (5,5 мл) добавляют к гидриду кальция (0,280 г, 6,66 ммоль). Раствор метил-4-ацетил-1-нафталинкарбоксилата (1,34 г, 5,88 ммоль) в N,N-диметилформамиде (5,5 мл) добавляют к смеси. Смесь нагревают до 45-50°C в течение 8 ч. Смесь охлаждают до комнатной температуры в течение ночи. После дополнительных 4 ч при 60°C, смесь охлаждают до комнатной температуры и добавляют по каплям к хлороводородной кислоте (1 Н, 100 мл). Смесь экстрагируют этилацетатом (2×100 мл), и объединенные экстракты сушат и испаряют, чтобы получить продукт (2,7 г, 102% выход), который содержит немного N,N-диметилформамида.1H ЯМР спектр основного изомера приведен далее.
1H ЯМР (CDCl3) 8,78-8,75 (м, 1H), 8,33-8,30 (м, 1H), 8,02 (д, J=7,7 Гц, 1H), 7,66-7,61 (м, 3H), 7,34 (с, 1H), 7,07-7,04 (м, 1H), 6,94 (д, J=2 Гц, 2H) 4,03 (с, 3H).
ПРИМЕР 4
Получение 2-хлор-6-йод-4-(трифторметил)бензоламина
Монохлорид йода (17,2 г, 108 ммоль) в хлороводородной кислоте (36%, 21,4 г) и воды (35 мл) добавляют по каплям к 2-хлор-4-(трифторметил)бензоламину (20,0 г, 102 ммоль) в хлороводородной кислоте (36%, 20,7 г) и воде (140 мл). Смесь нагревают до 50°C на протяжении суммарно 8 ч. Гидроксид натрия (50%, 33,5 г, 419 ммоль) добавляют к смеси при комнатной температуре. Смесь экстрагируют дихлорметаном (2×250 мл), и экстракты сушат и испаряют, чтобы получить продукт в виде масла (31,83 г, 97% выход).
1H ЯМР (CDCl3) 7,78 (с, 1H), 7,5 (с, 1H), 4,87 (ушир.с, 2H).
ПРИМЕР 5
Получение 1-хлор-3-йод-5-(трифторметил)бензола
2-Хлор-6-йод-4-(трифторметил)бензоламин (т.е. продукт Примера 4) (31,8 г, 98,9 ммоль) добавляют к хлороводородной кислоте (36%, 190 мл) и смесь нагревают до 55-60°C в течение 20 минут. Смесь охлаждают до 0°C. Нитрит натрия (13,6 г, 197 ммоль) в воде (36 мл) добавляют в течение 30 минут. Когда добавление завершают смесь перемешивают при 0-5°C в течение 70 минут. Гипофосфорную кислоту (50%, 36,5 мл, 351 ммоль) добавляют по каплям при 5-10°C в течение 40 минут. Когда добавление завершают смесь самопроизвольно резко нагревается до 35°C, и затем охлаждается до 10-20°C. После того как перемешивают при 10-20°C в течение 2 ч, смесь оставляют в холодильнике на ночь. Затем смесь нагревают до комнатной температуры и перемешивают в течение 1 часа. Смесь разбавляют водой (400 мл) и экстрагируют эфиром (2×250 мл). Объединенные экстракты сушат и испаряют. Дистиллируют и получают продукт в виде масла (19,93 г, 66% выход), Ткп=98-112°C при 2,0 кПа.
1H ЯМР (CDCl3) 7,89 (с, 1H), 7,84 (с, 1H), 7,58 (с, 1H).
ПРИМЕР 6
Получение 1-[3-хлор-5-(трифторметил)фенил]-2,2,2-трифторэтанона
Раствор хлорида изопропилмагния (2 M, 36,0 мл, 71,8 ммоль) в тетрагидрофуране добавляют по каплям к раствору 1-хлор-3-йод-5-(трифторметил)бензола (т.е. продукт Примера 5) (20,0 г, 65,3 ммоль) в тетрагидрофуране (30 мл) при -5°C. Смесь перемешивают в течение 1 ч при 0-5°C. Метилтрифторацетат (10,0 г, 78,1 ммоль) добавляют по каплям к смеси, в то время как поддерживают температуру 0-5°C. Когда добавление завершают, смесь перемешивают в течение 90 минут.
Хлороводородную кислоту (1 Н, 100 мл) добавляют по каплям к смеси при 0-5°C. Когда добавление завершают, смесь экстрагируют эфиром (2×100 мл).
Объединенные экстракты сушат и испаряют. Масло растворяют в толуоле (55 мл), и п-толуолсульфоновой кислоты моногидрат (0,100 г, 0,525 ммоль) добавляют к смеси. Смесь кипятят в течение 30 минут, и азеотропы вода/толуол, метанол/толуол удаляют, дистиллируя при атмосферном давлении. Дистилляцию продолжают при пониженном давлении, чтобы получить продукт в виде масла (12,4 г, 69% выход), Ткп=93-103°C при 6,7 кПа.
1H ЯМР (CDCl3) 8,21-8,19 (м, 2H), 7,95 (с, 1H).
ПРИМЕР 7
Получение 4-[5-[3-хлор-5-(трифторметил)фенил]-4,5-дигидро-5-(трифторметил)-3-изоксазолил]-N-[2-оксо-2-[(2,2,2-трифторэтил)амино]этил]-1-нафталинкарбоксамида
Этап A: Получение 4-ацетил-1-нафталинкарбонилхлорида
Тионилхлорид (35,00 г, 0,29 моль) добавляют к раствору 4-ацетил-1-нафталинкарбоновой кислоты (51,70 г, 0,24 моль) в толуоле (350 мл). Смесь нагревают до 90°C в течение 8,5 ч. После охлаждают до 25°C, растворитель удаляют при пониженном давлении, чтобы получить указанный в заглавии продукт в виде грязно-белого твердого вещества (55,1 г, 98,7% выход).
ИК (нуйол) 1758, 1681, 1515, 1352, 1282, 1245, 1218, 1190, 1117, 1053, 923, 762 см-1.
1H ЯМР (CDCl3): 8,72-8,69 (м, 1H), 8,50 (д, J=7,6 Гц, 1H), 8,44-8,41 (м, 1H), 7,82 (д, J=7,9 Гц, 1H), 7,76-7,65 (м, 2H), 2,77 (с, 3H).
Этап B: Получение 4-ацетил-N-[2-оксо-2-[(2,2,2-трифторэтил)амино]этил]-1-нафталинкарбоксамида
Раствор 2-амино-N-(2,2,2-трифторэтил)ацетамида (21,90 г, 0,14 моль) в 1,2-дихлорэтане (80 мл) добавляют по каплям в течение 15 минут к раствору продукта Примера 7, Этапа A (32,50 г, 0,14 моль) в 1,2-дихлорэтане (160 мл) при температуре от 25 до 30°C. Полученную в результате смесь дополнительно перемешивают в течение 10 минут при 25°C. Раствор триэтиламина (14,20 г, 0,14 моль) в 1,2-дихлорэтане (80 мл) затем добавляют по каплям в течение 44 минут при 25°C, и смесь перемешивают дополнительно в течение 20 минут при 25°C. Растворитель удаляют при пониженном давлении, и остаток растворяют в гарячем ацетонитриле (50 мл). Смесь затем охлаждают до 25°C, и воду (40 мл) добавляют по каплям. Смесь дополнительно охлаждают до 0°C и фильтруют. Отдельное твердое вещество промывают водой (100 мл) и сушат всю ночь в вакуумном сушильном шкафу (приблизительно 16-33 кПа при 50°C), чтобы получить указанный в заглавии продукт в виде грязно-белого твердого вещества (37 г, 75% выход), плавящийся при 169-169°C.
ИК (нуйол) 3303, 3233, 3072, 1698, 1683, 1636, 1572, 1548, 1447, 1279, 1241, 1186, 1159 см-1.
1H ЯМР (CD3S(=O)CD3): 8,95 (т, J=5,8 Гц, 1H), 8,72 (т, J=6,5 Гц, 1H), 8,55 (дд, J=6,5, 2 Гц, 1H), 8,37-8,33 (м, 1H), 8,13 (д, J=7,3 Гц, 1H), 7,70-7,60 (м, 3H), 4,07-3,95 (м, 4H), 2,75 (с, 3H).
Этап C: Получение 4-[3-[3-хлор-5-(трифторметил)фенил]-4,4,4-трифтор-1-оксо-2-бутен-1-ил]-N-[2-оксо-2-[(2,2,2-трифторэтил)амино]этил]-1-нафталинкарбоксамида
Смесь продукта Примера 7, Этапа B (10,00 г, 28,38 ммоль), 1-[3-хлор-5-(трифторметил)фенил]-2,2,2-трифторэтанона (9,00 г, 32,5 ммоль), гидроксида кальция (1,05 г, 14,2 ммоль), N,N-диметилформамида (20 мл) и трет-бутилметилового эфира (32 мл) помещают в реакционный сосуд, оборудованный термометром. Реакционный сосуд присоединяют к колонне Олдершоу с десятью тарелками, выход которой конденсируют и подают на декантатор изначально заполненный трет-бутилметиловым эфиром. В приборе поддерживают атмосферу азота. Верхнюю часть декантатора соединяют, чтобы возвращать конденсат, к пятой тарелке колонны Олдершоу. Данная установка обеспечит то, что мокрый (содержащий растворенную воду) трет-бутилметиловый эфир не возвращается из декантатора в реакционный сосуд. Сливной кран в нижней части декантатора позволяет удалять трет-бутилметиловый эфир в дополнение к воде из декантатора. Реакционную смесь нагревают до дистиллирования азеотропа трет-бутилметиловый эфир/вода. Поскольку ловушка декантатора содержит количество трет-бутилметилового эфира достаточное, чтобы растворить всю воду, образующуюся в реакции, конденсат в ловушке не разделяется на слои, содержащие преимущественно воду и преимущественно трет-бутилметиловый эфир. Поскольку реакционная смесь изначально содержала главным образом трет-бутилметиловый эфир, смесь кипит при температуре, не значительно превышающей нормальную точку кипения трет-бутилметилового эфира (например, приблизительно 65-70°C). Реакция продолжается относительно медленно при данной температура, так что конденсат постепенно сливают из ловушки декантатора, чтобы удалить трет-бутилметиловый эфир. Поскольку концентрация трет-бутилметилового эфира уменьшается в реакционной смеси, температура кипения реакционной смеси повышается. Трет-бутилметиловый эфир удаляют, гранулируя декантатор, пока температура кипения реакционной смеси повысится приблизительно до 85°C. Чтобы поддерживать данную температуру, добавляют трет-бутилметиловый эфир, поскольку требуется компенсировать потерю растворителя из прибора. Общее время от начала нагревания реакционной смеси до завершения дистилляции, не включающее период выключения на ночь, составляет приблизительно 6 ч.
Чтобы отделить продукт, смесь охлаждают до комнатной температуры и затем добавляют к смеси трет-бутилметилового эфира (50 мл) и 1 Н хлороводородной кислоты (100 мл). Органическую фазу разделяют, и гептан (60 мл) добавляют по каплям. Смесь фильтруют, чтобы получить указанный в заглавии продукт в виде грязно-белого твердой смеси изомеров, (14 г, 81% выход), плавящейся при 174,5-177°C.
ИК (нуйол) 3294, 1697, 1674, 1641, 1541, 1441, 1364, 1313, 1275, 1246, 1163, 1104 см-1.
1H ЯМР (CD3S(=O)CD3): (основной изомер) 8,91 (т, J=6,2 Гц, 1H), 8,73 (т, J=6,4 Гц, 1H), 8,44-8,30 (м, 2H), 8,18 (д, J=7,7 Гц, 1H), 7,97-7,61 (м, 7H), 4,06-3,95 (м, 4H).
Этап D: Получение 4-[5-[3-хлор-5-(трифторметил)фенил]-4,5-дигидро-5-(трифторметил)-3-изоксазолил]-N-[2-оксо-2-[(2,2,2-трифторэтил)амино]этил]-1-нафталинкарбоксамида
Водный гидроксид натрия (50%, 3,04 г, 38,0 ммоль) добавляют по каплям к перемешиваемому раствору сульфата гидроксиламина (1,48 г, 9,02 ммоль) в воде (28 мл) при 25°C. После того как данное добавление завершают, продукт Примера 7 Этапа C (10,00 г, 16,33 ммоль) в тетрагидрофуране (60 мл) добавляют по каплям в течение 40 минут. После того как добавления завершают, смесь перемешивают дополнительно в течение 30 минут. Растворитель удаляют при пониженном давлении и добавляют 1 Н хлороводородную кислоту (100 мл). Смесь экстрагируют эфиром (2×100 мл), и объединенные экстракты сушат и выпаривают. Остаток растворяют в ацетонитриле (30 мл), охлаждают до 0°C, и фильтруют, чтобы получить указанный в заглавии продукт в виде белого твердого вещества (7,84 г, 77% выход), плавящийся при 107-108,5°C (после перекристаллизации из ацетонитрила).
ИК (нуйол) 3312, 1681, 1642, 1536, 1328, 1304, 1271, 1237, 1173, 1116 см-1.
1H ЯМР (CD3S(=O)CD3): 8,98 (т, J=5,8 Гц, 1H), 8,82 (д, J=7,4 Гц, 1H), 8,74 (т, J=6,5 Гц, 1H), 8,40 (д, J=9,7 Гц, 1H), 8,09 (д, J=15,3 Гц, 2H), 7,93 (д, J=7,6 Гц, 2H), 7,75-7,04 (м, 3H), 4,63 (с, 2H), 4,07-3,96 (4H, м).
ПРИМЕР 7A
Альтернативное получение 4-[5-[3-хлор-5-(трифторметил)фенил]-4,5-дигидро-5-(трифторметил)-3-изоксазолил]-N-[2-оксо-2-[(2,2,2-трифторэтил)амино]этил]-1-нафталинкарбоксамида
Этап A: Получение 4-[3-[3-хлор-5-(трифторметил)фенил]-4,4,4-трифтор-1-оксо-2-бутен-1-ил]-N-[2-оксо-2-[(2,2,2-трифторэтил)амино]этил]-1-нафталинкарбоксамида
Смесь 4-ацетил-N-[2-оксо-2-[(2,2,2-трифторэтил)амино]этил]-1-нафталинкарбоксамида (100,00 г, 267,23 ммоль), 1-[3-хлор-5-(трифторметил)фенил]-2,2,2-трифторэтанона (86,92 г, 288,6 ммоль) и ацетонитрила (500 мл) помещают в реакционный сосуд, оборудованный термометром. Реакционный сосуд присоединяют к колонне Олдершоу с десятью тарелками. В приборе поддерживают атмосферу азота. Смесь нагревают до кипения в течение такого времени, пока температура верхней части колонны не станет 82°C. Карбонат калия добавляют реакционной смеси порциями так, чтобы контролировать скоростью реакции. Сначала добавляют 0,40 г карбоната калия, затем последовательно отдельно 0,1 г добавлений через 30, 60, 120 и 180 минут, и 0,40 г добавлений через 240 и 300 минут после начального добавления карбоната калия. Перед тем, как добавлять реакционные смеси, карбонат калия суспендируют в малом количестве ацетонитрила (приблизительно 3 мл ацетонитрила применяют, чтобы суспендировать 0,40 г количества карбоната калия, и приблизительно 2 мл ацетонитрила применяют, чтобы суспендировать 0,1 количества карбоната калия). Азеотроп ацетонитрил/вода (Ткип=76,5°C) непрерывно удаляют из верхней части колонны, поскольку он был сформирован. После конечного добавления карбоната калия смесь кипятят в течение дополнительно 60 минут. После общего времени 6 ч от начального добавления карбоната калия, больше ацетонитрила удаляют дистилляцией, пока все 265 мл ацетонитрила и азеотропа ацетонитрил/вода не удалят. Смесь охлаждают до 25°C, и воду (48 мл) добавляют к смеси. Смесь охлаждают до 0°C в течение 30 минут, выдерживают при данной температуре в течение 60 минут, и затем фильтруют. Отделенное твердое вещество промывают ацетонитрил:вода (96 мл, 26:5 ацетонитрил:вода).
Продукт сушат в вакуумной сушильной печи (приблизительно 16-33 кПа при 55°C) всю ночь, чтобы получить продукт в виде грязно-белого твердого вещества (150,51 г в виде смеси изомеров, 92,2% выход).
1H ЯМР спектр основного изомера является идентичным спектру вещества полученного в Примере 7, Этапе C.
Этап B: Получение 4-[5-[3-хлор-5-(трифторметил)фенил]-4,5-дигидро-5-(трифторметил)-3-изоксазолил]-N-[2-оксо-2-[(2,2,2-трифторэтил)амино]этил]-1-нафталинкарбоксамида
Раствор гидроксида натрия (15,10 г 50% водный раствор, 0,19 ммоль) в воде (общий объем 67,5 мл) и раствор сульфата гидроксиламина (7,75 г, 47,3 ммоль) в воде (общий объем 67,5 мл) добавляют одновременно к продукту Примера 7A, Этапа A (51,90 г, 81,78 ммоль) в тетрагидрофуран (300 мл) при 25°C в течение 75 минут. После того как добавления завершают, смесь перемешивают дополнительно в течение 180 минут. Смесь подкисляют до приблизительно pH 3, добавляя хлороводородную кислоту (концентрированную, приблизительно 11 г). Водный слой удаляют, и оставшийся органический раствор нагревают до кипения. Ацетонитрил добавляют, и дистиллят ацетонитрила/тетрагидрофурана удаляют, пока температура дистиллята не повысится до 82°C, указывая, что весь тетрагидрофуран был удален. Смеси позволяют остыть до 25°C, и ацетонитрил удаляют при пониженном давлении. Остаток растворяют в ацетонитриле (200 мл), охлаждают до 0°C, и полученную в результате смесь фильтруют, чтобы получить указанный в заглавии продукт в виде белого твердого вещества (43,45 г, 84% выход).
1H ЯМР спектр продукта является идентичным спектру вещества, полученному в Примере 7, Этапе D.
ПРИМЕР 7B
Альтернативное получение 4-[3-[3-хлор-5-(трифторметил)фенил]-4,4,4-трифтор-1-оксо-2-бутен-1-ил]-N-[2-оксо-2-[(2,2,2-трифторэтил)амино]этил]-1-нафталинкарбоксамида
Смесь 4-ацетил-N-[2-оксо-2-[(2,2,2-трифторэтил)амино]этил]-1-нафталинкарбоксамида (50,00 г, 135,1 ммоль), 1-[3-хлор-5-(трифторметил)фенил]-2,2,2-трифторэтанона (43,93 г, 145,8 ммоль) и ацетонитрила (250 мл) помещают в реакционный сосуд, оборудованный термометром. Реакционный сосуд присоединяют к колонне Олдершоу с десятью тарелками. В приборе поддерживают атмосферу азота. Смесь нагревают до кипения, в течение такого времени, пока температура верхней части колонны не станет 82°C. 1,8-Диазабицикло[5,4,0]ундец-7-ен (DBU) добавляют к реакционной смеси порциями, чтобы контролировать скорость реакции. В начале, 0,20 г DBU добавляют, затем последовательно отдельно 0,052 г добавления через 30, 90, 150 и 210 минут, и 0,20 г добавления через 270 и 330 минут после начального добавления DBU. Каждую отдельную порцию DBU разбавляют ацетонитрилом (2 мл) перед тем, как добавить к реакционной смеси. Азеотроп ацетонитрил/вода (Ткип=76,5°C) непрерывно удаляют из верхней части колонны, поскольку он был сформирован. После конечного добавления DBU смесь кипятят в течение дополнительных 60 минут. После общего времени 6 ч от начального добавления DBU, больше ацетонитрила удаляют дистилляцией, пока все 138 мл ацетонитрила и азеотропа ацетонитрил/вода не удалят. Смесь охлаждают до 25°C, и воду (24 мл) добавляют к смеси. Смесь охлаждают до 0°C в течение 30 минут, выдерживают при данной температура в течение 60 минут, и затем фильтруют. Отделенное твердое вещество промывают ацетонитрил:вода (48 мл, 26:5 ацетонитрил:вода).
Продукт сушат в вакуумной сушильной печи (приблизительно 16-33 кПа при 55°C) всю ночь, чтобы получить продукт в виде грязно-белого твердого вещества (76,0 г в виде смеси изомеров, 92,0% выход).
1H ЯМР спектр основного изомера является идентичным спектру вещества полученного в Примере 7, Этапе C.
ПРИМЕР 8
Получение метил-4-[5-[3-хлор-5-(трифторметил)фенил]-4,5-дигидро-5-(трифторметил)-3-изоксазолил]-1-нафталинкарбоксилата
Этап A: Получение метил-4-[3-[3-хлор-5-(трифторметил)фенил]-4,4,4-трифтор-1-оксо-2-бутен-1-ил]-1-нафталинкарбоксилата
Смесь метил-4-ацетил-1-нафталинкарбоксилата (7,83 г, 34,3 ммоль), 1-[3-хлор-5-(трифторметил)фенил]-2,2,2-трифторэтанона (10,43 г, 37,71 ммоль), гидроксида кальция (1,25 г, 16,9 ммоль), N,N-диметилформамида (27 мл) и трет-бутилметилового эфира (44 мл) нагревают до кипения. Азеотроп трет-бутилметиловый эфир/вода удаляют, как описано в Примере 7, Этап C. Поскольку ловушка декантатора содержит достаточное количество трет-бутилметилового эфира, чтобы растворить всю воду, образующуюся в реакции, конденсат в ловушке не разделяется на слои, содержащие преимущественно воду и преимущественно трет-бутилметиловый эфир. Трет-бутилметиловый эфир удаляют, постепенно гранулируя из ловушки декантатора, пока температура реакции не станет 85°C. Чтобы поддерживать данную температуру, трет-бутилметиловый эфир добавляют, поскольку требуется компенсировать потерю растворителя из прибора. Общее время от начала нагревания реакционной смеси до завершения дистилляции равно приблизительно 4,5 ч.
Смесь охлаждают до 25°C и выливают на смесь 0,5 Н хлороводородной кислоты (100 мл) и трет-бутилметилового эфира (50 мл). Смесь подкисляют концентрированной хлороводородной кислотой и выпаривают, и остаток кристаллизуют из гексанов (40 мл), чтобы получить указанный в заглавии продукт в виде желтого твердого вещества (13,24 г, 79% выход), плавящегося при 90-90,5°C (после перекристаллизации из гексанов).
ИК (нуйол) 3071, 1721, 1710, 1671, 1516, 1439, 1316, 1280, 1252, 1178, 1129, 1103, 1026, 888, 861 см-1.
1H ЯМР (CDCl3): 8,77-8,73 (м, 1H), 8,28-8,25 (м, 1H), 8,0 (д, J=7,6 Гц, 1H), 7,67-7,60 (м, 3H), 7,40 (д, J=1,4 Гц, 1H), 7,32 (с, 1H), 7,23 (с, 1H), 7,20 (с, 1H), 4,02 (с, 3H).
Этап B: Получение метил-4-[5-[3-хлор-5-(трифторметил)фенил]-4,5-дигидро-5-(трифторметил)-3-изоксазолил]-1-нафталинкарбоксилата
Водный гидроксид натрия (50%, 2,08 г, 25,5 ммоль) добавляют по каплям к перемешиваемому раствору сульфата гидроксиламина (1,07 г, 6,52 ммоль) в воде (20 мл) при 25°C. После того как данное добавление завершают, продукт Примера 8, Этапа A (5 г, 10,27 ммоль) в тетрагидрофуране (20 мл) добавляют по каплям в течение 40 минут. После того как добавления завершают, смесь перемешивают дополнительно в течение 30 минут. Органическую фазу разделяют и добавляют к хлороводородной кислоте (100 мл). Смесь экстрагируют этилацетатом (2×20 мл). Органический растворитель испаряют при пониженном давлении. Остаток повторно растворяют в уксусной кислоте (16 мл), и затем нагревают до 100°C. Воду (2 мл) добавляют по каплям, и смесь охлаждают до 50°C. Смесь затравили малым количеством ранее полученного метил-4-[5-[3-хлор-5-(трифторметил)фенил]-4,5-дигидро-5-(трифторметил)-3-изоксазолил]-1-нафталинкарбоксилата, и затем охлаждают до 25°C. Воду (2 мл) добавляют, и смесь охлаждают до 0°C. Смесь фильтруют, и твердое вещество промывают уксусной кислотой:водой (8 мл:2 мл). Твердое вещество сушат в вакуумной сушильной печи, чтобы получить указанный в заглавии продукт в виде белого твердого вещества (3,91 г, 76% выход), плавящийся при 111,5-112°C (после перекристаллизации из ацетонитрила).
ИК (нуйол) 1716, 1328, 1306, 1287, 1253, 1242, 1197, 1173, 1137, 1114, 1028, 771 см-1.
1H ЯМР (CDCl3): 8,90-8,87 (м, 1H), 8,82-8,79 (м, 1H), 8,10 (д, J=7,7 Гц), 7,87 (с, 1H), 7,81 (с, 1H), 7,72-7,67 (м, 3H) 7,55 (д, J=7,6 Гц, 1H), 4,34 (1/2 ABq, J=17,3 Гц, 1H), 4,03 (с, 3H), 3,93 (1/2 ABq, J=17,3 Гц, 1H).
Последующие Таблицы 1-8 определяют специфические сочетания реагентов, промежуточных соединений и продуктов, иллюстрирующих способы данного изобретения. Данные таблицы специфически раскрывают соединения также как определенные трансформации. В данных таблицах: Et обозначает этил, Me обозначает метил, CN обозначает циано, Ph обозначает фенил, Py обозначает пиридинил, c-Pr обозначает циклопропил, i-Pr обозначает изопропил, n-Pr обозначает нормальный пропил, s-Bu обозначает вторичный бутил, t-Bu обозначает третичный бутил, SMe обозначает метилтио, S(O)2 обозначает сульфонил и Thz обозначает тиазол. Сочленение групп являются сокращенными подобным образом; например, “S(O)2Me” обозначает метилсульфонил.
Таблицы 1-6 относятся к способу Схемы 1 превращения соединений Формулы 2 и 3 в соответствующие соединения Формулы 1. Данная трансформация предполагает прохождение через промежуточные соединения Формулы 11.

В примере трансформаций воплощенных в Таблицах 1-6, M представляет собой Ca, и воду дистиллируют как азеотроп из реакционной смеси, содержащей N,N-диметилформамид в качестве полярного апротонного растворителя, и трет-бутилметиловый эфир как апротонный растворитель, способный формировать низкокипящий азеотроп с водой.
Таблицы 7-9 относятся к способу Схемы 1a превращения соединений Формулы 2 и 3 в соответствующие соединения Формулы 1. Данная трансформация предполагает прохождение через промежуточные соединения Формулы 11.

В примере трансформаций воплощенных в Таблицах 7-9, M1 представляет собой K (т.е. основание представляет собой карбонат калия), и воду дистиллируют как азеотроп из реакционной смеси, содержащей ацетонитрил как апротонный растворитель, способный формировать низкокипящий азеотроп с водой.
Таблицы 10-12 относятся к способу Схемы 1b превращения соединений Формулы 2 и 3 в соответствующие соединения Формулы 1. Данная трансформация предполагает проходить через промежуточные соединения Формулы 11.
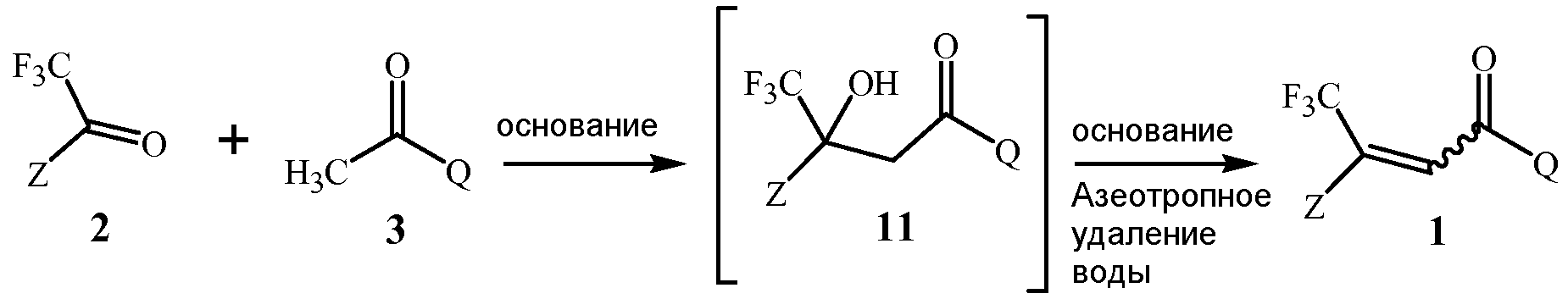
В примере трансформаций воплощенных в Таблицах 10-12, основание представляет собой 1,8-диазабицикло[5,4,0]ундец-7-ен, и воду дистиллируют как азеотроп из реакционной смеси, содержащей ацетонитрил как апротонный растворитель, способный формировать низкокипящий азеотроп с водой.
Таблицы 13-14 относятся к способу Схемы 2 превращения соединений Формулы 5 в реактивы Гриньяра, которые приводят в контакт с соединениями Формулы 6, чтобы получить соединения Формулы 2. X1 может быть таким же или отличным от X, как раскрыто в описании способа Схемы 2.
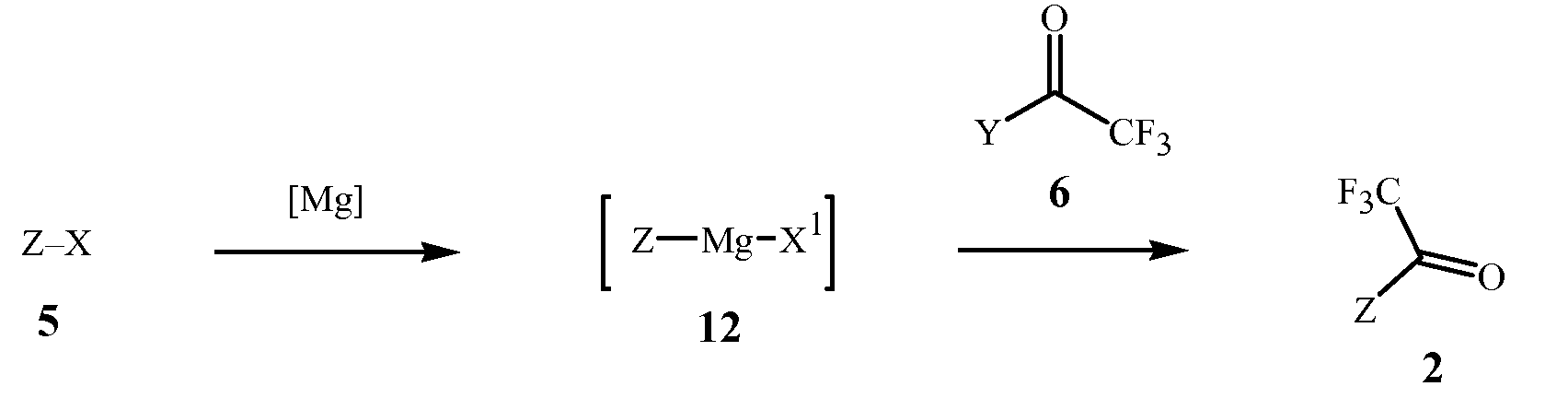
В примере трансформаций, воплощенных в данных таблицах, растворитель включает тетрагидрофуран.
Последующие соединения Формулы 3, определенные в Таблице 15, особо значимы как промежуточные соединения для получения соответствующего соединения Формулы 1, как показано в Схемах 1, 1a и 1b процедурами, описанными здесь, вместе со способами, известными в данной области техники.
Реферат
Изобретение относится к улучшенному способу получения соединения формулы, где Z представляет собой необязательно замещенный фенил; Q представляет собой фенил или 1-нафталенил, каждый необязательно замещенный. Способ включает дистилляцию воды из смеси, содержащей соединение формулысоединение формулы, основание, содержащее по меньшей мере одно соединение, выбранное из группы, содержащей гидроксиды щелочноземельного металла формулы, где M представляет собой Ca, Sr или Ba, карбонаты щелочного металла формулы, где Mпредставляет собой Li, Na или K, 1,5-диазабицикло[4.3.0]нон-5-ен и 1,8-диазабицикло[5.4.0]ундец-7-ен, и апротонный растворитель, способный образовывать низкокипящий азеотроп с водой. Изобретение также относится к способу получения соединения формулы 2, к способу получения соединения формулыиз соединения формулы 1 и к соединению формулы 2. Способ позволяет получать продукт с высоким выходом. 5 н. и 15 з.п. ф-лы, 15 табл., 8 пр.
Формула

где Z представляет собой необязательно замещенный фенил; и
Q представляет собой фенил или 1-нафталенил, каждый необязательно замещенный;
включающий дистилляцию воды из смеси, содержащей соединение Формулы 2
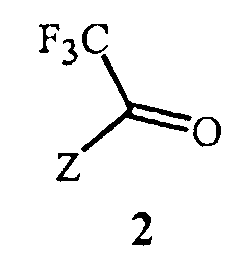
соединение Формулы 3

основание, содержащее по меньшей мере одно соединение, выбранное из группы содержащей гидроксиды щелочноземельного металла Формулы 4

где M представляет собой Ca, Sr или Ba, карбонаты щелочного металла Формулы 4a

где M1 представляет собой Li, Na или K,
1,5-диазабицикло[4.3.0]нон-5-ен и 1,8-диазабицикло[5.4.0]ундец-7-ен,
и апротонный растворитель, способный образовывать низкокипящий азеотроп с водой.
Z представляет собой фенил, необязательно замещенный до 5 заместителями, независимо выбранными из R2;
Q представляет собой фенил или 1-нафталенил, каждый необязательно замещенный до 4 заместителями, независимо выбранными из R3;
каждый R2 представляет собой независимо галоген, C1-C6алкил, C1-C6галоалкил, C1-C6алкокси, C1-C6галоалкокси, C1-C6алкилтио, C1-C6галоалкилтио, C1-C6алкиламино, C2-C6диалкиламино, -CN или -NO2;
каждый R3 представляет собой независимо галоген, C1-C6алкил, C1-C6галоалкил, C2-C6алкенил, C2-C6галоалкенил, C2-C6алкинил, C3-C6галоалкинил, C3-C6циклоалкил, C3-C6галоциклоалкил, C3-C6алкокси, C1-C6галоалкокси, C1-C6алкилтио, C2-C7алкилкарбонил, C2-C7галоалкилкарбонил, C1-C6галоалкилтио, C1-C6алкилсульфинил, C1-C6галоалкилсульфинил, C1-C6алкилсульфонил, C1-C6галоалкилсульфонил, -N(R4)R5, -C(=W)N(R4)R5, -C(=W)OR5, -CN, -OR11 или -NO2; или фенильное кольцо или 5- или 6-членное насыщенное или ненасыщенное гетероциклическое кольцо, каждое кольцо необязательно замещенное одним или более заместителем, независимо выбранным из галогена, C1-C6алкила, C1-C6галоалкила, C3-C6циклоалкила, C3-C6галоциклоалкила, C1-C6алкокси, C1-C6галоалкокси, C1-C6алкилтио, C1-C6галоалкилтио, C1-C6алкилсульфинила, C1-C6галоалкилсульфинила, C1-C6алкилсульфонила, C1-C6галоалкилсульфоннла, -CN, -NO2, N(R4)R5, -C(=W)N(R4)R5, -C(=O)OR5 и R7;
каждый R4 представляет собой независимо H, C1-C6алкил, C2-C6алкенил, C2-C6алкинил, C3-C6циклоалкил, C4-C7алкилциклоалкил, C4-C7циклоалкилалкил, C2-C7алкилкарбонил или C2-C7алкоксикарбонил;
каждый R5 представляет собой независимо H; или C1-C6алкил, C2-C6алкенил, C2-C6алкинил, C3-C6циклоалкил, C4-C7алкилциклоалкил или C4-C7циклоалкилалкил, каждый необязательно замещенный одним или более заместителем, независимо выбранным из R6;
каждый R6 представляет собой независимо галоген, C1-C6алкил, C1-C6алкокси, C1-C6алкилтио, C1-C6алкилсульфинил, C1-C6алкилсульфонил, C1-C6алкиламино, C2-C8диалкиламино, C3-C6циклоалкиламино, C2-C7алкилкарбонил, C2-C7алкоксикарбонил, C2-C7алкиламинокарбонил, C3-C9диалкиламинокарбонил, C2-C7галоалкилкарбонил, C2-C7галоалкоксикарбонил, C2-C7галоалкиламинокарбонил, C3-C9галодиалкиламинокарбонил, -OH, -NH2, -CN или -NO2; или Q1;
каждый R7 представляет собой независимо фенильное кольцо или пиридинильное кольцо, каждое кольцо необязательно замещенное одним или более заместителем, независимо выбранным из R8;
каждый R8 представляет собой независимо галоген, C1-C6алкил, C1-C6галоалкил, C1-C6алкокси, C1-C6галоалкокси, C1-C6алкилтио, C1-C6галоалкилтио, C1-C6алкилсульфинил, C1-C6галоалкилсульфинил, C1-C6алкилсульфонил, C1-C6галоалкилсульфонил, C1-C6алкиламино, C2-C6диалкиламино, C2-C4алкилкарбонил, C2-C4алкоксикарбонил, C2-C7алкиламинокарбонил, C3-C7диалкиламинокарбонил, -OH, -NH2, -C(O)OH, -CN или -NO2;
каждый Q1 представляет собой независимо фенильное кольцо или 5- или 6-членное насыщенное или ненасыщенное гетероциклическое кольцо, каждое кольцо необязательно замещенное одним или более заместителем, независимо выбранным из галогена, C1-C6алкила, C1-C6галоалкила, C3-C6циклоалкила, C3-C6галоциклоалкила, C1-C6алкокси, C1-C6галоалкокси, C1-C6алкилтио, C1-C6галоалкилтио, C1-C6алкилсульфинила, C1-C6галоалкилсульфинила, C1-C6алкилсульфонила, C1-C6галоалкилсульфонила, C1-C6алкиламино, C2-C6диалкиламино, -CN, -NO2, C(=W)N(R9)R10 и -C(=O)OR10;
каждый R9 представляет собой независимо H, C1-C6алкил, C1-C6галоалкил, C2-C6алкенил, C2-C6алкинил, C3-C6циклоалкил, C4-C7алкилциклоалкил, C4-C7циклоалкилалкил, C2-C7алкилкарбонил или C2-C7алкоксикарбонил;
каждый R10 представляет собой независимо H; или C1-C6алкил, C1-C6галоалкил, C2-C6алкенил, C2-C6алкинил, C3-C6циклоалкил, C4-C7алкилциклоалкил или C4-C7циклоалкилалкил;
каждый R11 представляет собой независимо H; или C2-C6алкенил, C2-C6алкинил, C3-C6циклоалкил, C4-C7алкилциклоалкил, C4-C7циклоалкилалкил, C2-C7 алкилкарбонил, C2-C7алкоксикарбонил, C1-C6алкилсульфонил или C1-C6галоалкилсульфонил; и
каждый W представляет собой независимо O или S.
Z представляет собой


R2a представляет собой галоген, C1-C2галоалкил или C1-C2галоалкокси;
R2b представляет собой H, галоген или циано;
R2c представляет собой H, галоген или CF3;
R3 представляет собой C(O)N(R4)R5 или C(O)OR5a;
R4 представляет собой H, C2-C7алкилкарбонил или C2-C7алкоксикарбонил; и
R5 представляет собой C1-C6алкил или C1-C6галоалкил, каждый замещенный одним заместителем, независимо выбранным из гидрокси, C1-C6алкокси, C1-C6алкилтио, C1-C6алкилсульфинила, C1-C6алкилсульфонила, C2-C7алкиламинокарбонила, C3-C9диалкиламинокарбонила, C2-C7галоалкиламинокарбонила и C3-C9галодиалкиламинокарбонила; и
R5a представляет собой C1-C6алкил, C2-C6алкенил или C2-C6алкинил, каждый необязательно замещенный одним или более заместителем, независимо выбранным из галогена, C1-C2алкокси и фенила, необязательно замещенного до 5 заместителями, выбранными из галогена и C1-C3алкила.
Z представляет собой фенил, необязательно замещенный до 5 заместителями, независимо выбранными из R2; и
каждый R2 представляет собой независимо F, Cl, Br, C1-C6алкил, C1-C6фторалкил, C1-C6алкокси, C1-C6фторалкокси, C1-C6алкилтио или C1-C6фторалкилтио;
дополнительно включает получение соединения Формулы 2
(1) образованием реакционной смеси, содержащей реактив Гриньяра, полученный из соединения Формулы 5

где X представляет собой Cl, Br или I,
путем контактирования соединения Формулы 5 с
(a) металлическим магнием, или
(b) галогенидом алкилмагния
в присутствии эфирного растворителя; и затем
(2) контактированием реакционной смеси с соединением Формулы 6

где Y представляет собой OR11 или NR12R13;
R11 представляет собой C1-C5алкил; и
R12 и R13 представляют собой независимо C1-C2алкил; или R12 и R13 взяты вместе как -CH2CH2OCH2CH2-.

R2a представляет собой F, Cl, Br, C1-C2фторалкил или C1-C2фторалкокси;
R2b представляет собой H, F, Cl или Br; и
R2c представляет собой H, F, Cl, Br или CF3.
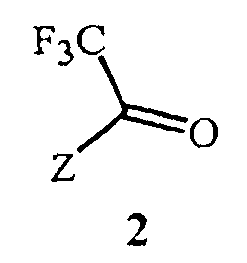
где Z представляет собой фенил, необязательно замещенный до 5 заместителями, независимо выбранными из R2; и
каждый R2 представляет собой независимо F, Cl, Br, C1-C6алкил, C1-C6фторалкил, C1-C6алкокси, C1-C6фторалкокси, C1-C6алкилтио или C1-C6фторалкилтио;
включающий
(1) образование реакционной смеси, содержащей реактив Гриньяра, полученный из соединения Формулы 5

где X представляет собой I,
путем контактирования соединения Формулы 5 с
(a) металлическим магнием, или
(b) галогенидом алкилмагния
в присутствии эфирного растворителя; и затем
(2) контактирование реакционной смеси с соединением Формулы 6
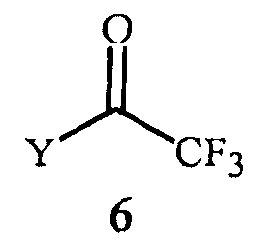
где Y представляет собой OR11 или NR12R13;
R11 представляет собой C1-C5алкил; и
R12 и R13 представляют собой независимо C1-C2алкил; или R12 и R13 взяты вместе как -CH2CH2OCH2CH2-.

R2a представляет собой F, Cl, Br, C1-C2фторалкил или C1-C2фторалкокси;
R2b представляет собой H, F, Cl или Br; и
R2c представляет собой H, F, Cl, Br или CF3.

где Z представляет собой необязательно замещенный фенил; и
Q представляет собой фенил или 1-нафталенил, каждый необязательно замещенный;
включающий контактирование соединения Формулы 1

полученного способом по п.1,
с гидроксиламином и основанием, выбранным из алкоксида щелочного металла, карбоната щелочного металла, гидроксида щелочного металла и органического основания, в присутствии подходящего растворителя, выбранного из спирта, эфира, нитрила или ароматического углеводорода, при температуре между 20 и 40°C.
Z представляет собой


R2a представляет собой галоген, C1-C2галоалкил или C1-C2галоалкокси;
R2b представляет собой H, галоген или циано;
R2c представляет собой H, галоген или CF3;
R4 представляет собой H, C2-C7алкилкарбонил или C2-C7алкоксикарбонил; и
R5 представляет собой C1-C6алкил или C1-C6галоалкил, каждый замещенный одним заместителем, независимо выбранным из гидрокси, C1-C6алкокси, C1-C6алкилтио, C1-C6алкилсульфинил, C1-C6алкилсульфонил, C2-C7алкиламинокарбонил, C3-C9диалкиламинокарбонил, C2-C7галоалкиламинокарбонил и C3-C9галодиалкиламинокарбонил.

где Z представляет собой

R2a представляет собой CF3; R2b представляет собой H или галоген; и R2c представляет собой галоген.
1-[3-хлор-5-(трифторметил)]-2,2,2-трифторэталон; и
1-[3-бром-5-(трифторметил)]-2,2,2-трифторэтанон.


























Комментарии