Изоксазолиновые соединения и их применение в борьбе с вредителями - RU2461546C2
Код документа: RU2461546C2
Описание
Настоящее изобретение относится к изоксазолиновому соединению и его применению в борьбе с вредителями.
В описании международной публикации No. WO 2005-51932 описан определенный класс изоксазолиновых соединений в качестве активных ингредиентов сельскохозяйственных и садоводческих фунгицидов и инсектицидов.
Авторы настоящего изобретения провели исследования для нахождения соединения, обладающего активностью по уничтожению вредителей, и таким образом обнаружили, что изоксазолиновое соединение, представленное формулой (1), приведенной ниже, показало уничтожающее действие против вредителей, в соответствии с чем было создано настоящее изобретение.
Таким образом, настоящее изобретение обеспечивает следующее.
1. Изоксазолиновое соединение, представленное формулой (1):

где R1 представляет собой C1-C4галогеналкильную группу,
R2 представляет собой C1-C6алкильную группу, незамещенную или замещенную одним или несколькими атомами галогена, C1-C6алкоксигруппу, незамещенную или замещенную одним или несколькими атомами галогена, атом галогена, C1-C6алкилсульфенильную группу, C1-C6алкилсульфинильную группу, C1-C6алкилсульфонильную группу, нитрогруппу или цианогруппу,
R3 представляет собой C1-C6алкильную группу, C1-C6алкоксигруппу, нитрогруппу или атом галогена,
m равно целому числу от 0 до 5,
n равно целому числу от 0 до 4,
M представляет собой атом кислорода или атом серы,
R4 представляет собой атом водорода; C1-C12алкильную группу, незамещенную или замещенную одним или несколькими атомами галогена; (C2-C5алкоксикарбонил)C1-C12алкильную группу; C2-C12цианоалкильную группу; C3-C12циклоалкильную группу, незамещенную или замещенную одним или несколькими атомами галогена; (C3-C6циклоалкил)C1-C6алкильную группу; (C1-C6алкокси)C2-C6алкильную группу; C2-C12алкенильную группу, незамещенную или замещенную одним или несколькими атомами галогена; C2-C12алкинильную группу, незамещенную или замещенную одним или несколькими атомами галогена; C1-C6алкоксигруппу, незамещенную или замещенную одним или несколькими атомами галогена; (C1-C6алкокси)C1-C6алкоксигруппу; C3-C6алкенилоксигруппу, незамещенную или замещенную одним или несколькими атомами галогена; бензилоксигруппу; фенил(C2-C6)алкенильную группу; (C1-C6алкиламино)C1-C6алкильную группу; (ди(C1-C6алкил)амино)C1-C6алкильную группу; группу, представленную следующей формулой:
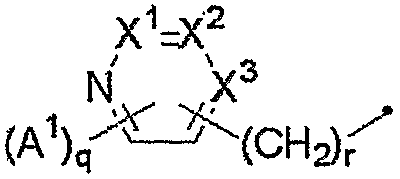
[где A1 представляет собой C1-C4алкильную группу, незамещенную или замещенную одним или несколькими атомами галогена, C1-C4алкоксигруппу, незамещенную или замещенную одним или несколькими атомами галогена, атом галогена или цианогруппу,
q равно целому числу от 0 до 3,
r равно целому числу от 0 до 2 и
X1, X2 и X3 представляют собой комбинацию одного атома азота и двух CH-групп или комбинацию трех CH-групп]; группу, представленную следующей формулой:

[где A2 представляет собой C1-C4алкильную группу, атом галогена или нитрогруппу,
t равно целому числу от 0 до 3,
u равно целому числу от 0 до 2 и
X4 представляет собой атом кислорода, атом серы или NH]; группу, представленную следующей формулой:

[где L1 представляет собой C1-C6алкильную группу, незамещенную или замещенную одним или несколькими атомами галогена, или C3-C8циклоалкильную группу и
L2 представляет собой атом водорода или C1-C6алкильную группу, незамещенную или замещенную одним или несколькими атомами галогена, или L1 и L2, взятые вместе, представляют собой C2-C9алкандиильную группу, группу CH2CH2CH(CH3)CH2CH2 или группу CH2CH2OCH2CH2]; фенильную группу; фенил(C1-C4)алкильную группу; феноксигруппу; фенокси(C1-C4)алкильную группу; фениламиногруппу или фенил(C1-C2)алкиламиногруппу, где бензольное кольцо любой из указанных фенильных групп, указанной фенил(C1-C4)алкильной группы, указанной феноксигруппы, указанной фенокси(C1-C4)алкильной группы, указанной фениламиногруппы и указанной фенил(C1-C2)алкиламиногруппы может быть замещено 1-5 группами, независимо выбранными из группы, состоящей из C1-C6алкильных групп, незамещенных или замещенных одним или несколькими атомами галогена, C1-C6алкоксигрупп, незамещенных или замещенных одним или несколькими атомами галогена, атомов галогена, нитрогруппы, цианогруппы, C1-C6алкилсульфенильных групп, C1-C6алкилсульфинильных групп, C1-C6алкилсульфонильных групп, C2-C6алкоксикарбонильных групп и бензоильной группы, и
R5 представляет собой атом водорода, C1-C12алкильную группу, C3-C12циклоалкильную группу, (C3-C6циклоалкил)C1-C6алкильную группу, C2-C6алкоксиалкильную группу, C3-C12алкенильную группу, C3-C12алкинильную группу, C1-C6ацильную группу, C2-C8цианоалкильную группу, нитрометильную группу, C2-C6алкоксикарбонильную группу, C3-C8алкоксикарбонилалкильную группу, фенил(C1-C4)алкильную группу или бензоильную группу, где бензольное кольцо указанной фенил(C1-C4)алкильной группы или указанной бензоильной группы может быть замещено 1-5 группами, независимо выбранными из группы, состоящей из C1-C6алкильных групп, незамещенных или замещенных одним или несколькими атомами галогена, C1-C6алкоксигрупп, незамещенных или замещенных одним или несколькими атомами галогена, атомов галогена, нитрогруппы и цианогруппы (указанное изоксазолиновое соединение здесь и далее обозначают как соединение настоящего изобретения).
2. Изоксазолиновое соединение по указанному выше пункту 1, где n в формуле (1) равно 0.
3. Изоксазолиновое соединение по указанному выше пункту 1, где в формуле (1) n равно 1 и R3 в качестве заместителя в положении 6 представляет собой C1-C6алкильную группу.
4. Изоксазолиновое соединение по указанному выше пункту 1, где в формуле (1) n равно 1 и R3 в качестве заместителя в положении 6 представляет собой метильную группу.
5. Изоксазолиновое соединение по указанному выше пункту 1, где в формуле (1) n равно 1 и R3 в качестве заместителя в положении 6 представляет собой атом галогена.
6. Изоксазолиновое соединение по указанному выше пункту 1, где в формуле (1) n равно 1 и R3 представляет собой C1-C4алкоксигруппу, незамещенную или замещенную одним или несколькими атомами галогена, которая является заместителем в положении 6.
7. Изоксазолиновое соединение по любому из указанных выше пунктов 1-6, где в формуле (1) R4 представляет собой C1-C12алкильную группу, незамещенную или замещенную одним или несколькими атомами галогена.
8. Изоксазолиновое соединение по любому из указанных выше пунктов 1-6, где в формуле (1) R4 представляет собой C2-C12алкенильную группу, незамещенную или замещенную одним или несколькими атомами галогена.
9. Изоксазолиновое соединение по любому из указанных выше пунктов 1-6, где в формуле (1) R4 представляет собой C1-C6алкоксигруппу, незамещенную или замещенную одним или несколькими атомами галогена.
10. Изоксазолиновое соединение по любому из указанных выше пунктов 1-6, где в формуле (1) R4 представляет собой фенильную группу, незамещенную или замещенную 1-5 группами, независимо выбранными из указанной ниже группы X:
группа X: C1-C6алкильные группы, незамещенные или замещенные одним или несколькими атомами галогена, C1-C6алкоксигруппы, незамещенные или замещенные одним или несколькими атомами галогена, атомы галогена, нитрогруппа, цианогруппа, C1-C6алкилсульфенильные группы, C1-C6алкилсульфинильные группы, C1-C6алкилсульфонильные группы, C2-C6алкоксикарбонильные группы и бензоильная группа.
11. Изоксазолиновое соединение по указанному выше пункту 1, где в формуле (1) R1 представляет собой трифторметильную группу, R4 представляет собой атом водорода, C1-C12алкильную группу, незамещенную или замещенную одним или несколькими атомами галогена, C2-C12алкенильную группу, незамещенную или замещенную одним или несколькими атомами галогена, или C1-C6алкоксигруппу, незамещенную или замещенную одним или несколькими атомами галогена, и R5 представляет собой атом водорода.
12. Изоксазолиновое соединение по указанному выше пункту 1, где в формуле (1) R1 представляет собой трифторметильную группу, R4 представляет собой фенильную группу, незамещенную или замещенную 1-5 группами, независимо выбранными из следующей группы X, и R5 представляет собой атом водорода:
группа X: C1-C6алкильные группы, незамещенные или замещенные одним или несколькими атомами галогена, C1-C6алкоксигруппы, незамещенные или замещенные одним или несколькими атомами галогена, атомы галогена, нитрогруппа, цианогруппа, C1-C6алкилсульфенильные группы, C1-C6алкилсульфинильные группы, C1-C6алкилсульфонильные группы, C2-C6алкоксикарбонильные группы и бензоильная группа.
13. Изоксазолиновое соединение по указанному выше пункту 1, где в формуле (1) R1 представляет собой трифторметильную группу, m равно 2, R2 в качестве заместителей соответственно в положении 3 и в положении 5 представляют собой атомы хлора, R4 представляет собой атом водорода, C1-C12алкильную группу, незамещенную или замещенную одним или несколькими атомами галогена, C2-C12алкенильную группу, незамещенную или замещенную одним или несколькими атомами галогена, или C1-C6алкоксигруппу, незамещенную или замещенную одним или несколькими атомами галогена, и R5 представляет собой атом водорода.
14. Изоксазолиновое соединение по указанному выше пункту 1, где в формуле (1) R1 представляет собой трифторметильную группу, m равно 2, R2 в качестве заместителей соответственно в положении 3 и в положении 5 представляют собой атомы хлора, R4 представляет собой фенильную группу, незамещенную или замещенную 1-5 группами, независимо выбранными из следующей группы X, и R5 представляет собой атом водорода:
группа X: C1-C6алкильные группы, незамещенные или замещенные одним или несколькими атомами галогена, C1-C6алкоксигруппы, незамещенные или замещенные одним или несколькими атомами галогена, атомы галогена, нитрогруппа, цианогруппа, C1-C6алкилсульфенильные группы, C1-C6алкилсульфинильные группы, C1-C6алкилсульфонильные группы, C2-C6алкоксикарбонильные группы и бензоильная группа.
15. Изоксазолиновое соединение по указанному выше пункту 1, где в формуле (1) R1 представляет собой трифторметильную группу, n равно 0 или 1, R4 представляет собой атом водорода, C1-C12алкильную группу, незамещенную или замещенную одним или несколькими атомами галогена, C2-C12алкенильную группу, незамещенную или замещенную одним или несколькими атомами галогена, или C1-C6алкоксигруппу, незамещенную или замещенную одним или несколькими атомами галогена, и R5 представляет собой атом водорода.
16. Изоксазолиновое соединение по указанному выше пункту 1, где в формуле (1) R1 представляет собой трифторметильную группу, n равно 0 или 1, R4 представляет собой фенильную группу, незамещенную или замещенную 1-5 группами, независимо выбранными из следующей группы X, и R5 представляет собой атом водорода:
группа X: C1-C6алкильные группы, незамещенные или замещенные одним или несколькими атомами галогена, C1-C6алкоксигруппы, незамещенные или замещенные одним или несколькими атомами галогена, атомы галогена, нитрогруппа, цианогруппа, C1-C6алкилсульфенильные группы, C1-C6алкилсульфинильные группы, C1-C6алкилсульфонильные группы, C2-C6алкоксикарбонильные группы и бензоильная группа.
17. Композиция для борьбы с вредителями, содержащая в качестве активного ингредиента изоксазолиновое соединение, представленное формулой (1), по любому из указанных выше пунктов 1-16.
18. Способ уничтожения вредителей, отличающийся тем, что применяют эффективное количество изоксазолинового соединения, представленного формулой (1), по любому из указанных выше пунктов 1-16, к вредителям или участку, где обитают вредители.
19. Применение изоксазолинового соединения, представленного формулой (1), по любому из указанных выше пунктов 1-16, для борьбы с вредителями.
20. Применение изоксазолинового соединения, представленного формулой (1), по любому из указанных выше пунктов 1-16, для получения композиции для борьбы с вредителями.
Соединение настоящего изобретения пригодно в качестве активного ингредиента композиции для борьбы с вредителями вследствие его уничтожающей активности против вредителей.
В настоящем изобретении C1-C4галогеналкильная группа, представленная R1, включает, например, трифторметильную группу, дифторметильную группу, хлордифторметильную группу и пентафторэтильную группу.
C1-C6алкильная группа, незамещенная или замещенная одним или несколькими атомами галогена, представленная R2, включает, например, метильную группу, этильную группу, пропильную группу, изопропильную группу, трет-бутильную группу и трифторметильную группу.
C1-C6алкоксигруппа, незамещенная или замещенная одним или несколькими атомами галогена, представленная R2, включает, например, метоксигруппу, этоксигруппу, пропоксигруппу, изопропоксигруппу, трет-бутоксигруппу, трифторметоксигруппу и дифторметоксигруппу.
Атом галогена, представленный R2, включает атом фтора, атом хлора, атом брома и атом йода.
C1-C6алкилсульфенильная группа, представленная R2, включает, например, метилтиогруппу, этилтиогруппу, пропилтиогруппу и изопропилтиогруппу.
C1-C6алкилсульфинильная группа, представленная R2, включает, например, метилсульфинильную группу, этилсульфинильную группу, пропилсульфинильную группу и изопропилсульфинильную группу.
C1-C6алкилсульфонильная группа, представленная R2, включает, например, метилсульфонильную группу, этилсульфонильную группу, пропилсульфонильную группу и изопропилсульфонильную группу.
C1-C6алкильная группа, представленная R3, включает, например, метильную группу, этильную группу, пропильную группу и изопропильную группу.
C1-C6алкоксигруппа, представленная R3, включает, например, метоксигруппу, этоксигруппу, пропоксигруппу и изопропоксигруппу.
Атом галогена, представленный R3, включает атом фтора, атом хлора, атом брома и атом йода.
C1-C12алкильная группа, незамещенная или замещенная одним или несколькими атомами галогена, представленная R4, включает, например, метильную группу, этильную группу, пропильную группу, изопропильную группу, бутильную группу, изобутильную группу, втор-бутильную группу, трет-бутильную группу, пентильную группу, 1-метилбутильную группу, 2-метилбутильную группу, 3-метилбутильную группу, 1-этилпропильную группу, 1,1-диметилпропильную группу, 1,2-диметилпропильную группу, 2,2-диметилпропильную группу, гексильную группу, 1-метилпентильную группу, 2-метилпентильную группу, 1,1-диметилбутильную группу, 1,3-диметилбутильную группу, гептильную группу, октильную группу, нонильную группу, децильную группу, ундецильную группу, додецильную группу, фторметильную группу, хлорметильную группу, бромметильную группу, йодометильную группу, дифторметильную группу, хлорфторметильную группу, дихлорметильную группу, бромфторметильную группу, трифторметильную группу, хлордифторметильную группу, дихлорфторметильную группу, трихлорметильную группу, бромдифторметильную группу, бромхлорфторметильную группу, дифторйодометильную группу, 2-фторэтильную группу, 2-хлорэтильную группу, 2-бромэтильную группу, 2,2-дифторэтильную группу, 2-хлор-2-фторэтильную группу, 2,2-дихлорэтильную группу, 2-бром-2-фторэтильную группу, 2,2,2-трифторэтильную группу, 2-хлор-2,2-дифторэтильную группу, 2,2-дихлор-2-фторэтильную группу, 2,2,2-трихлорэтильную группу, 2-бром-2,2-дифторэтильную группу, 1,1,2,2-тетрафторэтильную группу, 1,1,2,2,2-пентафторэтильную группу, 1-хлор-1,2,2,2-тетрафторэтильную группу, 2-хлор-1,1,2,2-тетрафторэтильную группу, 1,2-дихлор-1,2,2-трифторэтильную группу, 1-бром-1,2,2,2-тетрафторэтильную группу, 2-бром-1,1,2,2-тетрафторэтильную группу, 2-фторпропильную группу, 2-хлорпропильную группу, 2,3-дихлорпропильную группу, 3,3,3-трифторпропильную группу, 3-бром-3,3-дифторпропильную группу, 2,2,3,3-тетрафторпропильную группу, 2,2,3,3,3-пентафторпропильную группу, 1,1,2,3,3,3-гексафторпропильную группу, 1,1,2,2,3,3,3-гептафторпропильную группу, 2,3-дихлор-1,1,2,3,3-пентафторпропильную группу, 2-фтор-1-метилэтильную группу, 2-хлор-1-метилэтильную группу, 2-бром-1-метилэтильную группу, 2,2,2-трифтор-1-(трифторметил)этильную группу, 1,2,2,2-тетрафтор-1-(трифторметил)этильную группу и 1,1,2,2,3,3,4,4,4-нонафторбутильную группу.
(C2-C5алкоксикарбонил)C1-C12алкильная группа, представленная R4, включает, например, метоксикарбонилметильную группу, этоксикарбонилметильную группу, пропоксикарбонилметильную группу, изопропоксикарбонилметильную группу и трет-бутоксикарбонилметильную группу.
C2-C12цианоалкильная группа, представленная R4, включает, например, цианометильную группу.
C3-C12циклоалкильная группа, незамещенная или замещенная одним или несколькими атомами галогена, представленная R4, включает, например, циклопропильную группу, 1-метилциклопропильную группу, 2-метилциклопропильную группу, 2,2-диметилциклопропильную группу, 2,2,3,3-тетраметилциклопропильную группу, циклобутильную группу, циклопентильную группу, 1-метилциклопентильную группу, 2-метилциклопентильную группу, 3-метилциклопентильную группу, циклогексильную группу, 1-метилциклогексильную группу, 2-метилциклогексильную группу, 3-метилциклогексильную группу, 4-метилциклогексильную группу, циклогептильную группу, циклооктильную группу, 3-фторциклопропильную группу, 2-хлорциклопропильную группу, 2,2-дифторциклопропильную группу, 2,2-дихлорциклопропильную группу, 2,2-дибромциклопропильную группу, 2,2-дифтор-1-метилциклопропильную группу, 2,2-дихлор-1-метилциклопропильную группу, 2,2,3,3-тетрафторциклобутильную группу и 2-хлор-2,3,3-трифторциклобутильную группу.
(C3-C6циклоалкил)C1-C6алкильная группа, представленная R4, включает, например, циклопропилметильную группу, (1-метилциклопропил)метильную группу, циклобутилметильную группу, циклопентилметильную группу и циклогексилметильную группу.
(C1-C6алкокси)C2-C6алкильная группа, представленная R4, включает, например, 2-метоксиэтильную группу, 2-этоксиэтильную группу, 2-пропоксиэтильную группу, 2-изопропоксиэтильную группу, 2-бутоксиэтильную группу, 2-изобутоксиэтильную группу, 2-(втор-бутокси)этильную группу и 2-(трет-бутокси)этильную группу.
C2-C12алкенильная группа, незамещенная или замещенная одним или несколькими атомами галогена, представленная R4, включает, например, винильную группу, 1-пропенильную группу, 2-пропенильную группу, 1-метилэтенильную группу, 2-бутенильную группу, 1-метил-2-пропенильную группу, 2-метил-2-пропенильную группу, 2-пентенильную группу, 2-метил-2-бутенильную группу, 3-метил-2-бутенильную группу, 2-этил-2-пропенильную группу, 1,1-диметил-2-пропенильную группу, 2-гексенильную группу, 2-метил-2-пентенильную группу, 2,4-диметил-2,6-гептадиенильную группу, 3,7-диметил-2,6-октадиенильную группу, 2,2-дихлорвинильную группу, 2-фтор-2-пропенильную группу, 2-хлор-2-пропенильную группу, 3-хлор-2-пропенильную группу, 2-бром-2-пропенильную группу, 3-бром-2-пропенильную группу, 3,3-дифтор-2-пропенильную группу, 2,3-дихлор-2-пропенильную группу, 3,3-дихлор-2-пропенильную группу, 2,3-дибром-2-пропенильную группу, 2,3,3-трифтор-2-пропенильную группу, 2,3,3-трихлор-2-пропенильную группу, 1-(трифторметил)этенильную группу, 3-хлор-2-бутенильную группу, 3-бром-2-бутенильную группу, 4,4-дифтор-3-бутенильную группу, 3,4,4-трифтор-3-бутенильную группу, 3-хлор-3,4,4-трифтор-2-бутенильную группу и 3-бром-2-метил-2-пропенильную группу.
C2-C12алкинильная группа, незамещенная или замещенная одним или несколькими атомами галогена, представленная R4, включает, например, этинильную группу, 1-пропинильную группу, 2-пропинильную группу, 2-бутинильную группу, 1-метил-2-пропинильную группу, 2-пентинильную группу, 1-метил-2-бутинильную группу, 1,1-диметил-2-пропинильную группу, 2-гексинильную группу, 2-хлорэтинильную группу, 2-бромэтинильную группу, 2-йодэтинильную группу, 3-хлор-2-пропинильную группу, 3-бром-2-пропинильную группу и 3-йод-2-пропинильную группу.
C1-C6алкоксигруппа, незамещенная или замещенная одним или несколькими атомами галогена, представленная R4, включает, например, метоксигруппу, этоксигруппу, пропоксигруппу,
изопропоксигруппу, бутоксигруппу, изобутоксигруппу,
втор-бутоксигруппу, трет-бутоксигруппу, пентилоксигруппу,
гексилоксигруппу, дифторметоксигруппу,
трифторметоксигруппу, хлордифторметоксигруппу,
бромдифторметоксигруппу, 2-фторэтоксигруппу, 2-хлорэтоксигруппу,
2,2,2-трифторэтоксигруппу, 1,1,2,2-тетрафторэтоксигруппу,
2-хлор-1,1,2-трифторэтоксигруппу,
2-бром-1,1,2-трифторэтоксигруппу,
1,1,2,2,2-пентафторэтоксигруппу,
2,2-дихлор-1,1,2-трифторэтоксигруппу,
2,2,2-трихлор-1,1-дифторэтоксигруппу,
2-бром-1,1,2,2-тетрафторэтоксигруппу,
2,2,3,3-тетрафторпропоксигруппу,
1,1,2,3,3,3-гексафторпропоксигруппу,
2,2,2-трифтор-1-(трифторметил)этоксигруппу,
1,1,2,2,3,3,3-гептафторпропоксигруппу и
2-бром-1,1,2,3,3,3-гексафторпропоксигруппу.
(C1-C6алкокси)C1-C6алкоксигруппа, представленная R4, включает, например, 2-метоксиэтоксигруппу, 2-этоксиэтоксигруппу, 2-пропоксиэтоксигруппу, 2-изопропоксиэтоксигруппу и 2-трет-бутоксиэтоксигруппу.
C3-C6алкенилоксигруппа, незамещенная или замещенная одним или несколькими атомами галогена, представленная R4, включает, например, 2-пропенилоксигруппу.
Фенил(C2-C6)алкенильная группа, представленная R4, включает, например, 2-фенилвинильную группу.
(C1-C6алкиламино)C1-C6алкильная группа, представленная R4, включает, например, (метиламино)метильную группу, (этиламино)метильную группу, (метиламино)этильную группу и (этиламино)этильную группу.
(Ди(C1-C6алкил)амино)C1-C6алкильная группа, представленная R4, включает, например, (диметиламино)метильную группу, (диэтиламино)метильную группу, (диметиламино)этильную группу и (диэтиламино)этильную группу.
Группа для R4, представленного формулой:
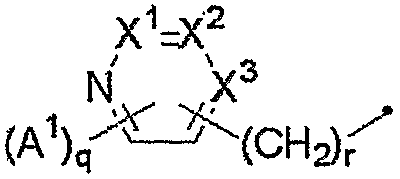
где A1, q, r, X1, X2 и X3 являются такими, как определено выше, включает, например, 2-пиридильную группу, 3-метил-2-пиридильную группу, 4-метил-2-пиридильную группу, 5-метил-2-пиридильную группу, 6-метил-2-пиридильную группу, 3-фтор-2-пиридильную группу, 4-фтор-2-пиридильную группу, 5-фтор-2-пиридильную группу, 6-фтор-2-пиридильную группу, 3-хлор-2-пиридильную группу, 4-хлор-2-пиридильную группу, 5-хлор-2-пиридильную группу, 6-хлор-2-пиридильную группу, 3-бром-2-пиридильную группу, 4-бром-2-пиридильную группу, 5-бром-2-пиридильную группу, 6-бром-2-пиридильную группу, 3-пиридильную группу, 2-метил-3-пиридильную группу, 4-метил-3-пиридильную группу, 5-метил-3-пиридильную группу, 6-метил-3-пиридильную группу, 2-фтор-3-пиридильную группу, 4-фтор-3-пиридильную группу, 5-фтор-3-пиридильную группу, 6-фтор-3-пиридильную группу, 2-хлор-3-пиридильную группу, 4-хлор-3-пиридильную группу, 5-хлор-3-пиридильную группу, 6-хлор-3-пиридильную группу, 2-метилтио-3-пиридильную группу, 4-метилтио-3-пиридильную группу, 5-метилтио-3-пиридильную группу, 6-метилтио-3-пиридильную группу, 2-трифторметил-3-пиридильную группу, 4-трифторметил-3-пиридильную группу, 5-трифторметил-3-пиридильную группу, 6-трифторметил-3-пиридильную группу, 5,6-дихлор-3-пиридильную группу, 2,6-дихлор-3-пиридильную группу, 6-циано-3-пиридильную группу, 4-пиридильную группу, 2-фтор-4-пиридильную группу, 3-фтор-4-пиридильную группу, 2-хлор-4-пиридильную группу, 3-хлор-4-пиридильную группу, 2,6-дихлор-4-пиридильную группу, 3,5-дихлор-4-пиридильную группу, 2-пиридилметильную группу, 3-пиридилметильную группу и 4-пиридилметильную группу.
Группа для R4, представленного формулой:

где A2, t, u и X4 являются такими, как определено выше, включает, например, 2-фурильную группу, 2-метил-2-фурильную группу, 5-бром-2-фурильную группу, 5-нитро-2-фурильную группу, 3,4-дибром-2-фурильную группу, 3-фурильную группу, 2-метил-3-фурильную группу и 2,5-диметил-3-фурильную группу.
Группа для R4, представленного формулой:

где L1 и L2 являются такими, как определено выше, включает, например, метиламиногруппу, этиламиногруппу, пропиламиногруппу,
изопропиламиногруппу, бутиламиногруппу, изобутиламиногруппу,
трет-бутиламиногруппу, диметиламиногруппу,
этил(метил)аминогруппу, диэтиламиногруппу,
пропил(метил)аминогруппу, изопропил(метил)аминогруппу,
дипропиламиногруппу, бутил(метил)аминогруппу,
изобутил(метил)аминогруппу, трет-бутил(метил)аминогруппу,
пирролидин-1-ильную группу, 2-метилпирролидин-1-ильную группу,
2-этилпирролидин-1-ильную группу,
2-пропилпирролидин-1-ильную группу,
2-изопропилпирролидин-1-ильную группу,
2-трет-бутилпирролидин-1-ильную группу,
3-метилпирролидин-1-ильную группу,
3-этилпирролидин-1-ильную группу,
2,5-диметилпирролидин-1-ильную группу,
3,4-диметилпирролидин-1-ильную группу,
3,3-диметилпирролидин-1-ильную группу, пиперидиногруппу,
2-метилпиперидиногруппу, 2-этилпиперидиногруппу,
2-пропилпиперидиногруппу, 2-изопропилпиперидиногруппу,
2-трет-бутилпиперидиногруппу, 2-втор-бутилпиперидиногруппу,
3-метилпиперидиногруппу, 3-этилпиперидиногруппу,
3-пропилпиперидиногруппу, 3-изопропилпиперидиногруппу,
3-трет-бутилпиперидиногруппу, 3-втор-бутилпиперидиногруппу,
4-метилпиперидиногруппу, 4-этилпиперидиногруппу,
4-пропилпиперидиногруппу, 4-изопропилпиперидиногруппу,
4-трет-бутилпиперидиногруппу, 4-(трифторметил)пиперидиногруппу,
2,6-диметилпиперидиногруппу, 2,4-диметилпиперидиногруппу,
2,5-диметилпиперидиногруппу, 3,5-диметилпиперидиногруппу,
2,2-диметилпиперидиногруппу, 3,3-диметилпиперидиногруппу,
4,4-диметилпиперидиногруппу, 3-этил-6-метилпиперидиногруппу,
3-этил-5-метилпиперидиногруппу, 3,5-диэтилпиперидиногруппу,
2,3-диметилпиперидиногруппу, 3,3,5-триметилпиперидиногруппу,
2,3,5,6-тетраметилпиперидиногруппу,
3,3,5,5-тетраметилпиперидиногруппу, гексаметилениминогруппу,
2-метилгексаметилениминогруппу, 2-этилгексаметилениминогруппу,
3-метилгексаметилениминогруппу, 3-этилгексаметилениминогруппу,
4-метилгексаметилениминогруппу, 4-этилгексаметилениминогруппу,
гептаметилениминогруппу и морфолиногруппу.
В качестве фенильной группы, представленной R4, которая может быть замещена 1-5 группами, независимо выбранными из группы, состоящей из C1-C6алкильных групп, незамещенных или замещенных одним или несколькими атомами галогена, C1-C6алкоксигрупп, незамещенных или замещенных одним или несколькими атомами галогена, атомов галогена, нитрогруппы, цианогруппы, C1-C6алкилсульфенильных групп, C1-C6алкилсульфинильных групп, C1-C6алкилсульфонильных групп, C2-C6алкоксикарбонильных групп и бензоильной группы, можно привести, например, фенильную группу,
2-метилфенильную группу, 3-метилфенильную группу,
4-метилфенильную группу, 2-(трифторметил)фенильную группу,
3-(трифторметил)фенильную группу,
4-(трифторметил)фенильную группу, 2-фторфенильную группу,
3-фторфенильную группу, 4-фторфенильную группу,
2-хлорфенильную группу, 3-хлорфенильную группу,
4-хлорфенильную группу, 2-бромфенильную группу,
3-бромфенильную группу, 4-бромфенильную группу,
2-йодоенильную группу, 3-йодоенильную группу,
4-йодоенильную группу, 2-цианофенильную группу,
3-цианофенильную группу, 4-цианофенильную группу,
2-нитрофенильную группу, 3-нитрофенильную группу,
4-нитрофенильную группу, 2-метоксифенильную группу,
3-метоксифенильную группу, 4-метоксифенильную группу,
2-(трифторметокси)фенильную группу,
3-(трифторметокси)фенильную группу,
4-(трифторметокси)фенильную группу, 2,3-дихлорфенильную группу,
2,4-дихлорфенильную группу, 2,5-дихлорфенильную группу,
2,6-дихлорфенильную группу, 3,4-дихлорфенильную группу,
3,5-дихлорфенильную группу, 2,3,4-трихлорфенильную группу,
2,3,5-трихлорфенильную группу, 3,4,5-трихлорфенильную группу,
2,4,6-трихлорфенильную группу, 2,3-дифторфенильную группу,
2,4-дифторфенильную группу, 2,5-дифторфенильную группу,
2,6-дифторфенильную группу, 3,4-дифторфенильную группу,
3,5-дифторфенильную группу, 3,4,5-трифторфенильную группу,
2,3,5,6-тетрафторфенильную группу,
2,3,4,5,6-пентафторфенильную группу,
3,5-бис(трифторметил)фенильную группу,
2,3-диметоксифенильную группу, 2,4-диметоксифенильную группу,
2,5-диметоксифенильную группу, 2,6-диметоксифенильную группу,
3,4-диметоксифенильную группу, 3,5-диметоксифенильную группу,
2-метансульфонилфенильную группу,
3-метансульфонилфенильную группу,
4-метансульфонилфенильную группу,
4-метоксикарбонилфенильную группу,
4-этоксикарбонилфенильную группу и 4-бензоилфенильную группу.
В качестве фенил(C1-C4)алкильной группы, представленной R4, которая может быть замещена 1-5 группами, независимо выбранными из группы, состоящей из C1-C6алкильных групп, незамещенных или замещенных одним или несколькими атомами галогена, C1-C6алкоксигрупп, незамещенных или замещенных одним или несколькими атомами галогена, атомов галогена, нитрогруппы, цианогруппы, C1-C6алкилсульфенильных групп, C1-C6алкилсульфинильных групп, C1-C6алкилсульфонильных групп, C2-C6алкоксикарбонильных групп и бензоильной группы, можно привести, например,
фенилметильную группу, (2-метилфенил)метильную группу,
(3-метилфенил)метильную группу, (4-метилфенил)метильную группу,
{2-(трифторметил)фенил}метильную группу,
{3-(трифторметил)фенил}метильную группу,
{4-(трифторметил)фенил}метильную группу,
(2-фторфенил)метильную группу, (3-фторфенил)метильную группу,
(4-фторфенил)метильную группу, (2-хлорфенил)метильную группу,
(3-хлорфенил)метильную группу, (4-хлорфенил)метильную группу,
(2-бромфенил)метильную группу, (3-бромфенил)метильную группу,
(4-бромфенил)метильную группу, (2-йодофенил)метильную группу,
(3-йодофенил)метильную группу, (4-йодофенил)метильную группу,
(2-цианофенил)метильную группу, (3-цианофенил)метильную группу,
(4-цианофенил)метильную группу, (2-нитрофенил)метильную группу,
(3-нитрофенил)метильную группу, (4-нитрофенил)метильную группу,
(2-метоксифенил)метильную группу,
(3-метоксифенил)метильную группу,
(4-метоксифенил)метильную группу,
(2-трифторметоксифенил)метильную группу,
(3-трифторметоксифенил)метильную группу,
(4-трифторметоксифенил)метильную группу,
(2,3-дихлорфенил)метильную группу,
(2,4-дихлорфенил)метильную группу,
(2,5-дихлорфенил)метильную группу,
(2,6-дихлорфенил)метильную группу,
(3,4-дихлорфенил)метильную группу,
(3,5-дихлорфенил)метильную группу,
(2,3-дифторфенил)метильную группу,
(2,4-дифторфенил)метильную группу,
(2,5-дифторфенил)метильную группу,
(2,6-дифторфенил)метильную группу,
(3,4-дифторфенил)метильную группу,
(3,5-дифторфенил)метильную группу,
(2,3,4-трифторфенил)метильную группу,
(3,4,5-трифторфенил)метильную группу,
(2,4,6-трифторфенил)метильную группу,
(2,3,5,6-тетрафторфенил)метильную группу,
(2,3,4,5,6-пентафторфенил)метильную группу,
{3,5-бис(трифторметил)фенил}метильную группу,
(2,3-диметоксифенил)метильную группу,
(2,4-диметоксифенил)метильную группу,
(2,5-диметоксифенил)метильную группу,
(2,6-диметоксифенил)метильную группу,
(3,4-диметоксифенил)метильную группу,
(3,5-диметоксифенил)метильную группу, 1-фенилэтильную группу,
1-(2-метилфенил)этильную группу,
1-(3-метилфенил)этильную группу,
1-(4-метилфенил)этильную группу,
1-{2-(трифторметил)фенил}этильную группу,
1-{3-(трифторметил)фенил}этильную группу,
1-{4-(трифторметил)фенил}этильную группу,
1-(2-фторфенил)этильную группу, 1-(3-фторфенил)этильную группу,
1-(4-фторфенил)этильную группу, 1-(2-хлорфенил)этильную группу,
1-(3-хлорфенил)этильную группу, 1-(4-хлорфенил)этильную группу,
1-(2-бромфенил)этильную группу, 1-(3-бромфенил)этильную группу,
1-(4-бромфенил)этильную группу, 1-(2-йодофенил)этильную группу,
1-(3-йодофенил)этильную группу, 1-(4-йодофенил)этильную группу,
1-(2-цианофенил)этильную группу,
1-(3-цианофенил)этильную группу,
1-(4-цианофенил)этильную группу,
1-(2-нитрофенил)этильную группу,
1-(3-нитрофенил)этильную группу,
1-(4-нитрофенил)этильную группу,
1-(2-метоксифенил)этильную группу,
1-(3-метоксифенил)этильную группу,
1-(4-метоксифенил)этильную группу,
1-(2-трифторметоксифенил)этильную группу,
1-(3-трифторметоксифенил)этильную группу,
1-(4-трифторметоксифенил)этильную группу,
1-(2,3-дихлорфенил)этильную группу,
1-(2,4-дихлорфенил)этильную группу,
1-(2,5-дихлорфенил)этильную группу,
1-(2,6-дихлорфенил)этильную группу,
1-(3,4-дихлорфенил)этильную группу,
1-(3,5-дихлорфенил)этильную группу,
1-(2,3,4-трихлорфенил)этильную группу,
1-(3,4,5-трихлорфенил)этильную группу,
1-(2,4,6-трихлорфенил)этильную группу,
1-(2,3-дифторфенил)этильную группу,
1-(2,4-дифторфенил)этильную группу,
1-(2,5-дифторфенил)этильную группу,
1-(2,6-дифторфенил)этильную группу,
1-(3,4-дифторфенил)этильную группу,
1-(3,5-дифторфенил)этильную группу,
1-(2,3,4-трифторфенил)этильную группу,
1-(3,4,5-трифторфенил)этильную группу,
1-(2,4,6-трифторфенил)этильную группу,
1-(2,3,5,6-тетрафторфенил)этильную группу,
1-(2,3,4,5,6-пентафторфенил)этильную группу,
1-{3,5-бис(трифторметил)фенил}этильную группу,
1-(2,3-диметоксифенил)этильную группу,
1-(2,4-диметоксифенил)этильную группу,
1-(2,5-диметоксифенил)этильную группу,
1-(2,6-диметоксифенил)этильную группу,
1-(3,4-диметоксифенил)этильную группу,
1-(3,5-диметоксифенил)этильную группу, 2-фенилэтильную группу,
2-(2-метилфенил)этильную группу,
2-(3-метилфенил)этильную группу,
2-(4-метилфенил)этильную группу,
2-{2-(трифторметил)фенил}этильную группу,
2-{3-(трифторметил)фенил}этильную группу,
2-{4-(трифторметил)фенил}этильную группу,
2-(2-фторфенил)этильную группу, 2-(3-фторфенил)этильную группу,
2-(4-фторфенил)этильную группу, 2-(2-хлорфенил)этильную группу,
2-(3-хлорфенил)этильную группу, 2-(4-хлорфенил)этильную группу,
2-(2-бромфенил)этильную группу, 2-(3-бромфенил)этильную группу,
2-(4-бромфенил)этильную группу, 2-(2-йодофенил)этильную группу,
2-(3-йодофенил)этильную группу, 2-(4-йодофенил)этильную группу,
2-(2-цианофенил)этильную группу, 2-(3-цианофенил)этильную
группу, 2-(4-цианофенил)этильную группу,
2-(2-нитрофенил)этильную группу,
2-(3-нитрофенил)этильную группу,
2-(4-нитрофенил)этильную группу,
2-(2-метоксифенил)этильную группу,
2-(3-метоксифенил)этильную группу,
2-(4-метоксифенил)этильную группу,
2-(2-трифторметоксифенил)этильную группу,
2-(3-трифторметоксифенил)этильную группу,
2-(4-трифторметоксифенил)этильную группу,
2-(2,3-дихлорфенил)этильную группу,
2-(2,4-дихлорфенил)этильную группу,
2-(2,5-дихлорфенил)этильную группу,
2-(2,6-дихлорфенил)этильную группу,
2-(3,4-дихлорфенил)этильную группу,
2-(3,5-дихлорфенил)этильную группу,
2-(2,3,4-трихлорфенил)этильную группу,
2-(3,4,5-трихлорфенил)этильную группу,
2-(2,4,6-трихлорфенил)этильную группу,
2-(2,3-дифторфенил)этильную группу,
2-(2,4-дифторфенил)этильную группу,
2-(2,5-дифторфенил)этильную группу,
2-(2,6-дифторфенил)этильную группу,
2-(3,4-дифторфенил)этильную группу,
2-(3,5-дифторфенил)этильную группу,
2-(2,3,4-трифторфенил)этильную группу,
2-(3,4,5-трифторфенил)этильную группу,
2-(2,4,6-трифторфенил)этильную группу,
2-(2,3,5,6-тетрафторфенил)этильную группу,
2-(2,3,4,5,6-пентафторфенил)этильную группу,
2-{3,5-бис(трифторметил)фенил}этильную группу,
2-(2,3-диметоксифенил)этильную группу,
2-(2,4-диметоксифенил)этильную группу,
2-(2,5-диметоксифенил)этильную группу,
2-(2,6-диметоксифенил)этильную группу,
2-(3,4-диметоксифенил)этильную группу и
2-(3,5-диметоксифенил)этильную группу.
В качестве фенокси(C1-C4)алкильной группы, представленной R4, которая может быть замещена 1-5 группами, независимо выбранными из группы, состоящей из C1-C6алкильных групп, незамещенных или замещенных одним или несколькими атомами галогена, C1-C6алкоксигрупп, незамещенных или замещенных одним или несколькими атомами галогена, атомов галогена, нитрогруппы, цианогруппы, C1-C6алкилсульфенильных групп, C1-C6алкилсульфинильных групп, C1-C6алкилсульфонильных групп, C2-C6алкоксикарбонильных групп и бензоильной группы, можно привести, например,
феноксиметильную группу, (2-фторфенокси)метильную группу,
(3-фторфенокси)метильную группу,
(4-фторфенокси)метильную группу,
(2-хлорфенокси)метильную группу,
(3-хлорфенокси)метильную группу,
(4-хлорфенокси)метильную группу,
(2-бромфенокси)метильную группу,
(3-бромфенокси)метильную группу,
(4-бромфенокси)метильную группу,
(2-метоксифенокси)метильную группу,
(3-метоксифенокси)метильную группу,
(4-метоксифенокси)метильную группу,
(2,3-дифторфенокси)метильную группу,
(2,4-дифторфенокси)метильную группу,
(2,5-дифторфенокси)метильную группу,
(2,6-дифторфенокси)метильную группу,
(3,4-дифторфенокси)метильную группу,
(3,5-дифторфенокси)метильную группу,
(2,3-дихлорфенокси)метильную группу,
(2,4-дихлорфенокси)метильную группу,
(2,5-дихлорфенокси)метильную группу,
(2,6-дихлорфенокси)метильную группу,
(3,4-дихлорфенокси)метильную группу,
(3,5-дихлорфенокси)метильную группу, 1-феноксиэтильную группу,
1-(2-фторфенокси)этильную группу,
1-(3-фторфенокси)этильную группу,
1-(4-фторфенокси)этильную группу,
1-(2-хлорфенокси)этильную группу,
1-(3-хлорфенокси)этильную группу,
1-(4-хлорфенокси)этильную группу,
1-(2-бромфенокси)этильную группу,
1-(3-бромфенокси)этильную группу,
1-(4-бромфенокси)этильную группу,
1-(2-метоксифенокси)этильную группу,
1-(3-метоксифенокси)этильную группу,
1-(4-метоксифенокси)этильную группу,
1-(2,3-дифторфенокси)этильную группу,
1-(2,4-дифторфенокси)этильную группу,
1-(2,5-дифторфенокси)этильную группу,
1-(2,6-дифторфенокси)этильную группу,
1-(3,4-дифторфенокси)этильную группу,
1-(3,5-дифторфенокси)этильную группу,
1-(2,3-дихлорфенокси)этильную группу,
1-(2,4-дихлорфенокси)этильную группу,
1-(2,5-дихлорфенокси)этильную группу,
1-(2,6-дихлорфенокси)этильную группу,
1-(3,4-дихлорфенокси)этильную группу,
1-(3,5-дихлорфенокси)этильную группу,
2-феноксиэтильную группу, 2-(2-фторфенокси)этильную группу,
2-(3-фторфенокси)этильную группу,
2-(4-фторфенокси)этильную группу,
2-(2-хлорфенокси)этильную группу,
2-(3-хлорфенокси)этильную группу,
2-(4-хлорфенокси)этильную группу,
2-(2-бромфенокси)этильную группу,
2-(3-бромфенокси)этильную группу,
2-(4-бромфенокси)этильную группу,
2-(2-метоксифенокси)этильную группу,
2-(3-метоксифенокси)этильную группу,
2-(4-метоксифенокси)этильную группу,
2-(2,3-дифторфенокси)этильную группу,
2-(2,4-дифторфенокси)этильную группу,
2-(2,5-дифторфенокси)этильную группу,
2-(2,6-дифторфенокси)этильную группу,
2-(3,4-дифторфенокси)этильную группу,
2-(3,5-дифторфенокси)этильную группу,
2-(2,3-дихлорфенокси)этильную группу,
2-(2,4-дихлорфенокси)этильную группу,
2-(2,5-дихлорфенокси)этильную группу,
2-(2,6-дихлорфенокси)этильную группу,
2-(3,4-дихлорфенокси)этильную группу и
2-(3,5-дихлорфенокси)этильную группу.
В качестве фенил(C1-C2)алкиламиногруппы, представленной R4, которая может быть замещена 1-5 группами, независимо выбранными из группы, состоящей из C1-C6алкильных групп, незамещенных или замещенных одним или несколькими атомами галогена, C1-C6алкоксигрупп, незамещенных или замещенных одним или несколькими атомами галогена, атомов галогена, нитрогруппы, цианогруппы, C1-C6алкилсульфенильных групп, C1-C6алкилсульфинильных групп, C1-C6алкилсульфонильных групп, C2-C6алкоксикарбонильных групп и бензоильной группы, можно привести, например, бензиламиногруппу,
2-метилбензиламиногруппу, 3-метилбензиламиногруппу,
4-метилбензиламиногруппу,
{2-(трифторметил)фенил}метиламиногруппу,
{3-(трифторметил)фенил}метиламиногруппу,
{4-(трифторметил)фенил}метиламиногруппу,
2-фторбензиламиногруппу, 3-фторбензиламиногруппу,
4-фторбензиламиногруппу, 2-хлорбензиламиногруппу,
3-хлорбензиламиногруппу, 4-хлорбензиламиногруппу,
2-бромбензиламиногруппу, 3-бромбензиламиногруппу,
4-бромбензиламиногруппу, (2,3-дифторфенил)метиламиногруппу,
(2,4-дифторфенил)метиламиногруппу,
(2,5-дифторфенил)метиламиногруппу,
(2,6-дифторфенил)метиламиногруппу,
(3,4-дифторфенил)метиламиногруппу,
(3,5-дифторфенил)метиламиногруппу,
(2,3-дихлорфенил)метиламиногруппу,
(2,4-дихлорфенил)метиламиногруппу,
(2,5-дихлорфенил)метиламиногруппу,
(2,6-дихлорфенил)метиламиногруппу,
(3,4-дихлорфенил)метиламиногруппу,
(3,5-дихлорфенил)метиламиногруппу,
(2,3-диметоксифенил)метиламиногруппу,
(2,4-диметоксифенил)метиламиногруппу,
(2,5-диметоксифенил)метиламиногруппу,
(2,6-диметоксифенил)метиламиногруппу,
(3,4-диметоксифенил)метиламиногруппу,
(3,5-диметоксифенил)метиламиногруппу, 1-фенилэтиламиногруппу и
2-фенилэтиламиногруппу.
C1-C12алкильная группа, представленная R5, включает, например, метильную группу, этильную группу, пропильную группу, изопропильную группу, бутильную группу, изобутильную группу, втор-бутильную группу, трет-бутильную группу, пентильную группу, 1-метилбутильную группу, 2-метилбутильную группу, 3-метилбутильную группу, 1-этилпропильную группу, 1,1-диметилпропильную группу, 1,2-диметилпропильную группу, 2,2-диметилпропильную группу, гексильную группу, 1-метилпентильную группу, 2-метилпентильную группу, 1,1-диметилбутильную группу, 1,3-диметилбутильную группу, гептильную группу, октильную группу, нонильную группу, децильную группу, ундецильную группу и додецильную группу.
C3-C12циклоалкильная группа, представленная R5, включает, например, циклопропильную группу, 1-метилциклопропильную группу, 2-метилциклопропильную группу, 2,2-диметилциклопропильную группу, 2,2,3,3-тетраметилциклопропильную группу, циклобутильную группу, циклопентильную группу, 1-метилциклопентильную группу, 2-метилциклопентильную группу, 3-метилциклопентильную группу, циклогексильную группу, 1-метилциклогексильную группу, 2-метилциклогексильную группу, 3-метилциклогексильную группу, 4-метилциклогексильную группу, циклогептильную группу и циклооктильную группу.
(C3-C6циклоалкил)C1-C6алкильная группа, представленная R5, включает, например, циклопропилметильную группу, (1-метилциклопропил)метильную группу, циклобутилметильную группу, циклопентилметильную группу, циклогексилметильную группу и циклогептилметильную группу.
C2-C6алкоксиалкильная группа, представленная R5, включает, например, метоксиметильную группу, 1-метоксиэтильную группу, 2-метоксиэтильную группу, 1-этоксиэтильную группу, 2-этоксиэтильную группу, 1-пропоксиэтильную группу, 2-пропоксиэтильную группу, изопропоксиметильную группу, 1-бутоксиэтильную группу, 2-бутоксиэтильную группу, 1-изобутоксиэтильную группу, 2-изобутоксиэтильную группу, 1-(втор-бутокси)этильную группу, 2-(втор-бутокси)этильную группу, 1-метоксипропильную группу, 2-метоксипропильную группу и 3-метоксипропильную группу.
C3-C12алкенильная группа, представленная R5, включает, например, 1-пропенильную группу, 2-пропенильную группу, 1-метилэтенильную группу, 2-бутенильную группу, 1-метил-2-пропенильную группу, 2-метил-2-пропенильную группу, 2-пентенильную группу, 2-метил-2-бутенильную группу, 3-метил-2-бутенильную группу, 2-этил-2-пропенильную группу, 1,1-диметил-2-пропенильную группу, 2-гексенильную группу, 2-метил-2-пентенильную группу, 2,4-диметил-2,6-гептадиенильную группу и 3,7-диметил-2,6-октадиенильную группу.
C3-C12алкинильная группа, представленная R5, включает, например, 1-пропинильную группу, 2-пропинильную группу, 2-бутинильную группу, 1-метил-2-пропинильную группу, 2-пентинильную группу, 1-метил-2-бутинильную группу, 1,1-диметил-2-пропинильную группу и 2-гексинильную группу.
C1-C6ацильная группа, представленная R5, включает, например, формильную группу, ацетильную группу, пропионильную группу, изобутироильную группу и триметилацетильную группу.
C2-C8цианоалкильная группа, представленная R5, включает, например, цианометильную группу и 2-цианоэтильную группу.
C2-C6алкоксикарбонильная группа, представленная R5, включает, например, метоксикарбонильную группу и этоксикарбонильную группу.
C3-C8алкоксикарбонилалкильная группа, представленная R5, включает, например, 1-(метоксикарбонил)этильную группу, 1-(этоксикарбонил)этильную группу, 2-(метоксикарбонил)этильную группу и 2-(этоксикарбонил)этильную группу.
В качестве фенил(C1-C4)алкильной группы, представленной R5, которая может быть замещена 1-5 группами, независимо выбранными из группы, состоящей из C1-C6алкильных групп, незамещенных или замещенных одним или несколькими атомами галогена, C1-C6алкоксигрупп, незамещенных или замещенных одним или несколькими атомами галогена, атомов галогена, нитрогруппы и цианогруппы, можно привести, например, бензильную группу, 1-фенилэтильную группу и 2-фенилэтильную группу.
В качестве бензоильной группы, представленной R5, которая может быть замещена 1-5 группами, независимо выбранными из группы, состоящей из C1-C6алкильных групп, незамещенных или замещенных одним или несколькими атомами галогена, C1-C6алкоксигрупп, незамещенных или замещенных одним или несколькими атомами галогена, атомов галогена, нитрогруппы и цианогруппы, можно привести, например, бензоильную группу, 2-фторбензоильную группу, 3-фторбензоильную группу, 4-фторбензоильную группу, 2-хлорбензоильную группу, 3-хлорбензоильную группу, 4-хлорбензоильную группу, 2-метоксибензоильную группу, 3-метоксибензоильную группу, 4-метоксибензоильную группу, 2-цианобензоильную группу, 3-цианобензоильную группу, 4-цианобензоильную группу, 2-нитробензоильную группу, 3-нитробензоильную группу и 4-нитробензоильную группу.
В качестве соединения настоящего изобретения можно привести, например, следующие изоксазолиновые соединения:

изоксазолиновые соединения формулы (1), где R1 представляет собой трифторметильную группу;
изоксазолиновые соединения формулы (1), где m равно 2 и каждый из R2 представляет собой атом галогена;
изоксазолиновые соединения формулы (1), где m равно 2 и каждый из R2 представляет собой атом хлора;
изоксазолиновые соединения формулы (1), где m равно 2 и R2 в качестве заместителей в положении 3 и в положении 5 соответственно представляют собой атомы хлора;
изоксазолиновые соединения формулы (1), где n равно 0 или 1;
изоксазолиновые соединения формулы (1), где n равно 0;
изоксазолиновые соединения формулы (1), где n равно 1;
изоксазолиновые соединения формулы (1), где n равно 1 и R3 в качестве заместителя в положении 6 представляет собой C1-C6алкильную группу;
изоксазолиновые соединения формулы (1), где n равно 1 и R3 в качестве заместителя в положении 6 представляет собой метильную группу;
изоксазолиновые соединения формулы (1), где R4 представляет собой атом водорода;
изоксазолиновые соединения формулы (1), где R4 представляет собой C1-C12алкильную группу, незамещенную или замещенную одним или несколькими атомами галогена;
изоксазолиновые соединения формулы (1), где R4 представляет собой C2-C12алкенильную группу, незамещенную или замещенную одним или несколькими атомами галогена;
изоксазолиновые соединения формулы (1), где R4 представляет собой C1-C6алкоксигруппу, незамещенную или замещенную одним или несколькими атомами галогена;
изоксазолиновые соединения формулы (1), где R4 представляет собой фенильную группу, которая может быть замещена 1-5 группами, независимо выбранными из группы, состоящей из C1-C6алкильных групп, незамещенных или замещенных одним или несколькими атомами галогена, C1-C6алкоксигрупп, незамещенных или замещенных одним или несколькими атомами галогена, атомов галогена, нитрогруппы, цианогруппы, C1-C6алкилсульфенильных групп, C1-C6алкилсульфинильных групп, C1-C6алкилсульфонильных групп, C2-C6алкоксикарбонильных групп и бензоильной группы (здесь и далее группу, состоящую из C1-C6алкильных групп, незамещенных или замещенных одним или несколькими атомами галогена, C1-C6алкоксигрупп, незамещенных или замещенных одним или несколькими атомами галогена, атомов галогена, нитрогруппы, цианогруппы, C1-C6алкилсульфенильных групп, C1-C6алкилсульфинильных групп, C1-C6алкилсульфонильных групп, C2-C6алкоксикарбонильных групп и бензоильной группы, в некоторых случаях обозначают как группа X);
изоксазолиновые соединения формулы (1), где R1 представляет собой трифторметильную группу, R4 представляет собой атом водорода, C1-C12алкильную группу, незамещенную или замещенную одним или несколькими атомами галогена, (C2-C5алкоксикарбонил)C1-C12алкильную группу, C2-C12цианоалкильную группу, C3-C12циклоалкильную группу, незамещенную или замещенную одним или несколькими атомами галогена, (C3-C6циклоалкил)C1-C6алкильную группу, (C1-C6алкокси)C2-C6алкильную группу, C2-C12алкенильную группу, незамещенную или замещенную одним или несколькими атомами галогена, C2-C12алкинильную группу, незамещенную или замещенную одним или несколькими атомами галогена, C1-C6алкоксигруппу, незамещенную или замещенную одним или несколькими атомами галогена, (C1-C6алкокси)C1-C6алкоксигруппу, C3-C6алкенилоксигруппу, незамещенную или замещенную одним или несколькими атомами галогена, бензилоксигруппу, фенил(C2-C6)алкенильную группу, (C1-C6алкиламино)C1-C6алкильную группу или (ди(C1-C6алкил)амино)C1-C6алкильную группу и R5 представляет собой атом водорода;
изоксазолиновые соединения формулы (1), где R1 представляет собой трифторметильную группу, R4 представляет собой фенильную группу, которая может быть замещена 1-5 группами, независимо выбранными из указанной выше группы X, и R5 представляет собой атом водорода;
изоксазолиновые соединения формулы (1), где R1 представляет собой трифторметильную группу, R4 представляет собой атом водорода, C1-C12алкильную группу, незамещенную или замещенную одним или несколькими атомами галогена, C2-C12алкенильную группу, незамещенную или замещенную одним или несколькими атомами галогена, или C1-C6алкоксигруппу, незамещенную или замещенную одним или несколькими атомами галогена, и R5 представляет собой атом водорода;
изоксазолиновые соединения формулы (1), где R1 представляет собой трифторметильную группу, m равно 2, R2 в качестве заместителей соответственно в положении 3 и в положении 5 представляют собой атомы хлора, R4 представляет собой атом водорода, C1-C12алкильную группу, незамещенную или замещенную одним или несколькими атомами галогена, (C2-C5алкоксикарбонил)C1-C12алкильную группу, C2-C12цианоалкильную группу, C3-C12циклоалкильную группу, незамещенную или замещенную одним или несколькими атомами галогена, (C3-C6циклоалкил)C1-C6алкильную группу, (C1-C6алкокси)C2-C6алкильную группу, C2-C12алкенильную группу, незамещенную или замещенную одним или несколькими атомами галогена, C2-C12алкинильную группу, незамещенную или замещенную одним или несколькими атомами галогена, C1-C6алкоксигруппу, незамещенную или замещенную одним или несколькими атомами галогена, (C1-C6алкокси)C1-C6алкоксигруппу, C3-C6алкенилоксигруппу, незамещенную или замещенную одним или несколькими атомами галогена, бензилоксигруппу, фенил(C2-C6)алкенильную группу, (C1-C6алкиламино)C1-C6алкильную группу или (ди(C1-C6алкил)амино)C1-C6алкильную группу и R5 представляет собой атом водорода;
изоксазолиновые соединения формулы (1), где R1 представляет собой трифторметильную группу, m равно 2, R2 в качестве заместителей соответственно в положении 3 и в положении 5 представляют собой атомы хлора, R4 представляет собой фенильную группу, которая может быть замещена 1-5 группами, независимо выбранными из указанной выше группы X, и R5 представляет собой атом водорода;
изоксазолиновые соединения формулы (1), где R1 представляет собой трифторметильную группу, m равно 2, R2 в качестве заместителей соответственно в положении 3 и в положении 5 представляют собой атомы хлора, R4 представляет собой атом водорода, C1-C12алкильную группу, незамещенную или замещенную одним или несколькими атомами галогена, C2-C12алкенильную группу, незамещенную или замещенную одним или несколькими атомами галогена, или C1-C6алкоксигруппу, незамещенную или замещенную одним или несколькими атомами галогена, и R5 представляет собой атом водорода;
изоксазолиновые соединения формулы (1), где R1 представляет собой трифторметильную группу, n равно 0 или 1, R4 представляет собой атом водорода, C1-C12алкильную группу, незамещенную или замещенную одним или несколькими атомами галогена, (C2-C5алкоксикарбонил)C1-C12алкильную группу, C2-C12цианоалкильную группу, C3-C12циклоалкильную группу, незамещенную или замещенную одним или несколькими атомами галогена, (C3-C6циклоалкил)C1-C6алкильную группу, (C1-C6алкокси)C2-C6алкильную группу, C2-C12алкенильную группу, незамещенную или замещенную одним или несколькими атомами галогена, C2-C12алкинильную группу, незамещенную или замещенную одним или несколькими атомами галогена, C1-C6алкоксигруппу, незамещенную или замещенную одним или несколькими атомами галогена, (C1-C6алкокси)C1-C6алкоксигруппу, C3-C6алкенилоксигруппу, незамещенную или замещенную одним или несколькими атомами галогена, бензилоксигруппу, фенил(C2-C6)алкенильную группу, (C1-C6алкиламино)C1-C6алкильную группу или (ди(C1-C6алкил)амино)C1-C6алкильную группу и R5 представляет собой атом водорода;
изоксазолиновые соединения формулы (1), где R1 представляет собой трифторметильную группу, n равно 0 или 1, R4 представляет собой фенильную группу, которая может быть замещена 1-5 группами, независимо выбранными из указанной выше группы X, и R5 представляет собой атом водорода; и
изоксазолиновые соединения формулы (1), где R1 представляет собой трифторметильную группу, m равно 2, R2 в качестве заместителей соответственно в положении 3 и в положении 5 представляют собой атомы хлора, n равно 0, R4 представляет собой фенильную группу, незамещенную или замещенную 1-5 группами, независимо выбранными из указанной выше группы X, и R5 представляет собой атом водорода;
изоксазолиновые соединения формулы (1), где R1 представляет собой трифторметильную группу, m равно 2, R2 в качестве заместителей соответственно в положении 3 и в положении 5 представляют собой атомы хлора, n равно 1, R3 в качестве заместителя в положении 6 представляет собой C1-C6алкильную группу, R4 представляет собой фенильную группу, незамещенную или замещенную 1-5 группами, независимо выбранными из указанной выше группы X, и R5 представляет собой атом водорода;
изоксазолиновые соединения формулы (1), где R1 представляет собой трифторметильную группу, m равно 2, R2 в качестве заместителей соответственно в положении 3 и в положении 5 представляют собой атомы хлора, n равно 0, R4 представляет собой фенильную группу, которая может быть замещена 1-5 группами, независимо выбранными из группы, состоящей из C1-C6алкильных групп, незамещенных или замещенных одним или несколькими атомами галогена, C1-C6алкоксигрупп, незамещенных или замещенных одним или несколькими атомами галогена, атомов галогена, нитрогруппы, цианогруппы, C1-C6алкилсульфонильных групп, C2-C6алкоксикарбонильных групп и бензоильной группы (группу, состоящую из C1-C6алкильных групп, незамещенных или замещенных одним или несколькими атомами галогена, C1-C6алкоксигрупп, незамещенных или замещенных одним или несколькими атомами галогена, атомов галогена, нитрогруппы, цианогруппы, C1-C6алкилсульфонильных групп, C2-C6алкоксикарбонильных групп и бензоильной группы, здесь и далее в некоторых случаях обозначают как группа Y), и R5 представляет собой атом водорода;
изоксазолиновые соединения формулы (1), где R1 представляет собой трифторметильную группу, m равно 2, R2 в качестве заместителей соответственно в положении 3 и в положении 5 представляют собой атомы хлора, n равно 1, R3 в качестве заместителя в положении 6 представляет собой C1-C6алкильную группу, R4 представляет собой фенильную группу, незамещенную или замещенную 1-5 группами, независимо выбранными из указанной выше группы Y, и R5 представляет собой атом водорода;
изоксазолиновые соединения формулы (1), где R1 представляет собой трифторметильную группу, n равно 0 или 1, R4 представляет собой атом водорода, C1-C12алкильную группу, незамещенную или замещенную одним или несколькими атомами галогена, C2-C12алкенильную группу, незамещенную или замещенную одним или несколькими атомами галогена, или C1-C6алкоксигруппу, незамещенную или замещенную одним или несколькими атомами галогена, и R5 представляет собой атом водорода.
Далее, получение соединения настоящего изобретения описано ниже.
(Способ получения 1)
Соединение настоящего изобретения может быть получено взаимодействием соединения, представленного формулой (2), с соединением, представленным формулой (3).

где R1, R2, R3, R4, R5, M, m и n являются такими, как определено выше, и L представляет собой гидроксильную группу или атом хлора.
Как правило, взаимодействие осуществляют в растворителе.
Используемый при данном взаимодействии растворитель включает, например, простые эфиры, такие как тетрагидрофуран, простой диэтиловый эфир, простой трет-бутилметиловый эфир, простой диметиловый эфир этиленгликоля, 1,4-диоксан и т.д.; амиды кислот, такие как N,N-диметилформамид и т.д.; нитрилы, такие как ацетонитрил и т.д.; углеводороды, такие как толуол и т.д.; сложные эфиры, такие как этилацетат и т.д.; сульфоксиды, такие как диметилсульфоксид и т.д., и их смеси.
Когда L представляет собой атом хлора, взаимодействие осуществляют в присутствии основания.
Используемое в данном взаимодействии основание включает, например, гидриды щелочных металлов, такие как гидрид натрия и т.д.; карбонаты, такие как карбонат калия и т.д.; алкоксиды щелочных металлов, такие как трет-бутоксид калия и т.д.; и органические амины, такие как триэтиламин, пиридин и т.д.
Когда L представляет собой гидроксильную группу, взаимодействие осуществляют в присутствии конденсирующего средства.
Используемое в данном взаимодействии конденсирующее средство включает, например, дициклогексилкарбодиимид и 1-(3-диметиламинопропил)-3-этилкарбодиимидгидрохлорид.
В отношении количеств реагентов, используемых при данном взаимодействии, количество соединения формулы (3), как правило, составляет от 1 до 2 моль на моль соединения формулы (2), и количество основания или конденсирующего средства, как правило, составляет от 1 до 2 моль на моль соединения формулы (2).
Температура реакции, как правило, находится в диапазоне от 0 до 80°C, и время реакции, как правило, составляет диапазон от 0,5 до 24 часов.
После завершения реакции соединение настоящего изобретения может быть выделено экстрагированием реакционной смеси органическим растворителем и последующей обработкой, такой как сушка и концентрирование. Выделенное соединение настоящего изобретения можно дополнительно очистить такими методами, как хроматография, перекристаллизация и т.п.
(Способ получения 2)
Соединение настоящего изобретения также может быть получено взаимодействием соединения, представленного формулой (4), сначала с основанием и последующим взаимодействием продукта реакции с соединением, представленным формулой (5).

где R1, R2, R3, R4, R5, M, m и n являются такими, как определено выше.
Как правило, взаимодействие осуществляют в растворителе.
Используемый при данном взаимодействии растворитель включает, например, простые эфиры, такие как тетрагидрофуран, простой диэтиловый эфир, простой трет-бутилметиловый эфир, простой диметиловый эфир этиленгликоля, 1,4-диоксан и т.д.; амиды кислот, такие как N,N-диметилформамид и т.д.; нитрилы, такие как ацетонитрил и т.д.; углеводороды, такие как толуол и т.д.; сложные эфиры, такие как этилацетат и т.д.; сульфоксиды, такие как диметилсульфоксид и т.д.; и их смеси.
Используемое при данном взаимодействии основание включает, например, гидриды щелочных металлов, такие как гидрид натрия и т.д.; карбонаты, такие как карбонат калия и т.д.; алкоксиды щелочных металлов, такие как калий трет-бутоксид и т.д.; и органические амины, такие как триэтиламин, пиридин и т.д.
В отношении количеств реагентов, используемых при данном взаимодействии, количество соединения формулы (5), как правило, составляет от 1 до 2 моль на моль соединения формулы (4), и количество основания, как правило, составляет от 1 до 2 моль на моль соединения формулы (4).
На стадии взаимодействия соединения формулы (4) сначала с основанием температура реакции, как правило, находится в диапазоне от 0 до 80°C, и время реакции, как правило, составляет диапазон от 0,5 до 24 часов.
Реакционную смесь, полученную на стадии взаимодействия соединения формулы (4) с основанием, можно использовать в неизменном виде на стадии взаимодействия с соединением формулы (5). На данной стадии температура реакции, как правило, находится в диапазоне от 0 до 80°C, и время реакции, как правило, составляет диапазон от 0,5 до 24 часов.
После завершения реакции соединение настоящего изобретения может быть выделено экстрагированием реакционной смеси органическим растворителем и последующей обработкой, такой как сушка и концентрирование. Выделенное соединение настоящего изобретения можно дополнительно очистить такими методами, как хроматография, перекристаллизация и т.п.
(Способ получения 3)
Соединение, представленное формулой (1-1), т.е. соединение настоящего изобретения, где R4 представляет собой C1-C6алкоксигруппу, незамещенную или замещенную одним или несколькими атомами галогена или т.п., может быть получено взаимодействием соединения, представленного формулой (2), сначала с карбонилирующим средством и последующим взаимодействием продукта реакции с соединением, представленным формулой (13).

где R4-1 представляет собой C1-C6алкоксигруппу, незамещенную или замещенную одним или несколькими атомами галогена, (C1-C6алкокси)C2-C6алкоксигруппу, C3-C6алкенилоксигруппу, незамещенную или замещенную одним или несколькими атомами галогена, бензилоксигруппу, группу, представленную следующей формулой:

феноксигруппу, незамещенную или замещенную 1-5 группами, независимо выбранными из группы X, фениламиногруппу, незамещенную или замещенную 1-5 группами, независимо выбранными из группы X, или фенил(C1-C2)алкиламиногруппу, незамещенную или замещенную 1-5 группами, независимо выбранными из группы X, и R1, R2, R3, R5, L1, L2, M, m и n являются такими, как определено выше.
Как правило, взаимодействие осуществляют в растворителе.
Используемый при данном взаимодействии растворитель включает, например, простые эфиры, такие как тетрагидрофуран, простой диэтиловый эфир, простой трет-бутилметиловый эфир, простой диметиловый эфир этиленгликоля, 1,4-диоксан и т.д.; амиды кислот, такие как N,N-диметилформамид и т.д.; нитрилы, такие как ацетонитрил и т.д.; углеводороды, такие как толуол и т.д.; сложные эфиры, такие как этилацетат и т.д.; сульфоксиды, такие как диметилсульфоксид и т.д.; и их смеси.
Используемое при данном взаимодействии карбонилирующее средство включает, например, фосген, трифосген и трихлорметилхлорформиат в случае, когда M представляет собой атом кислорода, и тиофосген в случае, когда M представляет собой атом серы.
В отношении количеств реагентов, используемых при данном взаимодействии, количество соединения формулы (13), как правило, составляет от 1 до 200 моль на моль соединения формулы (2), и количество карбонилирующего средства, как правило, составляет от 1 до 4 моль на моль соединения формулы (2).
На стадии взаимодействия соединения формулы (2) сначала с карбонилирующим средством температура реакции, как правило, находится в диапазоне от 0 до 100°C, и время реакции, как правило, составляет диапазон от 0,5 до 24 часов.
Реакционную смесь, полученную на стадии взаимодействия соединения формулы (2) с карбонилирующим средством, можно использовать в неизменном виде на стадии взаимодействия с соединением формулы (13). На данной стадии температура реакции, как правило, находится в диапазоне от 0 до 150°C, и время реакции, как правило, составляет диапазон от 0,5 до 24 часов.
После завершения всех реакций соединение настоящего изобретения может быть выделено экстрагированием реакционной смеси органическим растворителем и последующей обработкой, такой как сушка и концентрирование. Выделенное соединение формулы (1-1) можно дополнительно очистить такими методами, как хроматография, перекристаллизация и т.п.
Далее описан способ получения каждого промежуточного соединения, используемого для получения соединения настоящего изобретения.
Соединение, представленное формулой (4), может быть получено взаимодействием соединения, представленного формулой (6), с хлорирующим реагентом.

где R3, R4, R5, M и n являются такими, как определено выше.
Как правило, взаимодействие осуществляют в растворителе.
Используемый при данном взаимодействии растворитель включает, например, простые эфиры, такие как тетрагидрофуран, простой диэтиловый эфир, простой трет-бутилметиловый эфир, простой диметиловый эфир этиленгликоля, 1,4-диоксан и т.д.; углеводороды, такие как толуол и т.д.; сложные эфиры, такие как этилацетат и т.д.; амиды кислот, такие как N,N-диметилформамид и т.д.; нитрилы, такие как ацетонитрил и т.д.; сульфоксиды, такие как диметилсульфоксид и т.д.; и их смеси.
Хлорирующий реагент, используемый при данном взаимодействии, включает, например, газообразный хлор и N-хлорсукцинимид.
В отношении количеств реагентов, используемых при данном взаимодействии, количество хлорирующего реагента, как правило, составляет от 1 до 2 моль на моль соединения формулы (6).
Температура реакции, как правило, находится в диапазоне от -20 до 80°C, и время реакции, как правило, составляет диапазон от 0,5 до 24 часов.
После завершения реакции соединение формулы (4) может быть выделено экстрагированием реакционной смеси органическим растворителем и последующей обработкой, такой как сушка и концентрирование. Выделенное соединение формулы (4) можно дополнительно очистить такими методами, как хроматография, перекристаллизация и т.п.
Соединение, представленное формулой (6), может быть получено взаимодействием соединения, представленного формулой (7), с гидроксиламином.

где R3, R4, R5, M и n являются такими, как определено выше.
Как правило, взаимодействие осуществляют в растворителе.
Используемый при данном взаимодействии растворитель включает, например, простые эфиры, такие как тетрагидрофуран, простой диэтиловый эфир, простой трет-бутилметиловый эфир, простой диметиловый эфир этиленгликоля, 1,4-диоксан и т.д.; углеводороды, такие как толуол и т.д.; сложные эфиры, такие как этилацетат и т.д.; амиды кислот, такие как N,N-диметилформамид и т.д.; спирты, такие как этанол, метанол и т.д.; нитрилы, такие как ацетонитрил и т.д.; сульфоксиды, такие как диметилсульфоксид и т.д.; воду; и их смеси.
В качестве гидроксиламина, используемого при данном взаимодействии, можно привести, например, соли гидроксиламина с неорганической кислотой, такие как гидрохлорид гидроксиламина и сульфат гидроксиламина, которые в реакционной системе могут давать гидроксиламин. В данном случае взаимодействие осуществляют в присутствии основания. Используемое в таком случае основание включает, например, органические амины, такие как триэтиламин и т.д.; карбонаты, такие как карбонат натрия и т.д.; и гидроксиды щелочных металлов, такие как гидроксид натрия и т.д.
В отношении количеств реагентов, используемых при данном взаимодействии, количество гидроксиламина, как правило, составляет от 1 до 2 моль на моль соединения формулы (7), и количество используемого основания в случае использования соли гидроксиламина с неорганической кислотой, как правило, составляет от 1 до 2 моль на моль соли гидроксиламина с неорганической кислотой.
Температура реакции, как правило, находится в диапазоне от 0 до 80°C, и время реакции, как правило, составляет диапазон от 0,5 до 24 часов.
После завершения взаимодействия соединение формулы (6) может быть выделено экстрагированием реакционной смеси органическим растворителем и последующей обработкой, такой как сушка и концентрирование. Выделенное соединение формулы (6) можно дополнительно очистить такими методами, как хроматография, перекристаллизация и т.п.
Соединение, представленное формулой (2-1), т.е. соединение, представленное формулой (2), где R5 представляет собой атом водорода, может быть получено восстановлением соединения, представленного формулой (8), любым из следующих способов (i)-(iii).

где R1, R2, R3, M, m и n являются такими, как определено выше.
(i) Способ проведения взаимодействия соединения формулы (8) с газообразным водородом в присутствии катализатора переходного металла
Данное взаимодействие осуществляют в растворителе.
Используемый при данном взаимодействии растворитель включает, например, сложные эфиры, такие как этилацетат и т.д.; спирты, такие как этанол, метанол и т.д.; воду; уксусную кислоту; хлористоводородную кислоту и их смеси.
Катализатор переходный металл, используемый при данном взаимодействии, включает, например, никель Ренея, палладированный уголь и диоксид платины.
Количество катализатора переходного металла, используемого при данном взаимодействии, как правило, составляет 0,01 до 0,5 моля на моль соединения формулы (8).
Температура реакции, как правило, находится в диапазоне от 0 до 80°C, и время реакции, как правило, составляет диапазон от 0,5 до 24 часов.
После завершения реакции соединение формулы (2-1) может быть выделено фильтрованием реакционной смеси и, если необходимо, последующей обработкой, такой как экстракция органическим растворителем, сушка и концентрирование. Выделенное соединение формулы (2-1) можно дополнительно очистить такими методами, как хроматография, перекристаллизация и т.п.
(ii) Способ проведения взаимодействия соединения формулы (8) с гидразином в присутствии основания
Данное взаимодействие осуществляют в растворителе.
Используемый при данном взаимодействии растворитель включает, например, простые эфиры, такие как диэтиленгликоль, триэтиленгликоль и т.д., воду и их смеси.
Используемое при данном взаимодействии основание включает, например, гидроксиды щелочных металлов, такие как гидроксид калия и т.д.
Гидразин, используемый при данном взаимодействии, включает, например, гидразингидрат.
В отношении количеств реагентов, используемых при взаимодействии, количество основания, как правило, составляет от 1 до 10 моль на моль соединения формулы (8), и количество гидразина, как правило, составляет от 1 до 10 моль на моль соединения формулы (8).
После завершения реакции соединение формулы (2-1) может быть выделено экстрагированием реакционной смеси органическим растворителем и последующей обработкой, такой как сушка и концентрирование. Выделенное соединение формулы (2-1) можно дополнительно очистить такими методами, как хроматография, перекристаллизация и т.п.
(iii) Способ проведения взаимодействия соединения формулы (8) с металлом в присутствии кислоты
Данное взаимодействие, как правило, осуществляют в растворителе.
Используемый при данном взаимодействии растворитель включает, например, спирты, такие как этанол и т.д., воду и их смеси.
Металл, используемый при данном взаимодействии, включает, например, железо, олово и хлорид олова.
Кислота, используемая при данном взаимодействии, включает, например, уксусную кислоту, хлористоводородную кислоту и серную кислоту.
В отношении количеств реагентов, используемых при данном взаимодействии, количество металла, как правило, составляет от 2 до 20 моль на моль соединения формулы (8), и количество кислоты, как правило, составляет 0,1 до 2 моль на моль соединения формулы (8).
Температура реакции, как правило, находится в диапазоне от 0 до 100°C, и время реакции, как правило, составляет диапазон от 0,5 до 12 часов.
После завершения реакции соединение формулы (2-1) может быть выделено фильтрованием реакционной смеси и, если необходимо, последующей обработкой, такой как экстракция органическим растворителем, сушка и концентрирование. Выделенное соединение формулы (2-1) можно дополнительно очистить такими методами, как хроматография, перекристаллизация и т.п.
Соединение, представленное формулой (8), может быть получено взаимодействием соединения, представленного формулой (9), сначала с основанием и последующим взаимодействием продукта реакции с соединением, представленным формулой (5).

где R1, R2, R3, m и n являются такими, как определено выше.
Как правило, взаимодействие осуществляют в растворителе.
Используемый при данном взаимодействии растворитель включает, например, простые эфиры, такие как тетрагидрофуран, простой диэтиловый эфир, простой трет-бутилметиловый эфир, простой диметиловый эфир этиленгликоля, 1,4-диоксан и т.д.; амиды кислот, такие как N,N-диметилформамид и т.д.; нитрилы, такие как ацетонитрил и т.д.; углеводороды, такие как толуол и т.д.; сложные эфиры, такие как этилацетат и т.д.; сульфоксиды, такие как диметилсульфоксид и т.д.; и их смеси.
Используемое при данном взаимодействии основание включает, например, гидриды щелочных металлов, такие как гидрид натрия и т.д.; карбонаты, такие как карбонат калия и т.д.; алкоксиды щелочных металлов, такие как трет-бутоксид калий и т.д.; и органические амины, такие как триэтиламин, пиридин и т.д.
В отношении количеств реагентов, используемых при данном взаимодействии, количество соединения формулы (5), как правило, составляет от 1 до 2 моль на моль соединения формулы (9), и количество основания, как правило, составляет от 1 до 2 моль на моль соединения формулы (9).
На стадии взаимодействия соединения формулы (9) сначала с основанием температура реакции, как правило, находится в диапазоне от 0 до 80°C, и время реакции, как правило, составляет диапазон от 0,5 до 24 часов.
Реакционную смесь, полученную на стадии взаимодействия соединения формулы (9) с основанием, можно использовать в неизменном виде на стадии взаимодействия с соединением формулы (5). На данной стадии температура реакции, как правило, находится в диапазоне от 0 до 80°C, и время реакции, как правило, составляет диапазон от 0,5 до 24 часов.
После завершения реакции соединение формулы (8) может быть выделено экстрагированием реакционной смеси органическим растворителем и последующей обработкой, такой как сушка и концентрирование. Выделенное соединение формулы (8) можно дополнительно очистить такими методами, как хроматография, перекристаллизация и т.п.
Соединение, представленное формулой (9), может быть получено взаимодействием соединения, представленного формулой (10), с хлорирующим реагентом.

где R3 и n являются такими, как определено выше.
Как правило, взаимодействие осуществляют в растворителе.
Используемый при данном взаимодействии растворитель включает, например, простые эфиры, такие как тетрагидрофуран, простой диэтиловый эфир, простой трет-бутилметиловый эфир, простой диметиловый эфир этиленгликоля, 1,4-диоксан и т.д.; углеводороды, такие как толуол и т.д.; сложные эфиры, такие как этилацетат и т.д.; амиды кислот, такие как N,N-диметилформамид и т.д.; нитрилы, такие как ацетонитрил и т.д.; сульфоксиды, такие как диметилсульфоксид и т.д.; и их смеси.
Хлорирующий реагент, используемый при данном взаимодействии, включает, например, газообразный хлор и N-хлорсукцинимид.
В отношении количеств реагентов, используемых при данном взаимодействии, количество хлорирующего реагента, как правило, составляет от 1 до 2 моль на моль соединения формулы (10).
Температура реакции, как правило, находится в диапазоне от -20 до 80°C, и время реакции, как правило, составляет диапазон от 0,5 до 24 часов.
После завершения реакции соединение формулы (9) может быть выделено экстрагированием реакционной смеси органическим растворителем и последующей обработкой, такой как сушка и концентрирование. Выделенное соединение формулы (9) можно дополнительно очистить такими методами, как хроматография, перекристаллизация и т.п.
Соединение, представленное формулой (10), может быть получено взаимодействием соединения, представленного формулой (11), с гидроксиламином.

Как правило, взаимодействие осуществляют в растворителе.
Используемый при данном взаимодействии растворитель включает, например, простые эфиры, такие как тетрагидрофуран, простой диэтиловый эфир, простой трет-бутилметиловый эфир, простой диметиловый эфир этиленгликоля, 1,4-диоксан и т.д.; углеводороды, такие как толуол и т.д.; сложные эфиры, такие как этилацетат и т.д.; амиды кислот, такие как N,N-диметилформамид и т.д.; спирты, такие как этанол, метанол и т.д.; нитрилы, такие как ацетонитрил и т.д.; сульфоксиды, такие как диметилсульфоксид и т.д.; воду и их смеси.
В качестве гидроксиламина, используемого при данном взаимодействии, можно привести, например, соли гидроксиламина с неорганической кислотой, такие как гидрохлорид гидроксиламина и сульфат гидроксиламина, которые могут давать гидроксиламин в реакционной системе. В данном случае взаимодействие осуществляют в присутствии основания. Используемое в таком случае основание включает, например, органические амины, такие как триэтиламин и т.д.; карбонаты, такие как карбонат натрия и т.д.; и гидроксиды щелочных металлов, такие как гидроксид натрия и т.д.
В отношении количеств реагентов, используемых при данном взаимодействии, количество гидроксиламина, как правило, составляет от 1 до 2 моль на моль соединения формулы (11), и количество основания, используемого в случае использования соли гидроксиламина с неорганической кислотой, как правило, составляет от 1 до 2 моль на моль соли гидроксиламина с неорганической кислотой.
Температура реакции, как правило, находится в диапазоне от 0 до 80°C, и время реакции, как правило, составляет диапазон от 0,5 до 24 часов.
После завершения реакции соединение формулы (10) может быть выделено экстрагированием реакционной смеси органическим растворителем и последующей обработкой, такой как сушка и концентрирование. Выделенное соединение формулы (10) можно дополнительно очистить такими методами, как хроматография, перекристаллизация и т.п.
Конкретные примеры соединения настоящего изобретения приведены ниже:
изоксазолиновые соединения, представленные формулой (i):

где R4a представляет собой любую группу, выбранную из группы (A), описанной ниже в настоящем описании;
изоксазолиновые соединения, представленные формулой (ii):

где R4a представляет собой любую группу, выбранную из группы (A), описанной ниже в настоящем описании;
изоксазолиновые соединения, представленные формулой (iii):

где R4a представляет собой любую группу, выбранную из группы (A), описанной ниже в настоящем описании;
изоксазолиновые соединения, представленные формулой (iv):

где R4a представляет собой любую группу, выбранную из группы (A), описанной ниже в настоящем описании;
изоксазолиновые соединения, представленные формулой (v):

где R4a представляет собой любую группу, выбранную из группы (A), описанной ниже в настоящем описании;
изоксазолиновые соединения, представленные формулой (vi):

где R4a представляет собой любую группу, выбранную из группы (A), описанной ниже в настоящем описании;
изоксазолиновые соединения, представленные формулой (vii):

где R4a представляет собой любую группу, выбранную из группы (A), описанной ниже в настоящем описании;
изоксазолиновые соединения, представленные формулой (viii):

где R4a представляет собой любую группу, выбранную из группы (A), описанной ниже в настоящем описании;
изоксазолиновые соединения, представленные формулой (ix):
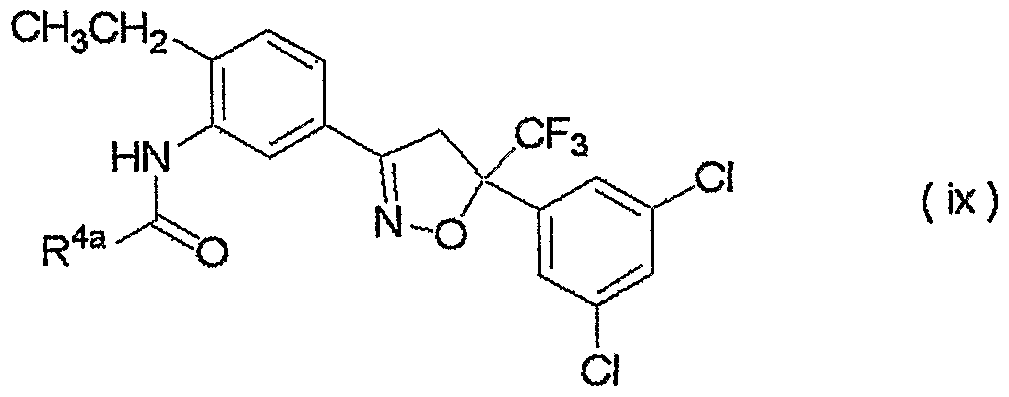
где R4a представляет собой любую группу, выбранную из группы (A), описанной ниже в настоящем описании;
изоксазолиновые соединения, представленные формулой (x):

где R4a представляет собой любую группу, выбранную из группы (A), описанной ниже в настоящем описании;
изоксазолиновые соединения, представленные формулой (xi):

где R4a представляет собой любую группу, выбранную из группы (A), описанной ниже в настоящем описании;
изоксазолиновые соединения, представленные формулой (xii):

где R4a представляет собой любую группу, выбранную из группы (A), описанной ниже в настоящем описании;
изоксазолиновые соединения, представленные формулой (xiii):

где R4a представляет собой любую группу, выбранную из группы (A), описанной ниже в настоящем описании;
изоксазолиновые соединения, представленные формулой (xiv):

где R4a представляет собой любую группу, выбранную из группы (A), описанной ниже в настоящем описании;
изоксазолиновые соединения, представленные формулой (xv):

где R4a представляет собой любую группу, выбранную из группы (A), описанной ниже в настоящем описании;
изоксазолиновые соединения, представленные формулой (xvi):

где R4a представляет собой любую группу, выбранную из группы (A), описанной ниже в настоящем описании;
изоксазолиновые соединения, представленные формулой (xvii):

где R4a представляет собой любую группу, выбранную из группы (A), описанной ниже в настоящем описании;
изоксазолиновые соединения, представленные формулой (xviii):

где R4a представляет собой любую группу, выбранную из группы (A), описанной ниже в настоящем описании;
изоксазолиновые соединения, представленные формулой (xix):

где R4a представляет собой любую группу, выбранную из группы (A), описанной ниже в настоящем описании;
изоксазолиновые соединения, представленные формулой (xx):

где R4a представляет собой любую группу, выбранную из группы (A), описанной ниже в настоящем описании;
изоксазолиновые соединения, представленные формулой (xxi):

где R4a представляет собой любую группу, выбранную из группы (A), описанной ниже в настоящем описании;
изоксазолиновые соединения, представленные формулой (xxii):

где R4a представляет собой любую группу, выбранную из группы (A), описанной ниже в настоящем описании;
изоксазолиновые соединения, представленные формулой (xxiii):

где R4a представляет собой любую группу, выбранную из группы (A), описанной ниже в настоящем описании; и
изоксазолиновые соединения, представленные формулой (xxiv):
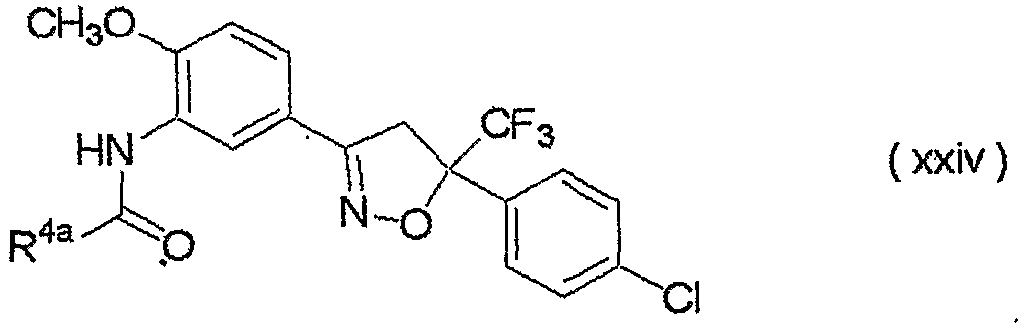
где R4a представляет собой любую группу, выбранную из группы (A), описанной ниже в настоящем описании.
Группа (A):
метильная группа, этильная группа, пропильная группа,
изопропильная группа, бутильная группа, изобутильная группа,
втор-бутильная группа, трет-бутильная группа, пентильная группа,
1-метилбутильная группа, 2-метилбутильная группа,
3-метилбутильная группа, 1-этилпропильная группа,
1,1-диметилпропильная группа, 1,2-диметилпропильная группа,
2,2-диметилпропильная группа, гексильная группа,
1-метилпентильная группа, 2-метилпентильная группа,
1,1-диметилбутильная группа, 1,3-диметилбутильная группа,
гептильная группа, октильная группа, нонильная группа,
децильная группа, ундецильная группа, додецильная группа,
метоксикарбонилметильная группа, этоксикарбонилметильная группа,
пропоксикарбонилметильная группа,
изопропоксикарбонилметильная группа,
трет-бутоксикарбонилметильная группа, цианометильная группа,
2-фенилвинильная группа, 2-метоксиэтоксигруппа,
2-этоксиэтоксигруппа, 2-пропоксиэтоксигруппа,
2-изопропоксиэтоксигруппа, 2-трет-бутоксиэтоксигруппа,
бензилоксигруппа, аллилоксигруппа, фторметильная группа,
хлорметильная группа, бромметильная группа,
йодометильная группа, дифторметильная группа,
хлорфторметильная группа, дихлорметильная группа,
бромфторметильная группа, трифторметильная группа,
хлордифторметильная группа, дихлорфторметильная группа,
трихлорметильная группа, бромдифторметильная группа,
бромхлорфторметильная группа, дифторйодометильная группа,
2-фторэтильная группа, 2-хлорэтильная группа,
2-бромэтильная группа, 2,2-дифторэтильная группа,
2-хлор-2-фторэтильная группа, 2,2-дихлорэтильная группа,
2-бром-2-фторэтильная группа, 2,2,2-трифторэтильная группа,
2-хлор-2,2-дифторэтильная группа,
2,2-дихлор-2-фторэтильная группа, 2,2,2-трихлорэтильная группа,
2-бром-2,2-дифторэтильная группа,
1,1,2,2-тетрафторэтильная группа,
1,1,2,2,2-пентафторэтильная группа,
1-хлор-1,2,2,2-тетрафторэтильная группа,
2-хлор-1,1,2,2-тетрафторэтильная группа,
1,2-дихлор-1,2,2-трифторэтильная группа,
1-бром-1,2,2,2-тетрафторэтильная группа,
2-бром-1,1,2,2-тетрафторэтильная группа,
2-фторпропильная группа, 2-хлорпропильная группа,
2,3-дихлорпропильная группа, 3,3,3-трифторпропильная группа,
3-бром-3,3-дифторпропильная группа,
2,2,3,3-тетрафторпропильная группа,
2,2,3,3,3-пентафторпропильная группа,
1,1,2,3,3,3-гексафторпропильная группа,
1,1,2,2,3,3,3-гептафторпропильная группа,
2,3-дихлор-1,1,2,3,3-пентафторпропильная группа,
2-фтор-1-метилэтильная группа, 2-хлор-1-метилэтильная группа,
2-бром-1-метилэтильная группа,
2,2,2-трифтор-1-(трифторметил)этильная группа,
1,2,2,2-тетрафтор-1-(трифторметил)этильная группа,
1,1,2,2,3,3,4,4,4-нонафторбутильная группа,
циклопропильная группа, 1-метилциклопропильная группа,
2-метилциклопропильная группа,
2,2-диметилциклопропильная группа,
2,2,3,3-тетраметилциклопропильная группа, циклобутильная группа,
циклопентильная группа, 1-метилциклопентильная группа,
2-метилциклопентильная группа, 3-метилциклопентильная группа,
циклогексильная группа, 1-метилциклогексильная группа,
2-метилциклогексильная группа, 3-метилциклогексильная группа,
4-метилциклогексильная группа, циклогептильная группа,
циклооктильная группа, 2-фторциклопропильная группа,
2-хлорциклопропильная группа, 2,2-дифторциклопропильная группа,
2,2-дихлорциклопропильная группа,
2,2-дибромциклопропильная группа,
2,2-дифтор-1-метилциклопропильная группа,
2,2-дихлор-1-метилциклопропильная группа,
2,2,3,3-тетрафторциклобутильная группа,
2-хлор-2,3,3-трифторциклобутильная группа,
циклопропилметильная группа, 1-метилциклопропилметильная группа,
циклобутилметильная группа, циклопентилметильная группа,
циклогексилметильная группа, циклогептилметильная группа,
2-метоксиэтильная группа, 2-этоксиэтильная группа,
2-пропоксиэтильная группа, 2-изопропоксиэтильная группа,
2-бутоксиэтильная группа, 2-изобутоксиэтильная группа,
2-(втор-бутокси)этильная группа,
2-(трет-бутокси)этильная группа, винильная группа,
1-пропенильная группа, 2-пропенильная группа,
1-метилэтенильная группа, 2-бутенильная группа,
1-метил-2-пропенильная группа, 2-метил-2-пропенильная группа,
2-пентенильная группа, 2-метил-2-бутенильная группа,
3-метил-2-бутенильная группа, 2-этил-2-пропенильная группа,
1,1-диметил-2-пропенильная группа, 2-гексенильная группа,
2-метил-2-пентенильная группа,
2,4-диметил-2,6-гептадиенильная группа,
3,7-диметил-2,6-октадиенильная группа,
2,2-дихлорвинильная группа, 2-фтор-2-пропенильная группа,
2-хлор-2-пропенильная группа, 3-хлор-2-пропенильная группа,
2-бром-2-пропенильная группа, 3-бром-2-пропенильная группа,
3,3-дифтор-2-пропенильная группа,
2,3-дихлор-2-пропенильная группа,
3,3-дихлор-2-пропенильная группа,
2,3-дибром-2-пропенильная группа,
2,3,3-трифтор-2-пропенильная группа,
2,3,3-трихлор-2-пропенильная группа,
1-(трифторметил)этенильная группа,
3-хлор-2-бутенильная группа, 3-бром-2-бутенильная группа,
4,4-дифтор-3-бутенильная группа,
3,4,4-трифтор-3-бутенильная группа,
3-хлор-4,4,4-трифтор-2-бутенильная группа,
3-бром-2-метил-2-пропенильная группа, этинильная группа,
1-пропинильная группа, 2-пропинильная группа,
2-бутинильная группа, 1-метил-2-пропинильная группа,
2-пентинильная группа, 1-метил-2-бутинильная группа,
1,1-диметил-2-пропинильная группа, 2-гексинильная группа,
2-хлорэтинильная группа, 2-бромэтинильная группа,
2-йодэтинильная группа, 3-хлор-2-пропинильная группа,
3-бром-2-пропинильная группа, 3-йод-2-пропинильная группа,
метоксигруппа, этоксигруппа, пропоксигруппа, изопропоксигруппа,
бутоксигруппа, изобутоксигруппа, втор-бутоксигруппа,
трет-бутоксигруппа, пентилоксигруппа, гексилоксигруппа,
дифторметоксигруппа, трифторметоксигруппа,
хлордифторметоксигруппа, бромдифторметоксигруппа,
2-фторэтоксигруппа, 2-хлорэтоксигруппа,
2,2,2-трифторэтоксигруппа, 1,1,2,2-тетрафторэтоксигруппа,
2-хлор-1,1,1-трифторэтоксигруппа,
2-бром-1,1,2-трифторэтоксигруппа,
1,1,2,2,2-пентафторэтоксигруппа,
2,2-дихлор-1,1,2-трифторэтоксигруппа,
2,2,2-трихлор-1,1-дифторэтоксигруппа,
2-бром-1,1,2,2-тетрафторэтоксигруппа,
2,2,3,3-тетрафторпропоксигруппа,
1,1,2,3,3,3-гексафторпропоксигруппа,
2,2,2-трифтор-1-(трифторметил)этоксигруппа,
1,1,2,2,3,3,3-гептафторпропоксигруппа,
2-бром-1,1,2,3,3,3-гексафторпропоксигруппа,
2-пиридильная группа, 3-метил-2-пиридильная группа,
4-метил-2-пиридильная группа, 5-метил-2-пиридильная группа,
6-метил-2-пиридильная группа, 3-фтор-2-пиридильная группа,
4-фтор-2-пиридильная группа, 5-фтор-2-пиридильная группа,
6-фтор-2-пиридильная группа, 3-хлор-2-пиридильная группа,
4-хлор-2-пиридильная группа, 5-хлор-2-пиридильная группа,
6-хлор-2-пиридильная группа, 3-бром-2-пиридильная группа,
4-бром-2-пиридильная группа, 5-бром-2-пиридильная группа,
6-бром-2-пиридильная группа, 3-пиридильная группа,
2-метил-3-пиридильная группа, 4-метил-3-пиридильная группа,
5-метил-3-пиридильная группа, 6-метил-3-пиридильная группа,
2-фтор-3-пиридильная группа, 4-фтор-3-пиридильная группа,
5-фтор-3-пиридильная группа, 6-фтор-3-пиридильная группа,
2-хлор-3-пиридильная группа, 4-хлор-3-пиридильная группа,
5-хлор-3-пиридильная группа, 6-хлор-3-пиридильная группа,
2-метилтио-3-пиридильная группа,
4-метилтио-3-пиридильная группа,
5-метилтио-3-пиридильная группа,
6-метилтио-3-пиридильная группа,
2-трифторметил-3-пиридильная группа,
4-трифторметил-3-пиридильная группа,
5-трифторметил-3-пиридильная группа,
6-трифторметил-3-пиридильная группа,
5,6-дихлор-3-пиридильная группа,
2,6-дихлор-3-пиридильная группа, 6-циано-3-пиридильная группа,
4-пиридильная группа, 2-фтор-4-пиридильная группа,
3-фтор-4-пиридильная группа, 2-хлор-4-пиридильная группа,
3-хлор-4-пиридильная группа, 2,6-дихлор-4-пиридильная группа,
3,5-дихлор-4-пиридильная группа, 2-пиридилметильная группа,
3-пиридилметильная группа, 4-пиридилметильная группа,
2-фурильная группа, 2-метил-2-фурильная группа,
5-бром-2-фурильная группа, 5-нитро-2-фурильная группа,
3,4-дибром-2-фурильная группа, 3-фурильная группа,
2-метил-3-фурильная группа, 2,5-диметил-3-фурильная группа,
метиламиногруппа, этиламиногруппа, пропиламиногруппа,
изопропиламиногруппа, бутиламиногруппа, изобутиламиногруппа,
трет-бутиламиногруппа, диметиламиногруппа,
этил(метил)аминогруппа, диэтиламиногруппа,
пропил(метил)аминогруппа, изопропил(метил)аминогруппа,
дипропиламиногруппа, бутил(метил)аминогруппа,
изобутил(метил)аминогруппа, трет-бутил(метил)аминогруппа,
пирролидин-1-ильная группа, 2-метилпирролидин-1-ильная группа,
2-этилпирролидин-1-ильная группа,
2-пропилпирролидин-1-ильная группа,
2-изопропилпирролидин-1-ильная группа,
2-трет-бутилпирролидин-1-ильная группа,
3-метилпирролидин-1-ильная группа,
3-этилпирролидин-1-ильная группа,
2,5-диметилпирролидин-1-ильная группа,
3,4-диметилпирролидин-1-ильная группа,
3,3-диметилпирролидин-1-ильная группа, пиперидиногруппа,
2-метилпиперидиногруппа, 2-этилпиперидиногруппа,
2-пропилпиперидиногруппа, 2-изопропилпиперидиногруппа,
2-трет-бутилпиперидиногруппа, 2-втор-бутилпиперидиногруппа,
3-метилпиперидиногруппа, 3-этилпиперидиногруппа,
3-пропилпиперидиногруппа, 3-изопропилпиперидиногруппа,
3-трет-бутилпиперидиногруппа, 3-втор-бутилпиперидиногруппа,
4-метилпиперидиногруппа, 4-этилпиперидиногруппа,
4-пропилпиперидиногруппа, 4-изопропилпиперидиногруппа,
4-трет-бутилпиперидиногруппа, 4-(трифторметил)пиперидиногруппа,
2,6-диметилпиперидиногруппа, 2,4-диметилпиперидиногруппа,
2,5-диметилпиперидиногруппа, 3,5-диметилпиперидиногруппа,
2,2-диметилпиперидиногруппа, 3,3-диметилпиперидиногруппа,
4,4-диметилпиперидиногруппа, 3-этил-6-метилпиперидиногруппа,
3-этил-5-метилпиперидиногруппа, 3,5-диэтилпиперидиногруппа,
2,3-диметилпиперидиногруппа, 3,3,5-триметилпиперидиногруппа,
2,3,5,6-тетраметилпиперидиногруппа,
3,3,5,5-тетраметилпиперидиногруппа, гексаметилениминогруппа,
2-метилгексаметилениминогруппа, 2-этилгексаметилениминогруппа,
3-метилгексаметилениминогруппа, 3-этилгексаметилениминогруппа,
4-метилгексаметилениминогруппа, 4-этилгексаметилениминогруппа,
гептаметилениминогруппа, морфолиногруппа, фенильная группа,
2-метилфенильная группа, 3-метилфенильная группа,
4-метилфенильная группа, 2-(трифторметил)фенильная группа,
3-(трифторметил)фенильная группа,
4-(трифторметил)фенильная группа, 2-фторфенильная группа,
3-фторфенильная группа, 4-фторфенильная группа,
2-хлорфенильная группа, 3-хлорфенильная группа,
4-хлорфенильная группа, 2-бромфенильная группа,
3-бромфенильная группа, 4-бромфенильная группа,
2-йодофенильная группа, 3-йодофенильная группа,
4-йодофенильная группа, 2-цианофенильная группа,
3-цианофенильная группа, 4-цианофенильная группа,
2-нитрофенильная группа, 3-нитрофенильная группа,
4-нитрофенильная группа, 2-метоксифенильная группа,
3-метоксифенильная группа, 4-метоксифенильная группа,
2-трифторметоксифенильная группа,
3-трифторметоксифенильная группа,
4-трифторметоксифенильная группа, 2,3-дихлорфенильная группа,
2,4-дихлорфенильная группа, 2,5-дихлорфенильная группа,
2,6-дихлорфенильная группа, 3,4-дихлорфенильная группа,
3,5-дихлорфенильная группа, 2,3,4-трихлорфенильная группа,
2,4,6-трихлорфенильная группа, 3,4,5-трихлорфенильная группа,
2,3-дифторфенильная группа, 2,4-дифторфенильная группа,
2,5-дифторфенильная группа, 2,6-дифторфенильная группа,
3,4-дифторфенильная группа, 3,5-дифторфенильная группа,
2,3,4-трифторфенильная группа, 2,4,6-трифторфенильная группа,
3,4,5-трифторфенильная группа,
2,3,5,6-тетрафторфенильная группа,
2,3,4,5,6-пентафторфенильная группа,
3,5-бис(трифторметил)фенильная группа,
2,3-диметоксифенильная группа, 2,4-диметоксифенильная группа,
2,5-диметоксифенильная группа, 2,6-диметоксифенильная группа,
3,4-диметоксифенильная группа, 3,5-диметоксифенильная группа,
2-метансульфонилфенильная группа,
3-метансульфонилфенильная группа,
4-метансульфонилфенильная группа, 4-бензоилфенильная группа,
4-метоксикарбонилфенильная группа,
4-этоксикарбонилфенильная группа, фенилметильная группа,
(2-метилфенил)метильная группа, (3-метилфенил)метильная группа,
(4-метилфенил)метильная группа,
{2-(трифторметил)фенил}метильная группа,
{3-(трифторметил)фенил}метильная группа,
{4-(трифторметил)фенил}метильная группа,
(2-фторфенил)метильная группа, (3-фторфенил)метильная группа,
(4-фторфенил)метильная группа, (2-хлорфенил)метильная группа,
(3-хлорфенил)метильная группа, (4-хлорфенил)метильная группа,
(2-бромфенил)метильная группа, (3-бромфенил)метильная группа,
(4-бромфенил)метильная группа, (2-йодофенил)метильная группа,
(3-йодофенил)метильная группа, (4-йодофенил)метильная группа,
(2-цианофенил)метильная группа, (3-цианофенил)метильная группа,
(4-цианофенил)метильная группа, (2-нитрофенил)метильная группа,
(3-нитрофенил)метильная группа, (4-нитрофенил)метильная группа,
(2-метоксифенил)метильная группа,
(3-метоксифенил)метильная группа,
(4-метоксифенил)метильная группа,
(2-трифторметоксифенил)метильная группа,
(3-трифторметоксифенил)метильная группа,
(4-трифторметоксифенил)метильная группа,
(2,3-дихлорфенил)метильная группа,
(2,4-дихлорфенил)метильная группа,
(2,5-дихлорфенил)метильная группа,
(2,6-дихлорфенил)метильная группа,
(3,4-дихлорфенил)метильная группа,
(3,5-дихлорфенил)метильная группа,
(2,3,4-трихлорфенил)метильная группа,
(3,4,5-трихлорфенил)метильная группа,
(2,4,6-трихлорфенил)метильная группа,
(2,3,5,6-тетрахлорфенил)метильная группа,
(2,3-дифторфенил)метильная группа,
(2,4-дифторфенил)метильная группа,
(2,5-дифторфенил)метильная группа,
(2,6-дифторфенил)метильная группа,
(3,4-дифторфенил)метильная группа,
(3,5-дифторфенил)метильная группа,
(2,3,4-трифторфенил)метильная группа,
(3,4,5-трифторфенил)метильная группа,
(2,4,6-трифторфенил)метильная группа,
(2,3,5,6-тетрафторфенил)метильная группа,
(2,3,4,5,6-пентафторфенил)метильная группа,
{3,5-бис(трифторметил)фенил}метильная группа,
(2,3-диметоксифенил)метильная группа,
(2,4-диметоксифенил)метильная группа,
(2,5-диметоксифенил)метильная группа,
(2,6-диметоксифенил)метильная группа,
(3,4-диметоксифенил)метильная группа,
(3,5-диметоксифенил)метильная группа, 1-фенилэтильная группа,
2-фенилэтильная группа, 1-(2-метилфенил)этильная группа,
2-(2-метилфенил)этильная группа,
1-(3-метилфенил)этильная группа,
2-(3-метилфенил)этильная группа,
1-(4-метилфенил)этильная группа,
2-(4-метилфенил)этильная группа,
1-{2-(трифторметил)фенил}этильная группа,
2-{2-(трифторметил)фенил}этильная группа,
1-{3-(трифторметил)фенил}этильная группа,
2-{3-(трифторметил)фенил}этильная группа,
1-{4-(трифторметил)фенил}этильная группа,
2-{4-(трифторметил)фенил}этильная группа,
1-(2-фторфенил)этильная группа, 2-(2-фторфенил)этильная группа,
1-(3-фторфенил)этильная группа, 2-(3-фторфенил)этильная группа,
1-(4-фторфенил)этильная группа, 2-(4-фторфенил)этильная группа,
1-(2-хлорфенил)этильная группа, 2-(2-хлорфенил)этильная группа,
1-(3-хлорфенил)этильная группа, 2-(3-хлорфенил)этильная группа,
1-(4-хлорфенил)этильная группа, 2-(4-хлорфенил)этильная группа,
1-(2-бромфенил)этильная группа, 2-(2-бромфенил)этильная группа,
1-(3-бромфенил)этильная группа, 2-(3-бромфенил)этильная группа,
1-(4-бромфенил)этильная группа, 2-(4-бромфенил)этильная группа,
1-(2-йодофенил)этильная группа, 2-(2-йодофенил)этильная группа,
1-(3-йодофенил)этильная группа, 2-(3-йодофенил)этильная группа,
1-(4-йодофенил)этильная группа, 2-(4-йодофенил)этильная группа,
1-(2-цианофенил)этильная группа,
2-(2-цианофенил)этильная группа,
1-(3-цианофенил)этильная группа,
2-(3-цианофенил)этильная группа,
1-(4-цианофенил)этильная группа,
2-(4-цианофенил)этильная группа,
1-(2-нитрофенил)этильная группа,
2-(2-нитрофенил)этильная группа,
1-(3-нитрофенил)этильная группа,
2-(3-нитрофенил)этильная группа,
1-(4-нитрофенил)этильная группа,
2-(4-нитрофенил)этильная группа,
1-(2-метоксифенил)этильная группа,
2-(2-метоксифенил)этильная группа,
1-(3-метоксифенил)этильная группа,
2-(3-метоксифенил)этильная группа,
1-(4-метоксифенил)этильная группа,
2-(4-метоксифенил)этильная группа,
1-{2-(трифторметокси)фенил}этильная группа,
2-{2-(трифторметокси)фенил}этильная группа,
1-{3-(трифторметокси)фенил}этильная группа,
2-{3-(трифторметокси)фенил}этильная группа,
1-{4-(трифторметокси)фенил}этильная группа,
2-{4-(трифторметокси)фенил}этильная группа,
феноксиметильная группа, (2-фторфенокси)метильная группа,
(3-фторфенокси)метильная группа,
(4-фторфенокси)метильная группа,
(2-хлорфенокси)метильная группа,
(3-хлорфенокси)метильная группа,
(4-хлорфенокси)метильная группа,
(2-бромфенокси)метильная группа,
(3-бромфенокси)метильная группа,
(4-бромфенокси)метильная группа,
(2-метоксифенокси)метильная группа,
(3-метоксифенокси)метильная группа,
(4-метоксифенокси)метильная группа, 1-феноксиэтильная группа,
2-феноксиэтильная группа, 1-(2-фторфенокси)этильная группа,
2-(2-фторфенокси)этильная группа,
1-(3-фторфенокси)этильная группа,
2-(3-фторфенокси)этильная группа,
1-(4-фторфенокси)этильная группа,
2-(4-фторфенокси)этильная группа,
1-(2-хлорфенокси)этильная группа,
2-(2-хлорфенокси)этильная группа,
1-(3-хлорфенокси)этильная группа,
2-(3-хлорфенокси)этильная группа,
1-(4-хлорфенокси)этильная группа,
2-(4-хлорфенокси)этильная группа,
1-(2-бромфенокси)этильная группа,
2-(2-бромфенокси)этильная группа,
1-(3-бромфенокси)этильная группа,
2-(3-бромфенокси)этильная группа,
1-(4-бромфенокси)этильная группа,
2-(4-бромфенокси)этильная группа,
1-(2-метоксифенокси)этильная группа,
2-(2-метоксифенокси)этильная группа,
1-(3-метоксифенокси)этильная группа,
2-(3-метоксифенокси)этильная группа,
1-(4-метоксифенокси)этильная группа,
2-(4-метоксифенокси)этильная группа, бензиламиногруппа,
(2-метилфенил)метиламиногруппа, (3-метилфенил)метиламиногруппа,
(4-метилфенил)метиламиногруппа,
{2-(трифторметил)фенил}метиламиногруппа,
{3-(трифторметил)фенил}метиламиногруппа,
{4-(трифторметил)фенил}метиламиногруппа,
(2-фторфенил)метиламиногруппа, (3-фторфенил)метиламиногруппа,
(4-фторфенил)метиламиногруппа, (2-хлорфенил)метиламиногруппа,
(3-хлорфенил)метиламиногруппа, (4-хлорфенил)метиламиногруппа,
(2-бромфенил)метиламиногруппа, (3-бромфенил)метиламиногруппа,
(4-бромфенил)метиламиногруппа, (2-метоксифенил)метиламиногруппа,
(3-метоксифенил)метиламиногруппа,
(4-метоксифенил)метиламиногруппа, (1-фенилэтил)аминогруппа,
(2-фенилэтил)аминогруппа, (метиламино)метильная группа,
(диметиламино)метильная группа, (этиламино)метильная группа,
(диэтиламино)метильная группа, (метиламино)этильная группа,
(диметиламино)этильная группа, (этиламино)этильная группа и
(диэтиламино)этильная группа.
В качестве вредителей, против которых эффективно соединение настоящего изобретения, можно привести, например, вредных членистоногих (например, вредных насекомых и вредных клещей) и нематод, принадлежащих к круглым червям. Конкретные примеры вредителей указаны ниже.
Полужесткокрылые
Дельфациды (Delphacidae), такие как малый коричневый дельфацид (Laodelphax striatellus), коричневый дельфацид (Nilaparvata lugens) и белоспинный рисовый дельфацид (Sogatella furcifera); цикадки (Deltocephalidae), такие как зеленая рисовая цикадка (Nephotettix cincticeps), зеленая рисовая цикадка (Nephotettix virescens) и зеленая чайная цикадка (Empoasca onukii); тли (Aphididae), такие как тля бахчевая (Aphis gossypii), тля персиковая зеленая (Myzus persicae), тля горчичная листовая (Brevicoryne brassicae), тля яблонная (Aphis spiraecola,Macrosiphum euphorbiae), тля картофельная обыкновенная (Aulacorthum solani), тля большая злаковая (Rhopalosiphum padi), тля тропическая цитрусовая (Toxoptera citricidus) и тля мучнистая сливовая (Hyalopterus pruni); щитники (Pentatomidae), такие как зеленый клоп-щитник обыкновенный (Nezara antennata), бобовый клоп (Riptortus clavetus,Leptocorisa chinensi, Eysarcoris parvus) и темно-мраморный клоп-щитник (Halyomorpha mista); белокрылки (Aleyrodidae), такие как белокрылка тепличная (Trialeurodes vaporariorum), табачная белокрылка (Bemisia tabaci), белокрылка магнолиевая (Bemisia argentifolii), белокрылка цитрусовая (Dialeurodes citri) и белокрылка цитрусовая шиповатая (Aleurocanthus spiniferus); щитовки (Coccidae), такие как щитовка красная померанцевая (Aonidiella aurantii), щитовка калифорнийская (Comstockaspis perniciosa), щитовка апельсиновая (Unaspis citri), рубиновая ложнощитовка (Ceroplastes rubens), червец австралийский желобчатый (Icerya purchasi, Planococcus kraunhiae, Pseudococcus longispinis) и щитовка тутовая (Pseudaulacaspis pentagona); кружевницы (Tingidae); псиллиды (Psyllidae) и т.д.
Чешуекрылые
Огневки (Pyralidae), такие как сверлильщик рисовый стеблевой (Chilo suppressalis), сверлильщик рисовый желтый (Tryporyza incertulas), листовертка рисовая (Cnaphalocrocis medinalis), огневка хлопковая (Notarcha derogata, Plodia interpunctella), мотылек кукурузный (Ostrinia furnacalis, Hellula undalis) и shibatsutoga (Pediasia teterrellus); совки, такие как совка табачная (Spodoptera litura), совка малая (Spodoptera exigua), совка рисовая (Pseudaletia separata), совка капустная (Mamestra brassicae), совка-ипсилон (Agrotis ipsilon), пяденица капустная (Plusia nigrisigna), виды Tricoplucia, виды Heliothis и виды Helicoverpa; белянки, такие как репная белянка (Pieris rapae); листовертки (Tortricidae), такие как виды Adoxophyes, плодожорка восточная персиковая (Grapholita molesta), плодожорка соевая (Leguminivora glycinivorella, Matsumuraeses azukivora), листовертка сетчатая (Adoxophyes orana fasciata), листовертка чайная малая (вид Adoxophyes), листовертка чайная (Homona magnanima), листовертка яблонная (Archips fuscocupreanus) и плодожорка яблонная (Cydia pomonella); моли-пестрянки, такие как листовертка чайная (Caloptilia theivora) и моль яблонная минирующая (Phyllonorycter ringoneella); садовые моли, такие как моль персиковая (Carposina niponensis); крохотки-моли (Lyonetiidae), такие как вид Lyonetia; волнянки (Lymantriidae), такие как вид Lymantria и вид Euproctis; горностаевые моли (Yponomeutidae), такие как моль капустная (Plutella xylostella); выемчатокрылые моли, такие как хлопковая моль (Pectinophora gossypiella) и картофельная моль (Phthorimaea operculella); медведицы, такие как американская белая бабочка (Hyphantria cunea); настоящие моли (Tineidae), такие как моль платяная (Tinea translucens) и моль комнатная (Tineola bisselliella) и т.д.
Бахромчатокрылые
Трипс цветочный западный (Frankliniella occidentalis, Thrips parmi), трипс чайный (Scirtothrips dorsalis, Thrips tabaci, Frankliniella intonsa) и т.д.
Двукрылые
Муха комнатная (Musca domestica), обычный комар (Culex popiens pallens), слепень (Tabanus trigonus), муха луковая (Hylemya antiqua), муха ростковая (Hylemya platura, Anopheles sinensis), минер ячменный (Agromyza oryzae), минер ячменный малый (Hydrelliagriseol, Chlorops oryzae), муха дынная (Dacus cucurbitae, Ceratitis capitata), американский змееподобный минер (Liriomyza trifolii, Liriomyza sativae, Chromatomyia horticola) и т.д.
Жесткокрылые
Божья коровка с двадцатью восемью пятнами (Epilachna vigintioctopunctata), листоед тыквенный (Aulacophora femoralis), жук-блошка полосатая (Phyllotreta striolata), листоед рисовый (Oulemaoryzae), долгоносик рисовый (Echinocnemus squameus), долгоносик рисовый водяной (Lissorhoptrus oryzophilus), долгоносик хлопковый (Anthonomus grandis), китайская зерновка (Callosobruchus chinensis, Sphenophorus venatus), хрущик японский (Popillia japonica), хрущ медный (Anomala cuprea), злаковый корневой червь (виды Diabrotica), колорадский жук (Leptinotarsa decemlineata), жуки-щелкуны (виды Agriotes), жук табачный (Lasioderma serricorne, Anthrenus verbasci), малый мучной хрущак (Tribolium castaneum), одноцветный древогрыз (Lyctus brunneus), белопятнистый усач (Anoplophora malasiaca), большой сосновый лубоед (Tomicus piniperda) и т.д.
Прямокрылые
Саранча перелетная (Locusta migratoria), медведки (Gryllotalpa africana, Oxya yazoensis, Oxya japonica) и т.д.
Перепончатокрылые
Пилильщик капустный (Athalia rosae, виды Acromyrmex), муравей огненный (виды Solenopsis) и т.д.
Нематоды
Рисовая листовая нематода (Aphelenchoides besseyi), нематода земляничных бутонов (Nothotylenchus acris), клубеньковая нематода южная (Meloidogyne incognita), клубеньковая нематода северная (Meloidogyne hapla), клубеньковая нематода яванская (Meloidogyne javanica), соевая цистообразующая нематода (Heterodera glycines), картофельная цистообразующая нематода (Globodera rostochiensis), кофейная корневая нематода (Pratylenchus coffeae), пшеничная корневая нематода (Pratylenchus neglectus) и т.д.
Тараканообразные
Таракан рыжий (Blattella germanica), дымчато-коричневый таракан (Periplaneta fuliginosa), таракан американский (Periplaneta americana), таракан коричневый (Periplaneta brunnea), таракан черный (Blattaorientalis) и т.д.
Клещи
Клещ паутинный (Tetranychidae), такой как клещ двупятнистый паутинный (Tetranychus urticae), клещ паутинный Кандзавы (Tetranychus kanzawai), клещ красный цитрусовый (Panonychus citri), клещ красный плодовый (Panonychus ulmi) и вид Oligonychus; галловые клещи (Eriophyidae), такие как pink citrus rust mite (Aculops pelekassi, Phyllocoptruta citri), tomato rust mite (Aculops lycopersici), purple tea mite (Calacarus carinatus), pink tea rust mite (Acaphylla theavagrans и Eriophyes chibaensis); клещи земляничные (Tarsonemidae), такие как оранжерейный прозрачный клещ (Polyphagotarsonemus latus); ложный паутинный клещ (Tenuipalpidae), такой как (Brevipalpusphoenicis); Tuckerellidae; иксодовые, такие как Haemaphysalis longicornis, Haemaphysalis flava, Dermacentor taiwanicus, Ixodes ovatus, клещ Шульце (Ixodes persulcatus, Boophilus microplus и Rhipicephalus sanguineus); акаридовые клещи (Acaridae), такие как зерновой клещ (Tyrophagus putrescentiae и Tyrophagussimilis); пироглифидовые клещи, такие как Dermatophagoides farinae и Dermatophagoides ptrenyssnus; Cheyletidae, такие как Cheyletus eruditus, Cheyletus malaccensis и Cheyletus moorei; Arachnida; и т.д.
Хотя композиция для борьбы с вредителями настоящего изобретения может представлять собой только соединение настоящего изобретения, соединение настоящего изобретения, как правило, формулируют в различные составы, например эмульгируемые концентраты, масляные составы, пудра, гранулы, смачивающиеся порошки, текучие концентраты, микрокапсулы, аэрозоли, составы для окуривания, ядовитые приманки, смолистые составы или т.п., смешивая соединение настоящего изобретения с инертным носителем, таким как твердый носитель, жидкий носитель и газообразный носитель, и необязательно, добавляя для формулирования поверхностно-активное вещество или другие вспомогательные средства. Такие составы, как правило, содержат соединение настоящего изобретения в количестве от 0,01 до 95% масс.
Твердый носитель, используемый для составления композиции, включает, например, тонкодисперсные порошки, гранулы глин (например, каолиновой глины, диатомовой земли, бентонита, глины Fubasami (Фубазами) и кислой глины), синтетический гидратированный диоксид кремния, различные виды талька, керамики и другие неорганические минералы (например, серицит, кварц, сера, активный уголь, карбонат кальция и гидратированный диоксид кремния) и химические удобрения (например, сульфат аммония, фосфат аммония, нитрат аммония, мочевина и хлорид аммония).
Жидкий носитель включает, например, воду, спирты (например, метанол, этанол, изопропиловый спирт, бутанол, гексанол, бензиловый спирт, этиленгликоль, пропиленгликоль и феноксиэтанол), кетоны (например, ацетон, метилэтилкетон и циклогексанон), ароматические углеводороды (например, толуол, ксилол, этилбензол, додецилбензол, фенилксилилэтан и метилнафталин), алифатические углеводороды (например, гексан, циклогексан, керосин и светлое масло), сложные эфиры (например, этилацетат, бутилацетат, изопропилмиристат, этилолеат, диизопропиладипат, диизобутиладипат и ацетат монометилового эфира пропиленгликоля), нитрилы (например, ацетонитрил и изобутиронитрил), простые эфиры (например, диизопропиловый простой эфир, 1,4-диоксан, простой диметиловый эфир этиленгликоля, простой диметиловый эфир диэтиленгликоля, простой монометиловый эфир диэтиленгликоля, простой монометиловый эфир пропиленгликоля, простой монометиловый эфир дипропиленгликоля и 3-метокси-3-метил-1-бутанол), амиды кислот (например, N,N-диметилформамид и N,N-диметилацетамид), галогенированные углеводороды (например, дихлорметан, трихлорэтан и тетрахлорид углерода), сульфоксиды (например, диметилсульфоксид), пропиленкарбонат и растительные масла (например, соевое масло и хлопковое масло).
Газообразный носитель включает, например, фторуглерод, газообразный бутан, LPG (сжиженный нефтяной газ), простой диметиловый эфир и диоксид углерода.
Поверхностно-активное вещество включает, например, неионные поверхностно-активные вещества, такие как простые алкиловые эфиры полиоксиэтилена, простые алкилариловые эфиры полиоксиэтилена, сложные эфиры полиэтиленгликоля и жирных кислот и т.д.; и анионные поверхностно-активные вещества, такие как алкилсульфонаты, алкилбензолсульфонаты, алкилсульфаты и т.д.
Другие вспомогательные средства для составления композиции включают, например, адгезионные средства, дисперсанты, красители и стабилизаторы. Их конкретные примеры представляют казеин, желатин, сахариды (например, крахмал, гуммиарабик, производные целлюлозы и альгиновую кислоту), производные лигнина, бентонит, синтетические водорастворимые полимеры [например, поли(виниловые спирты), поли(винилпирролидоны) и поли(акриловые кислоты)], PAP (кислый изопропилфосфат), BHT (2,6-ди-трет-бутил-4-метилфенол), BHA (смесь 2-трет-бутил-4-метоксифенола и 3-трет-бутил-4-метоксифенола) и т.д.
В способе борьбы с вредителями настоящего изобретения вредители, как правило, уничтожают, нанося композицию для борьбы с вредителями настоящего изобретения или прямо на вредителей, или на место обитания вредителей (например, растение, почва, домашний интерьер и животное).
В способе борьбы с вредителями настоящего изобретения соединения настоящего изобретения можно использовать как таковые, хотя в качестве используемого способа, как правило, применяют адаптированный способ, в котором соединение настоящего изобретения формулируют в указанную выше форму композиции для борьбы с вредителями настоящего изобретения и полученный состав применяют к вредителям или к их местам обитания по аналогичной методике, как в случае традиционных пестицидных композиций с приведением соединения в контакт с указанными выше вредителями, которые появляются, или обеспечением потребления соединения вредителями.
В качестве места обитания вредителей настоящего изобретения можно привести, например, рисовые поля, горные поля, фруктовые сады, непосевные площади и дома.
Способ применения включает, например, обработку опрыскиванием, почвенную обработку, протравливание семян и обработку гидропонных растворов.
В частности, обработка опрыскиванием настоящего изобретения представляет собой способ обработки, при котором уничтожающего эффекта против вредителей достигают путем обработки активным ингредиентом (соединение настоящего изобретения) поверхности растения или самих вредителей, например посредством нанесения на листья или на ствол.
Почвенная обработка представляет собой способ обработки, при котором активным ингредиентом обрабатывают почву, поливной раствор или т.п. с проникновением ингредиента через корень или т.п. в сельскохозяйственную культуру с защитой от повреждения (например, поедания) вредителями и, таким образом, сельскохозяйственную культуру защищают от повреждений вредителями. Конкретные примеры почвенной обработки представляют собой обработку посадочных лунок (например, нанесение в посадочные лунки и введение активного ингредиента в почву для обработки посадочных лунок), обработку нижних частей растений (например, нанесение на нижние части растений, введение активного ингредиента в почву у нижних частей растений, поливка нижних частей растений и обработка нижних частей растений в последней половине периода всходов/посадки), обработку посадочных борозд (например, нанесение в посадочные борозды и введение активного ингредиента в почву для посадочных борозд), обработку грядок (например, нанесение на грядки, введение активного ингредиента в почву грядок и обработка грядок в период вегетации), обработку грядок в посевной период (например, нанесение на грядки в посевной период и введение активного ингредиента в почву грядок в посевной период), общую обработку (например, общая обработка почвы и общее введение активного ингредиента в почву), внесение в почву (например, применение почвенных гранул в период вегетации, нанесение под кроны или вокруг ствола деревьев, нанесение на поверхность почвы, введение активного ингредиента в поверхность почвы, нанесение в посевные лунки, нанесение на земляные валики и нанесение на посевную поверхность), пропитывающую обработку (например, пропитка почвы, пропитка в период всходов/посадки дренажа, впрыск жидких химикатов, пропитка почвенных срезов, капельное орошение жидкими химикатами и внесение ядохимикатов с поливной водой), обработку ящиков для рассады (например, нанесение в ящики для рассады и пропитка ящиков для рассады), обработку лотков для рассады (например, нанесение в лотки для рассады и пропитка лотков для рассады), обработку грядок для рассады (например, нанесение в грядки для рассады и пропитка грядок для рассады, нанесение на орошаемые грядки для рассады и смачивание саженцев), обработку внесением в почву грядок (например, введение активного ингредиента в почву грядок и предпосевное введение активного ингредиента в почву грядок) и другие способы обработки (например, введение активного ингредиента в молдинги, запахивание, введение активного ингредиента в поверхностный слой почвы, введение активного ингредиента в почву в область выпадения дождя, обработка области насаждений, нанесение гранул corolla и введение активного ингредиента в смесь удобрений).
Протравливание семян представляет собой способ обработки, при котором уничтожающего эффекта против вредителей достигают посредством прямой обработки семян, семенных клубней, луковиц и т.п. сельскохозяйственных культур активным ингредиентом с защитой от повреждения (например, поедания) вредителями или обработки активным ингредиентом окружающего их пространства. Конкретные примеры протравливания семян представляют собой обработку продуванием, обработку нанесением покрытия, обработку пропитыванием, обработку импрегнацией, обработку обмазыванием, обработку нанесением пленки, обработку дражированием и т.д.
Обработка гидропонных растворов представляет собой способ обработки, при котором гидропонный раствор или т.п. обрабатывают активным ингредиентом для инфильтрации активного ингредиента через корень или т.п. в сельскохозяйственную культуру с защитой от повреждения (например, поедания) вредителями и, таким образом, сельскохозяйственную культуру защищают от повреждений вредителями. Конкретные примеры обработки гидропонных растворов представляют собой введение активного ингредиента в гидропонный раствор и смешивание активного ингредиента с гидропонным раствором.
Когда композицию для борьбы с вредителями настоящего изобретения используют для борьбы с вредителями в области агрономии, доза для ее нанесения, как правило, составляет от 1 до 10000 г (относительно соединения настоящего изобретения) на 10000 м2. Когда композиция для борьбы с вредителями настоящего изобретения представляет собой такой состав, как эмульгируемый концентрат, смачивающийся порошок, текучий концентрат или т.п., ее, как правило, наносят после разбавления, чтобы концентрация активного ингредиента составляла от 0,01 до 10000 ч./млн. Когда композиция для борьбы с вредителями представляет собой такой состав, как гранулы, пудра или т.п., ее применяют в неизменном виде.
Такой состав или разведенный состав в воде можно непосредственно наносить на вредителей или растения, такие как сельскохозяйственные культуры, для защиты от вредителей, или составом или разведенным составом в воде можно обрабатывать почву пахотных земель для борьбы с вредителями, живущими в почве.
Композицию для борьбы с вредителями настоящего изобретения также можно наносить таким способом, как обвивание слоями или нитями смолистых составов композиции вокруг сельскохозяйственной культуры, растягивая смолистый состав вокруг сельскохозяйственной культуры, или растягивание смолистого состава на почве у низа растений.
Когда композицию для борьбы с вредителями настоящего изобретения используют для борьбы с вредителями (например, мухами, комарами и тараканами), живущими в домах, доза ее нанесения, как правило, составляет от 0,01 до 1000 мг (относительно соединения настоящего изобретения) на м2 площади обработки в случае применения на поверхности и, как правило, составляет от 0,01 до 500 мг (относительно соединения настоящего изобретения) на м3 обрабатываемого пространства в случае применения на пространстве. Когда композиция для борьбы с вредителями настоящего изобретения представляет собой такой состав, как эмульгируемый концентрат, смачивающийся порошок, текучий концентрат или т.п., ее, как правило, наносят после разбавления, чтобы концентрация активного ингредиента составляла от 0,1 до 1000 ч./млн. Когда композиция для борьбы с вредителями представляет собой такой состав, как масляный состав, аэрозоль, состав для окуривания, ядовитая приманка или т.п., ее применяют в неизменном виде.
Соединение настоящего изобретения можно использовать в качестве инсектицида для таких посевных площадей, как горное поле, рисовое поле, газон, плодовый сад и т.д., и непосевных площадей. В некоторых случаях соединение настоящего изобретения может уничтожать насекомых-вредителей, например, на посевных площадях, где культивируют указанные ниже "сельскохозяйственные культуры" и т.п., без причинения химического повреждения сельскохозяйственным культурам и т.п.
Полевые культуры: кукуруза, рис, пшеница, ячмень, рожь, овес, сорго, хлопок, соя, арахис, гречиха, свекла, капуста, подсолнечник, сахарный тростник, табак и т.д.
Овощные культуры: пасленовые (например, баклажан, томат, зеленый перец, перец и картофель), тыквенные (например, огурец, тыква, цукини, арбуз и дыня), крестоцветные (например, дайкон, турнепс, хрен, кольраби, капуста китайская, капуста, сизая горчица, брокколи и цветная капуста), сложноцветные (например, лопух съедобный, хризантема овощная, артишок и латук), лилейные (например, лук дудчатый, лук, чеснок и спаржа), зонтичные (например, морковь, петрушка, сельдерей и пастернак), меревые (например, шпинат и свекла листовая), губоцветные (например, перилла, мята и базилик), земляника, батат, ямс китайский, таро и т.д.
Цветы и декоративные растения
Лиственные орнаментальные растения
Фруктовые деревья: семечковые (например, яблоко, груша, груша песчаная, китайская айва и айва), косточковые (например, персик, слива, нектарин, абрикос японский, вишня, абрикос и слива домашняя), цитрусовые (например, японский мандарин, апельсин, лимон, лайм и грейпфрут), орехоплодные деревья (например, каштан, грецкий орех, фундук, миндаль, фисташковое дерево, орех кешью и орех макадамия), ягоды (например, черника, клюква, ежевика и малина), виноград, хурма японская, оливки, локва, банан, кофе, финиковая пальма, кокосовая пальма и т.д.
Отличные от фруктовых деревья: чайное дерево, шелковица, цветковые деревья и кустарник, уличные деревья (японский ясень, береза, кизил флоридский, эвкалипт голубой, гинкго, сирень, клен, дуб, тополь, китайский багряник, тайваньское амбровое дерево, платан, дзелькова, японская туя, ель, тсуга разнолистная, можжевельник твёрдый, сосна, японская ель и тис дальневосточный) и т.д.
Указанные выше "сельскохозяйственные культуры" также включают сельскохозяйственные культуры с устойчивостью к гербицидам, таким как ингибиторы HPPD (например, изоксафлутол), ингибиторы ALS (например, имазетапил и тифенсульфонметил), ингибиторы EPSP-синтетазы, ингибиторы глутаминсинтетазы, бромоксинил и т.д., которые получают классическим способом скрещивания или технологии рекомбинантных генов.
В качестве "сельскохозяйственных культур" с устойчивостью, полученной классическим способом скрещивания, можно привести, например, Clearfield (зарегистрированное торговое название), устойчивую к имидазолиноновым гербицидам (например, имазетапилу) и STS-сою, устойчивую к гербицидам типа сульфонилкарбамидных ингибиторов ALS (например, канола и тифенсульфонметил). В качестве сельскохозяйственных культур с устойчивостью, полученной посредством технологии рекомбинантных генов, можно привести, например, культивары кукурузы, устойчивые к глифосату и глифозинату, и их уже продают под торговыми названиями RoundupReady (зарегистрированное торговое название) и LibertyLink (зарегистрированное торговое название).
Указанные выше "сельскохозяйственные культуры" также включают сельскохозяйственные культуры, у которых посредством технологии рекомбинантных генов обеспечен синтез известного селективного токсина, в случае, например, Bacillus.
В качестве токсина, продуцируемого в таких генетически модифицированных растениях, можно привести, например, инсектицидные белки, полученные из Bacillus cereus и Bacillus popilliae; инсектицидные белки, такие как δ-эндотоксины (например, Cry1Ab, Cry1Ac, Cry1F, Cry1Fa2, Cry2Ab, Cry3A, Cry3Bb1 и Cry9C), VIP1, VIP2, VIP3, VIP3A и т.д., которые получают из Bacillus thuringiensis; токсины, полученные из нематод; токсины, продуцируемые животными, такие как токсин скорпионов, токсин пауков, токсин пчел, специфичные для насекомых нейротоксины и т.д.; токсины нитевидных грибов; растительные лектины; агглютинин; ингибиторы протеаз, такие как ингибиторы трипсина, ингибиторы сериновых протеаз, пататин, цистатин, папаиновые ингибиторы и т.д.; инактивирующие рибосомы белки (RIP), такие как рицин, кукурузные RIP, абрин, руфин, саполин, приодин и т.д.; ферменты метаболизма стероидов, такие как 3-гидроксистероидоксидаза, экдистероид-УДФ-глюкозилтрансфераза, холестеролоксидаза и т.д.; ингибиторы экдизона; HMG-COA-редуктазу; ингибиторы ионных каналов, такие как ингибиторы натриевых каналов, ингибиторы кальциевых каналов и т.д.; эстеразу ювенильных гормонов; рецепторы диуретических гормонов; стильбенсинтетазу; дибензилсинтетазу; хитиназу и глюканазу.
Продуцируемые в таких генетически модифицированных сельскохозяйственных культурах токсины также включают гибридные токсины, частично недостаточные токсины и модифицированные токсины инсектицидных белков, такие как белки δ-эндотоксинов (например, Cry1Ab, Cry1Ac, Cry1F, Cry1Fa2, Cry2Ab, Cry3A, Cry3Bb1 и Cry9C), VIP1, VIP2, VIP3, VIP3A и т.д. Гибридные токсины получают посредством нового сочетания различных доменов таких белков посредством перехода к рекомбинантной технологии. В качестве частично недостаточного токсина известен Cry1Ab, недостаточный по части аминокислотной последовательности. В модифицированных токсинах заменяют одну или несколько аминокислот природного токсина.
Примеры таких токсинов и генетически модифицированных растений, способных к синтезу таких токсинов, описаны в EP-A-0374753, WO 93/07278, WO 95/34656, EP-A-0427529, EP-A-451878, WO 03/052073 и т.д.
Токсины, содержащиеся в таких генетически модифицированных растениях, придают растениям устойчивость к жесткокрылым насекомым-вредителям, двукрылым насекомым-вредителям и чешуекрылым насекомым-вредителям.
Уже известны генетически модифицированные растения, содержащие один или несколько инсектицидных генов устойчивости к насекомым и способные к продукции одного или нескольких токсинов, и некоторые из них находятся в продаже. В качестве таких генетически модифицированных растений можно привести, например, YieldGard (зарегистрированное торговое название) (культивар кукурузы, способный к продукции токсина Cry1Ab), YieldGard Rootworm (зарегистрированное торговое название) (культивар кукурузы, способный к продукции токсина Cry3Bb1), YieldGard Plus (зарегистрированное торговое название) (культивар кукурузы, способный к продукции токсинов Cry1Ab и Cry3Bb1), Herculex I (зарегистрированное торговое название) (культивар кукурузы, способный к продукции фосфинотризин-N-ацетилтрансферазы (PAT) с приданием устойчивости к токсину Cry1Fa2 и Glyfosinate), NuCOTN33B (зарегистрированное торговое название) (культивар хлопка, способный к продукции токсина Cry1Ac), Bollgard I (зарегистрированное торговое название) (культивар хлопка, способный к продукции токсина Cry1Ac), Bollgard II (зарегистрированное торговое название) (культивар хлопка, способный к продукции токсинов Cry1Ac и Cry2Ab), VIPCOT (зарегистрированное торговое название) (культивар хлопка, способный к продукции токсина VIP), NewLeaf (зарегистрированное торговое название) (культивар картофеля, способный к продукции токсина Cry3A), NatureGard (зарегистрированное торговое название), Agrisure (зарегистрированное торговое название), GT Advantage (свойства устойчивости к глифосату GA21), Agrisure (зарегистрированное торговое название), CB Advantage (свойства Bt11 зерновой точильщик (CB)) и Protecia (зарегистрированное торговое название).
Указанные выше "сельскохозяйственные культуры" также включают сельскохозяйственные культуры, способные продуцировать антипатогенное вещество с селективным действием, которое было придано посредством технологии рекомбинантных генов.
В качестве примеров антипатогенного вещества известны белки PR и т.п. (PRP, EP-A-0392225). Такие антипатогенные вещества и генетически модифицированные растения, способные к их продукции, описаны в EP-A-0392225, WO 95/33818, EP-A-0353191 и т.д.
В качестве таких антипатогенных веществ, продуцируемых генетически модифицированными растениями, можно привести, например, ингибиторы ионных каналов, такие как ингибиторы натриевых каналов, ингибиторы кальциевых каналов (например, известны токсины KP1, KP4 и KP6, продуцируемые вирусами) и т.д.; стильбенсинтетазы; дибензилсинтетазы; хитиназу; глюканазу; PR-белки и антипатогенные вещества, продуцируемые микроорганизмами, такие как пептидные антибиотики, антибиотики с гетероциклическим кольцом, белковые факторы, участвующие в устойчивости к заболеваниям растений (которые называют гены устойчивости к заболеваниям растений и которые описаны в WO 03/000906), и т.д.
Композиция для борьбы с вредителями настоящего изобретения может содержать другие средства для уничтожения вредных членистоногих, акарициды, нематоциды, фунгициды, гербициды, регуляторы роста растений, синергисты, удобрения, почвоулучшители, корм для животных и т.д.
Также возможно получать подходящим образом смешанный состав, смешивая соединение настоящего изобретения, например, с любым из других средств для борьбы с вредителями, таких как инсектициды, акарициды, нематоциды, фунгициды, препараты гормонов растений, регуляторы роста растений и гербициды (такие средства включают их изомеры и соли), синергисты, восстановители фитотоксичности, пигменты и удобрения, и использовать смешанный состав при опрыскивании, почвенной обработке и обработке гидропонных растворов.
В качестве активных ингредиентов указанных выше других средств для уничтожения вредных членистоногих, акарицидов и/или нематоцидов можно привести, например, следующие.
(1) Фосфорорганические соединения
Ацефат, фосфид алюминия, бутатиофос, кадузафоз, хлорэтоксифос, хлорфенвинфос, хлорпирифос, хлорпирифос-метил, цианофос:CYAP, диазинон, DCIP (простой дихлордиизопропиловый эфир), дихлофентион:ECP, дихлофос:DDVP, диметоат, диметилвинфос, дисульфотон, EPN, этион, этопрофос, этримфос, фентион:MPP, фенитротион:MEP, фостиазат, формотион, фосфин, изофенфос, изоксатион, малатион, мезульфенфос, метидатион:DMTP, монокротофос, налед:BRP, оксидепрофос:ESP, паратион, фосфалон, фосмет:PMP, пиримифос-метил, пиридафентион, квиналфос, фентоат:PAP, профенофос, пропафос, протиофос, пираклорфос, салитион, сульфрофос, тебупиримфос, темефос, тетрахлорвинфос, тербуфос, тиометон, трихлорфон:DEP, вамидотион и т.д.
(2) Карбаматные соединения
Аланикарб, бендиокарб, бенфуракарб, BPMC, карбарил, карбофуран, карбосульфан, клоэтокарб, этиофенкарб, фенобукарб, фенотиокарб, феноксикарб, фуратиокарб, изопрокарб:MIPC, метолкарб, метомил, метиокарб, NAC, оксамил, пиримикарб, пропоксур:PHC, XMC, тиодикарб, ксилилкарб и т.д.
(3) Синтетические пиретроидные соединения
Акринатрин, аллетрин, бенфлутрин, бета-цифлутрин, бифентрин, циклопротрин, цифлутрин, цигалотрин, циперметрин, дельтаметрин, эсфенвалерат, этофенпрокс, фенпропатрин, фенвалерат, флуцитринат, флуфенопрокс, флуметрин, флувалинат, хальфенпрокс, имипротрин, перметрин, праллетрин, пиретрины, ресметрин, сигма-циперметрин, силафлуофен, тефлутрин, тралометрин, трансфлутрин, 2,3,5,6-тетрафтор-4-(метоксиметил)бензил-(EZ)-(1RS,3RS;1RS,3SR)-2,2-диметил-3-проп-1-енилциклопропанкарбоксилат, 2,3,5,6-тетрафтор-4-метилбензил-(EZ)-(1RS,3RS;1RS,3SR)-2,2-диметил-3-проп-1-енилциклопропанкарбоксилат, 2,3,5,6-тетрафтор-4-(метоксиметил)бензил-(1RS,3RS;1RS,3SR)-2,2-диметил-3-(2-метил-1-пропенил)циклопропанкарбоксилат и т.д.
(4) Нереистоксиновые соединения
Картап, бенсультап, тиоциклам, моносультап, бисультап и т.д.
(5) Неоникотиноидные соединения
Имидаклоприд, нитренпирам, ацетамиприд, тиаметоксам, тиаклоприд, динотефуран, клотианидин и т.д.
(6) Соединения бензоилмочевины
Хлорфлуазурон, бистрифлурон, диафентиурон, дифлубензурон, флуазурон, флуциклоксурон, флуфеноксурон, гексафлумурон, луфенурон, новалурон, новифлумурон, тефлубензурон, трифлумурон и т.д.
(7) Фенилпиразоловые соединения
Ацетопрол, этиопрол, фипронил, ванилипрол, пирипрол, пирафлупрол и т.д.
(8) Инсектициды с Bt-токсином
Свежие споры и продуцированный кристаллический токсин, полученные из Bacillus thuringiensis, и их смесь.
(9) Гидразиновые соединения
Хромафенозид, галофенозид, метоксифенозид, тебуфенозид и т.д.
(10) Органические хлорсодержащие соединения
Алдрин, диелдрин, диенохлор, эндосульфан, метоксихлор и т.д.
(11) Природные инсектициды
Машинное масло, никотинсульфат и т.д.
(12) Другие инсектициды
Авермектин-B, бромопропилат, бупрофезин, хлорфенапил, ципромазин, D-D (1,3-дихлорпропен), эмамектин-бензоат, феназаквин, флупиразофос, гидропрен, индоксакарб, метоксадиазон, милбемицин-A, пиметрозин, пиридалил, пирипроксифен, спиносад, сульфлурамид, толфенпирад, триазамат, флубендиамид, SI-0009, цифлуметофен, мышьяковая кислота, бенклотиаз, цианамид кальция, полисульфид кальция, хлордан, DDT, DSP, флуфенерим, флоникамид, флуримфен, форметанат, метам-аммоний, метам-натрий, метилбромид, нидинотефуран, олеат калия, протрифенбут, спиромесифен, сера, метафлумизон, спиротетрамат и т.д.
Акарициды
Ацеквиноцил, амитраз, бензоксимат, бромпропилат, хинометионат, хлорбензилат, CPCBS (хлорфензон), клофентезин, диклофол, этоксазол, оксид фенбутатина, фенотиокарб, фенпироксимат, флуакрипирим, флупроксифен, гекситиазокс, пропаргит:BPPS, полинактины, пиридабен, пиримидифен, тебуфенпирад, тетрадифон, спиродиклофен, амидофлумет, бифеназат, цифлуметофен и т.д.
Нематоциды (ингредиенты с нематоцидальной активностью)
DCIP, фостиазат, левамизол, метилизотиоцианат, морантел тартарат и т.д.
[Примеры]
Настоящее изобретение проиллюстрировано в дополнительных подробностях следующими примерами получения, примерами составов и примерами тестирования, которые не следует рассматривать как ограничивающие объем настоящего изобретения.
Сначала приведены примеры получения соединения настоящего изобретения.
Пример получения 1
В 1 мл тетрагидрофурана растворяли 99 мг 3-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)анилина, полученного согласно справочному примеру получения 2, и 47 мг 3,3,3-трифторпропионилхлорида, по каплям при комнатной температуре добавляли 32 мг триэтиламина и перемешивали в течение 1 часа, затем полученной смеси давали возможность отстояться в течение 16 часов. К реакционной смеси добавляли воду, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 119 мг N-(3-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)фенил)-3,3,3-трифторпропиониламида (здесь и далее обозначаемого как соединение настоящего изобретения (1)).
Соединение настоящего изобретения (1):

1H-ЯМР (CDCl3) д: 7,92 (1H, т, J=1,7 Гц), 7,50-7,44 (7H, м), 4,09 (1H, д, J=17,4 Гц), 3,70 (1H, д, J=17,4 Гц), 3,27 (2H, кв, J=10,3 Гц).
Пример получения 2
В 1 мл тетрагидрофурана растворяли 99 мг 3-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)анилина, полученного согласно справочному примеру получения 2, и 52 мг 4,4,4-трифторбутаноилхлорида, по каплям при комнатной температуре добавляли 32 мг триэтиламина и перемешивали в течение 1 часа, затем полученной смеси давали возможность отстояться в течение 16 часов. К реакционной смеси добавляли воду, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 95 мг N-(3-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)фенил)-3,3,3-трифторбутаноиламида (здесь и далее обозначаемого как соединение настоящего изобретения (2)).
Соединение настоящего изобретения (2):

1H-ЯМР (CDCl3) д: 7,93 (1H, с), 7,50-7,47 (4H, м), 7,42-7,38 (2H, м), 7,29 (1H, ушир.с), 4,09 (1H, д, J=17,4 Гц), 3,70 (1H, д, J=17,4 Гц), 2,66-2,55 (4H, м).
Пример получения 3
В 2 мл тетрагидрофурана растворяли 200 мг 3-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)анилина, полученного согласно справочному примеру получения 2, и 47 мг 2,2,2-трихлорэтилхлорформиата, по каплям при комнатной температуре добавляли 54 мг триэтиламина и перемешивали в течение 6 часов. К реакционной смеси добавляли воду, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 263 мг N-(3-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)фенил)-2,2,2-трихлорэтилкарбамата (здесь и далее обозначаемого как соединение настоящего изобретения (3)).
Соединение настоящего изобретения (3):

1H-ЯМР (CDCl3) д: 7,83 (1H, с), 7,51-7,50 (2H, м), 7,47-7,38 (4H, м), 7,01 (1H, ушир.с), 4,84 (2H, с), 4,09 (1H, д, J=17,3 Гц), 3,70 (1H, д, J=17,3 Гц).
Пример получения 4
В 1 мл тетрагидрофурана растворяли 200 мг 3-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)анилина, полученного согласно справочному примеру получения 2, и 90 мг бензоилхлорида, по каплям при комнатной температуре добавляли 132 мг триэтиламина и перемешивали в течение 1 часа, затем полученной смеси давали возможность отстояться в течение 16 часов. К реакционной смеси добавляли воду, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 238 мг N-(3-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)фенил)бензамида (здесь и далее обозначаемого как соединение настоящего изобретения (4)).
Соединение настоящего изобретения (4):
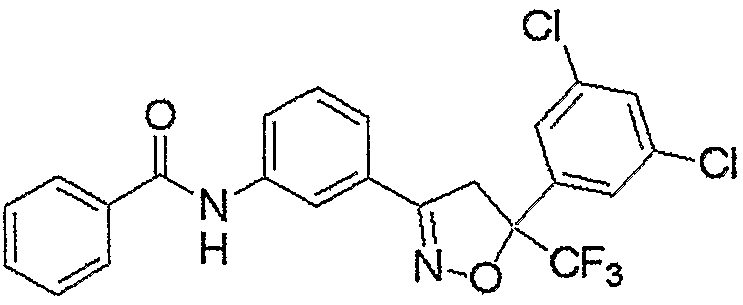
1H-ЯМР (CDCl3) д: 8,08 (1H, с), 7,92 (1H, ушир.с), 7,88 (2H, д, J=8,0 Гц), 7,67 (1H, дт, J=8,0, 1,0 Гц), 7,59-7,51 (6H, м), 7,44-7,42 (2H, м), 4,13 (1H, д, J=17,3 Гц), 3,74 (1H, д, J=17,3 Гц).
Пример получения 5
В 1 мл тетрагидрофурана растворяли 200 мг 3-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)анилина, полученного согласно справочному примеру получения 2, и 105 мг 4-цианобензоилхлорида, по каплям при комнатной температуре добавляли 132 мг триэтиламина и перемешивали в течение 30 минут. К реакционной смеси добавляли воду, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 210 мг N-(3-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)фенил)-4-цианобензамида (здесь и далее обозначаемого как соединение настоящего изобретения (5)).
Соединение настоящего изобретения (5):

1H-ЯМР (CDCl3) д: 8,06-8,05 (1H, м), 7,99-7,98 (3H, м), 7,82-7,80 (2H, м), 7,72-7,70 (1H, м), 7,50-7,44 (5H, м), 4,12 (1H, д, J=17,4 Гц), 3,73 (1H, д, J=17,4 Гц).
Пример получения 6
В 1 мл тетрагидрофурана растворяли 100 мг 3-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)анилина, полученного согласно справочному примеру получения 2, и 114 мг гидрохлорида пиколиноилхлорида, по каплям при комнатной температуре добавляли 130 мг триэтиламина и перемешивали в течение 20 минут. К реакционной смеси добавляли воду, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 210 мг N-(3-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)фенил)пиколиноиламида (здесь и далее обозначаемого как соединение настоящего изобретения (6)).
Соединение настоящего изобретения (6):

1H-ЯМР (CDCl3) д: 10,16 (1H, с), 8,64-8,63 (1H, м), 8,30 (1H, д, J=8,0 Гц), 8,21-8,21 (1H, м), 7,94 (1H, тд, J=7,7, 1,6 Гц), 7,78-7,76 (1H, м), 7,57-7,42 (6H, м), 4,16 (1H, д, J=17,1 Гц), 3,77 (1H, д, J=17,1 Гц).
Пример получения 7
В 1 мл тетрагидрофурана растворяли 200 мг 3-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)анилина, полученного согласно справочному примеру получения 2, и 113 мг 2-хлорникотиноилхлорида, по каплям при комнатной температуре добавляли 130 мг триэтиламина и перемешивали в течение 10 минут. К реакционной смеси добавляли воду, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 251 мг N-(3-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)фенил)-2-хлорникотинамида (здесь и далее обозначаемого как соединение настоящего изобретения (7)).
Соединение настоящего изобретения (7):

1H-ЯМР (CDCl3) д: 8,54 (1H, дд, J=4,8, 1,9 Гц), 8,38 (1H, ушир.с), 8,21 (1H, дд, J=7,7, 1,9 Гц), 8,06 (1H, т, J=1,7 Гц), 7,70-7,68 (1H, м), 7,56-7,41 (6H, м), 4,13 (1H, д, J=17,4 Гц), 3,74 (1H, д, J=17,4 Гц).
Пример получения 8
В 1 мл тетрагидрофурана растворяли 200 мг 3-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)анилина, полученного согласно справочному примеру получения 2, и 77 мг пивалоилхлорида, по каплям при комнатной температуре добавляли 64 мг триэтиламина и перемешивали в течение 1 часа. К реакционной смеси добавляли воду, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 215 мг N-(3-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)фенил)пивалоиламида (здесь и далее обозначаемого как соединение настоящего изобретения (8)).
Соединение настоящего изобретения (8):

1H-ЯМР (CDCl3) д: 8,02 (1H, т, J=1,8 Гц), 7,50-7,49 (4H, м), 7,41-7,37 (3H, м), 4,12 (1H, д, J=17,4 Гц), 3,72 (1H, д, J=17,4 Гц), 1,33 (9H, с).
Пример получения 9
В 1 мл тетрагидрофурана растворяли 200 мг 3-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)анилина, полученного согласно справочному примеру получения 2, и 58 мг акрилоилхлорида, по каплям при комнатной температуре добавляли 65 мг триэтиламина и перемешивали в течение 1 часа. К реакционной смеси добавляли воду, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 224 мг N-(3-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)фенил)акриламида (здесь и далее обозначаемого как соединение настоящего изобретения (9)).
Соединение настоящего изобретения (9):

1H-ЯМР (CDCl3) д: 8,04 (1H, с), 7,57-7,55 (1H, м), 7,52-7,49 (3H, м), 7,44-7,40 (1H, м), 7,38 (1H, д, J=8,0 Гц), 7,37 (1H, ушир.с), 6,47 (1H, дд, J=16,9, 1,2 Гц), 6,26 (1H, дд, J=16,9, 10,1 Гц), 5,83 (1H, дд, J=10,1, 1,2 Гц), 4,11 (1H, д, J=17,4 Гц), 3,72 (1H, д, J=17,4 Гц).
Пример получения 10
В 3 мл тетрагидрофурана растворяли 200 мг 3-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)анилина, полученного согласно справочному примеру получения 2, по каплям при комнатной температуре добавляли 76 мг фенилизоцианата и перемешивали в течение 1 часа. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 215 мг N-(3-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)фенил)-N'-фенилмочевины (здесь и далее обозначаемой как соединение настоящего изобретения (10)).
Соединение настоящего изобретения (10):

1H-ЯМР (CDCl3) д: 7,73 (1H, т, J=1,7 Гц), 7,48 (2H, д, J=1,7 Гц), 7,42-7,28 (8H, м), 7,15-7,13 (1H, м), 6,98 (1H, ушир.с), 6,82 (1H, ушир.с), 4,04 (1H, д, J=17,4 Гц), 3,64 (1H, д, J=17,4 Гц).
Пример получения 11
В 2 мл тетрагидрофурана растворяли 200 мг 3-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)анилина, полученного согласно справочному примеру получения 2, по каплям при комнатной температуре добавляли 87 мг фенилизотиоцианата и перемешивали в течение 1 часа. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 215 мг N-(3-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)фенил)-N'-фенилтиомочевины (здесь и далее обозначаемой как соединение настоящего изобретения (11)).
Соединение настоящего изобретения (11):

1H-ЯМР (CDCl3) д: 7,85 (1H, ушир.с), 7,81-7,78 (1H, м), 7,64 (1H, ушир.с), 7,58-7,34 (11H, м), 4,07 (1H, д, J=17,1 Гц), 3,69 (1H, д, J=17,1 Гц).
Пример получения 12
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 92 мг бензойной кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 178 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)бензамида (здесь и далее обозначаемого как соединение настоящего изобретения (12)).
Соединение настоящего изобретения (12):

1H-ЯМР (CDCl3) д: 8,31-8,31 (1H, м), 7,90-7,89 (2H, м), 7,74 (1H, ушир.с), 7,59-7,53 (6H, м), 7,42 (1H, т, J=1,8 Гц), 7,30 (1H, д, J=8,0 Гц), 4,14 (1H, д, J=17,3 Гц), 3,75 (1H, д, J=17,3 Гц), 2,39 (3H, с).
Пример получения 13
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 280 мг 2-фторбензойной кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 148 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-2-фторбензамида (здесь и далее обозначаемого как соединение настоящего изобретения (13)).
Соединение настоящего изобретения (13):
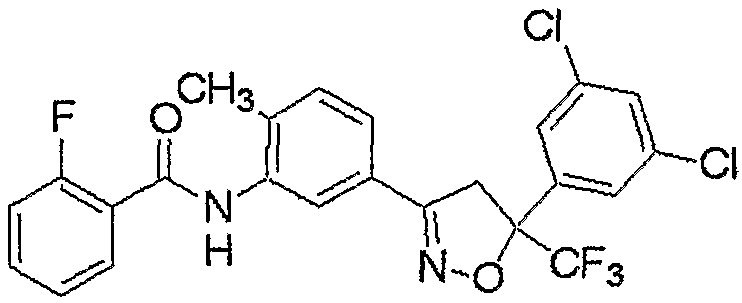
1H-ЯМР (CDCl3) д: 8,53 (1H, д, J=17,4 Гц), 8,44 (1H, д, J=1,5 Гц), 8,22 (1H, тд, J=8,0, 1,9 Гц), 7,60-7,53 (4H, м), 7,41 (1H, т, J=1,9 Гц), 7,37-7,35 (1H, м), 7,29 (1H, д, J=8,1 Гц), 7,22 (1H, ддд, J=12,6, 8,3, 1,0 Гц), 4,15 (1H, д, J=17,3 Гц), 3,75 (1H, д, J=17,3 Гц), 2,39 (3H, с).
Пример получения 14
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 280 мг 3-фторбензойной кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 209 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-3-фторбензамида (здесь и далее обозначаемого как соединение настоящего изобретения (14)).
Соединение настоящего изобретения (14):

1H-ЯМР (CDCl3) д: 8,23 (1H, д, J=1,8 Гц), 7,74 (1H, ушир.с), 7,66-7,56 (3H, м), 7,52-7,48 (3H, м), 7,42 (1H, т, J=1,9 Гц), 7,32-7,26 (2H, м), 4,12 (1H, д, J=17,3 Гц), 3,72 (1H, д, J=17,3 Гц), 2,38 (3H, с).
Пример получения 15
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 280 мг 4-фторбензойной кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 173 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-4-фторбензамида (здесь и далее обозначаемого как соединение настоящего изобретения (15)).
Соединение настоящего изобретения (15):

1H-ЯМР (CDCl3) д: 8,21 (1H, д, J=1,8 Гц), 7,91-7,89 (2H, м), 7,72 (1H, ушир.с), 7,55 (1H, дд, J=8,1, 1,8 Гц), 7,51 (2H, д, J=1,5 Гц), 7,41 (1H, т, J=1,8 Гц), 7,28 (1H, д, J=8,1 Гц), 7,22-7,16 (2H, м), 4,11 (1H, д, J=17,3 Гц), 3,72 (1H, д, J=17,3 Гц), 2,37 (3H, с).
Пример получения 16
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 313 мг 2-хлорбензойной кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 69 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-2-хлорбензамида (здесь и далее обозначаемого как соединение настоящего изобретения (16)).
Соединение настоящего изобретения (16):

1H-ЯМР (CDCl3) д: 8,35 (1H, с), 7,96 (1H, ушир.с), 7,86 (1H, дд, J=7,6, 1,6 Гц), 7,59 (1H, дд, J=7,6, 1,6 Гц), 7,53-7,40 (6H, м), 7,29 (1H, д, J=8,1 Гц), 4,14 (1H, д, J=17,3 Гц), 3,75 (1H, д, J=17,3 Гц), 2,39 (3H, с).
Пример получения 17
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 313 мг 3-хлорбензойной кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 278 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-3-хлорбензамида (здесь и далее обозначаемого как соединение настоящего изобретения (17)).
Соединение настоящего изобретения (17):

1H-ЯМР (CDCl3) д: 8,19 (1H, д, J=1,5 Гц), 7,87 (1H, т, J=1,9 Гц), 7,76-7,74 (2H, м), 7,57-7,41 (6H, м), 7,29 (1H, д, J=8,1 Гц), 4,11 (1H, д, J=17,4 Гц), 3,72 (1H, д, J=17,4 Гц), 2,38 (3H, с).
Пример получения 18
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 313 мг 4-хлорбензойной кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 179 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-4-хлорбензамида (здесь и далее обозначаемого как соединение настоящего изобретения (18)).
Соединение настоящего изобретения (18):

1H-ЯМР (CDCl3) д: 8,23 (1H, д, J=1,8 Гц), 7,84-7,81 (2H, м), 7,69 (1H, ушир.с), 7,57 (1H, дд, J=7,8, 1,8 Гц), 7,51-7,48 (4H, м), 7,41 (1H, т, J=1,9 Гц), 7,29 (1H, д, J=8,1 Гц), 4,12 (1H, д, J=17,4 Гц), 3,72 (1H, д, J=17,4 Гц), 2,37 (3H, с).
Пример получения 19
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 402 мг 3-бромбензойной кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 228 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-3-бромбензамида (здесь и далее обозначаемого как соединение настоящего изобретения (19)).
Соединение настоящего изобретения (19):

1H-ЯМР (CDCl3) д: 8,17 (1H, д, J=1,8 Гц), 8,03 (1H, т, J=1,8 Гц), 7,80-7,78 (1H, м), 7,75 (1H, ушир.с), 7,72-7,70 (1H, м), 7,56 (1H, дд, J=7,8, 1,8 Гц), 7,51 (2H, д, J=1,5 Гц), 7,41 (1H, т, J=1,9 Гц), 7,38 (1H, д, J=7,8 Гц), 7,29 (1H, д, J=8,1 Гц), 4,11 (1H, д, J=17,1 Гц), 3,72 (1H, д, J=17,1 Гц), 2,37 (3H, с).
Пример получения 20
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 402 мг 4-бромбензойной кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 192 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-4-бромбензамида (здесь и далее обозначаемого как соединение настоящего изобретения (20)).
Соединение настоящего изобретения (20):

1H-ЯМР (CDCl3) д: 8,23 (1H, д, J=1,8 Гц), 7,76-7,74 (2H, м), 7,69 (1H, ушир.с), 7,67-7,65 (2H, м), 7,57 (1H, дд, J=8,1, 1,8 Гц), 7,51 (2H, д, J=1,8 Гц), 7,41 (1H, т, J=1,8 Гц), 7,29 (1H, д, J=8,1 Гц), 4,12 (1H, д, J=17,3 Гц), 3,72 (1H, д, J=17,3 Гц), 2,37 (3H, с).
Пример получения 21
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 334 мг 2-нитробензойной кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 220 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-2-нитробензамида (здесь и далее обозначаемого как соединение настоящего изобретения (21)).
Соединение настоящего изобретения (21):

1H-ЯМР (CDCl3) д: 8,11-8,09 (2H, м), 7,76-7,74 (1H, м), 7,67-7,51 (6H, м), 7,42 (1H, т, J=1,8 Гц), 7,27 (1H, д, J=7,1 Гц), 4,12 (1H, д, J=17,1 Гц), 3,73 (1H, д, J=17,1 Гц), 2,33 (3H, с).
Пример получения 22
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 252 мг 2-пиколиновой кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов при комнатной температуре. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 73 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-2-пиколиламида (здесь и далее обозначаемого как соединение настоящего изобретения (22)).
Соединение настоящего изобретения (22):

1H-ЯМР (CDCl3) д: 10,23 (1H, ушир.с), 8,65-8,64 (1H, м), 8,58 (1H, д, J=1,8 Гц), 8,30 (1H, дт, J=7,8, 1,4 Гц), 7,95 (1H, тд, J=7,8, 1,6 Гц), 7,60 (1H, дд, J=8,0, 1,8 Гц), 7,54-7,53 (2H, м), 7,51 (1H, дд, J=4,8, 1,3 Гц), 7,41 (1H, т, J=1,8 Гц), 7,29 (1H, д, J=8,0 Гц), 4,17 (1H, д, J=17,2 Гц), 3,77 (1H, д, J=17,7 Гц), 2,47 (3H, с).
Пример получения 23
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 294 мг 3-цианобензойной кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 214 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-3-цианобензамида (здесь и далее обозначаемого как соединение настоящего изобретения (23)).
Соединение настоящего изобретения (23):

1H-ЯМР (CDCl3) д: 8,17-8,13 (3H, м), 7,87-7,85 (2H, м), 7,66 (1H, т, J=7,8 Гц), 7,55 (1H, дд, J=7,8, 1,8 Гц), 7,50 (2H, д, J=1,5 Гц), 7,42 (1H, т, J=1,8 Гц), 7,31 (1H, д, J=8,1 Гц), 4,10 (1H, д, J=17,0 Гц), 3,72 (1H, д, J=17,0 Гц), 2,38 (3H, с).
Пример получения 24
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 294 мг 4-цианобензойной кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 119 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-4-цианобензамида (здесь и далее обозначаемого как соединение настоящего изобретения (24)).
Соединение настоящего изобретения (24):

1H-ЯМР (CDCl3) д: 8,23 (1H, д, J=1,5 Гц), 8,00-7,98 (2H, м), 7,84-7,82 (2H, м), 7,70 (1H, ушир.с), 7,58 (1H, дд, J=7,8, 1,8 Гц), 7,51-7,51 (2H, м), 7,42 (1H, т, J=1,8 Гц), 7,32 (1H, д, J=8,1 Гц), 4,11 (1H, д, J=17,3 Гц), 3,72 (1H, д, J=17,3 Гц), 2,39 (3H, с).
Пример получения 25
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 400 мг 4-метилсульфонилбензойной кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 247 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-4-метилсульфонилбензамида (здесь и далее обозначаемого как соединение настоящего изобретения (25)).
Соединение настоящего изобретения (25):
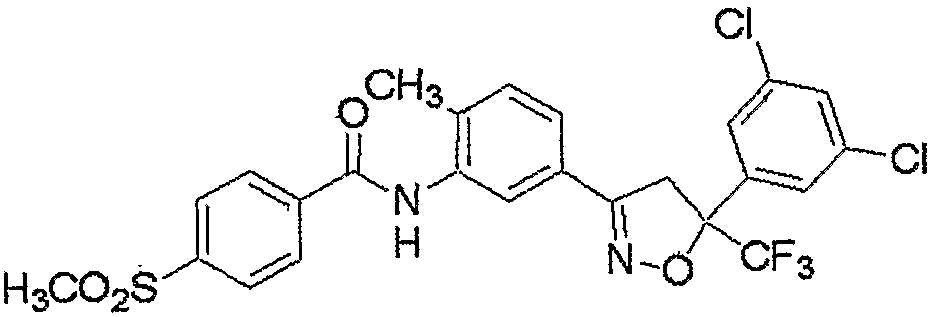
1H-ЯМР (CDCl3) д: 8,17 (1H, д, J=1,5 Гц), 8,08-8,03 (4H, м), 7,94 (1H, ушир.с), 7,55 (1H, дд, J=7,8, 1,8 Гц), 7,51-7,51 (2H, м), 7,42 (1H, т, J=1,9 Гц), 7,32 (1H, д, J=8,1 Гц), 4,12 (1H, д, J=17,4 Гц), 3,73 (1H, д, J=17,4 Гц), 3,10 (3H, с), 2,39 (3H, с).
Пример получения 26
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 272 мг 2-толуиловой кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 76 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-2-метилбензамида (здесь и далее обозначаемого как соединение настоящего изобретения (26)).
Соединение настоящего изобретения (26):

1H-ЯМР (CDCl3) д: 8,32 (1H, ушир.с), 7,57 (1H, дд, J=8,1, 1,8 Гц), 7,52-7,52 (3H, м), 7,41-7,38 (3H, м), 7,31-7,28 (3H, м), 4,14 (1H, д, J=17,3 Гц), 3,74 (1H, д, J=17,3 Гц), 2,55 (3H, с), 2,33 (3H, с).
Пример получения 27
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 272 мг 3-толуиловой кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 65 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-3-метилбензамида (здесь и далее обозначаемого как соединение настоящего изобретения (27)).
Соединение настоящего изобретения (27):

1H-ЯМР (CDCl3) д: 8,29 (1H, д, J=1,5 Гц), 7,73-7,71 (2H, м), 7,67-7,64 (1H, м), 7,58 (1H, дд, J=7,8, 1,8 Гц), 7,52 (2H, д, J=1,5 Гц), 7,42-7,40 (3H, м), 7,29 (1H, д, J=8,1 Гц), 4,13 (1H, д, J=17,2 Гц), 3,74 (1H, д, J=17,2 Гц), 2,45 (3H, с), 2,38 (3H, с).
Пример получения 28
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 272 мг 4-толуиловой кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 64 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-4-метилбензамида (здесь и далее обозначаемого как соединение настоящего изобретения (28)).
Соединение настоящего изобретения (28):

1H-ЯМР (CDCl3) д: 8,30 (1H, д, J=1,5 Гц), 7,80-7,77 (2H, м), 7,72 (1H, ушир.с), 7,58 (1H, дд, J=8,0, 1,9 Гц), 7,52 (2H, д, J=1,5 Гц), 7,41 (1H, т, J=1,8 Гц), 7,33-7,31 (2H, м), 7,28 (1H, д, J=8,1 Гц), 4,13 (1H, д, J=17,3 Гц), 3,74 (1H, д, J=17,3 Гц), 2,45 (3H, с), 2,38 (3H, с).
Пример получения 29
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 304 мг 3-анисовой кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 74 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-3-метоксибензамида (здесь и далее обозначаемого как соединение настоящего изобретения (29)).
Соединение настоящего изобретения (29):

1H-ЯМР (CDCl3) д: 8,30 (1H, д, J=1,8 Гц), 7,76 (1H, ушир.с), 7,58 (1H, дд, J=7,8, 1,8 Гц), 7,52-7,51 (2H, м), 7,45-7,40 (4H, м), 7,29 (1H, д, J=8,1 Гц), 7,14-7,11 (1H, м), 4,13 (1H, д, J=17,2 Гц), 3,89 (3H, с), 3,74 (1H, д, J=17,2 Гц), 2,38 (3H, с).
Пример получения 30
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 304 мг 4-анисовой кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 67 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-4-метоксибензамида (здесь и далее обозначаемого как соединение настоящего изобретения (30)).
Соединение настоящего изобретения (30):
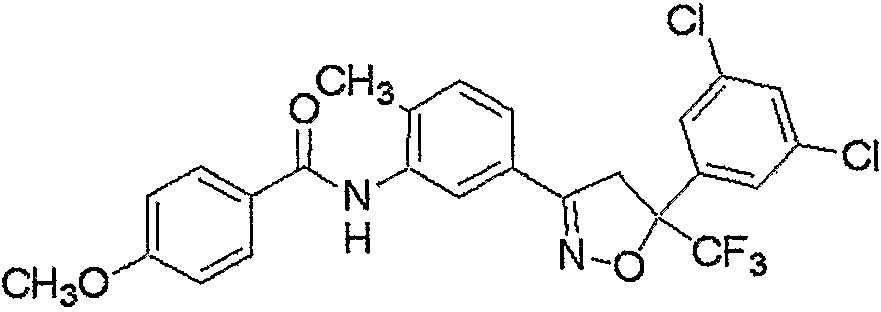
1H-ЯМР (CDCl3) д: 8,26 (1H, д, J=1,8 Гц), 7,87-7,84 (2H, м), 7,71 (1H, ушир.с), 7,56 (1H, дд, J=8,1, 1,8 Гц), 7,51-7,51 (2H, м), 7,41 (1H, т, J=1,8 Гц), 7,27 (1H, д, J=8,1 Гц), 7,01-6,98 (2H, м), 4,13 (1H, д, J=17,2 Гц), 3,89 (3H, с), 3,73 (1H, д, J=17,2 Гц), 2,37 (3H, с).
Пример получения 31
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 380 мг 4-трифторметилбензойной кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 204 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-4-трифторметилбензамида (здесь и далее обозначаемого как соединение настоящего изобретения (31)).
Соединение настоящего изобретения (31):

1H-ЯМР (CDCl3) д: 8,21 (1H, д, J=1,5 Гц), 8,00 (2H, д, J=8,1 Гц), 7,83 (1H, ушир.с), 7,78 (2H, д, J=8,3 Гц), 7,55 (1H, дд, J=7,8, 1,8 Гц), 7,51 (2H, д, J=1,5 Гц), 7,42 (1H, т, J=1,9 Гц), 7,29 (1H, д, J=8,1 Гц), 4,11 (1H, д, J=17,2 Гц), 3,72 (1H, д, J=17,2 Гц), 2,38 (3H, с).
Пример получения 32
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 452 мг 4-бензоилбензойной кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 261 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-4-бензоилбензамида (здесь и далее обозначаемого как соединение настоящего изобретения (32)).
Соединение настоящего изобретения (32):

1H-ЯМР (CDCl3) д: 8,30 (1H, д, J=1,5 Гц), 8,01-7,99 (2H, м), 7,95-7,92 (2H, м), 7,85-7,82 (2H, м), 7,79 (1H, ушир.с), 7,67-7,59 (2H, м), 7,54-7,51 (4H, м), 7,43-7,41 (1H, м), 7,32 (1H, д, J=8,3 Гц), 4,14 (1H, д, J=17,3 Гц), 3,75 (1H, д, J=17,3 Гц), 2,41 (3H, с).
Пример получения 33
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 315 мг 2-хлорникотиновой кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 174 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-2-хлорникотинамида (здесь и далее обозначаемого как соединение настоящего изобретения (33)).
Соединение настоящего изобретения (33):

1H-ЯМР (CDCl3) д: 8,55 (1H, дд, J=4,7, 1,9 Гц), 8,31-8,30 (3H, м), 7,57 (1H, дд, J=7,8, 1,5 Гц), 7,53-7,52 (2H, м), 7,45 (1H, дд, J=7,7, 4,7 Гц), 7,42 (1H, т, J=1,9 Гц), 7,31 (1H, д, J=7,8 Гц), 4,13 (1H, д, J=17,2 Гц), 3,74 (1H, д, J=17,2 Гц), 2,41 (3H, с).
Пример получения 34
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 315 мг 6-хлорникотиновой кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 303 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-6-хлорникотинамида (здесь и далее обозначаемого как соединение настоящего изобретения (34)).
Соединение настоящего изобретения (34):

1H-ЯМР (CDCl3) д: 8,88 (1H, д, J=2,0 Гц), 8,18 (1H, дд, J=8,3, 2,5 Гц), 8,13 (1H, д, J=1,5 Гц), 7,83 (1H, ушир.с), 7,54 (1H, дд, J=8,1, 1,8 Гц), 7,50-7,48 (3H, м), 7,42 (1H, т, J=1,9 Гц), 7,30 (1H, д, J=8,3 Гц), 4,10 (1H, д, J=17,3 Гц), 3,71 (1H, д, J=17,3 Гц), 2,37 (3H, с).
Пример получения 35
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 246 мг никотиновой кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 211 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)никотинамида (здесь и далее обозначаемого как соединение настоящего изобретения (35)).
Соединение настоящего изобретения (35):
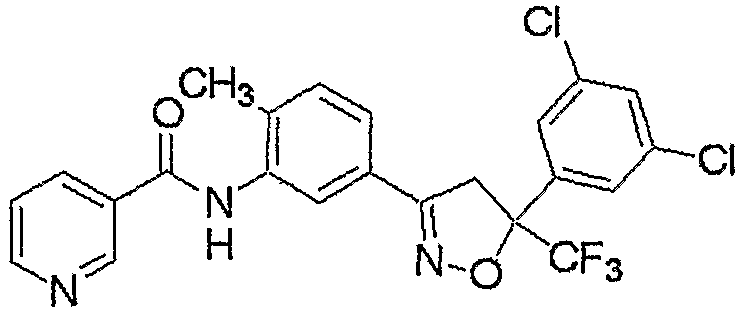
1H-ЯМР (CDCl3) д: 9,12 (1H, д, J=1,8 Гц), 8,79 (1H, дд, J=4,9, 1,6 Гц), 8,23 (1H, ддд, J=8,1, 2,3, 1,8 Гц), 8,16 (1H, д, J=1,5 Гц), 8,00 (1H, ушир.с), 7,54 (1H, дд, J=8,1, 1,8 Гц), 7,50 (2H, д, J=1,8 Гц), 7,47 (1H, ддд, J=7,8, 4,8, 0,8 Гц), 7,41 (1H, т, J=1,9 Гц), 7,30 (1H, д, J=8,1 Гц), 4,11 (1H, д, J=17,4 Гц), 3,72 (1H, д, J=17,4 Гц), 2,38 (3H, с).
Пример получения 36
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 92 мг муравьиной кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 144 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)формамида (здесь и далее обозначаемого как соединение настоящего изобретения (36)).
Соединение настоящего изобретения (36):
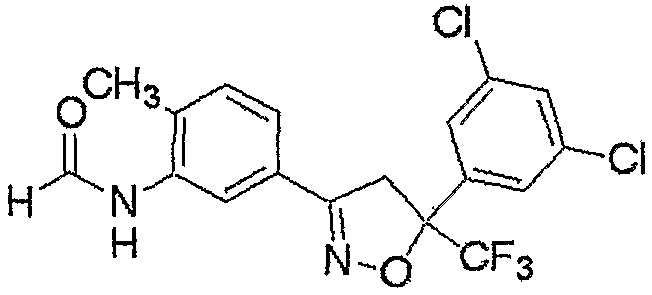
1H-ЯМР (CDCl3) д: 8,49 (1H, д, J=1,5 Гц), 8,24 (1H, д, J=1,8 Гц), 7,54 (1H, дд, J=7,7, 1,9 Гц), 7,51 (2H, с), 7,41 (1H, т, J=1,9 Гц), 7,26 (1H, д, J=7,8 Гц), 7,13 (1H, ушир.с), 4,07 (1H, д, J=17,4 Гц), 3,70 (1H, д, J=17,4 Гц), 2,33 (3H, с).
Пример получения 37
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 120 мг уксусной кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 181 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)ацетамида (здесь и далее обозначаемого как соединение настоящего изобретения (37)).
Соединение настоящего изобретения (37):

1H-ЯМР (CDCl3) д: 8,09 (1H, ушир.с), 7,52 (1H, д, J=1,8 Гц), 7,50 (2H, д, J=1,3 Гц), 7,41 (1H, т, J=1,8 Гц), 7,24 (1H, д, J=8,1 Гц), 7,01 (1H, ушир.с), 4,08 (1H, д, J=17,3 Гц), 3,69 (1H, д, J=17,3 Гц), 2,30 (3H, с), 2,23 (3H, с).
Пример получения 38
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 148 мг пропионовой кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 98 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)пропиониламида (здесь и далее обозначаемого как соединение настоящего изобретения (38)).
Соединение настоящего изобретения (38):

1H-ЯМР (CDCl3) д: 8,17 (1H, ушир.с), 7,53 (1H, дд, J=8,1, 1,8 Гц), 7,50 (2H, д, J=1,3 Гц), 7,41 (1H, т, J=1,9 Гц), 7,23 (1H, д, J=8,1 Гц), 7,01 (1H, с), 4,10 (1H, д, J=17,2 Гц), 3,70 (1H, д, J=17,2 Гц), 2,46 (2H, кв, J=7,5 Гц), 2,29 (3H, с), 1,28 (3H, т, J=7,5 Гц).
Пример получения 39
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 176 мг н-масляной кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 111 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-н-бутирамида (здесь и далее обозначаемого как соединение настоящего изобретения (39)).
Соединение настоящего изобретения (39):

1H-ЯМР (CDCl3) д: 8,16 (1H, ушир.с), 7,54-7,50 (3H, м), 7,41 (1H, т, J=1,9 Гц), 7,23 (1H, д, J=7,8 Гц), 7,03 (1H, ушир.с), 4,10 (1H, д, J=17,3 Гц), 3,70 (1H, д, J=17,3 Гц), 2,40 (2H, т, J=7,3 Гц), 2,29 (3H, с), 1,81-1,77 (2H, м), 1,04 (3H, т, J=7,3 Гц).
Пример получения 40
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 204 мг н-валериановой кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 129 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-н-валерамида (здесь и далее обозначаемого как соединение настоящего изобретения (40)).
Соединение настоящего изобретения (40):

1H-ЯМР (CDCl3) д: 8,18 (1H, ушир.с), 7,54-7,52 (3H, м), 7,41 (1H, т, J=1,9 Гц), 7,24 (1H, д, J=7,8 Гц), 6,97 (1H, ушир.с), 4,10 (1H, д, J=17,3 Гц), 3,70 (1H, д, J=17,3 Гц), 2,42 (2H, т, J=7,5 Гц), 2,30 (3H, с), 1,78-1,70 (2H, м), 1,46-1,42 (2H, м), 0,97 (3H, т, J=7,3 Гц).
Пример получения 41
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 176 мг изомасляной кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 141 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)изобутирамида (здесь и далее обозначаемого как соединение настоящего изобретения (41)).
Соединение настоящего изобретения (41):

1H-ЯМР (CDCl3) д: 8,19 (1H, ушир.с), 7,54 (1H, дд, J=8,1, 1,8 Гц), 7,51 (2H, д, J=1,5 Гц), 7,41 (1H, т, J=1,9 Гц), 7,23 (1H, д, J=8,1 Гц), 7,07 (1H, ушир.с), 4,10 (1H, д, J=17,3 Гц), 3,70 (1H, д, J=17,3 Гц), 2,64-2,54 (1H, м), 2,30 (3H, с), 1,30 (6H, дд, J=6,8, 1,5 Гц).
Пример получения 42
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 204 мг пивалиновой кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 55 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)пивалоиламида (здесь и далее обозначаемого как соединение настоящего изобретения (42)).
Соединение настоящего изобретения (42):

1H-ЯМР (CDCl3) д: 8,22 (1H, д, J=1,8 Гц), 7,56 (1H, дд, J=7,8, 1,8 Гц), 7,51 (2H, д, J=1,5 Гц), 7,41 (1H, т, J=1,8 Гц), 7,33 (1H, ушир.с), 7,23 (1H, д, J=8,1 Гц), 4,12 (1H, д, J=17,3 Гц), 3,71 (1H, д, J=17,3 Гц), 2,30 (3H, с), 1,36 (9H, с).
Пример получения 43
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 204 мг изовалериановой кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 116 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)изовалерамида (здесь и далее обозначаемого как соединение настоящего изобретения (43)).
Соединение настоящего изобретения (43):

1H-ЯМР (CDCl3) д: 8,16 (1H, ушир.с), 7,54-7,50 (3H, м), 7,41 (1H, т, J=1,9 Гц), 7,23 (1H, д, J=8,1 Гц), 7,00 (1H, ушир.с), 4,10 (1H, д, J=17,3 Гц), 3,70 (1H, д, J=17,3 Гц), 2,29 (3H, с), 2,28-2,18 (3H, м), 1,05 (6H, д, J=6,1 Гц).
Пример получения 44
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 284 мг 4,4,4-трифтормасляной кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 158 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-4,4,4-трифторбутирамида (здесь и далее обозначаемого как соединение настоящего изобретения (44)).
Соединение настоящего изобретения (44):

1H-ЯМР (CDCl3) д: 8,05 (1H, ушир.с), 7,52-7,49 (3H, м), 7,41 (1H, т, J=1,8 Гц), 7,24 (1H, д, J=7,8 Гц), 7,14 (1H, ушир.с), 4,07 (1H, д, J=17,3 Гц), 3,68 (1H, д, J=17,3 Гц), 2,70-2,54 (4H, м), 2,29 (3H, с).
Пример получения 45
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 312 мг 5,5,5-трифторвалериановой кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 164 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-5,5,5-трифторвалерамида (здесь и далее обозначаемого как соединение настоящего изобретения (45)).
Соединение настоящего изобретения (45):

1H-ЯМР (CDCl3) д: 8,11 (1H, ушир.с), 7,51-7,49 (3H, м), 7,41 (1H, т, J=1,9 Гц), 7,24 (1H, д, J=8,1 Гц), 7,09 (1H, ушир.с), 4,09 (1H, д, J=17,2 Гц), 3,69 (1H, д, J=17,2 Гц), 2,53 (2H, т, J=7,2 Гц), 2,29 (3H, с), 2,24-2,19 (2H, м), 2,05-2,02 (2H, м).
Пример получения 46
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 144 мг акриловой кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 106 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)акриламида (здесь и далее обозначаемого как соединение настоящего изобретения (46)).
Соединение настоящего изобретения (46):

1H-ЯМР (CDCl3) д: 8,21 (1H, ушир.с), 7,54 (1H, дд, J=7,8, 1,8 Гц), 7,50 (2H, д, J=1,5 Гц), 7,41 (1H, т, J=1,9 Гц), 7,24 (1H, д, J=8,1 Гц), 7,21 (1H, ушир.с), 6,47 (1H, дд, J=16,9, 1,2 Гц), 6,31 (1H, дд, J=16,9, 10,2 Гц), 5,82 (1H, дд, J=10,2, 1,2 Гц), 4,10 (1H, д, J=17,4 Гц), 3,70 (1H, д, J=17,4 Гц), 2,31 (3H, с).
Пример получения 47
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 280 мг 2-трифторметилакриловой кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 65 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-2-(трифторметил)акриламида (здесь и далее обозначаемого как соединение настоящего изобретения (47)).
Соединение настоящего изобретения (47):

1H-ЯМР (CDCl3) д: 8,19 (1H, д, J=1,8 Гц), 7,58 (1H, дд, J=8,1, 1,8 Гц), 7,56 (1H, ушир.с), 7,51-7,51 (2H, м), 7,41 (1H, т, J=1,8 Гц), 7,29 (1H, д, J=8,1 Гц), 6,77-6,76 (1H, м), 6,42-6,42 (1H, м), 4,10 (1H, д, J=17,3 Гц), 3,70 (1H, д, J=17,3 Гц), 2,32 (3H, с).
Пример получения 48
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 172 мг кротоновой кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 97 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)кротонамида (здесь и далее обозначаемого как соединение настоящего изобретения (48)).
Соединение настоящего изобретения (48):

1H-ЯМР (CDCl3) д: 8,23 (1H, ушир.с), 7,55 (1H, дд, J=8,0, 1,8 Гц), 7,51 (2H, д, J=1,3 Гц), 7,41 (1H, т, J=1,8 Гц), 7,24 (1H, д, J=8,0 Гц), 7,06-7,01 (1H, м), 6,95 (1H, ушир.с), 6,00 (1H, дд, J=15,2, 1,7 Гц), 4,10 (1H, д, J=17,3 Гц), 3,71 (1H, д, J=17,3 Гц), 2,31 (3H, с), 1,95 (3H, дд, J=6,8, 1,7 Гц).
Пример получения 49
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 296 мг циннамовой кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 163 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)циннамамида (здесь и далее обозначаемого как соединение настоящего изобретения (49)).
Соединение настоящего изобретения (49):

1H-ЯМР (CDCl3) д: 8,26 (1H, ушир.с), 7,78 (1H, д, J=15,4 Гц), 7,54-7,53 (3H, м), 7,51 (2H, д, J=1,5 Гц), 7,41 (1H, т, J=1,9 Гц), 7,39-7,38 (3H, м), 7,34 (1H, ушир.с), 7,24 (1H, д, J=8,1 Гц), 6,61 (1H, д, J=15,4 Гц), 4,11 (1H, д, J=17,3 Гц), 3,70 (1H, д, J=17,3 Гц), 2,34 (3H, с).
Пример получения 50
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 180 мг метоксиуксусной кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 98 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)метоксиацетамида (здесь и далее обозначаемого как соединение настоящего изобретения (50)).
Соединение настоящего изобретения (50):

1H-ЯМР (CDCl3) д: 8,31 (1H, ушир.с), 8,28 (1H, д, J=1,8 Гц), 7,54 (1H, дд, J=8,1, 1,8 Гц), 7,51 (2H, д, J=1,5 Гц), 7,41 (1H, т, J=1,8 Гц), 7,25 (1H, д, J=8,1 Гц), 4,10 (1H, д, J=17,3 Гц), 4,06 (2H, с), 3,71 (1H, д, J=17,3 Гц), 3,54 (3H, с), 2,31 (3H, с).
Пример получения 51
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 228 мг трифторуксусной кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 163 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)трифторацетамида (здесь и далее обозначаемого как соединение настоящего изобретения (51)).
Соединение настоящего изобретения (51):

1H-ЯМР (CDCl3) д: 8,05 (1H, д, J=1,5 Гц), 7,79 (1H, ушир.с), 7,61 (1H, дд, J=8,0, 1,6 Гц), 7,50 (2H, д, J=1,5 Гц), 7,42 (1H, т, J=1,9 Гц), 7,33 (1H, д, J=8,0 Гц), 4,08 (1H, д, J=17,3 Гц), 3,69 (1H, д, J=17,3 Гц), 2,35 (3H, с).
Пример получения 52
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 170 мг цианоуксусной кислоты, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 218 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)цианоацетамида (здесь и далее обозначаемого как соединение настоящего изобретения (52)).
Соединение настоящего изобретения (52):
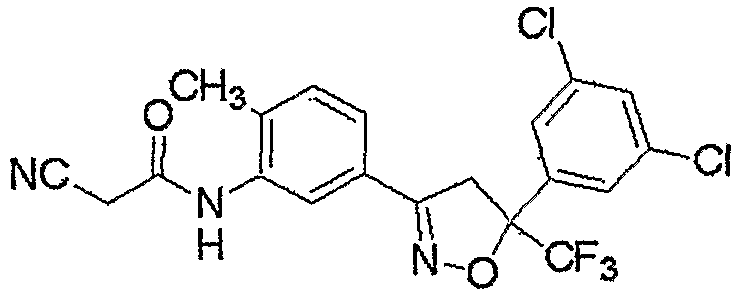
1H-ЯМР (CDCl3) д: 8,03 (1H, д, J=1,5 Гц), 7,79 (1H, ушир.с), 7,53 (1H, дд, J=8,1, 1,8 Гц), 7,50 (2H, д, J=1,5 Гц), 7,42 (1H, т, J=1,8 Гц), 7,28 (1H, д, J=8,1 Гц), 4,07 (1H, д, J=17,3 Гц), 3,68 (1H, д, J=17,3 Гц), 3,61 (2H, с), 2,34 (3H, с).
Пример получения 53
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 279 мг N,N-диметилглицингидрохлорида, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 28 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-(N,N-диметиламино)ацетамида (здесь и далее обозначаемого как соединение настоящего изобретения (53)).
Соединение настоящего изобретения (53):

1H-ЯМР (CDCl3) д: 9,34 (1H, ушир.с), 8,33 (1H, д, J=1,8 Гц), 7,54 (1H, дд, J=8,0, 1,8 Гц), 7,51 (2H, д, J=1,5 Гц), 7,41 (1H, т, J=1,8 Гц), 7,24 (1H, д, J=8,0 Гц), 4,11 (1H, д, J=17,4 Гц), 3,71 (1H, д, J=17,4 Гц), 3,13 (2H, с), 2,43 (6H, с), 2,31 (3H, с).
Пример получения 54
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 264 мг моноэтилмалоната, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 28 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)этоксикарбонилацетамида (здесь и далее обозначаемого как соединение настоящего изобретения (54)).
Соединение настоящего изобретения (54):

1H-ЯМР (CDCl3) д: 9,52 (1H, ушир.с), 8,28 (1H, д, J=1,5 Гц), 7,54 (1H, дд, J=8,0, 1,8 Гц), 7,51 (2H, д, J=1,5 Гц), 7,41 (1H, т, J=1,8 Гц), 7,25 (1H, д, J=8,0 Гц), 4,29 (2H, кв, J=7,2 Гц), 4,09 (1H, д, J=17,2 Гц), 3,70 (1H, д, J=17,2 Гц), 3,52 (2H, с), 2,37 (3H, с), 1,34 (3H, т, J=7,2 Гц).
Пример получения 55
В 1 мл N,N-диметилформамида растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 347 мг 2-пиридилуксусной кислоты гидрохлорида, при комнатной температуре добавляли 125 мг гидрохлорида 1-[3-(диэтиламино)пропил]-3-этилкарбодиимида и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 165 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-2-пиридилацетамида (здесь и далее обозначаемого как соединение настоящего изобретения (55)).
Соединение настоящего изобретения (55):

1H-ЯМР (CDCl3) д: 10,36 (1H, ушир.с), 8,62-8,61 (1H, м), 8,35 (1H, д, J=1,8 Гц), 7,73 (1H, тд, J=7,7, 1,8 Гц), 7,52-7,50 (3H, м), 7,40 (1H, т, J=1,9 Гц), 7,31-7,29 (2H, м), 7,21 (1H, д, J=8,1 Гц), 4,10 (1H, д, J=17,2 Гц), 3,93 (2H, с), 3,71 (1H, д, J=17,2 Гц), 2,34 (3H, с).
Пример получения 56
В 1 мл тетрагидрофурана растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 397 мг монометилтетрафталатхлорида, при комнатной температуре добавляли 101 мг триэтиламина и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 180 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-4-метоксикарбонилбензамида (здесь и далее обозначаемого как соединение настоящего изобретения (56)).
Соединение настоящего изобретения (56):

1H-ЯМР (CDCl3) д: 8,25 (1H, д, J=1,8 Гц), 8,19-8,17 (2H, м), 7,96-7,94 (2H, м), 7,79 (1H, ушир.с), 7,58 (1H, дд, J=8,0, 1,8 Гц), 7,51 (2H, д, J=1,5 Гц), 7,42 (1H, т, J=1,8 Гц), 7,30 (1H, д, J=8,0 Гц), 4,12 (1H, д, J=17,4 Гц), 3,97 (3H, с), 3,73 (1H, д, J=17,4 Гц), 2,39 (3H, с).
Пример получения 57
В 1 мл тетрагидрофурана растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 214 мг диметилкарбамоилхлорида, при комнатной температуре добавляли 101 мг триэтиламина и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 36 мг 3-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-1,1-диметилмочевины (здесь и далее обозначаемой как соединение настоящего изобретения (57)).
Соединение настоящего изобретения (57):

1H-ЯМР (CDCl3) д: 8,08 (1H, д, J=1,8 Гц), 7,50-7,48 (3H, м), 7,40 (1H, т, J=1,9 Гц), 7,20 (1H, д, J=8,1 Гц), 6,21 (1H, ушир.с), 4,12 (1H, д, J=17,2 Гц), 3,71 (1H, д, J=17,7 Гц), 3,07 (6H, с), 2,28 (3H, с).
Пример получения 58
В 1 мл тетрагидрофурана растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 266 мг 1-пирролидинкарбамоилхлорида, при комнатной температуре добавляли 101 мг триэтиламина и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 30 мг 1-(N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)аминокарбонил)пирролидина (здесь и далее обозначаемого как соединение настоящего изобретения (58)).
Соединение настоящего изобретения (58):

1H-ЯМР (CDCl3) д: 8,20 (1H, д, J=1,8 Гц), 7,50-7,49 (3H, м), 7,40 (1H, т, J=1,8 Гц), 7,19 (1H, д, J=8,1 Гц), 6,07 (1H, ушир.с), 4,13 (1H, д, J=17,4 Гц), 3,72 (1H, д, J=17,4 Гц), 3,50-3,49 (4H, м), 2,28 (3H, с), 2,03-2,01 (4H, м).
Пример получения 59
В 1 мл тетрагидрофурана растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 189 мг метилхлорформиата, при комнатной температуре добавляли 101 мг триэтиламина и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 22 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-O-метилкарбамата (здесь и далее обозначаемого как соединение настоящего изобретения (59)).
Соединение настоящего изобретения (59):

1H-ЯМР (CDCl3) д: 8,08 (1H, ушир.с), 7,51 (2H, д, J=1,5 Гц), 7,48 (1H, дд, J=7,9, 1,8 Гц), 7,41 (1H, т, J=1,8 Гц), 7,21 (1H, д, J=7,9 Гц), 6,47 (1H, ушир.с), 4,10 (1H, д, J=17,3 Гц), 3,81 (3H, с), 3,70 (1H, д, J=17,3 Гц), 2,28 (3H, с).
Пример получения 60
В 1 мл тетрагидрофурана растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 217 мг этилхлорформиата, при комнатной температуре добавляли 101 мг триэтиламина и перемешивали в течение 2 часов при комнатной температуре. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 83 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-O-этилкарбамата (здесь и далее обозначаемого как соединение настоящего изобретения (60)).
Соединение настоящего изобретения (60):

1H-ЯМР (CDCl3) д: 8,11 (1H, ушир.с), 7,51 (2H, д, J=1,3 Гц), 7,48 (1H, дд, J=8,0, 1,8 Гц), 7,41 (1H, т, J=1,8 Гц), 7,21 (1H, д, J=8,0 Гц), 6,46 (1H, ушир.с), 4,25 (2H, кв, J=7,1 Гц), 4,10 (1H, д, J=17,4 Гц), 3,70 (1H, д, J=17,4 Гц), 2,29 (3H, с), 1,34 (3H, т, J=7,1 Гц).
Пример получения 61
В 1 мл тетрагидрофурана растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 245 мг пропилхлорформиата, при комнатной температуре добавляли 101 мг триэтиламина и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 72 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-O-пропилкарбамата (здесь и далее обозначаемого как соединение настоящего изобретения (61)).
Соединение настоящего изобретения (61):

1H-ЯМР (CDCl3) д: 8,10 (1H, ушир.с), 7,51 (2H, д, J=1,5 Гц), 7,48 (1H, дд, J=8,0, 1,8 Гц), 7,41 (1H, т, J=1,8 Гц), 7,21 (1H, д, J=8,0 Гц), 6,46 (1H, ушир.с), 4,15 (2H, т, J=6,8 Гц), 4,10 (1H, д, J=17,2 Гц), 3,70 (1H, д, J=17,2 Гц), 2,29 (3H, с), 1,75-1,71 (2H, м), 1,00 (3H, т, J=7,3 Гц).
Пример получения 62
В 1 мл тетрагидрофурана растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 273 мг бутилхлорформиата, при комнатной температуре добавляли 101 мг триэтиламина и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 49 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-O-бутилкарбамата (здесь и далее обозначаемого как соединение настоящего изобретения (62)).
Соединение настоящего изобретения (62):

1H-ЯМР (CDCl3) д: 8,10 (1H, ушир.с), 7,51 (2H, д, J=1,3 Гц), 7,48 (1H, дд, J=8,1, 1,8 Гц), 7,41 (1H, т, J=1,8 Гц), 7,21 (1H, д, J=8,1 Гц), 6,45 (1H, ушир.с), 4,20 (2H, т, J=6,7 Гц), 4,10 (1H, д, J=17,2 Гц), 3,70 (1H, д, J=17,2 Гц), 2,29 (3H, с), 1,72-1,65 (2H, м), 1,48-1,39 (2H, м), 0,97 (3H, т, J=7,5 Гц).
Пример получения 63
В 1 мл тетрагидрофурана растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 245 мг изопропилхлорформиата, при комнатной температуре добавляли 101 мг триэтиламина и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 12 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-O-изопропилкарбамата (здесь и далее обозначаемого как соединение настоящего изобретения (63)).
Соединение настоящего изобретения (63):

1H-ЯМР (CDCl3) д: 8,13 (1H, ушир.с), 7,51 (2H, д, J=1,3 Гц), 7,47 (1H, дд, J=8,0, 1,8 Гц), 7,41 (1H, т, J=1,8 Гц), 7,20 (1H, д, J=8,0 Гц), 6,42 (1H, ушир.с), 5,08-4,99 (1H, м), 4,11 (1H, д, J=17,4 Гц), 3,70 (1H, д, J=17,4 Гц), 2,29 (3H, с), 1,34 (3H, д, J=2,3 Гц), 1,32 (3H, д, J=2,3 Гц).
Пример получения 64
В 1 мл тетрагидрофурана растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 273 мг изобутилхлорформиата, при комнатной температуре добавляли 101 мг триэтиламина и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 83 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-O-изобутилкарбамата (здесь и далее обозначаемого как соединение настоящего изобретения (64)).
Соединение настоящего изобретения (64):
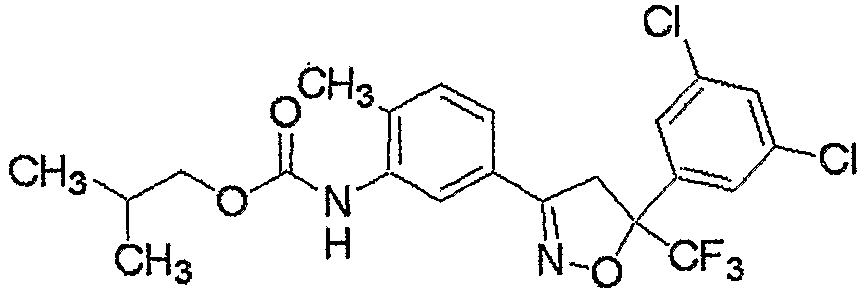
1H-ЯМР (CDCl3) д: 8,09 (1H, ушир.с), 7,51 (2H, д, J=1,3 Гц), 7,48 (1H, дд, J=8,0, 1,8 Гц), 7,41 (1H, т, J=1,8 Гц), 7,21 (1H, д, J=8,0 Гц), 6,47 (1H, ушир.с), 4,10 (1H, д, J=17,2 Гц), 3,98 (2H, д, J=6,6 Гц), 3,70 (1H, д, J=17,2 Гц), 3,29-3,27 (1H, м), 2,30 (3H, с), 0,98 (6H, д, J=6,8 Гц).
Пример получения 65
В 1 мл тетрагидрофурана растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 241 мг аллилхлорформиата, при комнатной температуре добавляли 101 мг триэтиламина и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 134 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-O-аллилкарбамата (здесь и далее обозначаемого как соединение настоящего изобретения (65)).
Соединение настоящего изобретения (65):
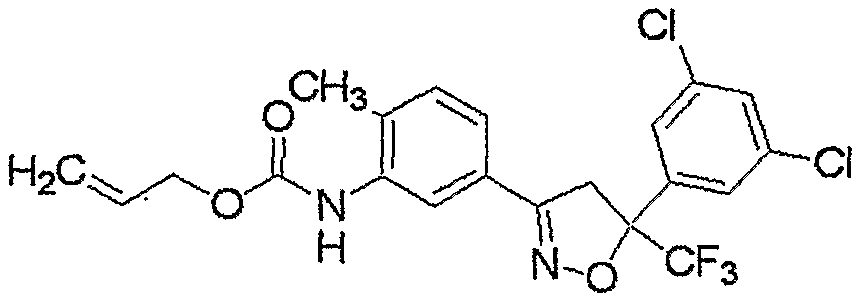
1H-ЯМР (CDCl3) д: 8,09 (1H, ушир.с), 7,51 (2H, д, J=1,3 Гц), 7,48 (1H, дд, J=8,0, 1,8 Гц), 7,41 (1H, т, J=1,8 Гц), 7,21 (1H, д, J=8,0 Гц), 6,52 (1H, ушир.с), 5,99 (1H, ддт, J=17,2, 10,4, 5,8 Гц), 5,39 (1H, дкв, J=17,2, 1,4 Гц), 5,30 (1H, дкв, J=10,4, 1,4 Гц), 4,69 (2H, дт, J=5,8, 1,4 Гц), 4,10 (1H, д, J=17,3 Гц), 3,70 (1H, д, J=17,3 Гц), 2,29 (3H, с).
Пример получения 66
В 1 мл тетрагидрофурана растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 286 мг 2-хлорэтилхлорформиата, при комнатной температуре добавляли 101 мг триэтиламина и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 144 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-O-(2-хлорэтил)карбамата (здесь и далее обозначаемого как соединение настоящего изобретения (66)).
Соединение настоящего изобретения (66):

1H-ЯМР (CDCl3) д: 8,08-8,05 (1H, ушир.м), 7,51 (2H, д, J=1,5 Гц), 7,48 (1H, дд, J=8,0, 1,8 Гц), 7,41 (1H, т, J=1,8 Гц), 7,23 (1H, д, J=8,0 Гц), 6,57 (1H, ушир.с), 4,47-4,44 (2H, м), 4,10 (1H, д, J=17,3 Гц), 3,78-3,75 (2H, м), 3,70 (1H, д, J=17,3 Гц), 2,31 (3H, с).
Пример получения 67
В 1 мл тетрагидрофурана растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 423 мг (2,2,2-трихлорэтил)хлорформиата, при комнатной температуре добавляли 101 мг триэтиламина и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 293 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-O-(2,2,2-трихлорэтил)карбамата (здесь и далее обозначаемого как соединение настоящего изобретения (67)).
Соединение настоящего изобретения (67):

1H-ЯМР (CDCl3) д: 8,04 (1H, ушир.с), 7,51-7,49 (3H, м), 7,41 (1H, т, J=1,9 Гц), 7,26 (1H, д, J=8,1 Гц), 6,72 (1H, ушир.с), 4,85 (2H, с), 4,09 (1H, д, J=17,3 Гц), 3,69 (1H, д, J=17,3 Гц), 2,34 (3H, с).
Пример получения 68
В 1 мл тетрагидрофурана растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 277 мг (2-метоксиэтил)хлорформиата, при комнатной температуре добавляли 101 мг триэтиламина и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 142 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-O-(2-метоксиэтил)карбамата (здесь и далее обозначаемого как соединение настоящего изобретения (68)).
Соединение настоящего изобретения (68):

1H-ЯМР (CDCl3) д: 8,11 (1H, ушир.с), 7,51 (2H, д, J=1,5 Гц), 7,48 (1H, дд, J=8,0, 1,8 Гц), 7,41 (1H, т, J=1,8 Гц), 7,21 (1H, д, J=8,0 Гц), 6,58 (1H, ушир.с), 4,37-4,35 (2H, м), 4,10 (1H, д, J=17,3 Гц), 3,70 (1H, д, J=17,3 Гц), 3,68-3,66 (2H, м), 3,43 (3H, с), 2,28 (3H, с).
Пример получения 69
В 1 мл тетрагидрофурана растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 341 мг бензилхлорформиата, при комнатной температуре добавляли 101 мг триэтиламина и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 44 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-O-бензилкарбамата (здесь и далее обозначаемого как соединение настоящего изобретения (69)).
Соединение настоящего изобретения (69):

1H-ЯМР (CDCl3) д: 7,50 (2H, д, J=1,5 Гц), 7,41-7,29 (7H, м), 7,10 (1H, д, J=7,6 Гц), 7,01 (1H, д, J=1,5 Гц), 6,83 (1H, дд, J=7,6, 1,5 Гц), 4,39 (2H, д, J=4,5 Гц), 4,02 (1H, д, J=17,5 Гц), 3,62 (1H, д, J=17,5 Гц), 2,18 (3H, с).
Пример получения 70
В 1 мл тетрагидрофурана растворяли 195 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина, полученного согласно справочному примеру получения 5, и 313 мг фенилхлорформиата, при комнатной температуре добавляли 101 мг триэтиламина и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 69 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-O-фенилкарбамата (здесь и далее обозначаемого как соединение настоящего изобретения (70)).
Соединение настоящего изобретения (70):

1H-ЯМР (CDCl3) д: 8,15 (1H, ушир.с), 7,56 (1H, дд, J=8,0, 1,5 Гц), 7,48 (2H, д, J=1,5 Гц), 7,45-7,39 (3H, м), 7,29-7,26 (2H, м), 7,22-7,19 (2H, м), 6,85 (1H, ушир.с), 4,07 (1H, д, J=17,3 Гц), 3,67 (1H, д, J=17,3 Гц), 2,38 (3H, с).
Пример получения 71
В 3 мл тетрагидрофурана растворяли 420 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-этиланилина, полученного согласно справочному примеру получения 28, и 183 мг 3,3,3-трифторпропионилхлорида, при комнатной температуре добавляли 126 мг триэтиламина и перемешивали в течение 1 часа. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 392 мг N-(3-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-6-этилфенил)-3,3,3-трифторпропиониламида (здесь и далее обозначаемого как соединение настоящего изобретения (71)).
Соединение настоящего изобретения (71):

1H-ЯМР (CDCl3) д: 8,01 (1H, д, J=1,8 Гц), 7,58 (1H, дд, J=8,0, 1,8 Гц), 7,50 (2H, д, J=1,4 Гц), 7,42 (1H, т, J=1,8 Гц), 7,38 (1H, ушир.с), 7,29 (1H, д, J=8,0 Гц), 4,08 (1H, д, J=17,4 Гц), 3,68 (1H, д, J=17,4 Гц), 3,31 (2H, кв, J=10,5 Гц), 2,62 (2H, кв, J=7,5 Гц), 1,24 (3H, т, J=7,5 Гц).
Пример получения 72
В 3 мл N,N-диметилформамида растворяли 80 мг N-(3,3,3-трифторпропионил)-2-метил-3-гидроксииминометиланилина, полученного согласно справочному примеру получения 9, и 43 мг N-хлорсукцинимида и полученный раствор перемешивали при 50°C в течение 30 минут. Реакционный раствор охлаждали до комнатной температуры, добавляли 78 мг 2-(3,5-дихлорфенил)-3,3,3-трифтор-1-пропена, затем 33 мг триэтиламина и перемешивали в течение 15 часов. К реакционной смеси добавляли воду, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 80 мг N-(3-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-3,3,3-трифторпропиониламида (здесь и далее обозначаемого как соединение настоящего изобретения (72)).
Соединение настоящего изобретения (72):

1H-ЯМР (CDCl3) д: 7,71 (1H, д, J=8,0 Гц), 7,50-7,50 (2H, м), 7,44-7,44 (1H, м), 7,38 (1H, ушир.с), 7,29-7,27 (1H, м), 7,18 (1H, д, J=7,5 Гц), 4,07 (1H, д, J=17,4 Гц), 3,71 (1H, д, J=17,6 Гц), 3,31 (2H, кв, J=10,5 Гц), 2,38 (3H, с).
Пример получения 73
В 6 мл N,N-диметилформамида растворяли 146 мг N-(3,3,3-трифторпропионил)-2-хлор-3-гидроксииминометиланилина, полученного согласно справочному примеру получения 12, и 98 мг N-хлорсукцинимида и полученный раствор перемешивали при 50°C в течение 30 минут. Реакционный раствор охлаждали до комнатной температуры, добавляли 240 мг 2-(3,5-дихлорфенил)-3,3,3-трифтор-1-пропена, затем 90 мг триэтиламина и перемешивали в течение 15 часов. К реакционной смеси добавляли воду, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 245 мг N-(3-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-хлорфенил)-3,3,3-трифторпропиониламида (здесь и далее обозначаемого как соединение настоящего изобретения (73)).
Соединение настоящего изобретения (73):

1H-ЯМР (CDCl3) д: 8,44 (1H, дд, J=7,6, 2,1 Гц), 7,94 (1H, с), 7,49-7,49 (2H, м), 7,45-7,45 (1H, м), 7,39-7,35 (2H, м), 4,19 (1H, д, J=17,6 Гц), 3,78 (1H, д, J=17,6 Гц), 3,34 (2H, кв, J=10,4 Гц).
Пример получения 74
В 2,5 мл N,N-диметилформамида растворяли 300 мг N-(3,3,3-трифторпропионил)-5-метил-3-гидроксииминометиланилина, полученного согласно справочному примеру получения 17, и 154 мг N-хлорсукцинимида и полученный раствор перемешивали при 50°C в течение 30 минут. Реакционный раствор охлаждали до комнатной температуры, добавляли 277 мг 2-(3,5-дихлорфенил)-3,3,3-трифтор-1-пропена, затем 116 мг триэтиламина и перемешивали в течение 20 часов. К реакционной смеси добавляли воду, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 151 мг N-(3-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-5-метилфенил)-3,3,3-трифторпропиониламида (здесь и далее обозначаемого как соединение настоящего изобретения (74)).
Соединение настоящего изобретения (74):

1H-ЯМР (CDCl3) д: 7,71-7,70 (1H, м), 7,44-7,39 (6H, м), 4,23-4,08 (1H, м), 3,83-3,69 (1H, м), 3,27-3,22 (2H, м), 2,39 (3H, с).
Пример получения 75
К 1 мл диметилформамида добавляли 55 мг N-(3,3,3-трифторпропионил)-2-метил-5-гидроксииминометиланилина, полученного согласно справочному примеру получения 21, и 30 мг N-хлорсукцинимида и полученную смесь перемешивали при 50°C в течение 1 часа. Реакционный раствор охлаждали до комнатной температуры, добавляли 54 мг 2-(3,5-дихлорфенил)-3,3,3-трифтор-1-пропена, затем 23 мг триэтиламина и перемешивали в течение 6 часов. К реакционной смеси добавляли воду, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 75 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилфенил)-3,3,3-трифторпропиониламида (здесь и далее обозначаемого как соединение настоящего изобретения (75)).
Соединение настоящего изобретения (75):

1H-ЯМР (CDCl3) д: 8,05 (1H, с), 7,57-7,55 (1H, м), 7,50 (2H, с), 7,42-7,41 (1H, м), 7,29 (2H, с), 4,08 (1H, д, J=17,1 Гц), 3,69 (1H, д, J=17,1 Гц), 3,31 (2H, кв, J=10,5 Гц), 2,31 (3H, с).
Пример получения 76
В 2 мл тетрагидрофурана растворяли 250 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-фторанилина, полученного согласно справочному примеру получения 24, и 93 мг 3,3,3-трифторпропионилхлорида, при комнатной температуре добавляли 64 мг триэтиламина и перемешивали в течение 6 часов. К реакционной смеси добавляли воду, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 265 мг N-(3-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-6-фторфенил)-3,3,3-трифторпирониламида (здесь и далее обозначаемого как соединение настоящего изобретения (76)).
Соединение настоящего изобретения (76):

1H-ЯМР (CDCl3) д: 8,53 (1H, дд, J=7,4, 2,1 Гц), 7,66-7,64 (2H, м), 7,51-7,50 (2H, м), 7,42 (1H, т, J=1,7 Гц), 7,20 (1H, дд, J=10,4, 8,7 Гц), 4,09 (1H, д, J=17,1 Гц), 3,70 (1H, д, J=17,4 Гц), 3,32 (2H, кв, J=10,2 Гц).
Пример получения 77
В 2 мл тетрагидрофурана растворяли 260 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-хлоранилина, полученного согласно справочному примеру получения 26, и 93 мг 3,3,3-трифторпропионилхлорида, при комнатной температуре добавляли 64 мг триэтиламина и перемешивали в течение 6 часов. К реакционной смеси добавляли воду, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 78 мг N-(3-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-6-хлорфенил)-3,3,3-трифторпирониламида (здесь и далее обозначаемого как соединение настоящего изобретения (77)).
Соединение настоящего изобретения (77):

1H-ЯМР (CDCl3) д: 8,55 (1H, д, J=1,8 Гц), 7,93 (1H, с), 7,63 (1H, дд, J=8,5, 1,8 Гц), 7,51-7,42 (4H, м), 4,09 (1H, д, J=17,3 Гц), 3,70 (1H, д, J=17,3 Гц), 3,35 (2H, кв, J=10,1 Гц).
Пример получения 78
В 13 мл N,N-диметилформамида растворяли 390 мг N-(5-гидроксилиминометил-2-метоксифенил)-3,3,3-трифторпропиониламида, полученного согласно справочному примеру получения 31, при комнатной температуре добавляли 392 мг N-хлорсукцинимида и перемешивали при 60°C в течение 1 часа. Реакционный раствор охлаждали до комнатной температуры, при комнатной температуре добавляли 342 мг 2-(3,5-дихлорфенил)-3,3,3-трифтор-1-пропена, затем 144 мг триэтиламина и перемешивали в течение 48 часов. К реакционной смеси добавляли воду, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 633 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метоксифенил)-3,3,3-трифторпропиониламида (здесь и далее обозначаемого как соединение настоящего изобретения (78)).
Соединение настоящего изобретения (78):

1H-ЯМР (CDCl3) д: 8,55 (1H, д, J=2,2 Гц), 8,01 (1H, ушир.с), 7,66-7,64 (1H, м), 7,51 (2H, д, J=1,7 Гц), 7,41 (1H, т, J=1,9 Гц), 6,96 (1H, д, J=8,7 Гц), 4,10 (1H, д, J=17,3 Гц), 3,96 (3H, с), 3,70 (1H, д, J=17,3 Гц), 3,29 (2H, кв, J=10,3 Гц).
Пример получения 79
В 5 мл толуола растворяли 250 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-хлоранилина, полученного согласно справочному примеру получения 26, и 198 мг трифосгена и полученный раствор перемешивали при температуре кипения с обратным холодильником в течение 2 часов. Реакционному раствору давали возможность охладиться до комнатной температуры с последующим добавлением 4 мл метанола и полученную смесь перемешивали при той же температуре в течение 5 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 218 мг N-(5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-хлорфенил)-O-метилкарбамата.
Соединение настоящего изобретения (79):

1H-ЯМР (CDCl3) д: 8,38 (1H, д, J=2,0 Гц), 7,52-7,50 (3H, м), 7,42-7,40 (2H, м), 7,23 (1H, ушир.с), 4,10 (1H, д, J=17,3 Гц), 3,84 (3H, с), 3,70 (1H, д, J=17,3 Гц).
Ниже описаны справочные примеры получения промежуточных соединений.
Справочный пример получения 1
В 15 мл N,N-диметилформамида растворяли 249 мг 3-нитробензальдоксима, при комнатной температуре добавляли 201 мг N-хлорсукцинимида и перемешивали при 60°C в течение 1 часа. Реакционный раствор охлаждали до комнатной температуры, добавляли 362 мг 2-(3,5-дихлорфенил)-3,3,3-трифтор-1-пропена, затем 152 мг триэтиламина и перемешивали в течение 6 часов. К реакционной смеси добавляли воду, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 232 мг 3-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)нитробензола.
3-(5-(3,5-Дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)нитробензол:

1H-ЯМР (CDCl3) д: 8,43 (1H, ушир.с), 8,34-8,32 (1H, м), 8,10 (1H, д, J=8,0 Гц), 7,67-7,65 (1H, м), 7,52 (2H, с), 7,45-7,45 (1H, м), 4,14 (1H, д, J=17,3 Гц), 3,76 (1H, д, J=17,3 Гц).
Справочный пример получения 2
К 1 мл 2,5% водного раствора уксусной кислоты добавляли 192 мг железного порошка (10-20 меш) и при 75°C добавляли суспензию 232 мг 3-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)нитробензола, полученного в справочном примере получения 1, в 1,5 мл этанола и перемешивали при той же температуре в течение 15 минут. Затем дополнительно добавляли 300 мг железного порошка и перемешивали в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры, фильтровали и осадок промывали этилацетатом. Для проведения экстракции к фильтрату добавляли воду и этилацетат. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 198 мг 3-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)анилина.
3-(5-(3,5-Дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)анилин:

1H-ЯМР (CDCl3) д: 7,51 (2H, ушир.с), 7,42 (1H, т, J=1,9 Гц), 7,20 (1H, т, J=7,8 Гц), 7,04 (1H, т, J=1,9 Гц), 6,95-6,93 (1H, м), 6,77-6,75 (1H, м), 4,05 (1H, д, J=17,1 Гц), 3,77 (2H, ушир.с), 3,66 (1H, д, J=17,1 Гц).
Справочный пример получения 3
К смеси 3,00 г 4-метил-3-нитробензальдегида, 1,64 г гидрохлорида гидроксиламина, 30 мл этанола и 15 мл воды при комнатной температуре добавляли 2,24 грамма ацетата натрия и перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь добавляли в воду, экстрагировали этилацетатом и органический слой сушили над безводным сульфатом натрия, затем концентрировали при пониженном давлении, с получением 2,77 г 5-гидроксииминометил-2-метилнитробензола.
5-Гидроксииминометил-2-метилнитробензол:

1H-ЯМР (DMSO-d6) д: 11,53 (1H, с), 8,24 (1H, с), 8,17 (1H, д, J=1,7 Гц), 7,84 (1H, дд, J=8,0, 1,7 Гц), 7,54 (1H, д, J=8,0 Гц), 2,52 (3H, с).
Справочный пример получения 4
В 30 мл N,N-диметилформамида растворяли 2,77 г 5-гидроксииминометил-2-метилнитробензола, полученного в справочном примере получения 3, и 2,06 г N-хлорсукцинимида и полученный раствор перемешивали при 50°C в течение нескольких часов. Реакционный раствор охлаждали до комнатной температуры, добавляли 3,71 г 2-(3,5-дихлорфенил)-3,3,3-трифтор-1-пропена, затем 1,56 г триэтиламина и перемешивали в течение 6 часов. К реакционной смеси добавляли воду, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 4,99 г 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилнитробензола.
5-(5-(3,5-Дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилнитробензол:

1H-ЯМР (CDCl3) д: 8,16 (1H, д, J=1,9 Гц), 7,90 (1H, дд, J=8,1, 1,9 Гц), 7,51 (2H, д, J=1,2 Гц), 7,45-7,43 (2H, м), 4,11 (1H, д, J=17,1 Гц), 3,73 (1H, д, J=17,1 Гц), 2,66 (3H, с).
Справочный пример получения 5
В 19 мл 2,5% водного раствора уксусной кислоты добавляли 1,89 г железного порошка (10-20 меш) и при 75°C добавляли суспензию 4,62 г 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метилнитробензола, полученного в справочном примере получения 4, в 29 мл этанола и перемешивали в течение 15 минут. Затем дополнительно добавляли 1,80 г железного порошка и перемешивали в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры, фильтровали и осадок промывали этилацетатом. Для проведения экстракции к фильтрату добавляли насыщенный водный раствор гидрокарбоната натрия и этилацетат. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 3,18 г 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилина.
5-(5-(3,5-Дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-метиланилин:

1H-ЯМР (CDCl3) д: 7,51 (2H, д, J=1,4 Гц), 7,41 (1H, т, J=1,8 Гц), 7,08 (1H, д, J=7,8 Гц), 7,05 (1H, д, J=1,8 Гц), 6,88 (1H, дд, J=7,8, 1,7 Гц), 4,04 (1H, д, J=17,1 Гц), 3,71 (2H, ушир.с), 3,65 (1H, д, J=17,1 Гц), 2,19 (3H, с).
Справочный пример получения 6
В 12 мл тетрагидрофурана растворяли 1,00 г метил 3-амино-2-метилбензоата, при охлаждении на льду добавляли 1,09 г 3,3,3-трифторпропионилхлорида и перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь добавляли в воду и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок перекристаллизовывали из смеси гексан-этилацетат, с получением 1,23 г метил-3-(3,3,3-трифторпропиониламино)-2-метилбензоата.
Метил-3-(3,3,3-трифторпропиониламино)-2-метилбензоат:

1H-ЯМР (CDCl3) д: 7,79 (1H, д, J=8,0 Гц), 7,72 (1H, д, J=7,7 Гц), 7,33-7,25 (2H, м), 3,90 (3H, с), 3,30 (2H, кв, J=10,5 Гц), 2,45 (3H, с).
Справочный пример получения 7
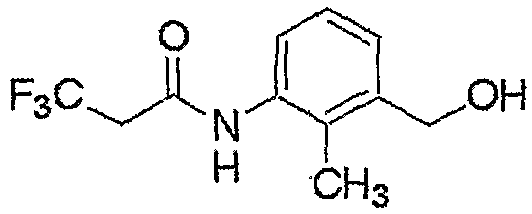
В 10 мл тетрагидрофурана растворяли 500 мг метил-3-(3,3,3-трифторпропиониламино)-2-метилбензоата, полученного в справочном примере получения 6, при охлаждении на льду добавляли 155 мг литийалюминийгидрида и перемешивали при охлаждении на льду в течение 20 минут. Реакционную смесь добавляли в воду и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 2-метил-3-(3,3,3-трифторпропионил)аминобензилового спирта.
Справочный пример получения 8
2-Метил-3-(3,3,3-трифторпропионил)аминобензиловый спирт, полученный в справочном примере получения 7, растворяли в 10 мл хлороформа, добавляли 5 г диоксида марганца и перемешивали в течение 2 часов. Затем полученной смеси давали возможность отстояться в течение 12 часов. Реакционную смесь фильтровали через целит и фильтрат концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 72 мг 2-метил-3-(3,3,3-трифторпропионил)аминобензальдегида.
2-Метил-3-(3,3,3-трифторпропионил)аминобензальдегид:

1H-ЯМР (CDCl3) д: 10,26 (1H, с), 7,87 (1H, д, J=7,7 Гц), 7,72 (1H, д, J=7,7 Гц), 7,43-7,41 (1H, м), 7,34 (1H, с), 3,33 (2H, кв, J=10,5 Гц), 2,57 (3H, с).
Справочный пример получения 9
Смешивали 72 миллиграмма 2-метил-3-(3,3,3-трифторпропионил)аминобензальдегида, полученного в справочном примере получения 8, 27 мг гидрохлорида гидроксиламина, 36 мг ацетата натрия, 5 мл этанола и 2,5 мл воды и полученную смесь перемешивали при комнатной температуре в течение 20 минут. Реакционную смесь добавляли в насыщенный водный раствор хлорида натрия, экстрагировали этилацетатом и органический слой сушили над безводным сульфатом натрия, затем концентрировали при пониженном давлении, с получением 80 мг N-(3,3,3-трифторпропионил)-2-метил-3-гидроксииминометиланилина.
N-(3,3,3-трифторпропионил)-2-метил-3-гидроксииминометиланилин:

1H-ЯМР (CDCl3) д: 10,32 (1H, с), 8,93 (1H, с), 8,42 (1H, с), 7,61 (1H, д, J=8,0 Гц), 7,44 (1H, д, J=7,8 Гц), 7,20-7,18 (1H, м), 3,32 (2H, кв, J=10,6 Гц), 2,27-2,24 (3H, ушир.м).
Справочный пример получения 10
В 20 мл хлороформа растворяли 813 мг 3-амино-2-хлорбензилового спирта и 8 г диоксида марганца и полученный раствор перемешивали при комнатной температуре в течение 14 часов. Реакционную смесь фильтровали через целит и фильтрат концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 284 мг 3-амино-2-хлорбензальдегида.
3-Амино-2-хлорбензальдегид:

1H-ЯМР (CDCl3) д: 10,45 (1H, д, J=0,7 Гц), 7,32 (1H, дд, J=7,6, 1,6 Гц), 7,20-7,18 (1H, м), 7,00 (1H, дд, J=8,0, 1,4 Гц), 4,24 (2H, ушир.с).
Справочный пример получения 11
В 4 мл тетрагидрофурана растворяли 134 мг 3-амино-2-хлорбензальдегида, полученного в справочном примере получения 10, при комнатной температуре добавляли 126 мг трифторпропионилхлорида, затем 87 мг триэтиламина и перемешивали в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении и полученный осадок подвергали хроматографии на силикагеле, с получением 106 мг 2-хлор-3-(3,3,3-трифторпропионил)аминобензальдегида.
2-Хлор-3-(3,3,3-трифторпропионил)аминобензальдегид:

1H-ЯМР (CDCl3) д: 10,46 (1H, с), 8,58 (1H, д, J=7,3 Гц), 7,98 (1H, с), 7,75 (1H, дд, J=7,7, 1,6 Гц), 7,46 (1H, т, J=8,0 Гц), 3,37 (2H, кв, J=10,4 Гц).
Справочный пример получения 12
Смешивали 176 миллиграмм 2-хлор-3-(3,3,3-трифторпропионил)аминобензальдегида, полученного в справочном примере получения 11, 60 мг гидрохлорида гидроксиламина, 81 мг ацетата натрия, 7 мл этанола и 3,5 мл воды и полученную смесь перемешивали при комнатной температуре в течение 5 часов. Реакционную смесь добавляли в воду, экстрагировали этилацетатом и органический слой сушили над безводным сульфатом натрия, затем концентрировали при пониженном давлении, с получением 143 мг N-(3,3,3-трифторпропионил)-2-хлор-3-гидроксииминометиланилина.
N-(3,3,3-трифторпропионил)-2-хлор-3-гидроксииминометиланилин:

1H-ЯМР (CDCl3) д: 8,55-8,54 (1H, м), 8,36 (1H, д, J=8,7 Гц), 7,91 (1H, с), 7,72-7,65 (1H, м), 7,51 (1H, с), 7,38-7,30 (1H, м), 3,33 (2H, кв, J=10,4 Гц).
Справочный пример получения 13
К 30 мл толуола добавляли 2,57 г 5-нитроизофталальдегида, 0,137 г моногидрата п-толуолсульфоновой кислоты и 1,49 г 2,2-диметил-1,3-пропандиола и полученную смесь кипятили при температуре кипения с обратным холодильником в течение 2 часов при дегидриратации с ловушкой Дина-Старка. Реакционную смесь охлаждали до комнатной температуры, добавляли к насыщенному водному раствору гидрокарбоната натрия и затем экстрагировали этилацетатом. Полученный органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 1,70 г 2-(3-нитро-5-формилфенил)-5,5-диметил-1,3-диоксана.
2-(3-Нитро-5-формилфенил)-5,5-диметил-1,3-диоксан:
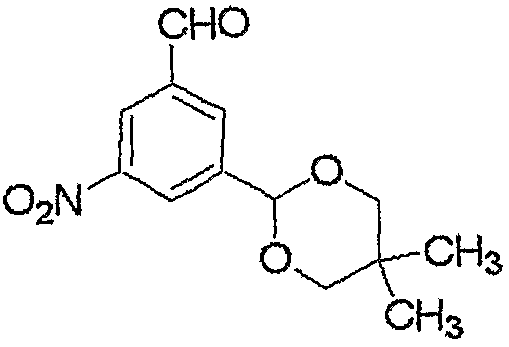
1H-ЯМР (CDCl3) д: 10,12 (1H, с), 8,69-8,69 (1H, м), 8,63-8,62 (1H, м), 8,37-8,36 (1H, м), 5,53 (1H, с), 3,83 (2H, д, J=11,2 Гц), 3,71 (2H, д, J=10,5 Гц), 1,28 (3H, с), 0,84 (3H, с).
Справочный пример получения 14
В 12 мл диэтиленгликоля растворяли 1,70 г 2-(3-нитро-5-формилфенил)-5,5-диметил-1,3-диоксана, полученного в справочном примере получения 13, и 1,93 г моногидрата гидразина и полученный раствор кипятили при температуре кипения с обратным холодильником в течение 1 часа. Добавляли раствор 1,43 г гидроксида калия в 1,93 г воды и полученную смесь нагревали при кипячении с обратным холодильником в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры, добавляли в воду и затем экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 0,6 г 2-(3-амино-5-метилфенил)-5,5-диметил-1,3-диоксана.
2-(3-Амино-5-метилфенил)-5,5-диметил-1,3-диоксан:

1H-ЯМР (CDCl3) д: 6,72 (1H, с), 6,66 (1H, с), 6,49 (1H, с), 5,27 (1H, с), 3,76 (2H, д, J=11,2 Гц), 3,62 (4H, д, J=10,5 Гц), 2,26 (3H, с), 1,29 (3H, с), 0,79 (3H, с).
Справочный пример получения 15
В 4 мл тетрагидрофурана растворяли 400 мг 2-(3-амино-5-метилфенил)-5,5-диметил-1,3-диоксана, полученного в справочном примере получения 14, и добавляли 300 мг 3,3,3-трифторпропионилхлорида, затем 183 мг триэтиламина при комнатной температуре и перемешивали в течение 15 часов. Реакционную смесь концентрировали при пониженном давлении и полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 0,40 г 2-(3-трифторпропиониламино-5-метилфенил)-5,5-диметил-1,3-диоксана.
2-(3-Трифторпропиониламино-5-метилфенил)-5,5-диметил-1,3-диоксан:

1H-ЯМР (CDCl3) д: 7,43 (2H, ушир.с), 7,35 (1H, с), 7,13 (1H, с), 5,34 (1H, с), 3,76 (2H, д, J=11,1 Гц), 3,64 (2H, д, J=10,6 Гц), 3,18 (2H, кв, J=10,5 Гц), 2,34 (3H, с), 1,29 (3H, с), 0,80 (3H, с).
Справочный пример получения 16
В смеси 8 мл ацетона и 15 мл воды растворяли 0,40 г 2-(3-трифторпропиониламино-5-метилфенил)-5,5-диметил-1,3-диоксана, полученного в справочном примере получения 15, и 46 мг моногидрата п-толуолсульфоновой кислоты и полученный раствор перемешивали при 60°C в течение 11 часов. Реакционную смесь охлаждали до комнатной температуры, добавляли к насыщенному водному раствору гидрокарбоната натрия и затем экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 260 мг 3-метил-5-(3,3,3-трифторпропионил)аминобензальдегида.
3-Метил-5-(3,3,3-трифторпропионил)аминобензальдегид:

1H-ЯМР (CDCl3) д: 9,95 (1H, с), 7,78-7,74 (3H, м), 7,49 (1H, с), 3,28 (2H, кв, J=10,4 Гц), 2,43 (3H, с).
Справочный пример получения 17
В смеси 3 мл этанола и 1,5 мл воды растворяли 380 мг 3-метил-5-(3,3,3-трифторпропионил)аминобензальдегида, полученного в справочном примере получения 16, при комнатной температуре добавляли 140 мг гидрохлорида гидроксиламина и 191 мг ацетата натрия и перемешивали в течение 1 часа. Реакционную смесь добавляли в воду, экстрагировали этилацетатом и органический слой сушили над безводным сульфатом натрия, затем концентрировали при пониженном давлении, с получением 366 мг N-(3,3,3-трифторпропионил)-5-метил-3-гидроксииминометиланилина.
N-(3,3,3-трифторпропионил)-5-метил-3-гидроксииминометиланилин:

1H-ЯМР (DMSO-d6) д: 11,22 (1H, с), 10,29 (1H, с), 8,05 (1H, с), 7,64 (1H, с), 7,38 (1H, с), 7,11 (1H, с), 3,48 (2H, кв, J=11,2 Гц), 2,28 (3H, с).
Справочный пример получения 18
В 25 мл тетрагидрофурана растворяли 825 мг метил 3-амино-4-метилбензоата с последующим добавлением 735 мг хлорангидрида 3,3,3-трифторпропионовой кислоты, затем 505 мг триэтиламина и полученную смесь нагревали при кипячении с обратным холодильником в течение 9 часов. Реакционную смесь охлаждали до комнатной температуры, добавляли в воду и затем экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении, с получением 1,3 г метил 3-(3,3,3-трифторпропиониламино)-4-метилбензоата.
Метил 3-(3,3,3-трифторпропиониламино)-4-метилбензоат:

1H-ЯМР (CDCl3) д: 8,30 (1H, с), 7,83 (1H, д, J=8,0 Гц), 7,30 (2H, д, J=8,0 Гц), 3,90 (3H, с), 3,31 (2H, кв, J=10,6 Гц), 2,31 (3H, с).
Справочный пример получения 19
В 20 мл тетрагидрофурана растворяли 1,3 г метил 3-(3,3,3-трифторпропиониламино)-4-метилбензоата, полученного в справочном примере получения 18, добавляли 380 мг гидрида алюминия лития при охлаждении на льду и перемешивали в течение 1 часа. К реакционной смеси добавляли 380 мг воды, 1,2 г 15% водного раствора гидроксида натрия и 380 мг воды в указанном порядке и полученную смесь фильтровали. Фильтрат сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении, с получением 3-(3,3,3-трифторпропиониламино)-4-метилбензилового спирта.
3-(3,3,3-Трифторпропиониламино)-4-метилбензиловый спирт:

Справочный пример получения 20
3-(3,3,3-Трифторпропиониламино)-4-метилбензиловый спирт, полученный в справочном примере получения 19, растворяли в 100 мл хлороформа, с последующим добавлением 12,3 г диоксида марганца, полученную смесь перемешивали при комнатной температуре в течение 4 часов и давали возможность отстояться 2,5 суток. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 55 мг 3-(3,3,3-трифторпропиониламино)-4-метилбензальдегида.
3-(3,3,3-Трифторпропиониламино)-4-метилбензальдегид:

1H-ЯМР (CDCl3) д: 9,97 (1H, с), 8,28 (1H, д, J=1,2 Гц), 7,68 (1H, дд, J=7,8, 1,2 Гц), 7,39 (1H, д, J=7,8 Гц), 7,28 (1H, ушир.с), 3,33 (2H, кв, J=10,5 Гц), 2,36 (3H, с).
Справочный пример получения 21
В смеси 1 мл этанола и 0,5 мл воды растворяли 55 мг 3-(3,3,3-Трифторпропиониламино)-4-метилбензальдегида, полученного в справочном примере получения 20, 20 мг гидрохлорида гидроксиламина и 41 мг ацетата натрия и полученный раствор перемешивали при комнатной температуре в течение 6 часов. Реакционную смесь добавляли в воду, экстрагировали этилацетатом и органический слой сушили над безводным сульфатом натрия, затем концентрировали при пониженном давлении, с получением 55 мг N-(3,3,3-трифторпропионил)-2-метил-5-гидроксииминометиланилина.
N-(3,3,3-трифторпропионил)-2-метил-5-гидроксииминометиланилин:

1H-ЯМР (CDCl3) д: 9,37 (1H, с), 8,14 (1H, с), 8,08 (1H, с), 7,87 (1H, с), 7,36 (1H, д, J=7,7 Гц), 7,21 (1H, д, J=7,5 Гц), 3,31 (2H, кв, J=10,6 Гц), 2,27 (3H, с).
Справочный пример получения 22
В смеси 20 мл этанола и 10 мл воды растворяли 2 г 4-фтор-3-нитробензальдегида, 1,07 г гидрохлорида гидроксиламина и 1,45 г ацетата натрия и полученный раствор перемешивали при комнатной температуре в течение 6 часов. Реакционную смесь добавляли в воду, экстрагировали этилацетатом и органический слой сушили над безводным сульфатом натрия, затем концентрировали при пониженном давлении, с получением 1,95 г 2-фтор-5-гидроксииминометилнитробензола.
2-Фтор-5-гидроксииминометилнитробензол:

1H-ЯМР (DMSO-D6) д: 11,63 (1H, с), 8,34 (1H, дд, J=7,2, 2,2 Гц), 8,28 (1H, с), 8,04-8,02 (1H, м), 7,65-7,62 (1H, м).
Справочный пример получения 23
В 20 мл N,N-диметилформамида растворяли 1,95 г 2-фтор-5-гидроксииминометилнитробензола, полученного в справочном примере получения 22, и 1,42 г N-хлорсукцинимида и полученный раствор перемешивали при 60°C в течение 1 часа. Раствор охлаждали до комнатной температуры, добавляли 2,55 г 2-(3,5-дихлорфенил)-3,3,3-трифтор-1-пропена, затем 1,07 г триэтиламина и перемешивали в течение 6 часов. К реакционной смеси добавляли воду, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 1,40 г 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-фторнитробензола.
5-(5-(3,5-Дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-фторнитробензол:

1H-ЯМР (CDCl3) д: 8,26 (1H, дд, J=6,9, 2,3 Гц), 8,08-8,05 (1H, м), 7,51 (2H, д, J=1,2 Гц), 7,45 (1H, т, J=1,9 Гц), 7,41 (1H, дд, J=10,1, 8,7 Гц), 4,11 (1H, д, J=17,4 Гц), 3,73 (1H, д, J=17,9 Гц).
Справочный пример получения 24
К смеси 0,2 г уксусной кислоты и 7 мл воды добавляли 1,85 г железного порошка, затем при 75°C добавляли суспензию 1,40 г 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-фторнитробензола, полученного в справочном примере получения 23, в 15 мл этанола и перемешивали при 75°C в течение 20 минут. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 806 мг 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-фторанилина.
5-(5-(3,5-Дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-фторанилин:

1H-ЯМР (CDCl3) д: 7,50 (2H, д, J=1,4 Гц), 7,42 (1H, т, J=1,8 Гц), 7,18 (1H, дд, J=8,5, 2,2 Гц), 7,01 (1H, дд, J=10,6, 8,5 Гц), 6,90-6,87 (1H, м), 4,03 (1H, д, J=17,0 Гц), 3,85 (2H, ушир.с), 3,64 (1H, д, J=17,0 Гц).
Справочный пример получения 25
В 30 мл N,N-диметилформамида растворяли 2,92 г 2-хлор-5-гидроксииминометилнитробензола и 1,94 г N-хлорсукцинимида и полученный раствор перемешивали при 60°C в течение 1 часа. Раствор охлаждали до комнатной температуры, добавляли 3,50 г 2-(3,5-дихлорфенил)-3,3,3-трифтор-1-пропена, затем 1,46 г триэтиламина и перемешивали в течение 6 часов. К реакционной смеси добавляли воду, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 4,42 г 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-хлорнитробензола.
5-(5-(3,5-Дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-хлорнитробензол:

1H-ЯМР (CDCl3) д: 8,09 (1H, д, J=2,1 Гц), 7,89 (1H, дд, J=8,5, 2,1 Гц), 7,65 (1H, д, J=8,5 Гц), 7,50 (2H, д, J=1,6 Гц), 7,45 (1H, т, J=1,6 Гц), 4,09 (2H, д, J=17,3 Гц), 3,71 (1H, д, J=17,3 Гц).
Справочный пример получения 26
К смеси 0,38 г уксусной кислоты, 15 мл воды и 30 мл этанола добавляли 3,46 г железного порошка, затем при 75°C добавляли 2,73 г 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-хлорнитробензола, полученного в справочном примере получения 25, и перемешивали при 75°C в течение 50 минут. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 1,65 г 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-хлоранилина.
5-(5-(3,5-Дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-хлоранилин:

1H-ЯМР (CDCl3) д: 7,49 (2H, д, J=1,7 Гц), 7,42 (1H, т, J=1,7 Гц), 7,29 (1H, д, J=8,4 Гц), 7,13 (1H, д, J=2,0 Гц), 6,89 (1H, дд, J=8,4, 2,0 Гц), 4,18 (2H, ушир.с), 4,03 (1H, д, J=17,1 Гц), 3,64 (1H, д, J=16,4 Гц).
Справочный пример получения 27
В 40 мл N,N-диметилформамида растворяли 4,30 г 2-этил-5-гидроксииминометилнитробензола и 2,97 г N-хлорсукцинимида и полученный раствор перемешивали при 60°C в течение 1 часа. Реакционный раствор охлаждали до комнатной температуры, добавляли 3,5 г 2-(3,5-дихлорфенил)-3,3,3-трифтор-1-пропена, затем 1,7 г триэтиламина и перемешивали в течение 6 часов. К реакционной смеси добавляли воду, с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 5,74 г 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-этилнитробензола.
5-(5-(3,5-Дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-этилнитробензол:

1H-ЯМР (CDCl3) д: 8,07 (1H, д, J=1,9 Гц), 7,91 (1H, дд, J=8,0, 1,9 Гц), 7,51 (2H, д, J=1,6 Гц), 7,46 (1H, д, J=8,0 Гц), 7,44 (1H, т, J=1,6 Гц), 4,10 (1H, д, J=17,3 Гц), 3,72 (1H, д, J=17,3 Гц), 2,96 (2H, кв, J=7,5 Гц), 1,30 (3H, т, J=7,5 Гц).
Справочный пример получения 28
К смеси 0,5 мл уксусной кислоты, 22 мл воды и 34 мл этанола добавляли 4,33 г железного порошка, затем при 75°C добавляли 5,60 г 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-этилнитробензола, полученного в справочном примере получения 27, и перемешивали в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры, фильтровали и осадок промывали этилацетатом. К фильтрату для проведения экстракции добавляли насыщенный водный раствор гидрокарбоната натрия и этилацетат. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении, с получением 5,20 г 5-(5-(3,5-дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-этиланилина.
5-(5-(3,5-Дихлорфенил)-4,5-дигидро-5-трифторметил-3-изоксазолил)-2-этиланилин:

1H-ЯМР (CDCl3) д: 7,51 (2H, д, J=1,7 Гц), 7,41 (1H, т, J=1,7 Гц), 7,10 (1H, д, J=7,8 Гц), 7,04 (1H, д, J=1,7 Гц), 6,93 (1H, дд, J=7,8, 1,7 Гц), 4,05 (1H, д, J=17,1 Гц), 3,74 (2H, ушир.с), 3,65 (1H, д, J=17,1 Гц), 2,52 (2H, кв, J=7,5 Гц), 1,25 (3H, т, J=7,5 Гц).
Справочный пример получения 29
К смеси 1,2 мл уксусной кислоты, 51 мл воды и 79 мл этанола добавляли 10,04 г железного порошка, затем при 75°C добавляли 5,44 г 4-метокси-3-нитробензальдегида и перемешивали в течение 1 часа. Реакционную смесь фильтровали и осадок промывали этилацетатом. К фильтрату для проведения экстракции добавляли насыщенный водный раствор гидрокарбоната натрия и этилацетат. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении, с получением 4,44 г 3-амино-4-метоксибензальдегида.
3-Амино-4-метоксибензальдегид:

1H-ЯМР (CDCl3) д: 9,80 (1H, с), 7,27 (1H, дд, J=8,2, 2,0 Гц), 7,23 (1H, д, J=2,0 Гц), 6,88 (1H, д, J=8,2 Гц), 3,97 (2H, ушир.с), 3,94 (3H, с).
Справочный пример получения 30
В 3 мл тетрагидрофурана растворяли 302 мг 3-амино-4-метоксибензальдегида, полученного в справочном примере получения 29, при комнатной температуре добавляли 322 мг 3,3,3-трифторпропионилхлорида, затем 223 мг триэтиламина и перемешивали в течение 15 минут. Реакционную смесь концентрировали при пониженном давлении и полученный осадок подвергали колоночной хроматографии на силикагеле, с получением 376 мг N-(5-формил-2-метоксифенил)-3,3,3-трифторпропиониламида.
N-(5-формил-2-метоксифенил)-3,3,3-трифторпропиониламид:

1H-ЯМР (CDCl3) д: 9,90 (1H, с), 8,86 (1H, д, J=1,9 Гц), 8,05 (1H, ушир.с), 7,71 (1H, дд, J=8,5, 1,9 Гц), 7,03 (1H, д, J=8,5 Гц), 4,00 (3H, с), 3,31 (2H, кв, J=10,4 Гц).
Справочный пример получения 31
В смеси 4,3 мл этанола и 2,2 мл воды растворяли 370 мг N-(5-формил-2-метоксифенил)-3,3,3-трифторпропиониламида, полученного в справочном примере получения 30, 131 мг гидрохлорида гидроксиламина и 174 мг ацетата натрия и полученный раствор перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь добавляли в воду и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении, с получением 390 мг N-(5-гидроксилиминометил-2-метоксифенил)-3,3,3-трифторпропиониламида.
N-(5-гидроксилиминометил-2-метоксифенил)-3,3,3-трифторпропиониламид:

Далее, примеры составов описаны ниже. В примерах составов все части указаны по массе.
Пример состава 1
10% эмульгируемые концентраты каждого из соединений настоящего изобретения (1)-(79) получают растворением 10 частей каждого из соединений настоящего изобретения в смеси 35 частей ксилола и 35 частей N,N-диметилформамида, добавлением 14 частей простого полиоксиэтиленстирилфенилового эфира и 6 частей додецилбензолсульфоната кальция и тщательным перемешиванием и смешиванием полученной смеси.
Пример состава 2
20% смачивающиеся порошки каждого из соединений настоящего изобретения (1)-(79) получают добавлением 20 частей каждого из соединений настоящего изобретения к смеси из 4 частей лаурилсульфата натрия, 2 частей лигносульфоната кальция, 20 частей тонкодисперсного порошка синтетического гидратированного диоксида кремния и 54 частей диатомовой земли и тщательным перемешиванием и смешиванием полученной смеси.
Пример состава 3
1 часть тонкодисперсного порошка синтетического гидратированного диоксида кремния, 2 части лигносульфоната кальция, 30 частей бентонита и 65 частей каолиновой глины добавляют к 2 частям каждого из соединений настоящего изобретения (1)-(79). Полученную смесь тщательно перемешивают и смешивают. Затем к полученной смеси добавляют подходящее количество воды и дополнительно перемешивают. В перемешанной таким образом смеси размер частиц регулируют гранулятором и последующей сушкой в сквозном потоке, с получением 2% гранул каждого из соединений настоящего изобретения.
Пример состава 4
1% пудру каждого из соединений настоящего изобретения (1)-(79) получают растворением 1 части каждого из соединений настоящего изобретения в подходящем количестве ацетона, добавлением 5 частей тонкодисперсного порошка синтетического гидратированного диоксида кремния, 0,3 частей PAP и 93,7 частей глины Fubasami, тщательным перемешиванием и смешиванием полученной смеси и последующим удалением ацетона выпариванием.
Пример состава 5
10% текучие концентраты каждого из соединений настоящего изобретения (1)-(79) получают смешиванием 10 частей каждого из соединений настоящего изобретения, 35 частей белой сажи, содержащей 50 частей сульфатаммониевой соли простого полиоксиэтиленалкилового эфира и 55 частей воды, и мелким измельчением полученной смеси способом мокрого измельчения.
Пример состава 6
0,1% масляные составы каждого из соединений настоящего изобретения (1)-(79) получают растворением 0,1 части каждого из соединений настоящего изобретения в смеси 5 частей ксилола и 5 частей трихлорэтана и смешиванием полученного раствора с 89,9 частями дезодорированного керосина.
Пример состава 7
Десять миллиграмм каждого из соединений настоящего изобретения (1)-(79) растворяют в 0,5 мл ацетона. Полученный раствор однородно смешивают с 5 г твердого пищевого порошка для животных (твердый пищевой порошок для выкармливания CE-2, торговое наименование Oriental Kobo Co.). Полученную смесь сушат для удаления ацетона путем выпаривания, с получением отравленных приманок каждого из соединений настоящего изобретения.
Пример состава 8
Смешанные смачивающиеся порошки получают добавлением 10 частей каждого из соединений настоящего изобретения (1)-(79) к смеси 10 частей любого из других средств для борьбы с вредителями, таких как инсектициды, акарициды, нематоциды или фунгициды, препараты гормонов растений, регуляторы роста растений и гербицидов (такие средства включают их изомеры и соли), синергистов и восстановителей фитотоксичности, 4 частей лаурилсульфата натрия, 2 частей лигносульфоната кальция, 20 частей тонкодисперсного порошка синтетического гидратированного диоксида кремния и 54 частей диатомовой земли, тщательным перемешиванием и смешиванием полученной смеси.
Следующий пример тестирования демонстрирует уничтожающее действие соединений настоящего изобретения на вредителей.
Пример тестирования 1
Каждый из составов соединений настоящего изобретения (1)-(3), (5), (7), (13), (15), (17), (19)-(25), (30), (31), (33)-(37), (43)-(45), (48), (57), (60), (64), (71), (72), (75)-(77) и (78), полученных согласно примеру состава 5, разбавляли водой, чтобы получить концентрацию активного ингредиента 500 ч./млн. Таким образом, получали опрыскивающую жидкость для тестирования.
С другой стороны, каждое растение капусты высаживали в полиэтиленовый стакан и выращивали до развития у него третьего настоящего листа или четвертого настоящего листа. Затем каждую из указанных выше опрыскивающих жидкостей для тестирования распыляли на растение капусты в объеме 20 мл на стакан.
После высыхания распыленного на растение жидкого химиката на растение капусты для паразитирования помещали 10 личинок третьей возрастной стадии моли капустной (Plutella xylostella). Через 5 суток подсчитывали капустную моль на растении капусты и эффективность уничтожения рассчитывали по следующему уравнению:
Эффективность уничтожения (%)={1-(Cb×Tai)/(Cai×Tb)}×100
В уравнении символы имеют следующие значения:
Cb: число насекомых до распыления в группе без обработки,
Cai: число насекомых после распыления в группе без обработки,
Tb: число насекомых до распыления в группе с обработкой,
Tai: число насекомых после распыления в группе с обработкой.
В результате было обнаружено, что соединения настоящего изобретения (1)-(3), (5), (7), (13), (15), (17), (19)-(25), (30), (31), (33)-(37), (43)-(45), (48), (57), (60), (64), (71), (72), (75)-(77) и (78) обладают эффективностью уничтожения 80% или более в группах, обработанных опрыскивающими жидкостями для тестирования, соответственно.
Пример тестирования 2
Состав соединения настоящего изобретения (79), полученный согласно примеру состава 5, разбавляли водой, чтобы получить концентрацию активного ингредиента 2500 ч./млн. Таким образом, получали раствор для тестирования.
Дно полиэтиленового стакана с диаметром 5,5 см покрывали фильтровальной бумагой с таким же диаметром. На фильтровальную бумагу помещали искусственное питание (Silkmate 2S; Nihon Nosan Kogyo K.K.), нарезанное с толщиной 2 мм, и на искусственное питание наносили 1 мл указанного выше раствора для тестирования. После высыхания раствора для тестирования на воздухе на искусственное питание помещали фильтровальную бумагу с диаметром 5,5 см и на эту фильтровальную бумагу выпускали 30 личинок листовертки сетчатой (Adoxophyes orana) первой возрастной стадии, затем стакан накрывали крышкой. Через 7 суток подсчитывали количество личинок листовертки сетчатой и смертность рассчитывали по следующему уравнению:
Смертность (%)=(число мертвых личинок/число выпущенных личинок)×100
В результате было обнаружено, что смертность в группе, подвергнутой обработке раствором соединения настоящего изобретения (79) для тестирования, составляла 80% или более.
Кроме того, способом аналогично примеру тестирования 1 и примеру тестирования 2 тестировали соединение, определенное как соединение номер 1-2 и описанное в описании международной публикации No. WO 2005-51932:

было обнаружено, что указанное соединение обладает эффективностью уничтожения 0% в примере тестирования 1 и обладает смертностью 0% в примере тестирования 2.
Реферат
Изобретение относится к соединениям общей формулы (1), где R1 представляет собой С1-С4галогеналкильную группу, R2 представляет собой атом галогена, R3 представляет собой C1-С6алкильную группу, C1-С6алкоксигруппу или атом галогена, m равно целому числу от 0 до 5, n равно целому числу от 0 до 4, М представляет собой атом кислорода или атом серы, R4 является таким, как определено в формуле изобретения. Также изобретение относится к способу борьбы с насекомыми, к применению соединений формулы (1) и композиции, содержащей соединения формулы (1), для борьбы с насекомыми. Технический результат - соединения формулы (1) для борьбы с насекомыми. 5 н. и 15 з.п. ф-лы, 119 пр.
Формула

где R1 представляет собой С1-С4 галогеналкильную группу,
R2 представляет собой атом галогена,
R3 представляет собой C1-С6алкильную группу, C1-С6алкоксигруппу или атом галогена,
m равно целому числу от 0 до 5,
n равно целому числу от 0 до 4,
М представляет собой атом кислорода или атом серы,
R4 представляет собой атом водорода; С1-С12алкильную группу, незамещенную или замещенную одним или несколькими атомами галогена; (С2-С5алкоксикарбонил)C1-С12алкильную группу; С2-С12цианоалкильную группу; С2-С12алкенильную группу, незамещенную или замещенную одним или несколькими атомами галогена; C1-С6алкоксигруппу, незамещенную или замещенную одним или несколькими атомами галогена; (С1-С6алкокси)C1-С6алкоксигруппу; С3-С6алкенилоксигруппу; бензилоксигруппу; фенил(С2-С6)алкенильную группу; (ди(С1-С6алкил)амино)С1-С6алкильную группу; группу, представленную следующей формулой:

[где А1 представляет собой атом галогена,
q равно целому числу от 0 до 3,
r равно целому числу от 0 до 2, и
X1, X2 и X3 представляют собой комбинацию трех СН-групп];
группу, представленную следующей формулой:
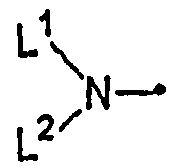
[где L1 представляет собой C1-С6алкильную группу, и
L2 представляет собой C1-С6алкильную группу, или L1 и L2, взятые вместе, представляют собой пирролидин-1-ил группу]; фенильную группу; феноксигруппу; или фениламиногруппу, где бензольное кольцо любой из указанных фенильных групп, указанной феноксигруппы и указанной фениламиногруппы может быть замещено 1-5 группами, независимо выбранными из группы, состоящей из C1-С6алкильных групп, незамещенных или замещенных одним или несколькими атомами галогена, C1-С6алкоксигрупп, атомов галогена, нитрогруппы, цианогруппы, C1-С6алкилсульфонильных групп, С2-С6алкоксикарбонильных групп и бензоильной группы, и R5 представляет собой атом водорода.
группа X: C1-С6алкильные группы, незамещенные или замещенные одним или несколькими атомами галогена, C1-С6алкоксигруппы, атомы галогена, нитрогруппа, цианогруппа, C1-С6алкилсульфонильные группы, С2-С6алкоксикарбонильные группы и бензоильная группа.
группа X: C1-С6алкильные группы, незамещенные или замещенные одним или несколькими атомами галогена, C1-С6алкоксигруппы, атомы галогена, нитрогруппа, цианогруппа, C1-С6алкилсульфонильные группы, С2-С6алкоксикарбонильные группы и бензоильная группа.
группа X: C1-С6алкильные группы, незамещенные или замещенные одним или несколькими атомами галогена, C1-С6алкоксигруппы, атомы галогена, нитрогруппа, цианогруппа, C1-С6алкилсульфонильные группы, С2-С12алкоксикарбонильные группы и бензоильная группа.
группа X: C1-С6алкильные группы, незамещенные или замещенные одним или несколькими атомами галогена, C1-С6алкоксигруппы, атомы галогена, нитрогруппа, цианогруппа, C1-С6алкилсульфонильные группы, С2-С6алкоксикарбонильные группы и бензоильная группа.
Документы, цитированные в отчёте о поиске
Изоксазолиновые производные и гербициды, содержащие их в качестве активных ингредиентов

Комментарии