Материал для аккумулирования тепла, способ изготовления материала для аккумулирования тепла и химический тепловой насос - RU2729004C1
Код документа: RU2729004C1
Чертежи

Описание
Область техники
[0001] Настоящее изобретение относится к материалу для аккумулирования тепла, способу изготовления материала для аккумулирования тепла и химическому тепловому насосу.
Уровень техники
[0002] К настоящему времени разработаны различные системы аккумулирования тепла, в частности, химические тепловые насосы, в которых используется теплоаккумулирующий материал, генерирующий теплоту реакции, теплоту адсорбции и/или теплоту гидратации при контакте с рабочим телом (теплоносителем), в частности, водой или аммонием.
[0003] В химическом тепловом насосе, использующем в качестве рабочего тела воду, например, при открытом соединительном клапане между блоком 10 хранения воды и блоком 20 удержания теплоаккумулирующего материала, как показано на левой стороне ФИГ. 1(a), вода в блоке хранения воды испаряется с образованием водяного пара (H2O (газ)), что обусловлено разностью давлений пара между блоком 10 хранения воды и блоком 20 удержания теплоаккумулирующего материала. Этот этап также называют этапом передачи холода из блока хранения воды наружу, осуществляемой путем испарения воды в блоке хранения воды с образованием водяного пара. В этом случае в таком химическом тепловом насосе водяной пар, образующийся в блоке 10 хранения воды, поступает в блок 20 удержания теплоаккумулирующего материала через канал 30 передачи водяного пара и вступает в реакцию с теплоаккумулирующим материалом с выделением теплоты реакции, теплоты адсорбции и/или теплоты гидратации наружу, как показано на правой стороне ФИГ. 1(a). Иными словами, в таком тепловом насосе тепло может передаваться со стороны блока 10 хранения воды на сторону блока 20 удержания теплоаккумулирующего материала.
[0004] Кроме того, в таком химическом тепловом насосе на этапе регенерации, обеспечивающем воспроизведение реакции, показанной на ФИГ. 1(a), тепло поступает снаружи в блок 20 удержания теплоаккумулирующего материала с целью десорбции воды из теплоаккумулирующего материала с образованием водяного пара, как показано на правой стороне ФИГ. 1(b). Этот этап может называться этапом передачи холода наружу из блока 20 удержания теплоаккумулирующего материала путем десорбции воды из теплоаккумулирующего материала в блоке 20 удержания теплоаккумулирующего материала. В этом случае в таком химическом тепловом насосе водяной пар, образующийся в блоке 20 удержания теплоаккумулирующего материала, поступает в блок 10 хранения воды, после чего конденсируется с выводом наружу скрытой теплоты конденсации.
[0005] В типичном варианте химического теплового насоса, в котором в качестве рабочего тела используется вода, теплоаккумулирующим материалом служат соединения щелочноземельных металлов, в частности, хлорид кальция. В этом случае, в частности, блок хранения воды поглощает тепло (то есть генерирует холод), а блок удержания теплоаккумулирующего материала может генерировать тепло при помощи описанных ниже реакций (а-1) и (а-2). Кроме того, возможны десорбция воды из теплоаккумулирующего материала, регенерация теплоаккумулирующего материала и конденсация десорбированной воды в блоке хранения воды путем подачи тепла в блок удержания теплоаккумулирующего материала при помощи описанных ниже реакций (b-1) и (b-2):
(а-1) H2O (жидкость)→Н20 (газ)…(поглощает тепло)
(а-2) CaCl2⋅H2O+H2O→CaCl2⋅H2O…(выделяет тепло)
(b-1) СаС12⋅2H2O→CaCl2⋅H2O+H2O…(поглощает тепло)
(b-2) H2O (газ)→H2O (жидкость)…(выделяет тепло)
[0006] В последние годы были предприняты усилия по совершенствованию характеристик накопления и рассеивания тепла в химических системах аккумулирования тепла, использующих в качестве рабочего тела воду или аммоний.
[0007] В частности, патентная литература 1 описывает химическую систему аккумулирования тепла, содержащую блок аккумулирования тепла для размещения теплоаккумулирующего материала, состоящего, по существу, из неорганического гидрата соли в жидком состоянии, блок хранения воды для хранения воды, участок подачи водяного пара для испарения воды, находящейся в блоке хранения воды, и подачи испаренной воды в теплоаккумулирующий материал в виде водяного пара, а также теплообменник для отведения тепла, выделяемого теплоаккумулирующим материалом в блоке аккумулирования тепла, наружу, причем тепло аккумулируется в теплоаккумулирующем материале путем испарения воды из теплоаккумулирующего материала, тепло рассеивается в результате реакции теплоаккумулирующего материала в состоянии аккумулирования тепла, и водяной пар улетучивается из блока хранения воды, причем теплоаккумулирующий материал содержит поверхностно-активное вещество и в состоянии аккумулирования тепла теплоаккумулирующий материал находится в жидком состоянии, обладая свойствами текучести.
[0008] Патентная литература 2 описывает способ производства композитного галогенида металла, содержащий этап подачи, на котором аммоний подают в контейнер, содержащий порошковую смесь, состоящую из множества исходных материалов галогенидов металла, отличающихся, по меньшей мере, металлическим или галогеновым элементом, или в формованное изделие, изготовленное из порошковой смеси, причем, по меньшей мере, один из множества металлических или галогеновых элементов, входящих в состав порошковой смеси, примешан для получения композитного галогенида металла.
[0009] Патентная литература 3 описывает химический теплоаккумулирующий материал, содержащий гидразиновый комплекс (МХ2⋅2NH3) галогенида металла (МХ2), содержащего один или несколько металлических элементов (М) из группы Mg, Mn, Fe, Со и Ni и один или несколько галогеновых элементов (X) из группы Br и I, причем гидразиновый комплекс галогенида металла представляет собой сложный гидразиновый комплекс галогенида металла, имеющий сложную кристаллическую структуру, относящуюся к пространственной группе Cmmm.
[0010] Патентная литература 4 описывает химический теплоаккумулирующий материал для выделения или аккумулирования тепла в результате поглощения или высвобождения рабочего тела, причем химический теплоаккумулирующий материал содержит сложную соль металла (MXn, где n=средняя валентность М), представляющую собой галогенид металла, содержащий металлический элемент (М) и галогеновый элемент (X), по меньшей мере, один из которых содержит два или более элементов, причем сложная соль металла имеет среднюю разность электроотрицательности (ΔЕа=ЕХа-ЕМа) от 0,3 до 2,16 или от 2,21 до 3,2, полученную вычитанием средней электроотрицательности металлического элемента (ЕМа) из средней электроотрицательности галогенового элемента (ЕХа).
[0011] Патентная литература 5 описывает двухвалентный активированный европием сложный галоидный люминофор, выраженный сложной формулой (I):

где MII представляет собой, по меньшей мере, один щелочноземельный металл, выбранный из группы Ва, Sr и Са; X и X' (каждый) - по меньшей мере, один галоген, выбранный из группы Cl, Br и I, причем X≠X'; Х''и X''' (каждый) - по меньшей мере, один галоген, выбранный из группы F, Cl, Br и I; а представляет собой числовое значение в диапазоне 0,1≤а≤10,0, b - числовое значение в диапазоне 0
[Список цитируемых материалов]
[Патентная литература]
[0012] [PTL1] Публикация не прошедшей экспертизу японской заявки на патент (Kokai) №2016-053438
[PTL2] Публикация не прошедшей экспертизу японской заявки на патент (Kokai) №2015-174783
[PTL3] Публикация не прошедшей экспертизу японской заявки на патент (Kokai) №2016-098234
[PTL4] Публикация не прошедшей экспертизу японской заявки на патент (Kokai) №2014-159497
[PTL5] Публикация не прошедшей экспертизу японской заявки на патент (Kokai) № S 61-235486
Сущность изобретения
[Техническая проблема]
[0013] Количество выделяемого тепла или холода в химической системе аккумулирования тепла, в которой в качестве рабочего тела используется вода, причем вода вступает в реакцию с теплоаккумулирующим материалом с образованием гидрата, теоретически определяется количеством воды, способной вступать в реакцию с теплоаккумулирующий материалом с образованием гидрата, то есть уровнем насыщения способности к гидратации теплоаккумулирующего материала.
[0014] Тем не менее, на практике в теплоаккумулирующем материале, обладающем склонностью к растворению в адсорбированной воде, в частности, соединениях щелочноземельных металлов, реакция с водяным паром не может протекать эффективно, поскольку площадь поверхности теплоаккумулирующего материала после его растворения в адсорбированной воде уменьшается; таким образом, трудно эффективно использовать теплоаккумулирующие материалы, обладающие склонностью к растворению в адсорбированной воде.
[0015] Кроме того, теплоаккумулирующие материалы, в частности, соединения щелочноземельных металлов, трудно использовать эффективно, поскольку реакция гидратации протекает в несколько этапов, и на этапе гидратации соединения переходят в метастабильное состояние, блокируя дальнейшее протекание реакции.
[0016] Таким образом, настоящее изобретение имеет целью разработку теплоаккумулирующего материала, обладающего высокой способностью к гидратации, который будет трудно поддаваться растворению в адсорбированной воде, и способность которого к гидратации можно будет эффективно использовать. Кроме того, настоящее изобретение имеет целью разработку способа производства такого теплоаккумулирующего материала, а также химического теплового насоса и способа аккумулирования тепла с использованием такого теплоаккумулирующего материала.
[Решение проблемы]
[0017] Примеры аспектов настоящего изобретения раскрыты ниже.
[0018] <Аспект 1>
Теплоаккумулирующий материал, представляющий собой композитный галогенид металла, содержащий одновалентный металл, двухвалентный металл и галоген.
<Аспект 2>
Теплоаккумулирующий материал в соответствии с аспектом 1, в котором композитный галогенид металла имеет структуру перовскита с соединением по формулам (1) или (2):


где А представляет собой одновалентный металл, В представляет собой двухвалентный металл, X представляет собой галоген, причем каждый из А, В и X может представлять собой один элемент или комбинацию из множества элементов с одинаковой валентностью.
<Аспект 3>
Теплоаккумулирующий материал в соответствии с аспектом 2, в котором композитный галогенид металла имеет структуру перовскита с соединением по формуле (1).
<Аспект 4>
Теплоаккумулирующий материал по любому из аспектов 1-3, в котором одновалентный металл выбран из группы, состоящей из щелочных и переходных металлов.
<Аспект 5>
Теплоаккумулирующий материал по аспекту 4, в котором одновалентный металл выбран из группы, состоящей из калия и цезия.
<Аспект 6>
Теплоаккумулирующий материал по любому из аспектов 1-5, в котором двухвалентный металл выбран из группы, состоящей из щелочноземельных и переходных металлов.
<Аспект 7>
Теплоаккумулирующий материал по аспекту 6, в котором двухвалентный металл выбран из группы, состоящей из магния и кальция.
<Аспект 8>
Теплоаккумулирующий материал по любому из аспектов 1-7, в котором галоген выбран из группы, состоящей из хлора, брома и йода.
<Аспект 9>
Теплоаккумулирующий материал по аспекту 8, в котором галоген представляет собой хлор.
<Аспект 10>
Способ изготовления теплоаккумулирующего материала по любому из аспектов 1-9, содержащий следующие этапы:
приготовление смеси путем смешивания галогенида одновалентного металла и гидрата галогенида двухвалентного металла, и
получение композитного галогенида металла путем термообработки
смеси.
<Аспект 11>
Химический тепловой насос, содержащий:
блок хранения воды для хранения воды, служащей в качестве рабочего тела,
блок удержания теплоаккумулирующего материала для удержания теплоаккумулирующего материала по любому из аспектов 1-9, и
канал передачи водяного пара, обеспечивающий возможность передачи водяного пара между блоком хранения воды и блоком удержания теплоаккумулирующего материала.
<Аспект 12>
Способ аккумулирования тепла, включающий в себя выполнение в химическом тепловом насосе по аспекту 11 аккумулирования и рассеивания тепла посредством гидратации и дегидратации рабочего тела в теплоаккумулирующем материале.
[Полезные эффекты изобретения]
[0019] Настоящим изобретением предложен теплоаккумулирующий материал, обладающий высокой способностью к гидратации, трудно поддающийся растворению в адсорбированной воде и позволяющий эффективно использовать свою способность к гидратации. Кроме того, настоящим изобретением предложены способ производства такого теплоаккумулирующего материала, а также химический тепловой насос и способ аккумулирования тепла с использованием такого теплоаккумулирующего материала.
Краткое описание чертежей
[0020] На ФИГ. 1 схематично изображен химический тепловой насос согласно настоящему изобретению и обычный химический тепловой насос.
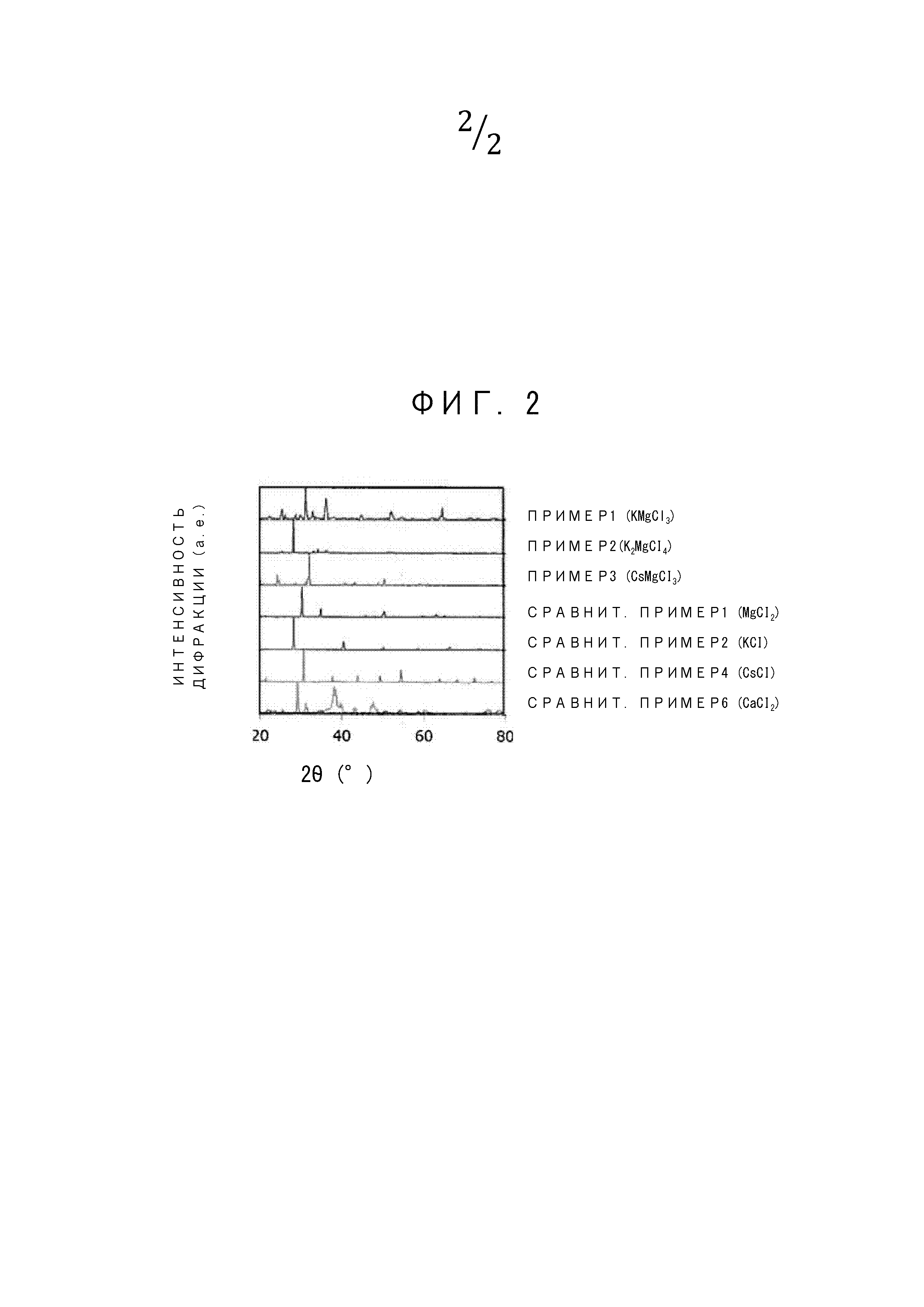
На ФИГ. 2 изображены результаты измерения рентгеновской дифракции для образцов, полученных в примерах 1-3 и сравнительных примерах 1, 2, 4 и 5.
Описание вариантов осуществления изобретения
[0021] Варианты осуществления настоящего изобретения будут раскрыты ниже. Тем не менее, настоящее изобретение не ограничено следующими вариантами осуществления.
[0022] <Теплоаккумулирующий материал>
Теплоаккумулирующий материал согласно настоящему изобретению представляет собой композитный галогенид металла, содержащий одновалентный металл, двухвалентный металл и галоген. «Композитный галогенид металла» согласно настоящему изобретению представляет собой соединение, в котором одновалентный металл и двухвалентный металл имеют ионную связь с галогеном с образованием единой соли, что отличает «композитный галогенид металла», например, от смеси галогенида одновалентного металла с галогенидом двухвалентного металла. Следует отметить, что форма теплоаккумулирующего материала не ограничена и обычно может представлять собой частицы или гранулы.
[0023] Авторы настоящего изобретения обнаружили, что композитные галогениды металла, содержащие одновалентный металл и двухвалентный металл (в дальнейшем - «композитный галогенид металла согласно настоящему изобретению»), обладают низкой склонностью к растворению в адсорбированной воде и/или полезными свойствами, благодаря чему их способность к гидратации может быть эффективно использована по сравнению с галогенидами двухвалентных металлов, в частности, соединениями щелочноземельных металлов. Такая низкая склонность к растворению в адсорбированной воде имеет преимущество с точки зрения формы теплоаккумулирующего материала и сохранения реакционной способности.
[0024] Несмотря на отсутствие теоретического обоснования, есть основания полагать, что двухвалентный металл полезен для гидратации, поскольку он может легко координироваться водой, и наоборот, одновалентный металл в меньшей степени допускает координирование водой по сравнению с двухвалентным металлом. Путем такой первичной координации галогена композитный галогенид металла сохраняет каркасную структуру, и растворение в адсорбированной воде предотвращается.
[0025] Таким образом, относительная влажность (RH relative humidity), при которой композитный галогенид металла согласно настоящему изобретению растворяется в адсорбированной воде при 20°С, составляет, например, 35% и более, 40% и более или 45% и более и 80% и менее, 70% и менее или 60% и менее.
[0026] Следует отметить, что соединения галогенидов двухвалентных металлов, в частности, соединения щелочноземельных металлов, обычно имеют метастабильное промежуточное состояние гидратации между безводным и насыщенным состоянием гидратации, в результате чего после этого этапа протекание гидратации может быть затруднено. Композитный галогенид металла согласно настоящему изобретению позволяет предотвратить такое метастабильное промежуточное состояние. Например, реакция гидратации композитного галогенида металла согласно настоящему изобретению может протекать в один этап.
[0027] (Кристаллическая структура)
В предпочтительных вариантах осуществления настоящего изобретения композитный галогенид металла согласно настоящему изобретению имеет структуру перовскита с соединением по формулам (1) или (2), приведенным ниже, в частности, имеет структуру перовскита с соединением по формуле (1), приведенной ниже:

где А представляет собой одновалентный металл, В - двухвалентный металл, X - галоген, причем каждый из А, В и X может представлять собой один элемент или комбинацию из множества элементов с одинаковой валентностью.
[0028] В качестве метода оценки наличия или отсутствия структуры перовскита были рассмотрены известные методы, в частности, анализ Ритвельда данных рентгеновской дифракции. Кроме того, наличие или отсутствие структуры перовскита можно подтвердить путем сравнения данных рентгеновской дифракции кристаллического образца с профилями рентгеновской дифракции известных кристаллов перовскита.
[0029] В структуре перовскита стабильная кристаллическая структура образуется благодаря заметному различию ионного радиуса между одновалентным и двухвалентным металлом. Следовательно, есть основания считать, что высокая способность к гидратации и низкая склонность к растворению в адсорбированной воде могут быть совместимы друг с другом благодаря наличию одновалентного металла с большим ионным радиусом, менее склонного к гидратации, и двухвалентного металла с малым ионным радиусом, более склонного к гидратации.
[0030] С точки зрения обеспечения благоприятных условий для формирования структуры перовскита комбинация одновалентного и двухвалентного металла предпочтительно подбирается так, чтобы разность между ионными радиусами была большой. Предпочтительные примеры такой комбинации включают в себя: KMgCl3, K2MgCl4 и CsMgCl3. Известно, что соединение MgCl2, являющееся галогенидом двухвалентного металла, отличается высокой склонностью к растворению в адсорбированной воде, в то же время, поскольку соединения KMgCl3, K2MgCl4 и CsMgCl3 дополнительно содержат одновалентный металл, они могут проявлять пониженную склонность к растворению в адсорбированной воде по сравнению с MgCl2, обладая при этом высокой способностью к гидратации.
[0031] (Одновалентный металл)
Одновалентные металлы обычно выбирают из группы, состоящей из щелочных и переходных металлов, в частности, щелочных металлов. В настоящем изобретении под щелочными металлами понимают элементы группы I. С точки зрения простоты получения композитного галогенида металла, щелочной металл выбирают из группы, состоящей из лития (Li), натрия (Na), калия (K), рубидия (Rb) и цезия (Cs). Кроме того, примеры переходных металлов, которые могут стать одновалентными металлами, включают в себя хром (Cr) и медь (Cu).
[0032] Относительно большой ионный радиус одновалентного металла предпочтителен с точки зрения облегчения образования стабильной галоидной соли (например, структуры перовскита) в сочетании с двухвалентным металлом, а также с точки зрения затруднения ее гидратации. Учитывая вышесказанное, одновалентный металл, предпочтительно, выбирают из группы, состоящей из калия (K), рубидия (Rb) и цезия (Cs).
[0033] Щелочной металл более предпочтителен в качестве одновалентного металла с точки зрения стабильности его склонности к гидратации по сравнению с переходными металлами, имеющими переменные валентности.
[0034] (Двухвалентный металл)
Двухвалентные металлы обычно выбирают из группы, состоящей из щелочноземельных и переходных металлов, в частности, щелочноземельных металлов. В настоящем изобретении под щелочноземельными металлами понимают элементы группы II. С точки зрения простоты получения композитного галогенида металла, щелочноземельный металл обычно выбирают из группы, состоящей из магния (Mg), кальция (Са), стронция (Sr) и бария (Ва). Кроме того, примеры переходных металлов, которые могут стать двухвалентными металлами, включают в себя цинк (Zn), медь (Cu), железо (Fe), свинец (Pb), никель (Ni), марганец (Mn) и олово (Sn).
[0035] Относительно малый ионный радиус двухвалентного металла предпочтителен с точки зрения облегчения образования стабильной галоидной соли (например, кристаллической структуры перовскита) в комбинации с одновалентным металлом, а также с точки зрения простоты ее гидратации. Учитывая вышесказанное, двухвалентный металл, предпочтительно, выбирают из группы, состоящей из магния и кальция, более предпочтительно, магния.
[0036] Щелочноземельные металлы более предпочтительны в качестве двухвалентного металла с точки зрения стабильности его склонности к гидратации по сравнению с переходными металлами, имеющими переменные валентности.
[0037] (Галоген)
В настоящем изобретении под галогенами понимают элементы группы 17. С точки зрения простоты получения композитного галогенида металла, галоген предпочтительно выбирают из группы, состоящей из хлора (Cl), брома (Br) и йода (I), более предпочтительно, хлора (Cl).
[0038] <Способ производства теплоаккумулирующего материала>
Способ производства теплоаккумулирующего материала согласно настоящему изобретению содержит следующие этапы:
приготовление смеси путем смешивания галогенида одновалентного металла и гидрата галогенида двухвалентного металла, и
получение композитного галогенида металла путем термообработки смеси.
[0039] Использование гидрата галогенида двухвалентного металла в качестве источника двухвалентного металла вместо ангидрида галогенида двухвалентного металла предпочтительно для надлежащего производства теплоаккумулирующего материала согласно настоящему изобретению.
[0040] В частности, если при получении композитного галогенида металла согласно настоящему изобретению используется ангидрид галогенида двухвалентного металла, то после смешивания галогенида одновалентного металла с ангидридом галогенида двухвалентного металла необходимо выполнить термообработку после выполнения механической операции по уплотнению смеси, а далее необходимо многократно повторять уплотнение и термообработку для увеличения выхода реакции. Таким образом, поскольку в предложенном настоящим изобретением способе вместо ангидрида галогенида двухвалентного металла используют гидрат галогенида двухвалентного металла, то композитный галогенид металла можно получать с высоким выходом реакции даже в отсутствие такой механической операции.
[0041] Число гидратации гидрата галогенида двухвалентного металла, используемого в способе согласно настоящему изобретению, предпочтительно, является максимальным числом гидратации соединения. Например, в случае MgCl2 предпочтительно использовать MgCl2⋅6H2O, представляющий собой гексагидрат. Таким образом, для получения, например, соединения KMgCl3, являющегося композитным галогенидом металла, KCl можно использовать в качестве галогенида одновалентного металла, a MgCl2⋅6H2O - в качестве гидрата галогенида двухвалентного металла.
[0042] Продолжительность смешивания галогенида одновалентного металла и гидрата галогенида двухвалентного металла в способе согласно настоящему изобретению может составлять, например, 1 минуту и более, 5 минут и более или 10 минут и более, и может составлять 1 час и менее, 30 минут и менее или 20 минут и менее.
[0043] Термообработка в способе согласно настоящему изобретению может выполняться в атмосфере инертного газа, например, азота. Температура термообработки, например, близка к температуре плавления соответствующего композитного галогенида металла и может составлять, например, 60% и более, 70% и более или 80% и более от температуры плавления (°С), и может составлять 100% и менее, 95% и менее или 90% и менее от температуры плавления (°С). Для справки: температура плавления KMgCl3 составляет примерно 487°С, температура плавления K2MgCl4 - примерно 429°С, температура плавления CsMgCl3 - примерно 610°С. Длительность термообработки может составлять, например, 1 час и более, 3 часа и более, 5 часов и более или 10 часов и более, и может составлять 24 часа и менее, 20 часов и менее или 15 часов и менее.
[0044] <Применение теплоаккумулирующих материалов>
Химический тепловой насос согласно настоящему изобретению содержит, как показано на ФИГ. 1(a), блок 10 хранения воды для хранения воды, служащей рабочим телом, блок 20 удержания теплоаккумулирующего материала, полученного согласно настоящему изобретению, и канал 30 передачи водяного пара, обеспечивающий передачу водяного пара между блоком хранения воды и блоком удержания теплоаккумулирующего материала.
[0045] При использовании такого химического теплового насоса аккумулирование и рассеивание тепла выполняется посредством гидратации и дегидратации рабочего тела в теплоаккумулирующем материале химического теплового насоса. В частности, например, при использовании этого химического насоса водяной пар, образующийся при испарении воды в блоке хранения воды, поступает в блок удержания теплоаккумулирующего материала, причем водяной пар вступает в реакцию с теплоаккумулирующим материалом, удерживаемым в блоке удержания теплоаккумулирующего материала, а тепловая энергия, выделенная реакцией гидратации, рассеивается. Соответственно, в блоке хранения воды образуется холод, обусловленный теплотой испарения. И, наоборот, во время регенерации теплоаккумулирующего материала из теплоаккумулирующего материала получают водяной пар путем введения тепла в блок удержания теплоаккумулирующего материала, и этот водяной пар конденсируется в блоке хранения воды для получения воды.
[0046] Химический тепловой насос могут использовать системы кондиционирования, осушения воздуха и т.п.
ПРИМЕРЫ
[0047] Настоящее изобретение будет детально раскрыто ниже на примерах. Тем не менее, настоящее изобретение не ограничивается этими примерами.
[0048] <Подготовка образца>
(Пример 1)
Эквимолярные KCl и MgCl2⋅6H2O смешивали при комнатной температуре в течение 20 минут, после чего смесь подвергали термообработке при 400°С в течение 12 часов, чтобы получить порошок KMgCl3 в качестве образца из примера 1. Следует отметить, что образцы для примера 1, а также приведенных ниже примеров и сравнительных примеров, были приготовлены в атмосфере азота.
[0049] Для справки: эквимолярные KCl и MgCl2 смешивали при комнатной температуре в течение 20 минут, после чего уплотняли под давлением 10 МПа при комнатной температуре. Полученное уплотненное тело подвергали термообработке при 400°С в течение 12 часов. Тем не менее, этот процесс не позволил получить порошок KMgCl3. При повторном смешивании, уплотнении и термообработке в таких же условиях удавалось получить порошок KMgCl3, аналогичный описанному выше (подтверждено с помощью профилирования рентгеновской дифракцией).
[0050] (Пример 2)
MgCl2 и KCl при двойном мольном числе MgCl2 смешивали при комнатной температуре в течение 20 минут, а затем уплотняли под давлением 10 МПа при комнатной температуре. Полученное уплотненное тело подвергали термообработке при 400°С в течение 12 часов. Смешивание, уплотнение и термообработку повторили при таких же условиях, чтобы получить порошок K2MgCl4 в качестве образца для примера 2.
[0051] (Пример 3)
Эквимолярные CsCl и MgCl2⋅6H2O смешивали при комнатной температуре в течение 20 минут, после чего подвергали термообработке при 480°С в течение 12 часов. Перемешивание и термообработку повторили для получения порошка CsMgCl3 в качестве образца для примера 3.
[0052] (Сравнительный пример 1)
В качестве образца для сравнительного примера 1 было взято доступное на рынке соединение MgCl2 в форме порошка.
[0053] (Сравнительный пример 2)
В качестве образца для сравнительного примера 2 было взято доступное на рынке соединение KCl в форме порошка.
[0054] (Сравнительный пример 3)
Эквимолярные порошок MgCl2, аналогичный использующемуся в сравнительном примере 1, и порошок KCl, аналогичный использующемуся в сравнительном примере 2, смешивали при комнатной температуре в течение 20 минут, чтобы получить композитный порошок в качестве образца для сравнительного примера 3.
[0055] (Сравнительный пример 4)
В качестве образца для сравнительного примера 4 было взято доступное на рынке соединение CsCl в форме порошка.
[0056] (Сравнительный пример 5)
Эквимолярные порошок MgCl2, аналогичный использующемуся в сравнительном примере 1, и порошок CsCl, аналогичный использующемуся в сравнительном примере 4, смешивали при комнатной температуре в течение 20 минут для получения композитного порошка в качестве образца для сравнительного примера 5.
[0057] (Сравнительный пример 6)
В качестве образца для сравнительного примера 6 было взято доступное на рынке соединение CaCl2 в форме порошка.
[0058] <Оценка>
1. Подтверждение кристаллической структуры
Кристаллические структуры образцов, полученных в описанных выше примерах и сравнительных примерах, были подтверждены измерением рентгеновской дифракции в следующих условиях:
Измерительное устройство: RINT RAPID II (производства Rigaku Corporation) Условия измерения: напряжение 50 В, ток 100 мА, коллиматор ϕ0.3, угол образца ω=15°
[0059] Чтобы образцы, полученные в примерах и сравнительных примерах, не вступали в реакцию с атмосферной влагой, поверхности образцов были покрыты клейкой лентой для использования в качестве образцов для измерения.
[0060] На ФИГ. 2 изображены результаты измерения рентгеновской дифракции образцов, полученных в примерах 1-3 и сравнительных примерах 1, 2, 4 и 6.
[0061] По результатам рентгеновской дифракции, показанным на ФИГ. 2, есть основания полагать, что дифракционный пик примера 1 (KMgCl3) отличается от простого суммирования дифракционных пиков сравнительного примера 1 (MgCl2) и сравнительного примера 2 (KCl), то есть дифракционный пик примера 1 (KMgCl3) представляет собой пик композитного галогенида металла, а не пик смеси галогенида щелочноземельного металла и галогенида щелочного металла.
[0062] 2. Измерение изотермы адсорбции водяного пара (гидратации)
Изотермы адсорбции водяного пара были получены для образцов до следующей обработки и после нее:
Устройство для предварительной обработки: BELSORP-vacII (производства Microtrac-Bel Corporation)
Условия предварительной обработки: Уровень вакуума: 10-2 Па и менее, с нагревом при 150°С в течение 6 часов
Измерительное устройство: BELSORP-max (производства Microtrac-Bel Corporation)
Условия измерения: Температура 20°С, величина адсорбции водяного пара измерена от относительного давления 0 до относительного давления при растворении (образца) в адсорбированной воде.
[0063] (1) Реакция гидратации, количество этапов
В описанных выше изотермах, если изотерма ступенчато изменялась по мере увеличения относительной влажности, то количество этапов оценивалось как равное количеству этапов реакции гидратации. Результаты оценки показаны в нижеприведенной таблице 1.
[0064] (2) Влажность растворения в адсорбированной воде
В описанных выше изотермах, когда величина адсорбции водяного пара резко возрастала при определенной относительной влажности и продолжала расти при этой относительной влажности, предполагалось, что образец растворяется в адсорбированной воде при этой относительной влажности. Результаты оценки показаны в нижеприведенной таблице 1.
[0065] 3. Способность к гидратации (термический гравиметрический анализ)
Образцы примеров и сравнительных примеров были гидратированы до этапа перед растворением в адсорбированной воде для получения гидратированных образцов. Гидратированные образцы были помещены в описанное ниже измерительное устройство, и было измерено изменение веса при повышении температуры в условиях повышения температуры, описанных ниже. Результаты оценки показаны в нижеприведенной таблице 1.
Измерительное устройство: Pyris TGA (производства Perkinelmer Corporation)
Условия нагрева: Температура от 30 до 500°С, скорость нагрева 2°С/мин
[0066]

[0067] Как показано в Таблице 1, в образцах примеров, соответствующих композитному галогениду металла согласно настоящему изобретению, способность к гидратации и влажность растворения в адсорбированной воде были выше по сравнению с образцами сравнительных примеров.
[0068] В частности, например, у хлорида магния (MgCl2) из сравнительного примера 1 способность к гидратации составила 0,215 г воды/г образца, а влажность растворения в адсорбированной воде - 32% RH. У хлорида калия (KCl) из сравнительного примера 2 способность к гидратации составила 0 г воды/г образца (неспособный к гидратации), а влажность растворения в адсорбированной воде - 75% RH. Напротив, у образцов из примеров 1, 2 и 3 (KMgCl3, K2MgCl4 и CsMgCl3) способность к гидратации была выше, чем таковая у образцов из сравнительных примеров, а влажность растворения в адсорбированной воде составила 49% RH. Эти результаты подтверждают, что композитный галогенид металла согласно настоящему изобретению отличается как хорошей способностью к гидратации, так и низкой склонностью к растворению в адсорбированной воде.
Реферат
Изобретение относится к теплоаккумулирующим материалам. Способ изготовления теплоаккумулирующего материала, представляющего собой композитный KMgCl, заключается в приготовлении смеси путем смешивания KCl и MgCl⋅6HO и получении композитного KMgClпутем термообработки смеси. Химический тепловой насос содержит блок хранения воды, служащей рабочим телом, блок удержания теплоаккумулирующего материала и канал для передачи водяного пара, обеспечивающий передачу водяного пара между блоком хранения воды и блоком удержания теплоаккумулирующего материала. Способ аккумулирования тепла включает в себя выполнение в химическом тепловом насосе аккумулирования и рассеивания тепла посредством гидратации и дегидратации рабочего тела в теплоаккумулирующем материале. Обеспечивается получение теплоаккумулирующего материала, обладающего высокой способностью к гидратации и трудно поддающегося растворению в адсорбированной воде. 3 н.п. ф-лы, 1 табл., 9 пр., 3 ил.
Формула
Документы, цитированные в отчёте о поиске
Теплоаккумулирующая смесь для накопления и использования тепла фазового превращения и способ ее получения

Комментарии