N,n'-ди(алкадиинил)диазациклоалканы и способ получения n,n'-ди(алкадиинил)диазациклоалканов, проявляющих фунгицидную активность по отношению к грибам bipolaris sorokiniana и rhizoctonia solani - RU2727138C1
Код документа: RU2727138C1
Описание
Предлагаемое изобретение относится к органической химии, в частности, к способу получения N,N'-ди(алкадиинил)диазациклоалканов общей формулы (1), обладающих фунгицидной активностью против фитопатогенных грибов Bipolaris sorokiniana, Rhizoctonia solani.

Соединения общей формулы (1) могут быть использованы в качестве универсальных прекурсоров для тонкого органического синтеза [Groaz Е., Banti D., North М. Tetrahedron, 2008, 64, 204-218; Kashid V.S., Balakrishna M S. Catalysis Comm., 2018, 103, 78-82] и получения биологически активных соединений [Afrakssou Z., Haoudi A., Capet F., Mazzah A., Rolandoc C, Amman L. El // J. Acta Cryst. 2013, E69. 944].
Известен способ (Kabalka G. W., Wang L., Pagni R. M. Microwave-Enhanced, Solventless Mannich Condensation on Cul-Doped Alumina. J. Synlett, 2001, 5, 676-678; Kabalka G.W, Zhou Li-Li, Wang L., Pagni R. M. J. Tetrahedron, 2006, 62, 857-867) получения диацетилендиаминов общей формулы (2) взаимодействием терминальных ацетиленов с пиперазином и формальдегидом под действием стехиометрических количеств иодида меди на окиси алюминия при ультразвуковом облучении с выходом 49-65% по схеме:

Известным способом не могут быть получены N,N'-ди(алкадиинил)диазациклоалканы общей формулы (1).
Известен способ [Zhang Y., Feng H., Liu X., Liliang H. Eur. J. Org. Chem., 2018, 2039-2046 DOI: 10.1002/ejoc.201800393] получения диацетилендиаминов общей формулы (3) с выходом 39-96% конденсацией α,ω-диаминов, 37%-ного формальдегида и α-ацетиленов в диоксане под действием CuCl (20 мол %) в условиях микроволнового облучения (максимальная мощность 100 Вт) при 70°С в течение 30 минут по схеме:

Известным способом не могут быть получены N,N'-ди(алкадиинил)диазациклоалканы общей формулы (1), сведения о которых в литературе отсутствуют.
Предлагается новый способ получения N,N'-ди(алкадиинил)диазациклоалканов общей формулы (1), проявляющих фунгицидную активность.
Сущность способа заключается во взаимодействии циклических вторичных диаминов (имидазолидин, пиперазин, 1,4-диазепан) с α,ω-диацетиленами общей формулы НС≡С-СН2-(СН2)n-СН2-С≡СН (где n=1-4) и альдегидами (RCHO, R=Н, p-F-C6H4) при мольном соотношении диамин : α,ω-диацетилен : альдегид, равном 1:2:2, в присутствии катализатора CuCl (10 мол %) в атмосфере аргона при температуре 100°С в среде толуола в течение 8 ч. Выход N,N'-ди(алкадиинил)диазациклоалканов формулы (1) составляет 31-68%. Реакция протекает по схеме:
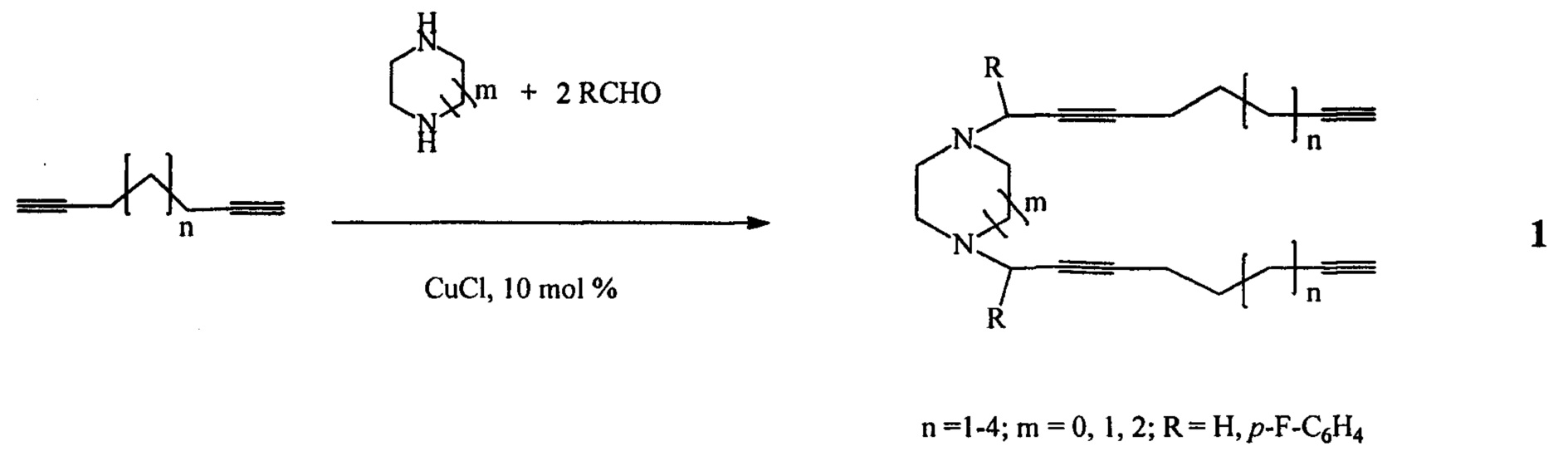
N,N'-Ди(алкадиинил)диазациклоалканы (1) образуются только лишь с участием циклических вторичных диаминов (имидазолидин, пиперазин, 1,4-диазепан), α,ω-диацетиленов и альдегидов, взятых в стехиометрическом соотношении 1:2:2, под действием катализатора CuCl (10 мол. %). При другом соотношении исходных реагентов или в присутствии других Cu-содержащих катализаторов (CuCl2, CuBr) снижается выход целевого продукта (1). При использовании в качестве катализатора CuBr2 реакция проходит с образованием целевых продуктов с выходами, не превышающими 25%. Реакции проводили при температуре 100°С. При более высокой температуре (например, 110°С) увеличиваются энергозатраты. При температуре ниже 100°С (например, 80°С) снижается скорость реакции. Опыты проводили в толуоле, т.к. в нем хорошо растворяются исходные реагенты и целевые продукты.
Существенные отличия предлагаемого способа:
В известных способах в качестве исходных реагентов применяются 1-алкины (фенилацетилен, 1-октан, 4-этинилтолуол, 1-этил-4-этинилбензол, циклопропилацетилен). Известные способы не позволяют получать индивидуальные N,N'-ди(алкадиинил)диазациклоалканы общей формулы (1). В предлагаемом способе в качестве исходных реагентов применяются α,ω-диацетилены. Предлагаемый способ позволяет селективно получать индивидуальные N,N'-ди(алкадиинил)диазациклоалканы общей формулы (1).
Способ поясняется следующими примерами:
Пример 1. В сосуд Шленка, установленный на магнитной мешалке, в атмосфере аргона помещают 0.085 г (1 ммоль) пиперазина, 3 мл толуола, 0.06 г (2 ммоль) параформа и 0.3 г (2 ммоль) 1,7-октадиина, добавляют CuCl (0.0099 г, 10 мол. %), перемешивают при температуре 100°С в течение 8 ч, отфильтровывают через слой SiO2, промывают хлороформом 3×5 мл, упаривают, целевой продукт очищают методом колоночной хроматографии. Выход 1,4-ди(2,7-октадиинил)пиперазина (1а) составляет 102 мг (68%). Другие примеры, подтверждающие способ, приведены в табл. 1.
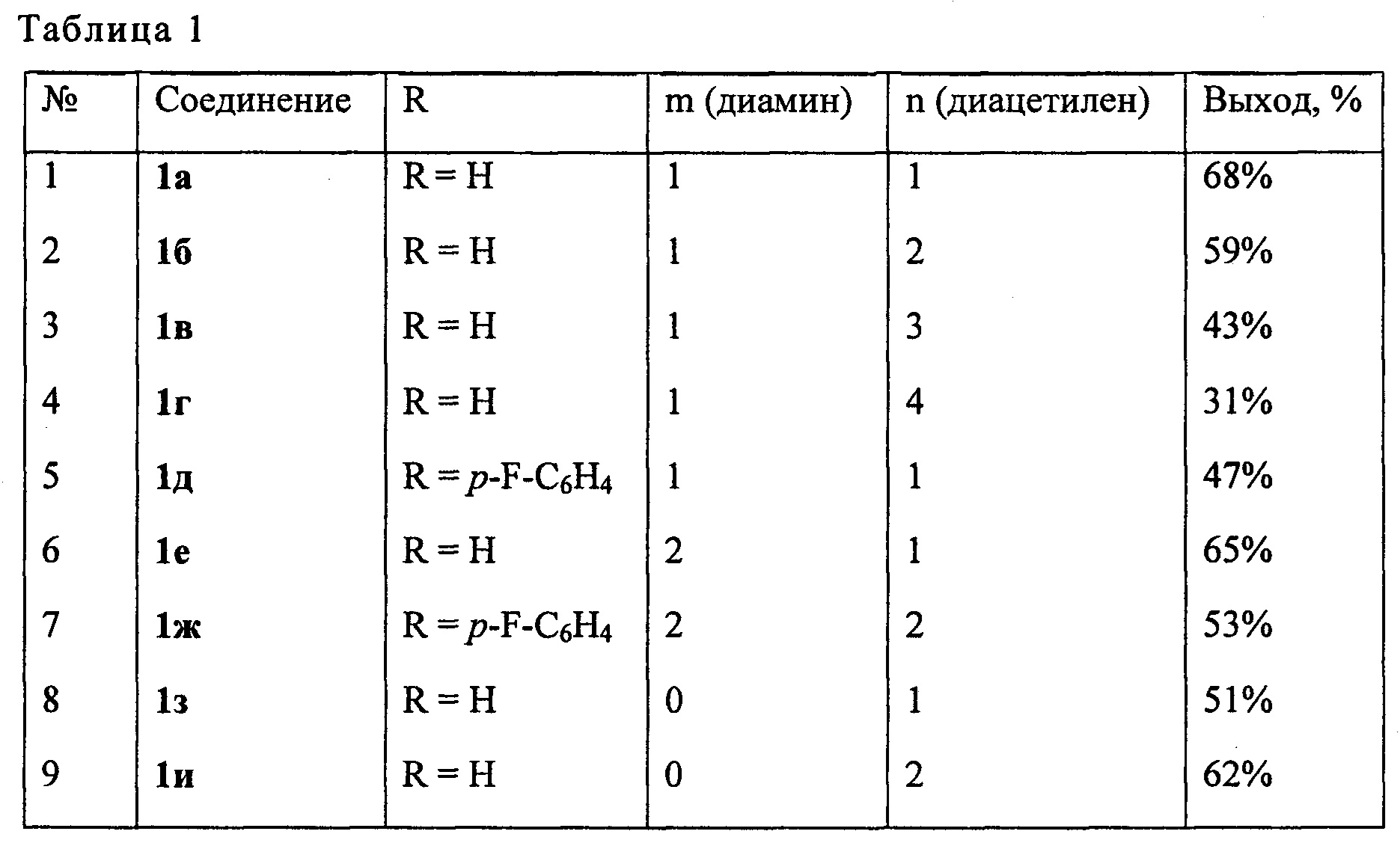
Физико-химические характеристики соединений 1а-и:*

1,4-Ди(2,7-октадиинил)пиперазин (1а).

Белый порошок, выход 0.199 г (68%); т. пл. 39-42°С. Rf 0.63 (бензол - ацетон, 1:1). ИК-спектр, v/см-1 (пленка): 3307, 2939, 2912, 2820, 2251, 2197, 1618, 1457, 1432, 1334, 1151, 1131, 1150, 1131, 1007, 908, 813, 733, 649. Спектр ЯМР1Н (400 МГц, CDC13, δ, м.д., J/Гц): 1.65-1.69 (м, 4Н, CH2CH2CH2), 1.92 (с, 2Н, С≡СН), 2.23-2.26 (м, 8Н, CH2CH2CH2), 2.57 (уш.с, 8Н, N(CH2CH2)2), 3.21 (уш с, 4Н, NCH2C≡C). Спектр ЯМР13С (100 МГц, δ, м.д.): 17.6 (СН2С≡СН), 17.8 (СН2С≡ССН2СН2), 27.6 (С≡СН2СН2), 47.2 (NCH2C≡C), 51.8(N(CH2CH2)N), 68.8 (-С≡СН), 75.4 (NCH2C≡C-), 83.5 (С≡СН), 84.2 (NCH2C≡C-). Масс-спектр MALDI-TOF, m/z: 295.2355 [М+Н]+ C20H27N2, 317.2100 [M+Na]+C20H26N2Na, 333.1723 [М+К]+C20H26N2K. Вычислено: 295.2174 [М+Н]+, 317.1994 [M+Na]+, 333.1733 [М+K]+.
1,4-Ди(2,8-нонадиинил)пиперазин (1б).

Белый порошок, выход 0.189 г (59%); т.пл. 62-65°С.Rf 0.45 (Et2O - С6Нб - изо-PrOH, 4:2:1). ИК-спектр, v/см-1 (пленка): 3302 (≡С-Н); 2928, 2858, 2814, 2767 (СН2), 2117 (-С≡С-); 1133, 1009 (-C-N-), 1456, 1384, 1331, 812 (-СН3). Спектр ЯМР1H (500 МГц, CDCl3, δ, м.д., J/Гц): 1.62-1.64 (м, 8Н, СН2(СН2)2СН2), 1.95-1.96 (т, 2Н,4J=2.7, С≡СН), 2.20-2.23 (м, 8Н, CH2(CH2)2CH2), 2.64 (уш с, 8Н, W1/2=50, N(CH2CH2)2), 3.27 (т, 4Н,4J=2, NCH2C≡C). Спектр ЯМР13С (125 МГц, δ, м.д.): 17.9 (СН2С≡СН), 18.3 (СН2С≡ССН2СН2), 27.6 (С=СН2СН2), 27.7 (СН2СН2С≡СН), 47.3 (NCH2C≡C), 51.9 (N(CH2CH2)N), 68.5 (-С≡СН), 75.1 (NCH2C≡C-), 84.2 (С≡СН), 84.9 (NCH2C≡C-). Масс-спектр MALDI-TOF, m/z: 323.2941 [М+Н]+ C22H31N2, 345.2606 [M+Na]+ C22H30N2Na, 361.2262 [M+K]+ C22H30N2K. Вычислено: 323.2487 [M+H]+, 345.2307 [M+Na]+, 361.2046 [M+K]+.
1,4-Ди(2,9-декадиинил)пиперазин (1в).
Коричневое масло, выход 0.15 г (43%); Rf 0.3 (С6Н6 - СО(СН3)2 - изо-PrOH, 1:2:0.5). ИК-спектр, v/см-1 (пленка): 636, 755, 812, 1009, 1133, 1150, 1332, 1455, 1680, 2116, 2230, 2254, 2814, 2860, 2932. Спектр ЯМР1Н (500 МГц, CDC13, δ, м.д., J/Гц): 1.45-1.48 (м, 12Н, СН2(СН2)3СН2), 1.92 (с, 2Н, С≡CH), 2.13-2.15 (м, 8Н, CH2(CH2)3CH2), 2.57 (уш с, 8Н, N(CH2CH2)2), 3.20 (с, 8Н, NCH2C≡C). Спектр ЯМР13С (125 МГц, δ, м.д.): 18.3 (СН2С≡СН), 18.6 (СН2С≡ССН2СН2), 27.9, 28.2, 28.3 (СН2(СН2)3СН2), 47.2 (NCH2C≡C), 51.8 (N(CH2CH2)2N), 68.3 (-С≡СН), 74.9 (NCH2C≡C-), 84.5 (С≡СН), 85.2 (NCH2C≡C-). Масс-спектр MALDI-TOF, m/z: 351.2679 [М+Н]+ C24H35N2, 373.2450 [M+Na]+ C24H34N2Na, 389.2048 [M+K]+ C24H34N2K. Вычислено: 351.2800 [M+H]+, 373.2620 [M+Na]+, 389.2359 [M+K]+.
1,4-Ди(2,10-ундекадиинил)пиперазин (1г).

Светло-коричневый порошок, выход 0.117 г (31%); т пл 46-48° Rf 0.63 (С6Н6 - EtOAc -изо-PrOH, 2:3:0.5). ИК-спектр, v/см-1 (пленка): 3295, 2931, 2858, 2814, 2767, 2117; 1455, 1338, 1289, 1133, 1009 (-C-N-), 1456, 1384, 1331, 812 (-СН3). Спектр ЯМР1Н (500 МГц, CDC13, δ, м.д., J/Гц): 1.39-1.42 (м, 8Н, CH2CH2(CH2)2CH2CH2), 1.50-1.53 (м, 8Н, СН2СН2(СН2)2СН2 СН2), 1.94 (м, 2Н, С=СН), 2.17-2.20 (м, 8Н, CH2(CH2)4CH2), 2.64 (уш с, 8Н, W1/2=40, N(CH2CH2)2N), 3.27 (с, 4Н, NCH2C≡C). Спектр ЯМР13С (125 МГц, δ, м.д.): 18.3 (СН2С≡СН), 18.7 (СН2С≡ССН2СН2), 28.2 (СН2), 28.3 (СН2), 28.4 (СН2), 28.6 (СН2), 47.3 (NCH2C≡C), 51.9 (N(CH2CH2)N), 68.2 (-С≡СН), 74.8 (NCH2C≡C-), 84.6 (С≡СН), 85.5 (NCH2C≡C-). Масс-спектр MALDI-TOF, m/z: 379.4382 [М+Н]+; C26H39N2. Вычислено: 379.3113
1,4-Бис[1-(4-фторфенил)-2,8-нонадиинил]пиперазин (1д).
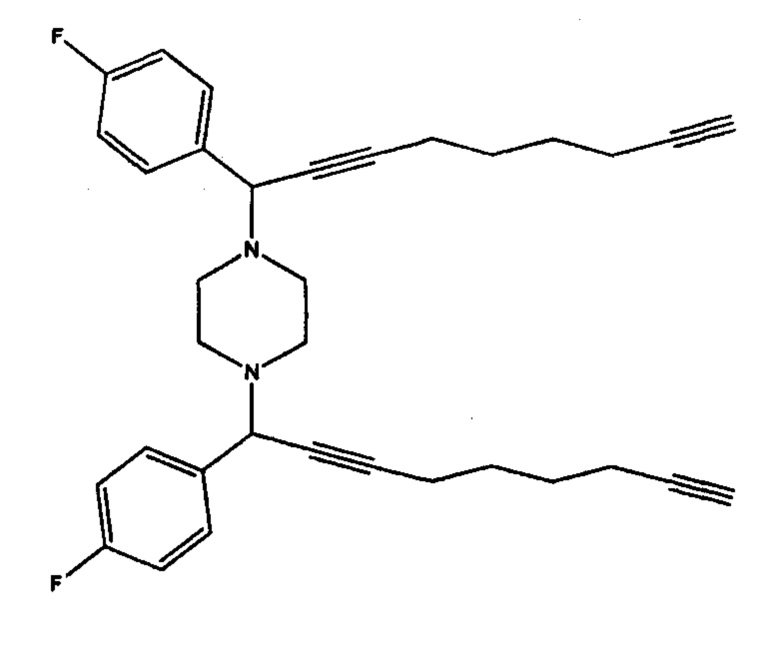
Коричневое масло, выход 0.239 мг (47%); Rf 0.75 (гексан - EtOAc, 2:1). ИК-спектр, v/см-1(пленка): 3305 (≡С-Н); 3069, 2928, 2861 (СН2), 2237 (-С≡С-); 1604 (Ph); 1227, 1156, 1094, 1015 (-C-N-), 998 (-CF), 757, 636 (≡С-Н). Спектр ЯМР1Н (500 МГц, CDC13, δ, м.д., J/Гц): 1.67-1.75 (м, 8Н, СН2(СН2)2СН2), 1.97-1.99 (д, 2Н, J=7, C≡СН), 2.24-2.28 (м, 4Н, СНС≡ССН2), 2.34-2.38 (м, 4Н, СН2С≡СН), 2.53 (уш с, 8Н, N(CH2CH2)2N), 4.53 (с, 2Н, NCH(Ar)C≡C), 6.99-7.05 (м, 4Н, (СН(Ar)), 7.48-7.55 (м, 4Н, СН(Ar)). Спектр ЯМР13С (125 МГц, δ, м.д., J/Гц): 18.0 (СН2С≡СН), 18.4 (СН2С≡ССН2СН2), 27.6 (СН2С≡ССН2СН2), 27.9 (СН2СН2С≡C), 49.3 (уш. с. N(CH2CH2)2N), 60.5 (NCH(Ar)C≡C), 68.5 (C≡C), 76.2 (NCH(Ar)C≡C), 84.1 (NCH(Ar)C≡C), 87.8 (C≡C), 114.8 (д, J=21.1, CH(Ar)), 130.1 (д, J=7.9, CH(Ar)), 134.4 (C(Ar)), 162.2 (д, J=244.5, CF(Ar)). Масс-спектр MALDI-TOF, m/z: 509.2870 [M-H]+. C34H35F2N2. Вычислено: 509.2768.
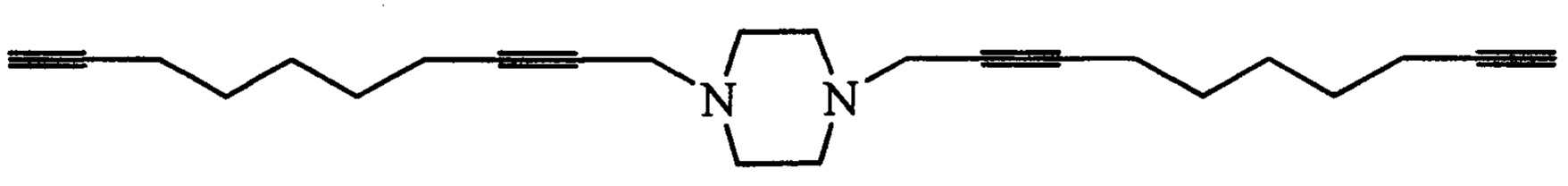
1,4-Ди(2,7-октадиинил)-1,4-диазепан (1e).

Светло-желтое масло, выход 0.308 мг (65%); Rf 0.5 (СбН6 - EtOAc - изо-PrOH, 2:1:0.5). ИК-спектр, v/см-1 (пленка): 3297, 2908, 2118, 16875, 1430, 1345, 1300, 1122, 640. Спектр ЯМР1Н (400 МГц, CDC13, δ, м.д., J/Гц): 1.65-1.72 (м, 4Н, CH2CH2CH2), 1.80-1.84 (м, 2Н, NCH2CH2CH2N), 1.94 (с, 2Н, С≡СН), 2.28-2.37 (м, 8Н, CH2CH2CH2), 2.75 (с, 8Н, NCH2CH2), 3.30 (с, 4Н, NCH2C≡C). Спектр ЯМР13С (100 МГц, δ, м.д.): 17.5 (СН2С=СН), 17.8 (С≡ССН2СН2), 27.4 (С=ССН2СН2), 27.7 (NCH2CH2), 47.9 (NCH2C=C), 53.6 (NCH2CH2CH2N), 54.5 (NCH2CH2N), 68.8 (C≡CH), 76.5 (NCH2C≡C-), 83.4 (C≡CH), 83.5 (NCH2C≡C). Масс-спектр MALDI-TOF, m/z: 307.1937 [M-H]+ C21H27N2, 331.2008 [M+Na]+ C21H28NaN2, 347.1736 [M+K]+ C21H28KN2. Вычислено: 307.2174 [M-H]+, 331.2150 [M+Na]+, 347.1890 [M+K]+.
1,4-Бис[1-(4-фторфенил)-2,8-нонадиинил]-1,4-диазепан (1ж).

Коричневое вязкое масло, выход 0.288 г (53%); Rf 0.59 (гексан - EtOAc, 1:2). ИК-спектр, v/см-1 (пленка): 3304 (С≡С-Н); 3068, 2942, 2869 (СН2), 2254 (-С≡С-); 2117 (С≡С-Н); 1599 (Ph); 1121, 1078, 1008 (-C-N-), 636 (≡С-Н). Спектр ЯМР1Н (500 МГц, CDC13, δ, м.д., J/Гц): 1.73-1.78 (м, 10Н, CH2(CH2)2CH2, N(CH2)2CH2), 1.99 (с, 2Н, С≡СН), 2.28 (с, 4Н, NCH2C≡CCH2), 2.38 (с, 4Н, СН2С≡СН), 2.58-2.70 (м, 4Н, N(CH2)2N), 2.70-2.77 (м, 4Н, (NCH2)2CH2), 4.64, 4.65 (с, 2Н, 2(NCHC≡C), 6.99-7.05 (м, 4Н, CH(Ph)), 7.56-7.61 (м, 4Н, CH(Ph)). Спектр ЯМР13С (125 МГц, δ, м.д., J/Гц): 18.0 (СН2С≡СН), 18.4 (СН2С≡ССН2СН2), 27.6, 27.9 (СН2СН2СН2С≡С), 28.1, 28.2 ((NCH2)2CH2), 50.9, 51.1 ((NCH2)2CH2), 52.6, 52.7 (N(CH2)2N), 61.0, 61.2 (NCH(Ar)C≡C), 68.6 (C≡CH), 76.7 (C≡C), 84.1 (C≡C), 87.1 (C≡C), 114.7 (д, J=20.7, CH(Ar)), 129.8 (д, J=7.5, CH(Ar)), 135.5 (CHC(Ar)), 162.7 (д, J=243.7, CF(Ar)). Масс-спектр MALDI-TOF, m/z: 523.2397 [M-H]+; C35H37F2N2. Вычислено: 523.2925.
1,3-Ди(2,7-октадиинил)имидазолидин (1з).

Желтое прозрачное вязкое масло, выход 0.142 мг (51%); Rf 0.35 (бензол - ацетон, 1:1). ИК-спектр, v/см-1 (пленка): 3295, 2936, 2866, 2258, 2117, 1681, 1432, 1345, 1328, 1127, 642. Спектр ЯМР1Н (400 МГц, CDC13, δ, м.д., J/Гц): 1.71 (квин, 4Н,3J=7.2, СН2СН2СН2), 1.95 (т, 2Н,4J=2.6, С≡СН), 2.28-2.33 (м, 8Н, СН2СН2СН2), 2.91 (с, 4Н, NCH2CH2), 3.38 (с, 4Н, NCH2C≡C), 3.58 (с, 2Н, NCH2N). Спектр ЯМР13С (100 МГц, δ, м.д.): 17.5 (СН2С≡СН), 17.8 (С≡ССН2СН2), 27.6 (С≡ССН2СН2), 42.9 (NCH2C≡C), 51.2 (NCH2CH2N), 68.8 (-С≡СН), 73.6 (NCH2N), 76.3 (NCH2C≡C-), 83.3 (С≡СН), 83.5 (NCH2C≡C-). Масс-спектр MALDI-TOF, m/z: 279.2228 [M-H]+ C19H23N2, 303.2210 [M+Na]+ C19H24NaN2, 319.2108 [M+K]+ C19H24KN2. Вычислено: 279.1861 [M-H]+, 303.1837 [M+Na]+, 319.1577 [M+K]+.
1,3-Ди(2,8-нонадиинил)имидазолидин (1и).
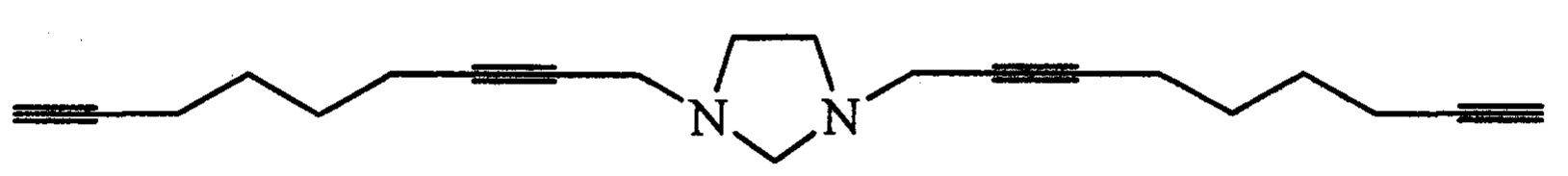
Светло-желтое масло, выход 0.19 мг (62%). Rf 0.45 (гексан - EtOAc, 1:2). ИК-спектр, v/см-1(пленка): 3292, 2932, 2861, 2115, 1673, 1433, 1327, 1140, 1049, 640. Спектр ЯМР1Н (400 МГц, CDC13, δ, м.д., J/Гц): 1.62-1.64 (м, 8Н, СН2(СН2)2СН2), 1.95 (т, 2Н,4J=2.6, С≡СН), 2.22-2.24 (м, 8Н, CH2(CH2)2CH2), 2.96 (с, 4Н, NCH2CH2), 3.42 (с, 4Н, NCH2C≡C), 3.64 (с, 2Н, NCH2N). Спектр ЯМР13С (100 МГц, δ, м.д.): 17.9 (СН2С≡СН), 18.2 (С≡ССН2СН2), 27.5, 27.6 (С≡ССН2(СН2)2), 42.9 (NCH2C≡C), 51.1 (NCH2CH2N), 68.5 (С≡СН), 73.5 (NCH2N), 75.6 (NCH2C≡C-), 84.1 (C≡CH), 84.3 (NCH2C≡C). Масс-спектр MALDI-TOF, m/z: 307.2240 [M-H]+ C21H27N2, 331.2177 [M+Na]+ C21H28NaN2, 347.1872 [M+K]+ C21H28KN2. Вычислено: 307.2174 [M-H]+, 331.2150 [M+Na]+, 347.1890 [M+K]+.
Выявление фунгицидной активности осуществлено с использованием микроскопических грибов Bipolaris sorokiniana, Fusarium oxysporum, Rhizoctonia solani, которые вызывают корневые гнили зерновых культур. Кроме того, фитопатогенный гриб Rhizoctonia solani является возбудителем бурой и сухой гнили (ризоктониоза), поражающий до 230 видов сельскохозяйственных растений (картофель, томат, капуста, редис, свекла, фасоль, чечевица, люцерна, лен и др.) (Микроорганизмы - возбудители болезней растений. / Под ред. Билай В.И. - Киев: Наукова Думка, 1988, 552 с.).
Оценку фунгицидной активности проводили методом диффузии в агар (Практикум по микробиологии. / Под ред. Егорова Н.С.- М.: Изд-во МГУ, 1976, 307 с.). Для испытания использовали растворы (1) в ДМФА (0.5%). Оценка влияния растворителя на тест-культуры грибков показала отсутствие негативного воздействия ДМФА на развитие микроскопических грибов. Результаты испытаний приведены в таблице 2.

Результаты, представленные в табл. 2, показывают, что 1б, в, е в концентрации 0.5% обладают фунгицидной активностью по отношению к Bipolaris sorokiniana, а соединения 1а и 1в угнетают развитие Rhizoctonia solani. Ни одно из испытанных соединений не проявляет фунгицидной активности к Fusarium oxysporum.
Таким образом, испытанные N,N'-ди(алкадиинил)диазациклоалканы (1а-в, е) обладают противогрибковой активностью по отношению к фитопатогенным грибам - Bipolaris sorokiniana и Rhizoctonia solani. Полученные результаты свидетельствуют о том, что соединения (1а), (1б), (1в) и (1е) могут быть использованы для создания на их основе фунгицидного препарата для защиты сельскохозяйственных растений от фитопатогенных грибов.
Реферат
Изобретение относится к области органической химии, в частности к N,N'-ди(алкадиинил)диазациклоалканам указанной ниже общей формулы (1), которые могут найти применение в качестве средства с фунгицидной активностью в отношении фитопатогенных грибов Bipolaris sorokiniana и Rhizoctonia solani. Изобретение относится также к способу получения N,N'-ди(алкадиинил)диазациклоалканов общей формулы (1) и их применению в качестве средства с фунгицидной активностью в отношении фитопатогенных грибов Bipolaris sorokiniana и Rhizoctonia solani. 3 н.п. ф-лы, 2 табл., 1 пр.
Формула



Комментарии