Способ получения сложного оксида манганита гадолиния состава gd0.9ba0.1mno3 - RU2775841C1
Код документа: RU2775841C1
Чертежи

Описание
Изобретение относится к неорганической химии, а именно к технологии получения керамики на основе оксида марганца и гадолиния, имеющего перовскитоподобную структуру, структурного типа АВО3.
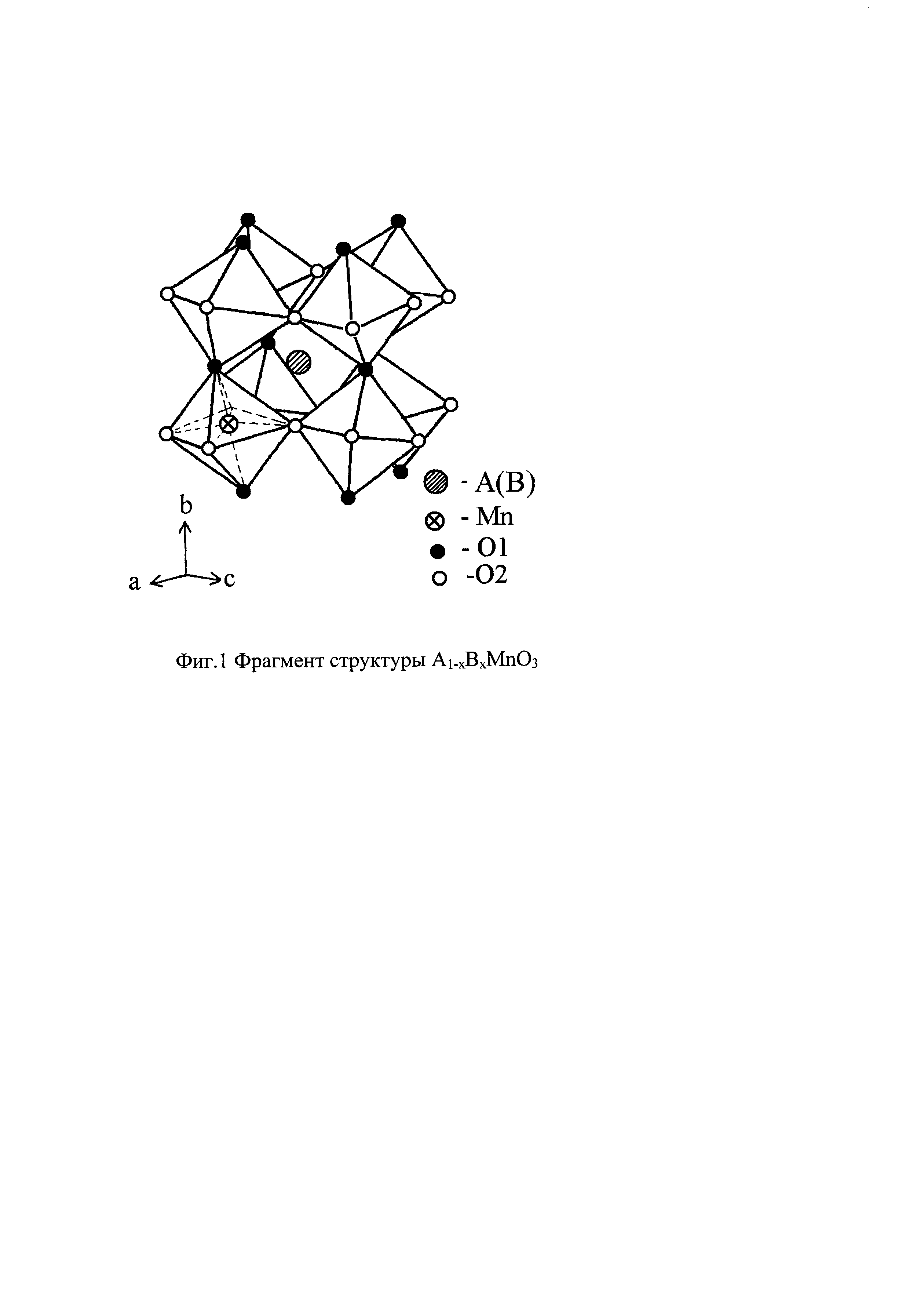
Интерес к соединениям с общей формулой A1-xBxMnO3 (где А3+ - редкоземельный элемент из группы Y, Nd, Sm, Eu, Dy, Ho, Er, Tm, Yb, Ln; B2+ - щелочноземельный элемент: Ca, Sr, Ba) вызван их практическими свойствами, потенциально важными для разработки и изготовления магнитных сенсоров, магнитооптических преобразователей, металлодетекторов, спинтронных устройств, возобновляемых источников энергии, таких как твердооксидные топливные элементы (ТОТЭ). Проявление магнитных или/и электрических свойств этих соединений тесно связано с их кристаллической структурой и определяется соотношением ионов марганца со смешанно-валентным состоянием Mn3+/Mn4+). Формирование различных степеней окисления переходного элемента (Mn), входящего в состав соединений возможно путем допирования (замещения части катионов А3+) в исходном соединении. По мере увеличения допирования элементом В2+ происходит увеличение концентрации ионов Mn4+. Несоответствие в размерах ионов А3+ и В2+ приводит к искажению структуры, повышению симметрии решетки. Широкое практическое использования этих соединений предполагает наличие данных об условиях получения, кристаллической структуре и свойствах в зависимости от внешних условий (температуры, приложенного магнитного поля). Фиг. 1 иллюстрирует структуру соединений А1-xBxMnO3. В структуре А1-xBxMnO3, катион трехвалентного марганца (Mn3+) окружен 6 атомами кислорода, четыре из которых лежат в основной плоскости (обозначены как O2), а два атома - в вершинах октаэдра (обозначены как O1). Расстояния Mn-О, характеризуют искажение октаэдра MnO6 [Alonso J.A., Martinez-Lope M.J., Casais М.Т. Evolution of the Jahn-Teller Distortion of MnO6 octahedra in RMnO3 Perovskites (R=Pr, Nd, Dy, Tb, Ho, Er, Y): a neutron diffraction study // Inorg.Chem. 2000. V.39. Р.917-923]. Расстояния Mn-O1 равны, а расстояния Mn-O2 отличаются друг от друга из-за ян-теллеровского искажения, вызванного наличием трехвалентных ионов марганца. Углы Mn-O-Mn показывают наклон этого октаэдра в зависимости от среднего радиуса редкоземельного элемента в А-участке перовскитоподобной структуры. По мере увеличения степени допирования родительского состава GdMnO3 уровень орторомбической деформации в образцах понижается, что свидетельствует об изменении искажений октаэдров MnO6 и их наклонов. Это, с одной стороны, является следствием замещения ионов Gd3+ (1.107
Керамические материалы на основе сложных манганитов редкоземельных элементов наиболее изучены на составах, легированных кальцием, менее исследованы составы со стронцием. Замещение катионов А3+ барием в литературе встречается реже. Это связано с ограниченной растворимостью Ва в структуре перовскита и трудностями получения высококачественной перовскитной фазы с таким замещением [Trukhanov S.V., Troyanchuk L.O., PushkarevN.V, Szymczak H. Magnetic properties of anion-deficient La1-xBaxMnO3-х/2 (0≤x≤0.3) manganites // J. Exp.Tech. Phys. 2003. V. 96. P. 110-117.]. Однако интерес к системам с замещением Ва обусловлен тем, что температура Кюри (Tc) перовскитов, легированных барием, приближается к комнатной температуре, что существенно для материалов перспективного практического применения [Trukhanov S.V., Troyanchuk L.O., PushkarevN.V, Szymczak H. Magnetic properties of anion-deficient La1-xBaxMnO3-x/2 (0≤x≤0.3) manganites // J. Exp.Tech. Phys. 2003. V. 96. P. 110-117.].
Известен способ получения манганитов Ln1-xBaxMnO3 (Ln=La, Nd, Sm, Gd), в котором образцы сложного оксида были получены твердофазной реакцией из простых оксидов и карбонатов при температуре Т=1500°С на воздухе. Все образцы медленно охлаждали со скоростью 100 град/ч. Синтезированные образцы проверяли на фазовую чистоту и параметры решетки рентгеновским излучением. Было обнаружено, что номинальные композиции Ln0.5Ва0.5MnO3 содержат некоторое количество посторонней фазы (~5%). (Troyanchuk L.O., Trukhanov S.V., Khalyavin D.D., Szymczak H. Magnetic properties of anion defcit manganites Ln0.55Ва0.45MnO3-γ(Ln=La, Nd, Sm, Gd, γ≤0.37) // J. of Magnetism and Magnetic Materials 2000. V.208. P. 217-220).
Недостатком способа является достаточно высокая температура термической обработки, значительная общая длительность охлаждения и присутствие посторонней фазы в некоторых композициях. Поэтому, используемый режим термообработки не может применяться для получения гомогенного сложного оксида манганита гадолиния состава Gd0.9Ba0.1MnO3.
Известен способ получения сложных оксидов NdxA1-xMnO3 (А=Ва, Sr, Са; х=0, 0.25), синтезированых цитрат-нитратным методом. Перед синтезом карбонаты АСО3 (А=Ва, Sr, Са) отжигали при 300°С в течение 12 ч на воздухе для удаления влаги и поглощенных газов. Исходные материалы: Nd2O3, Mn(СН3СОО)2×4H2O и карбонаты АСО3 (А=Ва, Sr, Са) смешивали в соответствующих молярных соотношениях с добавлением дистиллированной воды и азотной кислоты. После растворения исходных материалов в смесь добавляли моногидрат лимонной кислоты. Последний нагревали на горячей плите до самосгорания, с образованием серого порошка. Полученные порошки измельчали с использованием спирта (С2Н5ОН) и прокаливали при температуре 1100°С на воздухе в течение 20 ч с трехкратным промежуточным измельчением. На конечной стадии, образцы порошка гранулировали в прямоугольные бруски и отжигали при температуре 1350°С в течение 20 ч на воздухе. (Hossain A., Gilev A. R., Kiselev Е. А., Cherepanov V. A. Synthesis, crystal structure and properties of Nd1-xAxMnO3-δ (A=Ba, Sr and Ca) // AIP Conference Proceedings. 2019, 040018),
Существенными недостатками способа являются применение высокой конечной температуры отжига, многостадийность и продолжительность процесса.
Известен способ получения сложного оксида иттрия, бария и меди, в котором для получения YBa2Cu3O7-δ из водного раствора, содержащего нитраты иттрия, бария и меди, проводят совместную сорбцию иттрия, бария, меди в заданном мольном соотношении Y:Ba:Cu=1:2:3 из указанного раствора на карбоксильном катионите КБ-4п-2, дальнейшую сушку полученного материала и последовательное нагревание при температуре 110°С - 2 ч, при 250°С - 2 ч, при 450°С - 5 ч, при 600°С - 3 ч, при 850°С - 6 ч и затем 1 ч в атмосфере кислорода. При термическом разложении происходит выгорание органической части ионита и взаимодействие ионов с образованием сложного оксида YBa2Cu3O7-δ в виде микросфер (патент РФ №2503621, МПК C01F 17/00, опубл.10.01.2014).
Недостатком способа является многочисленность операций отжига и общая длительность его осуществления, использование различных газовых сред. Применяемые температуры обжига недостаточны для синтеза сложного оксида манганита гадолиния состава Gd0.9Ba0.1MnO3.
Известен способ получения керамических материалов на основе сложных оксидов АВО3 (например: BiFeO3, PbTiO3, YBa2Cu3O7-δ), включающий перемешивание в спиртовой среде в шаровой мельнице подготовленной в стехиометрической пропорции шихты исходных реагентов, сушку шихты в сушильном шкафу до достижения остаточной влажности 1%, охлаждение до комнатной температуры и гранулирование. Последующий твердофазный синтез ведут при индивидуально определяемой для каждого сложного оксида температуре отжига и длительности изотермических выдержек, гранулируют, нагревают в печи со скоростью 100 град/ч с одновременным снятием кривой расширения-сжатия для определения температур начальной стадии уплотнения заготовки и охлаждают до комнатной температуры. На начальной стадии уплотнения проводят дополнительную изотермическую выдержку в течение 10-30 мин при температуре индивидуальной для каждого оксида, для исключения водосодержащих соединений и продуктов гидролиза спекаемых фаз (патент РФ №2725358, МПК С04 В 35/645, оп.02.07.2020).
Недостатком представленного способа является множественность операций, введение дополнительных стадий для определения начальной стадии уплотнения и изотермической выдержки для удаления водородосодержащих соединений и продуктов гидролиза спекаемых фаз, дробность термической обработки.
Наиболее близким по технической сущности к предлагаемому способу является способ получения сложных оксидов общей формулы La0.7-xLnxBa0.3MnO3 (Ln=Pr, Nd, Gd or Dy) [Kundu A. K., Seikh Md. M., Ramesha K., Rao C.N.R. Novel effects of size disorder on the electronic and magnetic properties of rare earth manganates of the type La0.7-xLxBa0.3MnO3 (Ln=Pr, Nd, Gd or Dy) with large average radius of the A-site cations // J. Phys.: Condens. Matter. 2005.V. 17. P. 4171-4180], включающий смешивание в необходимых стехиометрических пропорциях оксида редкоземельного элемента, карбоната бария и оксида MnO2, гомогенизирование смеси путем перемешивания в течение нескольких часов с пропанолом, высушивания и прокаливания на воздухе с нагревом до температуре 950°С. Затем проводят двухстадийный отжиг с изотермической выдержкой на каждой стадии, при этом на начальной стадии последовательно нагревают до температуры 1000 и 1100°С и выдерживают при этой температуре в течение 12 ч, а на заключительной стадии нагревают до температуры 1400°С, выдерживают в течение 24 ч с промежуточным перетиранием и гранулированием смеси. Таким образом были получены поликристаллические образцы La0.7-xLnxBa0.3MnO3 (Ln=Pr, Nd, Gd or Dy), имеющие орторомбическую структуру, относящиеся к пространственной группе (пр.гр.) Pnma и данные о магнитных свойствах (намагниченности) образцов. Так для состава Gd0.7Ba0.3MnO3 - наиболее близкого по составу к заявляемому нами в способе получения составу Gd0.9Ba0.1MnO3, температура магнитного перехода не обнаружена. При этом авторы сообщают о неоднородности магнитного состояния в полученном составе. Данные по магнитным измерениям, проведенным в температурном диапазоне 4÷350К (-269÷77°С) и внешнем магнитном поле Н=5000е показывают отсутствие дальнего магнитного порядка (упорядочения). В составе Gd0.7Ва0.3MnO3 предполагают разделение фаз, присутствие ферромагнитных кластеров в изолирующей матрице, т.е. полученный продукт не гомогенный и не обладает магнитным упорядочением. Недостатком этого способа является высокая температура прокаливания на стадии гомогенизации подготовленной смеси реагентов (при температуре 950°С), а также высокая температура заключительного отжига при значительной общей длительности процесса и неоднородность магнитного состояния полученных оксидов.
Все рассматриваемые выше способы либо не обеспечивают получения гомогенного продукта, либо требуют введения дополнительных стадий обработки смесей исходных реагентов, при использовании высокой температуры отжига и/или длительности процесса термообработки.
Таким образом, перед авторами стояла задача разработать простой и надежный способ получения сложного оксида манганита гадолиния состава Gd0.9Ba0.1MnO3, обладающего гомогенностью (однофазностью) композиционного состава и магнитным упорядочением.
Техническим результатом предлагаемого способа является сокращение трудоемкости процесса, снижение температуры отжига при получении целевого продукта, обладающего магнитным упорядочением.
Указанный технический результат достигается тем, что в способе получения сложного оксида манганита гадолиния состава Gd0.9Ba0.1MnO3, включающем подготовку исходной смеси, содержащей оксид редкоземельного элемента, карбонат бария и марганецсодержащий реагент в стехиометрически необходимой пропорции, гомогенизацию полученной смеси путем перемешивания в спиртосодержащей среде, последующий двухстадийный отжиг с изотермической выдержкой на каждой стадии и промежуточным перетиранием и гранулированием смеси, при этом в качестве марганецсодержащего реагента в смеси используют оксид Мn2О3, перед отжигом гомогенизированную смесь гранулируют, начальную стадию отжига проводят при температуре 960°С с изотермической выдержкой в течение 24 ч, а заключительную стадию осуществляют при температуре 1250°С с изотермической выдержкой в течение 48 ч.
Кроме того, перед смешиванием исходные реагенты предварительно прокаливают при Т=500°С в течение 8 ч на воздухе.
Условия термообработки (температура и время двухстадийного отжига) установлены экспериментально.
Изобретение поясняется чертежами.
На фиг. 1 представлена перовскитная ячейка сложных оксидов, которая может быть заполнена в позиции А катионами Gd3+ и Ва2+, в позиции В-катионами Мn3+ и Мn4+.
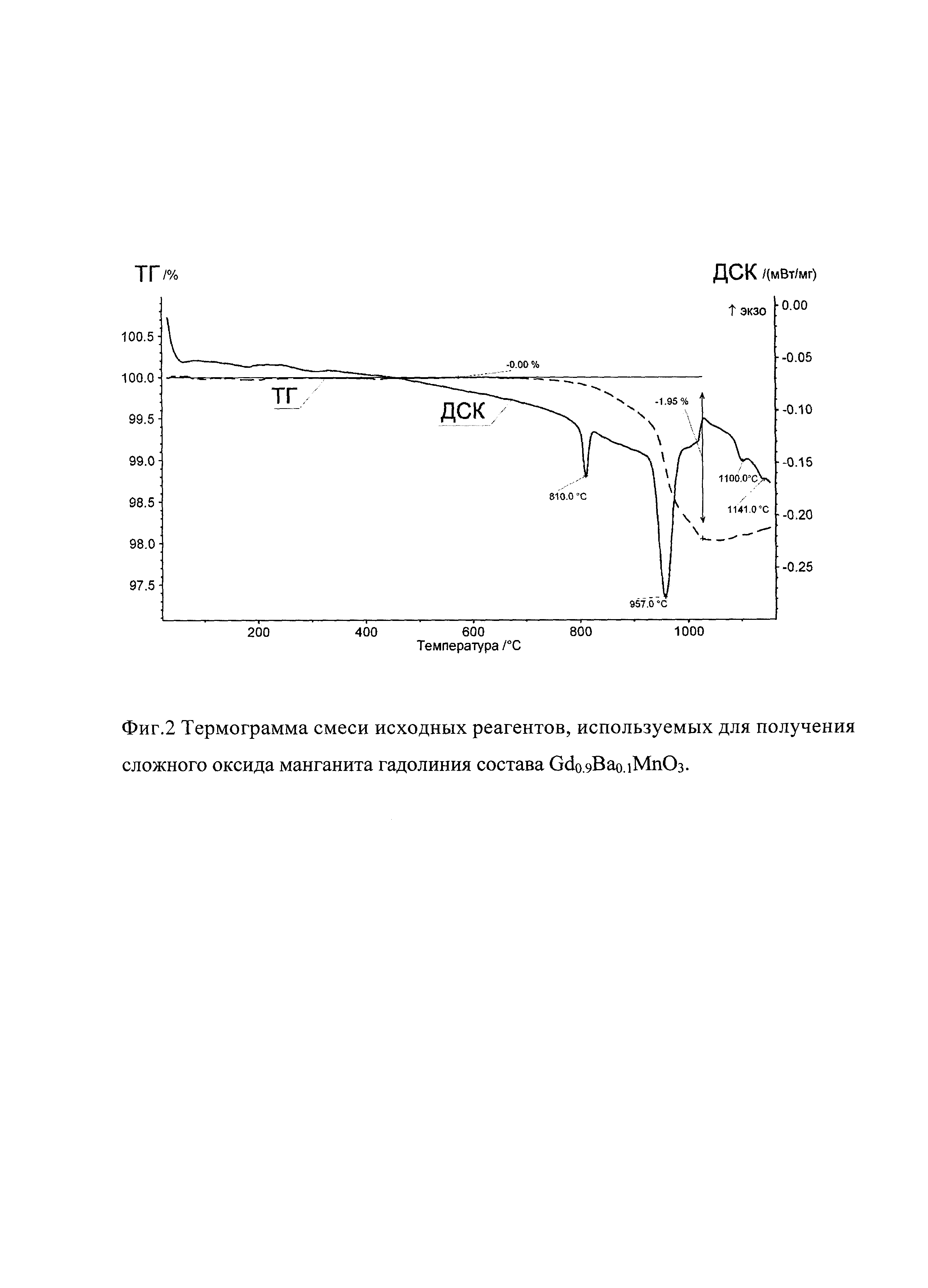
На фиг. 2 показана термограмма смеси исходных реагентов, используемых для получения сложного оксида манганита гадолиния состава Gd0.9Ba0.1MnO3.
На фиг. 3 приведены дифрактограммы смеси исходных реагентов, используемых для получения сложного оксида манганита гадолиния состава Gd0.9Ba0.1MnO3, при характеристических температурах 30, 960, 1100, 1150°С.
Обозначения фаз на рисунке: 1 - Gd2O3, 2 - Mn2O3, 3 - α-ВаСО3, 4 - β-ВаСО3, 5 - Mn3O4, 6 - GdxBa0.1MnO3.
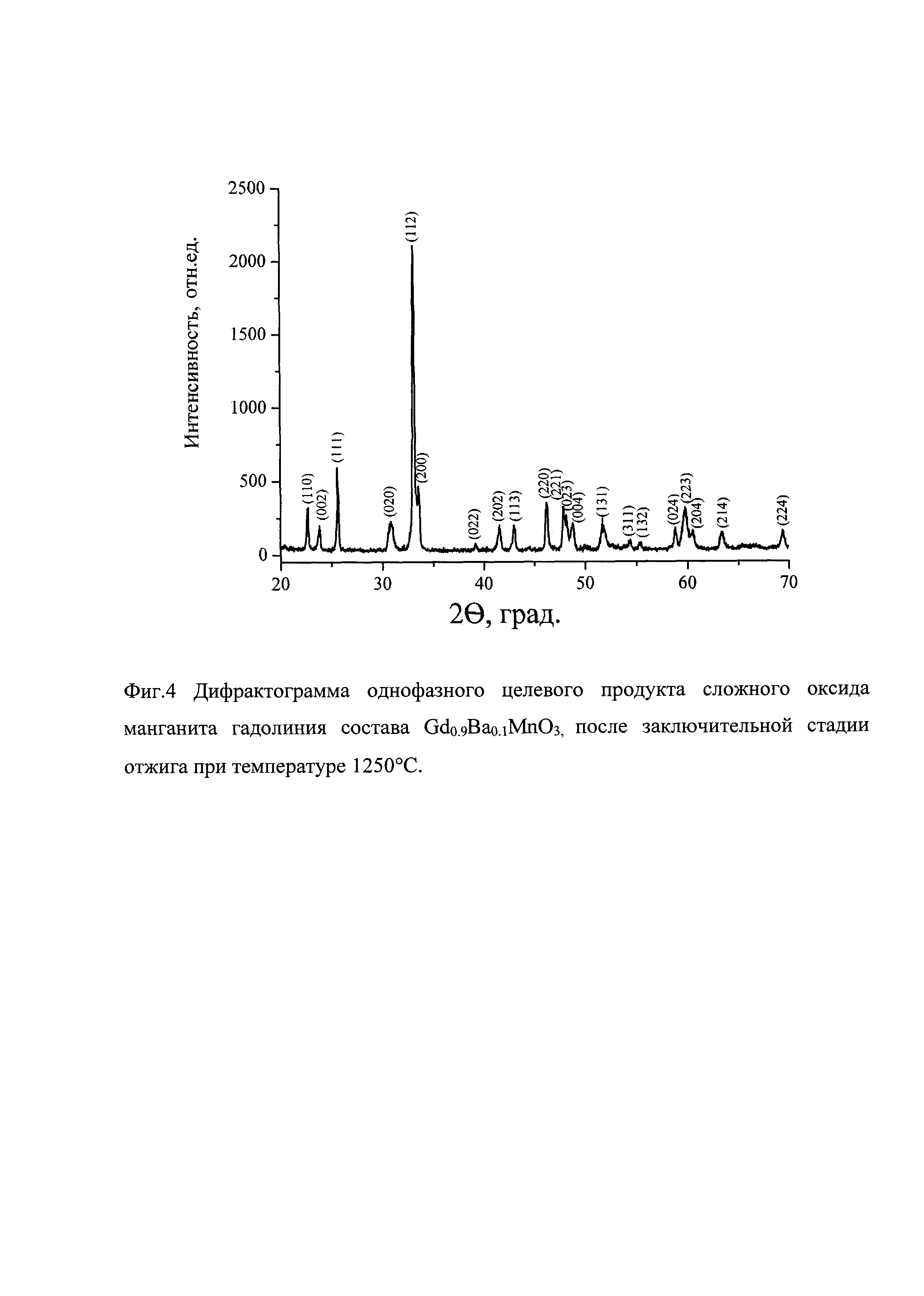
На фиг. 4 представлена дифрактограмма однофазного целевого продукта сложного оксида манганита гадолиния состава Gd0.9Ba0.1MnO3, после заключительной стадии отжига при температуре 1250°С.
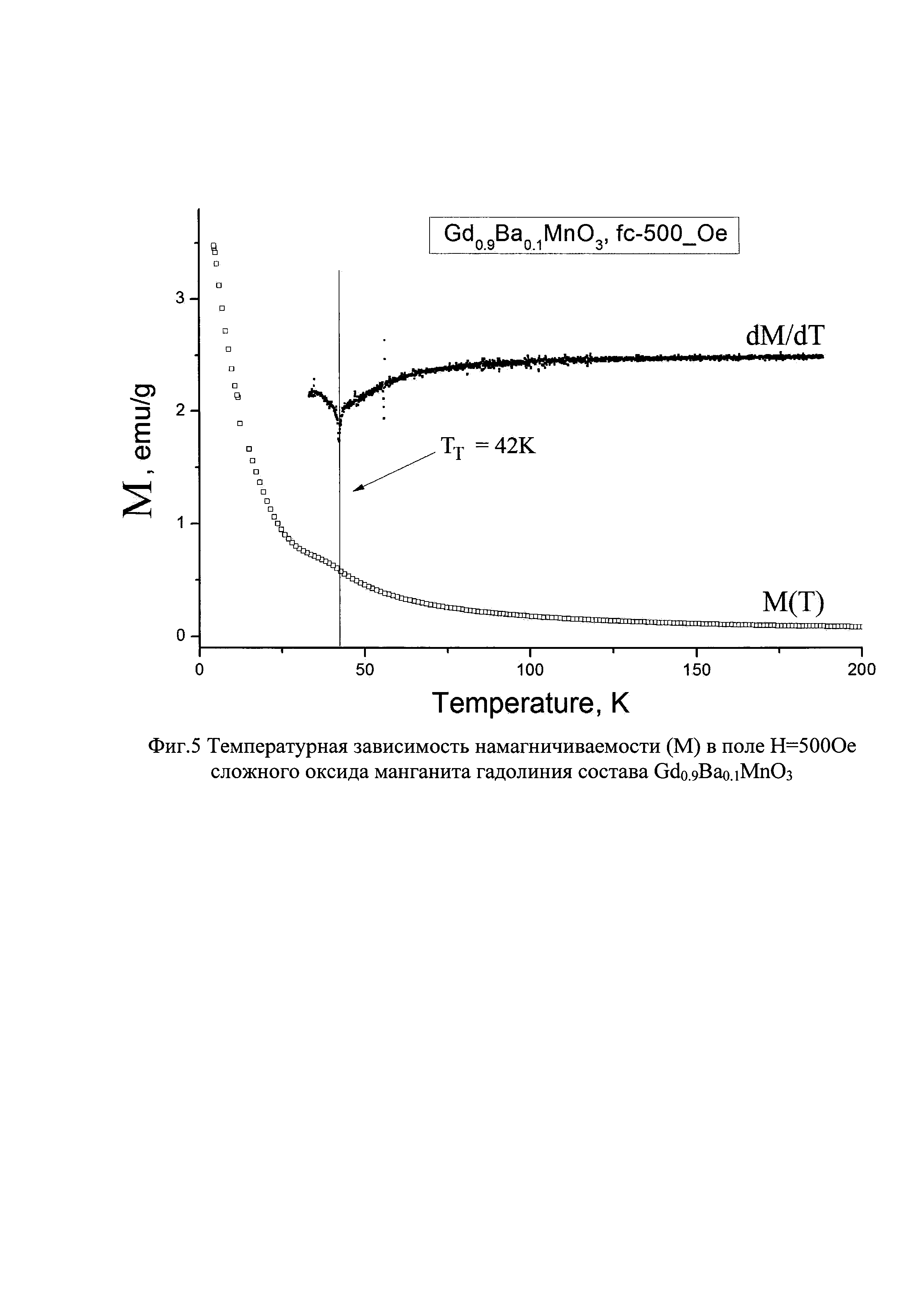
На фиг. 5 показана температурная зависимость намагничиваемости (М) в поле Н=5000е сложного оксида манганита гадолиния состава Gd0.9Ba0.1MnO3.
Предлагаемый способ осуществляют следующим образом: расчет навесок исходных реагентов смеси для получения готового целевого продукта планируемой массы 10г. проведен согласно схеме общего вида (1)
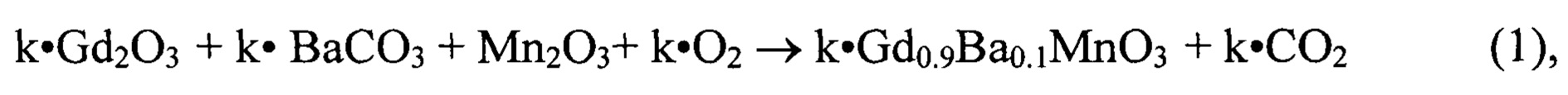
по формуле:
mк=mп⋅k⋅Mк/Mп,
где: mк - масса компонента (ВаСО3, Gd2O3, Mn2O3),
mп - масса продукта (Gd0.9Ba0.1MnO3)
k - коэффициент при компоненте,
Мк - молекулярная масса компонента,
Мп - молекулярная масса продукта.
Навески исходных реагентов составили:
Gd2O3 - 6.3375 г,
Mn2O3 - 3.0667 г,
α-ВаСО3 - 0.7667 г.
Для удаления адсорбированной влаги исходные реагенты предварительно прокаливали при Т=500°С в течение 8 ч на воздухе. Подготовленные таким образом исходные реагенты, взятые в стехиометрическом соотношении смешивали в агатовой ступке с добавлением технического этилового спирта в течение 15 мин. Полученную смесь гранулировали в таблетки диаметром 1 см на гидравлическом прессе под давлением 150 кПа/см2. На начальной стадии термообработки отжиг ведем на воздухе при температуре 960°С с изотермической выдержкой в течение 24 ч, охлаждаем с печью, смесь перетираем и гранулируем в таблетки, по описанной выше технологии. На заключительной стадии отжиг ведем при температуре 1250°С и выдерживаем в течение 48 ч.
В результате получаем однофазный продукт - сложный оксид манганита гадолиния состава Gd0.9Ba0.1MnO3, имеющий параметры элементарной ячейки: а=5.3154(2); b=5.8136(3); с=7.4549(3) (
Использование в исходной смеси в качестве марганецсодержащего реагента оксида Mn2O3 позволяет устранить образование при синтезе примесной фазы BaMnO3 и облегчает внедрение бария в структуру целевого продукта. Для получения целевого продукта сложного оксида манганита гадолиния допированного барием Gd0.9Ba0.1MnO3 использован карбонат бария (ВаСО3), который достаточно широко применяют в керамическом способе получения барийсодержащих фаз. Известны 4 модификации ВаСО3: α - орторомбическая (пр.гр.Pmcn), β - ромбоэдрическая (R3m), γ - кубическая (Fm3m) и δ - моноклинная (P21/m), имеющие характерные температуры полиморфных превращений, критические для процесса образования целевых барийсодержащих продуктов.
Для установления эволюции фазообразования при получении сложного оксида гадолиния состава Gd0.9Ba0.1MnO3 проведено комплексное исследование смеси исходных реагентов, включающее термогравиметрический анализ с использованием прибора STA 449 F3 (NETZSCH)", линейный нагрев выполнен на воздухе в температурном интервале от комнатной температуры 30 до 1200°С (фиг. 2) и высокотемпературный рентгенофазовый анализ (in situ) проведенный с помощью приставки НА-1001 (Shimadzu) к дифрактометру XRD-7000 (Shimadzu), в условиях нагрева в идентичном интервале температур 30-1200°С (скорость нагрева 10 град/мин, CuKα-излучение), выдержке при каждой температуре 10 мин и последующей съемке в диапазоне углов 20-60 по 2 Θ с шагом 0,02° и выдержкой 1,5 с (фиг. 3).
Методами дифференциальной сканирующей калориметрии (ДСК) и in situ выявлены фазовые переходы α→β-ВаСО3 и β→γ-ВаСО3. Установлено, что эндотермические пики на кривой ДСК (фиг. 2) свидетельствуют о полиморфном превращении α→β-BaCO3 при Т=810°С и β→γ-BaCO3 при Т=957°С. Превращение β→γ-ВаСО3 является критическим (служит триггером) для образования Gd0.9Ba0.1MnO3, на этом этапе начинает образовываться целевая фаза. Процесс сопровождается потерей массы 1,95%, что свидетельствует о выделении СО2. В основе отмеченных кинетических особенностей заложен эффект Хедвалла - повышение реакционной способности при переориентации кристаллитов в процессе фазового превращения одного из реагентов твердофазной химической реакции.
На фиг. 3 представлены дифрактограммы смеси исходных реагентов, используемых для получения Gd0.9Ba0.1MnO3, при характеристических температурах 30, 960, 1100, 1150°С. При комнатной температуре Т=30°С фиксируются рефлексы исходных реагентов α-ВаСО3, Gd2O3, Mn2O3. При дальнейшем нагреве последовательно происходит полиморфные превращения α→β-ВаСО3 при температуре Т=810°С и при температуре Т=960°С фиксируется β→γ-ВаСО3, последнее из которых провоцирует зарождение центров целевого продукта. При нагреве до температуры Т=1100°С оксид марганца Mn2O3 переходит в оксид Mn3O4. При температуре Т=1150°С на дифрактограммах видны пики исходного оксида гадолиния и твердого раствора GdxBa0.1MnO3 с параметрами элементарной ячейки: а=5.3049(3); b=5.8145(4); с=7.4472(4)
Для установления магнитного состояния полученного целевого продукта сложного оксида гадолиния состава Gd0.9Ba0.1MnO3 измерена намагниченность в диапазоне температур 4÷200К (-269 ÷ -73°С) и внешнего магнитного поля Н=500 Ое с помощью вибрационного магнитометра CFS-9T-CVTI (Cryogenic) (фиг. 5). Для измерения образец охлаждали до 4К (-269°С) в приложенном поле Н=500 Ое. Температуру магнитного перехода определяли по соответствующему экстремуму производной М(Т) в отношении температуры. Полученная температура экстремума свидетельствует о наличии магнитного перехода парамагнетик-антиферромагнетик при температуре Тт=42K (-231°С).
Таким образом, установленные нами условия получения сложного оксида манганита гадолиния состава Gd0.9Ba0.1MnO3 позволяют:
1 - получить гомогенный (однофазный) целевой продукт;
2 - минимизировать стадии обработки;
3 - снизить температуру отжига;
4 - получить целевой продукт, обладающий магнитными свойствами антиферромагнетика.
Эти факторы безусловно важны для потенциального практического применения сложного оксида манганита гадолиния состава Gd0.9Ba0.1MnO3.
Реферат
Изобретение относится к технологии получения керамики на основе сложного оксида марганца и гадолиния, имеющего перовскитоподобную структуру структурного типа АВО3, которая может быть использована для изготовления магнитных сенсоров, магнитооптических преобразователей, металлодетекторов, возобновляемых источников энергии, таких как твердоокисные топливные элементы. Способ получения сложного оксида манганита гадолиния состава Gd0.9Ba0.1MnO3 включает подготовку смеси, содержащей оксид редкоземельного элемента, карбонат бария и марганецсодержащий реагент в виде Mn2O3 в стехиометрически необходимой пропорции, гомогенизацию полученной смеси путем перемешивания в спиртосодержащей среде, гранулирование гомогенизированной смеси, последующий двухстадийный отжиг с изотермической выдержкой на каждой стадии и промежуточным перетиранием и гранулированием смеси. Начальную стадию отжига проводят при температуре 960°С с изотермической выдержкой в течение 24 ч, а заключительную стадию осуществляют при температуре 1250°С с изотермической выдержкой в течение 48 ч. Перед смешиванием исходные реагенты предварительно прокаливают при T=500°С в течение 8 ч на воздухе. В результате осуществления способа получен целевой продукт манганит гадолиния состава Gd0.9Ba0.1MnO3, обладающий антиферромагнитным состоянием с температурой перехода TT=42K и магнитным упорядочением. 2 з.п. ф-лы, 5 ил.

Комментарии