Производные n-фенилпиразола - RU2051909C1
Код документа: RU2051909C1
Описание
Изобретение относится к производным пиразола, конкретно к N-фенилпиразолу, которые могут найти применение в сельском хозяйстве.
Известно использование 3-алкил или 3-галоалкил-N-фенилпиразола в качестве инсектицида. Однако известные соединения проявляют недостаточную активность.
Целью изобретения является синтез новых производных N-фенилпиразола.
Цель достигается производными N-фенилпиразола формулы
(I)
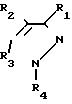
R3 водород, галоген или группа NR6R7, где R6 и R7 одинаковые, или различные означают водород, нормальную или разветвленную алкильную группу, алкилнилалкильную группу, содержащую до 5 атомов углерода, алканоильная группа, содержащие 2-5 атомов углерода, алкоксикарбонильная группа, содержащая 2-5 атомов углерода или обозначает нормальную или разветвленную алкоксиметиленаминогруппу, содержащую 2-5 атомов углерода, которая может быть незамещенной или замещенной на метиле нормальной или разветвленной алкильной группой, содержащей 1-4 атомов углерода.
R4
фенильная группа, замещенная во втором положении атомов галогена, в 4 положении
нормальной или
разветвленной алкильной группой или алкоксигруппой, содержащей 1-4 атомов углерода, которая может быть
незамещенной или замещенной одним или более атомами галогена или атомами хлора
и
брома, а 6-м
положении атомами галогена за исключением соединения, где R1-CN группа:
R2
метилсульфонильная группа, R3 аминогруппа, а R4 2,
6-дихлор-4-трифторметилфенильная группа.
Настоящее изобретение иллюстрируется следующими примерами, в которых были получены и исследованы следующие соотношения.
1. 5-Амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил)-4- трифторметилтиопиразол.
2. 5-Амино-3-циано-1-(2, 6-дихлор-4-трифторметоксифенил)-4- трифторметилтиопиразол.
3. 5-Амино-3-циано-1-(2,6-дихлор-4-дифторметоксифенил)-4- трифторметилтиопиразол.
4. 5-Амино-1-(2-хлор-4-трифторметилфенил)-3-циано-4- трифторметилтиопиразол.
5. 5-Амино-3-циано-1-(2,4,6-трихлорфенил)-4-трифторметил- тиопиразол.
6. 5-Амино-циано-1-(2, 6-дибром-4-трифторметилфенил)-4- трифторметилтиопиразол.
7. 5-Амино-1-(2-бром-4-трифторметилфенил)-3-циано-4- трифторметилтиопиразол.
8. 5-Амино-3-циано-1-(2, 6-дихлор-4-трифторметилфенил)-4- дифторметилтиопиразол.
9. 5-Амино-3-циано-1-1(2,6-дихлор-4-трифторметилфенил)-4- гептафторпропилтиопиразол.
10. 5-Амино-1-(2-бром-6-хлор-4-трифторметилфенил(-3-циано-4- трифторметилтиопиразол.
11. 5-Амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил)-4- трихлорметилтиопиразол.
12. 45-Амино-3-хлор-1-(2,6-дихлор-4-трифторметилфенил)-4- трифторметилтиопиразол.
13. 45-Амино-3-бром-1-1(2,6-дихлор-4-трифторметилфенил)-4- трифторметилтиопиразол.
14. 5-Амино-1-(2,6-дихлор-4-трифторметилфенил)-3-фтор-4- трифторметилтиопиразол.
15. 5-Амино-4-хлордифторметилтио-3-циано-1-(2,6-дихлор-4-трифторметилфенил)- пиразол.
16. 5-Хлор-3-циано-1-(2,6-дихлор-4-трифторметилфенил)-4- трифторметилтиопиразол.
17. 5-Амино-3-хлор-1-(2,6-дихлор-4-трифторметилфенил)-4- метансульфонилпиразол.
18. 3-Циано-1-(2, 6-дихлор-4-трифторметилфенил)-5-этоксиметиламино- 4-трифторметилтиопиразол.
19. 3-Циано-1-(2, 6-дихлор-4-трифторметилфенил)-5-этокси- этилендиамино-4-трифторметилтиопиразол.
20. 3-Циано-1-(2, 6-дихлор-4-трифторметилфенил)-5-этокси- метиленамино-4-метансульфонилпиразол.
21. 5-Ацетамидо-3-циано-1-(2, 6-дихлор-4-трифторметилфенил)-4- трифторметилтиопиразол.
22. 3-Циано-1-(2,6-дихлор-4-трифторметилфенил)-5-бис(пропионил) амино-4-трифторметилтиопиразол.
23. 3-Циано-1-(2, 6-дихлор-4-трифторметилфенил)-5-пропионамидо- 4-трифторметилтиопиразол.
24. 4-Ацетамидо-3-циано-1-(2, 6-дихлор-4-трифторметилфенил)-4-метансульфонилпираз ол.
25. 3-Циано-1-(2, 6-дихлор-4-трифторметилфенил)-4-трифторметилтио- 5-триметилацетамидопиразол.
26. 3-Циано-1-(2, 6-дихлор-4-трифторметилфенил)-5-бис-(метокси карбонил)амино-4-трифторметилтиопиразол.
27. 3-Циано-1-(2,6-дихлор-4-трифторметилфенил)-5-биc)этоксикарбонил)амино-4-триф торметилтиопиразол.
28. 5-Хлорацетамидо-3-циано-1-(2, 6-дихлор-4-трифторметилфенил)-4- трифторметилтиопиразол.
29. 3-Циано-1-(2, 6-дихлор-4-трифторметилфенил)-5-бис)этоксикарбонил)амино-4-мета нсульфонилпиразол.
30. 3-Циано-1-(2,6-дихлор-4-трифторметилфенил)-4-метансульфонил-5-триметил- ацетамидопиразол.
31. 3-Циано-1-(2, 6-дихлор-4-трифторметилфенил)-5-диметиламино-4-трифторметилтиоп иразол.
32. 3-Циано-1-(2,6-дихлор-4-трифторметилфенил)-5-изопропиламино-4-трифторметилти опиразол.
33. 3-Циано-1-(2,6-дихлор-4-трифторметилфенил)-5-пропиламино-4-трифторметилтиопи разол.
34. 3-Циано-1-(2, 6-дихлор-4-трифторметилфенил)-5-дипропил- амино-4-трифторметилтиопиразол.
35. 3-Циано-1-(2,6-дихлор-4-триформетилфенил)-5-бис(пропаргил) амино-4-трифторметилтиопиразол.
36. 3-Циано-1-(2, 6-дихлор-4-трифторметилфенил)-5-метиламино-4-метансульфо- нилпиразол.
37. 5-Бром-23-циано-1-(2, 6-дихлор-4-трифторэтилфенил)-4-трифторметансуль- фонилпиразол.
38. 5-Бром-3-циано-1-(2,6-дихлор-4-трифторметилфенил)-4-трифторметилтиопиразол.
39. 5-Бром-3-циано-1-(2, 6-дихлор-4-трифторметилфенил)-4- метансульфонилпиразол.
40. 5-Амино-3-бром-1-(2,6-дихлор-4-трифторметилфенил)-4- метансульфонилпиразол.
41. 3-Бром-1-(2, 6-дихлор-4-трифторметилфенил)-4-метансульфонилпиразол.
42. 3-Циано-1-(2, 6-дихлор-4-трифторметилфенил)-4-трифторметилтиопиразол.
43. 3-Циано-1-)2, 6-дихлор-4-трифторметилфенил)-4-трифторметансульфонилпира- зол.
44. 3-Циано-1-(2, 6-дихлор-4-трифторметоксифенил)-4-трифторметилтиопиразол.
45. 3-Циано-1-(2, 6-дихлор-4-трифторметилфенил)-4-метансульфонилпиразол.
46. 3-Циано-1-(2, 6-дихлор-4-трифторметилфенил)-5-иодо-4-трифторметилтиопира- зол.
47. 3-Циано-1-(2, 6-дихлор-4-трифторметилфенил)-5-иодо-4-трифторметансульфо- нилпиразол.
48. 5-Амино-1-(2,6-дихлор-4-трифторметилфенил)-3-иод-4-метансульфонилпира- зол.
49. 1-(2, 6-Дихлор-4-трифторметилфенил)-3-иодо-4-метансульфонилпиразол.
50. 1-(2, 6-Дихлор-4-трифторметилфенил)-3-иодно-4-трифторметил- тиопиразол.
51. 5-Амино-3-циано-1-(2, 6-дихлор-4-трифторметилфенил)-4-трифторметансульфонилпи разол.
52. 5-Амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил)-4-трифторметилсульфинилпи разол.
53. 5-Амино-3-циано-1-(2,6-дихлор-4-трифторметоксифенил)-4-трифторметансульфонил пиразол.
54. 5-Амино-3-циано-1-(2,6-дихлор-4-трифторметоксифенил)-4-трифторметилсульфинил пиразол.
55. 3-Циано-1-(2,6-дихлор-4-трифторметилфенил)-4-трифторметилсульфинилпиразол.
56. 5-Амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил)-4-(1-метилпропо-2-инилсул ьфонил)пиразол).
57. 5-Амино-3-циано-1-(2, 6-дихлор-4-трифторметилфенил)-4- метилсульфинилпиразол.
58. 5-Амино-3-циано-1-(2, 6-дихлор-4-трифторметилфенил)-4- изопропилсульфинилпиразол.
59. 5-Амино-3-бром-1-(2, 6-дихлор-4-трифторметилфенил)-4-трифторметилсуль- финилпиразол.
60. 5-Амино-4-трет-бутансульфонил-3-циано-1-(2,6-дихлор-4-трифторметилфенил)- пиразол.
61. 3-Циано-1-(2, 6-дихлор-4-трифторметилфенил)-5-пропиламино-4-трифторметилсульф онилпиразол.
62. 5-Ацетамидо-3-циано-1-(2, 6-дихлор-4-трифторметилфенил)-4-трифторметан- сульфонилпиразол.
63. 1-(2,6-Дихлор-4-трифторметилфенил)-4-метансульфонил-3- нитропиразол.
64. 5-Амино-1-(2, 6-дихлор-4-трифторметилфенил)-4-метансульфонил)-3-нитропиразол.
65. 1-(2, 6-Дихлор-4-трифторметилфенил)-3-нитро-4-трифторметилсульфинилпиразол.
66. 5-Амино-1-(2-бром-6-хлор-4-трифторметилфенил)-3-циано-4- метансульфонилпиразол.
67. 5-Амино-1-(2,6-дихлор-4-трифторметоксифенил)-3-циано- 4-метансульфонилпиразол.
68. 32а-Ацетил-5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4- метансульфонилпиразол.
69. 5-Амино-3-циано-1-(2,6-дихлор-4-трифторметилтиофенил)-4- метилтиопиразол.
70. 5-Амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил-4- этилтиопиразол.
71. 5-Амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил)-4- пропилтиопиразол.
72. 5-Амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил)-4- изопропилтиопиразол.
73. 5-Амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил)-4-(2- метилпропилтио)пиразол.
74. 5-Амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил)-4-(1- метилпропилтио)пиразол.
75. 4-Аллилтио-5-амино-3-циано-1-(2,6-дихлор-4-трифторметил- фенил)пиразол.
76. 5-Амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил)-4-пропил-2-инилтио)пиразо л.
77. 5-Амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил)-4- (1-метилпроп-2-инилтио)пиразол.
78. 5-Амино-3-бром-1-(2,6-дихлор-4-трифторметилфенил)-4- метилтиопиразол.
79. 5-Амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил)-4-трет. -бутилтиопиразол.
80. 5-Амино-3-бром-1-(2,6-дихлор-4-трифторметилфенил)-4- метилсульфинилпиразол.
81. 5-Амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил)-4-этан-сульфонилпи- разол.
82. 3-Циано-1-(2,6-дихлор-4-трифторметилфенил)-5-метиламино- 4-трифторметилтиопиразол.
83. 3-Циано-1-(2, 6-дихлор-4-трифторметилфенил)-5-этоксикарбонил)-4- метил(амино)-4-трифторметилтиопиразол.
84. 3-Циано-1-(2, 6-дихлор-5-трифторметилфенил)-5-трифтор- ацетамидо-4-трифторметилтиопиразол.
85. 3-Циано-1-(2,6-дихлор-4-трифторметилфенил)-5-этокси-карбониламино-4-три- фторметилтиопиразол.
86. 3-Ацетил-1-(2,6-дихлор-54-трифторметилфенил)-4-трифтор- метилтиопиразол.
87. 1-(2,6-Дихлор-4-трифторметилфенил)-3-формил-4-трифтор-метилтиопира- зол.
88. 5-Амино-1-(2,6-дихлор-4-трифторметилфенил)-3-формил-4-трифторметилтиопи- разол.
89. 3-Амино-1-(2,6-дихлор-4-трифторметилфенил)-5-фтор-4-трифторметансульфо- нилпиразол.
90. 5-Амино-3-циано-4-дихлорметилтио-1(2,6-дихлор-4-трифтор-метилфенил)пи- разол.
91. 5-Амино-3-хлор-1-(2,6-дихлор-4-трифторметилфенил)-4- трифторметансульфонилпиразол.
92. 5-Амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил)-4-пентафторэтилтио- пиразол.
93. 4-Циано-1-(2,6-дихлор-4-трифторметилфенил)-5-диметиламино-4-трифторметилсуль финилпиразол.
94. 3-Циано-1-(2,6-дихлор-4-трифторметилфенил)-5-иодо-4- трифторметилсульфинилпиразол.
95. 5-Бром-3-циано-1-(2, 6-дихлор-4-трифторметилфенил)-4-трифторметилсуль- финилпиразол.
96. 5-Ацетамидо-3-циано-1-(2,6-дихлор-4-трифторметилфенил)-4- трифторметилсульфинилпиразол.
97. 3-Циано-1-(2,6-дихлор-4-трифторметилфенил)-5-бис(этокси- карбонил)амино-4-трифторметансульфонилпиразол.
98. 3-Циано-1-(2, 6-дихлор-4-трифторметилфенил)-4-этоксикарбониламино-4-три- фторметансульфонилпиразол.
99. 3-Циано-1-(2, 6-дихлор-4-трифторметилфенил)-5-этоксиметил- енамино-4-трифторметансульфонилпиразол.
100. 5-Амино-4-(2-Хлор-1,1,2-трифторэтилтио)-3-циано-1-(2, 6-дихлор-4-трифторме- тилфенилпиразол.
101. 3-Циано-1-(2,6-дихлор-4-трифторметилфенил)-5-диметиламино- 4-трифторметансульфонилпиразол.
Биологический тест 1.
Одно или более из разбавлений соединений, подлежащих тестированию, проводили в 50%-ном водном ацетоне.
(а) Тестируемый вид: Plutella xylostella (моль капустная) и Phaedon cochluarial (жук горчичный).
Диски листьев турнепса помещают в агар в чашках Петри и заражают 10 личинками 2-я фаза Plutella или 3-я фаза Phaedon. Для повтора чашки помечали для каждой обработки и опрыскивали под Potter Lower соответствующим тестовым разбавлением. Спустя 4 или 5 дней после обработки чашки извлекали из помещения с постоянной температурой (25оС), где они выдерживались, и определяли средний процент гибели личинок. Эти данные были откорректированы по гибели в чашках, обработанных только 50%-ным водным ацетоном, который служил контролем.
(b) Megoura vicial (гороховая тля).
Растения горошка в горшках, предварительно инфицированные Mugoura, на различных стадиях развития опрыскивают до стекания, используя
лабораторный поворотный опрыскиватель. Обработанные растения выдерживают в теплице в течение 2 дней, а затем оценивают гибель тли, используя систему счета, когда результат оценивают по сравнению с
растениями, обработанными только 50%-ным водным ацетоном для контроля. Каждое измерение повторяли 4 раза. Оценка 3 гибель всей тли
2 несколько тлей живы
1 большинство тлей
живы
0 нет гибели
(с) Тестовый вид: Spodoptera
litloralis.
Диски листьев французского порошка помещают в агар в чашках Петри и инфицируют 5 личинками (2 стадия). Для повтора чашки оценивали для каждой обработки и опрыскивали под Potler Zower соответствующим тестовым раствором. Спустя 2 дня живые личинки переносят в аналогичные чашки, содержащие необработанные листья на агаре. Через 2 или три дня чашки извлекают из помещения с постоянной температурой (25оС), где их выдерживали, и определяют средний процент гибели личинок. В эти данные вносят поправки на гибель в чашках, которые были обработаны только 50%-ным водным ацетоном, которые служат контролем.
Вышеописанным способом определили, что нанесение следующих соединений оказалось эффективным против личинок Pluttella xylestella, которые обеспечивали более 65% гибели при концентрации менее 500 част. на млн: 1-10, 12-23, 25-27, 31-57, 76-79, 81-88, 90-92, 96, 101.
В соответствии с вышеуказанным способом нанесение следующих соединений оказалось эффективным против всех стадий Megoura vicial, давая оценку 7/12 при 50 част. на млн. 11,71, 73,74,75.
В соответствии с вышеуказанным способом нанесения следующих соединений оказались эффективными против личинок Phaedon cochleariae, обеспечивая по крайней мере 90% гибели при менее чем 5 част. на млн. 24,29,80,89.
Вышеописанным способом нанесения следующие соединения оказались эффективными против личинок Spodoptera littoralis, давая, по крайней мере, 70% гибели при менее чем 500 част. на млн. 28,30.
Далее в примерах показаны способы получения соединений.
П р и м е р 1. (Соединения 1,2,3,4,5,6, 7,8, 9,10, 11, 12,13,14,15,90).
Раствор 5-амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил)-пиразола (20,0 г) в дихлорметане (100 мл) перемешивают с помощью магнитной мешалки и обрабатывают, прикапывая раствор трифторме- тилсульфенилхлорида (10,8 г) в дихлорметане (50 мл) в течение 1 ч. Полученный раствор перемещают в течение ночи при комнатной температуре, затем промывают водой (100 мл), сушат над безводным сульфатом магния, фильтруют и выпаривают в вакууме до получения твердого продукта (26,3 г). Этот продукт кристаллизуют из смеси толуол/гексан до получения 5-амино-3-циано-1-(2, 6-дихлор-4-трифторметил фенил)- 4-трифторметил-тиопиразола в виде кристаллов желтовато-коричневого цвета (24,2 г) т.плавления 169-171оС.
Аналогичным способом, но заменяя 5-амино-3-циано-1-(2,6- дихлор-4-трифторметилфенил)пиразол на указанные далее замещенные пиразолы, получают из трифторметилсульфенилхлорида следующие соединения: 5-амино-3-циано-1- (2, 6-ди- хлор-4-трифторметоксифенил)- 4-трифторметилтиопиразол, т.пл. 125-126оС в виде бледно-желтых кристаллов, из 5-амино-3-циано-1-(2, 6-дихлор-4-трифторметокси- фенил)пиразола.
5-Амино-3-циано-1-(2,6-дихлор-4-ди- фторметоксифенил)-4-трифторметилпира- зол, т.пл. 127-128,5оС в виде темно-желтого твердого продукта из 5-амино-3-циано-1-(2, 6-дихлор-4-дифторметоксифенил)пиразо- ла.
5-Амино-3-циано-1-(2,6-дибром-4-три- фторметилфенил-4-трифтор- метилтиопиразол, т. пл. 202-204о С в виде оранжевых кристаллов из 5-амино-3-циано- 1-(2,6-дибром-4-трифторметилфенил)пиразола.
5-Амино-1-(2-бром-4-трифторметилфенил)-3-циано-4-трифторметил- тиопиразол, т.пл. 136-138оС в виде бледно-желтого твердого продукта из 5-амино-1-(2-бром-4-трифторметилфенил)-3-цианопиразола 5-амино- 32-циано-1-(2, 6-дихлор-4-трифторметилфе- нил)-4- дифторметилтиопиразол, т.пл. 159-161оС в виде светло-коричневого вещества из 5-амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил) пиразола и дифторметилсульфенилхлорида. 5-Амино-3-циано-1-(2, 6- дихлор-4-трифторметилфенил)-4-гептафто- рпропилтиопиразол, т. пл. 148-150оС в виде твердого вещества желтого цвета после флеш хроматографии на сухой колонке с элюированием дихлорметаном и петролейным эфиром (2:1) из 5-амино-3-циано-1-(2,6-дихлор-4- трифторметилфенил)пиразола и гептафторпропилсульфенилхлорида.
5-Амино-1-(2-бром-6-хлор-4-трифторме- тилфенил)-3-циано-4- трифторметилтиопиразол, т. пл. 183-185оС, в виде желтых кристаллов из 5-амино-1-(2-бром- 6-хлор-4-трифторметилфенил)-3-цианопи- разол и используя тетрагидрофуран в качестве растворителя.
5-Амино-3-циано-1-(2, 6-дихлор-4-три- фторметилфенил)-4-трихлорметил-тиопира- зол, т.пл. 245-247оС, в виде твердого вещества белого цвета после хромато- графической очистки, исходя из 5-амино-3-циано- 1-(2, 6-дихлор-4-трифторметилфенил)пиразола и трихлорметил- сульфенилхлорида.
Аналогичным способом, но заменяя трифторметилсульфенилхлорид на дихлорфторметилсульфенилхлорид и добавляя молярный эквивалент пиридина к реакционной смеси после перемешивания в течение ночи получают: 5-Амино-3-циано-4-дихлорметилтио-1-(2,6-дихлор-4-трифторметилфенил)пиразол, т.пл. 178-180оС, в виде твердого вещества белого цвета после хроматографической очистки и элюирования смесью диэтиловый эфир (гексан 1:1), из 5-амино-3-циано-1-(2,6-дихлор- 4-трифторметилфенил)пиразола).
Аналогичным способом, но используя молярный эквивалент пиридина в реакционном растворе, получают: 5-амино-3-хлор-1-(2,6-дихлор-4- трифторметил-фенил)-4- трифторметилтиопиразол, т. пл. 149-150,5оС, в виде твердого вещества белого цвета после перекристаллизации из гексана, из 5-амино-3-хлор-1-(2,6-дихлор-4-трифторметилфенил) пиразола. 5-амино-3-бром- 1-(2, 6-дихлор-4-трифторметилфенил)-4- трифторметилтиопиразол, т. пл. 154-156оС, в виде твердого вещества белого цвета, после перекристаллизации из смеси гексан этилацетат, а затем из смеси гексан-циклогексан, исходя из 5-амино-3-бром-1-(2,6-дихлор-4-трифторметилфенил)пиразола. 5-Амино-1-(2,6-дихлор-4-трифторметилфенил)-3-фтор-4-трифторметилтиопиразол, т.пл. 123-126оС, в виде твердого вещества белого цвета, исходя из 5-амино-1-(2,6-дихлор- 4-трифторметилфенил)-3- фторпиразола.
5-Амино-4-хлордифторметилтио-3-циа- но-1-(2, 6-дихлор-4-трифторметилфенилпиразол, т. пл. 167-168оС, в виде твердого продукта белого цвета, исходя из хлордифторметилсульфенилхлорида. Продукт очищали с помощью высокоэффективной жидкостной хроматографии, используя 8 микронную нерегулярную колонку (21,4 х 25 мм) и элюируя смесью ацетонитрил/вода (3:2).
Сравнительный пример 1.
5-Амино-3-циано-1-(2, 6-дихлор-4-три- фторметилфенил)пиразол, использованный в вышеприведенном примере, получали следующим образом.
Суспензию нитрозилсерной кислоты, полученную из нитрита натрия (7,0 г) и концентрированной серной кислоты (27,5 мл), разбавляют уксусной кислотой (25 мл), охлаждают до 25оС и перемешивают механической мешалкой. К этому добавляют раствор 2, 6-дихлор-4-трифторметиланилина (21,2 г) в уксусной кислоте (50 мл) по каплям за 15 мин при 25-32оС. Эту смесь нагревают до 55оС в течение 20 мин и выливают в перемешиваемый раствор этил-2,3-дицианопропионата (14,0 г) в уксусной кислоте (60 мл) и воды (125 мл) при 10-20оС. Спустя 15 мин добавляют воду (200 мл) и масляный слой выделяют. Затем водный слой экстрагируют дихлорметаном (3х70 мл) и полученные экстракты объединяют с маслом и промывают раствором аммиака до рН 9. Затем органическую фазу перемешивают с аммиаком (20 мл) в течение 2 ч и выделяют дихлорметановый слой. Его промывают водой (1х100 мл) 1 н.соляной кислотой (1х100 мл), сушат над безводным сульфатом магния, фильтруют и выпаривают в вакууме до получения маслянистого твердого вещества. После кристаллизации из смеси толуол/гексан получают указанное соединение в виде коричневых кристаллов (20,9 г), т.пл. 140-142оС.
Аналогичным способом, но заменяя 2,6-дихлор-4-трифторметил-анилин соответствующим образом замещенными анилинами, получают: 5-амино-3-циано-1-(2,6-дихлор-4-трифторметоксифенил)пиразол в виде твердого продукта желтовато-коричневого цвета, т.пл. 119-120,5оС, из 2,6-дихлор-4-трифторметоксианилина.
5-Амино-3-циано-1-(2, 6-дихлор-4-ди- фторметоксифенил)пиразола.
5-Амино-3-циано-1-(2, 6-дихлор-4-ди- фторметоксифенил)пиразол, после промывания образовавшегося вначале продукта в виде раствора в дихлорметане насыщенным раствором карбоната натрия. Получают указанное в заглавии соединение в виде твердого продукта желтого цвета после перекристаллизации из толуола, т.пл. 120-122,5о С, из 2,6-дихлор-4-дифторметоксианилина.
5-Амино-1-(2-хлор-4-трифторметилфе- нил)-3-цианопиразол в виде кристаллического продукта оранжевого цвета, т.пл. 133-135оС из 2-хлор-4-трифторметиланилина.
5-Амино-3-циано-1-(2,4-трихлорфенил)пиразол в виде твердого продукта светло-коричневого цвета, т.пл. 155-156оС, из 2,4, 6-трихлоранилина.
5-Амино-3-циано-1-(2, 6-дибром-4-три- фторметилфенил)пиразол в виде желтых кристаллов, т.пл. 142-146оС, из 2,6-дибром-4-трифторметиланилина.
5-Амино-1-(2-бром-6-хлор-4-трифторме- тилфенил)-3-цианопиразол в виде коричневых кристаллов, т.пл. 146-148оС, из 2-бром-6-хлор-4- трифторметиланилина.
5-Амино-1-(2, -бром-4-трифторметилфе- нил)-3-цианопиразол в виде желтого кристаллического вещества, т.пл. 159-162оС, из 2-бром-4-трифторметиланилина.
5-Амино-3-хлор-1-(2, 6-дихлор-4-три- фторметилфенил)пиразол, использованный в примере 1, получили следующим образом.
Смесь 5-амино-3-хлор-1-(2, 6-дихлор-4-трифторметилфенил)-4- этоксикарбонилпиразола (5, 0 г) и соляной кислоты (6н. 75 мл) в ледяной уксусной кислоте (75 мл) нагревают при кипении с обратным холодильником в течение 24 ч. Охлажденную реакционную смесь выпаривают до небольшого объема и подкисляют до pН 12 гидроокисью натрия (2н. ) и экстрагируют диэтиловым эфиром (3х75 мл). Эфирные экстракты объединяют и выпаривают в вакууме до получения смеси 5-амино и 5-ацетамидопиразолов в виде желтого смолистого твердого вещества (3,5 г). Этот твердый продукт растворяют в смеси соляной кислоты (6н. 30 мл) и диоксана (60 мл) и нагревают при кипении с обратным холодильником в течение 48 ч. Летучую часть отгоняют в вакууме, а остаток очищают на хроматографической колонке, используя смесь дихлорметан) гексан (4:1). После выпаривания элюата, содержащего основную компоненту, получают указанное в заглавии соединение (1,3 г), т. пл. 128-129оС, в виде грязно-белого твердого продукта 5-амино-3-хлор-1-(2, 6-дихлор-4- трифторметилфенил)-4-этоксикарбонилпиразол, использованный ранее, получают следующим образом. Трет-бутилнитрит (15,0 г) добавляют по каплям к перемешиваемой и охлаждаемой (0о С) смеси 3,5-диамино-1-(2, 6-дихлор-4-трифторметилфенил)-4-эток- сикарбонилпиразола) (50 г) и хлористой меди (21,0 г) в 600 мл ацетонитрила за 10 мин. Реакционную смесь перемешивают в течение 2 ч при 0оС и 2 ч при комнатной температуре, затем выпаривают до небольшого объема и выливают в соляную кислоту (5н. 1500 мл). Полученный раствор экстрагируют дихлорометаном (3х600 мл), промывают соляной кислотой (2н. 2х600 мл), сушат над безводным сульфатом магния и выпаривают до коричневого дегтя. Дегтеобразный продукт удаляют из продукта, используя хроматографию на сухой двуокиси кремния, элюируя смесью дихлорметан-гексан (4: 1), дальнейшую очистку проводят на хроматографической колонке, используя возрастающее соотношение дихлорметана (от 60 до 80%), в результате чего получают указанное в заглавии соединение (15,8 г), т.пл. 143-146,5оС, в виде оранжевого твердого продукта.
3,5-Диамино-1-(2, 6-дихлор-4-трифтор- метилфенил)-4-этоксикарбонил- пиразол, использованный ранее, получают следующим образом. Калиевую соль этилдицианоацетата (35,2 г) добавляют к перемешиваемой суспензии 2, 6-дихлор-4-трифторметилфенилгидразина (49 г) в соляной кислоте (0,9 н. 220 мл) и реакционную смесь перемешивают при кипении с обратным холодильником в течение 18 ч. Затем реакционную смесь охлаждают до осаждения твердого продукта, который отфильтровывают, тщательно растирают с диэтиловым эфиром (250 мл) и сушат до получения грязно-белого твердого продукта (56 г), который после перекристаллизации из смеси этилацетата и гексана дает указанное в заглавии соединение (29,2 г), т. пл. 196-197оС, в виде грязно-белого твердого продукта. Калиевую соль этилдицианоацетата получают следующим образом.
Раствор этилхлорформата (520 г) и малононитрила (330 г) в тетрагидрофуране (500 мл) добавляют по каплям в течение 1 ч к перемешиваемому раствору гидроокиси калия (560 г) и воды (2,01) при температуре ниже 40оС (внешнее охлаждение льдом). Реакционную смесь перемешивают при комнатной температуре в течение часа, а затем охлаждают до 0о для осаждения твердого продукта, который отфильтровывают и сушат над пятиокисью фосфора до получения указанного в заглавии соединения (334,4 г) в виде грязно-белого твердого продукта.
5-Амино-3-бром-1-(2,6-дихлор-4-триф- торметилфенил)пиразол, использованный в описанном примере, получают следующим образом.
Смесь 5-амино-4-карбэтокси-3-хлор-1-(2,6-дихлор-4-трифторметилфенил)пиразо- ла (3,3 г) и бромистоводородной кислоты (48% 30мл) в ледяной уксусной кислоте (50 мл) нагревают при кипении с обратным холодильником в течение 18 ч. Полученную смесь выпаривают до небольшого объема, подщелачивают раствором гидроокиси натрия (1Н.) и полученный продукт отфильтровывают и сушат (2,9 г). После перекристаллизации из смеси эталона и воды получают указанное в заглавии соединение (2,5 г), т.пл. 132,5-134оС, в виде бесцветного твердого продукта.
5-Амино-1-(2, 6-дихлор-4-трифторметил- фенил)-3-фторпиразол, использованный в описанном примере, получают следующим образом. Смесь 5-амино-1-(2, 6-дихлор-4-трифторметилфенил)-3-фтор-4- формилпиразол (1,5 г) в 40 мл метанола и 2н. соляной кислоты (10 мл) нагревают при кипении с обратным холодильником в течение 24 ч. После выпаривания в вакууме добавляют 100 мл воды и полученную смесь экстрагируют этилацетатом (2х100 мл). Полученный экстракт промывают насыщенным раствором бикарбоната натрия (50 мл), сушат над безводным сульфатом магния и выпаривают в вакууме.
После очистки на хроматографической колонке при элюировании дихлорметаном получают указанное в заглавии соединение, т.пл. 128-129оС, в виде белого твердого вещества.
5-Амино-1-(2, 6-дихлор-4-трифторметилфенил)-3-фтор-4-фтормилпиразол, использованный ранее, получают следующим образом, перемешиваемый раствор 5-амино-4-циано-(2, 6-дихлор-4-трифторме- тилфенил)-3-фторпиразол), полученный по описанию РСТ патентной публикации WO 8703-781-А (2,2 г) в сухом тетрагидрофуране (40 мл), обрабатывают при -70оС в атмосфере азота раствором диизобутилалюминийгидрида (13 мл) 1 м раствора толуола). Полученной смеси дают нагреться до комнатной температуры за 2 ч, оставляя на ночь, и выливают в смесь 2 н. соляной кислоты (50 мл) и льда (50 г). После перемешивания в течение 1 ч добавляют 25 мл толуола и выделяют органический слой. Водный слой повторно экстрагируют дихлорметаном (2х100 мл) и объединенные органические растворы промывают раствором бикарбоната натрия (20 мл) и сушат над безводным сульфатом магния. После выпаривания в вакууме получают твердый продукт коричневого цвета (1,5 г), который очищают на хроматографической колонке, элюируя смесью толуол/этилацетат (98:2), до получения указанного в заглавии соединения (1,0 г), т.пл. 137-139оС, в виде бледно-желтого твердого продукта.
П р и м е р 2. Соединения 16, 17.
Смесь безводной хлористой меди (1,15 г) в ацетонитриле (20 мл) перемешивают, добавляя третбутилнитрит (0,73 г) при 0оС. Спустя 10 мин добавляют раствор 5-амино-3-циано-1-(2,6-дихлор-4-трифторметилфе- нил)-4-трифторметилтиопиразола (3,0 г) в ацетонитриле (5 мл) при 0оС, и полученную смесь перемешивают при 0оС в течение 2 ч, а затем при комнатной температуре в течение ночи. После выпаривания в вакууме остаток растворяют в смеси дихлорметана (50 мл) и соляной кислоты (5М, 50 мл). Органический слой сушат над безводным сульфатом магния, выпаривают в вакууме и очищают хроматографически, элюируя петролейным эфиром (т.кипения 60-80оС) (дихлорметаном (2:1). После перекристал- лизации полученного продукта из петролейного эфира (т.кипения 60-80оС) получают 5-хлор-3-циано-1-(2,6-дихлор-4-трифторметилфенил-4- трифторметилтиопиразол (0,55 г) в виде белого кристаллического вещества, т. пл. 131-132оС.
Аналогичным образом, но исходя из 3,5-диамино-1-(2,6-дихлор-4-трифторметилфе- нил)-4-метансульфонилпиразола и проведя реакцию при 0о С в течение 2 ч, а затем нагревая до температуры кипения с обратным холодильником получают: 5-амино-3-хлор-1-(2, 6-дихлор-4-трифторметилфенил)-4-метансульфонилпиразол, т. пл. 177-179оС, в виде белого твердого продукта, после очистки на хроматографической колонке, элюируя дихлорметаном, а затем перекристаллизовывая из смеси толуола и гексана.
Сравнительный пример 2. 3,
5-Диамино-1-(2,6-дихлор-4-трифторметилфенил)-4-метансульфонилпиразол, использованный в вышеуказанном
примере, получают следующим образом:
карбонат калия
(11,7 г) добавляют порциями к
перемешиваемой смеси метансульфонилмалононитрилгидрохлорида (30,0 г) в воде (150 мл).
2, 6-Дихлоp-4-трифторметилфенилгид- разин (41,0 г) добавляют и полученную смесь нагревают при 100оС в течение ночи. После охлаждения отфильтровывают твердый продукт желтого цвета, промывают водой и перекристаллизовывают из водного метанола. Твердый продукт тщательно промывают эфиром, получая указанное в заглавии соединение в виде белого твердого вещества (14,6 г). Т. плавления 224-226оС.
П р и м е р 3. Соединения 18,
19, 20, 99
5-Амино-3-циано-1-(2,6-дихлор-4-три- фторметилфенил)-4-трифторметилтиопира- зол (4,0 г) добавляют к
триэтилортоформату (19,0 мл) и добавляют паратолуолсульфокислоту (0,019 г).
Полученную смесь
нагревают при кипении с обратным холодильником в течение 21 часа, охлаждают и триэтилортоформат
выпаривают в вакууме до получения в виде остатка коричневого масла. Его очищают
хроматографически,
элюируя смесью дихлорметана и гексана (1:1). После выпаривания элюата в вакууме получают
3-циано-1-(2,
6-дихлор-4-трифторметилфенил)-5-окс- этоксиметиленамино-4-трифторметилтио- пиразол в виде
бесцветного твердого продукта, т.плавления 70-71,5оС.
Аналогичным способом, но заменяя триэтилортоформат на триэтилортоацетат, и используя в качестве сорастворителя толуол, получают: 3-циано-1-(2, 6-дихлор-4-трифторметилфенил)-5-этокси-этилиденамино-4- трифторметилтиопиразол в виде твердого продукта бледно-желтого цвета, т.пл. 71-73оС.
Аналогичным образом, но заменяя 5-амино-3-циано-1-(2,6-дихлор- 4-трифторметилфенил)-4-трифторметилтиопиразол на 5-амино-3-циано-1-(2, 6-дихлор-4-трифтор- метилфенил)-4-метансульфонилпиразол и используя триэтилортоформат и толуол, получают 3-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-этоксиметилен амино-4-метансульфонилпиразол, т.плавления 145-147оС, в виде кремового твердого продукта.
Аналогичным способом, получают из 5-амино-3-циано-1-(2, 6-дихлор-4-трифторме- тилфенил-4-трифторметилсульфонилпиразола и триэтилортоформата, но без толуола в качестве сорастворителя 3-циано-1-(2, 6-дихлор-4-трифторметилфенил)-5-этоксиме- тиленамино-4- трифторметилсульфонилпиразол, т.пл. 118,8-119,8оС, в виде белого твердого продукта и после перекристаллизации из гексана.
П р и м е р 4. Соединения 21,22,23,24,26
К перемешиваемому раствору 5-амино-3-циано-1-(2,
6-дихлор-4- трифторметилфенил)-4-трифторметилтиопиразола (4,0 г) и
ацетилхлорида (2,3 г)
в 40 мл ацетонитрила при 0оС прикапывают 1,3 мл пиридина. Желтый раствор нагревают до комнатной
температуры в течение 45 мин, а затем нагревают при кипении с обратным
холодильником в
течение 24 ч. Охлаждаемый раствор выпаривают в вакууме и остаток растворяют в дихлорметане (100 мл), промывают
водой (2х100 м/л) сушат над безводным сульфатом магния и выпаривают в
вакууме до
получения желто-коричневого продукта (4,2 г). Его очищают хроматографически, элюируя дихлорметаном до получения
5-ацетамидо-3-циано-1-(2,
6-дихлор-4- трифторметил- фенил)-4-трифторметилтиопиразола
(2,
0 г) в виде твердого бесцветного продукта, т.плавления 217-218оС после перекристаллизации из
толуола.
Аналогичным образом, но заменяя ацетилхлорид пропионилхлоридом
получают следующие два соединения:
3-циано-1-(2,
6-дихлор-4-трифторметил- фенил)-5-бис(пропионил)амино- 4-трифторметилтиопиразол,
т. плавления 128-130оС, в виде белого
кристаллического вещества и 3-циано-1-(2,
6-дихлор-4-трифторметил- фенил)-5-пропионамидо-4-трифторметилтио- пиразол, т.плавления 178,5-182оС,
в виде бледно-желтого твердого продукта.
Аналогичным способом, но заменяя
5-амино-3-циано-1-(2,6-дихлор-4-трифторметил- фенил)-4-трифторметилтиопиразола 5-амино-3-циано-1-(2,
6-дихлор-4-трифторметил- фенил)-4-метансульфонил- пиразол,
получают: 5-ацетамидо-3-циано-1-(2,
6-дихлор-4-трифтор- метилфенил)-4-метансульфо- нилпиразол, т.плавления 220-222оС, в виде
твердого вещества кремового цвета.
Аналогичным образом получают 5-ацетамидо-3-циано-1-(2,6-дихлор-4-трифторме- тилфенил)-4-трифторметилфенил-4-трифторметилсульфонилпиразол, т.плавления 208-211оС, в виде белого твердого продукта из 5-амино-3-циано-1-(2, 6-дихлор-4-трифтор- метилфенил)-4-трифторметилсульфинилпи- разола. В этом случае реакционную смесь нагревают при кипении с обратным холодильником в течение 3 ч.
П р и м е р 5.
Соединения 25,26, 27,28, 29, 30,97
К перемешиваемому раствору 5-амино-3-циано-1-(2,
6-дихлор-4- трифторметилфенил)-4-трифторметилтиопиразола (5,0 г) в сухом
тетрагидрофуране
(80 мл),
перемешиваемому в атмосфере азота при комнатной температуре, добавляют гидрит натрия (0,36 г) 80%
дисперсия в масле за пол-часа. Спустя еще пол-часа добаляли еще 2 капли
15-краун-5-, а
затем
триметилацетилхлорид (16 г), полученную смесь нагревают при кипении с обратным холодильником в течение 24
ч. После охлаждения до 0оС проводят повторное добавление
гидрида натрия (0,
15 г) с
последующим добавлением триметилацетилхлорида (0,8 г) полученную смесь кипятят с обратным холодильником
еще в течение 18 ч. Полученную смесь охлаждают, выливают на воду
(100 мл) и
экстрагируют эфиром
(2х80 мл). Эфирные экстракты сушат над безводным сульфатом магния, выпаривают в вакууме до желтого масла
(6,2 г) которое очищают хроматографически, элюируя
петролейным эфиром в
смеси с дихлорметаном
(3:2) до получения 3-циано-1-(2,
6-дихлор-4-трифтор- метилфенил)-4-трифторметилтио-5-триметилацетамидопи- разола (0,82 г), т.плавления 172,5-173,5оС, в виде твердого
белого вещества.
Аналогичным образом,
но заменяя триметилацеталхлорид соответствующим ацилирующим агентом, получают:
3-циано-1(2,
6-дихлор-4-трифторметил- фенил)-5-бис(метоксикарбонил)
амино-4-трифторметилтиопиразол, т.плавления
135-136,5оС, в виде твердого белого продукта, используя метилхлорформат. 3-Амино-1- (2,
6-дихлор-4-трифторметилфенил)-5-бис(этоксикарбонил)амино-4- трифторметилтиопиразол т. плавления 83,
2-85,5оС, в виде белого твердого продукта, используя этилхлорформат и проводят реакцию
при комнатной температуре.
5-Хлорацетамидо-3-циано-1-(2, 6-ди- хлор-4-трифторметилфенил)-4- трифторметилтиопиразол, т. плавления 175-176оС в виде белого твердого вещества, используя хлорацетилхлорид и после очистки на хроматографической колонке и перекристаллизации из смеси толуол/гексан. Аналогичным образом, но заменяя 5-амино-3-циано-1-(2, 6-дихлор-4-трифторметилфе- нил-4-трифторметил- тиопиразол на 5-амино-3-циано-1-(2, 6-дихлор-4-триформетил- фенил)- 4-метансульфонилпиразо и используя соответствующий ацилирующий агент, получают 3-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-бисэтоксикарбонил)амино-4-метан сульфонилпиразол в виде белого твердого продукта, т.плавления 195-198оС, используя этихлорформат.
3-Циано-1-(2, 6-дихлор-4-трифторметил- фенил)-4-метансульфонил-5-триметилацет- амидопиразол в виде белого твердого продукта, т.плавления 245-247оС, используя триметилацетилхлорид.
Аналогичным образом получают из 5-амино-3-циано-1-(2,6-дихлор-4- трифторметилфенил)-4-трифторметилсульфонилпира- зола и этилхлорформата.
3-циано-1-(2, 6-дихлор-4-трифторметилфенил)-5-бис(этоксикарбонил) амино-4-трифторметилсульфонилпиразол, т. плавления 116-116,9оС, в виде белого твердого продукта после перекристаллизации из смеси толуол/гексан.
П р и м е р 6.
Соединения 31, 32, 33, 34, 45, 36, 93.
К смеси гидрата натрия (0,71 г 80% дисперсии в масле) в сухом тетрагидрофуране (30 мл) добавляют 5-амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил)-4-трифтор- метил- тиопиразол (4,0 г). Через 20 мин добавляют 3 капли 15-краун-5- и полученную смесь охлаждают до 0оС. Затем добавляют метилтиодид (3,4 г) и полученную смесь перемешивают при 0оС в течение получаса, а затем при комнатной температуре в течение ночи. Растворитель выпаривают в вакууме, а остаток разделяют между дихлорметаном (80 мл) и водой (80 мл). Органическую фазу сушат над безводным сульфатом магния и выпаривают в вакууме до получения бледно-желтого твердого продукта (4,29 г). После хроматографической очистки, элюируя смесь дихлорметан/петролейный эфир (1:1) получают 3-циано-1-(2, 6-дихлор-4-трифторметилфенил)-5- диметил-амино-4-трифторметилтиопиразол) 2,11 т.плавления 109, 5-110,8оС, в виде белого твердого продукта.
Аналогичным образом, но
заменяя
метилиодид соответствующими алкилгалоидами, получают:
3-циано-1-(2,
6-дихлор-4-трифторметил- фенил)-5-изопропиламино-4-трифторметилтиопиразол, т. плавления 173-175оС, в
виде
твердого продукта кремового цвета после хроматографической очистки и
перекристаллизации из смеси толуол/гексан, получают из изопропилиодида.
3-Циано-1-(2,
6-дихлор-4-трифторметил- фенил)-5-пропиламино-4-три- фторметилтиопиразол, т.плавления 162-163,
5оС, в виде белого твердого вещества, и
3-Циано-1-(2,
6-дихлор-4-трифторметил- фенил)-5-дипропиламино-4- трифторметилфенил)-5-дипропиламино-4-трифторметил- тиопиразол, т.
плавления
72,5-73оС, в виде белого твердого продукта, причем оба
продукта получают, используя пропилбромид и проводят реакцию вначале при 0оС, а затем при 80оС.
3-Циано-1-(2, 6-дихлор-4-трифторметил- фенил)-5-бис(пропаргил)- амино-4-трифторметилтиопиразол, т. плавления 86-89оС в виде белого твердого продукта после перекристаллизации из смеси толуол/гексан, получают из пропаргилбромида.
Аналогичным образом, но заменяя 5-амино-3-циано-1-(2,6-дихлор-4-трифторме- тилфенил)-4-трифторметилтиопиразол на
5-амино-3-циано-1-(2,
6-дихлор-4-трифторме- тилфенил)-4-метансульфонил пиразол и используя метилиодид в качестве алкилирующего агента получают:
3-циано-1-(2,
6-дихлор-4-трифторметил- фенил)-45-метиламино-4-метансульфонил- пиразол в виде твердого вещества желтого цвета, т.пл. 169-172оС.
Аналогичным способом, но заменяя 5-амино-3-циано-1-2,6-дихлор-4-трифторме- тилфенил-4-трифторметил- тиопиразол на 5-амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил)-4-трифторметилсульфонилфи нилпиразол и используя в качестве растворителя диоксан, при нагревании с обратным холодильником в течение 5 ч получают 3-циано-1-(2,6-дихлор-4-трифторметилфенил)- 5-диметиламино-4-трифтор- метилсульфонил- пиразол, т.пл. 154-161оС, в виде твердого продукта белого цвета.
П р и м е р 7. Соединения 37, 38, 39, 40, 41, 95
Суспензию 5-амино-3-циано-1-(2,
6-дихлор-4-трифторметилфенил)-4- трифторметансульфонилпиразола (43,8 г) перемешивают в смеси бромоформа (141 мл) и сухого ацетонитрила (63 мл). Прикапывают трет-бутилнитрит (29,9 г) в течение 5
мин,
и
полученную смесь нагревают при 60-70оС в течение 2,75 ч. После охлаждения до 25оС проводят следующее добавление трет-бутилнитрита (29,9 г), нагревание продолжают в
течение
2
ч.
После выпаривания в вакууме получают твердый продукт желтого цвета, который тщательно растирают с гексаном и отфильтровывают. После двух перекристаллизаций из смеси толуол/гексан
получают
5-бром-3-циано-1-(2,6-дихлор-4-трифторметилфенил)-4-трифторметан- сульфонилпиразол в виде твердого продукта желтого цвета (34,0 г), т.пл. 136-137оС.
Аналогичным способом,
но заменяя 5-амино-3-циано-1-(2,6-дихлор-4-трифторме- тилфенил)-4-трифторметансульфонилпира- зол следующими фенилпиразолами, получают:
5-бром-3-циано-1-(2,
6-дихлор-4-триф- торметилфенил)-4-трифторметилтиопира- зол, т.пл. 161,5-164оС в виде желтовато-коричневого твердого продукта из 5-амино-3-циано-1-(2,
6-дихлор-5-трифтор- метилфенил)-4-трифторметилтиопиразола. Для этого получения в качестве сорастворителя ацетонитрил не используют 5-бром-3-циано-1-(2,
6-дихлор-трифторметилфенил)-4-метансульфонилпиразол, т. плавления 160,5-162оС, в виде твердого продукта белого цвета из 5-амино-3-циано-1-(2,
6-дихлор-4-трифторметиофенил)-4-метансульфо- нилпиразола.
5-амино-3-бром-1-(2,6-дихлор-4-три- фторметилфенил-4-метансульфонилпира- зол, т. пл. 193-195оС, в виде белого твердого продукта из 2,5-диамино-1-(2,6-дихлор-4-трифторметилфенил)-4-метансульфонил- пиразола, и заменяя бромоформ на два эквивалента брома и используя в качестве растворителя хлороформ.
3-Бром-1-(2,6-дихлор-4-трифторметил- фенил)-4-метансульфонил-епиразол в виде белых кристаллов, т.плавления 178-180оС из 3-амино-1-(2, 6- дихлор-4-трифторметилфенил)-4-метансульфонипиразола.
Аналогичным способом получают:
5-Бром-3-циано-1-(2,
6-дихлор-4-три- фторметилфенил)-4-трифторметил- сульфонилпиразол,
т.плавления 147-148оС, в виде твердого продукта желтого цвета. В этом случае реакцию ведут при 52оС в
течение 2 ч.
Справочный пример 3.
Используемый в предыдущем примере 3-амино-1-(2,6-дихлор-4-трифторметилфе- нил)-4-метансульфонилпиразол готовили следующим образом.
Раствор 3-трет-бутоксикарбониламино-1-(2, 6-дихлор-4-трифторметилфенил)-4-ме- тансульфонилпиразола (6,4 г) в этаноле (150 мл) обрабатывали 50% -ным об/об. хлористоводородной кислотой (20 мл) и полученную смесь нагревали в течение 1 ч с обратным холодильником. Растворитель выпаривали в вакууме и остаток растворяли в дихлорметане, промывали раствором бикарбоната натрия, затем водой сушили над безводным сульфатом магния и выпаривали в вакууме. Полученный продукт перекристаллизовывали из смеси этих ацетат/гексан с образованием целевого соединения (3,0 г) в виде белых кристаллов, т.пл. 222-223оС.
3-Трет-бутоксикарбониламино-1-(2,6- дихлор-4-трифторметилфенил)-4- метансульфонилпиразол готовили следующим образом.
Смесь 3-карбокси-1-(2, 6-дихлор-4-трифторметилфенил)-4-метан- сульфонилпиразола (9,4 г) хлористого тионила (70 мл) и N,N-диметилформамида (3 капли нагревали с обратным холодильником в течение 2 ч. Растворитель выпаривали в вакууме и повторно выпаривали в вакууме после добавления сухого толуола (20 мл). Полученное в результате твердое вещество растворяли в сухом ацетате (60 мл) и перемешивали, добавляя при этом в течение 5 мин, при 10-15оС раствор азида натрия (2,1 г) в воде (15 мл). Через 30 мин смесь переливали в воду (250 мл) и экстрагировали дихлорметаном (3х80 мл). Объединенный экстракт промывали водой, сушили над безводным сульфатом магния и выпаривали в вакууме при 40оС или ниже с образованием желтовато-коричневого твердого вещества.
Полученный в результате азид растворяли в сухом толуоле (80 мл) и нагревали с обратным холодильником в течение 0,75 ч в ходе чего происходило гладкое выделение азота. После охлаждения полученную смесь обрабатывали трет-бутанолом (15 г) и затем в течение 2 ч нагревали с обратным холодильником. После выстаивания в течение ночи при комнатной температуре и выпаривания в вакууме полученное в результате коричневое полутвердое вещество (9,2 г) очищали методом хроматографии на колонке с силикагелем (Meroc 230-400 меш. 6,8 NM-2), проводя элюирование дихлорметаном и этилацетатом (98:2) с образованием целевого соединения (6,6 г).
3-Карбокси-1-(2, 6-дихлор-4-трифторме- тилфенил)-4-метансульфонил- пиразол готовили следующим образом.
Смесь, состоящую из 1-(2, 6-дихлор-4-трифторметилфенил)-3-этоксикарбонил-4-метансульфонилпиразола (14,0 г) и 80% серной кислоты (300 мл), нагревали и перемешивали в течение 4 ч при 80оС. После выстаивания в течение ночи при комнатной температуре полученный раствор переливали в избыточное количество льда и осадившееся твердое вещество отфильтровывали. Это твердое вещество растворяли в этилацетате, промывали водой, сушили (безводный сульфат магния) и выпаривали с образованием целевого соединения в виде темно-желтого твердого соединения (11,1 г), т.пл. 215-216оС.
Используемый выше 1-(2,6-дихлор-4-трифторметилфенил)-3-этоксикарбонил-4-метансульфонилпиразол получали следующим образом.
К раствору 5-амино-1-(2, 6-дихлор-4-трифторэтилфенил)-3-этокси- карбонил-4-метансульфонилпиразола (17,1 г) в сухом тетрагидрофуране (130 мл), перемешиваемому при комнатной температуре, в течение 2 мин добавляли трет-бутил нитрит (33 мл). Полученную смесь в течение 1,5 ч нагревали с обратным холодильником, растворитель выпаривали в вакууме и остаток растворяли в дихлорметане. После промывания водой, сушки (сухой сульфат магния) и выпаривания получали желтое твердое вещество. В результате перекристаллизации из смеси толуолпетролейный эфир (т.кип. 60-80оС получали целевое соединение в виде желтых кристаллов (15,2 г), т.пл. 183-185оС.
Используемый выше 5-амин-1-(2,6-дихлор-4-трифторметилфенил)-3- этоксикарбонил-4-метансульфонилпиразол, получали следующим образом. К абсолютированному этанолу (20 мл), охлажденному на бане со смесью лед-вода, добавляли гидрид натрия (0,25 г 80% дисперсии в масле), после чего добавляли метансульфонилацетонитрил (0,99 г), полученную смесь перемешивали в течение 0,5 ч. После этого добавляли раствор этил/хлор (2,6-дихлор-4-трифторметилфенил)- гидразонацетата (3,0 г) в абсолютированном этаноле (20 мл) и перемешивание продолжали в течение 5 ч. Желтое твердое вещество отфильтровывали (2,55 г) и перекристаллизовывали из этанола с образованием целевого соединения в виде бесцветного твердого вещества, т.пл. 255оС.
Этил хлор-(2,6-дихлор-4-трифторметилфенил)-гидразонацетат получали следующим образом.
Нитрит натрия (3,04 г) в течение 15 мин добавляли к перемешиваемой концентрированной серной кислоте (2,4 мл) и при 30-50оС. Этот раствор охлаждали до 20оС и по каплям добавляли в течение 15 мин к раствору 2,6-дихлор-4-трифтор-метиланилина (9, 2 г) в уксусной кислоте (90 мл), поддерживая при этом температуру 35-40оС. Затем такой раствор охлаждали до -10оС и по каплям добавляли к перемешиваемому раствору безводного ацетата натрия (54 г) и этилхлорацетата (70 г) в смеси воды (72 мл) и этанола (48 мл), в течение 45 мин охлаждая систему таким образом, чтобы поддерживать температуру на значении 10оС. Через 1 ч пребывания при комнатной температуре смесь разбавляли водой, фильтровали и твердое вещество растворяли в дихлорметане. Полученный раствор сушили над безводным сульфатом магния, фильтровали и выпаривали в вакууме с образованием целевого соединения в виде белого твердого вещества (11,9 г), т.пл. 96-98оС.
П р и м е р 8. Соединения 42, 43, 44,
45
Раствор
5-амино-3-циано-1-(2,
6-дихлор-4-трифторметилфенил)-4- трифторметилтиопиразола (4,0 г) в сухом тетрагидрофуране (20 мл) обрабатывали трет. -бутил натритом (5,76 г) при комнатной
температуре.
Затем
полученную смесь
нагревали в течение 3 ч с обратным холодильником и выпаривали в вакууме с образованием желтого твердого вещества.
В результате хроматографической очистки при элюировании смесь петролейный эфир/дихлорметан (2: 1) получали 3-циано-1-(2,6-дихлор-4-трифторметилфенил)-4-три- фторметилтиопиразол (3,12), т.пл. 126,5-128оС, в виде белого твердого вещества. Используя аналогичную методику, но заменяя 5-амино-3-циано-1-(2,6- дихлор-4-трифторметилфенил)-4-трифторметилтио-пира- зол на следующие фенилпиразолы, получали следующие соединения.
3-Циано-1-(2,6-дихлор-4-трифторметил- фенил)-4-трифторметансульфонилпиразол, т.пл. 149-151оС, в виде белого твердого вещества из 5-амино-3-циано-1-(2, 6-дихлор-4-трифторметилфенил)-4-трифторметан- сульфонилпиразола. Этот продукт получали через 29 ч нагревания обратным холодильником с последующей хроматографической очисткой и перекристаллизацией из смеси толуол/гексан.
3-Циано-1-(2,6-дихлор-4-трифторметок- сифенил)-4-трифторметилпиразол, т. пл. 64-65оС, в виде белого твердого вещества, из 5-амино-3-циано-1-(2, 6-дихлор-4-трифтор- метоксифенил)-4-трифторметил- тиопиразола.
3-Циано-1-(2,6-дихлор-4-трифторметил- фенил)-4-метансульфонил-пиразол, т.пл. 147-150о С, в виде желтых кристаллов, из 5-амино-3-циано-1- (2,6-дихлор-4-трифторметилфенил)-4-метансульфонилпиразола.
П р и м е р 9. Соединения 46, 47, 48, 49, 50, 94
К раствору
5-амино-3-циано-1-(2,
6-дихлор-4-трифторметил-фенил)-4- трифторметилтиопиразола (3,0 г) в хлороформе (50 мл), перемешиваемому при комнатной температуре, добавляли иод (3,61 г). Затем добавляли
трет-бутил нитрит (1,43 г) и
через 0,5 ч смесь нагревали в течение 2 ч с обратным холодильником и после этого оставляли на ночь при комнатной температуре. Твердое вещество отфильтровывали,
промывали
дихлорметаном (50 мл) и
объединенный фильтрат промывали раствором тиосульфата натрия (2х50 мл) и затем водой (50 мл). После сушки над безводным сульфатом магния раствор выпаривали в
вакууме с
получением желтого твердого
вещества (3,8 г), которое подвергали хроматографической очистке, проводя элюирование смесью петролейный эфир/дихлорметан (2:1). Перекристаллизацией из смеси
толуол/гексан
получали 3-циано-1-(2,
-дихлор-4-трифторметилфенил)-5-иод-4-трифторметилтиопи- разол, т.пл. 187,3-188,3оС, в виде белого твердого вещества.
Следуя аналогичной методике, но заменяя 5-амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил)-4-трифторметилтиопира- зол на следующие фенилпиразолы, получали: 3-Циано-1-(2, 6-дихлор-4-трифторметилфенил)-5-иод-4-трифторметилсульфонилпи- разол, т.пл. 180-181оС, в виде белого твердого вещества из 5-амино-3-циано-1-(2, 6-дихлор-4-трифторметилфенил)-4- трифторметансульфонилпиразола. В этом случае реакционную смесь нагревали с обратным холодильником в течение 24 ч.
5-Амино-1-(2, 6-дихлор-4-трифторметил- фенил)-3-иод-4-метансульфонилпиразол, т.пл. 226-227оС, в виде коричневого твердого вещества из 3, 5-диамино-1-(2, 6-дихлор-4-трифторметилфенил)-4-метансульфонил- пиразола. В этом случае реакционную смесь нагревали с обратным холодильником в течение 4,5 с 1-(2, 6-дихлор-4-трифторметилфенил)-3-иод-4-метансульфонилпиразол в виде кремового твердого вещества, т.пл. 150-151оС, получали из 3-амино-1-(2, 6-дихлор-4-трифторметилфенил)-4-метансульфо- нилпиразола). Получение описано в справочном примере 3).
1-(2,6-дихлор-4-трифторметилфенил)-3-иод-4-трифторметилтиопиразол, т.пл. 80-81, 5оС, в виде белого твердого вещества, получали из 3-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-трифторметилтиопира- зола.
Такую реакцию осуществляли с использованием в качестве растворителя сухого ацетонитрила и вначале при температуре 0-5оС, а затем в течение 0,5 ч при окружающей температуре.
Следуя аналогичной
методике получали:
из 5-Амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил)-4-трифторметилсуль- фонил пиразола 3-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-иод-4-трифторме- тил сульфонилпиразол,
т.пл. 165-166оС,
в виде бледно-желтого твердого вещества.
Справочный пример 4.
3-Амино-1-(2,6-дихлор-4-трифторметил- фенил)-4-трифторметилтиопиразол, используемый в предыдущем примере, получали следующим образом.
3-Трет-бутоксикарбониламино-1-(2,6- дихлор-4-трифторметилфенил)-4- трифторметилтиопиразол (3,45 г), растворенный в сухом ацетонитриле (80 мл), обрабатывали иодтриметилсиланом (2,6 г), прикапываемом к системе в атмосфере азота. После перемешивания в течение 45 мин добавляли метанол (10 мл) и еще через 15 мин раствор концентрировали в вакууме с образованием темной смолы. Это вещество растворяли в дихлорметане (100 мл), промывали раствором сульфита натрия (50 мл), затем водой (50 мл) и сушили над безводным сульфатом магния. В результате выпаривания дихлорметана получали целевое соединение (2,6 г), т.пл. 130-135оС, в виде белого твердого вещества.
3-Трет-бутоксикарбониламин-1-(2, 6-дихлор-4-трифторметилфенил)-4- трифторметилтиопиразол, используемый выше, получали следующим образом.
1-(2, 6-дихлор-4-трифторметилфенил)-4-трифторметилтиопиразол-3- карбоновую кислоту (5,6 г) растворяли в сухом N,N-диметилформамиде (50 мл) и добавляли триэтиламин (1,33 г). После охлаждения до 5оС добавляли раствор дифенилфосфарилазида (3,63 г) в N, N-диметилформамиде (20 л). После нагревания раствора до комнатной температуры его нагревали в течение 2,5 ч до 35оС. После выпаривания в вакууме при температуре ниже 40оС добавляли раствор хлористого натрия (5 г) в воде (100 мл) и полученную суспензию экстрагировали эфиром (3х100 мл). Объединенные экстракты промывали водой (50 мл), сушили над безводным сульфатом магния и выпаривали с образованием азида (2,6-дихлор-4-трифторметилфенил)-4-трифторметил-тиопира- зол-3- карбоновой кислоты (5,4 г). Раствор этого вещества в сухом толуоле (200 мл) нагревали с обратным холодильником при перемешивании в течение 1,5 ч, добавляли трет-бутанол (35 мл) и дефлегмацию продолжали в течение 4 ч. После выпаривания в вакууме остаток очищали методом колонной хроматографии, проводили элюирование дихлорметаном с получением целевого соединения (3,3 г) в виде беловатого твердого вещества, т.пл. 122-125оС.
1-(2,
6-Дихлор-4-трифторметилфенил)-4-трифторметилтиопиразол-3- карбоновую кислоту, используемую выше, получали следующим образом:
раствор гидроксида
натрия (1,73 г) в воде (50 мл) добавляли к
суспензии 1-(2,6-дихлор-4-трифторметилфенил)-3-этоксикарбо- нил-4- трифторметилтиопиразола (6,8 г) в этаноле (70 мл) и полученную смесь нагревали в
течение 1,5 с обратным холодильником. Растворитель
выпаривали в вакууме, добавляли воду (250 мл), после чего устанавливали рН системы, равным 1, с помощью концентрированной серной кислоты. Продукт
отфильтровывали, промывали водой (100 мл) и сушили
при
120оС в вакууме с образованием целевого соединения (5,7 г) в виде серого твердого вещества, т.пл. 175-177оС. 1-(2,
6-дихлор-4-трифторметилфенил)-3-этоксикарбонил-4-трифторметилтиопира- зол, используемый выше, получали согласно методике примера 8, заменяя 5-амино-3-циано-1-(2,
6-дихлор-4-трифторметилфенил)-4- трифторметилтиопиразол на 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3-этоксикарбонил-4-трифторметилти опиразол. Целевое соединение получали в виде беловатого
твердого
вещества, т.пл. 125,5-126оС.
5-Амино-(2,6-дихлор-4-трифторметил- фенил)-3-этоксикарбонил-4-трифторметил- тиопиразол, используемый выше, получали по методике, описанной в примере 1, в виде белого твердого вещества с т.пл. 213-214оС после хроматографической очистки из 5-амино-1-(2,6-дихлор-4-трифторметилфенил)- 3-этоксикарбонилпирапзола.
5-Амино-1-(2,6-дихлор-4-трифторметилфенил)-3-этоксикарбонил- пиразол получали следующим образом.
Раствор натриевой соли этилового эфира 3-циано-2-гидроксипроп-2-еновой кислоты (50,0 г) (С.А. 57:116604 Н.С.Вульфсон с сотр.) в холодной воде (500 мл) перемешивали, добавляя при этом холодную серную кислоту (2Н), до рН 1. Полученный раствор экстрагировали эфиром (2х400 мл) и экстракт промывали водой (200 мл), сушили над безводным сульфатом магния и выпаривали в вакууме с получением желтого масла (29,4 г). Раствор этого вещества в этаноле (400 мл) обрабатывали 2, 6-дихлор-4-трифторметилфенилгидразином (51,1 г) и полученный раствор нагревали в течение ночи с обратным холодильником. После охлаждения полученный раствор выпаривали в вакууме с образованием оранжевого твердого вещества. Перекристаллизацией из системы толуол/гексан получали целевое соединение в виде желтовато-коричневого твердого вещества (40,2 г), т. пл. 179-181оС.
П р и м е р 10. Соединения 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 91.
Неполный раствор 5-амино-3-циано-1-(2, 6-дихлор-4-трифторметилфенил)-4-три- фтор- метилтиопиразола (48,0 г) в хлороформе (600 мл) механически перемешивали и обрабатывали м-хлорпербензойной кислотой (61,4 г). Полученную смесь перемешивали и в течение 3,5 ч нагревали с обратным холодильником в атмосфере азота. После охлаждения добавляли дополнительное количество м-хлорпербензойной кислоты (12,3 г) и дефлегмацию продолжали в течение 1 ч. Охлажденную смесь разбавляли этилацетатом (600 мл), промывали раствором метабисульфита натрия (2х250 мл), затем раствором гидроксида натрия (2х250 мл) и, наконец, водой (1х500 мл). Органический слой сушили над безводным сульфатом магния, фильтровали и выпаривали в вакууме с образованием желтовато-коричневого твердого вещества. Перекристаллизацией из смеси толуол(гексан) этилацетат получали 5-амино-3-циано-1-(2,6-дихлор-4-трифторме- тилфенил)-4-трифторметансульфонилпира- зол в виде белых кристаллов (37,0 г) т.пл. 219-221,5оС.
Перемешиваемый раствор 5-амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил)- 4-трифторметилтиопиразола (10,0 г) в дихлорметане (100 мл) обрабатывали м-хлорпербензойной кислотой (4,5 г). После перемешивания в течение ночи двумя порциями добавляли дополнительное количество м-хлорпербензойной кислоты (1,6 г) и смесь оставляли на 2 дня. Продукт реакции разбавляли этилацетатом (30 мл) и затем промывали раствором сульфита натрия (50 мл), раствором карбоната натрия (50 мл) и водой (50 мл). После сушки над сульфатом магния его отфильтровывали и выпаривали в вакууме. В результате хроматографической очистки на окиси кремния и элюирования дихлорметаном получали 5-амино-3- циано-1-(2,6-дихлор-4-трифторметилфенил)- 4-трифторметилсульфинилпиразол в виде белого твердого вещества (6,0 г) т.пл. 200,5-201о С.
Следуя аналогичной методике и заменяя упомянутые выше фенилпиразолы на соответствующие фенилпиразолы получали:
5-амино-3-циано-(2,
6-дихлор-4-трифтор- метоксифенил)-4-трифторметансульфонил- пиразол, т.пл. 210-211,5оС, в виде белого твердого вещества и 5-амино-3-циано-1-(2,
6-дихлор-4-трифторметоксифенил)-4- трифторметилсульфинилпиразол, т.пл. 179-180оС, в виде белого твердого вещества.
Каждое из указанных выше соединений получали из 5-амино-3-циано- 1-(2,6-дихлор-4-трифторметоксифенил)-4-трифторметил- тиопиразола в результате использования соответствующего количества м-хлорпербензойной кислоты, 3-циано-1-(2, 6-дихлор-4-трифторметил- фенил)-4-трифторме- тилсульфинилпиразол, т. пл. 142,5-144,2оС, в виде белого твердого вещества получали из 3-циано-1-(2, 6-дихлор- 4-трифторметилфенил)-4-трифторметилтиопиразола проводят реакцию в течение 20 ч при 40-50оС.
5-Амино-3-циано-1-(2, 6-дихлор-4-три- фторметилфенил)-4-(1-метил-проп- 2-инилсульфинил)пиразол, т.пл. 136,6-137,2оС, в виде белого твердого вещества из 5-амино-3-циано-1-(2, 6-дихлор-4-трифторметилфе- нил)-4-(1-метилпроп-2-инилтио)пиразола.
5-Амино-3-циано-1-(2,6-дихлор-4-три- фторметилфенил)-4-метилсульфинилпира- зол, т. пл. 176-177оС, в виде желтовато-коричневого твердого вещества, полученного из 5-амино-3-циано-1-(2,6-дихлор-4-три- фторметилфенил)-4-метилтиопиразола.
5-Амино-3-циано-12-(2, 6-дихлор-4-три- фторметил)-4-изопропилсульфинилпиразо- л, т.пл. 187-188оС, в виде белого твердого вещества из 5-амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил)-4-изопропил тиопиразола.
5-Амино-3-бром-1-(2,6-дихлор-4-триф- торметилфенил)-4-трифторметилсульфи- нилпиразол, т.пл. 179-180оС, в виде белого твердого вещества из 5-амино-3-бром-1-(2, 6-дихлор-4-трифторметилфенил)-4- трифторметилтиопиразола. 5-Амино-4-трет-бутансульфонил-3-циано-1-(2,6-дихлор-4-трифторметилфенил)пи- разол, т. пл. 183-184оС, в виде бледно-желтого твердого вещества из 5-амино-4-трет-бутилтио-3-циано-1-(2,6-дихлор-4-трифтор- метилфенил)пиразола, с использованием 2 молярных эквивалентов м-хлорпербензойной кислоты в хлороформе и при проведении реакции в течение 4 ч при комнатной температуре.
Следуя аналогичной методике получали.
5-Амино-3-хлор-1-)2, 6-дихлор-4-трифторметилфенил)-4-трифторметан- сульфонилпиразол, т. пл. 162-164оС, в виде белого твердого вещества, из 5-амино-3-хлор-1-32, 6-дихлор-4-трифторметилфенил)- 4-трифторметилтиопиразола. 3-Циано-1-(2, 6-дихлор-4-трифторметилфенил)-5-пропиламино-4-трифторметан- сульфонилпиразол, т.пл. 49-65оС, в виде желтого твердого вещества из 3-циано-1-(2, 6-дихлор-4-трифторметилфенил)-5-про- пиламино-4-трифторметилтиопиразола при комнатной температуре, 5-ацетамидо-3-циано-1-(2, 6-дихлор-4-трифторметилфенил)- 4-трифторметансулфонилпиразол, т.пл. 174-175, 9оС, в виде белого твердого вещества получали из 5-ацетамидо-3-циано-1-(2, 6-дихлор-4-трифторметилфенил)-4-трифтор- метилтиопиразола, используя 2 молярных эквивалента м-хлорпербензойной кислоты и проводя реакцию в течение 20 ч при нагревании с обратным холодильником.
П р и м е р 11. Соединения 63, 64
Трифторуксусный ангидрид (6,0 мл) в течение 15 мин
прикапывали к перемешиваемой смеси 85% пероксида водорода ЭО, 96 мл) в дихлорметане (20 мл)
при 0-10оС. Полученную смесь нагревали в течение 5 мин при 20оС и в течение 5 мин
добавляли суспензию 3-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-метансульфонилпиразола (2,0
г)
в дихлорметане (20 мл). Затем полученный раствор нагревали в течение 1 ч с обратным холодильником и
оставляли на ночь при температуре (комнатной). Затем полученный раствор переливали в виде
(100
мл)
и органический слой последовательно промывали раствором метабилсульфита натрия (30 мл) и раствором
бикарбоната натрия (30 мл) и затем сушили над безводным сульфатом магния. Путем
выпаривания в
вакууме и последующей перекристаллизации из смеси дихлорметан/толуол/гексан получали 1-(2,
6-дихлор-4-трифторметилфенил)-4-метансульфонил-3-нитропиразол, т.пл. 190-192оС, в
виде белого
твердого вещества.
Следуя аналогичной методике, но заменяя 3-амино-1-(2,
6-дихлор-4- трифторметилфенил)-4-метансульфонилпиразол на 3,5- диамино-1-(2,
6-дихлор-4-трифторметилфе- нил)-4-метансульфонил- пиразол, получали:
5-амино-1-(2,
6-дихлор-4-трифторметил- фенил)-4-метансульфонил-3- нитропиразол в виде кормового твердого вещества,
т.пл.
190-192оС. Окисление проводили вначале при 0оС и затем нагревая смесь в
течение 1,5 ч до комнатной температуры. В этом случае необходимо было проводить
хроматографическую
очистку при элюировании дихлорметаном, а также перекристаллизацию из толуола.
П р и м е р 12. Соединение 65.
Перемешиваемую смесь 85% пероксида водорода (0,31 г) и дихлорметана (20 мл) обрабатывали трифторуксусным ангидридом (2,1 г), прикапывая этот реагент при -10оС. Через 15 мин смеси давали нагреваться до комнатной температуры и перемешивали в течение 15 мин. После повторного охлаждения до 0оС добавляли раствор 3-амино-1-(2, 6-дихлор-4-трифторметилфенил)- 4-трифторметилтиопиразола (1,0 г) (получение этого вещества описано в справочном примере 4) в дихлорметане (20 мл) и полученному раствору давали нагреваться до комнатной температуры. Через 2 ч добавляли дополнительное количество трифторперуксусной кислоты) полученной как описано выше, с использованием 85% пероксида водорода (0,31 г) дихлорметана (20 мл) и трифторуксусного ангидрида (2,1 г). Полученную смесь перемешивали в течение ночи, после чего переливали в воду (50 мл) и дихлорметановый слой последовательно промывали 5%-ным раствором сульфита натрия (30 мл), раствором бикарбоната натрия (30 мл) и водой (30 мл). Затем такой раствор сушили над безводным сульфатом магния и выпаривали в вакууме с образованием зеленой смолы (0,8 г). В результате хроматографической очистки при элюировании смесью дихлорметан/гексан (3:2) получали 1-(2, 6-дихлор-4-трифторметилфенил)-4-нитро-4-трифтор- метилсульфинилпиразол (0,3 г) т.пл. 124-130оС, в виде светло-зеленого твердого вещества.
П р и м е р 13. Соединения 66, 67.
Оксихлорид фосфора (20 мл) добавляли к 5-амино-1-(2-бром-6- хлор-4-4-трифторметилфенил)-43-карбамоил-4-метансульфони- лпиразолу (4,0 г) и раствор нагревали в течение 3,25 ч при 50-60оС, после чего оставляли на ночь при комнатной температуре. Полученную смесь осторожно добавляли в интенсивно перемешиваемую воду (200 мл), после чего осажденное твердое вещество собирали и сушили в вакууме. Перекристаллизацией из смеси толуол/этанол получали 5-амино-1-(2-бром-6-хром-4-трифторметил- фенил)-3-циано-4-метансульфонилпиразол в виде темно-желтых кристаллов, т.пл. 235-238оС.
Следуя аналогичной
методике, но заменяя
5-амино-1-(2-бром-6-хлор- 4-трифторметилфенил)-3-карбамоил-4-метилсульфонил- пиразол на 5-амино-3-карбамоил-1-(2,
6-дихлор-4-трифторметоксифенил)-4-метан- сульфонилпиразол,
получали:
5-амино-1-(2,6-дихлор-4-трифторметок- сифенил)-3-циано-4-метансульфонилпира- зол в виде белого твердого вещества, т.пл.
202,5-203,5оС.
Справочный пример 5. 5-Амино-3-карбамоил-1-(2,6-дихлор-4-трифторметоксифе- нил)-4-метансульфонилпиразол, используемый выше, получали следующим образом, суспензию 5-амино-3-карбокси-1-(2, 6-дихлор-4-трифторметоксифенил)-4- метансульфонилпиразол (40,0 г) в толуоле (160 мл) обрабатывали тионил хлоридом (150 мл) и полученную смесь нагревали обратным холодильником при перемешивании в течение 3 ч. Полученный раствор выпаривали в вакууме и повторно выпаривали после добавления толуола (100 мл). Полученный в результате хлорангидрид растворяли в тетрагидрофуране (200 мл) и этот раствор в течение 15 мин прикапывали к перемешиваемому раствору аммиака (30 мл) при охлаждении системы до 5-10oС в течение ночи. После выстаивания в течение ночи добавляли воду (250 мл) и раствор экстрагировали этилацетатом (3х100 мл). Объединенный экстракт промывали водой (2х250 мл), сушили над безводным сульфатом магния и выпаривали в вакууме с образованием твердого вещества (34,9 г). Целевое соединение (19,3 г) получали в виде белого твердого вещества, т. пл. 219-220оС, после перекристаллизации из смеси этил ацетат/гексан.
Следуя аналогичной
методике,
но заменяя 5-амино-3-карбокси-1- (2,6-дихлор-4-трифторметоксифенил)-4-метансульфонил- пиразол на
5-амино-1-(2-бром-6-хлор-4-трифторметилфенил)-3-карбокси-4- метансульфонилпиразол,
получали:
5-амино-1-(2-бром-6-хлор-4-трифторме- тилфенил)-4-карбамоил-4-метансульфонил- пиразол, т.пл.
250-253оС в виде серо-коричневого порошка.
5-Амино-3-карбокси-1-(2, 6-дихлор-4- трифторметоксифенил)-4-метансульфонил- пиразол, используемый выше, получали согласно методу, используемому для получения 3-карбокси-1-(2, 6-дихлор-4-трифтор- метилфенил)-4-метансульфонилпиразола путем замены 1-(2, 6-дихлор-4- трифторметилфенил)-3-этоксикарбонил-4-метансульф- онилпиразола (ссылочный пример 3) на 5-амино-1-(2, 6-дихлор-4-трифторметоксифе- нил)-3-этоксикарбонил-4-метансульфонил- пиразол. Его получали в виде белого твердого вещества, т.пл. 195-196оС.
5-Амино-1-(2-бром-6-хлор-4-трифторметилфенил)-3-карбокси-4- метансульфонилпиразол, используемый выше, готовили следующим образом.
5-Амино-1-(2-бром-6-хлор-4-трифторметилфенил)-3-этокси-карбонил- 4-метансульфонилпиразол (8,0 г) нагревали с обратным холодильником в присутствии 48% бромистоводородной кислоты (75 мл) в среде уксусной кислоты (75 мл) в течение 3 ч. После охлаждения в течение ночи полученный раствор выпаривания в вакууме и остаток обрабатывали водным раствором бикарбоната натрия. Целевое соединение получали в виде серого порошка (6,6 г), т.пл. 130-133оС, после сушки в вакууме 5-амино-1-(2, 6-дихлор- 4-трифторметоксифенил)-3-этоксикарбонил-4-метансульфонилпиразол, исполь- зуемый выше, получали по методике ссылочного примера 4 путем замены этил хлор(2,6-дихлор-4-трифторметилфенил) гидразонацетата на этил хлор(2,6-дихлор-4-трифторметоксифенил) гидразонацетата. Это вещество получали в виде светло-коричневого твердого вещества, т. пл. 207оС.
5-амино-1-(2-бром-6-хлор-4-трифторметилфенил)-3-этоксикарбонил- 4-метансульфонилпиразол, используемый выше, получали аналогичным образом из этих хлор (3-бром-6-хлор-4-трифторметилфенил)гид- разон ацетата. Это вещество получали в виде белого твердого вещества, т.пл. 255,5-256,6оС.
Этил хлор(2,6-дихлор-4-трифторметоксифенил)-гидразонацетата, используемый выше, получали по методике ссылочного примера 3 путем замены 2,6-дихлор-4-трифторметиланилина на 2, 6-дихлор-4- трифторметоксианилин, который синтезировали в виде коричневого твердого вещества, т.пл. 55-58оС.
Этил хлор-(2-бром-6-хлор-4-трифторметилфенил)гидразонацетат, используемый выше, получали аналогичным образом из 2-бром-6-хлор- 4-трифторметиланилина в виде светло-коричневого твердого вещества с т.пл. 116,5-177,5оС.
П р и м е р 14. Соединение 68.
Раствор этилата натрия, приготовленный из натрия (0,36 г) и абсолютированного этанола (50 мл) обрабатывали при комнатной температуре метансульфонил ацетонитрилом (1,88 г) и полученную смесь перемешивали в течение 1 ч. К полученной системе прикапывали, проводя перемешивание, раствор 1-хлор-1-(2, 6-дихлор- 4-трифторметилфенил)гидразонпропан-2-она (5,0 г) в эфире (50 мл). После перемешивания в течение ночи этот раствор разбавляли водой (100 мл), экстрагировали эфиром (3х50 мл) и объединенные эфирные экстракты сушили над безводным сульфатом магния, после чего выпаривали в вакууме с образованием коричневого твердого вещества. Перекристаллизацией из смеси толуол/гексан получали 3-ацетил-5-амино- 1-(2,6-дихлор-4-трифторметилфенил)-4-ме- тансульфонилпиразол (2,56 г) в виде темно-желтого твердого вещества, т. пл. 176,7-178, 9оС.
1-Хлор-1-(2,6-дихлор-4-трифторметил- фенил)гидразонпропан-2-он, используемый выше, получали по методике, описанной в справочном примере 3, заменяя этил хлорацетоацетат на 3-хлорпентан-2,4-дион. Это вещество получали в виде светло-коричневого твердого вещества, т.пл. 77-79оС, после перекристаллизации из петролейного эфира, т.кип. 60-80оС.
П р и м е р 15. Соединения 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 100.
Раствор 5-амино-3-циано-1-(2, 6-дихлор-4-трифторметилфенил)-4-тиоцианатопира- зола (3,1 г) в метаноле (50 мл) перемешивали в атмосфере азота при -7оС и добавляли иодистый метил (5:25 мл). Затем в течение 10 мин прикапывали раствор гидроксида калия (0,92 г) в воде (10 мл) поддерживали температуру смеси ниже 0оС. После перемешивания системы при комнатной температуре в течение 3 ч полученную смесь нейтрализовали путем добавления гранулированной двуокиси углерода, после чего добавляли воду (180 мл). Осажденное твердое вещество отфильтровывали и перекристаллизовывали из смеси толуол/гексан (2: 1). 5-амино-3-циано-1-(2, 6-дихлор-4-трифторме- тилфенил)-4-метилтиопиразол получали в виде коричневого кристаллического твердого вещества (1,94 г), т. пл. 170-172оС.
Следуя
аналогичной методике,
но заменяя иодистый метил на следующие алкилгалогениды, получали:
При использовании иодистого этила и этанола в качестве растворителя получали
5-амино-3-циано-1-(2,
6-дихлор-4-трифтор- метилфенил)-4-этилтиопиразол в виде желтого твердого вещества, т.пл. 158-160оС.
При использовании бромистого пропила и водного диоксана в качестве растворителя получали 5-амино-3-циано- 1-(2,6-дихлор-4-трифторметилфенил)-4-про- пилтиопиразол в виде бледно-коричневого твердого вещества, т.пл. 123-124оС.
При использовании бромистого изопропила и водного изопропилового спирта в качестве растворителя получали 5-амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил)- 4-изопропилтио- пиразол в виде бледно-коричневого твердого вещества, т.пл. 168-169оС.
В результате использования 1-иод-2-метилпропана и водного диоксана в качестве растворителя получали 5-амино-3-циано- 1-(2,6-дихлор-4-трифторметилфенил)-4-(2-метилпропилтио)пиразол в виде бледно-коричневого твердого вещества т.пл. 134-137оС.
При использовании 3 иодбутана и водного диоксана в качестве растворителя получали 5-амино-3-циано-(2,6-дихлор- 4-трифторметил- фенил)-4-(1-метилпропилтио)пиразол в виде бледно-коричневого твердого вещества, т.пл. 152-154о С. Этот продукт очищали методом колонной хроматографии на окиси кремния, проводя элюирование смесью гексан/диэтиловый эфир (1:1). В результате использования бромистого аллила и водного диоксана в качестве растворителя получали 4-аллилтио-5-амино-3-циано-1-(2,6-дихлор-4-трифторметил- фенил)пиразол в виде бледно-коричневого твердого вещества, т.пл. 140-141оС. Полученный продукт очищали методом хроматографии, проводя элюирование смесью гексан/диэтиловый эфир (1:1) с последующей перекристаллизацией из толуола.
При использовании бромистого пропаргила и водного метанола в качестве растворителя получали 5-амино-3-циано-1- (2,6-дихлор-4- трифторметилфенил)-4-(проп-2-инилтио)-пиразол в виде коричневого твердого вещества, т.пл. 161-163о С.
При использовании 3-бромбут-1-ина и водного метанола в качестве растворителя получали 5-амино-3-циано-1-(2, 6-дихлор-4-трифторметилфенил)-4-(1-метилпроп-2-ин- илтио)пиразол в виде белого твердого вещества, т.пл. 134-135оС. Этот продукт подвергали хроматографической очистке, проводя элюирование смесью диэтиловый эфир/гексан (1:1) с последующей перекристаллизацией из смеси толуол/гексан.
При использование иодистого метила и водного метанола в качестве
растворителя получали
5-амино-3-бром-1-(2,6-дихлор-4-трифторметил-фенил)-4-метилтиопиразол в
виде
белого твердого вещества, т.пл. 117-199оС. Этот продукт подвергали хроматографической
очистке проводя
элюирование дихлорметаном. Следуя аналогичной методике, получали:
5-амино-4-(2-хлор-1,1,2-трифторэтил- тио)-3-циано-1-(2,6-дихлор-4- трифторметилфенил)пиразол, т.пл.
116-118оС,
в виде белого твердого вещества при использовании хлортрифторэтилена и
водного
диоксана в качестве растворителя. Полученный продукт подвергали хроматографической очистке,
проводят элюирование
дихлорметаном с последующей перекристаллизацией из смеси толуол/гексан
(3:10).
Справочный пример 6. 5-Амино-3-циано-1-(2, 6-дихлор-4-трифторметилфенил)-4-тиоцианато- пиразол, используемый выше, получали следующим образом.
Суспензию тиоцианата калия (4, 99 г) в метаноле (75 мм) перемешивали при -78оС. Затем в течение 25 мин прикапывали бром (0, 8 мл), растворенный в метаноле (10 мл). Еще через 20 мин в течение 30 мин добавляли раствор 5-амино-3-циано-1-(2, 6-дихлор- 4-трифторметилфенил)пиразола (5,0 г) в метаноле (50 мл). Полученную смесь перемешивали при -78оС и затем давали нагреваться до комнатной температуры в течение 3 ч перед переливанием в воду (250 мл). Осажденное твердое вещество отфильтровывали, промывали водой и перекристаллизовывали из смеси толуол/гексан с получением целевого соединения (3,1 г) в виде белого твердого вещества, т.пл. 179-182оС.
Следуя аналогичной методике, но
заменяя 5-амино-4-циано-1-(2,6- дихлор-4-трифторметилфенил)пиразол,
указанный в приведенном выше
справочном примере на 5-амино-3-бром-1-(2,6-дихлор-4-трифтор- метилфенил)пиразол получали:
5-амино-3-бром-1-(2,
6-дихлор-4-три- фторметилфенил)-4-тиоцианатопиразол в виде белого твердого
вещества, т.пл. 162-163,5оС, после очистки методом хроматографии, проводя элюирование
дихлор- метаном. Получение
5-амино-3-бром-1-(2,6-дихлор-4-трифторметилфенил)пиразола, используемого
выше, описано в справочном примере 1.
П р и м е р 16. Соединение 79.
К перемешиваемому раствору 5-амино-3-циано-1-(2, 6-дихлор-4-трифторметилфе- нил)-4-тиоцианатопиразола (5,0 г) в сухом диэтиловом эфире (70 мл), при 0оС в атмосфере азота, прикапывали раствор хлорида трет.бутилмагния (7,92 мл 2М раствора в сухом эфире). Раствору давали нагреваться до комнатной температуры и перемешивание продолжали в течение 8 ч. Затем добавляли воду (40 мл) и смесь перемешивали в течение 15 мин. Эфирный слой отделяли, промывали водой (50 мл), сушили над безводным сульфатом магния и выпаривали в вакууме с образованием коричневого твердого вещества. В результате хроматографической очистки, при элюировании смесью дихлорметан/петролейный эфир (3:1) получали 5-амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил)-4-трет-бутилтио- пиразол (2, 62 г), т.пл. 196-198, 5оС в виде бледно-желтого твердого вещества.
П р и м е р 17. Соединения 80, 81.
Раствор 5-амино-3-бром-1-(2, 6-дихлор-4-трифторметилфенил)-4-метилтиопиразо- ла (2:0 г) (получение описано в примере 15) в метаноле (45 мл) при -25оС обрабатывали быстро добавляемым раствором кислого персульфата калия (1,66 г), после чего немедленно добавляли воду (22 мл). Полученную смесь перемешивали в течение 30 мин при 0оС и добавляли кислый персульфат калия (0,4 г). Через 2,5 ч перемешивали при комнатной температуре, полученную смесь переливали воду (300 мл) и добавляли насыщенный раствор бисульфата натрия (35 мл). Полученную смесь экстрагировали дихлорметаном (2х550 мл) и экстракт промывали водой (2х50 мл), сушили над безводным сульфатом магния и выпаривали в вакууме. Сырой продукт очищали методом хроматографии проводят элюирование смесью дихлорметан/этил ацетат (4:1) с получением 5-амино-3-бром-1-(2, 6-дихлор-4-трифторме- тилфенил)-4-метилсульфинилпиразола (0,9 г) в виде белого твердого вещества, т.пл. 135-136оС.
Следуя аналогичной методике, но заменяя 5-амино-3-бром-1-(2,6-дихлор-4-трифторметилфенил)-4-метилтиопиразол на 5-амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил)-4-этилтиопиразол и используя соответствующее количество кислого персульфата калия, получили: 5-амино-3-циано-1-(2, 6-дихлор-4-трифторметилфенил)-4-этансульфонилпиразол в виде твердого вещества, т.пл. 180-183оС. В этом случае реакционную смесь выдерживали в течение 20 ч при комнатной температуре и получали целевое соединение без хроматографической очистки.
П р и м е р 18. Соединение 82.
Раствор 3-циано-1-(2, 6-дихлор-4-трифторметилфенил)-5-этоксиметиленамино- 4-трифторметилтиопиразола (1,7 г) в метаноле (30 мл) подвергали перемешиванию и порциями добавляли в борогидрид натрия (1,08 г). Полученному раствору давали нагреваться до комнатной температуры и еще через 7 ч переливали в воду (200 мл). Полученную смесь экстрагировали дихлорметаном (3х50 мл), сушили над безводным сульфатом магния и выпаривали в вакууме с получением белого твердого вещества (1,4 г). В результате хроматографической очистки при элюировании смесью дихлорметан/пет- ролейный эфир (4:1) получали 3-циано-1-(2, 6-дихлор-4-трифторметилфенил)-5-метил- амино-4-трифторметилтиопиразол (0,42 г) в виде белого твердого вещества, т.пл. 208,5-209,5оС.
П р и м е р 19. Соединение 83.
К раствору 3-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-этокси- карбониламино-4-трифторметилтиопиразола (1,0 г) в сухом тетрагидрофуране (20 мл) при перемешивании и температуре 0-10оС добавляли гидрид натрия (0,095 г). После перемешивания в течение 2,5 ч при комнатной температуре, при охлаждении системы до 0-10оС прикапывали иодистый метил (0,6 г) и полученную смесь перемешивали в течение ночи. Добавляли дополнительное количество иодистого метила (0,6 г) и перемешивание продолжали в течение 8,5 ч. Полученный раствор переливали в воду (100 мл) и экстрагировали дихлорметаном (2х500 мл). Экстракты сушили над безводным сульфатом магния и выпаривали в вакууме с получением 3-циано-1-(2, 6-дихлор-4-трифторметилфенил)-5-(N-этоксикарбонил-N- метил)-амино-4-трифторметилтиопиразола (0,81 г), т.пл. 86,2-88,5оС в виде белого твердого вещества.
П р и м е р 20. Соединение 84.
Смесь 5-амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил)-4-трифторметилтио- пиразола (3,0 г) и трифторуксусного ангидрида (15,0 г) в тетрагидрофуране (25 мл) в течение 6 ч нагревали с обратным холодильником. После выстаивания в течение ночи смесь выпаривали в вакууме, растворяли остаток в дихлорметане (50 мл) и раствор промывали раствором бикарбоната натрия (50 мл) и водой (50 мл). Полученный раствор сушили над безводным сульфатом магния и выпаривали в вакууме с образованием коричневого масла (2,9 г). В результате обработки гексаном затем получали 3-циано-1-(2, 6-дихлор-4-трифторметилфе- нил)-5-трифторацетамидо-4- трифторметилтиопиразол (1,86 г), т. пл. 138,2-139,8оС, в виде белого твердого вещества.
П р и м е р 21. Соединение 85, 98.
Раствор 3-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-бисэтоксикарбонил)ами- но-4-трифторметилтиопиразола (1,8 г) в этаноле (20 мл) обработали насыщенным раствором бикарбоната натрия (20 мл), и смесь кипятили с обратным холодильником в течение 1,5 ч. После выпаривания в вакууме желтое масло распределили между дихлорметаном (70 мл) и водой (70 мл). Водный раствор вновь экстрагировали дихлорметаном (50 мл) и объединенный органический раствор сушили над безводным сульфатом магния, и выпаривали в вакууме. Дальнейшее перетирание с гексаном приводило к получению 3-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-этоксикарбониламино- 4-трифторметилтиопиразола (1,23 г), температура плавления 108,7-109,7оС, в виде белого твердого вещества.
С помощью аналогичной методики было получено из 3-циано-1-(2,6- дихлор-4-трифторметилфенил)-5-бис(этоксикарбонил)ами- но-4-трифторметилсульфонилпиразола:
3-циано-1-(2,
6-дихлор-4-трифторметил- фенил)-5-этоксикарбониламино- 4-трифторметилсульфонилпиразол температура плавления 112,4-113оС, в виде белого твердого вещества после очистки
хроматографией с
элюированием смесью дихлорметан/гексан (1:1).
П р и м е р 22. К раствору 1-(2,6-дихлор-4-трифторметилфенил)-3- (1-гидроксиэтил)-4-трифторметилтиопиразола (1,1 г) в дихлорметане (40 мл) добавляли хлорхромат пиридиния (0,62 г) и смесь перемешивали при комнатной температуре в течение ночи. Добавили эфир (50 мл) и смесь фильтровали через диатомитовую землю. Выпаривание фильтрата в вакууме привело к получению коричневого твердого вещества, которое затем перетирали с гексаном и фильтровали. Фильтрат выпаривали в вакууме с получением желтого твердого вещества, которое перекристаллизовывали из циклогексана с получением 3-ацетил-1-(2,6-дихлор-4-трифторметилфенил)-4-трифторметилтиопира- зола (0,4 г) в виде желтого твердого вещества с температурой плавления 89-91оС.
Справочный пример 7. 1-(2,6-дихлор-4-трифторметилфенил)-3-(1-гидроксиэтил)-4-трифторметил иодпиразол, используемый в вышеуказанном примере, был получен следующим образом.
Перемешиваемый раствор 1-(2,6-дихлор-4-трифторметилфенил)-3-формил-4- трифторметилтиопиразола (1,64 г) в сухом эфире (20 мл) обрабатывали раствором метил магний иодида (1,35 мл в 3М растворе в эфире), добавляемом по каплям в течение 5 мин в атмосфере азота. Раствор затем кипятили с обратным холодильником в течение 1,5 ч, после чего раствор охлаждали и обрабатывали дополнительной порцией раствора метилмагний иодида (0:2 мл) способом, аналогичным описанным выше. После 1 дополнительного часа кипячения с обратным холодильником смесь влили в избыток льда и разбавленной соляной кислоты (100 мл) и экстрагировали эфиром (2х50 мл). Экстракт промыли раствором бикарбоната натрия (50 мл), водой (50 мл) и сушили над безводным сульфатом магния. Выпаривание в вакууме приводило к получению целевого соединения (1,56 г) в виде желтого масла.
П р и м е р 23. Соединение 87.
Перемешиваемый раствор 3-циано-1-(2, 6-дихлор-4-трифторметилфенил)-4-три- фторметилтиопиразола (2,03 г) в сухом тетрагидрофуране (20 мл) обработали раствором диизобутил алюминий гидрида (10 мл) в 1,0М растворе толуола), который добавляли по каплям в атмосфере азота при -60-70оС в течение 10 мин. Раствору позволили нагреться до комнатной температуры в течение 3 ч и затем охладили до -10оС. После вливания в лед и 2 н. серную кислоту (100 мл) и перемешивания в течение 0,5 ч, смесь экстрагировали в дихлорметане (3х25 мл). Экстракт промыли водой (50 мл), сушили над безводным сульфатом магния, и выпаривали в вакууме с получением желтого масла (1,8 г). Очистка хроматографией с элюированием смесью дихлорметан/гексан (1:1) привело к получению 1-(2, 6-дихлор-4-три- фторметилфенил)-3-формил-4-трифторме- тилтиопиразола (1,5 г) в виде белого твердого вещества с температурой плавления 79-81оС.
П р и м е р 24. Соединение 88.
Раствор 5-амино-3-циано-1-(2, 6-дихлор-4-трифторметилфенил)-4-трифторметилтио- пиразола (2,0 г) в муравьиной кислоте (90% 50 мл) кипятили с обратным холодильником в течение 5 ч после добавления никеля Ренея (2,0 г). Отфильтрованную смесь разбавляли водой (250 мл) и экстрагировали дихлорметаном (4х50 мл). Экстракт промывали раствором бикарбоната натрия (2х50 мл), сушили над безводным сульфатом магния и выпаривали в вакууме с получением твердого вещества (1,0 г). Очистка хроматографией с элюированием дихлорметаном приводила к получению 5-амино-1-(2, 6-дихлор-4- трифторметилфенил)-3-формил-4-трифторметилтиопиразола (0,05 г) с температурой плавления 140-143оС в виде желтых кристаллов после перекристаллизации из смеси толуол/гексан.
П р и м е р 25. Соединение 89.
Смесь сухого сульфолана (15 мл) и молекулярного сита 4 А (3,0 г) перемешивали в атмосфере азота с фторидом цезия (2,4 г) при 60о С в течение 0,5 ч. К этой смеси добавили 5-бром-3-циано-1-(2,6-дихлор-4-трифторметилфенил)-4-трифторметансульфонилпир азола (2,0 г) и смесь перемешивали при 60оС в течение 2 ч и поддерживали при комнатной температуре в течение ночи. Эту смесь разбавили эфиром (50 мл), отфильтровывали и промывали водой (100 мл). Водный слой вновь экстрагировали эфиром (3х50 мл) и объединенный органический раствор вновь промывали водой (4х50 мл) сушили над безводным сульфатом магния, выпаривали в вакууме с получением масла. Очистка с помощью хроматографии с элюированием смесью эфир/гексан (1:4) привела к получению 3-циано-1-(2,6-дихлор-4-трифторметил- фенил)-5-фтор-4-трифторметансульфонил- пиразола (0,17 г) с температурой плавления 95-98оС в виде твердого вещества после перекристаллизации из гексана.
П р и м е р 26. Соединение 92.
Раствор пентафторэтил иодида (5,0 г) в сухом эфире (30 мл) перемешивали при -78оС, в то время как раствор фенилмагний бромида (0,02 моль) в сухом эфире (20 мл) и отдельный раствор 5-амино-3-циано-1-(2, 6-дихлор-4-трифторметилфенил)-4-тиоциана- топиразола (7-6 г) в сухом эфире (75 мл) добавили одновременно по каплям в течение 2,5 ч. Смеси позволяли достичь комнатной температуры и после дополнительных 0,5 ч обработали раствором соляной кислоты (2М, 15 мл) при 0оС. Эфирный слой сушили над безводным сульфатом магния, выпаривали в вакууме с получением коричневой смолы (8, 8 г). Очистка сухой колоночной флашхроматографией с элюированием смесью дихлорметан/петролейный эфир (1:1) проводили к получению 5-амино-3-иано-1-(2, 6-дихлор-4- трифторметилфенил)-4-пентафторэтилтиопиразола с темпера- турой плавления 134,5-136,5оС в виде желтого твердого вещества.
П р и м е р 27. Соединение 101.
К раствору 5-бром-3-циано-1-(2,6-дихлор-4-трифторметилфенил)-4- трифторметилсульфонилпиразола (1,5 г) в диоксане (20 мл) добавляли 1,1-диметилгидразин (0,62 г) и смесь нагревали до 60оС в течение 4,25 ч. После вливания в воду (20 мл) водный слой экстрагировали дихлорметаном (2х50 мл) и этот экстракт, соединеный с диоксановым слоем, промыли водой (1х50 мл), сушили над безводным сульфатом магния и выпаривали в вакууме с получением твердого вещества (1,4 г). Очистка хроматографией с элюированием дихлорметан/гексан (1: 1) приводила к получению 3-циано-1-(2, 6-дихлор-4-трифторметилфенил)-5-диметиламино-4-три- фторметилсульфонилпиразола с температурой 178-179оС в виде твердого белого вещества.
П р и м е р 28. Соединение 11, 1, 13 и интермедиат в справочном примере 4.
К перемешиваемому раствору 5-амино-3-циано-1-(2, 6-дихлор-4-трифторметилфе- нил)-пиразола (2,23 г) и пиридина (0,55 г) в хлороформе (50 мл) добавили по каплям при 0оС раствор трифторметилсульфенил хлорида (1,24 г) в хлороформе (15 мл) в течение 20 мин. Смесь перемешивали при 0оС в течение 3 ч и растворитель выпаривали в вакууме с получением желтого твердого вещества (3,1 г). Вещество очищали хроматографией на силикагеле (Merck, 230-400 меш (0,06-0,03 мм), 0,7 кг/см2 с элюированием дихлорметаном и петролейным эфиром с температурой кипения 40-60оС (3:1) с получением 5-амино-1-(2, 6-дихлор-4-трифторметилфенил)- 3-циано-4-трифторметилтиопиразола в виде твердого вещества (2,33 г) с температурой плавления 169,5-170,5оС.
С помощью вышеуказанной
методики,
но заменяя 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3-цианопиразол
следующими
фенилпиразолами был получен:
5-амино-3-бром-1-(2,
6-дихлор-4-три- фторметилфенил)-4-трифторметилтиопиразол в
виде бесцветного твердого вещества с температурой плавления 154,
5-156оС
из 5-амино-3-бромо-1-(2,
6-дихлор-4-трифторметилфенил/пиразола.
5-Амино-1-(2, 6-дихлор-4-трифторметил- фенил)-4-трифторметилтиопиразол-3-кар- боновой кислоты сложный эфир в виде твердого белого вещества с температурой плавления 213-215оС из 5-амино-1-(2, 6- дихлор-4-трифторметилфенил)-3-этоксикар- бонилпиразола.
5-Амино-1-(2,
6-дихлор-4-трифторметил- фенил)-3-этоксикарбонил- пиразол, используемый в вышеуказанном примере, был
приготовлен следующим образом:
раствор 3-циано-2-гидроксипроп-2-еновой кислоты
сложного
эфира натриевой соли (50,0 г) в холодной воде (500 мл) перемешивали и подкисляли до рН 1 холодной
разбавленной серной кислотой. Хлорид натрия (50 г) добавили и раствор экстрагировали
эфиром (2х20,0
мл). Этот экстракт промывали водой (50 мл), сушили (безводный сульфат магния) и выпаривали с
получением желтой жидкости (30,2 г). Жидкость растворили в этаноле (400 мл) и
перемешивали в то время,
как
быстро добавили 2,6-дихлор-4-тетрафторметилфенилгидразины (52,5 г). Затем раствор кипятили с
обратным холодильником в течение ночи, охлаждали и выпаривали в вакууме с
получением оранжевого
твердого
вещества. После перетирания с гексаном (300 мл), отфильтрованное твердое вещество
перекристаллизовывали из смеси толуол-гексан с активированным углем с получением
целевого соединения (43,4
г) с
температурой плавления 177-179оС в виде темно-желтых кристаллов.
Справочный пример 8. Раствор 2,6-дихлор-4-трифторметилфенилгидразина (10, 1 г) в тетрагидрофуране (50 мл) перемешивали при комнатной температуре и добавили карбонат калия (безводный 8,5 г). К этой смеси добавили по каплям при 0оС раствор 2-хлор-3- циано-3-(1-метил)-этилсульфонин-проп-2-еновой кислоты сложный эфир (11,0 г) в тетрагидрофуране (100 мл). После перемешивания в течение 2 ч смесь отфильтровывали и фильтрат выпаривали в вакууме с получением коричневого масла. После перетирания с гексаном (100 мл) это приводило к получению беловатого твердого вещества (11,7 г). После кипячения в этаноле и охлаждения был получен 5-амино-1- (2, 6-дихлор-4-трифторметилфенил-3-этоксикарбонил-4- (1-метил)- этилсульфонил пиразол (8,5 г) с температурой плавления 255,5-256,5оС в виде белых кристаллов.
Справочный пример 9. 2-Хлор-4-циано-3-(1-метил)этилсульфонилпроп-2-еновой кислоты сложный эфир, используемый выше, был получен следующим образом.
3-циано-2-гидрокси-2-(1-метил)-этилсу- льфонилпроп-2-еновой кислоты сложного эфира натриевую соль (10,7 г) добавили к перемешиваемому оксихлориду фосфора (28,5 г) при комнатной температуре. После 3 ч смесь нагревали при 50оС в течение 1 ч и затем выпаривали в вакууме. Остаток вновь выпаривали после добавления толуола с получением целевого соединения в виде коричневого масла.
3-Циано-2-гидрокси-3-(1-метил)-этилсу- льфонилпроп-2-еновой кислоты сложного эфира натриевая соль была получена следующим образом:
раствор этоксида натрия,
полученный из натрия
(4,
0 г) и этанола (80 мл), обработали пропан-2-сульфонилацетонитрилом (24,5 г) при перемешивании. После завершения растворения добавили этилоксалат (24,8 г) по каплям в течение
10 мин с получением
тяжелого осадка. После кипячения с обратным холодильником в течение 1 ч желтое твердое вещество отфильтровывали, промывали гексаном и сушили в вакуумном эксикаторе (41,3 г). Это
было целевое
соединение с температурой плавления 195-197,5оС.
П р и м е р 29. Соединения 59 и 52 и Интермедиат для 52.
С помощью способа, который описан
ниже, но
заменяя 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-метилтио-3-три- фторметилпиразол следующими фенилпиразолами было получено:
5-амино-1-(2,
6-дихлор-4-трифторметилфенил)-3-этоксикарбонил-4- трифторметилсульфинилпиразол в виде беловатого твердого вещества с температурой плавления 210-214оС из 5-амино-1-(2,
6-дихлор-4- трифторметилфенил)-3-этоксикарбонил-4-три- фторметилтиопиразола.
5-Амино-1-(2,6-дихлор-4-трифторметил- фенил)-3-бром-4-трифторметилсульфилин- пиразол в виде белого твердого вещества с температурой плавления 179-180оС из 5-амино-1-(2,6-дихлор-4-трифторметилфенил)- 3-бром-4-трифторметил- тиопиразола.
5-Амино-1-(2, 6-дихлор-4-трифторметил- фенил)-3-циано-4-трифторметилсульфинилпиразол в виде белого вещества с температурой плавления 203-203,5оС из 5-амино-1-(2, 6-дихлор-4-трифторметилфенил)-3- циано-4-трифторметилтиопиразола.
Перемешиваемый раствор 5-амино-1-(2,6-дихлор-4-трифторметил-фенил)-4-ме- тилтио-3-трифторметилпиразола (1,0 г) в хлороформе (40 мл) обработали мета-хлорпербензойной кислотой (0,42 г), которую внесли порциями при комнатной температуре. После перемешивания в течение 6 ч раствор разбавили хлорметаном и промыли последовательно раствором сульфита натрия, раствором гидроокиси натрия и водой. Раствор сушили над безводным сульфатом магния и выпаривали в вакууме с получением желтого масла. Очистка хроматографией на силикагеле 230-400 меш (0,06-0,03 мм) 0,7 кг/см2 с элюированием смесью дихлорметан/этилацетат(4: 1) привела к получению 5-амино-1-(2, 6-дихлор-4-трифторметилфенил)- 4-метил- сульфонил-3-трифторметилпиразола в виде белого вещества с температурой плавления 142-145оС с разложением.
Справочный пример 10.
5-Кабамоил-4-циано-1-(2,6-дихлор-4- трифторметилфенил)-3-трифторметилпира- зол (3,57 г) нагревали до 200оС с пятиокисью фосфора (2,82 г) при перемешивании. После 3 ч охлажденный продукт обработали льдом и экстрагировали дихлорметаном (3х50 мл). Органический раствор промыли водой, сушили над безводным сульфатом магния и выпаривали в вакууме с получением твердого вещества. Перекристаллизация из гексана привела к получению 1-(2,6-дихлор-4-трифторметилфенил)-4,5- дициано-3-трифторметил пиразола в виде белых кристалов (1,8 г) с температурой плавления 80оС.
С помощью аналогичной методики, которая описана выше, но заменяя 5-карбамоил-4-циано-1-(2,6-дихлор-4-трифторметил- фенил)-3-трифторметилпиразол на
5-амино-3-карбамоил-12-(2,
6-дихлор-4-трифторме- тил-фенил)-4- метансульфонилпиразол, было получено:
5-амино-3-циано-1-(2,6-дихлор-4-три- фторметилфенил)-4-метан- сульфонилпиразол в виде
белого вещества с температурой
плавления 214оС.
Справочный пример 11.
5-карбамоил-4-циано-1-(2,6-дихлор-4- трифторметилфенил)-3-трифторметилпира- зол, используемый в вышеуказанном справочном примере 10, был получен следующим образом: 5-карбокси-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол (6,0 г) добавили к тионилхлориду (30 мл) и перемешиваемый раствор кипятили с обратным холодильником в течение 4 ч. Растворитель выпаривали в вакууме и повторили выпаривание после добавления сухого толуола (30 мл). Полученное масло растворили в сухом эфире (20 мл) и добавляли по каплям к перемешиваемому раствору аммиака (0,88 г), 20 мл, охлаждаемому ледяной баней. После перемешивания в течение ночи добавили воду (150 мл) и смесь экстрагировали дихлорметаном (3х50 мл). Объединенный экстракт промыли водой, сушили над безводным сульфатом магния и выпаривали в вакууме с получением твердого вещества (7,0 г). Перекристаллизация из смеси этилацетата и петролейного эфира привела к получению целевого соединения (4,3 г) в виде кристаллов с температурой плавления 180-181оС.
5-Амино-3-карбамоил-1-(2, 6-дихлор-4-трифторметилфенил)-4- метансульфонилпиразол, используемый в вышеуказанном справочном примере 10, был получен по аналогичной методике, но заменяя 5-карбокси-4-циано-1-(2, 6-дихлор-4-трифторме- тилфенил)-3-трифторметилпиразол на 5-амино-3-карбокси-1-(2,6-дихлор-4-трифтор- метилфенил)-4-метансульфонилпиразол. Целевое соединение было получено в виде беловатого твердого вещества с температурой плавления 223-224оС.
5-Амино-3-карбокси-1-(2,6-дихлор-4- трифторметилфенил)-4-метансульфонилпи- разол, используемый
выше,
был получен следующим
образом:
5-амино-1-(2,6-дихлор-4-трифторметил- фенил)-3-этоксикарбонил-4-метансульфо- нилпиразол (8,15 г), справочный пример 3, добавили к перемешиваемому 80%
-ному
раствору серной кислоты
(80 мл) и нагревали при 100оС в течение 5 ч. После охлаждения раствор влили в лед, твердое вещество отфильтровывали и сушили над пятиокисью фосфора в
вакуумном
эксикаторе.
Перекристаллизация из смеси метанола и петролейного эфира привела к получению целевого соединения в виде белого твердого вещества с температурой плавления 203-205о
С.
Реферат
Использование: в сельском хозяйстве, в частности в качестве пестицидов.
Сущность
изобретения: продукт - производные N-фенилпиразола ф-лы
I:

Формула

где R1 - циано- или нитрогруппа;
R2 - группа R5SO2, R5SO или R5S, где R5 - нормальная или разветвленная алкильная, алкенильная или алкинильная группа, содержащую до 4 атомов углерода, которые могут быть незамещенными или замещенными одним или более атомами галогена, которые могут быть одинаковыми или различными;
R3 - водород, галоген или группа NR6R7, где R6 и R7, одинаковые или различные, - водород, нормальная или разветвленная алкильная группа, алкинилалкильная группа, содержащая до 5 атомов углерода, алканоильная группа, содержащую 2 - 5 атомов углерода, алкоксикарбонильная группа, содержащую 2 - 5 атомов углерода, или нормальная или разветвленная алкоксиметиленамино-группа, содержащая 2 - 5 атомов углерода, которая может быть незамещенной или замещенной на метилене нормальной или разветвленной алкильной группой, содержащей 1 - 4 атомов углерода;
R4 - фенильная группа, замещенная во втором положении атомом галогена, в 4-м положении нормальной или разветвленной алкильной группой или С1 - С4-алкоксигруппой, которая может быть незамещенной или замещенной одним или более атомами галогена или атомами хлора или брома и возможно в 6-м положении атомами галогена за исключением соединения, где R1 - цианогруппа, R2 - метансульфонильная группа, R3 - аминогруппа, R4 - 2, 6-дихлор-4-трифторметилфенильная группа.

Комментарии