Способ получения n-фенилпиразолов - RU2035452C1
Код документа: RU2035452C1
Чертежи







Описание
Изобретение относится к способу получения новых N-фенилпиразолов, обладающих ценными антипаразитарными свойствами в отношении членистоногих, растительных нематод и червеобразных паразитов.
Известны эксперименты по получению 4,
6-диаминопиразоло[3,
4-d]пиримидинов, которые согласно их предположениям должны были
обладать полезными фармакологическими свойствами. В качестве исходных соединений использовали
5-амино-4-цианопиразолы, содержащие в
положении 1 атом водорода, метильную группу, гидроксиэтильную группу
или фенильную группу, замещенную одним или более атомами хлора и/или метильными группами,
а в положении 3 атом водорода,
метильную
группу, фенильную или бензильную группу [1]
Однако такие
пиразольные соединения не обеспечивают получения полезных терапевтических
(антималярийных)
4,6-диаминопиразоло[3,
4-d]пиримидинов.
Известны некоторые 5-амино-1-фенилпиразолы, которые
являются ценными веществами в отношении улучшения воспалительных состояний
у теплокровных
животных: такие
соединения содержат в
положении 3 атом водорода или низшую алкильную группу, а в положении
4-карбамоильную или цианогруппу [2]
Известны 4-нитропиразолы,
которые оказались
полезными
веществами в отношении индукции
сбрасывания фруктов с фруктовых растений [3]
Известна
широкая группа 1,4-дизамещенных-3-нитропиразолов, как веществ, обладающих
антимикробиальными,
паразицидными и гербицидными свойствами:
указывается, что высокая биологическая активность соединений
ограничена 3-нитропиразолами, причем отличительным признаком таких
соединений является
3-нитропиразольные ядра [4]
Известен
способ получения 4-тиоцианотопиразоловых соединений, которые
являются ценными бактерицидными препаратами [5]
Известны
некоторые
пиразолсульфонамиды, обладающие антитромбогенными свойствами
[6]
Ни в одной из предыдущих публикаций не описывалось
и не предполагалось, что соединения общей формулы I обладают
или могут
обладать активностью в отношении членистоногих, червей или
растительных нематод.
Целью изобретения является разработка способа получения N-фенилпиразолов, обладающих антипаразитарными свойствами.
Поставленная цель достигается
способом получения N-фенилпиразолов общей формулы I
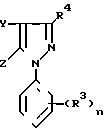
Способ заключается в том, что
соединение общей
формулы II
NH2NH
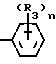




Испытательный пример 1. Производили одно или более разбавлений соединений, подлежащих испытанию, в 50%-ном водном растворе ацетона.
а). Испытуемые разновидности: Pluttela xylostella (моль капустная) и Phacdon cochleariae (горчичный жучок).
Диски листьев репы помещали на агар, находящийся в чашах Петри, и инфицировали 10 личинками (во второй возрастной стадии для Plutella и в 3-й возрастной стадии для Phaedon. В каждом испытании применяли по четыре дублирующих чаши и их опрыскивали из колонки Поттера соответствующим испытательным разбавлением. Через четыре или пять дней после обработки чаши удаляли из помещения с постоянной температурой (25oC), в которой их выдерживали, и определяли средний процент смертности личинок. Полученные данные корректировали с учетом смертности в чашах обработанных 50%-ным водным раствором ацетона, который служил контрольным веществом.
б) Megoura viciae (гороховая тля).
Посаженные в горшки бобовые растения, предварительно инфицированные Megoura, на смешанных стадиях развития опрыскивали до стекания с помощью лабораторного вращающегося опрыскивателя. Обработанные растения выдерживали в теплице в течение 2 дней и оценивали смертность тли с использованием счетной системы, учитывающей сравнительный результат полученный на растениях, обработанных 50%-ным водным раствором ацетона, в качестве контрольного соединения.
Оценка
3 все тли погибли;
2
несколько
экземпляров осталось
в живых;
1 большая часть осталась в живых;
0
существенной смертности не наблюдается
В
соответствии с описанным способом (а) применение
следующих
соединений в концентрации
500 ч/млн. оказалось полностью эффективным против личинок
Plutella xylostella обеспечивая 100% смертность.
Соединения 5, 6, 7, 8, 20, 21, 22, 28, 30, 31, 32, 35, 36, 37, 38, 39, 41, 42, 43, 44, 68, 69, 70, 71, 72, 73, 76, 79, 80, 81, 85, 87, 94, 99, 102, 103, 104, 105, 106, 108, 111, 120, 121.
Согласно описанному способу (а) применение следующих соединений в количестве 5 ч/млн, оказалось полностью эффективным против личиной Phaedon cochleariae, обеспечивая 100% смертность.
Соединения 36, 53, 57, 58, 70, 71, 74, 79, 80, 85, 90, 91, 97, 98, 99, 102, 104, 106, 108, 109, 111, 112, 116, 118, 120, 121.
Применение 50 ч/млн. cледующих ниже соединений согласно способу (а) оказалось полностью эффективным против Megeura viciae, обеспечивая 100% смертность, т.е. была получена оценка 12 для 4 повторных экспериментов.
Соединения 4, 5, 20, 21, 36, 48, 53, 57, 58, 82, 83, 92, 93, 98, 102, 106, 109, 111, 116, 117, 118, 120.
Данные, представленные в табл. 1-3, суммируют результаты ряда различных экспериментов, осуществленных в примере а и б.
Испытательный пример 2. Двадцать личинок Phipicephalus appendiculatus помещали в пластмассовые капсулы, которые присоединяли к обритому боку морских свинок. Через 3 ч, а затем через 23-часовые интервалы морским свинцам производили 4 подкожные инъекции испытуемого соединения. Примерно через 100 ч после инфицирования морских свинок умертвляли, отделяли напитанные кровью личинки клеща, подсчитывали их число и выдерживали при 23oC во влажной камере в течение 14-21 дней. После окончания этого периода оценивали процент выживаемости в результате линьки. Полученные результаты приведены в табл.4.
Испытательный пример 3. Высокая активность соединений общей формулы I против тараканов вида Periplaneta americana демонстрируется результатами следующего эксперимента.
Ацетоновый раствор испытуемого соединения в количестве 0, 2 мкл инъецировали через мягкую кожицу между лапой и грудной клеткой десяти насекомых, в результате чего обеспечивалась доза порядка 5 мкг на 1 г массы тела насекомого. Для контроля десяти тараканам производили аналогичную инъекцию 0,2 мкл одного ацетона. После обработки насекомых помещали в пластмассовые боксы с соответствующей пищей. Через пять дней после обработки подсчитывали число погибших и выживших насекомых и рассчитывали процент смертности.
В соответствии с указанным способом, доза в 5 мкг на 1 г массы тела насекомого следующих соединений оказалась полностью эффективной против тараканов вида Periplaneta americana обеспечивая 100% смертность.
Соединения 2, 5, 14, 17, 22, 53.
Примеры иллюстрируют композиции для использования против членистоногих, растительных нематод или червеобразных паразитов, которые включают в качестве активного ингредиента, соединения общей формулы I.
П р и м е р А. Порошок для напыления может быть получен однородным смешением 5-амино-4-циано-1-(2, 6-дихлор-4-трифторметил)-3-триформетилпиразола 1-10 мас. и тонкоразмолотого талька до 100 мас.
Этот порошок может быть применен к очагу заражения членистоногими, например к мусорным свалкам или кучам, местам хранения продуктов или хозяйственных товаров или к зараженным животным или к животным при риске заразиться членистоногими для контроля членистоногих при глотании. Подходящими устройствами для распределения порошка для напыления к очагу заражения членистоногими являются механическая воздуходувка, приспособления для обработки ручного инвентаря и домашних животных. 5-амино-4-циан-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол может быть, при необходимости, заменен в указанном порошке на любое другое соединение формулы I.
П р и м е р В. Съедобная приманка может быть приготовлена однородным смешением 5-амино-4-циан-1-(2, 6-дихлор -4-трифторметилфенил)-3-трифторметилпиразола 0,1-1,0 мас. пшеничной муки 80 мас. и мелассы до 100 мас.
Съедобная приманка может быть применена к очагу заражения, например к домашним или промышленным помещениям, то есть на кухнях, в госпиталях, складах или открытых площадках, зараженных членистоногими, например муравьями, саранчей, тараканами и мухами, для контроля членистоногих при оральном попадании.
5-амино-4-циан-1-(2, 6-дихлор-4-трифтор- метилфенил)-3-трифторметилпиразол может быть, при необходимости, заменен в указанной съедобной приманке на любое другое соединение общей формулы I.
П р и м е р С. Может быть приготовлен раствор, содержащий 5-амино-4-циан-1-(2,6-дихлор-4-трифторметилфенил)-3- трифторметилпиразол 15 мас./об. и диметилсульфоксид до 100% по объему, путем растворения производной пиразола в части диметилсульфоксида и затем добавления диметилсульфоксида до необходимого объема. Раствор может быть применен к домашним животным, зараженным членистоногими, путем непосредственного распределения на кожу или после стерилизации фильтрованием через политетрафторэтиленовую мембрану (0,22 микрона размер пор) парентеральной инъекцией при дозах от 1,2 до 12 мл раствора на 100 кг живой массы животного. 5-амино-4-циан-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол может быть, при необходимости, заменен в указанном растворе таким же количеством любого другого соединения общей формулы I.
П р и м е р D. Смачиваемый порошок может быть получен из 5-амино-4-циан-1-(2, 6-дихлор-4-трифторметилфенил)-3- трифторметилпиразола 50 мас. Ethylan ВСР (конденсат нонилфенол)этиленоксид, содержащий 9 моль этиленоксида на моль фенола) 5 вес. аэросила (тонкодисперсная двуокись кремния) 5 мас. и цеолита РF (носитель в виде синтетического силиката магния) 40 мас. путем адсорбции Ethylan ВСР на аэросил, смешения с другими ингредиентами и измельчения смеси в молотковой дробилке с получением смачиваемого порошка, который может быть разбавлен водой до концентрации 0,001 2 мас./объем соединения пиразола и применен к очагу заражения членистоногими, например к личинкам двукрылых или нематодам растений, путем разбрызгивания или к домашним животным, зараженным или при риске заражения членистоногими путем разбрызгивания или смачивания, или при оральном применении в виде питьевой воды, для контроля за членистоногими или гельминтами. 5-амино-4-циан-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол может быть при необходимости заменен в указанном порошке любым другим соединением общей формулы I.
П р и м е р Е. Пилюля с медленным выделением может быть получена из гранул, содержащих уплотняющий агент, связующее, агент медленного выделения и 5-амино-4-циан-1-(2, 6-дихлор-4- трифторметилфенил)-3-трифторметилпиразольное соединение при варьируемом процентном содержании композиций. Пилюли могут быть получены путем сжатия смеси с получением пилюли удельного веса 2 или более и пилюли могут быть применены орально для жвачных домашних животных для задержки в желудке с обеспечением непрерывного медленного выделения пиразольного соединения в течение длительного периода времени для контроля заражения жвачных домашних животных членистоногими или гельминтами. 5-амино-4-циан-1-(2, 6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол может быть, при необходимости, заменен в указанных пилюлях на любое другое соединение общей формулы I.
П р и м е р F. Композиция с медленным выделением может быть получена из 5-амино-4-циан-1-(2, 6-дихлор -4-трифторметилфенил) -3-трифторметилпиразола 0,5-25 мас. и поливинилхлоридной основы до 100 мас. путем смешивания поливинилхлоридной основы с пиразольным соединением и подходящим пластификатором, например диоктилфталатом, и экструдированием из расплава или горячей отливкой гомогенных композиций в подходящие формы, например гранулы, шарики, брикеты или ленты, подходящие для добавления к стоячей воде или, в случае лент, изготовления колец или повязок для применения к домашним животным для контроля паразитов путем медленного выделения пиразольного соединения.
Соединения общей формулы I могут быть получены с помощью применения или адаптации известных методов образования гетероциклов, обеспечивая, где необходимо, замену заместителей при защите/снятии защиты с других заместителей.
Согласно следующей цели изобретения, предлагаются промежуточные соединения для получения некоторых соединений общей формулы I, то есть соединений, для которых в их альтернативных значениях Y означает атом водорода, формильную группу или карбоксигруппу, алканоильную группу с нормальной или разветвленной цепью, содержащей 2-6 атомов углерода, которая замещена одним или более атомами галогенов, дитио-группу, которая соединяет два пиразольных кольца), амино-группу -SO2Cl группу, карбоксиалкильную группу с нормальной или разветвленной цепью, содержащей от 2 до 6 атомов углерода, Z означает карбамоильную группу или алкоксикарбонильную группу с нормальной или разветвленной цепью, содержащей от 2 до 7 атомов углерода или дифеноксикарбониламино группу, (R3)n замещение является предпочтительной комбинацией, данной ранее в спецификации или R4 представляет собой аминогруппу, оксиметильную группу, карбоксигруппу или карбамоильную группу, или алкоксикарбонильную группу с нормальной или разветвленной цепью, или алкоксикарбониламино группу, содержащую от 2 до 7 атомов углерода.
Примеры и ссылочные примеры иллюстрируют получение соединений общей формулы I согласно изобретению.
П р и м е р 1. Соединение 1.
Смесь 2,4, 6-трихлорфенилгидразина (21, 1 г) и тетрацианоэтилена (13,3 г) в этаноле (100 мл) нагревалась с обратным холодильником в течение 15 мин. Реакционная смесь охлаждалась, и твердый осадок отфильтровывался и промывался диэтиловым эфиром, давая 5-амино-3,4-дициано-1-(2,4,6-трихлорфенил)пиразол (13 г) в виде окрашенного в темно-желтый цвет твердого вещества, т.пл. 267-271o C.
П р и м е р 2. Соединения 2 и 3.
Тетрацианоэтилен (1,9 г) и 2,6-дихлор-4-трифторметилфенилгидразин (3,7 г) добавлялись к перемешиваемому магнитному раствору ацетата натрия (0,6 г) в ледяной уксусной кислоте (15 мл) при температуре лаборатории. После перемешивания в течение 15 мин из раствора выпадало в осадок бесцветное твердое вещество, перемешивание продолжалось в течение ночи, смесь затем фильтровалась. Полученное твердое вещество промывалось последовательно уксусной кислотой, водой, водным раствором бикарбоната натрия и водой, давая 5-амино-1-(2,6-дихлор-4-трифторметилфенил) -3, 4-дицианопиразол (2,5 г) в виде бежевых кристаллов, т.пл. 221-222oC.
При проведении процесса аналогичным образом, но при замене 2,6-дихлор-4-трифторметилфенилгидразина 2,3, 5, 6-тетрахлорфенилгидразином получался 5-амино-3,4- дициано-1-(2,3,5,6-тетрахлорфенил)пиразол, т. пл. выше 330oC, в виде окрашенного в темно-желтый цвет порошка.
Ссылочный пример 1. Фенилгидразины, используемые в качестве исходных материалов в примерах 1,2 и 11, приготавливались следующим образом.
2, 6-Дихлор-4-трифторметилфениланилин (4,3 г) растворялся при перемешивании в ледяной уксусной кислоте (23 мл). Затем добавлялся раствор нитрита натрия (1,5 г) в концентрированной серной кислоте (11 мл) при 55-60oC. Раствор, полученный таким образом, охлаждался до 0-5oC, и при энергичном перемешивании добавлялся раствор хлористого олова (2) (16,4 г) в концентрированной соляной кислоте (14 мл). Выпадало в осадок твердое вещество, окрашенное в кремовый цвет. Смесь фильтровалась, полученное твердое вещество добалялось к смеси водного раствора аммиака и льда. Полученная таким образом смесь экстрагировалась диэтиловым эфиром (6х500 мл), и объединенные эфирные экстракты сушились над сульфатом натрия, фильтровались и упаривались досуха, давая 2, 6-дихлор-4-трифторметилфенилгидразин (3,7 г), т.пл. 54-56oC, в форме бесцветного кристаллического твердого вещества.
При проведении процесса аналогичным образом, но при замене 2,6-дихлор-4-трифторметиланилина указанным анилином получали 2-хлор-4-трифторметилфенилгидразин, т. пл. 38-39oC, в виде бесцветного твердого вещества из 2-хлор-4-трифторметиланилина.
П р и м е р 3. Соединение 4.
Этоксиэтиленмалононитрил (44,5 г) и 2,6-дихлор-4-трифторметилфенилгидразин (80,0 г) добавлялись к перемешиваемому раствору ацетата натрия (13,4 г) в ледяной уксусной кислоте (110 мл) при комнатной температуре. Получалась густая суспензия, которая перемешивалась в течение ночи, после чего образовывался темный раствор. Растворитель упаривался в вакууме, и остаток разбавлялся водным раствором бикарбоната натрия (100 мл) и экстрагировался дихлорметаном (3 x 100 мл), объединенные экстракты промывались раствором бикарбоната натрия (50 мл), затем водой (100 мл), сушились над безводным сульфатом магния и упаривались в вакууме, давая темный сироп. Данное вещество нагревалось с обратным холодильником с 2-этоксиэтанолом (200 мл) в течение 1 ч, а затем упаривались в вакууме, давая темное масло. Масло растворялось в дихлорметане, промывалось раствором бикарбоната натрия (50 мл), затем водой (100 мл), сушилось над безводным сульфатом магния, обрабатывалось активированным углем и упаривалось в вакууме, давая черное твердое вещество. Твердое вещество перекристаллизовывалось два раза из смеси толуола и петролейного эфира (т. кип. 60-80oC), давая 5-амино-4-циано-1-(2, 6-дихлор-4- трифторметилфенил)-3-метилпиразол (49,3 г), т. пл. 194-196oC, в виде бледно-коричневых кристаллов.
П р и м е р 4. Соединения 5, 22, 24 и 36.
К перемешиваемому механическим путем раствору 2, 6-дихлор-4-трифторметилфенилгидразина (180,3 г) в сухом диэтиловом эфире (700 мл) добавлялся безводный карбонат калия (112 г), смесь охлаждалась до 0oC. К данной смеси добавлялся по каплям в течение получаса раствор 2-хлор-1,1-дициано-2-трифторметилэтилена (132,1 г) в сухом диэтиловом эфире (350 мл). В конце реакции ледяная баня удалялась, и смесь оставлялась на ночь, а затем выливалась в воду (2000 мл). Эфирный слой отделялся, а водный раствор экстрагировался диэтиловым эфиром (2х300 мл). Объединенные экстракты сушились над безводным сульфатом магния, фильтровались и упаривались в вакууме, давая твердое вещество темно-желтого цвета (350 г).
Перекристаллизация из смеси толуола и гексана дала белые кристаллы (169,5 г), т. пл. 202-204oC, 5-амино-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3- трифторметилпиразола.
Поступая аналогичным образом, но заменяя 2-хлор-1, 1-дициано-2- трифторметилэтилен 2-хлор-1-циано-1-метансульфонил-2- трифторметилэтиленом, получали 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-метансульфонил-3-трифторметилпи разов виде кристаллов темно-зеленого цвета, т.пл. 215-218oC, из смеси толуол-гексан.
При проведении процесса аналогичным образом, но при замене 2-хлор-1,1-дициано-2-трифторметилэтилена 2-хлор-1-циано-1-метоксикарбонил-2-трифторметилэтиленом, получался 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-метоксикарбонил-3-трифторметилп иразв виде желтовато-коричневых кристаллов, т. пл. 114-115oC, из гексана.
При проведении процесса аналогичным образом, но при замене 2,6-дихлор-4-трифторметилфенилгидразина 2,6-дихлор-4- трифторметоксифенилгидразином получался 5-амино-4-циано-1-(2,6-дихлор-4-трифторметоксифенил)-3-трифторметилпиразол в виде белых кристаллов, т.пл. 160-160,5oC, из смеси толуола и гексана.
П р и м е р 5. Соединения 19, 20, 21 и 47.
Безводный ацетат натрия (0,246 г) добавлялся к перемешиваемому раствору 2-хлор-1,1-дициано-2-пентафторэтилэтилена (1,38 г) в уксусной кислоте (5 мл). К данной смеси добавлялся 2,6-дихлор-4-трифторметилфенилгидразин (1,47 г) в течение 5 мин. После перемешивания в течение ночи смесь нейтрализовалась раствором бикарбоната натрия и экстрагировалась дихлорметаном (2 x 50 мл). Объединенные экстракты промывались водой, сушились над безводным сульфатом магния, фильтровались и упаривались в вакууме, давая твердое вещество цвета бычьей кожи (2,1 г). Данное вещество нагревалось с обратным холодильником с 2-этоксиэтанолом (10 мл) в течение 1 ч и упаривалось в вакууме, давая коричневое масло (2,2 г). Данное масло хроматографировалось на кремнеземе (Мерк, 230-400 меш, 0,7 кг см-2) c использованием смеси дихлорметана и этилацетата (98: 2), давая желтое твердое вещество. Перекристаллизация из смеси дихлорметана и петролейного эфира дала 5-амино-4-циано-1-(2,6-дихлор-4-трифторметил- фенил)-3-пентафторэтилпиразол в виде белых кристаллов, т.пл. 160-162oC.
При проведении реакции аналогичным образом, но при замене 2-хлор-1,1-дициано-2-пентафторэтилэтилена 2-хлор-1,1-дициано-2-хлордифторметилэтиленом получался: 5-амино-3-хлордифторметил-1-(2, 6-дихлор-4-трифторметилфенил)-4-цианопиразол в виде белых призм, т.пл. 192oC, из смеси толуола и гексана.
При работе аналогичным образом, но при замене 2-хлор-1, 1-дициано-2-пентафторэтилэтилена 2-хлор-1, 1-дициано-2-дифторметилэтиленом получался 5-амино-1-(2,6-дихлор-4- трифторметилфенил)-4-циано-3-дифторметилпиразол в виде бесцветного твердого вещества, т.пл. 184,5oC (из смеси толуол/петролейный эфир).
При работе аналогичным образом, но при замене 2-хлор-1,1-дициано-2-пентафторэтилена 2-хлор-1, 1-дициано-2-гептафторпропилэтиленом получался 5-амино-1-(2, 6-дихлор-4- трифторметилфенил)-4-циано-3- гептафторпропилпиразол в виде бесцветных призм, т.пл. 139-140oC (из толуолпетролейного эфира).
Ссылочный пример 2. Хлордицианоэтилены, используемые в качестве исходных веществ в приведенных примерах; приготавливались следующим образом: суспензия натриевой соли 2-циано-3-окси- 4-хлор-4,4-дифторобут-2-еннитрила (18, 56 г) в дихлорметане (69 мл) перемешивалась при комнатной температуре и обрабатывалась пентахлоридом фосфора (19,27 г). Смесь нагревалась с обратным холодильником в течение 6 ч, охлаждалась и фильтровалась, и фильтрат отгонялся. Применение фракционирующей колонки Widmera давало 2-хлор-1,1-дициано-2-хлордифторметилэтилен в виде жидкости, т.пл. 88oC (44 мм рт.ст.) (71 г).
При проведении процесса аналогичным образом, но при замене натриевой соли 2-циано-3-гидрокси-4-хлор-4,4-дифторбут -2-еннитрила натриевой солью 2-циано-3-гидро- кси-4,4-дифторбут-2-еннитрила получали 2-хлор-1,1-дициано-2-дифторметилэтилен в виде жидкости, т.пл. 94оС (46 мм рт.ст.).
Заменяя натриевую соль 2-циано-3-гидрокси-4-хлор-4,4-дифторбут-2- еннитрила натриевой солью 3-гидрокси-2-метансульфонил-4,4,4- трифторбут-2-еннитрила и проводя процесс аналогичным образом, получали 2-хлор-1-циано-1-метансульфонил-2-трифторметилэтилен в виде светло-коричневой жидкости.
Заменяя натриевую соль 2-циано-3-гидрокси-4-хлор-4,4- дифторбут-2-еннитрила натриевой солью 3-гидрокси-2-метоксикарбо- нил-4,4,4-трифторбут-2-еннитрила и проводя процесс аналогичным образом, приготавливали 2-хлор-1-циано-1-метоксикарбонил-2-трифторметилэтилен в виде бесцветного масла, т.пл. 86-92oC при 23-25 мм рт.ст.
Заменяя натриевую соль 2-циано-3-гидрокси-4-хлор-4,4-дифторбут-2-еннитрила натриевой солью 2-циано-3-гидрокси-4,4,5, 5,6,6, 6-гептафторгекс-2-еннитрила и при работе аналогичным образом, получали 2-хлор-1, 1-дициано-2-гептафторпропилэти- лен в виде светло-желтой жидкости, т.пл. 110oC при 60 мм рт.ст.
Ссылочный пример 3. Натриевые соли, используемые в приведенных ссылочных примерах в качестве исходных материалов, приготавливались следующим образом.
К раствору метилата натрия (5,61 г) в безводном метаноле (70 мл) добавлялся малононитрил (6,85 г), желтый раствор обрабатывался хлордифторацетатом (15 г). Смесь нагревалась с обратным холодильником в течение 4 ч, растворитель упаривался в вакууме и вторичное упаривание после добавления толуола давало натриевую соль 2-циано-3-гидрокси-4-хлор-4,4-дифторбут-2-еннитрила в виде коричневого твердого вещества (18, 9 г). Оно высушивалось в вакуумном эксикаторе.
При проведении процесса аналогичным образом, но заменяя метил хлордифторацетат этилдифторацетатом, получали натриевую соль 2-циано-3-гидрокси-4,4- дифторбут-2-еннитрила в виде светло-коричневого твердого вещества.
При работе аналогичным образом, но заменяя метилхлордифторацетат метилтрифторацетатом и малононитрил метансульфонилацетонитрилом, получали натриевую соль 3-гидрокси-2-метансульфонил-4,4, 4- трифторбут-2-еннитрила в виде коричневого твердого вещества.
Осуществляя процесс аналогичным образом, но заменяя метилхлордифторацетат метилтрифторацетатом и малононитрилметилцианоацетатом получали натриевую соль 3-гидрокси-2-метоксикарбонил-4,4, 4-трифторбут-2-еннитрила в виде твердого вещества цвета бычьей кожи.
При проведении процесса аналогичным образом, но при замене метилхлордифторацетата метилгептафторбутиратом, получали натриевую соль 2-циано-3-гидрокси-4,4,5,5,6,6,6-гептафторгекс -2-еннитрила в виде светло-коричневого гигроскопического твердого вещества.
П р и м е р 6. Соединение 23.
К перемешиваемой 80% серной кислоте (22 мл) добавлялся 5-амино-4-циано-1-(2, 6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол (3,98 г) при 80oC. Через 1 ч охлажденный раствор выливался на лед и экстрагировался дихлорметаном (3). Объединенные экстракты промывались водой, сушились над безводным сульфатом магния, фильтровались и упаривались в вакууме, давая белое твердое вещество. Данное твердое вещество перекристаллизовывалось из смеси этилацетата и петролейного эфира, давая 5-амино-4-карбамоил-4-карбамоил-1-(2, 6-дихлор-4-трифторметилфенил)-3- трифторметилпиразол (3,5 г), т. пл. 169-171oC в виде белых кристаллов.
П р и м е р 7. Соединения 6, 7 и 8.
3, 5-Диамино-4-циано-1-(2,6-дихлор-4- трифторметилфенил)пиразол (3,9 г; полученный, как описано ниже) растворялся при перемешивании в ледяной уксусной кислоте (60 мл) при 15oC. Затем на протяжении 5 мин добавлялся раствор нитрита натрия (0,88 г) в концентрированной серной кислоте (5,85 мл) при поддержании 15oC. После дополнительного 15-минутного нахождения при данной температуре раствор темно-красного масла выливался в течение 1 мин в перемешиваемый раствор хлористой меди (I) (2,32 г) в концентрированной соляной кислоте (36 мл). После 15-минутного нахождения при комнатной температуре, в течение которого выделение азота полностью прекращалось, реакционная смесь выливалась на избыток льда и воды и экстрагировалась дихлорметаном (3 x 50 мл). Объединенные экстракты промывались водой (2 x 50 мл), затем раствором бикарбоната натрия (50 мл), сушились над безводным сульфатом магния и упаривались в вакууме, давая коричневое полутвердое вещество (4,1 г).
Хроматография на кремнеземе (Мерк, 230-400 меш, 0,7 кг cм-2) c использованием смеси дихлорметана и этилацетата (98:2) в качестве элюента дала после упаривания элюата и перекристаллизации остатка из смеси дихлорметана и петролейного эфира (т.кип. 60-80oC) 5-амино-3-хлор-4-циано-1-(2, 6-дихлор-4-трифторметилфенил)пиразол (0,95 г), т.пл. 189-191oC, в виде белых кристаллов.
При проведении процесса аналогичным образом, но при замене хлористой меди и концентрированной соляной кислоты бромистой медью и 48 мас./объем бромистоводородной кислотой получили 5-амино-3- бром-4-циано-1-(2,6-дихлор-4-трифторметилфенил/пиразол, т.пл. 182-183oC, в виде белых кристаллов.
При замене хлористой меди и концентрированной соляной кислоты раствором иодистого калия в воде получали 5-амино-3-иод-4-циано- 1-(2, 6-дихлор-4-трифторметилфенил/пиразол, т.пл. 208-210oC, в форме белых кристаллов.
Ссылочный пример 4. Суспензия 2,6-дихлор-4-трифторметилфенилгидразина (14,7 г) в воде (40 мл) перемешивалась с концентрированной соляной кислотой (5,2 мл) и добавлялся цианоформ калия (8,52 г). Суспензия перемешивалась и нагревалась с обратным холодильником в течение 16 ч и оставлялась на ночь охлаждаться. Смесь промывалась в делительной воронке с помощью этилацетата и воды, и органическая фаза собиралась. Водная фаза повторно экстрагировалась этилацетатом (2 x 80 мл), и объединенные органические растворы промывались водой (2 x 50 мл), сушились над безводным сульфатом магния и упаривались в вакууме, давая оранжевое твердое вещество (20,9 г). Две перекристаллизации из смеси этилацетата и петролейного эфира (т.кип. 60-80oC) давали 3, 5-диамино-4-циано-1-(2, 6-дихлор-4-трифторметилфенил/пиразол (7,75 г), т. пл. 208-210oC, в виде белых кристаллов.
П р и м е р 8. Соединение 9.
Раствор этантиола (2,1 г) в толуоле (10 мл) добавлялся по каплям при 5-10oC к перемешиваемой суспензии N-хлорсукцинимида (4,7 г) в толуоле (40 мл). Реакционная смесь фильтровалась через 20 мин, давая раствор этансульфенилхлорида. Данный фильтрат добавлялся по каплям при перемешивании к раствору натриевой соли 5-амино-4-циано-1-(2,6-дихлор-4-трифтор- метилфенил)-3-метилпиразола (полученной на месте по реакции 5-амино-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-метилпиразола (5 г) с гидридом натрия (0,4 г) в тетрагидрофуране (50 мл), содержащем 15-крон-5 (3 капли) при температуре 5-10o C. Через 2 ч добавлялся водный раствор бикарбоната натрия (50 мл), и органическая фаза отделялась и промывалась водой (2 x 50 мл), сушилась над безводным сульфатом магния. Упаривание растворителя в вакууме дало темно-коричневую смолу, которая хроматографировалась на двуокиси кремния (Мерк 230-400 меш, 0,7 кг см-2) c использованием дихлорметана в качестве элюента. Упаривание элюатов дало оранжевое камедеобразное вещество, которое затем перекристаллизовывалось из смеси этилацетата и гексана, давая 4-циано-1-(2, 6-дихлор-4- трифторметилфенил)-3-метил-5-этансульфенила- минопиразол (2,3 г), т.пл. 160-161oC, в форме бледно-желтого твердого вещества.
П р и м е р 9. Соединения 10, 11 и 27.
Смесь 5-амино-4-циано-1-(2, 6-дихлор-4-трифторметилфенил) -3-метилпиразола (5 г) и гидрата n-толуолсульфокислоты (0,1 г) в триметилортоформиате (20 мл) нагревалась с обратным холодильником в течение 4,5 ч. После охлаждения реакционная смесь упаривалась досуха в вакууме. Остаток растворялся в диэтиловом эфире и оставлялся кристаллизоваться при 0oC. Темно-окрашенное твердое вещество перекристаллизовывалось из смеси этанола и воды, давая 4-циано-1-(2, 6-дихлор-4-трифторметилфенил)-3-метил-5-метоксим этиленаминопиразол (4,67 г), т.пл. 75-78oC, в виде кристаллов темно-желтого цвета.
При проведении процесса аналогичным образом, но заменяя триметилортоформат трипропилортоформатом получали 4-циано-1-(2, 6-дихлор-4-трифторметилфенил)-3-метил-5- пропоксиметиленаминопиразол, т.пл. 77-79oC, в виде темно-желтых кристаллов.
При проведении процесса аналогичным образом, но при замене 5-амино-4-циано-1-(2, 6-дихлор-4-трифторметилфенил)-3-метилпиразола 5-амино-4-циано-1-(2, 6-дихлор-4-трифторметилфенил)-3-трифторметилпиразолом и триметилортоформата триэтилортоформатом получали: 4-циано-1-(2, 6-дихлор-4-трифторметилфенил)-5-этоксиметиленамино-3- трифторметилпиразол, т.пл. 160-162oC, из гексана, в виде белых кристаллов.
П р и м е р 10. Соединения 12, 13, 14, 15, 16, 26 и 25.
Суспензия 5-амино-1-(2, 6-дихлор-4-трифторметилфенил)-3,4 -дицианопиразола (15,0 г) в хлороформе (250 мл) обрабатывалась ацетилхлоридом (42,8 мл) при механическом перемешивании при 0oC. При поддержании температуры 0oC на протяжении 30 мин по каплям добавлялся раствор сухого пиридина (7,0 мл) в хлороформе (30 мл). Смесь перемешивалась в течение ночи при комнатной температуре, а затем нагревалась с обратным холодильником для завершения реакции. После охлаждения раствор выливался в смесь льда и разбавленной соляной кислоты, и хлороформный слой отделялся. Водный раствор повторно экстрагировался хлороформом (2 x 100 мл), и объединенные органические экстракты промывались водой (100 мл), сушились над безводным сульфатом магния и упаривались в вакууме, давая окрашенное в темно-желтый цвет твердое вещество (23,0 г). Перекристаллизация из смеси этилацетата и петролейного эфира (т.кип. 60-80oC) дала 5-ацетамидо-1-(2,6-дихлор-4- трифторметилфенил)-3, 4-дицианопиразол, т.пл. 208-209oC, в виде белых кристаллов.
При проведении процесса аналогичным образом
при
ацилировании
5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3,
4-дицианопиразола соответствующим хлорангидридом кислоты получали следующие фенилпиразолы:
5-Дихлорацетамидо-1-(2,
6-дихлор-4-три- фторметилфенил)-3,4-дицианопиразол, т.пл. 186-187oC, после очистки при растирании с четыреххлористым углеродом и последующей перекристаллизации из смеси этанола и воды в
виде не совсем белого твердого вещества. Реакция проводилась при
комнатной температуре. 5-Циклопропилкарбонамидо-1-(2,6-дихлор-4-трифторметилфенил)-3,4-дицианопираз ол,т.пл. 217-218oC
после
перекристаллизации из смеси этанола и воды в виде не совсем
белого твердого вещества. Реакция проводилась при комнатной температуре.
5-Пентанамидо-1-(2, 6-дихлор-4-трифторметилфенил)-3, 4- дицианопиразол в виде бледно-желтого стекла. Полосы инфракрасного поглощения: 3260, 3100, 2960, 2880, 2240, 1730, 1700, 1315, 880, 820 см-1 (жидкая пленка). Реакция проводилась при 0oC во время добавления и после этого при комнатной температуре. 5-Пропионамидо-1-(2,6-дихлор-4-трифторметилфенил)-3,4-дицианопиразол, т.пл. 188-189oC, после очистки с помощью хроматографии на двуокиси кремния (Мерк, 230-400 меш, 0,7 кг cм-2/с использованием смеси ацетона и гексана (2: 3) в качестве элюента и последующего растирания с толуолом, в виде белого порошка. Реакция проводилась при комнатной температуре.
При проведении процесса аналогичным образом, но заменяя растворитель ацетонитрилом, при ацилировании 5-амино-1-(2, 6-дихлор-4-трифторметилфенил)-3,4-дицианопиразола триметилацетилхлоридом получали следующий фенилпиразол: 1-(2,6- дихлор-4-трифторметилфенил)-3,4-дициано- 5-(2, 2-диметилпропионамидо)пиразол в виде белых кристаллов, т.пл. 202-203oC, из смеси толуола и гексана и после очистки с помощью хроматографии на двуокиси кремния (Мерк, 230-400 меш, 0,7 кг ˙ см-2) c использованием смеси дихлорметана и этилацетата (9:1) в качестве элюента.
При проведении процесса аналогичным образом, но при замене 5-амино-1-(2, 6-дихлор-4-трифторметилфенил)-3, 4-дицианопиразола 5-амино-4-циано-1-(2, 6-дихлор-4-трифторметилфенил)-3-трифторметилпира- золом и с помощью нагревания с обратным холодильником в течение 18 ч получали 5-ацетамидо-4-циано-1-(2, 6-дихлор- 4-трифторметилфенил)-3-трифторметилпира- зол, т. пл. 225-227oC, из смеси этилацетата и гексана, в виде белых кристаллов.
П р и м е р 11. Соединения 17 и 18.
Безводный ацетат натрия (1,0 г) растворялся в перемешиваемой уксусной кислоте (40 мл) при комнатной температуре добавлялся тетрацианоэтилен (3,5 г). Добавлялся 2-хлор-4-трифторметилфенилгидразин (5,25 г) в виде одной порции, и смесь перемешивалась в течение ночи. После разбавления водой выпавшее в осадок твердое вещество отфильтровывалось, давая после сушки 5-амино-1-(2-хлор-4-трифторметилфенил)-3,4-дицианопиразол, т.пл. 209-210oC, в виде белого порошка.
При проведении процесса аналогичным образом, но заменяя 2-хлор-4-трифторметилфенилгидразин 2,3,5,6-тетрафтор-4-трифторметилфенилгидразином и при охлаждении в течение добавления фенилгидразина к раствору тетрацианоэтилена получали 5-амино-3, 4-дициано-1-(2, 3, 5,6-тетрафтор-4- трифторметилфенил)пиразол, т.пл. 262-263oC, в виде темно-желтого порошка.
П р и м е р 12. Соединения 28 и 29.
Гидрид натрия (80% 0,25 г) добавлялся к перемешиваемому раствору 5-амино-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3- трифторметилпиразола (2,9 г) в сухом тетрагидрофуране (50 мл). После 3 ч нахождения при комнатной температуре при 0oC добавлялись 15-крон-5 (1 капля) и метилиодид (2 г), и смесь оставлялась на ночь при комнатной температуре. Раствор упаривался в вакууме, и остаток растворялся в дихлорметане (50 мл), промывался водой, разбавленной соляной кислотой и водой. После сушки над безводным сульфатом магния, фильтрования и упаривания в вакууме получалось желтое масло.
Очистка с помощью хроматографии с использованием двуокиси кремния Мерк (230-400 меш, 0,7 кг ˙ см-2) c дихлорметаном в качестве элюента давала 4-циано-1-(2, 6-дихлор-4-трифторметилфенил) -5-диметиламино-3-трифторметилпиразол в виде белого твердого вещества, т.пл. 105-107oC.
При проведении процесса аналогичным образом, но заменяя метилиодид этилбромацетатом и применяя диоксан в качестве растворителя вместо тетрагидрофурана, получался 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-этоксикарбонилметиламино-3-триф тормв виде белых кристаллов, т.пл. 104-106oC из смеси этилацетата и петролейного эфира.
П р и м е р 13. Соединение 30.
К суспензии 4-циано-1-(2, 6-дихлор-4-трифторметилфенил)-5-этоксиметиленамино-3-трифтормет илпи(1,0) в метаноле (10 мл), перемешиваемой при комнатной температуре, добавлялся боргидрид натрия (0,17 г). Через 2 ч добавлялось еще 0,17 г боргидрида натрия, а через 1 ч еще 0,34 г. Спустя один час, смесь выливалась в воду (80 мл) и экстрагировалась дихлорметаном (3 x 25 мл). Объединенные экстракты сушились над безводным сульфатом магния, фильтровались и упаривались в вакууме. Полученное таким образом белое твердое вещество очищалось с помощью хроматографии на двуокиси кремния (Мекр, 230-400 меш, 0,7 кг ˙ см-2 ) c использованием дихлорметана в качестве элюента, давая 4-циано-5-метиламино-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразо л, в виде белого твердого вещества (0,6 г), т.пл. 200-202oC.
П р и м е р 14. Соединения 31, 37 и 38.
Гидрид натрия (80% 0,3 г) добавлялся к перемешиваемому раствору 5-амино-4-циано-1-(2, 6-дихлор-4-трифторметилфенил)-3- трифторметилпиразола (2,9 г) в сухом тетрагидрофуране (50 мл). Спустя 3 ч добавлялся 15-крон-5 (1 капля) и триметилацетилхлорид (1,8 г), смесь перемешивалась в течение ночи. Упаривание в вакууме давало темно-желтое полутвердое вещество, которое растворялось в дихлорметане. Данный раствор промывался водой, разбавленной соляной кислотой и снова водой и, наконец, сушился над безводным сульфатом магния. Фильтрование с последующим упариванием в вакууме давали желтое масло, которое очищалось с помощью хроматографии на двуокиси кремния (Мерк, 40-230 меш, 0,7 кг см-2). Элюирование дихлорметаном дало после упаривания 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-(2,2-диметилпропионамидо)-3- трифторметилпиразол в виде белого твердого вещества, т.пл. 198-200oC.
При проведении процесса аналогичным образом, но при замене триметилацетилхлорида этилхлорформатом получался после перекристаллизации из толуола 4-циано-1-(2, 6-дихлор-4- трифторметил) -5-бис-(этоксикарбонил)амино-3-трифторметилпиразол в виде белых кристаллов, т.пл. 62oC.
При проведении процесса аналогичным образом, но при замене триметилацетилхлорида хлорангидридом циклопропанкарбоновой кислоты получался 4-циано- 1-(2,6-дихлор-4-трифторметилфенил) -5-бис-(цианопропанкарбонил)амино-3-трифторметилпиразол в виде бледно-желтого твердого вещества, т.пл. 126-127oC.
П р и м е р 15. Соединение 39.
Раствор 4-циано-1-(2,6-дихлор-4-трифторметилфенил) -5-бис-(циклопропанкарбонил)-амино-3-трифторметилпиразола (1,0 г) в этаноле (50 мл) нагревался с обратным холодильником с насыщенным раствором бикарбоната натрия (25 мл) в течение 45 мин. После охлаждения и упаривания растворителя в вакууме остаток разбавлялся водой и экстрагировался дихлорметаном. Экстракт сушился над безводным сульфатом магния, фильтровался и упаривался в вакууме, давая 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-5- циклопропанкарбонамидо-3-трифторметилпиразол в виде белого твердого вещества, т.пл. 210-212oC.
П р и м е р 16. Соединение 33.
Перемешиваемая смесь 5-амино-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразола (3,89 г) и бромоформа (13 мл) обрабатывалась трет-бутилнитритом (2,26 мл) при комнатной температуре. Через 15 мин смесь нагревалась до 50oC в течение 1 ч и упаривалась в вакууме, давая красное масло. Оно очищалось с помощью хроматографии на двуокиси кремния (Мерк, 40-230 меш, 0,7 кг ˙ см-2) при элюировании смесью дихлорметана и петролейного эфира (1: 2), давая 5-бром-4-циано-1-(2, 6-дихлор-4-трифторметилфенил)- 3-трифторметилпира- зол в виде желтовато-коричневого твердого вещества с т. пл. 85-87oC (3,7 г).
П р и м е р 17. Соединение 34.
Раствор 5-амино-4-циано-1-(2, 6-дихлор-4-трифторметилфенил)-3-гидроксиметилпиразола (1,25 г) в дихлорметане (10 мл) добавлялся медленно к перемешиваемому раствору трехфтористой диэтиламиносеры (0,66 г) в дихлорметане (6 мл), охлажденному до -78oC. Через 30 м мин нахождения при данной температуре раствор подогревался до комнатной температуры и перемешивался в течение 2 ч. Смесь затем выливалась в воду (20 мл), и дихлорметановый слой отделялся, сушился над безводным сульфатом магния, фильтровался и упаривался в вакууме. Продукт очищался с помощью хроматографии на двуокиси кремния (Мерк, 40-230 меш, 0,7 кг ˙ см-2) при элюировании смесью дихлорметана и этилацетата (98:2) и последующей перекристаллизации из смеси дихлорметан-петролейный эфир, давая 5-амино-4-циано-1-(2, 6-дихлор-4-трифторметилфенил)-3-фторметилпиразол в виде белого твердого вещества с т.пл. 139-141oC.
Ссылочный пример 5. 5-Амино-4-циано-1-(2, 6-дихлор-4- трифторметилфенил)-3-гидроксиметилпиразол приготавливался следующим образом.
Раствор 5-амино-4-циано-1-(2, 6-дихлор-4-трифторметилфенил)-3-этоксикарбонилпиразола (1,0 г) в сухом тетрагидрофуране (15 мл) обрабатывался в атмосфере азота боргидридом лития (0,06 г) при перемешивании при комнатной температуре в течение 18 ч. Добавлялся этилацетат (5 мл) с последующим добавлением насыщенного раствора хлористого натрия (5 мл), и смесь подкислялась разбавленной соляной кислотой и экстрагировалась дихлорметаном. Экстракт сушился над безводным сульфатом магния, фильтровался и упаривался в вакууме. Остаточное масло очищалось с помощью хроматографии на двуокиси кремния (Мерк, 40-230 меш, 0,7 кг см-2) при элюировании смесью дихлорметана и этилацетата (1: 1), и чистые фракции упаривались в вакууме и перекристаллизовывались из смеси этилацетата и петролейного эфира, давая целевое соединение в виде белого твердого вещества с т.пл. 159-161o C. 5-Амино-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-этоксикарбонилпиразол приготавливался следующим образом.
К гидриду натрия (80% 0,9 г) в сухом этаноле (30 мл) добавлялся при перемешивании малононитрил (1,98 г). Затем при перемешивании и охлаждении добавлялся этилхлорид-(2, 6-дихлор-4- трифторметилфенил)гидразоноацетат (11,0 г). Внутренняя температура быстро повышалась до 20oC и поддерживалась на этом уровне в течение часа перед фильтрацией бледно-желтого твердого вещества. Фильтрат упаривался в вакууме, давая оранжевое твердое вещество. Объединенные твердые вещества растворялись в этилацетате, дважды промывались водой, сушились над безводным сульфатом магния, фильтровались и упаривались в вакууме, давая оранжевое твердое вещество (11,0 г). Перекристаллизация из смеси этил-ацетат петролейный эфир давала указанное соединение в виде желтовато-коричневых кристаллов (8,3 г), т.пл. 208-209oC.
Этил хлор-(2, 6-дихлор-4-трифторметилфенил)гидразоноацетат приготавливался следующим образом.
Нитрит натрия (3,04 г) добавлялся в течение 1 мин к перемешиваемой концентрированной серной кислоте (24 мл) при 30-50oC. Раствор охлаждался до 20oC и по каплям добавлялся в течение 15 мин к раствору 2,6-дихлор-4-трифторметиланилина (9,2 г) к уксусной кислоте (90 мл), температура которого поддерживалась в интервале 35-40oC. Этот раствор затем охлаждался до 10oC и добавлялся по каплям к перемешиваемому раствору безводного ацетата натрия (54 г) и этилхлорацетоацетата (7,0 г) в смеси воды (72 мл) и этанола (48 мл) в течение 45 мин при таком охлаждении, чтобы поддерживалась температура 10oC. По истечении 1 ч при комнатной температуре смесь разбавлялась водой, фильтровалась и твердое вещество растворялось в дихлорметане. Данный раствор сушился над безводным сульфатом магния, фильтровался и упаривался в вакууме, давая указанное соединение в виде белого твердого вещества (11,9 г), т.пл. 96-98oC.
П р и м е р 18. Соединения 32-40.
Смесь 5-амино-1-(2, 6-дихлор-4-трифторметилфенил)-3- трифторметилпиразола (3,64 г) и N-бромсукцинимида (1,78 г) в четыреххлористом углероде (30 мл) перемешивалась и нагревалась с обратным холодильником в течение 1 ч. Затем добавлялся N-бромсукцинимид (0,89 г) и нагревание с обратным холодильником продолжалось еще в течение 1 ч. Смесь охлаждалась, фильтровалась и фильтрат упаривался в вакууме, давая оранжевое твердое вещество. Перекристаллизация из петролейного эфира давала 5-амино-4-бром-1-(2, 6-дихлор-4-трифторметилфенил)-3- трифторметилпиразол в виде белых кристаллов (2,6 г), т.пл. 119-120о С.
Проводя процесс аналогичным образом, но заменяя N-бромсукцинимид N-хлорсукцинимидом, получали 5-амино-4-хлор-1-(2,6-дихлор-4-трифторметилфенил)-3-трифтор- метилпиразол в виде белых кристаллов с т.пл. 99-100оС. В этом случае не требовалось избытка хлорирующего агента.
Ссылочный пример 6. 5-Амино-1-(2, 6-дихлор-4-трифторметилфенил)-3- трифторметилпиразол приготавливался следующим образом.
Раствор 5-амино-4-карбокси-1-(2,6-дихлор-4-трифторметилфенил) -3-трифторметилпиразол (10,5 г) в N,N-диметиланилина (13 мл) нагревался с обратным холодильником в течение 3 ч. Охлажденная смесь выливалась в концентрированную соляную кислоту (15 мл) и экстрагировалась эфиром (4 x 30 мл). Объединенный экстракт промывался 6 н. соляной кислотой (3 x 30 мл), водой (2 x 30 мл) сушился над безводным сульфатом магния, фильтровался и упаривался в вакууме. Продукт перекристаллизовывался из циклогексана, давая указанное соединение (5,7 г) в виде белых игл, т.пл. 126-128оС.
5-Амино-4-карбокси-1-(2,6-дихлор-4-три- фторметилфенил)-3-трифторметилпиразол приготавливался следующим образом.
Смесь 5-амино-1-(2, 6-дихлор-4-трифторметилфенил)-4-метоксикарбонил-3-три- фторметилпиразола (101,2 г; описанного в примере 4) и гидроокиси натрия (48 г) в воде (170 мл) и метаноле (550 мл) перемешивалась при комнатной температуре в течение 2 дней, упаривалась в вакууме, и остаток растирался с разбавленной соляной кислотой. Твердое вещество фильтровалось, растворялось в этилацетате и полученный в результате раствор промывался раствором хлористого натрия. После сушки над безводным сульфатом магния, фильтрации и упаривания в вакууме получали полутвердый остаток. Этот остаток растирался с гексаном, и твердое вещество перекристаллизовывалось из смеси толуолгексан, давая целевое соединение в виде твердого вещества кремового цвета с т.пл. 212-215оС.
П р и м е р 19. Соединение 41.
Этилхлорформат (1,6 г) добавлялся к перемешиваемому раствору 5-амино-4-циано-1-(2, 6-дихлор-4-трифторметилфенил)-3- трифторметилпиразола (3,9 г) в пиридине (15 мл). После перемешивания в течение ночи производилось еще одно добавление этилхлорформата (1,0 мл), и смесь оставлялась стоять в течение 12 ч. Растворитель упаривался в вакууме, остаток подкислялся разбавленной соляной кислотой и экстрагировался дихлорметаном. Данный экстракт промывался водой (3), сушился над безводным сульфатом магния, фильтровался и упаривался в вакууме. Очистка с помощью хроматографии на двуокиси кремния (Мерк, 40-230 меш, 0,7 кг см-2) c элюированием смесью этилацетата и петролейного эфира (1: 1) давала белое твердое вещество, которое перекристаллизовывалось из смеси дихлорметана и гексана, давая белые кристаллы 4-циано-1-(2, 6-дихлорметилфенил)-5- этоксикарбониламино-3-трифтор- метилпиразола, т.пл. 177-179оС.
П р и м е р 20. Соединение 35.
Раствор 5-амино-1-(2, 6-дихлор-4-трифторметилфенил)-3-трифторметилпиразола (3,0 г) в концентрированной серной кислоте (10 мл) при 0oC обрабатывался дымящей азотной кислотой (9 мл) в течение 15 мин при поддержании температуры 5-15оС. Через 30 мин смесь выливалась в избыток льда, и осажденное твердое вещество отфильтровывалось и растворялось в этилацетате. После сушки над безводным сульфатом магния, фильтрования и упаривания в вакууме получалось коричневое масло. Данное масло растворялось в минимальном количестве этилацетате и разбавлялось гексаном. Выкристаллизовывалось бледно-желтое твердое вещество, которое отбрасывалось. Фильтрат упаривался в вакууме, давая твердое вещество, которое перекристаллизовывалось из смеси толуола и гексана, давая желтое твердое вещество. Одна дополнительная перекристаллизация из той же пары растворителей давала 5-амино-1-(2, 6-дихлор-4-трифторметилфенил)-4-нитро-3- трифторметилпиразол в виде белых кристаллов, т.пл. 214-215оC.
П р и м е р 21. Соединение 42.
К раствору 5-амино-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторме- тилпиразола (2,33 г) в сухом тетрагидрофуране (30 мл) добавлялся при перемешивании при комнатной температуре раствор трет-бутилнитрила (1,36 мл) в сухом тетрагидрофуране (5 мл) в течение 5 мин. Раствор затем нагревался с обратным холодильником в течение 1 ч и охлаждался, добавлялось дополнительное количество трет-бутилнитрила (2,72 мл). Раствор нагревался с обратным холодильником в течение 30 мин и оставлялся охлаждаться на ночь. Упаривание в вакууме давало оранжевое масло, которое очищалось с помощью хроматографии на двуокиси кремния (Мерк, 40-230 меш, 0,7 кг ˙ cм-2) c элюированием смесью дихлорметана и гексана (1:1). Продукт наконец перекристаллизовывался из гексана, давая 4-циано-1-(2,6-дихлор-4- трифторметилфенил)-3-трифторметилпира- зол, т.пл. 121-123оС, в виде белых кристаллов.
П р и м е р 22. Соединение 43.
К раствору 5-амино-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторме- тилпиразола (2,33 г) в хлороформе (30 мл), перемешиваемому при комнатной температуре, добавлялся иод (3,0 г) с последующим добавлением трет-бутилнитрила (1,1 г). Через 2 ч смесь нагревалась при кипячении с обратным холодильником в течение 1, 5 ч, охлаждалась и фильтровалась, фильтрат промывался раствором тиосульфата натрия для удаления избытка иода. После промывки водой, сушки над безводным сульфатом магния и упаривания в вакууме получалось желтое твердое вещество. Данное вещество хроматографировалось на двуокиси кремния (Мерк, 40-230 меш, 0,7 кг см-2) при элюировании смесью дихлорметана и гексана (1:1), давая желтое масло. Растворение в горячем гексане дало после охлаждения 4-циано-1-(2, 6-дихлор-4-трифторметилфенил)- 5- иод-3-трифторметилпиразол в виде белых кристаллов, т.пл. 86-87оС.
П р и м е р 23. Соединение 44.
К сухому диизопропиламину (0,135 г) в сухом тетрагидрофуране (4 мл), перемешиваемому при -78оС, в атмосфере азота добавлялся с помощью шприца раствор н-бутиллития (0,52 мл 2,6 М раствора в гексане). После подогревания до комнатной температуры в течение 1 мин раствор повторно охлаждался до -78oC, добавлялся с помощью шприца к перемешиваемому раствору 4-циано-1-(2, 6-дихлор-4-трифторметилфенил)-3-трифторметилпиразола (0,5 г) в сухом тетрагидрофуране (4 мл) в атмосфере азота при -78оС. Добавление в течение 2 мин было экзотермическим, внутренняя температура поддерживалась при -60оС в течение дальнейших 15 мин. Добавлялся метилиодид (0,1 мл). После 1,5 ч нахождения при данной температуре раствор выливался в избыток воды и экстрагировался дихлорметаном (3). Объединенная органическая фаза промывалась водой, сушилась над безводным сульфатом магния и упаривалась в вакууме, давая твердое вещество. Хроматография на двуокиси кремния (Мерк, 40-230 меш, 0,7 кг ˙ см-2) при элюировании смесью дихлорметан гексан (1:3) давала белое твердое вещество (0,2 г). Перекристаллизация из гексана давала 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-5- метил-3-трифторметилпиразол в виде белых кристаллов с т.пл. 90-92оС.
П р и м е р 24. Соединение 45.
Смесь 5-амино-4-хлорсульфонил-1-(2,6-дихлор-4-трифторметилфенил) -3-трифторметилпиразола (1,2 г) и диметиламина (17,6 мл 40%-ного водного раствора) нагревалась на паровой бане в течение часа, охлаждалась и выливалась в толченый лед (50 г), что давало коричневое твердое вещество. Это твердое вещество фильтровалось, сушилось и перекристаллизовывалось из толуола, давая 5-амино-1-(2, 6-дихлор-4-трифторметилфенил)-4-(N, N-диметилсульфамоил) -3-три фторметилпиразол (0,8 г) в виде светло-коричневых кристаллов, т.пл. 177,6-178,6oC.
Ссылочный пример 7. 5-Амино-4-хлорсульфонил-1-(2,6-дихлор-4-трифторметил-фенил)-3-трифторметилпи разоприготавливался следующим образом.
5-Амино-1-(2, 6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол (9, 1 г) добавлялся порциями к перемешиваемой охлажденной хлорсульфоновой кислоте (16,21 г), внутренняя температура поддерживалась ниже 10оС. Оранжевый раствор перемешивался при комнатной температуре в течение 30 мин, затем при 120оС в течение 5 ч и выливался в ледяную воду (300 мл), давая светло-коричневое твердое вещество. Это твердое вещество фильтровалось, сушилось и перекристаллизовывалось из циклогексана, давая указанное соединение в виде желтых кристаллов.
П р и м е р 25. Соединение 46.
Раствор 2, 6-дихлор-4-трифторметилфенилгидразина (3,8 г) и 1,1-дициано-2-циклопропил-2-метоксиэтилена (2,23 г) в метаноле (30 мл) перемешивался и обрабатывался гидридом натрия (80% 30 мг). Спустя 4 ч раствор упаривался в вакууме и остаток растворялся в этилацетате (40 мл), обрабатывался древесным углем и промывался водой. Органическая фаза упаривалась в вакууме, остаточное масло растворялось в петролейном эфире и получались кристаллы 5-амино-4-циано-3-циклопропил-1-(2,6-дихлор)-4-трифтор- метил/пиразола, т.пл. 197-199оС.
П р и м е р 26. Соединения 48, 49 и 50.
При проведении процесса по способу, аналогичному примеру 1, но при замене 2,4,6-трихлорфенилгидразина 2,6-дихлор-4-трифторметилтиофенилгидразином получали 5-амино-3, 4- дициано-1-(2, 6-дихлор-4- трифторметилтиофенил)пиразол, т. пл. 226-227оС, в виде не совсем белого твердого вещества после перекристаллизации из толуола.
При применении 2-хлор-3,5, 6-трифтор-4-трифторметилфенилгидразина получали 5-амино-1-(2-хлор-3,5,6-трифтор-4-трифторметилфенил) -3,4-дицианопиразол, т.пл. 242-243оС, в виде оранжевого твердого вещества, после перекристаллизации из смеси этанола и воды.
При применении 2,6-дихлор-3,5-дифтор-4-трифторметилфенилгидразина получали 5-амино-1-(2,6-дихлор-3, 5-дифтор-4- трифторметилфенил)-3, 4-дицианопиразол, т.пл. 245-247оС, в виде не совсем белого твердого вещества.
Ссылочный пример 8. 2, 6-Дихлор-4-трифторметилтиофенилгидразин приготавливался в соответствии с процедурой ссылочного примера 1 при проведении процесса аналогичным образом, но заменяя 2,6-дихлор-4-трифтор-метиланилина 2, 6-дихлор-4-трифторметилтиоанилином.
Ссылочный пример 9. 2-Хлор-3,5,6-трифтор-4-трифторметилфенилгидразин приготавливался следующим образом.
3-Хлор-2,4,5, 6-тетрафторбензотрифторид (12,1 г) и гидразингидрат (3,4 г) нагревались с обратным холодильником с этанолом (50 мл) в течение 3,5 ч. Смесь выливалась в смесь льда и воды (500 мл), перемешивалась, и продукт фильтровался. После промывки водой и сушки в эксикаторе получалось указанное соединение в форме белых кристаллов, т.пл. 91-92оС.
Осуществляя процесс аналогичным образом, но заменяя 3-хлор-2,4,5,6-тетрафторбензотрифторид 3,5-дихлор-2,4, 6-трифтор- бензотрифторидом, приготавливали 2,6-дихлор-3,5-дифтор-4-трифторметилфенил-гидразин в виде бледно-желтых кристаллов, т.пл. 78-80оС.
П р и м е р 27. Соединение 51.
Проводя процесс по примеру 2, но используя 2, 6-дихлор-4-трифторметоксифенилгидразин, получали 5-амино-1-(2,6-дихлор-4- трифторметоксифенил)-3,4-дицианопиразол, т.пл. 231-232оС, в форме коричневого твердого вещества, после перекристаллизации из толуола.
Ссылочный пример 10. 2,6-дихлор-4-трифторметоксифенилгидразин, используемый в примере 27, приготавливался с помощью метода ссылочного примера 1, но с заменой 2,6-дихлор-4-трифторметиланилина 2, 6-дихлор-4-трифторметоксианилином. Целевое соединение получалось в виде желтовато-коричневых кристаллов с т.пл. 64-65оС.
П р и м е р 28. Соединения 52, 53, 54 и 55.
Осуществляя процесс по примеру 3, но заменяя этоксиэтиленмалононитрил этоксипропилен-малононитрилом, получали 5-амино-4-циано-3-этил-1-(2, 6-дихлор-4-трифторметилфенил) пиразол в виде белых кристаллов, т.пл. 158-160оС, после перекристаллизации из смеси этилацетата и гексана.
Проводя процесс аналогичным образом, но заменяя этоксиэтиленмалононитрил этоксиэтиленметансульфонилацетонитрилом и заменяя ацетат натрия и ледяную уксусную кислоту этанолом, содержащим 10 мол. триэтиламина, при нагревании с обратным холодильником, получали 5-амино-1-(2, 6- дихлор-4- трифторметилфенил)-4-метансульфонил-3-метилпиразол в виде белого твердого вещества, т.пл. 195оС, после перекристаллизации из смеси этилацетата и гексана.
Проводя процесс аналогичным образом, но заменяя этоксиэтиленмалононитрил этиловым эфиром этоксиэтиленцианоуксусной кислоты получали 5-амино-1-(2, 6-дихлор-4-трифторметилфенил)-3-метил-4-этоксикарбонилпиразол в виде белых кристаллов, т. пл. 115-118оС, после перекристаллизации из смеси толуола и петролейного эфира.
Осуществляя процесс сходным образом, но заменяя этоксиэтиленмалононитрил этоксиэтиленметансульфонил- ацетонитрилом и заменяя 2, 6-дихлор-4-трифторметилфенилгидразин 2, 6-дихлор-4-трифторметоксифенилгидразином и выполняя реакцию в смеси 1:1 по объему этанола и триэтиламина при подходящей температуре, получали 5-амино-1-(2, 6-дихлор-4- трифторметоксифенил) -4-метансульфонил-3-метилпиразол в виде желтовато-коричневого твердого вещества, т.пл. 180-181оС.
Ссылочный пример 11. 3-Этокси-2-метансульфонилбут-2-еннитрил, использовавшийся в примере 28, приготавливался следующим образом.
Смесь метансульфонилацетонитрила (200 г), триэтилортоацетата (348 г) и хлористого цинка (21 г) перемешивалась в гексане (1200 мл) при нагревании с обратным холодильником. Дистиллят собирался через головку Mcintyre с дополнительным добавлением гексана к реакционной смеси по мере необходимости. Гексан (2800 мл) собирался в течение 8 ч. После охлаждения смесь упаривалась в вакууме и упаривалась вторично после добавления толуола (100 мл). Остаток растворялся в этилацетате и перекристаллизовывался из смеси этилацетата и гексана дважды, давая белые кристаллы, т.пл. 99оС, которые представляли собой целевое соединение.
П р и м е р 29. Соединения 56, 57, 58 и 59.
Осуществляя процесс по примеру 4, но заменяя 2,6-дихлор-4-трифторметилфенилгидразин 2-хлор-3,5,6-трифтор-4- трифторметилфенилгидразином, получали 5-амино-1-(2-хлор-3,5, 6- трифтор-4-трифторметилфенил)-4-циано-3-трифторметилпиразол в виде белых кристаллов, т.пл. 187-189оС, после перекристаллизации из толуола.
При использовании 2, 6-дихлор-4-трифторметилтиофенилгидразина получали 5-амино-4-циано-1-(2,6-дихлор-4-трифторметилтиофенил) -3-трифторметилпиразол в виде бледно-желтых кристаллов, т.пл. 133,5-134,5оС, после перекристаллизации из гексана.
Заменяя 2-хлор-1,1-дициано-2-трифторметилэтилен 2,3-дихлор-1,1-дициано-3-фторметилэтиленом получали 5-амино- 3-хлорфторметил-4-циано-1-(2, 6- дихлор-4-трифторметилфенил)пиразол после перекристаллизации из смеси толуола и гексана, в виде твердого вещества кремового цвета, т.пл. 186-188о С.
Применяя 2, 6-дихлор-3, 5-дифтор-4-трифторметилфенилгидразин, получали 5-амино-4-циано-1-(2,6-дихлор-3,5-дифтор-4- трифторметилфенил)-3-трифторметилпиразол в виде светло-коричневого твердого вещества, т.пл. 176-177оС.
Ссылочный пример 12. Хлордицианоэтилен, использовавшийся в качестве исходного вещества в примере 29, приготавливался следующим образом.
Осуществляя процесс как в ссылочном примере 2, но заменяя натриевую соль 2-циано-3-гидрокси-4-хлор-4,4-дифторбут -2-еннитрила соли натриевой солью 2-циано-3-гидрокси-4-хлор-4-фторбут-2-еннитрила получали 2-хлор-2-хлорфторметил-1,1-дицианоэтилен в виде жидкости, т.кип. 90оС (46 мм рт.ст.).
Осуществляя процесс как в ссылочном примере 3, но заменяя метилхлордифторацетат этилхлорфторацетатом, получали натриевую соль 2-циано-3-гидрокси-4- хлор-4-фторбут-2-еннитрила, представляющую собой оранжево-красное твердое вещество.
П р и м е р 30. Соединение 60.
При использовании методики примера 9, но заменяя триметилортоформат на триэтилортоацетат получают 4-циано-1-(2, 6- дихлор-4-трифторметилфенил)-5-(1-этоксиэтилиденамино)-3-метилпиразол в виде белого твердого вещества, т. пл. 50-53оС, после очистки при помощи хроматографии на двуокиси кремния (Мерк 230-400 меш, 0,7 кг см-2), с использованием дихлорметана в качестве элюанта.
П р и м е р 31. Соединения 61, 62 и 63.
При использовании методики примера 10, но заменяя 5-амино-1-(2,6- дихлор-4-трифторметилфенил)-3,4-дицианопиразол на 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-циано-3-метилпиразол и ацилируя хлорангидридом янтарной кислоты получают 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-метил-5-сукцинимидопиразол в виде белого твердого вещества, т.пл. 202-204оС, после очистки хроматографией на двуокиси кремния (Мерк 230-400 меш, 0,7 кг см-2), используя дихлорметан-этилацетат (98:2) в качестве элюанта.
При использовании той же методики, не заменяя 5-амино-1-(2, 6- дихлор-4-трифторметилфенил) 3, 4-дицианопиразол на 5-амино-1-(2,6-дихлор-4-трифторметил- фенил)-4-метансульфонил-3- трифторметилпиразол и применяя ацетонитрил в качестве растворителя для ацилирования, получают 5-ацетамидо-1-(2, 6-дихлор-4-трифторметилфенил)-4- метансульфонил-3-трифторметилпиразол в виде белого твердого вещества, т.пл. 194-195оС, после перекристаллизации из толуола.
При использовании методики примера 10, но заменяя 5-амино-1- (2,6-дихлор-4-трифторметилфенил)-3,4-дицианопиразол на 5-амино-1- (2, 6-дихлор-4-трифторметилфенил)-3-метил-4-метансульфонилпиразол, получают 5-ацетамидо-1-(2,6-дихлор-4- трифторметилфенил)-3-метил-4-метансульфонилпиразол в виде желтых кристаллов, т.пл. 202-203oC.
П р и м е р 32. Соединение 64.
При использовании методики примера 11, но заменяя 2-хлор-4-трифторметилфенилгидразин на 2,6-дихлор-4-нитрофенилгидразин, получают 5-амино-1-(2,6-дихлор-4-нитро- фенил)-3,4-дицианопиразол в виде бледно-коричневого твердого вещества, т.пл. 289-290оС.
П р и м е р 33. Соединения 65 и 66.
При использовании методики примера 12, но заменяя 5-амино-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол на 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3, 4-дицианопиразол и используя нужное количество метилйодида, получают 1-(2, 6-дихлор-4-трифторметилфенил)-3,4-дициано-5-метиламинопиразол в виде бледно-желтого твердого вещества, т.пл. 165-166оС, после перекристаллизации из толуола.
При использовании указанной методики но применяя этилйодид, получают 1-(2,6-дихлор-4-трифторметилфенил)-3, 4- дициано-5-этиламинопиразол в виде беловатого твердого вещества, т.пл. 245-246оС, после очистки хроматографией на двуокиси кремния (Мерк 230-400 меш, 0,7 кг ˙ cм-2), используя смесь этилацетата и петролейного эфира (15:85).
П р и м е р 34. Соединения 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78 и 79.
При использовании
методики примера 13, но заменяя 5-амино-4-циано-1-(2,
6-дихлор-4-трифторметилфенил)-3-трифторметил- пиразол и триметилацетилхлорид на нужные фенилпиразолы и ацилирующие агенты, по- лучают:
4-циано-1-(2,
6-дихлор-4-трифторметилфенил)-5- (N-метил-N-этоксикарбониламино)-3-трифторметилпиразол в виде белого твердого вещества, т.пл. 88-90оС, после перекристаллизации из гексана,
используя
4-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-ме- тиламино-3-трифторметилпиразол и этилхлорформат;
4-циано-1-(2,
6-дихлор-4-трифторметилфенил)-5-(N-ацетил-N- триметилацетиламино)-3-трифторметилпиразол в виде беловатого твердого вещества, т.пл. 83,5-84оС, после перекристаллизации из гексана,
используя
4-циано-1-(2,6-дихлор-4-трифторметилфенил) -5-триметилацетиламино-3-трифторметилпиразол и ацетилхлорид;
4-циано-1-(2,
6-дихлор-4-трифторметилфенил)-5-(N-пропионил-N- триметилацетиламино)-3-трифторметилпиразол в виде белого твердого вещества, т.пл. 56-56,5оС, после перекристаллизации из гексана,
используя
4-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-триметилацетиламино-3-трифторме тилпи пропио- нилхлорид;
1-(2,
6-дихлор-4-трифторметилфенил)-4-ни- тро-3-трифторметил-5-триметилацетиламинопиразол
в виде белого твердого вещества, т.пл. 219оС, используя 5-амино-1- (2,
6-дихлор-4-трифторметилфенил)-4-нитро-3-три- фторметилпиразол и триметилацетилхлорид;
1-(2,
6-дихлор-4-трифторметилфенил)-5- это- ксикарбониламино-4-нитро-3-трифторметил- пиразол в виде
бледно-желтых кристаллов, т.пл. 124oC, используя 5-амино-1-(2,
6-дихлор-4-трифторметилфенил)-4-нитро-3-трифторме- тилпиразол и этилхлорформат; 3-хлор-1-(2,
6-дихлор-4-трифторметилфенил)-4-циано-5-триметилацетиламинопираз ол в виде белого твердого вещества, т.пл.
203-204оС; 3-хлор-1-(2,
6-дихлор-4-трифторметилфенил)-4-циано-5-бис-(этоксикарбонил) аминопиразол в виде оранжевого кристаллического твердого вещества, т.пл. 67-69оС;
3-хлор-1-(2,
6-дихлор-4-трифторметил- фенил)-4-циано-5-этоксикарбониламино- пиразол в виде желтого твердого вещества, т.пл. 175-179оС;
(Последние три соединения были получены путем
взаимодействия 5-амино-3-хлор- 1-(2,6-дихлор-4-трифторметилфенил)-4- цианопиразола с соответствующими ацилхлоридами).
4-Циано-5-диацетиламино-1-(2,
6-ди- хлор-4-трифторметилфенил)-3- трифторметилпиразол в виде белых кристаллов, т.пл. 138-139оС
и 5-(N-ацетил-N-этоксикарбониламино)-4-циано-1-(2,6-дихлор-4-трифторметилфе-ни
л)-3в
виде белого твердого вещества, т.пл. 101-102оС;
(Два указанных соединения были получены путем взаимодействия 5-ацетиламино-1-(2,
6-дихлор-4-трифторметил)-4-циано-3-трифторметилпиразола и соответствующих ацилхлоридов).
1-(2,6-Дихлор-4-трифторметилфенил)-5-бис-(этоксикарбонил) амино-3,4-дицианопиразол и 1-(2, 6-дихлор-4- трифторметилфенил)-5-бис-(этоксикарбонил)амино-4- метан- сульфонил-3-трифторметилпиразол получают таким же образом, как описано в примере 14, но заменяя 5-амино-4-циано-1-(2, 6-дихлор-4-трифторметилфенил)-3-трифторметилпира-зол на 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3,4-дицианопиразол и на 5-амино-1-(2, 6-дихлор-4-трифторметилфенил)-4-метан- сульфонил-3-трифторметилпиразол соответственно. Триметилацетилхлорид заменяют на соответствующее количество этилхлорформата (два эквивалента) и также используют 2 эквивалента гидрида натрия. Продукты получают в виде белых кристаллов с т.пл. 74-76оС и 148-151оС cоответственно.
П р и м е р 35. Соединения 79 и 80.
При использовании методики примера 15, но заменяя 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-бис- (циклопропанкарбонил)амино-3-трифторметилпиразол на 1-(2, 6-дихлор-4-трифторметилфенил)-5-бис-(этоксикарбонил)амино-4-метансуль- фонил-3-трифторметилпиразол, получают 1-(2,6-дихлор-4-трифторметилфенил)-5-эток-сикарбониламино-4-метансульфонил-3 трифторметилпиразол в виде белого твердого вещества, т.пл. 138-141оС.
При использовании той же методики, но заменяя 4-циано-1-(2, 6-дихлор-4-трифторметилфенил)-5-бис-(циклопропанкарбонил) амино-3-трифторметилпиразол на 1-(2,6-дихлор-4-трифторметилфенил)-5-бис-(этоксикар- бонил)амино-3,4-дицианопиразол, получают 1-(2, 6-дихлор-4-трифторметилфенил)-3,4-ди- циано-5-этоксикарбониламинопиразол в виде белого твердого вещества, т.пл. 161-163оС.
П р и м е р 36. Соединения 81 и 82.
При использовании методики примера 18, но заменяя N-бромсукцинимид на N-йодсукцинимид получают 5-aмино-1-(2,6-дихлор-4-трифторметилфенил)-4-йод-3- трифторметилпиразол в виде белого твердого вещества, т.пл. 129оС.
Путем замены N-бромсукцинимида на N-йодсукцинимид и заменяя 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол на 5-амино-1-(2, 6-дихлор-4-трифторметилфенил)-3-метилпиразол (описанный в ссылочном примере 13), получают 5-амино-1-(2,6-дихлор-4- трифторметилфенил)-4-йод-3-метилпиразол в виде темно-желтого твердого вещества, т.пл. 108-109оС, после перекристаллизации из гексана.
Ссылочный пример 13. 5-Амино-1-(2,6-дихлор-4-трифторметилфенил)-3-метилпиразол получают следующим образом.
5-Амино-4-карбокси-1-(2,6-дихлор-4- трифторметилфенил)-3-метилпиразол (28 г) нагревают до 190оС в атмосфере азота и поддерживают при этой температуре до того, как прекратится выделение газа. После охлаждения указанное соединение получают в количестве 22 г в виде желтой смолы. 5-Амино-4-карбокси-1-(2,6-дихлор-4-три- фторметилфенил)-3-метилпиразол, используемый выше, получают методом ссылочного примера 6, но заменяя 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4- метоксикарбонил-3-трифторметилпиразол на 5-ами- но-1-(2, 6-дихлор-4-трифторметилфенил)-4-этоксикарбонил-3-метилпиразол) описанный в примере 28, и путем проведения основного гидролиза при температуре дефлегмации в этаноле в течение 13 ч. Получают указанное соединение в виде белого твердого вещества, т.пл. 183-184оС.
П р и м е р 37. Соединения 83, 84 и 85.
При использовании методики примера 20, но заменяя 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол на 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3-метилпиразол и заменяя смесь концентрированных серной и дымящей азотной кислот на концентрированную азотную кислоту, получают 5-амино-1-(2, 6-дихлор-4-трифторметилфенил)-3-метил-4-нитропиразол в виде оранжевых кристаллов, т.пл. 229-231оС, после перекристаллизации из смеси толуола и петролейного эфира.
При использовании той же методики, но заменяя 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол на 5-ацетамидо-1-(2, 6-дихлор-4-трифторметилфенил) -3-трифторметилпиразол и заменяя смесь концентрированных серной и дымящей азотной кислот на смесь уксусной кислоты и уксусного ангидрида, к которым прибавляют дымящую азотную кислоту, получают 5-ацетамидо-1-(2, 6-дихлор-4-трифторметилфенил)-4-нитро-3-трифторметилпиразол в виде кремового твердого вещества, т.пл. 194-195оС.
При использовании той же методики, но заменяя 5-амино-1-(2, 6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол на 1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол и заменяя смесь концентрированной серной кислоты и дымящей азотной кислоты на уксусный ангидрид, к которому добавляют дымящую азотную кислоту, получают 1-(2,6-дихлор-4-трифторметилфенил) -4-нитро-3-трифторметилпиразол в виде оранжевого твердого вещества, т.пл. 110-112оС, после перекристаллизации из смеси толуола и гексана.
Ссылочный пример 14. 1-(2, 6-Дихлор-4-трифторметилфенил)-3- трифторметилпиразол, используемый в примере 37, получают при помощи методики, описанной в примере 21, путем замены 5-амино-4-циано-1-(2, 6-дихлор-4-трифторметилфенил)-3- трифторметилпиразола на 5-амино-1-(2,6-дихлор-4- трифторметилфенил) -3-трифторметилпиразол. Указанное соединение получают в виде бледно-желтого масла. 5-Ацетамидо-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол, используемый в примере 37, получают при помощи методики примера 15, но заменяя 4-циано-1-(2, 6-дихлор-4-трифторметилфе-нил)-5-бис-(ци- клопропанкарбонил)амино-1-(2,6-дихлор-4-три- фторметилфенил)-5-бис- (циклопропанкарбонил)-амино-3-трифторметилпиразол на 5-бис-(ацетил)амино-1-(2, 6-дихлор-4-трифтор- метилфенил)-3- трифторметилпиразол. Указанное соединение получают в виде белых кристаллов, т.пл. 142-144оС, после перекристаллизации из этилацетата и гексана.
5-Бис-(ацетил)амино-1-(2,6-дихлор-4- трифторметилфенил)-3-трифторметилпиразол, используемый выше, получают при помощи методики примера 19, но заменяя 5-амино-4-циано-1-(2, 6-дихлор-4- трифторметилфенил)-3-трифторметилпиразол на 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол и этилхлорформат на ацетилхлорид. Указанное соединение получают в виде белого твердого вещества, т.пл. 130-131оС.
П р и м е р 38. Соединения 86, 87 и 88.
При использовании методики примера 21, но заменяя 5-амино-4-циано-1-(2, 6-дихлор-4-три фторметилфенил)-3- трифторметилпиразол на 5-амино-1-(2,6-дихлор-4-трифтор- метилфенил) -3-метил-4-метансульфонилпиразол, получают 1-(2, 6-дихлор-4-трифтор- метилфенил)-3-метил-4-метансульфонил- пиразол в виде желтых кристаллов, т.пл. 168-169оС.
При использовании той же методики, но заменяя 5-амино-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3- трифторметилпиразол на 5-амино-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-фторпиразол, получают 4-циано-1-(2, 6-дихлор-4-трифторметилфенил)- 3-фторпиразол в виде белых кристаллов, т.пл. 120-121оС. 1-(2,6-Дихлор-4-трифторметилфенил)-4- метансульфонил-3-трифторметилпиразол получают таким же путем, заменяя 5-амино-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3- трифторметилпиразол на 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-ме- тансульфонил-3-трифторметилпиразол. Указанное соединение получают в виде белых иголок, т.пл. 154-155оС.
П р и м е р 39. Соединение 89.
При использовании методики примера 22, но заменяя йод на безводный хлорид меди и заменяя хлороформ на безводный ацетонитрил, получают 5-хлор-1-(2,6-дихлор-4-трифторметилфенил) -4-трифторметилфенил)-4-циано-3-трифторметилпиразол в виде желтого масла после очистки хроматографией на двуокиси кремния (Мерк, 40-230 меш, 0,7 кг см-2), элюируя смесью дихлорметана и гексана (1:2). Полосы инфра-красной абсорбции: 2260, 1495, 1405, 1325, 1160 см-1 (жидкая пленка).
П р и м е р 40. Соединения 90 и 91.
При использовании методики примера 24, но заменяя диметиламин соответствующим амином, получают следующие фенилпиразолы: 5-амино-1-(2, 6-дихлор-4-три- фторметилфенил)-4-(N-этилсульфамоил)-3- трифторметилпиразол в виде кремообразного твердого вещества, т.пл. 200оС, после перекристаллизации из смеси толуола и петролейного эфира; 5-амино-1-(2,6-дихлор-4-(N- метилсульфамоил)-3-трифторметилпиразол в виде светло-коричневого твердого вещества, т.пл. 199-200оС, после перекристализаци из толуола.
П р и м е р 41. Соединения 92 и 93.
Трифторуксусный ангидрид (3,5 мл) добавляют по каплям к перемешиваемой смеси 85 маc./об. раствора перекиси водорода (0,56 мл) в дихлорметане (15 мл), поддерживая при 0-10оС. После нагревания до 20оС в течение 5 мин раствор 3-амино-1-(2,6-дихлор -4-трифторметилфенил)-4-цианопиразола (1,0 г; далее описан в ссылочном примере 15) в дихлорметане (10 мл) добавляют по каплям в течение 5 мин. Наблюдают подъем температуры на 10оС во время добавления, и смесь нагревают с обратным холодильником в течение 1,5 ч. После охлаждения раствор сливают на избыток воды, и органический раствор промывают по очереди раствором бикарбоната натрия и бисульфита натрия. После сушки над безводным сульфатом магния, с последующим упариванием в вакууме, получают отшлифованное твердое вещество, которое очищают хроматографией на двуокиси кремния (Мерк, 40-230 меш, 0,7 кг ˙ см-2), элюируя дихлорметаном. Полученное белое твердое вещество перекристаллизовывают из смеси дихлорметана и гексана с получением 1-(2, 6-дихлор-4-трифторметилфенил-4- циано-3-нитропиразол в виде белых кристаллов (0,7 г), т.пл. 163-165оC.
При использовании той же методики, но заменяя 3-амино-1-(2, 6-дихлор-4-трифторметилфенил)-4-цианопиразол на 5-амино-1-(2, 6-дихлор-4-трифторметилфенил)-3, 4-дицианопиразол (ранее описан в примере 2), получают 1-(2,6-дихлор-4-трифторметилфенил)-3, 4-дициано-5-нитропиразол в виде оранжевых кристаллов, т.пл. 138-140оС, после перекристаллизации из циклогексана.
Ссылочный пример 15. 3-Амино-1-(2, 6-дихлор-4-трифторметилфенил)-4-цианопиразол получают следующим образом.
Раствор 3-трет-бутоксикарбониламино-1-(2, 6-дихлор-4- трифторметилфенил)-4-цианопиразол (2,8 г) в этаноле (100 мл) обрабатывают 50 об./об соляной кислотой (10 мл), и смесь нагревают с обратным холодильником в течение 1 ч. После стояния в течение ночи при комнатной температуре карбонат натрия добавляют до достижения рН 8, и смесь экстрагируют три раза дихлорметаном. Экстракт промывают водой, сушат над безводным сульфатом магния и упаривают в вакууме с получением темно-желтого твердого вещества. После перекристаллизации из смеси этилацетата и петролейного эфира получают указанное соединение (1,4 г) в виде белых кристаллов, т.пл. 159-160оС.
3-трет-бутоксикарбониламино-1-(2,6- дихлор-4-трифторметилфенил)-4- цианопиразол получают следующим образом.
Смесь 3-карбокси-4-циано-1-(2, 6-дихлор-4- трифторметилфенил)пиразола (11 г) и тионилхлорида (35 мл) и N,N-диметилформамида (3 капли) нагревают с обратным холодильником в течение 2 ч. Растворитель упаривают в вакууме и вновь упаривают в вакууме после добавления сухого толуола (20 мл). Полученную смолу растворяют в сухом ацетоне (50 мл) и перемешивают в то время, как добавляют раствор азида натрия (2,9 г) в воде (15 мл) в течение 5 мин поддерживая температуру 10-15оС. Через 30 мин смесь сливают в воду (250 мл) и экстрагируют с дихлорметаном (3 x 80 мл). Объединенный экстракт промывают водой, сушат над безводным сульфатом магния и упаривают в вакууме при температуре, равной или ниже 40oC, с получением темно-желтого твердого вещества (13 г).
Полученный азид растворяют в сухом толуоле (200 мл) и нагревают с обратным холодильником в течение получаса при мягком выделении азота. После охлаждения его обрабатывают трет-бутаном (40 г), и смесь нагревают с обратным холодильником в течение ночи. После упаривания в вакууме полученное коричневое масло (15 г) очищают хроматографией на двуокиси кремния (Мерк, 230-400 меш, 0,6 кг ˙ см-2), элюируя дихлорметаном и этилацетатом (98:2) c получением указанного соединения (8,0 г) в виде белого твердого вещества т.пл. 154-155оС. 3-Карборси-4-циано-1-(2, 6-ди-хлор-4- трифторметилфенил)пиразол получают следующим образом.
Суспензию 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-этоксикарбонилпи- разол (5,0 г) в этаноле (100 мл) обрабатывают раствором гидроокиси натрия (0,63 г) в воде (15 мл) и перемешивают при комнатной температуре в течение 1,5 ч. После упаривания в вакууме при температуре, равной или ниже 40оС, остаток растворяют в воде (150 мл) и экстрагируют дихлорметаном (1х100 мл). Этот экстракт опять промывают водой (2х50 мл), объединенные водные растворы доводят до рН 1 при помощи разбавленной соляной кислоты и затем экстрагируют этилацетатом (3 x 50 мл). Этот экстракт сушат над безводным сульфатом магния и упаривают в вакууме с получением темно-желтого твердого вещества (4,6 г). После перекристаллизации из смеси толуола и гексана получают указанное соединение в виде темножелтых кристаллов (4,4 г), т.пл. 203-205оС.
4-Циано-1-(2, 6-дихлор-4-трифторметилфенил)-3-этоксикарбонилпиразол получают по примеру 21, заменяя 5-амино-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-три- фторметилпиразол на 5-амино-4-циано- 1-(2, 6-дихлор-4-трифторметилфенил) -3-этоксикарбонилпиразол. Указанное соединение получают в виде темно-желтых кристаллов, т.пл. 198-199оС.
П р и м е р 42. Соединения 94, 95 и 96.
Фторид серебра (1) в количестве 5 г добавляют по частям в течение 40 мин в энергично перемешиваемый раствор 1,1-дихлор- 2,2- дицианоэтилен в ацетонитриле (15 мл), поддерживая при 0-10оС при помощи внешнего охлаждения. Перемешивание продолжают при комнатной температуре в течение 1 ч и твердое вещество отфильтровывают. Фильтрат, содержащий 1,1-дифтор-2, 2-дицианоэтилен, перемешивают и охлаждают, в то время как раствор 2, 6-дихлор-4-трифторметилфенилгидразина (4,9 г) в ацетонитреле (15 мл) добавляют по каплям при 5оС. После перемешивания в течение ночи твердое вещество отфильтровывают и фильтрат упаривают в вакууме с получением темно-оранжевого масла (6 г). Его очищают при помощи хроматографии на двуокиси кремния (Мерк, 230-400 меш, 10 фунт дюйм-2), элюируя дихлорметаном с получением белого твердого вещества. После перекристаллизации из смеси циклогексана и этилацеата получают 5-амино-1-(2, 6-дихлор-4- трифторметилфенил)-4-циано-3-фторпиразол (0,9 г) в виде белого твердого вещества, т.пл. 193-194оС.
При использовании той же методики, но заменяя 2, 6-дихлор-4-трифторметилфенилгидразин на 2, 6-дихлор-4- трифторметоксифенилгидразин и применяя 1,1-дихлор- 2,2-дицианоэтилен вместо 1,1-дифтор-2,2-дицианоэтилена и используя диэтиловый эфир в качестве растворителя, получают 5-амино-3-хлор-1-(2, 6-дихлор-4-трифторметоксифенил)-4- цианопиразол в виде желтого твердого вещества, т.пл. 175-177оС.
При использовании указанной методики но заменяя 2, 6-дихлор-4- трифторметоксифенилгидразин на 2,6-дихлор-3, 5-дифтор- 4- трифторметилфенилгидразин, получают 5-амино-3-хлор-4-циано-1-(2,6-дихлор-3, 5-дифтор-4-трифторметилфенил)пиразол в виде желтых кристаллов, т.пл. 206-208оС.
П р и м е р 43. Соединения 97, 98, 99, 100, 101, 102 и 103.
Перемешиваемый раствор 4-циано-1-(2, 6-дихлор-4- трифторметилфенил)-3-трифторметилпиразол (1,5 г) в сухом тетрагидрофуране охлажденном до -78oC обрабатывают раствором н-бутиллития (2,6 М в гексане, 1,71 мл) по каплям в атмосфере азота. Температуру поддерживают ниже -65оС во время добавления, и полученный раствор поддерживают при -78оС в течение 1 ч. Раствор триметилсилилхлорида (0,56 мл) в сухом тетрагидрофуране (2 мл) затем добавляют по каплям в течение 2 мин. Смеси дают достичь комнатной температуры в течение 2 ч, оставляют на ночь и упаривают в вакууме с получением бледно-желтого твердого вещества. Его растворяют в дихлорметане, промывают водой, сушат над безводным сульфатом магния и упаривают в вакууме. Продукт перекристаллизовывают из гексана с получением 4-циано-1-(2, 6- дихлор-4-трифторметилфенил)-3-трифторметил- -5-триметилсилилпиразола в виде белых кристаллов, т.пл. 108-110оС.
При использовании той
же методики, но
заменяя хлорид
триметилсилила на реагенты, перечисленные ниже, получают следующие
фенилпиразолы:
5-трет-бутилдиметилсилил-4-циано-1- (2,
6-дихлор-4- трифторметилфенил)-3-трифторметилпиразол в
виде белых
кристаллов, т.пл. 113-115оС; из
трет-бутилдиметилсилилхлорида; 4-циано-1-(2,
6-дихлор-4-трифторметилфенил)-5-метилтио-3-трифторметилпиразол в виде белого порошка, т.пл. 73-74оС из
метилтиоцианата;
4-циано-1-(2,
6-дихлор-4-трифторметилфенил)-3-трифторметил-5- трифторметилтиопиразол в виде белых кристаллов, т.пл. 120-122оС из
бис-(трифторметил)дисульфида;
5-карбокси-4-циано-1-(2,
6-дихлор-4-трифторметилфенил)-3- трифторметилпиразол в виде белого твердого вещества, т.пл. 177-179оС, путем сливания
литиированного раствора пиразола на
большоей избыток
порошкообразного
твердого диоксида углерода.
При использовании той же методики, но заменяя 4-циано-1-(2, 6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол на 1-(2, 6-дихлор-4-трифторметилфенил)-4-нитро-3- трифторметилпиразол получают 1-(2, 6-дихлор-4-трифторметилфенил)-4-нитро-3- трифторметил-5-триметилсилилпиразол в виде бледно-зеленого твердого вещества, т.пл. 101-103оС.
При использовании той же методики, но заменяя 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол на 4-циано-1-(2, 6-дихлорметилфенил)-5-метил-3-трифторметилпиразол (раннeе описанный в примере 23), получают 4-циано-1-(2, 6-ди-хлор-4-трифторметилфенил)-3-трифторме-тил-5-триметилсилилм етилв виде бесцветного масла. Полосы инфра-красной абсорбции: 2250, 1400, 1325, 1260, 1180, 1150, 860 см-1 (жидкая пленка).
Ядерно-магнитный резонанс: химические уровни (дельта) для
-Si-СH2
2,
8 млд. в диметилсульфоксиде -D6
П р и м е р 44. Соединение 104.
Метоксид натрия (0,3 г) добавляют к ледяной перемешиваемой смеси 4-циано-1-(2, 6-дихлор-4-трифторметилфенил)-5-бис- (фе- ноксикарбонил)амино-3-трифторметилпиразол (3,1 г) в метаноле (30 мл) и нагревают с обратным холодильником в течение 2 ч. Это сливают на воду (200 мл) и экстрагируют дихлорметаном. Органический раствор промывают раствором карбоната натрия, затем водой, сушат над безводным сульфатом магния и упаривают в вакууме. Получают белое твердое вещество 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-5- метоксикарбониламино-3-трифторметилпиразол, т.пл. 182-183о С.
Ссылочный пример 16. 4-Циано-1-(2, 6-дихлор-4-трифторметилфенил) -5-бис-(феноксикарбонил)амино-3-трифторметилпиразол, используемый в примере 44, получают при помощи методики примере 14, но заменяя триметилацетилхлорид и фенилхлорформат. Указанное соединение получают в виде белого твердого вещества, т.пл. 168-169оС.
П р и м е р 45. Соединения 105 и 106.
5-Карбамоил-4-циано-1-(2,6-дихлор-4-трифторметилфенил) -3-трифторметилпиразол (3,57 г) нагревают до 200оС c пятиокисью фосфора (2,82 г) при перемешивании. Через 3 ч охлажденный продукт обрабатывают льдом и экстрагируют дихлорметаном (3 х 50 мл). Органический раствор промывают водой, сушат над безводным сульфатом магния и упаривают в вакууме с получением твердого вещества. После перекристаллизации из гексана получают 1-(2, 6-дихлор-4-трифторметилфенил)-4,5-дициано-3-трифторметилпиразол в виде белых кристаллов (1,8 г), т.пл. 80оС.
При использовании той же методики, но заменяя 5-карбамоил-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3- трифторметилпиразол на 5-амино-3-карбамоил-1-(2, 6-дихлор-4- трифторметилфенил)-4-метансульфонилпиразол, получают 5-амино-3- циано-1-(2, 6-дихлор-4-трифторметилфенил)-4-метансуль- фонилпиразол в виде белого твердого вещества, т.пл. 214о С.
Ссылочный пример 17. 5-Карбамоил-4-циано-1-(2, 6-дихлор-4- трифторметилфенил)-3-трифторметилпиразол, используемый в примере 45, получают следующим образом. 5-Карбокси-4-циано-1-(2, 6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол (6,0 г), описанный в примере 43, добавляют к тионилхлориду (30 мл) и перемешиваемый раствор нагревают с обратным холодильником в течение 4 ч. Раствор упаривают в вакууме и вновь упаривают после добавления сухого толуола (30 мл). Полученное оранжевое масло растворяют в сухом эфире (10 мл) и добавляют по каплям к перемешиваемому раствору аммиака (0,88, 20 мл), охлажденного ледяной баней. После перемешивания в течение ночи добавляют воду (150 мл), и смесь экстрагируют дихлорметаном (3 x 50 мл). Объединенный экстракт промывают водой, сушат над безводным сульфатом магния и упаривают в вакууме с получением белого твердого вещества (7,0 г). После перекристаллизации из смеси этилацетата и петролейного эфира получают указанное соединение (4,3 г) в виде белых кристаллов, т.пл. 180-181оС.
5-Амино-3-карбамоил-1-(2, 6-дихлор-4-трифторметилфенил)-4- метансульфонилпиразол, используемый в примере 45, получают при помощи той же методики, но заменяя 5-карбокси-4-циано-1-(2, 6- дихлор-4-трифторметилфенил)-3-трифторметилпиразол на 5-амино-3-карбокси-1-(2, 6-дихлор-4-трифторметилфенил)-4-метансульфонилпиразо л. Указанное соединение получают в виде беловатого твердого вещества, т.пл. 223-224оС.
5-Амино-3-карбокси-1-(2, 6-дихлор-4-трифторметилфенил)-4- метансульфонилпиразол получают следующим образом.
5-Амино-1-(2, 6-дихлор-4-трифторметилфенил)-3-этоксикарбонил-4- метансульфонилпиразол (8,15 г) добавляют к перемешиваемой 80% серной кислоте (80 мл) и нагревают до 100оС в течение 5 ч. После охлаждения раствор сливают в лед, твердое вещество отфильтровывают и сушат над пятиокисью фосфора в вакуумном эксикаторе. После перекристаллизации из смеси метанола и петролейного эфира получают указанное соединение в виде белого твердого вещества, т. пл. 203-205оС.
5-Амино-1-(2,6-дихлор-4-трифторметилфенил)-3-этоксикарбонил -4-метансульфонилпиразол получают при помощи методики примера 5 путем замены малононитрила на метансульфонилацетонитрил. Указанное соединение получают в виде белого твердого вещества, т.пл. 255оС после перекристаллизации из этанола.
П р и м е р 46. Соединение 107.
Раствор метилмагниййодида, полученный из магния (0,26 г) и метилйодида (1,5 г) в диэтиловом эфире (25 мл), обрабатывают раствором 1-(2,6-дихлор-4-трифторметилфенил)-4-циано-3- трифторметилпиразола (2 г) в диэтиловом эфире (20 мл) по каплям. Полученный бледный желтый раствор нагревают с обратным холодильником в течение 24 ч, охлаждают и обрабатывают соляной кислотой (2N, 10 мл). После перемешивания в течение 0,5 ч при комнатной температуре реакционную смесь разбавляют эфиром (50 мл). Эфирный экстракт промывают водой (50 мл), сушат над безводным сульфатом магния и упаривают в вакууме с получением желтой смолы. Ее очищают при помощи хроматографии на двуокиси кремния (Мерк, 230-400 меш, 0,7 кг ˙ см-2), элюируя смесью дихлорметана и петролейного эфира (4:1) c получением 4-ацетил-1-(2,6-дихлор-4-трифторметилфенил)-3- трифторметилпиразола в виде белого твердого вещества, т.пл. 134о С.
П р и м е р 47. Соединения 108-116.
Перемешиваемый раствор 5-амино-1-(2,6-дихлор-4-трифторметилфенил) -4-метилтио-3-трифторметилпиразола (1, 0 г) в хлороформе (40 мл) обрабатывают м-хлорпербензойной кислотой (0,42 г) по частям при комнатной температуре. После перемешивания в течение 6 ч раствор разбавляют дихлорметаном и промывают по очереди раствором сульфита натрия, раствором гидроокиси натрия и водой. Раствор сушат над безводным сульфатом магния и упаривают в вакууме с получением желтого масла.
После очистки хроматографией на двуокиси кремния (Мерк, 230-400 меш, 0,7 кг см-2), элюирования дихлорметан-этилацетатом (4:1), получают 5-амино-1-(2, 6-дихлор-4-трифторметилфенил)-4-метилсуль- финил-3-трифторметилпиразол в виде белого твердого вещества, т.пл. 142-145оС c разложением.
При помощи той же методики, но
заменяя 5-амино-1-(2,6-дихлор-4- трифторметилфенил)-4-метилтио-3-трифторметилпиразол
алкилтиофенилпиразоламин, получают: 5-амино-1-(2,
6-дихлор-4-трифторметилфенил)-4-этилсульфинил-3-трифторметил-пи
разв виде белого твердого вещества, т.пл. 170оС, из 5-амино-1-(2,
6-дихлор-4-три- фторметилфенил)-4- этилтио-3-трифторметилпиразола;
5-амино-1-(2,
6-дихлор-4-трифторметилфенил)-4-этилсульфинил-3- метилпиразол в виде темно-желтого твердого вещества, т.пл.
157-158оС, из 5-амино-1-(2,
6-дихлор-4-трифторметилфенил)-4-этилтио-3-метилпи- разола; 5-амино-4-циано-1-(2,6-дихлор-4-трифторметилсульфинилфенил)-3-трифторметил- пиразол в виде
оранжевого
твердого вещества, т.пл. 76оС, из 5-амино-4-циано- 1-(2,6-дихлор-4-трифторметилтиофенил)-3- трифторметилпиразола;
4-циано-1-(2,
6-дихлор-4-трифторметилфенил)-5-метилсульфинил-3- трифторметилпиразол в виде белых
кристаллов, т.пл. 97-98оС, из 4-циано-1-(2,
6-дихлор-4-трифтор- метилфенил)-5-метилтио-3-трифторметил-пиразола.
При помощи той же методики, но заменяя 5-амино-1-(2,
6-дихлор-4- трифторметилфенил)-4-метилтио-3-трифторметилпиразол
нужными алкилтиофенилпиразоламин и применяя 2 молярных эквивалента м-хлорпербензойной кислоты, получают:
5-амино-1-(2,
6-дихлор-4-трифторметилфенил)-4-этилсульфонил-3- трифторметилпиразол в
виде белых кристаллов, т.пл. 206-207оС, из 5-амино-1-(2,
6-дихлор-4-трифторметилфенил)-4-этилтио-3-трифторметилпиразола. 5-амино-1-(2,
6-дихлор-4-трифторметилфенил)-4-этилсульфонил-3-метилпиразол в виде белого твердого вещества, т.пл. 193оС,
из
5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-этилтио-3-метилпиразола.
При помощи той же методики, но заменяя 5-амино-1-(2,6-дихлор -4-трифторметилфенил)-4-метилтио-3-трифторметилпиразол на 5-амино-1-(2, 6-дихлор-4-трифторметилфенил)-4-н-пропилтио-3- метилпиразол, получают 5-амино-1-(2, 6-дихлор-4- трифторметилфенил)-3-метил-4-пропансульфонилпиразол в виде белого твердого вещества, т.пл. 145,5-147оС.
При помощи той же методики получают 5-амино-1-(2, 6-дихлор-4- трифторметилфенил)-4-трихлорметансульфонил-3-метилпиразол в виде бледно-розового твердого вещества, т.пл. 183-184оС, из 5-амино-1-(2, 6-дихлор-4-трифторметилфенил)-4-трихлорметилтио-3- метилпиразола.
П р и м е р 48. Соединения 117, 118 и 119.
Смесь бис-[5-амино-1-(2, 6-дихлор-4-трифторметилфенил)-3- метилпиразол-4-ил]дисульфида (4,0 г), дитионита натрия (2,02 г) и гидроокиси натрия (0,46 г) перемешивают и нагревают с обратным холодильником в смеси этанола и воды (60 мл, 1:1) в течение 4 ч. Охлажденный желтый раствор обрабатывают этилйодидом (2,17 г) и смесь перемешивают и нагревают с обратным холодильником в течение 2 ч. После упаривания в вакууме желтую смолу растворяют в эфире (100 мл), промывают водой, сушат над безводным сульфатом магния и вновь упаривают в вакууме.
Полученную смолу очищают при помощи хроматографии на двуокиси кремния (Мерк, 230-400 меш, 0,7 кг см-2), элюируя дихлорметаном с получением 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4- этилтио-3-метилпиразола в виде белого твердого вещества, т.пл. 117оС, после перекристаллизации из гексана.
При использовании той же методики, но заменяя этилйодид на метилйодид получают 5-Амино-1-(2, 6-дихлор-4-трифторметилфенил)-3-метил-4-метилтиопиразол в виде белого твердого вещества, т.пл. 112оС, после перекристаллизации из гексана.
При использовании той же методики, но заменяя гидроокись натрия карбонатом натрия и метилйодид н-пропилйодидом, получают 5-амино-1-(2,6-дихлор-4-трифтор- метилфенил)-4-н-пропилтио-3- метилпиразол в виде белого твердого вещества, т.пл. 100-102оС.
Ссылочный пример 18. Бис-[5-амино-1-(2,6-дихлор-4- трифторметилфенил)-3-метилпиразол-4-ил]дисульфид получают следующим образом.
Раствор 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3-метил-4-тиоцианатпира- зол (3,0 г, описанный в примере 50) в смеси этанола и воды (1:1, 100 мл) подкисляют добавлением соляной кислоты (10 N, 20 мл). Смесь нагревают с обратным холодильником в течение 8 ч, концентрируют до половины объема в вакууме, охлаждают в ледяной бане и добавляют раствор гидроокиси натрия до рН 9-10. Осажденный продукт фильтруют, промывают водой и сушат в вакууме с получением указанного в названии соединения (2,68 г) в виде аморфного желтого порошка, т.пл. 211-213оС.
П р и м е р 49. Соединения 120 и 121.
Раствор этилмагнийбромида, полученный из магния (0,57 г) и этилбромида (2,6 г) в сухом диэтиловом эфире (25 мл), добавляют по каплям к перемешиваемому раствору 5-амино-1-(2, 6-дихлор-4- трифторметилфенил)-4-тиоцианат-3-трифторметилпиразола (5,0 г) в сухом эфире (50 мл) при -20оС. После перемешивания в течение 2 ч при комнатной температуре осторожно добавляют воду (130 мл) и перемешивание продолжают в течение 0,25 ч. Эфирный слой отделяют, сушат над безводным сульфатом магния и упаривают в вакууме с получением желтой смолы. После очистки хроматографией на двуокиси кремния (Мерк, 230-400 меш, 0,7 кг ˙ cм-2), элюируя дихлорметаном-петролейным эфиром (1:1) с получением продукта, который после перекристаллизации из гексана дает 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-этилтио-3-трифторметил- пиразол в виде белых иголок, т.пл. 116-116,5оС.
При использовании той же методики, но заменяя этилмагниййодид на метилмагниййодид, получают 5-амино-1-(2,6-дихлор-4- трифторметилфенил)-4-метилтио-3-три- фторметилпиразол в виде белого твердого вещества, т.пл. 108оC, после перекристаллизации из гексана.
П р и м е р 50. Соединения 122 и 123.
Перемешиваемую смесь 5-амино-1-(2, 6-дихлор-4-трифторметилфенил) -3-трифторметилпиразола (0,7 г) тиоцианата калия (0,55 г) в метаноле (15 мл) обрабатывают раствором брома (0,3 г) в метаноле (2 мл) при 0-5оС. Перемешивание продолжают при этой температуре в течение 1,5 ч, смесь сливают в ледяную воду и доводят до рН путем добавления карбоната натрия. Продукт фильтруют, промывают водой и сушат. После очистки хроматографией на двуокиси кремния (Мерк, 230-400 меш, 0,7 кг ˙ см-2), элюируя дихлорметаном, получают 5-амино-1-(2, 6-дихлор-4-трифторметилфенил)-4- тиоцианат-3-трифторметилпиразол в виде белого твердого вещества, т.пл. 49-50оС.
При использовании той же методики но заменяя 5-амино-1-(2, 6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол на 5-амино-1-(2, 6-дихлор-4-трифторметилфенил) -3-метилпиразол получают 5-амино-1-(2, 6-дихлор-4-трифторметилфенил)-3-метил-4- тиоцианатпиразол в виде белого твердого вещества, т.пл. 133,5оС, после перекристаллизации из смеси гексана и этилацетата.
П р и м е р 51. Соединение 124.
При использовании методики примера 4, но заменяя 2, 6-дихлор-4-трифторметилфенилгидразин на 2,6-дихлор-4-метансульфонилфенилгидразин, получают 5-амино- 4-циано-1-(2,6-дихлор-4-метансульфонил)-3-трифторметилпиразол в виде белых кристаллов, т.пл. 270-272оС.
Ссылочный пример 19. Используя методику ссылочного примера 1, но заменяя 2,6-дихлор-4-трифторметиланилин на 2, 6-ди- хлор-4- метансульфониланилин, получают 2, 6-дихлор-4-метансульфонилфенилгидра- зин в виде белых кристаллов, т.пл. 163-166о С.
П р и м е р 52. Соединение 125.
К перемешиваемому ледяному раствору 5-амино-1-(2,6-дихлор-4- трифторметилфенил)-3-метилпиразола (2,0 г) в хлороформе (40 мл) и пиридине (0, 51 г) добавляют по каплям раствор трихлорметансульфенилхлорида (1,2 г) в хлороформе (10 мл). Полученный коричневый раствор перемешивают при 0оС в течение 2 ч, затем при комнатной температуре в течение 2 ч. Дополнительно добавляют трихлорметансульфенилхлорид (0,5 г), и смесь перемешивают в течение 2 ч при комнатной температуре. Затем добавляют воду (100 мл) и дихлорметан (100 мл), и органический слой промывают водой (1x100 мл), сушат над безводным сульфатом магния и упаривают в вакууме с получением желтой смолы (2,9 г). Ее очищают при помощи хроматографии на двуокиси кремния (Мерк, 100-230 меш, 0,7 кг ˙ см-2), элюируя дихлорметаном петролейным эфиром (3:2) c получением белого твердого вещества (0,98 г). После перекристаллизации из гексана получают 5-амино-1-(2, 6- дихлор-4-трифторметилфенил)-3-метил-4-трихлорметилтиопиразол в виде белых кристаллов, т.пл. 156оС.
П р и м е р 53. Соединение 126.
м-Хлорбензойную кислоту добавляют (2,1 г) к раствору 5-амино-4- циано-1-(2, 6-дихлор-4-трифторметилтиофенил)-3-трифторметилпиразола (2,3 г) в дихлорметане (20 мл), охлажденному до 10оС. После перемешивания в течение ночи при комнатной температуре раствор нагревают с обратным холодильником в течение 4 ч, охлаждают и еще добавляют м-хлорбензойную кислоты (2,1 г). Смесь перемешивают при комнатной температуре в течение 4 ч и нагревают с обратным холодильником в течение 4 ч. Охлажденный раствор промывают раствором бикарбоната натрия (20 x 20 мл), затем водой (2 x 20 мл), сушат над безводным сульфатом магния, фильтруют и упаривают в вакууме с получением оранжевого твердого вещества. После очистки при помощи хроматографии на двуокиси кремния (Мерк, 100-230 меш, 0,7 кг ˙ см-2), элюируя этилацетатом-петролейным эфиром (1:9), получают 4-циано-1-(2, 6-дихлортрифторметансуль- фонилфенил)-5-нитро-3- трифторметилпиразол (0,5 г) в виде твердого оранжевого вещества, т.пл. 168-169оС.
П р и м е р 54. Соединение 127.
К перемешиваемому раствору трифторида диэтиламиномеры (1,5 г) в дихлорметане (13 мл), охлажденному до -70оС, добавляют по каплям в атмосфере азота раствор 1-(2, 6-дихлор-4-трифторметилфенил)-4- формил-3-трифторметилпиразол (3,1 г) в дихлорметане (17 мл). После 1 ч при -70оС cмесь оставляют стоять в течение ночи при комнатной температуре, затем сливают на избыток ледяной воды. После экстракции дихлорметаном получают раствор, который промывают водой (2), сушат над безводным сульфатом магния и упаривают в вакууме с получением коричневого масла (3,26 г). После очистки при помощи хроматографии на двуокиси кремния (Мерк, 40-230 меш, 0,7 кг ˙ см-2), элюируя гексаномэтилацетатом (5: 1), получают 1-(2, 6-дихлор-4-трифторметилфенил)-4-дифторметил-3- трифторметилпиразол (1,15 г) из этилацетата-гексана) в виде бледно-желтого твердого вещества, т.пл. 88-90оС.
Ссылочный пример 20. Смесь 4-циано-1-(2,6-дихлор-4- трифторметилфенил)-3-трифторметилпиразола (5,0 г; описанный в примере 21) и муравьиной кислоты (120 мл) обрабатывают никелем Ренея (5,1 г), и смесь нагревают с обратным холодильником в течение ночи. После охлаждения смесь фильтруют и фильтрат разбавляют водой (900 мл) и экстрагируют дихлорметаном (4 x 100 мл), объединенный экстракт промывают раствором бикарбоната натрия (2), затем водой (1), сушат над безводным сульфатом магния и упаривают в вакууме с получением твердого коричневого вещества (3,7 г), т.пл. 80-82оС.
Получают 1-(2,6-дихлор-4-трифторметилфенил)-4-формил-3- трифторметилпиразол.
П р и м е р 55. Соединение 128.
К перемешиваемому раствору 5-амино-4-карбокси-1-(2,6-дихлор-4- трифторметилфенил)-3-трифторметилпиразола (15,0 г; описанного в ссылочном примере 6) в сухом тетрагидрофуране (50 мл) добавляют в атмосфере азота раствор комплекса борантетрагидрофурана (2 молярный, 27,5 г) в течение 10 мин, поддерживая при -20оС. Раствору дают достичь комнатной температуры и перемешивают в течение ночи. Далее вновь добавляют боран (10 мл) и раствор нагревают с обратным холодильником в течение ночи. После охлаждения дополнительно добавляют боран (20 мл) и раствор вновь нагревают с обратным холодильником в течение 4 ч. После охлаждения добавляют гидроокись натрия (6N) до рН 11 и раствор экстрагируют дихлорметаном. Органическую фазу промывают водой, сушат над безводным сульфатом магния и упаривают в вакууме с получением коричневого масла. После очистки при помощи хроматографии на двуокиси кремния (Мерк, 40-230 меш, 0,7 кг ˙ см-2 ), элюируя гексаном-этилацетатом (2:1) получают 5-амино-1- (2, 6-дихлор-4-трифторметилфенил)-4-метил-3-трифторметилпиразол (2,0 г) из толуол-гексана, т.пл. 97-100оС, в белых кристаллов. Данные соединений приведены в табл.5.
Результаты дополнительных экспериментов по определению пестицидных свойств.
Методы испытаний.
Предназначенные для испытания соединения разводили один или несколько раз в 50%-ном водном растворе ацетона.
а) Испытуемые виды: Plutella xylostella (моль капустная) и Phaedon cochieapriae (листоед распосый).
Диски листьев рапса помещали на агар в чашки Петри и заражали 10 личинками (2-я возрастная стадия Plutella или 3-я возрастная стадия Phaedon). В каждом испытании использовали четыре одинаковые чашки, которые опрыскивали под башенным аппаратом с распылителем соответствующим испытуемым раствором. Через четыре или пять дней после обработки чашки удаляли из комнаты с постоянной температурой (25о С), в которой они находились, и определяли средний процент смертности личинок. Эти данные сравнивали с данными смертности для чашек, обработанных 50%-ным водным раствором ацетона, которые служили в качестве контрольных чашек.
б) Megoura viciae (тля горошковая).
Посаженные в горшочки растения фасоли, предварительно зараженные смешанными возрастными стадиями Megoura, опрыскивали до стекания с помощью лабораторного поворотного опрыскивателя. Обработанные растения держали в теплице в течение 2 дней, а затем определяли у них степень смертности тли, сравнивая полученные результаты с подобными показателями у растений, обработанных 50% -ным водным раствором ацетона, которые служили в качестве контрольных растений.
Балл 3 Все тли
мертвы 2 Несколько тлей живы 1 Большая часть
тлей жива 0 Отсутствуют существенные
признаки гибели
в). Испытуемый
вид:
Spodoptera Littoralis.
Диски листьев фасоли обыкновенной помещали на агар в чашки Петри и заражали 5 личинками (2-я возрастная стадия). В каждом испытании использовали четыре одинаковые чашки, которые опрыскивали под башенным аппаратом с распылителем соответствующим испытуемым раствором. Через 2 дня живых личинок переносили в аналогичные чашки, содержащие необработанные листья, помещенные на агар. Через два или три дня эти чашки удаляли из комнаты с постоянной температурой (25оС), в которой они находились, и определяли средний процент смертности личинок. Эти данные сравнивали с процентом смертности личинок в чашках, обработанных 50%-ным водным раствором ацетона, которые служили в качестве контрольных чашек.
Данные, приведенные в табл. 6-8, суммируют результаты, полученные в ряде различных экспериментов.
В соответствии с
указанным способом было установлено, что внесение 500 частей на миллион
следующих
соединений
против личинок Spodoptera Littoralis позволило
получить следующий процент смертности: Соединение
смертности
50 5
56 7
59 5
62 18
84
98
Следующие испытания были проведены в отношении
Sitophilus granarius и Blatella germanica в соответствии с
приводимым ниже описанием.
Sitophilus qranarius.
Эти соединения растворяли в ацетоне с образованием раствора, имеющего необходимую концентрацию. 1,5 мл этого раствора носили пипеткой на 15 г зерен, которые затем оставляли для сушки. Эти зерна затем переносили в пробирки и заражали 20 взрослыми особями. Смертность определяли через 1 или 2 недели. Приведенные концентрации относятся к конечному уровню соединения в зерне (процентное соотношение).
В соответствии с указанным методом было установлено, что следующие соединения оказались эффективными против взрослых особей Sitophilujs granarius, позволив достичь 70% смертности при концентрации 200 частей на миллион.
Соединения 1 2 5 7 12 13 14 17 19 20 21 22 25 28 29
35 36 37 41 48 53 57 71 72 73 74 75 77 78 79 80 83 94 95
104 108 109 111
113
118 120
Blatella germanica
Эти
соединения растворяли в целлосольве или бутаноле с образованием раствора,
имеющего требуемую концентрацию. Восприимчивых самцов
тараканов
обрабатывали
0,5 мкл этого раствора, нанося его на брюшко
около третьей пары лапок. Тараканы получали пищу и воду в течение шести дней,
после чего определяли процент смертности.
В соответствии с указанным методом было установлено, что соединения 16, 26 и 92 оказались эффективными против Blatella germanica, позволив достичь 100% смертности при концентрации 250 частей на миллион.
Реферат
Изобретение относится к соединениям с антипаразитарной активностью в отношении членистоногих, растительных нематод и червеобразных паразитов. Сущность изобретения: соединения формулы I



Формула
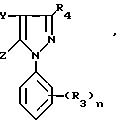
где Y-циано- или нитрогруппа, С1 С4-алкил с прямой или разветвленной цепью, незамещенный или замещенный одним или несколькими атомами галоида, группа RSO2, RSO или RS, где R С1 С4-алкил с прямой или разветвленной цепью, незамещенный или замещенный одним или несколькими галоидами, или алкоксикарбонильная группа с прямой или разветвленной цепью с 2 7 атомами углерода;
Z С1 С4-алкил с прямой или разветвленной цепью, или группа -NR1R2, где R1 и R2 одинаковые или различные и являются водородом или группой R5CO-, где R5 алкил или алкоксил с прямой или разветвленной цепью с 1 6 атомами углерода, возможно замещенный галоидом или С3 С6-циклоалкил, или NR1R2-сукцинимидогруппа или группа, где один или оба заместителя из числа R1 и R2 являются С1 С4-алкилом с прямой или разветвленной цепью, которые необязательно могут быть замещены алкоксикарбонилом с прямой или разветвленной цепью с 2 5 атомами углерода, или один из заместителей из числа R1 и R2 являются С3 - С6-циклоалкилом, а другой водородом;
R3 галоген, алкил или алкоксил с прямой или разветвленной цепью с 1 4 атомами углерода, незамещенные или замещенные одним или несколькими галоидами, С1 С4-алкил тио- или алкилсульфинильная группа, незамещенная или замещенная одним или более галоидами, нитро- или цианогруппа, или С1 С4 алкилсульфонильная группа с прямой или разветвленной цепью, незамещенной или замещенной одним или несколькими галоидами;
R4 фтор, хлор, бром или R4 цианогруппа, когда Y является цианогруппой, а Z незамещенная аминогруппа;
N 1 5,
отличающийся тем, что соединение общей формулы II

где R3 и n имеют указанные значения,
или его кислотно-аддитивную соль подвергают взаимодействию с соединением общей формулы III

где Y и R4 имеют указанные значения;
R6 цианогруппа или С2 С5-алканоил с прямой или разветвленной цепью;
R8 С1 С4-алкоксил с прямой или разветвленной цепью, гидроксил, фтор, хлор или бром для получения соединения I, где R4 имеет указанные значения или R4 R6 R8 Y цианогруппа, для получения соединения I, где R4 и Y цианогруппа и Z незамещенная аминогруппа с необязательным выделением промежуточного соединения общей формулы IV

где R3, R4, R6, Y и n имеют указанные значения,
и циклизацией в соединение I, и необязательно для получения соединения I, где Z группа NR1R2, где R1 является группой R5CO, где R5 имеет указанные значения, R2 водород или группа R5CO-, идентичная группе R1CO для R1, или ацилируют соединение I, где Z незамещенная аминогруппа, или его соль с щелочным металлом, галоидангидридом общей формулы R5COX, где R5 имеет указанные значения, а Х хлор или бром, необязательно, для получения соединения I, где Z группа NR1R2 сукцинимидогруппа, ацилируют сукцинилдигалогенидом, или для получения соединения I, где в группе NR1R2R1 или R2 или R1 и R2 являются С1 С6 -алкилом с прямой или разветвленной цепью, необязательно замещенной алкоксикарбонильной группой с 2 6 атомами углерода с прямой или разветвленной цепью, или С3 С6-циклоалкил, причем группы R1 и R2 являются идентичными, или соединение I, где Z - незамещенная аминогруппа, или его соль с щелочным металлом алкилируют соединением общей формулы R13X1, где R13 - С1 С6-алкил с прямой или разветвленной цепью, необязательно замещенный алкоксикарбонильной группой с прямой или разветвленной цепью с 2 - 5 атомами углерода, или С3 С6-циклоалкил, X1 хлор, бром или йод.

Комментарии