Промежуточные продукты для получения пиридазиноновых гербицидов и способ их получения - RU2743561C2
Код документа: RU2743561C2
Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к получению некоторых пиридазинонов, применимых в качестве гербицидов, и к способам их получения.
УРОВЕНЬ ТЕХНИКИ
Настоящее изобретение относится к способу получения некоторых пиридазиноновых гербицидов формулы 1, новым промежуточным продуктам, пригодным для их получения, и новому способу получения этих промежуточных продуктов.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способу получения соединения формулы 1
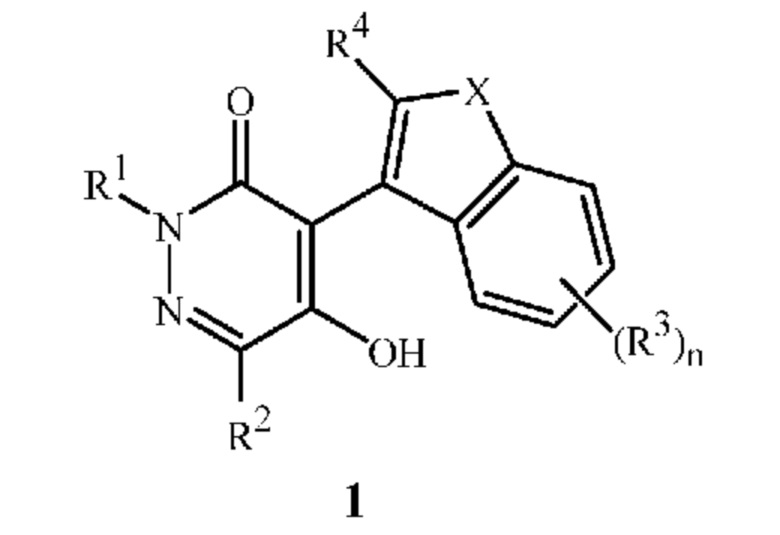
в которой
R1 означает H, C1-C7 алкил, C3-C8 алкоксикарбонилалкил, C4-C7 алкилциклоалкил, C3-C7 алкенил, C3-C7 алкинил, C3-C7 циклоалкил, C4-C7 циклоалкилалкил, C2-C3 цианоалкил, C1-C4 нитроалкил, C1-C7 галогеналкил, C3-C7 галогеналкенил, C2-C7 алкоксиалкил или C3-C7 алкилтиоалкил;
R2 означает C1-C7 алкил, C3-C8 алкилкарбонилалкил, C3-C8 алкоксикарбонилалкил, C4-C7 алкилциклоалкил, C3-C7 алкенил, C3-C7 алкинил, C3-C7 циклоалкил, C4-C7 циклоалкилалкил, C2-C3 цианоалкил, C1-C4 нитроалкил, C2-C7 галогеналкоксиалкил, C1-C7 галогеналкил, C3-C7 галогеналкенил, C2-C7 алкоксиалкил или C2-C3 алкоксикарбонил; или фенил, необязательно замещенный галогеном, C1-C4 алкилом или C1-C4 галогеналкилом;
X означает O или S; или
X означает -C(R6)=C(R7)-, где атом углерода, связанный с R6, также связан с атомом углерода, связанным с R4, и атом углерода, связанный с R7, также связан с фрагментом фенильного кольца в формуле 1;
каждый R3 независимо означает галоген, -CN, нитрогруппу, C1-C5 алкил, C2-C5 алкенил, C2-C5 алкинил, C3-C5 циклоалкил, C4-C5 циклоалкилалкил, C1-C5 галогеналкил, C3-C5 галогеналкенил, C3-C5 галогеналкинил, C2-C5 алкоксиалкил, C1-C5 алкоксигруппу, C1-C5 галогеналкоксигруппу, C1-C5 алкилтиогруппу, C1-C5 галогеналкилтиогруппу или C2-C5 алкоксикарбонил;
n равно 0, 1, 2 или 3; и
R4, R6 и R7 независимо означают H, галоген, нитрогруппу, -CN, C1-C5 алкил, C2-C5 алкенил, C2-C5 алкинил, C3-C5 циклоалкил, C4-C5 циклоалкилалкил, C1-C5 галогеналкил, C3-C5 галогеналкенил, C3-C5 галогеналкинил, C2-C5 алкоксиалкил, C1-C5 алкоксигруппу, C1-C5 галогеналкоксигруппу, C1-C5 алкилтиогруппу, C1-C4 алкилсульфинил, C1-C4 алкилсульфонил, C1-C5 галогеналкилтиогруппу или C2-C5 алкоксикарбонил;
включающему гидролиз гербицидного промежуточного соединения формулы 2
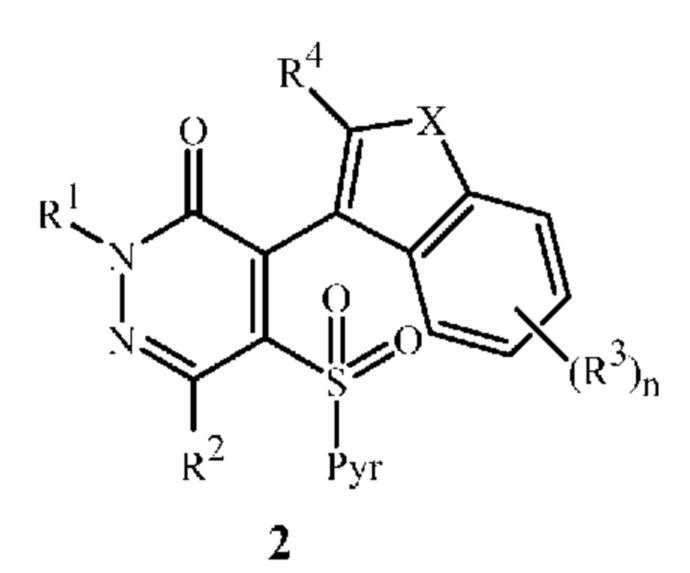
в которой
R1, R2, R3, n, R4, X, R6 и R7 являются такими, как определено для формулы 1 выше; и
Pyr означает пиридиновое кольцо, необязательно замещенное галогеном или C1-C4 алкилом.
Настоящее изобретение также относится к гербицидному промежуточному соединению формулы 2

в которой
R1 означает H, C1-C7 алкил, C3-C8 алкоксикарбонилалкил, C4-C7 алкилциклоалкил, C3-C7 алкенил, C3-C7 алкинил, C3-C7 циклоалкил, C4-C7 циклоалкилалкил, C2-C3 цианоалкил, C1-C4 нитроалкил, C1-C7 галогеналкил, C3-C7 галогеналкенил, C2-C7 алкоксиалкил или C3-C7 алкилтиоалкил;
R2 означает C1-C7 алкил, C3-C8 алкилкарбонилалкил, C3-C8 алкоксикарбонилалкил, C4-C7 алкилциклоалкил, C3-C7 алкенил, C3-C7 алкинил, C3-C7 циклоалкил, C4-C7 циклоалкилалкил, C2-C3 цианоалкил, C1-C4 нитроалкил, C2-C7 галогеналкоксиалкил, C1-C7 галогеналкил, C3-C7 галогеналкенил, C2-C7 алкоксиалкил или C2-C3 алкоксикарбонил; или фенил, необязательно замещенный галогеном, C1-C4 алкилом или C1-C4 галогеналкилом;
X означает O или S; или
X означает -C(R6)=C(R7)-, где атом углерода, связанный с R6, также связан с атомом углерода, связанным с R4, и атом углерода, связанный с R7, также связан с фрагментом фенильного кольца в формуле 2;
каждый R3 независимо означает галоген, -CN, нитрогруппу, C1-C5 алкил, C2-C5 алкенил, C2-C5 алкинил, C3-C5 циклоалкил, C4-C5 циклоалкилалкил, C1-C5 галогеналкил, C3-C5 галогеналкенил, C3-C5 галогеналкинил, C2-C5 алкоксиалкил, C1-C5 алкоксигруппу, C1-C5 галогеналкоксигруппу, C1-C5 алкилтиогруппу, C1-C5 галогеналкилтиогруппу или C2-C5 алкоксикарбонил;
n равно 0, 1, 2 или 3;
R4, R6 и R7 независимо означают H, галоген, нитрогруппу, -CN, C1-C5 алкил, C2-C5 алкенил, C2-C5 алкинил, C3-C5 циклоалкил, C4-C5 циклоалкилалкил, C1-C5 галогеналкил, C3-C5 галогеналкенил, C3-C5 галогеналкинил, C2-C5 алкоксиалкил, C1-C5 алкоксигруппу, C1-C5 галогеналкоксигруппу, C1-C5 алкилтиогруппу, C1-C4 алкилсульфинил, C1-C4 алкилсульфонил, C1-C5 галогеналкилтиогруппу или C2-C5 алкоксикарбонил; и
Pyr означает пиридиновое кольцо, необязательно замещенное галогеном или C1-C4 алкилом.
Настоящее изобретение также относится к способу получения гербицидного промежуточного соединения формулы 2,
включающему циклизацию продукта реакции гербицидного промежуточного соединения формулы 4

в которой
R1 означает H, C1-C7 алкил, C3-C8 алкоксикарбонилалкил, C4-C7 алкилциклоалкил, C3-C7 алкенил, C3-C7 алкинил, C3-C7 циклоалкил, C4-C7 циклоалкилалкил, C2-C3 цианоалкил, C1-C4 нитроалкил, C1-C7 галогеналкил, C3-C7 галогеналкенил, C2-C7 алкоксиалкил или C3-C7 алкилтиоалкил;
R2 означает C1-C7 алкил, C3-C8 алкилкарбонилалкил, C3-C8 алкоксикарбонилалкил, C4-C7 алкилциклоалкил, C3-C7 алкенил, C3-C7 алкинил, C3-C7 циклоалкил, C4-C7 циклоалкилалкил, C2-C3 цианоалкил, C1-C4 нитроалкил, C2-C7 галогеналкоксиалкил, C1-C7 галогеналкил, C3-C7 галогеналкенил, C2-C7 алкоксиалкил или C2-C3 алкоксикарбонил; или фенил, необязательно замещенный галогеном, C1-C4 алкилом или C1-C4 галогеналкилом; и
Pyr означает пиридиновое кольцо, необязательно замещенное галогеном или C1-C4 алкилом;
с соединением формулы 3
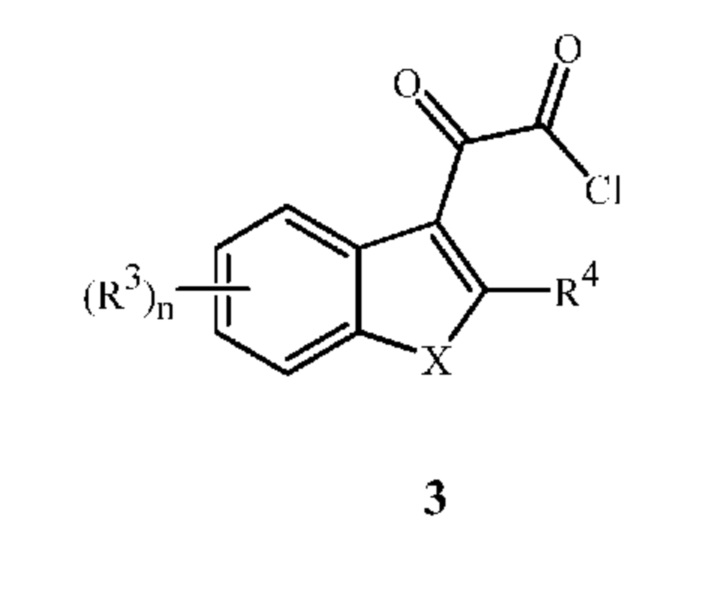
в которой
X означает O или S; или
X означает -C(R6)=C(R7)-, где атом углерода, связанный с R6, также связан с атомом углерода, связанным с R4, и атом углерода, связанный с R7, также связан с фрагментом фенильного кольца в формуле 3;
каждый R3 независимо означает галоген, -CN, нитрогруппу, C1-C5 алкил, C2-C5 алкенил, C2-C5 алкинил, C3-C5 циклоалкил, C4-C5 циклоалкилалкил, C1-C5 галогеналкил, C3-C5 галогеналкенил, C3-C5 галогеналкинил, C2-C5 алкоксиалкил, C1-C5 алкоксигруппу, C1-C5 галогеналкоксигруппу, C1-C5 алкилтиогруппу, C1-C5 галогеналкилтиогруппу или C2-C5 алкоксикарбонил;
n равно 0, 1, 2 или 3; и
R4, R6 и R7 независимо означают H, галоген, нитрогруппу, -CN, C1-C5 алкил, C2-C5 алкенил, C2-C5 алкинил, C3-C5 циклоалкил, C4-C5 циклоалкилалкил, C1-C5 галогеналкил, C3-C5 галогеналкенил, C3-C5 галогеналкинил, C2-C5 алкоксиалкил, C1-C5 алкоксигруппу, C1-C5 галогеналкоксигруппу, C1-C5 алкилтиогруппу, C1-C4 алкилсульфинил, C1-C4 алкилсульфонил, C1-C5 галогеналкилтиогруппу или C2-C5 алкоксикарбонил.
Настоящее изобретение также относится к гербицидному промежуточному соединению формулы 4

в которой
R1 означает H, C1-C7 алкил, C3-C8 алкоксикарбонилалкил, C4-C7 алкилциклоалкил, C3-C7 алкенил, C3-C7 алкинил, C3-C7 циклоалкил, C4-C7 циклоалкилалкил, C2-C3 цианоалкил, C1-C4 нитроалкил, C1-C7 галогеналкил, C3-C7 галогеналкенил, C2-C7 алкоксиалкил или C3-C7 алкилтиоалкил;
R2 означает C1-C7 алкил, C3-C8 алкилкарбонилалкил, C3-C8 алкоксикарбонилалкил, C4-C7 алкилциклоалкил, C3-C7 алкенил, C3-C7 алкинил, C3-C7 циклоалкил, C4-C7 циклоалкилалкил, C2-C3 цианоалкил, C1-C4 нитроалкил, C2-C7 галогеналкоксиалкил, C1-C7 галогеналкил, C3-C7 галогеналкенил, C2-C7 алкоксиалкил или C2-C3 алкоксикарбонил; или фенил, необязательно замещенный галогеном, C1-C4 алкилом или C1-C4 галогеналкилом; и
Pyr означает пиридиновое кольцо, необязательно замещенное галогеном или C1-C4 алкилом.
Настоящее изобретение также относится к способу получения гербицидного промежуточного соединения формулы 4,
включающему взаимодействие соединения формулы 5

в которой
R2 означает C1-C7 алкил, C3-C8 алкилкарбонилалкил, C3-C8 алкоксикарбонилалкил, C4-C7 алкилциклоалкил, C3-C7 алкенил, C3-C7 алкинил, C3-C7 циклоалкил, C4-C7 циклоалкилалкил, C2-C3 цианоалкил, C1-C4 нитроалкил, C2-C7 галогеналкоксиалкил, C1-C7 галогеналкил, C3-C7 галогеналкенил, C2-C7 алкоксиалкил, C2-C3 алкоксикарбонил; или фенил, необязательно замещенный галогеном, C1-C4 алкилом или C1-C4 галогеналкилом; и
Pyr означает пиридиновое кольцо, необязательно замещенное галогеном или C1-C4 алкилом;
с гидразином формулы 6
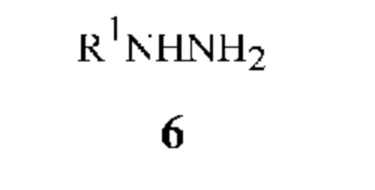
в которой
R1 означает H, C1-C7 алкил, C3-C8 алкоксикарбонилалкил, C4-C7 алкилциклоалкил, C3-C7 алкенил, C3-C7 алкинил, C3-C7 циклоалкил, C4-C7 циклоалкилалкил, C2-C3 цианоалкил, C1-C4 нитроалкил, C1-C7 галогеналкил, C3-C7 галогеналкенил, C2-C7 алкоксиалкил или C3-C7 алкилтиоалкил.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
При использовании в настоящем изобретении термины "содержит", "содержащий", "включает", "включающий", "имеет", "имеющий", "характеризующийся"или любые другие их варианты охватывают неисключительные включения, объект любого ограничения указан явно. Например, композиция, смесь, методика или способ, который включает перечень элементов необязательно ограничивается только этими элементами, а может включать другие элементы, явно не указанные или присущие такой композиции, смеси, методике или способу.
Переходное выражение "состоящий из" исключает любой не указанный элемент, стадию или ингредиент. В утверждении так заканчивается выражение о включении материалов, кроме указанных, за исключением примесей, обычно связанных с ними. Если выражение "состоящий из" содержится в разделе внутри выражения, а не сразу после начала, оно ограничивает только элемент, указанный в этом разделе; другие элементы не исключены из выражения в целом.
Переходное выражение "состоящий в основном из" используется для определения композиции или способа, который включает материалы, стадии, признаки, компоненты или элементы в дополнение к дословно раскрытым при условии, что эти дополнительные материалы, стадии, признаки, компоненты или элементы существенно не влияют на базовую и новую характеристику (характеристики) заявленного изобретения. Термин "состоящий в основном из" обладает промежуточным значением между терминами "включающий" и "состоящий из".
Когда заявители определили изобретение или его часть с помощью допускающего изменения термина, такого как "включающий", следует четко понимать, что (если не указано иное) описание следует понимать, как также описывающее такое изобретение с помощью терминов "состоящий в основном из" или "состоящий из".
Кроме того, если явно не указано иное, "или" означает включающее, а не исключающее "или". Например, условие A или B выполняется в любом из следующих случаев: A означает истинно (или содержится) и B означает ложно (или не содержится), A означает ложно (или не содержится) и B означает истинно (или содержится), и оба A и B означают истинно (или содержатся).
Кроме того, указание элемента или компонента в единственном числе не ограничивает количество случаев (т. е. появления) элемента или компонента. Поэтому указание в единственном числе следует понимать, как включающий один или по меньшей мере один, и указание элемента или компонента в единственном числе также включает множественное число, если количество очевидно не является единичным.
При использовании в настоящем изобретении термин "алкилирование" означает реакцию, в которой нуклеофил замещает отщепляющуюся группу, такую как галогенид или сульфонат в углеродсодержащем радикале. Если не указано иное, термин "алкилирование" не ограничивает углеродсодержащий радикал только алкилом.
В указанных выше случаях термин "алкил" при использовании по отдельности или в названиях соединений, таких как "алкилтиогруппа" или "галогеналкил", включают обладающий линейной или разветвленной цепью алкил, такой как, метил, этил, н-пропил, изопропил, или разные изомеры бутила, пентила или гексила. "Алкенил" включает обладающие линейной или разветвленной цепью алкены, такие как этенил, 1-пропенил, 2-пропенил, и разные изомеры бутенила, пентенила и гексенила. "Алкенил" также включает полиены, такие как 1,2-пропадиенил и 2,4-гексадиенил. "Алкинил" включает обладающие линейной или разветвленной цепью алкины, такие как этинил, 1-пропинил, 2-пропинил и разные изомеры бутинила, пентинила и гексинила. "Алкинил" также может включать фрагменты, содержащие несколько тройных связей, такие как 2,5-гексадиинил.
"Алкоксигруппа" включает, например, метоксигруппу, этоксигруппу, н-пропилоксигруппу, изопропилоксигруппу и разные изомеры бутоксигруппы, пентоксигруппы и гексилоксигруппы. "Алкоксиалкил" означает алкоксигруппу, замещенную алкилом. Примеры "алкоксиалкила" включают CH3OCH2, CH3OCH2CH2, CH3CH2OCH2, CH3CH2CH2CH2OCH2 и CH3CH2OCH2CH2. "Алкоксиалкоксигруппа" означает алкоксигруппу, замещенную алкоксигруппой. "Алкилтиогруппа" включает обладающие линейной или разветвленной цепью алкилтиольные фрагменты, такие как метилтиогруппу, этилтиогруппу, и разные изомеры пропилтиогруппы, бутилтиогруппы, пентилтиогруппы и гексилтиогруппы. "Алкилтиоалкил" означает алкилтиогруппу, замещенную алкилом. Примеры "алкилтиоалкила" включают CH3SCH2, CH3SCH2CH2, CH3CH2SCH2, CH3CH2CH2CH2SCH2 и CH3CH2SCH2CH2. "Цианоалкил" означает алкильную группу, замещенную одной цианогруппой. Примеры "цианоалкила" включают NCCH2 и NCCH2CH2 (альтернативно идентифицировали как CH2CH2CN). "Нитроалкил" означает включают группу, замещенную одной нитрогруппой. Примеры "нитроалкила" включают -CH2NO2 и -CH2CH2NO2.
"Циклоалкил" включает, например, циклопропил, циклобутил, циклопентил и циклогексил. Термин "циклоалкилалкил" означает циклоалкил, замещенный по алкильному фрагменту. Примеры "циклоалкилалкила" включают циклопропилметил, циклопентилэтил и другие циклоалкильные фрагменты, связанные с обладающими линейной или разветвленной цепью алкильными группами.
Термин "галоген" при использовании по отдельности или в названиях соединений, таких как "галогеналкил", или при использовании в описаниях, таких как "алкил, замещенный галогеном", включает фтор, хлор, бром или йод. Кроме того, при использовании в названиях соединений, таких как "галогеналкил", или при использовании в описаниях, таких как "алкил, замещенный галогеном", указанный алкил может быть частично или полностью замещен атомами галогенов, которые могут быть одинаковыми или разными. Примеры "галогеналкила" или "алкила, замещенного галогеном" включают F3C, ClCH2, CF3CH2 и CF3CCl2. Термины "галогеналкоксигруппа", "галогеналкилтиогруппа", "галогеналкенил", "галогеналкинил" и т. п., определены аналогично термину "галогеналкил". Примеры "галогеналкоксигруппы" включают CF3O-, CCl3CH2O-, HCF2CH2CH2O- и CF3CH2O-. Примеры "галогеналкилтиогруппы" включают CCl3S-, CF3S-, CCl3CH2S- и ClCH2CH2CH2S-. Примеры "галогеналкенила" включают (Cl)2C=CHCH2- и CF3CH2CH=CHCH2-. Примеры "галогеналкинила" включают HC≡CCHCl-, CF3C≡C-, CCl3C≡C- и FCH2C≡CCH2-.
"Алкоксикарбонил" означает обладающие линейной или разветвленной цепью алкоксильные фрагменты, связанные с фрагментом C(=O). Примеры "алкоксикарбонила" включают CH3OC(=O)-, CH3CH2OC(=O)-, CH3CH2CH2OC(=O)-, (CH3)2CHOC(=O)- и разные изомеры бутокси- или пентоксикарбонила. "Алкилкарбонилалкил" означает обладающий линейной или разветвленной цепью алкилкарбонильный фрагмент, присоединенный через обладающуь линейной или разветвленной цепью алкильную группу. Примеры "алкилкарбонилалкила" включают CH3C(=O)CH2-, CH3CH2C(=O)CH2-, CH3CH2CH2C(=O)CH2-, (CH3)2CHC(=O)CH2- разные изомеры бутокси- или пентоксикарбонила.
Полное количество атомов углерода в замещающей группе показывает префикс "Ci-Cj", в котором i и j являются числами, равными от 1 до 7. Например, C1-C4 алкилсульфонил означает метилсульфонил - бутилсульфонил; C2 алкоксиалкил означает CH3OCH2-; C3 алкоксиалкил означает, например, CH3CH(OCH3)-, CH3OCH2CH2- или CH3CH2OCH2-; и C4 алкоксиалкил означает разные изомеры алкильной группы, замещенные алкоксигруппой, содержащей всего 4 атома углерода, примеры включают CH3CH2CH2OCH2- и CH3CH2OCH2CH2-.
Если соединение содержит заместитель с нижним индексом, который показывает, что количество указанных заместителей может превышать 1, то указанные заместители (если их количество превышает 1) независимо выбраны из группы определенных заместителей, например, (R3)n, где n равно 1, 2 или 3. Если группа содержит заместитель, которым может быть водород, например, R4, то, если заместителем является водород, считается, что это эквивалентно тому, что указанная группа является незамещенной. Если указана переменная группа, необязательно присоединенная в некотором положении, например, (R3)n, где n может равняться 0, то в этом положении может находиться водород, даже если он не указан в определении переменной группы. Если одно или большее количество положений в группе указаны, как "не замещены" или "незамещенные", то атомы водорода присоединены к любой свободной валентности. Термин "кольцевая система" означает два или большее количество колец или конденсированные кольца.
Соединения, предлагаемые в настоящем изобретении, могут существовать в виде одного или большего количества стереоизомеров. Различные стереоизомеры включают энантиомеры, диастереоизомеры, атропоизомеры и геометрические изомеры. Стереоизомеры являются изомерами одинакового состава, но различаются расположением атомов в пространстве и включают энантиомеры, диастереоизомеры, цис-транс-изомеры (также известные как геометрические изомеры) и атропоизомеры. Атропоизомеры образуются вследствие ограниченного вращения вокруг ординарных связей, когда барьер вращения достаточно высок, чтобы обеспечить выделение изомерных частиц. Специалист в данной области техники должен знать, что один стереоизомер может быть более активным и/или может оказывать благоприятное воздействие при его избытке по сравнению с другим стереоизомером (стереоизомерами) или в случае отделения от другого стереоизомера (стереоизомеров). Кроме того, специалист знает, как разделить, увеличить содержание и/или селективно приготовить указанные стереоизомеры. Соединения, предлагаемые в настоящем изобретении, могут содержаться в виде смеси стереоизомеров, отдельных стереоизомеров или в виде оптически активной формы.
Гербицидные промежуточные соединения формул 2 и 4 обычно существуют более, чем в одной форме и, таким образом включают все кристаллические и некристаллические формы соединений, которые они образуют. Некристаллические формы включают варианты осуществления, которые являются твердыми веществами, такими как воска и камеди, а также варианты осуществления, которые являются жидкостями, такими как растворы и расплавы. Кристаллические формы включают варианты осуществления, которые представляют собой в основном монокристаллический тип, и варианты осуществления, которые представляют собой смесь полиморфных форм (т. е. разных кристаллических типов). Термин "полиморфная форма" означает конкретную кристаллическую форму химического соединения, которые могут кристаллизоваться в разных кристаллических формах, эти формы обладают разным расположением и/или конформациями молекул в кристаллической решетке. Хотя полиморфные формы могут обладать одинаковым химическим составом, они также могут различаться по составу вследствие присутствия или отсутствия совместно закристаллизованной воды или других молекул, которые могут быть слабо или сильно связаны в решетке. Полиморфные формы могут различаться по таким химическим, физическим и биологическим характеристикам, как форма кристалла, плотность, твердость, цвет, химическая стабильность, температура плавления, гигроскопичность, суспендируемость, скорость растворения и биологическая доступность. Специалист в данной области техники должен знать, что полиморфные формы гербицидных промежуточных соединений формулы 2 и 4 могут обладать более благоприятными характеристиками (например, пригодность для получения полезных препаратов, улучшенные биологические характеристики) чем другая полиморфная форма или смесь полиморфных форм того же гербицидного промежуточного соединения формулы 2 или 4. Получение и выделение конкретной полиморфной формы гербицидных промежуточных соединений формулы 2 или 4 можно провести по методикам, известным специалистам в данной области техники, включая, например, кристаллизацию с использованием подобранных растворителей и температур. Подробное обсуждение полиморфизма см. R. Hilfiker, Ed., Polymorphism in the Pharmaceutical Industry, Wiley-VCH, Weinheim, 2006.
Специалист в данной области техники знает, что в условиях проведения способа химические соединения можно выделить в соответствующих их несолевых или солевых формах. Таким образом, самые различные соли соединения формулы 1 можно выделить с использованием предложенного способа или способом в зависимости от основания, используемого в методике получения соединения формулы 1. Аналогичным образом, гербицидное промежуточное соединение формулы 2 можно выделить в солевой или несолевой форме в зависимости от основания, использующегося в методике его получения. Подходящие соли включают соли присоединения с неорганическими или органическими кислотами, такими как бромистоводородная, хлористоводородная, азотная, фосфорная, серная, уксусная, масляная, фумаровая, молочная, малеиновая, малоновая, щавелевая, пропионовая, салициловая, винная, 4-толуолсульфоновавя или валериановая кислоты. Настоящее изобретение включает гербицидные промежуточные соединения формулы 2 и 4 и способы получения соединения формулы 1 и гербицидных промежуточных соединений формул 2 и 4.
Варианты осуществления настоящего изобретения, описанные в Кратком изложении сущности изобретения, включают:
Вариант осуществления A1. Способ получения соединения формулы 1, описанный в Кратком изложении сущности изобретения, в котором гидролиз гербицидного промежуточного соединения формулы 2 проводят в подходящем растворителе и в присутствии подходящего органического или неорганического основания.
Вариант осуществления A2. Способ, соответствующий варианту осуществления A1, в котором гидролиз проводят в растворителе, выбранном из группы, включающей N-метилпирролидинон, H2O, N,N-диметилформамид и диметилсульфоксид, и основание выбрано из группы, включающей гидроксид натрия, гидроксид калия или карбонат калия.
Вариант осуществления A3. Способ, соответствующий варианту осуществления A2, в котором гидролиз проводят в растворителе, выбранном из группы, включающей N-метилпирролидинон и воду, и основанием является неорганическое основание, выбранное из группы, включающей гидроксид натрия или гидроксид калия.
Вариант осуществления A4. Способ, соответствующий варианту осуществления A1, в котором гидролиз проводят в смеси N-метилпирролидинона и H2O и основанием является гидроксид натрия.
Вариант осуществления A5. Способ, соответствующий любому из вариантов осуществления A1 - A4, в котором в соединении формулы 1
R1 означает H, C1-C7 алкил, C3-C8 алкоксикарбонилалкил, C4-C7 алкилциклоалкил, C3-C7 алкенил, C3-C7 алкинил, C3-C7 циклоалкил, C4-C7 циклоалкилалкил, C1-C7 галогеналкил, C2-C7 алкоксиалкил или C3-C7 алкилтиоалкил;
R2 означает C1-C7 алкил, C3-C7 циклоалкил, C4-C7 циклоалкилалкил, C1-C7 галогеналкил или C2-C7 алкоксиалкил;
каждый R3 независимо означает галоген, C1-C5 алкил, C3-C5 циклоалкил, C4-C5 циклоалкилалкил, C1-C5 галогеналкил, C2-C5 алкоксиалкил, C1-C5 алкоксигруппу, C1-C5 галогеналкоксигруппу или C1-C5 алкилтиогруппу;
n равно 0, 1 или 2;
R4, R6 и R7 независимо означают H, галоген, C1-C5 алкил, C3-C5 циклоалкил, C4-C5 циклоалкилалкил, C1-C5 галогеналкил, C2-C5 алкоксиалкил, C1-C5 алкоксигруппу, C1-C5 алкилтиогруппу; и
в котором в соединении формулы 2
R1, R2, R3, n, R4, X, R6 и R7 являются такими, как определено для формулы 1 выше; и
Pyr означает пиридиновое кольцо, необязательно замещенное с помощью F, Cl, Br или CH3.
Вариант осуществления A6. Способ, соответствующий варианту осуществления A5, в котором в соединении формулы 1
R1 означает H, C1-C7 алкил, C3-C7 алкенил, C3-C7 алкинил, C3-C7 циклоалкил или C4-C7 циклоалкилалкил;
R2 означает C1-C7 алкил, C3-C7 циклоалкил, C4-C7 циклоалкилалкил или C2-C7 алкоксиалкил;
X означает S; или
X означает -C(R6)=C(R7)-, где атом углерода, связанный с R6, также связан с атомом углерода, связанным с R4, и атом углерода, связанный с R7, также связан с фрагментом фенильного кольца в формуле 2;
каждый R3 независимо означает галоген, C1-C5 алкил, C3-C5 циклоалкил или C1-C5 алкоксигруппу;
R4, R6 и R7 независимо означают H, галоген, C1-C5 алкил или C1-C5 алкоксигруппу; и
в котором в соединении формулы 2
R1, R2, R3, R4, X, R6 и R7 являются такими, как определено для формулы 1 выше; и
Pyr означает 2-пиридинильное кольцо, необязательно замещенное с помощью F, Cl, Br или CH3.
Вариант осуществления A7. Способ, соответствующий варианту осуществления A6, в котором в соединении формулы 1
R1 означает H или C1-C7 алкил;
R2 означает C1-C7 алкил или C3-C7 циклоалкил;
X означает S;
каждый R3 независимо означает галоген C1-C5 алкил или C1-C5 алкоксигруппу;
R4 означает H, галоген или C1-C5 алкил; и
в котором в соединении формулы 2
R1, R2, R3, R4 и X являются такими, как определено для формулы 1 выше; и
Pyr означает незамещенное 2-пиридинильное кольцо.
Вариант осуществления A8. Способ, соответствующий варианту осуществления A6, в котором в соединении формулы 1
R1 означает H или C1-C7 алкил;
R2 означает C1-C7 алкил или C3-C7 циклоалкил;
X означает -C(R6)=C(R7)-, где атом углерода, связанный с R6, также связан с атомом углерода, связанным с R4, и атом углерода, связанный с R7, также связан с фрагментом фенильного кольца в формуле 2;
каждый R3 независимо означает галоген, C1-C5 алкил или C1-C5 алкоксигруппу;
R4, R6 и R7 независимо означают H, галоген или C1-C5 алкил; и
в котором в соединении формулы 2
R1, R2, R3, R4, X, R6 и R7 являются такими, как определено для формулы 1 выше; и
Pyr означает незамещенное 2-пиридинильное кольцо.
Вариант осуществления A9. Способ, соответствующий любому из вариантов осуществления A1 - A8, в котором
R1 означает H или CH3; и
R2 означает CH3 или c-Pr.
Вариант осуществления A10. Способ, соответствующий варианту осуществления A9, в котором
R1 означает CH3; и
R2 означает CH3.
Вариант осуществления A11. Способ, соответствующий любому из вариантов осуществления A1 - A10, в котором термин "гидролиз" заменен на "удаление защитной группы".
Вариант осуществления B1. Гербицидное промежуточное соединение формулы 2, определенное в Кратком изложении сущности изобретения, в которой
R1 означает H, C1-C7 алкил, C3-C8 алкоксикарбонилалкил, C4-C7 алкилциклоалкил, C3-C7 алкенил, C3-C7 алкинил, C3-C7 циклоалкил, C4-C7 циклоалкилалкил, C1-C7 галогеналкил, C2-C7 алкоксиалкил или C3-C7 алкилтиоалкил;
R2 означает C1-C7 алкил, C3-C7 циклоалкил, C4-C7 циклоалкилалкил, C1-C7 галогеналкил или C2-C7 алкоксиалкил;
каждый R3 независимо означает галоген, C1-C5 алкил, C3-C5 циклоалкил, C4-C5 циклоалкилалкил, C1-C5 галогеналкил, C2-C5 алкоксиалкил, C1-C5 алкоксигруппу, C1-C5 галогеналкоксигруппу или C1-C5 алкилтиогруппу;
n равно 0, 1 или 2;
R4, R6 и R7 независимо означают H, галоген, C1-C5 алкил, C3-C5 циклоалкил, C4-C5 циклоалкилалкил, C1-C5 галогеналкил, C2-C5 алкоксиалкил, C1-C5 алкоксигруппу или C1-C5 алкилтиогруппу; и
Pyr означает пиридиновое кольцо, необязательно замещенное с помощью F, Cl, Br или CH3.
Вариант осуществления B2. Гербицидное промежуточное соединение варианта осуществления B1, в котором
R1 означает H, C1-C7 алкил, C3-C7 алкенил, C3-C7 алкинил, C3-C7 циклоалкил или C4-C7 циклоалкилалкил;
R2 означает C1-C7 алкил, C3-C7 циклоалкил, C4-C7 циклоалкилалкил или C2-C7 алкоксиалкил;
X означает S; или
X означает -C(R6)=C(R7)-, где атом углерода, связанный с R6, также связан с атомом углерода, связанным с R4, и атом углерода, связанный с R7, также связан с фрагментом фенильного кольца в формуле 2;
каждый R3 независимо означает галоген, C1-C5 алкил, C3-C5 циклоалкил или C1-C5 алкоксигруппу;
R4, R6 и R7 независимо означают H, галоген, C1-C5 алкил или C1-C5 алкоксигруппу; и
Pyr означает 2-пиридинильное кольцо, необязательно замещенное с помощью F, Cl, Br или CH3.
Вариант осуществления B3. Гербицидное промежуточное соединение варианта осуществления B2, в котором
R1 означает H или C1-C7 алкил;
R2 означает C1-C7 алкил или C3-C7 циклоалкил;
X означает S;
каждый R3 независимо означает галоген C1-C5 алкил или C1-C5 алкоксигруппу;
R4 означает H, галоген или C1-C5 алкил; и
Pyr означает незамещенное 2-пиридинильное кольцо.
Вариант осуществления B4. Гербицидное промежуточное соединение варианта осуществления B2, в котором
R1 означает H или C1-C7 алкил;
R2 означает C1-C7 алкил или C3-C7 циклоалкил;
X означает -C(R6)=C(R7)-, где атом углерода, связанный с R6, также связан с атомом углерода, связанным с R4, и атом углерода, связанный с R7, также связан с фрагментом фенильного кольца в формуле 2;
каждый R3 независимо означает галоген, C1-C5 алкил или C1-C5 алкоксигруппу;
R4, R6 и R7 независимо означают H, галоген или C1-C5 алкил; и
Pyr означает незамещенное 2-пиридинильное кольцо.
Вариант осуществления B5. Гербицидное промежуточное соединение любого из вариантов осуществления B1 - B4, в котором
R1 означает H или CH3; и
R2 означает CH3 или c-Pr.
Вариант осуществления B6. Гербицидное промежуточное соединение варианта осуществления B5, в котором
R1 означает CH3; и
R2 означает CH3.
Вариант осуществления C1. Способ получения гербицидного промежуточного соединения формулы 2, описанный в Кратком изложении сущности изобретения, в котором циклизацию продукта реакции гербицидного промежуточного соединения формулы 4 с соединением формулы 3 проводят в присутствии подходящего органического или неорганического основания, где в формуле 4
R1 означает H, C1-C7 алкил, C3-C8 алкоксикарбонилалкил, C4-C7 алкилциклоалкил, C3-C7 алкенил, C3-C7 алкинил, C3-C7 циклоалкил, C4-C7 циклоалкилалкил, C1-C7 галогеналкил, C2-C7 алкоксиалкил или C3-C7 алкилтиоалкил;
R2 означает C1-C7 алкил, C3-C7 циклоалкил, C4-C7 циклоалкилалкил, C1-C7 галогеналкил или C2-C7 алкоксиалкил;
и где в соединении формулы 3
каждый R3 независимо означает галоген, C1-C5 алкил, C3-C5 циклоалкил, C4-C5 циклоалкилалкил, C1-C5 галогеналкил, C2-C5 алкоксиалкил, C1-C5 алкоксигруппу, C1-C5 галогеналкоксигруппу или C1-C5 алкилтиогруппу;
n равно 0, 1 или 2; и
R4, R6 и R7 независимо означают H, галоген, C1-C5 алкил, C3-C5 циклоалкил, C4-C5 циклоалкилалкил, C1-C5 галогеналкил, C2-C5 алкоксиалкил, C1-C5 алкоксигруппу или C1-C5 алкилтиогруппу.
Вариант осуществления C2. Способ, соответствующий варианту осуществления C1, в котором циклизацию продукта реакции гербицидного промежуточного соединения формулы 4 с соединением формулы 3 проводят в присутствии подходящего органического основания и в котором в формуле 4
R1 означает H или C1-C7 алкил;
R2 означает C1-C7 алкил или C3-C7 циклоалкил;
и в котором в соединении формулы 3
X означает S; или
X означает -C(R6)=C(R7)-, где атом углерода, связанный с R6, также связан с атомом углерода, связанным с R4, и атом углерода, связанный с R7, также связан с фрагментом фенильного кольца в формуле 3;
каждый R3 независимо означает галоген, C1-C5 алкил, C3-C5 циклоалкил или C1-C5 алкоксигруппу; и
R4, R6 и R7 независимо означают H, галоген, C1-C5 алкил или C1-C5 алкоксигруппу.
Вариант осуществления C3. Способ, соответствующий варианту осуществления C2, в котором циклизацию продукта реакции гербицидного промежуточного соединения формулы 4 с соединением формулы 3 проводят в присутствии подходящего основания, выбранного из группы, включающей триметиламин, триэтиламин и трибутиламин, и в котором в соединении формулы 4
R1 означает H или C1-C7 алкил;
R2 означает C1-C7 алкил или C3-C7 циклоалкил;
и в котором в соединении формулы 3
X означает S;
каждый R3 независимо означает галоген C1-C5 алкил или C1-C5 алкоксигруппу; и
R4 означает H, галоген или C1-C5 алкил.
Вариант осуществления C4. Способ, соответствующий варианту осуществления C2, в котором циклизацию продукта реакции гербицидного промежуточного соединения формулы 4 с соединением формулы 3 проводят в присутствии подходящего основания, выбранного из группы, включающей триметиламин, триэтиламин и трибутиламин, и в котором в соединении формулы 4
R1 означает H или C1-C7 алкил;
R2 означает C1-C7 алкил или C3-C7 циклоалкил;
и в котором в соединении формулы 3
X означает -C(R6)=C(R7)-, где атом углерода, связанный с R6, также связан с атомом углерода, связанным с R4, и атом углерода, связанный с R7, также связан с фрагментом фенильного кольца в формуле 3;
каждый R3 независимо означает галоген, C1-C5 алкил или C1-C5 алкоксигруппу; и
R4, R6 и R7 независимо означают H, галоген или C1-C5 алкил.
Вариант осуществления C5. Способ, соответствующий любому из вариантов осуществления C1 - C4, в котором
R1 означает H или CH3; и
R2 означает CH3 или c-Pr.
Вариант осуществления C6. Способ, соответствующий варианту осуществления C5, в котором
R1 означает CH3; и
R2 означает CH3.
Вариант осуществления C7. Соединение формулы 1, полученное способом, соответствующим любому из вариантов осуществления A1 - A10, с использованием соединения формулы 2, характеризующийся получением соединения формулы 2 способом, соответствующим любому из вариантов осуществления C1 - C6.
Вариант осуществления C8. Соединение формулы 2, полученное способом, соответствующим любому из вариантов осуществления C1 - C6.
Вариант осуществления C9. Способ, соответствующий любому из вариантов осуществления C1 - C8, в котором выражение "циклизацию продукта реакции гербицидного промежуточного соединения формулы 4 с соединением формулы 3" наменяют на "циклизацию гербицидного промежуточного соединения формулы 4 с соединением формулы 3".
Вариант осуществления D1. Гербицидное промежуточное соединение формулы 4, в котором
R1 означает H, C1-C7 алкил, C3-C8 алкоксикарбонилалкил, C4-C7 алкилциклоалкил, C3-C7 алкенил, C3-C7 алкинил, C3-C7 циклоалкил, C4-C7 циклоалкилалкил, C1-C7 галогеналкил, C2-C7 алкоксиалкил или C3-C7 алкилтиоалкил;
R2 означает C1-C7 алкил, C3-C7 циклоалкил, C4-C7 циклоалкилалкил, C1-C7 галогеналкил или C2-C7 алкоксиалкил; и
Pyr означает пиридиновое кольцо, необязательно замещенное с помощью F, Cl, Br или CH3.
Вариант осуществления D2. Гербицидное промежуточное соединение варианта осуществления D1, в котором
R1 означает H, C1-C7 алкил, C3-C7 алкенил, C3-C7 алкинил, C3-C7 циклоалкил или C4-C7 циклоалкилалкил;
R2 означает C1-C7 алкил, C3-C7 циклоалкил, C4-C7 циклоалкилалкил или C2-C7 алкоксиалкил; и
Pyr означает 2-пиридинильное кольцо, необязательно замещенное с помощью F, Cl, Br или CH3.
Вариант осуществления D3. Гербицидное промежуточное соединение варианта осуществления D2, в котором
R1 означает H или C1-C7 алкил;
R2 означает C1-C7 алкил или C3-C7 циклоалкил; и
Pyr означает незамещенное 2-пиридинильное кольцо.
Вариант осуществления D4. Гербицидное промежуточное соединение любого из вариантов осуществления D1 - D3, в котором
R1 означает H или CH3; и
R2 означает CH3 или c-Pr.
Вариант осуществления D5. Гербицидное промежуточное соединение варианта осуществления D4, в котором
R1 означает CH3; и
R2 означает CH3.
Вариант осуществления E1. Способ получения гербицидного промежуточного соединения формулы 4, описанный в Кратком изложении сущности изобретения, в котором в соединении формулы 5
R2 означает C1-C7 алкил, C3-C7 циклоалкил, C4-C7 циклоалкилалкил, C1-C7 галогеналкил или C2-C7 алкоксиалкил;
и в котором в соединении формулы 6
R1 означает H, C1-C7 алкил, C3-C8 алкоксикарбонилалкил, C4-C7 алкилциклоалкил, C3-C7 алкенил, C3-C7 алкинил, C3-C7 циклоалкил, C4-C7 циклоалкилалкил, C1-C7 галогеналкил, C2-C7 алкоксиалкил или C3-C7 алкилтиоалкил.
Вариант осуществления E2. Способ, соответствующий варианту осуществления E1, в котором в соединении формулы 5
R2 означает C1-C7 алкил или C3-C7 циклоалкил;
и в котором в соединении формулы 6
R1 означает H или C1-C7 алкил.
Вариант осуществления E3. Способ, соответствующий варианту осуществления E3, в котором в соединении формулы 5
R2 означает CH3 или c-Pr;
и в котором в соединении формулы 6
R1 означает H или CH3.
Вариант осуществления E4. Способ, соответствующий варианту осуществления E3, в котором в соединении формулы 5
R2 означает CH3;
и в котором в соединении формулы 6
R1 означает CH3.
Вариант осуществления E5. Соединение формулы 2, полученное способом, соответствующим любому из вариантов осуществления C2 - C4, с использованием соединения формулы 4, характеризующийся получением соединения формулы 4 способом, соответствующим любому из вариантов осуществления E1 - E4.
Вариант осуществления E6. Соединение формулы 4, полученное способом, соответствующим любому из вариантов осуществления E1 - E4.
Варианты осуществления настоящего изобретения, включая варианты осуществления A1 - A11, B1 - B6, C1 - C9, D1 - D5 и E1 - E6, приведенные выше, а также любые другие варианты осуществления, описанные в настоящем изобретении, можно объединить любым образом, описание переменных в вариантах осуществления относится не только к соединениям формулы 1, но и к исходным промежуточным соединениям формул 2, 4, 5 и 6, применяющимся для получения соединений формулы 1. Кроме того, варианты осуществления настоящего изобретения, включая варианты осуществления настоящего изобретения A1 - A11, B1 - B6, C1 - C9, D1 - D5 и E1 - E6, приведенные выше, а также любые другие варианты осуществления, описанные в настоящем изобретении, и любая их комбинация относятся к соединениям и способам, предлагаемым в настоящем изобретении.
Соединение формулы 1 можно получить в соответствии с общими методикам, известным в области синтетической органической химии. В данной области техники известны многочисленные методики синтеза для получения ароматических и неароматических гетероциклических колец и кольцевых систем; подробный обзор приведен в 8 томах комплекта Comprehensive Heterocyclic Chemistry, A. R. Katritzky и C. W. Rees editors-in-chief, Pergamon Press, Oxford, 1984 и 12 томах комплекта Comprehensive Heterocyclic Chemistry II, A. R. Katritzky, C. W. Rees and E. F. V. Scriven editors-in-chief, Pergamon Press, Oxford, 1996.
Гидроксипиридазиноны формулы 1 можно получить гидролизом пиридинилсульфонилпиридазинонов формулы 2 (т. е. "гидролиз" или, альтернативно "удаление защитной группы") в щелочной водной среде, как показано на схеме 1. Примеры подходящих оснований ("гидролизующих оснований" или альтернативно "удаляющих защитные группы оснований") включают, но не ограничиваются только ими, гидроксид натрия, гидроксид калия, гидроксиды других щелочноземельных или щелочных металлов и карбонаты щелочного или щелочноземельного металла. Подходящие сорастворители для этой реакции включают, но не ограничиваются только ими, метанол, этанол, изопропанол, ацетон, ацетонитрил, тетрагидрофуран, диоксан, диметилсульфоксид, N,N-диметилформамид или N-метилпирролидинон (или их смеси). Реакцию гидролиза обычно проводят при температуре в диапазоне примерно от 0 до 120 °C. Влияния растворителя, основания, температуры и времени добавления являются взаимозависимыми и выбор условий проведения реакции важен для сведения к минимуму образования побочных продуктов. Катализируемый основанием гидролиз пиридинилсульфонильной группы дает водную смесь, содержащую ионизированную форму полученного гидроксипиридазинона формулы 1. Подкисление подходящей кислотой, такой как хлористоводородная кислота, серная кислота или уксусная кислота, дает свободный гидроксипиридазинон 1, который можно выделить по методикам, известным специалистам в данной области техники, который включают методики осаждения, экстракции, кристаллизации или перегонки. В некоторых случаях может потребоваться очистка с помощью хроматографии.
Схема 1

Пиридинилсульфонилпиридазиноны формулы 2 можно получить циклизацией замещенного арил- или гетероарилоксалилхлорида формулы 3 пиридинилсульфонилметилгидразоном формулы 4 в присутствии подходящего основания и растворителя, как показано на схеме 2. Предпочтительные основания (т. е. "циклизующие основания") включают, но не ограничиваются только ими, триалкиламины (такие как триэтиламин или основание Хюнига), амидиновые основания, такие как 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU), пиридин или карбонат металла. Растворителями для этой реакции циклизации могут быть апротонные или протонные и включают, но не ограничиваются только ими, метанол, этанол, изопропанол, диметоксиэтан, ацетон, ацетонитрил, диоксан, диэтиловый эфир, тетрагидрофуран, диметилсульфоксид, N,N-диметилформамид или N-метилпирролидинон (или их смеси). Реакцию циклизации можно провести в диапазоне температур, обычно от 0°C до температуры кипения растворителя. Реакция циклизации может протекать в безводной среде или в вид водных смесей при условиях проведения реакции Шоттена-Баумана.
Схема 2
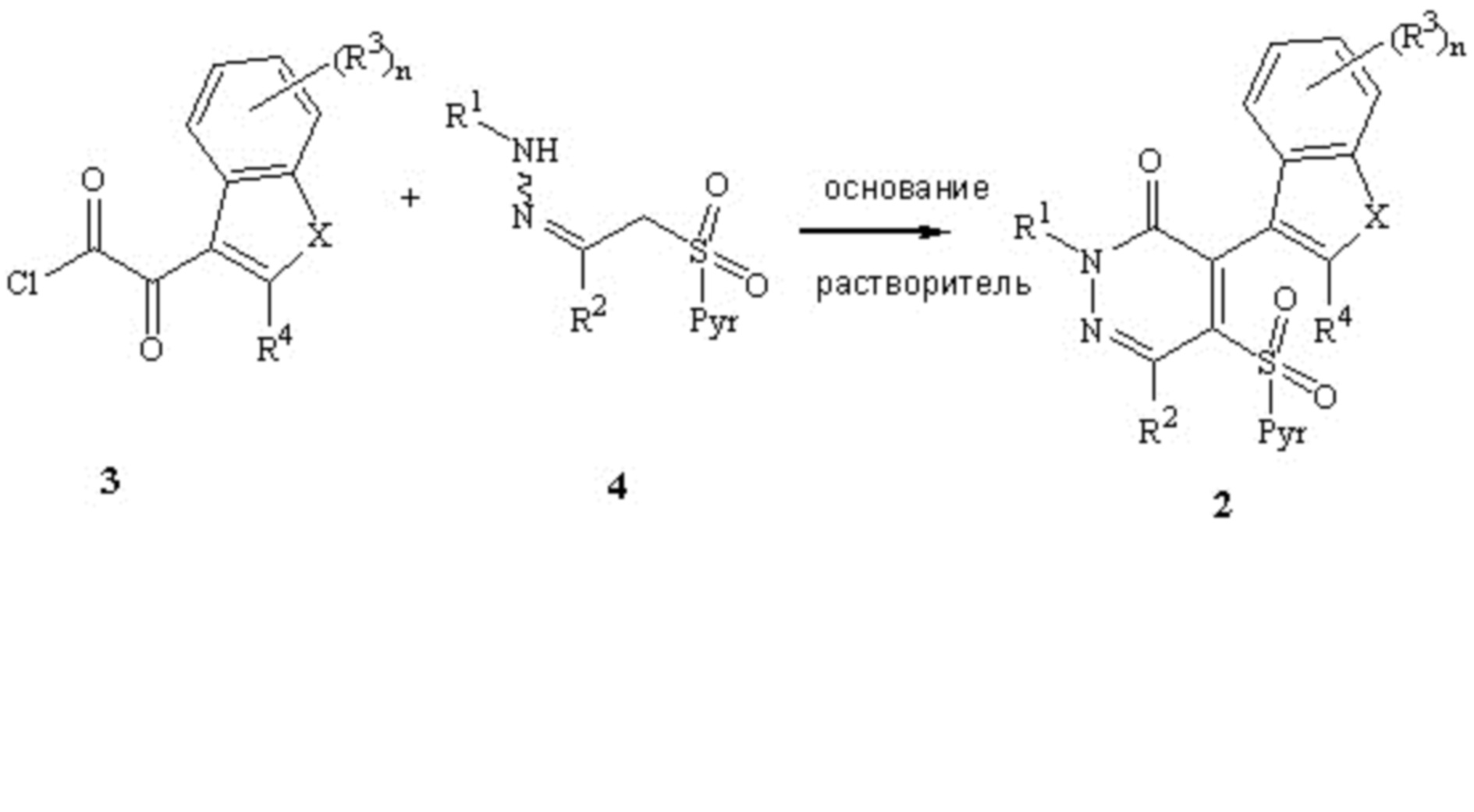
Гербицидное промежуточное соединение (пиридинилсульфонилпиридазиноны) формулы 2 можно получить путем циклизации продукта реакции пиридинилсульфонилметилгидразонового гербицидного промежуточного соединения формулы 4 замещенным арил- или гетероарилоксалилхлоридом формулы 3. При использовании в настоящем изобретении выражение "продукт реакции" означает кетоамид формулы 2A. Соединение формулы 2A можно выделить в качестве промежуточного продукта, но обычно его циклизуют in-situ в присутствии того же циклизующего основания, которое используется для взаимодействия соединения формулы 4 с соединением формулы 3. Как показано на схеме 2A, кетоамид формулы 2A циклизуется в присутствии подходящего основания и растворителя. Предпочтительные основания для циклизации соединения формулы 2A обычно являются такими же, как "циклизующие основания", определенные выше для схемы 2, но также включают гидрид натрия, алкоксиды натрия или алкоксиды других металлов. Подходящие "циклизующие основания" также включают моно-, ди- или триалкиламины, такие как метиламин, диэтиламин или N,N-диизопропилэтиламин.
Схема 2A

Гидразоны формулы 4 можно получить по реакции замещенного гидразина формулы 6 (т. е. R1NHNH2) с пиридинилсульфонилкетоном формулы 5, как показано на схеме 3. Подходящие растворители для этой реакции включают метанол, этанол, изопропанол, диметоксиэтан, ацетон, ацетонитрил, диоксан, диэтиловый эфир, тетрагидрофуран, диметилсульфоксид, N,N-диметилформамид или N-метилпирролидинон (или их смеси). В некоторых случаях можно использовать соль гидразина (т. е. гидрохлорид или сульфат) и эквивалентное или большее количество основания добавляют к реакционной смеси, обеспечивая превращение в свободное основание гидразина in situ. Примеры эффективных оснований, использующихся для получения свободного основания гидразина, включают ацетаты металлов (т. е. ацетат калия или натрия), карбонаты или бикарбонаты металлов (т. е. карбонат калия) и пиридин. Температура этой реакции обычно находится в диапазоне от 0°C до комнатной температуры. Некоторые гидразоны формулы 4 выделяют в виде геометрических изомеров, которые можно использовать на следующей стадии в виде смеси или разделить (с помощью кристаллизации или хроматографии) на син- и анти-изомеры, где любой их них можно использовать в последующей циклизации.
Схема 3

Пиридинилсульфонилкетоны формулы 5 можно получить по методикам, ранее описанным в литературе (Tetrahedron 2010, 66 (48), p 9445-9449; Asian Journal of Organic Chemistry, 2014, 3 (7), p 766-768, и WO 2009106817). Обычно пиридинилмеркаптан формулы Pyr-SH (который может существовать частично или исключительно в виде тиопиридонового таутомера) вводят в реакцию с α-галогенкетоном формулы XCH2COR2, где X означает галоген) в присутствии основания, такого как карбонат калия, гидроксид калия, гидроксид натрия или пиридин, в подходящем растворителе, предпочтительно ацетоне, ацетонитриле, этаноле, диметилсульфоксиде, N,N-диметилформамиде или N-метилпирролидиноне (или их смеси) при температуре в диапазоне от 0°C до 100°C.
Замещенные арил- или гетероарилоксалилхлориды формулы 3 в некоторых случаях можно получить ацилированием по Фриделю-Крафтсу подходящим образом замещенного арила или гетероарила формулы 7 этил- или метилоксалилхлоридом в присутствии кислоты Льюиса, такой как трихлорид алюминия, в хлорированном растворителе (т. е. дихлорметане), толуоле или ксилоле при температуре в диапазоне от 0°C до температуры кипения растворителя. Полученный оксалат формулы 8 затем можно гидролизовать в свободную кислоту или натриевую соль свободной кислоты. Затем полученную свободную кислоту можно превратить в соответствующий хлорангидрид кислоты формулы 3 по реакции с оксалилхлоридом или сульфонилхлоридом в растворителе, таком как толуол, дихлорметан или дихлорэтан. Некоторые литературные ссылки по получению арилоксалилхлоридов включают: WO 2015035051; Tetrahedron 2015, 71 (35), p 5776-5780; J.A.C.S. 2015, 137 (14), p 4626-4629 и WO 2012033225. Альтернативно, оксалаты формулы 8 можно получить из замещенных бромарилов и бромгетероарилов формулы 9 путем проводимого сначала образования реагента Гриньяра по реакции с магнием в растворителе, таком как тетрагидрофуран, с последующим добавлением этил- или метилоксалата (CO2Et2 или CO2Me2) [см. WO 2012033225 и Chem. Comm. 2014, 50 (100), p 15987-15990.
Схема 4

Соединения формулы 3 можно получить гидролизом эфира в карбоновую кислоту с последующей обработкой оксалилхлоридом, как показано на схеме 5, и получить ацилхлориды формулы 3. Соединения формулы 8 имеются в продаже или их можно получить по методикам, известным в данной области техники.
Схема 5

Известно, что некоторые реагенты и условия проведения реакции, описанные выше для получения соединений формул 1, 2 и 4 с использованием описанных методик, могут не быть совместимыми с некоторыми функциональными группами, содержащимися в промежуточных продуктах. В этих случаях последовательности введения/удаления защитных групп или взаимопревращения функциональных групп при синтезе способствует получению искомых продуктов. Применение и выбор защитных групп очевидны для специалиста в химическом синтезе (см., например, Greene, T. W.; Wuts, P. G. M. Protective Groups in Organic Synthesis, 2nd ed.; Wiley: New York, 1991). Специалист в данной области техники должен знать, что в некоторых случаях после введения данного реагента, как показано на любой отдельной схеме, может быть необходимо проведение дополнительных стандартных стадий синтеза, не описанных подробно в для завершения синтеза соединений формул 1, 2 и 4. Специалист в данной области техники также должен знать, что может быть необходимо проведение комбинаций стадий, представленных на приведенных выше схемах, в порядке, отличающемся от представленного для получения соединений формул 1, 2 и 4. Специалист в данной области техники также должен знать, что соединения формулы 1 2 и 4 и промежуточные продукты, описанные в настоящем изобретении, можно ввести в различные реакции - электрофильные, нуклеофильные, радикальные, металлоорганические, окисления и восстановления для добавления заместителей или изменения имеющихся заместителей.
Последующие неограничивающие примеры являются иллюстрацией предложенных способов получения соединений формулы 1, 2 и 4 и получения промежуточных продуктов формул 2 и 4. Все спектры ЯМР сняты в CDCl3 в слабопольном направлении от тетраметилсилана при 500 МГц, если не указано иное.
ПРИМЕР СИНТЕЗА 1
Получение 4-(4-фтор-1-нафталинил)-5-гидрокси-2,6-диметил-3(2H)-пиридазинона
Стадия A: Получение 1-(2-пиридинилсульфонил)-2-пропанона
1-(2-Пиридинилтио)-2-пропанон (например, Bradsher, C.K and Lohr D.F., J. Het. Chem. 1966, 3, 27-32) (9,26 г, 55,44 ммоля) растворяли в растворителе - смеси воды (150 мл) тетрагидрофурана (150 мл) и метанола (150 мл) и добавляли Оксон® (моноперсульфат калия) (66 г, 292 ммоля). Двухфазную реакционную смесь перемешивали при комнатной температуре в течение 24 ч. Реакционную смесь концентрировали до 1/3 объема и экстрагировали этилацетатом (3×50 мл). Органический слой промывали водой (2×20 мл) и рассолом (30 мл). Органический слой собирали, сушили над MgSO4 и концентрировали при пониженном давлении и получали искомое соединение в виде коричневого масла (8,00 г).
1H ЯМР δ 8,75 (m, 1H), 8,12 (m, 1H), 8,00 (t, 1H), 7,64 (m, 1H), 4,48 (s, 2H), 2,41 (s, 3H).
Стадия B: Получение 1-(2-пиридинилсульфонил)-2-пропанон 2-метилгидразона (соединение 3)
К раствору 1-(2-пиридинилсульфонил)-2-пропанона (т. е. продукта примера 1, стадия A) (8,00 г, 44,00 ммоля) в хлороформе (30 мл) добавляли сульфат магния (8,00 г, 66,46 ммоля). Смесь перемешивали при комнатной температуре и по каплям за 5 мин добавляли метилгидразин (2,62 мл, 50,00 ммоля). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь фильтровали через целит®, фильтрующее средство диатомовую землю, промывали хлороформом (30 мл). Фильтрат концентрировали при пониженном давлении и получали искомое соединение в виде густого коричневого масла (9,00 г).
1H ЯМР δ 8,82 (m, 1H), 8,00 (m, 1H), 7,92 (t, 1H), 7,62 (m, 1H), 4,82 (bs, 1H), 4,22 (s, 2H), 2,78 (s, 3H), 1,89 (d, 3H). Наличие 28% второго изомера подтверждали с помощью ЯМР.
Стадия C: Получение этилового эфира 4-фтор-α-оксо-1-нафталинуксусной кислоты
Суспензию хлорида алюминия (30,2 г, 226 ммоля) в дихлорметане (200 мл) охлаждали до 0°C. Суспензию перемешивали и по каплям за 30 мин добавляли раствор, содержащий 1-фторнафталин (25,1 г, 172 ммоля) и этилхлороксоацетат (25,2 г, 184 ммоля) в дихлорметане (150 мл) (немного экзотермичная реакция, максимальная температура реакционной смеси равнялась примерно 7°C). Смесь перемешивали в течение 15 мин и перемешивали при комнатной температуре в течение 4 ч. Реакционную смесь медленно добавляли к раствору воды со льдом (300 мл) и 1 н. водному раствору хлористоводородной кислоты (50 мл). Двухфазную смесь перемешивали в течение 30 мин и органический слой выделяли. Органический слой промывали водой (2×25 мл) и рассолом (30 мл), сушили (MgSO4) и концентрировали при пониженном давлении и получали желтое масло (42 г). Это вещество разбавляли гексаном (150 мл) и перемешивали. Полученный осадок собирали фильтрованием, промывали гексаном (15 мл) и сушили и получали искомое соединение в виде почти белого твердого вещества (34 г).
1H ЯМР δ 9,21 (m, 1H), 8,21 (m, 1H), 8,00 (m, 1H), 7,77 (m, 1H), 7,63 (m, 1H) 7,34 (m, 1H), 4,52 (q, 2H), 1,50 (t, 3H).
Стадия D: Получение 4-фтор-α-оксо-1-нафталинуксусной кислоты
Этиловый эфир 4-фтор-α-оксо-1-нафталинуксусной кислоты (т. е. продукт примера 1, стадия C) (21 г, 85 ммоля) растворяли в тетрагидрофуране (35 мл) и добавляли 1 н. водный раствор гидроксида натрия (112 мл, 101 ммоля), реакционную смесь перемешивали в течение 2 ч. Из реакционной смеси осаждался твердый осадок. Смесь разбавляли водой (100 мл). 1 н. Водный раствор хлористоводородной кислоты добавляли до установления pH реакционной смеси, равного 3. Полученные твердые вещества собирали фильтрованием, промывали водой (2×20 мл), гексаном (1×20 мл) и сушили в вакууме и получали искомое соединение в виде белого твердого вещества (15 г).
1H ЯМР δ 9,21 (m, 1H), 8,21 (m, 1H), 8,00 (m, 1H), 7,77 (m, 1H), 7,63 (m, 1H), 7,34 (m, 1H).
Стадия E: Получение 4-фтор-α-оксо-1-нафталинацетилхлорида
4-Фтор-α-оксо-1-нафталинуксусную кислоту (т. е. продукт примера 1, стадия D) (2,18 г, 10 ммоля) суспендировали в дихлорметане (20 мл) и одной порцией добавляли оксалилхлорид (3,81 г, 30 ммоля), затем 3 капли N,N-диметилформамида и реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь концентрировали при пониженном давлении и получали искомое соединение в виде желтого твердого вещества (2,4 г).
1H ЯМР δ 9,21 (m, 1H), 8,21 (m, 1H), 8,10 (m, 1H), 7,80 (m, 1H), 7,77 (m, 1H), 7,34 (m, 1H).
Стадия F: Получение 4-(4-фтор-1-нафталинил)-2,6-диметил-5-(2- пиридинилсульфонил)-3(2H)-пиридазинона (соединение 1)
1-(2-Пиридинилсульфонил)-2-пропанон 2-метилгидразон (т. е. продукт, полученный в примере 1, стадия B) (2,5 г, 11 ммоля) растворяли в дихлорметане (20 мл) и добавляли триэтиламин (2,6 г, 26 ммоля). Реакционную смесь охлаждали до 5°C водой со льдом и суспензию 4-фтор-α-оксо-1-нафталинацетилхлорида (т. е. продукт, полученный в примере 1, стадия E) в дихлорметане (2,4 г, 10 ммоля) добавляли за 5 мин. Реакционную смесь перемешивали при комнатной температуре в течение еще 18 ч. Реакционную смесь разбавляли водой (50 мл) и экстрагировали дихлорметаном (3×30 мл). Органический слой дополнительно промывали водой (2×20 мл) и рассолом (20 мл) и сушили (MgSO4). Органический слой фильтровали и концентрировали при пониженном давлении и получали твердый продукт. Твердый продукт суспендировали в смеси дихлорметан:диэтиловый эфир (2:8) (30 мл) и полученные твердые вещества собирали, сушили в вакууме и получали искомое соединение в виде светло-желтого твердого вещества (2,2 г).
1H ЯМР δ 8,21 (m, 1H), 7,91 (m, 1H), 7,42 (m, 1H), 7,30 (m, 1H), 7,23 (m, 2H), 7,12 (m, 3H), 6,8 (m, 1H), 3,84 (s, 3H), 2,88 (s, 3H).
Стадия G: Получение 4-(4-фтор-1-нафталинил)-5-гидрокси-2,6-диметил-3(2H)-пиридазинона
4-(4-Фтор-1-нафталинил)-2,6-диметил-5-(2- пиридинилсульфонил)-3(2H)-пиридазинон (т. е. продукт, полученный в примере 1, стадия F) (0,41 г, 1 ммоля) растворяли в 1,4-диоксане (5 мл) и добавляли гидроксид натрия (0,100 г, 2,5 ммоля), затем воду (0,5 мл) и реакционную смесь нагревали при 90°C в течение 1 ч. Реакционную смесь концентрировали при пониженном давлении и оставшиеся твердые вещества суспендировали в воде (5 мл). Смесь подкисляли до pH=3 путем добавления 1 н. водного раствора хлористоводородной кислоты. Полученные твердые вещества перемешивали при комнатной температуре в течение 15 мин и собирали фильтрованием, промывали водой (2×5 мл), гексаном (2×5 мл) и сушили в вакууме и получали искомое соединение в виде почти белого твердого вещества (0,265 г).
1H ЯМР (dmso-d6) δ 10,21 (bs, 1H), 8,15 (d, 1H), 7,70 (m, 1H), 7,55 (m, 2H), 7,40 (m, 1H), 7,30 (m, 1H).
ПРИМЕР СИНТЕЗА 2
Получение 4-(2,5-диметилбензо[b]тиен-3-ил)-5-гидрокси-2,6-диметил-3(2H)-пиридазинона
Стадия A: Получение 1-[(2-хлор-2-пропен-1-ил)тио]-4-метилбензола
2,3-Дихлор-1-пропен (20,5 г, 185 ммоля) добавляли к раствору 4-метилбензолтиола (22,0 г, 177 ммоля) в ацетоне (150 мл). Смесь охлаждали до 12°C и по каплям в течение 15 мин добавляли раствор карбоната калия (26 г, 188 ммоля) в воде (75 мл). Реакционную смесь перемешивали при 20°C в течение 18 ч. Смесь разбавляли водой (400 мл) и гексаном (500 мл). Смесь экстрагировали и органический слой собирали. Органический слой промывали водой (2×50 мл) и рассолом (50 мл), и концентрировали при пониженном давлении и получали искомое соединение в виде прозрачного оранжевого масла (34,7 г).
1H ЯМР δ 7,29 (m, 2H), 7,24 (m, 2H), 5,23 (m, 2H), 3,66 (m, 2H), 2,32 (s, 3H).
Стадия B: Получение 2,5-диметилбензо[b]тиофена
1-[(2-Хлор-2-пропен-1-ил)тио]-4-метилбензол (т. е. соединение примера 2, стадия A) (34,7 г, 175 ммоля) добавляли к N,N-диметиланилину (200 мл, 947 ммоля) и полученную смесь продували азотом в течение 10 мин. Реакционную смесь медленно нагревали до 195°C в течение 24 ч. Реакционную смесь концентрировали при пониженном давлении для удаления N,N-диметиланилина. Остаток разбавляли гексанами (500 мл) и фильтровали для удаления нерастворимых твердых веществ. Фильтрат промывали 1 н. водным раствором хлористоводородной кислоты (2×50 мл), водой (2×50 мл) и органический слой собирали. Органический слой концентрировали при пониженном давлении и получали масло янтарного цвета (20,95 г). Это вещество дополнительно очищали с помощью колоночной хроматографии на силикагеле при элюировании гексаном и получали искомое соединение в виде кристаллического желтого твердого вещества (17 г).
1H ЯМР δ 7,79 (d, 1H), 7,41 (s, 1H), 7,23 (d, 1H), 6,80 (d, 1H), 2,57 (s, 3H), 2,43 (s, 3H).
Стадия C: Получение этил-2,5-диметил-α-оксобензо[b]тиофен-3-ацетата
В атмосфере азота 2,5-диметилбензо[b]тиофен (т. е. соединение примера 2, стадия B) (23 г, 140 ммоля) растворяли в дихлорметане (280 мл), охлаждали до 0°C и за 2 мин добавляли этилхлороксоацетат (18 мл, 160 ммоля). Реакционную смесь перемешивали и порциями за 1 ч добавляли хлорид алюминия (24 г, 180 ммоля). Реакционную смесь перемешивали при температуре окружающей среды в течение 18 ч. Реакционную смесь выливали в смесь воды со льдом (300 мл) и 1 н. раствора хлористоводородной кислоты (50 мл). Смесь перемешивали в течение 1 ч и органический слой отделяли. Органический слой промывали водой (2×20 мл) и рассолом (20 мл). Органический слой сушили над MgSO4, концентрировали при пониженном давлении и получали искомого соединения в виде масла янтарного цвета (37,6 г).
1H ЯМР δ 8,20 (s, 1H), 7,64 (d, 1H), 7,23 (d, 1H), 4,45 (q, 2H), 2,73 (s, 3H), 2,47 (s, 3H), 1,43 (t, 3H).
Стадия D: Получение 2,5-диметил-α-оксобензо[b]тиофен-3-уксусной кислоты
Этил-2,5-диметил-α-оксобензо[b]тиофен-3-ацетат (т. е. продукт, полученный в примере 2, стадия C) (30,25 г, 115 ммоля) растворяли в тетрагидрофуране и добавляли 1 н. водный раствор гидроксида натрия (150 мл, 150 ммоля). Реакционную смесь нагревали при 68°C в течение 2 ч. Реакционной смеси давали охладиться до комнатной температуры и концентрировали при пониженном давлении и получали твердый остаток. Твердый остаток разбавляли водой (100 мл) и подкисляли до pH=3 6 н. раствором хлористоводородной кислоты, и экстрагировали дихлорметаном (3×50 мл). Органический слой собирали, промывали водой (2×20 мл), рассолом (20 мл), сушили над MgSO4 и фильтровали. Фильтрат концентрировали при пониженном давлении и получали искомое соединение в виде светло-желтого твердого вещества (26 г).
1H ЯМР δ 10,4 (bs, 1H), 8,12 (s, 1H), 7,65 (d, 1H), 7,21 (d, 1H), 2,79 (s, 3H), 2,47 (s, 3H).
Стадия E: Получение 2,5-диметил-α-оксобензо[b]тиофен-3-ацетилхлорида
2,5-Диметил-α-оксобензо[b]тиофен-3-уксусную кислоту (т. е. продукт, полученный в примере 2, стадия D) (12,55 г, и 53,6 ммоля) растворяли в дихлорметан (50 мл) и добавляли 3 капли N,N-диметилформамида. Смесь перемешивали при комнатной температуре и по каплям добавляли оксалилхлорид (13,6 мл, 160 ммоля). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Смесь концентрировали при пониженном давлении и получали искомое соединение в виде светло-желтого твердого вещества (13,56 г).
1H ЯМР δ 8,15 (s, 1H), 7,70 (d, 1H), 7,31 (d, 1H), 2,81 (s, 3H), 2,50 (s, 3H).
Стадия F: Получение 4-(2,5-диметилбензо[b]тиен-3-ил)-2,6-диметил-5-(2-пиридинилсульфонил)-3(2H)-пиридазинона (соединение 2)
1-(2-Пиридинилсульфонил)-2-пропанон 2-метилгидразон (т. е. соединение, полученное в примере 1, стадия B) (2,5 г, 11 ммоля) растворяли в дихлорметане (20 мл) и добавляли триэтиламин (2,6 г, 26 ммоля). Реакционную смесь охлаждали до 5°C водой со льдом и за 5 мин добавляли суспензию 2,5-диметил-a-оксобензо[b]тиофен-3-ацетилхлорида (т. е. продукт, полученный в примере 3, стадия E) (2,53 г, 10 ммоля). Реакционной смеси давали нагреться до комнатной температуры и перемешивали при комнатной температуре в течение еще 18 ч. Реакционную смесь разбавляли водой (50 мл) и экстрагировали дихлорметаном (3×30 мл). Органический слой дополнительно промывали водой (2×20 мл) и рассолом (20 мл) и сушили над MgSO4. Органический слой фильтровали и концентрировали при пониженном давлении и получали твердое вещество. Твердое вещество дополнительно очищали с помощью колоночной хроматографии на силикагеле при элюировании в градиентном режиме этилацетатом в гексанах и получали искомое соединение в виде светло-желтого твердого вещества (3,25 г).
1H ЯМР δ 8,25 (s, 1H), 7,40 (d, 1H), 7,31 (m, 2H), 6,91 (m, 1H), 6,81 (m, 1H), 6,63 (m, 1H), 3,83 (s, 3H), 2,91 (s, 3H), 2,35 (s, 3H), 2,27 (s, 3H).
Стадия G: Получение 4-(2,5-диметилбензо[b]тиен-3-ил)-5-гидрокси-2,6-диметил-3(2H)-пиридазинона
4-(2,5-Диметилбензо[b]тиен-3-ил)-2,6-диметил-5-(2-пиридинилсульфонил)-3(2H)-пиридазинон (т. е. продукт, полученный в примере 2, стадия F) (1,65 г, 3,88 ммоля) растворяли в N-метилпирролидоне, добавляли гидроксид натрия (0,40 г, 10 ммоля), затем воду (1 мл) и реакционную смесь нагревали при 90°C в течение 2 ч. Реакционной смеси давали нагреться до температуры окружающей среды, затем добавляли воду (10 мл) и толуол (15 мл). Смесь переносили в делительную воронку и толуольный слой удаляли. Водный слой подкисляли до pH=3 1 н. водным раствором хлористоводородной кислоты и смесь экстрагировали дихлорметаном (2×20 мл). Органический слой собирали, сушили над MgSO4 и концентрировали при пониженном давлении и получали полужидкий продукт. Это твердое вещество дополнительно очищали с помощью колоночной хроматографии на силикагеле при элюировании в градиентном режиме этилацетатом в гексанах и получали искомое соединение в виде почти белого твердого вещества (0,70 г).
1H ЯМР δ 7,68 (d, 1H), 7,14 (d, 1H), 7,07 (s, 1H), 5,65 (s, 1H), 3,77 (s, 3H), 2,4 (s, 6H), 2,36 (s, 3H).
Примеры промежуточных продуктов подходящих для получения соединений, предлагаемых в настоящем изобретении, и использования в способах приведены в таблицах 1-5. Положение (положения) группы (групп) R3 в таблицах I-1a - I-3d основаны на локальной нумерации, приведенной ниже.

В таблицах использованы указанные ниже аббревиатуры: Me означает метил, Et означает этил, Pr означает пропил и Ph означает фенил.
ТАБЛИЦА 1
X означает S, R1 означает Me, R2 означает Me и Pyr означает 2-пиридинил.
Таблица 2 построена таким же образом с тем отличием, что заголовок строки "X означает S, R1 означает Me и R2 означает Me" заменен на заголовок строки, приведенный ниже в таблице 2 (т. е. "X означает S, R1 означает Me и R2 означает Me".). Поэтому первый элемент в таблице 2 означает соединение формулы 1, в которой X означает S, R1 означает Me, R2 означает Me, (R3)n означает "-" (т. е. n равно 0; нет замещения с помощью R3) и R4 означает H. Таблицы 3-643 построены аналогично.
ТАБЛИЦА 644

Таблица 644 построена таким же образом, как таблица 1, с тем отличием, что структура в таблице 1 заменена на структуру, приведенную выше для таблицы 644.
Таблица 645 - таблица 1288
Таблица 645 построена таким же образом, как таблица 2, с тем отличием, что структура в таблице 2 заменена на структуру, приведенную выше для таблицы 644. Таблицы 646-1288 построены таким же образом, как таблицы 3-644.
ТАБЛИЦА 1289

Pyr означает 2-пиридинил
Настоящее раскрытие также включает соединения, указанные в таблицах 1289A - 1289I, где заголовок строки таблицы 1289 (т. е. Pyr означает 2-пиридинил) заменен на заголовок строки, приведенный ниже для каждой таблицы.
ТАБЛИЦА 1290

X означает S, R1 означает Me и R2 означает Me.
X означает S, R1 означает Me и R2 означает Et.
X означает S, R1 означает Et и R2 означает Me.
X означает S, R1 означает Et и R2 означает Et.
X означает -CH=CH-, R1 означает Me и R2 означает Me.
X означает -CH=CH-, R1 означает Me и R2 означает Et.
X означает -CH=CH-, R1 означает Et и R2 означает Me.
X означает -CH=CH-, R1 означает Et и R2 означает Et.
X означает -CH=CCl-, R1 означает Et и R2 означает Me.
X означает -CH=CCl-, R1 означает Et и R2 означает Et.
X означает -CH=CF-, R1 означает Me и R2 означает Me.
X означает -CH=CF-, R1 означает Me и R2 означает Et.
X означает -CH=CF-, R1 означает Et и R2 означает Me.
X означает -CH=CF-, R1 означает Et и R2 означает Et.
ТАБЛИЦА 1291
Таблица 1291 построена таким же образом, как таблица 1290, с тем отличием, что структура заменена на

ТАБЛИЦА 1292
Таблица 1292 построена таким же образом, как таблица 1291, с тем отличием, что структура заменена на

ТАБЛИЦА 1293

Pyr означает 2-пиридинил
**Данные1H ЯМР см. пример синтеза 1, стадия A.
Настоящее раскрытие также включает соединения, указанные в таблицах 1293A - 1293I, где заголовок строки таблицы 1293 (т. е. Pyr означает 2-пиридинил) заменен на заголовок строки, приведенный ниже для каждой таблицы.
ТАБЛИЦА 1294

Pyr означает 2-пиридил
Настоящее раскрытие также включает соединения, указанные в таблицах 1294A - 1294I, где заголовок строки таблицы 1294 заменен на заголовок строки, приведенный ниже для каждой таблицы.
В таблице индексов использованы указанные ниже аббревиатуры: Me означает метил, после слова "пример" приведен номер, указывающий, в каком примере получено соединение.
ТАБЛИЦА ИНДЕКСОВ A

* Данные1H ЯМР см. в примере синтеза.
ТАБЛИЦА ИНДЕКСОВ B

* Данные1H ЯМР см. в примере синтеза.
Реферат
Изобретение относится к способу получения соединений формулы 1, в которой R1означает H, C1-C7алкил, C3-C7алкенил, C3-C7алкинил, C3-C7циклоалкил или C4-C7циклоалкилалкил; R2означает C1-C7алкил, C3-C7циклоалкил, C4-C7циклоалкилалкил или C2-C7алкоксиалкил; X означает S; или X означает -C(R6)=C(R7)-, где атом углерода, связанный с R6, также связан с атомом углерода, связанным с R4, и атом углерода, связанный с R7, также связан с фрагментом фенильного кольца в формуле 2; каждый R3независимо означает H, галоген, C1-C5алкил, C3-C5циклоалкил или C1-C5алкоксигруппу; n равно 0, 1, 2 или 3. Способ осуществляют путем гидролиза промежуточного соединения формулы 2. Также изобретение относится к промежуточным соединениям формул 2, 4 и способам их получения. Технический результат - получение соединений формулы 1, обладающих гербицидными свойствами. 5 н. и 4 з.п. ф-лы, 10 табл., 2 пр.
Формула









Документы, цитированные в отчёте о поиске
Пиридазиноновое производное и его применение в качестве гербицида

Комментарии