2,6-дизамещенные пиридины или 2,4-дизамещенные пиримидины, способы их получения, гербицидная композиция на их основе и способ борьбы с нежелательной растительностью - RU2134261C1
Код документа: RU2134261C1
Чертежи




Описание
Изобретение относится к некоторым 2,6-дизамещенным пиридинам и 2,4-дизамещенным пиримидинам, способу их получения, к гербицидной композиции на их основе и к способу борьбы с ростом нежелательной растительности.
Пиридины, пиримидины и их производные широко применяются в фармацевтической области, а также в сельском хозяйстве (гербициды, фунгициды, акарициды, противоглистные средства, репелленты для отпугивания птиц), в качестве реагентов, промежуточных соединений и химикатов для полимерной и текстильной промышленности.
Например, 2-арилпиримидины и 2-пиримидинил-6-арилпиридины описаны в качестве фунгицидов (DE 4029654 и JO 2131-480 соответственно). EP 263958 касается имеющих гербицидные свойства 2,6-дифенилпиридинов, а структурно родственные 2,4-дифенилпиримидины, которые, как утверждается, также являются гербицидами, раскрыты в EP 354766 и 425547 соответственно. Другим примером являются 2,6-дифеноксипиридины, которые представлены в EP 572093 как гербициды. В DE 2935578 описано, что 4-фенокси-2-пиразол-1-ил-пиримидины проявляют фунгицидную активность. В работе Huelsen (Diplomarbeit, Konstanz, 1993) описаны четыре различных 2-(1-метил-3-трифторметил-пиразол-5- илокси)-6-фенилпиридина, однако их биологическая активность не раскрывается.
В настоящее время неожиданно обнаружено, что хорошую гербицидную активность проявляют близкие по структуре новые производные пиридина и пиримидина, имеющие как арильные группы, так и арилокси- или гетероарилоксигруппы. Эти соединения неожиданно проявляют отличную активность и хорошую избирательность в отношении культур при до- и послевсходовом нанесении как по отношению к широколиственным, так и к травянистым видам сорняков.
Таким образом, настоящее изобретение относится к 2,6-замещенным пиридинам и 2,4-замещенным пиримидинам общей формулы
I
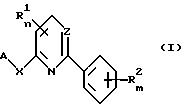
где X - атом кислорода,
Z - NH, CH,
A - фенил, замещенный атомом фтора или трифторметильной группой, пиридил, замещенный атомом хлора, пиразолил, замещенный трифторметильной и метильной группой или метильной и трет-бутильной группой, дифторбензодиоксолил.
каждый из R1, независимо, является группой, выбранной из атома водорода, атома галогена, низшего алкила, низшего алкилтио, низшего алкоксила,
R2 - каждый, независимо,
является группой, выбранной из атома водорода, трифторметила, низшего алкила, трифторметоксила, атома галогена,
m = 1-2,
n = 0-2,
при условии, что, если А представляет
1-метил-3- трифторметилпиразол-5-ильную группу, n = 0, X - атом кислорода,
Z - группа CH, тогда R2 не является водородом, 3-трифторметилом или 2,4-дихлором или 2,4-диметилом.
Предпочтительными соединениями являются замещенные 2-фенил-6-оксипиримидины формулы IA
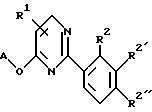
где А представляет 3-трифторметилфенил, 2-хлорпирид-4-ил или 1-метил-3-трифторметилпиразол-5-ил,
R1 имеет значения, указанные выше;
R2, R2' и R2'', независимо, представляют атом водорода, атом фтора, хлора или брома, один или два из них также представляют трифторметил, трифторметокси, R2'', кроме того, может быть C1-C4-алкильной группой, в частности трет-бутильной, за исключением соединений, где А - 1-метил-3-трифторметилпиразол-5-ил, R1 - водород, R2, R2'' - водород, R2' - трифторметил; R2 - водород, R2' = R2'' - хлор или метил; R2, R2', R2'' - водород.
Представительными соединениями являются следующие:
2-(1'-метил-3'-трифторметилпиразол-5'-илокси)-6-(4''- трифторметилфенил)пиридин,
2-(2',
4'-дифторфенил)-6-метил-4-(1''-метил-3''- трифторметилпиразол-5''-илокси)пиримидин,
2-(2',4'-дифторфенил)-6-метил-4-(3''-трифторметилфенокси)пиримидин,
2-(2'-хлорпирид-4'-илокси)-(4''-трифторметилфенил)пиридин,
2-(2'-хлорпирид-4'-илокси)-6-(3''-трифторметилфенил)пиридин,
2-(3'-хлорфенил)-5-метил-4-(1''-метил-3''-трифторметилпиразол-5''- илокси)пиримидин,
2-(3'-хлорфенил)-5-метил-4-(3''-трифторметилфенокси)пиримидин,
2-(4'-фторфенил)-6-метил-4-(3''-трифторметилфенокси)пиримидин,
2-(4'-фторфенил)-4-(1''-метил-3''-трифторметилпиразол-5''-илокси)- 5-метилпиримидин,
2-(4'-фторфенил)-(1''-метил-3''-трифторметилпиразол-5''-илокси)-6- метилпиримидин,
4-(2''-хлорпирид-4''-илокси)-2-(2',4'-дифторфенил)-5- метилпиримидин,
4-(2''-хлорпирид-4''-илокси)-5,6-диметил-2-(4'-трифторметоксифенил)пиримидин,
4-(2''-хлорпирид-4''-илокси)-5,6-диметил-2-(4'-трифторметилфенил)пиримидин,
4-(2''-хлорпирид-4''-илокси)-5-метил-2-(4'-трифторметоксифенил)пиримидин,
4-(2''-хлорпирид-4''-илокси)-5-метил-2-(4'-трифторметилфенил)пиримидин,
4-(2''-хлорпирид-4''-илокси)-6-метил-2-(4'-трифторметоксифенил)пиримидин,
4-(2''-хлорпирид-4''-илокси)-6-метил-2-(4'-трифторметилфенил)пиримидин,
5-этил-6-(4''-трифторметилфенил)-2-(3'-трифторметилфенил)пиридин,
4-метил-6-(4''-трифторметоксифенил)-2-(1'-метил-3'- трифторметилпиразол-5'-илокси)пиридин,
4-метил-6-(4''-трифторметоксифенил)-2-(2'-хлорпирид-4'-илокси)пиридин,
4-метил-6-(4''-трифторметилфенил)-2-(1'-метил-3'- трифторметилпиразол-5'-илокси)пиридин,
4-метил-6-(4''-трифторметилфенил)-2-(2'-хлорпирид-4'-илокси)пиридин,
4-метил-6-(4''-трифторметилфенил)-2-(2''-хлорпирид-4'-илокси)пиридин,
4-метил-6-(4''-фторфенил)-2-(1'-метил-3'-трифторметилпиразол- 5'-илокси)пиридин,
5,6-диметил-2-(4'-трифторметоксифенил)-4-(1''-метил-3''- трифторметилпиразол-5''-илокси)пиримидин,
5,
6-диметил-2-(4'-трифторметоксифенил)-4-(3''-трифторметилфенокси)пиримидин,
5,6-диметил-2-(4'-трифторметилфенил)-4-(3''-трифторметилфенокси)пиримидин,
5,
6-диметил-4-(1''-метил-3''-трифторметилпиразол-5''-илокси)-2- (4'-трифторметилфенил)пиримидин,
5-метил-2-(3'-метилфенил)-4-(1''-метил-3''-трифторметилпиразол- 5''-илокси)пиримидин,
5-метил-2-(3'-метилфенил)-4-(3''-трифторметилфенокси)пиримидин,
5-метил-2-(4'-трифторметоксифенил)-4-(1''-метил-3''- трифторметилпиразол-5''-илокси)пиримидин,
5-метил-2-(4'-трифторметоксифенил)-4-(3''-трифторметилфенокси)пиримидин,
5-метил-2-(4'-трифторметилфенил)-4-(1''-метил-3''- трифторметилпиразол-5''-илокси)пиримидин,
5-метил-4-(3''-трифторметилфенокси)-2-(4'-трифторметилфенил)пиримидин,
6-(4''-фторфенил)-2-(1'-метил-3'-трифторметилпиразол-5'- илокси)пиридин,
6-метил-2-(4'-трифторметоксифенил)-4-(1''-метил-3''- трифторметилпиразол-5''-илокси)пиримидин,
6-метил-2-(4'-трифторметоксифенил)-4-(3''-трифторметилфенокси)пиримидин,
6-метил-4-(3''-трифторметилфенокси)-2-(4'-трифторметилфенил)пиримидин,
6-этил-2-(4'-трифторметилфенил)-4-(1''-метил-3''- трифторметилпиразол-5''-илокси)пиримидин,
6-этил-2-(4'-трифторметилфенил)-4-(3-трифторметилфенокси)пиримидин,
6-этил-2-(4'-трифторметилфенил)-4-(2'-хлорпирид-4'-илокси)пиримидин,
6-метоксиметил-2-(4'-хлорфенил)-4-(1''-метил-3''- трифторметилпиразол-5''-илокси)пиримидин,
4-(3''-трифторметилфенокси)-2-(4'-трифторметилфенил)пиримидин,
4-(1''-метил-3''-трифторметилпиразол-5''-илокси)-2-(4'- трифторметилфенил)пиримидин,
6-хлор-2-(4'-трифторметилфенил)-4-(1''-метил-3''- трифторметилпиразол-5''-илокси)пиримидин,
6-бром-2-(4'-трифторметилфенил)-4-(1''-метил-3''- трифторметилпиразол-5''-илокси)пиримидин,
6-фтор-2-(4'-трифторметилфенил)-4-(1''-метил-3''- трифторметилпиразол-5''-илокси)пиримидин,
6-метокси-2-(4'-трифторметилфенил)-4-(3''-трифторметилфенокси)пиримидин,
6-метокси-2-(4'-трифторметилфенил)-4-(1''-метил-3''- трифторметилпиразол-5''-илокси)пиримидин,
6-метокси-2-(4'-трифторметилфенил)-4-(2'-хлорпирид-4'- илокси)пиримидин,
5-метокси-2-(4'-трифторметилфенил)-4-(3''-трифторметилфенокси)пиримидин,
5-метокси-2-(4'-трифторметилфенил)-4-(1''-метил-3''- трифторметилпиразол-5''-илокси)пиримидин,
5-метокси-2-(4'-трифторметилфенил)-4-(2'-хлорпирид-4'- илокси)пиримидин.
Соединения по изобретению могут быть получены обычными способами.
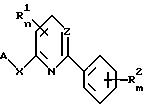
Приемлемым является способ получения 2,6-дизамещенных пиридинов или 2,4-дизамещенных пиримидинов общей формулы I по
п.1, заключающийся в том, что соединение общей формулы III
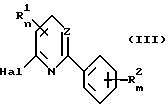
подвергают взаимодействию с соединением общей формулы IV
A-XM
где Z, A, R1, R2, m, n и X определены в п.1;
Hal представляет атом галогена;
M представляет атом металла.
Способ получения соединения общей формулы I, где R1 является низшим алкоксилом или низшим алкилтио, заключается во взаимодействии соединения общей формулы XV
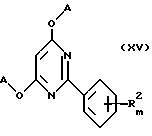
с соединением общей формулы R1-H или его солью с металлом, где A, m и R2 определены в п.1 и R1 указан выше.
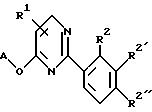
Альтернативно, способ получения замещенных 2-фенил-4,6- диоксипиримидинов формулы XV
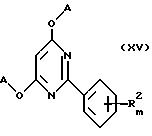
где A, R2 и m указаны в п. 1, заключается в том, что соединение формулы
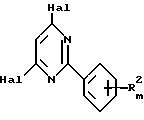
где R2 и m указаны выше, Hal - атом галогена,
подвергают взаимодействию с соединением формулы
A-OM,
где А имеет значения, указанные выше, и М - атом металла.
Предложены также замещенные 2-фенил-4,6-диоксипиримидины общей формулы XV
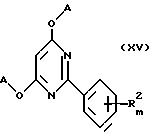
где A, R2 и m определены выше,
в качестве промежуточных соединений для синтеза соединений общей формулы I.
Соединение общей формулы I, если желательно, может быть выделено и очищено с использованием обычных методов.
Предлагаемые соединения в области применяемых доз нетоксичны.
Соединения XV могут быть получены из III, где R1 представляет Hal, Z представляет азот, Hal, R2 и m определены выше, путем взаимодействия с IV, описанным выше, X обозначает кислород, с использованием приблизительно 2 эквивалентов IV.
На практике взаимодействие можно проводить в отсутствие или в присутствии растворителя, который способствует взаимодействию, или по крайней мере не мешает ее протеканию. Предпочтительны полярные, апротонные либо протонные растворители, обычно таковыми являются N,N-диметилформамид или диметилсульфоксид, или сульфолан, или эфир, такой как тетрагидрофуран либо диоксан, или спирты, или вода, или их смеси. Взаимодействие проводят при температуре между комнатной температурой и температурой кипения реакционной смеси, предпочтительно при повышенной температуре, особенно при температуре перегонки.
Соединения формулы III, в которых Z представляет собой C-H-группу и n равно 0, могут быть
получены путем взаимодействия соединений с общей формулой V
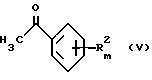
где R2 и m определены выше,
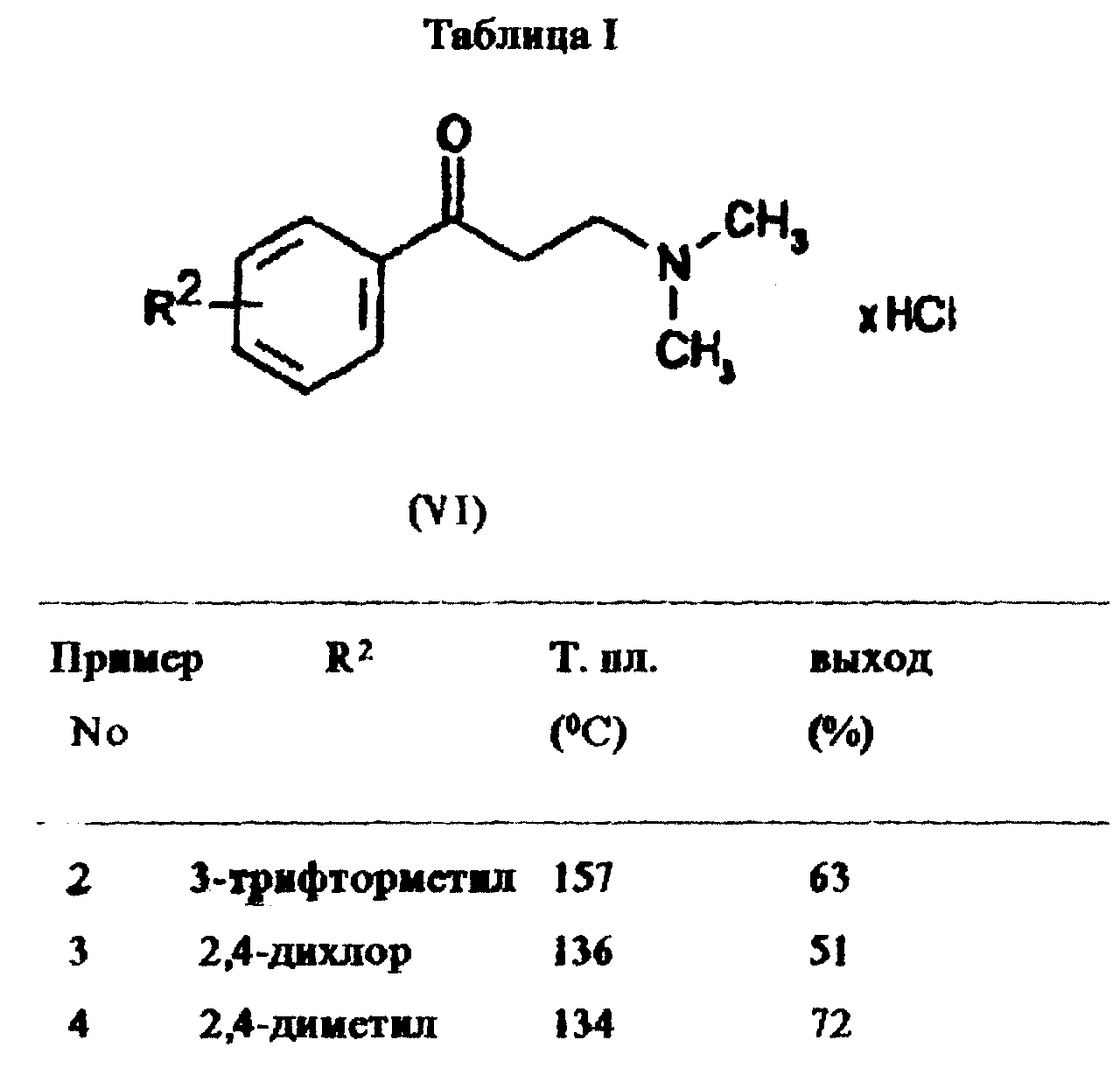
с альдегидом, подходящим является обычно формальдегид, и диалкиламин, подходящим является диметиламин, в соответствии с Org. Synthesis Col. Vol. III. 305f, в растворителе, обычно в спирте, предпочтительно в этаноле, с получением соединения общей формулы VI
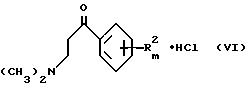
которые, согласно DBP 2147288 (1971), последовательно взаимодействуют с солью аммония, подходящим является ацетат аммония, и соединением общей формулы VII
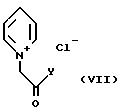
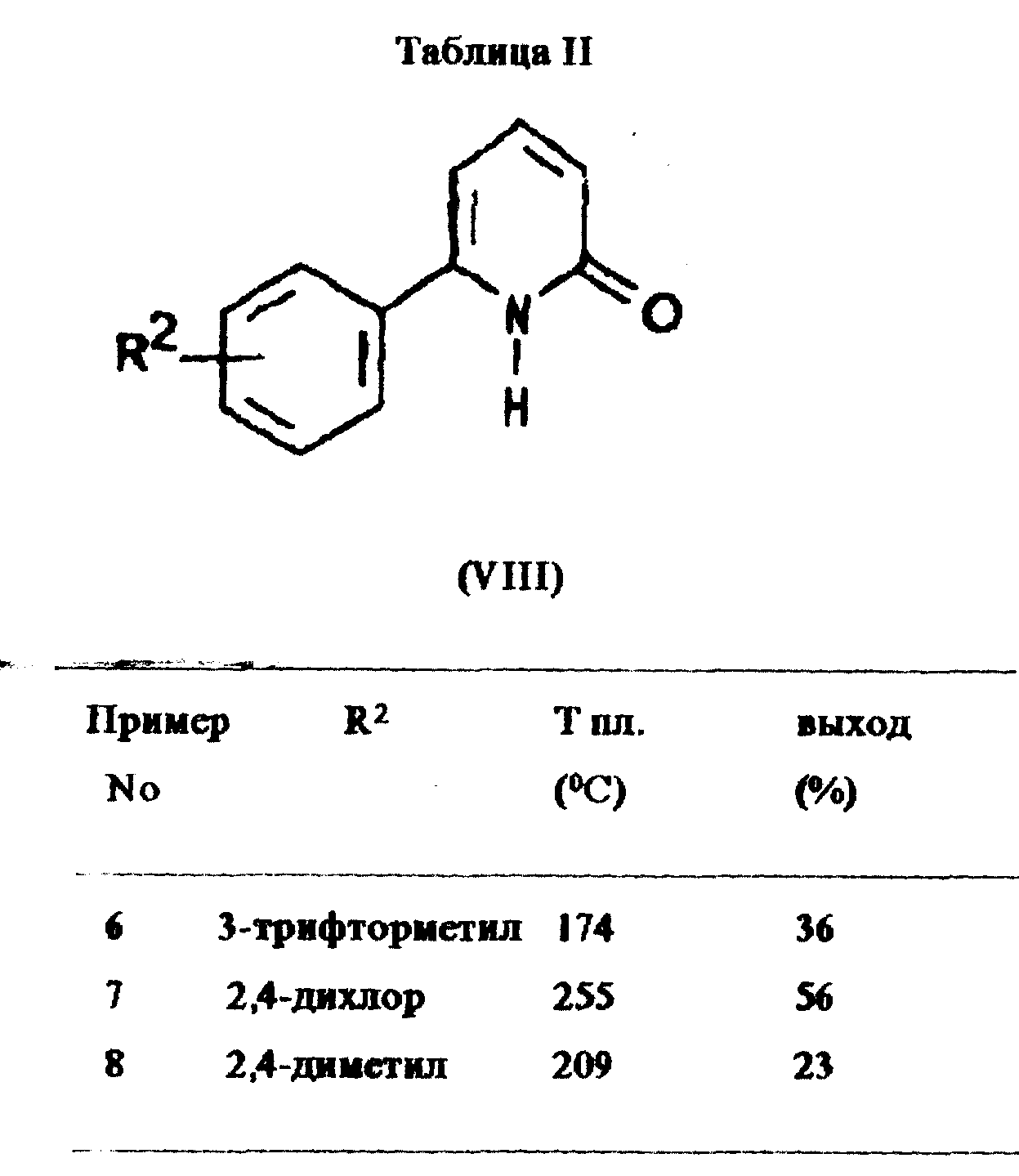
где Y является алкоксигруппой или NH2-группой, предпочтительно этоксигруппой, в растворителе, подходящим является спирт, предпочтительно этанол, с получением соединения общей формулы VIII
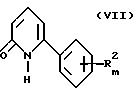
которые далее преобразуют путем взаимодействия VIII с фосфорил-галогенидами (Muller. Е., Chem.Ber. 42, 423 (1909), Katritzky et al., J.Chem.Soc., Perkin Trans. Part 1, 1980, 2743 - 2754), предпочтительно, фосфорилбромидом или фосфорилхлоридом, при повышенных температурах, в идеале при температуре кипения, с получением соединения общей формулы III.
Альтернативный и предпочтительный способ получения
соединений общей формулы III, в которых Z представляет собой C-H- группу, включает взаимодействие 2,6-дигалоидпиридинов общей формулы IX
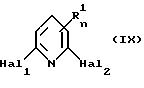
где R1 и n определены выше, и каждый из Hal1 и Hal2, независимо, представляет собой атом галогена,
с металлоорганическим производным бензола общей формулы (X), при приблизительно эквимолярном отношении,
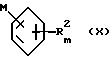
где R2 и m определены выше и M представляет собой атом щелочного металла, или бора, или олова, или магния, или цинка, или меди, необязательно в присутствии катализатора на основе переходных металлов.
Щелочным металлом может быть любой щелочной металл, предпочтительно литий, и реакцию можно проводить в апротонном полярном растворителе, предпочтительно эфире, с получением соединения общей формулы III, особенно как это показано в Cook and Wakcfield, J.Chem.Soc., 1969, 2376, или в неполярных растворителях, или воде, например как описано в Ali, N.M. et al.. Tetrahedron, 1992, 8117.
Соединения формулы III, где Z обозначает CH, Hal обозначает фтор, R1 представляет водород, R2 и m определены выше, могут быть далее превращены в соединения формулы III, в которых n=1, Z обозначает CH, Hal обозначает фтор, R2 и m определены выше и R1 находится в положении 3 и является метилтиогруппой (или другой группой из описанной выше совокупности, которая вводится в виде электрофильного реагента) аналогично методу, описанному в Gingor, Т., Marsais. F. and Queguiner, G.,J. Organometallic Chem., 1981, 139-150.
Способ получения соединений формулы III, в которых Z представляет собой атом азота, включает взаимодействие гидрохлорида бензамидина общей формулы XI
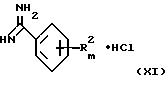
где R2 и m указаны выше,
с соединениями формулы XII или его солью
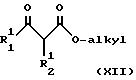
где R11 и R12, независимо, определены выше;
О-алкильная группа обычно представляет собой метокси или этокси,
с получением пиримидинона общей формулы XIII, в которой R1 может также быть гидроксилом
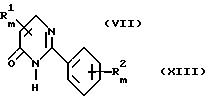
Соединения общей формулы XI известны либо могут быть получены в соответствии с описанными в литературе способами, например в Tetrahedron, 33, 1675f (1979) и J.Org.Chem., 26, 412f (1960).
Взаимодействие соединений с формулами XI и XII может быть проведено в соответствии с Liebigs Ann. 1980, 1392F в органических растворителях, обычно спиртах, предпочтительно в этаноле, и в присутствии основания, обычно алкоксидов металлов, предпочтительно, этоксида натрия.
Соединения формулы XIII могут быть последовательно преобразованы в соединения формулы III, в основном так, как описано в Davies and Pigott, J.Chem. Soc. 1945, 347, путем взаимодействия с фосфорилгалогенидом, или тионилгалогенидом, или фосгеном, предпочтительно с фосфорилхлоридом, фосфорилбромидом, лучше всего в отсутствие растворителя, при повышенных температурах, с получением соединений формулы III.
Соединения формулы III при значениях, указанных выше для R1=F, могут быть получены из соединения III, когда R1 является хлором или амино, в соответствии с известными в литературе способами, подобными описанным в Tullock C. W. et al., J.Am.Chem.Soc. 1960, 5197 или Kiburis J., Klister J., J. Chem.Soc.Chem.Com. 1969, 381.
Соединения общей формулы IV
известны или могут быть получены известными способами. Они могут быть получены и выделены отдельно либо могут быть приготовлены in situ. Обычно соединение общей формулы XIV
A-XH (XIV)
где A и X определены выше,
подвергают взаимодействию с подходящим металлосодержащим основанием, например карбонатом и гидридом металла. Предпочтительной солью металла является соль натрия
или калия.
В настоящем изобретении также предусматривается использование соединения общей формулы I в качестве гербицида. Далее, в соответствии с изобретением предусматривается способ борьбы с ростом нежелательной растительности в каком-либо локусе путем обработки этого локуса композицией по изобретению, или соединением формулы I. Так как полезное воздействие достигается применением опрыскивания листьев, то локус наиболее предпочтительно представляет собой растения, находящиеся на площади роста сельскохозяйственных культур, типичными культурами являются злаки, маис, соевые бобы, подсолнечник или хлопок. Однако для указанных соединений, обладающих довсходовым гербицидным действием, возможно также нанесение на почву. Доза используемого активного ингредиента может, например, находиться в диапазоне от 0,01 до 10 кг/га, предпочтительно от 0,05 до 1 кг/га.
Настоящее изобретение включает также способ получения гербицидной композиции согласно изобретению, который включает смешивание соединения формулы I с по меньшей мере одним носителем.
Предпочтительно в составе должны иметься, по меньшей мере, два носителя, хотя бы один из которых является поверхностно-активным агентом.
Носителем в составах согласно изобретению может являться любое вещество, с которым сочетается активный ингредиент с целью облегчения применения на локусе, который необходимо обработать, которым могут являться растения, семена или почва, либо для того, чтобы облегчить их хранение, транспортировку или обращение с ними. Носитель может быть твердым или жидким, включая вещества, которые обычно находятся в газообразном состоянии, но могут быть сжаты так, что образуется жидкость, а также могут быть использованы любые носители, обычно применяемые при приготовлении гербицидных составов. Предпочтительно композиции по изобретению содержат от 0,5 до 95% по весу активного ингредиента.
Подходящие твердые носители включают натуральные и синтетические глины и силикаты, к примеру натуральные силикаты, такие как диатомовые земли; силикаты магния, например, тальки; силикаты алюминия-магния, например, аттапульгиты и вермикулиты; силикаты алюминия, к примеру, каолиниты, монтмориллониты и слюды; карбонат кальция; сульфат кальция; сульфат аммония; синтетические гидратированные оксиды кремния и синтетические силикаты кальция или алюминия; элементы, например углерод и серу; натуральные и синтетические смолы, например кумароновые смолы, поливинилхлорид и стирольные полимеры и сополимеры; твердые полихлорфенолы; битум; воски; твердые удобрения, например суперфосфаты.
Подходящие жидкие носители включают воду; спирты, например изопропанол и гликоли; кетоны, к примеру ацетон, метилэтилкетон, метилизобутилкетон и циклогексанон; эфиры; ароматические или аралифатические углеводороды, например бензол, толуол и ксилол; фракции нефти, к примеру керосин и легкие минеральные масла; хлорированные углеводороды, например тетрахлоруглерод, перхлороэтилен и трихлорэтан. Часто являются пригодными смеси различных жидкостей.
Сельскохозяйственные композиции часто получают и транспортируют в концентрированной форме, которая впоследствии разбавляется пользователем перед применением. Присутствие малых количеств носителя, который является поверхностно-активным агентом, облегчает этот процесс разбавления. Таким образом, предпочтительно, чтобы по крайней мере один носитель в композиции согласно изобретению являлся поверхностно-активным агентом. К примеру, композиция может содержать не менее двух носителей, по меньшей мере один из которых является поверхностно-активным агентом.
Поверхностно-активный агент может быть эмульгатором, диспергатором или смачивающим агентом; он может быть неионным или ионным. Примеры подходящих поверхностно-активных агентов включают натриевые или кальциевые соли полиакриловых кислот и лигнинсульфоновых кислот; продукты конденсации жирных кислот либо алифатических аминов или амидов, содержащих не менее 12 атомов углерода в молекуле, с этиленоксидом и/или пропиленоксидом; эфиры жирных кислот и глицерина, сорбитола, сахарозы или пентаэритрола; их конденсаты с этиленоксидом и/или пропиленоксидом; продукты конденсации жирных спиртов или алкилфенолов, например п-октилфенола или п-октилкрезола, с этиленоксидом и/или пропиленоксидом; сульфаты или сульфонаты этих продуктов конденсации; соли щелочных или щелочноземельных металлов, предпочтительно соли натрия, и эфиров серной или сульфоновой кислоты, содержащих не менее 10 атомов углерода в молекуле, например лаурилсульфат натрия, вторичные алкилсульфаты натрия, натриевые соли сульфонированного касторового масла, и алкиларилсульфонаты натрия, такие как додецилбензолсульфонат; и полимеры этиленоксида и сополимеры этиленоксида и пропиленоксида.
Гербицидные составы согласно изобретению могут также содержать другие активные ингредиенты, к примеру соединения, обладающие инсектицидными или фунгицидными свойствами, или другие гербициды.
Готовый к использованию состав, содержащий соединения в соответствии с изобретением, может содержать 100 г активного ингредиента (соединение формулы I), 30 г диспергатора, 3 г пеногасителя, 2 г структурного агента, 50 г антифриза (добавки, снижающей температуру замерзания), 0,5 г биоцидного агента и воду до 1000 мл. Перед началом использования состав разводится водой для получения требуемой концентрации активного ингредиента.
Следующие примеры иллюстрируют изобретение. Структура соединений, полученных в следующих примерах, дополнительно подтверждена с помощью ЯМР и масс-спектрометрии.
Примеры
Пример 1:
Гидрохлорид β- диметиламинопропиофенона
Ацетофенон (29,1 мл, 0,25 моль), параформальдегид (12,0 г, 0,40 моль) и гидрохлорид диметиламина (28,5 г, 0,35 моль)
суспендировали в этаноле (50 мл). Добавляли концентрированную соляную кислоту (0,5 мл) и смесь нагревали с обратным холодильником в течение 4 ч. Затем добавляли ацетон (200 мл) и образовавшемуся
прозрачному раствору давали остыть до комнатной температуры. Осадок собирали путем фильтрации и кристаллизовали из этанола с получением указанного в заголовке соединения (40,7 г, 76,0% от
теоретического выхода) в виде бесцветных кристаллов с т. пл. 158oC.
Примеры 2-4:
Дополнительные примеры соединений общей формулы VI получены как описано в примере
1. Подробности даны в таблице 1.
Пример 5:
6-Фенил-2-пиридон
Этил-2-хлорацетат (10,6 мл, 0,1 моль) медленно добавляли к горячему (105oC) пиридину (8,9 мл,
0,11 моль), при этом температура поддерживалась в диапазоне от 100oC до 110oC. Полученное коричневое масло растворяли в этаноле (60 мл), добавляли гидрохлорид β
- диметиламинопропиофенона (17,7 г, 0,1 моль; получен в соответствии с примером 1) и ацетат аммония (60 г) и кипятили смесь с обратным холодильником в течение 4 ч. После охлаждения смесь фильтровали и
растворитель выпаривали в вакууме. Остаток кристаллизовали из воды, собирали при помощи фильтрации и очищали посредством рекристаллизации из толуола. Указанное в заголовке соединение получали в виде
бесцветных кристаллов (4,71 г, выход 28%) с т. пл. 200oC.
Примеры 6-8:
Дополнительные примеры соединений получены аналогично примеру 5.
Подробности даны в таблице II.
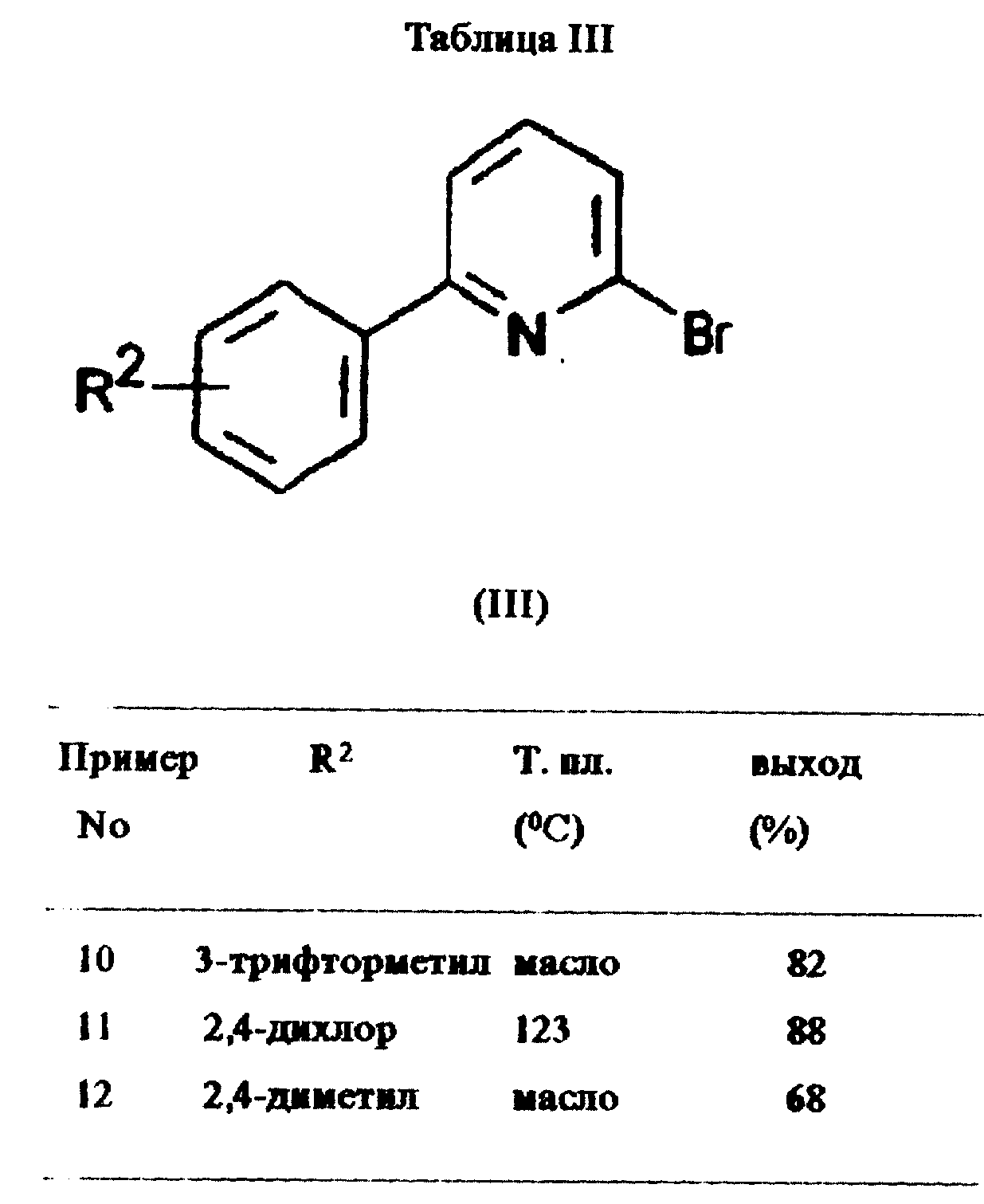
Пример 9:
2-Бром-6-фенилпиридин
Смесь 6-фенилпиридона (3 г, 17,5 ммоль, получен согласно примеру 5) и фосфорилбромида (7,2 г, 25,0 ммоль) нагревали
до 100oC в течение 5 ч. Охлажденную смесь выливали в воду (40 мл) и доводили pH до 9 путем добавления насыщенного раствора карбоната натрия. Затем слои разделяли и экстрагировали водный
слой этилацетатом (50 мл). Объединенные органические слои сушили над безводным сульфатом магния и выпаривали растворитель в вакууме. Сырой (неочищенный) продукт кристаллизовали из водного этанола.
Последующая очистка с помощью тонкослойной хроматографии (силикагель, гексан/этилацетат 9/1 об. /об. ) давала 2-бром-6-фенилпиридин (3,1 г, выход 76%) в виде светло-коричневых кристаллов с т. пл.
50oC.
Примеры 10-12:
Дополнительные соединения общей формулы III получены по методикам, аналогичным приведенной в примере 9. Подробности даны в таблице III.
Пример 13:
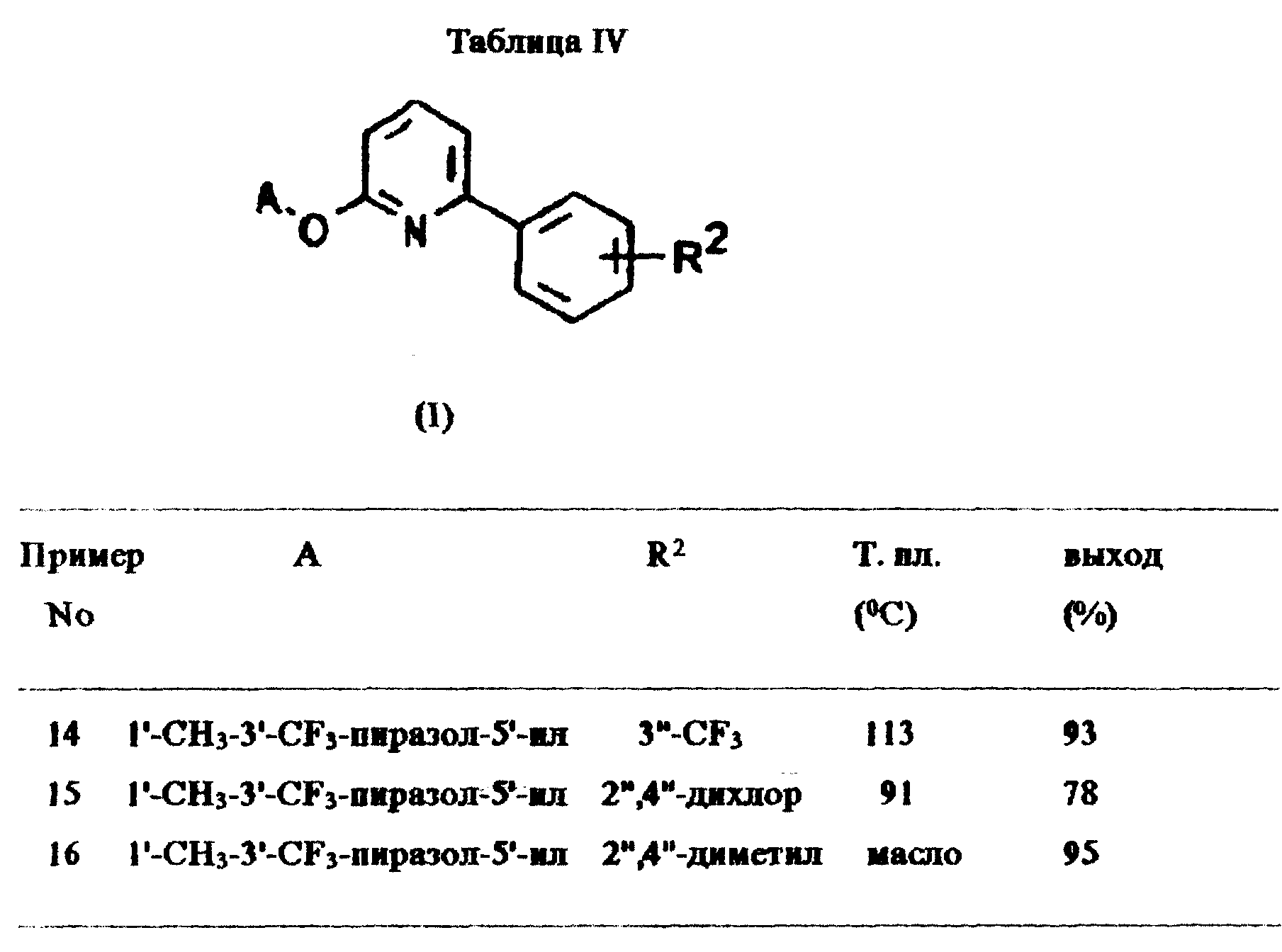
2-(1'-Метил-3'-трифторметилпиразол-5'-илокси)-6-фенилпиридин
Смесь 2-бром-6-фенилпиридина (0,5 г, 2,1 ммоль; получен согласно примеру 9),
1-метил-3-трифторметил-5-гидроксипиразола (0,65 г, 3,9 ммоль), карбоната калия (0,6 г, 4,3 ммоль) и N,N-диметилформамида (2 мл) нагревали с обратным холодильником в течение 12 ч. Затем реакционную
смесь помещали непосредственно в колонку для тонкослойной хроматографии (силикагель). Элюирование смесью гексан/этилацетат (9/1 об./об.) давало указанное в заголовке соединение (0,35 г, выход 52%) в
виде светло-желтого масла.
Примеры 14-16:
Соединения, описанные в таблице IV, получены по методикам, аналогичным приведенной в примере 13.
Пример 17:
2-Фтор-6-(4'-фторфенил)пиридин
Бутиллитий (105,0 мл, 0,26 моль, 2,5 М раствор в гексане) добавляли к раствору 1-бром-4-фторбензола (34,3 мл, 0,31 моль) в безводном диэтиловом эфире (200 мл)
при -20oC. Смесь перемешивали в течение 60 мин и затем охлаждали до -40oC. Добавляли 2,6-дифторпиридин (22,7 мл, 0,25 моль) и давали реакционной смеси нагреться до комнатной
температуры. В дальнейшем смесь промывали насыщенным водным раствором хлорида аммония (300 мл). Слои разделяли и водный слой промывали диэтиловым эфиром 3 раза (по 100 мл). После сушки объединенных
органических слоев над безводным сульфатом магния растворитель удаляли в вакууме. Сырой продукт очищали с помощью колонки тонкослойной хроматографии (силикагель, гексан/AcOEt 8/2), получая бесцветные
кристаллы 2-фтор-6-(4'-фторфенил)пиридина (19,8 г, выход 41,0%) с т. пл. 34oC.
Пример 18:
2-Фтор-6-(4'-фторфенил)-4-метилпиридин
Смесь
2-бром-6-фтор-4-метилпиридина (9,5 г, 50 ммоль), 4-фторбензолбороновой кислоты (7,8 г, 56 ммоль), бикарбоната натрия (12,6 г, 150 ммоль), воды (200 мл) и каталитических количеств
тетракис(трифенилфосфин)палладия(0) в диметиловом эфире в атмосфере азота нагревали с обратным холодильником в течение целой ночи. После фильтрации реакционной смеси растворители удалялись при
пониженном давлении. Остаток распределялся между водой и этилацетатом. Слои разделяли и водный слой промывали этилацетатом. После высушивания объединенных органических слоев над безводным сульфатом
магния растворитель удаляли в вакууме. Сырой продукт очищали с помощью тонкослойной колоночной хроматографии (силикагель, пентан/этилацетат 9/1) с получением бесцветных кристаллов
2-фтор-6-(4'-фторфенил)-4-метилпиридина (3,7 г, выход 36,1%) с т. пл. 49oC.
Пример 19:
2-Фтор-6-(4'-трифторфенил)-3-метилтиопиридин
К раствору
2-фтор-6-(4'-трифторфенил)пиридина (2,4 г, 10 ммоль, получен согласно способу примера 17), используя 1-бром-4-трифторметилбензол в качестве исходного продукта, в безводном ТГФ (тетрагидрофуране; 35
мл) добавляли по каплям 2 М раствор LDA в ТГФ (7,5 мл, 15 ммоль) при -70oC. После 2 ч выдерживания при -70oC добавляли диметилдисульфид (1,41 г, 15 ммоль) и давали реакционной
смеси нагреться до -20oC. Смесь гидролизовали и экстрагировали диэтиловым эфиром. После разделения органический слой сушили над безводным сульфатом магния. Растворители удаляли и сырой
продукт очищали с помощью тонкослойной колоночной хроматографии (силикагель). Элюирование смесью гексан/этилацетат (20/1 об./об.) приводило к получению указанного в заголовке соединения (1,2 г, выход
42%) с т. пл. 70-73oC.
Примеры 20-23:
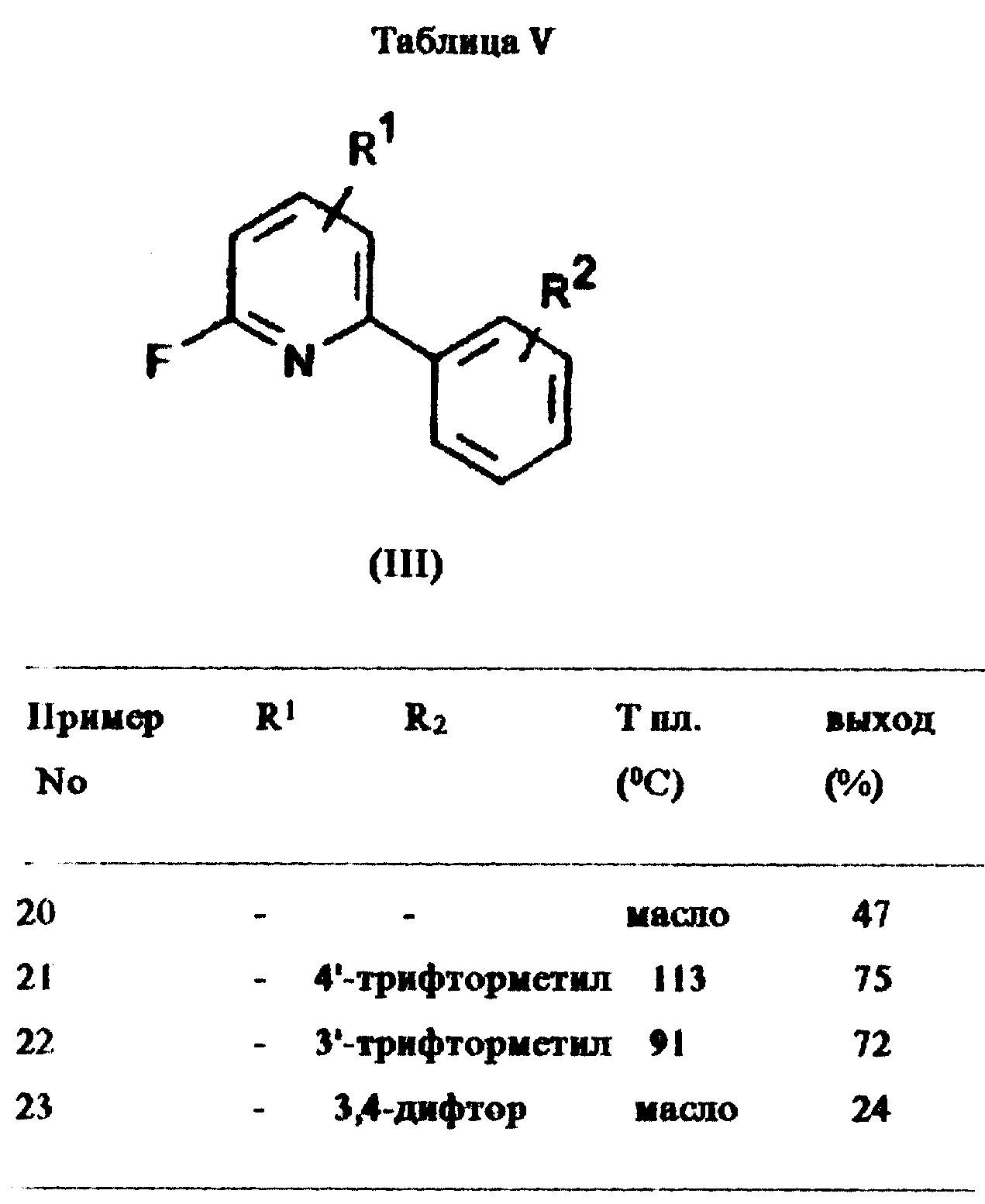
Аналогично примеру 17 были получены образцы соединений, описанные в таблице V.
Пример 24:
2-(3'-Хлорпирид-5'-илокси)-6-(4"-фторфенилокси)пиридин
Смесь 2-фтор-6-(4'-фторфенил)пиридина (1,9 г, 10 ммоль, получен в соответствии с примером 17), 3-хлор-5-гидроксипиридина (1,4 г, 11,0
ммоль) и карбоната калия (1,5 г, 11,0 ммоль) в сульфолане нагревали с обратным холодильником в течение 8 ч. Смеси давали охладиться до комнатной температуры и затем фильтровали через слой силикагеля,
который далее промывали этилацетатом. Полученные слои органического раствора объединяли и выпаривали растворитель в вакууме. Оставшееся вещество помещали в верхнюю часть колонки для тонкослойной
хроматографии (силикагель) и элюировали смесью гексан/этилацетат (8/2 об. /об.). Элюирование давало 2-(3'-хлорпирид-5'-илокси)-6-(4''-фторфенилокси)пиридин (1,4 г, выход 46%) в виде светло-коричневых
кристаллов с т. пл. 139oC.
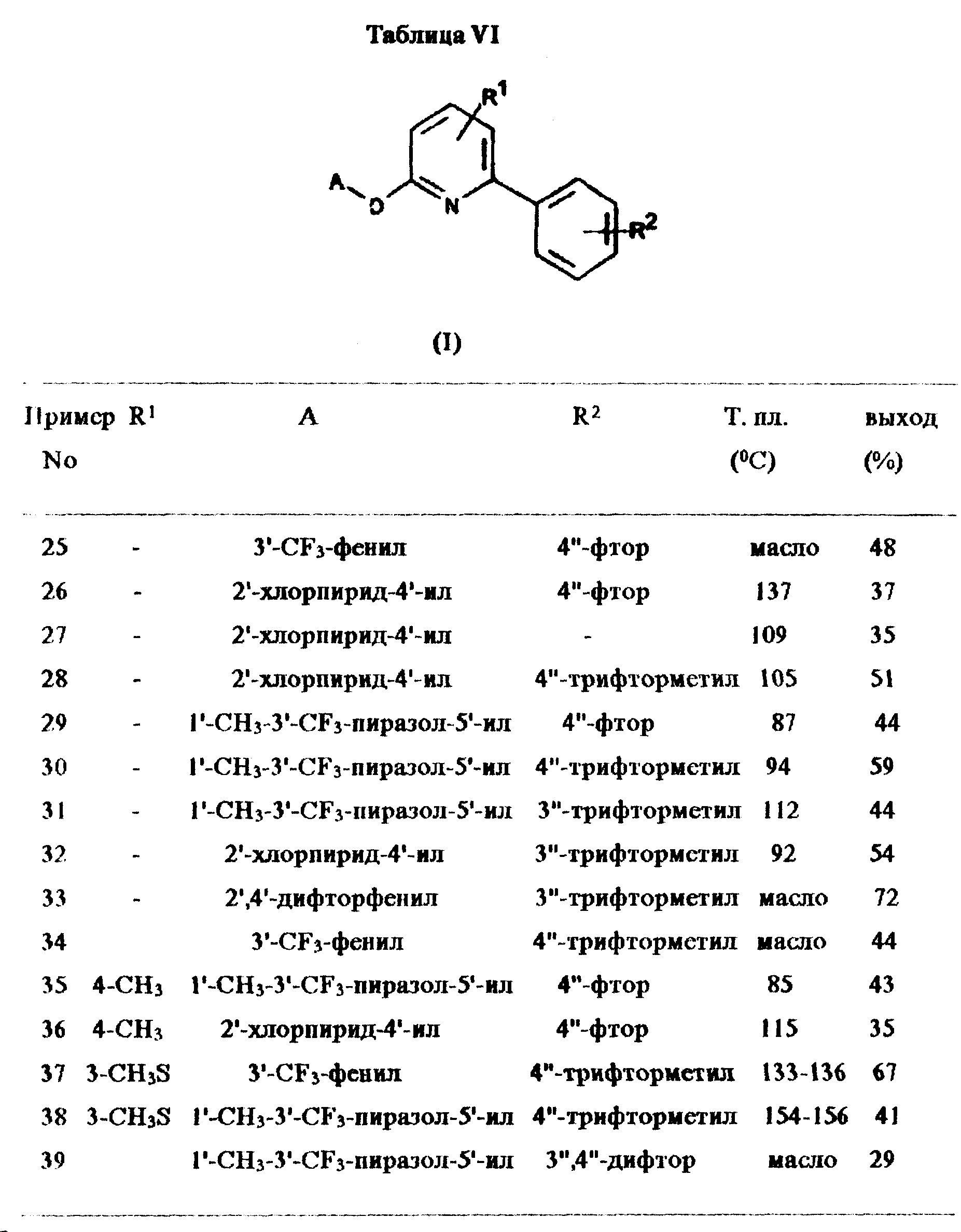
Примеры 25-39:
Дополнительные соединения получены аналогично примеру 24.
Подробности представлены в таблице VI.
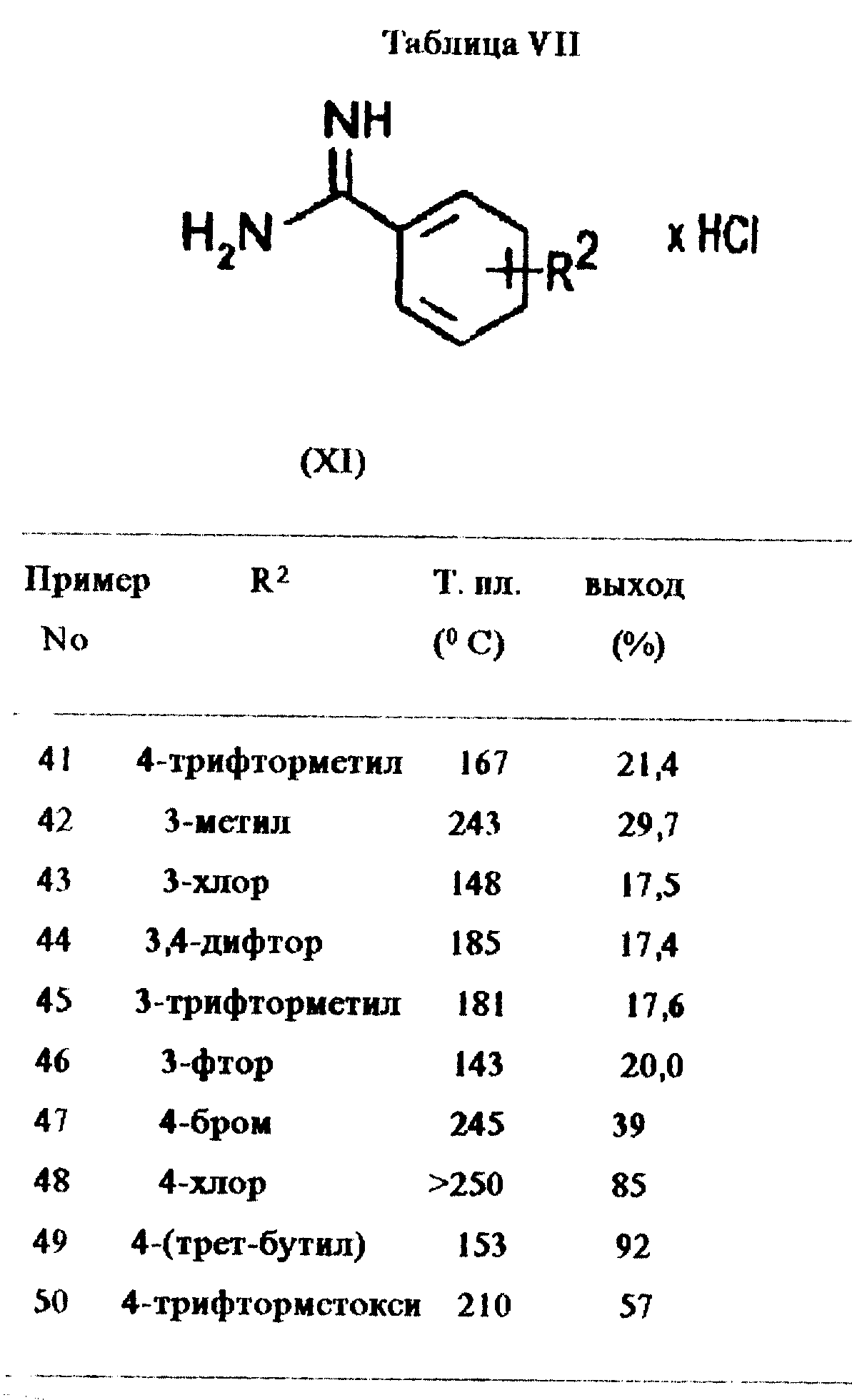
Пример 40:
Гидрохлорид 4-фторбензамидина
4-Фторбензонитрил (10 г, 83 ммоль) растворяли в смеси безводного этанола (5 мл) и диэтилового эфира (70 мл). Реакционную смесь
охлаждали до температуры ледяной бани и насыщали газообразным хлороводородом в течение 90 мин. Смеси давали нагреться до комнатной температуры и перемешивали ее в течение ночи.
Бесцветный осадок отфильтровывали, промывали диэтиловым эфиром и растворяли в безводном этаноле (20 мл). Добавляли диэтиловый эфир (100 мл), насыщенный газообразным аммиаком, и раствор перемешивали в течение 3 ч.
Образовавшуюся суспензию фильтровали и растворитель из фильтрата удаляли под вакуумом. Остаток промывали диизопропиловым эфиром. После высушивания получали бесцветные кристаллы (5,15 г, 35,5%) с т. пл. 210oC.
Примеры 41-50:
Следующие соединения общей формулы XI получены при помощи методов, аналогичных приведенному в примере 40.
Подробности даны в таблице VII.
Пример 51:
2-(4'-Фторфенил)-5-метил-4-пиримидинон
Гидрид натрия (0,52 г, 13 ммоль) добавляли к 20 мл безводного этанола и перемешивали
в течение 30 мин при комнатной температуре. Далее туда же добавляли гидрохлорид 4-фторбензамидина (1,47 г, 8,5 ммоль) (из примера 40) и смесь перемешивали в течение еще 30 мин. Добавляли по каплям
метил-2-формилпронионат (1 г, 10,6 ммоль) и реакционную смесь оставляли перемешиваться при комнатной температуре на 4 дня.
После охлаждения растворитель удаляли в вакууме и остаток растворяли в водном гидроксиде натрия (10 мл, 1 М). Затем pH смеси приводили к 5 при помощи 2 М соляной кислоты. Осадок отфильтровывали и промывали диизопропиловым эфиром. После высушивания получали бесцветные кристаллы (0,44 г, 10,3%) с т. пл. > 250oC.
Пример 52:
6-Гидрокси-2-(4'-трифторметилфенил)-4-пиримидинон
Гидрохлорид 4-трифторбензамидина
(22,4 г, 0,1 моль, из примера 41) добавляли к раствору метилата калия (0,22 моль) в безводном метиловом спирте (65 мл) и перемешивали в течение 15 мин при комнатной температуре. Добавляли
диметилмалонат (12,6 мл, 0,11 моль) и смесь нагревали с обратным холодильником в течение 4 ч. После охлаждения образовавшуюся суспензию разбавляли метиловым спиртом (50 мл). Растворитель удаляли в
вакууме и остаток растворяли в воде (50 мл). Затем pH смеси приводили к 1 при помощи концентрированной соляной кислоты. Осадок отфильтровывали и промывали водой. После высушивания получали
бледно-желтые кристаллы (15,1 г, 59%) с т. пл. > 200oC.
Пример 53:
5-Метокси-2-(4'-трифторметилфенил)-4-пиримидинон
К суспензии гидрида натрия (60%,
6 г, 0,15 моль) в безводном ТГФ (225 мл) добавляли в течение 30 мин раствор метилметоксиацетата (14,9 мл, 0,15 моль) в метилформиате (11,1 мл, 0,18 моль). Смесь перемешивали в течение 2 ч при
комнатной температуре. После добавления диэтилового эфира (300 мл) образовавшаяся натриевая соль моноальдегида метилметоксималоната может быть выделена посредством отсасывания. Далее эту натриевую
соль (0,075 моль) добавляли к гидрохлориду 4-трифторметилбензамидина (16,8 г, 0,075 ммоль, из примера 41) в безводном этиловом спирте (150 мл) и смесь перемешивали в течение 48 ч при комнатной
температуре. После нагревания с обратным холодильником в течение 1 ч к смеси добавляли воду (100 мл) и раствор фильтровали.
pH фильтрата доводили до 5 уксусной кислотой и удаляли этиловый спирт в вакууме. Осадок отфильтровывали и промывали этиловым спиртом. После высушивания получали кристаллы (13,7 г, 68%) с т. пл. > 200oC.
Примеры 54-78
Способом, продемонстрированным в примере 51, получены следующие соединения общей формулы III. Подробности даны в таблице VIII.
Пример 79:
2-(4'-Фторфенил)-4-хлор-5-метилпиримидин
Смесь 2-(4'-фторфенил)-5-метил-4-пиримидинона (0,79 г, 3,9 ммоль) (из примера 51) и оксихлорида фосфора (3 мл) нагревали с обратным холодильником в
течение 1 ч.
Основную часть избытка оксихлорида фосфора удаляли в вакууме и гасили остаток водой (10 мл), чтобы гидролизовать еще оставшийся реагент. Смесь нейтрализовали и затем экстрагировали этилацетатом (50 мл). После высушивания органического слоя безводным сульфатом магния растворитель удаляли в вакууме. Указанное в заголовке соединение (0,63 г, 72,6%) получали в виде бесцветных кристаллов с т. пл. 133oC.
Пример 80:
2-(4'-Хлорфенил)-4,5-дихлор-6-метоксипиримидин
К раствору 2-(4'-хлорфенил)-4,5,6-трихлорпиримидина (1,85 г,
6,3 ммоль) в метиловом спирте (30 мл) ТГФ (60 мл) добавляли раствор натрия (0,145 г, 6,3 ммоль) в метиловом спирте (10 мл) и смесь перемешивали при комнатной температуре в течение ночи. После
удаления растворителя в вакууме к остатку добавляли дихлорметан и образовавшуюся смесь промывали водой. После высушивания органического слоя безводным сульфатом магния растворитель удаляли. Обработка
остатка пентаном давала указанное в заголовке соединение (1,75 г, 96%) в виде бесцветных кристаллов с т. пл.157-159oC.
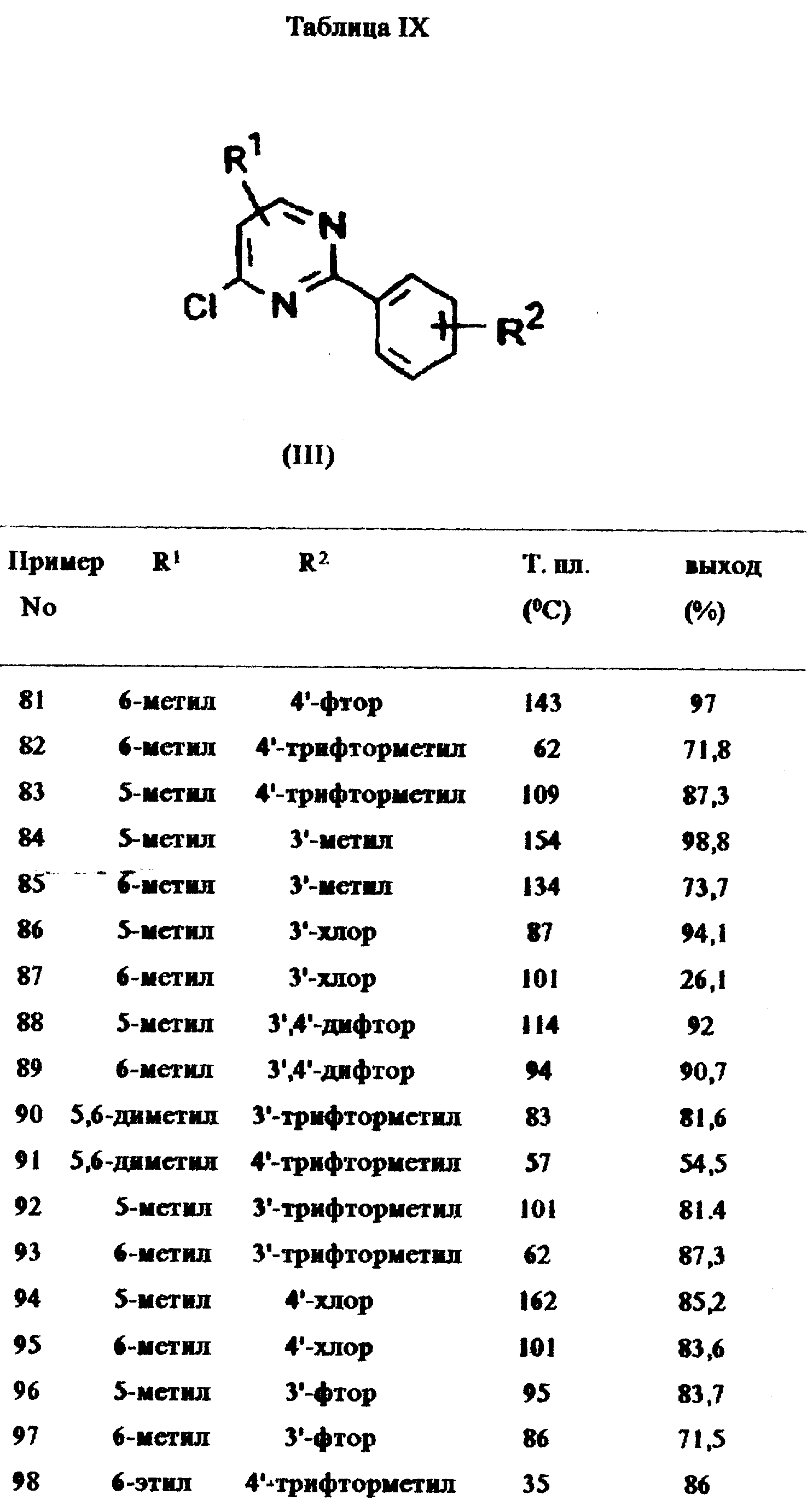
Примеры 81-108:
Соединения общей формулы XIII,
перечисленные в таблице IX, получены аналогично методу, описанному в примере 79.
Пример 109:
2-(4'-Фторфенил)-4-(3''-фторметилфенокси)-6-метилпиримидин
Смесь
2-(4'-фторфенил)-4-хлор-6-метилпиридина (0,6 г, 2,7 ммоль) (из примера 81), α,α,α- 3-гидроксибензотрифторида (0,49 г, 3 ммоль) и карбоната калия (0,41 г, 3 ммоль) в N,
N-диметилформамиде (3 мл) нагревали с обратным холодильником в течение 2 ч.
После охлаждения добавляли этилацетат (10 мл) и суспензию фильтровали через слой силикагеля, используя этилацетат. Растворитель из фильтрата удаляли под вакуумом и остаток очищали при помощи тонкослойной хроматографии на колонке с силикагелем, используя смесь гексан/этилацетат 7/2. Удаление растворителя давало бесцветные кристаллы (0,53 г, 56,4%) с т.пл. 58oC.
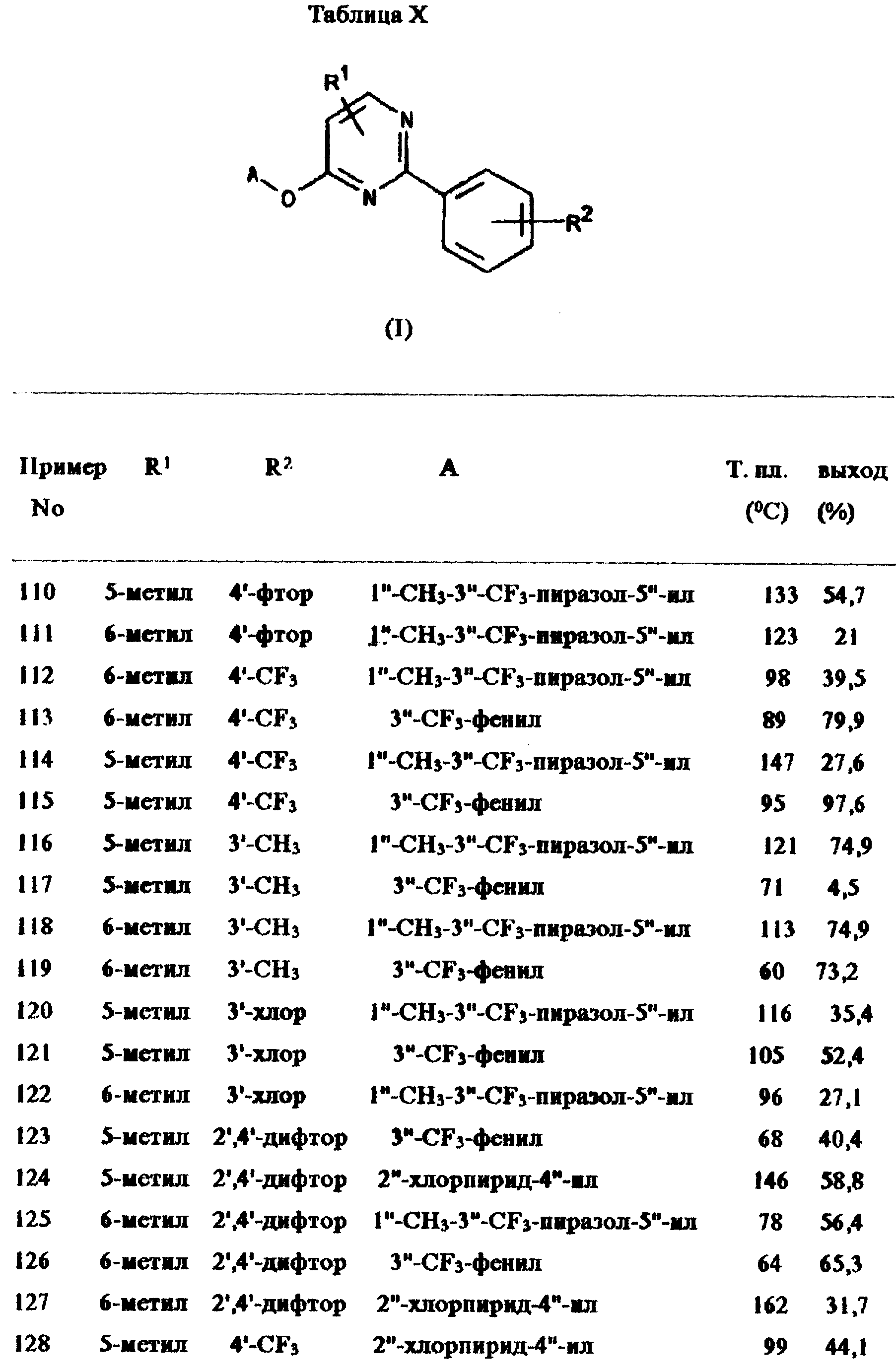
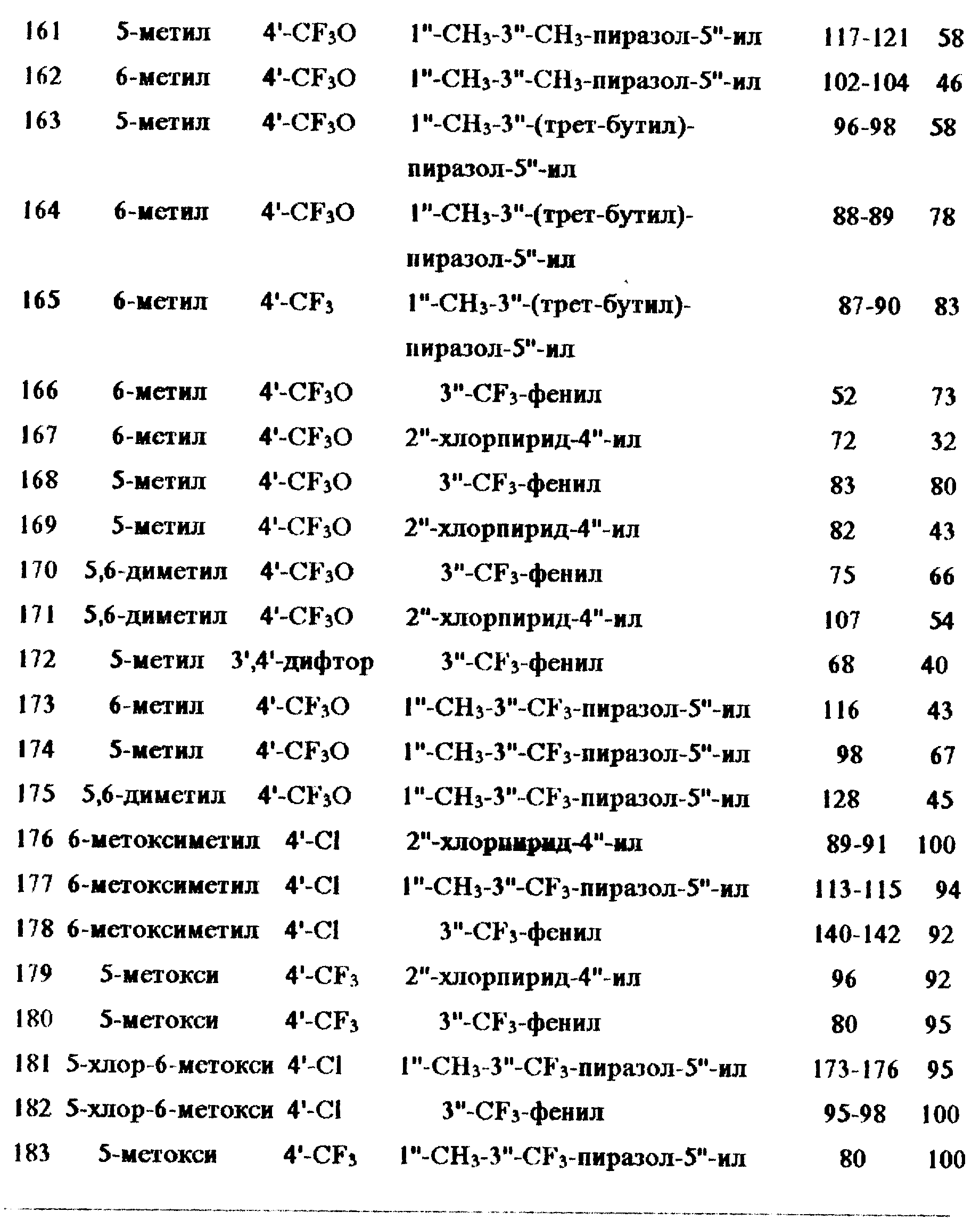
Примеры 110-183:
Следующие соединения общей формулы I получены согласно методике из примера
109. Подробности даны в таблице X.
Пример 184:
4,6-Бис(2"-хлорпирид-4''-илокси)-2-(4'-трифторметилфенил)пиримидин
Смесь 4,6-дихлор-2-(4'-трифторметилфенил)пиримидина
(2,93 г, 10 ммоль) (из примера 107), 2-хлор-4-гидроксипиридина (2,85 г, 22 ммоль) и карбоната калия (3,04 г, 22 ммоль) в безводном N,N-диметилформамидe (20 мл) нагревали при 80oC в течение
1 ч.
После охлаждения растворитель удаляли в вакууме, добавляли этилацетат и суспензию фильтровали через слой силикагеля. Получившийся в результате этого раствор трижды промывали водой. После высушивания органического слоя над безводным сульфатом магния растворитель удаляли и остаток очищали при помощи тонкослойной хроматографии на силикагеле с использованием смеси гексан/этилацетат 8/2. Удаление растворителя давало бесцветные кристаллы (4,1 г, 86%) с т. пл. 141oC.
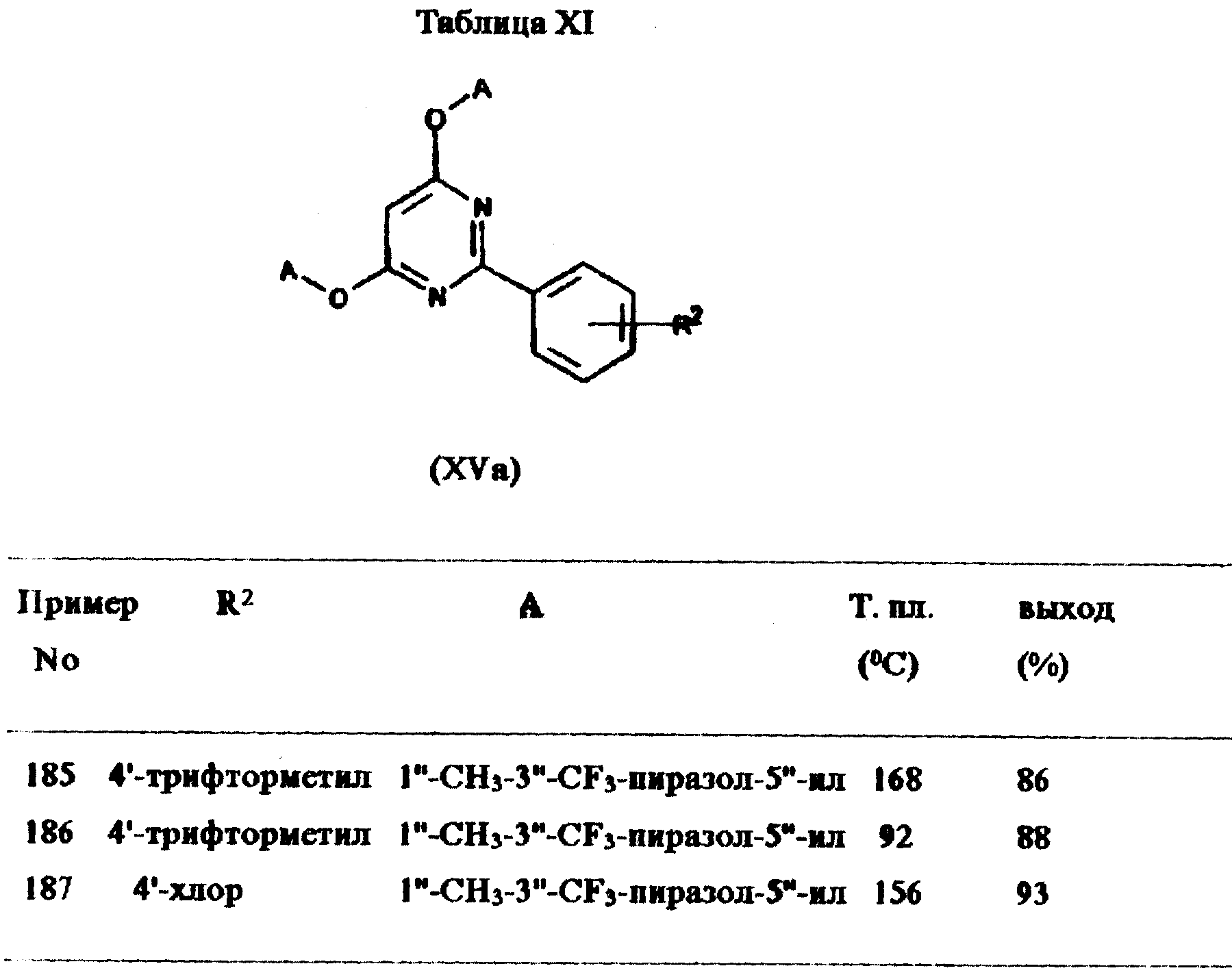
Примеры 185-187:
Соединения общей формулы XVa, перечисленные в
табл. XI, приготовлены аналогично методу из примера 184. Подробности приведены в таблице XI.
Пример 188:
6-Метокси-4-(2''-хлорпирид-4''-илокси)-2- (4'-трифторметилфенил)пиримидин
4,6-Бис(2''-хлорпирид-4''-илокси)-2-(4'- трифторметилфенил)пиримидин (2,0 г, 4,2 ммоль) (из примера 184) растворяли в
безводном метиловом спирте (5 мл), к этому раствору добавляли по каплям раствор метилата калия (4,2 ммоль) в метиловом спирте (1,2 мл) и смесь нагревали с обратным холодильником в течение 30 мин.
Растворитель удаляли в вакууме и остаток очищали при помощи тонкослойной хроматографии на силикагеле с использованием смеси гексан/этилацетат 9/1. Удаление растворителя давало бесцветные кристаллы (1,0 г, 62%) с т.пл. 128oC.
Пример 189:
4,6-Дибром-2-(4'-трифторметилфенил)пиримидин
Смесь 4,6-дигидрокси-2-(4'-трифторметилфенил)пиримидина (5,
12 г, 20 ммоль) и оксибромида фосфора (10 мл) нагревали в течение 3 ч при 100oC. К образовавшейся горячей суспензии добавляли лед, и далее продукт можно было выделить отсасыванием. После
высушивания получали почти бесцветные кристаллы (6,5 г, 86%) с т.пл. 87oC.
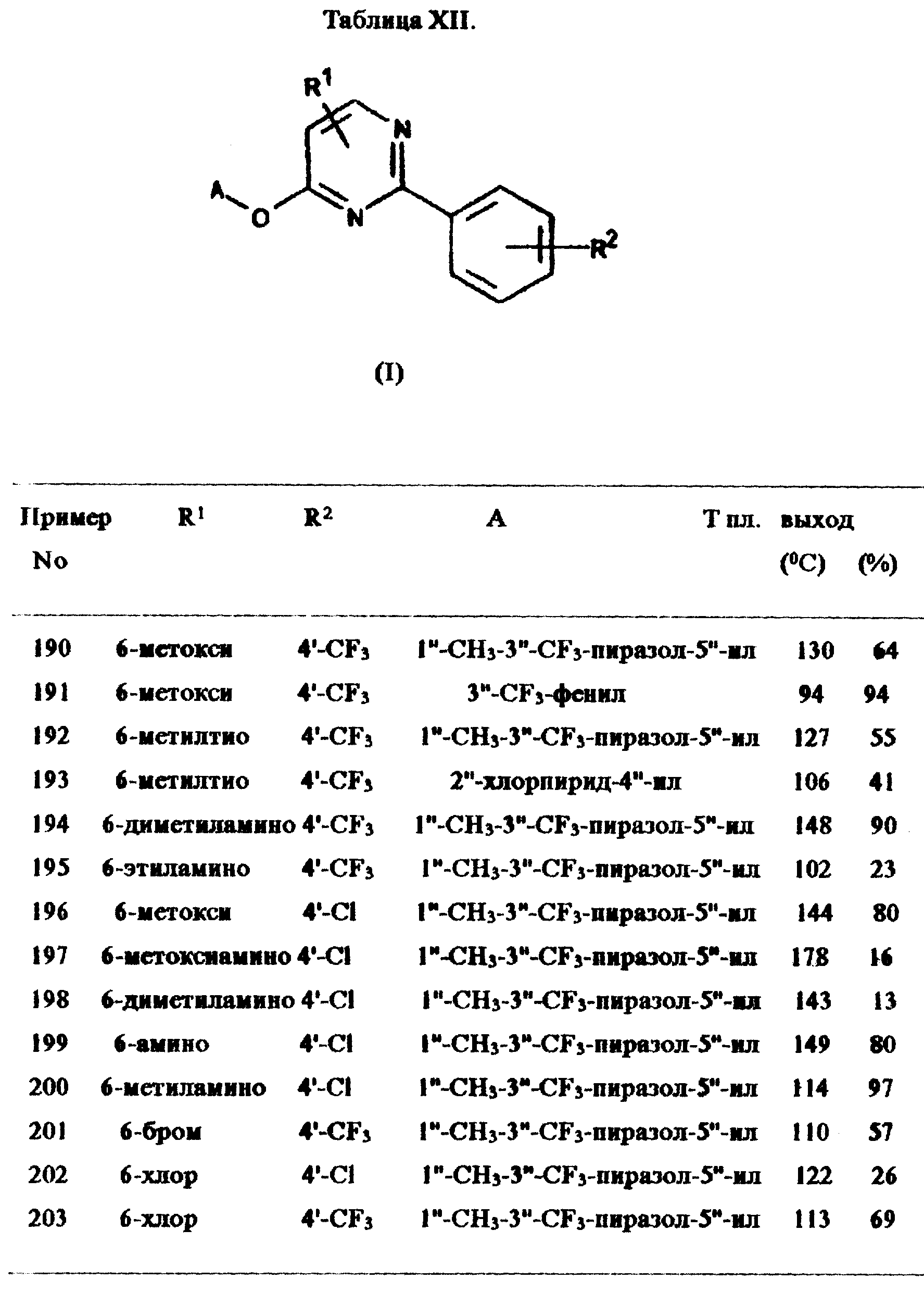
Примеры 190-203:
Соединения общей формулы I получены при помощи методик из примеров 188
или 189. Подробности даны в таблице XII.
Пример 204:
6-Винил-4-(1''-метил-3''-трифторметилпиразол-5''-ил)-2- (4'-трифторметилфенил)пиримидин
Смесь
6-бром-4-(1''-метил-3"-трифторметилпиразол-5''-ил)-2-(4'- трифторметилфенил)пиримидина (2 г, 4,3 ммоль, из примера 201), винилтрибутилстанната (1,4 мл, 4,7 ммоль), тетракис(трифенилфосфин)-палладия(0)
(0,1 г, 0,09 ммоль), толуола (20 мл) и трех кристаллов ди-(трет-бутил)-4-метилфенола нагревали с обратным холодильником в течение 90 мин. После охлаждения добавляли 1,2 н. раствор фторида пиридиния в
ТГФ/пиридине (4 мл) и пиридин (2 мл). Раствор перемешивали в течение 17 ч при комнатной температуре. К образовавшейся смеси добавляли этилацетат (100 мл) и раствор дважды промывали водой и насыщенным
раствором бикарбоната натрия. После высушивания органического слоя безводным сульфатом магния растворитель удаляли и остаток очищали при помощи тонкослойной хроматографии на силикагеле с
использованием смеси гексан/этилацетат 7/3. Удаление растворителя давало почти бесцветные кристаллы (1,45 г, 82%) с т. пл. 112oC.
Пример 205:
Гербицидная
активность:
С целью оценки их гербицидной активности соединения согласно изобретению испытывались с использованием репрезентативного ряда растений:
TRZAS Triticum aestivum
HORVW Hordeum vulgare
GOSHI Gossypium hirsutum
HELAN Helianthus annuus
ORYSA Oryza sativa
GLXMA Glycine max
BEAVA Beta vulgaris
ZEAMX Zea mays
ALOMY Alopecurus myosuroides
AVEFA Avena fatua
ECHCG Echinocloa crus-galli
SETVI Setaria viridis
GALAP Galium aparine
STEME Stellaria media
CHEAL Chenopodium album
VERPE Veronica persica
LAMPU Lamium purpureum
VIOAR Viola arvensis
SIDSP Sida spinosa
AMBAR Ambrosia artemisifolia
ABUTH
Abutilon theophrasti
IPOPU Ipomoea purpurea
SINAL Sinapis alba
AMARE Amaranthus retroflexus
Испытания подразделялись на две категории - довсходовые и
послевсходовые. Довсходовые испытания включали разбрызгивание жидких композиций на основе соединений на почву, в которую недавно посеяны семена вышеупомянутых видов растений. Послевсходовые испытания
включали опрыскивание взошедших сеянцев вышеуказанных видов такими составами.
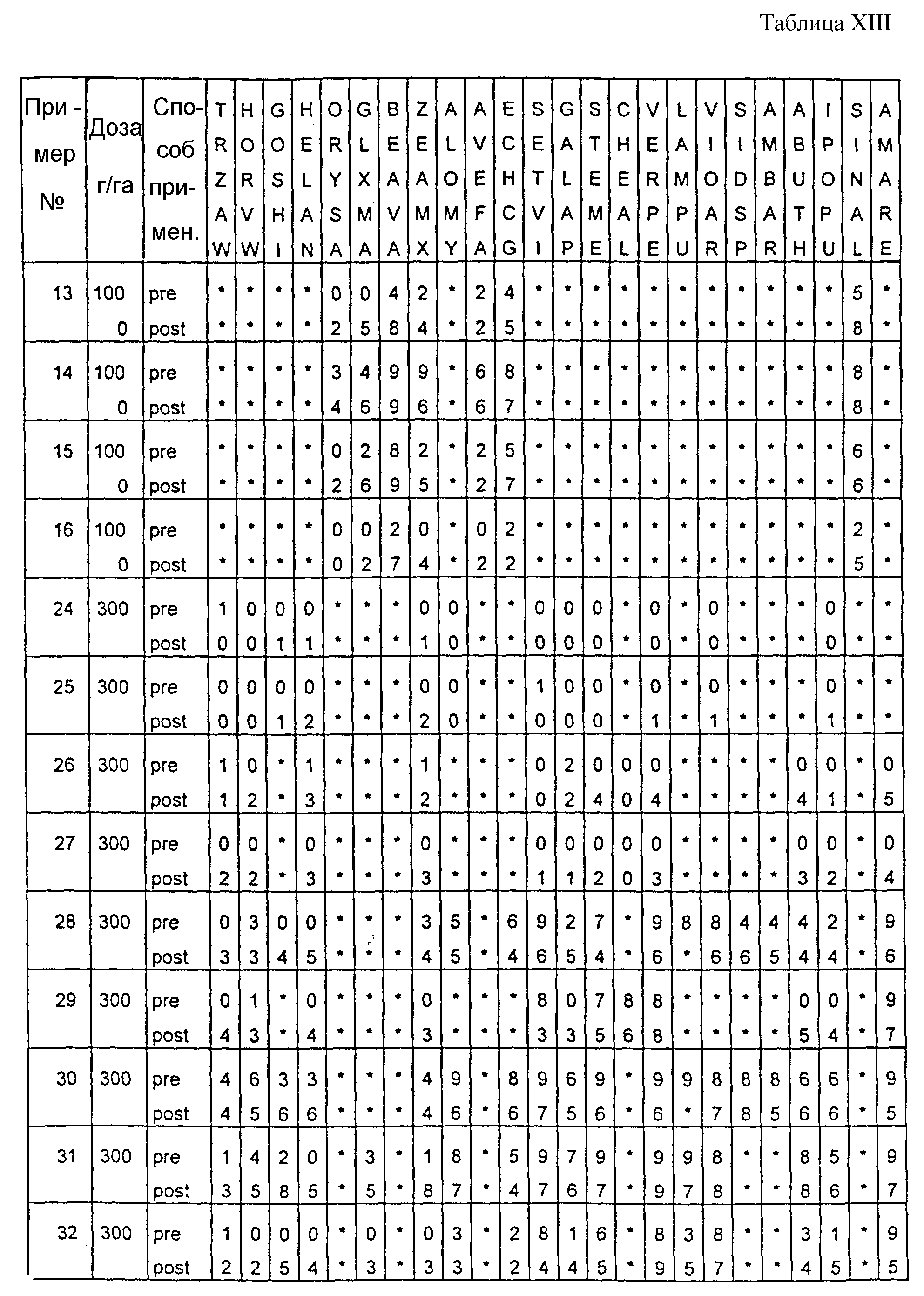
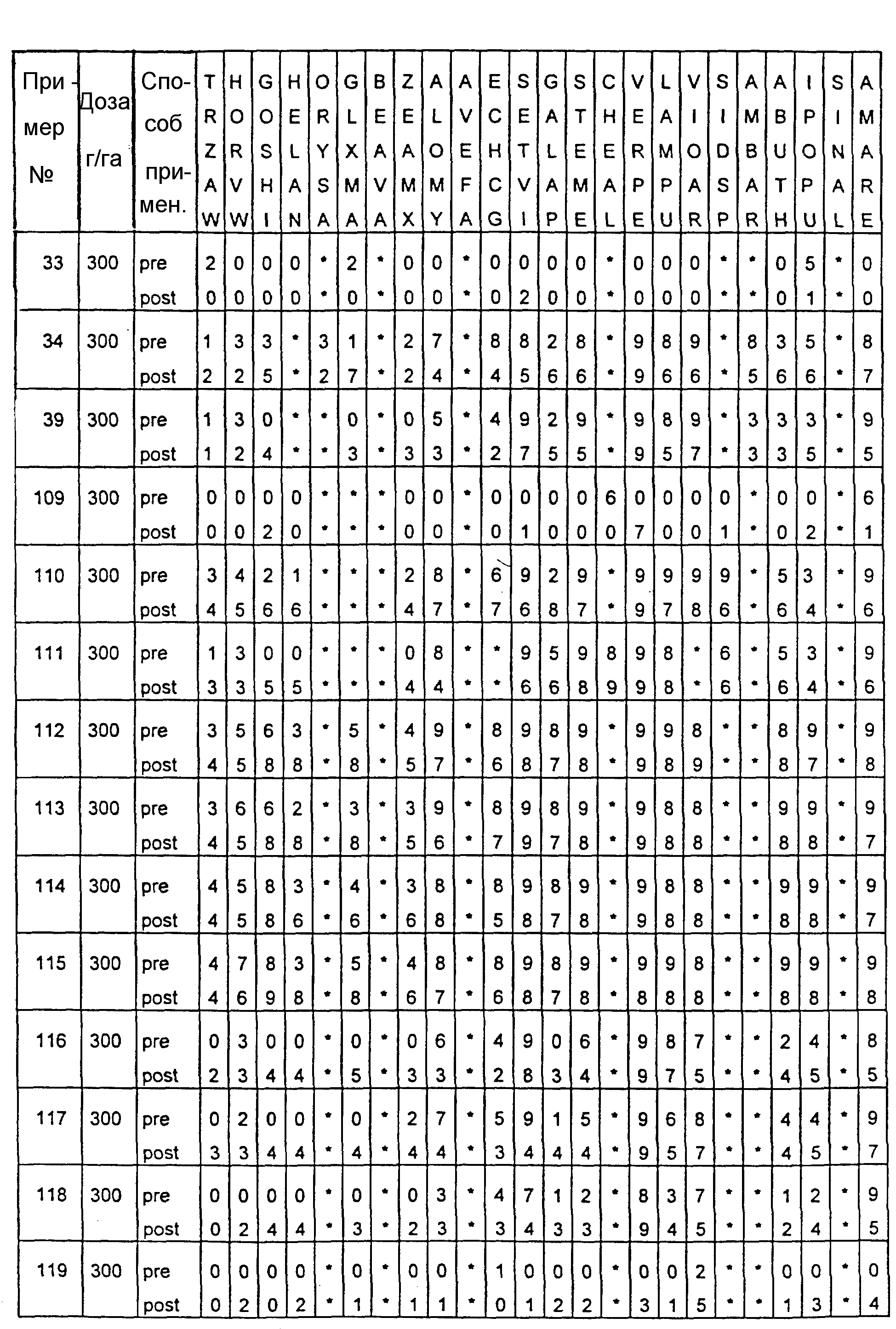
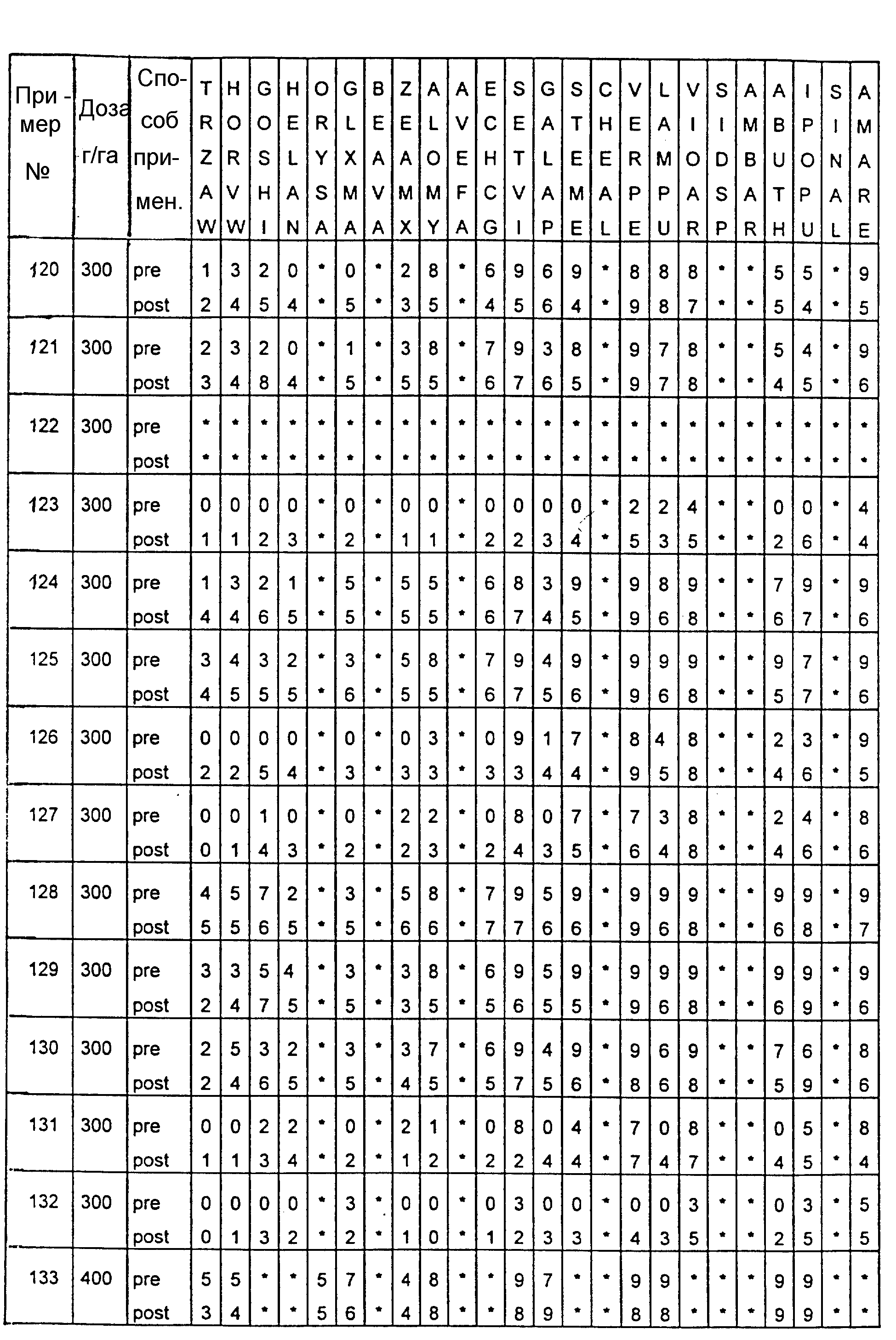
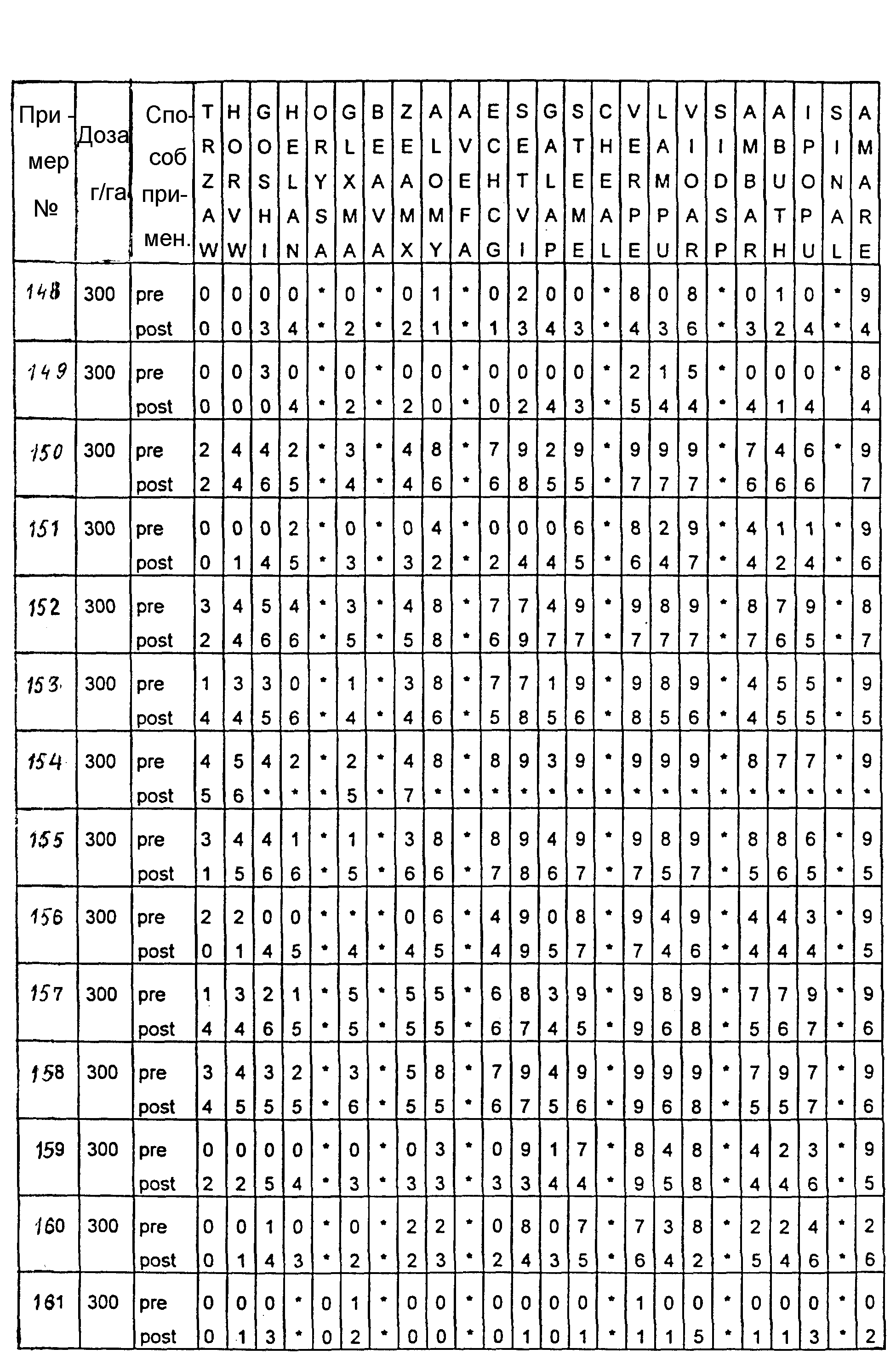
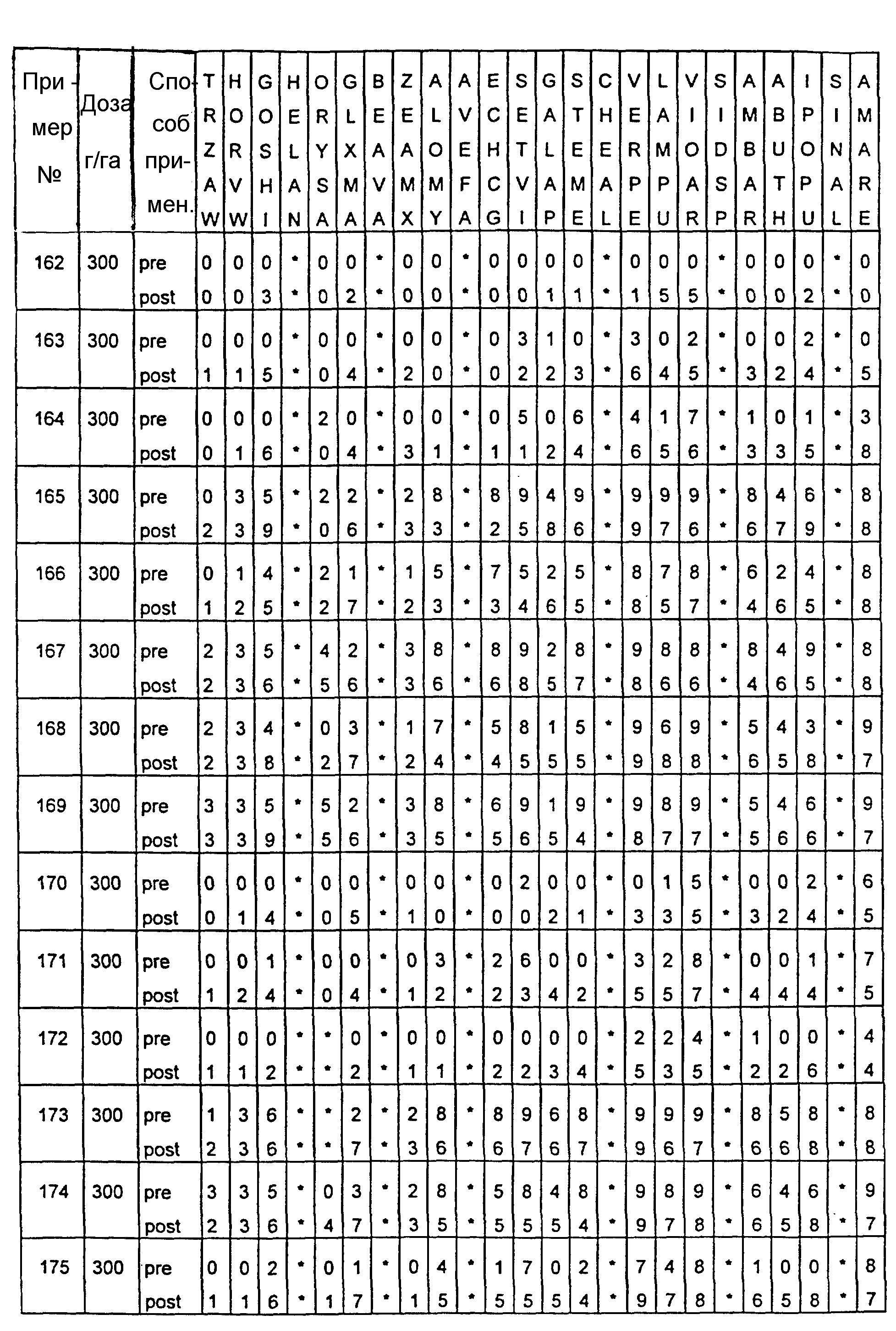
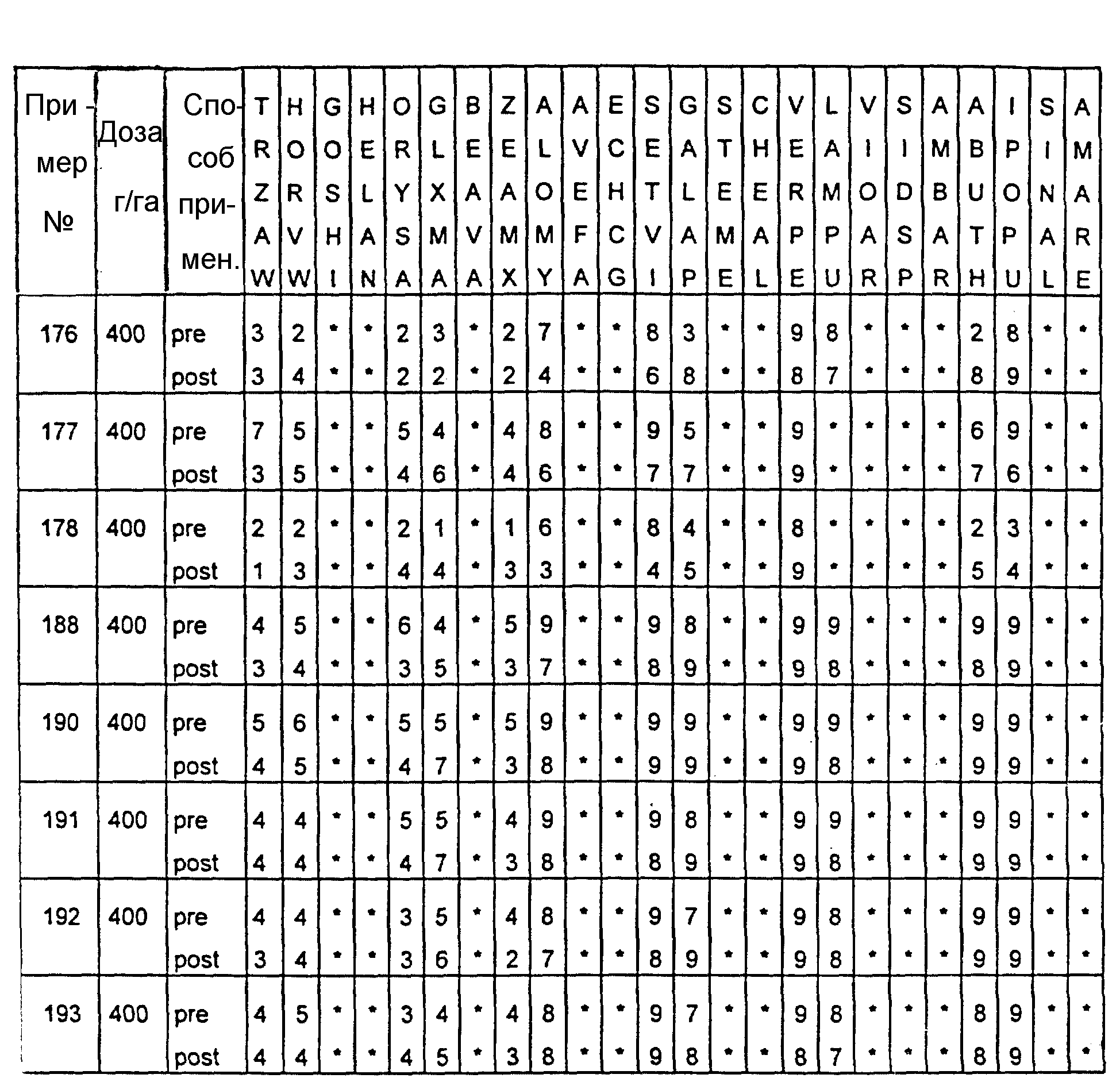
Почва, используемая в испытаниях, представляла собой приготовленную садовую плодородную землю. Использованные в тестах готовые составы получали из растворов испытуемых соединений в ацетоне, содержащих 0,4% (вес.) поверхностно-активной добавки типа конденсата алкилфенила с этиленоксидом, имеющейся под торговой маркой TRITON X 55. Раствор в ацетоне разбавляли водой, и полученные составы содержали 1000 г или 300 г активного вещества на гектар в объемах, эквивалентных 400 л/га. В качестве контрольных в довсходовых испытаниях использовались образцы необработанной засеянной почвы, а в послевсходовых испытаниях - образцы необработанных сеянцев растений, взошедших на необработанной почве.
Гербицидное воздействие испытуемых соединений определяли визуально через двадцать дней после опрыскивания листвы и почвы (в случае примеров 13-16 через тринадцать дней после обработки) и фиксировали по десятибалльной шкале (0-9). Оценка 0 обозначает такой же рост, как на необработанном контрольном объекте, оценка 9 обозначает полную гибель. Повышение на 1 единицу линейной шкалы соответствует росту степени воздействия приблизительно на 10%. Звездочки обозначают, что данные виды растений не обрабатывались в этом испытании.
Результаты испытаний представлены в приведенной ниже таблице XIII, в которой соединения определяются посредством ссылок на предшествующие примеры. Звездочки обозначают, что данные виды растений не обрабатывались в этом испытании. Обозначения "pre-" и "post-" в графе "Способ применения" соответствуют довсходовому и послевсходовому применению данного соединения.
Реферат
Описываются новые 2,6-дизамещенные пиридины или 2,4-дизамещенные пиримидины общей формулы I, где X - атом кислорода; Z - NH, CH; A - фенил, замещенный атомом фтора или трифторметильной группой, пиридил, замещенный атомом хлора, пиразолил, замещенный трифторметильной и метильной группой или метильной и трет-бутильной группой, дифторбензодиоксолил, каждый из R1, независимо, является группой, выбранной из атома водорода, атома галогена, низшего алкила, низшего алкилтио, низшего алкоксила; R2 - каждый, независимо, является группой, выбранной из атома водорода, трифторметила, низшего алкила, трифторметоксила, атом галогена; m = 1 - 2, n = 0 - 2, при условии, что, если A представляет 1-метил-3-трифторметилпиразол-5-ильную группу, n = 0, X - атом кислорода, Z - группа CH, тогда R2 не является водородом, 3-трифторметилом или 2,4-дихлором или 2,4-диметилом. Соединения проявляют гербицидную активность. Описывается способ получения соединений формулы I, гербицидная активность на основе вышеуказанных соединений и способ борьбы с нежелательной растительностью. 8 с. и 1 з.п.ф-лы, 13 табл.
Формула
где X - атом кислорода;
Z - NH, CH,
A - фенил, замещенный атомом фтора или трифторметильной группой, пиридил, замещенный атомом хлора, пиразолил, замещенный трифторметильной и метильной группой или метильной и трет-бутильной группой, дифторбензодиоксолил;
R1, каждый, независимо, является группой, выбранной из атома водорода, атома галогена, низшего алкила, низшего алкилтио, низшего алкоксила,
R2 - каждый, независимо, является группой, выбранной из атома водорода, трифторметила, низшего алкила, трифторметоксила, атома галогена,
m = 1 - 2;
n = 0 - 2,
при условии, что, если A представляет 1-метил-3-трифторметилпиразол-5-ильную группу, n = 0, X - атом кислорода, Z - группа CH, тогда R2 не является водородом, 3-трифторметилом или 2,4-дихлором или 2,4-диметилом.
2-(1'-метил-3'-трифторметилпиразол-5'-илокси)-6-(4''-трифторметилфенил)пиридин,
2-(2', 4'-дифторфенил)-6-метил-4-(1''-метил-3''-трифторметилпиразол-5''-илокси)пиримидин,
2-(2', 4'-дифторфенил)-6-метил-4-(3''-трифторметилфенокси)пиримидин,
2-(2'-хлорпирид-4'-илокси)-(4''-трифторметилфенил)пиридин,
2-(2'-хлорпирид-4'-илокси)-6-(3''-трифторметилфенил)пиридин,
2-(3'-хлорфенил)-5-метил-4-(1''-метил-3''-трифторметилпиразол-5''-илокси)пиримидин,
2-(3'-хлорфенил)-5-метил-4-(3''-трифторметилфенокси)пиримидин,
2-(4'-фторфенил)-6-метил-4-(3''-трифторметилфенокси)пиримидин,
2-(4'-фторфенил)-4-(1''-метил-3''-трифторметилпиразол-5''-илокси)-5-метилпиримидин,
2-(4'-фторфенил)-(1''-метил-3''-трифторметилпиразол-5''-илокси)-6-метилпиримидин,
4-(2''-хлорпирид-4''-илокси)-2-(2',4'-дифторфенил)-5-метилпиримидин,
4-(2''-хлорпирид-4''-илокси)-5,6-диметил-2-(4'-трифторметоксифенил)пиримидин,
4-(2''-хлорпирид-4''-илокси)-5, 6-диметил-2-(4'-трифторметилфенил)пиримидин,
4-(2''-хлорпирид-4''-илокси)-5-метил-2-(4'-трифторметоксифенил)пиримидин,
4-(2''-хлорпирид-4''-илокси)-5-метил-2-(4'-трифторметилфенил)пиримидин,
4-(2''-хлорпирид-4''-илокси)-6-метил-2-(4'-трифторметоксифенил)пиримидин,
4-(2''-хлорпирид-4''-илокси)-6-метил-2-(4'-трифторметилфенил)пиримидин,
5-этил-6-(4''-трифторметилфенил)-2-(3'-трифторметилфенил)пиридин,
4-метил-6-(4''-трифторметоксифенил)-2-(1'-метил-3'-трифторметилпиразол-5'-илокси)пиридин,
4-метил-6-(4''-трифторметоксифенил)-2-(2'-хлорпирид-4'-илокси)пиридин,
4-метил-6-(4''-трифторметилфенил)-2-(1'-метил-3'-трифторметилпиразол-5'-илокси)пиридин,
4-метил-6-(4''-трифторметилфенил)-2-(2'-хлорпирид-4'-илокси)пиридин,
4-метил-6-(4''-фторфенил)-2-(1'-метил-3'-трифторметилпиразол-5'-илокси)пиридин,
5,6-диметил-2-(4'-трифторметоксифенил)-4-(1''-метил-3''-трифторметилпиразол-5''-илокси)пиридин,
5, 6-диметил-2-(4'-трифторметоксифенил)-4-(3''-трифторметилфенокси)пиримидин,
5,6-диметил-2-(4'-трифторметилфенил)-4-(3''-трифторметилфенокси)пиримидин,
5, 6-диметил-4-(1''-метил-3''-трифторметилпиразол-5''-илокси)-2-(4'-трифторметилфенил)пиримидин,
5-метил-2-(3'-метилфенил)-4-(1''-метил-3''-трифторметилпиразол-5''-илокси)пиримидин,
5-метил-2-(3'-метилфенил)-4-(3''-трифторметилфенокси)пиримидин,
5-метил-2-(4'-трифторметоксифенил)-4-(1''-метил-3''-трифторметилпиразол-5''-илокси)пиримидин,
5-метил-2-(4'-трифторметоксифенил)-4-(3''-трифторметилфенокси)пиримидин,
5-метил-2-(4'-трифторметилфенил)-4-(1''-метил-3''-трифторметилпиразол-5''-илокси)пиримидин,
5-метил-4-(3''-трифторметилфенокси)-2-(4'-трифторметилфенил)пиримидин,
6-(4''-фторфенил)-2-(1'-метил-3'-трифторметилпиразол-5'-илокси)пиридин,
6-метил-2-(4'-трифторметоксифенил)-4-(1''-метил-3''-трифторметилпиразол-5''-илокси)пиримидин,
6-метил-2-(4'-трифторметоксифенил)-4-(3''-трифторметилфенокси)пиримидин,
6-метил-4-(3''-трифторметилфенокси)-2-(4'-трифторметилфенил)пиримидин,
6-этил-2-(4'-трифторметилфенил)-4-(1''-метил-3''-трифторметилпиразол-5''-илокси)пиримидин,
6-этил-2-(4'-трифторметилфенил)-4-(3''-трифторметилфенокси)пиримидин,
6-этил-2-(4'-трифторметилфенил)-4-(2'-хлорпирид-4'-илокси)пиримидин,
6-метоксиметил-2-(4'-хлорфенил)-4-(1''-метил-3''-трифторметилпиразол-5''-илокси)пиримидин,
4-(3''-трифторметилфенокси)-2-(4'-трифторметилфенил)пиримидин,
4-(1''-метил-3''-трифторметилпиразол-5''-илокси)-2-(4'-трифторметилфенил)пиримидин,
6-хлор-2-(4'-трифторметилфенил)-4-(1''-метил-3''-трифторметилпиразол-5''-илокси)пиримидин,
6-бром-2-(4'-трифторметилфенил)-4-(1''-метил-3''-трифторметилпиразол-5''-илокси)пиримидин,
6-фтор-2-(4'-трифторметилфенил)-4-(1''-метил-3''-трифторметилпиразол-5''-илокси)пиримидин,
6-метокси-2-(4'-трифторметилфенил)-4-(3''-трифторметилфенокси)пиримидин,
6-метокси-2-(4'-трифторметилфенил)-4-(1''-метил-3''-трифторметилпиразол-5''-илокси)пиримидин,
6-метокси-2-(4'-трифторметилфенил)-4-(2'-хлорпирид-4'-илокси)пиримидин,
5-метокси-2-(4'-трифторметилфенил)-4-(3''-трифторметилфенокси)пиримидин,
5-метокси-2-(4'-трифторметилфенил)-4-(1''-метил-3''-трифторметилпиразол-5''-илокси)пиримидин,
5-метокси-2-(4'-трифторметилфенил)-4-(2'-хлорпирид-4'-илокси)пиримидин.
где A представляет 3-трифторметилфенил, 2-хлорпирид-4-ил или 1-метил-3-трифторметилпиразол-5-ил,
R1 имеет значения, указанные в п.1;
R2, R2' и R2'', независимо, представляют атом водорода, атом фтора, хлора или брома, один или два из них также представляют трифторметил, трифторметокси, R2'', кроме того, может быть C1 - C4 - алкильной группой, в частности трет-бутильной, за исключением соединений, где A - 1-метил-3-трифторметилпиразол-5-ил, R1 - водород, R2, R2'' - водород, R2' - трифторметил; R2 - водород, R2' = R2'' - хлор или метил; R2, R2', R2'' - водород.

где A, R2 и m определены в п.1.
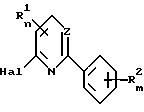
взаимодействует с соединением общей формулы IY
A - XM,
где Z, A, R1, R2, m, n и X определены в п.1;
Hal представляет атом галогена;
M представляет атом металла.
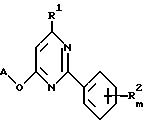
где R1 означает низший алкоксил, низший алкилтио;
A, R2, m имеют значения, указанные в п.1 формулы,
отличающийся тем, что соединение общей формулы XY
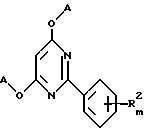
где A, R2, m указаны выше,
подвергают взаимодействию с соединением общей формулы R1 - H или его солью с металлом, где R1 указан выше.
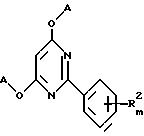
где A, R2 и m указаны в п.1,
отличающийся тем, что соединение формулы
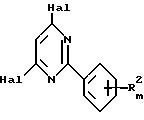
где R2 и m указаны выше,
Hal - атом галогена,
подвергают взаимодействию с соединением формулы
A - OM,
где A имеет значения, указанные выше, и M - атом металла.

Комментарии