Биосовместимый наноматериал для фотосенсибилизации синглетного кислорода и способ его получения - RU2607579C2
Код документа: RU2607579C2
Чертежи

Описание
Изобретение относится к областям медицины и биологии и может быть использовано в методе фотодинамической терапии (ФДТ) онкологических заболеваний.
В современной онкологии, наряду с хирургией, различными радиоизотопными методами, химиотерапией и т.п. признано перспективным направление фотодинамической терапии (ФДТ). В ФДТ исходным действующим агентом является высокоактивный синглетный кислород1O2. Его действие губительно для раковых клеток [Захаров С.Д. Светокислородный эффект в клетках и перспективы его применения в терапии опухолей / С.Д. Захаров, А.В. Иванов // Квантовая электроника. 1999. Т. 29, №3. С. 192-197], а также положительно для детоксикации организма, стимуляции обменных и регенеративных процессов в тканях и фотобактерицидных целей [А.А. Красновский, Фотодинамическая регуляция биологических процессов. Проблемы регуляции в биологических системах, Под общей ред. А.Б. Рубина. М.: Ижевск, (2006)]. Продуцирование синглетного кислорода светом в больных тканях и клетках возможно только в присутствии фотосенсибилизаторов, поскольку прямой фотопереход3О2→1О2 запрещен по орбитальным и спиновым правилам отбора [Шинкаренко Н.В. Синглетный кислород, методы получения и обнаружения / Н.В. Шинкаренко, В.Б. Алесковский // Успехи химии. 1981. T.L. В.3. С. 406-427; Захаров, С.Д. Светокислородный эффект в клетках и перспективы его применения в терапии опухолей / С.Д. Захаров, А.В. Иванов // Квантовая электроника. 1999. Т. 29, №3. С. 192-197].
В качестве фотосенсибилизаторов наибольшее распространение пока получили гетероциклические органические красители, обладающие высоким выходом триплетов. Однако их успешному использованию препятствуют низкопороговая фотодеградация, часто необратимая, а также склонность к внутри- и межмолекулярным взаимодействиям, приводящим к формированию новых форм красителя. В результате спектральные условия фотосенсибилизации нарушаются [А.А. Красновский, Фотодинамическая регуляция биологических процессов. Проблемы регуляции в биологических системах, Под общей ред. А.Б. Рубина. М.: Ижевск, (2006)]. Следовательно, разработка новых более устойчивых к окружению и действию света фотосенсибилизаторов синглетного кислорода для терапии онкологических заболеваний является крайне важным и необходимым предметом исследований в области интегрированных нано- и биотехнологий [С.Д. Захаров, А.В. Иванов, Квантовая электроника. 29, №3. 192-197, (1999); А.А. Красновский, Фотодинамическая регуляция биологических процессов. Проблемы регуляции в биологических системах, Под общей ред. А.Б. Рубина. М.: Ижевск, (2006); A. Fernandez-Fernandez, R. Manchanda, A.J. McGoron, Appl. Biochem. Biotechnol, 165, №7-8, 1628-1651, (2011)].
На сегодняший день реализованы конструкции фотосенсибилизаторов синглетного кислорода на основе фуллеренов [US 5866316, 02.02.1999], кремниевых нанокристаллов [JP 20020176515, 18.06.2002; RU 2329061, 20.07.2008], металлопорфиринов, органических красителей (метиленовый голубой, тионин и др.) и их производных [US 20120302557, 29.11.2012], а также композитов на основе светоизлучающих наночастиц в сочетании с молекулами органических фотосенсибилизаторов [US 20020127224, 12.09.2002].
Так, в патенте US 5866316, 02.02.1999 предложен метод получения фотосенсибилизатора синглетного кислорода на основе фуллеренов С60 в растворе, которые характеризуются квантовым выходом сенсибилизации синглетного кислорода, близким к единице и обладают низкой токсичностью. Однако существенным недостатком фуллеренов, полученных описанным способом, является гидрофобность, а также склонность к агрегации в необходимых для сенсибилизации синглетного кислорода концентрациях, что накладывает ограничения на применение подобного фотосенсибилизатора в ФДТ.
Часть недостатков фотосенсибилизатора, предложенного в патенте US 5866316, 02.02.1999, устранена в патенте RU 2329061, 20.07.2008, где авторы предлагают использовать нанокомпозиты на основе кремниевых нанокристаллов размером 2-100 нм с адсорбированными на поверхности молекулами фуллерена при относительном содержании фуллерена от 0.3 до 4% по весу. Недостатком данного изобретения является использование токсичных растворителей (например, тетрахлорида углерода) при синтезе нанокристаллов кремния. Удовлетворительные приемы очистки синтезируемых нанокристаллов, позволяющие их активно использовать в медицине и биологии, отсутствуют.
Использование органических красителей в качестве фотосенсибилизаторов синглетного кислорода хорошо известно [Methylene blue in photodynamic therapy: From basic mechanisms to clinical applications / Joao Paulo Tardivo, Auro Del Giglio, Carla Santos de Oliveira, Dino Santesso Gabrielli, Helena Couto Junqueira, Dayane Batista Tada, Divinomar Severino, Rozane de Fatima Turchiello, Mauricio S. Baptista Ph.D. // Photodiagnosis and Photodynamic Therapy (2005) 2, 175-191; Баштанов M.E. Влияние растворителей на квантовую эффективность индуцированной синглетным кислородом замедленной флуоресценции фталоцианина при лазерном возбуждении / М.Е. Баштанов, А.А. Красновский // Квантовая электроника. 1999. Т. 26. № 2. С. 163-167]. Так, в патенте US 20120302557, 29.11.2012, описан метод использования растворов метиленового голубого и его производных для ФДТ. Использование растворов метиленового голубого для ФДТ имеет ряд недостатков. Например, ввиду высокой растворимости молекул метиленового голубого при его введении в организм человека возможно распространение вне воздействуемых органов и тканей. Кроме того, использованию растворов метиленового голубого для ФДТ препятствуют трудности, связанные как с низкопороговой фотодеградацией, часто необратимой, так и внутри- и межмолекулярными взаимодействиями, приводящими к формированию новых форм красителя и нарушению спектральных условий сенсибилизации [Красновский А.А. (мл.) Фотодинамическая регуляция биологических процессов // Проблемы регуляции в биологических системах / Под общей ред. А.Б. Рубина. М.: Ижевск. 2006. 480 с.]. Для избежания нежелательных последствий необходимо сопряжение красителя с различными агентами.
Наиболее близким аналогом изобретения является предложенный в патенте US 20020127224, опубликованном 12.09.2002, материал для применения в ФДТ на основе агрегатов различных светоизлучающих полупроводниковых наночастиц (нанокристаллов, квантовых точек, квантовых стержней) и органических фотосенсибилизаторов. При поглощении кванта света происходит возбуждение наночастиц с последующим переносом энергии возбуждения от наночастиц к молекулам фотосенсибилизатора. Фотосенсибилизатор отдает энергию молекулам триплетного кислорода и они переходят в возбужденное синглетное состояние. В качестве наночастиц предлагается использовать CdSe/ZnS либо их смеси с наночастицами TiO2, а в качестве фотосенсибилизаторов различные уже применяемые препараты для лечения онкологических заболеваний, в том числе белковые ингибиторы (тропонин, ангиостатин и др.), различные энзимы, различные красители (methylene blue (метиленовый голубой), индоцианин зеленый и др.) и т.д.
Данный материал обладает рядом недостатков: отсутствуют данные о возможности генерации такими системами синглетного кислорода, предполагается использование квантовых точек, синтезированных с применением высокотоксичного триоктилфосфиноксида (ТОРО), гидрофобность получаемых в таком случае коллоидных растворов, для преодоления которой необходимо введение дополнительных технологических процедур, например, сопряжения наночастиц с веществами меркапто группы (меркаптоуксусной кислотой и др.), что приводит к усложнению технологии и удорожанию конечного продукта, отсутствуют сведения о конкретной реализации предложенного принципа.
Задачей данного изобретения является разработка биосовместимого наноматериала, обладающего способностью фотосенсибилизировать процесс образования синглетного кислорода и способа его получения.
Технический результат настоящего изобретения заключается в расширении арсенала фотосенсибилизаторов синглетного кислорода для фотодинамической терапии.
Технический результат достигается тем, что биосовместимый наноматериал для фотосенсибилизации синглетного кислорода представляет собой низкотоксичные гибридные ассоциаты люминесцирующих коллоидных квантовых точек CdS с катионами метиленового голубого (МВ+) в соотношении 10-1-10-4 (νкрасит/νCdS), а способ его получения включает двуструйное сливания 0,6-5% раствора сульфида натрия и 0,8-7% раствора бромида кадмия в термостатируемом реакторе, с расплавом желатины при постоянной температуре 40°C, согласно изобретению, вводят в полученный коллоидный раствор, содержащий коллоидные квантовые точки CdS, на завершающей стадии кристаллизации квантовых точек раствор катионов МВ+ в соотношении 10-1-10-4 (νкрасит/νCdS), с последующим охлаждением полученного золя до температуры от 4 до 10°C, раствор выдерживают при данной температуре на протяжении суток, после чего полученный желатиновый студень измельчают до размера гранул 5-10 мм, промывают в дистиллированной воде при температуре от 7 до 13°C в течение 30 мин, после чего сцеживается лишняя вода и гранулы нагреваются до температуры свыше 40°C.
В результате получают однородный расплав.
Используют водорастворимые коллоидные квантовые точки сульфида кадмия, синтезированные с помощью низкотемпературного золь-гель метода с использованием низкотоксичных компонентов синтеза в специальном термостатируемом реакторе (Патент на полезную модель РФ 134445, от 20.11.2013). Сопряжение катионов метиленового голубого (МВ+) с коллоидными КТ CdS приводит к увеличению длительности процесса фотосенсибилизации синглетного кислорода за счет блокирования механизмов фотодеградации метиленового голубого, а также предотвращения перехода красителя в другие протолитические и агрегатные формы, не пригодные для фотосенсибилизации синглетного кислорода.
На фиг. 1 приведена модель фотофизических процессов, происходящих при сенсибилизации процесса продуцирования синглетного кислорода катионами МВ+, сопряженным с КТ CdS.
На фиг. 2 представлены спектры: поглощения коллоидных КТ CdS - 1; люминесценции коллоидных КТ CdS - 2; люминесценции ассоциатов коллоидных КТ CdS с катионами метиленового голубого (МВ+), в соотношении 10-2 (νкрасит/νCdS) - 3. На врезке приведены: электронная фотография коллоидных КТ CdS, распределение по размеру коллоидных КТ CdS и рентгеновская дифракция коллоидных КТ CdS.
На фиг. 3 представлены спектры люминесценции синглетного кислорода в растворах: катионов МВ+ при λвозб=660 нм - 1; ассоциатов коллоидных КТ CdS с катионами МВ+ в соотношении 10-2 (νкрасит/νCdS) при λвозб=660 нм - 2; катионов МВ+ при λвозб=405 нм - 3; ассоциатов коллоидных КТ CdS с катионами MB+ в соотношении 10-2 (νкрасит/νCdS) при λвозб=405 нм - 4. На врезке приведены зависимости продуцирования1О2 от времени в растворах катионов МВ+ - 1 и ассоциатов коллоидных КТ CdS с катионами MB+ в соотношении 10-2 (νкрасит/νCdS).
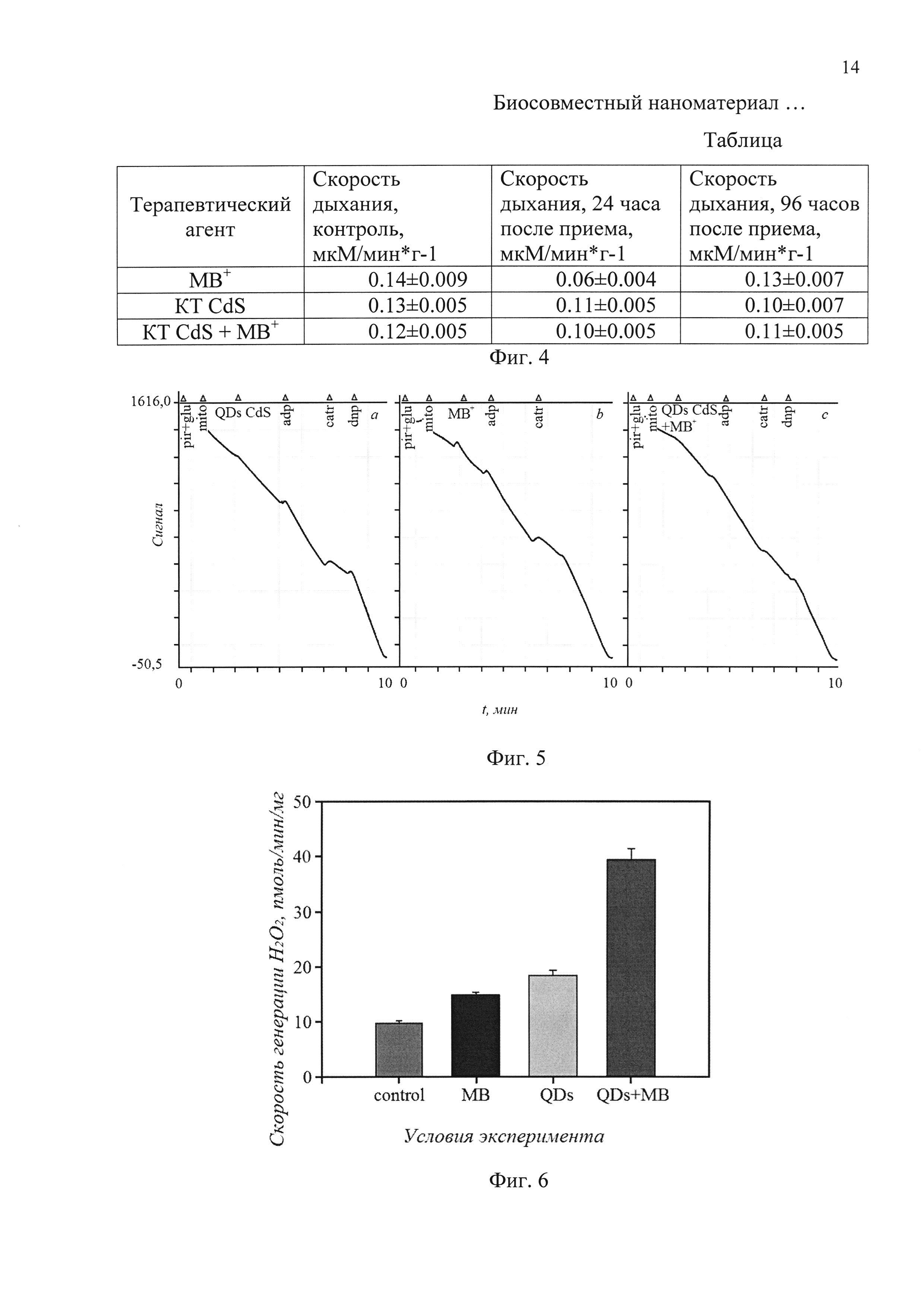
На фиг. 4 приведена таблица интенсивности дыхания крыс Rattus norvegicus в зависимости присутствия КТ CdS, катионов МВ+ и гибридных ассоциатов коллоидных КТ CdS с катионами МВ+.
На фиг. 5 представлены временные диаграммы поглощение кислорода изолированными митохондриями печени крыс в присутствии КТ CdS, катионов МВ+ и гибридных ассоциатов коллоидных КТ CdS с катионами МВ+.
На фиг. 6 приведена гистограмма отражающая влияние КТ CdS, катионов МВ+ и гибридных ассоциатов коллоидных КТ CdS с катионами МВ+ на генерацию перекиси водорода митохондриями печени крыс.
Физический принцип функционирования предложенного биосовместимого наноматериала для продуцирования синглетного кислорода заключается в следующем. Предлагаемый наноматериал обеспечивает возможность получения синглетного кислорода под действием излучения из двух диапазонов (фиг. 1): излучением с длиной волны 600-750 нм, которое соответствует области поглощения катионов метиленового голубого (МВ+), и 380-450 нм, приходящимся на область поглощения квантовых точек CdS. В первом случае при поглощении кванта света непосредственно катионами метиленового голубого (МВ+) (600-750 нм) энергия от молекулы красителя передается кислороду, переводя его из основного триплетного состояния в одно из возбужденных синглетных состояний, при этом наблюдается тушение люминесценции красителя в полосе триплетов. Энергия триплетного уровня возбуждения метиленового голубого 1.47 эВ и при его тушении может происходить только переход в первое синглетное состояние молекулы кислорода [Красновский, А.А. мл. Фотосенсибилизированная люминесценция синглетного кислорода в растворе. / А.А. Красновский // Биофизика. 1976. Т.21. N.4. С. 748-749, Krasnovsky, А.А. Jr. Photoluminescence of singlet oxygen in pigment solutions / A.A. Krasnovsky Jr.: Photochem. Photobiol. 1979. V. 29. № 1. P. 29-36]. Из синглетного состояния молекула кислорода переходит с излучением (λ=1270 нм) в свое основное триплетное состояние. Наличие свечения в этой области позволяет контролировать образование синглетного кислорода. Во втором случае более коротковолновое излучение (380-450 нм) поглощается квантовой точкой CdS, энергия возбуждения которой передается катионам метиленового голубого (МВ+). Далее энергия, запасенная в катионах метиленового голубого (МВ+), передается молекулам кислорода, переводя его из основного триплетного состояния в одно из возбужденных синглетных состояний.
Для получения биосовместимого наноматериала для фотосенсибилизации синглетного кислорода производится следующая последовательность операций. Для синтеза полупроводниковых коллоидных квантовых точек используется 1-5% раствор сульфида натрия и 1.1-7% раствор бромида кадмия в дистиллированной воде температурой от 7 до 13°C; 2.5-5% раствор полимера в дистиллированной воде загружается в реактор однократно до сливания растворов сульфида натрия и бромида кадмия при температуре 20-30°C, причем объем растворов - сульфида натрия: бромида кадмия: полимера 1:1:4, раствор желатина нагревается до 40-90°C, в реактор заливается 96%-этанол 2.5% от объема раствора желатина, после чего производят двуструйное сливание растворов сульфида натрия и бромида кадмия в реактор при постоянном перемешивании со скоростью 100-600 об/мин, по окончании сливания осуществляют перемешивание на протяжении 1-300 мин.
На завершающей стадии кристаллизации коллоидных квантовых точек CdS диспергированых в желатине добавляется раствор метиленового голубого в соотношении 10-l÷10-4 (νкрасит/νCdS)
После указанных процедур проводится охлаждение раствора до температуры от 4 до 10°C и раствор выдерживается при данной температуре на протяжении суток, после чего охлажденный раствор измельчают до размера гранул 5-10 мм, промывка проводится погружением в дистиллированную воду при температуре от 7 до 13°C на 30 мин, после чего сцеживается лишняя вода и гранулы нагреваются до температуры свыше 40°C для получения однородного расплава.
В результате получается биосовместимый наноматериал для фотосенсибилизации синглетного кислорода, представляющий собой гибридные ассоциаты коллоидных КТ CdS размером 2-4 нм с катионами метиленового голубого МВ+ в соотношении 10-1-10-4 (νкрасит/νCdS).
Формирование коллоидных КТ CdS подтверждается данными рентгеноской дифракции и просвечивающей электронной микроскопии (фиг. 2, врезка). Наличие гибридной ассоциации КТ CdS с катионами МВ+ подтверждается наличием провала в спектре люминесценции ассоциатов КТ CdS с катионами МВ+, приходящегося на область поглощения красителя, которого не наблюдалось в спектре люминесценции чистых КТ CdS (фиг. 2).
Фотосенсибилизация синглетного кислорода предлагаемым биосовместимым наноматериалом подтверждалась наличием полосы в районе 1270 нм, соответствующей люминесценции синглетного кислорода (фиг. 3).
Для установления биосовместимости предлагаемого наноматериала проводилась оценка уровня и скорости потребления кислорода у крыс Rattus norvegicus L. (Wistar) возрастом 5 месяцев, так как изменение интенсивности дыхания свидетельствует не только об эффективной, но и безопасной интенсификации работы электрон-транспортной цепи (ЭТЦ).
Для введения наноматериала в организм животных был выбран пероральный путь. Измерение скорости дыхания in vivo проводили с помощью оксиметра Vernier LabQuest (Vernier, США), оснащенного кислородным и углекислотным сенсорами. Животные получали 100 мг терапевтической композиции, через 24 часа осуществляли первое измерение. Выбранная доза не являлась токсической для животных. В течение срока эксперимента смертности среди крыс не наблюдалось. Масса тела также оставалась неизменной. Животные содержались при стандартной температуре 22°C, 12 часовом световом цикле в замкнутом герметичном объеме и перед началом экспериментов содержание кислорода в этом пространстве достигало 18-20%, как в обычной атмосфере.
Данные об оценке уровня и скорости потребления газообразного кислорода лабораторными крысами Rattus norvegicus линии Wistar обобщены в таблице 1. Снижение скорости потребления кислорода в условиях терапии квантовыми точками представляется незначительным и находящимся в пределах статистической погрешности.
КТ CdS и метиленовый голубой оказывают стимулирующее влияние на дыхание изолированных митохондрий печени крыс. При этом вид респираторной кривой не отклоняется от стандартного, что говорит о нормальной реакции митохондрий на присутствие препарата квантовых точек в среде регистрации (Фиг. 5). Поглощение кислорода изолированными митохондриями печени крысы в присутствии квантовых точек, метиленового голубого и гибридных ассоциатов КТ CdS с катионами МВ+ демонстрирует отсутствие токсического эффекта наноматериала (угнетения клеточного дыхания).
Исследование на изолированных митохондриях печени крыс в присутствии красителя метиленового голубого, КТ CdS и гибридных ассоциатов КТ CdS с катионами МВ+ генерации перекиси водорода как основного представителя группы активных форм кислорода, образуемых митохондриями, показало увеличение продукции активных форм кислорода в присутствии наноматериала (фиг. 6). Данный факт указывает на фотосенсибилизированное образование активных форм кислорода в митохондриях в присутствии красителя метиленового голубого, КТ CdS и гибридных ассоциатов КТ CdS с катионами МВ+. При этом дальнейшие добавки к митохондриям ротенона, индуцирующего обратный ток электронов и антимицина, блокирующего Q-цикл, показали, что митохондрии в каждом случае отвечали на них сходным паттерном изменении скорости продукции перекиси, соответствующим таковому в норме. Этот факт свидетельствует о сохранении респираторной активности митохондрий, их молекулярной организации и, таким образом, биосовместимости наноматериала.
Реферат
Группа изобретений относится к области медицины, в частности к онкологии, и описывает биосовместимый наноматериал и способ его получения. Предлагаемый биосовместимый наноматериал представляет собой гибридные ассоциаты коллоидных квантовых точек CdS средними размерами 2-4 нм с катионами метиленового голубого (МВ+) в концентрации 10-10(ν/ν). Способ включает двуструйное сливание 0,6-5% раствора сульфида натрия и 0,8-7% раствора бромида кадмия с расплавом желатины с получением коллоидного раствора, содержащего коллоидные квантовые точки CdS, раствор выдерживают при температуре 4- 10°C, полученный желатиновый студень измельчают до размера гранул 5-10 мм, промывают в дистиллированной воде при температуре от 7 до 13°C в течение 30 мин, сцеживают лишнюю воду и гранулы нагреваются до температуры свыше 40°C. Наноматериал обладает высокой эффективностью генерации синглетного кислорода и удовлетворительными параметрами цитотоксичности, свидетельствующими о его биосовместимости. Изобретение может быть использовано в медицине и биологии для фотодинамической терапии онкологических и других заболеваний человека. 2 н.п. ф-лы, 6 ил.

Комментарии