Соединения и способы лечения инфекций - RU2666540C2
Код документа: RU2666540C2
Чертежи












































Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к соединениям Формулы I, способам лечения или профилактики бактериальной инфекции у субъекта с применением соединения Формулы I, применению соединения Формулы I для производства лекарственного средства для лечения бактериальной инфекции у субъекта, а также к медицинским устройствам, применяемым в способах лечения или профилактики бактериальной инфекции у субъекта.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Заметное увеличение распространения множественной лекарственной устойчивости у болезнетворных грамположительных (G+) (Staphylococcus aureus, Enterococcus spp. и Streptococcus pneumoniae) и грамотрицательных (G-) патогенов (Escherichia colil, Enterobacter spp., Salmonella spp., Acinetobacter baumannii, Klebsiella pneumoniae и Pseudomonas aeruginosa) совпало с беспрецедентным глобальным снижением инвестиций в новые противоинфекционные лекарственные средства. В настоящее время зарегистрировано лишь небольшое количество лекарственных средств для лечения бактериальных инфекций со множественной лекарственной устойчивостью (МЛУ), в результате чего практикующие врачи вынуждены делать выбор в пользу лекарственных средств предыдущего поколения, таких как колистин, с узким спектром действия и значительным риском токсичных побочных эффектов. Кроме того, существует незначительное количество противоинфекционных терапевтических средств новых классов, находящихся в процессе разработки.
С 2000 года, в течение почти 15 лет, Управлением по контролю за продуктами питания и лекарственными средствами (FDA) США было одобрено только 5 антибактериальных агентов с новым механизмом действия: линезолид (оксазолидинон) - в 2000 году, даптомицин (липопептид) - в 2003 году, ретапамулин (плевромутилин) - в 2007 году, фидаксомицин (макролид тиакумицин) - в 2011 году, и бедаквилин (диарилхинолин) - в 2012 году. Примечательно, что ни один из этих агентов не обладает значительной активностью в отношении грамотрицательных бактерий. В 2013 году не было одобрено ни одного из антибактериальных агентов с новым механизмом действия, и на сегодняшний день в 2014 году для одобрения в США были рекомендованы только тедизолид и далбаванцин, которые оба являются аналогами существующих классов. Хотя в настоящее время более 300 противоинфекционных лекарственных средств находятся на различных стадиях разработки, большинство из них, представляют собой ранее одобренные антибактериальные соединения или их производные, которые проходят проверку на возможность применения по новым показаниям.
Кроме того, распространение множественной лекарственной устойчивости среди патогенов, специфичных для животных, наряду с усложнением процедур регистрации и применения противомикробных препаратов у животных, побуждает ветеринаров в большей степени полагаться на традиционные классы противомикробных агентов. Риск передачи зоонозовс МЛУ от животных человеку также вызвал призывы к дальнейшим ограничениям применения некоторых недавно зарегистрированных антибактериальных препаратов, таких как фторхинолоны и цефалоспорины третьего и четвертого поколения.
Эпидемиология развития антибактериальной устойчивости у патогенов человека и животных
Эволюция развития устойчивости во многом обусловлена изменениями в эпидемиологии ключевых организмов с МЛУ. Когда-то ограниченные только больницами и организациями по уходу за престарелыми, метициллин-устойчивые штаммы Staphylococcus aureus (MRSA, methicillin resistant Staphylococcus aureus) в настоящее время распространены среди населения в угрожающих масштабах. Кроме того, штаммы MRSA, приобретенные населением, с большей долей вероятности несут токсин лейкоцидин Пантон-Валентина (ПВЛ), фактор вирулентности, связанный с поражениями кожи и мягких тканей, а также быстрой, молниеносной, некротической пневмонией со значительным числом ассоциированных с ними смертельных исходов. Недавно штаммы MRSA адаптировались к обитанию в ряде значимых видов животных в качестве хозяев, включая домашний скот, лошадей и домашних животных, и известны регулярные случаи их передачи от человека к животному и от животного к человеку. Этот факт имеет важные последствия для передачи штаммов и общественного здоровья. Недавнее обследование 751 австралийских ветеринаров на назальное носительство MRSA показало, что 21,4% ветеринаров, работающих с лошадьми, оказались MRSA-положительными, по сравнению с 4,9% ветеринаров, работающими с мелкими животными, и 0,9% ветеринаров, имевших незначительные контакты с животными. Такого рода смещение в экологии MRSA наряду с появлением устойчивости к новым лекарственным средствам, разработанным специально для MRSA, например, к линезолиду, подтверждает, что срочно необходимы новые противоинфекционные средства для борьбы с MRSA. Более того, больницам, использующим ванкомицин для лечения MRSA, затем приходится бороться со вспышками среди пациентов инфекций, вызванных ванкомицин-устойчивыми энтерококками (VRE), для борьбы с которыми выбор противомикробных средств также ограничен.
Глобальное появление и распространение в обществе высоко вирулентных грамотрицательных (G-) бактерии с МЛУ, таких как Е. coli O25b:ST131, подтверждает, что у бактериальных патогенов могут одновременно развиваться детерминанты как вирулентности, так и устойчивости. Как отголосок недавних эпидемий MRSA, штамм Е. coli O25b:ST131, основной возбудитель инфекций мочевыводящих путей и кровотока в организме человека, в настоящее время выделяют из внекишечных инфекций у домашних животных и птиц. Растущая значимость E. coli O25b:ST131 и других энтеробактерий с МЛУ при их комбинированной устойчивости к фторхинолонам и бета-лактамам расширенного спектра, а также карбапенемам является другой тревожной тенденцией, особенно с учетом того, что за последнее время было разработано лишь небольшое количество противоинфекционных препаратов со спектром действия против «G-» бактерий, за исключением продолжающегося продвижения лекарственных средств класса карбапенемов.
Всемирная организация здравоохранения определила устойчивость к антибиотикам в качестве одного из трех основных угроз здоровью людей в будущем. В недавнем сообщении от Центров профилактики и контроля заболеваемости США (CDC) подсчитано, что «в Соединенных Штатах каждый год более двух миллионов человек заболевают инфекциями, устойчивыми к антибиотикам, и в результате по меньшей мере 23000 из них умирают». Только в США дополнительный медицинские расходы, связанные с лечением и контролем одного случая инфекции, устойчивой к антибиотикам, по оценкам составляют от 18588 $ до 29069 $ в год, в результате чего общие прямые затраты системы здравоохранения США составляют более 20 млрд $ в год. Кроме того, издержки американских семей в плане потери производительности оцениваются более чем в 35 млрд $ в год. Двадцать пять тысяч пациентов в странах Европейского союза (EC) по-прежнему ежегодно умирают в результате инфекций бактериями с МЛУ, несмотря на то, что во многих странах EC имеются лучшие системы надзора за больницами и стратегии инфекционного контроля мире. Затраты EC на здравоохранение и издержки в связи с потерей производительности, связанные с инфекциями с МЛУ, по оценкам составляют по меньшей мере

Существует неудовлетворенная клиническая потребность в антибактериальных агентах с новыми механизмами действия для дополнения и замещения имеющихся в настоящее время антибактериальных агентов, эффективность которых все в большей степени подрывается механизмами устойчивости бактерий. Кроме того, сохраняется потребность в альтернативных антибактериальных агентах в лечении инфекций, вызванных бактериями со множественной устойчивостью. Однако, по сообщению Американского общества инфекционистов и Европейского центра по контролю и профилактике заболеваний, в настоящее время разрабатывается лишь небольшое количество новых препаратов, предлагающих многообещающие результаты, по сравнению с существующими способами лечения (Infectious Diseases Society of America 2010, Clinical Infectious Diseases, 50(8): 1081-1083).
Задачей настоящего изобретения является преодоление по меньшей мере одного из недостатков предшествующего уровня техники.
Обсуждение предшествующего уровня техники, изложенное выше, предназначено для облегчения понимания всего настоящего изобретения. Обсуждение не подразумевает признание или принятие того, что какой-либо из упомянутых источников является или являлся частью общедоступных сведений на дату приоритета заявки.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В соответствии с одним аспектом настоящего изобретения, предложено соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемая соль или пролекарство:

В одном предпочтительном варианте реализации R1 представляет собой H, циклоалкил, или имеет Формулу II или Формулу III;


где R3 представляет собой H, NH2, NHNH2, О-СН2-CH3, NH-С(O)-фенил, NH-хлорфенил, NH-CH2-хлорфенил, NH-N=CH-циклоалкил или имеет Формулу IV, Формулу V или Формулу VI



где A0 представляет собой N, C, CH, или A0 представляет собой C и A0 соединен с R4 посредством R2 с образованием триазольного кольца;
где A1 представляет собой N, C, NH,=CH-CH=N-, =(C6H5)C-CH=N- или имеет Формулу VII;

A2 представляет собой N, С, NH, N-C(O)-фенил, или имеет формулу VII;
где A3, A4, A5, А6, А7, A8, A11, A12, A13, A14, A15, A16, A17, A18, A19, А20, А21, А23, А24, А25, А26 и А27 независимо представляют собой C, O, N, NH, S;
где A9 C, O, N, NH, N-C(O)-O-CH2-CH3, N-C(O)-O-CH(CH3)2, N-C(O)-NH-CH2-CH3, N-С(O)-NH-СН2-фенил, N-C(O)-CH2-CH2-CH2-CH2-CH2-CH3, N-С(O)-СН2-фуран-2-ил;
где A10 представляет собой C, NH, -N=CH-CH=, -N=CH-C(C6H5)=;
где A22 представляет собой CH(CH3)-, -N-CH-, -N-C(CH3)-, N-C(CH2OH)-;
R2 представляет собой H, COOH, CH2NH2, CH2OH, CH2NHNH2, метил, этил, пропил, бутил, циклопентил или имеет Формулу VII, и R2 и R4 соединены вместе с образованием кольца пиримидина, пиразина или триазина, или R2 и R9 соединены вместе с образованием кольца пирролидинила оксиндола;
где R4 представляет собой N, NH, O, S, или R4 и A0 соединены посредством R2 с образованием триазольного кольца, или R4 представляет собой N и R4 и R2 соединены с образованием пиримидинового кольца;
где R7 представляет собой H, Cl, Br, F, OH, CH3, OCH3, SCH3, CN, CCH, CF3, OCF3, SCF3, NO2, бутил, трет-бутил, диметиламино, фенил, н-пропил, изо-пропил, -NH-С(O)-CH3, -СН=СН-СООН, пиперазин-1-ил, или R7 и R8 соединены вместе с образованием замещенного или незамещенного, насыщенного или ненасыщенного алифатического кольца, гетероциклического кольца или бензольного кольца;
где R6, R8, R14, R16, R25 и R27 независимо представляют собой H, OH, Cl, F, Br, CH3, CN, OCH3, COOH, NO2, CF3, R8 и R7 соединены вместе с образованием замещенного или незамещенного, насыщенного или ненасыщенного алифатического кольца, гетероциклического кольца или бензольного кольца, R14 и R15 соединены вместе с образованием замещенного или незамещенного, насыщенного или ненасыщенного алифатического кольца, гетероциклическое кольца или бензольного кольца, R8 и R9 соединены вместе с образованием замещенного или незамещенного, насыщенного или ненасыщенного алифатического кольца, гетероциклического кольца или бензольного кольца, или R14 и R13 соединены вместе с образованием замещенного или незамещенного насыщенного или ненасыщенного алифатического кольца, гетероциклического кольца или бензольного кольца;
где R5, R9, R17, R24 и R28 независимо представляют собой H, O, OH, Cl, F, Br, NH2, CH3, CF3, OCH3, CN, NO2, фенил, -NH-CH(OH)-CH3, -NH-C(O)-CH3, или R9 и R8 соединены вместе с образованием замещенного или незамещенного, насыщенного или ненасыщенного алифатического кольца, гетероциклического кольца или бензольного кольца, или R13 и R14 соединены вместе с образованием замещенного или незамещенного насыщенного или ненасыщенного алифатического кольца, гетероциклического кольца или бензольного кольца;
где R10, R11, R19, R20, R22 и R23 независимо представляют собой H, Cl или Br, или R10 и R11 соединены вместе с образованием замещенного или незамещенного, насыщенного или ненасыщенного алифатического кольца, гетероциклического кольца или бензольного кольца, или R19 и R20 соединены вместе с образованием замещенного или незамещенного, насыщенного или ненасыщенного алифатического кольца, гетероциклического кольца или бензольного кольца, или R22 и R23 соединены вместе с образованием замещенного или незамещенного, насыщенного или ненасыщенного алифатического кольца, гетероциклического кольца или бензольного кольца;
где R12, R18 и R21 независимо представляют собой H, COOH, CH2NH2, СН2ОН, метил, этил, пропил, бутил, циклопентил, или R12 и R13 соединены вместе с образованием кольца пирролидинила оксиндола;
где R15 и R26 независимо представляют собой Н, Cl, Br, F, OH, CH3, OCH3, SCH3, CN, CF3, OCF3, SCF3, NO2, CCH, н-бутил, трет-бутил, диметиламино, фенил, н-пропил, изо-пропил, -NH-С(O)-CH3, -CH=СН-СООН, пиперазин-1-ил, или R15 и R14 соединены вместе с образованием замещенного или незамещенного, насыщенного или ненасыщенного алифатического кольца, гетероциклического кольца или бензольного кольцо;
где

Соединение формулы I предпочтительно представляет собой хлористую соль (хлорид).
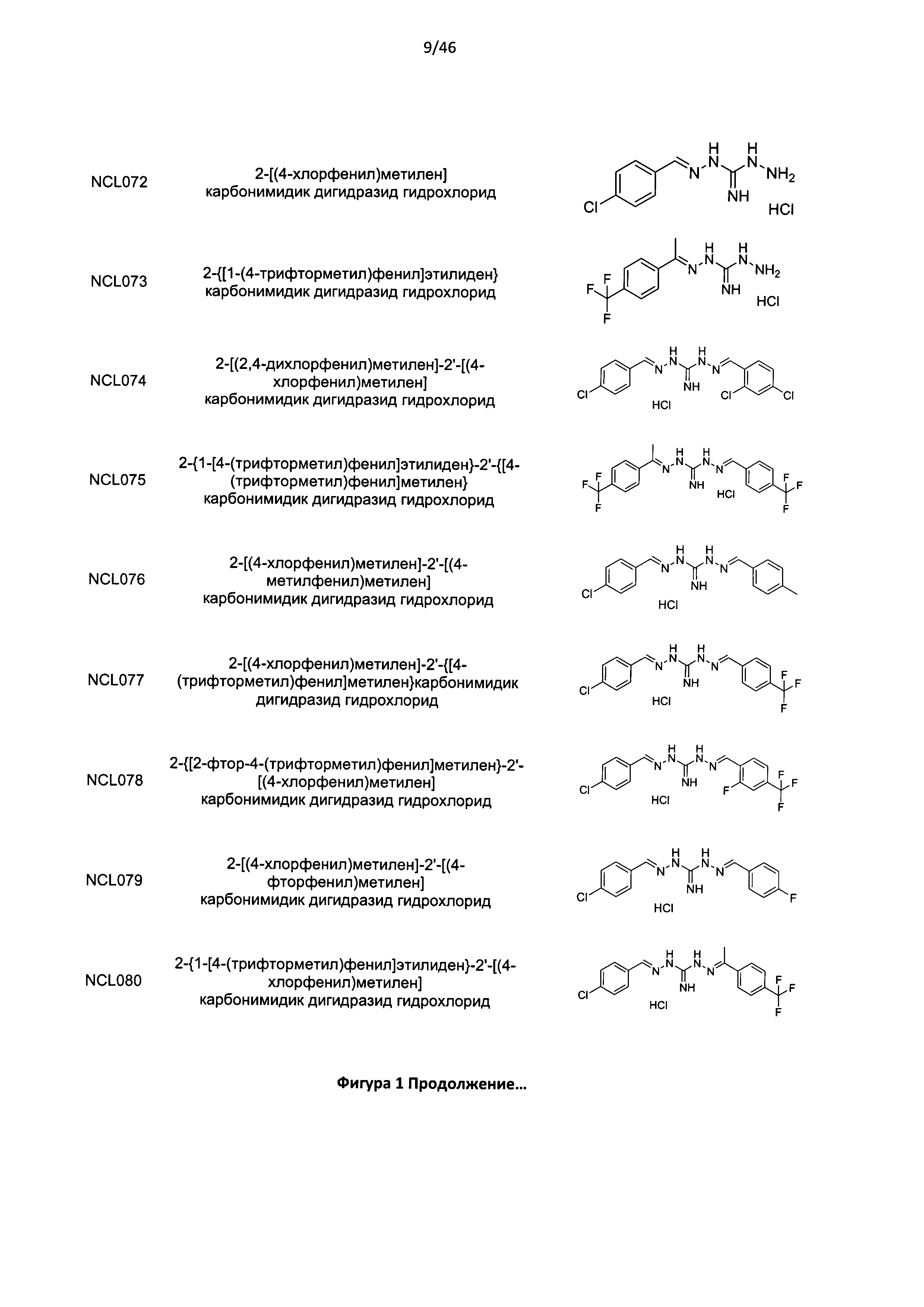
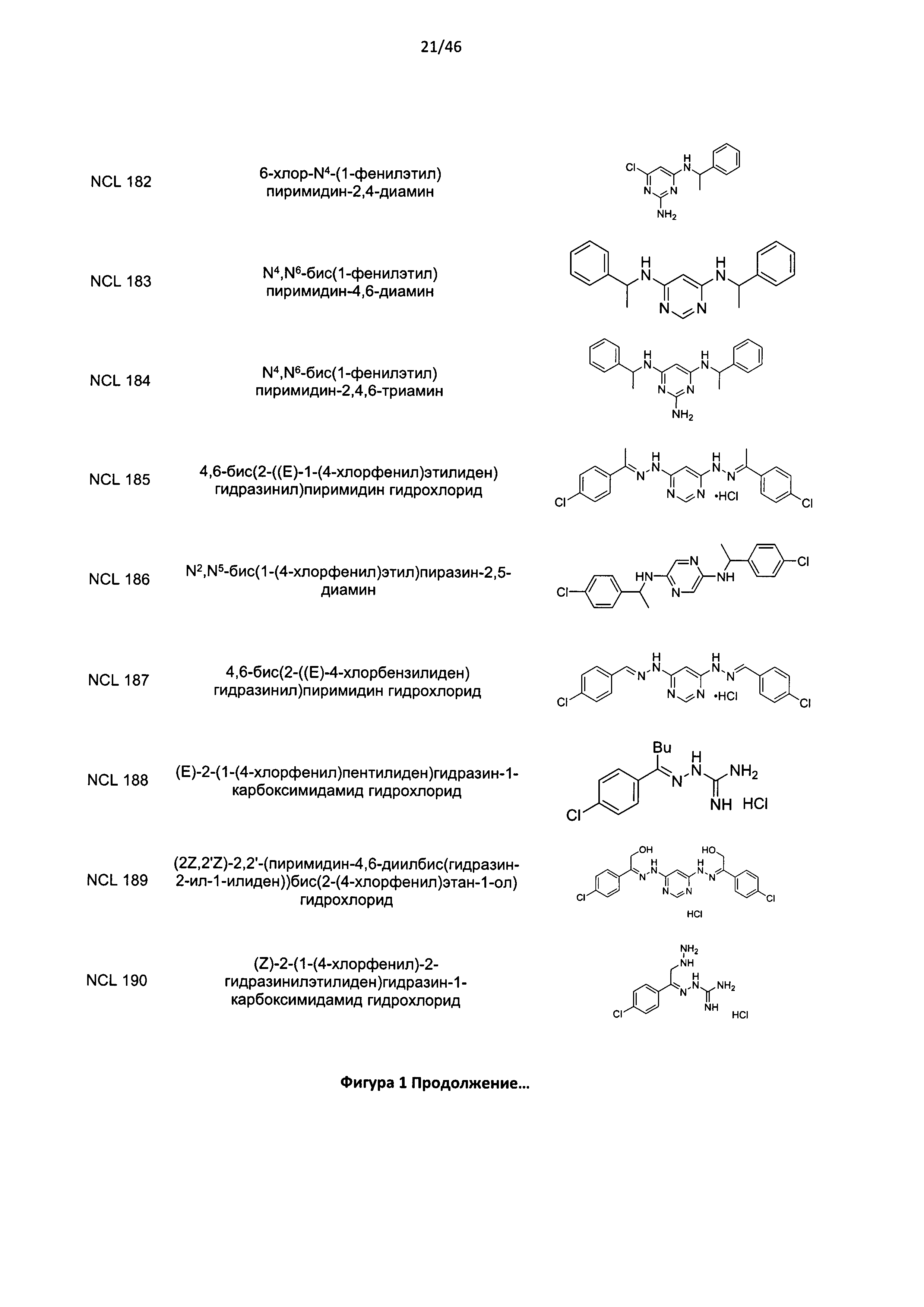
В другом аспекте изобретения предложено соединение или его стереоизомер, таутомер, фармацевтически приемлемая соль или пролекарство, выбранное из списка соединений, представленных на Фигуре 1. В тех случаях, где на Фигуре 1 приведена соль, изобретение охватывает как представленную соль, так и свободное основание этой соли и стереоизомеры, таутомеры, другие фармацевтически приемлемые соли, а также другие пролекарства свободного основания.
Предпочтительно, соединение согласно настоящему изобретению представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство,
где A0 представляет собой C;
где A1 представляет собой N или имеет Формулу VII;
где A2 представляет собой N или NH;
где A3, А4, A6, A7, A11, А12, А14, А15, представляют собой N или C;
где А5, А13, А23, А24, А25, А26 и А27 представляют собой C;
где А8 и А21 представляют собой S;
где A9 представляет собой NH;
где A10 представляет собой N;
где А22 представляет собой -N-CH-; -N-С(CH3)-; или -N-C(CH2OH)-;
где R1 представляет собой Н; имеет Формулу II; Формулу III; представляет собой циклоалкил;
где R2 представляет собой Н; метил; этил; CH2NHNH2; CH2OH; бутил; циклопентил; или имеет формулу VII, и R2 присоединен к R4 с образованием пиримидинового кольца;
где R3 представляет собой NH2; Формулу IV; Формулу V; Формулу VI; NH2, NH-N=CH-циклоалкил или О-СН2-CH3;
где R4 представляет собой NH; O; S; или R4 представляет собой N и R4 и R2 соединены вместе с образованием пиримидинового кольца;
где R7 представляет собой Н; F, Cl; CF3; метил; R7 и R8 соединены вместе с образованием незамещенного бензольного кольца; OH; трет-бутила; фенила; диметиламино; изо-пропила; н-пропила; CN; CCH; н-бутила; SCH3; R7 и R8 соединены вместе с образованием незамещенного ненасыщенного гетероциклического кольца; OCH3; Br; OCF3; пиперазин-1-ила или SCF3;
где R6, R8, R14 и R16 независимо представляют собой H; OH; F; OCH3; CF3; метил; Cl; CN; Br; R8 и R7 соединены вместе с образованием незамещенного бензольного кольца; R8 и R7 соединены вместе с образованием незамещенного ненасыщенного гетероциклического кольца; R14 и R15 соединены вместе с образованием незамещенного бензольного кольца; или R14 и R15 соединены вместе с образованием незамещенного ненасыщенного гетероциклического кольца;
где R5, R9, R13 и R17 независимо представляют собой Н; ОН; NH2; Cl; F; OCH3; ОН; -NH-CH(OH)-CH3;
где R12 представляет собой H; метил; этил; CH2OH; или циклопентил;
где R15 представляет собой Н; F, Cl; CF3; метил; R7 и R8 соединены вместе с образованием незамещенного бензольного кольца; OH; трет-бутила; фенила; диметиламино; изо-пропила; н-пропила; CN; CN; CCH; н-бутила; SCH3; R15 и R14 соединены вместе с образованием незамещенного ненасыщенного гетероциклического кольца; OCH3; Br; OCF3; пиперазин-1-ила или SCF3;
где R24 и R28 независимо представляют собой H; OH или Cl;
где R25 и R27 независимо представляют собой Н или OH;
где R26 представляет собой H; CH3; Br; Cl; OH; диметиламино; -O-P(O)(OEt)2; CF3 или F; и
где

Более предпочтительно, соединение согласно настоящему изобретению представляет собой соединение формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, выбранное из группы, включающей: NCL008; NCL009; NCL023; NCL025; NCL026; NCL029; NCL036; NCL037; NCL039; NCL040; NCL050; NCL061; NCL064; NCL065; NCL068; NCL075; NCL076; NCL078; NCL079; NCL080; NCL081; NCL084; NCL085; NCL086; NCL088; NCL089; NCL090; NCL092; NCL094; NCL095; NCL097; NCL098; NCL099; NCL101; NCL104; NCL105; NCL106; NCL108; NCL111; NCL112; NCL114; NCL115; NCL116; NCL118; NCL119; NCL121; NCL122; NCL123; NCL124; NCL125; NCL126; NCL130; NCL131; NCL132; NCL133; NCL135; NCL136; NCL137; NCL138; NCL139; NCL140; NCL141; NCL144; NCL145; NCL146; NCL147; NCL148; NCL150; NCL152; NCL153; NCL154; NCL156; NCL157; NCL158; NCL159; NCL161; NCL162; NCL164; NCL165; NCL166; NCL167; NCL168; NCL169; NCL170; NCL171; NCL172; NCL173; NCL174; NCL176; NCL177; NCL178; NCL179; NCL180; NCL181; NCL183; NCL184; NCL185; NCL186; NCL187; NCL188; NCL189; NCL190; NCL193; NCL194; NCL195; NCL196; NCL197; NCL198; NCL199; NCL200; NCL201; NCL202; NCL203; NCL204; NCL205; NCL206; NCL207; NCL208; NCL209; NCL210; NCL211; NCL212; NCL213; NCL215; NCL216; NCL217; NCL218; NCL219; NCL220; NCL221; NCL222; NCL223; NCL224; NCL225; NCL226; NCL227; NCL228; NCL229 и NCL230.
Еще более предпочтительно, соединение согласно настоящему изобретению представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, выбранное из группы, включающей: NCL040; NCL078; NCL079; NCL080; NCL081; NCL084; NCL088; NCL089; NCL097; NCL099; NCL123; NCL146; NCL157; NCL158; NCL177; NCL179; NCL188; NCL193; NCL195; NCL196; NCL197; NCL199; NCL202; NCL204; NCL205; NCL215; NCL216; NCL217; NCL219 и NCL221.
Еще более предпочтительно, соединение согласно настоящему изобретению представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, выбранное из группы, включающей: NCL078; NCL079; NCL080; NCL081; NCL084; NCL089; NCL097; NCL157; NCL158; NCL179; NCL188; NCL193; NCL195; NCL196; NCL199; NCL204; NCL216; NCL217; NCL219 и NCL221.
Еще более предпочтительно, соединение согласно настоящему изобретению представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, выбранное из группы, включающей: NCL089; NCL097; NCL157; NCL179; NCL188; NCL193; NCL195; NCL196; NCL216; NCL219 и NCL221.
Наиболее предпочтительно, соединение согласно настоящему изобретению представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, выбранное из группы, включающей: NCL097; NCL157; NCL179; NCL188; NCL195 и NCL196.
В одном предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где соединение не является соединением, выбранным из группы, включающей: NCL812, NCL001, NCL002, NCL003, NCL004, NCL005, NCL006, NCL007, NCL010, NCL011, NCL012, NCL013, NCL014, NCL015, NCL016, NCL017, NCL018, NCL019, NCL020, NCL021, NCL022, NCL024, NCL027, NCL028, NCL030, NCL031, NCL032, NCL033, NCL034, NCL035, NCL038, NCL041, NCL042, NCL043, NCL044, NCL045, NCL046, NCL047, NCL048, NCL049, NCL051, NCL052, NCL053, NCL054, NCL055, NCL056, NCL057, NCL058, NCL059, NCL060, NCL062, NCL063, NCL066, NCL067, NCL069, NCL070, NCL071, NCL072, NCL073, NCL074, NCL077, NCL082, NCL083, NCL087, NCL091, NCL093, NCL096, NCL100, NCL102, NCL103, NCL107, NCL109, NCL110, NCL113, NCL117, NCL120, NCL127, NCL128, NCL129, NCL134, NCL142, NCL143, NCL149, NCL151, NCL155, NCL160, NCL163, NCL175, NCL182, NCL191, NCL192 и NCL214.
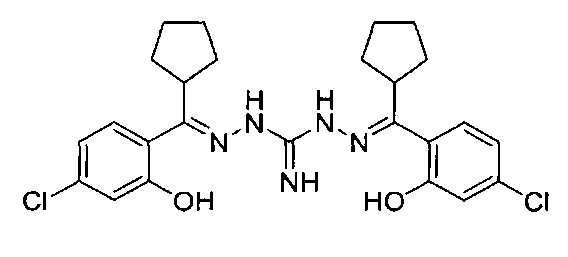
В предпочтительном аспекте настоящего изобретения соединение Формулы I не является робенидином (также упоминается в настоящей заявке как NCL812 и также известен как 1,3-бис[(E)-(4-хлорфенил)метиленамино]гуанидин), который имеет следующую структуру:

В одном предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, А4, А5, A6, А7, A11, А12, А13, A14 и А15 представляют собой C; R2, R5, R6, R7, R9, R12, R13, R15, R16, R17 представляют собой Н; R4 представляет собой O; R8 и R14 представляют собой CF3; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 представляет собой NH2; A1 представляет собой N и A2 представляет собой NH; A0, A3, A4, А5, A6 и А7 представляют собой C; R2, R5, R6, R7, и R8 представляют собой H; R4 представляет собой NH; R9 представляет собой Cl; и


В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, А5, A6, А7, A11, А12, А13, А14 и А15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, R16, R17 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой F; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, А3, A4, А5, A6, А7, A11, А12, A13, A14 и A15 представляют собой C; R2, R5, R6, R7, R9, R12, R13, R15, R16, R17 представляют собой Н; R4 представляет собой NH; R8 и R14 представляют собой F; и


В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV A1 и A10 представляют собой N; А2 и А9 представляют собой NH; А0, А3, А4, A5, А6, А7, A11, А12, А13, А14 и А15 представляют собой C; R2, R5, R6, R7, R8, R12, R14, R15, R16, R17 представляют собой H; R4 представляет собой NH; R9 и R13 представляют собой OCH3; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; А2 и А9 представляют собой NH; А0, А3, А4, А5, А6, А7, А11, А12, A13, А14 и А15 представляют собой C; R2, R5, R6, R7, R9, R12, R13, R15, R16, R17 представляют собой H; R4 представляет собой NH; R8 и R14 представляют собой OCH3; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 представляет собой NH2; A1 представляет собой N; A2 представляет собой NH; A0, А3, A4, A5, A6 и A7 представляют собой C; R2, R5, R6, R8 и R9 представляют собой H; R4 представляет собой NH; R7 представляет собой Cl; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, А13, А14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, R16, R17 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой CF3; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, А3, A4, A5, A6, A7, A11, А12, А13, А14 и А15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, R16, R17 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой метил; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, А12, А13, А14 и А15 представляют собой C; R2, R5, R6, R7, R8, R12, R14, R15, R16, R17 представляют собой Н; R4 представляет собой NH; R9 и R13 представляют собой метил; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, А3, A4, A5, A6, A7, A11, A12, A13, А14 и A15 представляют собой C; R2, R5, R6, R7, R9, R12, R13, R15, R16 и R17 представляют собой H; R4 представляет собой NH; R8 и R14 представляют собой метил; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 представляет собой NH2; A1 представляет собой N; A2 представляет собой NH; A0, А3, A4, A5, A6 и A7 представляют собой C; R2, R5, R6, R8, и R9 представляют собой H; R4 представляет собой NH; R7 представляет собой CF3; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 представляет собой NH2; A1 представляет собой N; A2 представляет собой NH; A0, A3, A4, A5, A6 и A7 представляют собой C; R2, R5, R6, R7, и R9 представляют собой H; R4 представляет собой NH; R8 представляет собой CF3; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 представляет собой NH2; A1 представляет собой N; A2 представляет собой NH; A0, А3, A4, A5, A6 и A7 представляют собой C; R2, R5, R6, R8, и R9 представляют собой H; R4 представляет собой NH; R7 представляет собой метил; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 представляет собой NH2; A1 представляет собой N; A2 представляет собой NH; A0, A3, A4, A5, A6 и A7 представляют собой C; R2, R5, R6, R7, и R9 представляют собой H; R4 представляет собой NH; R8 представляет собой Cl; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, А12, A13, А14 и A15 представляют собой C; R2, R5, R6, R7, R9, R12, R13, R15, R16, R17 представляют собой Н; R4 представляет собой NH; R8 и R14 представляют собой Cl; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, А12, А13, A14 и A15 представляют собой C; R2 и R12 представляют собой метил; R5, R6, R8, R9, R13, R14, R16, R17 представляют собой Н; R4 представляет собой NH; R7 и R15 представляют собой CF3; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, А3, A4, A5, A6, A7, A11, А12, A13, A14 и A15 представляют собой C; R2 и R12 представляют собой метил; R5, R6, R8, R9, R13, R14, R16 и R17 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой Cl; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 представляет собой NHNH2; A1 представляет собой N; A2 представляет собой NH; A0, A3, A4, A5, A6 и A7 представляют собой C; R2 представляет собой метил, R5, R6, R8 и R9 представляют собой Н; R4 представляет собой NH; R7 представляет собой Cl; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, А3, A4, A5, A6, A7, А11, А12, А13, А14 и A10 представляют собой C; R2, R5, R6, R7, R9, R12, R13, R15, R16, и R17 представляют собой H; R4 представляет собой S; R8 и R14 представляют собой Cl; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 представляет собой NH2; A1 представляет собой N; A2 представляет собой NH; A0, A3, A4, A5, A6 и A7 представляют собой C; R2, R5, R6, R8, и R9 представляют собой H; R4 представляет собой NH; R7 представляет собой Cl; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 представляет собой NHNH2; A1 представляет собой N; A2 представляет собой NH; A0, A3, A4, A5, A6 и A7 представляют собой C; R2 представляет собой метил; R5, R6, R8, и R9 представляют собой Н; R4 представляет собой NH; R7 представляет собой CF3; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, А3, A4, A5, A6, A7, A11, A12, А13, А14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, и R16 представляют собой H; R4 представляет собой NH; R7, R15 и R17 представляют собой Cl; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, А3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, и R16 представляют собой H; R4 представляет собой NH; R7 представляет собой Cl; R15 представляет собой CF3; R17 представляет собой F; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, R16 и R17 представляют собой Н; R4 представляет собой NH; R7 представляет собой Cl; R15 представляет собой F; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, А3, A4, A5, A6, A7, A11, A12, А13, А14 и A15 представляют собой C; R2, R5, R6, R8, R9, R13, R14, R16 и R17 представляют собой H; R4 представляет собой NH; R7 представляет собой Cl; R12 представляет собой метил; R15 представляет собой CF3; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, А11, A12, А13, A14 и A15 представляют собой C; R2, R5, R6, R8, R9, R13, R14, R16 и R17 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой Cl; R12 представляет собой метил; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, А13, А14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, R15, и R16 представляют собой H; R4 представляет собой NH; R7 и R17 представляют собой Cl; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, А3, A4, A5, A6, A7, A11, A12, А13, А14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, и R16 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой Cl; R17 представляет собой F; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, А13, А14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R15, R16, и R17 представляют собой H; R4 представляет собой NH; R7 представляет собой Cl; R14 представляет собой CN; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, А11, A12, А13, А14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, R15, и R16 представляют собой H; R4 представляет собой NH; R7 представляет собой Cl; R17 представляет собой F; и


В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, А11, A12, A13, A14 и A15 представляют собой C; R2 и R12 представляют собой метил; R5, R6, R8, R9, R13, R14, R16, и R17 представляют собой Н; R4 представляет собой NH; R7 представляет собой Cl; R15 представляет собой CF3; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R9, R12, R13, R16, и R17 представляют собой Н; R4 представляет собой NH; R7 и R8 соединены вместе с образованием незамещенного бензольного кольца; R14 и R15 соединены вместе с образованием незамещенного бензольного кольца; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где A0 представляет собой C; A1 представляет собой N; A2 представляет собой NH; R1 представляет собой циклогексил; R3 представляет собой NH-N=CH-циклогексил; R4 представляет собой NH; R2 представляет собой Н; и


В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, А3, A4, A5, A6, A7,, A12, A13, А14 и A15 представляют собой C; R2, R5, R9, R12, R13 и R17 представляют собой Н; R4 представляет собой NH; R6, R7, R8, R14, R15, и R16 представляют собой ОН; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, R16 и R17 представляют собой Н; R4 представляет собой NH; R7 и R15 представляют собой трет-бутил; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, А3, A4, A5, A6, A7, A11, A12, A13, А14 и A15 представляют собой C; R2, R7, R8, R9, R12, R13, R14, и R15 представляют собой Н; R4 представляет собой NH; R5, R6, R16, и R17 представляют собой OH; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, А3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R8, R12, R14, и R17 представляют собой Н; R4 представляет собой NH; R6, R7, R9, R13, R15, и R16 представляют собой ОН; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, А14 и A15 представляют собой C; R2, R5, R6, R12, R16, и R17 представляют собой Н; R4 представляет собой NH; R7, R8, R9, R13, R14, и R15 представляют собой ОН; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, А14 и A15 представляют собой C; R2, R6, R7, R8, R9, R12, R13, R14, R15, и R16 представляют собой H; R4 представляет собой NH; R5 и R17 представляют собой ОН; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, А11, A12, A13, A14 и A15 представляют собой C; R2, R5, R7, R8, R9, R12, R13, R14, R15, и R17 представляют собой H; R4 представляет собой NH; R6 и R16 представляют собой ОН; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, А14 и A15 представляют собой C; R2, R5, R8, R9, R12, R13, R14, и R17 представляют собой Н; R4 представляет собой NH; R6, R7, R15, и R16 представляют собой ОН; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, А3, A4, A5, A6, A7, A11, A12, A13, А14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, R16, и R17 представляют собой H; R4 представляет собой NH; R7 и R15 are phenyl; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, А11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, R16, и R17 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой диметиламино; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, А3, A4, A5, A6, A7, А11, A12, A13, A14 и A15 представляют собой C; R2, R5, R8, R9, R12, R13, R14, и R17 представляют собой Н; R4 представляет собой NH; R6 и R16 представляют собой OCH3; R7 и R15 представляют собой ОН; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, А3, A4, A5, A6, A7, А11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, R16, и R17 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой изо-пропил; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, А11, A12, A13, А14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, R16, и R17 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой N-пропил; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, А3, A4, A5, A6, A7, A11, A12, A13, А14 и A15 представляют собой C; R2, R5, R8, R9, R12, R13, R14, и R17 представляют собой H; R4 представляет собой NH; R6, R7, R15, и R16 представляют собой F; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, А3, A4, A5, A6, A7, A11, A12, A13, А14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, R16, и R17 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой ССН; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R7, R8, R9, R12, R13, R14, R15, и R17 представляют собой H; R4 представляет собой NH; R6 и R16 представляют собой Br; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, А3, A4, A5, A6, A7, A11, A12, A13, А14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, R16, и R17 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой бутил; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 представляет собой -C(C6H5)-CH-N- и A10 представляет собой -N=CH-C(C6H5)=; A2 и A9 представляют собой NH; A0, A3, А4, A5, A6, A7, A11, A12, A13, А14 и A15 представляют собой C; R2, R5, R6, R7, R8, R9, R12, R13, R14, R15, R16, и R17 представляют собой Н; R4 представляет собой NH; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, А3, A4, A5, A6, A7, A11, A12, A13, А14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, R16, и R17 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой CH3S; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу III; R3 имеет Формулу VI; A0 представляет собой C; R2 и R21 представляют собой Н; A1 и A20 представляют собой N; A2 и A19 представляют собой NH; A8 и A21 представляют собой S; R4 представляет собой NH; R10 и R11 соединены вместе с образованием замещенного бензольного кольца; R22 и R23 соединены вместе с образованием замещенного бензольного кольца; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, А14 и A15 представляют собой C; R2 и R12 представляют собой метил; R5, R6, R7, R8, R9, R13, R14, R15, R16, и R17 представляют собой Н; R4 представляет собой NH; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, А3, A4, A5, A6, A7, A11, A12, A13, А14 и A15 представляют собой C; R2, R5, R6, R9, R12, R13, R16, и R17 представляют собой Н; R4 представляет собой NH; R7 и R8 соединены вместе с образованием незамещенного гетероциклического кольца; R14 и R15 соединены вместе с образованием незамещенного ненасыщенного гетероциклического кольца; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 представляет собой =CH-CH=N- и A10 представляет собой -N-(CH)2-; A2 и A9 представляют собой NH; A0, А3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, R16, и R17 представляют собой Н; R4 представляет собой NH; R7 и R15 представляют собой OCH3; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, А14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, R16, и R17 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой ОН; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, А14 и A15 представляют собой C; R2 и R12 представляют собой этил; R5, R6, R8, R9, R13, R14, R16, и R17 представляют собой Н; R4 представляет собой NH; R7 и R15 представляют собой Cl; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, А4, A5, A6, А7, A11, A12, A13, A14 и A15 представляют собой C; R2 и R12 представляют собой метил; R5, R6, R8, R9, R13, R14, R16, и R17 представляют собой Н; R4 представляет собой NH; R7 и R15 представляют собой Br; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, А14 и A15 представляют собой C; R2, R5, R6, R8, R12, R14, R16, и R17 представляют собой Н; R4 представляет собой NH; R7 и R15 представляют собой Cl; R9 и R13 представляют собой NH2; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, А14 и A15 представляют собой C; R2 и R12 представляют собой этил; R5 и R17 представляют собой ОН; R6, R8, R9, R13, R14, и R16 представляют собой Н; R4 представляет собой NH; R7 и R15 представляют собой Cl; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, А4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2 и R12 представляют собой циклопентил; R5 и R17 представляют собой ОН; R6, R8, R9, R13, R14, и R16 представляют собой Н; R4 представляет собой NH; R7 и R15 представляют собой Cl; и


В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, А3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, R16 и R17 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой OCF3; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, А3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2 и R12 представляют собой метил; R5, R6, R8, R9, R13, R14, R16 и R17 представляют собой Н; R4 представляет собой NH; R7 и R15 представляют собой пиперазин-1-ил; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 представляет собой О-СН2-CH3; A1 представляет собой N; A2 представляет собой NH; A0, A3, A4, A5, A6 и A7 представляют собой C; R2 представляет собой метил; R5, R6, R8, и R9 представляют собой Н; R4 представляет собой NH; R7 представляет собой Cl; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, А14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, R16 и R17 представляют собой Н; R4 представляет собой NH; R7 и R15 представляют собой SCF3; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, А3, A4, A5, A6, A7, A11, A12, A13, А14 и A15 представляют собой C; R2, R6, R8, R9, R12, R13, R14, и R16 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой Cl; R5 и R17 are -NH-CH(OH)-CH3; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где A0 представляет собой C; R1 представляет собой Н; A2 и R4 представляют собой N; R3 представляет собой NH2; A1 имеет Формулу VII; R2 имеет Формулу VII и R2 соединен с R4 с образованием пиримидинового кольца;


В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 представляет собой NH2; A1 представляет собой N; A2 и R4 представляют собой NH; A0, A3, A4, A5, A6 и A7 представляют собой C; R5, R6, R8, и R9 представляют собой Н; R2 представляет собой бутил; R7 представляет собой Cl; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где A0 представляет собой C; R1 представляет собой Н; A2 и R4 представляют собой N; R3 представляет собой NH2; A1 имеет Формулу VII; R2 имеет Формулу VII и R2 соединен с R4 с образованием пиримидинового кольца;


В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где A0 представляет собой C; R1 представляет собой Н; A2 и R4 представляют собой N; R3 представляет собой NH2; A1 имеет Формулу VII; R2 имеет Формулу VII и R2 соединен с R4 с образованием пиримидинового кольца;


В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где A0 представляет собой C; R1 представляет собой Н; A2 и R4 представляют собой N; R3 представляет собой NH2; A1 имеет Формулу VII; R2 имеет Формулу VII и R2 соединен с R4 с образованием пиримидинового кольца;


В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где A0 представляет собой C; R1 представляет собой Н; A2 и R4 представляют собой N; R3 представляет собой NH2; A1 имеет Формулу VII; R2 имеет Формулу VII и R2 соединен с R4 с образованием пиримидинового кольца;


В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где A0 представляет собой C; R1 представляет собой Н; A2 и R4 представляют собой N; R3 представляет собой NH2; A1 имеет Формулу VII; R2 имеет Формулу VII и R2 соединен с R4 с образованием пиримидинового кольца;


В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R6, R8, R9, R12, R13, R14, и R16 представляют собой Н; R4 представляет собой NH; R7 и R15 представляют собой Cl; R5 и R17 представляют собой F; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, А3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2 и R12 представляют собой метил; R5, R6, R8, R9, R13, R14, R16 и R17 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой CH3; и


В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 имеет Формулу II; R3 имеет Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, А3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2 и R12 представляют собой метил; R5, R6, R8, R9, R13, R14, R16 и R17 представляют собой Н; R4 представляет собой NH; R7 и R15 представляют собой трет-бутил; и



В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где A0 представляет собой C; R1 представляет собой Н; A2 и R4 представляют собой N; R3 представляет собой NH2; A1 имеет Формулу VII; R2 имеет Формулу VII и R2 соединен с R4 с образованием пиримидинового кольца;


В соответствии с другим аспектом настоящего изобретения, предложен способ лечения или профилактики бактериальной колонизации или инфекции у субъекта, включающий стадию: введения субъекту терапевтически эффективного количества соединения Формулы I, или его терапевтически приемлемой соли. В этом аспекте бактериальная колонизация или инфекция вызвана бактериальным агентом. Способ лечения или профилактики бактериальной инфекции или колонизации у субъекта также может включать введение фармацевтической или ветеринарной композиции согласно настоящему изобретению.
В соответствии с другим аспектом настоящего изобретения, предложено применение соединения Формулы I или терапевтически приемлемой соли, в изготовлении лекарственного средства для лечения бактериальной колонизации или инфекции у субъекта. В этом аспекте бактериальная инфекция вызвана бактериальным агентом.
Субъект может представлять собой любой субъект, который может быть колонизирован и инфицирован бактериями. Субъект может представлять собой млекопитающее, рыбу или птицу. Предпочтительно субъект выбран из группы, включающей, но не ограниченной перечисленными, человека, псовых, кошачьих, крупный рогатый скот, овец, коз, других видов жвачных, свиней, лошадей, птиц или рыб.
Соединение Формулы I можно вводить субъекту в дозе, выбранной из группы, включающей от 0,1 мг до 250 мг/кг массы тела, предпочтительно от 1 мг/кг до 100 мг/кг массы тела, и более предпочтительно от 5 мг/кг до 50 мг/кг массы тела. Соединение Формулы I можно вводить субъекту с помощью режима дозирования, выбранного из группы, включающей: каждый час, три раза в день; два раза в день; ежедневно; через день; два раза в неделю; один раз в неделю; один раз в две недели; один раз в месяц; один раз в два месяца, или путем инфузии с постоянной скоростью или с переменной скоростью. Предпочтительно, соединение Формулы I вводят до тех пор, пока колонизация или признаки и симптомы инфекции или колонизации не будут по меньшей мере частично излечены или облегчены.
В одном варианте реализации концентрация соединения Формулы I (или метаболита) в крови субъекта после лечения находится в пределах диапазона, выбранного из группы, включающей, но не ограниченной перечисленными: от 0,1 до 10 мкг/мл через 2 часа, от 1 до 200 мкг/мл через 12 часов; от 0,1 до 5 мкг/мл после 24 часов; от 0,01 до 2 мкг/мл после 48 часов; от 0,0001 до 1 мкг/мл после 72 часов. Предпочтительно, концентрация выбрана из группы, включающей, но не ограниченной перечисленными, менее чем 200 мкг/мл после 12 часов; менее чем 5 мкг/мл после 24 часов; менее чем 1 мкг/мл после 48 часов и менее чем 0,5 мкг/мл после 72 часов.
Агент, вызывающий бактериальную инфекцию, представляет собой бактериальный агент. В одном предпочтительном варианте реализации агент не является видом простейших B одном предпочтительном варианте реализации агент не является простейшим группы кокцидий. Более предпочтительно агент не представляет собой ни Clostridiumperfringens, ни гетеротрофные виды бактерий, присутствующие в образцах почвы, собранных Хансеном и соавторами в Жиндеваде, Дания, как описано в следующих статьях: Hansenetal. 2012, Chemosphere, 86: 212-215; and Hansenetal. 2009, Environmental Pollution 157: 474-480.
В другом варианте реализации бактериальный агент является грамотрицательным. В другом варианте реализации бактериальный агент является грамположительным. В другом варианте реализации бактериальный агент не имеет клеточной стенки. В другом варианте реализации бактериальная инфекция вызвана смесью по меньшей мере двух агентов, выбранных из группы, включающей: грамотрицательных, грамположительных бактериальных агентов и бактериальных агентов, не имеющих клеточной стенки.
Бактериальный агент, вызывающий бактериальную инфекцию, может представлять собой грамположительный бактериальный агент, выбранный из группы, включающей, но не ограниченной перечисленными, Staphylococcus spp, стрептококки, Enterococcus spp, Leuconostoc spp, Corynebacterium spp, Arcanobacteria spp, Trueperella spp, Rhodococcus spp, Bacillus spp, анаэробные кокки, анаэробные грамположительные неспорулирующие бациллы, Actinomyces spp, Clostridium spp, Nocardia spp, Erysipelothrix spp, Listeriaspp, Kytococcus spp, Mycoplasma spp, Ureaplasma spp и Mycobacterium spp.
В одном варианте реализации бактериальный агент является грамположительным и выбран из группы, включающей, но не ограниченной перечисленными, Staphylococcus spp. Примеры бактерий Staphylococcus spp включают Staphylococcus epidermidis, Staphylococcus haemolyticus, Staphylococcus lugdunensis, Staphylococcus saprophytics, Staphylococcus auricularis, Staphylococcus capitis, Staphylococcus caprae, Staphylococcus carnosus, Staphylococcus cohnii, Staphylococcus hominis, Staphylococcus pasteuri, Staphylococcus pettenkoferi, Staphylococcus pulvereri, Staphylococcus saccharolyticus, Staphylococcus simulans, Staphylococcus schleiferi, Staphylococcus warneri, Staphylococcus xylosus, Staphylococcus arlettae, Staphylococcus caseolyticus, Staphylococcus chromogenes, Staphylococcus condimenti, Staphylococcus delphini, Staphylococcus equorum, Staphylococcus felis, Staphylococcus fleurettii, Staphylococcus gallinarum, Staphylococcus hyicus, Staphylococcus intermedius, Staphylococcus kloosii, Staphylococcus lentus, Staphylococcus lutrae, Staphylococcus muscae, Staphylococcus nepalensis, Staphylococcus piscifermentans, Staphylococcus pseudintermedius, Staphylococcus sciuri, Staphylococcus simiae, Staphylococcus succinus и Staphylococcus vitulinus.
В другом варианте реализации бактериальный агент является грамположительным и выбран из группы, включающей, но не ограниченной перечисленными, Streptococcus spp. Примеры Streptococcus spp включают Streptococcus agalactiae, Streptococcus alactolyticus, Streptococcus anginosus, Streptococcus canis, Streptococcus constellatus, Streptococcus cricetus, Streptococcus cristatus, Streptococcus downei, Streptococcus dysgalactiaesubsp. dysgalactiae, Streptococcus dysgalactiaesubsp. equisimilis, Streptococcus equi subsp. equi, Streptococcus equi subsp. zooepidemicus, Streptococcus ferus, Streptococcus gallolyticus subsp. gallolyticus (ранее Streptococcus bovis биотип i), Streptococcus gallolyticus subsp. pasteurianus (ранее Streptococcus bovis биотип ii.2), Streptococcus gordonii, Streptococcus hyointestinalis, Streptococcus hyovaginalis, Streptococcus infantarius, Streptococcus infantariussvbspinfantarius, Streptococcus infantis, Streptococcus iniae, Streptococcus intermedius, Streptococcus lutetiensis (ранее Streptococcus bovis биотип ii.1), Streptococcus macaccae, Streptococcus mitis, Streptococcus mutans, Streptococcus oralis, Streptococcus orisratti, Streptococcus parasanguinis, Streptococcus peroris, Streptococcus pneumoniae, Streptococcus porcinus, Streptococcus pseudintermedius, Streptococcus pyogenes, Streptococcus ratti, Streptococcus salivarius, Streptococcus sanguinis, Streptococcus sobrinus, Streptococcus suis, Streptococcus thermophilus, Streptococcusvestibularis, а также варианты стрептококков по потребляемым питательным веществам (недостаточность по питательным веществам) (Abiotrophia defectiva, Granulicatella adiacens, Granulicatella elegans и Granulicatella para-adiacens) и родственные виды, такие как Rothia mucilaginosa (ранее Stomatococcus mucilaginosus) и Pediococcus.
В другом варианте реализации бактериальный агент является грамположительным и выбран из группы, включающей, но не ограниченной перечисленными, Enterococcus spp. Примеры Enterococcus spp включают Enterococcus faecalis, Enterococcus faecium, Enterococcus gallinarum, Enterococcus durans, Enterococcus avium, Enterococcus raffinosus, Enterococcus pallens, Enterococcus gilvus, Enterococcus cecorum, Enterococcus malodoratus, Enterococcus italicus, Enterococcus sanguinicola, Enterococcus mundtii, Enterococcus casseliflavus/flavescens, Enterococcus dispar, Enterococcus hirae, Enterococcus pseudoavium и Enterococcus bovis.
В другом варианте реализации бактериальный агент является грамположительным и выбраны из группы, включающей, но не ограниченной перечисленными, Leuconostocspp. Примеры Leuconostoc spp. включают Leuconostoc mesenteroides, Leuconostoc pseudomesenteroides, Leuconostoc paramesenteroides, Leuconostoc citreum и Leuconostoc lactis.
В другом варианте реализации бактериальный агент является грамположительным и выбран из группы, включающей, но не ограниченной перечисленными, Corynebacterium spp. Примеры Corynebacterium spp включают нелипофильные ферментативные виды Corynebacterium spp, такие как Corynebacterium ulcerans, Corynebacterium pseudotuberculosis, Corynebacterium xerosis, Corynebacterium striatum, Corynebacterium minutissimum, Corynebacterium amycolatum, Corynebacterium glucuronolyticum, Corynebacterium argentoratense, Corynebacterium matruchotii, Corynebacterium riegelii, Corynebacterium confusum, Corynebacterium cystidis, Corynebacterium diphtheria, Corynebacterium simulans, Corynebacterium sundvallense, Corynebacterium thomssensii, Corynebacterium freneyi и Corynebacterium aurimucosum, нелипофильные неферментативные виды Corynebacterium spp, такие как Corynebacterium afermentansafermentans, Corynebacterium auris, Corynebacterium pseudodiphtheriticumw Corynebacterium propinquum, и липофильные виды Corynebacterium spp, такие как Corynebacterium jeikeium, Corynebacterium urealyticum, Corynebacterium afermentanslipophilum, Corynebacterium accolens, Corynebacterium macginleyi, Corynebacterium tuberculostearum, Corynebacterium kroppenstedtii, Corynebacterium kutscheri, Corynebacterium pilosum, Corynebacterium bovis, CDCcoryneformгрупп-1 и Gb Corynebacterium lipophiloflavum, а также другие виды Corynebacterium spp, такие как Turicella, Arthrobacter, Brevibacterium, Dermabacter, Rothia, Oerskovia, Microbacteriumw Leifsoniaaquatica.
В другом варианте реализации бактериальный агент является грамположительным и выбран из группы, включающей, но не ограниченной перечисленными, Arcanobacteria spp. Примеры Arcanobacteria spp. включают A. haemolyticum, A. pyogenes (сейчас известный как Trueperella pyogenes, ранее известный как Actinomyces pyogenes) и A. bernardiae.
В другом варианте реализации бактериальный агент является грамположительным и выбран из группы, включающей, но не ограниченной перечисленными, Rhodococcus spp. Примеры Rhodococcus spp включают Rhodococcus equi, Rhodococcus erythropolis, Rhodococcus fasciens и Rhodococcus rhodochrous.
В другом варианте реализации бактериальный агент является грамположительным и выбран из группы, включающей, но не ограниченной перечисленными, Gordonia spp.
В другом варианте реализации бактериальный агент является грамположительным и выбран из группы, включающей, но не ограниченной перечисленными, Tsukamurella spp.
В другом варианте реализации бактериальный агент является грамположительным и выбран из группы, включающей, но не ограниченной перечисленными, Acholeplasma spp.
В другом варианте реализации бактериальный агент является грамположительным и выбран из группы, включающей, но не ограниченной перечисленными, такие как актинобактерии, такие как Crossiella equi.
В другом варианте реализации бактериальный агент является грамположительным и выбран из группы, включающей, но не ограниченной перечисленными, Bacillus spp. Примеры Bacillus spp. включают Bacillus anthracis, Bacillus cereus, Bacillus circulans, Bacillus licheniformis, Bacillus megaterium, Bacillus pumilus, Bacillus sphaericus, Bacillus subtilis, Brevibacillus brevis, Brevibacillus laterosporus и Paenibacillus alvei.
В другом варианте реализации бактериальный агент является грамположительным и выбран из группы, включающей, но не ограниченной перечисленными, анаэробные кокки. Примеры анаэробных кокков включают Anaerococcus murdochii, Anaerococcus prevotii, Anaerococcus tetradius, Anaerococcus octavius, Anaerococcus hydrogenalis, Anaerococcus lactolyticus, Anaerococcus vaginalis, Atopobium parvulum, Finegoldia magna, Gallicola barnesae, Gemella asaccharolytica, Gemella bergeri, Gemella cuniculi, Gemella haemolysans, Gemella morbillorum, Gemella palaticanis, Gemella sanguinis; Parvimona smicra, Peptococcus niger, Peptoniphilus asaccharolyticus, Peptoniphilus gorbachii, Peptoniphilu sindolicus, Peptoniphilus harei, Peptoniphilus ivorii, Peptoniphilus lacrimalis, Peptoniphilus olsenii, Peptostreptococcus stomatis, Peptostreptococcus anaerobius, Ruminococcus productus, Slackia heliotrinireducens и Staphylococcus saccharolyticus.
В другом варианте реализации бактериальный агент является грамположительным и выбран из группы, включающей, но не ограниченной перечисленными, анаэробные грамположительные неспорулирующие бациллы. Примеры анаэробных грамположительных неспорулирующих бацилл включают Alloscardoviaomnicolens, виды Atopobium такие как Atopobiumminutum, Atopobiumrimae, Atopobiumparvulum и Atopobiumvaginae), Bifidobacteria (такие как Bifidobacteria adolescentis, Bifidobacteria dentium, Bifidobacteria scardovii), Catabacter hongkongensis, Collinsellaaerofaciens, Eggerthella (такие как Eggerthella lenta, Eggerthella hongkongensisu Eggerthella sinensis), Eubacterium и родственные виды (такие как Eubacterium nodatum, Eubacterium tenue. Eubacterium brachy, Eubacterium infirmum, Eubacterium minutum, Eubacterium nodatum, Eubacterium saphenum, Eubacterium sulci, Filifactoralocis, Mogibacterium timidum, Mogibacterium vescum, Pseudoramibacteralactolyticus, Bulleidiaextructa и Solobacterium moorei), виды Lactobacillus (такие как Lactobacillus rhamnosus, Lactobacillus casei, Lactobacillus fermentum, Lactobacillus gasseri, Lactobacillus plantarum, Lactobacillus acidophilus, Lactobacillus iners и Lactobacillus ultunensis), виды Mobiluncus (такие как Mobiluncus curtisii, Mobiluncus mulieris), Moryella indoligenes, оральные виды Olsenella (такие как Olsenellauli и Olsenellaprofuse), Oribacterium sinus, Propionibacterium (такие как Propionibacterium acnes и Propionibacterium propionicum), Slackia exigua и Turicibacter sanguine.
В другом варианте реализации бактериальный агент является грамположительным и выбран из группы, включающей, но не ограниченной перечисленными, Actinomycesspp. Примеры Actinomycesspp включают Actinomyces israelii, Actinomyces naeslundii, Actinomyces viscosus, Actinomyces odontolyticus, Actinomyces meyeri и Actinomyces gerencseriae (paneeActinomyces israelii серотип II), Actinomyces europaeus, Actinomyces neuii, Actinomyces radingae, Actinomyces graevenitzii, Actinomyces hordeovulneris, Actinomyces turicensis. Actinomyces georgiae, Arcanobacterium (Actinomyces) pyogenes, Arcanobacterium (Actinomyces) bernardiae, Actinomyces funkei.Actinomyces lingnae, Actinomyces houstonensiswActinomyces cardiffensis.
В другом варианте реализации бактериальный агент является грамположительным и выбран из группы, включающей, но не ограниченной перечисленными, Clostridium spp. Примеры Clostridium spp.включают Clostridium baratii, Clostridium bifermentans, Clostridium botulinum, Clostridium botulinum (типы A, B, C, D, E, F, G), Clostridium butyricum, Clostridium difficile, Clostridium histolyticum, Clostridium novyi (тип A), Clostridium novyi (тип B), Clostridium perfringens, Clostridium perfringens (типы A-E), Clostridium ramosum, Clostridium septicum, Clostridium sordelli, Clostridium sphenoides, Clostridium tertium, Clostridium tetani.
В другом варианте реализации бактериальный агент является грамположительным и выбран из группы, включающей, но не ограниченной перечисленными, Nocardiaspp. Примеры Nocardiaspp включают Nocardia asteroides, Nocardia brasiliensis, Nocardia farcinica, Nocardia nova, Nocardia otitidiscaviarum и Nocardia transvalensis.
В другом варианте реализации бактериальный агент является грамположительным и выбран из группы, включающей, но не ограниченной перечисленными, Erysipelothrixspp, такие как Erysipelothrixrhusiopathiae.
В другом варианте реализации бактериальный агент является грамположительным и выбран из группы, включающей, но не ограниченной перечисленными, Listeriaspp, например, Listeriamonocytogenes.
В другом варианте реализации бактериальный агент является грамположительным и выбран из группы, включающей, но не ограниченной перечисленными, Kytococcus spp, такие как Kytococcusschroeteri.
В другом варианте реализации бактериальный агент является грамположительным и выбран из группы, включающей, но не ограниченной перечисленными, Mycobacteriumspp. Примеры Mycobacteriumspp включают Mycobacterium abscessus, Mycobacterium arupense, asiaticum, Mycobacterium aubagnense, Mycobacterium avium complex, Mycobacterium bolletii, Mycobacterium bolletii, Mycobacterium branderi, Mycobacterium canettii, Mycobacterium caprae, Mycobacterium celatum, Mycobacterium chelonae, Mycobacterium chimaera, Mycobacterium colombiense, Mycobacterium conceptionense, Mycobacterium conspicuum, Mycobacterium elephantis, Mycobacterium farcinogenes, Mycobacterium florentinum, Mycobacterium fortuitum group, Mycobacterium genavense, Mycobacterium goodii, Mycobacterium haemophilum, Mycobacterium heckeshornense, Mycobacterium heidelbergense, Mycobacterium houstonense, Mycobacterium immunogenum, Mycobacterium interjectum, Mycobacterium intracellulare, Mycobacterium senegalense, Mycobacterium africanum, Mycobacterium avium subsp paratuberculosis, Mycobacterium kansasii, Mycobacterium lacus, Mycobacterium lentiflavum, Mycobacterium leprae, Mycobacterium lepraemurium, Mycobacterium mageritense, Mycobacterium malmoense, Mycobacterium marinum, Mycobacterium massiliense, Mycobacterium microti, Mycobacterium montefiorense (патогенугрей), Mycobacterium moracense, Mycobacterium mucogenicum, Mycobacterium nebraskense, Mycobacterium neoaurum, Mycobacterium novocastrense, Mycobacterium palustre, Mycobacterium parmense, Mycobacterium phlei, Mycobacterium phocaicum, Mycobacterium pinnipedii, Mycobacterium porcinum, Mycobacterium pseudoshottsii (патоген рыб), Mycobacterium pseudotuberculosis, Mycobacterium saskatchewanense, Mycobacterium scrofulaceum, Mycobacterium senuense, Mycobacterium septicum, Mycobacterium simiae, Mycobacterium smegmatis, Mycobacterium szulgai, Mycobacterium terrae/chromogenicum complex, Mycobacterium triplex, Mycobacterium tuberculosis, Mycobacterium tusciae, Mycobacterium ulcerans, Mycobacterium wolinskyi и Mycobacterium xenopi.
В другом варианте реализации бактериальный агент является грамположительным и выбран из группы, включающей, но не ограниченной перечисленными, Trueperellaspp. Примеры trueperellaspp включают Trueperella abortisuis, Trueperella bernardiae, Trueperella bialowiezensis, Trueperella bonasi, Trueperella pyogenes (Arcanobacterium pyogenes).
В другом варианте реализации бактериальный агент является грамположительным, грамотрицательным или не имеет клеточной стенки, и выбран из группы, включающей, но не ограниченной перечисленными, патогены сельскохозяйственных животных. Примеры патогенов сельскохозяйственных животных включают Actinobaculumsuis, Actinomycesbovis, Arcanobacteriumpyogenes, Bacillusanthracis, cereus, licheniformis, pumilus, melaninogenicus, subtilis, Clostridiumbotulinum, chauvoei, haemolyticum, novyi, perfringens, septicum, sordellii, tetani, colinum, Corynebacterium pseudotuberculosis, renale, Dermatophilus congolensis, Enterococcus spp (такие как E. faecalis, E. faecium, E. durans, E. avium, E. hirae), Erysipelothrix rhusiopathiae, Listeriaivanovii, grayi, innocua, seeligeri, welshimeri, monocytogenes, Mycobacterium avium, bovis, paratuberculosis (болезнь Джона), Mycoplasma (такие как capricolumsubsp. capripneumoniae, subsp. capricolum, M. Mycoides subsp mycoides, M. agalactiae, M. ovipneumoniae, M. conjunctivae, M. arginini, M. Bovis и M. putrefaciens) Mycoplasma bovis, dispar, mycoidessubsp. mycoides (например, возбудители контагиозной плевропневмонии крупного рогатого скота, СВРР) Mycoplasma gallisepticum (MG), iowaemeleagridis (MM), synoviae (MS) Mycoplasma haemosuis (ранее Eperythrozoonsuis), alkalescens, bovigenitalum, bovirhinis, bovoculi, californicum, canadense, cynos, equigenitalium, gateae, haemocanis, haemofelis, hyopneumoniae, hyorhinis, hyosynoviae, iowae, leachii, meleagridis, mycoidessubspcapri, wenyonii. suis, Rhodococcus equi, Staphylococcus epidermidis, Staphylococcus simulans, Staphylococcus felis, Staphylococcus xylosus, Staphylococcus chromogenes, Staphylococcus warneri, Staphylococcus haemolyticus, Staphylococcus sciuri, Staphylococcus saprophytics, Staphylococcus hominis, Staphylococcus caprae, Staphylococcus cohniisubsp. cohnii, Staphylococcus cohniisubsp. urealyticus, Staphylococcus capitissubsp.capitis, Staphylococcus capitissubsp.urealyticus, Staphylococcus hyicus, Staphylococcus aureus, Staphylococcus pseudintermedius, Staphylococcus delphini, Staphylococcus schleiferisubsp. coagulans, Staphylococcus aureussubsp.anaerobius, Streptococcus uberis, Streptococcus canis, Streptococcus agalactiae, Streptococcus dysgalactiae, Streptococcus pyogenes, Streptococcus bovis, Streptococcus equisubsp. Zooepidemicus, Streptococcus equinus, Streptococcus equi (Streptococcus equisubspequi), Streptococcus equisimilis (Streptococcus dysgalactiaesubspequisimilis), porcinus, suis, zooepidemicus, Streptococcus zooepidemicus (Streptococcus equisubspzooepidemicus), Streptococcus dysgalactiaesubsp.equisimilis, Propionibacteriumacnes, Propionibacteriumgranulosum, Eubacterium, Peptococcus indolicus и Peptostreptococcus anaerobius; а также различные виды родов следующих грамотрицательных бактерий: Actinobacillus, Aeromonas, Anaplasma, Arcobacter, Avibacterium, Bacteroides, Bartonella, Bordetella, Borrelia, Brachyspira, Brucella, Campylobacter, Capnocytophaga, Chlamydia, Chlamydophila, Chryseobacterium, Coxiella, Cytophaga, Dichelobacter, Edwardsiella, Ehrlichia, Escherichia, Flavobacterium, Francisella, Fusobacterium, Gallibacterium, Haemophilus, Histophilus, Klebsiella, Lawsonia, Leptospira, Mannheimia, Megasphaera, Moraxella, Neorickettsia, Nicoletella, Ornithobacterium, Pasteurella, Photobacterium, Piscichlamydia, Piscirickettsia, Porphyromonas, Prevotella, Proteus, Pseudomonas, Rickettsia, Riemerella, Salmonella, Streptobacillus, Tenacibaculum, Vibriou Yersinia.
В другом варианте реализации бактериальный агент является грамположительным и выбран из группы, включающей, но не ограниченной перечисленными, патогены видов домашних животных (животных-компаньонов), таких как кошки, собаки и лошади. Примерами таких патогенов являются патогены лошадей, такие как Streptococcus equi, Streptococcus zooepidemicus, Rhodococcus equi, Clostridium difficile, Clostridium perfringens, Corynebacterium pseudotuberculosis, Clostridium piliforme, Actinomyces bovis, Staphylococcus aureus, betahaemolytic, Steptococcus spp, Dermatophilus congolense, Clostridiium tetani и Clostridium botulinum. Другие примеры включают патогены собак и кошек, такие как Staphylococcus spp, Streptococcus spp, Clostridiumspp, Actinomycesspp, Enterococcus spp, Nocardiaspp, Mycoplasmaspp и Mycobacteriumspp.
В другом варианте реализации бактериальный агент является грамотрицательным и выбраны из группы, включающей следующие репрезентативные семейства и виды:
Acetobacteraceae: - Roseomonas cervicalis; Roseomonas fauriae; Roseomonas gilardii. -- Aeromonadaceae: - Aeromonas allosaccharophila; Aeromonas aquariorum; Aeromonas caviae; Aeromonas hydrophila (and subspecies); Aeromonas salmonicida; Aeromonas shubertii; Aeromonas veronii biovar sobria (Aeromonas sobria). -- Alcaligenaceae: - Achromobacter xylosoxidans; Alcaligenes faecalis; Bordetella ansorpii; Bordetella avium; Bordetella bronchiseptica; Bordetella hinzii; Bordetella holmesii; Bordetella parapertussis; Bordetella pertussis; Bordetella petrii; Bordetella trematum; Oligella ureolytica; Oligella urethralis. -- Anaplasmataceae: - Anaplasma phagocytophilum; Anaplasma platys; Anaplasma bovis; Anaplasma centrale; Anaplasma marginale; Anaplasma odocoilei; Anaplasma ovis; Ehrlichia canis; Ehrlichia chaffeensis; Ehrlichia ewingii; Ehrlichia muris; Ehrlichia ovina; Ehrlichia ruminantium; Neoehrlichia lotoris; Neoehrlichia mikurensis; Neorickettsia helminthoeca; Neorickettsia risticii; Neorickettsia sennetsu; Wolbachia pipientis. -- Armatimonadaceae: - Armatimonas rosea. -- Bacteroidaceae: - Bacteroides forsythus; Bacteroides fragilis; Bacteroides melaninogenicus; Bacteroides ruber; Bacteroides urealtyicus. -- Bartonellaceae: - Bartonella alsatica; Bartonella australis; Bartonella bacilliformis; Bartonella birtlesii; Bartonella bovis; Bartonella capreoli; Bartonella chomelii; Bartonella clarridgeiae; Bartonella doshiae; Bartonella elizabethae; Bartonella grahamii; Bartonella henselae; Bartonella koehlerae; Bartonella peromysci; Bartonella phoceensis; Bartonella quintana; Bartonella rattimassiliensis; Bartonella rochalimae; Bartonella schoenbuchensis; Bartonella talpae; Bartonella tamiae; Bartonella taylorii; Bartonella tribocorum; Bartonella vinsonii subsp berkhoffii; Bartonella vinsonii subsp. arupensis; Bartonella vinsonii subsp. vinsonii. -- Bdellovibrionaceae: - Bdellovibrio spp. -- Brachyspiraceae: - Brachyspira spp including Brachyspira hampsonii, Brachyspira hyodysenteriae, Brachyspira murdochii, Brachyspira pilosicoli. -- Brucellaceae: - Brucella abortus; Brucella canis; Brucella ceti; Brucella melitensis; Brucella ovis; Brucella pinnipedialis; Brucella suis; Ochrobactrum anthropi; Ochrobactrum intermedium. -- Burkholderiaceae:-Burkholderia aborts; Burkholderia ambifaria (genomovar VII); Burkholderia anthina (genomovar VIII); Burkholderia cenocepacia (genomovar III); Burkholderia cepacia (genomovar I); Burkholderia diffusa; Burkholderia dolosa (genomovar VI); Burkholderia latens; Burkholderia mallei; Burkholderia metallica; Burkholderia multivorans (genomovar II); Burkholderia pseudomallei; Burkholderia pyrrocinia (genomovar IX); Burkholderia seminalis; Burkholderia stabilis (genomovar IV); Burkholderia ubonensis (genomovar X); Burkholderia vietnamiensis (genomovar V); Cupriavidus pauculus; Cupriavidus gilardii; Ralstonia pickettii; Ralstonia mannitolilytica; Sphaerotilus hippei; Sphaerotilus montanus; Sphaerotilus natans. -- Campylobacteraceae: - Arcobacter spp includng Arcobacter skirrowii; Campylobacter coli; Campylobacter concisus; Campylobacter curvus; Campylobacter fetus; Campylobacter gracilis; Campylobacter helveticus; Campylobacter hominis; Campylobacter hyointestinalis; Campylobacter insulaenigrae; Campylobacter jejuni; Campylobacter lanienae; Campylobacter lari; Campylobacter laridis; Campylobacter mucosalis; Campylobacter rectus; Campylobacter showae; Campylobacter sputorum; Campylobacter upsaliensis. -- Candidatus: - Piscichlamydia salmonis. -- Cardiobacteriaceae: - Cardiobacterium hominis; Cardiobacterium valvarum; Dichelobacter nodosus. -- Chlamydiaceae: - Chlamydia spp including Chlamydia avium, Chlamydia gallinacea, Chlamydia muridarum, Chlamydia suis, Chlamydia trachomatis; Chlamydophila spp including Chlamydophila pneumoniae, Chlamydophila pecorum, Chlamydophila psittaci, Chlamydophila abortus, Chlamydophila caviae, and Chlamydophila felis. -- Chthonomonadaceae: - Chthonomonas calidirosea. -- Comamonadaceae: - Comamonas testosteroni; Verminephrobacter spp. -- Coxiellaceae: - Coxiella burnetii. -- Cytophagaceae: - Cytophaga columnaris; Cytophaga hutchinsonii; Flexibacter echinicida; Flexibacter elegans; Flexibacter flexilis; Flexibacter litoralis; Flexibacter polymorphus; Flexibacter roseolus; Flexibacter ruber. -- Desulfovibrionaceae: - Bilophila wadsworthia; Lawsonia intracellularis. -- Enterobacteriaceae: - Cedecea davisae; Cedecea lapagei; Cedecea neteri; amalonaticus; Citrobacter diversus; Citrobacter freundii; Citrobacter koseri; Cronobacter condimenti; Cronobacter dublinensis; Cronobacter helveticus; Cronobacter malonaticus; Cronobacter muytjensii; Cronobacter pulveris; Cronobacter sakazakii; Cronobacter turicensis; Cronobacter universalis; Cronobacter zurichensis; Edwardsiella ictaluri; Edwardsiella tarda; Enterobacter aerogenes; Enterobacter agglomerans; Enterobacter cloacae; Enterobacter cowanii; Escherichia albertii; Escherichia coli, в том числе AIEC = адгезивно-инвазивные E. coli, EaggEC = энтероагрегативные E. coli; EHEC = энтерогеморрагические E. coli; EIEC = энтероинвазивные E. coli; EPEC = энтеропатогенные E. coli; ETEC = энтеротоксигенные E. coli; ExPEC = внекишечныепатогенные E. coli, NMEC = E. coli неонатальногоменингита, NTEC = некротоксигенные E. coli, UPEC = уропатогенные E. coli.; Escherichia fergusonii; Ewingella americana; Hafnia alvei; Hafnia paralvei; Klebsiella granulomatis; Klebsiella oxytoca; Klebsiella pneumoniae; Kluyvera ascorbata; Kluyvera cryocrescens; Morganella morganii; Pantoea (также известный как Enterobacter) agglomerans; Photorhabdus asymbiotica; Plesiomonas shigelloides; Proteus mirabilis; Proteus penneri; Proteus vulgaris; Providencia alcalifaciens; Providencia rettgeri; Providencia stuartii; Raoultella electrica; Raoultella ornithinolytica; Raoultella planticola; Raoultella terrigena; Salmonella bongori, Salmonella enterica subspecies enterica (множество серотипов); Serratia liquifaciens; Serratia marcesans; Shigella boydii; Shigella dysenteriae; Shigella flexneri; Shigella sonnei; Yersinia enterocolitica; Yersinia pestis; Yersinia pseudotuberculosis; Yersinia ruckeri. -- Fimbriimonadaceae: - Fimbriimonas ginsengisoli. -- Flavobacteriaceae: - Bergeyella zoohelcum; Capnocytophaga canimorsus; Capnocytophaga cynodegmi; Capnocytophaga gingivalis; Capnocytophaga granulosa; Capnocytophaga haemolytica; Capnocytophaga leadbetteri; Capnocytophaga ochracea; Capnocytophaga sputigena; Chryseobacterium indologenes; Chryseobacterium piscicola; Elizabethkingia meningoseptica; Flavobacterium branchiophilum; Flavobacterium columnare; Flavobacterium oncorhynchi; Flavobacterium piscicida; Flavobacterium psychrophilum; Myroides odoratus; Myroides odoratimimus; Ornithobacterium rhinotracheale; Riemerella anatipestifer; Riemerella columbina; Riemerella columbipharyngis; Tenacibaculum dicentrarchi; Tenacibaculum discolour; Tenacibaculum gallaicum; Tenacibaculum maritimum; Tenacibaculum soleae; Weeksella virosa. -- Francisellaceae: - Francisella tularensis subsp.tularensis; Francisella tularensis subsp. holarctica; Francisella tularensis subsp. novicida; Francisella philomiragia; Francisella noatunensis; Francisella noatunensis subsp.orientalis (также известный как Francisella asiatica). -- Fusobacteriaceae: - Fusobacterium spp. Включая usobacterium necrophorum, Fusobacterium nucleatum, Fuso-bacterium polymorphum. -- Helicobacteraceae: - Helicobacter cinaedi; Helicobacter fennelliae; Helicobacter pylori. -- Legionellaceae: - Legionella pneumophila and other species including; Legionella anisa; Legionella birminghamensis; Legionella bozemannii; Legionella cincinnatiensis; Legionella dumoffii; Legionella feeleii; Legionella gormanii; Legionella hackeliae; Legionella jordanis; Legionella lansingensis; Legionella longbeachae; Legionella maceachernii; Legionella micdadei; Legionella oakridgensis; Legionella parisiensis; Legionella sainthelens; Legionella tusconensis; Legionella wadsworthii; Legionella waltersii. -- Leptospiraceae: - Leptospira alexanderi (включая Leptospira alexanderi serovar Hebdomadis, Leptospira alexanderi serovar Manhao 3); Leptospira alstoni (включая Leptospira alstoni serovar Pingchang, Leptospira alstoni serovar Sichuan); Leptospira biflexa (включая Leptospira biflexa serovar Ancona, Leptospira biflexa serovar Canela); Leptospira borgpetersenii (включая Leptospira borgpetersenii serovar Hardjo, Leptospira borgpetersenii serovar Hardjo-bovis, Leptospira borgpetersenii serovar Pomona, Leptospira borgpetersenii serovar Tarassovi); Leptospira broomii (включая Leptospira broomii serovar Hurstbridge); Leptospira fainei (включая Leptospira fainei serovar Hurstbridge); Leptospira idonii; Leptospira inadai (включая Leptospira inadai serovar Lyme, Leptospira inadai serovar Malaya); Leptospira interrogans (включая Leptospira interrogans serovar Australis, Leptospira interrogans serovar Autumnalis, Leptospira interrogans serovar Bratislava, Leptospira interrogans serovar Canicola, Leptospira interrogans serovar Grippotyphosa, Leptospira interrogans serovar Hardjo, Leptospira interrogans serovar Hardjo-bovis, Leptospira interrogans serovar Icterohaemorrhagiae, Leptospira interrogans serovar Pomona, Leptospira interrogans serovar Pyrogenes, Leptospira interrogans serovar Tarassovi); Leptospira kirschneri (включая Leptospira kirschneri serovar Bulgarica, Leptospira kirschneri serovar Cynopteri, Leptospira kirschneri serovar Grippotyphosa); Leptospira kmetyi; Leptospira licerasiae; Leptospira meyeri (включая Leptospira meyeri serovar Sofia); Leptospira noguchii (включая Leptospira noguchii serovar Panama, Leptospira noguchii serovar Pomona); Leptospira santarosai; Leptospira terpstrae; Leptospira vanthielii; Leptospira weilii (включая Leptospira weilii serovar Celledoni, Leptospira weilii serovar Sarmin); Leptospira wolbachii; Leptospira wolffii; Leptospira yanagawae. -- Leptotrichiaceae: - Leptotrichia buccalis; Streptobacillus moniliformis. -- Methylobacteriaceae: - Methylobacterium extorquens group; Methylobacterium fujisawaense; Methylobacterium mesophilicum; Methylobacterium zatmanii. -- Moraxellaceae: - Acinetobacter baumannii (genomic species 2); Acinetobacter baylyi; Acinetobacter bouvetii; Acinetobacter calcoaceticus (genomic species 1); Acinetobacter gerneri; Acinetobacter grimontii; Acinetobacter haemolyticus (genomic species 4); Acinetobacter johnsonii (genomic species 7); Acinetobacter junii (genomic species 5); Acinetobacter lwoffi (genomic species 8/9); Acinetobacter parvus; Acinetobacter radioresistens (genomic species 12); Acinetobacter schindleri; Acinetobacter tandoii; Acinetobacter tjernbergiae; Acinetobacter towneri; Acinetobacter ursingii; Acinetobacter venetianus; Moraxella atlantae; Moraxella boevrei; Moraxella bovis; Moraxella bovoculi; Moraxella canis; Moraxella caprae; Moraxella catarrhalis; Moraxella caviae; Moraxella cuniculi; Moraxella equi; Moraxella lacunata; Moraxella lincolnii; Moraxella macacae; Moraxella nonliquefaciens; Moraxella oblonga; Moraxella osloensis; Moraxella ovis; Moraxella phenylpyruvica; Moraxella pluranimalium; Moraxella porci. -- Moritellaceae: - Moritella abyssi; Moritella dasanensis; Moritella japonica; Moritella marina; Moritella pro-funda; Moritella viscosa; Moritella yayanosii. -- Neisseriaceae: - Chromobacterium violaceum; Eikenella corrodens; Kingella denitrificans, Kingella kingae, Kingella oralis, Kingella potus; Neisseria cinerea; Neisseria elongata; Neisseria flavescens; Neisseria gonorrhoeae; Neisseria lactamica; Neisseria meningitidis; Neisseria mucosa; Neisseria polysaccharea; Neisseria sicca; Neisseria subflava; Neisseria weaver; Vitreoscilla spp. -- Nitrosomonadaceae: - Nitrosomonas eutropha; Nitrosomonas halophila; Nitrosomonas oligotropha. -- Pasteurellaceae: - Actinobacillus actinomycetemcomitans; Actinobacillus equuli; Actinobacillus lignieresii; Actinobacillus pleuropneumoniae; Actinobacillus seminis; Actinobacillus succinogenes; Actinobacillus ureae; Aggregatibacter actinomycetemcomitans, Aggregatibacter segnis, Aggregatibacter aphrophilus; Avibacterium avium; Avibacterium endocarditidis; Avibacterium gallinarum; Avibacterium paragallinarum; Avibacterium volantium; Bibersteinia trehalose; Gallibacterium anatis; Gallibacterium genomospecies 1; Gallibacterium genomospecies 2; Gallibacterium genomospecies 3; Gallibacterium group V; Gallibacterium melopsittaci; Gallibacterium salpingitidis; Gallibacterium trehalosifermentans; Haemophilus aegyptius; Haemophilus avium; Haemophilus ducreyi; Haemophilus haemolyticus; Haemophilus influenzae; Haemophilus parahaemolyticus; Haemophilus parainfluenzae; Haemophilus parasuis; Histophilus somni; Mannheimia caviae; Mannheimia glucosida; Mannheimia granulomatis; Mannheimia haemolytica; Mannheimia ruminalis; Mannheimia varigena; Nicoletellasemolina; Pasteurella aerogenes; Pasteurella bettyae; Pasteurella caballi; Pasteurella canis; Pasteurella dagmatis; Pasteurella multocida (подвиды multocida, septicum, gallicida); Pasteurella pneumotropica; Pasteurella stomatis; Pasteurella trehalosi. -- Piscirickettsiaceae: - Piscirickettsia salmonis. - Plesiomonadaceae: -- Plesiomonas shigelloides. -- Polyangiaceae: - Sorangium cellulosum. -- Porphyromonadaceae: - Dysgonomonas capnocytophagoides; Dysgonomonas gadei; Dysgonomonas hofstadii; Dysgonomonas mossii; Dysgonomonas oryzarvi; Dysgonomonas wimpennyi; Porphyromonas gingivalis. -- Prevotellaceae: - Prevotella spp.включая Prevotella intermedia, Prevotella melaninogenica. -- Pseudomonadaceae: - Chryseomonas luteola; Pseudomonas aeruginosa; Pseudomonas luteola; Pseudomonas fluorescens; Pseudomonas putida; Pseudomonas stutzeri; Pseudomonas oryzihabitans. -- Rhizobiaceae: - Agrobacterium tumefaciens; Rhizobium radiobacter. -- Rickettsiaceae: - Orientia chuto; Orientia tsutsugamushi; Rickettsia aeschlimannii; Rickettsia africae; Rickettsia akari; Rickettsia argasii; Rickettsia asiatica; Rickettsia australis; Rickettsia bellii; Rickettsia canadensis; Rickettsia conorii; Rickettsia cooleyi; Rickettsia felis; Rickettsia heilongjiangensis; Rickettsia helvetica; Rickettsia honei; Rickettsia hoogstraalii; Rickettsia hulinensis; Rickettsia hulinii; Rickettsia japonica; Rickettsia marmionii; Rickettsia martinet; Rickettsia massiliae; Rickettsia monacensis; Rickettsia montanensis; Rickettsia monteiroi; Rickettsia moreli; Rickettsia parked; Rickettsia peacockii; Rickettsia philipii; Rickettsia prowazekii; Rickettsia raoultii; Rickettsia rhipicephali; Rickettsia rickettsii; Rickettsia sibirica subgroup; Rickettsia slovaca; Rickettsia tamurae; Rickettsia typhi. -- Shewanellaceae: - Shewanella putrefaciens. - Sphingomonadaceae: -- Sphingobacterium multivorum; Sphingobacterium spiritivorum; Sphingomonas paucimobilis. -- Spirillaceae: - Spirillum minus; Spirillum volutans; Spirillum winogradskyi. -- Spirochaetaceae: - Borrelia afzelii; Borrelia anserina; Borrelia bissettii; Borrelia burgdorferi; Borrelia coriaceae; Borrelia duttonii; Borrelia garinii; Borrelia hermsii; Borrelia hispanica; Borrelia japonica; Borrelia lonestari; Borrelia lusitaniae; Borrelia miyamotoi; Borrelia parkeri; Borrelia persica; Borrelia recurrentis; Borrelia spielmanii; Borrelia turicatae; Borrelia turicatae; Borrelia valaisiana; Treponema carateum; Treponema pallidum ssp. endemicum; Treponema pallidum ssp. pallidum; Treponema pallidum ssp. pertenue. -- Succinivibrionaceae: - Anaerobiospirillum spp. -- Sutterellaceae: -- Sutterella spp включая Sutterella wadsworthia. -- Thermaceae: - Meiothermus spp. -- Thermotogaceae: - Thermotoga neapolitana. -- Veillonellaceae: - Dialister spp; Megamonas spp; Megasphaera spp; Pectinatus spp; Pelosinus spp; Propionispora spp; Sporomusa spp; Veillonella spp.; Zymophilus spp. -- Vibrionaceae: - Photobacterium damselae; Vibrio adaptatus; Vibrio alginolyticus; Vibrio azasii; Vibrio campbellii; Vibrio cholera; Vibrio damsel; Vibrio fluvialis; Vibrio furnisii; Vibrio hollisae; Vibrio metchnikovii; Vibrio mimicus; Vibrio parahaemolyticus; Vibrio vulnificus. -- Wolbachieae: - Wolbachia spp. -- Xanthomonadaceae: - Luteimonas aestuarii; Luteimonas aquatica; Luteimonas composti; Luteimonas lutimaris; Luteimonas marina; Luteimonas mephitis; Luteimonas vadosa; Pseudoxanthomonas broegbernensis; Pseudoxanthomonas japonensis; Stenotrophomonas maltophilia; Stenotrophomonas nitritireducens.
Наиболее предпочтительно, бактериальный агент, вызывающий бактериальную инфекцию, является грамотрицательным и выбран из группы, включающей: виды Acinetobacter, Aeromonas hydrophila, Citrobacter species, Enterobacter species, Escherichia coli, Klebsiella pneumoniae, Morganella morganii, Pseudomonas aeruginosa и Stenotrophomonas maltophilia.
В другом предпочтительном варианте реализации бактериальный агент, вызывающий бактериальную колонизацию или инфекцию, устойчив к стандартным антибиотикам, используемым для лечения колонизации или инфекции. В одном предпочтительном варианте реализации бактериальный агент устойчив к соединению, выбранному из группы, включающей: один или более аминогликозид (например гентамицин, тобрамицин, амикацин или нетилмицин); цефалоспорины, действующие против MRSA (например цефтаролин); антипсевдомонадные пенициллины + ингибиторы β-лактамазы (например тикарциллин-клавулановая кислота или пиперациллин-тазобактам); карбапенемы (например, эртапенем, имипенем, меропенем или дорипенем); цефалоспорины не расширенного спектра; цефалоспорины 1-го и 2-го поколения (например цефазолин или цефуроксим); цефалоспорины расширенного спектра; цефалоспорины 3-го и 4-го поколения (например цефотаксим или цефтриаксон); цефамицины (например цефокситин или цефотетан); фторхинолоны (например, ципрофлоксацин); ингибиторы фолатного пути (например, триметоприм-сульфаметоксазол); глицилциклины (например, тигециклин); монобактамы (например, азтреонам); пенициллины (например, ампициллин); пенициллины + ингибиторы β-лактамазы (например амоксициллин-клавуланат или ампициллин сульбактам); фениколы (например, хлорамфеникол); фосфоновые кислоты (например фосфомицин), полимиксины (например колистин) и тетрациклины (например тетрациклин, доксициклин или миноциклин). Предпочтительно, бактериальный агент, устойчивый к этим соединениям, является грамотрицательным.
Предпочтительно, бактериальный агент устойчив к соединению, выбранному из группы, включающей: пенициллины, цефалоспорины, карбапенемы, монобактамы и другие β-лактамные антибиотики, фузиданы, аминогликозиды, фторхинолоны, стрептограмины, тетрациклины, глицилциклины, хлорамфеникол и других фениколы, макролиды и кетолиды, линкозамиды, оксазолидиноны, аминоциклитоли, полимиксины, гликопептиды, липопептиды, бацитрацин, мупирицин, плевромутилины, рифамицины, сульфаниламиды и триметоприм. Предпочтительно, соединение выбрано из группы, включающей: бета-лактамы, гликопептиды, липопептиды, макролиды, тетрациклины и оксазолидиноны. Предпочтительно, бактериальный агент является устойчивым к указанному соединению, когда соединение находится в диапазоне концентраций, выбранным из следующих: 0,001 мкг/мл - 10000 мкг/мл; 0,01 мкг/мл - 1000 мкг/мл; 0,10 мкг/мл -100 мкг/мл; и 1 мкг/мл - 50 мкг/мл.
В другом варианте реализации бактериальный агент, вызывающий бактериальную инфекцию выбран из группы, включающей, но не ограниченной перечисленными, грамположительные бактерии. Микроорганизм предпочтительно представляет собой грамположительный бактериальный агент, выбранный из группы, включающей Staphylococcus aureus, Staphylococcus pseudintermedius, Streptococcus pneumoniae, Streptococcus pyogenes, Streptococcusagalactiae, Streptococcus uberis, Enterococcus faecium, Enterococcusfaecalis и Clostridium difficile.
В одном предпочтительном варианте реализации бактериальный агент не имеет клеточной стенки. Предпочтительно, бактериальный агент выбран из группы, включающей: Mycoplasma spp, Mycoplasma agalactiae, Mycoplasma alkalescens, Mycoplasma amphoriforme, Mycoplasma arginini, Mycoplasma bovigenitalum, Mycoplasma bovirhinis, Mycoplasma bovis, Mycoplasma bovoculi, Mycoplasma buccale, Mycoplasma californicum, Mycoplasma canadense, Mycoplasma capricolumsubsp. capricolum, Mycoplasma capricolumsubsp. capripneumoniae, Mycoplasma conjunctivae, Mycoplasma cynos, Mycoplasma dispar, Mycoplasma equigenitalium, Mycoplasma faucium, Mycoplasma felis, Mycoplasma fermentans (incognitusstr.), Mycoplasma gallisepticum (MG), Mycoplasma gateae, Mycoplasma genitalium, Mycoplasma haemocanis, Mycoplasma haemofelis, Mycoplasma haemosuis (ранее Eperythrozoonsuis), Mycoplasma hominis, Mycoplasma hyopneumoniae, Mycoplasma hyorhinis, Mycoplasma hyosynoviae, Mycoplasma iowaemeleagridis (MM), Mycoplasma iowae, Mycoplasma leachii, Mycoplasma lipophilum, Mycoplasma meleagridis, Mycoplasma mycoidessubspcapri, Mycoplasma mycoidessubspmycoides, Mycoplasma mycoidessubsp.mycoides (например, возбудитель контагиозной плевропневмонии крупного рогатого скота, CBPP), Mycoplasma orale, Mycoplasma ovipneumoniae, Mycoplasma ovis, Mycoplasma penetrans, Mycoplasma pirum, Mycoplasma pneumoniae, Mycoplasma primatum, Mycoplasma putrefaciens, Mycoplasma salivarium, Mycoplasma spermatophilum, Mycoplasma suis, Mycoplasma synoviae (MS), Mycoplasma wenyonii, Mycoplasma, Ureaplasma spp, Ureaplasma parvum, Ureaplasma urealyticum, Ureaplasma и Ureoplasma diversum.
В другом наиболее предпочтительном варианте реализации бактериальный агент представляет собой Staphylococcus aureus.
В другом предпочтительном варианте реализации бактериальный агент устойчив к соединению, выбранному из группы, включающей: один или более из аминогликозидов (например гентамицин); ансамицинов (например рифампицин); цефалоспорины, действующие против MRSA (например цефтаролин); противостафилококковые β-лактамы (или цефамицины) (например, оксациллин или цефокситин); карбапенемы (например, имипенем эртапенем, меропенем или дорипенем); цефалоспорины не с расширенным спектром; цефалоспорины 1-го и 2-го поколения (например, цефазолин или цефуроксим); цефалоспорины расширенного спектра; цефалоспорины 3-го и 4-го поколения (например, цефотаксим или цефтриаксон); цефамицины (например, цефокситин или цефотетан); фторхинолоны (например, ципрофлоксацин или моксифлоксацин); ингибиторы фолатного пути (например, триметоприм-сульфаметоксазол); фуциданы (например, фузидовая кислота); гликопептиды (например, ванкомицин, тейкопланин или телаванцин); глицилциклины (например, тигециклин); линкозамиды (например, клиндамицин); липопептиды (например, даптомицин); макролиды (например, эритромицин); оксазолидиноны (например, линезолид или тедизолид); фениколы (например, хлорамфеникол); фосфоновые кислоты (например, фосфомицин); стрептограмины (например, хинупристин-дальфопристин); тетрациклины (например, тетрациклин, доксициклин или миноциклин). Предпочтительно, бактериальный агент, устойчивый к этим соединениям, является грамположительным.
В другом наиболее предпочтительном варианте бактериальный агент представляет собой Streptococcus pneumoniae. Streptococcus pneumonia может представлять собой штамм, устойчивый к одному или более из β-лактамов и макролидов.
В другом наиболее предпочтительном варианте реализации бактериальный агент представляет собой Streptococcus pyogenes.
В другом наиболее предпочтительном варианте бактериальный агент представляет собой Streptococcus agalactiae.
В другом наиболее предпочтительном варианте реализации бактериальный агент представляет собой Enterococcus faecium или Enterococcus faecalis. Enterococcus faeciumwnu Enterococcus faecalis может представлять собой штамм, устойчивый к аминогликозидам (например, к гентамицину (высокий уровень) или к стрептомицину (например, стрептомицинк (высокий уровень)); карбапенемам (например, имипенему, меропенему или дорипенему); фторхинолонам (например, ципрофлоксацину, левофлоксацину или моксифлоксацину); гликопептидам (например, ванкомицину или тейкопланину); глицилциклинам (например, тигециклину); липопептидам (например, даптомицину); оксазолидинонам (например, линезолиду); пенициллинам (например, ампициллину); стрептограминам (например, хинупристин-дальфопристину); тетрациклинам (например, доксициклину или миноциклину).
В другом наиболее предпочтительном варианте реализации бактериальный агент представляет собой Clostridium difficile.
Бактериальная инфекция у субъекта может вызывать заболевание, выбранное из группы, включающей, но не ограниченной перечисленными, внутрибольничную пневмонию, вызванную Starphylococcus aureus (штаммы с МЛУ, ШЛУ, ПЛУ или метициллин-чувствительные или устойчивые штаммы), или инвазивные пневмококковые заболевания, такие как пневмония, бронхит, острый синусит, отит среднего уха, конъюнктивит, менингит, бактериемия, сепсис, остеомиелит, септический артрит, эндокардит, перитонит, перикардит, подкожная флегмона и абсцесс головного мозга, вызванный Streptococcus pneumoniae (в том числе штаммами с множественной лекарственной устойчивостью [MDRSP], например, устойчивыми к β-лактамам и макролидам), осложненные инфекции кожи и подкожной клетчатки, в том числе инфекции на фоне диабетической стопы, с или без сопутствующего остеомиелита, вызванные Staphylococcus aureus (метициллин-чувствительные и устойчивые штаммы), Streptococcus pyogenes или Streptococcus agalactiae, неосложненные инфекции кожи и подкожной клетчатки, вызванные Staphylococcus aureus (метициллин-чувствительные или устойчивые штаммы) или Streptococcus pyogenes, внебольничная пневмония, вызванная Streptococcus pneumonia (в том числе штаммами с множественной лекарственной устойчивостью [MDRSP], в том числе случаи с сопутствующей бактериемией), или Staphylococcus aureus (метициллин-чувствительные или устойчивые штаммы) инфекции кровотока, вызванные Staphylococcus aureus (бактериемия), в том числе с правосторонним инфекционным эндокардитом, вызванным метициллин-чувствительными и метициллин-устойчивыми изолятами, инфекции, вызванные устойчивыми к ванкомицину энтерококками, в том числе случаи с сопутствующей бактериемия, а также лечение Clostridium difficile-ассоциированной диареи (CDAD).
Грамотрицательные организмы являются значимыми возбудителями многих инфекционных заболеваний у человека и других видов животных: инфекции костей и суставов (грамотрицательные организмы или смешанные бактерии, являются значимыми возбудителями вертебрального остеомиелита и септического артрита), инфекции сердечно-сосудистой системы (в том числе эндокардит, вызванный группой HACEK - Haemophilus parainfluenzae, Haemophilus aphrophilus, Aggregatibacter actinomycetemcomitans, Cardiobacterium hominis, Eikenella corrodens, Kingella kingae), инфекции центральной нервной системы (наиболее распространенными возбудителями бактериального менингита являются Neisseriameningitidis, Streptococcuspneumoniae, а также, у невакцинированных детей младшего возраста, Haemophilus influenza типа B (Hib), у новорожденных и детей младше 3 месяцев - Streptococcus agalactiae (стрептококк группы B), Escherichia coli и другие аэробные грамотрицательные палочки являются значимыми патогенами, абсцесс головного мозга или субдуральная эмпиема, при этом вызывающий инфекцию организм (организмы) варьируют в зависимости от провоцирующих причин, но в случаях, когда местом начала инфекции является ухо, обычно задействованы кишечные грамотрицательные палочки), инфекции глаза (распространенные патогены включают Haemophilus influenza, Neisseria gonorrhoeae или Chlamydia trachomatis), инфекции желудочно-кишечного тракта (задействован широкий спектр патогенных микроорганизмов, в том числе энтеротоксигенная кишечная палочка Escherichia coli (ETEC), Salmonella, Campylobacter, Shigella, Vibrio cholera и Yersinia enterocolitica), генитальные инфекции (бактериальный вагиноз представляет собой полимикробный клинический синдром с высокой концентрацией анаэробных (например, видов Mobiluncus) и других бактерий, требующих особых условий обитания (в том числе Gardnerella vaginalis и Atopobium vaginae), и Mycoplasma hominis; воспалительные заболевания органов малого таза (ВЗОМТ), приобретенные не половым путем, как правило, вызываются смешанной вагинальной флорой, в том числе анаэробными, факультативными грамотрицательными бактериями и Mycoplasma hominis, тоща как ВЗОМТ, передающиеся половым путем, обычно инициируются С. trachomatisunu N. gonorrhoeae, при этом появляется все больше свидетельств в пользу того, что инфекция М. Genitalium участвует в значительном меньшинстве случаев), инфекции брюшной полости (перитонит вследствие перфорированности внутреннего органа, как правило, представляет собой полимикробную инфекцию аэробной и анаэробной флорой кишечника, а спонтанный бактериальный перитонит (СБП), как правило, вызывается грамотрицательными энтеробактериями, такими как Escherichia coli и виды Klebsiella, при этом все чаще выявляют Klebsiella pneumonia как причину абсцесса печени), внебольничная пневмония (Mycoplasma pneumoniae, Chlamydophila (Chlamydia) pneumoniae, Chlamydophila (Chlamydia) psittaci, Haemophilus influenza, аэробные грамотрицательные палочки, в том числе Klebsiella pneumonia, Pseudomona saeruginosa, Acinetobacter baumannii, Burkholderia pseudomallei), отит наружного уха (в том числе острый диффузный) (в бактериальных культурах обычно выявляют Pseudomona saeruginosa, Staphylococcus aureus, а также виды Proteus и Klebsiella), отит среднего уха (в том числе острый) (распространенные бактериальные патогенны включают Streptococcus pneumoniae, Haemophilus influenza и Moraxella catarrhalis), сепсис (в том числе тяжелой формы) (в том числе Acinetobacter baumannii, диссеминированный гонококковый сепсис, вызванный грамотрицательными энтеробактериями, Neisseria meningitides, менингококковый сепсис) и Pseudomona saeruginosa, системные инфекции (пятнистая лихорадка (Rickettsia) и речная японская лихорадка (Orientia), бруцеллез, болезнь кошачьих царапин и другие инфекции, вызываемые Bartonella, лептоспироз, болезнь Лайма, мелиоидоз, лихорадка Q, тифозные и паратифозные лихорадки (кишечные лихорадки), инфекции мочевыводящих путей (острый цистит, острый пиелонефрит, рецидивирующие инфекции мочевыводящих путей и катетер-ассоциированная бактериурия и инфекции мочевых путей).
У человека грамотрицательные бактерии являются распространенными причинами инфекций брюшной полости (ИБП), инфекций мочевыводящих путей (ИМП), внутрибольничной пневмонии м бактериемии. Escherichia coli (Е. coli), Klebsiellapneumoniae (К. pneumoniae) и Pseudomonasaeruginosa (Р. aeruginosa) являются значимыми патогенами в условиях больниц, и на них приходится 27% среди всех патогенов и 70% среди всех грамотрицательных патогенов, вызывающих внутрибольничные инфекции [Sievert DM, Ricks P, Edwards JR, et al. Antimicrobial-resistant pathogens associated with healthcare-associated infections: summary of data reported to the National Healthcare Safety Network at the Centers for Disease Control and Prevention, 2009-2010. Infect Control Hosp Epidemiol. 2013; 34: 1-14].
Грамотрицательные бактерии демонстрируют возрастающую степень устойчивости к современной терапии. Распространенным механизмом устойчивости является продукция ферментов β-лактамаз расширенного спектра (БЛРС). Доля БЛРС-продуцирующих E. coli и К. pneumoniae значительно возросла, в результате чего эти бактерии становятся все более устойчивыми к широко используемым противомикробным препаратам.
P. aeruginosa является самым распространенным грамотрицательным возбудителем внутрибольничной пневмонии, а вторым по распространенности возбудителем ИМП, связанных с катетером, в США.
Е. coli является наиболее распространенным возбудителем ИМП. Увеличивается число случаев ИМП, вызванных БЛРС-продуцирующих E. coli и K. Pneumonia, а также Р. aeruginosa, в том числе штаммов с МЛУ. БЛРС-продуцирующие Е. coli и K. pneumoniae также часто выделяют у пациентов с осложненными инфекциями брюшной полости (ИБП).
P. aeruginosa представляет собой клинически сложный и вирулентный патоген, которые может быть причиной распространенных инфекций у человека, таких как внутрибольничная пневмония, ИМП, ИБП, и инфекций кровотока. Р. aeruginosa является наиболее распространенным грамотрицательным организмом, вызывающим ИВЛ-ассоциированная пневмонию, и вторым по распространенности возбудителем катетер-ассоциированной ИМП.
Увеличение числа инфекций, вызванных грамотрицательными бактериями, сопровождается ростом степени устойчивости. Возможности терапии для решения этой проблемы являются все более и более ограниченными. Существует острая необходимость в новых антибиотиках для удовлетворения потребностей пациентов в настоящее время и в будущем.
В одном предпочтительном аспекте настоящего изобретения субъекту вводят более одного соединения по настоящему изобретению.
В другом предпочтительном варианте реализации соединение Формулы I или его терапевтически приемлемую соль вводят вместе с соединением или агентом, который устраняет или по существу устраняет или уменьшает целостность клеточной стенки бактериальной агента. В качестве примера, соединение выбрано из группы, включающей: β-лактамы, фосфомицин, лизоцим, полимиксины и хелатирующие агенты, такие как этилендиаминтетрауксусная кислота (ЭДТА). В качестве примера, агент представляет собой иммунологическим агент (такой как антитело или вакцина), который уменьшает целостность клеточной стенки. В одном предпочтительном варианте реализации соединение Формулы I или его терапевтически приемлемую соль вводят вместе с соединением, которое устраняет или по существу устраняет или уменьшает целостность наружной клеточной стенки грамотрицательного бактериального агента.
В соответствии с другим аспектом настоящего изобретения предложена антибактериальная фармацевтическая композиция, содержащая терапевтически эффективное количество соединения Формулы I или его терапевтически приемлемой соли. Предпочтительно, композиция представляет собой антибактериальную фармацевтическую композицию.
В соответствии с другим аспектом настоящего изобретения предложена антибактериальное ветеринарная композиция, содержащая терапевтически эффективное количество соединения Формулы I или его терапевтически приемлемой соли. Предпочтительно, композиция представляет собой антибактериальную ветеринарную композицию.
Фармацевтическая композиция может дополнительно включать фармацевтически приемлемое вспомогательное вещество или носитель. Ветеринарная композиция может дополнительно включать ветеринарно приемлемое вспомогательное вещество или носитель.
Фармацевтическая или ветеринарная композиция согласно настоящему изобретению предпочтительно содержит соединение Формулы I или его фармацевтически приемлемую соль в концентрации, выбранной и группы, включающей: от 1 мг/г до 500 мг/г; от 5 мг до 400 мг/г; от 10 мг/г до 200 мг/г; от 20 мг/г до 100 мг/г; от 30 мг/г до 70 мг/г и от 40 мг/г до 60 мг/г.
В другом варианте реализации фармацевтическая или ветеринарная композиция содержит примеси, при этом количество примесей в процентах от общей массы композиции выбрано из группы, включающей: менее 20% примесей (от общей массы композиции); менее 15% примесей; менее 10% примесей; менее 8% примесей; менее 5% примесей; менее 4% примесей; менее 3% примесей; менее 2% примесей; менее 1% примесей, менее 0,5% примесей; менее 0,1% примесей. В одном варианте реализации фармацевтическая или ветеринарная композиция содержит микробные примеси или вторичные метаболиты, при этом количество микробных примесей в процентах от общей массы композиции выбрано из группы, включающей: менее 5%; менее 4%; менее 3%; менее 2%; менее 1%; менее 0,5%; менее 0,1%; менее 0,01%; менее 0,001%. В одном варианте реализации фармацевтическая или ветеринарная композиция стерильна и хранится в герметичном и стерильном контейнере. В одном варианте реализации фармацевтическая или ветеринарная композиция не содержит детектируемого уровня микробного загрязнения.
Фармацевтическая или ветеринарная композиция согласно настоящему изобретению может содержать дополнительный противомикробный агент. Дополнительный противомикробный агент может представлять собой противогрибковый агент или антибактериальный агент. Способ лечения или профилактики бактериальной инфекции или колонизации у субъекта также может включать введение соединения Формулы I с дополнительным противомикробным агентом.
Фармацевтическая или ветеринарная композиция согласно настоящему изобретению может содержать более одного соединения согласно настоящему изобретению, например, комбинацию соединений. Способ лечения или профилактики бактериальной инфекции или колонизации у субъекта также может включать в себя введение более одного соединения согласно настоящему изобретению.
В одном варианте реализации противогрибковый агент выбран из группы, включающей, но не ограниченной природными агентами, включающими Эхинокандины (Анидулафунгин, Каспофунгина, Микафунгин), Полиены (Амфотерицин B, Кандицидин, Филипин, Фунгихромин (Пентамицин), Хачимицин, Гамицин, Люцензомицин, Мепартрицин, Натамицин, Нистатин, Пецилоцин, Перимицин), и другие природные противогрибковые агенты, включающие Гризеофульвин, Олигомицины, Пирролнитрин, Сикканин и Виридин. Противогрибковое средство может быть синтетическим соединением, выбранным из группы, включающей, но не ограниченной перечисленными, Аллиламины (бутенафин, Нафтифин, Тербинафин) Имидазолы (Бифоназол, Бутоконазол, Хлормидазол, Климбазол, Кроконазол (Клоконазол), Клотримазол, Эберконазол, Эконазол, Энилконазаол, Фентиконазол, Флутримазол, Фосфлюконазол, Изоконазол, Кетоконазол, Ланоконазол, Луликоназол, Миконазол, Нетриконазол, Омоконазол, Оксиконазола нитрат, Парконазол, Сертаконазол, Сулконазол, Тиоконазол), Тиокарбаматы (Лиранафтат, Толциктат, Толиндат, Толнафтат), Триазолы (Флуконазол, Изавуконазол, Итраконазол, Позаконазол, Равуконазол, Саперконазол, Терконазол, Вориконазол), и другие синтетические агенты, такие как Акризорцин, Аморолфин, Бромсалицилхлоранилид (Бромхлорсалициланилид), Буклозамил, Кальция пропионат, Хлорфенезин, Циклопирокс, Клоксиквин, Копараффинат, Экзаламид, Флуцитозин, Галопрогин, Гексетидин, Лофлукарбан, Нифуратель, Нифуроксим, Пироктон, Калия йодид, Пропионовую кислоту, Пиритион, Салициланилид, Натрия парахлорбензоат, Натрия пропионат, Сулбентин, Тенонитрозол, Триацетин, Триметрексат, Ундециленовую кислоту (Ундеценовую кислоту) и Цинка пропионат.
Композиция согласно настоящему изобретению может дополнительно содержать антибиотик, выбранный из группы, включающей, но не ограниченный перечисленными ингибиторы β-лактамазы (Авибактам, Клавулановую кислоту, Сульбактам, Сультамициллин, Тазобактам), ингибиторы почечной дипептидазы (Циластатин) и протекторы почек (Бетамипрон).
В одном варианте реализации композиция по настоящему изобретению содержит дополнительный антибиотик, выбранный из группы, включающей, но не ограниченной перечисленными, 2,4-ДИАМИНОПИРИМИДИНЫ, в том числе, Баквилоприм, Бродимоприм, Иклаприм, Орметоприм, Пириметамин, Тетроксоприм, Триметоприм; АМИНОКУМАРИНЫ, в том числе Новобиоцин; АМИНОЦИКЛИТОЛИ, в том числе Спектиномицин, АМИНОГЛИКОЗИДЫ, в том числе Амикацин, Апрамицин, Арбекацин, Беканамицин, Бутирозин, Дибекацин, Дигидрострептомицин, Этимицин, Фортимицины (Астромицин), Фрамицетин, Гентамицин, Гигромицин, Изепамицин, Канамицин, Микрономицин, Неомицин, Нетилмицин, Паромомицин, Плазомицин, Рибостамицин, Сизомицин, Стрептомицин, Тобрамицин, Вердамицин; АМИНОМЕТИЦИКЛИНЫ, в том числе Омадациклин; АМФЕНИКОЛЫ, в том числе Азидамфеникол, Хлорамфеникол, Флорфеникол, Тиамфеникол; АНСАМИЦИНЫ, в том числе Рифабутин, Рифамид, Рифампин (Рифампицин), Рифамицин, Рифапентин, Рифаксимин; АНТИСЕПТИЧЕСКИЕ АГЕНТЫ, в том числе производные Акридина (в том числе Акрифлавин, Аминоакридин, Этакридин, Профлавин), Биспиридины (в том числе октенидина дигидрохлорид), Бромированные салициланилиды (в том числе бромсалаеы), Хлоргексидин, производны Фенола (в том числе тимол и триклозан), Четвертичные аммониевые соединения (в том числе Алкилдиметилэтилбензиламмония хлорид, хлорид бензалкония, хлорид цетилпиридиния, бензетонийхлорид, цетримониум); ПРОТИВОТУБЕРКУЛЕЗНЫЕ АГЕНТЫ, в том числе, Циклосерин, Деламанид, Этамбутол, Этионамид, Изониазид (Фтивазид), Моринамид, Парааминосалициловая кислота (ПАС), Протионамид, Пиразинамид, Теризидон, Тиоацетазон, Тиокарлид; МЫШЬЯКОВИСТЫЕ СОЕДИНЕНИЯ, в том числе Арсаниловая кислота, Роксарзон; БАКТЕРИОЦИНЫ, в том числе Низин, Брилацидин (РМХ-30063); β-ЛАКТАМНЫЕ КАРБАЦЕФЕМЫ, в том числе Лоракарбеф; β-ЛАКТАМНЫЕ КАРБАПЕНЕМЫ, в том числе Биапенем, Дорипенем, Эртапенем, Фаропенем, Имипенем, Меропенем, Панипенем, Разупенем, Ритипенем, Сулопенем, Тебипенем, Томопенем; β-ЛАКТАМНЫЕ ЦЕФАПОСПОРИНЫ, в том числе Цефацетрил, Цефаклор, Цефадроксил, Цефалексин, Цефалоглицин, Цефалониум, Цефалоридин, Цефалотин, Цефамандол, Цефапирин, Цефатризин, Цефазафлур, Цефазедон, Цефазолин, Цефкапен, Цефдинир, Цефдиторен, Цефепим, Цефетамет, Цефиксим, Цефменоксим, Цефодизим, Цефоницид, Цефоперазон, Цефоранид, Цефоселис, Цефотаксим, Цефотиам, Цефовецин, Цефозопран, Цефпимизол, Цефпирамид, Цефпиром, Цефподоксим, Цефпрозил, Цефхином, Цефрадин, Цефроксанид, Цефсулодин, Цефтаролин, Цефтазидим, Цефтерам, Цефтезол, Цефтибутен, Цефтиофур, Цефтизоксим, Цефтобипрол, Цефтолозан, Цефтрадин, Цефтрезол, Цефтриаксон, Цефтоксадин, Цефуроксим, Цефузонам, Пивцефалексин; β-ЛАКТАМНЫЕЦЕФАМИЦИНЫ, в том числе Цефбуперазон, Цефметазол, Цефминокс, Цефотетан, Цефокситин; β-ЛАКТАМНЫЕМОНОБАКТАМЫ, в том числе Азтреонам, Карумонам, Тигемонам; β-ЛАКТАМНЫЕОКСАЦЕФЕМЫ, в том числе Фломоксев, Латамоксев, Моксалактам; β-ЛАКТАМНЫЕПЕНИЦИЛЛИНЫ, в том числе Амдиноциллин (Мециллинам), Амоксициллин, Ампициллин, Апалциллин, Аспоксициллин, Азидоциллин, Азлоциллин, Бакампициллин, Карбенициллин, Кариндациллин, Циклациллин, Клемизол Пенициллин, Клометоциллин, Клоксациллин, Циклациллин, Диклоксациллин, Эпициллин, Фенбенициллин, Флоксациллин (Флуклоксациллин), Гетациллин, Ленампициллин, Мециллинам, Метампициллин, Метициллин натрия, Мезлоциллин, Нафциллин, Оксациллин, Пенамециллин, Пенетамат гидроиодид, Пенициллин G, Пенициллин G Бензатин, Пенициллин G Прокаин, Пенициллин N, Пенициллин O, Пенициллин V, Фенетициллин калия, Пиперациллин, Пивампициллин, Пивмециллинам, Пропициллин, Квинациллин, Сулбенициллин, Сультамициллин, Талампициллин, Темоциллин, Тикарциллин; БИЦИКЛОМИЦИНЫ, в том числе Бикозамицин; БОРСОДЕРЖАЩИЕ АНТИБАКТЕРИАЛЬНЫЕ АГЕНТЫ, в том числе AN3365 (аминометил бензоксаборолы), GSK2251052 (ингибиторы лейцил-тРНК синтетазы); ЦИКЛИЧЕСКИЕ СЛОЖНЫЕ ЭФИРЫ, в том числе Фосфомицин; ИНГИБИТОРЫ СИНТЕЗА ЖИРНЫХ КИСЛОТ (Fabl), AFN-1252, MUT056399, FAB-001; ФТОРХИНОЛОНЫ, в том числе Аварофлоксацин, Балофлоксацин, Безифлоксацин, Чинфлоксацин, Циноксацин, Ципрофлоксацин, Клинафлоксацин, Данофлоксацин, Делафлоксацин, Дифлоксацин, Эноксацин, Энрофлоксацин, Финафлоксацин, Флероксацин, Флумекин, Гареноксацин, Гатифлоксацин, Гемифлоксацин, Грепафлоксацин, Ибафлоксацин, Левофлоксацин, Ломефлоксацин, Марбофлоксацин, Милоксацин, Моксифлоксацин, Надифлоксацин, Норфлоксацин, Офлоксацин, Орбифлоксацин, Пазуфлоксацин, Пефлоксацин, Прадофлоксацин, Прулифлоксацин, Розоксацин, Руфлоксацин, Сарафлоксацин, Ситафлоксацин, Спарфлоксацин, Темафлоксацин, Тосуфлоксацин, Тровафлоксацин, Забофлоксацин; ФУЗИДАНЫ, в том числе фузидовая кислота; ГЛИКОЛИПОДЕПСИПЕПТИДЫ, в том числе Рамопланин; ГЛИКОПЕПТИДЫ, в том числе Авопарцин, Далбаванцин, Норванкомицин, Оритаванцин, Тейкопланин, Телаванцин, Ванкомицин; ГЛИКОФОСФОЛИПИДЫ, в том числе Бамбермицины (бамбермицин, моеномицины, флавофосфолипол); ГЛИЦИЛЦИКЛИНЫ, в том числе Тигециклин; ГИБРИДЫ, Кадазолид (Оксазолидинон-хинолон), TD-1792 (гликопептид-цефалоспорин); ЛИНКОЗАМИДЫ, в том числе Клиндамицин, Линкомицин, Пирлимицин; ЛИПОПЕПТИДЫ, в том числе Даптомицин, Суротомицин; МАКРОЛИДЫ, в том числе Азитромицин, Карбомицин, Цетромицин, Кларитромицин, Диритромицин, Эритромицин, Фидаксомицин, Флуритромицин, Гамитромицин, Джозамицин, Китазамицин, Лейкомицин, Мелеумицин, Мидекамицины, Миокамицин, Мирозамицин, Олеандомицин, Примицин, Рокитамицин, Розарамицин, Рокситромицин, Седекамицин, Солитромицин, Спирамицин, Телитромицин, Тердекамицин, Тилдипирозин, Тилмикозин, Тролеандомицин, Тулатромицин, Тилозин, Тилвалозин; НИТРОФУРАНЫ, в том числе Фуралтадон, Фуразидин, Фуразолидон, Фуразолиум хлорид, Нифуратель, Нифурфолин, Нифуроксазид, Нифурпиринол, Нифуртоинол, Нифурзид, Нитрофурал, Нитрофурантоин, Нитрофуразон; НИТРОИМИДАЗОЛЫ, в том числе Диметридазол, Метронидазол, Орнидазол, Ронидазол, Секнидазол, Тинидазол; ОЛИГОСАХАРИДЫ, в том числе Авиламицин, Эверниномицин; ДРУГИЕ АНТИБАКТЕРИАЛЬНЫЕ СРЕДСТВА, в том числе Ауриклосен, Хлороксин, Хпорхинальдол, Клиохинол, Клофоктол, Халхинол, Лотилибцин, Миндальная кислота, Метенамин (гексамин), Нитазол, Нитроксолин, Перхлозон, Тауролидин, Теноевая кислота, Ксиборнол; ОКСАЗОЛИДИНОНЫ, в том числе Эперезолид, Линезолид, Позизолид, Радезолид, Сутезолид, Тедизолид (Торезолид); ИНГИБИТОРЫ ПЕПТИД-ДЕФОРМИЛАЗЫ, в том числе GSK1322322; ПЕПТИДЫ, в том числе Омиганан, Пексиганан; ПЛЕВРОМУТИЛИНЫ, в том числе Ретапамулин, Тиамулин, Валнемулин; ПОЛИЭФИРНЫЕ ИОНОФОРЫ, в том числе Лайдломицин, Лазалоцид, Мударамицин, Монензин, Наразин, Салиномицин, Семдурамицин; ПОЛИМИКСИНЫ, в том числе Колистин, ПолимиксинВ; ПОЛИПЕПТИДЫ, в том числе, Бацитрацин Амфомицин, Капреомицин, Эндурацидин, Анрамицин, Энвиомицин, Фузафунгин, Грамицидин (Грамицидины), Изеганан, Магаинины, Нозигептид, Ристоцетин, Тиострептон, Туберактиномицин, Тироцидин, Тиротрицин, Биомицин; ПСЕВДОМОНОВЫЕ КИСЛОТЫ, в том числе Мупироцин; ХИНОЛОНЫ, в том числе Налидиксовая кислота, Немоноксацин, Оксолиновая кислота, Озеноксацин, Пипемидовая кислота, Пиромидиновая кислота; ХИНОКСАЛИНЫ, в том числе Карбадокс, Олаквиндокс; РИМИНОФЕНАЗИНЫ, в том числе Клофазимин; СТАТИНЫ, в том числе Аторвастатин, Флувастатин, Ловастатин, Мевастатин, Питавастатин, Правастатин, Розувастатин, Симвастатин; СТРЕПТОГРАМИНЫ, в том числе Дальфопристин, Флопристин, Линопристин, Пристинамицин, Квинупристин, Виргиниамицин; СТРЕПТОТРИЦИНЫ, в том числе Ноурсетрицин; СУЛЬФАНИЛАМИДЫ, в том числе Ацетил Сульфаметоксипиразин, Хлорамин-B, Хлорамина-Т, Дихлорамин T, Формосульфатиазол, Мафенид, N4-Сульфанилилсульфаниламид, Ноприлсульфамид, N-Сульфанилил-3,4-ксиламид, Ормаосульфатиазол, Фталилсульфацетамид, Фталилсульфатиазол, Салазосульфадимидин, Сукцинилсульфатиазол, Сульфабензамид, Сульфакарбамид, Сульфацетамид, Сульфахлорпиридазин, Сульфахризоидин, Сульфаклозин, Сульфацитин, Сульфадиазин, Сульфадикрамид, Сульфадиметоксин, Сульфадимидин, Сульфадоксин, Сульфаэтидол, Сульфагуанидин, Сульфагуанол, Сульфален, Сульфалоксовая кислота, Сульфамеразин, Сульфаметер, Сульфаметазин, Сульфаметизол, Сульфаметомидин, Сульфаметоксазол, Сульфаметоксипиридазин, Сульфаметилтиазол, Сульфаметопиразин, Сульфаметрол, Сульфамидохризоидин, Сульфамонометоксин, Сульфамоксол, Сульфаниламид, Сульфанилмочевина, Сульфаперин, Сульфафеназол, Сульфапроксилин, Сульфапиразин, Сульфапиридин, Сульфахиноксалин, Сульфатиазол, Сульфатиомочевина, Сульфатроксазол, Сульфизомидин, Сульфисоксазол (Сульфафуразол); СУЛЬФОНЫ, в том числе Ацедиасульфон, Дапсон, Глюкосульфон натрия, p-Сульфанилилбензиламин, Сукцисульфон, Сульфаниловая кислотуа, Сульфоксон натрия, СульфоксонТиазосульфон; Тетрациклины, в том числе Хлортетрациклин, Кломоциклин, Демеклоциклин, Доксициклин, Эравациклин, Гуамециклин, Лимециклин, Меклоциклин, Метациклин, Миноциклин, Окситетрациклин, Пенимепициклин, Пипациклин, Ролитетрациклин, Сарециклин, Тетрациклин.
Композиция согласно настоящему изобретению может дополнительно содержать вспосогательное вещество, выбранное из группы, включающей, но не ограниченной перечисленными, связующие агенты и добавки для прессования, покрытия и пленки, красители, разбавители и носители, разрыхлители, эмульгаторы и солюбилизаторы, ароматизаторы и подсластители, репелленты, скользящие вещества и смазывающие вещества, пластификаторы, консерванты, пропелленты, растворители, стабилизаторы, суспендирующие агенты и усилители вязкости.
В соответствии с еще одним аспектом настоящего изобретения предложено медицинское устройство для применения в способе лечения или профилактики бактериальной инфекции у субъекта.
В соответствии с еще одним аспектом настоящего изобретения предложено медицинское устройство, содержащее композицию согласно настоящему изобретению. Композиция согласно настоящему изобретению может быть в любой форме с замедленным высвобождением и/или в форме покрытия на указанном медицинском устройстве.
Медицинское устройство может быть представлено в форме, выбранной из группы, включающей: имплантат, пластырь, бинт и другую повязку, применяемую при бактериальной инфекции у субъекта.
В соответствии с еще одним аспектом настоящего изобретения предложен способ уничтожения бактерий, при этом способ включает стадию контактирования бактерий с соединением настоящего изобретения или его терапевтически приемлемой солью.
В соответствии с еще одним аспектом настоящего изобретения предложено применение соединения настоящего изобретения или терапевтически приемлемой соли для уничтожения бактерий, при этом указанное применение включающий стадию контактирования бактерий с соединением настоящего изобретения или его терапевтически приемлемой солью.
Термины, используемые в настоящей заявке, имеют свои обычные значения в данной области техники, если не указано иное. При использовании в настоящей заявке термин робенидин (также известный как 1,3-бис[(E)-(4-хлорфенил)метилиденамино]гуанидин или NCL812, согласно настоящему описанию) относится к соединению, имеющему химическую структуру:

КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Дополнительные признаки настоящего изобретения более полно описаны в последующем описании нескольких не ограничивающих вариантов его реализации. Данное описание представлено исключительно для иллюстрации настоящего изобретения. Описанные варианты реализации изобретения никоим образом не ограничивают краткого описания, раскрытия или описания изобретения, как изложено выше. Описание приведено со ссылкой на прилагаемые фигуры, где:
На Фигуре 1 приведено химическое название и химическая структура соединений с NCL001 по NCL230;
На Фигуре 2 показан график, иллюстрирующий влияние NCL812 на синтез макромолекул ДНК у Staphylococcus aureus в соответствии с Примером 2;
На Фигуре 3 показан график, иллюстрирующий влияние NCL812 на синтез макромолекул РНК у Staphylococcus aureus в соответствии с Примером 2;
На Фигуре 4 показан график, иллюстрирующий влияние NCL812 на синтез макромолекул белка у Staphylococcus aureus (АТСС29213) в соответствии с Примером 2;
На Фигуре 5 показан график, иллюстрирующий влияние NCL812 на синтез макромолекул клеточной стенки у Staphylococcus aureus (АТСС29213) в соответствии с Примером 2;
На Фигуре 6 показан график, иллюстрирующий влияние NCL812 на синтез макромолекул липидов у Staphylococcus aureus (АТСС29213) в соответствии с Примером 2;
На Фигуре 7 показан график, суммирующий влияние NCL812 на синтез макромолекул у Staphylococcus aureus (АТСС29213) в соответствии с Примером 2;
На Фигуре 8 показан график, иллюстрирующий влияние NCL812 на высвобождение АТФ у Staphylococcus aureus (АТСС29213) в соответствии с Примером 3;
На Фигуре 9 приведен график, показывающий средние пики кривых плавления на основании отрицательных производных -dF/dT после ПЦР в реальном времени с праймерами к гену mecA для метициллин-устойчивых изолятов S. aureus, сгруппированных по генным комплексам тес, А (n=4), В (n=10), C2 (n=4) и неклассифицированные (n=2). Группы, обозначенные различными надстрочными индексами статистически значимо различаются (p<0,05) в соответствии с Примером 4;
На Фигуре 10 представлен график со значениями оптической плотности в контрольном образце (рост в контроле) без добавок, а также при добавлении ампициллина и различных концентраций антибактериального агента NCL812, действующих против метициллин-чувствительного штамма S. aivreus ATCC 49775, полученные при использовании метода микроразведений в среде в соответствии с Примером 4. Тестируемые значения концентраций NCL812 составили МИК и четырехкратную МИК, определенную в условиях тестирования при инкубации до 24 ч. Ампициллин тестировали при МИК. Бактерицидную активность антибактериальных агентов тестировали на сроках 0, 1, 2, 4, 8, 12 и 24 ч;
На Фигуре 21 представлен график с кинетическими кривыми элиминации (kill kinetic curves) для метициллин-чувствительного штамма S. Aureus АТСС 49775, демонстрирующий бактерицидную активность NCL812 с помощью метода макроразведений Института клинических и лабораторных стандартов в 10 мл флаконах в соответствии с Примером 4. Концентрации тестируемых антибактериальных агентов составили


На Фигуре 12 приведен график, иллюстрирующий изменение pH при анализе методом макроразведений в среде для штамма S. pneumoniae D39 под воздействием 4 мкг/мл NCL812 и 0,0023 мкг/мл ампициллина в соответствии с Примером 5;
На Фигуре 13 приведен график, иллюстрирующий результаты анализа time-kill («время-элиминация») в течение 48-часового периода для штамма S. pneumoniae D39, обработанного NCL812 в соответствии с Примером 5;
На Фигуре 14 приведен график, иллюстрирующий результаты анализа time-kill («время-элиминация») в течение 48-часового периода для штамма S. pneumoniae D39, обработанного NCL062 в соответствии с Примером 5;
На Фигуре 15 приведен график, иллюстрирующий результаты анализа time-kill в течение 14-часового периода для штамма S. pneumoniae D39, обработанного NCL812 в соответствии с Примером 5;
На Фигуре 16 приведен график, иллюстрирующий результаты анализа time-kill в течение 14-часового периода для штамма S. pneumoniae D39, обработанного NCL062 в соответствии с Примером 5;
На Фигуре 17 приведен график, иллюстрирующий результаты анализа time-kill в течение 14-часового периода для штамма S. pneumoniae D39, обработанного ампицилллином в соответствии с Примером 5;
На Фигуре 18 приведен график, иллюстрирующий результаты анализа time-kill в течение 12-часового периода для штамма S. pneumoniae D39, обработанного NCL812 (взятый с Фигуры 43) в соответствии с Примером 5;
На Фигуре 19 приведен график, иллюстрирующий результаты анализа time-kill в течение 12-часового периода для штамма S. pneumoniae D39, обработанного NCL062 (взятый с Фигуры 44) в соответствии с Примером 5;
На Фигуре 20 приведен график, иллюстрирующий результаты анализа time-kill в течение 48-часового периода для штамма S. pneumoniae D39, обработанного ампицилллином в соответствии с Примером 5;
На Фигуре 21 приведен график, иллюстрирующий результаты анализа time-kill в течение 48-часового периода для штамма S. pneumoniae D39, обработанного эритромицином в соответствии с Примером 5;
На Фигуре 22 приведен график, иллюстрирующий результаты анализа time-kill в течение 48-часового периода для штамма S. pneumoniae D39, обработанного NCL812 и 5% хлоридом холина;
На Фигуре 23 приведен график, иллюстрирующий результаты анализа time-kill в течение 12-часового периода для штамма S. pneumoniae D39, обработанного NCL812 и 5% хлоридом холина в соответствии с Примером 5;
На Фигуре 24 приведен график, иллюстрирующий результаты анализа time-kill в течение 48-часового периода для штамма S. pneumoniae D39, обработанного NCL062 и 5% хлоридом холина в соответствии с Примером 5;
На Фигуре 25 приведен график, иллюстрирующий результаты анализа time-kill в течение 12-часового периода для штамма S. pneumoniae D39, обработанного NCL062 и 5% хлоридом холина в соответствии с Примером 5;
На Фигуре 26 приведен график, иллюстрирующий результаты анализа time-kill в течение 48-часового периода для штамма S. pneumoniae D39, обработанного ампициллином и хлоридом холина в соответствии с Примером 5;
На Фигуре 27 приведен график, иллюстрирующий относительную МБК для штамма D39, обработанного NCL812 или NCL062 в течение 48-часового периода в соответствии с Примером 5;
На Фигуре 28 приведен график, иллюстрирующий относительную минимальную бактерицидную концентрацию (МБК) для штамма S. pneumoniae D39, обработанного ампициллином в течение 48-часового периода в соответствии с Примером 5;
На Фигуре 29 приведен график, иллюстрирующий относительную МБК для штамма S. pneumoniae D39, обработанного эритромицином в течение 48-часового периода в соответствии с Примером 5;
На Фигуре 30 приведен график, иллюстрирующий количество жизнеспособных микроорганизмов (log10 KOE/мл) штамма S. pneumoniae D39, обработанного NCL812, полученное для макроразведений в анализе time-kill в течение 24 часов в соответствии с Примером 5;
На Фигуре 31 приведен график, иллюстрирующий количество жизнеспособных микроорганизмов (log10 КОЕ/мл) штамма S. pneumoniae D39, обработанного ампициллином, полученное для макроразведений в анализе time-kill в течение 24 часов в соответствии с Примером 5;
Фигура 32 представляет собой гистограмму, иллюстрирующую среднюю толщину клеточной мембраны у обработанного и необработанного штамма D39 в соответствии с Примером 5;
Фигура 33 представляет собой гистограмму, иллюстрирующую среднюю ширину периплазматического пространства у обработанных (16 мкг/мл NCL812) и необработанных образцов штамма D39 в соответствии с Примером 5;
На Фигуре 34 приведены данные по анализу кинетики элиминации (kill kinetics) для изолята MRSA 580 при разных концентрациях NCL812 при времени инкубации 8 ч в соответствии с Примером 7;
На Фигуре 35 приведены данные по анализу кинетики элиминации (kill kinetics) для изолята MRSA 580 при разных концентрациях NCL812 при времени инкубации 24 ч в соответствии с Примером 7;
На Фигуре 36 приведены данные по анализу кинетики элиминации (kill kinetics) для изолята MRSA 698 при разных концентрациях NCL812 при времени инкубации 24 ч в соответствии с Примером 7;
На Фигуре 37 приведены данные по анализу кинетики элиминации (kill kinetics) для изолята VRE 26c(dc) при разных концентрациях NCL812 при времени инкубации 24 ч в соответствии с Примером 7;
На Фигуре 38 приведены данные по анализу кинетики элиминации (kill kinetics) для изолята VRE 16c(dc) при разных концентрациях NCL812 при времени инкубации 24 ч в соответствии с Примером 8;
На Фигуре 39 приведены данные по анализу кинетики элиминации (kill kinetics) для Staphylococcus aureus KC01 при разных концентрациях NCL812 при времени инкубации до 24 ч в соответствии с Примером 8;
На Фигуре 40 приведены данные по анализу кинетики элиминации (kill kinetics) для Enterococcus faecalis USA01 при разных концентрациях NCL812 при времени инкубации до 24 ч в соответствии с Примером 8; и
Фигура 41 представляет собой график, иллюстрирующий совокупное высвобождение NCL812 и NCL099 из Препарата B в соответствии с Примером 10;
ОПИСАНИЕ ВАРИАНТОВ РЕАЛИЗАЦИИ
Общая часть
Перед описанием настоящего изобретения в деталях следует отметить, что изобретение не ограничивается конкретными способами, приведенными в качестве примеров, или композициями, описанными в данном документе. Также следует понимать, что используемая в настоящей заявке терминология предназначена только описания конкретных вариантов реализации изобретения и не является ограничивающей.
Все публикации, упоминаемые в настоящей заявке, в том числе патенты и заявки на патент, включены посредством ссылок в полном объеме. Однако, заявки, упомянутые в настоящем документе, приведены только в целях описания и раскрытия способов, протоколов и реагентов, указанных в публикации, которые могут быть использованы в связи с настоящим изобретением. Цитирование какой-либо публикации в данном документе не следует толковать как признание того, что изобретение не имеет права датироваться более ранним числом на основании предшествующего изобретения.
Кроме того, при осуществлении настоящего изобретения специалистами в данной области техники используются стандартные микробиологические методы, если не указано иное. Такие стандартные методы известны специалистам в данной области.
В настоящем описании и в прилагаемой формуле изобретения формы слов, приведенные в единственном числе, включают также множественное число, если из контекста явно не следует иное.
Если не указано иное, все технические и научные термины, используемые в настоящей заявке, имеют те же значения, которые обычно понятны среднему специалисту в области, к которой относится данное изобретение. Хотя для осуществления настоящего изобретения могут использоваться любые материалы и методы, аналогичные или эквивалентные тем, которые описаны в настоящей заявке, предпочтительные материалы и методы описаны в данном документе.
Изобретение, описанное в настоящей заявке, может включать один или несколько диапазонов значений (например, размер, концентрация, доза и т.д.). Следует понимать, что диапазон значений включает все значения в пределах диапазона, в том числе значения, определяющие диапазон, и значения, примыкающие к диапазону, которые обеспечивают такой же или по существу такой же результат, как и значения, непосредственно примыкающие к тому значению, которое определяет границу диапазона.
Фармацевтические или ветеринарные композиции согласно настоящему изобретению можно вводить в различных стандартных дозах в зависимости от способа введения, целевой области, физиологического состояния пациента и других вводимых лекарственных средств. Например, стандартная лекарственная форма, пригодная для перорального введения, включает твердые лекарственные формы, такие как порошки, таблетки, пилюли и капсулы, а также жидкие лекарственные формы, такие как эликсиры, сиропы, растворы и суспензии. Активные ингредиенты могут быть также введены парентерально в стерильных жидких лекарственных формах. Желатиновые капсулы могут содержать активный ингредиент и неактивные ингредиенты, такие как порошок-носитель, глюкоза, лактоза, сахароза, маннитол, крахмал, целлюлоза или производные целлюлозы, стеарат магния, стеариновая кислота, натриевая соль сахарин, тальк, карбонат магния и тому подобное.
Выражение «терапевтически эффективное количество» при использовании в настоящей заявке относится к количеству, достаточному для ингибирования роста бактерий, ассоциированного с бактериальной инфекцией или колонизацией. То есть, упоминание введения терапевтически эффективного количества соединения Формулы I согласно способам или композициям по настоящему изобретению относится к терапевтическому эффекту, в котором существенная бактерицидная или бактериостатическая активность вызывает существенное ингибирование бактериальной инфекции. Термин «терапевтически эффективное количество» при использовании в настоящей заявке относится к нетоксичному, но достаточному для обеспечения желаемого биологического, терапевтического и/или профилактического результата количеству композиции. Желаемые результаты включают устранение бактериальной инфекции или колонизации или уменьшение и/или облегчение признаков, симптомов или причин заболевания или любое другое желаемое изменение биологической системы. Эффективное количество в каждом отдельном случае может быть определено одним из специалистов в данной области техники с использованием стандартных экспериментов. По отношению к фармацевтической или ветеринарной композиции, эффективные количества могут представлять собой дозы, рекомендуемые для изменения болезненного состояния или признаков, или их симптомов. Эффективные количества различаются в зависимости от применяемой композиции и применяемого способа введения. Эффективные количества обычно оптимизированы с учетом фармакокинетических и фармодинамических характеристик, а также различных факторов у конкретного пациента, таких как возраст, вес, пол, и т.д., и области, подверженной заболеванию, или микроорганизмов, вызвавших заболевание.
При использовании в настоящей заявке термин «лечение» относится к полному или частичному снятию симптомов и признаков заболевания. Например, при лечении бактериальной инфекции или колонизации лечение полностью или частично снимает симптомы инфекции. Предпочтительно при лечении инфекции лечение уменьшает или устраняет инфицирующий бактериальный патоген, что приводит к микробному излечению.
При использовании в настоящей заявке термин «бактерии» относится к членам большого домена прокариотических микроорганизмов. Обычно несколько микрометров в длину, бактерии могут иметь разную форму, от сфер до палочек и спиралей, и могут быть представлены в виде отдельных клеток или в виде линейных цепочек или кластеров, состоящих из разного количества клеток и имеющих разнообразную форму. Предпочтительно термин «бактерии» и его прилагательное «бактериальный» относятся к бактериям, таким как грамположительные бактерии из родов Staphylococcus spp, Streptocccus spp, Bacillus spp, Enterococcus spp, Listeria spp, и анаэробные бактерии; грамотрицательные бактерии из родов Escherichia coli, Enterobacter spp, Klebsiella spp и Pseudomonas spp; и не имеющие клеточной стенки бактерии, такие как Mycoplasma spp и Ureaplasma spp. Указанные термины могут относиться к штаммам, чувствительным к антибиотикам, или к штаммам, устойчивым к антибиотикам. В предпочтительном варианте реализации термины относятся к MRSA или MRSP. В другом предпочтительном варианте реализации термины относятся к видам с МЛУ родов Staphylococcus spp, Streptococcus spp, Enterococcus spp, Clostridium difficile, Escherichia coli, Enterobacter spp, Klebsiella spp и Pseudomonas spp.
При использовании в настоящей заявке термин «метициллин-устойчивые бактерии» (например, метициллин-устойчивый Staphylococcus) относится к бактериальному изоляту, который демонстрирует устойчивость в любой дозе ко всем бета-лактамам, включая пенициллины, карбапенемы и цефалоспорины от первого до четвертого поколения, но не цефалоспорины пятого поколения, действующие против MRSA (например, цефтаролин). Множественную лекарственную устойчивость (МЛУ) определяют как приобретенную невосприимчивость по меньшей мере к одному агенту в трех или более категориях противомикробных агентов, широкую лекарственную устойчивость (ШЛУ) определяют как невосприимчивость по меньшей мере к одному агенту ко всем, кроме двух или менее категориям противомикробных агентов (то есть бактериальные изоляты остаются чувствительными только к одой или двум категориям) и полная лекарственная устойчивость (ПЛУ) определяется как не восприимчивость ко всем агентам во всех категориях противомикробных агентов, имеющихся в настоящее время.
Примером восприимчивых (чувствительных) бактерий и бактерий с МЛУ, ШЛУ и ПЛУ являются следующие. Изоляты Staphylococcus aureus дикого типа, которые не подвергались воздействию антибактериальных агентов, которые, вероятно, будут восприимчивыми ко всем следующим категориям антибактериальных агентов (и антибактериальным агентам): аминогликозиды (например, гентамицин); ансамицины (например, рифампицин); цефалоспорины, действующий против MRSA (например, цефтаролин); противостафилококковые бета-лактамы (например, оксациллин или цефокситин); карбапенемы (например, имипенем, эртапенем, меропенем или дорипенема); цефалоспорины не с расширенным спектром; цефалоспорины 1-го и 2-го поколения (например, цефазолин или цефуроксим); цефалоспорины расширенного спектра; цефалоспорины 3-го и 4-го поколения (например, цефотаксим или цефтриаксон); цефамицины (например, цефокситин или цефотетан); фторхинолоны (например, ципрофлоксацин или моксифлоксацин); ингибиторы фолатного пути (например, триметоприм-сульфаметоксазол); фуциданы (например, фузидовая кислота); гликопептиды (например, ванкомицин, тейкопланин или телаванцин); глицилциклины (например, тигециклин); линкозамиды (например, клиндамицин); липопептиды (например, даптомицин); макролиды (например, эритромицин); оксазолидиноны (например, линезолид или тедизолид); фениколы (например, хлорамфеникол); фосфоновые кислоты (например, фосфомицин); стрептограмины (например, хинупристин-дальфопристин); тетрациклины (например, тетрациклин, доксициклин или миноциклин). Изоляты, которые являются невосприимчивыми (устойчивы) более чем к одному агенту из более чем трех категорий противомикробных агентов, относят к МЛУ (все MRSA, например, отвечают определению бактерий с МЛУ). Изоляты, которые являются невосприимчивыми более чем к одному агенту из всех, кроме одного или двух категорий противомикробных агентов, относят к ШЛУ. Изоляты, которые являются невосприимчивыми ко всем перечисленным антибактериальными агентами являются ПЛУ
Фармацевтически и ветеринарно приемлемые соли включают соли, которые сохраняют биологическую эффективность и свойства соединений согласно настоящему изобретению и которые не являются биологически или иным образом нежелательными. Во многих случаях соединения, описанные в настоящей заявке здесь, способны образовывать кислотные и/или основные соли в силу наличия амино и/или карбоксильных групп, или групп подобных им. Приемлемые аддитивные соли могут быть получены из неорганических и органических оснований. Соли, полученные из неорганических оснований, включают, в качестве примера, соли натрия, калия, лития, аммония, кальция и магния. Соли, полученные из органических оснований, включают, но не ограничиваются перечисленными, соли первичных, вторичных и третичных аминов, таких как, только в качестве примера, алкиламины, диалкиламины, триалкиламины, замещенные алкиламины, ди- (замещенный алкил) амины, три (замещенный алкил) амины, алкениламины, диалкениламины, триалкениламины, замещенные алкениламины, ди- (замещенный алкенил) амины, три- (замещенный алкенил) амины, циклоалкиламины, ди- (циклоалкил) амины, три- (циклоалкил) амины, замещенные циклоалкиламины, дизамещенные циклоалкиламины, тризамещенные циклоалкиламины, циклоалкениламины, ди(циклоалкенил)амины, три(циклоалкенил)амины, замещенные циклоалкениламины, дизамещенные циклоалкениламины, тризамещенные циклоалкениламины, ариламины, диариламины, триариламины, гетероариламины, дигетероариламины, тригетероариламины, гетероциклические амины, дигетероциклические амины, тригетероциклические амины, смешанные ди- и триамины, где по меньшей мере два из заместителей у амина различаются между собой и выбраны из группы, включающей алкил, замещенный алкил, алкенил, замещенный алкенил, циклоалкил, замещенный циклоалкил, циклоалкенил, замещенный циклоалкенил, арил, гетероарил, гетероциклил, и т.п. Также охвачены амины, где два или три заместителя вместе с атомом азота из аминогруппы образуют гетероциклическую или гетероарильную группу.
Фармацевтически и ветеринарно приемлемые кислотно-аддитивные соли могут быть получены из неорганических и органических кислот. Неорганические кислоты, которые могут быть использованы для этой цели, включают, в качестве примера, соляную кислоту, бромистоводородную кислоту, серную кислоту, азотную кислоту, фосфорную кислоту и т.п. Органические кислоты, которые могут быть использованы для этой цели, включают, в качестве примера, уксусную кислоту, пропионовую кислоту, гликолевую кислоту, пировиноградную кислоту, щавелевую кислоту, яблочную кислоту, малоновую кислоту, янтарную кислоту, малеиновую кислота, фумаровую кислоту, винную кислоту, лимонную кислоту, бензойную кислоту, коричную кислоту, миндальную кислоту, метансульфоновую кислоту, этансульфоновую кислоту, п-толуолсульфоновую кислоту, салициловую кислоту и т.п.
Фармацевтически и ветеринарно приемлемые соли соединений, применяемых в настоящем изобретении, могут быть синтезированы из исходного соединения, которое содержит основную или кислотную группу, обычным химическими способами. Как правило, такие соли могут быть получены взаимодействием свободных кислотных или основных форм указанных соединений со стехиометрическим количеством соответствующего основания или кислоты в воде или в органическом растворителе или в смеси двух. Как правило, предпочтительны неводные среды, такие как эфир, этилацетат, этанол, изопропанол или ацетонитрил. Списки подходящих солей можно найти в справочнике Ремингтона Remington'sPharmaceuticalSciences. 17thed., MackPublishingCompany, Easton, Pa. (1985), p. 1418, включено в настоящее описание посредством ссылки. Примерами таких приемлемых солей являются иодид, ацетат, фенилацетат, трифторацетат, акрилат, аскорбат, бензоат, хлорбензоат, динитробензоат, гидроксибензоат, метоксибензоат, метилбензоат, o-ацетоксибензоат, нафталин-2-бензоат, бромид, изобутират, фенилбутират, γ-гидроксибутират, β-гидроксибутират, бутин-1,4-диоат, гексин-1,4-диоат, гексин-, 6-диоат, капроат, каприлат, хлорид, циннамат, цитрат, деканоат, формиат, фумарат, гликолат, гептаноат, гиппурат, лактат, малат, малеат, гидроксималеат, малонат, манделат, мезилат, никотинат, изоникотинат, нитрат, оксалат, фталат, терефталат, фосфат, моногидрофосфат, дигидрофосфат, метафосфат, пирофосфат, пропионат, пропионат, фенилпропионат, салицилат, соль себациновой кислоты, сукцинат, суберат, сульфат, бисульфат, пиросульфат, сульфит, бисульфит, сульфонат, бензолсульфонат, п-бромфенилсульфонат, хлорбензолсульфонат, пропансульфонат, этансульфонат, 2-гидроксиэтансульфонат, метансульфонат, нафталин-1-сульфонат, нафталин-2-сульфонат, p-толуолсульфонат, ксилолсульфонат, тартрат и т.п.
Фармацевтические или ветеринарные композиции согласно настоящему изобретению могут быть включены в состав препаратов традиционным способом, вместе с другими фармацевтически приемлемыми вспомогательными веществами, если это необходимо, в форме, подходящей для перорального, парентерального или местного введения. Способы введения могут включать в себя парентеральное, например, внутримышечное, подкожное и внутривенное введение, пероральное введение, местное введение и прямое введение в место инфекции, такое как внутриглазное, внутриушное, внутриматочное, интраназальное, интрамаммарне, внутрибрюшинное, внутриочаговое и т.п.
Фармацевтические или ветеринарные композиции согласно настоящему изобретению могут быть приготовлены для перорального введения. Могут быть добавлены стандартные неактивные ингредиенты для обеспечения желаемого цвета, вкуса, стабильности, буферной емкости, дисперсии или других известных желаемых особенностей. Примеры включают красную окись железа, силикагель, лаурилсульфат натрия, диоксид титана, пищевые белила и т.п. Стандартные разбавители могут применяться для получения прессованных таблеток. И таблетки и капсулы могут быть приготовлены в виде композиций с замедленным высвобождением для постоянного высвобождения лекарства в течение определенного периода времени. Прессованные таблетки могут иметь сахарную оболочку или пленочное покрытие, или энтеросолюбильное покрытие таблетки для селективного распада в желудочно-кишечном тракте. Жидкие лекарственные формы для перорального введения могут содержать красители и/или ароматизаторы для увеличения комплаентности у пациентов. В качестве примера, пероральный препарат, содержащий соединение согласно настоящему изобретению, может представлять собой таблетку, содержащую любой из, или комбинацию из, следующих вспомогательных веществ: двузамещенный кальция фосфат дигидрат, микрокристаллическая целлюлоза, лактоза, гидроксипропилметилцеллюлоза и тальк.
Описанные в настоящей заявке композиции могут быть в форме жидкого препарата. Примерами предпочтительных жидких композиций включают растворы, эмульсии, инъекции и растворы, содержащиеся в капсулах. Жидкий препарат может содержать раствор, который включает терапевтический агент, растворенный в растворителе. Как правило, можно применять любой растворитель, который имеет желаемый эффект, в котором растворяется терапевтический агент и который может быть введен субъекту. Как правило, можно применять любую концентрацию терапевтического агента, которая оказывает желаемое действие. В некоторых вариантах препарат представляет собой раствор, который является ненасыщенным, насыщенным или перенасыщенным. Растворитель может быть чистым растворителем или может быть смесью жидких компонентов растворителя. В некоторых вариантах раствор представлен в форме гелеобразующего insitu препарата. Растворители и типы растворов, которые можно применять, хорошо известны специалистам в области технологии доставки лекарств.
Композиция, описанная в настоящей заявке, может быть в форме жидкой суспензии. Жидкие суспензии могут быть получены в соответствии со стандартными процедурами, известными в данной области технике. Примеры жидких суспензий включают микроэмульсии, образование комплексных соединений и стабилизирующие суспензий. Жидкая суспензия может находиться в неразбавленной или концентрированной форме. Жидкие суспензии для перорального применения могут содержать подходящие консерванты, антиоксиданты и другие вспомогательные вещества, известные в данной области, в качестве одного или более диспергирующих агентов, суспендирующих агентов, загустителей, эмульгаторов, увлажнителей, солюбилизаторов, стабилизаторов, вкусовых добавок и подсластителей, красителей и т.п. Жидкой суспензии могут содержать глицерин и воду.
Композиция, описанная в настоящей заявке, может быть представлена в форме пасты для перорального введения. Паста для перорального введения может быть получена в соответствии со стандартными процедурами, известными в данной области.
Композиция, описанная в настоящей заявке, может быть представлена в форме жидкого препарата для инъекций, например, внутримышечных инъекций, и она может быть получена с применением способов, известных в данной области техники. Например, жидкий препарат может содержать поливинилпирролидон K30 и воду.
Композиция, описанная в настоящей заявке, может быть представлена в форме препаратов для местного применения. Препарат для местного применения может быть в форме лосьона или крема, полученных с использованием способов, известных в данной области техники. Например, лосьон может быть приготовлены на водной или масляной основе и может включать в себя одно или более вспомогательных веществ, известных в данной области, в качестве усилителей вязкости, эмульгаторов, ароматизаторов или отдушек, консервантов, хелатирующих агентов, модификаторов pH, антиоксидантов и т.п. Например, препарат для местного применения, содержащий одно или более соединение согласно настоящему изобретению, может представлять собой гель, содержащего любой из следующих экципиентов или их комбинацию: ПЭГ 8000, ПЭГ 4000, ПЭГ 200, глицерин, пропиленгликоль. Соединение NCL812 также может быть приготовлено в виде твердой дисперсии с использованием SoluPlus (BASF, www.soluplys.com) и может входить в состав препарата вместе и одним из следующих вспомогательных веществ или их комбинацией: ПЭГ 8000, ПЭГ 4000, ПЭГ 200, глицерин и пропиленгликоль.
Для аэрозольного введения композиция по изобретению может быть представлена в тонкодисперсной форме вместе с нетоксичным поверхностно-активным веществом и пропеллентом. Поверхностно-активное вещество предпочтительно растворимо в пропелленте. Такие поверхностно-активные вещества могут включать эфиры или неполные эфиры жирных кислот.
Композиции согласно настоящему изобретению, как альтернатива, могут быть приготовлены для доставки путем инъекции. В качестве примера, соединение вводят путем инъекции с помощью одного из следующих путей: внутривенного, внутримышечного, внутрикожного, внутрибрюшинного и подкожного.
Препараты, включающие композиции согласно настоящему изобретению, как альтернатива, могут быть составлены с применением методов доставки лекарств на основе нанотехнологий, таких, которые известны в данной области. Преимуществом систем доставки лекарств на основе нанотехнологий является улучшенная биодоступность, комплаентность пациента и снижение побочных эффектов.
Приготовление препаратов, включающих композиции настоящего изобретения включает приготовление наночастиц в виде наносуспензий или наноэмульсий, основанных на растворимости соединения. Наносуспензий представляют собой дисперсии наноразмерных частиц лекарственного средства, подготовленных на основе технологии «снизу вверх» или «сверху вниз» и стабилизированных с помощью подходящих вспомогательных веществ. Этот подход может применяться для соединений настоящего изобретения, которые могут иметь низкую водную и липидную растворимость, в целях повышения растворимости при насыщении и улучшения характеристик растворения. Пример такого подхода изложен в работе Шарма и Гарг (Sharma and Garg (2010). Pure drug and polymer-based nanotechnologies for the improved solubility, stability, bioavailability, and targeting of anti-HIV drugs. AdvancedDrugDeliveryReviews, 62: p. 491-502). Растворимость при насыщении, как следует понимать, является константой, специфичной для конкретного соединения и зависящая от температуры, свойств среды для растворения и размера частиц (<1-2 мкм).
Композиция согласно настоящему изобретению может быть представлена в виде наносуспензий. Для наносуспензий увеличение площади поверхности может привести к увеличению растворимости при насыщении. Наносуспензий представляют собой коллоидные системы доставки лекарственных средств, состоящие из частиц менее 1 мкм. Композиции согласно настоящему изобретению могут быть в форме наносуспензий, включая нанокристаллические суспензии, твердые липидные наночастицы (solid lipid nanoparticles, SLNs), полимерные наночастицы, нанокапсулы, полимерные мицеллы, и дендримерэ. Наносуспензии могут быть получены с использованием подхода «сверху вниз» таким образом, что более крупные частицы могут быть измельчены до нанометровых размеров с помощью различных методов, известных в данной области, в том числе мокрого помола и гомогенизации при высоком давлении. В качестве альтернативы, наносуспензии могут быть получены с использованием технологии «снизу вверх» таким образом, что контролируемое осаждение частиц может осуществляться из раствора.
Композиция согласно настоящему изобретению может быть представлена в виде наноэмульсии. Наноэмульсии обычно представляют собой прозрачные двухфазные системы «масло-в-воде» или «вода-в-масле» с размером капель в интервале 100-500 нм, и при этом целевое соединение присутствует в гидрофобной фазе. Приготовление наноэмульсии может улучшить растворимость соединения согласно настоящему изобретению, описанного в настоящей заявке, что обеспечивает лучшую биодоступность. Наноразмерные суспензии могут включать агенты для электростатической или стерической стабилизации, такие как полимеры и поверхностно-активные вещества. Композиции в форме SLN могут содержать биоразлагаемые липиды, такие как триглицериды, стероиды, воски и эмульгаторы, такие как соевый лецитин, яичный лецитин, и полоксамеры. Приготовление препаратов SLN может включать растворение/диспергирование лекарственного средства в расплавленном липиде с последующей горячей или холодной гомогенизацией. Если используется горячая гомогенизация, расплавленная липидная фаза может быть диспергирована в водной фазе, и таким образом получена эмульсия. Она может быть отверждена путем охлаждения до достижения SLN. При использовании холодной гомогенизации липидная фаза может быть отверждена в жидком азоте и измельчена до микронных размеров. Полученный порошок может быть подвергнут гомогенизации при высоком давлении в водном растворе поверхностно-активного вещества.
Соединение Формулы I, как описано в настоящей заявке, может быть растворено в маслах / жидких липидах и стабилизирован с образованием препарата в виде эмульсии. Наноэмульсии могут быть получены с помощью высоко- и низкоэнергетических методов измельчения капель. Высокоэнергетические методы могут включать гомогенизацию при высоком давлении, ультразвуковую обработку и микрофлюидизацию. При использовании низкоэнергетических методов спонтанную наноэмульсию создает диффузия растворителя и инверсия фазы. Липиды, используемые в наноэмульсиях, могут быть выбраны из группы, включающей триглицериды, соевое масло, сафлоровое масло, кунжутное масло. Также могут быть добавлены другие компоненты, такие как эмульгаторы, антиоксиданты, модификаторы pH и консерванты.
Композиция может быть представлена в форме препарата с контролируемым высвобождением и может включать разлагаемый или неразлагаемый полимер, гидрогель, органогель или другую физическую структуру, которая модифицирует высвобождение соединения настоящего изобретения. Следует понимать, что такие композиции могут включать дополнительные неактивные ингредиенты, которые добавляют для обеспечения желаемого цвета, стабильности, буферной емкости, дисперсии или других известных желательных характеристик. Такие препараты могут дополнительно включать липосомы, такие как эмульсии, пены, мицеллы, нерастворимые монослои, жидкие кристаллы, фосфолипидные дисперсии, пластинчатые слои и т.п. Липосомы для применения в настоящем изобретении могут быть изготовлены из стандартных образующих везикулы липидов, как правило, включающих нейтральные и отрицательно заряженные фосфолипиды и стерол, такой как холестерин.
Препараты настоящего изобретения могут иметь преимущество, заключающееся в повышенной растворимости и/или стабильности соединений, в особенности для препаратов, приготовленных с применением методов нанотехнологий. Такое повышение растворимости и/или стабильности соединений Формулы I может улучшить биологическую доступность и усилить воздействие препарата в виде лекарственных форм для перорального и/или парентерального введения.
В данном описании, если из контекста не следует иное, слово «содержать» или его формы, такие как «содержит» или «содержащий», подразумевает включение указанного элемента или группы элементов, но не исключение любого другого элемента или группы элемента.
ПРИМЕРЫ
ПРИМЕР 1: Минимальная ингибирующая концентрация (МИК) для NCL812 у метициллин-устойчивого Staphylococcus aureus (MRSA), ванкомицин-устойчивого Enterococcus spp. (VRE) и Streptococcus pneumoniae.
Специальные сведения
Как видно из предыдущего описания изобретения, изобретение относится к соединениям Формулы I, способам лечения бактериальной инфекции, к применению и медицинским устройствам.
Другое исследование было проведено для определения минимальных ингибирующих концентраций (МИК) для антибактериального агента NCL812. Этот антибактериальный агент представляет собой потенциально новый класс препаратов с узконаправленным спектром действия по отношению к бактериям и с новым механизмом действия. В данном исследовании внимание уделено недавно выделенным изолятам трех основных оппортунистических патогенов человека, с которыми связана проблема развития устойчивости к существующим классам антибактериальных агентов: метициллин-устойчивому Staphylococcus aureus (MRSA), ванкомицин-устойчивому Enterococcus spp. (VRE) и Streptococcus pneumoniae,
В этом примере, минимальные ингибирующие концентрации (МИК) NCL812 были определены для 61 австралийского клинического изолята (в том числе 21 изолята MRSA, 20 предположительных изолятов VRE и 20 изолята S. pneumoniae). Профили МИК для NCL812 оказались существенно согласованными при значениях МИК50 и МИК90, составляющих 4 мкг/мл, как было определено для каждого из тестируемых видов.
Материалы и методы
Сбор и идентификация бактериальных изолятов
Шестьдесят один тестируемый изолят был получен из клинических диагностических микробиологических лабораторий. Изоляты MRSA изначально были культивированы на селективном хромогенном агаре для MRSA (Brilliance MRSA Chromogenic Agar, Oxoid). Были отобраны предполагаемые колонии на основании их появления на данном агаре, идентификация их как Staphylococcus aureus проводилась на основании характеристик колоний на неселективном агаре с овечьей кровью (Sheep Blood Agar, SBA) и фенотипических характеристик, таких как окрашивание по Граму, положительный тест на каталазу, положительный тест на коагулазу (пробирочный тест на коагулазу с применением плазмы крови кролика) и фактора агглютинации (агглютинация с помощью латексного теста Oxoid Staphytect latex test), положительный результат в тесте Фогеса-Проскауера и способность производить кислоту из трегалозы. Положительная устойчивость к цефокситину позволила определить изоляты как MRSA. Все изоляты Enterococcus прошли стандартную биохимическую идентификацию. Биохимическое профилирование позволило предположительно определить четыре из изолятов VRE как Enterococcus faecalis и оставшийся как Enterococcus faecium. Все изоляты S. pneumoniae были идентифицированы на основании стандартного биохимического профилирования.
Подготовка антибактериальных агентов
Был получено соединение NCL812 с аналитической степенью чистоты (номер партии 20081214) со определенной активностью 1000 мг/г (т.е. 100%). Порошок хранили при температуре -20°C. Аликвоты (1 мл) исходного раствора (25,6 мг/мл) готовили в ДМСО, хранили при -80°C и размораживали непосредственно перед использованием.
Подготовка 96-луночных планшетов для тестирования МИК с помощью микроразведений в среде с использованием NCL812
Среду Мюллера-Хинтона со стандартизированным содержанием катионов (САМНВ) готовили с использованием 100 мл стерильной среды Мюллера Хинтона (с отрегулированным значением pH). В каждый объем 100 мл добавляли в асептических условиях 125 мкл стокового раствора кальция (10 мг Ca2+ на мл) и 43 мкл стокового раствора магния (10 мг Mg2+ на мл). Готовили достаточное количество среды для использования в течение дня, не использованные остатки хранили при 4°C в течение ночи.
Планшеты для микроразведений с 4% лизированной лошадиной кровью в САМНВ готовили путем лизирования лошадиной крови (Oxoid) при повторном замораживании и оттаивании (3-4 раза) и смешивания лизированной лошадиной крови (LHB) 50:50 со стерильной дистиллированной воды в асептических условиях. Бесклеточную суспензию получали при центрифугировании 50% LHB при 16000 × g (7000 об/мин/) в течение 20 мин. Супернатант удаляли, повторно центрифугировали и хранили в замороженном виде. 50% LHB разбавляли САМНВ с получением конечной концентрации 4% (7 мл LHB в 93 мл САМНВ). 4% LHB-CAMHB использовали вместо САМНВ на всех этапах при подготовке планшетов с микроразведениями и подготовки растворов противомикробных агентов для видов Streptococcus.
Рабочие стоковые растворы антибиотика NCL812 готовили в концентрации 25,60 мг/мл. Эффективность была определена как 1000 мг/г или 100%. Порошок растворяли в 10 мл ДМСО, распределяли аликвоты объемом 1 мл по пробиркам типа эппендорф и хранили при -80°C. При добавлении к САМНВ образовывался тонкий белесоватый осадок, и его хорошо тщательно встряхивали до и во время разделения на аликвоты.
Стоковый раствор ампициллина готовили в концентрации 25,60 мг/мл. Ампициллин использовали для внутреннего контроля качества. Ампициллин в виде порошка растворяли в 4 мл фосфатного буфера pH 8,0, 0,1 моль/л, затем разбавляли в 6 мл фосфатного буфера pH 6,0, 0,1 моль/л. Аликвоты объемом 1 мл распределяли в пробирки типа эппендорф и хранили при -80°C.
Для Staphylococcus aureus готовили рабочий раствор с концентрацией 256 мкг/мл путем разведения исходных растворов, описанных выше, 1:100 в САМНВ (100 мкл в 9,9 мл). При добавлении 90 мкл в каждую лунку 12 осуществляли разведение 1:2, таким образом, что в лунке 12 содержался антибиотик в концентрации 128 мкг/мл. Диапазон противомикробного агента рассчитывали как от 0,25 мкг/мл (лунка 3) до 128 мкг/мл (лунка 12).
Для видов Enterococcus готовили рабочий раствор с концентрацией 64 мкг/мл путем разведения стоковых растворов, описанных выше, 1:400 в САМНВ (100 мкл в 9,9 мл, с последующим разбавлением 1:4). При добавлении 90 мкл к лунке 12 осуществляли разведение 1:2, таким образом, что в лунке 12 содержался антибиотик в концентрации 32 мкг/мл.
Для Streptococcus pneumonia готовили рабочий раствора 64 мкг/мл готовили разведением стоковых растворов, описанных выше, 1:400 в 4% LHB-CAMHB (100 мкл в 9,9 мл, с последующим разведением 1:4). При добавлении 90 мкл к лунке 12 осуществляли разведение 1:2, таким образом, что в лунке 12 содержался антибиотик в концентрации 32 мкг/мл.
Серийные разведения готовили в 96-луночных планшетах в боксе с биологической безопасностью в соответствии с методами, стандартными в данной области техники. Кратко: 90 мкл рабочего раствора антибиотика добавляли в каждую лунку в колонке 12 планшета и хорошо перемешивали перед тем как перенести 90 мкл в колонку 11. Растворы вновь перемешивали, а затем переносили в следующую колонку, как и раньше, продолжая разведения до колонки 3. Для перемешивания содержимого лунки необходимо отобрать дозатором и вновь выпустить объем 90 мкл в каждой лунке 3-4 раза, прежде чем отобрать и перенести 90 мкл в следующую лунку. Колонка 2 (бактериальный положительный контроль) и колонка 1 (отрицательный контроль) не входили в серийные разведения. Планшеты распределяли следующим образом: 2 штамма тестировали в двух повторностях на одном планшете, один планшет, таким образом, что штамм 1 был расположен в рядах с A по D, штамм 2 был расположен в рядах с E по H и т.п. Стандарты для интерпретации МИК (мкг/мл) для ампициллина с использованием контрольных штаммов приведены в Таблице 1 ниже. Принятый диапазон МИК для ампициллина у Staphylococcus aureus АТСС 29213 = от 0,5 до 2 мкг/мл, Принятый диапазон МИК для ампициллина у Enterococcus faecalis АТСС 29212 = 0,5 2 мкг/мл, Принятый диапазон МИК для ампициллина у Streptococcus pneumoniae АТСС 49619=0,06 до 0,25 мкг/мл.

Подготовка бактериальной суспензии для определения МИК методом микроразведений в среде
Готовили свежие культуры бактерий для тестирования на агаре с овечьей кровью (SBA) и инкубировали их в течение ночи при 37°C, как описано ниже; 2-3 колонии каждого из штаммов выращивали в 7 мл стерильного солевого раствора, и измеряли CD600 как показатель оптической плотности (прибл. 0,5 × 108 КОЕ/мл или 0,5 по стандарту МакФарланда). Суспензию бактерий доводили до конечного значения поглощения от 0,08 до 0,100 с использованием солевого раствора для достижения необходимой плотности, и использовали солевой раствор как контрольный образец для измерения. В течение 15 минут подготовки доведенные до необходимой плотности бактериальные суспензии разбавляли стерильным физиологическим раствором 1:20 (1 мл в 19 мл стерильного физиологического раствора) до достижения конечной концентрации бактерий от 4 до 5 × 106 КОЕ/мл. Бактериальный раствор помещали в стерильную кювету и добавляли по 10 мкл бактериального раствора в лунки с 2 по 12 в каждом необходимом ряду (разведение 1:10 при конечной концентрации бактерий в лунках = 5 × 105 КОЕ/мл). Планшеты запечатывали пленкой и инкубировали при 37°C в течение 18-24 ч. Чистоту бактериальной суспензии проверяли, нанося штрихи из 50 мкл разведения 1:20 на чашки с SBA, которые инкубировали при 37°C в течение 18 ч и затем оценивали. Учет о жизнеспособных микроорганизмов проводили для проверки того, что в лунки был добавлен бактериальный раствор с правильной концентрацией бактерий. Разбавленный бактериальный раствор (от 4 до 5 × 106 КОЕ/мл) разводили 1:10 в сторону уменьшения, добавляя от 100 мкл до 900 мкл стерильного солевого раствора в стерильные пробирки, и продолжали серийные разведения 1:10 для 5 пробирок. 100 мкл (4-5 капли) в 4-го и 5-го разведения (пробирка 4 = 105 и пробирка 5 = 106 КОЕ/мл) высевали в двух повторностях на предварительно высушенные чашки с агаром PCA и инкубировали при 37°C в течение ночи. На следующий день подсчитывали число колоний на чашках и оценивали среднее количество в 100 мкл. Полученное значение умножали на 10 с получением количества жизнеспособных бактерий на мл.
Описание и идентификация изолятов
Изоляты MRSA изначально культивировали на селективном хромогенном агаре для MRSA (Brilliance MRSA Chromogenic Agar, Oxoid). Были отобраны предполагаемые колонии на основании их появления на данном агаре, идентификация их как Staphylococcus aureus проводилась на основании характеристик колоний на неселективном агаре SBA и фенотипических характеристик, таких как окрашивание по Граму, положительный тест на каталазу, положительный тест на коагулазу (пробирочный тест на коагулазу с применением плазмы крови кролика) и фактора агглютинации (агглютинация с помощью латексного теста Oxoid Staphytect latex test), положительный результат в тесте Фогес-Проскауэра и способность производить кислоту из трегалозы. Положительная устойчивость к цефокситину позволила определить изоляты как MRSA.
Клональные комплексы MRSA определяли с помощью быстрого молекулярного типирования. Два штамма из исследованных не смогли пройти типирование с помощью быстрого метода, как показано в Таблице 2 ниже.
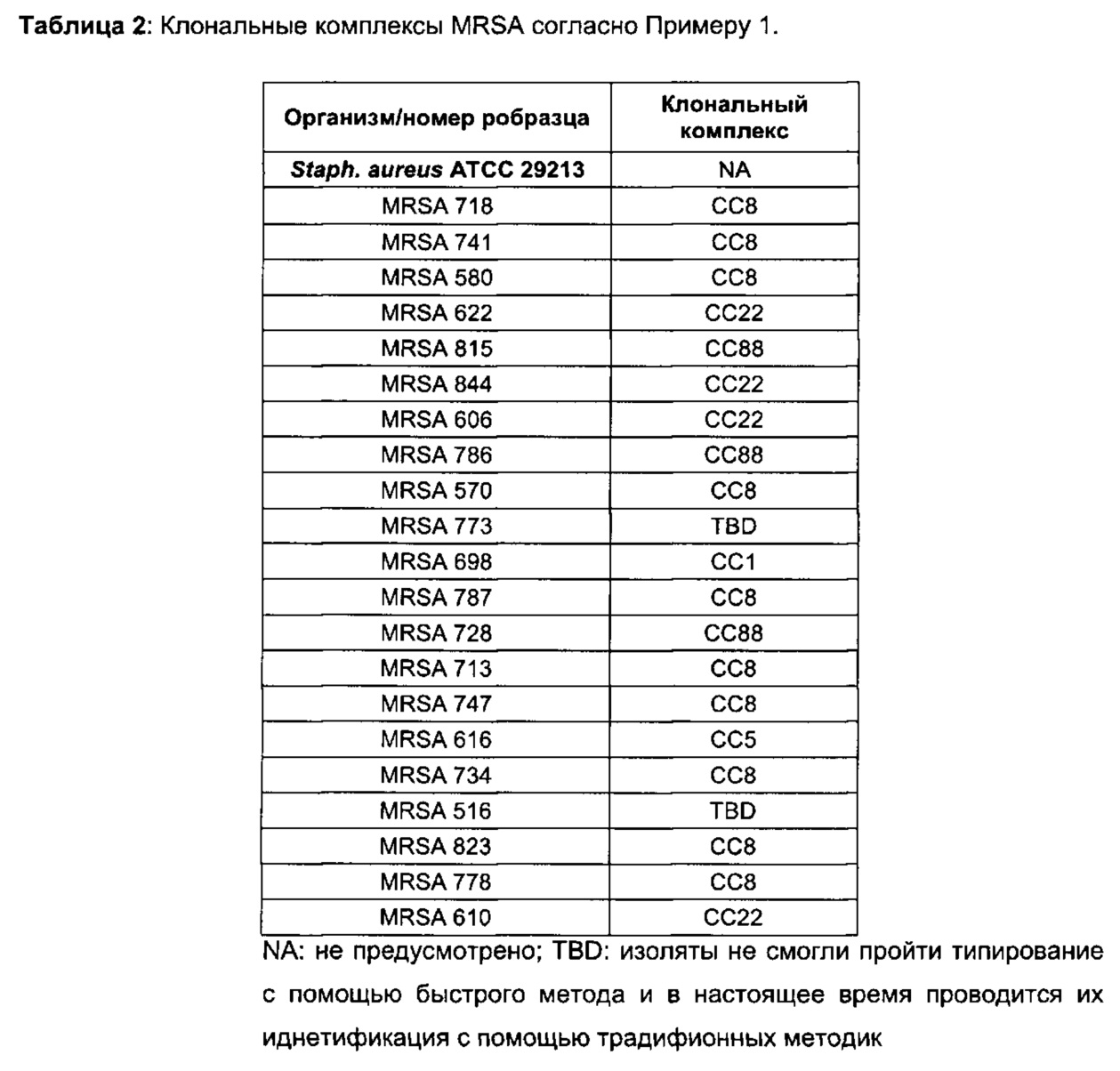
Все изоляты Enterococcus прошли упрощенную биохимическую идентификацию на основании Квинн и соваторов (Quinn et al., 1994, Clinical Veterinary Microbiology, Mosby Ltd, New York). Биохимическое профилирование позволило предположительно определить четыре из изолятов VRE как Enterococcus faecalis и оставшийся как Enterococcus faecium. Все изоляты S. Pneumonia были идентифицированы на основании стандартного биохимического профилирования.
Тестируемый продукт и его хранение
Было получено соединение NCL812 аналитической степени чистоты (номер партии 20081214) с определенной активностью 1000 мг/г (т.е. 100%), и порошок хранили при температуре -20°C. Аликвоты (1 мл) раствора (25,6 мг/мл) готовили в ДМСО и хранили при -80°C, и размораживают непосредственно перед использованием.
Определение минимальной ингибирующей концентрации
Минимальные ингибирующие концентрации (мкг/мл) определяли с помощью метода микроразведений в среде, рекомендованного Институтом клинических и лабораторных стандартов (CLSI) (Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria That Grow Aerobically; Approved Standard - Seventh Edition. CLSI M7-A7, 2006; Performance Standards for Antimicrobial Disk and Dilution Susceptibility Tests for Bacteria Isolated from Animals; Approved Standard - Second Edition. CLSI M31-A2, 2002; Performance Standards for Antimicrobial Susceptibility Testing; CLSI M2-A9, 2006).
МИК определяли как наименьшую концентрацию противомикробного агента, которая полностью ингибирует рост организмов в лунках микропланшета с микроразведениями при оценке невооруженным глазом. Пограничные значения МИК определяли путем визуальной оценки, а затем подтверждали с помощью планшет-ридера для ИФА, измеряя оптическую плотность при 450 нм. Рост бактерий (мутности) в лунках с противомикробным агентом сравнивали с уровнем роста (мутностью) в лунке с контролем роста (не содержащей противомикробный агент). Все изоляты тестировали в двух повторностях, если в результатах наблюдалась разница более чем в одно двухкратное разведение, тест повторяли в третий раз. Степень чистоты изолятов тщательно контролировать в процессе тестирования, пересевая подготовленный бактериальный инокулюм на чашки с SBA. Контрольные организмы (штамм Enterococcus faecalis АТСС 29212, штамм S. aureus ATCC 29213 и штамм S. pneumoniae ATCC 49619) использовали в ходе тестирования для оценки контроля качества. МИК для контрольных штаммов для ампициллина (составляющие 1,0, 2,0 и 0,06 мкг/мл, соответственно) определяли при каждом измерении в качестве внутреннего контроля качества. Значения МИК50, МИК90 и диапазон МИК (минимальное и максимальное) рассчитывали для каждой из групп бактерий.
Результаты
Значения МИК для ампициллина, полученные для контрольных штаммов АТСС, находились в пределах нормального диапазона, ожидаемого на основании рекомендаций CLSI. Значения МИК для NCL812 и ампициллина для каждого изолята указаны в Таблице 3 (изоляты MRSA), на Таблице 4 (изоляты VRE) и в Таблице 5 (изоляты S. pneumoniae) ниже. Значения МИК50, МИК90, моду МИК и диапазон МИК для каждого из протестированных видов бактерий представлены в Таблице 6 ниже. За МИК50 принимали самую низкую концентрацию, которая ингибировала видимый рост для 50% изолятов. За МИК90 принимали самую низкую концентрацию, которая ингибировала видимый рост у 90% изолятов. Мода МИК представляет собой наиболее часто встречающееся значение МИК, а диапазон МИК - полученные минимальные и максимальные значения МИК.




Значения МИК для NCL812 были согласованы в пределах видов и между каждым из трех видов. Значения МИК50 и МИК90 были оба равными (4 мкг/мл) для изолятов MRSA, VRE и S. pneumoniae, при этом менее 10% изолятов показали значения МИК либо на 1-2 разведение ниже или только на одно разведение выше этого значения.
На основании полученных результатов NCL812 представляет новый антибактериальный агент.
ПРИМЕР 2: Влияние NCL812 на синтез макромолекул у Staphylococcus aureus
Материалы и методы
Тестируемые соединения
Тестируемое соединение NCL812 доставляли к экспериментальной установке в условиях температуры окружающей среды и затем хранили при 2-8°C до анализа. Стоковые растворы получали растворением сухого порошка NCL812 в 100% ДМСО до концентрации 6400 мкг/мл. Ванкомицин (кат. №1134335), рифампицин (кат. №R-7382) и церуленин (кат. №C-2389) были приобретены у Sigma, ципрофлоксацин был получен от USP (кат. №1134335), а линезолид был получен от ChemPacific (кат. №35710).
Оценка минимальной ингибирующей концентрации
Метод оценки МИК соответствовал процедуре, описанной Институтом клинических и лабораторных стандартов или CLSI (Clinical and Laboratory Standards Institute) Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria That Grow Aerobically; Approved Standard-Eighth Edition. CLSI document M07-A8 [ISBN 1-56238-689-1]. Clinical and Laboratory Standards Institute, 940 West Valley Road, Suite 1400, Wayne, Pennsylvania 19087-19898 USA, 2009), и для проведения серийных разведений и переноса жидкостей использовали автоматизированное устройство для дозирования жидкостей. Для анализа МИК использовали среду Мюллера-Хинтона II (МНВ II - Becton Dickinson, Sparks, MD; Cat No 212322; Lot 9044411). Штамм S. aureus ATCC 29213 служил в качестве штамма контроля качества, линезолид был использован как контроль качества антибиотика для проверки работы метода. NCL812 и линезолид растворяли в 100% ДМСО перед добавлением к питательной среде.
Оценка синтеза макромолекул
Бактерии и условия роста
Эффект NCL812 на синтез тотальной клеточную ДНК, РНК, клеточной стенки, белков и липидов был исследован с помощью АТСС 29213 S. aureus. Клетки выращивали при 35°C в течение ночи на триптиказо-соевом агаре. Колонии с чашки использовали для инокуляции 10 мл среды Мюллера-Хинтона II (МНВII), культуру выращивали до ранней экспоненциальной фазы роста (OD600 = от 0,2 до 0,3) при инкубации в шейкере при 35°C и 200 об/мин.
Синтез ДНК, РНК и белков.
Когда клетки достигали ранней экспоненциальной фазы 100 мкл культуры добавляли в лунки с тремя повторностями, содержащими различные концентрации тестируемого соединения или контрольные антибиотики (5 мкл) при 20-кратной конечной концентрации в 100% ДМСО. Культура, обработанная 5% ДМСО, служила в качестве контроля «без лекарственных агентов» во всех экспериментов. Клетки добавляли в МНВII при 105% для учета объема добавленного препарата в каждой реакции или в минимальную среду M9 для реакций синтеза белка. После 15 мин инкубации при комнатной температуре добавляли либо [3H] тимидин (синтез ДНК), либо [3H] уридин (синтез РНК), либо [3H] лейцин (синтез белка) по 0,5-1,0 мкКи на реакцию, в зависимости от эксперимента. Реакции проводили при комнатной температуре в течение 15-30 мин, затем их останавливали добавлением 12 мкл холодной 5% трихлоруксусной кислоты (ТХУ) или 5% ТХУ/2% казаминовой кислоты (только синтез белка). Реакционные смеси инкубировали на льду в течение 30 мин и преципитированное ТХУ вещество собирали на 25 мм GF/A фильтр. После трехкратной промывки с 5 мл холодной 5% ТХУ фильтры промывали два раза с помощью 5 мл 100% этанола, оставляли высушиваться, а затем считывали, используя жидкостной сцинтилляционный счетчик Beckman LS3801.
Синтез клеточной стенки
Бактериальные клетки в ранней экспоненциальной фазе роста переносили на минимальную среду M9 и добавляли в 1,5 мл пробирки Эппендорф (по 100 мкл на пробирку), содержащие различные концентрации тестируемого соединения или контрольных антибиотиков (5 мкл) в 20Х конечной концентрации в 100% ДМСО, как описано выше. После 5 мин инкубации при 37°C в каждую пробирку добавляли [14С] N-ацетилглюкозамин (0,4 мкКи/реакция) и инкубировали в течение 45 мин при 37°C в нагревательном блоке. Реакции останавливали путем добавления 100 мкл 8% SDS в каждую пробирку. Затем реакции нагревали при 95°C в течение 30 мин в нагревательном блоке, охлаждали, коротко центрифугировали и наносили на предварительно увлажненные фильтры HA (0,45 мкм). После трехкратной промывки с 5 мл 0,1% SDS фильтры промывали два раза с помощью 5 мл деионизированной воды, оставляли высушиваться, а затем считывали с использованием жидкостного сцинтилляционного счетчика Beckman LS3801.
Синтез липидов
Бактериальные клетки выращивали до ранней экспоненциальной фазы роста в среде MHBII и добавляли в 1,5 мл пробирки Эппендорф (в трех повторностях), содержащие различные концентрации тестируемого соединения или контрольные антибиотики, как описано выше. После 5 мин инкубации при комнатной температуре добавляли [3H] глицерин по 0,5 мкКи на реакцию.
Реакции проводили при комнатной температуре в течение 15 мин, а затем останавливали путем добавления 375 мкл смеси хлороформ/метанол (1:2) с последующим встряхиванием на вортексе в течение 20 секунд после каждого добавления. Затем к каждой реакции добавляли хлороформ (125 мкл), встряхивали на вортексе, и затем добавляли 125 мкл dH2O и встряхивали на вортексе. Реакции центрифугировали при 13000 оборотах в минуту в течение 10 мин, а затем 150 мкл органической фазы переносили в сцинтилляционный флакон и оставляли высушиваться в вытяжном шкафу в течение по меньшей мере 1 часа. Затем считывали образцы с помощью жидкостного сцинтилляционного счетчика.
Результаты
Оценку восприимчивости проводили с NCL812 и штаммом S. aureus АТСС 29213 для определения концентраций лекарственного средства, необходимых для оценки синтеза макромолекул.
В Таблице 7 показано, что МИК для NCL812 составляла 4 мкг/мл, в то время как МИК для контрольного агента линезолид соответствовала установленному CLSI диапазону контроля качества (Институт клинических и лабораторных стандартов. Стандарты для тестирования противомикробной восприимчивости;. Девятнадцатое Информационное приложение, документ CLSI M100-S20 [ISBN 1-56238-716-2]. Институт Клинических и лабораторных стандартов, 940 West Valley Road, Suite 1400, Уэйн, штат Пенсильвания 19087-1898 США, 2010 г.). Преципитация NCL812 наблюдалась при ≥8 мкг/мл на чашках, подготовленных идентичным образом, но не инокулированных S. aureus. Оценку ингибирования синтеза макромолекул проводили с использованием концентраций NCL812, эквивалентных 0, 0.25, 0.5, 1, 2, 4 или 8-кратному значению МИК (4 мкг/мл) для S. aureus АТСС 29213 (Фигуры 11-16).

На Фигуре 2 показано влияние NCL812 на синтез ДНК. NCL812 демонстрирует отсутствие ингибирования при 0,25-кратной МИК, 40% ингибирование при 0,5-кратной и примерно 95% ингибирование при МИК. Для сравнения, используемый в качестве контроля ципрофлоксацин демонстрировал 51% ингибирование при 8-кратной МИК (0,5 мкг мл). Результаты ингибирования синтеза РНК для NCL812 были очень схожи с данными по оценке синтеза ДНК, при этом рифампицин использовали в качестве положительного контроля (Фигура 3). Следует отметить, что преципитация наблюдалась при 4-8 кратной МИК в среде Мюллера-Хинтона II, используемой при анализе синтеза ДНК и РНК.
Синтез белка ингибировался дозозависимым способом при 0,25, 0,5 и 1-кратных значениях МИК для NCL812, демонстрируя до 97% ингибирование при МИК (Фигура 4). Линезолид показал приблизительно 61% ингибирование синтеза белка при 8-кратной МИК (2 мкг/мл). В анализе синтеза белка преципитация NCL812 наблюдалась при 4 и 8-кратной МИК.
На Фигуре 5 соединение NCL812 также показало в некоторой степени дозозависимое ингибирование синтеза клеточной стенки, хотя при этом наблюдалось значительное увеличение ингибирования при от 1- до 2-кратной МИК. Однако ингибирование снижалось до примерно 68% и 52% при 4- и 8-кратной МИК, соответственно. Преципитация NCL812 наблюдалась при 2-, 4- и 8-кратной МИК в минимальной среде M9, используемой для анализа синтеза клеточной стенки, и это является вероятной причиной снижения ингибирования. Для сравнения, используемый в качестве положительного контроля ванкомицин показал 96% ингибирование при 8-кратной МИК (2 мкг/мл). NCL812 показало профиль ингибирования в отношении синтеза липидов, схожий с тем, который был показан для синтеза ДНК и РНК, достигая примерно 90% ингибирования при МИК (Фигура 6). Используемый в качестве положительного контроля ингибитор церулинин показал 72% ингибирование при 8-кратной МИК (32 мкг/мл).
Фигура 7 представляет собой объединение результатов для всех пяти реакций синтеза макромолекул. Видно, что кривые ингибирования были сходными для каждого пути, что свидетельствует о глобальном ингибировании NCL812 нескольких путей одновременно. Возможно, что мишенью NCL812 является клеточная мембрана, в результате чего происходит утечка основных ионов и/или метаболитов, что приводит к глобальной остановке путей синтеза в клетке.
Таким образом, NCL812 ингибировало пути синтеза ДНК, РНК, белков, клеточной стенки и липидов в растущей культуре S. aureus. Хотя отмечены некоторые случаи дозозависимого ингибирования синтеза, все пять макромолекулярных реакций синтеза были одинаково чувствительны к NCL812.
ПРИМЕР 3: Влияние NCL812 на высвобождение АТФ у Staphylococcus aureus
Материалы и методы
Тестируемые соединения
Тестируемое соединение NCL812 доставляли в условиях температуры окружающей среды и затем хранили при 2-8°C до проведения анализа. Стоковые растворы получали растворением сухого порошка NCL812 в 100% ДМСО до концентрации 1600 мкг/мл. Полимиксин B был получен от Sigma (кат. №P-4932).
Тестируемый организм
S. aureus АТСС 29213 был изначально получен из Американской коллекции типовых культур (Манассас, Виргиния).
Анализ высвобождения АТФ
Люминесцентный анализ жизнеспособности клеток с системой CellTiter-Glo (Promega) был использован для измерения утечки АТФ из бактерий. Культуры выращивали до ранней экспоненциальной фазы (0,2-0,3 OD600) в среде Мюллера-Хинтона II, затем обрабатывали семью различными концентрациями NCL812 или полимиксином B (положительный контроль) с использованием значений МИК для каждого соединения в качестве ориентиров (0, 0,25-, 0,5-, 1-, 2-, 3-, 4- или 8-кратная МИК). Отрицательный контроль обрабатывали 2% ДМСО, который представлял собой конечную концентрацию ДМСО в каждом анализе. После 30 мин воздействия лекарственным агентом клетки осаждали центрифугированием и супернатант анализировали на присутствие АТФ. Результаты учитывали в виде концентрации АТФ, высвобожденного в среду (мкм).
Результаты
МИК для NCL812 ранее была определена как 4 мкг/мл. Анализ высвобождения АТФ осуществлялся путем выращивания S. aureus до экспоненциальной фазы и последующего добавления лекарственного средства при кратных значениях МИК с целью выявления дозозависимого ответа.
Как показано на Фигуре 8, используемый в качестве положительного контроля полимиксин B дозозависимым способом стимулировал высвобождение АТФ из клеток S. aureus с максимальным высвобождением примерно 0,34 мкМ АТФ при 8-кратной МИК (256 мкг/мл). Высвобождение АТФ в присутствии NCL812 зависело от дозы при 0,5-1-кратной МИК, при этом максимальное высвобождение (0,33 мкМ) наблюдали при МИК (4 мкг/мл). Высвобождение АТФ затем фактически снижалось при 2-8-кратной МИК. Следует отметить, что в предыдущих исследованиях при 4-8-кратной МИК в среде Мюллера-Хинтона II наблюдалась преципитация NCL812.
Таким образом, соединение NCL812 демонстрировало дозозависимое высвобождение АТФ из активно растущих клеток S. aureus. Высвобождение АТФ из клеток в питательную среду достигало максимальных уровней при значениях МИК, и затем высвобождение АТФ снижалось при более высоких дозах. Полученные энные указывают на то, что NCL812 может взаимодействовать с клеточной мембраной S. aureus, в результате чего происходит утечка жизненно важных метаболитов, таких как АТФ.
ПРИМЕР 4: Антибактериальная активность NCL812 in vitro в отношении метициллин-устойчивого и метициллин-чувствительного Staphylococcus aureu
Материалы и методы
Противомикробные агенты
Аликвоты стокового раствора NCL812 (25,6 мг/л) готовили в диметилсульфоксиде, хранили при -80°C и размораживали непосредственно перед использованием. Ампициллин был получен от Sigma-Aldrich (Австралия). Противомикробные диски были получены от Thermo Fisher Scientific (Австралия).
Микроорганизмы
Были получены клинические изоляты MRSA, которые представляют собой наиболее распространенные типы последовательностей как для больничных MRSA (HA-MRSA), так и для внебольничных MRSA (CA-MRSA), которые описаны в Таблице 8 ниже. В качестве контрольного организма использовали S. aureus АТСС 49775. Идентификация изолятов была подтверждена общепринятыми способами фенотипической характеристики, в том числе с помощью пробы на коагулазу, теста Фогеса-Проскауэра, чувствительности к полимиксину B (300-единиц) и реакции латекс-агглюцинации белка A на стеклах (Staphytect Plus Protein A latex slide agglutination, Thermo Fisher Scientific, Австралия). Бактерии хранили при -80°C в 40% глицериновой среде, выращивали из стока на стандартном агаре с овечьей кровью (SBA) при 37°C. В последующих экспериментах были использованы только свежие культуры <24 ч.


Определение профиля устойчивости изолятов
Определение профиля восприимчивости к антибиотикам коллекции изолятов проводилось с помощью диско-диффузионного метода Кирби-Бауэра, как это рекомендовано Институтом клинических и лабораторных стандартов (CLSI) на агаре Мюллера-Хинтона. Изоляты выращивали в течение ночи на SBA при 37°C. Колонии суспендировали в физиологическом растворе. Мутность доводили до 0,5 по стандарту МакФарланда, суспензии распределяли по среде. Диски с антибиотиками согласно Таблице 9, ниже, переносили на инокулированную среду и анализировали после 24-часовой инкубации при 37°C. Изоляты, определенные как MRSA, которые не были устойчивыми к бета-лактаму на основании теста Кирби-Бауэра, выращивали из стока на агаре для подсчета колоний с добавлением 5 мкг/мл ампициллина, и подвергали их повторному тестированию, поскольку экспрессия РВР2а (Penicillin Binding Protein2a) может быть индуцирована путем воздействия бета-лактамных противомикробных агентов.


Молекулярное определение белка A и генов mecA для подтверждения статуса MRSA
Идентичность изолятов была подтверждена генотипически при применении дуплексного с помощью полимеразной цепной реакции (ПЦР), направленной на гены spa (белок А) и mecA (устойчивость к метициллину). Кроме того, изоляты тестировали на наличие генов mecA и spa с помощью ПЦР в реальном времени с использованием красителя SYBR Green. Приблизительно десять колоний из каждой ночной бактериальной субкультуры суспендировали в

Определение минимальной ингибирующей концентрации
Активности in vitro NCL812 и ампициллина в качестве положительного контроля были определены путем микроразведений в среде, как рекомендовано CLSI, в среде Мюллера-Хинтона II со стандартизированным содержанием катионов. Микротитровальные планшеты, содержащие двукратные разбавления каждого противомикробного агента, инокулировали с ~ 105 КОЕ/мл каждого изолята в 100 мкл конечного объема. Планшеты инкубировали в течение 24 ч при 37°C. Мутность (поглощение при OD600) измеряли с помощью микропланшетного спектрофотометра Bio-Rad Benchmark Plus с использованием Microplate Manager® версии 5.2.1 (Bio-Rad). Предельные значения минимальной ингибирующей концентрации (МИК) определяли как наиболее низкую концентрацию противомикробного агента, измеренную при помощи спектрофотометра, ингибирующую рост бактерий. АТСС 49775 был включен коллекцию изолятов в качестве контрольного организма, с предельными значениями, определенными CLSI. Рассчитывали значения МИК50, МИК90 (концентрации, ингибирующие рост ниже 50% и 90% от общего объема организмов, соответственно), и диапазон МИК (минимальное и максимальное значения) для определения профиля чувствительности к противомикробным агентам у коллекции изолятов.
Бактерицидная активность
Бактерицидная активность NCL812 была установлена путем определения минимальной бактерицидной концентрации (МБК) и анализа «время-элиминация» (time-kill) с использованием рекомендаций CLSI. МБК была определена, как самая низкая концентрация лекарственного агента, при которой было элиминировано 99,95% от исходного инокулюма.
Анализ «время-элиминации» (time-kill assay) для АТСС 49775 проводили в среде Мюллера-Хинтона II со стандартизированным содержанием катионов в микротитровальных планшетах также в объеме 10 мл для анализа макроразведений при концентрациях противомикробных агентов, эквивалентных


Статистические методы
Микробиологические данные интерпретировали с использованием рекомендаций CLSI. Данные исследовали с помощью t-теста Стьюдента, точного критерия Фишера, дисперсионного анализа и обобщенной линейной модели для тестирования межсубъектных эффектов, где это было необходимо. Различия считались статистически значимыми при уровне 0,05 при использовании программного обеспечения IBM SPSS® версии 19.0.
Результаты
Подтверждение индентификации Staphylococcus aureus и статуса гена mecA
Реакция латекс-аглюцинации подтвердила, что все 30 изолятов являлись положительными на присутствие белка A. При использовании агглютинации на стеклах изоляты дали положительную реакцию на коагулазную активность. Проба Фогеса-Проскауера и тест на устойчивость к полимиксину B подтвердили, что все изоляты принадлежали к S. aureus кроме единственного метициллин-чувствительного изолята MSSA DE-25, как показано в Таблице 10, ниже. На основании ПЦР-амплификации гена spa это изолят не был идентифицирован как изолят S. aureus, несмотря на положительный результат в тесте латекс-агглютинации на белок A и коагулозный тест на стеклах. Этот изолят Staphylococcus spp, полученный от собак, был идентифицирован как Staphylococcus pseudintermedius на основе биохимических характеристик. Результаты стандартной ПЦР и ПЦР в реальном времени для гена mecA подтвердили, что 66,66% изолятов были отнесены к метициллин-устойчивым на основании присутствия гена mecA. Никаких существенных различий между стандартной ПЦР и ПЦР в реальном времени по способности определять наличие гена mecA обнаружено не было (P>0,05).


Определение профилей чувствительности к антибиотикам у Staphylococcus aureus
Анализ чувствительности к антибиотикам показал, что изоляты HA-MRSA имели высший средний показатель распространенности устойчивости к нескольким классам антибиотиков (P<0,000). Изоляты CA-MRSA были следующими по устойчивости (P<0,007), а вслед за ними - метициллин-чувствительные стафилококки (P<0,037), как показано в Таблице 11 ниже. Устойчивость к оксациллину наблюдалась только у 80,00% и 10,00% изолятов HA-MRSA и CA-MRSA, соответственно. Устойчивость к цефотетану наблюдалась у 80,00% и 20,00% изолятов HA-MRSA и CA-MRSA, соответственно. Хотя оксациллин и цефотетан существенно не различались по способности выявлять MRSA (P>0,05), детекция была значительно улучшена при использовании ПЦР для гена mecA, при сравнении с диско-диффузным методом (P<0,013). Большинство изолятов HA-MRSA проявляли устойчивость к амоксициллин-клавулановой кислоте, цефотетану, цефалексину, клиндамицину, эритромицину, оксациллину, пенициллину G, в то время как большинство изолятов CA-MRSA были устойчивы только к клиндамицину, эритромицину, пенициллину-G. Ни один из протестированных изолятов не был устойчив к ванкомицину. В целом, наиболее распространенными были устойчивые фенотипы, устойчивые к пенициллину G (83,33%), эритромицину (73,33%) и клиндамицину (43,33%), в то время как лишь единичные изоляты (3,33%) были устойчивы к триметоприм-сульфаметоксазолу и рифампицину.
Взаимодействия в пределах генного комплекса тес
У всех изолятов MRSA, принадлежащих к типу A генного комплекса mec, наблюдалась устойчивость к оксациллину и цефотетану, как показано в Таблице 12, ниже. Однако, только 20% изолятов MRSA с типом B генного комплекса mec были фенотипически устойчивы к этим антибактериальным агентам. Среди изолятов MRSA, содержащих тип C2 генного комплекса mec, только у одного изолята наблюдалась метициллин-устойчивость к оксациллину, и только у двух изолятов наблюдалась устойчивость к цефотетану. У не классифицированных изолятов MRSA наблюдалась полная устойчивость к оксациллину и цефотетану.

Указаны соответствующие комплексы стафилококковой хромосомной кассеты (SCCmec) и типы, проявляющие фенотипически устойчивость к оксациллину и цефотетану, а также статус при анализе гена mecA методом ПЦР в реальном времени, и средние отрицательные пики dF/dT, полученные в анализе кривых плавления для гена mecA методом ПЦР в реальном времени
Пики точек плавления на графике отрицательных производных -dF/dT, полученных при ПЦР в реальном времени для гена mecA, отличались между типами комплекса генов mec (P<0,003) (Фигура 9) В среднем, тип B генного комплекса mec и неклассифицированные изоляты демонстрировали более высокие значения пиков температуры плавления, чем другие типы SCCmec (P<0,012).
Физические свойства тестируемых антибактериальных агентов и сравнение результатов оценки минимальных ингибирующих концентраций с исходным аналогичным тестированием
Тестируемые противомикробные агенты были выбраны на основании их растворимости и противомикробной активности из предварительных исследований. При растворении NCL812 в среде Мюллера-Хинтона II со стендартизированным содержанием катионов наблюдали образование белесоватых преципитатов, как показано в Таблице 13 ниже. На основании исходного тестирования структуры и активности каждого синтезированного аналога было показано, что NCL812 обладает согласованными значениями МИК в настоящем исследовании.

Подробное описание растворимости антибактериальных агентов в диметилсульфоксиде (ДМСО), в среде Мюллера-Хинтона II со стандартизированным содержанием катионов (САМНВ), и средние значения минимальных ингибирующих концентраций (МИК) (мкг/мл при 24 ч) в отношении метициллин-устойчивых S. aureus (MRSA), которые были определены в предварительных исследований и в ходе настоящего исследования. АТСС 49775; метициллин-чувствительный изолят S. aureus и контрольный штамм АТСС.MRSA580; метициллин-устойчивый изолят S. aureus #580. MRSA698; метициллин-устойчивый изолят S. aureus #698
Антибактериальная активность In vitro: минимальные ингибирующие концентрации
Значения МИК50 и МИК90 для соединения NCL812 (4- и 4-8 мкг/мл) приведены в Таблице 14, ниже. Значения МИК отличались у разных классов S. aureus (восприимчивые, HA- или CA-MRSA) (P<0,005). Во многих случаях соединение NCL812 показывало значительно более высокую активность против CA-MRSA и метициллин-чувствительных стафилококков при одном разведении, при сравнении с HA-MRSA (P<0,002 и P<0,020, соответственно), однако не было обнаружено существенных различий между значениями МИК для метициллин-чувствительных стафилококков и CA-MRSA (P>0,05). Значения МИК для ампициллина, полученные для контрольного штамма АТСС, находились в пределах нормального диапазона, ожидаемого на основании рекомендаций CLSI.
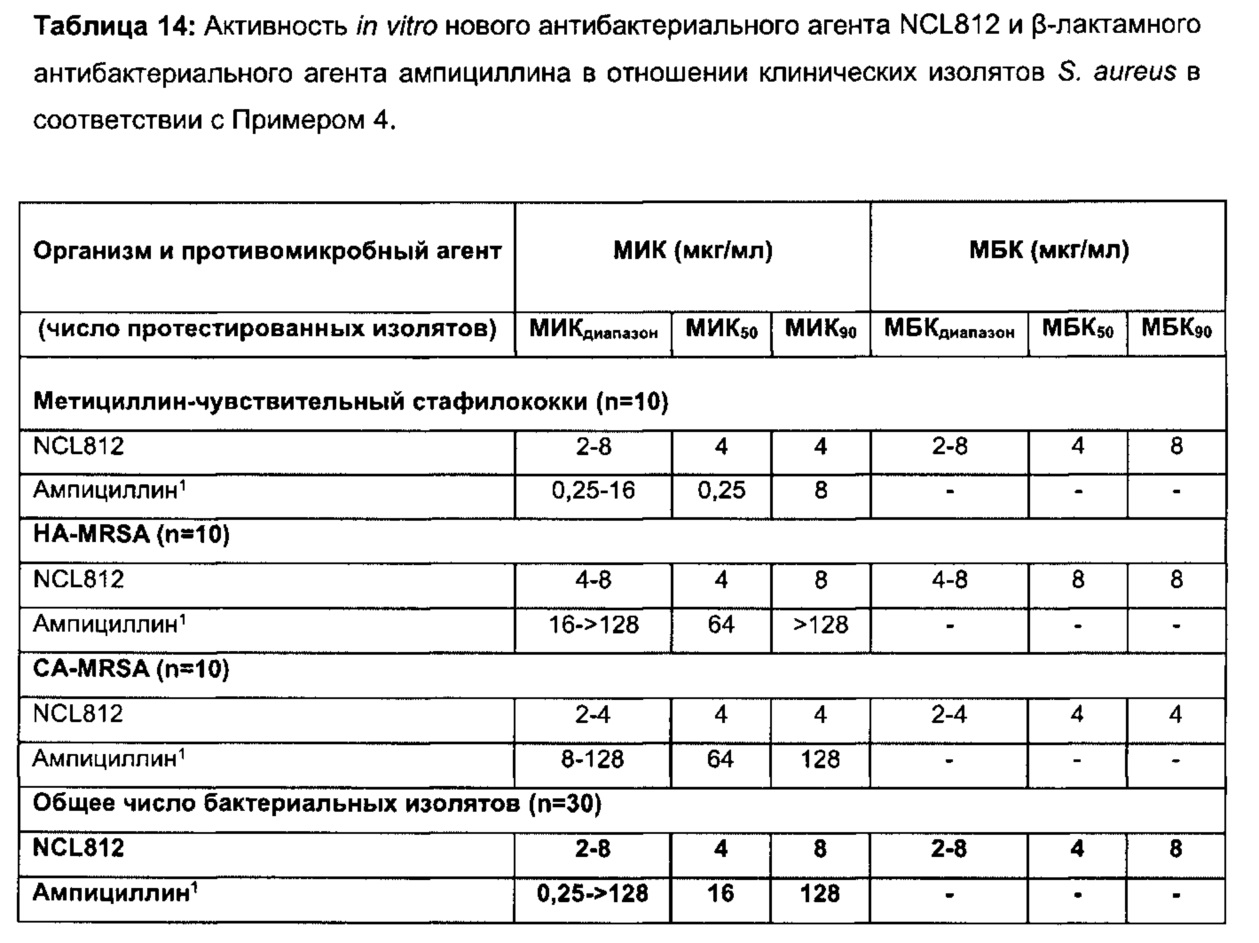
HA-MRSA; больничный метициллин-устойчивый S. aureus. CA-MRSA; внебольничный метициллин-устойчивый S. aureus.. МИК; минимальная ингибирующая концентрация (мкг/мл). МБК; минимальная бактерицидная концентраций (мкг/мл). Диапазон МИК/МБК; минимальный и максимальные значения МИК/МБК для всех изолятов. МИК/МБК50; значение МИК/МБК, при котором ингибируется 50% изолятов. МИК/МБК90; значение МИК/МБК, при котором ингибируется 90% изолятов
Антибактериальная активность in vitro: минимальные бактерицидные концентрации
Значения МБК, определенные для NCL812, были эквивалентны МИК для 93,33% и 83,33% изолятов S. aureus, соответственно (Таблица 14). Во всех остальных случаях значения МБК были на одно разведение выше. Для NCL812 диапазон значений МБК составил 2-8 мкг/мл и 4-16 мкг/мл, соответственно.
Исследования «время-элиминация» (time-kill studies)
По сравнению с турбидиметрической кривой роста для АТСС 49775, видимого роста бактерий не наблюдалось при инокуляции АТСС 49775 в среде Мюллера-Хинтона со стандартизированным содержанием катионов с добавлением NCL812 при


При анализе методом макроразведений в 10 мл в среде с добавлением противомикробных агентов при



Таким образом, пример, изложенный выше, показывает бактерицидную активность по отношению как к метициллин-чувствительным стафилококкам, так и к метициллин-устойчивым стафилококкам. Значения МИК и МБК были стабильно низкими для разных изолятов (диапазон МИК 2-8 мкг/мл). NCL812 сохраняет хорошую противомикробную активность in vitro в отношении распространенных изолятов MRSA со множественной лекарственной устойчивостью, в том числе вызывающие эпидемии изоляты UK EMRSA-15, EMRSA-16 и EMRSA-17, Irish EMRSA-1, AUS EMRSA-3, NY/JAPAN HA-MRSA и доминирующие клоны CA-MRSA. Соединение NCL812 было также активно в отношении одного изолята S. pseudintermedius, который был первоначально идентифицирован как штамм S. aureus.
Предварительное тестирование позволяет предположить, что мишенью соединения NCL812 является клеточная мембрана S. aureus, в результате чего происходит дозозависимое высвобождение жизненно важных метаболитов, таких как АТФ. Нарушение мембранного бислоя бактерий или белков, которые являются важной составляющей функционирования мембраны у бактерий, является мишенью для многочисленных крупных групп противомикробных агентов, которые широко распространены в природе; в том числе гликолипидов, липопептидов, липопротеинов, жирных кислот, нейтральных липидов, фосфолипидов и биосурфактантов. Хотя NCL812 является искусственным соединением с низкой молекулярной массой (≤500-DA), оно, по-видимому, оказывает аналогичное с другими противомикробными агентами бактерицидное действие, которое нацелено на грамположительную клеточную мембрану, в том числе с таким, как высокомолекулярный противомикробный агент из группы циклических липодепсипептидов даптомицин или низкомолекулярное соединение HT61, производное хинолона, химическая структура которого на настоящий момент недоступна. Многие из таких липофильных антибактериальных агентов также не эффективны в отношении грамотрицательных микроорганизмов из-за наличия наружного липидного слоя двухслойной мембраны, в котором находятся узкие каналы порины, которые препятствуют проникновению некоторых соединений в клетку.
Нерастворимость NCL812 даже в низких концентрациях в микробиологических средах может отражать амфипатическую и олигомерную природу этого противомикробного агента и предполагается, что реальная МИК может быть значительно ниже, чем наблюдаемое значение, так как существует вероятность того, что NCL812 является биологически активным только в растворе. В исследованиях «время-элиминация» соединение NCL812 проявляло быструю бактерицидную активность in vitro в отношении АТСС 49775. Эти данные также согласуются с профилем в анализе «время-элиминация» для ингибиторов функции клеточной мембраны, таких как даптомицин и HT61.
Важно отметить, что видимый короткий период полураспада in vitro этого противомикробного агента приводил к возобновлению бактериального роста, который наблюдался через 12 ч после добавления противомикробного агента. Это указывает на то, что если жизнеспособная бактериальная популяция выживает после первоначального воздействия NCL812 до инактивации противомикробного агента, то произойдет возобновление бактериального роста. Развитие устойчивости к NCL812 в этих исследованиях было исключено, поскольку тестируемые бактерии остались восприимчивы к NCL812 после сбора, промывок и тестирования МИК. Хотя видимый короткий период полураспада NCL812 in vitro может быть желаемой характеристикой для будущего применения in vivo, это указывает на то, что NCL812 следует вводить каждые 8 часов в последующих экспериментах in vivo по исследованию безопасности и для поддержания адекватной системной концентрации, хотя из профиля «время-элиминация» представляется, что серии соединения NCL являются скорее зависимыми от концентрации, чем зависимыми от времени противомикробными агентами.
Для преодоления метициллин-чувствительного фенотипа увеличение времени инкубации диффузии дисков с 24 до 48 часов компенсирует медленную дерепресию гена mecR. Хотя эффект более длительной инкубации не был изучен, и малый размер выборки изолятов MRSA препятствует дальнейшему изучению взаимодействий генного комплекса mec, генетические методы значительно улучшили чувствительность, по сравнению с фенотипическими методами подтверждения статуса mecA у изолятов в настоящем исследовании. Хотя генетические методы не всегда используются в качестве рутинного метода обнаружения MRSA, идентификация присутствия гена mecA в изолятах Staphylococcus spp с помощью ПЦР в реальном времени остается золотым стандартом диагностики.
ПРИМЕР 5: Фармакодинамика in vitro нового противомикробного агента для Streptococcus pneumoniae.
Материалы и методы
Пневмококковая чувствительность к антибиотикам
Пневмококковые штаммы и условия роста
Объектами данного исследования были двадцать пневмококковых изолятов, которые состоят из шести охарактеризованных лабораторных штаммов и 14 клинических изолятов (P9/6А, Р21/3, WCH16/6A, WCH43/4, WCH46/4, WCH57/8, WCH77/5, WCH86/4, WCH89/7, WCH92/4, WCH137/6A, WCH158/19F, WCH184/19F and WCH211/11; штамм/серотип, соответственно). Также в данном примере были использованы другие изоляты: A66.1/3 (Francis et al., 2001. Infect Immun. 69: 3350-2358); EF3030/19F (Briles et al., 2003 J. Infec. Diseases. 188: 339-348); L82016/6B (Briles et al., 2000 Infect Immun. 68: 796-800); TIGR4/4 (Tettlelin et al., 2001 Science 293: 498-506) и WU2/3 (Briles et al., 1981 J. Exp Med. 153: 694-705). Фенотипические характеристики изолятов, использованных в настоящем исследовании, см. в Таблице 15 ниже. В качестве контроля роста для всех исследований МИК и МБК был использован контрольный штамм D39 (Avery et al., 2010 Nature Reviews Microbiology 8: 260-271) из Национальной коллекции типовых культур (NCTC, The National Collection of Type Cultures). D39 позже был взят для исследования кинетики элиминации клеток, оценки устойчивости и анализа методом просвечивающей электронной микроскопии (ПЭМ), поскольку этот штамм является широко исследованным лабораторным штаммом с определенным патогенезом in vivo (Таблица 15), что отразилось в согласованных значениях МИК и МБК для NCL812.

Для всех исследований in vitro свежие пневмококковые изоляты выращивали в течение ночи (O/N, overnight) в чашках Петри на агаре с кровью лошади (НВА, horse blood agar) (39 г/л Основа колумбийского кровяного агара [Oxoid] 5% [об/об] дефибринированная кровь лошади [Oxoid]) при 37°C с добавлением 5% CO2. Кровяной агар Мюллера-Хинтона с 5% дефибринированной овечьей кровью (MHSBA Roseworthy Media and Blood Service) был использован для диско-диффузного анализа в соответствии со стандартами Клинического института лабораторных стандартов (CLSI). Пневмококков выращивали в среде, содержащей 4% лизированной крови лошади (LHB, lysed horse blood) в среде Мюллера-Хинтона со стандартизированным содержанием катионов (САНМВ, Cation Adjusted Mueller Hinton Broth) [Difco] при 37°C с добавлением 5% CO2. Среда с лошадиной сывороткой (HSB, Horse serum broth, 10% (об/об) донорной лошадиной сыворотки в среде [10 г/л пептона, 10 г/л Lab Lemco (Oxiod) и 5 г/л NaCl]) также была использована в некоторых исследованиях МИК. Изоляты хранили в HSB при -80°C.
Стоковые растворы антибиотиков и реагенты
NCL812 был получен в виде сухого порошка. Всего 256 мг было разведено в 10 мл 100% ДМСО для приготовления стокового раствора 25,6 мг/мл, который затем разбавляли в соотношении 1:100 в САНМВ для получения окончательного рабочего стокового раствора 256 мкг/мл. Ампициллин в виде сухого порошка был получен от Sigma A0166. Исходный стоковый раствор 25,6 мг/мл разбавляли в солевом растворе в соотношении 1:100, 1:4, 1:20 и 1:16 в САМНВ с получением окончательного рабочего стокового раствора 0,18 мкг/мл. Эритромицин был приобретен у Sigma Aldrich, хлорид холина был получен от Roche Diagnostics. Двадцать микролитров раствора эритромицина с концентрацией 0,05 мкг/мл разбавляли в соотношении 1:25 в 4,980 миллилитрах САМНВ для получения конечного рабочего стокового раствора 0,2 мкг/мл. Холин хлорид (0,5%) добавляли в 4% LHB САМНВ для отдельных исследований кинетики элиминации (kill kinetic assays).
Определение чувствительности к антибиотикам у пневмококковых изолятов
Восприимчивость изолятов к 12 разным противомикробным агентам (Таблица 16) была определена методами согласно CLSI и Европейскому комитету по тестированию противомикробной восприимчивости (EUCAST). Противомикробные агенты были выбраны на основании рекомендаций CLSI и EUCAST. Стандартизированные бактериальные суспензии наносили на MHSBA с помощью стерильного ватного тампона. [Бактериальные суспензии Streptococcus pneumoniae были стандартизированы по OD600nm между 0,08 и 0,1 с использованием спектрофотометра, а затем разбавлены в соотношении 1:20. Бактериальные колонии были взяты с O/N чашек Петри с агаром с лошадиной кровью. Для проверки чистоты бактериальной суспензии 1:20 50 мкл суспензии на носили на агар с лошадиной кровью и инкубировали O/N при 37°C с 5% CO2. КОЕ рассчитывали и сравнивали с исходными количеством на чашках.] Диски с антибиотиками (приобретены у Sigma Aldrich) были размещены с помощью дискового дозатора (приобретен у Oxoid) в соответствии со стандартами CLSI. Планшеты MHSBA инкубировали в течение 16-24 часов при 37°C в 5% CO2. Зоны полного ингибирования измеряли в трех повторностях с точностью до миллиметра с помощью линейки при оценке роста в естественном освещении, и моду представляли как величину диаметра для каждого изолята. Пневмококковые изоляты классифицировали как чувствительные, промежуточные (I) и устойчивые (R) в соответствии с диапазонами стандартов CLSI и контролем качества (QC) (Таблица 16).

Определение МИК50, МИК90, диапазона МИК и МБК50, МБК90, диапазона МБК
Значения МИК для NCL812 всех изолятов, перечисленных в Таблице 15, определяли путем измерения оптической плотности OD600 (спектрофотометр Spectramax, Molecular Devices Corporation) в качестве показателя бактериального роста с использованием 96-луночных микротитровальных планшетов после инкубации в течение 24 часов при 37°C в 5% CO2. [Микроразведения в среде и 96-луночные планшеты получали следующим способом: наносили аликвоты 90 мкл 4% LHB: САМНВ во все лунки с помощью многоканальной пипетки. 90 мкл рабочих растворов противомикробных агентов не серийным способом разбавляли вниз по планшету в соотношении 1:2. Среду как отрицательный контроль и контроль разведения были учтены при планировании схемы расположения проб в 96-луночном планшете.] Затем 10 мкл бактериальной суспензии добавляли в соответствующие лунки 96-луночного планшета. В каждый анализ включали соответствующие контроли: положительный (без противомикробного агента), отрицательный (без противомикробного агента или бактерий) и отрицательный контроль для разведения (контрольное серийное разведение противомикробного агента и среды). МБК и число колоний на чашках при анализе кинетики элиминации определяли путем нанесения аликвоты 20 мкл из каждой лунки микротитрационного 96-луночного планшета на среду НВ и инкубирования при 37°C с 5% CO2. МБК определяли по 99,95% ингибированию S. pneumoniae с учетом коэффициента разбавления. МИК и МБК были определяли в четырех повторностях и полученную моду принимали в качестве репрезентативного значения. МИК50, МИК90, диапазон МИК и МБК50, МБК90 и диапазон МБК определяли в соответствии со стандартами CLSI. МИК50 и МИК90 или МБК50 и МБК90 определяли как самые низкие концентрации, которые, после того как все полученные значения МИК и МБК изолятов были отсортированы от низшего к высшему, ингибировали 50-й и 90-й перцентиль от общего количества изолятов, соответственно.
Анализ «время-элиминация» при микроразведениях в среде для NCL812 с использованием штамма D39
Бактериальные суспензии добавляли в трех повторностях в 96-луночный планшет, содержащий NCL812 с исходной концентрацией 128 мкг/мл и последовательно серийно разведенный в соотношении 1:2 до концентрации 0,25 мкг/мл. Отрицательные контроли разведения вычитали из медианного значения роста для получения подходящего показателя общей продукции бактерий. 96-луночный планшет инкубировали при 37°C в 5% CO2 и OD600 считывали каждые 2 часа в течение первых 12 часов, после чего конечное считывание проводили через 24 и 48 ч. Для дальнейшего расширения этих данных для подтверждения тенденции в кривых роста, наблюдаемых при исходных исследованиях микроразведений в среде, проводили отдельный эксперимент, в котором 96-луночный планшет автоматически считывали каждые полчаса с помощью спектрофотометра (Spectramax спектрофотометра, Molecular Devices Corporation) в течение 14 ч.
МБК и исследование «время-элиминация» для NCL812 с использованием штамма D39
Оценку МБК «время-элиминация» проводили с использованием 96-луночных микропланшетов. В определенные моменты времени на основании аликвот, взятых с планшетов после инкубации при 37 градусах в 5% CO2 на НВА, оценивали количество жизнеспособных микроорганизмов, и определяли МБК после 24 часов роста.
Исследование «время-элиминация» при макроразведениях в среде для NCL812 с использованием D39
Бактериальные суспензии и рабочие стоковые растворы антибиотиков получали как описано выше. [Для приготовления макроразведений в среде в каждую из 20 мл пробирок добавляли 9 мл 4% LHB:САМНВ. 9 мл рабочего стокового раствора антибиотика разбавляли в соотношении 1:2 при добавлении к одной пробирок, и затем серийно разбавляли от высокой до низкой концентрации противомикробного агента. В соответствующие пробирки, в том числе с положительным контролем, добавляли 1 мл бактериальной суспензии S. pneumoniae. Пробирки инкубировали при 37°C с 5% CO2 при осторожном покачивании вручную пробирок с добавлением NCL812 каждые 10 мин в течение первых 12 часов. Каждые 2-3 часа в течение первых 12 часов роста, а затем через 24 часа и 48 часов, по 50 мкл каждой бактериальной суспензии высевали на НВА и инкубировали при 37°C с 5% CO2 в течение 16-24 часов.]
В Таблице 17 ниже указаны концентрации, используемые для каждого противомикробного агента. Культуры инкубировали при 37°C в 5% CO2, осторожно наклоняя вручную через каждые 10 минут в течение первых 12 часов. Число жизнеспособных микроорганизмов из 50 мкл аликвот каждой концентрации учитывали после инкубации при 37°C в 5% CO2 в течение 24 часов. Значения pH каждого образца измеряли в заданные моменты времени с помощью индикаторных полосок pH. Сплошной рост определяли в том случае, когда на чашку насчитывалось более 1000 колоний. Бактерицидное действие определяли как 100-кратное снижение (99,9%) от исходной суспензии клеток, которое определяли через 24 часа для каждой концентрации.

Проверка устойчивости к NCL812
Макроразведения в среде проводили, как описано выше. Культуры штамма D39 (10 мл) инкубировали в присутствии 2 мкг/мл и 4 мкг/мл NCL812 и 0,022 мкг/мл ампициллина в течение 6 ч при 37°C в 5% CO2. Образцы центрифугировали при центробежном ускорении 101,45 RCF (relative centrifugal force) в течение 10 мин и дважды промывали в 50 мл фосфатно-солевого буфера (PBS) для удаления остатков противомикробных агентов и/или бактериальных конечных продуктов и среды. Промытые бактерии ресуспендировали, и затем определяли МИК.
Влияние NCL812 на ультраструктуру клеточной мембраны D39.
Просвечивающая электронная микроскопия
С помощью просвечивающей электронной микроскопии (ПЭМ) определяли морфологические особенности и проводили морфометрический анализ клеточной мембраны. Бактериальные суспензии и 10 мл культуры D39 готовили, как описано выше. Образцы инкубировали при 37°C в 5% CO2 при осторожном ручном перемешивании культур каждые 10 минут. К культурам добавляли 1 мкг/мл, 4 мкг/мл либо 16 мкг/мл NCL812, и собирали бактерии через 6 или 12 ч путем центрифугирования при RCF 101,45 × g в течение 20 мин, и дважды промывали в 50 мл PBS. Критические моменты времени для работы ПЭМ определяли путем анализа тенденций в кривых роста, полученных из исследований кинетики элиминации. Образцы ресуспендировали в PBS, содержащем 20% глицерин, и хранили при -80°C до использования. Перед фиксацией удаляли 20% глицерин путем центрифугирования и трижды промывали на льду в 50 мл PBS.
Образцы фиксировали с использованием модифицированных протоколов, определенных в предыдущем исследовании по изучению ультраструктуры клеточной стенки S. pneumoniae, (Hammerschmidt S. и др 2005. Infect Immun 73:. 4653-4667). Процедура фиксации на основе ацетата лизина с использованием глутаральдегида-формальдегида рутения красного-осмия включала фиксацию бактериальных осадков с помощью какодилатного буферного раствора, содержащего 2% формальдегида, 2,5% глутарового альдегида, 0,075% рутения красного и 0,075 M ацетата лизина в течение 1 ч. После 3х-кратной промывки в какодилатном буфере, содержащем 0,075% рутения красного, в течение 1,5 ч проводили вторую фиксацию в какодилатном буферном растворе, содержащем 2% формальдегида, 2,5% глутарового альдегида и 0,075% рутения красного. Затем клетки промывали три раза в какодилатном буферном растворе, содержащем 0,075% рутения красного, и подвергали окончательной фиксации в 1% тетроксиде осмия в какодилате, содержащим 0,075% рутения красного, в течение 1 часа. Затем образцы промывали три раза в какодилатном буфере, содержащем только 0,075% рутений красный.
Образцы промывали и обезвоживали при помощи градуированных серий этанола (70, 90, 95 и 100%) в течение 10-20 мин, по два раза для каждого этапа. Образцы инфильтрировали с помощью 50:50 смолы LR White в 100% этаноле в течение 1 ч, а затем промывали с 100% смолы LR White в течение 1 ч и оставляли O/N в третьей смене 100% смолы LR White для обеспечения адекватной инфильтрации смолы. Затем образцы заключали в свежую смолу LR White и инкубировали при 50°C в течение 48 ч. Получали срезы по 1 мкм с использованием стеклянного ножа, затем окрашивали толуидиновым синим и просматривали под световым микроскопом при 400-кратном увеличении для идентификации присутствия окрашенных пневмококков. Затем делали по меньшей мере четыре ультратонких среза толщиной 90 нм с использованием алмазного ножа и помещали на матричную решетку, по одному срезу на решетку. Ультратонкие срезы окрашивали уранилацетатом и цитратом свинца поочередно с 5-минутными интервалами с последующими тремя промывками дистиллированной водой в промежутках между каждой экспозицией. Окрашенные срезы помещали на решетки и просматривали при 25000-кратном и 130000-кратном увеличении на просвечивающим электронном микроскопе Philips СМ100. Изображения были получены при 130000-кратном увеличении и проанализированы с помощью системы analySIS [Olympus Soft Imaging Systems].
Статистический анализ
Был проведен статистический анализ с помощью статистической программы GraphPad Prism (5-е изд, GraphPad Software Inc.) для Windows. Для кривых роста были представлены средние значения и стандартная ошибка среднего (SEM) (представлены в виде планок погрешностей) для каждой точки, за исключением исследований макроразведений в среде, где не могло быть проведено несколько повторностей из-за высоких затрат, связанных с данным анализом. Проводили двусторонние, непарные t-тесты.
Результаты
Фармакодинамика NCL812 для S. pneumoniae
Контроль качества диско-диффузного анализа для 20 изолятов S. pneumoniae
Хотя для девяти из двенадцати противомикробных агентов, использованных для диско-диффузного анализа, был установлен диапазон контроля качества (КК) от EUCAST, диапазоны КК не были определены для амоксициллина-клавуланата, кларитромицина и клиндамицина (Таблица 18 и Таблица 19). WCH16 и WCH184 были устойчивы по меньшей мере к двум антибактериальным агентам, тогда как изоляты EF3030 и WCH137 оказались промежуточным и устойчивым к триметоприм-сульфаметоксазолу, соответственно (Таблица 19). Другие оставшиеся шестнадцать изолятов были чувствительны ко всем двенадцати противомикробным агентам. Чувствительность к ампициллину была подтверждена для каждого изолята, что позволяет использовать ампициллин в качестве положительного контроля в последующих анализах микроразведений в среде (Таблица 18).).


Растворимость и активность NCL812 и NCL062 в различных средах
Соединение NCL812 визуально имело более высокую растворимость в 100% ДМСО, по сравнению с NCL062, и давало мутный раствор. только при дальнейшем его разбавлении в САМНВ или PBS (Таблица 20). Хотя растворитель САМНВ для NCL062 казался прозрачным при визуальной оценке (Таблица 20), дальнейшие исследования NCL062 с использованием разбавителя САМНВ выявили полную конфлюентность в анализе микроразведений в среде для шести изолятов S. pneumoniae по сравнению с ростом с разбавителем ДМСО (Таблица 21 и Таблица 22).



Рост штамма S. pneumoniae D39 при анализе МИК для NCL812 и NCL062 с использованием 10% HSB (220 мл лошадиной сыворотки фильтровали до 10% в 180 мл в питательной среде LEMCO) привел к трехкратному увеличению МИК для штамма D39, обработанного NCL812 и NCL062 (Таблица 23) с двукратным увеличением для положительного контроля - ампициллина. При различных условиях хранения предварительно подготовленных микротитрационных 96-луночных планшетов не наблюдалось изменений в МИК для D39 (Таблица 24). При макроразведениях в среде pH среды не изменялся, по сравнению с соответствующим контролем (Фигура 12.


Определение восприимчивости S. pneumoniae к NCL812 и NCL062 in vitro
Определение МИК50, МИК90, диапазона МИК для NCL812 и NCL062
NCL812 демонстрировал МИК50 и МИК90, составляющие 8 мкг/мл, а диапазон МИК составил 4-8 мкг/мл, тогда как соответствующие значения для NCL062 были выше и более вариабельными (Таблица 25 и Таблица 26). МИК для ампициллина был сопоставим с недавно опубликованными результатами, полученными с помощью метода микроразведений, как ожидаемый результат для устойчивости к противомикробным агентам у пневмококковых изолятов, подтверждая тем самым достоверность МИК, полученных для NCL812 и NCL062 (Таблицы 25-26 и Фигура 13).



Определение МБК50, МБК90, диапазона МБК для NCL812 и NCL062
Минимальные бактерицидные концентрации (МБК50, МБК90 и диапазон МБК, соответственно) были определены для NCL812 и ампициллина для всех двадцати изолятов (Таблица 25 и Таблица 26). Значения МБК50, МБК90 и диапазона МБК были ниже и более согласованы для NCL812, по сравнению с NCL062 (Таблица 25).
Исследование «время-элиминация» (time kill studies) с помощью микроразведений в среде для штамма D39, обработанного соединением NCL812 и NCL062
Под воздействием субингибирующих концентраций (≤2 мкг/мл) NCL812 или NCL062 штамм D39 характеризовался ростом, схожим с ростом у не обработанных контролей в течение 48-часового периода (Фигуры 13 и 14). Более высокие концентрации NCL812 и NCL062 (≥16 мкг/мл) приводили к отсутствию роста бактерий в течение 48 часов (Фигуры 14 и 15). Такие характеристики роста были подтверждены исследованием кинетики элиминации на основе микроразведений в среде с использованием спектрофотометра Spectramax, оценивающего рост (представленный как OD600) в получасовых интервалах в течение 14 часов при действии NCL812, NCL062 и ампициллина (Фигуры с 15 по 17). Наблюдалось примерно шестичасовое различие между началом экспоненциального роста у D39, обработанным NCL812 и у D39, обработанным NCL062 (Фигуры 13, 14, 18 и 19).
Рост штамма D39, обработанного NCL812 или NCL062, сравнивали с ростом D39, обработанным ампициллином или эритромицином в течение 48 часов (Фигуры 20 и 21). D39, обработанный ампициллином демонстрировал такой же рост, как и при воздействии NCL812 или NCL062 в течение 48 часов (Фигура 20). D39, обработанный эритромицином, характеризовался кривыми роста, отличающихся от тех, которые наблюдались при обработке NCL812 и NCL062, где наблюдалась большая разница в росте между концентрациями (Фигура 21). Добавление 5% хлорида холина в среду в течение 48-часов не привело к значительным отличиям в росте для NCL812 и NCL062, по сравнению с положительным контролем и ростом в контроле (Фигуры с 22 по 26).
Проверка возможной устойчивости
Штамм D39, обработанный ≤4 мкг/мл NCL812, входил в логарифмическую фазу роста в течение 6 часов (Фигуры 13 и 18), как показано в четырех независимых экспериментах. Возможность противомикробной устойчивости к NCL812 между 5 и 6 часами исследовали при дальнейшем определении МИК на D39 при воздействии 2 мкг/мл NCL812, 4 мкг/мл NCL812 и 0,0225 мкг/мл ампициллина в течение 6 ч. Согласно полученным результатам не наблюдалось значительного увеличения МИК для всех образцов D39, подвергавшихся воздействию NCL812, по сравнению с ростом в контроле и ампициллином (Таблица 27).

Макроразведения в среде путем измерения относительной МБК в заданные временных точках
Относительные значения МБК были определены в заданные промежутки времени с использованием проб из анализа разведений в среде, инкубированных в течение 48 часов, для NCL812 и NCL062 (Фигура 27), а также контрольных противомикробных агентов ампициллина и эритромицина (Фигуры 20 и 21). Были определены значения МИК ампициллина и эритромицина для штамма D39 (Таблицы 26 и 28). Описаны сравнительные особенности роста при воздействии ампициллина и эритромицина (Фигуры 28 и 29). Ампициллин и эритромицин демонстрировали зависящее от времени уменьшение бактерий. NCL062 демонстрировал быстрое бактерицидное действие, с быстродействующей (в пределах первых 10 минут введения) МБК, составляющей 8 мкг/мл (Фигура 27). Хотя наблюдалась несогласованность в значениях МИК для NCL062 между 5 и 12 ч, соединение NCL062 характеризовалось стабильной бактерицидной концентрацией (4 мкг/мл) между 24 и 48 ч. Соединение NCL812 демонстрировало быстрое бактерицидное действие, о чем свидетельствует приблизительно 3х-кратное снижение МБК в течение 5 часов (Фигура 27). Устойчивые бактерицидные концентрации для NCL812 (8 мкг/мл) поддерживались в течение полных 48 часов.

Исследование «время-элиминация» для D39 на основе макроразведений в среде с использованием NCL812 и NCL062
Количество жизнеспособных бактерий для каждого момента времени было представлено в виде log10 КОЕ/мл снижения для NCL812 (Фигура 30) и для ампициллина (Фигура 31). Согласованный сплошной рост (определяемый пределом 2×104 КОЕ) наблюдали у контрольной группы без воздействия агентов и при воздействии 2 мкг/мл NCL812. Полная бактерицидная активность (определяемая как 3log10 снижение КОЕ) наблюдалась для 128 мкг/мл NCL812 при 4log10 снижении КОЕ в течение 3 ч, и концентрации между 16 мкг/мл и 64 мкг/мл NCL812 были эффективны для устранения бактериального роста в течение 8 часов (Фигура 30). По всей вероятности, NCL812 при концентрациях 4 мкг/мл и 8 мкг/мл инактивируется через 11 часов после воздействия, так как после этого момента времени наблюдалось увеличение роста штамма D39 (Фигура 20 и 31). Значения количества жизнеспособных бактерий штамма D39, обработанного ампициллином, были согласованными в данном конкретном исследовании, демонстрируя постоянное снижение зависимой от времени элиминации в течение 48 ч (Фигура 31).
Просвечивающая электронная микроскопия
Морфометрический анализ показал значительные изменения в клеточной мембране штамма D39 при воздействии 16 мкг/мл NCL812 в течение 6 ч, по сравнению с контролем роста. Образцы, обработанные 4 мкг/мл, а также 12 ч культуры не включали в морфометрический анализ в связи с отсутствием бактериальных клеток в каждом срезе. Обработанные образцы обладали значительно более толстой клеточной мембраной (6,43±0,29 нм), по сравнению с необработанными образцами (4,35±0,24 нм) (p<0,0001) (Фигуры 32 и 29). Периплазматическое пространство (внутриклеточное пространство между клеточной мембраной и клеточной стенкой) у клеток штамма D39, обработанного 16 мкг/мл NCL812, было значительно шире (4,54±0,096 нм), по сравнению с необработанными образцами (3,91±0,14 нм) (P<0,001) (Фигуры 29 и 33).

Таким образом, соединение NCL812 демонстрирует в высокой степени стабильные значения МИК и эквивалентные МБК для коллекции штамма S. pneumoniae, что подтверждаем, что данное соединение обладает бактерицидным действием против этого организма. В исследованиях кинетики элиминации, в которых измеряли относительную МБК в течение 48 ч, соответствующий бактерицидный эффект был выявлен у D39 после 6 часов от первоначального воздействия NCL812.
Такая бактерицидная активность была показана для S. pneumoniae впервые. Этот результат свидетельствует о том, что NCL812 эффективен в отношении пневмококков in vitro.
Конкурентное связывание между компонентами в крови, сыворотке или среде привело к снижению противомикробной активности NCL. Это отразилось в увеличении значений МИК, наблюдаемых для различных типов сред и растворителей. После завершения этих исследований, последние независимые исследования подтвердили преципитацию NCL812 в PBS и показали полную растворимость в воде, содержащей 4% ДМСО после первоначального разбавления в 100% ДМСО. Водорастворимый NCL812 позволит значительно улучшить биодоступность in vivo и преодолеть отрицательное взаимодействие с белками сыворотки или крови.
На основании результатов данного исследования, соединение NCL812 характеризуется механизмом действия против S. pneumoniae, который отличается от механизма действия атибиотиков из классов β-лактамов или макролидов, поскольку данное соединение, по-видимому, демонстрирует зависимую от концентрации бактерицидную активность, в противоположность активности, зависящей от времени. Определение максимальной фармакокинетической концентрации в сыворотке для NCL812 in vivo позволит подтвердить зависимый от концентрации характер его фармакодинамической активности. Кроме того, добавление в среду хлорида холина подтвердило, что механизм действия соединения NCL не связан со сродством к холин-связывающим белкам клеточной стенки, и, следовательно, может быть не ассоциирован с клеточной стенкой.
Морфометрический анализ клеточной мембраны и периплазматического пространства клеток штамма D39, обработанных 16 мкг/мл NCL812 в течение 6 ч, показал, что клеточная мембрана и периплазматическое пространство были шире в обработанных образцах, по сравнению с контрольными образцами. Очевидное увеличение размера мембраны может быть обусловлено накоплением электроноплотного внутриклеточного вещества под клеточной мембраной. Увеличение размера периплазматического пространства может быть обусловлено нарушением клеточной мембраны, возможно, за счет деполяризации или ингибирования АТФ. Механизм действия NLC812 может быть не зависимым от кальция, поскольку на электронных микрофотографиях, по всей видимости, не наблюдалось конкурентного связывания между NLC812 и рутениевым красным, ингибитором кальциевых каналов липидного бислоя.
В заключение, данное исследование in vitro показало, что NCL812 обладает многими востребованными характеристиками как быстродействующий зависимый от концентрации бактерицидный противомикробный агент, мишенью которого, по-видимому, является клеточная мембрана S. pneumoniae. Эти характеристики являются желаемыми для лечения острых пневмококковых инфекций. Так как NCL812 может обладать механизмом действия, который нацелен на клеточную мембрану, он будет действовать гораздо быстрее, чем зависящие от времени противомикробные агенты, такие, как β-лактамы и макролиды, и потенциально является более эффективным, чем другие бактерицидные противомикробные агенты, зависящие от концентрации, такие как фторхинолоны, которые воздействуют на внутриклеточные мишени.
ПРИМЕР 6: Характеристика метициллин-чувствительных и метициллин-устойчивых изолятов Staphylococcus pseudintermedius из Австралии и предварительный анализ эффективности in vitro нового противостафилококкового соединения.
Материалы и методы
Сбор образцов и идентификация метициллин-чувствительных изолятов Staphylococcus pseudintermedius (MSSP) и метициллин-устойчивых изолятов Staphylococcus pseudintermedius (MRSP).
Всего было получено 23 изолята Staphylococcus pseudintermedius из собак (Таблица 30).

Для исследования было собрано десять метициллин-чувствительных и 13 метициллин-устойчивых изолятов Staphylococcus pseudintermedius. Изоляты были фенотипически классифицированы как устойчивые к метициллину на основании их устойчивости к оксациллину in vitro и наличия гена mecA, что было проанализировано в соответствии со стандартными процедурами.
Проводили оценку чувствительности к оксациллину и цефокситину с использованием диско-диффузного метода и эпсилометрии (E-тест). Идентификацию гена mecA осуществляли с помощью полимеразной цепной реакции ПЦР (ПЦР).
Тестирование чувствительности диско-диффузным методом CLSI проводили для 23 изолятов Staphylococcus pseudintermedius для следующих противомикробных агентов: пенициллин, амоксициллин, эритромицин, гентамицин, клиндамицин, ципрофлоксацин, цефалексин, хлорамфеникол, тетрациклин, окситетрациклин, ванкомицин, цефотетан, моксифлоксацин и рифампин.
Оценку минимальной ингибирующей концентрации (МИК) и минимальной бактерицидной концентрации (МБК) для NCL812 проводили с использованием методологии CLSI, используя ампициллин в качестве контроля. Затем тестировали активность противостафилококковых соединений против всех изолятов 23 и определяли минимальные ингибирующие концентрации (МИК) в соответствии со стандартными протоколами. После определения МИК проводили оценку минимальных бактерицидных концентраций для определения того, обладают ли эти соединения бактериостатическим или бактерицидным действием.
Результаты
Наличие гена mecA было выявлено у 13 изолятов MRSP, а его отсутствие - у 10 изолятов MSSP (Таблицы 30 и 31). Все изоляты MRSP были устойчивы к оксациллину на основании диско-диффузного анализа (≤17 мм) и E-теста МИК (≥0,5 мг/л).

При установленном пограничном значении для устойчивости к цефокситину на уровне ≤24 мм, 3/13 (23%) и 5/13 (38%) из протестированных изолятов MRSP были восприимчивы к цефокситину. При пограничном значении на уроне ≤30 мм только 1/13 (7,7%) из изолятов протестированных MRSP оказались восприимчивыми к цефокситину (Таблица 30 и 31).
Изоляты MRSP были устойчивы к нескольким классам антибиотиков. Из 13 изолятов MRSP все 13 были чувствительны к рифампицину. 3/13 (23%) были чувствительны к хлорамфениколу; 10/13 (77%) были чувствительны к ванкомицину (Таблица 30 и 31).
Интересно, что 3/13 (23%) из MRSP изолятов были чувствительны к амоксициллину; 8/13 (62%) были чувствительны к цефалотину; 12/13 (92%) были чувствительны к цефотетану и 12/13 (92%) были чувствительны к моксифлоксацину (Таблица 30 и 31).
Все 23 изолята были чувствительны к NCL812 на основании МИК. Кроме того, соединение NCL812 проявляло бактерицидное действие на основании минимальных бактерицидных концентрациях (МБК).
Диапазон МИК для NCL812 в отношении изолятов Staphylococcus pseudintermedius составил от 1 мкг/мл до 4 мкг/мл (Таблица 32). Значения МИК50 и МИК90 для NCL812 в отношении изолятов Staphylococcus pseudintermedius были определены как 2 мкг/мл и 4 мкг/мл, соответственно (Таблица 33). Мода МИК и диапазон МИК длят NCL812 в отношении изолятов Staphylococcus pseudintermedius были определены как 2 мкг/мл и 1-4 мкг/мл, соответственно (Таблица 33).



Метициллин-устойчивый Staphylococcus pseudintermedius (MRSP) является новым угрожающим фактором для собак, кошек и лошадей. Были идентифицированы два основных клона MRSP среди собак в Европе (ST 71) и Северной Америке (ST 68). Также были сообщения о MRSP, поражающих собак в Японии, один случай обнаружения MRSP у ветеринарного персонала в Гонконге.
В настоящем исследовании изоляты MRSP были определены на основании комбинации методов, по наличию гена mecA и наличия устойчивости к оксациллину in vitro. Устойчивость к цефокситину была использована в качестве замены для оксациллина для метициллин-устойчивых изолятов Staphylococcus aureus. Однако, оценка устойчивости к цефокситину с помощью диско-диффузного метода на основании принципов интерпретации, рекомендованных для изолятов человека метициллин-устойчивого Staphylococcus aureus и коагулазо-негативных стафилококков является ненадежной при определении MRSP. Пограничное значение для устойчивости к цефокситину, согласно которому ≤30 мм = устойчивые и ≥31 = восприимчивые изоляты, было предложено Бемис и соавторами, 2012 Bemis, D.A., R.D. Jones, et al. (2012). "Evaluation of cefoxitin disk diffusion breakpoint for detection of methicillin resistance in Staphylococcus pseudintermedius isolates from dogs." Journal of Veterinary Diagnostic Investigation 24(5): 964-967]. Результаты данного исследования согласуются с тем, что данное пограничное значение быть более надежным в прогнозировании метициллин-устойчивых изолятов Staphylococcus pseudintermedius.
Изоляты MRSP, как правило, устойчивы к нескольким классам антибиотиков. В связи с этим, для всех инфекций с подозрением на MRSP рекомендуется анализ бактериальной культуры и устойчивости к антибиотикам для выбора соответствующих антибиотиков. Ограничением, отмеченным в данном исследовании, является наблюдаемая in vitro восприимчивость изолятов MRSP к амоксициллину и цефалоспоринам (цефалотин и цефотетан).
NCL812 эффективен против всех 23 изолятов, как MSSP так и MRSP. Необходимо более масштабное исследование для подтверждения эффективности NCL812 против Staphylococcus pseudintermedius, поскольку это соединение может представлять собой безопасный альтернативный вариант антибиотика для появляющихся инфекции MRSP у домашних животных.
ПРИМЕР 7: Приготовление и тестирование аналогов NCL812 (также известных как соединения согласно настоящему изобретению).
Материалы и методы
NCL812
Было получено соединение NCL812 аналитической степени чистоты с определенной активностью 960 мг/г (т.е. 96%). Порошок хранили в герметичном контейнере для образцов вне воздействия прямых солнечных лучей и при комнатной температуре в исследовательском центре. Готовили аликвоты (1 мл) стокового раствора, (содержащего 25,6 мг/мл NCL812 в ДМСО), хранили при -80°C и размораживали непосредственно перед использованием.
Синтез и тестирование аналогов NCL812
Аналоги с NCL001 по NCL230, как указано на Фигуре 1, были синтезированы с использованием стандартных методов в данной области. В качестве примера, методы, используемые для изготовления соединений NCL097; NCL157; NCL179; NCL188; NCL195; и NCL196 были следующими:
NCL 097 (2,2'-бис[(3,4,5-тригидроксифенил)метилен]карбонимидик дигидразид гидрохлорид)
Суспензию 3,4,5-тригидроксибензальдегида (412,0 мг, 2,673 ммоль, 2,21 экв.) и N,N'-диаминогуанидин гидрохлорида (152,0 мг, 1,211 ммоль) в EtOH (5 мл) подвергали микроволновому облучению (150 Вт) при 100°C в течение 10 мин. Затем реакционную смесь оставляли охлаждаться до температуры окружающей среды. Полученный осадок собирали и промывали охлажденным EtOH (5 мл) и Et2O (5 мл) с получением указанного карбонимидик дигидразида (369,0 мг, 77%) в виде бледно-коричневого твердого вещества. Темп, плавл. 292°C (разл.)1H ЯМР (300 МГц, ДМСО-d6) δ 9,06 (уш.с, 6Н), 8,25 -. 8,01 (м, 4Н), 6,83 (с, 4Н).13C ЯМР (75 МГц, ДМСО-d6) δ 152,2 149,7, 146,2, 136,5, 123,7, 107,4,. МСНР (ESI+): 361,95 [М+1]+.
NCL157 (2,2'-бис[(2-амино-4-хлорфенил)метилен]карбонимидик дигидразид гидрохлорид)
Синтез 2-амино-4-хлор-N-метокси-N-метилбензамида. К раствору 2-амино-4-хлорбензойной кислоты (5,6691 г, 33,041 ммоль), N, O-диметилгидроксиламин (5,7504 г, 58,954 ммоль, 1,78 экв.), N-(3-диметиламинопропил)-N'-этилкарбодиимид гидрохлорида (7,7925 г, 40,649 ммоль, 1,23 экв.) и N-гидроксибензотриазола (5,2371 г, 38,793 ммоль (на безводной основе), 1,17 экв.) в ДМФ (100 мл) добавляли диизопропилэтиламин (18,0 мл, 13,4 г, 104 ммоль, 3,15 экв.) и коричневый раствор перемешивали при комнатной температуре в течение 7 ч. Затем реакционную смесь концентрировали в вакууме перед ее разбавлением с помощью 1 М NaOH (100 мл) и экстрагировали с CH2Cl2 (3×100 мл). Объединенные органические экстракты промывали 1 М HCl (100 мл), затем высушивали над MgSO4 и концентрировали в вакууме с получением коричневого сиропа. Полученное вещество затем дополнительно сушили при 60°C под высоким вакуумом с получением неочищенного амида Вайнреба (7,021 г, 99%) в виде коричневого сиропа, который кристаллизовался при стоянии. Полученное неочищенное вещество использовали без дальнейшей очистки.1Н-ЯМР (400 МГц, CDCl3) δ 7,24 (д, J=8,4 Гц, 1Н), 6,62 (д, J=18 Гц, 1Н), 6,54 (дд, J=8,4, 1,9 Гц, 1Н), 4,75 (с, 2Н), 3,48 (с, 3H), 3,24 (с, 3H).13C-ЯМР (101 МГц, CDCl3) δ 169,2, 148,4, 137,1, 130,6, 116,6, 116,1, 115,0, 61,1, 34,0.
Синтез 2-амино-4-хлорбензальдегида. Неочищенный 2-амино-4-хлор-N-метокси-N-метилбензамид (751,1 мг, 3,532 ммоль) разделяли на порции примерно по 120 мг, и каждую из них растворяли в ТГФ (10 мл) и охлаждали до 0°C перед добавлением к каждому из растворов LiAlH4 (2М в ТГФ, 0,5 мл) и полученные растворы перемешивали в течение 16 ч до достижения реакционной смеси комнатной температуры. Реакции гасили насыщенным NH4Cl (1 мл) перед объединением, разбавляли насыщенным раствором NaHCO3 (160 мл) и экстрагировали CHCl3 (2×150 мл, 1×75 мл). Объединенные органические слои сушили над MgSO4 и концентрировали в вакууме с получением неочищенного бензальдегида (463,3 мг, 85%) в виде желтых/оранжевых кристаллов. Вещество использовали без дальнейшей очистки.1Н (400 МГц, CD3OD) 9,77 (д, J=0,7 Гц, 1Н), 7,46 (д, J=8,3 Гц, 1Н), 6,83-6,71 (м, 1Н), 6,63 (дд, J=8,4, 1,9 Гц, 1Н).13C-ЯМР (101 МГц, CD3OD) δ 194,6 153,0, 142,5, 138,4, 118,3, 116,8, 116,1.
Синтез 2,2'-бис[(2-амино-4-хлорфенил)метилен] карбонимидик дигидразид гидрохлорида. Суспензию 2-амино-4-хлорбензальдегида (128,0 мг, 0,823 ммоль, 1,78 экв.) и N,N'-диаминогуанидин гидрохлорида (58,0 мг, 0,462 ммоль) в EtOH (2 мл) подвергали микроволновому облучению (100 Вт) при 60°C в течение 5 минут. Затем большую часть растворителя удаляли в вакууме, добавляли EtOH (1 мл) и колбу переносили в морозильную камеру для кристаллизации. Полученный осадок собирали и промывали этанолом (1 мл) с получением указанного карбонимидик дигидразида (21,0 мг, 13%) в виде бледно-желтого твердого вещества.1H ЯМР (400 МГц, ДМСО-d6) δ 11,71 (уш.с, 2Н), 8,40 (с, 2Н), 8,37 (с, 2Н), 7,29 (д, J=8,4 Гц, 2Н), 6,87 (д, J=2,0 Гц, 2Н), 6,73 (уш.с, 4Н), 6,59 (дд, J=8,3, 2,0 Гц, 2Н).13С ЯМР (101 МГц, ДМСО-d6) δ 152,1 151,5, 148,9, 136,0, 134,7, 115,1, 114,5, 112,8.
NCL179 (4,6-бис(2((E)-4-хлорбензилиден)гидразинил)пиримидин-2-амин)
Суспензию 2-амино-4,6-дигидразинилпиримидина (67,3 мг, 0,434 ммоль) и 4-хлорбензальдегида (198,8 мг, 1,414 ммоль, 3,26 экв.) в EtOH (25 мл) нагревали с обратным холодильником в течение 16 ч. По истечении этого времени конденсатор удаляли и раствор концентрировали до прибл. 1 мл и полученный осадок фильтровали в горячем состоянии и промывали Et2O (10 мл) с получением указанного аминопиримидина (42,8 мг, 25%) в виде белесого аморфного порошка. Темп, плавл. 275°C (разл.).1Н-ЯМР (400 МГц, ДМСО) δ 10,70 (с, 2Н), 8,02 (с, 2Н), 7,67 (д, J=8,4 Гц, 4Н), 7,52 (д, J=8,4 Гц, 4Н), 6,28 (с, 1Н), 5,85 (с, 2Н).13C-ЯМР (101 МГц, ДМСО) δ 162,8 162,6, 138,8, 134,1, 133.1, 128.9, 127.6, 73,5.
NCL188 ((Е)-2-(1-(4-хлорфенил)пентилиден)гидразин-1-карбоксимидамид гидрохлорид)
Суспензию 1-(4-хлорфенил)пентанона (1.8319 г, 9,3146 ммоль, 1,95 экв.) и аминогуанидин гидрохлорида (527,6 мг, 4,773 ммоль) в EtOH (15 мл) нагревали при 65°C в течение 16 ч. Неочищенный продукт охлаждали до комнатной температуры перед разбавлением Et2O (60 мл) и охлаждали до 0°C для осаждения непрореагировавшего аминогуанидина гидрохлорида (174,5 мг). Маточную жидкость концентрировали в вакууме и остаток растворяли в Et2O (20 мл). Затем раствор кипятили и добавляли гексаны (10 мл) с получением указанного карбоксимидамида в виде кремового твердого вещества.1Н-ЯМР (400 МГц, ДМСО) δ 11,54 (с, 1Н), 7,99 (д, J=8,7 Гц, 2Н), 7,90 (с, 3H), 7,47 (д, J=8,6 Гц, 2Н), 2,91-2,82 (м, 2Н), 1,48-1,32 (м, 4Н), 0,89-0,84 (м, 3H).13C-ЯМР (101 МГц, ДМСО) δ 156,2, 153,8, 134,8, 134,4, 128,7, 128,4, 28,1, 26,6, 22,0, 13,8.
NCL195 (4,6-бис(2-((Е)-4-метилбензилиден)гидразинил) пиримидин-2-амин)
Суспензию 2-амино-4,6-дигидразинопиримидина (58,9 мг, 0,380 ммоль) и 4-метилбензальдегида (0,10 мл, 100 мг, 0,832 ммоль, 2,19 экв.) в EtOH (4 мл) нагревали с обратным холодильником в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры перед сбором гранулоподобного преципитата, промывали Et2O (20 мл). Затем «гранулы» разбивали и дополнительно промывали твердое вещество Et2O (10 мл) с получением указанного пиримидина (85,8 мг, 63%) в виде белого «пушистого» порошка. Темп, плавл. 274-276°C.1Н-ЯМР (400 МГц, ДМСО) δ 10,51 (с, 2Н), 8,00 (с, 2Н), 7,54 (д, J=8,0 Гц, 4Н), 7,26 (д, J=7,9 Гц, 4Н), 6,26 (с, 1Н), 5,77 (с, 2Н), 2,34 (с, 6Н).13C-ЯМР (101 МГц, ДМСО) δ 162,8 162,6, 140,1, 138,4, 132,5, 129,4, 126,0, 73,3, 21,0.
NCL196 (4,4'-((1Е,1'Е)-((2-аминопиримидин-4,6-диил)-бис(гидразин-2-ил-1-илиден))бис(метанилилиден))дифенола)
Суспензию 2-амино-4,6-дигидразинопиримидина (70,4 мг, 0,454 ммоль) и 4-гидроксибензальдегида (140,3 мг, 1,149 ммоль, 2,53 экв.) в EtOH (3 мл) нагревали с обратным холодильником в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры перед сбором преципитата, промывали Et2O (25 мл) с получением указанного пиримидина (91,4 мг, 55%) в виде белесого порошка. Темп, плавл. 298°C (разл.).1Н-ЯМР (400 МГц, ДМСО) δ 10,31 (с, 2Н), 9,74 (с, 2Н), 7,94 (с, 2Н), 7,48 (д, J=8,6 Гц, 4Н), 6,83 (д, J=8,6 Гц, 4Н), 6,20 (с, 1Н), 5,70 (с, 2Н).13С (101 МГц, ДМСО) δ 162,7, 162,5, 158,3, 140,5, 127,7, 126,3, 115,7, 73,0.
Оценка МИК
Минимальные ингибирующие концентрации (мкг/мл) определяли с использованием метода микроразведений в среде, рекомендованного Институтом клинических и лабораторных стандартов (CLSI). Пограничные значения МИК были определены путем визуальной оценки, а затем их подтверждали с помощью планшет-ридера для ИФА, измеряя оптическую плотность при 600 нм. Рост бактерий (мутность) в лунках с противомикробными агентами сравнивали с ростом (мутностью) в лунке с контролем роста (не содержащей противомикробный агент). Все изоляты тестировали в двух повторностях, если в результатах наблюдалась разница более чем в одно двухкратное разведение, тест повторяли в третий раз. Степень чистоты изолятов тщательно контролировать в процессе тестирования, пересевая подготовленный бактериальный инокулюм на чашки с SBA (агар с овечьей кровью). МИК для контрольных штаммов для ампициллина определяли при каждом измерении в качестве внутреннего контроля качества. Значения МИК50, МИК90 и диапазон МИК (минимальное и максимальное) рассчитывали для каждой из групп бактерий.
Активность NCL812 и МИК в отношении грамотрицательных бактерий
Активность NCL812 против грам-отрицательных бактерий оценивали с помощью метода микроразведений в среде, рекомендованным Институтом клинических и лабораторных стандартов (CLSI), и определяли МИК (мкг/мл) для NCL812 и ампициллина.
Определение минимального бактерицидная концентрация (МБК)
Методология CLSI
Вкратце, 10 мкл содержимого каждой лунки, начиная с МИК, засевали на чашки с агаром с овечьей кровью (SBA) Columbia и инкубировали при 37°C в течение 48 ч. Чашки оценивали через 24 и 48 ч, и МБК определяли как наименьшую концентрацию NCL812, при которой на чашке не наблюдалось роста бактериальных колоний (или наблюдалось значительное ингибирование роста, по сравнению с контролем) (CLSI 2005).
Оценка кинетики элиминации клеток (MRSA и VRE)
MRSA/VRE выращивали в течение ночи на агаре Columbia SBA при 37°C Несколько колоний бактерий суспендировали в САМНВ и доводили до оптической плотности от 0,08 до 0,10. Суспензию бактерий разводили 1:10. Один миллилитр бактерий добавляли к 9 мл среде САМНВ, содержащей различные концентрации (до

Исследование взаимодействия с другими классами противомикробных агентов.
Метод «шахматной доски» (Gunics et al., 2000 Int. J. Antimicrob. Agents. 14: 239-42) был использован для поиска взаимодействий (синергизм, антагонизм, отсутствие эффекта) соединения NCL812 в комбинации с тетрациклином, хлорамфениколом, эритромицином (макролид), ампициллином (β-лактам широкого спектра), гентамицином (аминогликозид), ципрофлоксацином (фторхинолон), сульфаметоксазолом (сульфонамид) или пенициллином G (β-лактам узкого спектра). Для первоначальных экспериментов был использован лабораторный штамм Staphylococcus aureus Т3-129, однако этот штамм продемонстрировал противоречивые результаты для некоторых противомикробных препаратов, и в последующих тестах использовали новый штамм Staphylococcus spp., обозначенный как MK1 (в настоящий момент проводится окончательная видовая идентификация), который был чувствителен ко всем тестируемым противомикробным препаратам.
Сначала были определены значения МИК для каждого антибиотика в отдельности в соответствии со стандартными принципами CLSI. Затем соединение NCL812 было протестировано в комбинации с каждым из указанных антибиотиков в двух повторностях. Для оценки эффекта комбинации была рассчитана фракционная ингибирующая концентрация (ФИК) для каждого антибиотика следующим образом:
ФИК для тестируемого антибиотика = МИК для тестируемого антибиотика в комбинации/МИК для антибиотика в отдельности;
ФИК для NCL812 = МИК для NCL812 в комбинации/МИК для NCL812 в отдельности;
ФИКи = индекс ФИК = ФИК для NCL812 + ФИК для каждого тестируемого антибиотика.
В соответствии с методологией «шахматной доски» синергизм (S) определяли при ФИКи < 0,5, отсутствие эффекта (NE) определяли при 0,5 < ФИКи < 4, антагонизм (А) определяли как 4 < ФИКи.
Тестирование аналогов NCL812
Аналоги NCL812 хранили при 4°C до начала тестирования. Значения МИК определяли в отношении двух штаммов MRSA, двух штаммов VRE, одного штамма Е. coli и одного штамма Pseudomonas aeruginosa.
Результаты
Определение минимальной ингибирующей концентрации (МИК)
Были определены сравнительные значения МИК для NCL812 и ампициллина (мкг/мл) для 21 изолята MRSA. Результаты исходных экспериментов (фаза I) и повторного тестирования (фаза II) приведены в Таблице 34. Каждый тест по определению МИК проводили в двух повторностях.

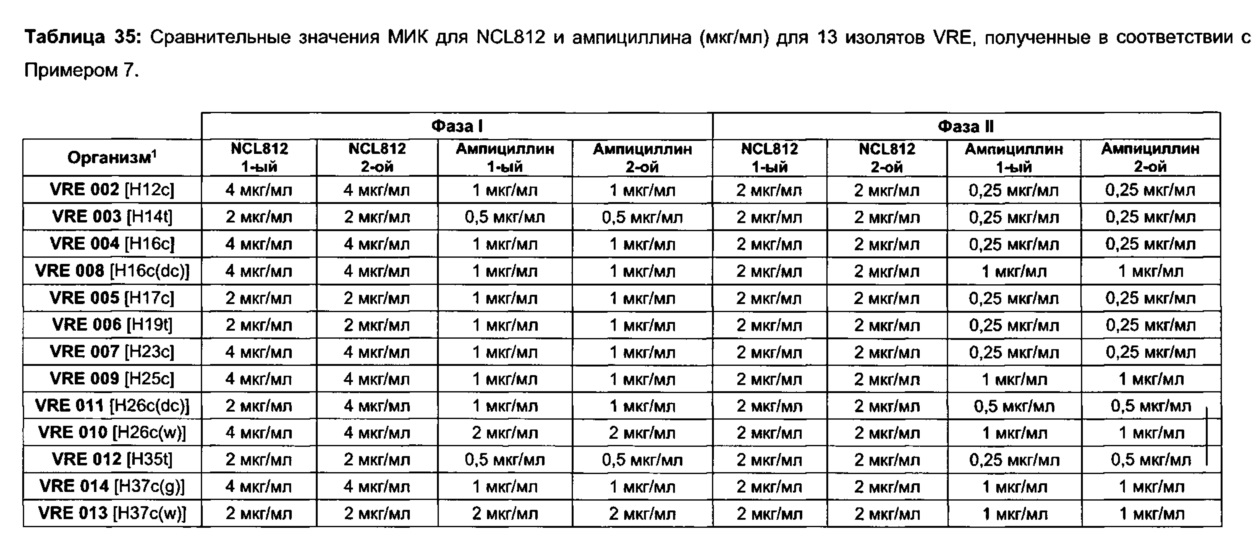
Были определены сравнительные значения МИК для NCL812 и ампициллина (мкг/мл) для 13 изолятов VRE. Результаты исходных экспериментов (фаза I) и повторного тестирования (фаза II) приведены в Таблице 35. Каждый тест по оценке МИК проводили в двух повторностях.
Значения МИК50, МИК90, моду МИК и диапазон МИК для NCL812 были определены для австралийских изолятов MRSA и VRE, как показано в Таблице 6. Сравнительные значения МИК для ампициллина указаны в скобках.
Активность NCL812 и МИК в отношении грамотрицательных бактерий
Были определены сравнительные значения для NCL812 и ампициллина (мкг/мл) для Escherichia coli, Pseudomonas aeruginosa и Salmonella arizonae, как показано в Таблице 36. Каждый тест по оценке МИК проводили в двух повторностях.

Противомикробная активность NCL812 в отношении выбранных грамотрицательных бактерий составила >128 мкг/мл.
Определение минимальной бактерицидной концентрации (МБК)
Результаты оцени МБК для изолятов MRSA показаны в Таблице 37, в которой указаны значения МБК для NCL812 (мкг/мл) для 20 изолятов MRSA. Каждый тест по оценке МБК проводили в двух повторностях, начиная с концентрации, соответствующей МИК, до 16-кратной МИК. Для всех изолятов МБК была равной МИК. Однако, для некоторых концентраций наблюдали рост на чашках с агаром, не согласующийся с другими результатами.


Результаты для 10 изолятов VRE показаны в Таблице 38. Каждый тест по оценке МБК проводили в двух повторностях, начиная с концентрации МИК для NCL812 до 32-кратной МИК. Как и в случае протестированных изолятов MRSA, значения МБК оказались равными значениям МИК. Однако, для изолятов VRE наблюдался аномальный рост при более высоких концентрациях NCL812. Наблюдалось значимое подавление роста при концентрациях, близких к значениям МИК, но по мере увеличения концентрации NCL812 рост бактерии оказывался в меньшей степени ингибирован. Большое число бактерий наблюдалось на чашках при концентрациях NCL812 ≥16 мкг/мл.


Показано, что соединив NCL812 оказывает бактерицидное действие в отношении грамотрицательных бактерий при концентрациях, эквивалентных МИК.
Анализ кинетики элиминации (MRSA и VRE)
В предварительных экспериментах подсчет колоний проводили в моменты времени 15, 30, 45 и 60 мин. Никаких существенных изменений в концентрации бактерий не наблюдалось на этих сроках, на основании чего можно предположить, что NCL812 не является быстродействующим бактерицидным агентов (для сравнения, липогликопептид Оритаванцин, как было показано (McKay et al. (2009) J. Antimicrob. Chemother. 63 (6): 1191-1199), вызывает 3log10 снижение числа жизнеспособных микроорганизмов в течение часа воздействия при концентрации, эквивалентной Cmax). Таким образом, для будущих экспериментов сроки для оценки жизнеспособных клеток были увеличены до одночасового, а затем двухчасовых интервалов.
В исходных экспериментах для MRSA на сроке 4 часов наблюдалось снижение, составляющее по меньшей мере 2,51log10 КОЕ/мл, по сравнению с ростом в контроле. На сроке 8 ч наблюдалось различие между ростом бактерий в контроле и ростом бактерий, обработанных NCL812, составляющее по меньшей мере 3,5log10 КОЕ/мл. Через 24 ч число бактерий, присутствующих при всех концентрациях NCL812, существенно не отличалось от контроля. Наблюдалось последовательное снижения числа бактерий при концентрациях 4-16 NCL812 мкг/мл до 8 ч, но такого не наблюдалось при концентрациях, превышающих 16 мкг/мл. Для сравнения, большинство бактерицидных противомикробных агентов, которые применяются или разрабатываются для лечения MRSA и VRE (оритаванцин, даптомицин, ванкомицин) являются быстродействующими бактерицидным агентами, которые достигают аналогичного log снижения в пределах 1 ч обработки в зависимости от концентрации (McKay et al., 2009). В исследовании кинетики элиминации клеток бактериостатические противомикробные препараты, рекомендованные для лечения инфекций MRSA и VRE (тейкопланин и линезолид) лишь незначительно снижают количество жизнеспособных микроорганизмов и рост).
В случае VRE наблюдаемое снижение числа КОЕ/мл бактерий, обработанных NCL812, было меньше, чем в случае MRSA. На сроке 4 ч наблюдалось приблизительно 2log10 снижение жизнеспособных микроорганизмов, по сравнению с контролем, а на сроке 8 ч было примерно 2,5log10 снижение. Однако, через 24 ч рост бактерий больше не был в такой значительной степени снижен, по сравнению с контролем. Число бактерий увеличивалось после 8 часов инкубации, и такой эффект оказался более выраженным с увеличением концентрации NCL812.
Были получены данные по кинетике элиминации для MRSA 580 при различных концентрациях NCL812 в течение периода 8 ч, как показано на Фигуре 34. Кинетика элиминации MRSA 580 при различных концентрациях NCL812 в течение периода 24 ч показана на Фигуре 35. Через 4 ч инкубации среду заменяли на свежую, содержащую такую же концентрацию NCL812.
Данные по кинетике элиминации MRSA 698 при различных концентрациях NCL812 в течение периода 24 ч показаны на Фигуре 36 Через 4 ч инкубации среду заменяли на свежую, содержащую такую же концентрацию NCL812.
Данные по кинетике элиминации VRE 26c(dc) при различных концентрациях NCL812 в течение периода 24 ч показаны на Фигуре 37.
Данные по кинетике элиминации VRE 16c(dc) при различных концентрациях NCL812 в течение периода 24 ч показаны на Фигуре 38.
Проверка бактериальной устойчивости к NCL812
Были проведены предварительные испытания для определения того, может ли устойчивость бактерий объяснить наблюдаемый бактериальный рост при более высоких концентрациях NCL812 и увеличение числа бактерий в экспериментах по оценке кинетики элиминации при инкубации 24 ч. Бактерии (MRSA), растущие при высоких концентрациях NCL812 в 96-луночных микротитрационных планшетах, пересевали на SBA и инкубировали в течение 24 ч, а затем проводили оценку МИК. У таких бактерий не было обнаружено изменений МИК. Бактерии, растущие в среде, используемые для экспериментов по оценке кинетики элиминации, также оценивали на возможное изменение значений МИК. Никаких изменений обнаружено не было.
Кроме того, бактерии, которые росли при высоких концентрациях NCL812, затем пересевали на чашки с агаром для подсчета колоний, содержащий NCL812 (64 мкг/мл и 128 мкг/мл) и инкубировали в течение 24 ч при 37°C. Бактерии, растущие на чашках, затем использовали для оценки МИК. В этом случае для бактерий также не наблюдали изменений МИК.
В целом, NCL812 обладает бактерицидной активностью против MRSA, которая в меньшей степени выражен в отношении штаммов VRE. Бактерицидный эффект не является быстрым, по сравнению с бактерицидными противомикробными агентами, разработанными для инфекций MRSA и VRE (даптомицин, оратованцин, ванкомицин). Аберрантные результаты по бактерицидной активности при более высоких концентрациях NCL812 не свидетельствуют о развитии устойчивости, но могут указывать на потерю активности. В связи с этим, для понимания таких интересных, но в настоящее время не объяснимых результатов, необходимо исследование стабильности в питательной среде. Также в это исследование необходимо включить подробное изучение литературы для определения того, наблюдалось ли такое явление для других классов противомикробных агентов. В этом случае потребуется более тщательное исследование кинетики элиминации между 8 и 24 ч. Кривые элиминации для NCL812 в отношении MRSA и VRE указывают на более высокую бактерицидную активность, в сравнении с бактериостатическими противомикробными препаратами (линезолида, тейкопланин). Также необходима оценка кривых элиминации для Streptococcus pneumonia, после того как будет исследован вопрос о стабильности NCL812, как, например, в случае с линезолидом, поскольку некоторые антибактериальные агенты могут оказывать бактериостатическое действие против одних бактерий и бактерицидное действие против других.
Исследования совместного действия с другими классами противомикробных агентов
Значения МИК, ФИК, ФИКИ и взаимодействие между NCL812 и восемью антибиотиками приведены в Таблице 39. Ни одно из восьми тестируемых соединений, представляющих различные классы противомикробных агентов, не показало ни положительного (синергизм), ни отрицательного (антагонизм) взаимодействия с NCL812, что согласуется с аддитивным эффектом при добавлении антибактериальных агентов к NCL812.

Тестирование аналогов NCL812
Химическая структура аналогов с NCL001 по NCL230 показана на Фигуре 1.
Значения МИК для NCL812 и аналогов NCL001-070 приведены в Таблице 40.
Значения МИК для аналогов с NCL071 по 171 приведены в Таблице 41.
Значения МИК для аналогов с NCL171 по 230 приведены в Таблице 42.












Аналоги NCL, демонстрирующие наибольший уровень антибактериальной активности в отношении грамотрицательных бактерий, включали NCL030 (в особенности Pseudomonas), NCL041, NCL043, NCL044 (в особенности Pseudomonas), NCL052 (в особенности Pseudomonas) и NCL053 (в особенности Pseudomonas), NCL097 (в особенности Pseudomonas), NCL196 и NCL188 (в особенности Е. coli).
Аналоги NCL, демонстрирующие наибольший уровень активности в отношении MRSA, включали: NCL021; NCL023; NCL029; NCL030; NCL035; NCL038; NCL039; NCL040; NCL041; NCL043; NCL044; NCL052; NCL054; NCL062; NCL069; NCL072; NCL073; NCL074; NCL078; NCL079; NCL080; NCL081; NCL082; NCL084; NCL088; NCL089; NCL093; NCL094; NCL097; NCL099; NCL101; NCL104; NCL107; NCL108; NCL111; NCL113; NCL117; NCL120; NCL121; NCL123; NCL136; NCL138; NCL140; NCL143; NCL146; NCL150; NCL151; NCL153; NCL155; NCL157; NCL158; NCL159; NCL160; NCL161; NCL166; NCL168; NCL169; NCL171; NCL172; NCL173; NCL174; NCL177; NCL178; NCL179; NCL180; NCL181; NCL182; NCL183; NCL184; NCL185; NCL186; NCL187; NCL188; NCL189; NCL190; NCL191; NCL192; NCL193; NCL195; NCL196; NCL197; NCL199; NCL201; NCL202; NCL203; NCL204; NCL205; NCL207; NCL215; NCL216; NCL217; NCL219; NCL220 и NCL221.
Аналоги NCL, демонстрирующие наибольший уровень активности в отношении VRE, включали: NCL011; NCL021; NCL023; NCL029; NCL030; NCL035; NCL038; NCL039; NCL040; NCL041; NCL043; NCL044; NCL052; NCL054; NCL061; NCL062; NCL069; NCL070; NCL072; NCL073; NCL074; NCL078; NCL079; NCL080; NCL081; NCL082; NCL084; NCL088; NCL093; NCL094; NCL097; NCL099; NCL101; NCL105; NCL107; NCL108; NCL111; NCL112; NCL113; NCL117; NCL120; NCL121; NCL123; NCL126; NCL131; NCL136; NCL140; NCL141; NCL143; NCL146; NCL151; NCL153; NCL155; NCL157; NCL158; NCL159; NCL160; NCL161; NCL166; NCL168; NCL169; NCL171; NCL173; NCL174; NCL175; NCL177; NCL178; NCL179; NCL180; NCL181; NCL182; NCL183; NCL184; NCL185; NCL186; NCL187; NCL188; NCL189; NCL190; NCL191; NCL192; NCL193; NCL195; NCL196; NCL197; NCL202; NCL203; NCL204; NCL205; NCL210; NCL212; NCL215; NCL216; NCL217; NCL218; NCL219; NCL220; and NCL221.
Ранговая оценка биологической активности протестированных аналогов указан в Таблице 43.


ПРИМЕР 8: Влияние NCL812 на чувствительные к антимикробным агентам изоляты Staphylococcus aureus и Enterococcus faecalis
Материалы и методы
Сведения о штаммах
В следующих экспериментах были использованы два изолята Staphylococcus aureus: S. aureus MK01, штамм обитающий на коже человека, и S. aureus KC01, штамм, обитающий на коже лошадей. Эти изоляты были идентифицированы методом окрашивания по Граму и биохимическими методами, в том числе с помощью коммерческого набора Remel Staphaurex. Один изолят Enterococcus faecalis (USA01) был идентифицирован как штамм не являющийся VRE (т.е. не ванкомицин-устойчивый энтерококк). Поскольку вид этого изолята был определен ранее, его не подвергали дальнейшим исследованиям, помимо наблюдений за равномерным характерным ростом на кровяном агаре.
Исследование Минимальной бактерицидной концентрации (МБК)
Методология CLSI
Как и в предыдущих экспериментах, 10 мкл содержимого каждой лунки, начиная с МИК, засевали на чашки с агаром с овечьей кровью (SBA) Columbia и инкубировали при 37°C в течение 48 ч. Чашки оценивали через 24 и 48 ч, и МБК определяли как наименьшую концентрацию NCL812, при которой на чашке не наблюдалось роста бактериальных колоний (или наблюдалось значительное ингибирование роста, по сравнению с контролем) (CLSI 2005).
Метод оценки кинетики элиминации клеток (kill kinetics assays) S. aureus KC01 и E. faecalis USA01
S. aureus KC01 и E. faecalis USA01, которые были идентифицированы как не MRSA и не VRE, соответственно, выращивали в течение ночи на агаре Columbia SBA при 37°C. Затем несколько бактериальных колоний суспендировали в среде САМНВ (среда Мюллера-Хинтона со стандартизированным содержанием катионов) и доводили до оптической плотности OD800 от 0,08 до 0,10. Суспензию бактерий разводили 1:10. Один миллилитр бактерий добавляли к 9 мл среде САМНВ, содержащей различные концентрации (до 4

Результаты
Минимальная ингибирующая концентрация (МИК)
Оценивали МИК соединения NCL812 в отношении изолятов S. aureus МК01 и КС01, а также Е. faecalis USA01. В результате было получено: МИК для S. aureus МК01 = 4-8 мкг/мл, МИК для S. aureus КС01 = 2 мкг/мл, МИК для Е. faecalis USA 01 = 4 мкг/мл.
При исследовании изолятов S. aureus МК01 и КС01 не наблюдали роста бактерий, или наблюдали рост только при низких концентрациях NCL812 (2 мкг/мл), что свидетельствует о том, что это NCL812 оказывает бактерицидное действие против S. aureus. Однако, для тестируемого изолята Е. faecalis (USA01) рост бактерий наблюдался при всех протестированных концентрациях NCL812. Было заметно уменьшение числа бактерий с увеличением концентрации NCL812, но рост присутствовал, в сравнении с отсутствием роста у S. aureus. Обобщенные результаты данного эксперимента приведены в Таблице 45. В Таблице 45 показаны результаты для оценки МБК для NCL812 на двух изолятах S. aureus, не являющихся MRSA, и на одном изоляте E. faecalis, не являющимся VRE. Каждый тест по оценке МБК проводили в двух повторностях. Никаких изменений в результатах не наблюдали на сроке 48 ч. В Таблице 37 указаны значения МБК (мкг/мл) для NCL812 для 20 изолятов MRSA. Каждый тест по оценке МБК проводили в двух повторностях, начиная с концентрации NCL812, соответствующей МИК, до 16-кратной МИК. В Таблице 38 указаны значения МБК (мкг/мл) для NCL812 для 10 VRE изолятов. Каждый тест по оценке МБК проводили в двух повторностях, начиная с концентрации NCL812, соответствующей МИК, до 32-кратной МИК.

Анализ кинетики элиминации (kill kinetics assays) для S. aureus KC01 и E. faecalis USA01
Подсчет колоний проводили при t=0, 120, 240 и 360 мин, и затем при 24 ч. На сроке 2 ч S. aureus KC01 показали не менее 2,5log10 снижение количества бактерий, по сравнению с исходными значениями, и более чем 3log10 снижение, по сравнению с контролем на этом же сроке. Не менее 2log10 снижение было все еще очевидно при 6-часовой инкубации, однако через 24 ч число присутствующих бактерий, возросло, и оно существенно не отличалось от контроля.
Аналогичные результаты были получены для Е. faecalis USA01, однако, наблюдаемое уменьшение числа бактерий было меньше, чем для S. aureus KC01. 2log10 снижение КОЕ/мл наблюдалось через 2 ч, по сравнению с ростом в контроле. Однако, уменьшение КОЕ/мл, по сравнению с исходным числом бактерий, было больше только 1log10. При концентрации NCL812 4-16 мкг/мл уменьшение числа бактерий оставалось неизменной до срока 6 ч. При концентрациях 32 и 64 мкг/мл на этом же сроке, однако, наблюдалось примерно 11одю увеличение числа бактерий. Через 24 ч количество бактерий при всех концентрациях увеличивалось почти до такого же уровне, как и при росте в контроле.
Результаты, полученные для этих штаммов S. aureus and Е. faecalis, согласуются с результатами, полученными в анализе кинетики элиминации для всех протестированных изолятов MRSA и VRE. Результаты анализа кинетики элиминации Staphylococcus aureus KC01 при различных концентрациях NCL812 до 24 ч периода инкубации показаны на Фигуре 39. Результаты анализа кинетики элиминации Enterococcus faecalis USA01 при различных концентрациях NCL812 до 24 ч периода инкубации показаны на Фигуре 40.
Пример 9: Препараты, содержащие соединения.
С помощью стандартных способов, используемых в данной области, были приготовлены следующие препараты.
Препарат Ф - Препарат для местного применения - Гель на основе ПЭГ, содержащий соединения настоящего изобретения
4,0 г ПЭГ 4000;
3,5 ПЭГ 200;
0,6 пропиленгликоль;
1,9 г воды; и
0,204 г соединения (например, NCL099).
Смешивали ПЭГ 4000, ПЭГ 200 и пропиленгликоль и нагревали до 150°C до растворения всех твердых кристаллов. Соединение добавляли к воде и обрабатывали ультразвуком в течение 30 минут до полного суспендирования. Раствор соединения смешивали с гель-растворами и оставляли для охлаждения и отвердевания. Препарат A показал приемлемую вязкость, легкость нанесения на кожу, однородную суспензии и последовательной и соответствующую тонкую текстуру.
Препарат B - Препарат для местного применения - Гель на основе ПЭГ, содержащий соединения настоящего изобретения
3,0 г ПЭГ 4000;
1,0 г ПЭГ 8000;
3,0 ПЭГ 200;
1,0 пропиленгликоль;
1,9 г воды; и
0,202 г соединения (например, NCL099).
Смешивали ПЭГ 4000, ПЭГ 8000, ПЭГ 200 и пропиленгликоль и нагревали до 150°C до растворения всех твердых кристаллов. Соединение (например, NCL099) добавляли к воде и обрабатывали ультразвуком в течение 30 минут до полного суспендирования. Раствор соединения смешивали с гель-растворами и оставляли для охлаждения и отвердевания. Препарат B показал приемлемую вязкость, легкость нанесения на кожу, однородную суспензии и последовательной и соответствующую тонкую текстуру.
Препарат C - Препарат для местного применения - Гель на основе ПЭГ, содержащий соединение-Soluplus
2,5 г ПЭГ 4000;
4,0 ПЭГ 200;
2,5 пропиленгликоль;
1,0 г воды; и
1,8 г твердой дисперсии соединение-SoluPlus.
SoluPlus был приобретен у BASF (www.soluplus.com). NCL812-SoluPlus готовили с помощью стандартных способов, известных в данной области. Смешивали ПЭГ 4000, ПЭГ 200, соединение-SoluPlus и пропиленгликоль и нагревали до 150°C до растворения всех твердых кристаллов. Добавляли воду, после чего раствор обрабатывали ультразвуком. Раствор оставляли для охлаждения и отвердевания. Препарат C показал приемлемую вязкость, легкость нанесения на кожу, однородную суспензии и последовательной и соответствующую тонкую текстуру.
Препарат D - Препарат в форме таблеток
30 мг двузамещенный кальция фосфат дигидрат;
80 мг микрокристаллической целлюлозы;
50 мг лактозы;
8 мг гидроксипропилметилцеллюлозы 1,5 мг талька
10 мг соединения (например, NCL099)
Вспомогательные вещества взвешивали и смешивали в течение 5 минут. Смесь помещали в загрузочную воронку таблеточного пресса, и запускали работу прибора в соответствии со стандартными процедурами в данной области техники. Препарат D показал приемлемую твердость, растворение и истираемость таблеток.
Препарат E - Суспензия для перорального применения
2,0 мл глицерина;
1,5 мл абсолютного этанола;
600 мг NCL812; и
до 60 мл носителя (
Порошок NCL812 просеивали через сито 75 мкм. 600 мг просеянного NCL812 смешивали с 2,0 мл глицерина и 1,5 мл абсолютного этанола. Смесь помещали в ступку и измельчали вручную до однородности суспензии NCL812. Суспензию обрабатывали ультразвуком в течение 30 минут. Затем к суспензии добавляли носитель (55 мл Ora Sweet и Ora Plus mixture) измельчали в течение еще 10 минут. Доводили объем до 60 мл со смесью Ora plus и Ora sweet, перенося суспензию в мерный цилиндр.
Препарат E характеризовался приемлемой суспензией и показал приемлемую краткосрочную стабильности.
Препарат F - Препарат для внутримышечной инъекции
20 мг/мл поливинилпирролидона K30 (PVPK30);
0,09 мг/мл NCL812; и
50 мл воды.
Готовили двухпроцентный (вес/масса) раствор PVP K30 путем добавления 1,0 г поливинилпирролидона K30 к 50 мл воды MilliQ. Затем раствор помещали в ультразвуковой аппарат на 30 минут для уравновешивания, добавляли 4,5 мг NCL812 к растворе PVP и оставляли в шейкере инкубатор при максимальной скорости 10 об./мин. в течение 24 часов с регулируемой температурой 25±1°C. Раствор переносили во флаконы по 5 мл и оценивали их прозрачность, внешний вид, pH и краткосрочную стабильность. Значение pH раствора составило 7,25.
Препарат F показал приемлемую прозрачность и краткосрочную стабильность.
ПРИМЕР 10: Высвобождение NCL812 и NCL099 из препарата В.
Цель данного исследования была оценка высвобождения соединения NCL812 и NCL099 из Препарата B, полученного в Примере 9.
Для количественной оценки скорости высвобождения NCL812 и NCL099 из препарата для местного применения использовали диффузионные ячейки Франца. Пять миллилитров абсолютного этанола, который был выбран в качестве среды для желаемого высвобождения, загружали в камеру-приемник. Температура жидкости приемника поддерживалась на постоянном уровне при 32°C±1 с использованием водяной рубашки. Были выбраны ацетилцеллюлозные мембраны с размером пор 0,45 мкм (Pall Corporation), и их помещали между донорной камерой и камерой-приемником. После этого, в донорную камеру загружали ряд тестовых образцов (препарат В). Один миллилитр жидкости приемника собирали через определенные промежутки времени, составляющие 0,25, 0,50, 0,75, 1, 2, 3, 4, 5, 6, 7, 8 и 24 часов, через порт для отбора проб. Один миллилитр свежего абсолютного этанола немедленно возвращали в камеру-приемник. Для анализа полученного содержимого жидкости приемника использовали УФ-ВЭЖХ.
На Фигуре 41 представлен совокупное высвобождение NCL812 и NCL099 с течением времени. Данное исследование показывает, что препарат B обеспечивает приемлемый профиль высвобождения для NCL812 и NCL099.
ПРИМЕР 11: Данные ЯМР-спектроскопии для соединений NCL812, NCL001-NCL230
ЯМР-спектрокопию проводили для соединений NCL812, NCL001-NCL230 с использованием стандартных методов в данной области. Перечень данных по ЯМР-спектрокопии представлен в Таблице 46.










ПРИМЕР 12: Способ лечения бактериальной инфекции in vivo путем введения NCL812 или NCL099.
Целью данного исследования было определении эффективности исследуемого Ветеринарного лекарственного препарата, содержащего NCL812 или NCL099., в лечении инфекции кожи у мышей.
Краткое описание модели: Применяемая модельная система на животных должна быть клинически релевантной, экспериментально надежной, приемлемой с этической точки зрения, удобной в осуществлении, и она должна давать надежные и воспроизводимые результаты. Описано много моделей на животных для изучения местных инфекций кожи, в том числе модель «кротоновое масло-воспаленная кожа» (Akiyama, Н., Н. Kanzaki, Y. Abe, J. Tada and J. Arata (1994). "Staphylococcus aureus infection on experimental croton oil-inflamed skin in mice." Journal of Dermatological Science 8(1): 1-10), модель «обожженной кожи» (Stieritz, D.D., A. Bondi, D. McDermott and E.B. Michaels (1982). "A burned mouse model to evaluate anti-pseudomonas activity of topical agents." Journal of Antimicrobial Chemotherapy 9(2): 133-140), модель «кожный шов-рана» (McRipley, R.J. and R.R. Whitney (1976). "Characterization and Quantitation of Experimental Surgical-Wound Infections Used to Evaluate Topical Antibacterial Agents." Antimicrobial Agents and Chemotherapy 10(1): 38-44), модель с использованием липкой ленты (Kugelberg, E.,

В ходе предварительных исследований перед проведением настоящего исследования был разработан новый метод инфицирования кожи в результате детального изучения моделей, упомянутых выше. Вкратце, мышей анестезировали, выстригали участок шкуры на спине до оголения кожи и иссекали круглый участок кожи с помощью ручного штампа, оставляя рану на спине с полостью в центре. Рану инфицировали с помощью микроорганизма с известным номером. Примерно через четыре-шесть часов после заражения, рану либо обрабатывали местно с помощью препарата, содержащего только носитель, либо с помощью активного препарата. Инфицированные кожные раны повторно обрабатывали каждые 12 часов, всего 14 обработок. Мышей подвергали эвтаназии гуманным способом, обрезали площадь исходной инфицированной раны, и оценивали содержание бактерий в извлеченном кожном участке с помощью стандартных микробиологических тестов. Таким образом, изменение концентрации бактерий за счет обработки активным препаратом можно легко определить путем анализа снижения бактериальной нагрузки, по сравнению с контрольным образцом, обработанным только носителем.
Материалы и методы
Приготовление инокулята для инфекции
Свежие культуры бактерий (Staphylococcus aureus) выращивали на агаре с овечьей кровью при 37°C в течение 16-18 часов. Несколько типичных колоний отбирали и суспендировали в 10 мл трипсинового соевого бульона и инкубировали в течение ночи в шейкере-инкубаторе (240 об./мин.) при 37°C. Ночную суспензию перемешивали и разводили (1:100) в свежем триптическом соевом бульоне (100 мкл [0,1 мл] в 9.9 ml бульона). Свежую суспензию инкубировали в течение 3 часов в шейкере-инкубаторе (как описано выше) для получения бактерий в середине логарифмической фазы роста. Бактерий осаждали центрифугированием при 7500 об./мин. в течение 10 мин. Супернатант удаляли и бактерий суспендировали в 10 мл фосфатно-солевого буфера (PBS). Эти стадии повторяли еще два раза. Плотность суспензии проверяли путем измерения оптической плотности при 600 нм с помощью спектрофотометра, с физиологическим раствором в качестве контрольного образца, для подтверждения необходимой плотности примерно 0,100, что соответствовало плотности бактерий 2,5×107 КОЕ/мл. Суспензию помещали в штатив, помещенный в сейф для транспортировки с кусочками льда для охлаждения во время транспортировки, а затем хранили в прохладном помещении после доставки в лабораторию, где осуществляли инфицирование кожи мышей. Конечную суспензию тщательно перемешивали перед инфицировали кожной раны у мышей.
В целях обеспечения чистоты и точности суспензии, проводили следующие операции перед помещением суспензии в сейф.
Чистоту бактериальной суспензии проверяли, высевая 100 мкл конечной суспензии на чашку с SBA (агар с овечьей кровью), которую инкубируют при 37°C в течение 18 часов и впоследствии осматривали для проверки равномерного роста колоний одного типа. Оценку количества жизнеспособных микроорганизмов проводили для конечной суспензии, добавляя физиологический раствор в пробирки-эппендорфы (примерно 900 мкл на пробирку), отбирая по 100 мкл образца, и добавляя к первой пробирке, встряхивали смесь, и повторяли с использованием второго эппендорфа, содержащего солевой раствор. Этот процесс продолжали для 5-6 пробирок. Наконец, 100 мкл 5-го и 6-го разведения высевали на агар для подсчета колоний, инкубировали при 37°C в течение 18 часов, и оценивали число колоний для подтверждения значения КОЕ/мл, равного примерно 2,5×107. После инокуляции раны этот этап повторяли для проверки того, что в ходе операции не произошла контаминации или снижение числа жизнеспособных бактерий.
Хирургическая процедура нанесения раны на кожу
Каждую мышь помещали в индукционную камеру и анестезировали с помощью 2% изофлурана. Глаза каждой анестезированной мыши покрывали ветеринарной смазкой для глаз для предотвращения обезвоживания роговицы. Каждую мышь удаляли из индукционной камеры и помещали в операционное поле напротив индивидуального носового конуса для анестезии. В ходе анестезии у каждой мыши контролировали оценку глубины анестезии (ответ на боль, мигательный рефлекса, тонус скелетных мышц), а также дыхательную и сердечную функции. Волосы на спине выбривали в хирургической области с помощью механической машинки для стрижки. Выбритый участок очищали с помощью бумажного полотенца, смоченного 70% этанолом, а затем 10% раствором вес/объем повидон-йод. После высыхания раствора йода, вводили подкожную инъекцию нестероидного противовоспалительного агента мелоксикама. Аккуратно прищипывали кожу спины для возможности нанесения округлой раны во всю толщину кожи с помощью ушного штампа / дерматома для биопсии. Раны у контрольных мышей (только носитель) и мышей из группы NCL812 и группы NCL099, инокулировали с помощью 10 мкл бактериальной суспензии с помощью микропипетки (2,5×105 КОЕ/10 мкл). После высыхания бактериальной суспензии мышей помещали в индивидуальные боксы для восстановления, маркированные номерами, соответствующими каждой мыши. Записывали время прививки. Для каждой мыши измеряли массу тела и записывали значение в соответствующем протоколе. Мыши возвращались в полное сознание в течение 5 минут. После восстановления мышей возвращали в отдельные боксы для почасового наблюдения за осложнениями после хирургии или анестезии
Послеоперационный уход (4 часа после операции)
Мышей оценивали на послеоперационные осложнения, и наблюдения записывали на клиническом учетном бланке. Каждую мышь тщательно извлекали из ИВК (индивидуальной вентилируемой камеры) и помещали в контейнер для оценки, стараясь не прикасаться к хирургической области. После помещения внутрь контейнера каждую мышь обследовали, и наблюдения записывали на пост-хирургическом клиническом учетном бланке. Всякий раз, когда показания соответствовали угрозе здоровья, вводили послеоперационное обезболивание и записывали на клиническом учетном бланке.
Наблюдение и ежедневный уход за животными
Введение антибиотика (7 часов утра и 6 часов вечера). Первое нанесение мази с носителем или мази с NCL812 или NCL099 осуществляли через 4 часа после операции. Каждый контейнер с мазью взвешивали перед введением, и записывали значения. Каждую мышь осторожно придерживали. Мазь (носитель или NCL812, или NCL099) наносили на область поражения и обработанную мышь возвращали в ИВК, отслеживая, чтобы мазь не была сразу же удалена при груминге. Измеряли вес контейнера с мазью после применения, и записывали. Препарат с носителем и активный препарат с NCL812 наносили на кожные раны каждые 12 часов после первого введения, в общей сложности в ходе 14 последовательных процедур. Продукты как с NCL812, так и с NCL099 (Препарат B, как описано в Примере 9) содержали соответствующий активный ингредиент в концентрации 20 мг/г. Каждый раз наносили примерно 0,1-0,2 г мази, обеспечивая полную актуальную дозу NCL812 или NCL099 от 28 до 56 мг для мышей весом от 18 г до 25 г.
Ежедневное наблюдение. Наблюдение каждой мыши проводили один раз в день около 12 часов дня. Каждую мышь аккуратно извлекали из ИВК и помещали в контейнер для обследования, стараясь не прикасаться к хирургической области. Тщательно оценивали параметры шерстного покрова, позы, глаза, поведение, вокализацию и активность во время пребывания в контейнере, и наблюдения записывали на учетном бланке. Оценивали консистенцию фекалий мышей (на полу клетки или в контейнере), наблюдения заносили в протокол. Массу тела каждой мыши определяли во время ее пребывания в контейнере, рассчитывали изменение массы тела и показания заносили в протокол. Контейнер для обследования дезинфицировали этанолом и оставляли высушиваться, и для следующей мыши использовали свежий контейнер. Каждый второй день мышей повторно анестезировали с помощью 2% изофуран и фотографировали с использованием линейки для масштаба. На этих фотографиях оценивали размер пораженных участков и прогрессирование инфекции в ходе испытания.
Анализ тканей и оценка антибактериальной эффективности B конце 7 дня оценки кожных ран всех тестовых мышей подвергали эвтаназии перед сбором образцов ран для патологоанатомического обследования. На спинке у каждой мыши иссекали кожную рану. Образец помещали в пробирку и взвешивали перед добавлением 1 мл PBS и стерильных бусин для гомогенизации ткани. Образцы ткани гомогенизировали в течение 10 минут с помощью гомогенизатора тканей (Next Advance Bullet Blender) и затем встряхивали на вортексе в течение примерно 30 секунд. Отбирали 100 мкл супернатанта и помещали в пробирку-эппендорф, содержащую 900 мкл PBS. Эту процедуру повторяли с использованием серийных разведений, всего для 8 разведений. Наконец, по 100 мкл каждого разведения с помощью пипетки наносили на агар для подсчета колоний в двух повторностях и инкубировали в течение ночи при 37°C. Десять микролитров исходной суспензии помещали на овечий кровяной агар для оценки чистоты культуры и инкубировали в течение ночи при 37°C. На следующий день оценивали количество жизнеспособных микроорганизмов с использованием чашек с агаром для подсчета колоний, и подтверждали идентичность собранного штамма Staphylococcus aureus (микроорганизм, используемый для инфицирования).
Результаты
Среднее количество колоний на грамм ткани в группе, обработанной только носителем, составило 5888436 (6,77 log10). Среднее количество колоний на грамм ткани в группе, обработанной NCL812, составило 141254 (5,15 log10). Среднее количество колоний на грамм ткани у мышей, обработанных NCL099, составило 1,318 (3.12log10). Значения log10 колониеобразующих единиц на грамм ткани и % снижения суммированы в следующей таблице.
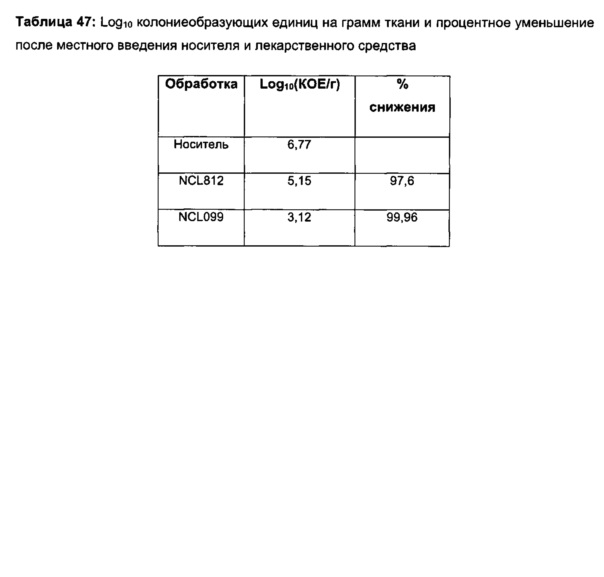
Из данной таблицы следует, что обработка либо NCL812, либо NCL099 приводит к снижению числа инфицирующего патогена Staphylococcus aureus. Эти результаты свидетельствуют об эффективном лечении бактериальной колонизации или инфекции in vivo за счет введения соединений настоящего изобретения.
Реферат
Изобретение относится к конкретным соединениям, перечисленным в п.1 формулы изобретения, которые могут найти применение при лечении или профилактике бактериальной колонизации или инфекции у субъекта. Изобретение относится также к антибактериальной фармацевтической композиции, содержащей указанные соединения, и их применению при производстве лекарственного средства для лечения или профилактики бактериальной колонизации или инфекции у субъекта, причем указанная бактериальная инфекция вызвана бактериальным агентом. 3 н. и 16 з.п. ф-лы, 41 ил., 47 табл., 12 пр.
Формула




Комментарии