Замещенные бензамиды для борьбы с членистоногими - RU2713949C2
Код документа: RU2713949C2
Описание
Область изобретения и уровень техники
Настоящее изобретение относится к новым трифтор-замещенным соединениям, способам их получения и их применению для борьбы с животными вредителями, прежде всего с членистоногими и наиболее предпочтительно с насекомыми, паукообразными и нематодами.
Известно, что определенные галоген-замещенные соединения обладают инсектицидной активностью (ЕР 1911751, WO 2012/069366, WO 2012/080376, WO 2012/107434 и WO 2012/175474).
В WO 2011/113756 раскрываются триазольные производные, которые проявляют инсектицидное действие.
Кроме того, известно, что определенные галоген-замещенные соединения проявляют цитокин-ингибирующее действие (WO 2000/07980).
Современные средства для защиты растений должны удовлетворять многим требованиям, например, с точки зрения их эффективности, продолжительности и широты действия и возможного применения. Играют роль вопросы токсичности, комбинируемости с другими активными соединениями или вспомогательными средствами для композиций, а также вопрос затрат, необходимых для синтеза активных веществ. Кроме того, может встречаться резистентность. По всем этим причинам поиск новых средств для защиты растений не может считаться законченным, и все еще существует потребность в новых соединениях, которые в отличие от известных соединений, обладают улучшенными свойствами в отношении отдельных аспектов.
Задача настоящего изобретения состоит в обеспечении соединений, которые расширяют спектр действия пестицидов в различных аспектах и/или улучшают их активность.
Неожиданно было обнаружено, что определенные галоген-замещенные соединения, а также их соли проявляют биологические свойства и являются особенно подходящими для борьбы с животными вредителями, и поэтому являются особенно хорошо подходящими для применения в сельском хозяйстве и в ветеринарии.
Подобные соединения уже стали известны из WO 2010/051926.
Описание изобретения
Обнаружены новые эффективные в качестве инсектицидов, акарицидов и/или паразитицидов галоген-замещенные соединения общей формулы (I):

в которой
R1 представляет собой Н, в каждом случае необязательно замещенный C2-C6-алкенил, C2-C6-алкинил, C3-C7-циклоалкил, C1-C6-алкилкарбонил, C1-C6-алкоксикарбонил, арил(C1-C3)-алкил, гетероарил(C1-C3)-алкил или представляет собой необязательно замещенный C1-C6-алкил, предпочтительно представляет собой Н или предпочтительно представляет собой C1-C2-алкил, особенно предпочтительно представляет собой Н или метил, наиболее предпочтительно представляет собой Н,
группы
A1 представляет собой CR2 или N,
A2 представляет собой CR3 или N,
A3 представляет собой CR4 или N,
A4 представляет собой CR5 или N,
B1 представляет собой CR6 или N,
B2 представляет собой CR7 или N,
B3 представляет собой CR8 или N,
B4 представляет собой CR9 или N, и
B5 представляет собой CR10 или N,
причем не более трех из групп A1-A4 представляют собой N, и не более трех из групп B1-B5 представляют собой N;
R2, R3, R4, R5, R6, R7, R9 и R10 независимо друг от друга представляют собой Н, галоген, циано, нитро, в каждом случае необязательно замещенный C1-C6-алкил, C3-C6-циклоалкил, C1-C6-алкокси, N-C1-C6-алкокси-имино-C1-C3-алкил, C1-C6-алкилсульфанил, C1-C6-алкилсульфинил, C1-C6-алкилсульфонил, N-C1-C6-алкиламино, N,N-ди-C1-C6-алкиламино или N-C1-C3-алкокси-C1-C4-алкиламино или 1-пирролидинил;
когда ни одна из групп A2 и A3 не представляет собой N, R3 и R4 могут образовывать вместе с атомом углерода, с которым они связаны 5- или 6-членное кольцо, содержащее 0, 1 или 2 атома N и/или 0 или 1 атом О и/или 0 или 1 атом S; или
когда ни одна из групп A1 и A2 не представляет собой N, R2 и R3 могут образовывать вместе с атомом углерода, с которым они связаны 6-членное кольцо, содержащее 0, 1 или 2 атома N;
R8 представляет собой галоген, циано, нитро, в каждом случае необязательно замещенный C1-C6-алкил, C3-C6-циклоалкил, C1-C6-алкокси, N-C1-C6-алкокси-имино-C1-C3-алкил, C1-C6-алкилсульфанил, C1-C6-алкилсульфинил, C1-C6-алкилсульфонил, N-C1-C6-алкиламино или N,N-Ди-C1-C6-алкиламино;
W представляет собой О или S;
Q представляет собой Н, формил, гидрокси, амино или в каждом случае необязательно замещенный C1-C6-алкил, C2-C6-алкенил, C2-C6-алкинил, C3-C6-циклоалкил, c1-C5-гетероциклоалкил, C1-C4-алкокси, C1-C6-алкил-C3-C6-циклоалкил, C3-C6-циклоалкил-C1-C6-алкил, C6-,C10-,C14-арил, C1-C5-гетероарил, C6-,C10-,C14-арил-(C1-C3)-алкил, C1-C5-гетероарил-(C1-C3)-алкил, N-C1-C4-алкиламино, N-C1-C4-алкилкарбониламино, или N,N-ди-C1-C4-алкиламино; или
представляет собой необязательно многократно замещенный заместителями V ненасыщенный 6-членный карбоцикл; или
представляет собой необязательно многократно замещенное заместителями V ненасыщенное 4-, 5- или 6-членное гетероциклическое кольцо, причем
V независимо друг от друга представляет собой галоген, циано, нитро, в каждом случае необязательно замещенный C1-C6-алкил, C1-C4-алкенил, C1-C4-алкинил, C3-C6-циклоалкил, C1-C6-алкокси, N-C1-C6-алкокси-имино-C1-C3-алкил, C1-C6-алкилсульфанил, C1-C6-алкилсульфинил, C1-C6-алкилсульфонил, или N,N-ди-(C1-C6-алкил)амино;
Т представляет собой необязательно замещенное 5-членное гетероароматическое соединение, содержащее, самое большее, 2 гетероатома (1 или 2 гетероатома), как например четыре атома С и один (1) гетероатом, предпочтительно один (1) N-, один (1) О- или один (1) S-атом или три атома С и два гетероатома, предпочтительно два атома N, один (1) N- и один (1) О-, или один (1) N- и один (1) S-атом,
а также соли, N-оксиды и таутомерные формы соединений формулы (I).
Одним объектом настоящего изобретения являются соединения формулы (Ia)

в которой
группы D1, D2 в каждом случае независимо друг от друга представляют собой С-R11 или гетероатом, выбранный из N и О;
группы D3 и D4 независимо друг от друга представляют собой С или представляют собой гетероатом, выбранный из N (другими словами, группы D3 и D4 независимо друг от друга представляют собой С или N);
причем, самое большее, одна (1) или две группы, выбранные из D1, D2, D3 и D4, представляет собой/представляют собой гетероатом, причем одна (1) или две группы, выбранные из D1, D2, D3 и D4, представляют собой гетероатом, выбранный из N или О, в случае D1 и D2, или N, в случае D3 и D4;

R1, A1, A2, A3, A4, B1, B2, B3, B4, B5, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, W, Q, V, и Т имеют значения, как определено в настоящей заявке, причем, самое большее, одна группа, выбранная из A1, A2, A3, A4, представляет собой N, и, самое большее, одна группа, выбранная из B1, B2, B3, B4, и B5, представляет собой N; или причем одна или две группы, выбранные из A1, A2, A3, A4, могут представлять собой N, и, самое большее, одна группа, выбранная из B1, B2, B3, B4, и В5, представляет собой N,
а также соли, N-оксиды и таутомерные формы соединений формулы (I).
Одним объектом настоящего изобретения являются соединения формулы (Ia')

в которой
R1, R11, Q, W, A1, A2, A3, A4, В1, B2, B4, и В5 имеют значения, как определено в настоящей заявке, причем, самое большее, одна группа, выбранная из A1, A2, A3, A4, представляет собой N, и, самое большее, одна группа, выбранная из B1, B2, B3, B4, и B5, представляет собой N; или причем одна или две группы, выбранные из A1, A2, A3, A4, могут представлять собой N, и, самое большее, одна группа, выбранная из B1, B2, B3, B4, и B5, представляет собой N;
D1 и D2 в каждом случае независимо друг от друга представляют собой C-R11 или гетероатом, предпочтительно представляют собой C-R11 или гетероатом, выбранный из N, О или S, особенно предпочтительно представляют собой C-R11 или гетероатом, выбранный из N или О;
группы D3 и D4 независимо друг от друга представляют собой С или гетероатом, выбранный из N;
причем, самое большее, одна (1) или две группы, выбранные из D1, D2, D3 и D4, представляет собой/представляют собой гетероатом, причем одна (1) или две группы, выбранные из D1, D2, D3 и D4, представляют собой гетероатом, выбранный из N или О, в случае D1 и D2, или N, в случае D3 и D4;

и R8 имеет значения, как определено в настоящей заявке, предпочтительно представляет собой перфторированный C1-C4-алкил.
Другим вариантом выполнения настоящего изобретения являются соединения формулы (Ia'')

в которой
D1 представляет собой C-R11 или гетероатом, выбранный из N или О;
D2 представляет собой C-R11 или гетероатом, выбранный из N или О;
D3 представляет собой С или N;
D4 представляет собой С или N;
D5 представляет собой C-R11 или N;
причем, самое большее, одна (1) или две группы, выбранные из D1, D2, D3, D4 и D5, представляют собой гетероатом;

R1 представляет собой Н, в каждом случае необязательно замещенный C2-C6-алкенил, C2-C6-алкинил, C3-C7-циклоалкил, C1-C6-алкилкарбонил, C1-C6-алкоксикарбонил, арил(C1-C3)-алкил или гетероарил(C1-C3)-алкил, или представляет собой необязательно замещенный C1-C6-алкил, особенно предпочтительно представляет собой Н
группы
A1 представляет собой CR2 или N,
A2 представляет собой CR3 или N,
A3 представляет собой CR4 или N,
A4 представляет собой CR5 или N,
B1 представляет собой CR6 или N,
B2 представляет собой CR7 или N,
B3 представляет собой CR8 или N,
B4 представляет собой CR9 или N, и
B5 представляет собой CR10 или N,
причем не более трех из групп A1-A4; представляют собой N, и не более трех из групп B1-B5, представляют собой N;
R2, R3, R4, R5, R6, R7, R9 и R10 независимо друг от друга представляет собой Н, галоген, циано, нитро, в каждом случае необязательно замещенный C1-C6-алкил, C3-C6-циклоалкил, C1-C6-алкокси, N-C1-C6-алкокси-имино-C1-C3-алкил, C1-C6-алкилсульфанил, C1-C6-алкилсульфинил, C1-C6-алкилсульфонил, N-C1-C6-алкиламино или N,N-ди-C1-C6-алкиламино;
когда ни одна из групп A2 и A3 не представляет собой N, R3 и R4 могут образовывать вместе с атомом углерода, с которым они связаны, 5- или 6-членное кольцо, содержащее 0, 1 или 2 Атома N и/или 0 или 1 атом О и/или 0 или 1 атом S, или
когда ни одна из групп A1 и A2 не представляет собой N, R2 и R3 могут образовывать вместе с атомом углерода, с которым они связаны, 6-членное кольцо, содержащее 0, 1 или 2 атома N;
R8 представляет собой галоген, циано, нитро, в каждом случае необязательно замещенный C1-C6-алкил, C3-C6-циклоалкил, C1-C6-алкокси, N-C1-C6-алкокси-имино-C1-C3-алкил, C1-C6-алкилсульфанил, C1-C6-алкилсульфинил, C1-C6-алкилсульфонил, N-C1-C6-алкиламино или N,N-ди-C1-C6-алкиламино;
R11 независимо друг от друга представляет собой Н, галоген, циано, нитро, амино или необязательно замещенный C1-C6-алкил, C1-C6-алкилокси, C1-C6-алкилкарбонил, C1-C6-алкилсульфанил, C1-C6-алкилсульфинил, C1-C6-алкилсульфонил, предпочтительно представляет собой Н;
W представляет собой О или S;
Q представляет собой Н, формил, гидрокси, амино или в каждом случае необязательно замещенный C1-C6-алкил, C2-C6-алкенил, C2-C6-алкинил, C3-C6-циклоалкил, C1-C5-гетероциклоалкил, C1-C4-алкокси, C1-C6-алкил-C3-C6-циклоалкил, C3-C6-циклоалкил-C1-C6-алкил, C6-,C10-,C14-арил, C1-C5-гетероарил, C6-,C10-,C14-арил-(C1-C3)-алкил, C1-C5-гетероарил-(C1-C3)-алкил, N-C1-C4-алкиламино, N-C1-C4-алкилкарбониламино, или N,N-Ди-C1-C4-алкиламино; или
представляет собой необязательно многократно замещенный заместителями V ненасыщенный 6-членный карбоцикл; или
представляет собой необязательно многократно замещенное заместителями V ненасыщенное 4-, 5- или 6-членное гетероциклическое кольцо, причем
V независимо друг от друга представляет собой галоген, циано, нитро, в каждом случае необязательно замещенный C1-C6-алкил, C1-C4-алкенил, C1-C4-алкинил, C3-C6-циклоалкил, C1-C6-алкокси, N-C1-C6-алкокси-имино-C1-C3-алкил, C1-C6-алкилсульфанил, C1-C6-алкилсульфинил, C1-C6-алкилсульфонил, или N,N-ди-(C1-C6-алкил)амино.
а также соли, N-оксиды и таутомерные формы соединений формулы (Ia'').
Другим вариантом выполнения настоящего изобретения являются соединения формулы (Ia''), причем соединения формулы (Ia'') представляют собой соединения формулы (I-T3)

в которой R1, A1, A2, A3, A4, R11, B1, B2, B4, B5, R8, Q и W имеют значения, как определено в настоящей заявке, причем, самое большее, одна группа, выбранная из A1, A2, A3, A4, представляет собой N, и, самое большее, одна группа, выбранная из B1, B2, B3, B4, и B5, представляет собой N; или причем одна или две группы, выбранные из A1, A2, A3, A4, могут представлять собой N и, самое большее, одна группа, выбранная из B1, B2, B3, B4, и B5, представляет собой N.
Другим вариантом выполнения настоящего изобретения являются соединения формулы (Ia''), причем соединения формулы (Ia'') представляют собой соединения формулы (I-T2)
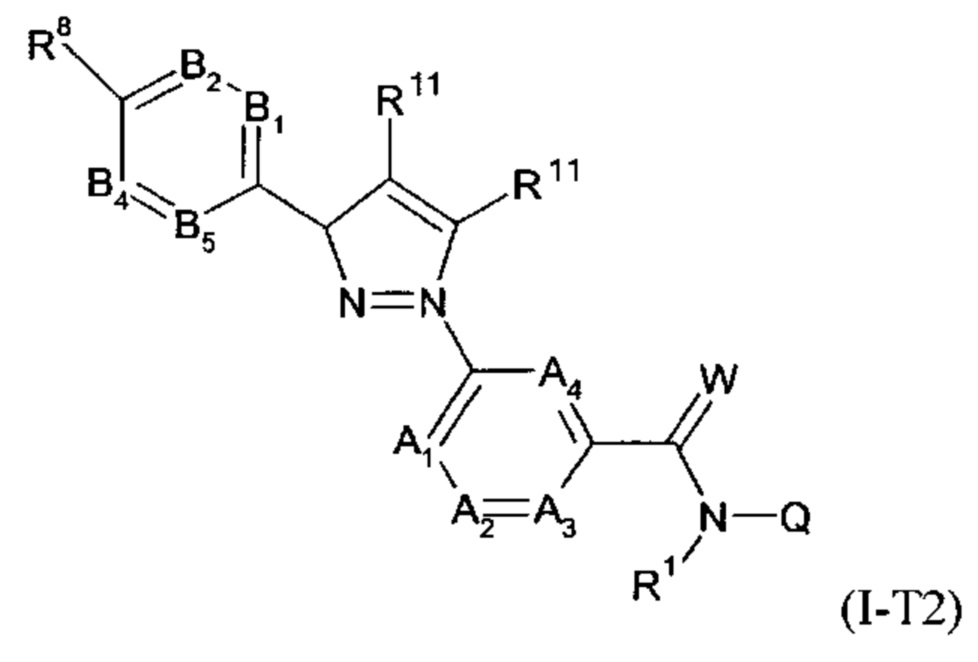
в которой R1, A1, A2, A3, A4, R11, B1, B2, B4, B5, R8, Q и W имеют значения, как определено в настоящей заявке, причем, самое большее, одна группа, выбранная из A1, A2, A3, A4, представляет собой N, и, самое большее, одна группа, выбранная из B1, B2, B3, B4, и B5, представляет собой N; или причем одна или две группы, выбранные из A1, A2, A3, A4, могут представлять собой N, и, самое большее, одна группа, выбранная из B1, B2, B3, B4, и B5 представляет собой N.
Другим вариантом выполнения настоящего изобретения являются соединения формулы (Ia''), причем соединения формулы (Ia'') представляют собой соединения формулы (I-T4)

в которой R1, A1, A2, A3, A4, R11, B1, B2, B4, B5, R8, Q и W имеют значения, как определено в настоящей заявке, причем, самое большее, одна группа, выбранная из A1, A2, A3, A4, представляет собой N, и, самое большее, одна группа, выбранная из B1, B2, B3, B4, и B5, представляет собой N; или причем одна или две группы, выбранные из A1, A2, A3, A4, могут представлять собой N, и, самое большее, одна группа, выбранная из B1, B2, B3, B4, и B5, представляет собой N.
Другим вариантом выполнения настоящего изобретения являются соединения формулы (Ia''), причем соединения формулы (Ia'') представляют собой соединения формулы (I-T22)

в которой R1, A1, A2, A3, A4, R11, B1, B2, B4, B5, R8, Q и W имеют значения, как определено в настоящей заявке причем, самое большее, одна группа, выбранная из A1, A2, A3, A4, представляет собой N, и, самое большее, одна группа, выбранная из B1, B2, B3, B4, и B5, представляет собой N; или причем одна или две группы, выбранные из A1, A2, A3, A4, могут представлять собой N, и, самое большее, одна группа, выбранная из B1, B2, B3, B4, и B5 представляет собой N.
Другим вариантом выполнения настоящего изобретения являются соединения формулы (Ia''), причем соединения формулы (Ia'') представляют собой соединения формулы (I-T23)

в которой R1, A1, A2, A3, A4, R11, B1, B2, B4, B5, R8, Q и W имеют значения, как определено в настоящей заявке, причем, самое большее, одна группа, выбранная из A1, A2, A3, A4, представляет собой N, и, самое большее, одна группа, выбранная из B1, B2, B3, B4, и B5, представляет собой N; или причем одна или две группы, выбранные из A1, A2, A3, A4, могут представлять собой N, и, самое большее, одна группа, выбранная из B1, B2, B3, B4, и B5, представляет собой N.
Другой вариант выполнения настоящего изобретения относится к соединениям согласно описанным в настоящей заявке формулам и вариантам выполнения, причем R11 независимо друг от друга представляет собой Н, и W представляет собой О.
Другой вариант выполнения настоящего изобретения относится к соединениям согласно описанным в настоящей заявке формулам и вариантам выполнения, причем R11 независимо друг от друга представляет собой Н, и W представляет собой О, и B3 представляет собой C-R8, R8 представляет собой замещенный галогеном C1-C3-алкил (предпочтительно перфторированный C1-C3-алкил, особенно предпочтительно перфторированный C1-C3-алкил) или замещенный галогеном C1-C3-алкокси (предпочтительно перфторированный C1-C3-алкокси, особенно предпочтительно перфторированный C1-C3-алкокси).
Другой вариант выполнения настоящего изобретения относится к соединениям согласно описанным в настоящей заявке формулам и вариантам выполнения, причем группы A1-A4 и B1-B5 представляют собой
A1 С-Н,
A2 CR3 или N,
A3 CR4,
A4 С-Н,
B1 CR6 или N,
B2 С-Н,
B3 CR8,
B4 С-Н и
B5 CR10 или N.
Другой вариант выполнения настоящего изобретения относится к соединениям согласно описанным в настоящей заявке формулам и вариантам выполнения, причем R1 представляет собой Н.
Другой вариант выполнения настоящего изобретения относится к соединениям согласно описанным в настоящей заявке формулам и вариантам выполнения, причем Q представляет собой замещенный фтором C1-C4-алкил, C3-C4-циклоалкил, необязательно замещенный циано или фтором C3-C4-циклоалкил, C4-C6-гетероциклоалкил, 1-оксидо-тиетан-3-ил, 1,1-диоксидо-тиетан-3-ил, бензил, пиридин-2-илметил, метилсульфонил, или 2-оксо-2-(2,2,2-трифтороэтиламино)этил.
Другой вариант выполнения настоящего изобретения относится к соединениям согласно описанным в настоящей заявке формулам и вариантам выполнения, причем R8 представляет собой галоген или замещенный галогеном C1-C4-алкил.
Другой вариант выполнения настоящего изобретения относится к соединениям согласно описанным в настоящей заявке формулам, причем R11 независимо друг от друга представляет собой Н.
Другой вариант выполнения настоящего изобретения относится к соединениям согласно описанным в настоящей заявке формулам, причем R6, R7, R9 и R10 независимо друг от друга представляет собой Н, галоген, циано, нитро, в каждом случае необязательно замещенный C1-C4-алкил, C3-C4-циклоалкил, C1-C4-алкокси, N-алкоксииминоалкил, C1-C4-алкилсульфанил, C1-C4-алкилсульфинил, C1-C4-алкилсульфонил, N-C1-C4-алкиламино, N,N-ди-С1-C4-алкиламино.
Другой вариант выполнения настоящего изобретения относится к соединениям согласно описанным в настоящей заявке формулам, причем R2, R3, R4, и R5 независимо друг от друга представляет собой Н, галоген, циано, нитро, в каждом случае необязательно замещенный C1-C4-алкил, C3-C4-циклоалкил, C1-C4-алкокси, N-С1-C4-алкоксиимино-C1-C4-алкил, C1-C4-алкилсульфанил, C1-C4-алкилсульфинил, C1-C4-алкилсульфонил, N-C1-C4-алкиламино, или N,N-ди-C1-C4-алкиламино.
Другой вариант выполнения настоящего изобретения относится к соединениям согласно описанным в настоящей заявке формулам, причем группы A1-A4 и B1-B5 представляют собой
A1 С-Н,
A2 CR3 или N,
A3 CR4,
A4 С-Н,
B1 CR6 или N,
B2 С-Н,
B3 CR8,
B4 С-Н и
B5 CR10 или N.
Другой вариант выполнения настоящего изобретения относится к соединениям согласно описанным в настоящей заявке формулам, причем R1 представляет собой Н.
Другой вариант выполнения настоящего изобретения относится к соединениям согласно описанным в настоящей заявке формулам, причем Q представляет собой замещенный фтором или карбамидом (-C(=O)N(R)2, причем R независимо друг от друга представляет собой Н, C1-C3-алкил или замещенный галогеном C1-C3-алкил) C1-C4-алкил, необязательно замещенный циано или фтором C3-C4-циклоалкил, C4-C6-гетероциклоалкил, 1-оксидо-тиетан-3-ил, 1,1-диоксидо-тиетан-3-ил, бензил, пиридин-2-илметил, метилсульфонил, или 2-оксо-2-(2,2,2-трифторэтиламино)этил.
Другой вариант выполнения настоящего изобретения относится к соединениям согласно описанным в настоящей заявке формулам, причем Q представляет собой 2,2,2-трифторэтил, 2,2-дифторэтил, 3,3,3-трифторпропил, циклопропил, циклобутил, циклопропил, циклобутил, 1-циано-циклопропил, транс-2-фторциклопропил, или цис-2-фторциклопропил, оксетан-3-ил, тиетан-3-ил, 1-оксидо-тиетан-3-ил, 1,1-диоксидо-тиетан-3-ил, бензил, пиридин-2-илметил, метилсульфонил, или 2-оксо-2-(2,2,2-трифтороэтиламино)этил.
Другой вариант выполнения настоящего изобретения относится к соединениям согласно описанным в настоящей заявке формулам, причем R8 представляет собой галоген или замещенный галогеном C1-C4-алкил.
Другим объектом настоящего изобретения является инсектицидное средство, отличающееся тем, что оно содержит по меньшей мере одно соединение формулы (I), как описано в настоящей заявке, и наполнитель и/или поверхностно-активное вещество.
Другим объектом настоящего изобретения является способ защиты трансгенных или обычных семян и прорастающих из них растений от повреждения вредителями, отличающийся тем, что семена обрабатываются по меньшей мере одним соединением общей формулы (I), как описано в настоящей заявке.
Еще одним объектом настоящего изобретения является применение соединений формулы (I), как описано в настоящей заявке, или инсектицидного средства, как описано в настоящей заявке, для борьбы с вредителями.
Другим объектом настоящего изобретения является применение соединений формулы (I), как описано в настоящей заявке, для борьбы с переносчиками инфекций.
Еще одним объектом настоящего изобретения является семя, на которое соединение формулы (I), как описано в настоящей заявке, наносится в виде компонента оболочки или в виде другого слоя или других слоев, в дополнение к оболочке.
Соответственно, другим объектом настоящего изобретения является способ нанесения оболочки, содержащей по меньшей мере одно соединение формулы (I), как описано в настоящей заявке, или нанесения соединения формулы (I), как описано в настоящей заявке, в качестве слоя или других слоев, в дополнение к оболочке, на семя, включающий стадии а) смешение семени с материалом оболочки, состоящим из или содержащим соединение формулы (I), как описано в настоящей заявке, b) обогащение полученной массы покрытых семян, с) сушку полученной обогащенной массы семян, d) дис- или деаггломерацию полученной высушенной массы семян.
Описанные в настоящей заявке соединения формулы (I) в зависимости от вида заместителей при необходимости могут существовать в виде геометрических и/или в виде оптически активных изомеров или соответствующих смесей изомеров с разным составом. Настоящее изобретение охватывает как очищенный изомер, так и смесь изомеров.
Соединения согласно настоящему изобретению могут также присутствовать в виде комплексов металлов.
Определения
Специалисту в данной области техники должно быть очевидно, что если иного не указано, форма единственного числа, как раскрывается в настоящей заявке, охватывает в зависимости от ситуации "один (1)", "один (1) или более" или "по меньшей мере один (1)".
Для всех описанных в настоящей заявке структур, как в циклических системах, так и в группах, не могут присутствовать в качестве соседних атомов ни -O-O-, ни -O-S-.
Структуры с переменным числом возможных атомов углерода (атомы С) могут обозначаться в настоящей заявке как Cнижняя граница атомовС-Cверхняя граница атомов С- структуры (Снг-Свг-структуры). Например: алкильная группа может состоять из от 3 до 10 атомов углерода, и тогда соответствует C3-С10-алкилу. Кольцевые структуры из атомов углерода и гетероатомов могут обозначаться в виде „нг-вг-членных" структур. Примером 6-членной кольцевой структуры является толуол (6-членная кольцевая структура, замещенная метальной группой).
Если общий термин для заместителя, например Снг-Свг-алкил, находится в конце сложного заместителя, например, Снг-Совг-циклоалкил-Снг-Свг-алкил, тогда составляющая в начале сложного заместителя, например, Снг-Свг-циклоалкил, может быть моно или полизамещенной одинаковыми или различными, независимо друг от друга, последними заместителями, например, Снг-Саг-алкил. Все общие термины, применяемые в настоящей заявке для химических групп, циклических систем и циклических групп, могут быть выражены более конкретно путем добавления „Снг-Свг" или „нг-вг-членный".
Если иного не указано, определение общих терминов также относится к этим общим терминам в сложных заместителях. Например: определение Снг-Свг-алкила также относится к Снг-Свг-алкилу в качестве части сложного заместителя, например, Снг-Свг-циклоалкил-Снг-Свг-алкил.
Специалисту в данной области техники очевидно, что приведенные в настоящей заявке примеры не нужно рассматривать как ограничивающие, а лишь как подробно описывающие некоторые отдельные варианты выполнения настоящего изобретения.
При определениях символов, приведенных в вышеуказанных формулах, применяются общие термины, которые, как правило, представляют следующие заместители:
Галоген охватывает элементы главной группы 7, предпочтительно фтор, хлор, бром и иод, более предпочтительно фтор, хлор и бром, и еще более предпочтительно фтор и хлор.
Примерами гетероатома являются N, О, S, Р, В, Si. Предпочтительно понятие гетероатом охватывает N, S и О.
Согласно настоящему изобретению термин "алкил" - сам по себе или в виде составляющей химической группы - означает разветвленный или неразветвленный углеводород, предпочтительно содержащий от 1 до 6 атомов углерода, как например метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, 1,2-диметилпропил, 1,1-диметилпропил, 2,2-диметилпропил, 1-этилпропил, гексил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 1,2-диметилпропил, 1,3-диметилбутил, 1,4-диметилбутил, 2,3-диметилбутил, 1,1-диметилбутил, 2,2-диметилбутил, 3,3-диметилбутил, 1,1,2-триметилпропил, 1,2,2-триметилпропил, 1-этилбутил и 2-этилбутил. Более предпочтительным является алкил, содержащий от 1 до 4 атомов углерода, как например, среди прочего, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил или трет-бутил. Согласно настоящему изобретению алкил может быть замещен одним или более, одинаковыми или различными заместителями.
Согласно настоящему изобретению термин "алкенил" - сам по себе или в виде составляющей химической группы - означает разветвленный или неразветвленный углеводород, предпочтительно содержащий от 2 до 6 атомов углерода и по меньшей мере одну двойную связь, как например винил, 2-пропенил, 2-бутенил, 3-бутенил, 1-метил-2-пропенил, 2-метил-2-пропенил, 2-пентенил, 3-пентенил, 4-пентенил, 1-метил-2-бутенил, 2-метил-2-бутенил, 3-метил-2-бутенил, 1-метил-3-бутенил, 2-метил-3-бутенил, 3-метил-3-бутенил, 1,1-диметил-2-пропенил, 1,2-диметил-2-пропенил, 1-этил-2-пропенил, 2-гексенил, 3-гексенил, 4-гексенил, 5-гексенил, 1-метил-2-пентенил, 2-метил-2-пентенил, 3-метил-2-пентенил, 4-метил-2-пентенил, 3-метил-3-пентенил, 4-метил-3-пентенил, 1-метил-4-пентенил, 2-метил-4-пентенил, 3-метил-4-пентенил, 4-метил-4-пентенил, 1,1-диметил-2-бутенил, 1,1-диметил-3-бутенил, 1,2-диметил-2-бутенил, 1,2-диметил-3-бутенил, 1,3-диметил-2-бутенил, 2,2-диметил-3-бутенил, 2,3-диметил-2-бутенил, 2,3-диметил-3-бутенил, 1-этил-2-бутенил, 1-этил-3-бутенил, 2-этил-2-бутенил, 2-этил-3-бутенил, 1,1,2-триметил-2-пропенил, 1-этил-1-метил-2-пропенил и 1-этил-2-метил-2-пропенил. Более предпочтительным является алкенил, содержащий от 2 до 4 атомов углерода, как например, среди прочего, 2-пропенил, 2-бутенил или 1-метил-2-пропенил. Согласно настоящему изобретению алкенил может быть замещен одним или более, одинаковыми или различными заместителями.
Согласно настоящему изобретению термин "алкинил" - сам по себе или в виде составляющей химической группы - означает разветвленный или неразветвленный углеводород, предпочтительно содержащий от 2 до 6 атомов углерода и по меньшей мере одну тройную связь, как например 2-пропинил, 2-бутинил, 3-бутинил, 1-метил-2-пропинил, 2-пентинил, 3-пентинил, 4-пентинил, 1-метил-3-бутинил, 2-метил-3-бутинил, 1-метил-2-бутинил, 1,1-диметил-2-пропинил, 1-этил-2-пропинил, 2-гексинил, 3-гексинил, 4-гексинил, 5-гексинил, 1-метил-2-пентинил, 1-метил-3-пентинил, 1-метил-4-пентинил, 2-метил-3-пентинил, 2-метил-4-пентинил, 3-метил-4-пентинил, 4-метил-2-пентинил, 1,1-диметил-3-бутинил, 1,2-диметил-3-бутинил, 2,2-диметил-3-бутинил, 1-этил-3-бутинил, 2-этил-3-бутинил, 1-этил-1-метил-2-пропинил и 2,5-гексадиинил. Более предпочтительным является алкинил, содержащий от 2 до 4 атомов углерода, как например, среди прочего, этинил, 2-пропинил или 2-бутинил-2-пропенил. Согласно настоящему изобретению алкинил может быть замещен одним или более, одинаковыми или различными заместителями.
Согласно настоящему изобретению термин "циклоалкил" - сам по себе или в виде составляющей химической группы - представляет собой моно-, би- или трициклический углеводород, предпочтительно содержащий от 3 до 10 атомов углерода, как например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, бицикло[2.2.1]гептил, бицикло[2.2.2]октил или адамантил. Более предпочтительным является циклоалкил, содержащий 3, 4, 5, 6 или 7 атомов углерода, как например, среди прочего, циклопропил или циклобутил. Согласно настоящему изобретению циклоалкил может быть замещен одним или более, одинаковыми или различными заместителями.
Согласно настоящему изобретению термин "алкилциклоалкил" представляет собой моно-, би- или трициклический алкилциклоалкил, предпочтительно содержащий от 4 до 10 или от 4 до 7 атомов углерода, как например метилциклопропил, этилциклопропил, изопропилциклобутил, 3-метилциклопентил и 4-метил-циклогексил. Более предпочтительным является алкилциклоалкил, содержащий 4, 5 или 7 атомов углерода, как например, среди прочего, этилциклопропил или 4-метил-циклогексил. Согласно настоящему изобретению алкилциклоалкил может быть замещен одним или более, одинаковыми или различными заместителями.
Согласно настоящему изобретению термин "циклоалкилалкил" представляет собой моно-, би- или трициклический циклоалкилалкил, предпочтительно содержащий от 4 до 10 или от 4 до 7 атомов углерода, как например циклопропилметил, циклобутилметил, циклопентилметил, циклогексилметил и циклопентилэтил. Более предпочтительным является циклоалкилалкил, содержащий 4, 5 или 7 атомов углерода, как например, среди прочего циклопропилметил или циклобутилметил. Согласно настоящему изобретению циклоалкилалкил может быть замещен одним или более, одинаковыми или различными заместителями.
Согласно настоящему изобретению термин "гидроксиалкил" представляет собой неразветвленный или разветвленный спирт, предпочтительно содержащий от 1 до 6 атомов углерода, как например, метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, втор-бутанол и трет-бутанол. Более предпочтительной является гидроксиалкильная группа, содержащая от 1 до 4 атомов углерода. Гидроксиалкильные группы согласно настоящему изобретению могут быть замещены одним или более, одинаковыми или различными заместителями
Согласно настоящему изобретению термин "алкокси" представляет собой неразветвленный или разветвленный О-алкил, предпочтительно содержащий от 1 до 6 атомов углерода, как например метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси и трет-бутокси. Более предпочтительной является алкоксигруппа, содержащая от 1 до 4 атомов углерода. Алкоксигруппы согласно настоящему изобретению могут быть замещены одним или более, одинаковыми или различными заместителями.
Согласно настоящему изобретению термин "алкилсульфанил" представляет собой неразветвленный или разветвленный S-алкил, предпочтительно содержащий от 1 до 6 атомов углерода, как например метилтио, этилтио, н-пропилтио, изопропилтио, н-бутилтио, изобутилтио, втор-бутилтио и трет-бутилтио. Более предпочтительной является алкилсульфанилгруппа, содержащая от 1 до 4 атомов углерода. Алкилсульфанильные группы согласно настоящему изобретению могут быть замещены одним или более, одинаковыми или различными заместителями.
Согласно настоящему изобретению термин "алкилсульфинил" представляет собой неразветвленный или разветвленный алкилсульфинил, предпочтительно содержащий от 1 до 6 атомов углерода, как например, метилсульфинил, этилсульфинил, н-пропилсульфинил, изопропилсульфинил, н-бутилсульфинил, изобутил-сульфинил, втор-бутилсульфинил и трет-бутилсульфинил. Более предпочтительными являются алкилсульфинильные группы, содержащие от 1 до 4 атомов углерода. Алкилсульфинильные группы согласно настоящему изобретению могут быть замещены одним или более, одинаковыми или различными заместителями.
Согласно настоящему изобретению термин "алкилсульфонил" представляет собой неразветвленный или разветвленный алкилсульфонил, предпочтительно содержащий от 1 до 6 атомов углерода, как например, метилсульфонил, этилсульфонил, н-пропилсульфонил, изопропилсульфонил, н-бутилсульфонил, изобутилсульфонил, втор-бутилсульфонил и трет-бутилсульфонил. Более предпочтительными являются алкилсульфонильные группы, содержащие от 1 до 4 атомов углерода. Алкилсульфонильные группы согласно настоящему изобретению могут быть замещены одним или более, одинаковыми или различными заместителями.
Согласно настоящему изобретению термин "алкилкарбонил" представляет собой неразветвленный или разветвленный акил-C(=O), предпочтительно содержащий от 2 до 7 атомов углерода, как например метилкарбонил, этилкарбонил, н-пропилкарбонил, изопропилкарбонил, втор-бутилкарбонил и трет-бутилкарбонил. Более предпочтительным является алкилкарбонил, содержащий от 1 до 4 атомов углерода. Согласно настоящему изобретению алкилкарбонил может быть замещен одним или более, одинаковыми или различными заместителями.
Согласно настоящему изобретению термин "циклоалкилкарбонил" представляет собой неразветвленный или разветвленный циклоалкилкарбонил, предпочтительно содержащий от 3 до 10 атомов углерода в циклоалкильной части, как например циклопропилкарбонил, циклобутилкарбонил, циклопентилкарбонил, циклогексил-карбонил, циклогептилкарбонил, циклооктилкарбонил, бицикло[2.2.1]гептил, бицикло[2.2.2]октилкарбонил и адамантилкарбонил. Более предпочтительным является циклоалкилкарбонил, содержащий 3, 5 или 7 атомов углерода в циклоалкильной части. Согласно настоящему изобретению циклоалкилкарбонильная группа может быть замещена одним или более, одинаковыми или различными заместителями.
Согласно настоящему изобретению термин "алкоксикарбонил" - сам по себе или в виде составляющей химической группы - представляет собой неразветвленный или разветвленный алкоксикарбонил, предпочтительно содержащий от 1 до 6 атомов углерода или от 1 до 4 атомов углерода в алкильной части, как например метоксикарбонил, этоксикарбонил, н-пропоксикарбонил, изопропоксикарбонил, втор-бутоксикарбонил и трет-бутоксикарбонил. Согласно настоящему изобретению алкоксикарбонильная группа может быть замещена одним или более, одинаковыми или различными заместителями.
Согласно настоящему изобретению термин "алкиламинокарбонил" представляет собой неразветвленный или разветвленный алкиламинокарбонил, предпочтительно содержащий от 1 до 6 атомов углерода или от 1 до 4 атомов углерода в алкильной части, как например метиламинокарбонил, этиламинокарбонил, н-проиламинокарбонил, изопропиламинокарбонил, втор-бутиламинокарбонил и трет-бутиламинокарбонил. Согласно настоящему изобретению алкиламинокарбонильная группа может быть замещена одним или более, одинаковыми или различными заместителями.
Согласно настоящему изобретению термин "N,N-диалкиламино-карбонил" представляет собой неразветвленный или разветвленный N,N-диалкиламинокарбонил, предпочтительно содержащий от 1 до 6 атомов углерода или от 1 до 4 атомов углерода в алкильной части, как например N,N-диметиламино-карбонил, N.N-диэтиламино-карбонил, N,N-ди(н-пропиламино)-карбонил, N,N-ди-(изопропиламино)-карбонил и N,N-ди-(втор-бутиламино)-карбонил. Согласно настоящему изобретению N,N-диалкиламино-карбонильная группа может быть замещена одним или более, одинаковыми или различными заместителями.
Согласно настоящему изобретению термин "арил" обозначает моно-, би- или полициклическую ароматическую систему, содержащую предпочтительно от 6 до 14, наиболее предпочтительно от 6 до 10 кольцевых атомов углерода, как например фенил, нафтил, антрил, фенантренил, предпочтительно фенил. Кроме того, арил охватывает полициклические системы, такие как тетрагидронафтил, инденил, инданил, флуоренил, бифенил, причем местом присоединения является ароматическая система. Согласно настоящему изобретению арильная группа может быть замещен одним или более, одинаковыми или различными заместителями.
Примерами замещенных арилов являются арилалкилы, которые подобным образом могут быть замещены одним или более, одинаковыми или различными заместителями в C1-C4-алкильной и/или C6-C14-арильной части. Примерами таких арилалкилов являются, среди прочего, бензил и 1-фенилэтил.
Согласно настоящему изобретению термин "гетероцикл", "гетероциклическое кольцо" или "гетероциклическая кольцевая система" представляет собой карбоциклическую кольцевую систему с по меньшей мере одним кольцом, в котором по меньшей мере один атом углерода замещен на гетероатом, предпочтительно гетероатом из группы N, О, S, Р, В, Si, Se, и которое является насыщенным, ненасыщенным или гетероароматическим, и при этом может быть незамещенным или замещенным, причем место присоединения расположено при кольцевом атоме. Если иного не указано, гетероциклическое кольцо содержит предпочтительно от 3 до 9 кольцевых атомов, наиболее предпочтительно от 3 до 6 кольцевых атомов, и один или более, предпочтительно от 1 до 4, наиболее предпочтительно 1, 2 или 3 гетероатома в гетероциклическом кольце, предпочтительно из группы N, О, и S, причем, однако, два атома кислорода не должны находиться непосредственно по соседству. Гетероциклическое кольцо содержит, как правило, не более 4 атомов азота, и/или не более 2 атомов кислорода, и/или не более 2 атомов серы. Если гетероциклический остаток или гетероциклическое кольцо при необходимости замещено, оно может быть конденсировано с другими карбоциклическими или гетероциклическими кольцами. В случае необязательно замещенного гетероциклила, настоящим изобретением также охватываются полициклические системы, как например 8-аза-бицикло[3.2.1]октанил или 1-аза-бицикло[2.2.1]гептил. В случае необязательно замещенного гетероциклила, настоящим изобретением также охватываются спироциклические системы, как например 1-окса-5-аза-спиро[2.3]гексил.
Согласно настоящему изобретению гетероциклильными группами являются, например, пиперидинил, пиперазинил, морфолинил, тиоморфолинил, дигидропиранил, тетрагидропиранил, диоксанил, пирролинил, пирролидинил, имидазолинил, имидазолидинил, тиазолидинил, оксазолидинил, диоксоланил, диоксолил, пиразолидинил, тетрагирофуранил, дигидрофуранил, оксетанил, оксиранил, азетидинил, азиридинил, оксазетидинил, оксазиридинил, оксазепанил, оксазинанил, азепанил, оксопирролидинил, диоксопирролидинил, оксоморфолинил, оксопиперазинил и оксепанил.
Особое значение имеют гетероарилы, а также гетероароматические системы. Согласно настоящему изобретению термин гетероарил означает гетероароматические соединения, это означает полностью ненасыщенные ароматические гетероциклические соединения, которые подпадают под вышеприведенное определение гетероциклов. Предпочтительными являются 5- 7-членные кольца с 1-3, предпочтительно 1 или 2 одинаковыми или различными гетероатомами из вышеуказанной группы. Гетероарилы согласно настоящему изобретению представляют собой, например, фурил, тиенил, пиразолил, имидазолил, 1,2,3- и 1,2,4-триазолил, изоксазолил, тиазолил, изотиазолил, 1,2,3-, 1,3,4-, 1,2,4- и 1,2,5-оксадиазолил, азепинил, пирролил, пиридил, пиридазинил, пиримидинил, пиразинил, 1,3,5-, 1,2,4- и 1,2,3-триазинил, 1,2,4-, 1,3,2-, 1,3,6- и 1,2,6-оксазинил, оксепинил, тиепинил, 1,2,4-триазолонил и 1,2,4-диазепинил. Гетероарильные группы согласно настоящему изобретению могут быть далее замещены одним или более одинаковыми или различными заместителями.
Термин „(необязательно) замещенные" группы/заместители, как например замещенная алкильная, алкенильная, алкинильная, алкокси, алкилсульфанильная, алкилсульфинильная, алкилсульфонильная, циклоалкильная, арильная, фенильная, бензильная, гетероциклильная и гетероарильная группа, означает, например, ответвленный замещенный остаток незамещенной основной части, причем заместители, например, один (1) заместитель или более заместителей, предпочтительно 1, 2, 3, 4, 5, 6, или 7, выбираются из группы, состоящей из амино, гидрокси, галоген, нитро, циано, изоциано, меркапто, изотиоцианато, C1-C4-карбокси, карбамид, SF5, аминосульфонил, C1-C4-алкил, C3-C4-циклоалкил, C2-C4-алкенил, C3-C4-циклоалкенил, C2-C4-алкинил, N-моно-C1-C4-алкил-амино, N,N-ди-C1-C4-алкиламино, N-С1-C4-алканоиламино, C1-C4-алкокси, C2-C4-алкенилокси, C2-C4-алкинилокси, C3-C4-циклоалкокси, C3-C4-циклоалкенилокси, C1-C4-алкоксикарбонил, C2-C4- C2-C4-алкенилоксикарбонил, C2-C4-алкинилоксикарбонил, C6-,C10-,C14-арилоксикарбонил, C1-C4-алканоил, C2-C4-алкенилкарбонил, C2-C4-алкинилкарбонил, C6-,C10-,C14-арилкарбонил, C1-C4-алкилсульфанил, C3-C4-циклоалкилсульфанил, C1-C4-алкилтио, C2-C4-алкенилтио, C3-C4-циклоалкенилтио, C2-C4-алкинилтио, C1-C4-алкилсульфенил и C1-C4-алкилсульфинил, причем охватываются обо энантиомера C1-C4-алкилсульфинильной группы, C1-C4-алкилсульфонил, N-моно-C1-C4-алкил-аминосульфонил, N,N-ди-C1-C4-алкил-аминосульфонил, C1-C4-алкилфосфинил, C1-C4-алкилфосфонил, причем для C1-C4-алкилфосфинила или C1-C4-алкилфосфонила охватываются обо энантиомера, N-C1-C4-алкил-аминокарбонил, N,N-ди-C1-C4-алкил-амино-карбонил, N-C1-C4-алканоил-амино-карбонил, N-C1-C4-алканоил-N-C1-C4-алкил-аминокарбонил, C6-,C10-,C14-арил, C6-,C10-,C14-арилокси, бензил, бензилокси, бензилтио, C6-,C10-,C14-арилтио, C6-,C10-,C14-ариламино, бензиламино, гетероциклил и триалкилсилил, заместители с двойной связью, как например C1-C4-алкилиден (например, метилиден или этилиден), оксогруппа, тиоксогруппа, иминогруппа, а также замещенная имногруппа. Если две или более группы образуют одно или более колец, то они могут быть карбоциклическими, гетероциклическими, насыщенными, частично насыщенными, ненасыщенными, например, также ароматическими и далее замещенными.
Упомянутые в качестве примеров заместители («заместители первого уровня") могут, если они имеют углеводородсодержащую часть, далее необязательно замещены («заместители второго уровня"), например, один или более заместителей в каждом случае независимо друг от друга выбираются из Галогена, гидрокси, амино, нитро, циано, изоциано, азидо, ациламино, оксогруппы и иминогруппы. Предпочтительно только заместители первого или второго уровня охватываются термином "(необязательно) замещенная" группа.
Согласно настоящему изобретению замещенные галогеном химические группы или галогенированные группы (как например, алкил или алкокси) являются однократно или более раз или до максимально возможного количества раз замещенными галогеном. Такие группы обозначаются также как галогруппы (как, например, галоалкил). При многократном замещении галогеном, атомы галогена могут быть одинаковыми или различными, и все могут быть присоединены к одному или более атомам углерода. При этом галоген наиболее предпочтительно представляет собой фтор, хлор, бром или иод, предпочтительно фтор, хлор или бром и особенно предпочтительно фтор. Наиболее предпочтительно замещенными галогенами группами являются моногалоциклоалкил, как например, 1-фтор-циклопропил, 2-фтор-циклопропил или 1-фтор-циклобутил, моногалоалкил, как например 2-хлор-этил, 2-фтор-этил, 1-хлор-этил, 1-фтор-этил, хлорметил, или фторметил; пергалоалкил, как например трихлорметил или трифторметил или CF2CF3, полигалоалкил, как например дифторметил, 2-фтор-2-хлор-этил, дихлорметил, 1,1,2,2-тетрафторэтил, или 2,2,2-трифторэтил. Другими примерами галогеналкила являются трихлорметил, хлордифторметил, дихлорфторметил, хлорметил, бромметил, 1-фторэтил, 2-фторэтил, 2,2-дифторэтил, 2,2,2-трифторэтил, 2,2,2-трихлорэтил, 2-хлор-2,2-дифторэтил, пентафторэтил, 3,3,3-трифторпропил и пентафтор-трет-бутил. Предпочтительным является галогеналкил, содержащий от 1 до 4 атомов углерода и от 1 до 9, предпочтительно от 1 до 5 одинаковых или различных атомов галогенов, выбранных из фтора, хлора или брома. Особенно предпочтительным является галогеналкил, содержащий 1 или 2 атома углерода и от 1 до 5 одинаковых или различных атомов галогенов, выбранных из фтора или хлора, как например, среди прочего, дифторметил, трифторметил или 2,2-дифторэтил. Другими примерами галогензамещенных соединений являются гало-алкокси, как например OCF3, OCHF2, OCH2F, OCF2CF3, OCH2CF3, OCH2CHF2 и OCH2CH2Cl, галогеналкилсульфанил, как например дифторметилтио, трифторметилтио, трихлорметилтио, хлордифторметилтио, 1-фторэтилтио, 2-фторэтилтио, 2,2-дифторэтилтио, 1,1,2,2-тетрафторэтилтио, 2,2,2-трифторэтилтио или 2-хлор-1,1,2-трифторэтилтио, галогеналкилсульфинил, как например дифторметилсульфинил, трифторметилсульфинил, трихлорметилсульфинил, хлордифторметилсульфинил, 1-фторэтилсульфинил, 2-фторэтилсульфинил, 2,2-дифторэтилсульфинил, 1,1,2,2-тетрафторэтилсульфинил, 2,2,2-трифторэтилсульфинил и 2-хлор-1,1,2-трифторэтилсульфинил, галогеналкилсульфинил, как например дифторметилсульфинил, трифторметилсульфинил, трихлорметилсульфинил, хлордифторметилсульфинил, 1-фторэтилсульфинил, 2-фторэтилсульфинил, 2,2-дифторэтилсульфинил, 1,1,2,2-тетрафторэтилсульфинил, 2,2,2-трифторэтилсульфинил и 2-хлор-1,1,2-трифторэтилсульфинил, галогеналкилсульфонильные группы, как например дифторметилсульфонил, трифторметилсульфонил, трихлорметилсульфонил, хлордифторметилсульфонил, 1-фторэтилсульфонил, 2-фторэтилсульфонил, 2,2-дифторэтилсульфонил, 1,1,2,2-тетрафторэтилсульфонил, 2,2,2-трифторэтилсульфонил и 2-хлор-1,1,2-трифторэтилсульфонил.
В случае радикалов, включающих атомы углерода, предпочтение отдается содержащим от 1 до 4 атомов углерода, наиболее предпочтительно 1 или 2 атома углерода. Предпочтительными, как правило, являются из группы, включающей галоген, например, фтор и хлор, (C1-C4)алкил, предпочтительно метил или этил, (C1-C4)галоалкил, предпочтительно трифторметил, (C1-C4)алкокси, предпочтительно метокси или этокси, (C1-C4)галоалкокси, нитро и циано. При этом особенно предпочтительными заместителями являются метил, метокси, фтор и хлор.
Замещенный амино, как например моно- или дизамещенный амино, означает остаток из группы замещенных аминоостатков, которые, например, являются N-замещенными одним или двумя одинаковыми или различными остатками из группы, включающей алкил, гидрокси, амино, алкокси, ацил и арил; предпочтительно N-моно- и N,N-диалкиламино, (например, метиламино, этиламино, N,N-диметиламино, N,N-диэтиламино, N,N-ди-н-пропиламино, N,N-диизопропиламино или N,N-дибутиламино), N-моно- или N,N-диалкоксиалкил аминогруппы (например, N-метоксиметиламино, N-метоксиэтиламино, N,N-ди-(метоксиметил)-амино или N,N-ди-(метоксиэтил)-амино), N-моно- и N,N-диариламино, как например, необязательно замещенный анилин, ациламино, N,N-диациламино, N-алкил-N-ариламино, N-алкил-N-ациламино, а также насыщенные N-гетероциклы; при этом алкильный остаток предпочтительно имеет от 1 до 4 атомов углерода; при этом арил предпочтительно представляет собой фенил или замещенный фенил; при этом ацил рассматривается как определено далее, предпочтительно представляет собой (C1-C4)алканоил. Соответственно это относится к замещенному гидроксиламино или гидразино.
Согласно настоящему изобретению термин «циклические аминогруппы» охватывает гетероароматические или алифатические кольцевые системы с одним или более атомами азота. Гетероциклы являются насыщенными или ненасыщенными, состоят из одного или более, при необходимости конденсированных кольцевых систем и содержат при необходимости другие гетероатомы, как например, один или два атома азота, кислорода и/или серы. Кроме того, термин охватывает также группы, которые имеют спирокольцо или мостиковую кольцевую систему. Количество атомов, которые образуют циклическую аминогруппу, может быть любым и может составлять, например, в случае однокольцевой системы, от 3 до 8 кольцевых атомов, и в случае двукольцевых систем, от 7 до 11 атомов.
Примерами циклических аминогрупп с насыщенными и ненасыщенными моноциклическими группами с атомом азота в качестве гетероатома являются 1-азетидинил, пирролидино, 2-пирролидин-1-ил, 1-пирролил, пиперидино, 1,4-дигидропиразин-1-ил, 1,2,5,6-тетрагидропиразин-1-ил, 1,4-дигидропиридин-1-ил, 1,2,5,6-тетрагидропиридин-1-ил, гомопиперидинил; Примерами циклических аминогрупп с насыщенными и ненасыщенными моноциклическими группами с двумя или более атомами азота в качестве гетероатомов являются 1-имидазолидинил, 1-имидазолил, 1-пиразолил, 1-триазолил, 1-тетразолил, 1-пиперазинил, 1-гомопиперазинил, 1,2-дигидро-пиперазин-1-ил, 1,2-дигидро-пиримидин-1-ил, регтидропиримидин-1-ил, 1,4-диазациклогептан-1-ил; Примерами циклических аминогрупп с насыщенными и ненасыщенными моноциклическими группами с одним или двумя атомами кислорода и от одного до трех атомами азота в качестве гетероатомов являются, например, оксазолидин-3-ил, 2,3-дигидроизоксазол-2-ил, изоксазол-2-ил, 1,2,3-оксадиазин-2-ил, морфолино, примерами циклических аминогрупп с насыщенными и ненасыщенными моноциклическими группами с от одного до трех атомами азота и одним или двумя атомами серы в качестве гетероатомов являются тиазолидин-3-ил, изотиазолин-2-ил, тиоморфолино, или диоксотиоморфолино; примерами циклических аминогрупп с насыщенными и ненасыщенными конденсированными циклическими группами являются индол-1-ил, 1,2-дигидробензимидазол-1-ил, пергидропирроло[1,2-а]пиразин-2-ил; Примером циклических аминогрупп со спироциклической группой является 2-азаспиро[4,5]декан-2-ил; Примером циклических аминогрупп с мостиковой гетероциклической группой является 2-азабицикло[2,2,1]гептан-7-ил.
Замещенный амино охватывает также четвертичные соединения аммония (соли) с четырьмя органическими заместителями при атоме азота.
Необязательно замещенный фенил предпочтительно представляет собой фенил, незамещенный или один или более раз, предпочтительно до трех раз замещенный одинаковыми или различными радикалами, выбранными из группы, включающей галоген, C1-C4-алкил, C1-C4-алкокси, C1-C4-алкокси-С1-С4-алкокси, C1-C4-алкокси-C1-C4-алкил, C1-C4-галогеналкил, C1-C4-галогеналкокси, C1-C4-алкилсульфанил, C1-C4-галогеналкилсульфанил, циано, изоциано и нитро, например, о-, м- и п-толил, диметилфенил, 2-, 3- и 4-хлорфенил, 2-, 3- и 4-фторфенил, 2-, 3- и 4-трифторметил- и -трихлорметилфенил, 2,4-, 3,5-, 2,5- и 2,3-дихлорфенил, о-, м- и п-метоксифенил, 4-гептафторфенил.
Необязательно замещенный циклоалкил предпочтительно представляет собой циклоалкил, незамещенный или один или более раз, предпочтительно до трех раз замещенный одинаковыми или различными радикалами, выбранными из группы, включающей галоген, циано, C1-C4-алкил, C1-C4-Алкокси, C1-C4-алкокси-C1-C4-алкокси, C1-C4-алкокси-C1-C4-алкил, C1-C4-галогеналкил и C1-C4-галогеналкокси, наиболее предпочтительно замещенный одной или двумя C1-C4-алкильными группами.
Необязательно замещенный гетероциклил предпочтительно представляет собой гетероциклил, незамещенный или один или более раз, предпочтительно до трех раз замещенный одинаковыми или различными радикалами, выбранными из группы, включающей галоген, циано, C1-C4-алкил, C1-C4-алкокси, C1-C4-алкокси-C1-C4-алкокси, C1-C4-алкокси-C1-C4-алкил, C1-C4-галогеналкил, C1-C4-галогеналкокси, нитро и оксо, более предпочтительно замещенный одним или более заместителями, выбранными из группы, включающей галоген, C1-C4-алкил, C1-C4-алкокси, C1-C4-галогеналкил и оксо, наиболее предпочтительно замещенный одной или двумя C1-C4-алкильными группами.
Примерами алкила, замещенного гетероарилом является, фурилметил, тиенилметил, пиразолилметил, имидазолилметил, 1,2,3- и 1,2,4-триазолилметил, изоксазолилметил, тиазолилметил, изотиазолилметил, 1,2,3-, 1,3,4-, 1,2,4- и 1,2,5-оксадиазолилметил, азепинилметил, пирролилметил, пиридилметил, пиридазинилметил, пиримидинилметил, пиразинилметил, 1,3,5-, 1,2,4- и 1,2,3-триазинилметил, 1,2,4-, 1,3,2-, 1,3,6- и 1,2,6-оксазинилметил, оксепинилметил, тиепинилметил и 1,2,4-диазепинилметил.
Соединения согласно настоящему изобретению могут существовать в предпочтительных вариантах выполнения. При этом отдельные описанные в настоящей заявке варианты выполнения могут комбинироваться друг с другом. Не охватываются такие комбинации, которые противоречат законам природы и которые специалист в данной области техники исключил бы на основании своих знаний. Например, исключены кольцевые структуры с тремя или более соседними атомами кислорода.
Варианты выполнения соединений согласно настоящему изобретению
Специалисту в данной области техники очевидно, что все варианты выполнения настоящего изобретения могут существовать сами по себе или в комбинации.
Соединения формулы (I), наиболее предпочтительно соединения формул (Ia), (Ib), (I-T2), (I-T3), (I-T4), (I-T22) и (I-T23), могут в зависимости от вида заместителя находиться при необходимости в виде соли, таутомера, геометрического и/или оптически активного изомера или соответствующих изомерных смесей с разным составом.
Соединения согласно настоящему изобретению могут находиться в различных полиморфных формах или в виде смесей различных полиморфных форм. Как чистые полиморфы, так и смеси полиморфов являются объектом настоящего изобретения и могут применяться согласно настоящему изобретению.
Далее подробно описываются варианты выполнения соединений формулы (I):

в которой
R1 представляет собой Н, в каждом случае необязательно замещенный C2-C6-алкенил, C2-C6-алкинил, C3-C7-циклоалкил, C1-C6-алкилкарбонил, C1-C6-алкоксикарбонил, арил(C1-C3)-алкил, гетероарил(C1-C3)-алкил или представляет собой необязательно замещенный C1-C6-алкил, предпочтительно представляет собой Н или предпочтительно представляет собой C1-C2-алкил, особенно предпочтительно представляет собой Н или представляет собой метил,
группы
A1 представляет собой CR2 или N,
A2 представляет собой CR3 или N,
A3 представляет собой CR4 или N,
A4 представляет собой CR5 или N,
B1 представляет собой CR6 или N,
B2 представляет собой CR7 или N,
B3 представляет собой CR8 или N,
B4 представляет собой CR9 или N, и
B5 представляет собой CR10 или N,
причем не более трех из групп A1-A4 представляют собой N, и не более трех из групп B1-B5 представляют собой N;
R2, R3, R4, R5, R6, R7, R9 и R10 независимо друг от друга представляет собой Н, галоген, циано, нитро, в каждом случае необязательно замещенный C1-C6-Алкил, C3-C6-циклоалкил, C1-C6-алкокси, N-C1-C6-алкокси-имино-C1-C3-алкил, C1-C6-алкилсульфанил, C1-C6-алкилсульфинил, C1-C6-алкилсульфонил, N-C1-C6-алкиламино, N,N-ди-C1-C6-алкиламино или N-C1-C3-алкокси-C1-C4-алкиламино или 1-пирролидинил;
когда ни одна из групп A2 и A3 не представляет собой N, R3 и R4 могут образовывать вместе с атомом углерода, с которым они связаны, 5- или 6-членное кольцо, содержащее 0, 1 или 2 атома N и/или 0 или 1 атом О и/или 0 или 1 атом S, или
когда ни одна из групп A1 и A2 не представляет собой N, R2 и R3 могут образовывать вместе с атомом углерода, с которым они связаны, 6-членное кольцо, содержащее 0,1 или 2 атома N;
R8 представляет собой галоген, циано, нитро, в каждом случае необязательно замещенный C1-C6-алкил, C3-C6-циклоалкил, C1-C6-алкокси, N-C1-C6-алкокси-имино-C1-C3-алкил, C1-C6-алкилсульфанил, C1-C6-алкилсульфинил, C1-C6-алкилсульфонил, N-C1-C6-алкиламино или N,N-ди-C1-C6-алкиламино;
W представляет собой О или S;
Q представляет собой Н, формил, гидрокси, амино или в каждом случае необязательно замещенный C1-C6-алкил, C2-C6-алкенил, C2-C6-алкинил, C3-C6-циклоалкил, C1-C5-гетероциклоалкил, C1-C4-алкокси, C1-C6-алкил-C3-C6-циклоалкил, C3-C6-циклоалкил-C1-C6-алкил, C6-,C10-,C14-арил, C1-C5-гетероарил, C6-,C10-,C14-арил-C1-C3-алкил, C1-C5-гетероарил-C1-C3-алкил, N-C1-C4-алкиламино, N-C1-C4-алкилкарбониламино, или N,N-ди-C1-C4-алкиламино; или
представляет собой необязательно многократно замещенный заместителями V ненасыщенный 6-членный карбоцикл; или
представляет собой необязательно многократно замещенное заместителями V ненасыщенное 4-, 5- или 6-членное гетероциклическое кольцо, причем
V независимо друг от друга представляет собой галоген, циано, нитро, в каждом случае необязательно замещенный C1-C6-алкил, C1-C4-алкенил, C1-C4-алкинил, C3-C6-циклоалкил, C1-C6-алкокси, N-C1-C6-алкокси-имино-C1-C3-алкил, C1-C6-алкилсульфанил, C1-C6-алкилсульфинил, C1-C6-алкилсульфонил, или N,N-ди-(C1-C6-алкил)амино;
Т представляет собой необязательно замещенное 5-членное гетероароматическое соединение, содержащее, самое большее, 2 гетероатома, как например четыре атома С и один (1) гетероатом, предпочтительно один (1) N-, один (1) O- или один (1) S-атом, или три атома С и два гетероатома, предпочтительно два атома N, один (1) N- и один (1) O-, или один (1) N- и один (1) S-атом.
а также соли, N-оксиды и таутомерные формы соединения формулы (I).
R1
В одном предпочтительном варианте выполнения настоящего изобретения R1 в соединении формулы (I) представляет собой Н, в каждом случае необязательно замещенный метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, метоксиметил, этоксиметил, пропоксиметил, метилкарбонил, этилкарбонил, н-пропилкарбонил, изопропилкарбонил, втор-бутилкарбонил, трет-бутилкарбонил, метоксикарбонил, этоксикарбонил, н-пропоксикарбонил, изопропоксикарбонил, втор-бутоксикарбонил, трет-бутоксикарбонил, цианометил, 2-цианоэтил, бензил, 4-метоксибензил, пирид-2-ил-метил, пирид-3-ил-метил, пи-рид-4-ил-метил, 4-хлор-пирид-3-ил-метил.
В еще одном предпочтительном варианте выполнения настоящего изобретения R1 представляет собой Н.
W
В другом предпочтительном варианте выполнения настоящего изобретения W представляет собой О.
Q
В другом предпочтительном варианте выполнения настоящего изобретения Q представляет собой Н, в каждом случае необязательно замещенный метил, этил, н-пропил, 1-метилэтил, 1,1-диметилэтил, 1-метилпропил, н-бутил, 2-метилпропил, 2-метилбутил, гидроксиметил, 2-гидроксипропил, цианометил, 2-цианоэтил, 2-фторэтил, 2,2-дифторэтил, 2,2,2-трифторэтил, 1-трифторметилэтил, 2,2-дифторпропил, 3,3,3-трифторпропил, 2,2-диметил-3-фторпропил, циклопропил, 1-циано-циклопропил, 1-метоксикарбонил-циклопропил, 1-(N-метилкарбамоил)циклопропил, 1-(N-циклопропилкарбамоил)циклопропил, 1-(тиокарбамоил)циклопропил, циклопропил-метил, циклобутил, циклопентил, циклогексил, 1-циклопропилэтил, бис(циклопропил)метил, 2,2-диметилциклопропил-метил, 2-фенилциклопропил, 2,2-дихлорциклопропил, транс-2-хлорциклопропил, цис-2-хлорциклопропил, 2,2-дифторциклопропил, транс-2-фторциклопропил, цис-2-фторциклопропил, транс-4-гидроксициклогексил, 4-трифторметилциклогексил, проп-2-енил, 2-метилпроп-2-енил, проп-2-инил, 1,1-диметилбут-2-инил, 3-хлор-проп-2-енил„ 3,3-дихлор-проп-2-енил, 3,3-дихлор-1,1-диметилпроп-2-енил, фенил, 2-хлорфенил, 3-хлорфенил, 4-хлорфенил, оксетан-3-ил, тиетан-3-ил, 1-оксидо-тиетан-3-ил, 1,1-диоксидотиетан-3-ил, изоксазол-3-илметил, 2-оксо-2-(2,2,2-трифтороэтиламино)этил, 1,2,4-триазол-3-илметил, 3-метилоксетан-3-илметил, бензил, 2,6-дифторфенилметил, 3-фторфенилметил, 2-фторфенилметил, 2,5-дифторфенилметил, 1-фенилэтил, 4-хлорфенилэтил, 2-трифторметилфенилэтил, 1-пиридин-2-илэтил, пиридин-2-илметил, 5-фторпиридин-2-илметил, (6-хлор-пиридин-3-ил)метил, пиримидин-2-илметил, метокси, 2-этоксиэтил, 2-(метилсульфанил)этил, 1-метил-2-(этилсульфанил)этил, 2-метил-1-(метилсульфанил)пропан-2-ил, метоксикарбонил, метоксикарбонилметил, NH2, N-этиламино, N-аллиламино, N,N-диметиламино, N,N-диэталамино; или
Q представляет собой замещенный 0-4 заместителями V фенил, нафтил, пиридазин, пиразин, пиримидин, триазин, пиридин, пиразол, тиазол, изотиазол, оксазол, изоксазол, триазол, имидазол, фуран, тиофен, пиррол, оксадиазол, тиадиазол, причем
V независимо друг от друга представляет собой F, Cl, Br, I, циано, нитро, метил, этил, дифторметил, трихлорметил, хлордифторметил, дихлорфторметил, трифторметил, хлорметил, бромметил, 1-фторэтил, 2-фторэтил, 2,2-дифторэтил, 2,2,2-трифторэтил, 1,2,2,2-тетрафторэтил, 1-хлор-1,2,2,2-тетрафторэтил, 2,2,2-трихлорэтил, 2-хлор-2,2-дифторэтил, 1,1-дифторэтил, пентафторэтил, гептафтор-н-пропил, гептафтор-изопропил, нонафтор-н-бутил, циклопропил, циклобутил, метокси, этокси, н-пропокси, 1-метилэтокси, фторметокси, дифторметокси, хлор-дифторметокси, дихлор-фторметокси, трифторметокси, 2,2,2-трифторэтокси, 2-хлор-2,2-дифторэтокси, пентафторэтокси, N-метоксииминометил, 1-(N-метоксиимино)-этил, метилсульфанил, метилсульфонил, метилсульфинил, трифторметилсульфонил, трифторметилсульфинил, трифторметилсульфанил, диметиламино.
В другом предпочтительном варианте выполнения настоящего изобретения Q представляет собой необязательно замещенный C1-C4-алкил или необязательно замещенный C3-C6-циклоалкил или представляет собой необязательно замещенное одним, двумя или тремя заместителями V ненасыщенное 4-, 5- или 6-членное гетероциклическое кольцо, причем V независимо друг от друга представляют собой галоген, циано, нитро, оксо (=O), необязательно замещенный галогеном C1-C6-алкил, C1-C4-алкенил, C1-C6-алкокси, C1-C6-алкилсульфанил, C1-C6-алкилсульфинил, C1-C6-алкилсульфонил. Предпочтительно Q представляет собой замещенный галогеном C1-C3-Алкил; замещенный циано, гидрокси или карбамидом (-C(=O)N(R)2, причем R независимо друг от друга представляют собой Н или C1-C3-алкил, C1-C3-алкил; C3-циклоалкил; замещенный циано, галогеном, нитро или галогенированным C1-C2-алкилом C3-циклоалкил; необязательно замещенное одним, двумя, или тремя заместителями V ненасыщенное 4-, 5- или 6-членное гетероциклическое кольцо, содержащее один или два гетероатома, выбранные из группы, состоящей из N, О и S, причем V независимо друг от друга представляют собой галоген, циано, нитро, оксо (=O), необязательно замещенный галогеном C1-C6-алкил. Особенно предпочтительно Q представляет собой фторированный C1-C3-алкил, такой как CF3, CH2CF3 или CH2CH2CF3; замещенный карбамидом (-C(=O)N(R)2, причем R независимо друг от друга представляет собой Н, C1-C3-алкил или замещенный галогеном C1-C3-алкил, замещенный C1-C3-алкил, такой как 2-оксо-2-(2,2,2-трифтороэтиламино)этил; циклопропил; замещенный циано или фторированным C1-C2-алкилом циклопропил, такой как 1-(циано)циклопропил или 1-(трифторметил)циклопропил); 4-членное гетероциклическое кольцо, содержащее гетероатом, выбранный из группы, состоящей из N, О или S, как например тиетан-3-ил.
В более предпочтительном варианте выполнения настоящего изобретения Q представляет собой замещенный фтором C1-C4-алкил, такой как 2,2,2-трифторэтил, 2,2-дифторэтил, 3,3,3-трифторпропил; C3-C4-циклоалкил, такой как циклопропил или циклобутил; необязательно замещенный C3-C4-циклоалкил, такой как 1-трифторметил-циклопропил, 1-трет-бутил-циклопропил, 1-тиокарбамоил-циклопропил, 1-циано-циклопропил, транс-2-фторциклопропил, цис-2-фторциклопропил; C4-С6-гетероциклоалкил, как например оксетан-3-ил, тиетан-3-ил, 1-оксидо-тиетан-3-ил, или 1,1-диоксидо-тиетан-3-ил; бензил; пири-дин-2-илметил; метилсульфонил; или 2-оксо-2-(2,2,2-трифтороэтиламино)этил.
В особенно предпочтительном варианте выполнения настоящего изобретения Q представляет собой замещенный фтором C1-C3-алкил, такой как 2,2,2-трифтороэтил или 3,3,3-трифторопропил; циклопропил; необязательно замещенный циклопропил, такой как 1-циано-циклопропил или 1-трифторметил-циклопропил, тиетан-3-ил; или 2-оксо-2-(2,2,2-трифторэтил)аминоэтил.
А1-A4
В одном предпочтительном варианте выполнения настоящего изобретения, самое большее, одна (1) группа A1-A4 представляет собой N (другими словами: одна (1) группа A1-A4 (предпочтительно A2) представляет собой N); или ни одна из групп (0) A1-A4 не представляет собой N (другими словами: A1-A4 представляет собой CR2, CR3, CR4, и CR5); или одна или две группы, выбранные из A1, A2, A3, A4, могут представлять собой N, и, самое большее, одна группа, выбранная из B1, B2, B3, B4, и B5, представляет собой N.
В другом предпочтительном варианте выполнения настоящего изобретения R2, R3, R4, и R5 (когда соответствующая группа А представляет собой CR) в соединении формулы (I) независимо друг от друга представляют собой Н, галоген, циано, нитро, в каждом случае необязательно замещенный C1-C4-алкил, C3-C4-циклоалкил, C1-C4-алкокси, N-C1-C4-алкоксиимино-C1-C4-алкил, C1-C4-алкилсульфанил, C1-C4-алкилсульфинил, C1-C4-алкилсульфонил, N-C1-C4-алкиламино, N,N-ди-C1-C4-алкиламино или N-C1-C3-алкокси-C1-C4-алкиламино или 1-пирролидинил.
В другом предпочтительном варианте выполнения настоящего изобретения R2 и R5 независимо друг от друга представляют собой Н, метил, F и Cl.
В другом предпочтительном варианте выполнения настоящего изобретения R3 и R4 независимо друг от друга представляют собой Н, F, Cl, Br, I, циано, нитро, метил, этил, фторметил, дифторметил, хлордифторметил, трифторметил, 2,2,2-трифторэтил, метокси, этокси, н-пропокси, 1-метилэтокси, фторметокси, дифторметокси, хлор-дифторметокси, дихлор-фторметокси, трифторметокси, 2,2,2-трифторэтокси, 2-хлор-2,2-дифторэтокси, пентафторэтокси, N-метоксииминометил, 1-(N-метоксиимино)-этил, метилсульфанил, трифторметил сульфанил, метилсульфонил, метилсульфинил, трифторметилсульфонил, трифторметилсульфинил.
В1-B5
В одном предпочтительном варианте выполнения настоящего изобретения, самое большее, одна (1) группа B1-B5 представляет собой N (другими словами: одна (1) группа B1-B5 представляет собой N); или ни одна из групп (0) B1-B5 не представляет собой N (B1-B5 представляет собой CR6, CR7, CR8, CR9 и CR10).
В другом предпочтительном варианте выполнения настоящего изобретения R6, R7, R9 и R10 (когда соответствующая группа В представляет собой CR) независимо друг от друга представляет собой Н, галоген, циано, нитро, в каждом случае необязательно замещенный C1-C4-алкил, C3-C4-циклоалкил, C1-C4-алкокси, N-алкоксииминоалкил, C1-C4-алкилсульфанил, C1-C4-алкилсульфинил, C1-C4-алкилсульфонил, N-C1-C4-алкиламино, N,N-ди-C1-C4-алкиламино.
В другом предпочтительном варианте выполнения настоящего изобретения R6, R7, R9 и R10 независимо друг от друга представляют собой Н, галоген, циано, нитро, метил, этил, фторметил, дифторметил, хлордифторметил, трифторметил, 2,2,2-трифторэтил, метокси, этокси, н-пропокси, 1-метилэтокси, фторметокси, дифторметокси, хлор-дифторметокси, дихлор-фторметокси, трифторметокси, 2,2,2-трифторэтокси, 2-хлор-2,2-дифторэтокси, пентафторэтокси, N-метоксииминометил, 1-(N-метоксиимино)-этил, метилсульфанил, трифторметилсульфанил, метилсульфонил, метилсульфинил, трифторметилсульфонил, трифторметилсульфинил.
В другом предпочтительном варианте выполнения настоящего изобретения R6 и R10 независимо друг от друга представляют собой Н, галоген (наиболее предпочтительно хлор, бром, фтор), циано, нитро, метил, этил, дифторметил, хлордифторметил, трифторметил, метокси, этокси, 1-метилэтокси, дифторметокси, хлор-дифторметокси, дихлор-фторметокси, трифторметокси, 2,2,2-трифторэтокси, 2-хлор-2,2-дифторэтокси, метилсульфанил, трифторметилсульфанил, метилсульфонил, метилсульфинил, трифторметилсульфонил, трифторметилсульфинил.
В другом предпочтительном варианте выполнения настоящего изобретения R6 и R10 представляют собой описанные в настоящей заявке заместители, однако R6 и R10 не одновременно в одном соединении представляют собой Н. Другими словами, когда R6 в соединении представляет собой Н, R10 представляет один из других описанных в настоящей заявке заместителей, и наоборот.
В другом предпочтительном варианте выполнения настоящего изобретения R6 и R10 в каждом случае представляет собой заместитель, выбранный из галогена (предпочтительно Cl, Br или F), C1-C3-алкила, замещенного галогеном C1-C3-алкила, C1-C3-алкокси или замещенного галогеном C1-C3-алкокси.
В другом предпочтительном варианте выполнения настоящего изобретения R6 и R10 в каждом случае представляет собой галоген (как например, Cl, Br или F), в каждом случае представляет собой C1-C3-алкил, или в каждом случае представляет собой замещенный галогеном C1-C3-алкил, такой как, например, перфторированный C1-C3-алкил (перфторметил, перфторэтил или перфторпропил).
В другом предпочтительном варианте выполнения настоящего изобретения R6 представляет собой перфторированный C1-C3-алкил (например, перфторметил), и R10 представляет собой Cl, Br или F, особенно предпочтительно представляет собой Cl или Br.
R8
В одном особенно предпочтительном варианте выполнения настоящего изобретения В3 представляет собой C-R8, где R8 представляет собой галоген, циано, нитро, замещенный галогеном C1-C4-алкил, C3-C4-циклоалкил, C1-C4-алкокси, N-C1-C4-алкоксиимино-C1-C4-алкил, C1-C4-алкилсульфанил, C1-C4-алкилсульфинил, C1-C4-алкилсульфонил, N-C1-C4-алкиламино, или N,N-ди-C1-C4-алкиламино.
В другом предпочтительном варианте выполнения настоящего изобретения R8 представляет собой галоген, такой как фтор, хлор, бром, иод или замещенный галогеном C1-C4-алкил, циано, нитро, метил, этил, дифторметил, трихлорметил, хлордифторметил, дихлорфторметил, трифторметил, хлорметил, бромметил, 1-фторэтил, 2-фторэтил, 2,2-дифторэтил, 2,2,2-трифторэтил, 1,2,2,2-тетрафторэтил, 1-хлор-1,2,2,2-тетрафторэтил, 2,2,2-трихлорэтил, 2-хлор-2,2-дифторэтил, 1,1-дифторэтил, пентафторэтил, пентафтор-трет-бутил, гептафтор-н-пропил, гептафтор-изопропил, нонафтор-н-бутил, нонафтор-втор-бутил, циклопропил, циклобутил, метокси, этокси, н-пропокси, 1-метилэтокси, фторметокси, дифторметокси, хлор-дифторметокси, дихлор-фторметокси, трифторметокси, 2,2,2-трифторэтокси, 2-хлор-2,2-дифторэтокси, пентафторэтокси, N-метоксииминометил, 1-(N-метоксиимино)-этил, метилсульфанил, метилсульфонил, метилсульфинил, трифторметилсульфонил, трифторметилсульфинил, трифторметилсульфанил, N,N-диметиламино.
В более предпочтительном варианте выполнения настоящего изобретения R8 представляет собой дифторметил, трихлорметил, хлордифторметил, дихлорфторметил, трифторметил, 1-фторэтил, 2-фторэтил, 2,2-дифторэтил, 2,2,2-трифторэтил, 1,2,2,2-тетрафторэтил, 1-хлор-1,2,2,2-тетрафторэтил, 2,2,2-трихлорэтил, 2-хлор-2,2-дифторэтил, 1,1-дифторэтил, пентафторэтил, пентафтор-трет-бутил, гептафтор-н-пропил, гептафтор-изопропил, нонафтор-н-бутил, нонафтор-втор-бутил, фторметокси, дифторметокси, хлор-дифторметокси, дихлор-фторметокси, трифторметокси, 2,2,2-трифторэтокси, 2-хлор-2,2-дифторэтокси, пентафторэтокси, трифторметилсульфонил, трифторметилсульфинил, трифторметилсульфанил.
В более предпочтительном варианте выполнения настоящего изобретения R8 представляет собой замещенный галогеном C1-C3-алкил (предпочтительно перфторированный C1-C3-алкил (CF3, C2F5 или C3F7)) или замещенный галогеном алкокси (предпочтительно перфторированный C1-C3-алкокси (OCF3, OC2F5 или OC3F7)).
В особенно предпочтительном варианте выполнения настоящего изобретения R8 представляет собой перфторированный C1-C3-алкил, такой как перфторированный н- или изо-пропил (-C3F7), перфторированный этил (C2F5) или перфторированный метил (CF3), особенно предпочтительно перфторированный н- или изо-пропил (-C3F7) или перфорированный метил.
А и В
В другом предпочтительном варианте выполнения настоящего изобретения группы A1-A4 и B1-B5 в соединениях формулы (I) представляют собой
A1 С-Н,
A2 CR3 или N,
A3 CR4,
A4 CR5 или N,
B1 CR6 или N,
B2 CR7,
B3 CR8,
B4 CR9 и
B5 CR10 или N.
В еще одном предпочтительном варианте выполнения настоящего изобретения группы A1-A4 и B1-B5 в соединениях формулы (I) представляют собой
А1 С-Н,
A2 CR3 или N,
A3 CR4,
A4 С-Н,
B1 CR6 или N,
B2 С-Н,
B3 CR8,
B4 С-Н и
B5 CR10 или N.
В еще одном предпочтительном варианте выполнения настоящего изобретения группы A1-A4 и B1-B5 в соединениях формулы (I) представляют собой
А1 С-Н,
A2 CR3 или N,
A3 CR4,
A4 С-Н или N,
B1 CR6,
B2 С-Н,
B3 CR8,
B4 С-Н и
B5 CR10 или N.
T
В другом предпочтительном варианте выполнения настоящего изобретения Т представляет собой одно из следующих указанных 5-членных гетероароматических соединений, причем связь с С-атомом (С-B1-B5)-кольцевой системы обозначена пунктирной линией со стрелкой, и связь с С-атомом (С-А1-A2-A3-С-A4)-кольцевой системы обозначена пунктирной линией,






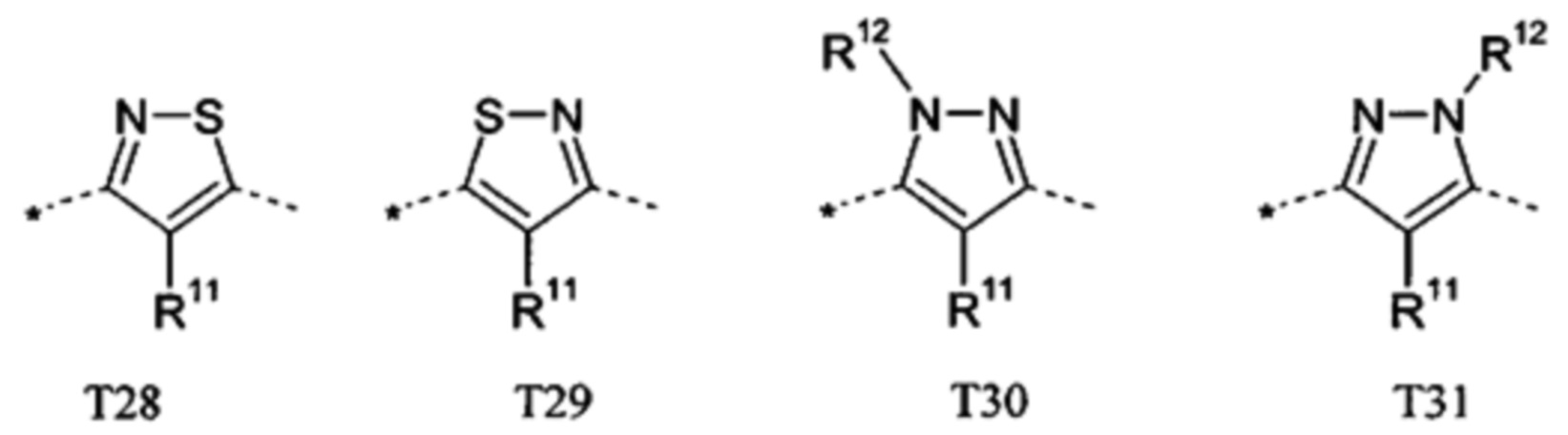

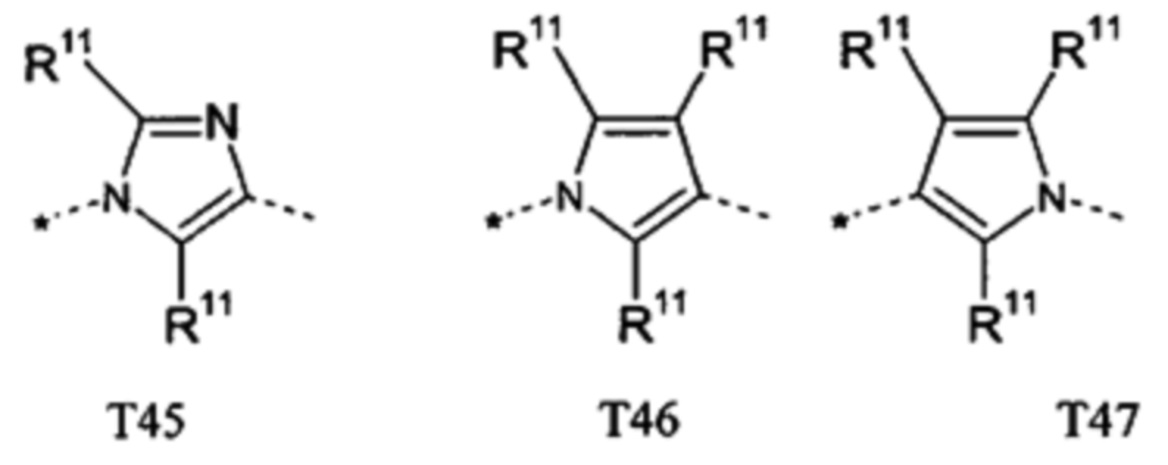
причем
R11 независимо друг от друга представляет собой Н, галоген, циано, нитро, амино или необязательно замещенный C1-C6-алкил, C1-C6-алкилокси, C1-C6-алкилкарбонил, C1-C6-алкилсульфанил, C1-C6-алкилсульфинил, C1-C6-алкилсульфонил, предпочтительно представляет собой Н; и
R12 представляет собой Н, галоген, циано, нитро, амино или необязательно замещенный C1-C6-алкил, C1-C6-алкилокси, C1-C6-алкилкарбонил, C1-C6-алкилсульфанил, C1-C6-алкилсульфинил, C1-C6-алкилсульфонил, предпочтительно представляет собой Н или метил.
В другом предпочтительном варианте выполнения настоящего изобретения R11 независимо друг от друга представляет собой галоген, циано, нитро, амино, метил, этил, 1-метилэтил, трет-бутил, трифторметил, дифторметил, меток-си, этокси, трифторметокси, 2,2-дифторэтокси, 2,2,2-трифторэтокси, метилкарбонил, этилкарбонил, трифторметилкарбонил, метилсульфанил, метилсульфинил, метилсульфонил, трифторметилсульфонил, трифторметилсульфанил, или трифторметилсульфинил.
В более предпочтительном варианте выполнения настоящего изобретения R11 независимо друг от друга представляет собой Н, метил, этил, 2-метилэтил, 2,2-диметилэтил, фтор, хлор, бром, иод, нитро, трифторметил, или амино.
В другом предпочтительном варианте выполнения настоящего изобретения Т представляет собой одно из следующих указанных 5-членных гетероароматических соединений, причем связь с С-атомом (С-В1-B5)-кольцевой системы обозначена пунктирной линией со стрелкой, и связь с С-атомом (С-А1-A2-A3-С-A4)-кольцевой системы обозначена пунктирной линией,




причем R11 независимо друг от друга имеют значения, как описано в настоящей заявке.
В более предпочтительном варианте выполнения настоящего изобретения Т представляет собой одно из следующих указанных 5-членных гетероароматических соединений, причем связь с С-атомом (С-В1-B5)-кольцевой системы обозначена пунктирной линией со стрелкой, и связь с С-атомом (С-А1-A2-A3-С-A4)-кольцевой системы обозначена пунктирной линией,



причем R11 имеют значения, как описано в настоящей заявке, и n равно 1 или 2.
В особенно предпочтительном варианте выполнения настоящего изобретения Т представляет собой одно из следующих указанных 5-членных гетероароматических соединений, причем связь с С-атомом (С-B1-B5)-кольцевой системы обозначена пунктирной линией со стрелкой, и связь с С-атомом (С-А1-A2-A3-С-A4)-кольцевой системы обозначена пунктирной линией,


причем R11 независимо друг от друга имеют значения, как описано в настоящей заявке.
В другом особенно предпочтительном варианте выполнения настоящего изобретения Т представляет собой одно из следующих указанных 5-членных гетероароматических соединений, причем связь с С-атомом (С-В1-B5)-кольцевой системы обозначена пунктирной линией со стрелкой, и связь с С-атомом (С-А1-A2-A3-С-А4)-кольцевой системы обозначена пунктирной линией,

причем R11 независимо друг от друга имеют значения, как описано в настоящей заявке.
В еще одном предпочтительном варианте выполнения настоящего изобретения в формуле (I) и в других приведенных в настоящей заявке общих формулах
A1 представляет собой C-R2 или N, предпочтительно представляет собой С-R2,
A2 представляет собой CR3 или N,
A3 представляет собой CR4,
A4 представляет собой C-R5 или N,
B1 представляет собой CR6,
B2 представляет собой С-Н,
B3 представляет собой CR8,
B4 представляет собой С-Н,
B5 представляет собой CR10 или N,
R1 представляет собой водород,
R2 представляет собой водород, C1-C3-алкил, фтор или хлор, предпочтительно представляет собой Н,
R3 представляет собой водород или замещенный галогеном C1-C3-алкил (предпочтительно перфторированный C1-C3-алкил (CF3, C2F5 или C3F7)),
R4 представляет собой водород, хлор, фтор, C1-C3-алкил (такой как -CH3), циклопропил, C1-C3-алкокси (такой как -О-СН3), N-C1-C4-алкиламино (-NH-C1-C3-алкил, такой как -NH-CH3), C3-циклоалкиламино (такой как -NH-C3H5), N-C1-C3-алкокси-C1-C3-алкиламино (такой как -NH-C2H4-O-CH3) или 1-пирролидинил, особенно предпочтительно хлор,
R5 представляет собой водород или фтор, предпочтительно Н,
R6 и R10 независимо друг от друга представляют собой водород, C1-C3-алкил (предпочтительно R6 и R10 представляют собой C1-C3-алкил), C1-C3-алкокси, замещенный галогеном C1-C3-алкил (предпочтительно перфторированный C1-C3-алкил (CF3, C2F5 или C3F7)), замещенный галогеном C1-C3-алкокси (предпочтительно перфторированный C1-C3-алкокси (OCF3, OC2F5 или OC3F7)), C1-C3-алкилсульфанил, C1-C3-алкилсульфинил, C1-C3-алкилсульфонил, фтор, бром или хлор (предпочтительно R6 и R10 представляют собой хлор),
R8 представляет собой замещенный галогеном C1-C3-алкил (предпочтительно перфторированный C1-C3-алкил (CF3, C2F5 или C3F7)) или замещенный галогеном C1-C3-алкокси (предпочтительно перфторированный C1-C3-алкокси (OCF3, OC2F5 или OC3F7)),
R11 представляет собой водород, циано (CN) или амино (NH2),
W представляет собой кислород или серу, предпочтительно представляет собой кислород,
Q представляет собой C1-C3-алкил, циклопропил, 1-(циано)-циклопропил, 1-(перфторированный C1-C3-алкил)-циклопропил (такой как (1-(трифторметил)-циклопропил), 1-(C1-C4-алкил)-циклопропил (такой как 1-(трет-бутил)-циклопропил), 1-(тиокарбамоил)-циклопропил, замещенный галогеном C1-C3-алкил (например, CH2CF3, CH2CH2CF3), тиетан-3-ил, N-метил-пиразол-3-ил, 2-оксо-2(2,2,2-трифторэтиламино)этил, и
Т представляет собой Т, выбранный из группы, состоящей из T1-Т47, предпочтительно представляет собой Т2, Т3, Т4, Т22 или Т23 (особенно предпочтительно представляет собой Т22 или Т23).
В еще одном предпочтительном варианте выполнения настоящего изобретения в формуле (I) и в других приведенных в настоящей заявке общих формулах
A1 представляет собой C-R2 или N, предпочтительно представляет собой С-R2,
A2 представляет собой CR3 или N,
A3 представляет собой CR4,
A4 представляет собой C-R5 или N,
B1 представляет собой CR6,
B2 представляет собой С-Н,
B3 представляет собой CR8,
B4 представляет собой С-Н,
B5 представляет собой CR10 или N,
R1 представляет собой C1-С2-алкил (метил или этил, особенно предпочтительно представляет собой метил),
R2 представляет собой водород, C1-C3-алкил, фтор или хлор, предпочтительно представляет собой Н,
R3 представляет собой водород или замещенный галогеном C1-C3-алкил (предпочтительно перфторированный C1-C3-алкил (CF3, C2F5 или C3F7)),
R4 представляет собой водород, хлор, фтор, C1-C3-алкил (такой как -СН3), циклопропил, C1-C3-алкокси (такой как -O-СН3), N-C1-C4-алкиламино (-NH-C1-C3-алкил, такой как -NH-СН3), C3-циклоалкиламино (такой как -NH-C3H5), N-C1-C3-алкокси-C1-C3-алкиламино (такой как -NH-C2H4-O-CH3) или 1-пирролидинил, особенно предпочтительно хлор,
R5 представляет собой водород или фтор, предпочтительно Н,
R6 и R10 независимо друг от друга представляет собой водород, C1-C3-алкил (предпочтительно R6 и R10 представляют собой C1-C3-алкил), C1-C3-алкокси, замещенный галогеном C1-C3-алкил (предпочтительно перфторированный C1-C3-алкил (CF3, C2F5 или C3F7)), замещенный галогеном C1-C3-алкокси (предпочтительно перфторированный C1-C3-алкокси (OCF3, OC2F5 или OC3F7)), C1-C3-алкилсульфанил, C1-C3-алкилсульфинил, C1-C3-алкилсульфонил, фтор, бром или хлор (предпочтительно R6 и R10 представляют собой хлор),
R8 представляет собой замещенный галогеном C1-C3-алкил (предпочтительно перфторированный C1-C3-алкил (CF3, C2F5 или C3F7)) или замещенный галогеном C1-C3-алкокси (предпочтительно перфторированный C1-C3-алкокси (OCF3, OC2F5 или OC3F7)),
R11 представляет собой водород, циано (CN) или амино (NH2),
W представляет собой кислород или серу, предпочтительно представляет собой кислород,
Q представляет собой C1-C3-алкил, циклопропил, 1-(циано)-циклопропил, 1-(перфторированный C1-C3-алкил)-циклопропил (такой как (1-(трифторметил)-циклопропил), 1-(C1-C4-алкил)-циклопропил (такой как 1-(трет-бутил)-циклопропил), 1-(тиокарбамоил)-циклопропил, замещенный галогеном C1-C3-алкил (например, CH2CF3, CH2CH2CF3), тиетан-3-ил, N-метил-пиразол-3-ил, 2-оксо-2(2,2,2-трифторэтиламино)этил, и
Т представляет собой Т, выбранный из группы, состоящей из T1-Т47, предпочтительно представляет собой Т2, Т3, Т4, Т22 или Т23 (особенно предпочтительно представляет собой Т22 или Т23).
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (Ia)

в которой
R1, R11, Q, W, A1, A2, A3, А4, B1, B2, B3, B4, и B5 имеют значения, как определено в настоящей заявке, причем, самое большее, одна группа, выбранная из A1, A2, A3, A4, представляет собой N, и, самое большее, одна группа, выбранная из B1, B2, B3, B4, и B5, представляет собой N; или причем одна или две группы, выбранные из A1, A2, A3, A4, могут представлять собой N, и, самое большее, одна группа, выбранная из B1, B2, B3, B4, и B5, представляет собой N; и
D1 и D2 в каждом случае независимо друг от друга представляют собой C-R11 или гетероатом, предпочтительно представляет собой C-R11 или гетероатом, выбранный из N, О или S, особенно предпочтительно представляет собой С-R11 или гетероатом, выбранный из N или О;
группы D3 и D4 независимо друг от друга представляют собой С или гетероатом, выбранный из N;
причем одна (1) или две группы, выбранные из D1, D2, D3 и D4, представляют собой гетероатом;

Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (Ia')

в которой,
R1, R11, Q, W, A1, A2, A3, A4, B1, B2, B4, и B5 имеют значения, как определено в настоящей заявке, причем, самое большее, одна группа, выбранная из A1, A2, A3, A4, представляет собой N, и, самое большее, одна группа, выбранная из B1, B2, B3, B4, и B5, представляет собой N; или причем одна или две группы, выбранные из A1, A2, A3, A4, могут представлять собой N, и, самое большее, одна группа, выбранная из B1, B2, B3, B4, и B5, представляет собой N;
D1 и D2 в каждом случае независимо друг от друга представляет собой C-R11 или гетероатом, предпочтительно представляет собой C-R11 или гетероатом, выбранный из N, О или S, особенно предпочтительно представляет собой С-R11 или гетероатом, выбранный из N или О;
группы D3 и D4 независимо друг от друга представляет собой С или гетероатом, выбранный из N;
причем одна (1) или две группы, выбранные из D1, D2, D3 и D4, представляют собой гетероатом; другими словами: причем, самое большее, одна (1) или две группы, выбранные из D1, D2, D3 и D4, представляет собой/представляют собой гетероатом, причем одна (1) или две группы, выбранные из D1, D2, D3 и D4, представляют собой гетероатом, выбранный из N или О, в случае D1 и D2, или N, в случае D3 и D4;

и R8 имеет значения, как определено в настоящей заявке, предпочтительно представляет собой перфторированный C1-C4-алкил.
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (Ib)

в которой R1, R2, R4, R5, R6, R7, R8, R9, R10, R11 A2, Q, D1, D2, D3 D4 и

Двумя особенно предпочтительными вариантами выполнения настоящего изобретения являются соединения формул (Ib) и (Id), в которых D1 представляет собой N, D2 представляет собой О, и D3 и D4 представляют собой С; или D1 представляет собой C-R13, D2 представляет собой N, и D3 представляет собой N, и D4 представляет собой С, причем R13 представляет собой Н, галоген, циано, нитро, амино или необязательно замещенный C1-C6-алкил, C1-C6-алкилокси, C1-C6-алкилкарбонил, C1-C6-алкилсульфанил, C1-C6-алкилсульфинил, C1-C6-алкилсульфонил, предпочтительно представляет собой Н или галоген, как например F, Cl, Br или I, и особенно предпочтительно представляет собой Н; и R1 предпочтительно представляет собой Н, или R1 предпочтительно представляет собой метил.
Другим особенно предпочтительным вариантом выполнения настоящего изобретения являются соединения формул (Ib) и (Id), в которых D1 представляет собой О, D2 представляет собой N, и D3 и D4 представляют собой С; причем R13 представляет собой Н, галоген, циано, нитро, амино или необязательно замещенный C1-C6-алкил, C1-C6-алкилокси, C1-C6-алкилкарбонил, C1-C6-алкилсульфанил, C1-C6-алкилсульфинил, C1-C6-алкилсульфонил, предпочтительно представляет собой Н или галоген, такой как F, Cl, Br или I, и особенно предпочтительно представляет собой Н; и R1 предпочтительно представляет собой Н, или R1 предпочтительно представляет собой метил.
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (Ic)

в которой R1, R2, R4, R5, R6, R7, R8, R9, R10, R11, A2, и Q имеют значения, как определено в настоящей заявке, и

D5 представляет собой N или C-R11;
при условии, что самое большее, две группы, выбранные из D4, D5 и D6, представляют собой N.
Предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (Ic), в которой D4 представляет собой N, и D5 и D6 в каждом случае представляют собой C-R11; где D6 представляет собой N, и D5 и D4 в каждом случае представляют собой C-R11; или где D4 и D5 в каждом случае представляют собой N, и D6 представляет собой C-R11.
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (Id)

причем R1, R11, Q, W, A1, A2, A3, A4, B1, B2, B3, B4, и B5, D1, D2, D3 и D4, а также

Особенно предпочтительным вариантом выполнения настоящего изобретения являются соединения формул (Ia), (Ib), (Ic) или (Id), в которых R8 представляет собой C1-C6-алкил, замещенный галогеном C1-C6-алкил, C3-C6-циклоалкил, замещенный галогеном C3-C6-циклоалкил, C1-C6-алкокси, замещенный галогеном C1-C6-алкокси, N-алкоксииминоалкил, замещенный галогеном C1-C6-алкилсульфанил, замещенный галогеном C1-C6-алкилсульфинил, замещенный галогеном C1-C6-алкилсульфонил, N-C1-C6-алкиламино, N,N-Ди-C1-C4-алкиламино, а также представляет собой галоген, циано или нитро. Примером является фтор, хлор, бром, иод, циано, нитро, метил, этил, дифторметил, трихлорметил, хлордифторметил, дихлорфторметил, трифторметил, хлорметил, бромметил, 1-фторэтил, 2-фторэтил, 2,2-дифторэтил, 2,2,2-трифторэтил, 1,2,2,2-тетрафторэтил, 1-хлор-1,2,2,2-тетрафторэтил, 2,2,2-трихлорэтил, 2-хлор-2,2-дифторэтил, 1,1-дифторэтил, пентафторэтил пентафтор-трет-бутил, гептафтор-н-пропил, гептафтор-изопропил, нонафтор-н-бутил, нонафтор-втор-бутил, циклопропил, циклобутил, метокси, этокси, н-пропокси, 1-метилэтокси, фторметокси, дифторметокси, хлор-дифторметокси, дихлор-фторметокси, трифторметокси, 2,2,2-трифторэтокси, 2-хлор-2,2-дифторэтокси, пентафторэтокси, n-метоксииминометил, 1-(n-метоксиимино)-этил, метилсульфанил, метилсульфонил, метилсульфинил, трифторметилсульфонил, трифторметилсульфинил, трифторметилсульфанил, N,N-диметиламино. Более предпочтительно R8 представляет собой замещенный галогеном C1-C4-алкил, такой как дифторметил, трихлорметил, хлордифторметил, дихлорфторметил, трифторметил, 1-фторэтил, 2-фторэтил, 2,2-дифторэтил, 2,2,2-трифторэтил, 1,2,2,2-тетрафторэтил, 1-хлор-1,2,2,2-тетрафторэтил, 2,2,2-трихлорэтил, 2-хлор-2,2-дифторэтил, 1,1-дифторэтил, пентафторэтил пентафтор-трет-бутил, гептафтор-н-пропил, гептафтор-изопропил, нонафтор-н-бутил, нонафтор-втор-бутил; замещенный галогеном C1-C4-алкокси, как например фторметокси, дифторметокси, хлор-дифторметокси, дихлор-фторметокси, трифторметокси, 2,2,2-трифторэтокси, 2-хлор-2,2-дифторэтокси, пентафторэтокси; трифторметилсульфонил; трифторметилсульфинил; или трифторметилсульфанил. еще более предпочтительно R8 представляет собой дифторметил, трихлорметил, хлордифторметил, дихлорфторметил, трифторметил, 1-фторэтил, 2-фторэтил, 2,2-дифторэтил, 2,2,2-трифторэтил, 1,2,2,2-тетрафторэтил, 1-хлор-1,2,2,2-тетрафторэтил, 2,2,2-трихлорэтил, 2-хлор-2,2-дифторэтил, 1,1-дифторэтил, пентафторэтил пентафтор-трет-бутил, гептафтор-н-пропил, гептафтор-изопропил, нонафтор-н-бутил, нонафтор-втор-бутил, фторметокси, дифторметокси, хлор-дифторметокси, дихлор-фторметокси, трифторметокси, 2,2,2-трифторэтокси, 2-хлор-2,2-дифторэтокси, пентафторэтокси, трифторметилсульфонил, трифторметилсульфинил, или трифторметилсульфанил. Особенно предпочтительно R8 в соединениях формулы (Ib) представляет собой перфторированный C1-C3-алкил, как например перфторированный пропил (-C3F7), перфторированный этил (C2F5) или перфторированный метил (CF3), особенно предпочтительно представляет собой перфторированный пропил (-C3F7) или перфторированный метил.
Особенно предпочтительными соединениями формулы (Ia) являются соединения формул (I-T2), (I-T3), (I-T4), (I-T22) и (I-T23).
Вариантом выполнения настоящего изобретения являются соединения формул (I-Т2) и (I-T4).
Другим вариантом выполнения настоящего изобретения являются соединения формулы (I-T3).
Другим вариантом выполнения настоящего изобретения являются соединения формул (I-T22) и (I-T23).
Таким образом, особенно предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I-T2). При этом предпочтительным вариантом выполнения настоящего изобретения также являются соединения формулы (I-T2), в которой R1 представляет собой Н. При этом другим предпочтительным вариантом выполнения настоящего изобретения также являются соединения формулы (I-T2), в которой R1 представляет собой метил.
Другим особенно предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I-T3). При этом предпочтительным вариантом выполнения настоящего изобретения также являются соединения формулы (I-T3), в которой R1 представляет собой Н. При этом другим предпочтительным вариантом выполнения настоящего изобретения также являются соединения формулы (I-T3), в которой R1 представляет собой метил.
Другим особенно предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I-T4). При этом предпочтительным вариантом выполнения настоящего изобретения также являются соединения формулы (I-Т4), в которой R1 представляет собой Н. При этом другим предпочтительным вариантом выполнения настоящего изобретения также являются соединения формулы (I-T4), в которой R1 представляет собой метил.
Другим особенно предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I-T22). При этом предпочтительным вариантом выполнения настоящего изобретения также являются соединения формулы (I-T22), в которой R1 представляет собой Н. При этом другим предпочтительным вариантом выполнения настоящего изобретения также являются соединения формулы (I-T22), в которой R1 представляет собой метил.
Другим особенно предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I-T23). При этом предпочтительным вариантом выполнения настоящего изобретения также являются соединения формулы (I-T23), в которой R1 представляет собой Н. При этом другим предпочтительным вариантом выполнения настоящего изобретения также являются соединения формулы (I-T23), в которой R1 представляет собой метил.

в которой
R1, A1, A2, A3, A4, R11, B1, B2, B4, B5, R8, R11 Q и W имеют значения, как определено в настоящей заявке причем, самое большее, одна группа, выбранная из A1, A2, A3, A4, представляет собой N и, самое большее, одна группа, выбранная из B1, B2, B3, B4, и В5, представляет собой N; или причем одна или две группы, выбранные из A1, A2, A3, А4, могут представлять собой N, и, самое большее, одна группа, выбранная из B1, B2, B3, B4, и B5, представляет собой N; или

в которой
R1, A1, A2, A3, A4, R11, B1, B2, B4, B5, R8, R11 Q и W имеют значения, как определено в настоящей заявке причем, самое большее, одна группа, выбранная из A1, A2, A3, A4, представляет собой N, и, самое большее, одна группа, выбранная из B1, B2, B3, B4, и B5, представляет собой N; или причем одна или две группы, выбранные из A1, A2, A3, A4, могут представлять собой N, и, самое большее, одна группа, выбранная из B1, B2, B3, B4, и B5, представляет собой N; или

в которой
R1, A1, A2, A3, A4, R11, B1, B2, B4, B5, R8, R11 Q и W имеют значения, как определено в настоящей заявке причем, самое большее, одна группа, выбранная из A1, A2, A3, A4, представляет собой N, и, самое большее, одна группа, выбранная из B1, B2, B3, B4, и B5, представляет собой N; или причем одна или две группы, выбранные из A1, A2, A3, A4, могут представлять собой N, и, самое большее, одна группа, выбранная из B1, B2, B3, B4, и B5, представляет собой N; или

в которой
R1, A1, A2, A3, A4, R11, B1, B2, B4, B5, R8, R11 Q и W имеют значения, как определено в настоящей заявке причем, самое большее, одна группа, выбранная из A1, A2, A3, A4, представляет собой N, и, самое большее, одна группа, выбранная из B1, B2, B3, B4, и B5, представляет собой N; или причем одна или две группы, выбранные из A1, A2, A3, A4, могут представлять собой N, и, самое большее, одна группа, выбранная из B1, B2, B3, B4, и B5, представляет собой N; или

в которой
R1, A1, A2, A3, A4, R11, B1, B2, B4, B5, R8, R11 Q и W имеют значения, как определено в настоящей заявке причем, самое большее, одна группа, выбранная из А1, A2, A3, A4, представляет собой N, и, самое большее, одна группа, выбранная из B1, B2, B3, B4, и B5, представляет собой N; или причем одна или две группы, выбранные из A1, A2, A3, A4, могут представлять собой N, и, самое большее, одна группа, выбранная из B1, B2, B3, B4, и B5, представляет собой N.
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (In) (Т=Т2)

в которой R1, Q, W, A2, B1, B5, R2, R4, R5, R6, R7, R8, R9 и R11 имеют значения, как определено в настоящей заявке, предпочтительно, где R1 и представляет собой Н, или где R1 представляет собой метил.
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (In), в которой
W представляет собой О;
Q представляет собой необязательно замещенный C1-C4-алкил или необязательно замещенный C3-C6-циклоалкил или представляет собой необязательно замещенное одним, двумя или тремя заместителями V ненасыщенное 4-, 5- или 6-членное гетероциклическое кольцо, причем V независимо друг от друга представляют собой галоген, циано, нитро, оксо (=О), необязательно замещенный галогеном C1-C6-алкил, C1-C4-алкенил, C1-C6-алкокси, C1-C6-алкилсульфанил, C1-C6-алкилсульфинил, C1-C6-алкилсульфонил;
предпочтительно представляет собой замещенный галогеном C1-C3-алкил; замещенный циано, гидрокси или карбамидом (-C(=O)N(R)2, причем R независимо друг от друга представляет собой Н или C1-C3-алкил, C1-C3-алкил; C3-циклоалкил; замещенный циано, галогеном, нитро или галогенированным C1-C2-алкилом C3-циклоалкил; замещенное одним, двумя или тремя заместителями V ненасыщенное 4-, 5- или 6-членное гетероциклическое кольцо, содержащее один или два гетероатома, выбранные из группы, состоящей из N, О и S, причем V независимо друг от друга представляют собой галоген, циано, нитро, оксо (=O), необязательно замещенный галогеном C1-C6-алкил;
особенно предпочтительно представляет собой фторированный C1-C3-алкил, такой как CF3, CH2CF3 или CH2CH2CF3; представляет собой замещенный карбамидом (-C(=O)N(R)2, причем R независимо друг от друга представляет собой Н, C1-C3-алкил или замещенный галогеном C1-C3-алкил) C1-C3-алкил, такой как 2-оксо-2-(2,2,2-трифтороэтиламино)этил; представляет собой циклопропил; представляет собой замещенный циано циано или фторированным C1-C2-алкилом циклопропил, такой как 1-(циано)циклопропил или 1-(трифторметил)циклопропил); представляет собой 4-членное гетероциклическое кольцо, содержащее один гетероатом, выбранный из группы, состоящей из N, О или S, как например тиетан-3-ил;
R7 и R9 в каждом случае представляет собой Н;
R11 в каждом случае представляет собой Н;
R1 представляет собой Н;
R2 представляет собой Н, галоген или C1-C4-алкил, предпочтительно представляет собой Н, фтор, хлор или метил;
R4 представляет собой Н или галоген, предпочтительно представляет собой Н, фтор или хлор;
R5 представляет собой Н или Галоген, предпочтительно представляет собой Н, фтор или хлор;
B5 представляет собой N или C-R10, предпочтительно представляет собой C-R10, где
R10 представляет собой водород, C1-C3-алкил, C1-C3-алкокси, замещенный галогеном C1-C3-алкил (предпочтительно перфторированный C1-C3-алкил (CF3, C2F5 или C3F7)), замещенный галогеном C1-C3-алкокси (предпочтительно перфторированный C1-C3-алкокси (OCF3, OC2F5 или OC3F7)), C1-C3-алкилсульфанил, C1-C3-алкилсульфинил, C1-C3-алкилсульфонил фтор, бром или хлор;
A2 представляет собой N или C-R3, предпочтительно представляет собой C-R3, где
R3 представляет собой Н, галоген, или необязательно замещенный C1-C4-алкил, предпочтительно представляет собой Н, фтор, хлор или необязательно замещенный галогеном C1-C2-алкил, особенно предпочтительно представляет собой Н или замещенный фтором метил, как например, перфторметил;
R6 представляет собой водород, C1-C3-алкил, C1-C3-алкокси, замещенный галогеном С1-C3-алкил (предпочтительно перфторированный C1-C3-алкил (CF3, C2F5 или C3F7)), замещенный галогеном C1-C3-алкокси (предпочтительно перфторированный C1-C3-алкокси (OCF3, OC2F5 или OC3F7)), C1-C3-алкилсульфанил, C1-C3-алкилсульфинил, C1-C3-алкилсульфонил, фтор, бром или хлор, предпочтительно представляет собой фтор, бром, хлор, C1-С2-алкил, замещенный галогеном C1-C2-алкил (например, перфторметил) или необязательно замещенный галогеном C1-C2-алкокси, особенно предпочтительно представляет собой фтор, бром, хлор, метил, этил, фторированный метил или фторированный этил (особенно предпочтительно перфторметил или перфторэтил), фторированный метокси или фторированный этокси (особенно предпочтительно перфторметокси);
R8 представляет собой галоген или необязательно замещенный галогеном C1-C4-алкил или необязательно замещенный галогеном C1-C4-алкокси, предпочтительно представляет собой замещенный галогеном C1-C3-алкил или замещенный галогеном C1-C3-алкокси, более предпочтительно представляет собой замещенный галогеном C1-C3-алкил, как например фторированный C1-C3-алкил (например, фторированный C3-алкил, как например перфторпропил).
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (In), в которой
W представляет собой О;
Q представляет собой необязательно замещенный C1-C4-алкил или необязательно замещенный C3-C6-циклоалкил или представляет собой необязательно замещенное одним, двумя или тремя заместителями V ненасыщенное 4-, 5- или 6-членное гетероциклическое кольцо, причем V независимо друг от друга представляют собой галоген, циано, нитро, оксо (=O), необязательно замещенный галогеном C1-C6-алкил, C1-C4-алкенил, C1-C6-алкокси, C1-C6-алкилсульфанил, C1-C6-алкилсульфинил, C1-C6-алкилсульфонил;
предпочтительно представляет собой замещенный галогеном C1-C3-алкил; замещенный циано, гидрокси или карбамидом (-C(=O)N(R)2, причем R независимо друг от друга представляет собой Н или C1-C3-алкил) C1-C3-алкил; C3-циклоалкил; замещенный циано, галогеном, нитро или галогенированным C1-C2-алкилом C3-циклоалкил; необязательно замещенное одним, двумя или тремя заместителями V ненасыщенное 4-, 5- или 6-членное гетероциклическое кольцо, содержащее один или два гетероатома, выбранные из группы, состоящей из N, О и S, причем V независимо друг от друга представляют собой галоген, циано, нитро, оксо (=O), необязательно замещенный галогеном C1-C6-алкил;
особенно предпочтительно представляет собой фторированный C1-C3-алкил, такой как CF3, CH2CF3 или CH2CH2CF3; представляет собой замещенный карбамидом (-C(=O)N(R)2, причем R независимо друг от друга представляет собой Н, C1-C3-алкил или замещенный галогеном C1-C3-алкил) C1-C3-алкил, как например 2-оксо-2-(2,2,2-трифтороэтиламино)этил; представляет собой циклопропил; представляет собой замещенный циано или фторированным C1-C2-алкилом циклопропил, как например 1-(циано)циклопропил или 1-(трифторметил)циклопропил); представляет собой 4-членное гетероциклическое кольцо, содержащее один гетероатом, выбранный из группы, состоящей из N, О или S, как например тиетан-3-ил;
R7 и R9 в каждом случае представляет собой Н;
R11 в каждом случае представляет собой Н;
R1 представляет собой метил;
R2 представляет собой Н, галоген или C1-C4-алкил, предпочтительно представляет собой Н, фтор, хлор или метил;
R4 представляет собой Н или галоген, предпочтительно представляет собой Н, фтор или хлор;
R5 представляет собой Н или галоген, предпочтительно представляет собой Н, фтор или хлор;
B5 представляет собой N или C-R10, предпочтительно представляет собой C-R10, где
R10 представляет собой водород, C1-C3-алкил, C1-C3-алкокси, замещенный галогеном C1-C3-алкил (предпочтительно перфторированный C1-C3-алкил (CF3, C2F5 или C3F7)), замещенный галогеном C1-C3-алкокси (предпочтительно перфторированный C1-C3-алкокси (OCF3, OC2F5 или OC3F7)), C1-C3-алкилсульфанил, C1-C3-алкилсульфинил, C1-C3-алкилсульфонил, фтор, бром или хлор;
A2 представляет собой N или C-R3, предпочтительно представляет собой C-R3, где
R3 представляет собой Н, галоген, или необязательно замещенный C1-C4-алкил, предпочтительно представляет собой Н, фтор, хлор или необязательно замещенный галогеном C1-C2-алкил, особенно предпочтительно представляет собой Н или замещенный фтором метил, как например, перфторметил;
R6 представляет собой водород, C1-C3-алкил, C1-C3-алкокси, замещенный галогеном C1-C3-алкил (предпочтительно перфторированный C1-C3-алкил (CF3, C2F5 или C3F7)), замещенный галогеном C1-C3-алкокси (предпочтительно перфторированный C1-C3-алкокси (OCF3, OC2F5 или OC3F7)), C1-C3-алкилсульфанил, C1-C3-алкилсульфинил, C1-C3-алкилсульфонил фтор, бром или хлор, предпочтительно представляет собой фтор, бром, хлор, C1-C2-алкил, замещенный галогеном C1-C2-алкил (например, перфторметил) или необязательно замещенный галогеном C1-C2-алкокси, особенно предпочтительно представляет собой фтор, бром, хлор, метил, этил, фторированный метил или фторированный этил (особенно предпочтительно перфторметил или перфторэтил), фторированный метокси или фторированный этокси (особенно предпочтительно перфторметокси);
R8 представляет собой галоген или необязательно замещенный галогеном C1-C4-алкил или необязательно замещенный галогеном C1-C4-алкокси, предпочтительно представляет собой замещенный галогеном C1-C3-алкил или замещенный галогеном C1-C3-алкокси, более предпочтительно представляет собой замещенный галогеном C1-C3-алкил, как например фторированный C1-C3-алкил (например, фторированный C3-алкил, такой как перфторпропил).
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (Ie) (Т=T3)
в которой R1, Q, W, A2, B1, B5, R2, R4, R5, R6, R7, R8, R9 и R11 имеют значения, как определено в настоящей заявке, предпочтительно, где R1 представляет собой Н, или где R1 представляет собой метил.
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (Ie), в которых
W представляет собой О;
Q представляет собой необязательно замещенный C1-C4-алкил или необязательно замещенный C3-C6-циклоалкил или представляет собой необязательно замещенное одним, двумя или тремя заместителями V ненасыщенное 4-, 5- или 6-членное гетероциклическое кольцо, причем V независимо друг от друга представляют собой галоген, циано, нитро, оксо (=O), необязательно замещенный галогеном C1-C6-алкил, C1-C4-алкенил, C1-C6-алкокси, C1-C6-алкилсульфанил, C1-C6-алкилсульфинил, C1-C6-алкилсульфонил;
предпочтительно представляет собой замещенный галогеном C1-C3-Алкил; замещенный циано, гидрокси или карбамидом (-C(=O)N(R)2, причем R независимо друг от друга представляет собой Н или C1-C3-алкил) C1-C3-алкил; C3-циклоалкил; замещенный циано, галогеном, нитро или галогенированным C1-C2-алкилом C3-циклоалкил; необязательно замещенное одним, двумя или тремя заместителями V ненасыщенное 4-, 5- или 6-членное гетероциклическое кольцо, содержащее одно или два гетероатома, выбранные из группы, состоящей из N, О и S, причем V независимо друг от друга представляют собой галоген, циано, нитро, оксо (=O), необязательно замещенный галогеном C1-C6-алкил;
особенно предпочтительно представляет собой фторированный C1-C3-алкил, как например CF3, CH2CF3 или CH2CH2CF3; представляет собой замещенный карбамидом (-C(=O)N(R)2, причем R независимо друг от друга представляет собой Н, C1-C3-алкил или замещенный галогеном C1-C3-алкил) C1-C3-алкил, такой как 2-оксо-2-(2,2,2-трифтороэтиламино)этил; представляет собой циклопропил; представляет собой замещенный циано или фторированным C1-C2-алкилом циклопропил, такой как 1-(циано)циклопропил или 1-(трифторметил)циклопропил); представляет собой 4-членное гетероциклическое кольцо, содержащее один гетероатом, выбранный из группы, состоящей из N, О или S, как например тиетан-3-ил;
R7 и R9 в каждом случае представляет собой Н;
R11 в каждом случае представляет собой Н;
R1 представляет собой Н;
R2 представляет собой Н, галоген или C1-C4-алкил, предпочтительно представляет собой Н, фтор, хлор или метил;
R4 представляет собой H или галоген, предпочтительно представляет собой H, фтор или хлор;
R5 представляет собой Н или галоген, предпочтительно представляет собой Н, фтор или хлор;
B5 представляет собой N или C-R10, предпочтительно представляет собой C-R10, где
R10 представляет собой водород, C1-C3-алкил, C1-C3-алкокси, замещенный галогеном C1-C3-алкил (предпочтительно перфторированный C1-C3-алкил (CF3, C2F5 или C3F7)), замещенный галогеном C1-C3-алкокси (предпочтительно перфторированный C1-C3-алкокси (OCF3, OC2F5 или OC3F7)), C1-C3-алкилсульфанил, C1-C3-алкилсульфинил, C1-C3-алкилсульфонил фтор, бром или хлор;
A2 представляет собой N или C-R3, предпочтительно представляет собой C-R3, где
R3 представляет собой Н, галоген, или необязательно замещенный C1-C4-алкил, предпочтительно представляет собой Н, фтор, хлор или необязательно замещенный галогеном C1-C2-алкил, особенно предпочтительно представляет собой Н или замещенный фтором метил, как например, перфторметил;
R6 представляет собой водород, C1-C3-алкил, C1-C3-алкокси, замещенный галогеном C1-C3-алкил (предпочтительно перфторированный C1-C3-алкил (CF3, C2F5 или C3F7)), замещенный галогеном C1-C3-алкокси (предпочтительно перфторированный C1-C3-алкокси (OCF3, OC2F5 или OC3F7)), С1-C3-алкилсульфанил, C1-C3-алкилсульфинил, C1-C3-алкилсульфонил фтор, бром или хлор, предпочтительно представляет собой фтор, бром, хлор, С1-С2-алкил, замещенный галогеном C1-C2-алкил (например, перфторметил) или необязательно замещенный галогеном C1-C2-алкокси, особенно предпочтительно представляет собой фтор, бром, хлор, метил, этил, фторированный метил или фторированный этил (особенно предпочтительно перфторметил или перфторэтил), фторированный метокси или фторированный этокси (особенно предпочтительно перфторметокси);
R8 представляет собой галоген или необязательно замещенный галогеном C1-C4-алкил или необязательно замещенный галогеном C1-C4-алкокси, предпочтительно представляет собой замещенный галогеном C1-C3-алкил или замещенный галогеном C1-C3-алкокси, более предпочтительно представляет собой замещенный галогеном C1-C3-алкил, как например фторированный C1-C3-алкил (например, фторированный C3-алкил, такой как перфторпропил).
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (Ie), в которой
W представляет собой О;
Q представляет собой необязательно замещенный C1-C4-алкил или необязательно замещенный C3-C6-циклоалкил или представляет собой необязательно замещенное одним, двумя или тремя заместителями V ненасыщенное 4-, 5- или 6-членное гетероциклическое кольцо, причем V независимо друг от друга представляют собой галоген, циано, нитро, оксо (=O), необязательно замещенный галогеном C1-C6-алкил, C1-C4-алкенил, C1-C6-алкокси, C1-C6-алкилсульфанил, C1-C6-алкилсульфинил, C1-C6-алкилсульфонил;
предпочтительно представляет собой замещенный галогеном C1-C3-алкил; замещенный циано, гидрокси или карбамидом (-C(=O)N(R)2, причем R независимо друг от друга представляет собой Н или C1-C3-Алкил) C1-C3-алкил; C3-Циклоалкил; замещенный циано, галогеном, нитро или галогенированным C1-C2-алкилом C3-циклоалкил; необязательно замещенное одним, двумя или тремя заместителями V ненасыщенное 4-, 5- или 6-членное гетероциклическое кольцо, содержащее один или два гетероатома, выбранные из группы, состоящей из N, О и S, причем V независимо друг от друга представляют собой галоген, циано, нитро, оксо (=O), необязательно замещенный галогеном C1-C6-алкил;
особенно предпочтительно представляет собой фторированный C1-C3-алкил, как например CF3, CH2CF3 или CH2CH2CF3; представляет собой замещенный карбамидом (-C(=O)N(R)2, причем R независимо друг от друга представляет собой Н, C1-C3-алкил или замещенный галогеном C1-C3-алкил) C1-C3-алкил, как например 2-оксо-2-(2,2,2-трифтороэтиламино)этил; представляет собой циклопропил; представляет собой замещенный циано или фторированным С1-C2-алкилом циклопропил, как например 1-(циано)циклопропил или 1-(трифторметил)циклопропил); представляет собой 4-членное гетероциклическое кольцо, содержащее гетероатом, выбранный из группы, состоящей из N, О или S, как например тиетан-3-ил;
R7 и R9 в каждом случае представляет собой Н;
R11 в каждом случае представляет собой Н;
R1 представляет собой метил;
R2 представляет собой Н, галоген или C1-C4-алкил, предпочтительно представляет собой Н, фтор, хлор или метил;
R4 представляет собой Н или галоген, предпочтительно представляет собой Н, фтор или хлор;
R5 представляет собой Н или галоген, предпочтительно представляет собой Н, фтор или хлор;
B5 представляет собой N или C-R10, предпочтительно представляет собой C-R10, где
R10 представляет собой водород, C1-C3-алкил, C1-C3-алкокси, замещенный галогеном C1-C3-алкил (предпочтительно перфторированный C1-C3-алкил (CF3, C2F5 или C3F7)), замещенный галогеном C1-C3-алкокси (предпочтительно перфторированный C1-C3-алкокси (OCF3, OC2F5 или OC3F7)), C1-C3-алкилсульфанил, C1-C3-алкилсульфинил, C1-C3-алкилсульфонил фтор, бром или хлор;
A2 представляет собой N или C-R3, предпочтительно представляет собой C-R3, где
R3 представляет собой Н, галоген, или необязательно замещенный C1-C4-алкил, предпочтительно представляет собой Н, фтор, хлор или необязательно замещенный галогеном C1-C2-алкил, особенно предпочтительно представляет собой Н или замещенный фтором метил, как например, перфторметил;
R6 представляет собой водород, C1-C3-алкил, C1-C3-алкокси, замещенный галогеном C1-C3-алкил (предпочтительно перфторированный C1-C3-алкил (CF3, C2F5 или C3F7)), замещенный галогеном C1-C3-алкокси (предпочтительно перфторированный C1-C3-алкокси (OCF3, OC2F5 или OC3F7)), C1-C3-алкилсульфанил, C1-C3-алкилсульфинил, C1-C3-алкилсульфонил фтор, бром или хлор, предпочтительно представляет собой фтор, бром, хлор, C1-C2-алкил, замещенный галогеном C1-C2-алкил (например, перфторметил) или необязательно замещенный галогеном С1-C2-алкокси, особенно предпочтительно представляет собой фтор, бром, хлор, метил, этил, фторированный метил или фторированный этил (особенно предпочтительно перфторметил или перфторэтил), фторированный метокси или фторированный этокси (особенно предпочтительно перфторметокси);
R8 представляет собой галоген или необязательно замещенный галогеном C1-C4-алкил или необязательно замещенный галогеном C1-C4-алкокси, предпочтительно представляет собой замещенный галогеном C1-C3-алкил или замещенный галогеном C1-C3-алкокси, более предпочтительно представляет собой замещенный галогеном C1-C3-алкил, как например фторированный C1-C3-алкил (например, фторированный C3-алкил, как например перфторопропил).
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (If) (Т=Т23)

в которой R1, Q, W, A2, B1, B5, R2, R4, R5, R6, R7, R8, R9 и R11 имеют значения, как определено в настоящей заявке, предпочтительно, где R1 представляет собой Н, или где R1 представляет собой метил.
Предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (If), в которой
W представляет собой О;
Q представляет собой необязательно замещенный C1-C4-алкил или необязательно замещенный C3-C6-циклоалкил или представляет собой необязательно замещенное одним, двумя или тремя заместителями V ненасыщенное 4-, 5- или 6-членное гетероциклическое кольцо, причем V независимо друг от друга представляют собой галоген, циано, нитро, оксо (=O), необязательно замещенный галогеном C1-C6-алкил, C1-C4-алкенил, C1-C6-алкокси, C1-C6-алкилсульфанил, C1-C6-алкилсульфинил, C1-C6-алкилсульфонил;
предпочтительно представляет собой замещенный галогеном C1-C3-алкил; замещенный циано, гидрокси или карбамидом (-C(=O)N(R)2, причем R независимо друг от друга представляет собой Н или C1-C3-алкил) C1-C3-алкил; C3-циклоалкил; замещенный циано, галогеном, нитро или галогенированным C1-C2-алкилом C3-циклоалкил; необязательно замещенное одним, двумя или тремя заместителями V ненасыщенное 4-, 5- или 6-членное гетероциклическое кольцо, содержащее один или два гетероатома, выбранные из группы, состоящей из N, О и S, причем V независимо друг от друга представляют собой галоген, циано, нитро, оксо (=O), необязательно замещенный галогеном C1-C6-алкил;
особенно предпочтительно представляет собой фторированный C1-C3-алкил, как например CF3, CH2CF3 или CH2CH2CF3; представляет собой замещенный карбамидом (-C(=O)N(R)2, причем R независимо друг от друга представляет собой Н, C1-C3-алкил или замещенный галогеном C1-C3-алкил) C1-C3-алкил, как например 2-оксо-2-(2,2,2-трифтороэтиламино)этил; представляет собой циклопропил; представляет собой замещенный циано или фторированным C1-C2-алкилом циклопропил, как например 1-(циано)циклопропил или 1-(трифторметил)циклопропил); представляет собой 4-членное гетероциклическое кольцо, содержащее один гетероатом, выбранный из группы, состоящей из N, О или S, как например тиетан-3-ил;
R7 и R9 в каждом случае представляет собой H;
R11 в каждом случае представляет собой Н;
R1 представляет собой Н;
R2 представляет собой Н, галоген или C1-C4-алкил, предпочтительно представляет собой Н, фтор, хлор или метил;
R4 представляет собой Н или галоген, предпочтительно представляет собой Н, фтор или хлор;
R5 представляет собой Н или галоген, предпочтительно представляет собой Н, фтор или хлор;
B5 представляет собой N или C-R10, предпочтительно представляет собой C-R10, где
R10 представляет собой Н, галоген, C1-C4-алкил или С1-C4-алкокси, предпочтительно представляет собой Н, фтор, бром, хлор, С1-C2-алкил или C1-C2-алкокси, особенно предпочтительно представляет собой Н, хлор, бром фтор, метил или метокси;
A2 представляет собой N или C-R3, предпочтительно представляет собой C-R3, где
R3 представляет собой Н, галоген, или необязательно замещенный C1-C4-алкил, предпочтительно представляет собой Н, фтор, хлор или необязательно замещенный галогеном C1-C2-алкил, особенно предпочтительно представляет собой Н или замещенный фтором метил, как например, перфторметил;
R6 представляет собой H, галоген, необязательно замещенный C1-C4-алкил или необязательно замещенный C1-C4-алкокси, предпочтительно представляет собой фтор, хлор, C1-C2-алкил, замещенный галогеном C1-C2-алкил (например, перфторметил) или необязательно замещенный галогеном C1-C2-алкокси, особенно предпочтительно представляет собой фтор, бром, хлор, метил, этил, фторированный метил или фторированный этил (особенно предпочтительно перфторметил или перфторэтил), фторированный метокси или фторированный этокси (особенно предпочтительно перфторметокси);
R8 представляет собой галоген или необязательно замещенный галогеном C1-C4-алкил или необязательно замещенный галогеном C1-C4-алкокси, предпочтительно представляет собой замещенный галогеном C1-C3-алкил или замещенный галогеном C1-C3-алкокси, более предпочтительно представляет собой замещенный галогеном C1-C3-алкил, как например фторированный C1-C3-алкил (например, фторированный C3-алкил, такой как перфторпропил).
Предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (If), в которой
W представляет собой О;
Q представляет собой необязательно замещенный C1-C4-алкил или необязательно замещенный C3-C6-циклоалкил или представляет собой необязательно замещенное одним, двумя или тремя заместителями V ненасыщенное 4-, 5- или 6-членное гетероциклическое кольцо, причем V независимо друг от друга представляют собой галоген, циано, нитро, оксо (=O), необязательно замещенный галогеном C1-C6-алкил, C1-C4-алкенил, C1-C6-алкокси, C1-C6-алкилсульфанил, C1-C6-алкилсульфинил, C1-C6-алкилсульфонил;
предпочтительно представляет собой замещенный галогеном C1-C3-Алкил; замещенный циано, гидрокси или карбамидом (-C(=O)N(R)2, причем R независимо друг от друга представляет собой Н или C1-C3-алкил) C1-C3-алкил; C3-циклоалкил; замещенный циано, галогеном, нитро или галогенированным C1-С2-алкилом C3-циклоалкил; необязательно замещенное одним, двумя или тремя заместителями V ненасыщенное 4-, 5- или 6-членное гетероциклическое кольцо, содержащее один или два гетероатома, выбранные из группы, состоящей из N, О и S, причем V независимо друг от друга представляют собой галоген, циано, нитро, оксо (=O), необязательно замещенный галогеном C1-C6-алкил;
особенно предпочтительно представляет собой фторированный C1-C3-алкил, как например CF3, CH2CF3 или CH2CH2CF3; представляет собой замещенный карбамидом (-C(=O)N(R)2, причем R независимо друг от друга представляет собой Н, C1-C3-алкил или замещенный галогеном C1-C3-алкил) C1-C3-алкил, такой как 2-оксо-2-(2,2,2-трифтороэтиламино)этил; представляет собой циклопропил; представляет собой замещенный циано или фторированным C1-C2-алкилом циклопропил, такой как 1-(циано)циклопропил или 1-(трифторметил)циклопропил); представляет собой 4-членное гетероциклическое кольцо, содержащее один гетероатом, выбранный из группы, состоящей из N, О или S, как например тиетан-3-ил.
R7 и R9 в каждом случае представляет собой Н;
R11 в каждом случае представляет собой Н;
R1 представляет собой метил;
R2 представляет собой Н, галоген или C1-C4-алкил, предпочтительно представляет собой Н, фтор, хлор или метил;
R4 представляет собой Н или галоген, предпочтительно представляет собой H, фтор или хлор;
R5 представляет собой Н или галоген, предпочтительно представляет собой Н, фтор или хлор;
B5 представляет собой N или C-R10, предпочтительно представляет собой C-R10, где
R10 представляет собой водород, C1-C3-алкил, C1-C3-алкокси, замещенный галогеном C1-C3-алкил (предпочтительно перфторированный C1-C3-алкил (CF3, C2F5 или C3F7)), замещенный галогеном C1-C3-алкокси (предпочтительно перфторированный C1-C3-алкокси (OCF3, OC2F5 или OC3F7)), C1-C3-алкилсульфанил, C1-C3-алкилсульфинил, C1-C3-алкилсульфонил фтор, бром или хлор;
A2 представляет собой N или C-R3, предпочтительно представляет собой C-R3, где
R3 представляет собой Н, галоген, или необязательно замещенный C1-C4-алкил, предпочтительно представляет собой Н, фтор, хлор или необязательно замещенный галогеном C1-C2-алкил, особенно предпочтительно представляет собой Н или замещенный фтором метил, как например, перфторметил;
R6 представляет собой водород, C1-C3-алкил, C1-C3-алкокси, замещенный галогеном C1-C3-алкил (предпочтительно перфторированный C1-C3-алкил (CF3, C2F5 или C3F7)), замещенный галогеном C1-C3-алкокси (предпочтительно перфторированный C1-C3-алкокси (OCF3, OC2F5 или OC3F7)), C1-C3-алкилсульфанил, C1-C3-алкилсульфинил, C1-C3-алкилсульфонил фтор, бром или хлор, предпочтительно представляет собой фтор, бром, хлор, C1-C2-алкил, замещенный галогеном C1-C2-алкил (например, перфторметил) или необязательно замещенный галогеном C1-C2-алкокси, особенно предпочтительно представляет собой фтор, бром, хлор, метил, этил, фторированный метил или фторированный этил (особенно предпочтительно перфторметил или перфторэтил), фторированный метокси или фторированный этокси (особенно предпочтительно перфторметокси);
R8 представляет собой галоген или необязательно замещенный галогеном C1-C4-алкил или необязательно замещенный галогеном C1-C4-алкокси, предпочтительно представляет собой замещенный галогеном C1-C3-алкил или замещенный галогеном C1-C3-алкокси, более предпочтительно представляет собой замещенный галогеном C1-C3-алкил, такой как фторированный C1-C3-алкил (например, фторированный C3-алкил, как например перфторпропил).
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (Ig) (Т=Т4)

в которой R1, Q, W, A2, B1, B5, R2, R4, R5, R6, R7, R8, R9 и R11 имеют значения, как определено в настоящей заявке предпочтительно, где R1 представляет собой Н, или где R1 представляет собой метил.
Предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (Ig), в которой
W представляет собой O;
Q представляет собой необязательно замещенный C1-C4-алкил или необязательно замещенный C3-C6-циклоалкил или представляет собой необязательно замещенное одним, двумя или тремя заместителями V ненасыщенное 4-, 5- или 6-членное гетероциклическое кольцо, причем V независимо друг от друга представляют собой галоген, циано, нитро, оксо (=O), необязательно замещенный галогеном C1-C6-алкил, C1-C4-алкенил, C1-C6-алкокси, C1-C6-алкилсульфанил, C1-C6-алкилсульфинил, C1-C6-алкилсульфонил;
предпочтительно представляет собой замещенный галогеном C1-C3-алкил; замещенный циано, гидрокси или карбамидом (-C(=O)N(R)2, причем R независимо друг от друга представляет собой Н или C1-C3-алкил) C1-C3-алкил; C3-циклоалкил; замещенный циано, галогеном, нитро или галогенированным C1-C2-алкилом C3-циклоалкил; необязательно замещенное одним, двумя или тремя заместителями V ненасыщенное 4-, 5- или 6-членное гетероциклическое кольцо, содержащее один или два гетероатома, выбранные из группы, состоящей из N, О и S, причем V независимо друг от друга представляет собой галоген, циано, нитро, оксо (=O), необязательно замещенный галогеном C1-C6-алкил;
особенно предпочтительно представляет собой фторированный C1-C3-алкил, такой как CF3, CH2CF3 или CH2CH2CF3; представляет собой замещенный карбамидом (-C(=O)N(R)2, причем R независимо друг от друга представляет собой Н, C1-C3-алкил или замещенный галогеном C1-C3-алкил) C1-C3-алкил, такой как 2-оксо-2-(2,2,2-трифтороэтиламино)этил; представляет собой циклопропил; представляет собой замещенный циано или фторированным C1-C2-алкилом циклопропил, такой как 1-(циано)циклопропил или 1-(трифторметил)циклопропил); представляет собой 4-членное гетероциклическое кольцо, содержащее один гетероатом, выбранный из группы, состоящей из N, О или S, как например тиетан-3-ил.
R7 и R9 в каждом случае представляет собой Н;
R11 в каждом случае представляет собой Н;
R1 представляет собой Н;
R2 представляет собой Н, галоген или C1-C4-алкил, предпочтительно представляет собой Н, фтор, хлор или метил;
R4 представляет собой Н или галоген, предпочтительно представляет собой Н, фтор или хлор;
R5 представляет собой Н или галоген, предпочтительно представляет собой Н, фтор или хлор;
B5 представляет собой N или C-R10, предпочтительно представляет собой C-R10, где
R10 представляет собой водород, C1-C3-алкил, C1-C3-алкокси, замещенный галогеном C1-C3-алкил (предпочтительно перфторированный C1-C3-алкил (CF3, C2F5 или C3F7)), замещенный галогеном C1-C3-алкокси (предпочтительно перфторированный C1-C3-алкокси (OCF3, OC2F5 или OC3F7)), C1-C3-алкилсульфанил, C1-C3-алкилсульфинил, C1-C3-алкилсульфонил фтор, бром или хлор;
A2 представляет собой N или C-R3, предпочтительно представляет собой C-R3, где
R3 представляет собой Н, галоген, или необязательно замещенный C1-C4-алкил, предпочтительно представляет собой Н, фтор, хлор или необязательно замещенный галогеном C1-C2-алкил, особенно предпочтительно представляет собой Н или замещенный фтором метил, как например, перфторметил;
R6 представляет собой водород, C1-C3-алкил, C1-C3-алкокси, замещенный галогеном C1-C3-алкил (предпочтительно перфторированный C1-C3-алкил (CF3, C2F5 или C3F7)), замещенный галогеном C1-C3-алкокси (предпочтительно перфторированный C1-C3-алкокси (OCF3, OC2F5 или OC3F7)), C1-C3-алкилсульфанил, C1-C3-алкилсульфинил, C1-C3-алкилсульфонил фтор, бром или хлор, предпочтительно представляет собой фтор, бром, хлор, C1-C2-алкил, замещенный галогеном C1-C2-алкил (например, перфторметил) или необязательно замещенный галогеном C1-C2-алкокси, особенно предпочтительно представляет собой фтор, бром, хлор, метил, этил, фторированный метил или фторированный этил (особенно предпочтительно перфторметил или перфторэтил), фторированный метокси или фторированный этокси (особенно предпочтительно перфторметокси);
R8 представляет собой галоген или необязательно замещенный галогеном C1-C4-алкил или необязательно замещенный галогеном C1-C4-алкокси, предпочтительно представляет собой замещенный галогеном C1-C3-алкил или замещенный галогеном C1-C3-алкокси, более предпочтительно представляет собой замещенный галогеном C1-C3-алкил, как например фторированный C1-C3-алкил (например, фторированный C3-алкил, как например перфторпропил).
Предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (Ig), в которой
W представляет собой O;
Q представляет собой необязательно замещенный C1-C4-алкил или необязательно замещенный C3-C6-циклоалкил или представляет собой необязательно замещенное одним, двумя или тремя заместителями V ненасыщенное 4-, 5- или 6-членное гетероциклическое кольцо, причем V независимо друг от друга представляют собой галоген, циано, нитро, оксо (=O), необязательно замещенный галогеном C1-C6-алкил, C1-C4-алкенил, C1-C6-алкокси, C1-C6-алкилсульфанил, C1-C6-алкилсульфинил, C1-C6-алкилсульфонил;
предпочтительно представляет собой замещенный галогеном C1-C3-алкил; замещенный циано, гидрокси или карбамидом (-C(=O)N(R)2, причем R независимо друг от друга представляет собой Н или C1-C3-алкил) C1-C3-алкил; C3-циклоалкил; замещенный циано, галогеном, нитро или галогенированным C1-C2-алкилом C3-циклоалкил; необязательно замещенное одним, двумя или тремя заместителями V ненасыщенное 4-, 5- или 6-членное гетероциклическое кольцо, содержащее один или два гетероатома, выбранные из группы, состоящей из N, О и S, причем V независимо друг от друга представляет собой галоген, циано, нитро, оксо (=O), необязательно замещенный галогеном C1-C6-алкил;
особенно предпочтительно представляет собой фторированный C1-C3-алкил, как например CF3, CH2CF3 или CH2CH2CF3; представляет собой замещенный карбамидом (-C(=O)N(R)2, причем R независимо друг от друга представляет собой Н, C1-C3-алкил или замещенный галогеном C1-C3-алкил) C1-C3-алкил, как например 2-оксо-2-(2,2,2-трифтороэтиламино)этил; представляет собой циклопропил; представляет собой замещенный циано или фторированным C1-C2-алкилом циклопропил, как например 1-(циано)циклопропил или 1-(трифторметил)циклопропил); представляет собой 4-членное гетероциклическое кольцо, содержащее один гетероатом, выбранный из группы, состоящей из N, О или S, как например тиетан-3-ил.
R7 и R9 в каждом случае представляет собой Н;
R11 в каждом случае представляет собой Н;
R1 представляет собой метил;
R2 представляет собой Н, галоген или C1-C4-алкил, предпочтительно представляет собой Н, фтор, хлор или метил;
R4 представляет собой Н или галоген, предпочтительно представляет собой Н, фтор или хлор;
R5 представляет собой Н или галоген, предпочтительно представляет собой Н, фтор или хлор;
B5 представляет собой N или C-R10, предпочтительно представляет собой C-R10, где
R10 представляет собой водород, C1-C3-алкил, C1-C3-алкокси, замещенный галогеном C1-C3-алкил (предпочтительно перфторированный C1-C3-алкил (CF3, C2F5 или C3F7)), замещенный галогеном C1-C3-алкокси (предпочтительно перфторированный C1-C3-алкокси (OCF3, OC2F5 или OC3F7)), C1-C3-алкилсульфанил, C1-C3-алкилсульфинил, C1-C3-алкилсульфонил фтор, бром или хлор;
A2 представляет собой N или C-R3, предпочтительно представляет собой C-R3, где
R3 представляет собой H, галоген, или необязательно замещенный C1-C4-алкил, предпочтительно представляет собой Н, фтор, хлор или необязательно замещенный галогеном C1-C2-алкил, особенно предпочтительно представляет собой Н или замещенный фтором метил, как например, перфторметил;
R6 представляет собой водород, C1-C3-алкил, C1-C3-алкокси, замещенный галогеном C1-C3-алкил (предпочтительно перфторированный C1-C3-алкил (CF3, C2F5 или C3F7)), замещенный галогеном C1-C3-Алкокси (предпочтительно перфторированный C1-C3-алкокси (OCF3, OC2F5 или OC3F7)), C1-C3-алкилсульфанил, C1-C3-алкилсульфинил, C1-C3-алкилсульфонил фтор, бром или хлор, предпочтительно представляет собой фтор, бром, хлор, C1-C2-алкил, замещенный галогеном C1-C2-алкил (например, перфторметил) или необязательно замещенный галогеном С1-C2-алкокси, особенно предпочтительно представляет собой фтор, бром, хлор, метил, этил, фторированный метил или фторированный этил (особенно предпочтительно перфторметил или перфторэтил), фторированный метокси или фторированный этокси (особенно предпочтительно перфторметокси);
R8 представляет собой галоген или необязательно замещенный галогеном C1-C4-алкил или необязательно замещенный галогеном C1-C4-алкокси, предпочтительно представляет собой замещенный галогеном C1-C3-алкил или замещенный галогеном C1-C3-алкокси, более предпочтительно представляет собой замещенный галогеном C1-C3-алкил, как например фторированный C1-C3-алкил (например, фторированный C3-алкил, такой как перфторпропил).
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (Io) (Т=Т22)

в которых R1, Q, W, A2, B1, B5, R2, R4, R5, R6, R7, R8, R9 и R11 имеют значения, как определено в настоящей заявке, предпочтительно, где R1 представляет собой Н, или R1 представляет собой метил.
Предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (Io), где
W представляет собой О;
Q представляет собой необязательно замещенный C1-C4-алкил или необязательно замещенный C3-C6-циклоалкил или представляет собой необязательно замещенное одним, двумя или тремя заместителями V ненасыщенное 4-, 5- или 6-членное гетероциклическое кольцо, причем V независимо друг от друга представляет собой галоген, циано, нитро, оксо (=O), необязательно замещенный галогеном C1-C6-алкил, C1-C4-алкенил, C1-C6-алкокси, C1-C6-алкилсульфанил, C1-C6-алкилсульфинил, C1-C6-алкилсульфонил;
предпочтительно представляет собой замещенный галогеном C1-C3-алкил; замещенный циано, гидрокси или карбамидом (-C(=O)N(R)2, причем R независимо друг от друга представляет собой Н или C1-C3-алкил) C1-C3-алкил; C3-циклоалкил; замещенный циано, галогеном, нитро или галогенированным C1-C2-алкилом C3-циклоалкил; необязательно замещенное одним, двумя или тремя заместителями V ненасыщенное 4-, 5- или 6-членное гетероциклическое кольцо, содержащее один или два гетероатома, выбранные из группы, состоящей из N, О и S, причем V независимо друг от друга представляет собой галоген, циано, нитро, оксо (=O), необязательно замещенный галогеном C1-C6-алкил;
особенно предпочтительно представляет собой фторированный C1-C3-алкил, такой как CF3, CH2CF3 или CH2CH2CF3; представляет собой замещенный карбамидом (-C(=O)N(R)2, причем R независимо друг от друга представляет собой Н, C1-C3-алкил или замещенный галогеном C1-C3-алкил) C1-C3-алкил, такой как 2-оксо-2-(2,2,2-трифтороэтиламино)этил; представляет собой циклопропил; представляет собой замещенный циано или фторированным C1-C2-алкилом циклопропил, такой как 1-(циано)циклопропил или 1-(трифторметил)циклопропил); представляет собой 4-членное гетероциклическое кольцо, содержащее один гетероатом, выбранный из группы, состоящей из N, О или S, как например тиетан-3-ил.
R7 и R9 в каждом случае представляет собой Н;
R11 в каждом случае представляет собой Н;
R1 представляет собой Н;
R2 представляет собой Н, галоген или C1-C4-алкил, предпочтительно представляет собой Н, фтор, хлор или метил;
R4 представляет собой H или галоген, предпочтительно представляет собой H, фтор или хлор;
R5 представляет собой Н или галоген, предпочтительно представляет собой Н, фтор или хлор;
B5 представляет собой N или C-R10, предпочтительно представляет собой C-R10, где
R10 представляет собой водород, C1-C3-алкил, C1-C3-алкокси, замещенный галогеном C1-C3-алкил (предпочтительно перфторированный C1-C3-алкил (CF3, C2F5 или C3F7)), замещенный галогеном C1-C3-алкокси (предпочтительно перфторированный C1-C3-алкокси (OCF3, OC2F5 или OC3F7)), С1-C3-алкилсульфанил, C1-C3-алкилсульфинил, C1-C3-алкилсульфонил фтор, бром или хлор;
A2 представляет собой N или C-R3, предпочтительно представляет собой C-R3, где
R3 представляет собой Н, галоген, или необязательно замещенный С1-C4-алкил, предпочтительно представляет собой Н, фтор, хлор или необязательно замещенный галогеном C1-C2-алкил, особенно предпочтительно представляет собой Н или замещенный фтором метил, такой как, например, перфторметил;
R6 представляет собой водород, C1-C3-алкил, C1-C3-алкокси, замещенный галогеном C1-C3-алкил (предпочтительно перфторированный C1-C3-алкил (CF3, C2F5 или C3F7)), замещенный галогеном C1-C3-алкокси (предпочтительно перфторированный C1-C3-алкокси (OCF3, OC2F5 или OC3F7)), С1-C3-алкилсульфанил, C1-C3-алкилсульфинил, C1-C3-алкилсульфонил фтор, бром или хлор, предпочтительно представляет собой фтор, бром, хлор, C1-C2-алкил, замещенный галогеном С1-C2-алкил (например, перфторметил) или необязательно замещенный галогеном C1-C2-алкокси, особенно предпочтительно представляет собой фтор, бром, хлор, метил, этил, фторированный метил или фторированный этил (особенно предпочтительно перфторметил или перфторэтил), фторированный метокси или фторированный этокси (особенно предпочтительно перфторметокси);
R8 представляет собой галоген или необязательно замещенный галогеном C1-C4-алкил или необязательно замещенный галогеном C1-C4-алкокси, предпочтительно представляет собой замещенный галогеном C1-C3-алкил или замещенный галогеном C1-C3-алкокси, более предпочтительно представляет собой замещенный галогеном C1-C3-алкил, такой как фторированный C1-C3-алкил (например, фторированный C3-алкил, такой как перфторпропил).
Предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (Io), в которой
W представляет собой О;
Q представляет собой необязательно замещенный C1-C4-алкил или необязательно замещенный C3-C6-циклоалкил или представляет собой необязательно замещенное одним, двумя или тремя заместителями V ненасыщенное 4-, 5- или 6-членное гетероциклическое кольцо, причем V независимо друг от друга представляют собой галоген, циано, нитро, оксо (=O), необязательно замещенный галогеном C1-C6-алкил, C1-C4-алкенил, C1-C6-алкокси, C1-C6-алкилсульфанил, C1-C6-алкилсульфинил, C1-C6-алкилсульфонил;
предпочтительно представляет собой замещенный галогеном C1-C3-алкил; замещенный циано, гидрокси или карбамидом (-C(=O)N(R)2, причем R независимо друг от друга представляет собой Н или C1-C3-алкил) C1-C3-алкил; C3-циклоалкил; замещенный циано, галогеном, нитро или галогенированным C1-C2-алкилом C3-циклоалкил; необязательно замещенное одним, двумя или тремя заместителями V ненасыщенное 4-, 5- или 6-членное гетероциклическое кольцо, содержащее один или два гетероатома, выбранные из группы, состоящей из N, О и S, причем V независимо друг от друга представляют собой галоген, циано, нитро, оксо (=O), необязательно замещенный галогеном C1-C6-алкил;
особенно предпочтительно представляет собой фторированный C1-C3-алкил, такой как CF3, CH2CF3 или CH2CH2CF3; представляет собой замещенный карбамидом (-C(=O)N(R)2, причем R независимо друг от друга представляет собой Н, C1-C3-алкил или замещенный галогеном C1-C3-алкил) C1-C3-алкил, такой как 2-оксо-2-(2,2,2-трифторэтиламино)этил; представляет собой циклопропил; представляет собой замещенный циано или фторированным C1-C2-алкилом циклопропил, такой как 1-(циано)циклопропил или 1-(трифторметил)циклопропил); представляет собой 4-членное гетероциклическое кольцо, содержащее один гетероатом, выбранный из группы, состоящей из N, О или S, как например тиетан-3-ил.
R7 и R9 в каждом случае представляет собой Н;
R11 в каждом случае представляет собой Н;
R1 представляет собой метил;
R2 представляет собой Н, галоген или C1-C4-алкил, предпочтительно представляет собой Н, фтор, хлор или метил;
R4 представляет собой Н или галоген, предпочтительно представляет собой Н, фтор или хлор;
R5 представляет собой H или галоген, предпочтительно представляет собой H, фтор или хлор;
B5 представляет собой N или C-R10, предпочтительно представляет собой С-R10, где
R10 представляет собой водород, C1-C3-алкил, C1-C3-алкокси, замещенный галогеном C1-C3-алкил (предпочтительно перфторированный C1-C3-алкил (CF3, C2F5 или C3F7)), замещенный галогеном C1-C3-алкокси (предпочтительно перфторированный C1-C3-алкокси (OCF3, OC2F5 или OC3F7)), C1-C3-алкилсульфанил, C1-C3-алкилсульфинил, C1-C3-алкилсульфонил фтор, бром или хлор;
A2 представляет собой N или C-R3, предпочтительно представляет собой C-R3, где
R3 представляет собой Н, галоген, или необязательно замещенный C1-C4-алкил, предпочтительно представляет собой Н, фтор, хлор или необязательно замещенный галогеном C1-C2-алкил, особенно предпочтительно представляет собой Н или замещенный фтором метил, как например, перфторметил;
R6 представляет собой водород, C1-C3-алкил, C1-C3-алкокси, замещенный галогеном C1-C3-алкил (предпочтительно перфторированный C1-C3-алкил (CF3, C2F5 или C3F7)), замещенный галогеном C1-C3-алкокси (предпочтительно перфторированный C1-C3-алкокси (OCF3, OC2F5 или OC3F7)), C1-C3-алкилсульфанил, C1-C3-алкилсульфинил, C1-C3-алкилсульфонил фтор, бром или хлор, предпочтительно представляет собой фтор, бром, хлор, C1-C2-алкил, замещенный галогеном C1-C2-алкил (например, перфторметил) или необязательно замещенный галогеном C1-C2-алкокси, особенно предпочтительно представляет собой фтор, бром, хлор, метил, этил, фторированный метил или фторированный этил (особенно предпочтительно перфторметил или перфторэтил), фторированный метокси или фторированный этокси (особенно предпочтительно перфторметокси);
R8 представляет собой галоген или необязательно замещенный галогеном С1-C4-алкил или необязательно замещенный галогеном C1-C4-алкокси, предпочтительно представляет собой замещенный галогеном C1-C3-алкил или замещенный галогеном C1-C3-алкокси, более предпочтительно представляет собой замещенный галогеном C1-C3-алкил, такой как фторированный C1-C3-алкил (например, фторированный C3-алкил, как например перфторпропил).
В качестве примеров соединений формулы (I) упоминаются следующие структуры:

2-Хлор-N-циклопропил-5-[1-[4-(1,1,1,2,3,3,3-гептафторпропан-2-ил)-2-метил-6-(трифторметил)фенил]-1Н-пиразол-4-ил]бензамид,

2-Хлор-N-(1-цианоциклопропил-5-[1-[4-(1,1,1,2,3,3,3-гептафторпропан-2-ил)-2-метил-6-(трифторметил)фенил]-1Н-пиразол-4-ил]бензамид,

2-Хлор-N-циклопропил-5-[4-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиразол-1-ил]бензамид,

2-Хлор-N-(1-цианоциклопропил)-5-[4-[2,6-дихлор-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиразол-1-ил]бензамид,

2-Хлор-5-[3-[2-хлор-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-6-(трифторметил)фенил]изоксазол-5-ил]-N-циклопропил-бензамид,

2-Хлор-N-(1-цианоциклопропил)-5-[3-[2-метил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-6-(трифторметил)фенил]изоксазол-5-ил]бензамид,
Другие соединения согласно настоящему изобретению представляют собой

2-Хлор-N-(1-цианоциклопропил)-5-[1-[2,6-дихлор-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиррол-3-ил]бензамид,
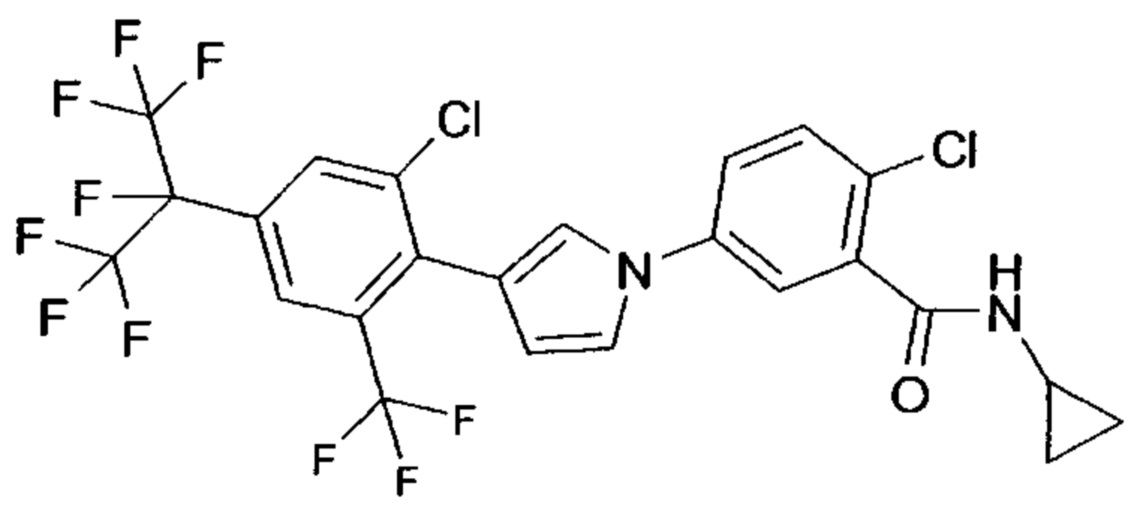
2-Хлор-5-[3-[2-хлор-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-6-(трифторметил)фенил]пиррол-1-ил]-N-циклопропил-бензамид.
R1 Метил
Предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой метил, и все другие параметры имеют значения, как определено в абзаце [0085].
Т3 - Метил
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой метил, Т представляет собой T3, R11 в T3 представляет собой Н, W представляет собой О, и все другие параметры имеют значения, как определено в абзацах [0085] и [0112].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой метил, Т представляет собой T3, R11 в T3 представляет собой Н, W представляет собой О, A1 представляет собой CR2, А2 представляет собой CR3 или N, A3 представляет собой CR4, A4 представляет собой CR5, B1 представляет собой CR6, В2 представляет собой CR7, B3 представляет собой CR8, В4 представляет собой CR9, В5 представляет собой CR10, и все другие параметры имеют значения, как определено в абзацах [0085] и [0112].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой метил, Т представляет собой T3, R11 в T3 представляет собой Н, W представляет собой О, A1 представляет собой СН, А2 представляет собой СН или N, A3 представляет собой CR4, A4 представляет собой СН, B1 представляет собой CR6, В2 представляет собой СН, B3 представляет собой CR8, В4 представляет собой СН, В5 представляет собой CR10, причем R6 и R10 в каждом случае представляют собой заместитель, выбранный из галогена (предпочтительно хлор, бром или фтор), C1-C3-алкила, замещенного галогеном C1-C3-алкила, C1-C3-алкокси или замещенного галогеном C1-C3-алкокси, и все другие параметры имеют значения, как определено в абзацах [0085] и [0112].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой метил, Т представляет собой T3, R11 в T3 представляет собой Н, W представляет собой О, A1 представляет собой СН, А2 представляет собой СН или N, A3 представляет собой CR4, A4 представляет собой СН, B1 представляет собой CR6, В2 представляет собой СН, B3 представляет собой CR8, В4 представляет собой СН, В5 представляет собой CR10, причем R6 и R10 в каждом случае представляют собой заместитель, выбранный из галогена (предпочтительно хлор, бром или фтор), C1-C3-алкила, замещенного галогеном C1-C3-алкила, C1-C3-алкокси или замещенного галогеном C1-C3-алкокси, и все другие параметры имеют значения, как определено в абзацах [0085] и [0112].
Т2 - Метил
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой метил, Т представляет собой Т2, R11 в Т2 представляет собой Н, W представляет собой О, и все другие параметры имеют значения, как определено в абзацах [0085] и [0112].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой метил, Т представляет собой Т2, R11 в Т2 представляет собой Н, W представляет собой О, A1 представляет собой CR2, А2 представляет собой CR3 или N, A3 представляет собой CR4, A4 представляет собой CR5, B1 представляет собой CR6, В2 представляет собой CR7, B3 представляет собой CR8, В4 представляет собой CR9, В5 представляет собой CR10, и все другие параметры имеют значения, как определено в абзацах [0085] и [0112].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой метил, Т представляет собой Т2, R11 в Т2 представляет собой Н, W представляет собой О, A1 представляет собой СН, А2 представляет собой СН или N, A3 представляет собой CR4, A4 представляет собой СН, B1 представляет собой CR6, В2 представляет собой СН, B3 представляет собой CR8, В4 представляет собой СН, В5 представляет собой CR10, причем R6 и R10 в каждом случае представляет собой заместитель, выбранный из галоген (предпочтительно хлор, бром или фтор), C1-C3-алкил, замещенный галогеном C1-C3-алкил, C1-C3-алкокси или замещенный галогеном C1-C3-алкокси, и все другие параметры имеют значения, как определено в абзацах [0085] и [0112].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой метил, T представляет собой Т2, R11 в Т2 представляет собой Н, W представляет собой О, A1 представляет собой СН, А2 представляет собой СН или N, A3 представляет собой CR4, A4 представляет собой СН, В1 представляет собой CR6, В2 представляет собой СН, B3 представляет собой CR8, В4 представляет собой СН, В5 представляет собой CR10, причем R6 и R10 в каждом случае представляют собой заместитель, выбранный из галогена (предпочтительно хлор, бром или фтор), C1-C3-алкила, замещенного галогеном C1-C3-алкила, C1-C3-алкокси или замещенного галогеном C1-C3-алкокси, и все другие параметры имеют значения, как определено в абзацах [0085] и [0112].
Т4 - Метил
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой метил, Т представляет собой Т4, R11 в Т4 представляет собой Н, W представляет собой О, и все другие параметры имеют значения, как определено в абзацах [0085] и [0112].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой метил, Т представляет собой Т4, R11 в Т4 представляет собой Н, W представляет собой О, A1 представляет собой CR2, А2 представляет собой CR3 или N, A3 представляет собой CR4, A4 представляет собой CR5, B1 представляет собой CR6, В2 представляет собой CR7, B3 представляет собой CR8, В4 представляет собой CR9, В5 представляет собой CR10, и все другие параметры имеют значения, как определено в абзацах [0085] и [0112].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой метил, Т представляют собой Т4, R11 в Т4 представляет собой Н, W представляет собой О, A1 представляет собой СН, А2 представляет собой СН или N, A3 представляет собой CR4, A4 представляет собой СН, B1 представляет собой CR6, В2 представляет собой CH, B3 представляет собой CR8, B4 представляет собой CH, B5 представляет собой CR10, причем R6 и R10 в каждом случае представляют собой заместитель, выбранный из галогена (предпочтительно хлор, бром или фтор), C1-C3-алкила, замещенного галогеном C1-C3-алкила, C1-C3-алкокси или замещенного галогеном C1-C3-алкокси, и все другие параметры имеют значения, как определено в абзацах [0085] и [0112].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой метил, Т представляет собой Т4, R11 в Т4 представляет собой Н, W представляет собой О, A1 представляет собой СН, A2 представляет собой СН или N, A3 представляет собой CR4, A4 представляет собой СН, B1 представляет собой CR6, В2 представляет собой СН, B3 представляет собой CR8, В4 представляет собой СН, В5 представляет собой CR10, причем R6 и R10 в каждом случае представляют собой заместитель, выбранный из галогена (предпочтительно хлор, бром или фтор), C1-C3-алкила, замещенного галогеном C1-C3-алкила, C1-C3-алкокси или замещенного галогеном C1-C3-алкокси, и все другие параметры имеют значения, как определено в абзацах [0085] и [0112].
Т22 - Метил
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой метил, Т представляет собой Т22, R11 в Т22 представляет собой Н, W представляет собой О, и все другие параметры имеют значения, как определено в абзацах [0085] и [0112].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой метил, Т представляет собой Т22, R11 в Т22 представляет собой Н, W представляет собой О, А1 представляет собой CR2, А2 представляет собой CR3 или N, A3 представляет собой CR4, A4 представляет собой CR5, B1 представляет собой CR6, В2 представляет собой CR7, B3 представляет собой CR8, В4 представляет собой CR9, В5 представляет собой CR10, и все другие параметры имеют значения, как определено в абзацах [0085] и [0112].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой метил, Т представляют собой Т22, R11 в Т22 представляет собой Н, W представляет собой О, A1 представляет собой СН, А2 представляет собой СН или N, A3 представляет собой CR4, A4 представляет собой СН, B1 представляет собой CR6, В2 представляет собой СН, B3 представляет собой CR8, В4 представляет собой СН, В5 представляет собой CR10, причем R6 и R10 в каждом случае представляют собой заместитель, выбранный из галогена (предпочтительно хлор, бром или фтор), C1-C3-алкила, замещенного галогеном C1-C3-алкила, C1-C3-алкокси или замещенного галогеном C1-C3-алкокси, и все другие параметры имеют значения, как определено в абзацах [0085] и [0112].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой метил, Т представляет собой Т22, R11 в Т22 представляет собой Н, W представляет собой О, A1 представляет собой СН, А2 представляет собой СН или N, A3 представляет собой CR4, A4 представляет собой СН, B1 представляет собой CR6, В2 представляет собой СН, B3 представляет собой CR8, В4 представляет собой СН, В5 представляет собой CR10, причем R6 и R10 в каждом случае представляют собой заместитель, выбранный из галогена (предпочтительно хлор, бром или фтор), C1-C3-алкила, замещенного галогеном C1-C3-алкила, C1-C3-алкокси или замещенного галогеном C1-C3-алкокси, и все другие параметры имеют значения, как определено в абзацах [0085] и [0112].
Т23 - Метил
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой метил, Т представляет собой Т23, R11 в Т23 представляет собой Н, W представляет собой О, и все другие параметры имеют значения, как определено в абзацах [0085] и [0113].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой метил, T представляет собой Т23, R11 в Т23 представляет собой Н, W представляет собой О, A1 представляет собой CR2, А2 представляет собой CR3 или N, A3 представляет собой CR4, A4 представляет собой CR5, B1 представляет собой CR6, В2 представляет собой CR7, B3 представляет собой CR8, В4 представляет собой CR9, В5 представляет собой CR10, и все другие параметры имеют значения, как определено в абзацах [0085] и [0113].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой метил, Т представляет собой Т23, R11 в Т23 представляет собой Н, W представляет собой О, A1 представляет собой СН, А2 представляет собой СН или N, A3 представляет собой CR4, A4 представляет собой СН, B1 представляет собой CR6, В2 представляет собой СН, B3 представляет собой CR8, В4 представляет собой СН, В5 представляет собой CR10, причем R6 и R10 в каждом случае представляют собой заместитель, выбранный из галогена (предпочтительно хлор, бром или фтор), C1-C3-алкила, замещенного галогеном C1-C3-алкила, C1-C3-алкокси или замещенного галогеном C1-C3-алкокси, и все другие параметры имеют значения, как определено в абзацах [0085] и [0113].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой метил, Т представляет собой Т23, R11 в Т23 представляет собой Н, W представляет собой О, A1 представляет собой СН, А2 представляет собой СН или N, A3 представляет собой CR4, A4 представляет собой СН, B1 представляет собой CR6, В2 представляет собой СН, B3 представляет собой CR8, В4 представляет собой СН, В5 представляет собой CR10, причем R6 и R10 в каждом случае представляют собой заместитель, выбранный из галогена (предпочтительно хлор, бром или фтор), C1-C3-алкила, замещенного галогеном C1-C3-алкила, C1-C3-алкокси или замещенного галогеном C1-C3-алкокси, и все другие параметры имеют значения, как определено в абзацах [0085] и [0113].
T3 - H
Предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой водород (Н), и все другие параметры имеют значения, как определено в абзацах [0085] и [0113].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой Н, Т представляет собой T3, R11 в T3 представляет собой Н, W представляет собой О, и все другие параметры имеют значения, как определено в абзацах [0085] и [0113].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой Н, Т представляет собой T3, R11 в T3 представляет собой Н, W представляет собой О, A1 представляет собой CR2, А2 представляет собой CR3 или N, A3 представляет собой CR4, A4 представляет собой CR5, B1 представляет собой CR6, В2 представляет собой CR7, B3 представляет собой CR8, В4 представляет собой CR9, В5 представляет собой CR10, и все другие параметры имеют значения, как определено в абзацах [0085] и [0113].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой Н, Т представляет собой T3, R11 в T3 представляет собой Н, W представляет собой О, A1 представляет собой СН, А2 представляет собой СН или N, A3 представляет собой CR4, A4 представляет собой СН, B1 представляет собой CR6, В2 представляет собой СН, B3 представляет собой CR8, В4 представляет собой СН, В5 представляет собой CR10, причем R6 и R10 в каждом случае представляют собой заместитель, выбранный из галогена (предпочтительно хлор, бром или фтор), C1-C3-алкила, замещенного галогеном C1-C3-алкила, C1-C3-алкокси или замещенного галогеном C1-C3-алкокси, и все другие параметры имеют значения, как определено в абзацах [0085] и [0113].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой Н, Т представляет собой T3, R11 в T3 представляет собой Н, W представляет собой О, A1 представляет собой СН, A2 представляет собой СН или N, A3 представляет собой CR4, A4 представляет собой СН, B1 представляет собой CR6, B2 представляет собой СН, B3 представляет собой CR8, В4 представляет собой СН, В5 представляет собой CR10, причем R6 и R10 в каждом случае представляют собой заместитель, выбранный из галогена (предпочтительно хлор, бром или фтор), C1-C3-алкила, замещенного галогеном C1-C3-алкила, C1-C3-алкокси или замещенного галогеном C1-C3-алкокси, и все другие параметры имеют значения, как определено в абзацах [0085] и [0113].
Т2 - Н
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой Н, Т представляет собой Т2, R11 в Т2 представляет собой Н, W представляет собой О, и все другие параметры имеют значения, как определено в абзацах [0085] и [0113].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой Н, Т представляет собой Т2, R11 в Т2 представляет собой Н, W представляет собой О, A1 представляет собой CR2, A2 представляет собой CR3 или N, A3 представляет собой CR4, A4 представляет собой CR5, B1 представляет собой CR6, B2 представляет собой CR7, B3 представляет собой CR8, В4 представляет собой CR9, В5 представляет собой CR10, и все другие параметры имеют значения, как определено в абзацах [0085] и [0113].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой Н, Т представляет собой Т2, R11 в Т2 представляет собой Н, W представляет собой О, A1 представляет собой СН, A2 представляет собой СН или N, A3 представляет собой CR4, A4 представляет собой СН, B1 представляет собой CR6, В2 представляет собой СН, B3 представляет собой CR8, В4 представляет собой СН, В5 представляет собой CR10, причем R6 и R10 в каждом случае представляют собой заместитель, выбранный из галогена (предпочтительно хлор, бром или фтор), C1-C3-алкила, замещенного галогеном C1-C3-алкила, C1-C3-алкокси или замещенного галогеном C1-C3-алкокси, и все другие параметры имеют значения, как определено в абзацах [0085] и [0113].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой Н, Т представляет собой Т2, R11 в Т2 представляет собой Н, W представляет собой О, A1 представляет собой СН, A2 представляет собой СН или N, А3 представляет собой CR4, A4 представляет собой СН, B1 представляет собой CR6, В2 представляет собой СН, B3 представляет собой CR8, В4 представляет собой СН, В5 представляет собой CR10, причем R6 и R10 в каждом случае представляют собой заместитель, выбранный из галогена (предпочтительно хлор, бром или фтор), C1-C3-алкила, замещенного галогеном C1-C3-алкила, C1-C3-алкокси или замещенного галогеном C1-C3-алкокси, и все другие параметры имеют значения, как определено в абзацах [0085] и [0113].
Т4 - Н
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой Н, Т представляет собой Т4, R11 в Т4 представляет собой Н, W представляет собой О, и все другие параметры имеют значения, как определено в абзацах [0085] и [0113].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой Н, Т представляет собой Т4, R11 в Т4 представляет собой Н, W представляет собой О, A1 представляет собой CR2, A2 представляет собой CR3 или N, А3 представляет собой CR4, A4 представляет собой CR5, B1 представляет собой CR6, B2 представляет собой CR7, B3 представляет собой CR8, В4 представляет собой CR9, В5 представляет собой CR10, и все другие параметры имеют значения, как определено в абзацах [0085] и [0113].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой Н, Т представляет собой Т4, R11 в Т4 представляет собой Н, W представляет собой О, A1 представляет собой СН, A2 представляет собой СН или N, A3 представляет собой CR4, A4 представляет собой СН, B1 представляет собой CR6, В2 представляет собой СН, B3 представляет собой CR8, В4 представляет собой СН, В5 представляет собой CR10, причем R6 и R10 в каждом случае представляет собой заместитель, выбранный из галогена (предпочтительно хлор, бром или фтор), C1-C3-алкила, замещенного галогеном C1-C3-алкила, C1-C3-алкокси или замещенного галогеном C1-C3-алкокси, и все другие параметры имеют значения, как определено в абзацах [0085] и [0113].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой Н, Т представляет собой Т4, R11 в Т4 представляет собой Н, W представляет собой О, A1 представляет собой СН, А2 представляет собой СН или N, A3 представляет собой CR4, A4 представляет собой СН, B1 представляет собой CR6, В2 представляет собой СН, B3 представляет собой CR8, В4 представляет собой СН, В5 представляет собой CR10, причем R6 и R10 в каждом случае представляют собой заместитель, выбранный из галогена (предпочтительно хлор, бром или фтор), C1-C3-алкила, замещенного галогеном C1-C3-алкила, C1-C3-алкокси или замещенного галогеном C1-C3-алкокси, и все другие параметры имеют значения, как определено в абзацах [0085] и [0113].
Т22 - Н
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой Н, Т представляет собой Т22, R11 в Т22 представляет собой Н, W представляет собой О, и все другие параметры имеют значения, как определено в абзацах [0085] и [0113].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой Н, Т представляет собой Т22, R11 в Т22 представляет собой Н, W представляет собой О, A1 представляет собой CR2, А2 представляет собой CR3 или N, A3 представляет собой CR4, A4 представляет собой CR5, B1 представляет собой CR6, B2 представляет собой CR7, B3 представляет собой CR8, В4 представляет собой CR9, В5 представляет собой CR10, и все другие параметры имеют значения, как определено в абзацах [0085] и [0113].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой Н, Т представляет собой Т22, R11 в Т22 представляет собой Н, W представляет собой О, A1 представляет собой СН, А2 представляет собой СН или N, А3 представляет собой CR4, A4 представляет собой СН, B1 представляет собой CR6, В2 представляет собой СН, B3 представляет собой CR8, В4 представляет собой СН, В5 представляет собой CR10, причем R6 и R10 в каждом случае представляют собой заместитель, выбранный из галогена (предпочтительно хлор, бром или фтор), C1-C3-алкила, замещенного галогеном C1-C3-алкила, C1-C3-алкокси или замещенного галогеном C1-C3-алкокси, и все другие параметры имеют значения, как определено в абзацах [0085] и [0113].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой Н, Т представляет собой Т22, R11 в Т22 представляет собой Н, W представляет собой О, A1 представляет собой СН, А2 представляет собой СН или N, A3 представляет собой CR4, A4 представляет собой СН, B1 представляет собой CR6, В2 представляет собой СН, B3 представляет собой CR8, В4 представляет собой СН, В5 представляет собой CR10, причем R6 и R10 в каждом случае представляют собой заместитель, выбранный из галогена (предпочтительно хлор, бром или фтор), C1-C3-алкила, замещенного галогеном C1-C3-алкила, C1-C3-алкокси или замещенного галогеном C1-C3-алкокси, и все другие параметры имеют значения, как определено в абзацах [0085] и [0113].
Т23 - Н
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой Н, Т представляет собой Т23, R11 в Т23 представляет собой Н, W представляет собой О, и все другие параметры имеют значения, как определено в абзацах [0085] и [0113].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой Н, Т представляет собой Т23, R11 в Т23 представляет собой Н, W представляет собой О, A1 представляет собой CR2, А2 представляет собой CR3 или N, A3 представляет собой CR4, A4 представляет собой CR5, B1 представляет собой CR6, B2 представляет собой CR7, B3 представляет собой CR8, В4 представляет собой CR9, В5 представляет собой CR10, и все другие параметры имеют значения, как определено в абзацах [0085] и [0113].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой Н, Т представляет собой Т23, R11 в Т23 представляет собой Н, W представляет собой О, A1 представляет собой СН, А2 представляет собой СН или N, A3 представляет собой CR4, A4 представляет собой СН, B1 представляет собой CR6, В2 представляет собой СН, B3 представляет собой CR8, В4 представляет собой СН, В5 представляет собой CR10, причем R6 и R10 в каждом случае представляют собой заместитель, выбранный из галогена (предпочтительно хлор, бром или фтор), C1-C3-алкила, замещенного галогеном C1-C3-алкила, C1-C3-алкокси или замещенного галогеном C1-C3-алкокси, и все другие параметры имеют значения, как определено в абзацах [0085] и [0113].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой Н, Т представляет собой Т23, R11 в Т23 представляет собой Н, W представляет собой О, A1 представляет собой СН, А2 представляет собой СН или N, A3 представляет собой CR4, А4 представляет собой СН, B1 представляет собой CR6, В2 представляет собой СН, B3 представляет собой CR8, В4 представляет собой СН, В5 представляет собой CR10, причем R6 и R10 в каждом случае представляют собой заместитель, выбранный из галогена (предпочтительно Хлор, Бром или Фтор), C1-C3-алкила, замещенного галогеном C1-C3-алкила, C1-C3-алкокси или замещенного галогеном C1-C3-алкокси, и все другие параметры имеют значения, как определено в абзацах [0085] и [0113].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой B1 представляет собой C-R6, и R6 представляет собой галоген (предпочтительно представляет собой хлор или фтор), С1-С4-алкил, С1-С4-алкокси, С1-С4-галогеналкил (предпочтительно перфторированный C1-C4-алкил), C1-C4-галогеналкокси (предпочтительно перфторированный C1-C4-алкокси), C1-C4-алкилсульфанил или С1-С4-алкилсульфонил.
Согласно настоящему изобретению подходящими солями соединений согласно настоящему изобретению являются все обычно применяемые нетоксичные соли, предпочтительно сельскохозяйственно и/или физиологически приемлемые соли, соли с основаниями или соли кислотного добавления. Предпочтительными являются соли с неорганическими основаниями, такие как, например (например, соль натрия, калия или цезия), соли щелочноземельных металлов (например, соль кальция или магния), аммониевая соль, или соли с органическими основаниями, наиболее предпочтительно с органическими аминами, как например триэтилам-мониевая, дициклогексиламмониевая, N,N'-дибензилэтилендиаммониевая соль, соль пиридиния, соль пиколиния или этаноламмониевая соль, соли с неорганическими кислотами (например, гидрохлорид, гидробромид, дигидросульфат, три-гидросульфат или фосфат), соли с органическими карбоновыми кислотами или органическими сульфоновыми кислотами (например, формиат, ацетат, трифтор-ацетат, малеат, тартрат, метансульфонат, бензолсульфонат или 4-толуолсульфонат). Хорошо известно, что т-амины, как например, некоторые из соединений согласно настоящему изобретению, способны образовывать N-оксиды, которые, подобным образом, представляют собой соли согласно настоящему изобретению.
В зависимости от природы заместителей, соединения формулы (I) могут находиться в форме геометрических и/или оптически активных изомеров или соответствующих смесей изомеров в различных композициях. Этими стереоизомерами являются, например, энантиомеры, диастереомеры, атропизомеры или геометрические изомеры. Соответственно, настоящее изобретение охватывает как чистые стереоизомеры, так и любые смеси этих изомеров.
Настоящее изобретение также относится к способам борьбы с животным вредителями, в которых соединения формулы (I) воздействуют на животные вредители и/или их среду обитания. Борьбы с животными вредителями предпочтительно осуществляется в сельском хозяйстве и лесоводстве, и при защите материалов. Предпочтительно из настоящего изобретения исключены способы хирургического и терапевтического лечения человека или животного и способы диагностики, проводимые для человека или животного.
Настоящее изобретение, кроме того, относится к применению соединений формулы (I) в качестве пестицидов, в частности средств для защиты сельскохозяйственных культур.
В контексте настоящего изобретения, термин "пестицид" в каждом случае также всегда охватывает термин "средство для защиты сельскохозяйственных культур".
Соединения формулы (I), имеющие хорошую толерантность к растениям, благоприятную гомеотермальную токсичность и хорошую совместимость с окружающей средой, подходят для защиты растений и органов растений от биотических и абиотических стрессов, для увеличения собираемого урожая, для улучшения качества собираемого урожая и для борьбы с животными вредителями, особенно с насекомыми, паукообразными, гельминтами, нематодами и моллюсками, которые встречаются в сельском хозяйстве, в садоводстве, в животноводстве, в водяных культурах, в лесах, в садах и средах для отдыха, для защиты продуктов и материалов при хранении, и в гигиеническом секторе. Они могут предпочтительно применяться в качестве пестицидов. Они активы против нормально чувствительных и резистентных видов и против всех или некоторых стадий развития. Вышеуказанные вредители включают:
Вредители из филума Членистоногие, в частности из класса Паукообразные, например, Acarus spp., например, Acarus siro, Aceria kuko, Aceria sheldoni, Aculops spp., Aculus spp., например, Aculus fockeui, Aculus schlechtendali, Amblyomma spp., Amphitetranychus viennensis, Argas spp., Boophilus spp., Brevipalpus spp., например, Brevipalpus phoenicis, Bryobia graminum, Bryobia praetiosa, Centruroides spp., Chorioptes spp., Dermanyssus gallinae, Dermatophagoides pteronyssinus, Dermatophagoides farinae, Dermacentor spp., Eotetranychus spp., например, Eotetranychus hicoriae, Epitrimerus pyri, Eutetranychus spp., например, Eutetranychus banksi, Eriophyes spp., например, Eriophyes pyri, Glycyphagus domesticus, Halotydeus destructor, Hemitarsonemus spp., например, Hemitarsonemus latus (=Polyphagotarsonemus latus), Hyalomma spp., Ixodes spp., Latrodectus spp., Loxosceles spp., Neutrombicula autumnalis, Nuphersa spp., Oligonychus spp., например, Oligonychus coniferarum, Oligonychus ilicis, Oligonychus indicus, Oligonychus mangiferus, Oligonychus pratensis, Oligonychus punicae, Oligonychus yothersi, Ornithodorus spp., Ornithonyssus spp., Panonychus spp., например, Panonychus citri (=Metatetranychus citri), Panonychus ulmi (=Metatetranychus ulmi), Phyllocoptruta oleivora, Platytetranychus multidigituli, Polyphagotarsonemus latus, Psoroptes spp., Rhipicephalus spp., Rhizoglyphus spp., Sarcoptes spp., Scorpio maurus, Steneotarsonemus spp., Steneotarsonemus spinki, Tarsonemus spp., например, Tarsonemus confusus, Tarsonemus pallidus, Tetranychus spp., например, Tetranychus canadensis, Tetranychus cinnabarinus, Tetranychus turkestani, Tetranychus urticae, Trombicula alfreddugesi, Vaejovis spp., Vasates lycopersici;
из класса Губоногие, например, Geophilus spp., Scutigera spp.;
из отряда или класса Вилохвостки, например, Onychiurus armatus; Sminthurus viridis;
из класса Двупарноногие, например, Blaniulus guttulatus;
из класса Насекомые, например, из отряда Тараканы, например, Blatta orientalis, Blattella asahinai, Blattella germanica, Leucophaea maderae, Panchlora spp., Parcoblatta spp., Periplaneta spp., например, Periplaneta americana, Periplaneta australasiae, Supella longipalpa;
из отряда Жесткокрылые, например, Acalymma vittatum, Acanthoscelides obtectus, Adoretus spp., Agelastica alni, Agriotes spp., например, Agriotes linneatus, Agriotes mancus, Alphitobius diaperinus, Amphimallon solstitialis, Anobium punctatum, Anoplophora spp., Anthonomus spp., например, Anthonomus grandis, Anthrenus spp., Apion spp., Apogonia spp., Atomaria spp., например, Atomaria linearis, Attagenus spp., Baris caerulescens, Bruchidius obtectus, Bruchus spp., например, Bruchus pisorum, Bruchus ruflmanus, Cassida spp., Cerotoma trifurcata, Ceutorrhynchus spp., например, Ceutorrhynchus assimilis, Ceutorrhynchus quadridens, Ceutorrhynchus rapae, Chaetocnema spp., например, Chaetocnema confinis, Chaetocnema denticulata, Chaetocnema ectypa, Cleonus mendicus, Conoderus spp., Cosmopolites spp., например, Cosmopolites sordidus, Costelytra zealandica, Ctenicera spp., Curculio spp., например, Curculio caryae, Curculio caryatrypes, Curculio obtusus, Curculio sayi, Cryptolestes ferrugineus, Cryptolestes pusillus, Cryptorhynchus lapathi, Cryptorhynchus mangiferae, Cylindrocopturus spp., Cylindrocopturus adspersus, Cylindrocopturus furnissi, Dermestes spp., Diabrotica spp., например, Diabrotica balteata, Diabrotica barberi, Diabrotica undecimpunctata howardi, Diabrotica undecimpunctata undecimpunctata, Diabrotica virgifera virgifera, Diabrotica virgifera zeae, Dichocrocis spp., Dicladispa armigera, Diloboderus spp., Epilachna spp., например, Epilachna borealis, Epilachna varivestis, Epitrix spp., например, Epitrix cucumeris, Epitrix fuscula, Epitrix hirtipennis, Epitrix subcrinita, Epitrix tuberis, Faustinus spp., Gibbium psylloides, Gnathocerus cornutus, Hellula undalis, Heteronychus arator, Heteronyx spp., Hylamorpha elegans, Hylotrupes bajulus, Hypera postica, Hypomeces squamosus, Hypothenemus spp., например, Hypothenemus hampei, Hypothenemus obscurus, Hypothenemus pubescens, Lachnosterna consanguinea, Lasioderma serricorne, Latheticus oryzae, Lathridius spp., Lema spp., Leptinotarsa decemlineata, Leucoptera spp., например, Leucoptera coffeella, Lissorhoptrus oryzophilus, Lixus spp., Luperomorpha xanthodera, Luperodes spp., Lyctus spp., Megascelis spp., Melanotus spp., например, Melanotus longulus oregonensis, Meligethes aeneus, Melolontha spp., например, Melolontha melolontha, Migdolus spp., Monochamus spp., Naupactus xanthographus, Necrobia spp., Niptus hololeucus, Oryctes rhinoceros, Oryzaephilus surinamensis, Oryzaphagus oryzae, Otiorhynchus spp., например, Otiorhynchus cribricollis, Otiorhynchus ligustici, Otiorhynchus ovatus, Otiorhynchus rugosostriarus, Otiorhynchus sulcatus, Oxycetonia jucunda, Phaedon cochleariae, Phyllophaga spp., Phyllophaga helleri, Phyllotreta spp., например, Phyllotreta armoraciae, Phyllotreta pusilla, Phyllotreta ramosa, Phyllotreta striolata, Popillia japonica, Premnotrypes spp., Prostephanus truncatus, Psylliodes spp., например, Psylliodes affinis, Psylliodes chrysocephala, Psylliodes punctulata, Ptinus spp., Rhizobius ventralis, Rhizopertha dominica, Sitophilus spp., например, Sitophilus granarius, Sitophilus linearis, Sitophilus oryzae, Sitophilus zeamais, Sphenophorus spp., Stegobium paniceum, Sternechus spp., например, Sternechus paludatus, Symphyletes spp., Tanymecus spp., например, Tanymecus dilaticollis, Tanymecus indicus, Tanymecus palliatus, Tenebrio molitor, Tenebrioides mauretanicus, Tribolium spp., например, Tribolium audax, Tribolium castaneum, Tribolium confusum, Trogoderma spp., Tychius spp., Xylotrechus spp., Zabrus spp., например, Zabrus tenebrioides;
из отряда Двукрылые, например, Aedes spp., например, Aedes aegypti, Aedes albopictus, Aedes sticticus, Aedes vexans, Agromyza spp., например, Agromyza frontella, Agromyza parvicornis, Anastrepha spp., Anopheles spp., например, Anopheles quadrimaculatus, Anopheles gambiae, Asphondylia spp., Bactrocera spp., например, Bactrocera cucurbitae, Bactrocera dorsalis, Bactrocera oleae, Bibio hortulanus, Calliphora erythrocephala, Calliphora vicina, Ceratitis capitata, Chironomus spp., Chrysomya spp., Chrysops spp., Chrysozona pluvialis, Cochliomya spp., Contarinia spp., например, Contarinia johnsoni, Contarinia nasturtii, Contarinia pyrivora, Contarinia schulzi, Contarinia sorghicola, Contarinia tritici, Cordylobia anthropophaga, Cricotopus sylvestris, Culex spp., например, Culex pipiens, Culex quinquefasciatus, Culicoides spp., Culiseta spp., Cuterebra spp., Dacus oleae, Dasineura spp., например, Dasineura brassicae, Delia spp., например, Delia antiqua, Delia coarctata, Delia florilega, Delia platura, Delia radicum, Dermatobia hominis, Drosophila spp., например, Drosphila melanogaster, Drosophila suzukii, Echinocnemus spp., Fannia spp., Gasterophilus spp., Glossina spp., Haematopota spp., Hydrellia spp., Hydrellia griseola, Hylemya spp., Hippobosca spp., Hypoderma spp., Liriomyza spp., например, Liriomyza brassicae, Liriomyza huidobrensis, Liriomyza sativae, Lucilia spp., например, Lucilia cuprina, Lutzomyia spp., Mansonia spp., Musca spp., например, Musca domestica, Musca domestica vicina, Oestrus spp., Oscinella frit, Paratanytarsus spp., Paralauterborniella subcincta, Pegomya spp., например, Pegomya betae, Pegomya hyoscyami, Pegomya rubivora, Phlebotomus spp., Phorbia spp., Phormia spp., Piophila casei, Prodiplosis spp., Psila rosae, Rhagoletis spp., например, Rhagoletis cingulata, Rhagoletis completa, Rhagoletis fausta, Rhagoletis indifferens, Rhagoletis mendax, Rhagoletis pomonella, Sarcophaga spp., Simulium spp., например, Simulium meridionale, Stomoxys spp., Tabanus spp., Tetanops spp., Tipula spp., например, Tipula paludosa, Tipula simplex;
из отряда Клопы, например, Anasa tristis, Antestiopsis spp., Boisea spp., Blissus spp., Calocoris spp., Campylomma livida, Cavelerius spp., Cimex spp., например, Cimex adjunctus, Cimex hemipterus, Cimex lectularius, Cimex pilosellus, Collaria spp., Creontiades dilutus, Dasynus piperis, Dichelops furcatus, Diconocoris hewetti, Dysdercus spp., Euschistus spp., например, Euschistus heros, Euschistus servus, Euschistus tristigmus, Euschistus variolarius, Eurygaster spp., Halyomorpha halys, Heliopeltis spp., Horcias nobilellus, Leptocorisa spp., Leptocorisa varicornis, Leptoglossus occidentalis, Leptoglossus phyllopus, Lygocoris spp., например, Lygocoris pabulinus, Lygus spp., например, Lygus elisus, Lygus hesperus, Lygus lineolaris, Macropes excavatus, Monalonion atratum, Nezara spp., например, Nezara viridula, Oebalus spp., Piesma quadrata, Piezodorus spp., например, Piezodorus guildinii, Psallus spp., Pseudacysta persea, Rhodnius spp., Sahlbergella singularis, Scaptocoris castanea, Scotinophora spp., Stephanitis nashi, Tibraca spp., Triatoma spp.;
из отряда Полужесткокрылые, например, Acizzia acaciaebaileyanae, Acizzia dodonaeae, Acizzia uncatoides, Acrida turrita, Acyrthosipon spp., например, Acyrthosiphon pisum, Acrogonia spp., Aeneolamia spp., Agonoscena spp., Aleyrodes proletella, Aleurolobus barodensis, Aleurothrixus floccosus, Allocaridara malayensis, Amrasca spp., например, Amrasca bigutulla, Amrasca devastans, Anuraphis cardui, Aonidiella spp., например, Aonidiella aurantii, Aonidiella citrina, Aonidiella inomata, Aphanostigma piri, Aphis spp., например, Aphis citricola, Aphis craccivora, Aphis fabae, Aphis forbesi, Aphis glycines, Aphis gossypii, Aphis hederae, Aphis illinoisensis, Aphis middletoni, Aphis Nasturtii, Aphis Nerii, Aphis pomi, Aphis spiraecola, Aphis viburniphila, Arboridia apicalis, Arytainilla spp., Aspidiella spp., Aspidiotus spp., например, Aspidiotus nerii, Atanus spp., Aulacorthum solani, Bemisia tabaci, Blastopsylla occidentalis, Boreioglycaspis melaleucae, Brachycaudus helicbxysi, Brachycolus spp., Brevicoryne brassicae, Cacopsylla spp., например, Cacopsylla pyricola, Calligypona marginata, Cameocephala fulgida, Ceratovacuna lanigera, Cercopidae, Ceroplastes spp., Chaetosiphon fragaefolii, Chionaspis tegalensis, Chlorita onukii, Chondracris rosea, Chromaphis juglandicola, Chrysomphalus ficus, Cicadulina mbila, Coccomytilus halli, Coccus spp., например, Coccus hesperidum, Coccus longulus, Coccus pseudomagnoliarum, Coccus viridis, Cryptomyzus ribis, Cryptoneossa spp., Ctenarytaina spp., Dalbulus spp., Dialeurodes citri, Diaphorina citri, Diaspis spp., Drosicha spp., Dysaphis spp., например, Dysaphis apiifolia, Dysaphis plantaginea, Dysaphis tulipae, Dysmicoccus spp., Empoasca spp., например, Empoasca abrupta, Empoasca fabae, Empoasca maligna, Empoasca solana, Empoasca stevensi, Eriosoma spp., например, Eriosoma americanum, Eriosoma lanigerum, Eriosoma pyricola, Erythroneura spp., Eucalyptolyma spp., Euphyllura spp., Euscelis bilobatus, Ferrisia spp., Geococcus coffeae, Glycaspis spp., Heteropsylla cubana, Heteropsylla spinulosa, Homalodisca coagulata, Hyalopterus arundinis, Hyalopterus pruni, Icerya spp., например, Icerya purchasi, Idiocerus spp., Idioscopus spp., Laodelphax striatellus, Lecanium spp., например, Lecanium corni (=Parthenolecanium corni), Lepidosaphes spp., например, Lepidosaphes ulmi, Lipaphis erysimi, Lycorma delicatula, Macrosiphum spp., например, Macrosiphum euphorbiae, Macrosiphum lilii, Macrosiphum rosae, Macrosteles facifrons, Mahanarva spp., Melanaphis sacchari, Metcalfiella spp., Metcalfa pruinosa, Metopolophium dirhodum, Monellia costalis, Monelliopsis pecanis, Myzus spp., например, Myzus ascalonicus, Myzus cerasi, Myzus ligustri, Myzus ornatus, Myzus persicae, Myzus nicotianae, Nasonovia ribisnigri, Nephotettix spp., например, Nephotettix cincticeps, Nephotettix nigropictus, Nilaparvata lugens, Oncometopia spp., Orthezia praelonga, Oxya chinensis, Pachypsylla spp., Parabemisia myricae, Paratrioza spp., например, Paratrioza cockerelli, Parlatoria spp., Pemphigus spp., например, Pemphigus bursarius, Pemphigus populivenae, Peregrinus maidis, Phenacoccus spp., например, Phenacoccus madeirensis, Phloeomyzus passerinii, Phorodon humuli, Phylloxera spp., например, Phylloxera devastatrix, Phylloxera notabilis, Pinnaspis aspidistrae, Planococcus spp., например, Planococcus citri, Prosopidopsylla flava, Protopulvinaria pyriformis, Pseudaulacaspis pentagona, Pseudococcus spp., например, Pseudococcus calceolariae, Pseudococcus comstocki, Pseudococcus longispinus, Pseudococcus maritimus, Pseudococcus viburni, Psyllopsis spp., Psylla spp., например, Psylla buxi, Psylla mali, Psylla pyri, Pteromalus spp., Pyrilla spp., Quadraspidiotus spp., например, Quadraspidiotus juglansregiae, Quadraspidiotus ostreaeformis, Quadraspidiotus perniciosus, Quesada gigas, Rastrococcus spp., Rhopalosiphum spp., например, Rhopalosiphum maidis, Rhopalosiphum oxyacanthae, Rhopalosiphum padi, Rhopalosiphum rufiabdominale, Saissetia spp., например, Saissetia coffeae, Saissetia miranda, Saissetia neglecta, Saissetia oleae, Scaphoideus titanus, Schizaphis graminum, Selenaspidus articulatus, Sitobion avenae, Sogata spp., Sogatella furcifera, Sogatodes spp., Stictocephala festina, Siphoninus phillyreae, Tenalaphara malayensis, Tetragonocephela spp., Tinocallis caryaefoliae, Tomaspis spp., Toxoptera spp., например, Toxoptera aurantii, Toxoptera citricidus, Trialeurodes vaporariorum, Trioza spp., например, Trioza diospyri, Typhlocyba spp., Unaspis spp., Viteus vitifolii, Zygina spp.;
из отряда Перепончатокрылые, например, Acromyrmex spp., Athalia spp., например, Athalia rosae, Atta spp., Diprion spp., например, Diprion similis, Hoplocampa spp., например, Hoplocampa cookei, Hoplocampa testudinea, Lasius spp., Monomorium pharaonis, Sirex spp., Solenopsis invicta, Tapinoma spp., Urocerus spp., Vespa spp., например, Vespa crabro, Xeris spp.;
из отряда Изоподы, например, Armadillidium vulgare, Oniscus asellus, Porcellio scaber;
из отряда Термиты, например, Coptotermes spp., например, Coptotermes formosanus, Cornitermes cumulans, Cryptotermes spp., Incisitermes spp., Microtermes obesi, Odontotermes spp., Reticulitermes spp., например, Reticulitermes flavipes, Reticulitermes hesperus;
из отряда Чешуекрылые бабочки, например, Achroia grisella, Acronicta major, AdoKcophyes spp., например, Adoxophyes orana, Aedia leucomelas, Agrotis spp., например, Agrotis segetum, Agrotis ipsilon, Alabama spp., например, Alabama argillacea, Amyelois transitella, Anarsia spp., Anticarsia spp., например, Anticarsia gemmatalis, Argyroploce spp., Barathra brassicae, Borbo cinnara, Bucculatrix thurberiella, Bupalus piniarius, Busseola spp., Cacoecia spp., Caloptilia theivora, Capua reticulana, Carpocapsa pomonella, Carposina niponensis, Cheimatobia brumata, Chilo spp., например, Chilo plejadellus, Chilo suppressalis, Choristoneura spp., Clysia ambiguella, Cnaphaloceras spp., Cnaphalocrocis medinalis, Cnephasia spp., Conopomorpha spp., Conotrachelus spp., Copitarsia spp., Cydia spp., например, Cydia nigricana, Cydia pomonella, Dalaca noctuides, Diaphania spp., Diatraea saccharalis, Earias spp., Ecdytolopha aurantium, Elasmopalpus lignosellus, Eldana saccharina, Ephestia spp., например, Ephestia elutella, Ephestia kuehniella, Epinotia spp., Epiphyas postvittana, Etiella spp., Eulia spp., Eupoecilia ambiguella, Euproctis spp., например, Euproctis chrysorrhoea, Euxoa spp., Feltia spp., Galleria mellonella, Gracillaria spp., Grapholitha spp., например, Grapholita molesta, Grapholita prunivora, Hedylepta spp., Helicoverpa spp., например, Helicoverpa armigera, Helicoverpa zea, Heliothis spp., например, Heliothis virescens Hofmannophila pseudospretella, Homoeosoma spp., Homona spp., Hyponomeuta padella, Kakivoria flavofasciata, Laphygma spp., Leucinodes orbonalis, Leucoptera spp., например, Leucoptera coffeella, Lithocolletis spp., например, Lithocolletis blancardella, Lithophane antennata, Lobesia spp., например, Lobesia botrana, Loxagrotis albicosta, Lymantria spp., например, Lymantria dispar, Lyonetia spp., например, Lyonetia clerkella, Malacosoma neustria, Maruca testulalis, Mamestra brassicae, Melanitis leda, Mocis spp., Monopis obviella, Mythimna separata, Nemapogon cloacellus, Nymphula spp., Oiketicus spp., Oria spp., Orthaga spp., Ostrinia spp., например, Ostrinia nubilalis, Oulema melanopus, Oulema oryzae, Panolis flammea, Parnara spp., Pectinophora spp., например, Pectinophora gossypiella, Perileucoptera spp., Phthorimaea spp., например, Phthorimaea operculella, Phyllocnistis citrella, Phyllonorycter spp., например, Phyllonorycter blancardella, Phyllonorycter crataegella, Pieris spp., например, Pieris rapae, Platynota stultana, Plodia interpunctella, Plusia spp., Plutella xylostella (=Plutella maculipennis), Prays spp., Prodenia spp., Protoparce spp., Pseudaletia spp., например, Pseudaletia unipuncta, Pseudoplusia includens, Pyrausta nubilalis, Rachiplusia nu, Schoenobius spp., например, Schoenobius bipunctifer, Scirpophaga spp., например, Scirpophaga innotata, Scotia segetum, Sesamia spp., например, Sesamia inferens, Sparganothis spp., Spodoptera spp., например, Spodoptera eradiana, Spodoptera exigua, Spodoptera frugiperda, Spodoptera praefica, Stathmopoda spp., Stomopteryx subsecivella, Synanthedon spp., Tecia solanivora, Thermesia gemmatalis, Tinea cloacella, Tinea pellionella, Tineola bisselliella, Tortrix spp., Trichophaga tapetzella, Trichoplusia spp., например, Trichoplusia ni, Tryporyza incertulas, Tuta absoluta, Virachola spp.;
из отряда Прямокрылые или Ортоптероидные, например, Acheta domesticus, Dichroplus spp., Gryllotalpa spp., например, Gryllotalpa gryllotalpa, Hieroglyphus spp., Locusta spp., например, Locusta migratoria, Melanoplus spp., например, Melanoplus devastator, Paratlanticus ussuriensis, Schistocerca gregaria;
из отряда Пухоеды и вши, например, Damalinia spp., Haematopinus spp., Linognathus spp., Pediculus spp., Phylloxera vastatrix, Phthirus pubis, Trichodectes spp.;
из отряда Сеноеды, например, Lepinotus spp., Liposcelis spp.;
из отряда Блохи, например, Ceratophyllus spp., Ctenocephalides spp., например, Ctenocephalides cams, Ctenocephalides felis, Pulex irritans, Tunga penetrans, Xenopsylla cheopis;
из отряда Бахромчатокрылые, например, Anaphothrips obscurus, Baliothrips biformis, Drepanothrips reuteri, Enneothrips flavens, Frankliniella spp., например, Frankliniella fusca, Frankliniella occidentalis, Frankliniella schultzei, Frankliniella tritici, Frankliniella vaccinii, Frankliniella williamsi, Heliothrips spp., Hercinothrips femoralis, Rhipiphorothrips cruentatus, Scirtothrips spp., Taeniothrips cardamomi, Thrips spp., например, Thrips palmi, Thrips tabaci;
из отряда Щетинохвостки (=Thysanura), например, Ctenolepisma spp., Lepisma saccharina, Lepismodes inquilinus, Thermobia domestica;
из класса Симфилы, например, Scutigerella spp., например, Scutigerella immaculata;
вредители из филума Моллюски, например, из класса Bivalvia, например, Dreissena spp.,
а также из класса Брюхоногие, например, Arion spp., например, Arion ater rafus, Biomphalaria spp., Bulinus spp., Deroceras spp., например, Deroceras laeve, Galba spp., Lymnaea spp., Oncomelania spp., Pomacea spp., Succinea spp.;
Животные вредители из штамма Плоские глисты и Нематоды, например, Ancylostoma spp., например, Ancylostoma duodenale, Ancylostoma ceylanicum, Ancylostoma braziliensis, Ascaris spp., Brugia malayi, Brugia timori, Bunostomum spp., Chabertia spp., Clonorchis spp., Cooperia spp., Dicrocoelium spp., Dictyocaulus filaria, Diphyllobothrium latum, Dracunculus medinensis, Echinococcus granulosus, Echinococcus multilocularis, Enterobius vermicularis, Faciola spp., Haemonchus spp., Heterakis spp., Hymenolepis nana, Hyostrongulus spp., Loa Loa, Nematodirus spp., Oesophagostomum spp., Opisthorchis spp., Onchocerca volvulus, Ostertagia spp., Paragonimus spp., Schistosomen spp., Strongyloides fuelleborni, Strongyloides stercoralis, Stronyloides spp., Taenia saginata, Taenia solium, Trichinella spiralis, Trichinella nativa, Trichinella britovi, Trichinella nelsoni, Trichinella pseudopsiralis, Trichostrongulus spp., Trichuris Trichuria, Wuchereria bancrofti;
Вредители растений из штамма Нематоды, т.е. паразитические на растениях нематоды, наиболее предпочтительно Aglenchus spp., например, Aglenchus agricola, Anguina spp., например, Anguina tritici, Aphelenchoides spp., например, Aphelenchoides arachidis, Aphelenchoides fragariae, Belonolaimus spp., например, Belonolaimus gracilis, Belonolaimus longicaudatus, Belonolaimus nortoni, Bursaphelenchus spp., например, Bursaphelenchus cocophilus, Bursaphelenchus eremus, Bursaphelenchus xylophilus, Cacopaurus spp., например, Cacopaurus pestis, Criconemella spp., например, Criconemella curvata, Criconemella onoensis, Criconemella ornata, Criconemella rusium, Criconemella xenoplax (=Mesocriconema xenoplax), Criconemoides spp., например, Criconemoides ferniae, Criconemoides onoense, Criconemoides ornatum, Ditylenchus spp., например, Ditylenchus dipsaci, Dolichodorus spp., Globodera spp., например, Globodera pallida, Globodera rostochiensis, Helicotylenchus spp., например, Helicotylenchus dihystera, Hemicriconemoides spp., Hemicycliophora spp., Heterodera spp., например, Heterodera avenae, Heterodera glycines, Heterodera schachtii, Hoplolaimus spp., Longidorus spp., например, Longidorus africanus, Meloidogyne spp., например, meloidogyne chitwoodi, Meloidogyne fallax, Meloidogyne hapla, Meloidogyne incognita, Meloinema spp., Nacobbus spp., Neotylenchus spp., Paraphelenchus spp., Paratrichodorus spp., например, Paratrichodorus minor, Pratylenchus spp., например, Pratylenchus penetrans, Pseudohalenchus spp., Psilenchus spp., Punctodera spp., Quinisulcius spp., Radopholus spp., например, Radopholus citrophilus, Radopholus similis, Rotylenchulus spp., Rotylenchus spp., Scutellonema spp., Subanguina spp., Trichodorus spp., например, Trichodorus obtusus, Trichodorus primitives, Tylenchorhynchus spp., например, Tylenchorhynchus annulatus, Tylenchulus spp., например, Tylenchulus semipenetrans, Xiphinema spp., например, Xiphinema index;
Кроме того, возможно бороться, из подцарства простейшие, с отрядом Кокцидии, например, Eimeria spp
Соединения формулы (I) могут, необязательно, при определенных условиях или нормах нанесения, также применяться в качестве гербицидов, защитных средств, регуляторов роста или средств для улучшения свойств растений, в качестве микробиоцидов или гаметоцидов, например, в качестве фунгицидов, противогрибковых средств, бактерицидов, вирицидов (включая средства против вироидов) или в качестве агентов против MLO (микоплазма-подобные организмы) и RLO (риккетсия-подобные организмы). Если является подходящим, они могут применяться в качестве промежуточных соединений или предшественников для синтеза других активных соединений.
Настоящее изобретение также относится к композициям и формам применения, полученным из них, в качестве пестицидов, например, жидкостей для смачивания, окунания и распыления, содержащим по меньшей мере одно соединение формулы (I). В некоторых случаях, формы применения содержат дополнительные пестициды и/или адъюванты, которые улучшают действие, как например, пенетранты, примерами являются растительные масла, такие как, например, рапсовое масло, подсолнечное масло, минеральные масла, такие как, например, жидкие парафины, алкиловые сложные эфиры растительных жирных кислот, как например, метиловый сложный эфир рапсового масла или соевого масла, или алканол алкоксилаты, и/или распределители, такие как, например, алкилсилоксаны и/или соли, примерами являются органические или неорганические аммониевые или фосфониевые соли, примерами является сульфат аммония или гидрофосфат диаммония, и/или промоторы сдерживания, как например, диоктилсульфосукцинаты или гидрокси-пропилгуаровые полимеры, и/или увлажняющие вещества, как например, глицерин, и/или удобрения, как например, аммониевые, калиевые или фосфорные удобрения.
Типичными композициями являются, например, растворимые в воде жидкости (SL), эмульгируемые концентраты (ЕС), эмульсии в воде (EW), концентраты в виде суспензий (SC, SE, FS, OD), диспергируемые в воде гранулы (WG), гранулы (GR) и капсульные концентраты (CS); эти и другие типы композиций описаны, например, в Crop Life International и в Pesticide Specifications, Manual on development and use of FAO and WHO specifications for pesticides, FAO Plant Production and Protection Papers - 173, prepared by the FAO/WHO Joint Meeting on Pesticide Specifications, 2004, ISBN: 9251048576. Композиции могут содержать активные сельскохозяйственные соединения, отличные от одного или более соединений формулы (I) согласно настоящему изобретению.
Рассматриваемые композиции и формы применения предпочтительно содержат вспомогательные вещества, как например, наполнители, растворители, промоторы самопроизвольности, носители, эмульгаторы, диспергирующие средства, защищающие от мороза вещества, биоциды, загустители и/или другие вспомогательные вещества, как например, адъюванты, например. Адъювантом в этом контексте является компонент, который усиливает биологический эффект композиции, причем компонент сам по себе не обладает биологическим эффектом. Примерами адъювантов являются агенты, которые промотируют удерживание, распределение, присоединение к поверхности листа или проникновение.
Эти композиции получают известным образом, например, путем смешивания соединений формулы (I) со вспомогательными веществами, такими как, например, наполнители, растворители и/или твердые носители и/или другие вспомогательные вещества, такие как, например, поверхностно-активные вещества. Композиции получают либо в подходящих растениях или еще до или в ходе применения.
Подходящими для применения вспомогательными веществами являются вещества, которые подходят для придания конкретных свойств, как например, определенные физические, технические и/или биологические свойства, композициям соединения формулы (I) или полученным из них формам применения (как например, готовые к применению пестициды, как например, жидкости для распыления или подкормки семян).
Подходящие наполнители представляют собой, например, воду, полярные и неполярные органические химические жидкости, например из классов ароматических и неароматических углеводородов (как например, парафины, алкилбензолы, алкилнафталины, хлорбензолы), спирты и полиолы (которые, если подходит, могут также быть замещенными, этерифицированными и/или эстерифицированными), кетоны (как например, ацетон, циклогексанон), сложные эфиры (включая жиры и масла) и простые (поли)эфиры, незамещенные и замещенные амины, амиды, лактамы (как например, N-алкилпирролидоны) и лактоны, сульфоны и сульфоксиды (как например, диметилсульфоксид).
Если используемый наполнитель является водой, также возможно, например, применять органические растворители в качестве вспомогательных растворителей. Подходящие жидкие растворители представляют собой по существу: ароматические соединения, такие как ксилол, толуол или алкилнафталины, хлорированные ароматические соединения или хлорированные алифатические углеводороды, такие как хлорбензолы, хлорэтилены или метиленхлорид, алифатические углеводороды, такие как циклогексан или парафины, например фракции минерального масла, минеральные и растительные масла, спирты, такие как бутанол или гликоль, а также их простые эфиры и сложные эфиры, кетоны, такие как ацетон, метилэтилкетон, метилизобутилкетон или циклогексанон, сильнополярные растворители, такие как диметилформамид и диметилсульфоксид, а также воду.
На самом деле, возможно применять все подходящие растворители. Подходящими растворителями являются, например, ароматические углеводороды, как например, такие как ксилол, толуол или алкилнафталины, например, хлорированные ароматические или алифатические углеводороды, как например, хлорбензол, хлорэтилен или метиленхлорид, например, алифатические углеводороды, как например, циклогексан, например, парафины, фракции петролейного эфира, минеральные и растительные масла, спирты, как например, метанол, этанол, изопропанол, бутанол или гликоль, например, а также их простые эфиры и сложные эфиры, кетоны, как например, ацетон, метил этил кетон, метил изобутил кетон или циклогексанон, например, сильнополярные растворители, как например диметилсульфоксид, а также вода.
В принципе могут применяться все подходящие носители. Подходящими носителями в частности являются: например, аммониевые соли и обнаруживаемые в земле природные полезные ископаемые, как например, каолины, глины, тальк, мел, кварц, аттапульгит, монтмориллонит или диатомовая земля, и обнаруживаемые в земле синтетические минералы, как например, тонко измельченный кварц, глинозем, и природные или синтетические силикаты, смолы, воски и/или твердые удобрения. Подобным образом могут применяться смеси таких носителей. Носители, подходящие для гранул, включают следующие: например, измельченные и фракционированные природные минералы, как например, кальцит, мрамор, пемза, сепиолит, доломит, а также синтетические гранулы неорганической и органической муки, а также гранулы органического материала, как например, древесные опилки, бумага, кокосовая скорлупа, початки кукурузы и стебли табака.
Также могут применяться сжиженные газообразные наполнители или растворители. Особенно подходящими являются наполнители или носители, которые являются газообразными при стандартной температуре и при стандартном давлении, примерами являются аэрозольные пропелленты, как например, галогенированные углеводороды, а также бутан, пропан, азот и диоксид углерода.
Примерами эмульгаторов и/или пенообразователей, диспергирующих веществ или смачивающих веществ, имеющих ионные или неионные свойства, или смесей этих поверхностно-активных веществ, являются соли полиакриловой кислоты, соли лигносульфоновой кислоты, соли фенолсульфоновой кислоты или нафталинсульфоновой кислоты, поликонденсаты этиленоксида с жирными спиртами или с жирными кислотами или с аминами жирных кислот, с замещенными фенолами (предпочтительно алкилфенолы или арилфенолы), соли сульфосукциновых сложных эфиров, тауриновые производные (предпочтительно алкилтаураты), фосфорные сложные эфиры полиэтоксилированных спиртов или фенолов, сложные эфиры жирных кислот и полиолов, и производные соединений, содержащие сульфаты, сульфонаты и фосфаты, примерами являются алкиларилполигликолевые простые эфиры, алкилсульфонаты, алкилсульфаты, арилсульфонаты, гидролизаты белков, лигнин-сульфитный щелок и метилцеллюлоза. Присутствие поверхностно-активного вещества предпочтительно, если одно из соединений формулы (I) и/или один из инертных носителей нерастворим в воде и если применение осуществляется в воде.
Возможно применение красителей, таких как неорганические пигменты, примерами являются оксид железа, оксид титана, берлинская лазурь, и органические красители, как например, ализариновые красители, азокрасители и красители на основе фталоцианинов металлов, и питательных веществ и микроэлементов, таких как, соли железа, марганца, бора, меди, кобальта, молибдена и цинка, в качестве других вспомогательных веществ, которые могут присутствовать в композициях и в формах применения, полученных из них.
Дополнительными компонентами могут быть стабилизаторы, как например низкотемпературные стабилизаторы, консерванты, антиоксиданты, светостабилизаторы, или другие агенты, которые улучшают химическую и/или физическую стабильность. Дополнительно могут присутствовать пенообразователи или пеногасители.
Связующие вещества, такие как, карбоксиметилцеллюлоза и природные и синтетические полимеры в форме порошка, гранул или латексной форме, как например, гуммиарабик, поливиниловый спирт, поливинилацетат, или еще природные фосфолипиды, как например, цефалины и лецитины, и синтетические фосфолипиды могут присутствовать в качестве других вспомогательных веществ в композициях и в формах применения, полученных из них. Другие возможные вспомогательные вещества включают минеральные и растительные масла.
Необязательно, другие вспомогательные вещества могут присутствовать в композициях и полученных из них формах применения. Примеры таких добавок включают ароматизирующие вещества, защитные коллоиды, связующие вещества, адгезивы, загустители, тиксотропные вещества, пенетранты, промоторы сдерживания, стабилизаторы, секвестранты, комплексообразователи, увлажняющие вещества и распределители. Говоря в общем, соединения формулы (I) могут объединяться с любой твердой или жидкой добавкой, обычно применяемой в целях получения композиции.
Подходящие промоторы сдерживания включают все вещества, которые уменьшают динамическое поверхностное натяжение, как например, диоктилсульфосукцинат, или повышают вязкоупругость, как например, гидроксипропилгуаровые полимеры.
Подходящие пенетранты в контексте настоящего изобретения включают все вещества, которые, как правило, применяются для усиления проникновения активных сельскохозяйственных соединений в растения. Пенетранты в контексте настоящего изобретения определяются тем, что из (как правило, водного) применяемого раствора и/или из распыляемого покрытия они способны проникать в кожицу растения и, таким образом, повышать подвижность активных соединений в кожице. Это свойство может определяться с применением способа, описанного в литературе (Baur et al., 1997, Pesticide Science 51, 131-152). Примеры включают алкоксилаты спиртов, как например, этоксилат кокосового жира (10) или изотридецил этоксилат (12), сложные эфиры жирных кислот, как например, метиловые сложные эфиры рапсового или соевого масла, аминалкоксилаты жиров, как например, талового жира амин этоксилат (15), или аммониевые и/или фосфониевые соли, как например, сульфат аммония, или гидрофосфат диаммония.
Композиции предпочтительно содержат от 0.00000001 мас. % до 98 мас. % соединения формулы (I) или особенно предпочтительно от 0.01 мас. % до 95% мас. % соединения формулы (I), более предпочтительно от 0.5 мас. % до 90% мас. % соединения формулы (I), от массы композиции.
Содержание соединения формулы (I) в формах применения, полученных из композиций (в частности пестициды), может варьироваться в широких диапазонах. Концентрация соединения формулы (I) в формах применения может, как правило, лежать в интервале от 0.00000001 мас. % до 95 мас. % соединения формулы (I), предпочтительно от 0.00001 мас. % до 1 мас. %, от массы формы применения. Соединения применяются обычным образом, адаптированным для форм применения.
Соединения формулы (I) могут также применяться в виде смеси с одним или более подходящими фунгицидами, бактерицидами, акарицидами, моллюскицидами, нематицидами, инсектицидами, микробиологическими средствами, полезными видами, гербицидами, удобрениями, репеллентами от птиц, фитотонизирующими средствами, стерилизующими средствами, защитными средствами, химическими сигнальными веществами и/или регуляторами роста растений, чтобы, таким образом, например, расширить спектр действия, увеличить продолжительность действия, увеличить скорость действия, предотвратить отторжение или предотвратить развитие резистентности. В дополнение, такие комбинации активных соединений могут улучшить рост растений и/или толерантность к абиотическим факторам, например, высоким или низким температурам, к засухе или увеличенному содержанию воды или солености почвы. Также возможно улучшить цветение и эффективность плодоношения, оптимизировать способность к прорастанию и развитие корня, ускорить сбор урожая и улучшить выходы, повлиять на созревание, улучшить качество и/или питательную ценность собранных продуктов, увеличить срок хранения и/или улучшить обрабатываемость собранных продуктов.
Кроме того, соединения формулы (I) могут присутствовать в смеси с другими активными соединениями или химическими сигнальными веществами, такими как привлекающие вещества и/или репелленты от птиц и/или растительные активаторы и/или регуляторы роста и/или удобрения. Подобным образом, соединения формулы (I) могут применяться для улучшения свойств растений, таких как, например, рост, выход и качество собранного вещества.
В конкретном варианте выполнения настоящего изобретения, соединения формулы (I) присутствуют в композициях или формах применениях, полученных из этих композиций, в смеси с другими соединениями, предпочтительно описанными далее.
Если одно из соединений, упомянутых далее, может существовать в различных таутомерных формах, все эти формы также охватываются, даже если специально не упоминаются в каждом случае.
Инсектициды/акарициды/нематициды
Активные ингредиенты, указанные под их "общим названием" известны и описаны, например, в справочнике пестицидов ("The Pesticide Manual" 16th Ed., British Crop Protection Council 2012) или могут быть обнаружены в интернете (например, http://www.alanwood.net/pesticides).
(1) Ингибиторы ацетилхолинэстеразы (AChE), например карбаматы, например, Аланикарб, Альдикарб, Бендиокарб, Бенфуракарб, Бутокарбоксим, Бутоксикарбоксим, Карбарил, Карбофуран, Карбосульфан, Этиофенкарб, Фенобукарб, Форметанат, Фуратиокарб, Изопрокарб, Метиокарб, Метомил, Метолкарб, Оксамил, Пиримикарб, Пропоксур, Тиодикарб, Тиофанокс, Триазамат, Триметакарб, ХМС, и Ксилилкарб; или фосфорорганические соединения, например, Ацефат, Азаметифос, Азинфос-этил, Азинфос-метил, Кадузафос, Хлорэтоксифос, Хлорфенвинфос, Хлормефос, Хлорпирифос, Хлорпирифос-метил, Кумафос, Цианофос, Деметон-S-метил, Диазинон, Дихлорвос/DDVP, Дикротофос, Диметоат, Диметилвинфос, Дисульфотон, EPN, Этион, Этопрофос, Фамфур, Фенамифос, Фенитротион, Фентион, Фостиазат, Гептенофос, Имициафос, Изофенфос, Изопропил-О-(метоксиаминотио-фосфорил) салицилат, Изоксатион, Малатион, Мекарбам, Метамидофос, Метидатион, Мевинфос, Монокротофосфос, Налед, Ометоат, Оксидеметон-метил, Паратион, Паратион-метил, Фентоат, Форат, Фосалон, Фосмет, Фосфамидон, Фоксим, Пиримифос-метил, Профенофос, Пропетамфос, Протиофос, Пираклофос, Пиридафентион, Хиналфос, Сульфотеп, Тебупиримфос, Темефос, Тербуфос, Тетрахлорвинфос, Тиометон, Триазофос, Трихлорфон и Вамидотион.
(2) Антагонисты ГАМК-зависимого хлоридного канала, например циклодиеновые хлорорганические соединения, например, Хлордан и Эндосульфан; или фенилпиразолы (фипролы), например, Этипрол и Фипронил.
(3) Модуляторы натриевого канала / Блокаторы потенциал-зависимого натриевого канала, например пиретроиды, например, Акринатрин, Аллетрин, d-цис-транс Аллетрин, d-транс-Аллетрин, Бифентрин, Биоаллетрин, Биоаллетрина S-циклопентенил-изомер, Биоресметрин, Циклопротрин, Цифлутрин, бета-Цифлутрин, Цигалотрин, лямбда-Цигалотрин, гамма-Цигалотрин, Циперметрин, альфа-Циперметрин, бета-Циперметрин, тета-Циперметрин, зета-Циперметрин, Цифенотрин [(1R)-транс-изомеры], С.3.6 Дельтаметрин, Эмпентрин [(EZ)-(1R) изомеры), Эсфенвалерат, Этофенпрокс, Фенпропатрин, Фенвалерат, Флуцитринат, Флуметрин, тау-Флувалинат, Галфенпрокс, Имипротрин, Кадетрин, Перметрин, Фенотрин [(1R)-транс-изомер), Праллетрин, Пиретрин (пиретрум), Ресметрин, Силафлуофен, Тефлутрин, Тетраметрин, Тетраметрин [(1R) изомеры)], Тралометрин, и Трансфлутрин; или ДДТ; или Метоксихлор.
(4) Агонисты никотинового холинорецептора (nAChR), например, неоникотинои-ды, например, Ацетамиприд, Клотианидин, Динотефуран, Имидаклоприд, Нитенпирам, Тиаклоприд, и Тиаметоксам; или Никотин; или Сульфоксахлор.
(5) Аллостерические активаторы никотинового холинорецептора (nAChR), например спиносины, например, Спинеторам и Спиносад.
(6) Активаторы хлоридного канала, например авермектины/мильбемицины, например, Абамектин, Эмамектина бензоат, Лепимектин и Мильбемектин.
(7) Миметики ювенильного гормона, например, аналоги ювенильного гормона, например, Гидропрен, Кинопрен и Метопрен; или Феноксикарб; или Пирипроксифен.
(8) Активные соединения с неизвестными или неспецифическими механизмами действия, такие как, например, алкилгалогениды, например, метилбромид и другие алкилгалогениды; или хлорпикрин; или сульфурилфторид; или Боракс; или антимонил-тартрат калия.
(9) Селективные блокаторы питания равнокрылых, например, Пиметрозин; или Флоникамид.
(10) Ингибиторы роста клещей, например, Клофентезин, Гекситиазокс, и Дифловидазин; или Этоксазол.
(11) Микробные разрушители мембран средней кишки насекомых, например, Bacillus thuringiensis subspecies israelensis, Bacillus sphaericus, Bacillus thuringiensis subspecies aizawai, Bacillus thuringiensis, подвид kurstaki, Bacillus thuringiensis subspecies tenebrionis, и ВТ растительные белки: Cry1Ab, Cry1Ac, Cry1Fa, Cry2Ab, mCry3A, Cry3Ab, Cry3Bb, Cry34/35Ab1.
(12) Ингибиторы окислительного фосфорилирования, АТФ дезинтеграторы, такие как, например; или оловоорганические митициды, например, Азоциклотин, Цигексатин, и Фенбутатина оксид; или Пропаргит; или Тетрадифон.
(13) Средства, разобщающие окислительное фосфорилирование посредством разрушения протонового градиента, например, Хлорфенапир, DNOC и Сульфлурамид.
(14) Антагонисты никотинергического ацетилхолинового рецептора, такие как, например, Бенсультап, Картапа гидрохлорид, Тиоциклам и Тиосультап-натрий.
(15) Ингибиторы биосинтеза хитина, типа 0, например Бистрифлурон, Хлофлуазурон, Дифлубензурон, Флуциклоксурон, Флуфеноксурон, Гексафлумурон, Луфенурон, Новалурон, Новифлумурон, Тефлубензурон и Трифлумурон.
(16) Ингибиторы биосинтеза хитина, типа 1, например Бупрофезин.
(17) Ингибиторы линьки (в частности для Двукрылых, т.е. мух), такие как, например, Циромазин.
(18) Агонисты рецептора экдизона, например Хромафенозид, Галофенозид, Метоксифенозид и Тебуфенозид.
(19) Октопаминергические агонисты, такие как, например, Амитраз.
(20) Ингибиторы транспорта электронов митохондриального комплекса III, например Гидраметилнон; или Ацехиноцил; или Флуакрипирим.
(21) Ингибиторы транспорта электронов митохондриального комплекса I, например, из группы METI акарицидов, например, Феназахин, Фенпироксимат, Пиримидифен, Пиридабен, Тебуфенпирад и Толфенпирад; или Ротенон (Деррис).
(22) Блокаторы потенциалзависимого натриевого канала, например, Индоксакарб; или Метафлумизон.
(23) Ингибиторы ацетил-КоА-карбоксилазы, например, производные тетроновой и тетраминовой кислоты, например, кетоенолы, такие как, в частности, Спиротетрамат, Спиромезифен и Спиродиклофен.
(24) Ингибиторы транспорта электронов митохондриального комплекса IV, например, фосфины, например, фосфид алюминия, фосфид кальция, Фосфин и фосфид цинка; или Цианид.
(25) Ингибиторы транспорта электронов митохондриального комплекса II, например, Циенопирафен и Цифлуметофен.
(28) Эффекторы рианодинового рецептора, такие как, например, диамиды, например, хлорантранилипрол, циантранилипол и флубендиамид,
другие активные соединения, такие как, например, афидопиропен, азадирахтин, бенклотиаз, бензоксимат, бифеназат, бромпропилат, хинометионат, криолит, дикофол, дифловидазин, флуенсульфон, флометоквин, флуфенерим, флуфеноксистробин, флуфипрол, флуопирам, флупирадифурон, фуфенозид, гептафлутрин, имидаклотиз, ипродион, меперфлутрин, паичонгдинг, пифлубумид, пирифлуквиназон, пириминостробин, тетраметилфлутрин и иодметан; кроме того, препараты на основе Bacillus firmus (I-1582, BioNeem, Votivo), а также следующие соединения: 3-бром-N-{2-бром-4-хлор-6-[(1-циклопропилэтил)карбамоил]фенил}-1-(3-хлорпиридин-2-ил)-1Н-пиразол-5-карбоксамид (известно из WO 2005/077934) и 1-{2-фтор-4-метил-5-[(2,2,2-трифторэтил)сульфинил]фенил}-3-(трифторметил)-1H-1,2,4-триазол-5-амин (известно из WO 2006/043635), {1'-[(2Е)-3-(4-хлорфенил)проп-2-ен-1-ил]-5-фторспиро[индол-3,4'-пиперидин]-1(2Н)-ил}(2-хлорпиридин-4-ил)метанон (известно из WO 2003/106457), 2-хлор-N-[2-{1-[(2Е)-3-(4-хлорфенил)проп-2-ен-1-ил]пиперидин-4-ил}-4-(трифторметил)фенил]изоникотинамид (известно из WO 2006/003494), 3-(2,5-диметилфенил)-4-гидрокси-8-метокси-1,8-диазаспиро[4.5]дец-3-ен-2-он (известно из WO 2009/049851), 3-(2,5-диметилфенил)-8-метокси-2-оксо-1,8-диазаспиро[4.5]дец-3-ен-4-ил-этилкарбонат (известно из WO 2009/049851), 4-(бут-2-ин-1-илокси)-6-(3,5-диметилпиперидин-1-ил)-5-фторпиримидин (известно из WO 2004/099160), 4-(бут-2-ин-1-илокси)-6-(3-хлорфенил)пиримидин (известно из WO 2003/076415), PF1364 (CAS Reg. No. 1204776-60-2), 4-[5-(3,5-дихлорфенил)-5-(трифторметил)-4,5-дигидро-1,2-оксазол-3-ил]-2-метил-N-{2-оксо-2-[(2,2,2-трифторэтил)амино]этил}бензамид (известно из WO 2005/085216), 4-{5-[3-хлор-5-(трифторметил)фенил]-5-(трифторметил)-4,5-дигидро-1,2-оксазол-3-ил}-N-{2-оксо-2-[(2,2,2-трифторэтил)амино]этил}-1-нафтамид (известно из WO 2009/002809), метил 2-[2-({[3-бром-1-(3-хлорпиридин-2-ил)-1Н-пиразол-5-ил]карбонил}амино)-5-хлор-3-метилбензоил]-2-метилгидразинкарбоксилат (известно из WO 2005/085216), метил 2-[2-({[3-бром-1-(3-хлорпиридин-2-ил)-1Н-пиразол-5-ил]карбонил}амино)-5-циано-3-метилбензоил]-2-этилгидразинкарбоксилат (известно из WO 2005/085216), метил 2-[2-({[3-бром-1-(3-хлорпиридин-2-ил)-1H-пиразол-5-ил]карбонил}амино)-5-циано-3-метилбензоил]-2-метилгидразинкарбоксилат (известно из WO 2005/085216), метил 2-[3,5-дибром-2-({[3-бром-1-(3-хлорпиридин-2-ил)-1H-пиразол-5-ил]карбонил}амино)бензоил]-2-этилгидразинкарбоксилат (известно из WO 2005/085216), 1-(3-хлорпиридин-2-ил)-N-[4-циано-2-метил-6-(метилкарбамоил)фенил]-3-{[5-(трифторметил)-2Н-тетразол-2-ил]метил}-1Н-пиразол-5-карбоксамид (известно из WO 2010/069502), N-[2-(5-амино-1,3,4-тиадиазол-2-ил)-4-хлор-6-метилфенил]-3-бром-1-(3-хлорпиридин-2-ил)-1Н-пиразол-5-карбоксамид (известно из CN 102057925), 3-хлор-N-(2-цианопропан-2-ил)-N-[4-(1,1,1,2,3,3,3-гептафторпропан-2-ил)-2-метилфенил]фталамид (известно из WO 2012/034472), 8-хлор-N-[(2-хлор-5-метоксифенил)сульфонил]-6-(трифторметил)имидазо[1,2-а]пиридин-2-карбоксамид (известно из WO 2010/129500), 4-[5-(3,5-дихлорфенил)-5-(трифторметил)-4,5-дигидро-1,2-оксазол-3-ил]-2-метил-N-(1-оксидотиэтан-3-ил)бензамид (известно из WO 2009/080250), 4-[5-(3,5-дихлорфенил)-5-(трифторметил)-4,5-дигидро-1,2-оксазол-3-ил]-2-метил-N-(1-оксидотиэтан-3-ил)бензамид (известно из WO 2012/029672), 1-[(2-хлор-1,3-тиазол-5-ил)метил]-4-оксо-3-фенил-4Н-пиридо[1,2-а]пиримидин-1-иум-2-олат (известно из WO 2009/099929), 1-[(6-хлорпиридин-3-ил)метил]-4-оксо-3-фенил-4Н-пиридо[1,2-а]пиримидин-1-иум-2-олат (известно из WO 2009/099929), (5S,8R)-1-[(6-хлорпиридин-3-ил)метил]-9-нитро-2,3,5,6,7,8-гексагидро-1Н-5,8-эпоксиимидазо[1,2-а]азепин (известно из WO 2010/069266), (2Е)-1-[(6-хлорпиридин-3-ил)метил]-N'-нитро-2-пентилиденгидразинкарбоксимидамид (известно из WO 2010/060231), 4-(3-{2,6-дихлор-4-[(3,3-дихлорпроп-2-ен-1-ил)окси]фенокси}пропокси)-2-метокси-6-(трифторметил)пиримидин (известно из CN 101337940), N-[2-(трет-бутилкарбамоил)-4-хлор-6-метилфенил]-1-(3-хлорпиридин-2-ил)-3-(фторметокси)-1Н-пиразол-5-карбоксамид (известно из WO 2008/134969).
Фунгициды
Активные соединения, указанные в настоящей заявке под их общим наименованием, известны и описываются, например, в "Pesticide Manual" или в интернете (например,: http://www.alanwood.net/pesticides).
(1) Ингибиторы биосинтеза эргостерина, такие как, например, (1.1) алдиморф, (1.2) азаконазол, (1.3) битетртанол, (1.4) бромуконазол, (1.5) ципроконазол, (1.6) диклобутразол, (1.7) дифеноконазол, (1.8) диниконазол, (1.9) диниконазол-М, (1.10) додеморф, (1.11) додеморф ацетат, (1.12) эпоксиконазол, (1.13) этаконазол, (1.14) фенаримол, (1.15) фенбуконазол, (1.16) фенгексамид, (1.17) фенпропидин, (1.18) фенпропиморф, (1.19) флуквинконазол, (1.20) флупримидол, (1.21) флусилазол, (1.22) флутриафол, (1.23) фурконазол, (1.24) фурконазол-цис, (1.25) гексаконазол, (1.26) имазалил, (1.27) имазалил сульфат, (1.28) имибенконазол, (1.29) ипконазол, (1.30) метконазол, (1.31) миклобутанил, (1.32) нафтифин, (1.33) нуаримол, (1.34) окспоконазол, (1.35) паклобутразол, (1.36) пефуразоат, (1.37) пенконазол, (1.38) пипералин, (1.39) прохлораз, (1.40) пропиконазол, (1.41) протиоконазол, (1.42) пирибутикарб, (1.43) пирифенокс, (1.44) квинконазол, (1.45) семиконазол, (1.46) спироксамин, (1.47) тебуконазол, (1.48) тербинафин, (1.49) тетраконазол, (1.50) триадимефон, (1.51) триадименол, (1.52) тридеморф, (1.53) трифлумизол, (1.54) трифорин, (1.55) тритиконазол, (1.56) униконазол, (1.57) униконазол-Р, (1.58) виниконазол, (1.59) вориконазол, (1.60) 1-(4-хлорфенил)-2-(1Н-1,2,4-триазол-1-ил)циклогептанол, (1.61) метил 1-(2,2-диметил-2,3-дигидро-1Н-инден-1-ил)-1Н-имидазол-5-карбоксилат, (1.62) N'-{5-(дифторметил)-2-метил-4-[3-(триметилсилил)пропокси]фенил}-N-этил-N-метилимидоформамид, (1.63) N-этил-N-метил-N'-{2-метил-5-(трифторметил)-4-[3-(триметилсилил)пропокси]фенил}имидоформамид и (1.64) O-[1-(4-метоксифенокси)-3,3-диметилбутан-2-ил]-1Н-имидазол-1-карботиоат, (1.65) пиризоксазол.
(2) Ингибиторы дыхания (ингибиторы дыхательной цепи), такие как, например, (2.1) биксафен, (2.2) боскалид, (2.3) карбоксин, (2.4) дифлуметорим, (2.5) фенфурам, (2.6) флуопирам, (2.7) флутоланил, (2.8) флуксапироксид, (2.9) фураметпир, (2.10) фурмециклокс, (2.11) изопиразамная смесь syn-эпимерного рацемата 1RS,4SR,9RS и anti-эпимерного рацемата 1RS,4SR,9SR, (2.12) изопиразам (anti-эпимерный рацемат), (2.13) изопиразам (anti-эпимерный энантиомер 1R,4S,9S), (2.14) изопиразам (anti-эпимерный энантиомер 1S,4R,9R), (2.15) изопиразам (syn-эпимерный рацемат 1RS,4SR,9RS), (2.16) изопиразам (syn-эпимерный энантиомер 1R,4S,9R), (2.17) изопиразам (syn-эпимерный энантиомер 1S,4R,9S), (2.18) мепронил, (2.19) оксикарбоксин, (2.20) пенфлуфен, (2.21) пентиопирад, (2.22) седаксан, (2.23) трифлузамид, (2.24) 1-метил-N-[2-(1,1,2,2-тетрафторэтокси)фенил]-3-(трифторметил)-1Н-пиразол-4-карбоксамид, (2.25) 3-(дифторметил)-1-метил-N-[2-(1,1,2,2-тетрафторэтокси)фенил]-1Н-пиразол-4-карбоксамид, (2.26) 3-(дифторметил)-N-[4-фтор-2-(1,1,2,3,3,3-гексафторпропокси)фенил]-1-метил-1Н-пиразол-4-карбоксамид, (2.27) N-[1-(2,4-дихлорфенил)-1-метоксипропан-2-ил]-3-(дифторметил)-1-метил-1H-пиразол-4-карбоксамид, (2.28) 5,8-дифтор-N-[2-(2-фтор-4-{[4-(трифторметил)пиридин-2-ил]окси}фенил)этил]хиназолин-4-амин, (2.29) бензовиндифлупир, (2.30) N-[(1S,4R)-9-(дихлорметилен)-1,2,3,4-тетрагидро-1,4-метаннафталин-5-ил]-3-(дифторметил)-1-метил-1H-пиразол-4-карбоксамид и (2.31) N-[(1R,4S)-9-(дихлорметилен)-1,2,3,4-тетрагидро-1,4-метаннафталин-5-ил]-3-(дифторметил)-1-метил-1H-пиразол-4-карбоксамид, (2.32) 3-(дифторметил)-1-метил-N-(1,1,3-триметил-2,3-дигидро-1H-инден-4-ил)-1Н-пиразол-4-карбоксамид, (2.33) 1,3,5-триметил-N-(1,1,3-триметил-2,3-дигидро-1H-инден-4-ил)-1Н-пиразол-4-карбоксамид, (2.34) 1-метил-3-(трифторметил)-N-[-(1,1,3-триметил-2,3-дигидро-1H-инден-4-ил)-1H-пиразол-4-карбоксамид, (2.35) 1-метил-3-(трифторметил)-N-[(3R)-1,1,3-триметил-2,3-дигидро-1H-инден-4-ил]-1Н-пиразол-4-карбоксамид, (2.36) 1-метил-3-(трифторметил)-N-[(3S)-1,1,3-триметил-2,3-дигидро-1H-инден-4-ил]-1H-пиразол-4-карбоксамид, (2.37) 3-(дифторметил)-1-метил-N-[(3S)-1,1,3-триметил-2,3-дигидро-1H-инден-4-ил]-1H-пиразол-4-карбоксамид, (2.38) 3-(дифторметил)-1-метил-N-[(3R)-1,1,3-триметил-2,3-дигидро-1Н-инден-4-ил]-1H-пиразол-4-карбоксамид, (2.39) 1,3,5-триметил-N-[-[(3R)-1,1,3-триметил-2,3-дигидро-1H-инден-4-ил]-1H-пиразол-4-карбоксамид, (2.40) 1,3,5-триметил-N-[(3S)-1,1,3-триметил-2,3-дигидро-1H-инден-4-ил]-1Н-пиразол-4-карбоксамид, (2.41) беноданил, (2.42) 2-хлор-N-(1,1,3-триметил-2,3-дигидро-1Н-инден-4-ил)пиридин-3-карбоксамид, (2.43) изофетамид.
(3) Ингибиторы дыхания (ингибиторы дыхательной цепи), действующие на комплекс III дыхательной цепи, такие как, например, (3.1) аметоктрадин, (3.2) амисулбром, (3.3) азокситробин, (3.4) циазофамид, (3.5) коуметоксистробин, (3.6) коумоксистробин, (3.5) димоксистробин, (3.8) энестробурин, (3.9) фамоксадон, (3.10) фенамидон, (3.11) флуфеноксистробин, (3.12) флуоксастробин, (3.13) крезоксим-метил, (3.14) метоминостробин, (3.15) оризастробин, (3.16) пикоксистробин, (3.17) пираклостробин, (3.18) пираметостробин, (3.19) пираоксистробин, (3.20) пирибенкарб, (3.21) триклопирикарб, (3.22) трифлоксистробин, (3.23) (2Е)-2-(2-{[6-(3-хлор-2-метилфенокси)-5-фторпиримидин-4-ил]окси}фенил)-2-(метоксиимино)-N-метилэтанамид, (3.24) (2Е)-2-(метоксиимино)-N-метил-2-(2-{[({(1Е)-1-[3-(трифторметил)фенил]этилиден}амино)окси]метил}фенил)этанамид, (3.25) (2Е)-2-(метоксиимино)-N-метил-2-{2-[(Е)-({1-[3-(трифторметил)фенил]этокси}имино)метил]фенил}этанамид, (3.26) (2Е)-2-{2-[({[(1Е)-1-(3-{[(Е)-1-фтор-2-фенилэтенил]окси}фенил)этилиден]амино}окси)метил]фенил}-2-(метоксиимино)-N-метилэтанамид, (3.27) (2Е)-2-{2-[({[(2E,3E)-4-(2,6-дихлорфенил)бут-3-ен-2-илиден]амино}окси)метил]фенил}-2-(метоксиимино)-N-метилэтанамид, (3.28) 2-хлор-N-(1,1,3-триметил-2,3-дигидро-1H-инден-4-ил)пиридин-3-карбоксамид, (3.29) 5-метокси-2-метил-4-(2-{[({(1Е)-1-[3-(трифторметил)фенил]этилиден}амино)окси]метил}фенил)-2,4-дигидро-3H-1,2,4-триазол-3-он, (3.30) метил (2Е)-2-{2-[({циклопропил[(4-метоксифенил)имино]метил}сульфанил)метил]фенил}-3-метоксипроп-2-еноат, (3.31) N-(3-этил-3,5,5-триметилциклогексил)-3-(формиламино)-2-гидроксибензамид, (3.32) 2-{2-[(2,5-диметилфенокси)метил]фенил}-2-метокси-N-метилацетамид, (4) ингибитора митоза и клеточного деления, такие как, например, (4.1) беномил, (4.2) карбендазим, (4.3) хлорфеназол, (4.4) диэтофенкарб, (4.5) этабоксам, (4.6) флуопиколид, (4.7) фуберидазол, (4.8) пенцикурон, (4.9) тиабендазол, (4.10) тиофанат-метил, (4.11) тиофанат, (4.12) зоксамид, (4.13) 5-хлор-7-(4-метилпиперидин-1-ил)-6-(2,4,6-трифторфенил)[1,2,4]триазол[1,5-а]пиримидин и (4.14) 3-хлор-5-(6-хлорпиридин-3-ил)-6-метил-4-(2,4,6-трифторфенил)пиридазин.
(5) Соединения, имеющие мультинаправленную активность, такие как, например, (5.1) бордосская жидкость, (5.2) каптафол, (5.3) каптан, (5.4) хлорталонил, (5.5) препараты меди, такие как гидроксид меди (5.6) нафтенат меди, (5.7) оксид меди, (5.8) оксихлорид меди, (5.9) сульфат меди, (5.10) дихлорфуанид, (5.11) дитианон, (5.12) додин, (5.13) до дин свободное основание, (5.14) фербам, (5.15) флуорфолпет, (5.16) фолпет, (5.17) квазатин, (5.18) квазатин ацетат, (5.19) иминоктадин, (5.20) иминоктадин албезилат, (5.21) иминоктадин триацетат, (5.22) манмедь, (5.23) манкозеб, (5.24) манеб, (5.25) метирам, (5.26) метирам цинка, (5.27) оксин меди, (5.28) пропамидин, (5.29) пропинеб, (5.30) сера и препараты серы, такие как, например, полисульфид кальция, (5.31) тирам, (5.32) толилфлуанид, (5.33) зинеб, (5.34) зирам и (5.35) анилазин.
(6) Индукторы резистентности, такие как, например, (6.1) ацибензолар-S-метил, (6.2) изотианил, (6.3) пробеназол, (6.4) тиадинил и (6.5) ламинарин.
(7) Ингибиторы биосинтеза аминокислот и белков, такие как, например, (7.1), (7.2) бластицидин-S, (7.3) ципродинил, (7.4) касугамицин, (7.5) касугамицин гидрохлорид гидрат, (7.6) мепанипирим, (7.7) пириметанил, (7.8) 3-(5-фтор-3,3,4,4-тетраметил-3,4-дигидроизохинолин-1-ил)хинолин и (7.9) окситетрациклин и (7.10) стрептомицин.
(8) Ингибиторы продукции АТФ, такие как, например, (8.1) фентин ацетат, (8.2) фентин хлорид, (8.3) фентин гидроксид и (8.4) силтиофам.
(9) Ингибиторы синтеза клеточных стенок, такие как, например, (9.1) бентиаваликарб, (9.2) диметоморф, (9.3) флуморф, (9.4) ипроваликарб, (9.5) мандипропамид, (9.6) полиоксины, (9.7) полиоксорим, (9.8) валидамицин А, (9.9) валифеналат и (9.10) полиоксин В.
(10) Ингибиторы липидного и мембранного синтеза, такие как, например, (10.1) бифенил, (10.2) клорнеб, (10.3) диклоран, (10.4) эдифенфос, (10.5) этридиазол, (10.6) иодкарб, (10.7) ипробенфос, (10.8) изопротиолан, (10.9) пропамокарб, (10.10) пропамокарб гидрохлорид, (10.11) протиокарб, (10.12) пиразофос, (10.13) квинтозен, (10.14) текназен и (10.15) токлофос-метил.
(11) Ингибиторы биосинтеза меланина, например, (11.1) карпропамид, (11.2) диклоцимет, (11.3) феноксанил, (11.4) фталид, (11.5) пироквилон, (11.6) трициклазол и (11.7) 2,2,2-трифторэтил{3-метил-1-[(4-метилбензоил)амино]бутан-2-ил}карбамат.
(12) Ингибиторы синтеза нуклеиновых кислот, такие как, например, (12.1) беналаксил, (12.2) беналаксил-М (киралаксил), (12.3) бупиримат, (12.4) клозилакон, (12.5) диметиримол, (12.6) этиримол, (12.7) фуралаксил, (12.8) гимексазол, (12.9) металаксил, (12.10) металаксил-М (мефеноксам), (12.11) офурак, (12.12) оксадиксил, (12.13) оксолиновая кислота и (12.14) октилинон.
(13) Ингибиторы сигнальной трансдукции, такие как, например, (13.1) хлозолинат, (13.2) фенпиклонил, (13.3) флудиоксонил, (13.4) ипродион, (13.5) процимидон, (13.6) квиноксифен, (13.7) винклозолин и (13.8) проквиназид.
(14) Разобщители, такие как, например, (14.1) бинапакрил, (14.2) динокап, (14.3) феримзон, (14.4) флуазинам и (14.5) мептилдинокап.
(15) Другие соединения, такие как, например, (15.1) бентиазол, (15.2) бетоксазин, (15.3) капсимицин, (15.4) карион, (15.5) хинометионат, (15.6) пириофенон (хлазафенон), (15.7) куфранеб, (15.8) цифлуфенамид, (15.9) цимоксанил, (15.10) ципросульфамид, (15.11) дазомет, (15.12) дебакарб, (15.13) дихлорфен, (15.14) дикломезин, (15.15) дифензокват, (15.16) дифензокват метилсульфат, (15.17) дифениламин, (15.18) EcoMate, (15.19) фенпиразамин, (15.20) флуметовер, (15.21) флуоримид, (15.22) флусульфамид, (15.23) флутианил, (15.24) фосетил-алюминия, (15.25) фосетил-кальция, (15.26) фосетил-натрия, (15.27) гексахлорбензол, (15.28) ирумамицин, (15.29) метасульфокарб, (15.30) метилизотиоцианат, (15.31) метрафенон, (15.32) милдиомицин, (15.33) натамицин, (15.34) никеля диметилдитиокарбамат, (15.35) нитротал-изопропил, (15.36) октилинон, (15.37) оксамокарб, (15.38) оксифентиин, (15.39) пентахлорфенол и их соли, (15.40) фенотрин, (15.41) фосфорная кислота и ее соли, (15.42) пропамокарб-фосетилат, (15.43) пропанозин-натрия, (15.44) пириморф, (15.45) (2Е)-3-(4-трет-бутилфенил)-3-(2-хлорпиридин-4-ил)-1-(морфолин-4-ил)проп-2-ен-1-он, (15.46) (2Z)-3-(4-трет-бутилфенил)-3-(2-хлорпиридин-4-ил)-1-(морфолин-4-ил)проп-2-ен-1-он, (15.47) пирролнитрин, (15.48) тебуфлоквин, (15.49) теклофталам, (15.50) толнифанид, (15.51) триазоксид, (15.52) трихламид, (15.53) зариламид, (15.54) (3S,6S,7R,8R)-8-бензил-3-[({3-[(изобутирилокси)метокси]-4-метоксипиридин-2-ил}карбонил)амино]-6-метил-4,9-диоксо-1,5-диоксонан-7-ил 2-метилпропаноат, (15.55) 1-(4-{4-[(5R)-5-(2,6-дифторфенил)-4,5-дигидро-1,2-оксазол-3-ил]-1,3-тиазол-2-ил}пиперидин-1-ил)-2-[5-метил-3-(трифторметил)-1Н-пиразол-1-ил]этанон, (15.56) 1-(4-{4-[(5S)-5-(2,6-дифторфенил)-4,5-дигидро-1,2-оксазол-3-ил]-1,3-тиазол-2-ил}пиперидин-1-ил)-2-[5-метил-3-(трифторметил)-1H-пиразол-1-ил]этанон, (15.57) 1-(4-{4-[5-(2,6-дифторфенил)-4,5-дигидро-1,2-оксазол-3-ил]-1,3-тиазол-2-ил}пиперидин-1-ил)-2-[5-метил-3-(трифторметил)-1Н-пиразол-1-ил]этанон, (15.58) 1-(4-метоксифенокси)-3,3-диметилбутан-2-ил 1Н-имидазол-1-карбоксилат, (15.59) 2,3,5,6-тетрахлор-4-(метилсульфонил)пиридин, (15.60) 2,3-дибутил-6-хлортиено[2,3-d]пиримидин-4(3H)-он, (15.61) 2,6-диметил-1Н,5Н-[1,4]дитиино[2,3-с:5,6-с']дипиррол-1,3,5,7(2Н,6Н)-тетрон, (15.62) 2-[5-метил-3-(трифторметил)-1H-пиразол-1-ил]-1-(4-{4-[(5R)-5-фенил-4,5-дигидро-1,2-оксазол-3-ил]-1,3-тиазол-2-ил}пиперидин-1-ил)этанон, (15.63) 2-[5-метил-3-(трифторметил)-1H-пиразол-1-ил]-1-(4-{4-[(5S)-5-фенил-4,5-дигидро-1,2-оксазол-3-ил]-1,3-тиазол-2-ил}пиперидин-1-ил)этанон, (15.64) 2-[5-метил-3-(трифторметил)-1H-пиразол-1-ил]-1-{4-[4-(5-фенил-4,5-дигидро-1,2-оксазол-3-ил)-1,3-тиазол-2-ил]пиперидин-1-ил}этанон, (15.65) 2-бутокси-6-иод-3-пропил-4Н-хромен-4-он, (15.66) 2-хлор-5-[2-хлор-1-(2,6-дифтор-4-метоксифенил)-4-метил-1Н-имидазол-5-ил]пиридин, (15.67) 2-фенилфенол и соли, (15.68) 3-(4,4,5-трифтор-3,3-диметил-3,4-дигидроизохинолин-1-ил)хинолин, (15.69) 3,4,5-трихлорпиридин-2,6-дикарбонитрил, (15.70) 3-хлор-5-(4-хлорфенил)-4-(2,6-дифторфенил)-6-метилпиридазин, (15.71) 4-(4-хлорфенил)-5-(2,6-дифторфенил)-3,6-диметилпиридазин, (15.72) 5-амино-1,3,4-тиадиазол-2-тиол, (15.73) 5-хлор-N'-фенил-N'-(проп-2-ин-1-ил)тиофен-2-сульфонгидразид, (15.74) 5-фтор-2-[(4-фторбензил)окси]пиримидин-4-амин, (15.75) 5-фтор-2-[(4-метилбензил)окси]пиримидин-4-амин, (15.76) 5-метил-6-октил[1,2,4]триазол[1,5-а]пиримидин-7-амин, (15.77) этил (2Z)-3-амино-2-циано-3-фенилакрилат, (15.78) N'-(4-{[3-(4-хлорбензил)-1,2,4-тиадиазол-5-ил]окси}-2,5-диметилфенил)-N-этил-N-метилимидоформамид, (15.79) N-(4-хлорбензил)-3-[3-метокси-4-(проп-2-ин-1-илокси)фенил]прпанамид, (15.80) N-[(4-хлорфенил)(циано)метил]-3-[3-метокси-4-(проп-2-ин-1-илокси)фенил]прпанамид, (15.81) N-[(5-бром-3-хлорпиридин-2-ил)метил]-2,4-дихлорникотинамид, (15.82) N-[1-(5-бром-3-хлорпиридин-2-ил)этил]-2,4-дихлорникотинамид, (15.83) N-[1-(5-бром-3-хлорпиридин-2-ил)этил]-2-фтор-4-иодникотинамид, (15.84) N-{(E)-[(циклопропилметокси)имино][6-(дифторметокси)-2,3-дифторфенил]метил}-2-фенилацетамид, (15.85) N-{(Z)-[(циклопропилметокси)имино][6-(дифторметокси)-2,3-дифторфенил]метил}-2-фенилацетамид, (15.86) N'-{4-[(3-трет-бутил-4-циано-1,2-тиазол-5-ил)окси]-2-хлор-5-метилфенил}-N-этил-N-метилимидоформамид, (15.87) N-метил-2-(1-{[5-метил-3-(трифторметил)-1H-пиразол-1-ил]ацетил}пиперидин-4-ил)-N-(1,2,3,4-тетрагидронафталин-1-ил)-1,3-тиазол-4-карбоксамид, (15.88) N-метил-2-(1-{[5-метил-3-(трифторметил)-1H-пиразол-1-ил]ацетил}пиперидин-4-ил)-N-[(1R)-1,2,3,4-тетрагидронафталин-1-ил]-1,3-тиазол-4-карбоксамид, (15.89) N-метил-2-(1-{[5-метил-3-(трифторметил)-1Н-пиразол-1-ил]ацетил}пиперидин-4-ил)-N-[(1S)-1,2,3,4-тетрагидронафталин-1-ил]-1,3-тиазол-4-карбоксамид, (15.90) пентил {6-[({[(1-метил-1H-тетразол-5-ил)(фенил)метилен]амино}окси)метил]пиридин-2-ил}карбамат, (15.91) феназин-1-карбоновая кислота, (15.92) хинолин-8-ол, (15.93) хинолин-8-ол сульфат (2:1), (15.94) трет-бутил {6-[({[(1-метил-1Н-тетразол-5-ил)(фенил)метилен]амино}окси)метил]пиридин-2-ил}карбамат, (15.95) 1-метил-3-(трифторметил)-N-[2'-(трифторметил)бифенил-2-ил]-1Н-пиразол-4-карбоксамид, (15.96) N-(4'-хлорбифенил-2-ил)-3-(дифторметил)-1-метил-1H-пиразол-4-карбоксамид, (15.97) N-(2',4'-дихлорбифенил-2-ил)-3-(дифторметил)-1-метил-1Н-пиразол-4-карбоксамид, (15.98) 3-(дифторметил)-1-метил-N-[4'-(трифторметил)бифенил-2-ил]-1Н-пиразол-4-карбоксамид, (15.99) N-(2',5'-дифторбифенил-2-ил)-1-метил-3-(трифторметил)-1Н-пиразол-4-карбоксамид, (15.100) 3-(дифторметил)-1-метил-N-[4'-(проп-1-ин-1-ил)бифенил-2-ил]-1Н-пиразол-4-карбоксамид, (15.101) 5-фтор-1,3-диметил-N-[4'-(проп-1-ин-1-ил)бифенил-2-ил]-1H-пиразол-4-карбоксамид, (15.102) 2-хлор-N-[-[4'-(проп-1-ин-1-ил)бифенил-2-ил]никотинамид, (15.103) 3-(дифторметил)-N-[4'-(3,3-диметилбут-1-ин-1-ил)бифенил-2-ил]-1-метил-1Н-пиразол-4-карбоксамид, (15.104) N-[4'-(3,3-диметилбут-1-ин-1-ил)бифенил-2-ил]-5-фтор-1,3-диметил-1Н-пиразол-4-карбоксамид, (15.105) 3-(дифторметил)-N-(4'-этинилбифенил-2-ил)-1-метил-1Н-пиразол-4-карбоксамид, (15.106) N-(4'-этинилбифенил-2-ил)-5-фтор-1,3-диметил-1H-пиразол-4-карбоксамид, (15.107) 2-хлор-N-(4'-этинилбифенил-2-ил)никотинамид, (15.108) 2-хлор-N-[4'-(3,3-диметилбут-1-ин-1-ил)бифенил-2-ил]никотинамид, (15.109) 4-(дифторметил)-2-метил-N-[4'-(трифторметил)бифенил-2-ил]-1,3-тиазол-5-карбоксамид, (15.110) 5-фтор-N-[4'-(3-гидрокси-3-метилбут-1-ин-1-ил)бифенил-2-ил]-1,3-диметил-1H-пиразол-4-карбоксамид, (15.111) 2-хлор-N-[4'-(3-гидрокси-3-метилбут-1-ин-1-ил)бифенил-2-ил]никотинамид, (15.112) 3-(дифторметил)-N-[4'-(3-метокси-3-метилбут-1-ин-1-ил)бифенил-2-ил]-1-метил-1Н-пиразол-4-карбоксамид, (15.113) 5-фтор-N-[4'-(3-метокси-3-метилбут-1-ин-1-ил)бифенил-2-ил]-1,3-диметил-1Н-пиразол-4-карбоксамид, (15.114) 2-хлор-N-[4'-(3-метокси-3-метилбут-1-ин-1-ил)бифенил-2-ил]никотинамид, (15.115) (5-бром-2-метокси-4-метилпиридин-3-ил)(2,3,4-триметокси-6-метилфенил)метанон, (15.116) N-[2-(4-{[3-(4-хлорфенил)проп-2-ин-1-ил]окси}-3-метоксифенил)этил]-N2-(метилсульфонил)валинамид, (15.117) 4-оксо-4-[(2-фенилэтил)амино]бутановая кислота, (15.118) бут-3-ин-1-ил {6-[({[(Z)-(1-метил-1H-тетразол-5-ил)(фенил)метилен]амино}окси)метил]пиридин-2-ил}карбамат, (15.119) 4-амино-5-фторпиримидин-2-ол (таутомерная форма: 4-амино-5-фторпиримидин-2(1Н)-он), (15.120) пропил 3,4,5-тригидроксибензоат, (15.121) 1,3-диметил-N-(1,1,3-триметил-2,3-дигидро-1H-инден-4-ил)-1H-пиразол-4-карбоксамид, (15.122) 1,3-диметил-N-[(3R)-1,1,3-триметил-2,3-дигидро-1Н-инден-4-ил]-1H-пиразол-4-карбоксамид, (15.123) 1,3-диметил-N-[(3S)-1,1,3-триметил-2,3-дигидро-1H-инден-4-ил]-1H-пиразол-4-карбоксамид, (15.124) [3-(4-хлор-2-фторфенил)-5-(2,4-дифторфенил)-1,2-оксазол-4-ил](пиридин-3-ил)метанол, (15.125) (S)-[3-(4-хлор-2-фторфенил)-5-(2,4-дифторфенил)-1,2-оксазол-4-ил](пиридин-3-ил)метанол, (15.126) (R)-[3-(4-хлор-2-фторфенил)-5-(2,4-дифторфенил)-1,2-оксазол-4-ил](пиридин-3-ил)метанол, (15.127) 2-{[3-(2-хлорфенил)-2-(2,4-дифторфенил)оксиран-2-ил]метил}-2,4-дигидро-3H-1,2,4-триазол-3-тион, (15.128) 1-{[3-(2-хлорфенил)-2-(2,4-дифторфенил)оксиран-2-ил]метил}-1Н-1,2,4-триазол-5-ил тиоцианат, (15.129) 5-(аллилсульфанил)-1-{[3-(2-хлорфенил)-2-(2,4-дифторфенил)оксиран-2-ил]метил}-1Н-1,2,4-триазол, (15.130) 2-[1-(2,4-дихлорфенил)-5-гидрокси-2,6,6-триметилгептан-4-ил]-2,4-дигидро-3H-1,2,4-триазол-3-тион, (15.131) 2-{[rel(2R,3S)-3-(2-хлорфенил)-2-(2,4-дифторфенил)оксиран-2-ил]метил}-2,4-дигидро-3H-1,2,4-триазол-3-тион, (15.132) 2-{[rel(2R,3R)-3-(2-хлорфенил)-2-(2,4-дифторфенил)оксиран-2-ил]метил}-2,4-дигидро-3H-1,2,4-триазол-3-тион, (15.133) 1-{[rel(2R,3S)-3-(2-хлорфенил)-2-(2,4-дифторфенил)оксиран-2-ил]метил}-1Н-1,2,4-триазол-5-ил тиоцианат, (15.134) 1-{[rel(2R,3R)-3-(2-хлорфенил)-2-(2,4-дифторфенил)оксиран-2-ил]метил}-1Н-1,2,4-триазол-5-ил тиоцианат, (15.135) 5-(аллилсульфанил)-1-{[rel(2R,3S)-3-(2-хлорфенил)-2-(2,4-дифторфенил)оксиран-2-ил]метил}-1Н-1,2,4-триазол, (15.136) 5-(аллилсульфанил)-1-{[rel(2R,3R)-3-(2-хлорфенил)-2-(2,4-дифторфенил)оксиран-2-ил]метил}-1Н-1,2,4-триазол, (15.137) 2-[(2S,4S,5S)-1-(2,4-дихлорфенил)-5-гидрокси-2,6,6-триметилгептан-4-ил]-2,4-дигидро-3H-1,2,4-триазол-3-тион, (15.138) 2-[(2R,4S,5S)-1-(2,4-дихлорфенил)-5-гидрокси-2,6,6-триметилгептан-4-ил]-2,4-дигидро-3H-1,2,4-триазол-3-тион, (15.139) 2-[(2R,4R,5R)-1-(2,4-дихлорфенил)-5-гидрокси-2,6,6-триметилгептан-4-ил]-2,4-дигидро-3H-1,2,4-триазол-3-тион, (15.140) 2-[(2S,4R,5R)-1-(2,4-дихлорфенил)-5-гидрокси-2,6,6-триметилгептан-4-ил]-2,4-дигидро-3H-1,2,4-триазол-3-тион, (15.141) 2-[(2S,4S,5R)-1-(2,4-дихлорфенил)-5-гидрокси-2,6,6-триметилгептан-4-ил]-2,4-дигидро-3H-1,2,4-триазол-3-тион, (15.142) 2-[(2R,4S,5R)-1-(2,4-дихлорфенил)-5-гидрокси-2,6,6-триметилгептан-4-ил]-2,4-дигидро-3H-1,2,4-триазол-3-тион, (15.143) 2-[(2R,4R,5S)-1-(2,4-дихлорфенил)-5-гидрокси-2,6,6-триметилгептан-4-ил]-2,4-дигидро-3H-1,2,4-триазол-3-тион, (15.144) 2-[(2S,4R,5S)-1-(2,4-дихлорфенил)-5-гадрокси-2,6,6-триметилгептан-4-ил]-2,4-дигидро-3H-1,2,4-триазол-3-тион, (15.145) 2-фтор-6-(трифторметил)-N-(1,1,3-триметил-2,3-дигидро-1Н-инден-4-ил)бензамид, (15.146) 2-(6-бензилпиридин-2-ил)хиназолин, (15.147) 2-[6-(3-фтор-4-метоксифенил)-5-метилпиридин-2-ил]хиназолин, (15.148) 3-(4,4-дифтор-3,3-диметил-3,4-дигидроизохинолин-1-ил)хинолин, (15.149) абсцизовая кислота, (15.150) 3-(дифторметил)-N-метокси-1-метил-N-[1-(2,4,6-трихлорфенил)пропан-2-ил]-1H-пиразол-4-карбоксамид, (15.151) N'-[5-бром-6-(2,3-дигидро-1Н-инден-2-илокси)-2-метилпиридин-3-ил]-N-этил-N-метилимидоформамид, (15.152) N'-{5-бром-6-[1-(3,5-дифторфенил)этокси]-2-метилпиридин-3-ил}-N-этил-N-метилимидоформамид, (15.153) N'-{5-бром-6-[(1R)-1-(3,5-дифторфенил)этокси]-2-метилпиридин-3-ил}-N-этил-N-метилимидоформамид, (15.154) N'-{5-бром-6-[(1S)-1-(3,5-дифторфенил)этокси]-2-метилпиридин-3-ил}-N-этил-N-метилимидоформамид, (15.155) N'-{5-бром-6-[(цис-4-изопропилциклогексил)окси]-2-метилпиридин-3-ил}-N-этил-N-метилимидоформамид, (15.156) N'-{5-бром-6-[(транс-4-изопропилциклогексил)окси]-2-метилпиридин-3-ил}-N-этил-N-метилимидоформамид, (15.157) N-циклопропил-3-(дифторметил)-5-фтор-N-(2-изопропилбензил)-1-метил-1H-пиразол-4-карбоксамид, (15.158) N-циклопропил-N-(2-циклопропилбензил)-3-(дифторметил)-5-фтор-1-метил-1Н-пиразол-4-карбоксамид, (15.159) N-(2-трет-бутилбензил)-N-циклопропил-3-(дифторметил)-5-фтор-1-метил-1H-пиразол-4-карбоксамид, (15.160) N-(5-хлор-2-этилбензил)-N-циклопропил-3-(дифторметил)-5-фтор-1-метил-1Н-пиразол-4-карбоксамид, (15.161) N-(5-хлор-2-изопропилбензил)-N-циклопропил-3-(дифторметил)-5-фтор-1-метил-1H-пиразол-4-карбоксамид, (15.162) N-циклопропил-3-(дифторметил)-N-(2-этил-5-фторбензил)-5-фтор-1-метил-1H-пиразол-4-карбоксамид, (15.163) N-циклопропил-3-(дифторметил)-5-фтор-N-(5-фтор-2-изопропилбензил)-1-метил-1Н-пиразол-4-карбоксамид, (15.164) N-циклопропил-N-(2-циклопропил-5-фторбензил)-3-(дифторметил)-5-фтор-1-метил-1Н-пиразол-4-карбоксамид, (15.165) N-(2-циклопентил-5-фторбензил)-N-циклопропил-3-(дифторметил)-5-фтор-1-метил-1Н-пиразол-4-карбоксамид, (15.166) N-циклопропил-3-(дифторметил)-5-фтор-N-(2-фтор-6-изопропилбензил)-1-метил-1H-пиразол-4-карбоксамид, (15.167) N-циклопропил-3-(дифторметил)-N-(2-этил-5-метилбензил)-5-фтор-1-метил-1Н-пиразол-4-карбоксамид, (15.168) N-циклопропил-3-(дифторметил)-5-фтор-N-(2-изопропил-5-метилбензил)-1-метил-1Н-пиразол-4-карбоксамид, (15.169) N-циклопропил-N-(2-циклопропил-5-метилбензил)-3-(дифторметил)-5-фтор-1-метил-1Н-пиразол-4-карбоксамид, (15.170) N-(2-трет-бутил-5-метилбензил)-N-циклопропил-3-(дифторметил)-5-фтор-1-метил-1Н-пиразол-4-карбоксамид, (15.171) N-[5-хлор-2-(трифторметил)бензил]-N-циклопропил-3-(дифторметил)-5-фтор-1-метил-1Н-пиразол-4-карбоксамид, (15.172) N-циклопропил-3-(дифторметил)-5-фтор-1-метил-N-[5-метил-2-(трифторметил)бензил]-1H-пиразол-4-карбоксамид, (15.173) N-[2-хлор-6-(трифторметил)бензил]-N-циклопропил-3-(дифторметил)-5-фтор-1-метил-1Н-пиразол-4-карбоксамид, (15.174) N-[3-хлор-2-фтор-6-(трифторметил)бензил]-N-циклопропил-3-(дифторметил)-5-фтор-1-метил-1Н-пиразол-4-карбоксамид, (15.175) N-циклопропил-3-(дифторметил)-N-(2-этил-4,5-диметилбензил)-5-фтор-1-метил-1H-пиразол-4-карбоксамид, (15.176) N-циклопропил-3-(дифторметил)-5-фтор-N-(2-изопропилбензил)-1-метил-1Н-пиразол-4-карботиоамид, (15.177) 3-(дифторметил)-N-(7-фтор-1,1,3-триметил-2,3-дигидро-1Н-инден-4-ил)-1-метил-1Н-пиразол-4-карбоксамид, (15.178) 3-(дифторметил)-N-[(3R)-7-фтор-1,1,3-триметил-2,3-дигидро-1Н-инден-4-ил]-1-метил-1Н-пиразол-4-карбоксамид, (15.179) 3-(дифторметил)-N-[(3S)-7-фтор-1,1,3-триметил-2,3-дигидро-1H-инден-4-ил]-1-метил-1H-пиразол-4-карбоксамид, (15.180) N'-(2,5-диметил-4-феноксифенил)-N-этил-N-метилимидоформамид, (15.181) N'-{4-[(4,5-дихлор-1,3-тиазол-2-ил)окси]-2,5-диметилфенил}-N-этил-N-метилимидоформамид, (15.182) N-(4-хлор-2,6-дифторфенил)-4-(2-хлор-4-фторфенил)-1,3-диметил-1Н-пиразол-5-амин. Все партнеры смешивания, упомянутые в классах (1)-(15), могут, если они способны на основании их функциональных групп, необязательно образовывать соли с подходящими основаниями или кислотами.
Биологические пестициды в качестве смешивающихся компонентов
Соединения формулы (I) могут быть объединены с биологическими пестицидами.
Биологические пестициды содержат в частности бактерии, грибы, дрожжи, растительные экстракты и продукты, образованные микроорганизмами, включая белки и вторичные метаболиты.
Биологические пестициды включают бактерии, спорообразующие бактерии, корень-колонизирующие бактерии и бактерии, которые действуют в качестве биологических инсектицидов, фунгицидов или нематицидов.
Примерами таких бактерий, которые применяются или могу применяться в качестве биологических пестицидов, являются:
Bacillus amiloliquefaciens, штамм FZB42 (DSM 231179), или Bacillus cereus, в частности В. cereus штамм CNCM I-1562 или Bacillus firmus, штамм I-1582 (Номер доступа CNCM I-1582) или Bacillus pumilus, в частности штамм GB34 (Номер доступа АТСС 700814) и штамм QST2808 (Номер доступа NRRL В-30087), или Bacillus subtilis, в частности штамм GB03 (Номер доступа АТСС SD-1397), или Bacillus subtilis штамм QST713 (Номер доступа NRRL В-21661) или Bacillus subtilis штамм OST 30002 (Номер доступа NRRL В-50421) Bacillus thuringiensis, в частности В. thuringiensis подвид israelensis (серотип Н-14), штамм АМ65-52 (Номер доступа АТСС 1276), или В. thuringiensis подвид aizawai, в частности штамм ABTS-1857 (SD-1372), или В. thuringiensis подвид kurstaki штамм HD-1, или В. thuringiensis подвид tenebrionis штамм NB 176 (SD-5428), Pasteuria penetrans, Pasteuria spp. (Rotylenchulus reniformis Нематода)-PR3 (Номер доступа АТСС SD-5834), Streptomyces microflavus штамм AQ6121 (=QRD 31.013, NRRL B-50550), Streptomyces galbus штамм AQ 6047 (Номер доступа NRRL 30232).
Примерами грибов и дрожжей, которые применяются или могут применяться в качестве биологических пестицидов, являются:
Beauveria bassiana, в частности штамм АТСС 74040, Coniothyrium minitans, в частности штамм CON/M/91-8 (Номер доступа DSM-9660), Lecanicillium spp., в частности штамм HRO LEC 12, Lecanicillium lecanii, (ранее известный как Verticillium lecanii), в частности штамм KV01, Metarhizium anisopliae, в частности штамм F52 (DSM3884 / АТСС 90448), Metschnikowia fructicola, в частности штамм NRRL Y-30752, Paecilomyces fumosoroseus (в настоящее время: Isaria fumosorosea), в частности штамм IFPC 200613, или штамм Apopka 97 (Номер доступа АТСС 20874), Paecilomyces lilacinus, в частности P. lilacinus штамм 251 (AGAL 89/030550), Talaromyces flavus, в частности штамм V117b, Trichoderma atroviride, в частности штамм SC1 (Номер доступа CBS 122089), Trichoderma harzianum, в частности Т. harzianum rifai Т39. (Номер доступа CNCM I-952).
Примерами вирусов, которые применяются или могут применяться в качестве биологических пестицидов, являются:
Adoxophyes orana (сетчатая листокрутка) вирус зернистости (GV), Cydia pomonella (яблоневая плодожорка) вирус зернистости (GV), Helicoverpa armigera (коробочный червь) вирус ядерного полиэдроза (NPV), Spodoptera exigua (совка малая) mNPV, Spodoptera frugiperda (совка травяная) mNPV, Spodoptera littoralis (гусеница, питающаяся листьями африканского хлопка) NPV.
Также охватываются бактерии и грибы, которые добавляются в качестве «инокулянта» на растения или части растений или органы растений, и которые, в силу их особенных свойств, способствуют росту растения и здоровью растения. Примерами, которые можно упомянуть, являются:
Agrobacterium spp., Azorhizobium caulinodans, Azospirillum spp., Azotobacter spp., Bradyrhizobium spp., Burkholderia spp., наиболее предпочтительно Burkholderia cepacia (ранее известный как Pseudomonas cepacia), Gigaspora spp., или Gigaspora monosporum, Glomus spp., Laccaria spp., Lactobacillus buchneri, Paraglomus spp., Pisolithus tinctorus, Pseudomonas spp., Rhizobium spp., наиболее предпочтительно Rhizobium mpufolii, Rhizopogon spp., Scleroderma spp., Suillus spp., Streptomyces spp..
Защитные средства в качестве смешивающихся компонентов
Соединения формулы (I) могут быть объединены с защитными средствами, такими как, например, беноксакор, клоквинтоцет (-мексил), циометринил, ципросульфамид, дихлормид, фенхлоразол (-этил), фенклорим, флуразол, флуксофеним, фурилазол, изоксадифен (-этил), мефенпир (-диэтил), нафтойный ангидрид, оксабетринил, 2-метокси-N-({4-[(метилкарбамоил)амино]фенил}сульфонил)бензамид (CAS 129531-12-0), 4-(дихлорацетил)-1-окса-4-азаспиро[4.5]декан (CAS 71526-07-3), 2,2,5-триметил-3-(дихлорацетил)-1,3-оксазолидин (CAS 52836-31-4).
Растения и части растений
Все растения и части растений любого вида можно обработать в соответствии с настоящим изобретением. Растения в контексте настоящего изобретения представляют собой все растения и популяции растений, такие как желательные и нежелательные дикие растения или культурные растения (включая природные культурные растения), например, зерновые (пшеница, рис, тритикале, ячмень, рожь, овес), кукуруза, соевые бобы, картофель, сахарная свекла, сахарный тростник, томаты, горох и другие виды овощей, хлопок, табак, масленичный рапс, а также фруктовые растения (яблони, груши вместе с плодами, цитрусовые плоды и виноград). Культурные растения могут представлять собой растения, которые можно получить с помощью обычных способ селекции растений и оптимизации или с помощью способ биотехнологии и генной инженерии, или с помощью комбинаций этих способ, включая трансгенные растения и включая множество растений, которые могут или не могут быть защищены авторскими правами селекционеров. Части растения представляют собой все части и органы растений, находящиеся выше и ниже уровня почвы, такие как всход, лист, цветок и корень, причем конкретными примерами являются листья, хвоя, стебли, стволы, цветки, плодовые тела, плоды, семена, корни, клубни и корневища. Части растения также включают собранный материал и вегетативный и генеративный материал для размножения, например, черенки, клубни, корневища, боковые побеги и семена.
Обработку по настоящему изобретению растений и частей растений соединениями формулы (I) проводят непосредственно или с помощью обычных способ обработки, например, путем погружения, опрыскивания, испарения, туманообразования, разбрасывания, покрытия или инъекции и, в случае материала для размножения, в частности, в случае семян, также путем одного или более покрытий.
Как уже отмечено выше, можно обработать все растения и их части в соответствии с настоящим изобретением. В предпочтительном варианте осуществления обрабатывают дикие виды растений и сорта растений или полученные с помощью обычных способ селекции, таких как скрещивание или слияние протоплазмы, и их части. В другом предпочтительном варианте осуществления обрабатывают трансгенные растения и сорта растений, полученные с помощью способов генной инженерии, если это возможно, в комбинации с обычными способами (генетически модифицированные организмы), и их части. Термины "растения", "части растений" и "части растения" пояснены выше. Более предпочтительно, если в соответствии с настоящим изобретением обрабатывают растения и сорта растений, которые в каждом случае являются коммерчески доступными или выращиваются. Сорта растения представляют собой растения, обладающие новыми характеристиками ("особенностями"), которые придаются с помощью обычного скрещивания, мутагенеза или способа с использованием рекомбинантных ДНК. Ими могут быть культивары, биотипы или генотипы.
Трансгенное растение, обработка семян и события интеграции
Предпочтительные трансгенные растения и сорта растений (полученные с помощью генной инженерии), которые следует обрабатывать в соответствии с настоящим изобретением включают все растения, которые вследствие генетических модификаций дают генетический материал, который придает этим растениям особенно предпочтительные, полезные свойства («признаки»). Примерами таких свойств являются лучший рост растения, повышенная стойкость к высоким или низким температурам, повышенная стойкость к засухе или к воде, или к содержанию соли в почве, улучшенные характеристики цветения, ускоренное созревание, более высокие урожаи, лучшее качество и/или более высокая питательная ценность собранных продуктов, более высокая стабильность при хранении и/или перерабатываемость собранных продуктов. Другими и особенно важными примерами таких свойств являются лучшая защита растений от животных и микробиологических вредителей, таких как насекомые, паукообразные, нематоды, личинки и улитки, благодаря токсинам, образующимся в растениях, в частности, образующимся в растениях генетическим материалом из Bacillus thuringiensis (например, генами CryIA(a), CryIA(b), CryIA(c), CryIIA, CryIIIA, CryIIIB2, Cry9c Cry2Ab, Cry3Bb и CryIF, а также их комбинациями), кроме того, улучшенная стойкость растений к фитопатогенным грибам, бактериям и/или вирусам, благодаря, например, приобретенной системной стойкости (SAR), системину, фитоалексинов, элициторов и генов резистентности и соответственно экспрессированных белков и токсинов, а также повышенная толерантность растений к определенным гербицидно активным соединениям, например, имидазолинонам, сульфонилмочевинам, глифосату или фосфинотрицину (например, ген "PAT"). Гены, которые придают необходимые характеристики, также могут содержаться в трансгенных растениях в комбинациях друг с другом. Примерами трансгенных растений, которые можно упомянуть, являются важные культурные растения, такие как зерновые (пшеница, рис, тритикале, ячмень, рожь, овес), кукуруза, соевые бобы, картофель, сахарная свекла, сахарный тростник, томаты, горох и другие виды овощей, хлопок, табак, масленичный рапс, а также фруктовые растения (яблони, груши вместе с плодами, цитрусовые плоды и виноград), особенно предпочтительными являются кукуруза, соевые бобы, пшеница,, рис, картофель, хлопок, сахарный тростник, табак и масленичный рапс. Признаками, которые особенно выделяются, являются повышенная стойкость растений к насекомым, паукообразным, нематодам, личинкам и улиткам.
Защита культурных растений - виды обработки
Обработка растений и частей растений соединениями формулы (I) осуществляется непосредственно или путем действия на окружающую их среду, среду обитания или пространство для хранения посредством применения обычных способов обработки, например, путем окунания, распыления, атомизации, орошения, испарения, опыливания, аэрозольного орошения, разбрасывания, ценообразования, окрашивания, распространения, впрыскивания, поливки (вымачивания), капельного орошения и, в случае материала для размножения, в частности в случае семени, кроме того в виде порошка для сухой обработки семян, раствора для жидкой обработки семян, растворимого в воде порошка для суспензионной обработки, посредством покрытия коркой, путем покрытия одним или более покрытиями, и т.д. Кроме того, возможно наносить соединения формулы (I) с помощью микрообъемного способа или впрыскивать форму для применения или соединение формулы (I) само по себе в почву.
Предпочтительной прямой обработкой растений является внекорневое внесение, т.е. соединения формулы (I) наносятся на листья, где частота обработки и норма нанесения должны регулироваться в зависимости от уровня заражения рассматриваемым вредителем.
В случае системных активных соединений, соединения формулы (I) также имеют доступ к растениям через корневую систему. Растения затем обрабатываются путем действия соединений формулы (I) на среду обитания растений. Это может быть сделано, например, посредством заливания или посредством подмешивания в почву или питательного раствора, т.е. локус растения (например, почва или гидропонные системы) пропитывается жидкой формой соединений формулы (I), или посредством нанесения в почву, т.е. соединения формулы (I) согласно настоящему изобретению вводятся в твердой форме (например, в форме гранул) в локус растений. В случае культур риса-падди это может быть сделано путем дозирования соединения формулы (I) в форме нанесения в почву (например, в виде гранул) в заводненное рисовое поле.
Обработка семени
Борьбы с животными вредителями путем обработки семени растений известна в течение долгого времени и является объектом непрерывных улучшений. Однако обработка семени связана с рядом проблем, которые не всегда могут быть решены удовлетворительным образом. Таким образом, желательно разработать способы защиты семени и прорастающего растения, которые не связаны с или по меньшей мере значительно уменьшают дополнительное применение пестицидов в ходе хранения, после посева или после прорастания растений. Кроме того, желательно оптимизировать количество применяемого активного соединения таким образом, чтобы обеспечить оптимальную защиту для семени и прорастающего растения от воздействия животными вредителями, но без повреждения растения самого по себе применяемым активным соединением. В частности, способы обработки семени должны также учитывать собственные инсектицидные или нематицидные свойства резистентных или толерантных к вредителям трансгенных растений, чтобы достигнуть оптимальной защиты семени, а также прорастающего растения с минимальными применяемыми пестицидами.
Настоящее изобретение поэтому в частности также относится к способу защиты семени и прорастающих растений от воздействия вредителей посредством обработки семени одним из соединений формулы (I). Способ согласно настоящему изобретению для защиты семени и прорастающих растений от воздействия вредителей, кроме того, охватывает способ, в котором семя обрабатывается одновременно за одну операцию или последовательно соединением формулы (I) и смешивающимся компонентом. Также охватывается способ, в котором семя обрабатывается в различные моменты времени соединением формулы (I) и смешивающимся компонентом.
Настоящее изобретение, подобным образом, относится к применению соединений формулы (I) для обработки семени для защиты семени и полученного растения от животных вредителей.
Кроме того, настоящее изобретение относится к семени, которое было обработано соединением формулы (I) согласно настоящему изобретению, так что достигается защита от животных вредителей. Настоящее изобретение также относится к семени, которое было обработано одновременно соединением формулы (I) и смешивающимся компонентом. Настоящее изобретение, кроме того, относится к семени, которое было обработано в различные моменты времени соединением формулы (I) и смешивающимся компонентом. В случае семени, которое было обработано в различные моменты времени соединением формулы (I) и смешивающимся компонентом, причем отдельные вещества могут присутствовать на семени в различных слоях. Согласно настоящему изобретению, слои, содержащие соединение формулы (I) и смешивающиеся компоненты, могут необязательно быть разделены промежуточными слоями. Настоящее изобретение также относится к семени, на которое соединение формулы (I) и смешивающийся компонент наносится в виде компонента покрытия или в виде дополнительного слоя или дополнительных слоев, в дополнение к покрытию.
Кроме того, настоящее изобретение относится к семени, которое, которое после обработки соединением формулы (I), подвергается процессу покрытия пленкой, чтобы предотвратить абразивное действие пыли на семени.
Одним из преимуществ, обеспечиваемых системным действием соединения формулы (I), является тот факт, что посредством обработки семени не только семя само по себе, но также растения, полученные из них, защищаются после прорастания от животных вредителей. Таким образом, можно избежать немедленной обработки культуры в момент посева или сразу после.
Другое рассматриваемое преимущество состоит в том, что посредством обработки семени соединением формулы (I), развитие и прорастание обработанного семени могут быть усилены.
Подобным образом, рассматривается преимущество, состоящее в том, что соединения формулы (I) могут применяться, в частности, также для трансгенного семени.
Кроме того, соединения формулы (I) могут применяться в комбинации с композициями или соединениями процесса передачи сигнала, приводя к более хорошей колонизации симбиотическими организмами, такими как, например, клубеньковые бактерии, микориза и/или эндофитные бактерии или грибы, и/или к оптимизации фиксации азота.
Соединения формулы (I) подходят для защиты семени любого сорта растения, который применяется в сельском хозяйстве, в теплице, в лесах или в садоводстве. В частности, оно принимает форму семени зерновых (например, пшеница, ячмень, рожь, просо и овес), кукурузы, хлопка, сои, риса, картофеля, подсолнечника, кофе, табака, канолы, масличного рапса, свеклы (например, сахарная свекла и кормовая свекла), арахиса, овощей (например, томаты, огурцы, фасоль, крестоцветные овощи, лук и садат-латук), фруктовых растений, газонных трав и декоративных растений. Обработка семени зерновых (таких как пшеница, ячмень, рожь и овес), кукуруза, соя, хлопок, канола, масличный рапс и рис имеет особое значение.
Как уже было упомянуто выше, обработка трансгенного семени соединением формулы (I) также имеет особое значение. Она осуществляется в отношении формы семени растений, которые, как правило, содержат по меньшей мере один гетерологичный ген, который управляет экспрессией полипептида с в частности инсектицидными и/или нематицидными свойствами. Гетерологичные гены в трансгенном семени могут происходить из микроорганизмов, таких как Bacillus, Rhizobium, Pseudomonas, Serratia, Trichoderma, Clavibacter, Glomus или Gliocladium. Настоящее изобретение в частности подходит для обработки трансгенного семени, которое содержит по меньшей мере один гетерологичный ген, происходящий из Bacillus sp. Особенно предпочтительно гетерологичный ген происходит из Bacillus thuringiensis.
В контексте настоящего изобретения, соединение формулы (I) наносится на семя. Предпочтительно, семя обрабатывается в состоянии, в котором оно достаточно стабильно, чтобы избежать повреждение в ходе обработки. В общем, семя может быть обработано в любой момент времени сбором и посевом. Семя, обычно применяемое, отделяется от растения и освобождается от початков, кожуры, стеблей, покрытий, волосков или мякоти плодов. Например, возможно применять семя, которое было собрано, очищено и высушено до содержания влаги, которое обеспечивает хранение. Альтернативно, также возможно применять семя, которое, после сушки, было обработано, например, водой и затем высушивается снова, например, впитыванием.
При обработке семени, в общем нужно заботиться о том, чтобы количество соединения формулы (I), наносимое на семя, и/или количество других добавок выбиралось таким образом, чтобы не оказывалось отрицательного воздействия на прорастание семени, или чтобы полученное растение не повреждалось. Это должно обеспечиваться, в частности, в случае активных соединений, которые могут проявлять фитотоксические эффекты при определенных нормах нанесения.
В общем, соединения формулы (I) наносятся на семя в форме подходящей композиции. Подходящие композиции и способы обработки семян известны специалистам в данной области техники.
Соединения формулы (I) могут быть превращены в стандартные композиции для протравливания семян, такие как растворы, эмульсии, суспензии, порошки, пены, взвеси или другие покрывающие композиции для семян, а также ULV композиции.
Эти композиции получают известным образом, посредством смешивания соединений формулы (I) со стандартными добавками, такими как, например, стандартные наполнители, а также растворители или разбавители, красители, смачивающие агенты, диспергирующие средства, эмульгаторы, противовспениватели, консерванты, вторичные загустители, адгезивы, гиббереллины, а также вода.
Красители, которые могут присутствовать в композициях для протравливания семян, которые могут применяться согласно настоящему изобретению, представляют собой все красители, которые являются стандартными для таких целей. Возможно применять либо пигменты, которые мало растворимы в воде, либо красители, которые растворимы в воде. Примеры включают красители, известные под наименованиями Родамин В, С.I. Пигмент красный 112 и C.I. Растворитель красный 1.
Полезные смачивающие агенты, которые могут присутствовать в композициях для протравливания семян, применяемые согласно настоящему изобретению, представляют собой все вещества, которые обеспечивают смачивание и которые обычно применяются для композиции сельскохозяйственно активных соединений. Предпочтительным является применение алкилнафталинсульфонаты, а также диизопропил- или диизобутилнафталинсульфонаты.
Полезные диспергирующие средства и/или эмульгаторы, которые могут присутствовать в композициях для протравливания семян, применяемые согласно настоящему изобретению, представляют собой все неионные, анионные и катионные диспергирующие средства, обычно применяемые для композиции активных сельскохозяйственных ингредиентов. Предпочтительным является применение неионных или анионных диспергирующих средств или смесей неионных или анионных диспергирующих средств. Подходящие неионные диспергирующие средства включают в частности этиленоксид/пропиленоксид блочные полимеры, алкилфенолполигликолевые простые эфиры и тристирилфенолполигликолевые простые эфиры, и их фосфатированные или сульфатированные производные. Подходящие анионные диспергирующие средства включают в частности лигносульфонаты, соли полиакриловой кислоты и арилсульфонат/формальдегид конденсаты.
Противовспениватели, которые могут присутствовать в композициях для протравливания семян, применяемые согласно настоящему изобретению, представляют собой все вещества, ингибирующие пенообразование, обычно применяемые для композиции активных сельскохозяйственных ингредиентов. Предпочтительным является применение противовсениватели на основе кремния и стеарата магния.
Концертанты, которые могут присутствовать в композициях для протравливания семян, применяемые согласно настоящему изобретению, представляют собой все вещества, применяемые для таких целей в сельскохозяйственных композициях. Примеры включают дихлорофен и полуацеталь бензилового спирта.
Вторичные загустители, которые могут присутствовать в композициях для протравливания семян, применяемые согласно настоящему изобретению, представляют собой все вещества, которые могут применяться для таких целей в сельскохозяйственных композициях. Предпочтительными являются производные целлюлозы, производные акриловой кислоты, ксантан, модифицированные глины и тонко измельченный диоксид кремния.
Адгезивы, которые могут присутствовать в композициях для протравливания семян, применяемые согласно настоящему изобретению, представляют собой все стандартные связующие вещества, применяемые в продуктах для протравливания семян. В качестве предпочтительных могут быть упомянуты поливинилпирролидон, поливинилацетат, поливиниловый спирт и тилоза.
Гиббереллины, которые могут присутствовать в композициях, применяемых в соответствии с настоящим изобретением, могут предпочтительно представлять собой гиббереллины А1, A3 (= гибберелловая кислота), A4 и А7; особенно предпочтительным является применение гибберелловой кислоты. Гиббереллины известны (смотрите R. Wegler„ Chemie der Pflanzenschutz- und

Композиции для протравливания семян, применяемые согласно настоящему изобретению, могут применяться для обработки широкого многообразия различных видов семян, либо непосредственно, либо после предварительного разбавления водой. Например, концентраты или препараты, получаемые из них посредством разбавления водой, могут применяться для протравливания семян зерновых, таких как пшеница, ячмень, рожь, овес и тритикале, а также семян кукурузы, риса, масличного рапса, гороха, бобов, хлопка, подсолнуха, сои и свеклы, или еще широко многообразия различных семян овощей. Композиции для протравливания семян, применяемые согласно настоящему изобретению, или их разбавленные формы применения, также могут применяться для протравливания семян трансгенных растений.
Для обработки семени композиции композициями для протравливания семян, применяемыми согласно настоящему изобретению, или формами применения, полученными из них путем добавления воды, полезными являются все смешивающиеся компоненты, обычно применяемые для протравливания семян. В частности, методика протравливания семян состоит в помещении семени в смеситель, работающий периодическим образом или непрерывно, добавлении конкретного желаемого количества композиции для протравливания семян, либо как таковой, либо после предварительного разбавления водой, и смешении всех компонентом до достижения желаемой гомогенности композиции на семени. При необходимости это сопровождается операцией сушки.
Норма нанесения композиций для протравливания семян, применяемые согласно настоящему изобретению, может варьироваться в относительно широком диапазоне. При этом руководствуются конкретным содержанием соединений формулы (I) в композициях и семенем. Нормы нанесения соединения формулы (I) в общем составляют от 0.001 до 50 г на килограмм семени, предпочтительно от 0.01 до 15 г на килограмм семени.
Здоровье животных
В области здоровья животных, т.е. в области ветеринарии, активные соединения являются активными против животных вредителей, в частности эктопаразитов или, в другом варианте выполнения настоящего изобретения, также эндопаразитов. Термин эндопаразиты включает наиболее предпочтительно гельминты, такие как цестоды, нематоды или трематоды, и простейшие, такие как кокцидии. Эктопаразитами, как правило и предпочтительно, являются членистоногие, в частности насекомые, такие как Мухи (жалящие и лижущие), паразитические личинки мух, вошь, власоеды, пухоеды, блохи и тому подобное; и акариды, такие как клещи, как например, иксодовый клещ или аргасовые клещи, или клещи, такие как чесоточные, бегающие, пухоеды и тому подобное, а также водные эктопаразиты, такие как веслоногие ракообразные.
В области ветеринарии соединения формулы (I) являются подходящими, с благоприятной гомеотермной токсичностью, для контроля паразитов, которые встречаются в животноводстве и скотоводческом хозяйстве у сельскохозяйственных животных, племенных животных, животных, содержащихся в зоопарках, лабораторных животных, животных для экспериментов и домашних животных. Они активных против всех или конкретных стадий развития паразитов.
Сельскохозяйственные животные включают, например, млекопитающих, таких как овцы, козлы, лошади, ослы, верблюды, буйволы, кролики, северные олени, лани и в частности крупный рогатый скот и свиньи; или домашних птиц, таких как индюки, утки, гуси и в частности куры; рыбу и ракообразные, например, в аквакультуре; а также насекомых, таких как пчелы.
Домашние животные включают, например, млекопитающих, таких как хомяки, морские свинки, крысы, мыши, шиншиллы, хорьки, и в особенности собак, кошек, птиц клеточного содержания, пресмыкающихся, земноводных и аквариумных рыбок.
Согласно предпочтительному варианту выполнения настоящего изобретения, соединения формулы (I) вводятся млекопитающим.
Согласно другому предпочтительному варианту выполнения настоящего изобретения, соединения формулы (I) вводятся птицам, а именно птицам клеточного содержания и в частности домашней птице.
Посредством применения соединений формулы (I) для борьбы с паразитами животных, предполагается уменьшение или предотвращение болезней, случаев смерти и приведение характеристик к стандартным условиям (в случае мяса, молока, шерсти, шкур, яиц, меда и тому подобного), так что становится возможным более экономичное и облегченное содержание животных и достигается более хорошее самочувствие животных.
достигается более хорошее самочувствие животных.
Термин "контроль" или "борьба", как применяется в настоящей заявке, в отношении области здоровья животных, означает, что соединения формулы (I) являются эффективными для сокращения поражения соответствующим паразитом у животного, инфицированного такими паразитами, до безопасных уровней. Более конкретно, термин "борьба", как применяется в настоящей заявке, означает, что соединение формулы (I) эффективно для уничтожения соответствующего паразита, ингибирования его роста или ингибирования его размножения.
Членистоногие включают:
из отряда Вши, например, Haematopinus spp., Linognathus spp., Pediculus spp., Phthirus spp., Solenopotes spp.; специфическими примерами являются: Linognathus setosus, Linognathus vituli, Linognathus ovillus, Linognathus oviformis, Linognathus pedalis, Linognathus stenopsis, Haematopinus asini macrocephalus, Haematopinus eurysternus, Haematopinus suis, Pediculus humanus capitis, Pediculus humanus corporis, Phylloera vastatrix, Phthirus pubis, Solenopotes capillatus;
из отряда Mallophagida и подотрядов Amblycerina и Ischnocerina например, Trimenopon spp., Menopon spp., Trinoton spp., Bovicola spp., Werneckiella spp., Lepikentron spp., Damalina spp., Trichodectes spp., Felicola spp.; специальными примерами являются: Bovicola bovis, Bovicola ovis, Bovicola limbata, Damalina bovis, Trichodectes canis, Felicola subrostratus, Bovicola caprae, Lepikentron ovis, Werneckiella equi;
из отряда Diptera и подотрядов Nematocerina и Brachycerina, например, Aedes spp., Anopheles spp., Culex spp., Simulium spp., Eusimulium spp., Phlebotomus spp., Lutzomyia spp., Culicoides spp., Chrysops spp., Odagmia spp., Wilhelmia spp., Hybomitra spp., Atylotus spp., Tabanus spp., Haematopota spp., Philipomyia spp., Braula spp., Musca spp., Hydrotaea spp., Stomoxys spp., Haematobia spp., Morellia spp., Fannia spp., Glossina spp., Calliphora spp., Lucilia spp., Chrysomyia spp., Wohlfahrtia spp., Sarcophaga spp., Oestrus spp., Hypoderma spp., Gasterophilus spp., Hippobosca spp., Lipoptena spp., Melophagus spp., Rhinoestrus spp., Tipula spp.; специфическими примерами являются: Aedes aegypti, Aedes albopictus, Aedes taeniorhynchus, Anopheles gambiae, Anopheles maculipennis, Calliphora erythrocephala, Chrysozona pluvialis, Culex quinquefasciatus, Culex pipiens, Culex tarsalis, Fannia canicularis, Sarcophaga carnaria, Stomoxys calcitrans, Tipula paludosa, Lucilia cuprina, Lucilia sericata, Simulium reptans, Phlebotomus papatasi, Phlebotomus longipalpis, Odagmia ornata, Wilhelmia equina, Boophthora erythrocephala, tabanus bromius, Tabanus spodopterus, Tabanus atratus, Tabanus sudeticus, Hybomitra ciurea, Chrysops caecutiens, Chrysops relictus, Haematopota pluvialis, Haematopota italica, Musca autumnalis, Musca domestica, Haematobia irritans irritans, Haematobia irritans exigua, Haematobia stimulans, Hydrotaea irritans, Hydrotaea albipuncta, Chrysomya chloropyga, Chrysomya bezziana, Oestrus ovis, Hypoderma bovis, Hypoderma lineatum, Przhevalskiana silenus, Dermatobia hominis, Melophagus ovinus, Lipoptena capreoli, Lipoptena cervi, Hippobosca variegata, Hippobosca equina, Gasterophilus intestinalis, Gasterophilus haemorroidalis, Gasterophilus inermis, Gasterophilus nasalis, Gasterophilus nigricornis, Gasterophilus pecorum, Braula coeca;
из отряда Siphonapterida, например, Pulex spp., Ctenocephalides spp., Tunga spp., Xenopsylla spp., Ceratophyllus spp.; специфическими примерами являются: Ctenocephalides canis, Ctenocephalides felis, Pulex irritans, Tunga penetrans, Xenopsylla cheopis;
из отряда Клопы, например, например, Cimex spp., Triatom spp., Rhodnius spp., Panstrongylus spp.
из отряда Тараканы, например, Blatta orientalis, Periplaneta americana, Blattela germanica, Supella spp. (например, Suppella longipalpa);
Из подкласса Клещи (Acarina) и отряда Meta- и Mesostigmata, например, Argas spp., Ornithodorus spp., Otobius spp., Ixodes spp., Amblyomma spp., Rhipicephalus (Boophilus) spp., Dermacentor spp., Haemophysalis spp., Hyalomma spp., Dermanyssus spp., Rhipicephalus spp.(первоначальный род клещей с множеством хозяином), Ornithonyssus spp., Pneumonyssus spp., Raillietia spp., Pneumonyssus spp., Sternostoma spp., Varroa spp., Acarapis spp.; специфическими примерами являются: Argas persicus, Argas reflexus, Ornithodorus moubata, Otobius megnini, Rhipicephalus (Boophilus) microplus, Rhipicephalus (Boophilus) decoloratus, Rhipicephalus (Boophilus) annulatus, Rhipicephalus (Boophilus) calceratus, Hyalomma anatolicum, Hyalomma aegypticum, Hyalomma marginatum, Hyalomma transiens, Rhipicephalus evertsi, Ixodes ricinus, Ixodes hexagonus, Ixodes canisuga, Ixodes pilosus, Ixodes rubicius, Ixodes scapularis, Ixodes holocyclus, Haemaphysalis concinna, Haemaphysalis punctata, Haemaphysalis cinnabarina, Haemaphysalis otophila, Haemaphysalis leachi, Haemaphysalis longicorni, Dermacentor marginatus, Dermacentor reticulatus, Dermacentor pictus, Dermacentor albipictus, Dermacentor andersoni, Dermacentor variabilis, Hyalomma mauritanicum, Rhipicephalus sanguineus, Rhipicephalus bursa, Rhipicephalus appendiculatus, Rhipicephalus capensis, Rhipicephalus turanicus, Rhipicephalus zambeziensis, Amblyomma americanum, Amblyomma variegatum, Amblyomma maculatum, Amblyomma hebraeum, Amblyomma cajennense, Dermanyssus gallinae, Ornithonyssus bursa, Ornithonyssus sylviarum, Varroa jacobsoni;
Из отряда Actinedida (Prostigmata) и Acaridida (Astigmata) например, Acarapis spp., Cheyletiella spp., Ornithocheyletia spp., Myobia spp., Psorergates spp., Demodex spp., Trombicula spp., Listrophorus spp., Acarus spp., Tyrophagus spp., Caloglyphus spp., Hypodectes spp., Pterolichus spp., Psoroptes spp., Chorioptes spp., Otodectes spp., Sarcoptes spp., Notoedres spp., Knemidocoptes spp., Cytodites spp., Laminosioptes spp.; специфическими примерами являются: Cheyletiella yasguri, Cheyletiella blakei, Demodex canis, Demodex bovis, Demodex ovis, Demodex caprae, Demodex equi, Demodex caballi, Demodex suis, Neotrombicula autumnalis, Neotrombicula desaleri,

Из подкласса Веслоногие, отряда Siphonostomatoida, в частности рода Lepeophtheirus и Caligus, в качестве примера и особенно предпочтительно могут быть упомянуты виды Lepeophtheirus salmonis, Caligus elongatus и Caligus clemensi.
В общем, активные соединения согласно настоящему изобретению могут применяться непосредственно, если они подходят для лечения животных. Предпочтительно они применяются в виде фармацевтических композиций, которые могут содержать известные из уровня техники фармацевтически приемлемые эксципиенты и/или вспомогательные вещества.
В области ветеринарии и животноводства активные соединения применяются (=вводятся) известным образом, посредством энтерального введения в форме, например, таблеток, капсул, настоек, киселей, гранул, паст, болюсов, в процессе питания и в виде суппозиториев, посредством парентерального введения, например путем инъекции (внутримышечной, подкожной, внутривенной, интраперитонеальной, среди прочего), имплантов, посредством назального введения, посредством дермального введения в форме, например, окунания или купания, распыления, поливания и маркирования, промывания и опыления, а также с помощью формованных изделий, содержащих активное вещество, как например, ошейник, клеймо, отметки на хвосте, повязки на лапах, удавки, маркирующие устройства и т.д. Активные соединения могут быть получены в виде шампуня или в виде подходящих композиций, применяемых в аэрозолях или не находящихся под давлением спреях, как например, пульверизатор и распылитель.
При применении для домашнего скота, домашней птицы, домашних животных и тому подобного, активные соединения по настоящему изобретению, могут применяться в виде композиции (например, порошков, влажных порошков ["WP"], эмульсий, эмульгируемых концентратов ["ЕС"], текучих материалов, гомогенных растворов и концентратов для суспензий ["SC"]), которые содержат активное соединение в количестве от около 1 до 80 мас. %, либо сразу, либо после разбавления (например, 100-10000-кратное разбавление), или еще в виде химической бани.
При применении в области ветеринарии активные соединения согласно настоящему изобретению для расширения спектра действия могут применяться в комбинации с подходящими синергистами, репеллентами или другими активными соединениями, такими как, например, акарициды, инсектициды, антигельминтики, средства против простейших. Потенциальными партнерами смешивания для соединений согласно настоящему изобретению формулы (I) может быть, при применении в области ветеринарии, одно или более соединений групп (In-1)-(In-25).
(In-1) Ингибиторы ацетилхолинэстеразы (AChE), например карбаматы, например, Аланикарб, Альдикарб, Бендиокарб, Бенфуракарб, Бутокарбоксим, Бутоксикарбоксим, Карбарил, Карбофуран, Карбосульфан, Этиофенкарб, Фенобукарб, Форметанат, Фуратиокарб, Изопрокарб, Метиокарб, Метомил, Метолкарб, Оксамил, Пиримикарб, Пропоксур, Тиодикарб, Тиофанокс, Триазамат, Триметакарб, ХМС, и Ксилилкарб; особенно предпочтительным является применение против эктопаразитов Бендиокарба, Карбарила, Метомила, Промацила и Пропоксура; или
Органофосфаты, например, ацефат, азаметифос, азинфос (-метил, -этил), кадусафос, хлорэтоксифос, хлорфенвинфос, хлормефос, хлорпирифос (-метил), коумафос, цианофенфос, деметон-S-метил, диазинон, дихлорвос/DDVP, дикротофос, диметоат, диметилвинфос, дисульфотон, EPN, этион, этопрофос, фамфур, фенамифос, фенитротион, фентион, фостиазат, гептенофос, изофенфос, Изопропил О-(метоксиаминотио-фосфорил) салицилат, изоксатион, малатион, мекарбам, метамидофос, метидатион, меинфос, монокротофос, налед, ометоат, оксидеметон-метил, пиратион (-метил), фентоат, форат, фозалон, фосмет, фосфамидон, фоксим, пиримифос (-метил), профенофос, пропетамфос, протиофос, пираклофос, пиридафентион, квиналфос, сульфотеп, тебупиримфос, темефос, тербуфос, тетрахлорвинфос, тиометон, триазофос, триклорфон и вамидотион; особенно предпочтительными согласно настоящему изобретению для применения против эктопаразитов являются азаметифос, хлорфенвинфос, хлорпирифос, коумафос, цитиоат, диазинон (димпилат), дихлорвос (DDVP), дикротофос, диметоат, этион (диэтион), фамфур (фамофос), фенитротион, фентион (МРР), гептенофос, малатион, налед, фосмет (РМР, фталофос) фоксим, пропетамфос, темефос, тетрахлорвинфос (CVMP) и триклорфон/метрифонат.
(In-2) GABA-регулируемые антагонисты хлоридных каналов, как например органохлорины, например, бромоциклен, хлордан и эндосульфан (альфа-), гептахлор, линдан и токсафен; особенно предпочтительными согласно настоящему изобретению для применения против эктопаразитов являются эндосульфан (альфа-) и линдан; или
фипрол (фенилпиразол), например, ацетопрол, этипрол, фипронил, пирафлупрол и пирипрол, ризазол; особенно предпочтительными согласно настоящему изобретению для применения против эктопаразитов являются фипронил и пирипрол; или
Арилизоксазолин, Арилпирролин, Арилпирролидин, например, флураланер (известно из WO 2009/2024541, Примеры 11-1; а также соединения из WO 2012007426, WO 2012042006, WO 2012042007, WO 2012107533, WO 2012120135, WO 2012165186, WO 2012155676, WO 2012017359, WO 2012127347, WO 2012038851, WO 2012120399, WO 2012156400, WO 2012163959, WO 2011161130, WO 2011073444, WO 2011092287, WO 2011075591, WO 2011157748, WO 2007/075459, WO 2007/125984, WO 2005/085216, WO 2009/002809), афоксоланер (например, в WO 2011149749) и структурно родственные Арилпирролины (известны, например, из WO 2009/072621, WO 2010020522, WO 2009112275, WO 2009097992, WO 2009072621, JP 2008133273, JP 2007091708), или Арилпирролидины (например, в WO 2012004326, WO 2012035011, WO 2012045700, WO 2010090344, WO 2010043315, WO 2008128711, JP 2008110971), и соединения из группы, так называемых метадиамидов (известны, например, из WO 2012020483, WO 2012020484, WO 2012077221, WO 2012069366, WO 2012175474, WO 2011095462, WO 2011113756, WO 2011093415, WO 2005073165), особенно предпочтительными согласно настоящему изобретению для применения против эктопаразитов являются афоксоланер и флураланер.
(In-3) Модуляторы натриевых каналов / блокатары зависимых от напряжения натриевых каналов, как например пиретроиды, например, акринатрин, аллетрин (d-цис-транс, d-транс), бифентрин, биоаллетрин, биоаллетрин-S-циклопентил, био-ресметрин, циклопротрин, цифлутрин (бета-), цигалотрин (гамма-, лямбда-), циперметрин (альфа-, бета-, тета-, зета-), цифенотрин [(1R)-транс-Изомер], дельта-метрин, димефлутрин, эмфентрин [(EZ)-(1R)-Изомер], эсфенвалерат, этофенпрокс, фенпропатрин, фенвалерат, флуцитринат, флуметрин, флувалинат (тау-), гальфенпрокс, имипротрин, метофлутрин, перметрин, фенотрин [(1R)-транс-изомер], праллетрин, профлутрин, пиретрин (пиретрум), ресметрин, RU 15525, силафлуофен, тефлутрин, Тетраметрин [(1R)-Изомер], тралометрин, трасфлутрин и ZXI 8901; особенно предпочтительными согласно настоящему изобретению для применения против эктопаразитов являются пиретроиды типа I аллетрин, биоаллетрин, перметрин, фенотрин, ресметрин, тетраметрин, и пиретроиды типа II (альфа-цианопиретроиды) альфа-циперметрин, цифлутрин (бета-), цигалотрин (лямбда-), циперметрин (альфа-, зета-), дельтаметрин, фенвалерат, флуцитринат, флуметрин, флувалинат (тау-), и эстерифицированные пиретроиды этофенпрокс и силафлуофен; или хлорорганические соединения, например, DDT; или метоксихлор. Активные вещества этого класса являются особенно подходящими в качестве партнеров смешивания, так как они обладают более длительным непрерывным репеллентным действием и, таким образом, расширяют спектр действия для этого компонента.
(In-4) Агонисты никотинового ацетилхолинового рецептора, как например неоникотиноиды, например, ацетамиприд, клотианидин, динотефуран, имидаклоприд, имидаклотиз, нитенпирам, тиаклоприд, и тиаметоксам; особенно предпочтительными согласно настоящему изобретению для применения против эктопаразитов являются клотианидин, динотефуран, имидаклоприд, нитенпирам и тиаклоприд; или никотин.
(In-5) Модуляторы (агонисты) аллостерического ацетилхолинового рецептора, как например спинозины, например, спинеторам и спиносад; особенно предпочтительными согласно настоящему изобретению для применения против эктопаразитов являются спиносад и спинотерам.
(In-6) Активаторы хлоридного канала, например авермектины/мильбемицины, например, абамектин, дорамектин, эмамектин-бензоат, эприномектин, ивермектин, латидектин, лепимектин, мильбемицин оксим, мильбемектин, моксидектин и селамектин; индолтерпеноид, как например, производные нодулиспориновой кислоты, наиболее предпочтительно нодулиспориновая кислота А; особенно предпочтительными согласно настоящему изобретению для применения против эктопаразитов являются дорамектин, эприномектин, ивермектин, мильбемицин оксим, моксидектин, селамектин и нодулиспориновая кислота А.
(In-7) Аналоги ювенильного гормона, например, Гидропрен (S-), Кинопрен, Метопрен (S-); или Феноксикарб; Пирипроксифен; особенно предпочтительными согласно настоящему изобретению для применения против эктопаразитов являются метопрен (S-) и Пирипроксифен.
(In-8) Ингибиторы роста клещей, например, Клофентезин, Дифловидазин, Гекситиазокс, Этоксазол; особенно предпочтительными согласно настоящему изобретению для применения против эктопаразитов являются этоксазол.
(In-9) Агонисты Slo-1- и латрофилиновых рецепторов, как например, циклические депсипептиды, например, эмодепсид, а также их исходные соединения PF1022A (известно из ЕР 382173, соединение I); эмодепсид.
(In-10) Ингибиторы окислительного фосфорилирования, АТФ-разобщители, как например, диафентиурон.
(In-12) Антагонисты никотинергического ацетилхолинового рецептора, такие как, например, Бенсультап, Картап (-гидрохлорид), Тиоциклам, и Тиосультап (-натрий).
(In-13) Ингибиторы биосинтеза хитина, типа 0, как например Бензоилмочевины, например, Бистрифлурон, Хлофлуазурон, Дифлубензурон, Флуциклоксурон, Флуфеноксурон, Гексафлумурон, Луфенурон, Новалурон, Новифлумурон, Тефлубензурон и Трифлумурон; особенно предпочтительными согласно настоящему изобретению для применения против эктопаразитов являются Дифлубензурон, Флуазурон, Луфенурон и Трифлумурон.
(In-14) Ингибиторы биосинтеза хитина, типа 1, например Бупрофезин.
(In-15) Ингибиторы линьки, как например, Циромазин и Дицикланил; особенно предпочтительными согласно настоящему изобретению для применения против эктопаразитов являются Циромазин и Дицикланил.
(In-16) Агонисты рецептора экдизона/-разобщители, как например Диацилгидразины, например, Хромафенозид, Галофенозид, Метоксифенозид и Тебуфенозид.
(In-17) Октопаминергические агонисты, такие как, например, Амитраз, цимиазол, Хлордимеформ и демидитраз; особенно предпочтительными согласно настоящему изобретению для применения против эктопаразитов являются амитраз, цимиазол и цимиазол.
(In-18) Ингибиторы транспорта электронов митохондриального комплекса III, как например Гидраметилнон; Ацехиноцил; Флуакрипирим.
(In-19) Ингибиторы транспорта электронов митохондриального комплекса I, например, из группы METI акарицидов, например, Феназахин, Фенпироксимат, Пиримидифен, Пиридабен, Тебуфенпирад, Толфенпирад; особенно предпочтительными согласно настоящему изобретению для применения против эктопаразитов являются Фенпироксимат, Пиримидифен и Тебуфенпирад;
(In-20) Блокаторы потенциалзависимого натриевого канала, например, Индоксакарб и Метафлумизон; особенно предпочтительными согласно настоящему изобретению для применения против эктопаразитов являются Индоксакарб и Метафлумизон.
(In-21) Ингибиторы ацетил-CoA-карбоксилазы, как например производные тетроновой кислоты, например, спиродиклофен и спиромезифен; или производные тетрамовой кислоты, например, спиротетрамат.
(In-22) Ингибиторы транспорта электронов митохондриального комплекса II, например, Циенопирафен.
(In-23) Эффекторы рианодинового рецептора, как например диамид, например, флубендиамид, хлорантранилипрол (ринаксипир), циантранилипол (циазипир), а также 3-бром-N-{2-бром-4-хлор-6-[(1-циклопропилэтил)карбамоил]фенил}-1-(3-хлорпиридин-2-ил)-1Н-пиразол-5-карбоксамид (известно из WO 2005/077934) или Метил-2-[3,5-дибром-2-({[3-бром-1-(3-хлорпиридин-2-ил)-1Н-пиразол-5-ил]карбонил}амино)бензоил]-1,2-диметилгидразинкарбоксилат (известно из WO 2007/043677).
(In-24) Другие активные вещества с неизвестным механизмом действия, как например, азадирахтин, амидофлумет, бензоксимат, бифеназат, хинометионат, криолит, цифлуметофен, дикофол, флуенсульфон (5-хлоро-2-[(3,4,4-трифторобут-3-ен-1-ил)сульфонил]-1,3-тиазол), флуфенерим, пиридалил и пирифлуквиназон; кроме того, препараты на основе Bacillus firmus (I-1582, BioNeem, Votivo), а также следующие соединения: 4-{[(6-бромпирид-3-ил)метил](2-фторэтил)амино}фуран-2(5Н)-он (известно из WO 2007/115644), 4-{[(6-фторпирид-3-ил)метил](2,2-дифторэтил)амино}фуран-2(5Н)-он (известно из WO 2007/115644), 4-{[(2-хлор-1,3-тиазол-5-ил)метил](2-фторэтил)амино}фуран-2(5Н)-он (известно из WO 2007/115644), 4-{[(6-хлорпирид-3-ил)метил](2-фторэтил)амино}фуран-2(5Н)-он (известно из WO 2007/ 115644), 4-{[(6-хлорпирид-3-ил)метил](2,2-дифтор-этил)амино}фуран-2(5Н)-он (известно из WO 2007/115644), 4-{[(6-хлор-5-фторпирид-3-ил)метил](метил)амино}фуран-2(5Н)-он (известно из WO 2007/115643), 4-{[(5,6-дихлорпирид-3-ил)метил](2-фторэтил)амино}фуран-2(5Н)-он (известно из WO 2007/115646), 4-{[(6-хлор-5-фторпирид-3-ил)метил](циклопропил)амино}фуран-2(5Н)-он (известно из WO 2007/115643), 4-{[(6-хлорпирид-3-ил)метил](циклопропил)амино}фуран-2(5Н)-он (известно из ЕР-А-0539588), 4-{[(6-хлорпирид-3-ил)метил](метил)амино}фуран-2(5Н)-он (известно из ЕР-А-0539588), [(6-хлорпирид-3-ил)метил](метил)оксидо-λ4-сульфанилиденцианамид (известно из WO 2007/149134), [1-(6-хлорпиридин-3-ил)этил](метил)оксидо-λ4-сульфанилиденцианамид (известно из WO 2007/149134), [(6-трифторметилпиридин-3-ил)метил](метил)оксидо-λ4-сульфанилиденцианамид (известно из WO 2007/095229), сульфоксафлор (также известно из WO 2007/149134), 11-(4-хлор-2,6-диметилфенил)-12-гидрокси-1,4-диоха-9-азадиспиро[4.2.4.2]тетрадец-11-ен-10-он (известно из WO 2006/089633), 3-(4'-фтор-2,4-диметилбифенил-3-ил)-4-гидрокси-8-окса-1-азаспиро[4.5]дец-3-ен-2-он (известно из WO 2008/067911), 1-[2-фторо-4-метил-5-[(2,2,2-трифторо-этил)сульфинил]фенил]-3-(трифторметил)-1Н-1,2,4-триазол-5-амины (известно из WO 2006/043635), [(3S,4aR,12R,12aS,12bS)-3-[(циклопропилкарбонил)окси]-6,12-дигидрокси-4,12b-диметил-11-оксо-9-(пиридин-3-ил)-1,3,4,4а,5,6,6а,12,12а,12b-декагидро-2Н,11Н-бензо[f]пирано[4,3-b]хромен-4-ил]метилцикло-пропанкарбоксилат (известно из WO 2006/129714), 2-Циано-3-(дифторометокси)-N-этил-бензолсульфонамид (известно из WO 2005/035486), N-[1-(2,3-диметилфенил)-2-(3,5-диметилфенил)этил]-4,5-дигидро-2-тиазоламины (известно из WO 2008/104503); Penigequinolone А (известно из ЕР 2248422 (соединение I) и WO 2009/060015 (соединение №11).
(In-25) В качестве подходящих синергистов при применении с эктопаразитицидами в настоящей заявке упоминаются MGK264 (N-октилбициклогептенкарбоксамид), пиперонилбутоксид (РВО) и вербутин; особенно предпочтительно пиперонилбутоксид и MGK264.
В дополнение к этим группам в смесях или в комбинациях также могут применяться кратковременные репелленты. Примерами являются DEET (N,N-диэтил-3-метилбензамид), икаридин (1-пиперидинкарбоновая кислота), (1S, 20S)-2-метилпиперидинил-3-циклогексен-1-карбоксамид (SS220), индалон (бутил 3,4-дигидро-2, 2-диметил-4-оксо-2Н-пиран-6-карбоксилат), дигидронепеталактоны, нооткатон, IR3535 (3-[н-бутил-N-ацетил]-аминопропионовой кислоты этиловый сложный эфир), 2-Этилгексан-1,3-диол, (1R,2R,5R)-2-(2-Гидроксипропан-2-ил)-5-метил-циклогексан-1-ол, диметил бензол-1,2-дикарбоксилате до декановая кислота, ундекан-2-он, N,N-диэтил-2-фенил-ацетамид, и простые эфирные масла или другие растительные компоненты с известным репеллентным действием, как например, борнеол, калликарпенал, 1,8-цинеол (эвкалиптол), карвакрол, b-цитронеллол, a-копаен, кумарин (или их синтетические производные, известные из US 20120329832), при использовании против эктопаразитов особенно предпочтительными являются икаридин, индалон и IR3535 (3-[н-бутил-N-ацетил]-аминопропионовой кислоты этиловый сложный эфир)
Из вышеупомянутых групп (In-1)-(In-25) следующие группы являются предпочтительными в качестве партнеров смешения: (In-2), (In-3), (In-4), (In-5), (In-6), (In-17), (In-25).
Особенно предпочтительные примеры инсектицидных или акарицидных активных соединений, синергистов или репеллентов в качестве партнеров смешения с соединениями формулы (I) согласно настоящему изобретению являются афоксоланер, аллетрин, амитраз, биоаллетрин, хлотианидин, цифлутрин (бета-), цигалотрин (лямда-), цимиазол, циперметрин (альфа-, зета-), цифенотрин, дельтиметрин, демидитраз, динотефурана, дорамектин, эприномектин, этофенпрокс, фенвалерат, фипронил, флуазурон, флуцитринат, флуметрин, флураланер, флувалинат (tau-), икаридин, имидаклоприд, ивермектин, MGK264, мильбемицин оксим, моксидектин, нитенпирам, перметрин, фенотрин, пиперонилбутоксид, пирипрол, ресметрин, салемектин, силафлуофен, спинеторам, спиносад, тетраметрин, тиаклоприд.
Борьба с переносчиками инфекций
Соединения формулы (I) могут также применяться для борьбы с переносчиками инфекций. В целях настоящего изобретения, переносчиком инфекции является членистоногое, в частности насекомое или паукообразное, способное передавать патогены, такие как, например, вирусы, глисты, одноклеточные организмы и бактерии от резервента (растение, животное, человек, и т.д.) хозяину. Патогены могут передаваться либо механически (например, трахома посредством не жалящих мух) хозяину, или путем инъекции (например, малярийный плазмодий из-за москитов) в хозяина.
Примерами переносчиков инфекций и заболеваний и патогенов, которые они могут переодевать, являются:
1) Москиты
- Комар малярийный: малярия, филяриоз;
- Кулекс: японский энцефалит, филяриоз, другие вирусные заболевания, перенос глистов;
- Кусака: тропическая лихорадка, лихорадка денге, филяриоз, другие вирусные заболевания;
- Мошки: перенос глистов, в частности Onchocerca volvulus;
2) Вошь: кожные инфекции, госпитальная лихорадка;
3) Блохи: чума, госпитальная лихорадка;
4) Мухи: африканский трипаносомоз (трипаносомоз); холера, другие бактериальные заболевания;
5) Клещи: акародерматит, госпитальная лихорадка, везикулезный риккетсиоз, туляремия, энцефалит Сент-Луиса, клещевой энцефалит (ТВЕ), геморрагическая лихорадка Crimean-Congo, боррелиоз;
6) Зудни: боррелиоз, такой как Borrelia duttoni, клещевой энцефалит, австралийская лихорадка Q (Coxiella burnetii), бабезиоз (Babesia canis canis).
Примеры примерами переносчиков инфекций в контексте настоящего изобретения являются насекомые, например, тля, мухи, кобылочка или трипе, которые способны передавать вирусы растений растениям. Другими переносчиками инфекций, способными передавать вирусы растений, являются клещик паутинный, вошь, жуки и нематоды.
Другими примерами переносчиков инфекций в контексте настоящего изобретения являются насекомые и паукообразные, такие как москиты, в частности рода Кусака, Комар малярийный, например, A. gambiae, A. arabiensis, A. funestus, A. dirus (малярия) и Кулекс, вши, блохи, мухи, клещи и зудни, способные передавать патогены животным и/или людям.
Борьба с переносчиками инфекций также возможна, если соединения формулы (I) являются преодолевающими резистентность.
Соединения формулы (I) подходят для применения для профилактики заболеваний и/или патогенов, передаваемых переносчиками инфекций. Таким образом, другим объектом настоящего изобретения является применение соединений формулы (I) для борьбы с переносчиками инфекций, например, в сельском хозяйстве, в садоводстве, в парках и пространствах для отдыха, а также для защиты материалов и продуктов на хранении.
Защита промышленных материалов
Соединения формулы (I) подходят для защиты промышленных материалов от воздействия или разрушения насекомыми, например, из отрядов Жесткокрылые, Перепончатокрылые, Термиты, Чешуекрылые, Сеноеды и Щетинохвостики.
Промышленные материалы в контексте настоящего изобретения, как понимается, означают неодушевленные материалы, такие как предпочтительно пластики, грунты, камни, бумага и картон, кожа, древесина, продукты обработанной древесины и покрывающие композиции. Применение настоящего изобретения для защиты древесины является особенно предпочтительно.
В другом варианте выполнения настоящего изобретения, соединения формулы (I) применяются вместе с по меньшей мере одним другим инсектицидом и/или по меньшей мере одним фунгицидом.
В другом варианте выполнения настоящего изобретения, соединения формулы (I) присутствуют в виде пестицида, готового к применению, т.е. они могут наноситься на рассматриваемый материал без дальнейших модификаций. Подходящие другие инсектициды или фунгициды в частности представляют собой упомянутые выше.
Неожиданно было обнаружено, что соединения формулы (I) могут применяться для защиты объектов, которые вступают в контакт с соленой водой или жесткой водой, в частности одежды, ограждений, сетей, строений, якорей и сигнальных систем, от биологических обрастаний. Подобным образом, соединения формулы (I), сами по себе или в комбинации с другими активными соединениями, могут применяться в качестве средств против биологического обрастания.
Борьбы с животными вредителями в биологическом секторе
Соединения формулы (I) подходят для борьбы с животными вредителями в гигиеническом секторе. В частности, настоящее изобретение может применяться в бытовом секторе, в гигиеническом секторе и для защиты продуктов при хранении, особенно для борьбы с насекомыми, паукообразными и клещами, встречающимися в закрытых пространствах, таких как жилые помещения, фабричные помещения, офисы, кабины транспортных средств. Для борьбы с животными вредителями соединения формулы (I) применяются сами по себе или в комбинации с другими активными соединениями и/или вспомогательными веществами. Они предпочтительно применяются в бытовых инсектецидных продуктах. Соединения формулы (I) эффективны против чувствительных и резистентных видов, и против всех стадий развития.
Эти вредители включают, например, вредители из класса Паукообразные, из отрядов Скорпионы, Пауки и Сенокосцы, из классов Губоногие и Двупарноногие, из класса Насекомые из отряда Таракановые, из отрядов Жесткокрылые, Кожистокрылые, Двукрылые, Клопы, Перепончатокрылые, Термиты, Чешуекрылые, Пухоеды и вши, Сеноеды, Ортоптероидные или Прямокрылые, Блохи и Щетинохвостики и из класса Высшие раки из отряда Равноногие.
Они применяются, например, в виде аэрозолей, свободных от давления распылительных продуктов, например, пульверизаторов и атомизированных спреев, автоматических систем аэрозольного орошения, аэрозольных опрыскивателей, пен, гелей, продуктов на основе испарителя с таблетками испарителя, изготовленными из целлюлозы или пластика, жидкостных испарителей, гелевых и мембранных испарителей, винтовых испарителей, свободных от энергии или пассивных выпарных систем, бумаги против моли, мешочков против моли и гелей в виде моли, в виде гранул или пыли, в виде приманок для распространения или в виде ловушек.
Способы получения
Соединения согласно настоящему изобретению могут быть получены стандартными известными специалисту в данной области техники способами.
Соединения структуры (I-T1) и (I-T2) могут быть получены согласно способам, описанным в литературе для аналогичных соединений:
Способ I-T1
Соединения структуры (I-T1) могут быть получены согласно способу, показанному на реакционной схеме 1.
Реакционная схема 1

Группы А1-A4, В1-В5, алкил, Q, R1 и R11 имеют значения, описанные выше. U представляет собой, например, бром, иод или трифлат. Исходные соединения структуры (А-1) (например, WO 2004/099146, стр. 75-76) и (А-7) (например, US 5,739,083, стр. 10, US 2003/187233 А1, стр. 6) известны или могут быть получены известными способами.
Соединения общей структуры (А-2) могут быть получены согласно способам, известным из литературы, из соединений общей структуры (А-1) и амидацеталей карбоновой кислоты (В-8) (например, WO 2013/009791, Стр. 50, Пример 43; WO 2004/099146, Стр. 75-76). Соединения общей структуры (А-3) могут быть получены согласно способам, известным из литературы, из соединений общей структуры (А-2) и гидразина (например, WO 2013/009791, Стр. 50, Пример 43; WO 2004/099146, Стр. 75-76). Соединения общей структуры (А-4) могут быть получены согласно способам, известным из литературы, из соединений общей структуры (А-3) и (А-6) (например, WO 2013/009791, Стр. 50, Пример 44). Соединения общей структуры (А-5) могут быть получены аналогично способам, известным из литературы, посредством расщепления сложного эфира, из соединений общей структуры (А-4) (смотрите, например, WO 2010/051926 или WO 2010/133312). Соединения согласно настоящему изобретению общей структуры (I-T1) могут быть получены аналогично известным из литературы способам пептидного сочетания из исходных соединений (А-5) и (А-7) (например, WO 2010/051926 или WO 2010/133312).
Способ I-T2
Соединения структуры (I-T2) могут быть получены согласно способу, показанному на реакционной схеме 1.
Реакционная схема 2

Группы A1-A4, B1-В5, алкил, Q, R1 и R11 имеют значения, описанные выше. X представляет собой, например, представляет собой Cl, Br, I или остаток бороновой кислоты или остаток сложного эфира бороновой кислоты. Исходные соединения структуры (В-1) (например, Filler, Robert; Kong, Zhengrong; Zhang, Zhaoxu; Sinha, Arun Kr.; Li, Xiaofang Journal of Fluorine Chemistry, 80 (1996) Стр. 71-76; US 2003/187233, Стр. 14, Пример 21) и (В-6) известны или могут быть получены известными способами.
Соединения общей структуры (В-2) могут быть получены согласно способам, известным из литературы, из соединений общей структуры (В-1) и амидацеталей карбоновой кислоты (В-8) (например, WO 2006/044505, соединение 60, Part А; WO 2012/4604, промежуточное соединение 2). Соединения общей структуры (В-3) могут быть получены согласно способам, известным из литературы, из соединений общей структуры (В-2) и гидразина (например, WO 2013/009791, Стр. 50, Пример 43; WO 2004/099146, Стр. 75-76). Соединения общей структуры (В-4) могут быть получены согласно способам, известным из литературы, из соединений общей структуры (В-3) и (В-6) (например, WO 2013/009791, Стр. 50, Пример 44, X=Br). Соединения общей структуры (В-5) могут быть получены аналогично способам, известным из литературы, посредством расщепления сложного эфира, из соединений общей структуры (В-4) (например, WO 2010/051926 или WO 2010/133312). Соединения согласно настоящему изобретению общей структуры (I-T1) могут быть получены аналогично описанным в литературе способам пептидного связывания из исходных соединений (В-5) и (В-7) (например, WO 2010/051926 или WO 2010/133312).
Стадия 1 Диалкиламиноалкенилирование

Соединения общей структуры (В-2) могут быть получены аналогично известным из литературы способам из исходных веществ структуры (В-1) и (В-8). Группы B1-В5, алкил и R11 имеют описанные выше значения. Исходные соединения структуры (В-1) (например, Filler, Robert; Kong, Zhengrong; Zhang, Zhaoxu; Sinha, Arun Kr.; Li, Xiaofang Journal of Fluorine Chemistry, 80 (1996) Стр. 71-76; US 2003/187233, Стр. 14, Пример 21 [0294], US 5739083, Пример 6) известны или могут быть получены известными способами. Реакция проводится при осуществления взаимодействия соединений (В-1) с соединениями (В-8) при известных из литературы условий для аналогичных реакций (например, ЕР 1204323, Стр. 25, Пример 13).
Стадия 2 Закрытие пиразольного кольца

Соединения общей структуры (В-3) могут быть получены аналогично известным из литературы способам из исходных веществ структуры (В-2) и гидразина. Группы B1-В5, и R11 имеют описанные выше значения. Получение исходных соединений структуры (В-2) описано выше. Реакция проводится при осуществлении взаимодействия соединений (В-2) с гидразином при известных из литературы условиях для аналогичных реакций (ЕР 1382603, Пример 3, Стр. 43)
Стадия 3 Арильное сочетание

Соединения общей структуры (В-4) могут быть получены аналогично известным из литературы способам из исходных веществ структуры (В-3) и (В-6). Группы A1-A4, В1-В5, алкил, R1 и R11 имеют значения, описанные выше. X представляет собой остаток бороновой кислоты или сложного эфира бороновой кислоты. Получение исходных соединений структуры (В-3) описано выше. Соединения общей структуры (В-6) являются коммерчески доступными или могут быть получены способами, известными специалистам в данной области техники. Реакция проводится при условиях, известных из литературы для аналогичных реакций (WO 2009140342, Стр. 96).
Стадии 4,5 Гидролиз, амидирование

Соединения согласно настоящему изобретению общей структуры (I-T2) могут быть получены согласно известным из литературы способам пептидного сочетания из исходных веществ (В5) и (В7) [WO 2010-051926; WO 2010-133312]. Соединения общей структуры (В5) могут быть получены аналогично способам, известным из литературы, посредством расщепления сложного эфира, из соединений общей структуры (В4) [WO 2010-051926; WO 2010-133312]. Группы A1-A4, B1-В5, алкил, Q, R1 и R11 имеют значения, описанные выше. Получение соединений структуры (В-7) описано выше.
Способ I-T3
Соединения структуры (I-T3) могут быть получены согласно способу, показанному на реакционной схеме 3а.
Реакционная схема 3а

Группы A1-А4, B1-В5, алкил, Q, R1, n и R11 имеют значения, описанные выше. М представляет собой, например, бороновую кислоту, сложный эфир бороновой кислоты или трифторборонат. U представляет собой, например, бром, иод или трифлат. X, например, представляет собой Cl, Br, I.
Стадия 1 Пиразол
Стадия 1 способа получения соединений согласно настоящему изобретению (1-T3):

Соединения согласно настоящему изобретению общей структуры (Y-2) могут быть получены аналогично известным из литературы способам из исходных веществ структуры (Y-1). Группы В1-В5 и R11 имеют значения, описанные выше. Исходные соединения структуры (Y1) известны или могут быть получены известными способами. В качестве примеров приводятся [2,6-дихлор-4-(трифторметил)фенил]гидразин, [3-хлор-5-(трифторметил)-2-пиридил]гидразин, [2,6-дихлор-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]гидразин, [2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]гидразин, [2-метил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-6-(трифторметил)фенил]гидразин, или [2-хлор-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-6-(трифтор-метил)фенил]гидразин. Они могут быть получены, например, согласно способам, описанным в US 2003/187233, Стр. 13; Haga, Takahiro et al., Heterocycles, 22 (1984), Стр. 117-124.
Стадия 2 Иодпиразол
Стадия 2 способа получения соединений согласно настоящему изобретению (1-T3):

Группы В1-В5, n и R11 имеют значения, описанные выше. U представляет собой, например, бром или иод.
Соединениями согласно структурной формуле (Y-3) являются, например, 1-(2,6-дихлоро-4-трифторметил-фенил)-4-иод-пиразол, 3-хлор-2-(4-иодпиразол-1-ил)-5-(трифторметил)пиридин (CAS-RN: 8611-89-2), 1-(2,6-дихлор-4-гептафторизопропил-фенил)-4-иод-пиразол, 1-(2,6-диметил-4-гептафторизопропил-фенил)-4-иод-пиразол, 1-[2-метил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-6-(трифторметил)фенил]-4-иод-пиразол, 1-[2-хлор-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-6-(трифторметил)фенил]-4-иод-пиразол, или 1-[2-этил-6-метил-4-[1,2,2,2-тетрафтор-1-(трифтор-метил)эти л]фенил]-4-иод-пиразол.
Соединения согласно настоящему изобретению общей структуры (Y-3) получают посредством взаимодействия пиразола структуры (Y-2) с галогенирующими средствами. Группы В1-В5 и R11 имеют значения, описанные выше. Подходящие га-логенирующие соединения известны специалистам в данной области техники, как например, хлор, бром, иод, N-хлорсукцинимид, N-бромсукцинимид, N-иодсукцинимид, 1,3-дихлор-5,5-диметилгидантоин, 1,3-дибром-5,5-диметилгидантоин, гипохлорит натрия и иодмонохлорид. Предпочтительно применяются бром, иод и иодсукцинимид. При необходимости предпочтительно проводить реакцию в присутствии окисляющего средства, например, пероксида водорода. Взаимодействие осуществляется при известных из литературы условиях, например, Guo Li et al., Tetrahedron Letters 48 (2007), 4595-4599; Mary M. Kim et al., Tetrahedron Letters 49 (2008), 4026-4028.
Альтернативное сочетание с пиразолом
Альтернативно можно получать соединения структуры Y-3 согласно известному из литературы способу посредством прямого связывания иодпиразола с соответствующим арилгалогенидом (например, Sammelson, Robert Е. et al., J. of Organic Chemistry, 68 (2003), 8075-8079).

Группы B1-B5, n и R11 имеют значения, описанные выше. X представляет собой, например, галоген. U представляет собой, например, бром, иод или трифлат
Исходные соединения структуры (Y-8) известны или могут быть получены известными способами. В качестве примера упоминаются 2-бром-1,3-дихлор-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]бензол, 2-бром-1,3-диметил-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]бензол, 2-бром-1-этил-3-метил-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]бензол, 2-бром-1-хлор-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-3-(трифторметил)бензол, 2-бром-1-метил-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-3-(трифторметил)бензол, 2-бром-1-хлор-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-3-(трифторметокси)бензол, 2-бром-1-метил-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-3-(трифторметокси)бензол. Они могут, например, быть получены согласно способам, описанным в ЕР 1253128, Стр. 8-10.
Стадия 3 сочетание с бороновой кислотой
Стадия 3 способа получения соединений согласно настоящему изобретению (1-T3):

Группы A1-A4, B1-В5, алкил, n и R11 имеют значения, описанные выше. U представляет собой, например, бром, иод или трифлат, если М представляет собой бо-роновую кислоту, сложный эфир бороновой кислоты или трифторборонат; или U представляет собой, например, бороновую кислоту, сложный эфир бороновой кислоты или трифторборонат, если М представляет собой бром, иод или трифлат.
Соединения согласно настоящему изобретению общей структуры (Y-5) могут быть получены согласно способам, известным из литературы, посредством катализируемых палладием реакций из партнеров реакции (Y-3) и (Y-4) (например, WO 2005/040110 или WO 2009/089508). Соединения общей структуры (Y-4) являются коммерчески доступными или могут быть получены способами, известными специалистам в данной области техники.
Стадии 4,5 Гидролиз, Амидирование
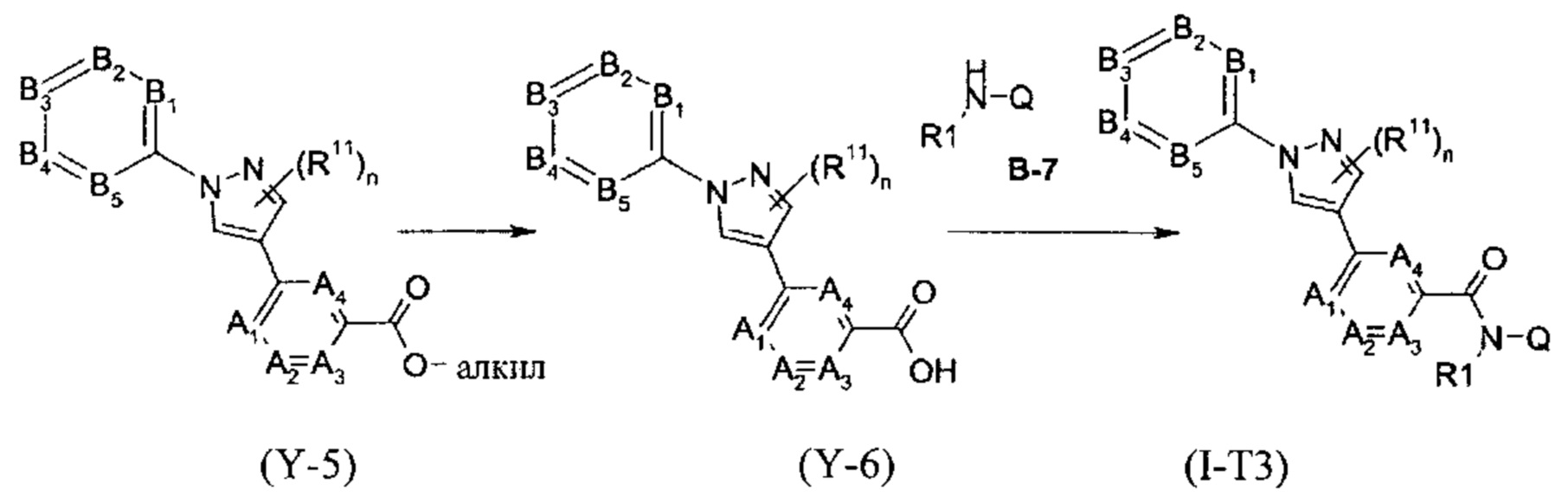
Соединения согласно настоящему изобретению общей структуры (I-T3) могут быть получены согласно описанным в литературе способам пептидного сочетания из исходных веществ (Y-6) и (Y-7) (например, WO 2010/051926 или WO 2010/133312). Соединения общей структуры (Y-6) могут быть получены аналогично способам, известным из литературы, посредством расщепления сложного эфира, из соединений общей структуры (Y-5) (например, WO 2010/051926 или WO 2010/133312). Группы A1-A4, B1-B5, алкил, Q, R1 и R11 имеют значения, описанные выше.
Стадия 3 альтернативная: сочетание с амидами
Альтернативно соединения согласно настоящему изобретению (I-T3) получают согласно общему способу получения 3b.
Реакционная схема 3b

Группы A1-A4, B1-В5, алкил, Q, R1, n и R11 имеют значения, описанные выше. U представляет собой бром, иод или трифлат, если М представляет собой бороно-вую кислоту, сложный эфир бороновой кислоты или трифторборонат.U представляет собой бороновую кислоту, сложный эфир бороновой кислоты или трифторборонат, если М представляет собой бром, иод или трифлат.
Соединения согласно настоящему изобретению общей структуры (I-T3) могут быть получены согласно способам, известным из литературы, посредством катализируемых палладием реакций из партнеров реакции (Y-3) и (Y-10) (например, WO 2005/040110 или WO 2009/089508). Соединения общей структуры (Y-10) являются коммерчески доступными или могут быть получены способами, известными специалистам в данной области техники. Получение соединений структуры (Y-3) уже описано выше.
Способ I-T4
Соединения структуры (I-T4) могут быть получены согласно способу, показанному на реакционной схеме 4.
Реакционная схема 4

Группы A1-A4, B1-В5, алкил, Q, и R1 имеют значения, описанные выше. X представляет собой Cl, Br, I. Исходные соединения структуры (D-1) (например, ЕР 2319830, Стр. 330) и (D-7) известны или могут быть получены известными способами.
Реакции могут осуществляться согласно способам, описанным в литературе, например, WO 2012/149236, Majumder, Supriyo et al., Advanced Synthesis and Catalysis, 351 (2009), 2013-2023, или US 5,061,705.
Соединения общей структуры (D2) могут быть получены согласно способам, известным из литературы, из соединений общей структуры (D1) (например, WO 2008148868 A1, Стр. 87). Соединения общей структуры (D3) могут быть получены согласно описанным в литературе способам из соединений общей структуры (D2) и их иминиевых солей (например, Knorr, Rudolf; Loew, Peter; Hassel, Petra; Bronberger, Hildegard Journal of Organic Chemistry, 49 (1984) Стр. 1288-1290). Соединения общей структуры (D4) могут быть получены аналогично известным из литературы способам Соединения общей структуры (D3) и гидразина (например, WO 2008080969 А1, Стр. 102-103, Пример 104). Соединения общей структуры (D5) могут быть получены согласно способам, известным из литературы, из соединений общей структуры (D4) и (D7) (например, WO 2013009791, Стр. 50, Пример 44). Соединения общей структуры (D6) могут быть получены аналогично способам, известным из литературы, посредством расщепления сложного эфира, из соединений общей структуры (D5) [WO 2010-051926; WO 2010-133312]. Соединения согласно настоящему изобретению общей структуры (I-T4) могут быть получены согласно описанным в литературе способам пептидного сочетания из исходных веществ (D6) и (D8) [WO 2010-051926; WO 2010-133312].
Соединения структуры (I-T4) альтернативно могут быть получены согласно способу, показанному на реакционной схеме 5.
Реакционная схема 5

Группы A1-A4, B1-В5, алкил, Q, R1 и R11 имеют значения, описанные в настоящей заявке. X представляет собой Cl, Br, I. Исходные соединения структуры (D-7), (D-9) и (D-11) (например, ЕР 1253128, Стр. 8-10) известны и отчасти имеются в продаже или могут быть получены известными способами.
Реакции могут осуществляться согласно способам, описанным в литературе:
Стадия 1 Пиразольное сочетание
Стадия 1 способа получения соединений согласно настоящему изобретению (I-Т4):

Соединения общей структуры (D-9) могут быть получены аналогично известным из литературы способам из исходных веществ структуры (D-7) и (D-11). Группы А1-A4, Алкил и X имеют описанные выше значения. Исходные соединения структуры (D-7) известны (например, WO 2004099146 A1, Стр. 68-69) или могут быть получены известными способами. В качестве примера упоминаются: 2-хлор-5-иод-бензойной кислоты сложный метиловый эфир, 2-бром-5-иод-бензойной кислоты сложный этиловый эфир, 5-бром-2-хлор-3-фтор-бензойной кислоты сложный метиловый эфир, 5-бром-2-хлор-никотиновой кислоты сложный этиловый эфир. Исходные соединения структуры (D-11) известны и отчасти имеются в продаже или могут быть получены известными способами. В качестве примера упоминаются 4-бром-пиразол, 4-бром-3-метил-пиразол 4-бром-3,5-диметилпиразол и 4-бром-3-(трифторметил)-пиразол.
Получение еще не известных соединений (D-9) может осуществляться аналогично известному способу связывания пиразола с ароматическим соединением (например, WO 2013009791, Стр. 50, Пример 44).
Альтернативное получение пиразола
Альтернативно соединения согласно настоящему изобретению общей структуры (D9) получают путем, показанным на реакционной схеме 6.
Реакционная схема 6

Группы A1-A4, алкил, и R11 имеют описанные выше значения. X представляет собой Cl, Br, I. Исходные соединения структуры (D-13) известны (например, WO 2004099146 A1, Стр. 68-69) или могут быть получены известными способами. В качестве примера упоминаются: 5-амино-2-хлор-бензойной кислоты сложный метиловый эфир, 5-амино-2-хлор-бензойной кислоты сложный этиловый эфир, 5-амино-2-хлор-3-фтор-бензойной кислоты сложный метиловый эфир, 5-амино-2-хлор-никотиновой кислоты сложный этиловый эфир.
Получение еще не известных соединений (D-14) может осуществляться аналогично известному способу получения арилгидразинов (например, WO 2004058731, Стр. 65).
Соединения согласно настоящему изобретению общей структуры (D-15) могут быть получены аналогично известным из литературы способам из исходных веществ структуры (D-14). Группы A1-A4, Алкил, и R11 имеют значения, описанные выше. Исходные соединения структуры (D-14) известны или могут быть получены известными способами. В качестве примера упоминаются 2-хлор-5-гидразино-бензойной кислоты сложный метиловый эфир, 2-хлор-5-гидразино-бензойной кислоты сложный этиловый эфир, 2-хлор-3-фтор-5-гидразино-бензойной кислоты сложный метиловый эфир, 2-хлор-5-гидразино-никотиновой кислоты сложный этиловый эфир. Реакция может осуществляться при условиях, известных из литературы, для пиразольной циклизации (например, Sachweh, Volker; Langhals, Heinz Chemische Berichte, 119 (1986) 1627-1639).
Соединения согласно настоящему изобретению общей структуры (D9) получают посредством взаимодействия Пиразол структуры (D-15) с галогенирующими средствами. Группы A1-A4, алкил, и R11 имеют значения, описанные выше. В качестве предпочтительных соединений структуры (D15) упоминаются 2-хлор-5-(пиразол-1-ил)-бензойной кислоты сложный метиловый эфир, 2-хлор-5-(пиразол-1-ил)-бензойной кислоты сложный этиловый эфир, 2-хлор-3-фтор-5-(пиразол-1-ил)-бензойной кислоты сложный метиловый эфир, 2-хлор-5-(пиразол-1-ил)-никотиновой кислоты сложный этиловый эфир.
Подходящие галогенирующие соединения известны специалистам в данной области техники, как например, например, хлор, бром, иод, N-хлорсукцинимид, N-бромсукцинимид, N-иодсукцинимид, 1,3-дихлор-5,5-диметилгидантоин, 1,3-дибром-5,5-диметилгидантоин, гипохлорит натрия и иодмонохлорид. Предпочтительно применяются бром, иод, бромсукцинимид и иодсукцинимид. При необходимости предпочтительно проводить реакцию в присутствии окисляющего средства, например, пероксид водорода. Взаимодействие осуществляется при известных из литературы условиях, например, Guo Li et al., Tetrahedron Letters 48 (2007), 4595-4599; Mary M. Kim et al., Tetrahedron Letters 49 (2008), 4026-4028.
Стадия 2 сложный эфир бороновой кислоты
Стадия 2: Получение исходных соединений структуры (D12)

Соединения согласно настоящему изобретению общей структуры (D-12) могут быть получены согласно описанным в литературе способам (Chien, Yuh-Yih; Chou, Meng-Yen; Leung, Man-Kit; Liao, Yuan-Li; Lin, Chang-Chih; Wong, Ken-Tsung; Journal of Organic Chemistry, 67 (2002) Стр. 1041-1044) из исходных веществ структуры (D-10) посредством взаимодействия с магнием и последующим взаимодействием со сложным эфиром борной кислоты структуры (D-16).
Группы В1-В5 и алкил имеют значения, описанные выше.
Применяемый в реакции сложный эфир борной кислоты структуры (D-13) известен или может быть получены известными способами. В качестве примера упоминаются триметиловый сложный эфир борной кислоты, триэтиловый сложный эфир борной кислоты и 2-метокси-4,4,5,5-тетраметил-1,3,2-диоксаборолан.
Альтернативно соединения согласно настоящему изобретению общей структуры (D-12) могут быть получены согласно описанным в литературе способам (Tang, Wenjun; Keshipeddy, Santosh; Zhang, Yongda; Wei, Xudong; Savoie, Jolaine; Patel, Nitinchandra D.; Yee, Nathan K.; Senanayake, Chris H.; Organic Letters, 13 (2011) Стр. 1366-1369) из исходных веществ структуры (D-10) посредством взаимодействия с дибораном структуры (D-14) в присутствии катализаторов.

Применяемый в реакции сложный эфир борной кислоты структуры (D-17) известен или может быть получены известными способами. В качестве примеров указываются 4,4,5,5-тетраметил-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2-диоксаборолан (бис(пинаколато)дибор).
В качестве катализаторов, прежде всего, могут применяться соединения и комплексы палладия и Cu(I).
Стадия 3 Арильное сочетание

Соединения согласно настоящему изобретению общей структуры (D-5) получают при взаимодействии соединения структуры (D-9) со сложным эфиром бороновой кислоты структуры (D-12).
Группы А1-A4, B1-В5, R11, алкил и X имеют описанные выше значения.
Получение соединений структур (D-9) и (D-12) описано выше.
В качестве примеров соединений структуры (D-9) указываются: 5-(4-бромпиразол-1-ил)-2-хлор-бензойной кислоты сложный метиловый эфир, 5-(4-иодпиразол-1-ил)-2-хлор-бензойной кислоты сложный метиловый эфир, 5-(4-бром-3-метилпиразол-1-ил)-2-хлор-бензойной кислоты сложный этиловый эфир, 5-(4-бром-3-(трифторметил)пиразол-1-ил)-2-хлор-бензойной кислоты сложный метиловый эфир, 5-(4-бром-3-(трифторметил)пиразол-1-ил)-2-хлор-бензойной кислоты сложный метиловый эфир, 5-(4-бром-3,5-диметилпиразол-1-ил)-2-хлор-бензойной кислоты сложный метиловый эфир и 5-(4-бром-3-метилпиразол-1-ил)-2-хлор-сложный этиловый эфир никотиновой кислоты.
Реакция проводится при условиях, описанных в литературе, например, WO 2005040110 или WO 2009089508.
Стадии 4, 5 Гидролиз, амидирование

Соединения согласно настоящему изобретению общей структуры (I-T4) могут быть получены согласно описанным в литературе способам пептидного сочетания из исходных веществ (D-6) и (D-8) [WO 2010051926; WO 2010133312]. Соединения общей структуры (D-6) могут быть получены аналогично способам, известным из литературы, посредством расщепления сложного эфира, из соединений общей структуры (D-5) [WO 2010-051926; WO 2010133312]. Группы A1-A4, B1-B5, алкил, Q, R1 и R11 имеют значения, описанные выше. Получение соединений структуры (D5) описано выше.
(I-T5): Соединения формулы (I-Т5) могут, например, быть получены аналогично Friedrich, L.E. et al. Journal of Organic Chemistry, 43 (1978), 34-38; или Huettel, R. et al. Chemische Berichte, 93 (1960), Стр. 1425-1432; или Sato, T et al., Bulletin of the Chemical Society of Japan, 41 (1968), Стр. 3017-3018.
(I-T8): Соединения формулы (I-T8) могут, например, быть получены аналогично ЕР 1405636, Пример 5; или ЕР 2301538, Стр. 162; или Schmidt, Bernd et al., European Journal of Organic Chemistry, (2011), Стр. 4814-4822.
(I-T9): Соединения формулы (I-T9) могут, например, быть получены аналогично Ma, Shengming et al., Chemistry-A European Journal, 9 (2003), Стр. 2447-2456.
(I-T10): Соединения формулы (I-T10) могут, например, быть получены аналогично ЕР 2301538, Стр. 162.
(I-T11): Соединения формулы (I-T11) могут, например, быть получены аналогично ЕР 2301538, Стр. 165.
(I-T12): Соединения формулы (I-T12) могут, например, быть получены аналогично ЕР 2301538, Стр. 164.
(I-T13): Соединения формулы (I-T13) могут, например, быть получены аналогично ЕР 2301538, Стр. 164.
(I-T14): Соединения формулы (I-T14) могут, например, быть получены аналогично Hibi, Shigeki et al., Bioorganic & Medicinal Chemistry Letters, 10 (2000), Стр. 623-626 или Wang, Xiang et al. Journal of Organic Chemistry, 72 (2007), 1476-1479; EP 1405636, Стр. 31.
(I-T15): Соединения формулы (I-T15) могут, например, быть получены аналогично Chattopadhyay, Buddhadeb et al., Organic Letters, 13 (2011), Стр. 3746-3749.
(I-T16): Соединения формулы (I-T16) могут, например, быть получены аналогично Campi, Eva М. et al. Tetrahedron Letters, 32 (1991), Стр. 1093-1094; или Thompson, Benjamin В. et al., Organic Letters, 13 (2011), Стр. 3289-3291; или Kloetzel et al. Journal of the American Chemical Society, 79 (1957), Стр. 4222; или Chi, Yonggui Robin et al., Journal of the American Chemical Society, 135 (2013), Стр. 8113-8116.
(I-T18): Соединения формулы (I-T18) могут, например, быть получены аналогично ЕР 2311455, Стр. 150; или Balaban, А.Т. et al. Tetrahedron, 19 (1963), Стр. 2199-2207.
(I-T19): Соединения формулы (I-T19) могут, например, быть получены аналогично WO 2004/14366, Стр. 108.
(I-T20): Соединения формулы (I-T20) могут, например, быть получены аналогично Araki, Hiroshi; Katoh, Tadashi; Inoue, Munenori; Synlett, (2006), Стр. 555-558; US 6,545,009, Стр. 27, Пример 1.
(I-T21): Соединения формулы (I-T21) могут, например, быть получены аналогично WO 2004/72050, Стр. 13; или US 6,545,009, Стр. 27.
Способ I-T22
Соединения структуры (I-T22) могут быть получены способом, показанном на схеме 7.
Реакционная схема 7

Группы А1-A4, В1-В5, Алкил, Q, R1 и R11 имеют значения, описанные выше. X представляет собой Cl, Br, I. Исходные соединения структуры (W-1) и (W-6) известны (W1 например, US 2011/53904 Стр. 19, W6 например, WO 2012/175474, Стр. 117-118) или могут быть получены известными способами. Реакции проводятся при аналогичных условиях, указанных для получения соединений (I-T23).
Стадия 1 Альдегид
Стадия 1 способа получения соединений согласно настоящему изобретению (I-Т22):

Соединения согласно настоящему изобретению общей структуры (W2) могут быть получены согласно описанным в литературе способам (US 5739083, Пример 2; WO 2011/23667, Стр. 34) из исходных веществ структуры (W1).
Группы В1-В5 и X имеют значения, описанные выше. X, например, представляет собой Хлор, Бром или Иод.
Исходные соединения структуры (В1) известны или могут быть получены известными способами. В качестве примера упоминаются 2-бром-1,3-дихлор-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]бензол, 2-бром-1,3-диметил-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]бензол, 2-бром-1-этил-3-метил-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]бензол, 2-бром-1-хлор-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-3-(трифторметил)бензол, 2-бром-1-метил-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-3-(трифторметил)бензол, 2-бром-1-хлор-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-3-(трифторметокси)бензол, 2-бром-1-метил-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-3-(трифторметокси)бензол, 1,3-диметил-2-иод-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]бензол, 2-иод-1-метил-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-3-(трифторметил)бензол. Они могут, например, быть получены согласно способам, описанным в ЕР 1253128, Стр. 8-10.
Стадия 2 Оксим
1. Стадия 2 способа получения соединений согласно настоящему изобретению (1-Т22):

Соединения согласно настоящему изобретению общей структуры (W3) могут быть получены аналогично известным из литературы способам Из исходных веществ структуры (W2). Группы B1-B5 имеют значения, описанные выше. Получение исходных соединений структуры (W2) описано выше. В качестве примера упоминаются 2,6-дихлор-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]бензальдегид, 2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]бензальдегид, 2-этил-6-метил-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]бензальдегид, 2-хлор-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-6-(трифторметил)бензальдегид, 2-метил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-6-(трифторметил)бензальдегид, 2-хлор-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-6-(трифторметокси)бензальдегид, 2-метил-4-[1,2,2,2-тетрафтор-1-(трифторметил )этил]-6-(трифторметокси)бензальдегид. Их получение описано выше.
Соединения согласно структурной формуле (W3) являются новыми. Получение еще не известных соединений (W3) можно осуществлять согласно известному способу получения оксима из альдегида (Н. Metzger in Houben-Weyl, Band Х/4, Стр. 55 ff, Georg Thieme Verlag Stuttgart 1968). Соединениями согласно структурной формуле (W3) могут существовать в виде чистых стереоизомеров, а также в виде смесей стереоизомеров.
Стадия 3 хлорид гидроксамовой кислоты
Стадия 3 способа получения соединений согласно настоящему изобретению (1-Т22):

Соединения согласно настоящему изобретению общей структуры (W4) получают посредством взаимодействия оксима структуры (W3) с галогенирующими средствами.
Группы В1-В5 имеют значения, описанные выше. X представляет собой хлор, бром или иод.
Типичными соединениями структуры (W4) являются, например, 2,6-дихлор-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-N-гидроксибензимидоилхлорид, 2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-N-гидроксибензимидоилхлорид, 2-этил-6-метил-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-N-гидроксибензимидоилхлорид, 2-Хлор-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-6-(трифторметил)-N-гидроксибензимидоилхлорид, 2-метил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-6-(трифторметил)-N-гидроксибензимидоилхлорид, 2-Хлор-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-6-(трифторметокси)-]-N-гидроксибензимидоилхлорид, 2-метил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-6-(трифторметокси)-N-гидроксибензимидоилхлорид, 2-метил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-6-(трифторметил)-N-гидроксибензимидоилбромид.
Подходящие галогенирующие соединения известны специалистам в данной области техники, как например, хлор, бром, иод, N-хлорсукцинимид, N-бромсукцинимид, N-иодсукцинимид, 1,3-дихлор-5,5-диметилгидантоин, 1,3-дибром-5,5-диметилгидантоин, бензилтриметиламмония-тетрахлороиодат и гипохлорит натрия. Предпочтительно применяются хлорирующие реагенты.
Для проведения реакции могут применяться подходящие растворители.
В качестве разбавителей или растворителей для проведения способа согласно настоящему изобретению, как правило, рассматриваются все инертные при специфических условиях реакции органические растворители. В качестве примера необходимо указать: галогенуглеводороды (например, хлоруглеводороды, как например, тетраэтилен, тетрахлорэтан, дихлорпропан, метиленхлорид, дихлорбутан, хлороформ, тетрахлоруглерод, трихлорэтан, трихлорэтилен, пентахлорэтан, дифторбензол, 1,2-дихлорэтан, хлорбензол, бромбензол, дихлорбензол, хлортолуол, трихлорбензол), спирты (например, метанол, этанол, изопропанол, бутанол), простой эфир (например, этилпропиловый простой эфир, метил-трет-бутиловый простой эфир, н-бутиловый простой эфир, анизол, фенетол, циклогексилметиловый простой эфир, диметиловый простой эфир, диэтиловый простой эфир, дипропиловый простой эфир, диизопропиловый простой эфир, ди-н-бутиловый простой эфир, диизобутиловый простой эфир, диизоамиловый простой эфир, этиленгликольдиметиловый простой эфир, тетрагидрофуран, диоксан, дихлордиэтиловый простой эфир и простые полиэфиры этиленоксидов и/или пропиленоксидов), амины (например, триметил-, триэтил-, трипропил-, трибутиламин, N-метилморфолин, пиридин и тетраметилендиамин), нитроуглеводороды (например, нитрометан, нитроэтан, нитропропан, нитробензол, хлорнитробензол, о-нитротолуол; нитрилы, такие как ацетонитрил, пропионитрил, бутиронитрил, изобутиронитрил, бензонитрил, м-хлорбензонитрил), тетрагидротиофендиоксид, диметилсульфоксид, тетраметиленсульфоксид, дипропилсульфоксид, бензилметилсульфоксид, диизобутилсульфоксид, дибутилсульфоксид, диизоамилсульфоксид, сульфоны (например, диметил-, диэтил-, дипропил-, дибутил-, дифенил-, дигексил-, метилэтил-, этилпропил-, этилизобутил- и пентаметиленсульфон), алифатические, циклоалифатические или ароматические углеводороды (например, пентан, гексан, гептан, октан, нонан и технические углеводороды), компоненты, далее упоминаемые как "уайт спириты", с точкой кипения в диапазоне, например, от 40°C до 250°C, кумол, бензиновые фракции с диапазоном температур кипения от 70°C до 190°C, циклогексан, метилциклогексан, петролейный простой эфир, лигроин, октан, бензол, толуол, хлорбензол, бромбензол, нитробензол, ксилен, сложный эфир (например, метил-, этил-, бутил-, изобутилацетат, диметил-, дибутил-, этиленкарбонат); амид (например, гексаметиленфосфорной кислоты триамид, формамид, N-метил-формамид, N,N-диметил-формамид, N,N-дипропил-формамид, N,N-дибутил-формамид, N-метил-пирролидин, N-метил-капролактам, 1,3-диметил-3,4,5,6-тетрагидро-2(1Н)-пиримидин, октилпирролидон, октилкапролактам, 1,3-диметил-2-имидазолиндион, N-формил-пиперидин, N,N'-1,4-диформил-пиперазин) и кетоны (например, ацетон, ацетофенон, метилэтилкетон, метилбутилкетон).
В качестве предпочтительного разбавителя может применяться любой разбавитель, который не ухудшает реакцию, например, вода. Могут рассматриваться ароматические углеводороды, такие как бензол, толуол, ксилол или хлорбензол; галогенированные углеводороды, такие как дихлорметан, хлороформ, 1,2-дихлорэтан или тетрахлоруглерод, нециклические или циклические простые эфиры, такие как диэтил простой эфир, диоксан, тетрагидрофуран или 1,2-диметоксиэтан; сложный эфир, как например этилацетат и бути л ацетат; кетоны, как например, ацетон, метил-изобутилкетон и циклогексанон; амиды, как например диметилформамид и диметилацетамид, N-метил-пирролидинон; нитрилы, такие как ацетонитрил или пропионитрил; и другие инертные растворители, такие как 1,3-диметил-2-имидазолидинон; растворитель может применяться сам по себе или в комбинации из двух или более.
Реакция может проводиться при широком диапазоне температур. Как правило, она проводится при диапазоне температур от -78 до 200°C, предпочтительно при температуре от -10 до 150°C. Реакция может проводиться как при повышенном, так и при пониженном давлении. Однако предпочтительно она проводится при нормальном давлении. Продолжительность реакции составляет от 0,1 и 72 часов, предпочтительно от 1 до 24 часов.
Для проведения реакции применяется от 1 до 3 моль, предпочтительно от 1 до 1,5 моль галогенирующего средства на моль соединения структуры (W3) в растворителе, таком как, например, диметилформамид (DMF).
Стадия 4 Циклизация
Стадия 4 способа получения соединений согласно настоящему изобретению (1-Т22):

Соединения согласно настоящему изобретению общей структуры (W5) получают посредством взаимодействия хлорида гидроксамовой кислоты структуры (W4) с ацетиленом структуры (W8).
Группы А1-A4, В1-В5, R11 и алкил имеют значения, описанные выше. X представляет собой галоген, как например хлор, бром, иод.
Получение соединений структуры (W4) описано выше. Типичными соединениями структуры (W4) являются, например, 2,6-дихлор-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-N-гидроксибензимидоилхлорид, 2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-N-гидроксибензимидоилхлорид, 2-Этил-6-метил-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-N-гидроксибензимидоилхлорид, 2-хлор-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-6-(трифторметил)-N-гидроксибензимидоилхлорид, 2-метил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-6-(трифторметил)-N-гидроксибензимидоилхлорид, 2-хлор-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-6-(трифторметокси)-N-гидроксибензимидоилхлорид, 2-метил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-6-(трифторметокси)-N-гидроксибензимидоилхлорид, 2-метил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-6-(трифторметил)-N-гидроксибензимидоилбромид.
Соединения структуры (W8) известны (WO 2012107434, Стр. 103) или могут быть получены согласно известным из литературы способам (Chinchilla, Rafael; Najera, Carmen, Chemical Society Reviews (2011), 40(10), 5084-5121, Chinchilla, Rafael; Najera, Carmen, Chemical Reviews (Washington, DC, United States) (2007), 107(3), 874-922). Типичными соединениями структуры (W8) являются, например, 2-Хлор-5-этинил-бензойной кислоты сложный метиловый эфир, 2-бром-5-этинил-бензойной кислоты сложный этиловый эфир, 2-хлор-5-этинил-3-фтор-бензойной кислоты сложный метиловый эфир, 2-хлор-5-этинил-никотиновой кислоты сложный этиловый эфир, 5-этинил-2-метил-никотиновой кислоты сложный этиловый эфир
Для проведения реакции могут применяться подходящие растворители.
В качестве разбавителей или растворителей для проведения способа согласно настоящему изобретению, как правило, рассматриваются все инертные при специфических условиях реакции органические растворители. В качестве примера необходимо указать: галогенуглеводороды (например, хлоруглеводороды, как например, тетраэтилен, тетрахлорэтан, дихлорпропан, метиленхлорид, дихлорбутан, хлороформ, тетрахлоруглерод, трихлорэтан, трихлорэтилен, пентахлорэтан, дифторбензол, 1,2-дихлорэтан, хлорбензол, бромбензол, дихлорбензол, хлортолуол, трихлорбензол), спирты (например, метанол, этанол, изопропанол, бутанол), простой эфир (например, этилпропиловый простой эфир, метил-трет-бутиловый простой эфир, н-бутиловый простой эфир, анизол, фенетол, циклогексилметиловый простой эфир, диметиловый простой эфир, диэтиловый простой эфир, дипропиловый простой эфир, диизопропил простой эфир, ди-н-бутил простой эфир, диизобутил простой эфир, диизоамиловый простой эфир, этиленгликольдиметиловый простой эфир, тетрагидрофуран, диоксан, дихлордиэтиловый простой эфир и простые полиэфиры этиленоксидов и/или пропиленоксидов), амины (например, триметил-, триэтил-, трипропил-, трибутиламин, N-метилморфолин, пиридин и тетраметилендиамин), нитроуглеводороды (например, нитрометан, нитроэтан, нитропропан, нитробензол, хлорнитробензол, о-нитротолуол; нитрилы, такие как ацетонитрил, пропионитрил, бутиронитрил, изобутиронитрил, бензонитрил, м-хлорбензонитрил), тетрагидротиофендиоксид, диметилсульфоксид, тетраметиленсульфоксид, дипропилсульфоксид, бензилметилсульфоксид, диизобутилсульфоксид, дибутилсульфоксид, диизоамилсульфоксид, сульфоны (например, диметил-, диэтил-, дипропил-, дибутил-, дифенил-, дигексил-, метилэтил-, этилпропил-, этилизобутил- и пентаметиленсульфон), алифатические, циклоалифатические или ароматические углеводороды (например, пентан, гексан, гептан, октан, нонан и технические углеводороды), компоненты, далее упоминаемые как «уайт спириты», с точкой кипения в диапазоне, например, от 40°C до 250°C, кумол, бензиновые фракции с диапазоном температур кипения от 70°C до 190°C, циклогексан, метилциклогексан, петролейный простой эфир, лигроин, октан, бензол, толуол, хлорбензол, бромбензол, нитробензол, ксилол, сложный эфир (например, метил-, этил-, бутил-, изобутилацетат, диметил-, дибутил-, этиленкарбонат); амид (например, гексаметиленфосфорной кислоты триамид, формамид, N-метил-формамид, N,N-диметил-формамид, N,N-дипропил-формамид, N,N-дибутил-формамид, N-метил-пирролидин, N-метил-капролактам, 1,3-диметил-3,4,5,6-тетрагидро-2(1Н)-пиримидин, октилпирролидон, октилкапролактам, 1,3-диметил-2-имидазолиндион, N-формил-пиперидин, N,N'-1,4-диформил-пиперазин) и кетоны (например, ацетон, ацетофенон, метилэтилкетон, метилбутилкетон).
В качестве предпочтительного разбавителя может применяться любой разбавитель, который не ухудшает реакцию, например, вода. Могут рассматриваться ароматические углеводороды, такие как бензол, толуол, ксилол или хлорбензол; галогенированные углеводороды, такие как дихлорметан, хлороформ, 1,2-дихлорэтан или тетрахлоруглерод, нециклические или циклические простые эфиры, такие как диэтил простой эфир, диоксан, тетрагидрофуран или 1,2-диметоксиэтан; сложные эфиры, такие как этилацетат и бутилацетат; кетоны, как например, ацетон, метил-изобутилкетон и циклогексанон; амиды, как например диметилформамид и диметилацетамид, N-метил-пирролидинон; нитрилы, такие как ацетонитрил или пропионитрил; и другие инертные растворители, такие как 1,3-диметил-2-имидазолидинон; растворитель может применяться сам по себе или в комбинации из двух или более.
При взаимодействии соединений структуры (W4) с ацетиленом структуры (W8) могут добавляться основания. В качестве примера необходимо указать соединения щелочноземельных или щелочных металлов (например, гидроксид, гидрид, оксид и карбонат лития, натрия, калия, магния, кальция и бария), амидиновые основания или гуанидиновые основания (например, 7-Метил-1,5,7-триазабицикло(4.4.0)дец-5-ен (MTBD); диазабицикло(4.3.0)нонен (DBN), Диазабицикло(2.2.2)октан (DABCO), 1,8-диазабицикло(5.4.0)ундецен (DBU), циклогексилтетра-бутил-гуанидин (CyTBG), циклогексилтетраметилгуанидин (CyTMG), N,N,N,N-Тетраметил-1,8-нафталиндиамин, пентаметилпиперидин) и амины, наиболее предпочтительно третичные амины, (например, триэтиламин, триметиламин, трибензиламин, триизопропиламин, трибутиламин, трициклогексиламин, триамиламин, тригексиламин, N,N-диметиланилин, N,N-диметил-толуидин, N,N-диметил-п-аминопиридин, N-метил-пирролидин, N-метил-пиперидин, N-метил-имидазол, N-метил-пиразол, N-метил-морфолин, N-метил-гексаметилендиамин, пиридин, 4-пирролидинопиридин, 4-диметил-амино-пиридин, хинолин, α-пиколин,

В качестве предпочтительных основных вспомогательных средств реакции могут применяться органические основания, такие как триэтиламин, этил-диизопропиламин, три-н-бутиламин, пиридин и 4-диметиламино-пиридин; кроме того, могут применяться, например, следующие основания: гидроксиды щелочных металлов, такие как, например, гидроксид натрия и гидроксид калия; карбонаты, такие как, например, гидрокарбонат натрия и карбонат калия; фосфаты, как например дикалия-гидрофосфат и тринатрия фосфат.
Реакция может проводиться при широком диапазоне температур. Как правило, она проводится при диапазоне температур от -78 до 200°C, предпочтительно при температуре от -10 до 150°C. Реакция может проводиться как при повышенном, так и при пониженном давлении. Однако предпочтительно она проводится при нормальном давлении. Продолжительность реакции составляет от 0,1 до 72 часов, предпочтительно от 1 до 24 часов.
Для проведения реакции применяется, например, 1-2 Мольных эквивалента соединений структуры (W8) и от 1 мольного эквивалента до легкого избытка основания на моль соединения структуры (W4) в растворителе, таком как, например, Диметилформамид (DMF)
Стадии 3 и 4 получения соединений структуры (W5) могут проводиться в виде отдельных стадий или в виде единой реакции.
Стадии 5, 6 Гидролиз, амидирование

Соединения согласно настоящему изобретению общей структуры (I-T22) могут быть получены согласно описанным в литературе способам Пептидного сочетания из исходных веществ (W6) и (W9) (WO 2010051926; WO 2010133312). Соединения общей структуры (W6) могут быть получены аналогично способам, известным из литературы, посредством расщепления сложного эфира, из соединений общей структуры (W5) (WO 2010051926; WO 2010133312). Группы A1-A4, B1-B5, алкил, Q, R1 и R11 имеют значения, описанные выше.
Способ I-T23
Соединения структуры (I-T23) могут быть получены согласно способу, показанному на реакционной схеме 8.
Реакционная схема 8

Группы А1-A4, B1-B5, алкил, Q, R1 и R11 имеют значения, описанные выше. X представляет собой, например, представляет собой Cl, Br, I.
Стадия 1 оксим
Стадия 1 способа получения соединений согласно настоящему изобретению (I-Т23):

Соединения согласно настоящему изобретению общей структуры (Х-2) могут быть получены аналогично известным из литературы способам из исходных веществ структуры (Х-1). Группы А1-A4 и Алкил имеют значения, описанные выше. Исходные соединения структуры (Х-1) известны или могут быть получены известными способами. В качестве примера упоминаются 3-Карбометокси-бензальдегид, 3-карбометокси-4-хлор-бензальдегид, 3-карбометокси-4-бром-бензальдегид, 3-карбометокси-4-фтор-бензальдегид, 3-карбометокси-4-хлор-5-фтор-бензальдегид или соответствующие сложные этиловые эфиры. Они могут, например, быть получены согласно способам, описанным в WO 2010/011584, Стр. 19-20; Journal of Organic Chemistry, 76 (2011), Стр. 1062-1071; WO 2012/114268, Стр. 137; Journal of the American Chemical Society, 108 (1986), Стр. 452-461.
Получение еще не известных соединений (Х-2) можно осуществлять согласно известному способу получения оксима из альдегида (Н. Metzger in Houben-Weyl, Band X/4, Стр. 55 ff, Georg Thieme Verlag Stuttgart 1968). Соединениями согласно структурной формуле (Х-2) могут существовать в виде чистых стереоизомеров, а также в виде смесей стереоизомеров.
Стадия 2 Хлорид гидроксамовой кислоты
Стадия 2 способа получения соединений согласно настоящему изобретению (I-Т23):

Соединения согласно настоящему изобретению общей структуры (Х-3) получают посредством взаимодействия оксима структуры (Х-2) с галогенирующими средствами.
Группы А1-A4 и Алкил имеют значения, описанные выше.
Типичными соединениями структуры (Х-3) являются, например, карбометокси-4-хлор-N-гидроксибензимидоилхлорид, 3-карбометокси-4-фтор-N-гидроксибензимидоилхлорид, 3-карбометокси-4-хлор-5-фтор-N-гидроксибензимидоилхлорид, 3-карбометокси-4-бром-N-гидроксибензимидоилхлорид.
Подходящие галогенирующие соединения известны специалистам в данной области техники, такие как, например, хлор, бром, иод, N-хлорсукцинимид, N-бромсукцинимид, N-иодсукцинимид, 1,3-дихлор-5,5-диметилгидантоин, 1,3-дибром-5,5-диметилгидантоин, бензилтриметиламмония-тетрахлороиодат и гипохлорит натрия. Предпочтительно применяются хлорирующие реагенты.
В качестве разбавителей или растворителей для проведения способа согласно настоящему изобретению, как правило, рассматриваются все инертные при специфических условиях реакции органические растворители. В качестве примера необходимо указать: галогенуглеводороды (например, хлоруглеводороды, такие как тетраэтилен, тетрахлорэтан, дихлорпропан, метиленхлорид, дихлорбутан, хлороформ, тетрахлоруглерод, трихлорэтан, трихлорэтилен, пентахлорэтан, дифторбензол, 1,2-дихлорэтан, хлорбензол, бромбензол, дихлорбензол, хлортолуол, трихлорбензол), спирты (например, метанол, этанол, изопропанол, бутанол), простой эфир (например, этилпропиловый простой эфир, метил-трет-бутиловый простой эфир, н-бутиловый простой эфир, анизол, фенетол, циклогексилметиловый простой эфир, диметиловый простой эфир, диэтиловый простой эфир, дипропиловый простой эфир, диизопропиловый простой эфир, ди-н-бутиловый простой эфир, диизобутиловый простой эфир, диизоамиловый простой эфир, этиленгликольдиметиловый простой эфир, тетрагидрофуран, диоксан, дихлордиэтиловый простой эфир, и простые полиэфиры этиленоксидов и/или пропиленоксидов), амины (например, триметил-, триэтил-, трипропил-, трибутиламин, N-метилморфолин, пиридин и тетраметилендиамин), нитроуглеводороды (например, нитрометан, нитроэтан, нитропропан, нитробензол, хлорнитробензол, о-нитротолуол; нитрилы, такие как ацетонитрил, пропионитрил, бутиронитрил, изобутиронитрил, бензонитрил, м-хлорбензонитрил, тетрагидротиофендиоксид, диметилсульфоксид, тетраметиленсульфоксид, дипропилсульфоксид, бензилметилсульфоксид, диизобутилсульфоксид, дибутилсульфоксид, диизоамилсульфоксид, сульфоны (например, диметил-, диэтил-, дипропил-, дибутил-, дифенил-, дигексил-, метилэтил-, этил-пропил-, этилизобутил- и пентаметиленсульфон), алифатические, циклоалифатические или ароматические углеводороды (например, пентан, гексан, гептан, октан, нонан и технические углеводороды), компоненты, далее упоминаемые как «уайт спириты», с точкой кипения в диапазоне, например, от 40°C до 250°C, кумол, бензиновые фракции с диапазоном температур кипения от 70°C до 190°C, циклогексан, метилциклогексан, петролейный простой эфир, лигроин, октан, бензол, толуол, хлорбензол, бромбензол, нитробензол, ксилол, сложный эфир (например, метил-, этил-, бутил-, изобутилацетат, диметил-, дибутил-, этиленкарбонат); амид (например, гексаметиленфосфорной кислоты триамид, формамид, N-метил-формамид, N,N-диметил-формамид, N,N-дипропил-формамид, N,N-дибутил-формамид, N-метил-пирролидин, N-метил-капролактам, 1,3-диметил-3,4,5,6-тетрагидро-2(1Н)-пиримидин, октилпирролидон, октилкапролактам, 1,3-диметил-2-имидазолиндион, N-формил-пиперидин, N,N’-1,4-диформил-пиперазин) и кетоны (например, ацетон, ацетофенон, метилэтилкетон, метилбутилкетон).
В качестве предпочтительного разбавителя может применяться любой разбавитель, который не ухудшает реакцию, например, вода. Могут рассматриваться ароматические углеводороды, такие как бензол, толуол, ксилол или хлорбензол; галогенированные углеводороды, такие как дихлорметан, хлороформ, 1,2-дихлорэтан или тетрахлоруглерод, нециклические или циклические простые эфиры, такие как диэтиловый простой эфир, диоксан, тетрагидрофуран или 1,2-диметоксиэтан; сложные эфиры, такие как этилацетат и бутилацетат; кетоны, как например, ацетон, метил-изобутилкетон и циклогексанон; амиды, как например диметилформамид и диметилацетамид, N-метил-пирролидинон; нитрилы, такие как ацетонитрил или пропионитрил; и другие инертные растворители, такие как 1,3-диметил-2-имидазолидинон; растворитель может применяться сам по себе или в комбинации из двух или более.
Реакция может проводиться при широком диапазоне температур. Как правило, она проводится при диапазоне температур от -78 и 200°C, предпочтительно при температуре от -10 и 150°C. Реакция может проводиться как при повышенном, так и при пониженном давлении. Однако предпочтительно она проводится при нормальном давлении. Продолжительность реакции составляет от 0,1 до 72 часов, предпочтительно от 1 до 24 часов.
Для проведения реакции применяется от 1 до 3 моль, предпочтительно от 1 до 1,5 моль галогенирующего средства на моль соединения структуры (Х-2) в растворителе, таком как, например, диметилформамид (DMF).
Стадия 3 Циклизация
Стадия 3 способа получения соединений согласно настоящему изобретению (1-Т23):

Соединения согласно настоящему изобретению общей структуры (Х-4) получают посредством взаимодействия Хлорида гидроксамовой кислоты структуры (Х-3) с ацетиленом структуры (Х-6).
Группы A1-A4, В1-В5, R11 и алкил имеют значения, описанные выше.
Типичными соединениями структуры (Х-3) являются, например, карбометокси-4-хлор-N-гидрокси-бензимидоилхлорид, 3-карбометокси-4-фтор-N-гидрокси-бензимидоилхлорид, 3-карбометокси-4-хлор-5-фтор-N-гидрокси-бензимидоилхлорид, 3-карбометокси-4-бром-N-гидрокси-бензимидоилхлорид.
В качестве разбавителей или растворителей для проведения способа согласно настоящему изобретению, как правило, рассматриваются все инертные при специфических условиях реакции органические растворители. В качестве примера необходимо указать: галогенуглеводороды (например, хлоруглеводороды, такие как тетраэтилен, тетрахлорэтан, дихлорпропан, метиленхлорид, дихлорбутан, хлороформ, тетрахлоруглерод, трихлорэтан, трихлорэтилен, пентахлорэтан, дифторбензол, 1,2-дихлорэтан, хлорбензол, бромбензол, дихлорбензол, хлортолуол, трихлорбензол), спирты (например, метанол, этанол, изопропанол, бутанол), простые эфиры (например, этилпропиловый простой эфир, метил-трет-бутиловый простой эфир, н-бутиловый простой эфир, анизол, фенетол, циклогексилметиловый простой эфир, диметиловый простой эфир, диэтиловый простой эфир, дипропиловый простой эфир, диизопропиловый простой эфир, ди-н-бутиловый простой эфир, диизобутиловый простой эфир, диизоамиловый простой эфир, этиленгликольдиметиловый простой эфир, тетрагидрофуран, диоксан, дихлордиэтиловый простой эфир, и простые полиэфиры этиленоксидов и/или пропиленоксидов), амины (например, триметил-, триэтил-, трипропил-, трибутиламин, N-метилморфолин, пиридин и тетраметилендиамин), нитроуглеводороды (например, нитрометан, нитроэтан, нитропропан, нитробензол, хлорнитробензол, о-нитротолуол; нитрилы, такие как ацетонитрил, пропионитрил, бутиронитрил, изобутиронитрил, бензонитрил, м-хлорбензонитрил, тетрагидротиофендиоксид, диметилсульфоксид, тетраметиленсульфоксид, дипропилсульфоксид, бензилметилсульфоксид, диизобутилсульфоксид, дибутилсульфоксид, диизоамилсульфоксид, сульфоны (например, диметил-, диэтил-, дипропил-, дибутил-, дифенил-, дигексил-, метилэтил-, этил-пропил-, этилизобутил- и пентаметиленсульфон), алифатические, циклоалифатические или ароматические углеводороды (например, пентан, гексан, гептан, октан, нонан и технические углеводороды), компоненты, далее упоминаемые как «уайт спириты», с точкой кипения в диапазоне, например, от 40°C до 250°C, кумол, бензиновые фракции с диапазоном температур кипения от 70°C до 190°C, циклогексан, метилциклогексан, петролейный простой эфир, лигроин, октан, бензол, толуол, хлорбензол, бромбензол, нитробензол, ксилол, сложный эфир (например, метил-, этил-, бутил-, изобутилацетат, диметил-, дибутил-, этиленкарбонат); амид (например, гексаметиленфосфорной кислоты триамид, формамид, N-метил-формамид, N,N-диметил-формамид, N,N-дипропил-формамид, N,N-дибутил-формамид, N-метил-пирролидин, N-метил-капролактам, 1,3-диметил-3,4,5,6-тетрагидро-2(1Н)-пиримидин, октилпирролидон, октилкапролактам, 1,3-диметил-2-имидазолиндион, N-формил-пиперидин, N,N'-1,4-диформил-пиперазин) и кетоны (например, ацетон, ацетофенон, метилэтилкетон, метилбутилкетон).
В качестве предпочтительного разбавителя может применяться любой разбавитель, который не ухудшает реакцию, например, вода. Могут рассматриваться ароматические углеводороды, как например бензол, толуол, ксилол или хлорбензол; галогенированные углеводороды, как например дихлорметан, хлороформ, 1,2-дихлорэтан или тетрахлоруглерод, нециклические или циклические простые эфиры, такие как диэтиловый простой эфир, диоксан, тетрагидрофуран или 1,2-диметоксиэтан; сложные эфиры, такие как этил ацетат и бутил ацетат; кетоны, как например, ацетон, метил-изобутилкетон и циклогексанон; амиды, как например диметилформамид и диметилацетамид, N-метил-пирролидинон; нитрилы, такие как ацетонитрил или пропионитрил; и другие инертные растворители, такие как 1,3-диметил-2-имидазолидинон; растворитель может применяться сам по себе или в комбинации из двух или более.
При взаимодействии соединений структуры (Х-3) с ацетиленом структуры (Х-6) могут добавляться основания. В качестве примера необходимо указать соединения щелочноземельных или щелочных металлов (например, гидроксид, гидрид, оксид и карбонат лития, натрия, калия, магния, кальция и бария), амидиновые основания или гуанидиновые основания (например, 7-метил-1,5,7-триазабицикло(4.4.0)дец-5-ен (MTBD); диазабицикло(4.3.0)нонен (DBN), диазабицикло(2.2.2)октан (DABCO), 1,8-диазабицикло(5.4.0)ундецен (DBU), циклогексилтетра-бутил-гуанидин (CyTBG), циклогексилтетраметилгуанидин (CyTMG), N,N,N,N-тетраметил-1,8-нафталиндиамин, пентаметилпиперидин) и амины, наиболее предпочтительно третичные амины, (например, триэтиламин, триметиламин, трибензиламин, триизопропиламин, трибутиламин, трициклогексиламин, триамиламин, тригексиламин, N,N-диметиланилин, N,N-диметил-толуидин, N,N-диметил-п-аминопиридин, N-метил-пирролидин, N-метил-пиперидин, N-метил-имидазол, N-метил-пиразол, N-метил-морфолин, N-метил-гексаметилендиамин, пиридин, 4-пирролидинопиридин, 4-диметил-амино-пиридин, хинолин, α-пиколин,

В качестве предпочтительных основных вспомогательных средств реакции могут применяться органические основания, такие как триэтиламин, этил-диизопропиламин, три-н-бутиламин, пиридин и 4-диметиламино-пиридин; Кроме того, могут применяться, например, следующие основания: гидроксиды щелочных металлов, такие как, например, гидроксид натрия и гидроксид калия; карбонаты, такие как, например, гидрокарбонат натрия и карбонат калия; фосфаты, как например дикалия-гидрофосфат и тринатрия фосфат.
Реакция может проводиться при широком диапазоне температур. Как правило, она проводится при диапазоне температур от -78 до 200°C, предпочтительно при температуре от -10 и 150°C. Реакция может проводиться как при повышенном, так и при пониженном давлении. Однако предпочтительно она проводится при нормальном давлении. Продолжительность реакции составляет от 0,1 и 72 часов, предпочтительно от 1 до 24 часов.
Для проведения реакции применяется, например, 1-2 мольных эквивалента соединений структуры (Х-6) и от 1 мольного эквивалента до легкого избытка основания на моль соединения структуры (Х-3) в растворителе, таком как, например, диметилформамид (DMF)
Стадии 2 и 3 получения соединений структуры (Х-4) могут проводиться в виде отдельных стадий или в виде единой реакции.
Стадии 4, 5 Гидролиз, амидирование
Последние стадии (Стадии 4 и 5) получения соединений согласно настоящему изобретению (1-Т23), гидролиз сложного эфира карбоновой кислоты (Х-4) и амидирование карбоновой кислоты Х-5, могут осуществляться согласно описанному выше общему способу (реакционной схеме) гидролиза сложного эфира и амидирования карбоновой кислоты.
Стадия 6 получение ацетилена
Стадия 6 получение исходного соединения структуры (Х-6)
Группы В1-В5, R11 и U имеют значения, описанные выше. U представляет собой, например, бром, иод или трифлат.
Соединения согласно настоящему изобретению общей структуры (Х-6) могут быть получены согласно описанным в литературе способам Methoden (Chinchilla, Rafael et al., Chemical Society Reviews (2011), 40(10), Стр. 5084-5121, Chinchilla, Rafael et al., Chemical Reviews (Washington, DC, United States) (2007), 107(3), стр. 874-922) из исходных веществ структуры (Х-7) при катализе с помощью катализаторов на основе переходного металла и палладия и меди.
Исходные соединения структуры (Х-7) известны или могут быть получены известными способами. В качестве примера упоминаются 2-бром-1,3-дихлор-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]бензол, 2-бром-1,3-диметил-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]бензол, 2-бром-1-этил-3-метил-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]бензол, 2-бром-1-хлор-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-3-(трифторметил)бензол, 2-бром-1-метил-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-3-(трифторметил)бензол, 2-бром-1-хлор-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-3-(трифторметокси)бензол, 2-бром-1-метил-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-3-(трифторметокси)бензол. Они могут, например, быть получены согласно способам, описанным в ЕР 1253128, стр. 8-10.
Исходные соединения структуры (Х-8) известны или могут быть получены известными способами. Если R6=H, в этом способе может применяться защитная группа вместо R6. Подходящими защитными группами являются, например, триметилсилил, триэтилсилил и диметил-гидроксиметил. Другие защитные группы и способы введения и отделения описываются в литературе [смотрите Auflistungen in Greene's protective groups in organic synthesis, 4. Edition, P.G.M. Wuts, T.W. Greene, John Wiley & Sons, Inc., Hoboken, New Jersey, 2007, стр. 927-933.]
Стадия 3 альтернативно: сочетание с амидами
Альтернативно соединения согласно настоящему изобретению соединения (I-Т23) получают согласно общему способу получения В (Реакционная схема 9).
Реакционная схема 9

Группы А1-A4, В1-В5, Q, R1 и R11 имеют значения, описанные выше.
Соединения согласно настоящему изобретению общей структуры (Х-4) получают посредством взаимодействия хлорида гидроксамовой кислоты структуры (Х-9) с ацетиленом структуры (Х-6).
Получение соединений структуры (Х-6) описано выше. Получение соединений структуры (Х-9) осуществляют аналогично описанному выше способу получения соединений структуры (Х-3).
Типичными соединениями структуры (Х-3) являются, например, 4-хлор-3-(циклопропилкарбамоил)-N-гидрокси-бензимидоил хлорид, 3-(циклопропилкарбамоил)-4-фтор-N-гидрокси-бензимидоил хлорид, 4-хлор-3-(циклопропилкарбамоил)-5-фтор-N-гидрокси-бензимидоил хлорид, 4-бром-3-(циклопропилкарбамоил)-N-гидрокси-бензимидоил хлорид.
(I-T24): Соединения формулы (I-24) могут, например, быть получены аналогично Furukawa, Hirotoshi et al. Heterocycles, 79 (2009), Стр. 303-309; US 6,545,009, Стр. 34, Пример 111
(I-T25): Соединения формулы (I-25) могут, например, быть получены аналогично WO 2004/14366, Стр. 113.
(I-T26): Соединения формулы (I-26) могут, например, быть получены аналогично Chihiro, Masatoshi et al., Journal of Medicinal Chemistry, 38 (1995), Стр. 353-358.
(I-T27): Соединения формулы (I-27) могут, например, быть получены аналогично US 6,545,009, Стр. 31, Пример 74.
Соединения структуры (I-T28) могут быть получены согласно способу, показанному на реакционной схеме 10.
Реакционная схема 10

Группы А1-A4, В1-В5, алкил, Q, R1 и R11 имеют значения, описанные выше. Исходные соединения структуры (S-1) известны (например, US 5,739,083 Стр. 10, или WO 2012/175474, Стр. 117-118) или могут быть получены известными способами. Реакция осуществляется при известных из литературы условиях (например, Abdelrahman S. Mayhoub et al., Bioorg. Med. Chem. 20 (2012) стр. 2427-2434 или WO 2009/023372).
Способ I-T29
Соединения структуры (I-T29) могут быть получены согласно способу, показанному на реакционной схеме 11.
Реакционная схема 3

Группы А1-A4, В1-В5, алкил, Q, R1 и R11 имеют значения, описанные выше. Исходные соединения структуры (Н-1) и (Н-7) известны (например, US 3,725,417 Стр. 7 или WO 2012/175474, Стр. 117-118) или могут быть получены известными способами. Реакция осуществляется при известных из литературы условиях (например, Abdelrahman S. Mayhoub, et al., Bioorg. Med. Chem. 20 (2012) стр. 2427-2434 или WO 2009/023372).
Способ I-T30
(I-T30): Соединения формулы (I-T30) могут, например, быть получены аналогично WO 2011/9484, Стр. 104; или Gamber, Gabriel G. et al., Bioorganic and Medicinal Chemistry Letters, 21 (2011), Стр. 1447-1451.
(I-T31): Соединения формулы (I-T31) могут, например, быть получены аналогично Bishop, Brian С. et al., Synthesis, (2004), Стр. 43-52; или Heller, Stephen Т. et al., Organic Letters, 8 (2006), стр. 2675-2678; или Baddar, F.G. et al. Journal of Heterocyclic Chemistry, 15 (1978), стр. 385-393.
(I-T32): Соединения формулы (I-T32) могут, например, быть получены аналогично Joo, Jung Min et al., Journal of Organic Chemistry, 75 (2010), Стр. 4911-4920.
(I-T33): Соединения формулы (I-T33) могут, например, быть получены аналогично Joo, Jung Min et al., Journal of Organic Chemistry, 75 (2010), Стр. 4911-4920; или WO 2004/91610, Стр. 70.
(I-T34): Соединения формулы (I-T34) могут, например, быть получены аналогично Al-Tel, Taleb et al., Journal of Medicinal Chemistry, 54 (2011), Стр. 8373-8385.
(I-T35): Соединения формулы (I-T35) могут, например, быть получены аналогично Yang, Shu-wie et al., Bioorganic and Medicinal Chemistry Letters, 21 (2011), Стр. 182-185; или Kennedy, Andrew J. et al, Journal of Medicinal Chemistry, 54 (2011), Стр. 3524-3548.
Соединения структуры (I-T45) могут быть получены согласно способу, показанному на реакционной схеме 12.
Реакционная схема 12

Группы А1-A4, В1-В5, алкил, Q, R1 и R11 имеют значения, описанные выше. U представляет собой бороновую кислоту, сложный эфир бороновой кислоты или трифторборонат. X представляет собой бром, иод или трифлат. Исходные соединения структуры (G-1), (G-5) и (G6) известны или могут быть получены известными способами.
Реакции могут осуществляться согласно способам, описанным в литературе (смотрите, например, Стадия G1->G2 US 2013/0012532, Стр. 29).
Способ I-T46
Соединения структуры (I-T46) могут быть получены согласно способу, показанному на реакционной схеме 13.
Реакционная схема 228

Группы А1-A4, В1-В5, алкил, Q, R1 и R11 имеют значения, описанные выше. U представляет собой бороновую кислоту, сложный эфир бороновой кислоты или трифторборонат. X представляет собой бром, иод или трифлат. Исходные соединения структуры (F-1) и (F-5) известны (например, F-1: Hulcoop, David G. et al., Organic Letters, 9 (2007), Стр. 1761-1764), или могут быть получены известными способами.
Реакции могут осуществляться согласно способам, описанным в литературе например, US 2009/209476, Стр. 18-19.
Способ I-T47
Соединения структуры (I-T47) могут быть получены согласно способу, показанному на реакционной схеме 14.
Реакционная схема 14

Группы А1-A4, В1-В5, алкил, Q, R1 и R11 имеют значения, описанные выше. U представляет собой бром, иод или трифлат, если М представляет собой бороновую кислоту, Сложный эфир бороновой кислоты или трифторборонат. U представляет собой бороновую кислоту, сложный эфир бороновой кислоты или трифторборонат, если М представляет собой бром, иод или трифлат. Исходные соединения структуры (Е-1) и (Е-6) известны (например, Liu, Kun et al., Journal of Medicinal Chemistry, 51 (2008), Стр. 7843-7854; или Cornet, Stephanie M. et al., Transactions, (2003), Стр. 4395-4405), или могут быть получены известными способами.
Реакции могут осуществляться согласно способам, описанным в литературе например, US 2009/209476, стр. 18-19.
Способ получения тиоамида
Соединения структуры (Ii) могут быть получены согласно способу, показанному на реакционной схеме 15 из соединения структуры (Ih) посредством взаимодействия с несущим серу реагентом.
Реакционная схема 15

Группы А1-A4, В1-В5, алкил, Q, Т, и R1 имеют значения, описанные выше. В качестве несущего серу реагента (2) могут применяться, например, P4S10 или реагент Лавессона (2,4-бис(4-метоксифенил)-1,3,2,4-дитиадифосфэтан-2,4-дисульфид).
Получение соединений (Ih) описано выше.
Несущий серу реагент является коммерчески доступным или может быть получен известным специалисту в данной области техники способом или аналогично этому способу.
Реакция осуществляется аналогично известным из литературы способам сульфирования карбонамидов (например, WO 2012056372, Стр. 77; WO 2003066050, Стр. 31).
Способ получения (Ik)
Соединения согласно настоящему изобретению (Ik) могут быть получены согласно способу, показанному на реакционной схеме 16, из соединений (Ij) посредством взаимодействия с серосодержащими соединениями структуры (Y-3).
Реакционная схема 16

Группы A1-A4, B1-В4, алкил, Q, R1, n и R11 имеют значения, описанные выше. X представляет собой подходящую уходящую группу бром или иод. R14 представляет собой необязательно замещенный C1-C6-алкил. Y представляет собой водород или щелочной металл, как например, натрий или литий.
Реакция может проводиться согласно описанным в литературе способам введения алкилтиоруппы в ароматические соединения [например, Organometallics 1989, 8(5), 1303-1308; WO 1998056761, Пример 63, Стр. 97].
Способ получения (Ika) и (Ikb)
Согласно настоящему изобретению соединения (Ika) или (Ikb) могут быть получены согласно способу, показанному на реакционной схеме 17, из соединений структуры (Ik) посредством взаимодействия с окислительным соединением.
Реакционная схема 17

Группы A1-A4, B1-В4, алкил, Q, R1, n и R11 имеют значения, описанные выше. R14 представляет собой необязательно замещенный C1-C6-алкил.
Получение соединений структуры (Ik) описано выше.
В качестве окислительного средства специалисты в данной области техники могут применять реагенты, известные из литературы для получения сульфоксидов и сульфонов. Они являются коммерчески доступными или могут быть получены способом, известным специалисту в данной области техники, или аналогично этому способу. В качестве примера упоминаются: пероксид водорода, пероксиуксусная кислота, 3-хлорпербензойная кислота и трифторперуксусная кислота.
Реакция может проводиться согласно описанным в литературе способам получения сульфоксидов и сульфонов [Сульфоксидные производные: WO 2006/097766; WO 2005/019151; сульфоновые производные: WO 2008/125214; WO 2005/121087].
Способ получения N-алкильных соединений
Соединения структуры (I) могут быть получены согласно способу, показанному на реакционной схеме 18, из соединений структуры (Im) посредством взаимодействия с алкилирующим средством.
Реакционная схема 18

Группы А1-A4, В1-В5, алкил, и Q имеют значения, описанные выше. U представляет собой, например, бром, иод или трифлат. R1 представляет собой в каждом случае, первичный или вторичный, необязательно замещенный C1-C6-алкил, C3-C6-алкенил, C3-C6-алкинил, С4-С7-циклоалкил, C1-C6-алкилкарбонил, C1-C6-алкоксикарбонил, арил(C1-C3)-алкил, гетероарил(C1-C3)-алкил. W представляет собой кислород.
Соединения структуры U-R1 являются коммерчески доступными или известны из литературы или могут быть получены согласно описанным в литературе способам. В качестве примера необходимо указать: метилхлорид, метилбромид, метилиодид, димеитлсульфат, метилтрифлат, этилбромид, этилиодид, диэтилсульфат и этилтрифлат.
Подходящие для реакции основания являются коммерчески доступными. В качестве примера необходимо указать соединения щелочноземельных металлов или щелочных металлов (например, гидроксид, гидрид, оксид и карбонат лития, натрия, калия, магния, кальция и бария), как например, гидрид натрия, гидроксид натрия и гидроксид калия; карбонаты, такие как, например, гидрокарбонат натрия и Карбонат калия
Реакция проводится аналогично способам, описанным в литературе, для N-алкилирования вторичного амида (например, G.L. Gisele, A.


Получение исходного вещества 4-гептафторизопропил-2-метил-6-трифторметил-анилина
Исходное вещество 4-гептафторизопропил-2-метил-6-трифторметил-анилин структуры (D-1a) до сих пор не описано в литературе. Получение может осуществляться согласно двум различным способам.

Способ получения тиоамида
Соединения структуры (Ii) могут быть получены согласно способу, показанному на реакционной схеме 15, из соединений структуры (In) посредством взаимодействия с несущим серу реагентом.
Реакционная схема 236

Группы А1-A4, В1-В5, алкил, Q, Т, и R1 имеют значения, описанные выше. В качестве реагента сульфирования (2) может применяться, например, P4S10 или реагент Лавессона (2,4-бис(4-метоксифенил)-1,3,2,4-дитиадифосфетан-2,4-дисульфид).
Получение соединений (Ih) описано выше.
Реагенты сульфирования являются коммерчески доступными или могут быть получены способом, известным специалисту в данной области техники, или аналогично этому способу.
Реакция проводится аналогично способам, описанным в литературе, сульфирования карбонамида (например, WO 2012056372, Стр. 77; WO 2003066050, Стр. 31).
Способ получения (Ik)
Согласно настоящему изобретению соединения (Ik) могут быть получены согласно способу, приведенному на реакционной схеме 16, из соединений (Ij) посредством взаимодействия с серосодержащими соединениями структуры (Y-3).
Реакционная схема 237

Группы A1-A4, B1-В4, алкил, Q, R1, n и R11 имеют значения, описанные выше. X представляет собой подходящую уходящую группу, как например, фтор, хлор, бром или иод. R14 представляет собой необязательно замещенный C1-C6-алкил. Y представляет собой водород или щелочной металл, как например, натрий или литий.
Реакция проводится аналогично способам, описанным в литературе, для введения алкилтиогруппы в ароматические соединения. [Например, Organometallics 1989, 8(5), 1303-1308; WO 1998056761, Пример 63, Стр. 97].
Способ 1:
4-Гептафторизопропил-2-метил-6-трифторметил-анилин структуры (K-1) может быть получен из 2-метил-6-трифторметил-анилина согласно способу, приведенному на реакционной схеме 1, посредством взаимодействия с гептафторизопропилиодидом в присутствии пероксида водорода.
Реакционная схема 4

2-Метил-6-трифторметил-анилин известен из литературы (John P. Chupp, Terry М. Balthazor, Michael J. Miller, and Mark J. Pozzo, J. Org. Chem. 49 (1984), 4711-4716 или Thomas E. Nickson J. Org. Chem. 51 (1986) 3903-3904), и гептафторизопропилиодид является коммерчески доступным.
Реакция осуществляется аналогично известному способу трифторметилирования ароматических соединений (Tatsuhito Kino, Yu Nagase, Yuhki Ohtsuka, Kyoko Yamamoto, Daisuke Uraguchi, Kenji Tokuhisa and Tetsu Yamakawa, Journal of Fluorine Chemistry 131 (2010) 98-105).
Способ 2
Далее 4-гептафторизопропил-2-метил-6-трифторметил-анилин структуры (K-1) может быть получен из 4-гептафторизопропил-2-метил-анилина согласно способу, приведенному на схеме 2, посредством взаимодействия с трифторметилсульфинат натрия в присутствии окислительного средства и катализатора на основе переходного металла.
Реакционная схема 5

X представляет собой NaSO2- (трифторметилсульфинат натрия), KSO2- (трифторметилсульфинат калия). Особенно предпочтительным является трифторметилсульфинат натрия.
4-Гептафторизопропил-2-метил-анилин известен (US 2004/92762).
Подходящими катализаторами являются переходные металлы, такие как железа(II) сульфат, железо(III) нитрат, меди(II) трифлат или ферроцен. Особенно предпочтительным является железо(II) сульфат.
Подходящими окислительными средствами являются, среди прочего, пероксиды, такие как пероксид водорода, трет.-бутилгидропероксид или пероксодисульфат натрия, пероксодисульфат калия, пероксомоносульфат натрия или пероксомоносульфат калия. Особенно предпочтительным является трет.-бутилгидропероксид.
При проведении реакции может применяться подходящий растворитель.
В качестве разбавителей или растворителей для проведения способа согласно настоящему изобретению, как правило, рассматриваются все инертные при специфических условиях реакции органические растворители. В качестве примера необходимо указать: нитрилы, такие как ацетонитрил, пропионитрил, бутиронитрил, изобутиронитрил; воду, тетрагидротиофендиоксид, диметилсульфоксид, тетраметиленсульфоксид, дипропилсульфоксид, диизобутилсульфоксид, дибутилсульфоксид, диизоамилсульфоксид, сульфоны (например, диметил-, диэтил-, дипропил-, дибутил-, дигексил-, метилэтил-, этилпропил-, этилизобутил- и пентаметиленсульфон); алифатические, циклоалифатические (например, пентан, гексан, гептан, октан, нонан и технические углеводороды), компоненты, далее упоминаемые как «уайт спириты», с точкой кипения в диапазоне, например, от 40°C до 250°C, Бензиновые фракции с диапазоном температур кипения от 70°C до 190°C, циклогексан, метилциклогексан, петролейный простой эфир, лигроин, октан.
В качестве предпочтительного разбавителя может применяться любой разбавитель, который не ухудшает реакцию, например, вода; нитрилы, такие как ацетонитрил, пропионитрил, бутиронитрил, изобутиронитрил. Растворитель может применяться сам по себе или в комбинации из двух или более.
При взаимодействии могут добавляться основания. В качестве примера необходимо указать соединения щелочноземельных металлов или щелочных металлов (например, гидроксид, гидрид, оксид и карбонат лития, натрия, калия, магния, кальция и бария).
В качестве предпочтительного основного вспомогательного средства реакции может применяться гидрокарбонат натрия; кроме того, могут применяться, например, следующие основания: гидроксид щелочного металла, как например гидроксид натрия и гидроксид калия; карбонаты, такие как, например, гидрокарбонат натрия и карбонат калия; фосфаты, как например, дигидрофосфат натрия, дикалия гидрофосфат и тринатрия фосфат.
Реакция может проводиться при широком диапазоне температур. Как правило, она проводится при диапазоне температур от -78-200°C, предпочтительно при температуре от -10 и 150°C. Реакция может проводиться как при повышенном, так и при пониженном давлении. Однако предпочтительно она проводится при нормальном давлении. Продолжительность реакции составляет от 0,1 до 72 часов, предпочтительно от 1 до 24 часов.
Для проведения реакции применяется, от 1 от 10 моль, предпочтительно от 1 до 4 моль трифторметилирующего средства; от 1 до 20 моль, предпочтительно от 1 до 8 моль окисляющего средства и от 0,01 до 1 моль, предпочтительно от 0,05 до 0,4 моль катализатора на моль 4-гептафторизопропил-2-метил-6-трифторметил-анилина в растворителе или смеси растворителей, как например, в смеси ацетонитрила и воды.
Способ I-T46 расширенный
Соединения структуры (I-T46) могут быть получены согласно способу, показанному на реакционной схеме 1.
Реакционная схема 6

Группы А1-A4, В1-В5, алкил, Q, R1 и R11 имеют значения, описанные выше. U представляет собой бороновую кислоту, Сложный эфир бороновой кислоты или трифторборонат. X представляет собой бром, иод или трифлат. Исходные соединения структуры (F-1) и (F-5) известны (например, F-1: Hulcoop, David G. et al., Organic Letters, 9 (2007), Стр. 1761-1764, Supporting information стр. 1 ff), или могут быть получены известными способами (например, из D-1).
Реакции могут осуществляться согласно способам, описанным в литературе например, US 2009/209476, Стр. 18-19.
Стадия 1 Пиррольная циклизация
Стадия 1 способа получения соединений согласно настоящему изобретению (I-Т46).

Соединения согласно настоящему изобретению общей структуры (F-1) могут быть получены аналогично известным из литературы способам из исходных веществ структуры (D-1) и (F-1b). Группы В1-В5 имеют значения, описанные выше. Соединения структуры (D-1) известны из литературы (например, US 2002/198399, WO 2009/30457, Стр. 28) или могут быть получены согласно известным из литературы способам. Соединения (F1-b) коммерчески доступны. В качестве типичных примеров соединений структуры (D-1) упоминаются 2-амино-1,3-дихлор-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]бензол, 2-амино-1,3-диметил-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]бензол, 2-амино-1-этил-3-метил-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]бензол, 2-амино-1-хлор-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-3-(трифторметил)бензол, 2-амино-1-метил-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-3-(трифторметил)бензол, 2-амино-1-хлор-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-3-(трифторметокси)бензол, 2-амино-1-метил-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-3-(трифторметокси)бензол. Реакция проводится при условиях, известных из литературы для аналогичных соединений (например, Hulcoop, David G. et al., Organic Letters, 9 (2007), Стр. 1761-1764, Supporting information стр. 1 ff)
Стадия 2 Галогенирование
Стадия 1 способа получения соединений согласно настоящему изобретению (I-Т46):

Соединения согласно настоящему изобретению общей структуры (F-2) могут быть получены аналогично известным из литературы способам Из исходных веществ структуры (F-1) посредством галогенирования. Группы В1-В5 имеют значения, описанные выше. Соединения структуры (F-1) известны из литературы (например, F-1: Hulcoop, David G. et al., Organic Letters, 9 (2007), стр. 1761-1764, Supporting information стр. 1 ff) или могут быть получены согласно описанным выше способам получения. В качестве типичных примеров соединений структуры (F-1) упоминаются 1-[2,6-дихлор-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиррол, 1-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиррол, 1-[2-этил-6-метил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиррол, 1-[2-хлор-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-6-(трифторметил)фенил]пиррол, 1-[2-Метил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-6-(трифторметил)фенил]пиррол, 1-[1-хлор-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-6-(трифторметокси)фенил]пиррол, 1-[1-метил-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-6-(трифторметокси)фенил]пиррол.
Подходящие галогенирующие соединения известны специалистам в данной области техники, как например, бром, иод, N-бромсукцинимид, N-иодсукцинимид, 1,3-дибром-5,5-диметилгидантоин и бензилтриметиламмония-тетрахлороиодат. Предпочтительно применяется бром, иод и иодсукцинимид. Взаимодействие осуществляется при известных из литературы условиях, (например, Tatsuta; Itoh Bulletin of the Chemical Society of Japan, 67 (1994) 1449-1455).
Стадия 3 сочетание с бороновой кислотой
Стадия 3 способа получения соединений согласно настоящему изобретению (I-Т46):

Группы A1-A4, B1-B5, алкил, n и R11 имеют значения, описанные выше. U представляет собой, например, бороновую кислоту, сложный эфир бороновой кислоты или трифторборонат, X представляет собой бром, иод или трифлат.
Соединения согласно настоящему изобретению общей структуры (F-3) могут быть получены согласно способам, известным из литературы, посредством катализируемых палладием реакций из партнеров реакции общей структуры (F-2) и (F-5) (например, WO 2005/040110 или WO 2009/089508). Соединения общей структуры (F-5) являются коммерчески доступными или могут быть получены способами, известными специалистам в данной области техники.
Стадии 4, 5 Гидролиз, амидирование

Соединения согласно настоящему изобретению общей структуры (I-T46) могут быть получены согласно описанным в литературе способам Пептидного сочетания из исходных веществ (F-4) и (В-7) (например, WO 2010/051926 или WO 2010/133312). Соединения общей структуры (F-4) могут быть получены аналогично способам, известным из литературы, посредством расщепления сложного эфира, из соединений общей структуры (F-3) (например, WO 2010/051926 или WO 2010/133312). Группы A1-A4, В1-В5, Алкил, Q, R1 и R11 имеют значения, описанные выше.
Q
В более предпочтительном варианте выполнения настоящего изобретения Q в соединении формулы (I) или (Ia'') или (IT-2) или (I-T3) или (I-Т4) или (I-T22) или (I-Т23) или (I-T46) представляет собой C1-C4-Алкил, 2-оксо-2-(2,2,2-трифтороэтиламино)-этил, замещенный фтором или 1-циано-пропилом или пиридином C1-C4-алкил, как например 2,2,2-трифторэтил, 2,2-дифторэтил, 3,3,3-трифторпропил, пиридин-2-илметил или (1-циано-циклопропил)метил; C3-C4-циклоалкил, как например циклопропил или циклобутил; необязательно замещенный C3-C4-циклоалкил, как например необязательно замещенный фторзамещенным C1-C4-алкилом циклопропил (например, 1-трифторметил-циклопропил, 1-трет-бутил-циклопропил), 1-тиокарбамоил-циклопропил, 1-карбамоил-циклопропил, 1-циано-циклопропил, транс-2-фторциклопропил, цис-2-фторциклопропил; С4-С6-гетероциклоалкил, как например оксетан-3-ил, тиетан-3-ил, 1-оксидо-тиетан-3-ил, или 1,1-диоксидо-тиетан-3-ил; или в каждом случае необязательно замещенный C1-C4-алкилом бензил; пиразол (как например, N-метил-пиразол-3-ил), пиридин; метилсульфонил; или 2-оксо-2-(2,2,2-трифтороэтиламино)этил.
В особенно предпочтительном варианте выполнения настоящего изобретения Q в соединении формулы (I) или (Ia'') или (IT-2) или (I-T3) или (I-Т4) или (I-T22) или (I-T23) или (I-T46) представляет собой замещенный фтором C1-C3-алкил, как например 2,2,2-трифторэтил или 3,3,3-трифторопропил; циклопропил; необязательно замещенный циано, C1-C4-алкилом циклопропил, как например 1-циано-циклопропил или 1-трифторметил-циклопропил; тиетан-3-ил; или 2-оксо-2-(2,2,2-трифтороэтил)аминоэтил.
Формула (I)
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой Т представляет собой Т2, T3, Т4, Т22, Т23 или Т46, и все другие параметры имеют значения, как описано в абзаце [0009].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой Т представляет собой Т2, T3, Т4, Т22, Т23 или Т46, и все другие параметры имеют значения, как описано в абзаце [0009].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой Т представляет собой Т2 или Т4, и все другие параметры имеют значения, как описано в абзаце [0009].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой Т представляет собой T3 или Т46, и все другие параметры имеют значения, как описано в абзаце [0009].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой Т представляет собой Т22 или Т23, и все другие параметры имеют значения, как описано в абзаце [0009].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой Т представляет собой Т2, T3, Т4, Т22, Т23 или Т46, В3 представляет собой C-R8, и R8 представляет собой в каждом случае замещенный (С1-С6)-алкил, (С1-С6)-алкокси или алкилсульфанил, причем заместители выбираются из галогена и гидрокси, причем по меньшей мере одним заместителем является галоген, и все другие параметры имеют значения, как описано в абзаце [0009].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой Т представляет собой Т2, T3, Т4, Т22, Т23 или Т46, В3 представляет собой C-R8, и R8 представляет собой в каждом случае замещенный (С1-С6)-алкил, (С1-С6)-алкокси или алкилсульфанил, причем заместители выбираются из галогена и гидрокси, причем по меньшей мере одним заместителем является галоген, и все другие параметры имеют значения, как описано в абзаце [0009].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой Т представляет собой Т2 или Т4, В3 представляет собой C-R8, и R8 представляет собой в каждом случае замещенный (С1-С6)-алкил, (С1-С6)-алкокси или алкилсульфанил, причем заместители выбираются из галогена и гидрокси, причем по меньшей мере одним заместителем является галоген, и все другие параметры имеют значения, как описано в абзаце [0009].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой Т представляет собой T3 или Т46, В3 представляет собой C-R8, и R8 представляет собой в каждом случае замещенный (С1-С6)-алкил, (С1-С6)-алкокси или алкилсульфанил, причем заместители выбираются из галогена и гидрокси, причем по меньшей мере одним заместителем является галоген, и все другие параметры имеют значения, как описано в абзаце [0009].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой Т представляет собой Т22 или Т23, В3 представляет собой C-R8, и R8 представляет собой в каждом случае замещенный (С1-С6)-алкил, (С1-С6)-алкокси или алкилсульфанил, причем заместители выбираются из галогена и гидрокси, причем по меньшей мере одним заместителем является галоген, и все другие параметры имеют значения, как описано в абзаце [0009]. При этом особенно предпочтительным вариантом выполнения настоящего изобретения являются соединения, в которых R8 представляет собой перфторированный (С1-С6)-алкил, (С1-С6)-алкокси или алкилсульфанил, особенно предпочтительно представляет собой перфторированный (C1-C4)-алкил, (C1-C4)-алкокси.
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой Т представляет собой Т2, T3, Т4, Т22, Т23 или Т46, В3 представляет собой C-R8, и R8 представляет собой в каждом случае замещенный (С1-С6)-алкил, (С1-С6)-алкокси или алкилсульфанил, причем заместители выбираются из галогена и гидрокси, причем по меньшей мере одним заместителем является галоген, особенно предпочтительно, в которой R8 представляет собой перфторированный (С1-С6)-алкил, (С1-С6)-алкокси или алкилсульфанил, особенно предпочтительно представляет собой перфторированный (C1-C4)-алкил, (C1-C4)-алкокси, в которой В1, В2, В4 и В5 представляют собой CR6, CR7, CR9 или CR10, в которой R6, R7, R9 и R10 независимо друг от друга представляют собой Н, галоген, циано, нитро, в каждом случае необязательно по меньшей мере одним заместителем, выбранным из галогена и гидрокси, причем по меньшей мере одним заместителем является галоген, замещенный C1-C4-алкил, C3-C4-циклоалкил, C1-C4-алкокси, N-алкоксииминоалкил, C1-С4-алкилсульфанил, C1-C4-алкилсульфинил, C1-C4-алкилсульфонил, N-C1-C4-алкиламино, N,N-ди-С1-С4-алкиламино, и все другие параметры имеют значения, как описано в абзаце [0009]. В другом предпочтительном варианте выполнения настоящего изобретения R6 и R10 в каждом случае представляют собой галоген (как например, Cl, Br или F), в каждом случае представляют собой C1-C3-алкил, или в каждом случае представляют собой замещенный галогеном C1-C3-алкил, как например, перфторированный C1-C3-алкил (Перфторметил, перфторэтил или перфторпропил).
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой Т представляет собой Т2, T3, Т4, Т22, Т23 или Т46, В3 представляет собой C-R8, и R8 представляет собой в каждом случае замещенный (С1-С6)-алкил, (C1-C6)-алкокси или алкилсульфанил, причем заместители выбираются из галогена и гидрокси, причем по меньшей мере одним заместителем является галоген, особенно предпочтительно, в которой R8 представляет собой перфторированный (С1-С6)-алкил, (С1-С6)-алкокси или алкилсульфанил, особенно предпочтительно представляет собой перфторированный (C1-C4)-алкил, (C1-C4)-алкокси, в которой B1, В2 и В4 представляет собой CR6, CR7, или CR9, и В5 представляет собой N, в которой R6, R7 и R9 независимо друг от друга представляет собой Н, галоген, циано, нитро, в каждом случае необязательно по меньшей мере одним заместителем, выбранным из галогена и гидрокси, причем по меньшей мере одним заместителем является галоген, замещенный C1-C4-алкил, С3-С4-циклоалкил, C1-C4-алкокси, N-алкоксииминоалкил, C1-C4-алкилсульфанил, C1-C4-алкилсульфинил, C1-C4-алкилсульфонил, N-C1-C4-алкиламино, N,N-ди-C1-С4-алкиламино, и все другие параметры имеют значения, как описано в абзаце [0009].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой Т представляет собой Т2, T3, Т4, Т22, Т23 или Т46, В3 представляет собой C-R8, и R8 представляет собой в каждом случае замещенный (С1-С6)-алкил, (С1-С6)-алкокси или алкилсульфанил, причем заместители выбираются из галогена и гидрокси, причем по меньшей мере одним заместителем является галоген, особенно предпочтительно, в которой R8 представляет собой перфторированный (С1-С6)-алкил, (С1-С6)-алкокси или алкилсульфанил, особенно предпочтительно представляет собой перфторированный (C1-C4)-алкил, (C1-C4)-алкокси, в которой В1, В2, В4 и В5 представляет собой CR6, CR7, CR9 или CR10, в которой R6, R7, R9 и R10 независимо друг от друга представляет собой Н, галоген, циано, нитро, в каждом случае необязательно по меньшей мере одним заместителем, выбранным из галогена и гидрокси, причем по меньшей мере одним заместителем является галоген, замещенный C1-C4-алкил, С3-С4-циклоалкил, C1-C4-алкокси, N-алкоксииминоалкил, C1-C4-алкилсульфанил, C1-C4-алкилсульфинил, C1-C4-алкилсульфонил, N-C1-C4-алкиламино, N,N-ди-C1-C4-алкиламино, R11 в каждом случае независимо друг от друга представляют собой Н, амино (NH2) или циано, предпочтительно представляет собой Н, W представляет собой О, R1 представляет собой Н, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, предпочтительно представляет собой Н или метил, и все другие параметры имеют значения, как описано в абзаце [0009]. В другом предпочтительном варианте выполнения настоящего изобретения R6 и R10 в каждом случае представляют собой галоген (как например, Cl, Br или F), в каждом случае представляет собой C1-C3-алкил, или в каждом случае представляет собой замещенный галогеном C1-C3-алкил, как например, перфторированный C1-C3-алкил (перфторметил, перфтороэтил или перфторпропил).
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой Т представляет собой Т2, T3, Т4, Т22, Т23 или Т46, В3 представляет собой C-R8, и R8 представляет собой в каждом случае замещенный (С1-С6)-алкил, (С1-С6)-алкокси или алкилсульфанил, причем заместители выбираются из галогена и гидрокси, причем по меньшей мере одним заместителем является галоген, особенно предпочтительно, в которой R8 представляет собой перфторированный (С1-С6)-алкил, (С1-С6)-алкокси или алкилсульфанил, особенно предпочтительно представляет собой перфторированный (C1-C4)-алкил, (C1-C4)-алкокси, в которой В1, B2 и В4 представляет собой CR6, CR7, или CR9, и В5 представляет собой N, в которой R6, R7 и R9 независимо друг от друга представляют собой Н, галоген, циано, нитро, в каждом случае необязательно по меньшей мере одним заместителем, выбранным из галогена и гидрокси, причем по меньшей мере одним заместителем является галоген, замещенный C1-С4-алкил, С3-С4-циклоалкил, C1-C4-алкокси, N-алкоксииминоалкил, C1-C4-алкилсульфанил, C1-C4-алкилсульфинил, C1-C4-алкилсульфонил, N-C1-C4-алкиламино, N,N-ди-C1-C4-алкиламино, R11 в каждом случае независимо друг от друга представляет собой Н, амино (NH2) или циано, предпочтительно представляет собой Н, W представляет собой О, R1 представляет собой Н, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, предпочтительно представляет собой Н или метил, и все другие параметры имеют значения, как описано в абзаце [0009].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой Т представляет собой Т2, T3, Т4, Т22, Т23 или Т46, В3 представляет собой C-R8, и R8 представляет собой в каждом случае замещенный (С1-С6)-алкил, (С1-С6)-алкокси или алкилсульфанил, причем заместители выбираются из галогена и гидрокси, причем по меньшей мере одним заместителем является галоген, особенно предпочтительно, в которой R8 представляет собой перфторированный (С1-С6)-алкил, (С1-С6)-алкокси или алкил сульфанил, особенно предпочтительно представляет собой перфторированный (C1-C4)-Алкил, (C1-C4)-алкокси, в которой B1, B2, В4 и В5 представляет собой CR6, CR7, CR9 или CR10, в которой R6, R7, R9 и R10 независимо друг от друга представляет собой Н, галоген, циано, нитро, в каждом случае необязательно по меньшей мере одним заместителем, выбранным из галогена и гидрокси, причем по меньшей мере одним заместителем является галоген, замещенный C1-C4-алкил, C3-C4-циклоалкил, C1-C4-алкокси, N-алкоксииминоалкил, C1-C4-алкилсульфанил, C1-C4-алкилсульфинил, C1-C4-алкилсульфонил, N-C1-C4-алкиламино, N,N-ди-C1-C4-алкиламино, R11 в каждом случае независимо друг от друга представляет собой Н, амино (NH2) или циано, предпочтительно представляет собой Н, W представляет собой О, R1 представляет собой Н, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, предпочтительно представляет собой Н или метил, Q представляет собой C1-C4-алкил, 2-оксо-2-(2,2,2-трифтороэтиламино)-этил, замещенный фтором или 1-циано-пропилом или пиридином C1-C4-алкил, как например 2,2,2-трифторэтил, 2,2-дифторэтил, 3,3,3-трифторпропил, пиридин-2-илметил или (1-циано-циклопропил)метил; C3-C4-циклоалкил, как например циклопропил или циклобутил; необязательно замещенный C3-C4-циклоалкил, как например необязательно замещенный фторзамещенным C1-C4-алкилом замещенный циклопропил (например, 1-трифторметил-циклопропил, 1-третбутил-циклопропил), 1-тиокарбамоил-циклопропил, 1-карбамоил-циклопропил, 1-Циано-циклопропил, транс-2-фторциклопропил, цис-2-фторциклопропил; С4-С6-гетероциклоалкил, как например оксетан-3-ил, тиетан-3-ил, 1-оксидо-тиетан-3-ил, или 1,1-диоксидо-тиетан-3-ил; или в каждом случае необязательно замещенный C1-C4-алкилом бензил; пиразол (как например, N-метил-пиразол-3-ил), пиридин; метилсульфонил; или 2-оксо-2-(2,2,2-трифтороэтиламино)этил, предпочтительно представляет собой замещенный фтором C1-C3-Алкил, как например 2,2,2-трифтороэтил или 3,3,3-трифторопропил; циклопропил; необязательно замещенный циклопропил, как например 1-циано-циклопропил или 1-трифторметил-циклопропил, тиетан-3-ил; или 2-оксо-2-(2,2,2-трифтороэтил)аминоэтил, и все другие параметры имеют значения, как описано в абзаце [0009]. В другом предпочтительном варианте выполнения настоящего изобретения R6 и R10 в каждом случае представляют собой галоген (как например, Cl, Br или F), в каждом случае представляют собой C1-C3-алкил, или в каждом случае представляют собой замещенный галогеном C1-C3-алкил, как например, перфторированный C1-C3-алкил (перфторметил, перфторэтил или перфторпропил).
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой Т представляет собой Т2, T3, Т4, Т22, Т23 или Т46, В3 представляет собой C-R8, и R8 представляет собой в каждом случае замещенный (С1-С6)-алкил, (С1-С6)-алкокси или алкилсульфанил, причем заместители выбираются из галогена и гидрокси, причем по меньшей мере одним заместителем является галоген, особенно предпочтительно, в которой R8 представляет собой перфторированный (С1-С6)-алкил, (С1-С6)-алкокси или алкилсульфанил, особенно предпочтительно представляет собой перфторированный (C1-C4)-алкил, (C1-C4)-алкокси, в которой B1, В2 и В4 представляет собой CR6, CR7, или CR9, и В5 представляет собой N, в которой R6, R7 и R9 независимо друг от друга представляют собой Н, галоген, циано, нитро, в каждом случае необязательно по меньшей мере одним заместителем, выбранным из галогена и гидрокси, причем по меньшей мере одним заместителем является галоген, замещенный C1-C4-алкил, C3-C4-циклоалкил, C1-C4-алкокси, N-алкоксииминоалкил, C1-C4-алкилсульфанил, C1-C4-алкилсульфинил, C1-C4-алкилсульфонил, N-C1-C4-алкиламино, N,N-ди-C1-C4-алкиламино, R11 в каждом случае независимо друг от друга представляет собой Н, амино (NH2) или циано, предпочтительно представляет собой Н, W представляет собой О, R1 представляет собой Н, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, предпочтительно представляет собой Н или метил, Q представляет собой C1-C4-алкил, 2-оксо-2-(2,2,2-трифторэтиламино)-этил, замещенный фтором или 1-циано-пропилом или пиридином C1-C4-алкил, как например 2,2,2-трифторэтил, 2,2-дифторэтил, 3,3,3-трифторпропил, пиридин-2-илметил или (1-циано-циклопропил)метил; C3-C4-циклоалкил, как например циклопропил или циклобутил; необязательно замещенный C3-C4-циклоалкил, как например необязательно замещенный фторзамещенным C1-C4-алкилом циклопропил (например, 1-трифторметил-циклопропил, 1-трет.бутил-циклопропил), 1-тиокарбамоил-циклопропил, 1-карбамоил-циклопропил, 1-циано-циклопропил, транс-2-фторциклопропил, цис-2-фторциклопропил; С4-С6-гетероциклоалкил, как например оксетан-3-ил, тиетан-3-ил, 1-оксидо-тиетан-3-ил, или 1,1-диоксидо-тиетан-3-ил; или в каждом случае необязательно замещенный C1-C4-алкилом бензил; пиразол (как например, N-метилпиразол-3-ил), пиридин; метилсульфонил; или 2-оксо-2-(2,2,2-трифтороэтиламино)этил, предпочтительно представляет собой замещенный фтором C1-C3-алкил, как например 2,2,2-трифтороэтил или 3,3,3-трифторопропил; циклопропил; необязательно замещенный циклопропил, как например 1-циано-циклопропил или 1-трифторметил-циклопропил, тиетан-3-ил; или 2-оксо-2-(2,2,2-трифтороэтил)аминоэтил, и все другие параметры имеют значения, как описано в абзаце [0009].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой Т представляет собой Т2, T3, Т4, Т22, Т23 или Т46, В3 представляет собой C-R8, и R8 представляет собой в каждом случае замещенный (С1-С6)-алкил, (С1-С6)-алкокси или алкилсульфанил, причем заместители выбираются из галогена и гидрокси, причем по меньшей мере одним заместителем является галоген, особенно предпочтительно, в которой R8 представляет собой перфторированный (С1-С6)-алкил, (С1-С6)-алкокси или алкилсульфанил, особенно предпочтительно представляет собой перфторированный (C1-C4)-алкил, (C1-C4)-алкокси, в которой B1, B2, В4 и В5 представляют собой CR6, CR7, CR9 или CR10, в которой R6, R7, R9 и R10 независимо друг от друга представляют собой Н, галоген, циано, нитро, в каждом случае необязательно по меньшей мере одним заместителем, выбранным из галогена и гидрокси, причем по меньшей мере одним заместителем является галоген, замещенный C1-C4, C3-C4-циклоалкил, C1-C4-алкокси, N-алкоксииминоалкил, C1-C4-алкилсульфанил, C1-C4-алкилсульфинил, C1-C4-алкилсульфонил, N-C1-C4-алкиламино, N,N-ди-C1-С4-алкиламино, R11 в каждом случае независимо друг от друга представляют собой Н, амино (NH2) или циано, предпочтительно представляет собой Н, W представляет собой О, R1 представляет собой Н, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, предпочтительно представляет собой Н или метил, Q представляет собой C1-C4, 2-оксо-2-(2,2,2-трифтороэтиламино)-этил, замещенный фтором или 1-циано-пропилом или пиридином C1-C4-алкил, как например 2,2,2-трифторэтил, 2,2-дифторэтил, 3,3,3-трифторпропил, пиридин-2-илметил или (1-циано-циклопропил)метил; С3-С4-циклоалкил, как например циклопропил или циклобутил; необязательно замещенный C3-C4-циклоалкил, как например необязательно замещенный фторзамещенным C1-C4-алкилом циклопропил (например, 1-трифторметилциклопропил, 1-трет-бутил-циклопропил), 1-тиокарбамоил-циклопропил, 1-карбамоил-циклопропил, 1-циано-циклопропил, транс-2-фторциклопропил, цис-2-фторциклопропил; С4-С6-гетероциклоалкил, как например оксетан-3-ил, тиетан-3-ил, 1-оксидо-тиетан-3-ил, или 1,1-диоксидо-тиетан-3-ил; или в каждом случае необязательно замещенный C1-C4-алкилом бензил; пиразол (как например, N-метил-пиразол-3-ил), пиридин; метилсульфонил; или 2-оксо-2-(2,2,2-трифтороэтиламино)этил, предпочтительно представляет собой замещенный фтором C1-C3-алкил, как например 2,2,2-трифтороэтил или 3,3,3-трифторпропил; циклопропил; необязательно замещенный циклопропил, как например 1-циано-циклопропил или 1-трифторметил-циклопропил, тиетан-3-ил; или 2-оксо-2-(2,2,2-трифторэтил)аминоэтил, A1 представляет собой CR2 или N, A2 представляет собой CR3 или N, А3 представляет собой CR4 и A4 представляет собой CR5 или N, причем R2 представляет собой Н, C1-C4-алкил или галоген (как например, метил, F, Cl или Н), R3 представляет собой Н или галогенированный C1-C4-алкил (как например, Н или -CF3), R4 представляет собой Н, C1-C4-алкил, C1-C4-алкиламин (как например, -NH-CH3), циклопропиламин, C1-C4-алкокси (как например, -О-СН3), C1-C4-алкокси-C1-C4-алкиламин (как например, NH-CH2-CH2-O-CH3) или галоген (как например, F или Cl). В другом предпочтительном варианте выполнения настоящего изобретения R6 и R10 в каждом случае представляют собой галоген (как например, Cl, Br или F), в каждом случае представляет собой С1-C3-алкил, или в каждом случае представляет собой замещенный галогеном С1-C3-алкил, как например, перфторированный C1-C3-алкил (перфторметил, перфторэтил или перфторпропил).
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой Т представляет собой Т2, T3, Т4, Т22, Т23 или Т46, В3 представляет собой C-R8, и R8 представляет собой в каждом случае замещенный (С1-С6)-алкил, (С1-С6)-алкокси или алкилсульфанил, причем заместители выбираются из галогена и гидрокси, причем по меньшей мере одним заместителем является галоген, особенно предпочтительно, в которой R8 представляет собой перфторированный (С1-С6)-алкил, (С1-С6)-алкокси или алкилсульфанил, особенно предпочтительно представляет собой перфторированный (C1-C4)-алкил, (C1-C4)-алкокси, в которой B1, В2 и В4 представляют собой CR6, CR7, или CR9, и B5 представляет собой N, где R6, R7 и R9 независимо друг от друга представляют собой Н, галоген, циано, нитро, в каждом случае необязательно по меньшей мере одним заместителем, выбранным из галогена и гидрокси, причем по меньшей мере одним заместителем является галоген, замещенный C1-C4-алкил, C3-C4-циклоалкил, C1-C4-алкокси, N-алкоксииминоалкил, C1-C4-алкилсульфанил, C1-C4-алкилсульфинил, С1-С4-алкилсульфонил, N-C1-C4-алкиламино, N,N-ди-C1-С4-алкиламино, R11 в каждом случае независимо друг от друга представляет собой Н, амино (NH2) или циано, предпочтительно представляет собой Н, W представляет собой О, R1 представляет собой Н, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, предпочтительно представляет собой Н или метил, Q представляет собой C1-C4-алкил, 2-оксо-2-(2,2,2-трифторэтиламино)-этил, замещенный фтором или 1-циано-пропилом или пиридином C1-C4-алкил, как например, 2,2,2-трифторэтил, 2,2-дифторэтил, 3,3,3-трифторпропил, пиридин-2-илметил или (1-циано-циклопропил)метил; C3-C4-циклоалкил, как например, циклопропил или циклобутил; необязательно замещенный C3-C4-циклоалкил, как например необязательно замещенный фторзамещенным C1-C4-алкилом циклопропил (например, 1-трифторметил-циклопропил, 1-третбутил-циклопропил), 1-тиокарбамоил-циклопропил, 1-карбамоил-циклопропил, 1-циано-циклопропил, транс-2-фторциклопропил, цис-2-фторциклопропил; С4-С6-гетероциклоалкил, как например оксетан-3-ил, тиетан-3-ил, 1-оксидо-тиетан-3-ил, или 1,1-диоксидо-тиетан-3-ил; или в каждом случае необязательно замещенный C1-C4-алкилом бензил; пиразол (как например, N-метил-пиразол-3-ил), пиридин; метилсульфонил; или 2-оксо-2-(2,2,2-трифтороэтиламино)этил, предпочтительно представляет собой замещенный фтором C1-C3-алкил, как например 2,2,2-трифторэтил или 3,3,3-трифторопропил; циклопропил; необязательно замещенный циклопропил, как например 1-циано-циклопропил или 1-трифторметил-циклопропил, тиетан-3-ил; или 2-оксо-2-(2,2,2-трифтороэтил)аминоэтил, A1 представляет собой CR2 или N, А2 представляет собой CR3 или N, A3 представляет собой CR4, и A4 представляет собой CR5 или N, причем R2 представляет собой Н, C1-C4-алкил или галоген (как например, метил, F, Cl или Н), R3 представляет собой Н или галогенированный C1-C4-алкил (как например, Н или -CF3), R4 представляет собой Н, C1-C4-алкил, C1-C4-алкиламин (как например, -NH-CH3), циклопропиламин, C1-C4-алкокси (как например, -О-СН3), C1-C4-алкокси-C1-C4-алкиламин (как например, NH-CH2-CH2-O-CH3) или галоген (как например, F или Cl).
В другом предпочтительном варианте выполнения настоящего изобретения R6 представляет собой перфторированный C1-C3-алкил (например, перфторметил) и R10 представляет собой Cl, Br или F, особенно предпочтительно представляет собой Cl или Br.
Формула (Ia'')
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (Ia'')

в которой один D, выбранный из D1 и D2 представляет собой N, и в каждом случае другой D, выбранный из D1 и D2, представляет собой О; или D4 представляет собой N, и один D, выбранный из D1 и D5, представляет собой N; или D3 представляет собой N, и D1, D2 и D5 представляет собой C-R11, и D4 представляет собой С, и все остальные параметры имеют значения, как описано в абзаце [0012].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (Ia''), в которой R8 представляет собой в каждом случае замещенный (С1-С6)-Алкил, (C1-C6)-алкокси или алкилсульфанил, причем заместители выбираются из галогена и гидрокси, причем по меньшей мере одним заместителем является галоген, и один D, выбранный из D1 и D2, представляет собой N, и в каждом случае другой D, выбранный из D1 и D2, представляет собой О; или D4 представляет собой N, и один D, выбранный из D1 и D5, представляет собой N; или D3 представляет собой N, и D1, D2 и D5 представляют собой C-R11, и D4 представляет собой С, и все остальные параметры имеют значения, как описано в абзаце [0012].
В одном предпочтительном варианте выполнения настоящего изобретения, самое большее, одна (1) Группа В1-В5 представляет собой N (другими словами: одна (1) группа B1-В5 представляет собой N); или ни одна группа (0) B1-В5 не представляет собой N (B1-В5 представляет собой CR6, CR7, CR8, CR9 и CR10).
В другом предпочтительном варианте выполнения настоящего изобретения R6, R7, R9 и R10 (когда соответствующая группа В представляет собой CR) независимо друг от друга представляют собой Н, галоген, циано, нитро, в каждом случае необязательно замещенный C1-C4-алкил, C3-C4-циклоалкил, C1-C4-алкокси, N-алкоксииминоалкил, C1-C4-алкилсульфанил, C1-C4-алкилсульфинил, C1-C4-алкилсульфонил, N-C1-C4-алкиламино, N,N-Ди-C1-C4-алкиламино.
В другом предпочтительном варианте выполнения настоящего изобретения R6, R7, R9 и R10 независимо друг от друга представляют собой Н, галоген, циано, нитро, метил, этил, фторметил, дифторметил, хлордифторметил, трифторметил, 2,2,2-трифторэтил, метокси, этокси, н-пропокси, 1-метилэтокси, фторметокси, дифтор-метокси, хлор-дифторметокси, дихлор-фторметокси, трифторметокси, 2,2,2-трифторэтокси, 2-хлор-2,2-дифторэтокси, пентафторэтокси, N-метоксииминометил, 1-(N-метоксиимино)-этил, метилсульфанил, трифторметил-сульфанил, метилсульфонил, метилсульфинил, трифторметилсульфонил, трифторметилсульфинил.
В другом предпочтительном варианте выполнения настоящего изобретения R6 и R10 независимо друг от друга представляет собой Н, галоген (наиболее предпочтительно хлор, бром, фтор), циано, нитро, метил, этил, дифторметил, хлордифторметил, трифторметил, метокси, этокси, 1-метилэтокси, дифторметокси, хлордифторметокси, дихлор-фторметокси, трифторметокси, 2,2,2-трифторэтокси, 2-хлор-2,2-дифторэтокси, метилсульфанил, трифторметилсульфанил, метилсульфонил, метилсульфинил, трифторметилсульфонил, трифторметилсульфинил.
В другом предпочтительном варианте выполнения настоящего изобретения R6 и R10 представляют собой описанные в настоящей заявке заместители, однако, R6 и R10 не одновременно в соединении представляет собой Н. Другими словами, если R6 в соединении представляет собой Н, R10 представляет собой другой описанный в настоящей заявке заместитель, и наоборот.
В другом предпочтительном варианте выполнения настоящего изобретения R6 и R10 в каждом случае представляют собой заместитель, выбранный из галогена (предпочтительно Cl, Br или F), C1-C3-алкила, замещенного галогеном C1-C3-алкила, C1-C3-алкокси или замещенного галогеном C1-C3-алкокси.
В другом предпочтительном варианте выполнения настоящего изобретения R6 и R10 в каждом случае представляют собой галоген (как например, Cl, Br или F), в каждом случае представляет собой C1-C3-алкил, или в каждом случае представляют собой замещенный галогеном C1-C3-алкил, как например, перфторированный C1-C3-алкил (перфторметил, перфторэтил или перфторпропил).
В другом предпочтительном варианте выполнения настоящего изобретения R6 представляет собой перфторированный C1-C3-алкил (например, перфторметил) и R10 представляет собой Cl, Br или F, особенно предпочтительно представляет собой Cl или Br.
Т46-Метил
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой метил, Т представляет собой Т46, R11 в Т46 представляет собой Н, W представляет собой О, и все другие параметры имеют значения, как описано в абзаце [0085] и [0113].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой метил, Т представляет собой Т46, R11 вТ46 представляет собой Н, W представляет собой О, A1 представляет собой CR2, А2 представляет собой CR3 или N, А3 представляет собой CR4, A4 представляет собой CR5, B1 представляет собой CR6, В2 представляет собой CR7, В3 представляет собой CR8, B4 представляет собой CR9, В5 представляет собой CR10, и все другие параметры имеют значения, как описано в абзаце [0085] и [0113].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой метил, Т представляет собой Т46, R11 в Т46 представляет собой Н, W представляет собой О, A1 представляет собой СН, А2 представляет собой СН или N, A3 представляет собой CR4, A4 представляет собой СН, B1 представляет собой CR6, В2 представляет собой СН, В3 представляет собой CR8, B4 представляет собой СН, В5 представляет собой CR10, причем R6 и R10 в каждом случае представляют собой заместитель, выбранный из галоген (предпочтительно хлор, бром или фтор), C1-C3-алкил, замещенный галогеном C1-C3-алкил, C1-C3-алкокси или замещенный галогеном C1-C3-алкокси, и все другие параметры имеют значения, как описано в абзаце [0085] и [0113].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой метил, Т представляет собой Т46, R11 в Т46 представляет собой Н, W представляет собой О, A1 представляет собой СН, А2 представляет собой СН или N, А3 представляет собой CR4, A4 представляет собой СН, B1 представляет собой CR6, В2 представляет собой СН, В3 представляет собой CR8, B4 представляет собой СН, B5 представляет собой CR10, причем R6 и R10 в каждом случае представляют собой заместитель, выбранный из галоген (предпочтительно хлор, бром или фтор), C1-C3-алкил, замещенный галогеном C1-C3-алкил, C1-C3-алкокси или замещенный галогеном C1-C3-алкокси, и все другие параметры имеют значения, как описано в абзаце [0085] и [0113].
Т46-Н
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой Н, Т представляет собой Т46, R11 в Т46 представляет собой Н, W представляет собой О, и все другие параметры имеют значения, как описано в абзаце [0085] и [0112].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой Н, Т представляет собой Т46, R11 в Т46 представляет собой Н, W представляет собой О, A1 представляет собой CR2, А2 представляет собой CR3 или N, А3 представляет собой CR4, A4 представляет собой CR5, B1 представляет собой CR6, B2 представляет собой CR7, В3 представляет собой CR8, B4 представляет собой CR9, B5 представляет собой CR10, и все другие параметры имеют значения, как описано в абзаце [0085] и [0113].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой Н, Т представляет собой Т46, R11 в Т46 представляет собой Н, W представляет собой О, A1 представляет собой СН, А2 представляет собой СН или N, А3 представляет собой CR4, А4 представляет собой СН, В1 представляет собой CR6, В2 представляет собой СН, B3 представляет собой CR8, В4 представляет собой СН, В5 представляет собой CR10, причем R6 и R10 в каждом случае представляют собой заместитель, выбранный из галоген (предпочтительно хлор, бром или фтор), C1-C3-алкил, замещенный галогеном C1-C3-алкил, C1-C3-алкокси или замещенный галогеном C1-C3-алкокси, и все другие параметры имеют значения, как описано в абзаце [0085] и [0113].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения формулы (I), в которой R1 представляет собой Н, Т представляет собой Т46, R11 в Т46 представляет собой Н, W представляет собой О, A1 представляет собой СН, А2 представляет собой СН или N, A3 представляет собой CR4, A4 представляет собой СН, B1 представляет собой CR6, В2 представляет собой СН, B3 представляет собой CR8, В4 представляет собой СН, В5 представляет собой CR10, причем R6 и R10 в каждом случае представляют собой заместитель, выбранный из галогена (предпочтительно хлор, бром или фтор), C1-С3-алкила, замещенного галогеном C1-C3-алкила, C1-C3-алкокси или замещенного галогеном C1-С3-алкокси, и все другие параметры имеют значения, как описано в абзаце [0085] и [0113].
Другим вариантом выполнения настоящего изобретения являются Соединения формулы (I-T46):

в которой
R1, A1, A2, А3, A4, R11, B1, В2, B4, В5, R8, R11 Q и W определены, как описано в настоящей заявке, причем, самое большее, одна группа, выбранная из A1, A2, A3, A4, представляет собой N, и, самое большее, одна группа, выбранная из B1, В2, B3, B4, и B5 представляет собой N; или причем одна или две группы, выбранные из A1, A2, A3, A4, могут представлять собой N и, самое большее, одна группа, выбранная из В1, B2, В3, B4, и B5 представляет собой N.
Другим вариантом выполнения настоящего изобретения являются соединения формулы (I-T2), (I-T3), (I-T4), (I-T22), (I-T23) или (I-T46), в которой R1, A1, A2, А3, A4, R11, B1, В2, B4, В5, R8, Q и W имеют значения, как описано в абзаце [0120].
Другим вариантом выполнения настоящего изобретения являются соединения формулы (I-T2), (I-T3), (I-T4), (I-T22), (I-T23) или (I-T46), в которой R1, A1, A2, А3, A4, R11, B1, В2, B4, B5, R8, Q и W имеют значения, как описано в абзаце [0121].
Другим предпочтительным вариантом выполнения настоящего изобретения являются соединения D-1a
Другим вариантом выполнения настоящего изобретения является применение соединения D-1a для получения соединения формулы (I).
Следующим вариантом выполнения настоящего изобретения является способ получения соединения Формула (I), в которой предпочтительно Т=Т4, охватывающий применение соединения D-1a, предпочтительно в последовательности реакций согласно реакционной схеме 4.
Другим вариантом выполнения настоящего изобретения является соединение D-1b

Другим вариантом выполнения настоящего изобретения является применение соединения D-1b для получения соединения формулы (I).
Следующим вариантом выполнения настоящего изобретения является способ получения соединения Формула (I), в которой предпочтительно Т=Т4, охватывающий применение соединения D-1b, предпочтительно в последовательности реакций согласно реакционной схеме 4.
Другим вариантом выполнения настоящего изобретения является соединение D-1с

Другим вариантом выполнения настоящего изобретения является применение соединения D-1c для получения соединения формулы (I).
Следующим вариантом выполнения настоящего изобретения является способ получения соединения Формула (I), в которой предпочтительно Т=Т4, охватывающий применение соединения D-1c, предпочтительно в последовательности реакций согласно реакционной схеме 4.
Другим вариантом выполнения настоящего изобретения является соединения 2-(3,5-дихлор-4-гидразино-фенил)-1,1,1,3,3,3-гексафтор-пропан-2-ол.
Другим вариантом выполнения настоящего изобретения является применение соединения 2-(3,5-дихлор-4-гидразино-фенил)-1,1,1,3,3,3-гексафтор-пропан-2-ола для получения соединения формулы (I).
Следующим вариантом выполнения настоящего изобретения является способ получения соединения формулы (I), в которой предпочтительно Т=Т4, охватывающий применение соединения 2-(3,5-дихлор-4-гидразино-фенил)-1,1,1,3,3,3-гексафтор-пропан-2-ол, предпочтительно в последовательности реакций согласно реакционной схеме 4.
Экспериментальная часть
Способ получения I-T2
Пример I-T2-1


710 мг (2,24 ммоль) 1-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]этанон добавили к 401 мг (3,36 ммоль) N,N-диметилформамиддиметилацеталя, и смесь нагревали с возвратом флегмы в течение 5 часов. Для обработки смесь немного охладили, и все летучие составляющие выпарили на роторном испарителе в вакууме. Остаток подвергли хроматографии с применением картриджа, содержащего 40 г силикагеля, и градиента циклогексан/этилацетат от 90:10 до 50:50 (об./об.). Получили 675 мг 3-(Диметиламино)-1-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]проп-2-ен-1-она.

1,2 г (3,23 ммоль) 3-(даметиламино)-1-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]проп-2-ен-1-он добавили к 15,5 мл этанола, добавили 170 мг (3,39 ммоль) гидразин гидрата и 192 мг (3,2 ммоль) ледяной уксусной кислоты. Смесь перемешивали при комнатной температуре в течение 7 часов. Затем добавили еще 170 мг (3,39 ммоль) гидразин гидрата, и смесь перемешивали еще 4 часа при комнатной температуре. Так как превращение все еще было не полным, добавили еще 190 мг (3,2 ммоль) ледяной уксусной кислоты, и смесь перемешивали в течение 17 часов при 60°C. Для обработки смесь концентрировали на роторном испарителе в вакууме, и остаток распределили между этилацетатом и водой. Органическую фазу отделили, промыли водой, высушили над сульфатом натрия и концентрировали на роторном испарителе в вакууме. В качестве остатка получили 1,04 г (3-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]-1H-пиразола.

23 мл дихлорметана, 353 мг (4.46 ммоль) пиридина, 609 мг (3,35 ммоль) меди(II) ацетата, 958 мг (4.46 ммоль) 3-карбоксиметил-4-хлор-фенилбороновой кислоты и 760 мг (2.23 ммоль3-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]-1Н-пиразола загрузили, и затем добавили 1,1 г свежеизмельченных 3


609 мг (1.19 ммоль) 2-хлор-5-[3-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиразол-1-ил]бензойной кислоты сложного метилового эфира сначала загрузили в смеси 14 мл диоксана и 5 мл воды, добавили 53 мг (1.25 ммоль) гидрата гидроксида лития, и смесь перемешивали при комнатной температуре. Через 2 часа добавили еще 25 мг (0,6 ммоль) гидрата гидроксида лития, и смесь перемешивали при комнатной температуре еще один час. После этого летучие компоненты удалили на роторном испарителе в вакууме. Остаток распределили между разбавленной соляной кислотой и дихлорметаном. Органическую фазу отделили, и водную фазу дважды экстрагировали дихлорметаном. Объединенные органические фазы затем промыли насыщенным водным раствором хлорида натрия, высушили над сульфатом натрия и концентрировали на роторном испарителе в вакууме. В качестве остатка получили 554 мг 2-хлор-5-[3-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиразол-1-ил]бензойной кислоты.

100 мг (0,2 ммоль) 2-хлор-5-[3-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиразол-1-ил]бензойной кислоты сначала загрузили в 2 мл сухого толуола, затем добавили 120 мг (1 ммоль) тионилхлорида (SOCl2) и 1 каплю диметилформамида (DMF), и смесь нагревали с возвратом флегмы. После завершения выделения газа, смесь перемешивали с возвратом флегмы еще 30 минут и затем концентрировали на роторном испарителе в вакууме. Остаток растворили в 1 мл сухого дихлорметана и по каплям добавили в раствор 29 мг (0,5 ммоль) циклопропиламина в 1 мл дихлорметана при 0°C. Смесь перемешивали при комнатной температуре в течение 2 часов. Для обработки смесь перелили в 5% водный раствор гидрокарбоната натрия, и органическую фазу отделили, промыли насыщенным водным раствором хлорида натрия, высушили над сульфатом натрия и концентрировали на роторном испарителе в вакууме. Для очистки хроматографию осуществили с применением картриджа, содержащего 40 г силикагеля, и градиента циклогексан/этилацетат от 90:10 до 50:50 (об./об.). Получили 159,5 мг 2-хлор-N-циклопропил-5-[3-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиразол-1-ил]бензамида (соединение I-T2-1).
HPLC-MSa): logP=4,9, масса (m/z)=534 [М+Н]+.
1Н-ЯМР (400 МГц, d3-Ацетонитрил): δ (ppm)=8.29 (д, J=2,5 Гц, 1Н), 7,82-7,85 (м, 2Н), 7,52 (д, J=8.8 Гц, 1H), 7,44 (с, 2H), 6,97 (с (расширенный), 1Н (N-H)), 6,54 (д, J=2.5 Гц, 1H), 2,82-2,86 (м, 1Н), 0,74-0,79 (м, 2H), 0,59-0,61 (м, 2H).
Получение исходных соединений:

271 мг (11,1 мг атом) магниевой стружки загрузили, покрыли небольшим количество сухого тетрагидрофурана, и после добавления нескольких капель 3 г (8,49 ммоль) 2-бром-1,3-диметил-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]бензола (полученного согласно US 2003/187233, стр. 6, Пример 2/4 [0080]) в 10 мл сухого тетрагидрофурана добавили немного иода. Для начала реакции смесь нагрели до 60°C. После начала реакции остаток раствора, содержащего 2-бром-1,3-диметил-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]бензол, добавили по каплям при 60°C. После завершения добавления смесь перемешивали при 60°C еще один час. После этого смесь охладили до 0°C с помощью ледяной бани, и 1,86 г (25,4 ммоль) N,N-диметилформамид, растворенный в 5 мл сухого тетрагидрофурана, добавили по каплям. Затем смесь перемешивали без охлаждения до тех пор, пока смесь не достигла комнатной температуры. Для обработки смесь перелили в насыщенный водный раствор хлорида аммония. Фазы разделили, водную фазу экстрагировали этилацетатом. Объединенные органические фазы промыли насыщенным водным раствором хлорида натрия, высушили над сульфатом натрия и концентрировали на роторном испарителе в вакууме. В качестве остатка получили 2,34 г 2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]бензальдегида, который применяли на следующей стадии без очистки.

2,34 г (7,74 ммоль) 2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]бензальдегида сначала загрузили в 15,5 мл сухого тетрагидрофуран, и 2,58 мл (7,74 ммоль) 3 М раствора метилмагния иодида в диэтиловом простом эфире добавили по каплям при охлаждении на ледяной бане. Затем смесь перемешивали без охлаждения еще один час. Для обработки смесь перелили в 100 мл насыщенного водного раствора хлорида аммония. Смесь дважды экстрагировали этилацетатом. Объединенные органические фазы промыли насыщенным водным раствором хлорида натрия, высушили над сульфатом натрия и концентрировали на роторном испарителе в вакууме. Остаток хроматографировали с применением картриджа, содержащего 40 г силикагеля, и градиента циклогексан/этилацетат от 90:10 до 70:30 (об./об.), и получили 1,0 г 1-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]этанола.
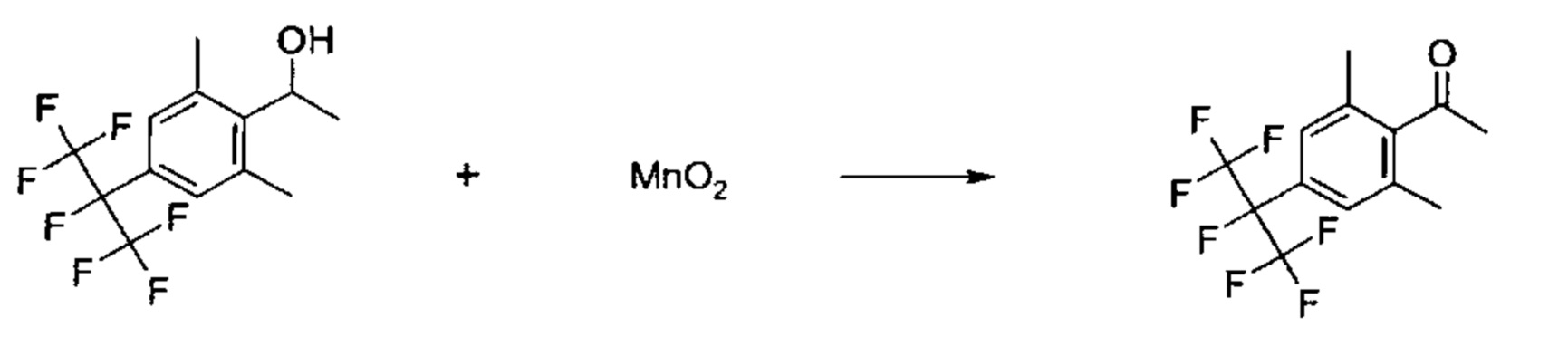
1,49 г (4,68 ммоль) 1-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]этанола сначала загрузили в 84 мл толуола, и добавили 10,8 г (124 ммоль) оксид марганца (IV). Смесь нагревали с возвратом флегмы при перемешивании в течение одного часа. Затем охладили, отфильтровали через слой кизельгура промыли этилацетатом. Фильтрат концентрировали на роторном испарителе в вакууме. Остаток подвергли хроматографии с применением картриджа, содержащего 50 г силикагеля, и градиента циклогексан/этилацетат от 95:5 до 70:30 (об./об.). Получили 1,03 г 1-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]этанона.
Способ получения I-T3
Пример I-T3-1:

Получение предшественника [2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]гидразина описано в литературе (US 2003/187233).
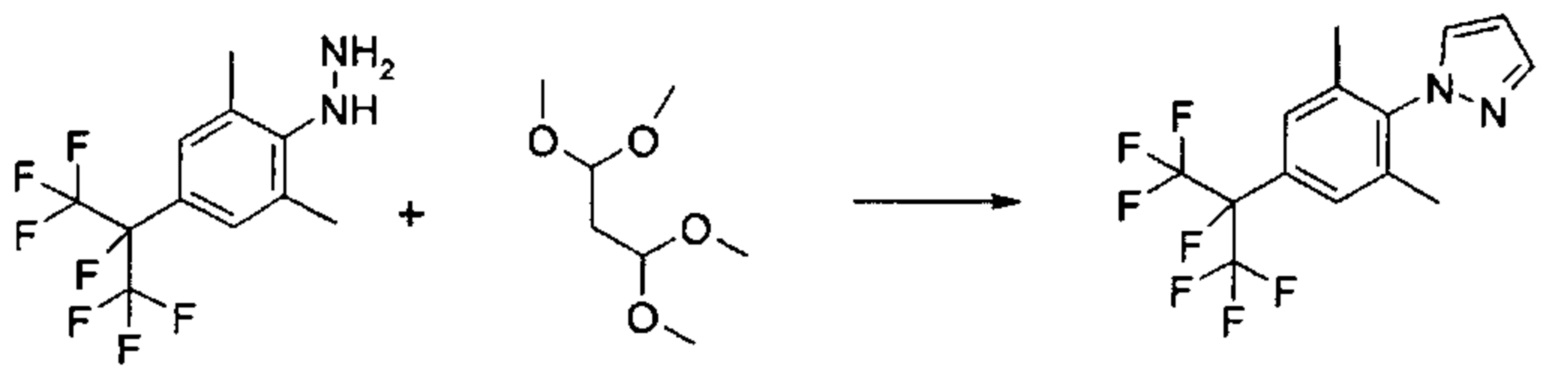
В колбу, объемом 25 мл, загрузили 3,41 г (11,2 ммоль) [2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]гидразина (свободное основание) в 13 мл этанола. Затем добавили 1,84 г (11,2 ммоль) тетраметоксипропана, и затем добавили 0,55 г (5,6 ммоль) 96% серной кислоты. Реакционную смесь нагревали с возвратом флегмы в течение 2 часов. Этанол выпарили на роторном испарителе в вакууме. Остаток распределили между этилацетатом и насыщенным водным раствором гидрокарбоната натрия. Органическую фазу отделили, высушили над сульфатом натрия и концентрировали на роторном испарителе в вакууме. Остаток отогнали в трубке с шаровым расширением в вакууме при 1 мбар и 150°C, и получили 2,5 г 1-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиразола.

В колбу, объемом 250 мл, загрузили 2,5 г (7,34 ммоль) 1-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиразола в 30 мл ацетонитрила, и добавили 8,3 г (36,9 ммоль) N-иод-сукцинимида в 50 мл ацетонитрила. Затем смесь нагревали с возвратом флегмы. Для обработки смесь концентрировали, и остаток распределили между водой и этилацетатом. Органическую фазу отделили, сначала промыли насыщенным водным раствором гидросульфита натрия, затем насыщенным раствором хлорида натрия, высушили над сульфатом натрия, и концентрировали. Остаток очистили с помощью хроматографии на силикагеле с помощью градиента от 90:10 до 70:30 (об./об.) циклогексан/этилацетат. После концентрации фракций, содержащих продукт, получили 2,5 г остатка, который состоял из 1-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]-4-иод-пиразола и некоторого количества толуола.

В колбу, объемом 100 мл, загрузили 280 мг (0,6 ммоль) 1-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]-4-иод-пиразола и 0,129 г (0,60 ммоль) [4-хлор-3-(метоксикарбонил)фенил]бороновой кислоты в 21 мл изопропанола, и наконец 1,84 мл (1,84 ммоль) дегазированного одномолярного раствора гидрокарбоната натрия. Получили 0,035 г (0,03 ммоль) тетракис(трифенилфосфин)палладия (0). Затем смесь нагревали с возвратом флегмы. Для обработки смесь концентрировали на роторном испарителе, и остаток распределили между водой и этилацетатом. Органическую фазу отделили, один раз промыли насыщенным раствором хлорида натрия и концентрировали на роторном испарителе в вакууме. Остаток очистили с помощью хроматографии на силикагеле, применяя градиент от 90:10 до 70:30 (об./об.) циклогексана/этилацетата, и получили 151 мг 2-хлор-5-[1-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиразол-4-ил] бензойной кислоты сложного метилового эфира.
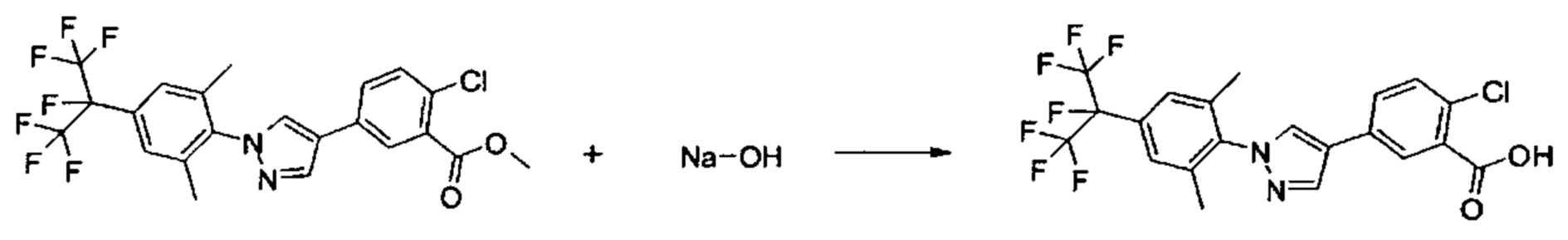
0,151 г (0,29 ммоль) 2-хлор-5-[1-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиразол-4-ил]бензойной кислоты сложного метилового эфира загрузили в 11 мл метанола, и добавили 0,3 мл (0,3 ммоль) 1 М раствора гидроксида натрия. Затем смесь нагревали с возвратом флегмы в течение 6 часов, избыток растворителя выпарили в вакууме, остаток растворили в разбавленной соляной кислоте и трижды экстрагировали этилацетатом. Объединенные экстракты промыли насыщенным раствором хлорида натрия, высушили над сульфатом натрия, и получили 130 мг 2-хлор-5-[1-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиразол-4-ил]бензойной кислоты.

0,134 г (0,27 ммоль) 2-хлор-5-[1-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиразол-4-ил]бензойной кислоты растворили в 1,26 мл толуола, и добавили 0,161 г (1,35 ммоль) тионилхлорида. Смесь нагрели до 80°C в течение 2 часов. Затем концентрировали в вакууме. Остаток растворили в 1,26 мл дихлорметана и по каплям добавили в раствор 39 мг (0,67 ммоль) циклопропиламина в 0,63 мл дихлорметана при 0°C при охлаждении, и раствор охладили. Для обработки добавили 5% водного раствора дигидрофосфата натрия, и органическую фазу отделили, высушили над сульфатом натрия и концентрировали на роторном испарителе в вакууме. Остаток отделили на силикагеле с применением градиента циклогексан/этилацетат от 9:1 до 7:3 (об./об.), и получили 46 мг 2-хлор-N-циклопропил-5-[1-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиразол-4-ил]бензамида (соединение I-T3-1).
HPLC-MSa): logP=4,36, масса (m/z) = 534 [М+Н]+.
1H-ЯМР (400 МГц, d3-Ацетонитрил): δ=8,11 (с, 1H), 8,06 (с, 1H), 7,68 (д, J1=2,2 Гц, 1H), 7,62-7,65 (дд, J1=8,4 Гц, J2=2,2 Гц, 1Н), 7,45 (д, J=8,4 Гц, 1H), 6,9 (с (расширенный), 1Н (N-H)), 3,97 (с, 3Н), 2,82-2,88 (м, 1H), 0,76-0,8 (м, 2H), 0,57-0,61 (м, 2H).
Примеры I-T3-48 и IT-T3-50

2,46 г (5,9 ммоль) метил-2-хлор-5-[1-[2,6-дифтор-4-(трифторметил)фенил]пиразол-4-ил]бензоата загрузили в 127 мл метанола, и добавили 5,9 мг (5,9 ммоль) 1 молярного раствора гидроксида натрия. Смесь нагревали с возвратом флегмы в течение 2 часов. После этого смесь охладили, и большую часть этанола удалили на роторном испарителе в вакууме. Водный остаток экстрагировали дихлорметаном. Экстракт отделили. Значение pH водной фазы довели до 1 с помощью 33% соляной кислоты, и дважды экстрагировали дихлорметаном. Объединенные экстракты промыли насыщенным водным раствором хлорида натрия, высушили над сульфатом натрия, и концентрировали. Получили 1,41 г остатка в виде 45:55 (LC/MS-площади) смеси 2-хлор-5-[1-[2,6-дифтор-4-(трифторметил)фенил]пиразол-4-ил]бензойной кислоты и 2-хлор-5-[1-[2-фтор-6-метокси-4-(трифторметил)фенил]пиразол-4-ил] бензойной кислоты.

700 мг (около 1,7 ммоль) 45:55 (LC/MS-площади) смеси 2-хлор-5-[1-[2,6-дифтор-4-(трифторметил)фенил]пиразол-4-ил]бензойной кислоты и 2-хлор-5-[1-[2-фтор-6-метокси-4-(трифторметил)фенил]пиразол-4-ил]бензойной кислоты растворили в 6,6 мл толуола, и добавили 1,34 г (8,7 ммоль) тионилхлорида. Смесь нагревали в течение двух часов до 80°C. Затем все летучие компоненты удалили на роторном испарителе в вакууме. Остаток растворили в 3,3 мл дихлорметана и добавили по каплям к раствору 248 мг (4,34 ммоль) циклопропиламина в 3,3 мл дихлорметана при 0°C. Смесь затем перемешивали без охлаждения в течение двух часов. После этого раствор промыли с помощью 5% водного раствора дигидрофосфата натрия, высушили с помощью сульфата натрия и концентрировали. Остаток подвергли хроматографии с применением картриджа, содержащего 40 г силикагеля, и градиента циклогексан/этилацетат от 90:10 до 50:50 (об./об.). Получили 240 мг 2-хлор-N-циклопропил-5-[1-[2,6-дифтор-4-(трифторметил)фенил]пиразол-4-ил]бензамида (Пример I-T3-48)
HPLC-MSa): logP = 3,2, масса (m/z) = 442 [М+Н]+.
1Н-ЯМР (400 МГц, d3-Ацетонитрил): δ (ppm) = 8,26 (с, 1H), 8,19 (с, 1Н), 7,61-7,69 (м, 4Н), 7,46 (д, J=8,3 Гц, 1H), 6,94 (с, 1Н (расширенный)), 2,82-2,88 (м, 1Н), 0,75-0,80 (м, 2H), 0,58-0,62 (м, 2H).
И получили 2-хлор-N-циклопропил-5-[1-[2-фтор-6-метокси-4-(трифторметил)фенил]пиразол-4-ил]бензамид (Пример I-T3-50).
HPLC-MSa): logP = 3,1, масса (m/z) = 454 [М+Н]+.
1Н-ЯМР (400 МГц, d3-Ацетонитрил): δ (ppm) = 8,13 (с, 1H), 8,11 (с, 1Н), 7,67 (д, J=2,2 Гц, 1H), 7,62 (дд, J1=8,3 Гц, J2=2,2 Гц, 1H), 7,45 (д, J=8,3 Гц, 1H), 7,32 (с, 1H), 7,30 (с, 1H), 6,91 (с, 1Н (расширенный)), 3,90 (с, 3Н), 2,83-2,87 (м, 1H), 0,75-0,79 (м, 2H), 0,57-0,61 (м, 2H).
Пример I-T3-121:

4,6 мл (49,6 ммоль) фосфороксихлорида загрузили, и ввели 1,3 г (7,44 ммоль) 5-хлор-2-оксо-1Н-пиримидин-6-карбоновой кислоты (коммерчески доступной или получаемой согласно способам, известным из литературы (например, Gacek, Michel; Ongstad, Leif; Undheim, Kjell; Acta Chemica Scandinavica, Series B: Organic Chemistry and Biochemistry B33(2), (1979), Стр. 150-1)). Смесь постепенно нагревали и хранили в течение 2 часов с возвратом флегмы. После этого смесь немного охладили, и избыток фосфороксихлорида удалили на роторном испарителе в вакууме. К остатку добавили 20 мл сухого этанола, и смесь затем перемешивали при комнатной температуре всю ночь. После этого избыток этанола удалили на роторном испарителе в вакууме. Остаток растворили в дихлорметане и трижды промыли насыщенным водным раствором гидрокарбоната натрия. Водные фазы повторно экстрагировали с помощью дихлорметана, затем объединенные органические фазы промыли насыщенным водным раствором хлорида натрия, высушили над сульфатом натрия и концентрировали на роторном испарителе в вакууме. Остаток подвергли хроматографии с применением картриджа, содержащего 15 г силикагеля, и градиента от чистого циклогексана до циклогексан/этилацетата 50:50 (об./об.), и получили 115 мг 2,5-дихлоропиримидин-4-карбоновой кислоты этиловый сложный эфир.

В нагреваемую трехгорлую колбу, объемом 25 мл загрузили 5,94 мл (7,72 ммоль) 1,3 молярного раствора комплекса изопропил-магния хлорида/хлорида лития, и по каплям добавили раствор 4-иод-1-[2-метил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-6-(трифторметил)фенил]пиразола (для получения смотрите Пример I-T3-1) в 3,4 мл сухого тетрагидрофурана. Перемешивание смеси при комнатной температуре продолжали всю ночь, и затем смесь охладили до -20°C, и по каплям добавили 1,63 г (10,2 ммоль) 2-метокси-4,4,5,5-тетраметил-1,3,2-диоксаборолана. Смесь перемешивали в течение еще одного часа при 0-10°C. Для обработки смесь перелили в 30 мл насыщенного водного раствора хлорида аммония и разбавили циклогексаном. Фазы разделили, водную фазу повторно экстрагировали циклогексаном. Объединенные органические фазы сначала промыли насыщенным водным раствором гидрокарбоната натрия и затем насыщенным водным раствором хлорида натрия, высушили над сульфатом натрия и концентрировали на роторном испарителе в вакууме. После хроматографии с применением 40 г картриджа с силикагелем и градиента чистый циклогексан - циклогексан/этилацетат 80:20 (об./об.) получили 0,6 г 1-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиразола.

155 мг (0,7 ммоль) 2,5-дихлоропиримидин-4-карбоновой кислоты этилового сложного эфира и 327 мг (0,7 ммоль) 1-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиразола загрузили в 25 мл диоксана, и добавили 234 мг (2,2 ммоль) карбоната натрия и 1,25 мл воды. Смесь дегазировали аргоном, и затем добавили 81 мг (0,07 ммоль) тетракис(трифенилфосфин)палладия (0). Смесь снова дегазировали аргоном и перемешивали при 100°C всю ночь. На следующее утро смесь охладили, и растворитель удалили на роторном испарителе в вакууме. Остаток распределили между водой и этилацетатом. Органическую фазу отделили, промыли насыщенным водным раствором хлорида натрия и затем концентрировали на роторном испарителе в вакууме. Для очистки хроматографию осуществили с применением 15 г картриджа, содержащего силикагель, и градиента от чистого циклогексана до смеси циклогексан/этилацетат 70:30 (об./об.). Получили 120 мг 5-хлор-2-[1-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиразол-4-ил]пиримидин-4-карбоновой кислоты этилового сложного эфира.

0,120 г (0,23 ммоль) 5-хлор-2-[1-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиразол-4-ил]пиримидин-4-карбоновой кислоты этилового сложного эфира загрузили в смесь 4,1 мл диоксана и 1,44 мл воды, и добавили 31 мг (0,74 ммоль) моногидрата гидроксида лития. Затем смесь перемешивали при комнатной температуре в течение 4 часов, затем избыток растворителя выпарили в вакууме, и остаток растворили в разбавленной соляной кислоте и трижды экстрагировали дихлорметаном. Объединенные экстракты промыли насыщенным водным раствором хлорида натрия, высушили над сульфатом натрия и концентрировали, с получением 115 мг неочищенной 5-хлор-2-[1-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиразол-4-ил]пиримидин-4-карбоновой кислоты.

0,110 г (0,22 ммоль) неочищенной 5-хлор-2-[1-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиразол-4-ил]пиримидин-4-карбоновой кислоты растворили в 2 мл толуола, и добавили 0,132 г (1,1 ммоль) тионилхлорида и одну каплю диметилформамида. Смесь в течение двух часов нагрели до 80°C. Затем концентрировали в вакууме. Остаток растворили в 1 мл дихлорметана и по каплям добавили в раствор 32 мг (0,55 ммоль) циклопропиламина в 1 мл дихлорметана при 0°C при охлаждении, и затем смесь перемешивали в течение 2 часов без охлаждения. Для обработки добавили 5% водный раствор дигидрофосфата натрия, и органическую фазу удалили, высушили над сульфатом натрия и концентрировали на роторном испарителе в вакууме. Остаток подвергли хроматографии с применением 15 г картриджа, содержащего силикагель, и градиента циклогексан/этилацетат от 9:1 до 7:3 (об./об.), и получили 49 мг 5-хлор-N-циклопропил-2-[1-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиразол-4-ил]пиримидин-4-карбоксамида (соединения I-T3-121).
HPLC-MSa): logP = 4,5, масса (m/z) = 536 [М+Н]+.
1Н-ЯМР (400 МГц, d3-Ацетонитрил): δ (ppm)=8,84 (с, 1H), 8,46 (с, 1H), 8,44 (с, 1H), 7,87 (с, 1Н (расширенный)), 7,55 (с, 2H), 2,84-2,91 (м, 1H), 2,2 (с, 6Н), 0,79-0,83 (м, 2H), 0,64-0,68 (м, 2H).
Пример I-T3-134:

К смеси, охлажденной до 0°C, 6.5 мг (0.163 ммоль) гидрида натрия (60% в минеральном масле) в 2 мл сухого тетрагидрофурана добавили 49.3 мг (0,08 ммоль) 2-хлор-N-циклопропил-5-{1-[4-(1,1,1,2,3,3,3-гептафторпропан-2-ил)-2-(трифторметил)фенил]-1Н-пиразол-4-ил}бензамида. Через 30 минут добавили 35 мг (0.24 ммоль) метилиодида, и смесь перемешивали при 0°C в течение 1 часа, затем нагревали до комнатной температуры в течение 1 часа и перемешивали при комнатной температуры в течение еще 14 часов. Затем к смеси добавили воду, экстрагировали этилацетатом, органическую фазу высушили над сульфатом натрия, и растворитель удалили при пониженном давлении. Остаток очистили с помощью хроматографии на обращено-фазовом силикагеле (С18) с применением воды/ацетонитрила (градиента) в качестве элюента. Получили 40.0 мг (0.068 ммоль, 78%) 2-хлор-N-циклопропил-5-[5-[2,6-дихлор-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]изоксазол-3-ил]бензамида (соединение I-T3-134).
HPLC-MSa): logP = 4.88, масса (m/z) = 588 [М+Н]+.
1Н-ЯМР (400 МГц, d6-DMSO): δ (ppm) = 8,82 (с, 1H), 8,43 (с, 1H), 8,25 (д, 1H), 8,11 (д, 1H), 8,06 (д, 1H), 7,81 (д, 1H), 7,75 (м, 1H), 7,54 (д, 1H), 3,02 (с, 3Н), 2,72 (м, 1H), 0,55 (м, 2H), 0,46 (м, 2H).
Пример I-T3-156:
2-Хлор-N-циклопропил-5-{1-[3-(этилсульфанил)-5-(1,1,1,2,3,3,3-гептафторпропан-2-ил)пиридин-2-ил]-1Н-пиразол-4-ил}бензамид

2-(4-бром-1Н-пиразол-1-ил)-3-хлор-5-(1,1,1,2,3,3,3-гептафторпропан-2-ил)пиридин
1,0 г (3,16 ммоль) 2,3-дихлор-5-(1,1,1,2,3,3,3-гептафторпропан-2-ил)пиридина добавили по каплям к суспензии 0,51 г (3,48 ммоль) 4-бром-1Н-пиразола и 2,58 г (7,91 ммоль) карбоната цезия в 10,0 мл диметилформамида ч.д.а. Реакционную смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь затем разбавили этилацетатом и затем промыли полунасыщенным водным раствором хлорида аммония. Водную фазу затем повторно экстрагировали этилацетатом, и объединенные органические фазы затем промыли дистиллированной водой и насыщенным раствором хлорида натрия. Органическую фазу высушили над сульфатом магния, отфильтровали и концентрировали на роторном испарителе при пониженном давлении. Неочищенный продукт очистили с помощью колоночной хроматографии на силикагеле.
Получили 1,34 г (3,14 ммоль) 2-(4-бром-1H-пиразол-1-ил)-3-хлор-5-(1,1,1,2,3,3,3-гептафторпропан-2-ил)пиридина в виде бесцветного масла.
HPLC-MSa): logP = 4,74, масса (m/z) = 428 [М+Н]+.
1Н-ЯМР (400 МГц, D6-DMSO): 8,90 (с, 1Н), 8,67 (с,1Н), 8,63 (д, 1Н), 8,06 (с, 1Н).
2-Хлор-5-{1-[3-хлор-5-(1,1,1,2,3,3,3-гептафторпропан-2-ил)пиридин-2-ил]-1H-пиразол-4-ил}-N-циклопропилбензамид
150 мг (0,35 ммоль) 2-(4-бром-1H-пиразол-1-ил)-3-хлор-5-(1,1,1,2,3,3,3-гептафторпропан-2-ил)пиридина, 136 мг (0,42 ммоль) 2-хлор-N-циклопропил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензамида, 59 мг (0,70 ммоль) гидрокарбоната натрия и 20 мг тетракис(трифенилфосфин)палладия (0,01 ммоль) растворили в смеси 1,5 мл диоксана и 0,5 мл дистиллированной воды. Растворители насытили аргоном в течение 30 минут перед применением, путем пропускания газа аргона через растворители. Реакционную смесь нагрели на масляной бане до 100°C в течение 16 часов. После охлаждения реакционной смеси до комнатной температуры, смесь смешали с водой, и неочищенный продукт повторно экстрагировали этилацетатом. Объединенные органические фазы высушили над сульфатом магния и отфильтровали через силикагель. Растворители удалили на роторном испарителе при пониженном давлении. Неочищенный продукт очистили с помощью колоночной хроматографии на силикагеле.
Получили 25 мг (0,05 ммоль) 2-хлор-5-{1-[3-хлор-5-(1,1,1,2,3,3,3-гептафторпропан-2-ил)пиридин-2-ил]-1H-пиразол-4-ил}-N-циклопропилбензамида в качестве бесцветного твердого вещества.
HPLC-MSa): logP = 4,08, масса (m/z) = 541 [М+Н]+.
1H-ЯМР (400 МГц, D6-DMSO): 9,02 (с, 1Н), 8,89 (с, 1Н), 8,61 (д, 1Н), 8,54-8,52 (м, 1Н), 8,50 (с, 1Н), 7,83-7,81 (м, 2Н), 7,52 (д, 1Н), 2,87-2,81 (м, 1Н), 0,74-0,65 (м, 2Н), 0,60-0,50 (м, 2Н)
2-Хлор-N-циклопропил-5-{1-[3-(этилсульфанил)-5-(1,1,1,2,3,3,3-гептафторпропан-2-ил)пиридин-2-ил]-1H-пиразол-4-ил}бензамид
300 мг (0,55 ммоль) 2-хлор-5-{1-[3-хлор-5-(1,1,1,2,3,3,3-гептафторпропан-2-ил)пиридин-2-ил]-1H-пиразол-4-ил}-N-циклопропилбензамида растворили в 5,0 мл DMF абс. И охладили с помощью бани сухой лед/ацетон. К охлажденной реакционной смеси добавили по каплям раствор 81,6 мг (0,97 ммоль) этантиолат натрия в 5 мл DMF абс. Через 3 часа реакционную смесь нагрели до комнатной температуры и осторожно перелили в воду. Неочищенный продукт повторно экстрагировали этилацетатом. Объединенные органические фазы промыли насыщенным водным раствором хлорида натрия, высушили над сульфатом магния, отфильтровали и концентрировали на роторном испарителе при пониженном давлении. Неочищенный продукт очистили с помощью колоночной хроматографии на силикагеле.
Получили 226 мг (0,40 ммоль) 2-хлор-N-циклопропил-5-{1-[3-(этилсульфанил)-5-(1,1,1,2,3,3,3-гептафторпропан-2-ил)пиридин-2-ил]-1H-пиразол-4-ил}бензамид в виде бесцветного твердого вещества.
HPLC-MSa): logP = 4,69, масса (m/z) = 567 [М+Н]+.
1Н-ЯМР (400 МГц, D6-DMSO): 9,08 (д, 1Н), 8,59 (д, 1H), 8,53 (д, 1H), 8,47 (с, 1H), 8,02 (д, 1H), 7,85-7,82 (м, 2Н), 7,53-7,50 (м, 1Н), 3,08 (кв, 2Н), 2,87-2,81 (м, 1H), 1,22 (т, 3H), 0,74-0,69 (м, 2Н), 0,58-0,54 (м, 2Н).
Пример I-T3-157:
2-Хлор-N-циклопропил-5-{1-[3-(этилсульфинил)-5-(1,1,1,2,3,3,3-гептафторпропан-2-ил)пиридин-2-ил]-1H-пиразол-4-ил}бензамид

100 мг (0,17 ммоль) 2-хлор-N-циклопропил-5-{1-[3-(этилсульфанил)-5-(1,1,1,2,3,3,3-гептафторпропан-2-ил)пиридин-2-ил]-1H-пиразол-4-ил}бензамид растворли в 10,0 мл дихлорметана и охладили на масляной бани. По частям добавили 43,5 мг 3-хлорпербензойной кислоты. Реакционную смесь перемешивали при охлаждении льдом в течение 2-х часов. Реакционную смесь смешали с 5 мл 1Н раствора гидроксида натрия. Через 5 минут водную фазу отделили. После проверки на пероксиды органическую фазу концентрировали на роторном испарителе при пониженном давлении. Неочищенный продукт очистили с помощью колоночной хроматографии на силикагеле.
Получили 61 мг 2-хлор-N-циклопропил-5-{1-[3-(этилсульфинил)-5-(1,1,1,2,3,3,3-гептафторпропан-2-ил)пиридин-2-ил]-1H-пиразол-4-ил}бензамида в качестве бесцветного твердого вещества.
HPLC-MSa): logP = 3,79, масса (m/z) = 583 [М+Н]+.
1H-ЯМР (400 МГц, D6-DMSO): 9,36 (с, 1H), 8,96 (д, 1H), 8,63 (с, 1Н), 8,58 (с, 1Н), 8,53 (д, 1H), 7,91 (с, 1H), 7,89 (д, 1H), 7,53 (д, 1Н), 3,45-3,30 (м, 1H ниже воды), 2,95-2,88 (м, 1Н), 2,86-2,81 (м, 1Н), 1,08 (т, 3H), 0,74-0,69 (м, 2Н), 0,60-0,50 (м, 2Н).
Получение исходных соединений
2,3-дихлор-5-(1,1,1,2,3,3,3-гептафторпропан-2-ил)пиридин

1. Стадия: 3-Хлор-5-(1,1,1,2,3,3,3-гептафторпропан-2-ил)пиридин-2-амин
130,6 г (750 ммоль) дитионита натрия добавили к охлажденной до температуры 0-5°C смеси 64,3 г (500 ммоль) 3-хлорпиридин-2-амина, 222 г (750 ммоль) 1,1,1,2,3,3,3-гептафтор-2-иодпропана и 126 г (1500 ммоль) гидрокарбоната натрия в 2000 мл смеси 3:1 ацетонитрила/воды (об./об.) под защитным газом. Реакционную смесь перемешивали при комнатной температуре в течение 48 часов. Ацетонитрил удалили на роторном испарителе при пониженном давлении. Остаток разбавили с помощью 500 мл воды. Неочищенный продукт повторно экстрагировали из водной фазы этилацетатом. Объединенные органические фазы высушили над сульфатом натрия, отфильтровали и концентрировали на роторном испарителе при пониженном давлении. Неочищенный продукт очистили с помощью колоночной хроматографии на силикагеле.
2. Стадия: 3-Хлор-5-(1,1,1,2,3,3,3-гептафторпропан-2-ил)пиридин-2(1Н)-он
5,8 г (19,5 ммоль) 3-хлор-5-(1,1,1,2,3,3,3-гептафторпропан-2-ил)пиридин-2-амина растворили в 150 мл серной кислоты (20%, масс./масс.) и охладили до 0-5°C. Раствор смешали с 2,7 г (40 ммоль) нитрита натрия по частям. Реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Неочищенный продукт повторно экстрагировали из реакционной смеси с помощью дихлорметана (DCM). Объединенные органические фазы высушили над сульфатом натрия, отфильтровали и концентрировали на роторном испарителе при пониженном давлении. Неочищенный продукт применяли на следующей стадии без дальнейшей очистки.
3. Стадия: 2,3-дихлор-5-(1,1,1,2,3,3,3-гептафторпропан-2-ил)пиридин
15,4 г (51,7 ммоль) 3-хлор-5-(1,1,1,2,3,3,3-гептафторпропан-2-ил)пиридин-2(1Н)-он и 150 мл фосфорилхлорид нагревали до 105°C в течение 5 часов. Реакционную смесь бережно нейтрализовали с помощью раствора гидрокарбоната натрия. Неочищенный продукт повторно экстрагировали из реакционной смеси с помощью DCM. Объединенные органические фазы промыли насыщенным водным раствором хлорида натрия, высушили над сульфатом натрия, отфильтровали и концентрировали на роторном испарителе при пониженном давлении. Продукт получили с помощью вакуумной дистилляции (точка кипения 40°C при 1 мбар).
Получили 14,8 г 2,3-дихлор-5-(1,1,1,2,3,3,3-гептафторпропан-2-ил)пиридина в виде бесцветной жидкости.
MS: масса (m/z) = 315 [М]+.
1Н-ЯМР (400 МГц, d1-Хлороформ): 8,48 (с, 1Н), 7,95 (с, 1Н).
Пример I-T3-161:
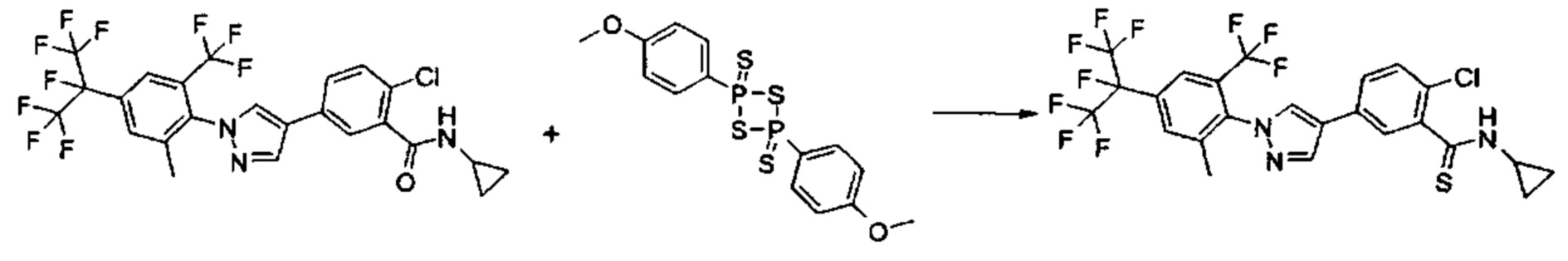
294 мг (0,5 ммоль) 2-хлор-N-циклопропил-5-[1-[2-метил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-6-(трифторметил)фенил]пиразол-4-ил]бензамида загрузили в смеси 0,5 мл этанол-свободного трихлорметана и 1,5 мл 1,2-диметоксиэтана, и затем добавили 101 мг (0,25 ммоль) реагента Лавессона (2,4-бис(4-метоксифенил)-1,3,2,4-дитиадифосфэтан-2,4-дисульфид). Смесь нагревали до 50°C в течение 4 часов. После этого смесь охладили, и растворитель удалили на роторном испарителе при пониженном давлении. Остаток распределили между этилацетатом и насыщенным водным раствором гидрокарбоната натрия, водную фазу повторно экстрагировали один раз этилацетатом. Объединенные органические фазы высушили над сульфатом натрия и концентрировали на роторном испарителе при пониженном давлении. Для очистки хроматографию осуществили с применением 40 г картриджа, содержащего силикагель, и градиента циклогексан/этилацетат от 90:10 до 50:50 (об./об.). Получили 248 мг 2-хлор-N-циклопропил-5-[1-[2-метил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]-6-(трифторметил)фенил]пиразол-4-ил]бензолкарботиоамид (соединение I-T3-161).
HPLC-MSa): logP=5,0, масса (m/z) = 604 [М+Н]+.
1H-ЯМР (400 МГц, (d3-Ацетонитрил): δ (ppm) = 8,62 (с, 1Н (расширенный)), 8,14 (с, 1H), 8,10 (с, 1H), 8,0 (с, 1H), 7,95 (с, 1H), 7,63 (д, J=2,2 Гц, 1H), 7,57-7,60 (м, 1H), 7,42 (д, J=8,4 Гц, 1H), 3,02 (с, 3Н), 3,37-3,44 (м, 1H), 0,92-0,95 (м, 2H), 0,74-0,78 (м, 2H).
Способ получения I-T4
Пример I-T4-1:

3,81 г (12,2 ммоль) 2-хлор-5-иод-бензойной кислоты сложного этилового эфира загрузили в 37 мл диметилформамида, добавили 2,885 г (19,6 ммоль) 4-бром-пиразола, 5,09 г (36,8 ммоль) свежеизмельченного карбоната калия, 0,349 г (2,4 ммоль) 1,2 бис-(метиламино)-циклогексана (рацемический, транс) и 0,234 г (1,22 ммоль) иодида меди (I). Смесь дегазировали аргоном и затем нагревали с возвратом флегмы в течение 1 часа. Для обработки смесь охладили, перелили в 100 мл воды и дважды экстрагировали, каждый раз с помощью 100 мл этилацетата. Объединенные органические фазы дважды промыли с помощью 100 мл воды и затем с помощью насыщенного раствора хлорида натрия, высушили над сульфатом натрия и концентрировали на роторном испарителе в вакууме. Для очистки остаток хроматографировали с помощью 120 г-картриджа, содержащего силикагель, с применением градиента циклогексан/этилацетат от 90:10 до 70:30 (об./об.). Получили 1,41 г 5-(4-бромпиразол-1-ил)-2-хлор-бензойной кислоты сложного этилового эфира.
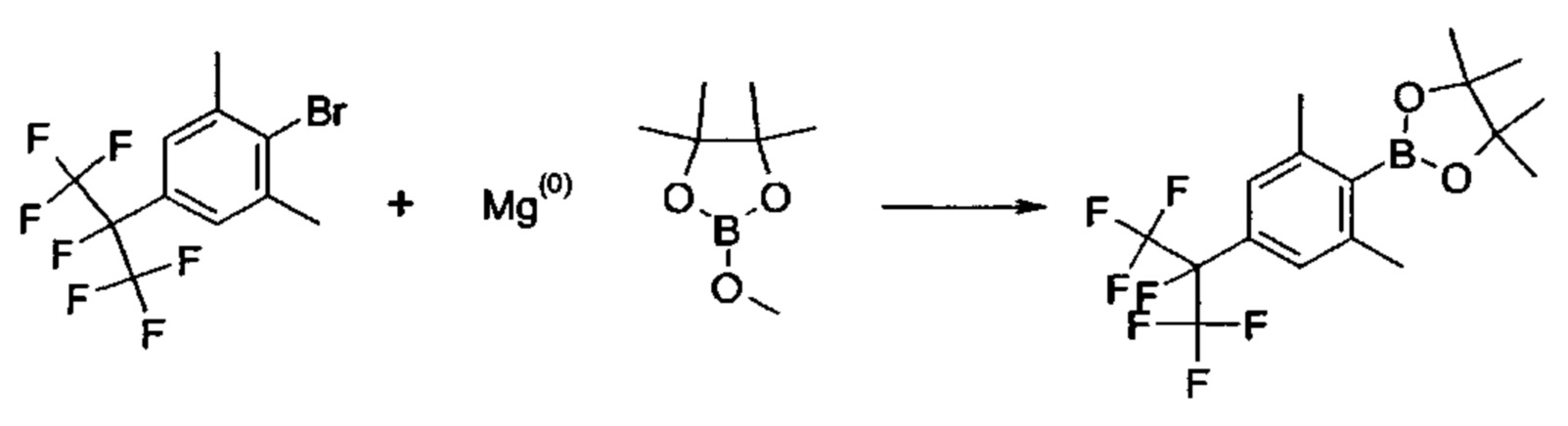
0,158 г (6,49 мг) магниевой стружки покрыли 1,5 мл сухого тетрагидрофурана. Добавили несколько капель раствора 1,75 г (4,95 ммоль) 2-бром-1,3-диметил-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]бензола (получили согласно US 2003/187233, стр. 6) в 2,5 мл сухого тетрагидрофурана. Для начала реакции добавили крошки иода, и смесь нагревали до около 55°C. После начала реакции оставшийся раствор 2-бром-1,3-диметил-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]бензола добавили по каплям при температуре 55°C. После завершения добавления перемешивание продолжали при 55°C в течение еще 1 часа, затем смесь охладили до 0°C, и по каплям добавили раствор 2-метокси-4,4,5,5-тетраметил-1,3,2-диоксаборолана в 2,5 мл сухого тетрагидрофурана. Затем смесь позволили нагреться до комнатной температуры. Для обработки смесь перелили в насыщенный водный раствор хлорида аммония. Фазы разделили, водную фазу повторно экстрагировали этилацетатом, затем объединенные органические фазы промыли насыщенным водным раствором хлорида натрия, высушили над сульфатом натрия и концентрировали на роторном испарителе в вакууме. Остаток подвергли дистилляции в трубке с шаровым расширением при вакууме 1 мбар и 220°C. Получили 1,85 г 2-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]-4,4,5,5-тетраметил-1,3,2-диоксаборолана.

0,947 г (2,87 ммоль) 5-(4-бромпиразол-1-ил)-2-хлор-бензойной кислоты сложного этилового эфира и 1,15 г (2,87 ммоль) 2-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]-4,4,5,5-тетраметил-1,3,2-диоксаборолана растворили в 62 мл изопропанола, и добавили 8,7 мл (8,7 ммоль) дегазированного одномолярного водного раствора гидрокарбоната натрия. Смесь дегазировали аргоном, и добавили 0,166 г (0,14 ммоль) тетракис(трифенилфосфин)палладия (0), и смесь нагревали с обратным холодильником всю ночь.
Для обработки смесь концентрировали на роторном испарителе в вакууме, и остаток распределили между водой и этилацетатом. Органическую фазу отделили, водную фазу повторно экстрагировали этилацетатом. Объединенные органические фазы затем один раз промыли насыщенным водным раствором хлорида натрия и концентрировали на роторном испарителе в вакууме. В качестве остатка получили 1,17 г неочищенного 2-хлор-5-[4-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиразол-1-ил]бензойной кислоты сложного этилового эфира.

1,76 г (3,36 ммоль) 2-хлор-5-[4-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиразол-1-ил]бензойной кислоты сложного этилового эфира загрузили в 72 мл метанола, и добавили 4,03 мл (4,03 ммоль) одномолярного раствора гидроксида натрия. Смесь затем нагревали с обратным холодильником в течение трех часов. Для обработки смесь концентрировали на роторном испарителе в вакууме, остаток растворили в разбавленной соляной кислоте и трижды экстрагировали этилацетатом. Объединенные экстракты промыли насыщенным раствором хлорида натрия, высушили над сульфатом натрия, концентрировали, и получили 1,36 г неочищенной 2-хлор-5-[4-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиразол-1-ил]бензойной кислоты.

1,36 г (2,76 ммоль) неочищенной 2-хлор-5-[4-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиразол-1-ил]бензойной кислоты растворили в 14 мл сухого толуола, добавили 1 мл (13,8 ммоль) тионилхлорида, и затем смесь нагревали до 80°C в течение двух часов. Затем смесь концентрировали на роторном испарителе в вакууме, добавили 1 мл сухого толуола, и смесь снова концентрировали. Получили 1,4 г неочищенного хлорида кислоты в качестве остатка. 0,7 г остатка растворили в 5 мл дихлорметана и по каплям добавили к раствору 0,195 г (3,41 ммоль) циклопропиламина в 2 мл дихлорметана при комнатной температуре. Смесь перемешивали при комнатной температуре в течение еще 2 часов, затем перелили в 20 мл 5% водного раствора дигидрофосфата натрия. Органическую фазу отделили и промыли насыщенным раствором хлорида натрия, высушили над сульфатом натрия и концентрировали на роторном испарителе в вакууме. Остаток очистили в ходе двух циклов хроматографии с применением картриджа, содержащего 15 г силикагеля, и градиента циклогексан/этилацетат от 90:10 до 50:50 (об./об.). Получили 91 мг (1,36 ммоль) N-циклопропил-2-хлор-5-[4-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиразол-1-ил]бензамида (соединение I-T4-1).
HPLC-MSa): logP=4,74, масса (m/z)=534 [М+Н]+.
1Н-ЯМР (400 МГц, d3-Ацетонитрил): δ = (ppm) 8,17 (с, 1H), 7,86 (с, 1H), 7,84 (д, J1=2,7 Гц, 1H), 7,69 (с, 1H), 7,54 (д, J1=8,8 Гц, 1Н), 7,44 (с, 2H), 6,97 (с (расширенный), 1Н (N-H)), 2,83-2,87 (м, 1Н), 2,25 (с, 6Н), 0,76-0,8 (м, 2H), 0,58-0,62 (м, 2Н).
Пример I-T4-3:


2 г (9,96 ммоль) 5-амино-2-хлор-никотиновой кислоты сложного этилового эфира (коммерчески доступен) загрузили в 8,6 мл 33% водной соляной кислоты, и смесь перемешивали при комнатной температуре в течение 30 минут. Затем добавили 7 мл воды, и смесь охладили до 0°C с помощью ледяной бани. К этой смеси по каплям добавили раствор 750 мг (10,8 ммоль) нитрита натрия в 6,92 мл воды в течение 30 минут. Температуру поддерживали ниже +5°C с помощью ледяной бани. Перемешивание продолжали при 0°C в течение 15 минут.
Во вторую колбу загрузили 5,77 г (25,5 ммоль) дигидрат хлорида олова (II) в 24 мл 16% водной соляной кислоте, и суспензию диазониевой соли, полученной выше, по каплям добавили при 0°C. Перемешивание продолжали при 0°C в течение 1 часа. После этого добавили 50 мл ацетонитрила и 40 мл насыщенного водного раствора хлорида натрия. Образованные фазы разделили. Водную фазу дважды экстрагировали, каждый раз с помощью 50 мл ацетонитрила. Объединенные органические фазы высушили над сульфатом натрия и концентрировали на роторном испарителе в вакууме. В качестве остатка получили 10,7 г неочищенного 2-хлор-5-гидразино-никотиновой кислоты сложного этилового эфира.

10,7 г неочищенного 2-хлор-5-гидразино-никотиновой кислоты сложного этилового эфира загрузили в 50 мл этанола, затем добавили 1,63 г (9,92 ммоль) 1,1,3,3-тетраметоксипропана и 487 мг 96% серной кислоты. Смесь затем нагревали с обратным холодильником в течение двух часов. Большую часть этанола удалили на роторном испарителе в вакууме, и остаток распределили между насыщенным водным раствором гидрокарбоната натрия и этилацетата. Органическую фазу отделили, промыли насыщенным водным раствором хлорида натрия, высушили над сульфатом натрия и концентрировали на роторном испарителе в вакууме. Остаток подвергли хроматографии с применением картриджа, содержащего 15 г силикагеля, и градиента от чистого циклогексана до циклогексан/этилацетат 50:50 (об./об.). Получили 396 мг 2-хлор-5-(пиразол-1-ил)-никотиновой кислоты сложного этилового эфира.

396 мг (1,57 ммоль) 2-хлор-5-(пиразол-1-ил)-никотиновой кислоты сложного этилового эфира загрузили в 10 мл ацетонитрила, и добавили 1,062 г (4,72 ммоль) N-иодсукцинимида. Затем смесь нагревали с возвратом флегмы в атмосфере аргона в течение трех часов. Смесь немного охладили, и растворитель удалили на роторном испарителе в вакууме. Остаток распределили между водой и этилацетатом. Органическую фазу отделили, сначала промыли насыщенным водным раствором гидросульфита натрия, затем насыщенным водным раствором гидрокарбоната натрия и, наконец, насыщенным водным раствором хлорида натрия, высушили над сульфатом натрия и концентрировали на роторном испарителе в вакууме. Остаток подвергли хроматографии с применением картриджа, содержащего 15 г силикателя, и градиента от чистого циклогексана до циклогексан/этилацетат 50:50 (об./об.).

401 мг (1,06 ммоль) 2-хлор-5-(4-иодпиразол-1-ил)пиридин-3-карбоновой кислоты этилового сложного эфира и 425 мг (1,06 ммоль) 2-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]-4,4,5,5-тетраметил-1,3,2-диоксаборолана загрузили в 23 мл изопропанола, и добавили 3,24 мл (3,24 ммоль) дегазированного одномолярного водного раствора гидрокарбоната натрия и 61 мг (0,05 ммоль) тетракис(трифенилфосфин)палладия (0). Смесь снова дегазировали аргоном и нагревали с возвратом флегмы всю ночь. Затем смесь охладили, и летучие компоненты удалили на роторном испарителе при пониженном давлении. Остаток распределили между водой и этилацетатом. Органическую фазу отделили, один раз промыли насыщенным водным раствором хлорида натрия и концентрировали на роторном испарителе в вакууме. Получили 415 мг неочищенного 2-хлор-5-[4-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиразол-1-ил]пиридин-3-карбоновой кислоты этилового сложного эфира.

416 мг (0,79 ммоль) неочищенного 2-хлор-5-[4-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиразол-1-ил]пиридин-3-карбоновой кислоты этилового сложного эфира растворили в 16,9 мл метанола, и добавили 0,952 мл (0,95 ммоль) 1 М раствора гидроксида натрия. Смесь нагревали с возвратом флегмы в течение 6 часов, затем охладили и концентрировали на роторном испарителе в вакууме. Остаток распределили между этилацетатом и разбавленной соляной кислотой. Водную фазу дважды повторно экстрагировали этилацетатом. Объединенные органические фазы промыли насыщенным водным раствором хлорида натрия, высушили над сульфатом натрия и концентрировали на роторном испарителе в вакууме. Получили 380 мг неочищенной 2-хлор-5-[4-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиразол-1-ил]пиридин-3-карбоновой кислоты.
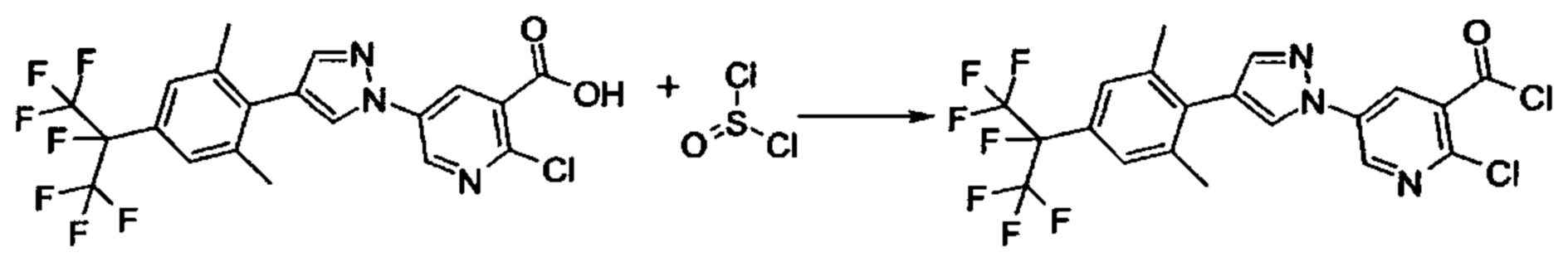
380 мг (0,76 ммоль) неочищенной 2-хлор-5-[4-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиразол-1-ил]пиридин-3-карбоновой кислоты растворили в толуоле, и добавили 456 мг (3,83 ммоль) тионилхлорида. Смесь нагревали до 80°C в течение 2 часов и концентрировали на роторном испарителе в вакууме. Получили 400 мг неочищенного 2-хлор-5-[4-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиразол-1-ил]пиридин-3-карбоновой кислоты хлорида.
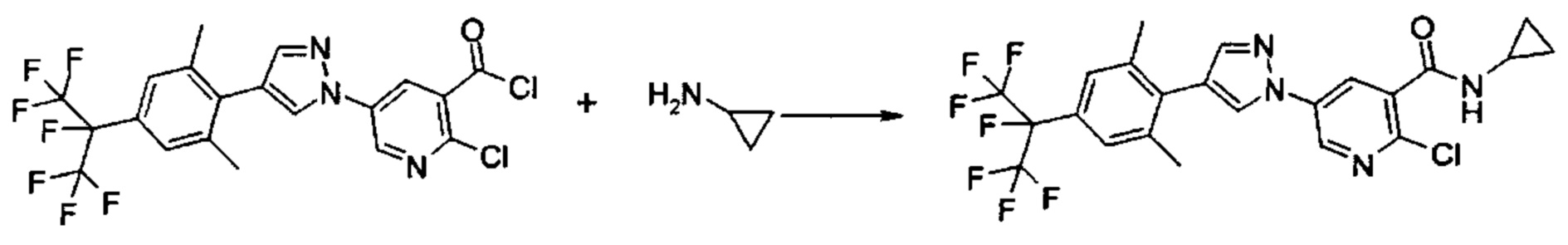
138 мг (0,26 ммоль) 2-хлор-5-[4-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиразол-1-ил]пиридин-3-карбоновой кислоты хлорида растворили в 1 мл дихлорметана и по каплям добавили к раствору 38 мг циклопропиламина в 1 мл дихлорметана при комнатной температуре. Смесь перемешивали при комнатной температуре в течение еще 2 часов. Затем смесь промыли 5% раствором дигидрофосфата натрия и затем насыщенным водным раствором хлорида натрия, высушили над сульфатом натрия и концентрировали на роторном испарителе в вакууме. Для очистки хроматографию осуществили с применением картриджа, содержащего 15 г силикагеля, и градиента циклогексан/этилацетат от 90:10 до 50:50 (об./об.). Получили 30 мг 2-хлор-N-циклопропил-5-[4-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиразол-1-ил]пиридин-3-карбоксамида.
HPLC-MSa): logP=4,42, масса (m/z) = 534 [М+Н]+.
1Н-ЯМР (400 МГц, d3-Ацетонитрил): δ (ppm) = 8,92 (д, J=2,8 Гц, 1H), 8,22 (д, J1=2,8 Гц, 1H), 8,20 (с, 1H), 7,75 (с, 1Н), 7,44 (с, 2H), 5,1 (с (расширенный), 1Н (N-H)), 2,84-2,88 (м, 1H), 2,25 (с, 6Н), 0,78-0,81 (м, 2H), 0,59-0,63 (м, 2H).
Способ получения I-T22
Пример I-T22-1:

Получение 2,6-диметил-4-гептафторизопропил-бромбензола описано в US 2003/187233, Стр. 6 [0080].
В трехгорлой колбе, объемом 25 мл, 158 мг (6,5 мг-атом) магниевой стружки покрыли сухим тетрагидрофураном (THF). Затем добавили несколько капель раствора 1,75 г (4,95 ммоль) 2,6-диметил-4-гептафторизопропил-бромбензола в 2,5 мл сухого THF. Для начала реакции добавили крошки иода, и смесь нагрели до около 60°C. После начала реакции по каплям добавили остаток раствора 2,6-диметил-4-гептафторизопропил-бромбензола при около 60°C. После завершения перемешивания перемешивание продолжали при 60°C еще один час, затем смесь охладили до 0°C, и по каплям добавили раствор 1,09 г (14,8 ммоль) диметилформамида в 2,5 мл сухого THF. Затем смеси позволили охладиться до комнатной температуры. Для обработки добавили избыток насыщенного водного раствора хлорида аммония, фазы разделили, водную фазу повторно экстрагировали этилацетатом. Объединенные органические фазы промыли насыщенным раствором хлорида натрия, высушили над сульфатом натрия и концентрировали на роторном испарителе в вакууме. В качестве остатка получили 1,3 г неочищенного 2,6-диметил-4-гептафторизопропил-бензальдегида (чистота около 80%), который далее применяли без очистки.

1,3 г (около 3,44 ммоль) неочищенного 2,6-диметил-4-гептафторизопропил-бензальдегида растворили в 26 мл метанола, добавили 361 мг (4,3 ммоль) гидрокарбоната натрия, и смесь охладили до 0°C. После этого добавили 1,2 г (17,2 ммоль) хлорида гидроксиламмония, и смесь перемешивали при комнатной температуре всю ночь. Для обработки смесь концентрировали на роторном испарителе в вакууме, и остаток растворили в 100 мл этилацетата. Нерастворенные составляющие отфильтровали, и фильтрат концентрировали на роторном испарителе в вакууме. Остаток затем очистили с помощью хроматографии, применяя 40 г картридж с силикагелем и градиент от чистого циклогексана до циклогексан/этилацетат 70:30 (об./об.). Получили 0,5 г 2,6-диметил-4-гептафторизопропил-бензальдегидоксима.

505 мг (1,59 ммоль) 2,6-диметил-4-гептафторизопропил-бензальдегидоксима загрузили в 3,5 мл диметилформамида (DMF), и добавили 234 мг (1,75 ммоль) N-хлорсукцинимида. Смесь перемешивали при комнатной температуре в течение 3,5 часов. Затем смесь охладили до 0°C, и по каплям добавили раствор 310 мг (1,59 ммоль) 2-хлор-5-этинил-бензойной кислоты сложного метилового эфира (получен согласно WO 2012/107434, Стр. 103) в 1,5 мл DMF, а затем 355 мг (3,5 ммоль) триэтиламина. Реакционную смесь затем перемешивали при комнатной температуре всю ночь. Для обработки смесь перелили в воду и дважды экстрагировали дихлорметаном, и объединенные экстракты промыли водой, высушили над сульфатом натрия и концентрировали на роторном испарителе в вакууме. Для очистки применяли 40 г картридж с силикагелем и градиент от чистого циклогексана до циклогексан/этилацетат 80:20 (об./об.). Получили 488 мг 2-хлор-5-[3-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]изоксазол-5-ил]бензойной кислоты сложного метилового эфира.

0,8 г (1,56 ммоль) 2-хлор-5-[3-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]изоксазол-5-ил]бензойной кислоты сложного метилового эфира загрузили в смеси 18 мл диоксана и 6,5 мл воды, и добавили 86 мг (2,04 ммоль) моногидрата гидроксида лития, и смесь перемешивали при комнатной температуре всю ночь. Для обработки смесь концентрировали в вакууме, и остаток распределили между смесью разбавленной соляной кислоты и дихлорметаном. Органическую фазу отделили, водную фазу сначала экстрагировали дихлорметаном, затем экстрагировали этилацетатом. Объединенные органические фазы промыли насыщенным водным раствором хлорида натрия, высушили над сульфатом натрия и концентрировали на роторном испарителе в вакууме. Получили 680 мг 2-хлор-5-[3-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]изоксазол-5-ил]бензойной кислоты.

680 мг (1,37 ммоль) 2-хлор-5-[3-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]изоксазол-5-ил]бензойной кислоты растворили в 7 мл толуола, и добавили 0,5 мл (6,89 ммоль) тионилхлорида. Смесь нагревали до 80°C в течение 2 часов и затем концентрировали на роторном испарителе в вакууме. 200 мг (0,38 ммоль) полученного таким образом неочищенного хлорида кислоты растворили в 1 мл дихлорметана и по каплям добавили в раствор 56 мг (0,97 ммоль) циклопропиламина в 0,95 мл дихлорметана при комнатной температуре. Смесь затем перемешивали при комнатной температуре всю ночь. Для обработки смесь перелили в 5% водный раствор дигидрофосфата натрия, и органическую фазу отделили, высушили над сульфатом натрия и концентрировали на роторном испарителе в вакууме. Для очистки хроматографию осуществили с применением картриджа, содержащего 15 г силикагеля, и градиент неочищенный циклогексан -циклогексан/этилацетат 80:20 (об./об.). Получили 165 мг 2-хлор-N-циклопропил-5-[3-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]изоксазол-5-ил]бензамида (соединение I-T22-1).
HPLC-MSa): logP = 4,75, масса (m/z) = 535 [М+Н]+.
1H-ЯМР (400 МГц, d3-Ацетонитрил): δ (ppm) = 7,93 (д, J=2,2 Гц, 1H), 7,89 (дд, J1=8,4 Гц, J2=2,2 Гц, 1H), 7,6 (д, J=8,4 Гц, 1Н), 7,49 (с, 2H), 7,03 (с (расширенный), 1Н (N-H)), 6,86 (с, 1H), 2,83-2,88 (м, 1H), 0,75-0,79 (м, 2H), 0,59-0,62 (м, 2H).
Способ получения I-T23
Пример I-T23-1:


3 г (7,61 ммоль) 2-бБром-1,3-дихлор-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]бензола (получено согласно ЕР 1253128, стр. 10), 1,21 г (12,3 ммоль) этинилтриметилсилана, 86 мг (0,38 ммоль) палладия(II) ацетата и 260 мг (1,0 ммоль) трифенилфосфина загрузили в 20 мл сухого триэтиламина и нагревали с обратным холодильником. После концентрации объема на роторном испарителе при 30°C, остаток смешали с 20 мл насыщенного раствора гидрокарбоната натрия и трижды экстрагировали и дихлорметаном. Объединенные экстракты промыли 5% водным раствором NaH2PO4 и затем насыщенным раствором хлорида натрия. После сушки раствора с помощью сульфата натрия и концентрации объема на роторном испарителе при 30°C, очистку провели посредством хроматографии на силикагеле с применением циклогексана в качестве элюента. Выход: 1,4 г 2-[2,6-дихлор-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]этинил-триметил-силана с чистотой около 50% (LC/MS-площадь).

1,4 г (3,4 ммоль) 2-[2,6-дихлор-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]этинил-триметил-силана растворили в 7 мл тетрагидрофурана, и добавили смесь 7 мл метанола и 214 мг (5,1 ммоль) моногидрата гидроксида лития при комнатной температуре. Реакционный раствор концентрировали на роторном испарителе, и остаток растворили в смеси дихлорметана и воды. Органическую фазу отделили, высушили над сульфатом натрия, концентрировали на роторном испарителе в вакууме, и получили 880 мг около 50% 1,3-дихлор-2-этинил-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]бензола.
Получение 4-хлор-3-карбометокси-бензальдегида уже описано в литературе (смотрите, например, WO 2010/011584, стр. 19-20).

4,1 г (20,6 ммоль) 4-хлор-3-карбометокси-бензальдегида растворили в 82 мл метанола, добавили 1,734 г (20,6 ммоль) гидрокарбоната натрия, и смесь охладили до 0°C. Затем 5,738 г (82,5 ммоль) гидрохлорида гидроксиламина добавили, и смесь перемешали. Для обработки смесь концентрировали на роторном испарителе, и остаток растворили в 100 мл этилацетата. Твердые вещества отфильтровали, и фильтрат концентрировали на роторном испарителе при пониженном давлении. Для очистки остаток подвергли хроматографии на силикагеле с помощью градиента циклогексан/этилацетат от 9:1 до 7:3 (об./об.), и получили 2,68 г 2-хлор-5-[(Е)-гидроксииминометил] бензойной кислоты сложного этилового эфира.

277 мг (1,29 ммоль) 2-хлор-5-[(Е)-гидроксииминометил]бензойной кислоты сложного этилового эфира загрузили в 4,6 мл диметилформамида, и добавили 381 мг (2,84 ммоль) N-хлор-сукцинимида, и смесь перемешивали при комнатной температуре. Смесь затем охладили до 0°C на ледяной бане, и по каплям добавили раствор 880 мг (около 50%, 1,29 ммоль) 1,3-дихлор-2-этинил-5-[1,2,2,2-тетрафтор-1-(трифторметил)этил]бензола в 1,5 мл диметилформамида, а затем 289 мг (2,85 ммоль) триэтиламина. Смесь перемешали при комнатной температуре. Для обработки смесь разбавили водой и дважды экстрагировали дихлорметаном. Объединенные экстракты промыли водой, высушили над сульфатом натрия и концентрировали на роторном испарителе. Остаток очистили в ходе двух циклов хроматографиина силикагеле с градиентом от чистого циклогексана до циклогексан/этилацетат 80:20 (об./об.) в качестве элюента, и получили 410 мг 2-хлор-5-[5-[2,6-дихлор-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]изоксазол-3-ил]бензойной кислоты сложного метилового эфира.

410 мг (0,74 ммоль) 2-хлор-5-[5-[2,6-дихлор-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]изоксазол-3-ил]бензойной кислоты сложного метилового эфира загрузили в 21 мл метанола, добавили 0,74 мл (0,74 ммоль) 1 М раствора гидроксида натрия, и смесь перемешивали с возвратом флегмы. Затем метанол удалили на роторном испарителе. Остаток смешали с разбавленной соляной кислотой и трижды экстрагировали этилацетатом. Объединенные экстракты высушили над сульфатом натрия и концентрировали на роторном испарителе в вакууме. Получили 405 мг 2-хлор-5-[5-[2,6-дихлор-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]изоксазол-3-ил]бензойной кислоты в качестве остатка.

125 мг (0,23 ммоль) 2-хлор-5-[5-[2,6-дихлор-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]изоксазол-3-ил]бензойной кислоты растворили в 1,1 мл сухого толуола, и добавили 0,14 г (1,16 ммоль) тионилхлорида. Смесь нагрели до 80°C и затем концентрировали на роторном испарителе. Остаток растворили в 0,25 мл дихлорметана и по каплям добавили в раствор 33 мг (0,58 ммоль) циклопропиламина в 0,75 мл дихлорметана при 0°C, и смесь перемешивали при комнатной температуре в течение двух часов. Для обработки добавили 5% водный раствор дигидрофосфата натрия, и затем отделили органическую фазу. Органическую фазу высушили над сульфатом натрия и концентрировали на роторном испарителе. Остаток очистили с применением хроматографии на силикагеле и циклогексан/этилацетат 70:30 (об./об.) в качестве элюента. Получили 49 мг 2-хлор-N-циклопропил-5-[5-[2,6-дихлор-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]изоксазол-3-ил]бензамида (соединение I-T23-1).
HPLC-MSa): logP=4,96, масса (m/z) = 575 [М+Н]+.
1Н-ЯМР (400 МГц, d3-Ацетонитрил): δ=7,96 (с, 1H), 7,94-7,96 (дд, J1=8,4 Гц, J2=2,2 Гц, 1H), 7,86 (с, 2H), 7,6 (д, J1=7,6 Гц, J2=1,2, 1H), 7,15 (с, 1H), 6,9 (с (расширенный), 1Н (N-H)), 3,97 (с, 3Н), 2,83-2,88 (м, 1Н), 0,75-0,79 (м, 2H), 0,58-0,62 (м, 2H).
Способ 1 Пример 4-гептафторизопропил-2-метил-6-трифторметил-анилин
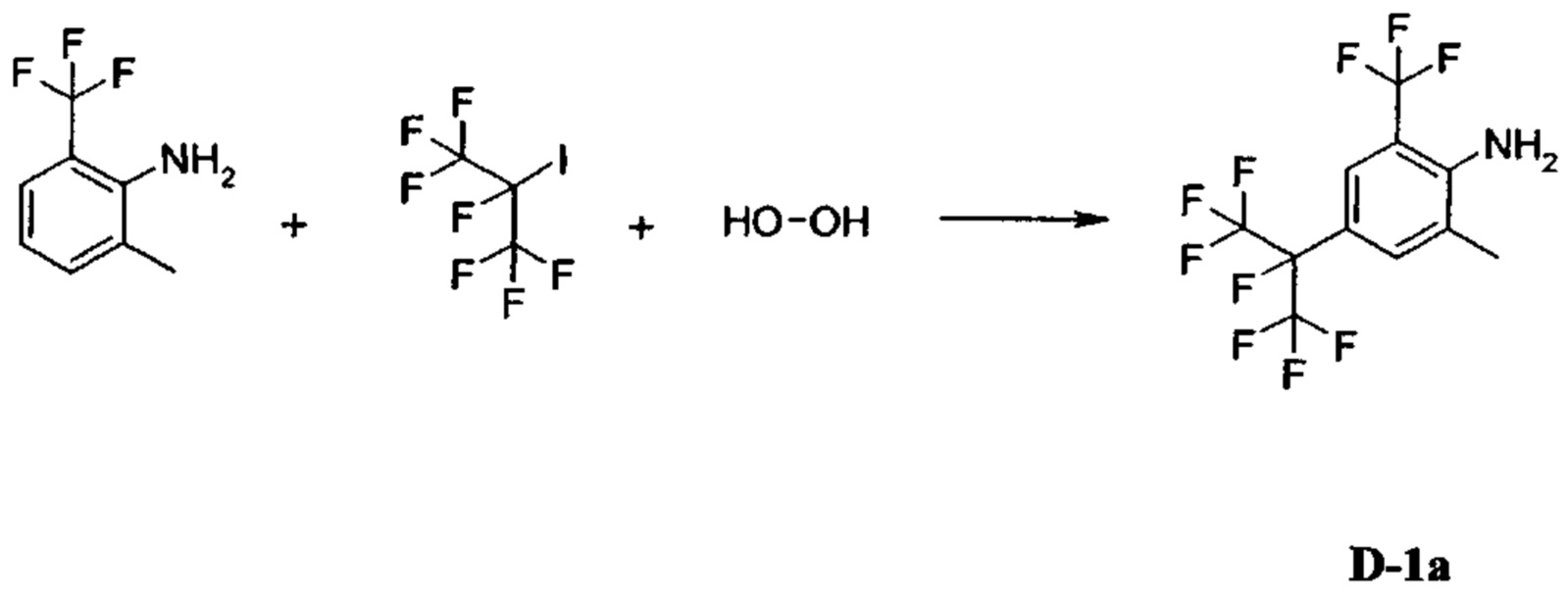
В трехгорлую колбу загрузили 17,48 г (100 ммоль) 2-метил-6-трифторметил-анилина в 498 мл диметилсульфоксида и затем добавили 44,3 г (21,095 мл, 150 ммоль) 2-иодгептафторпропана, 29,9 мл (29,9 ммоль) 1 молярного раствора сульфата железа (II) в воде и 5,43 мл (104 ммоль) 96% серной кислоты. Смесь затем дегазировали аргоном, и затем шприцевой насос применяли, чтобы добавить по каплям 20,4 мл 30% водного раствора пероксида водорода в течение 15 минут. Температура поднялась до 54°C. К концу добавления по каплям смесь быстро нагрели до 60°C. Смесь перемешивали в течение еще 20 минут без нагревания, в ходе которого температура опустилась до 36°C. Для обработки смесь перелили в насыщенный водный раствор гидрокарбоната натрия, и продукт экстрагировали этилацетатом. Объединенные экстракты сначала промыли водой и затем промыли насыщенным водным раствором хлорида натрия, высушили над сульфатом натрия и концентрировали на роторном испарителе в вакууме. Для очистки две части подвергли хроматографии на колонке, содержащей 120 г силикагеля, применяя градиент от чистого циклогексана до циклогексан/этилацетат 95:5 (об./об.). Получили 18,9 г 4-гептафторизопропил-2-метил-6-трифторметил-анилина.
Аналогично также получили 2-хлор-4-гептафторизопропил-6-трифторметил-анилин из 2-хлор-6-трифторметил-анилин и 2-иодгептафторпропан а:

В трехгорлую колбу загрузили 30 г (0,153 моль) 2-хлор-6-трифторметиланилина (коммерчески доступен) в 765 мл диметилсульфоксида (DMSO), и затем добавили 68,1 г (0,23 моль) 2-иодгептафторпропана, 46 мл 1 молярного водного раствора сульфата железа (II) и 15,4 г 98% серной кислоты. Смесь дегазировали аргоном, и затем шприцевой насос применяли, чтобы добавить по каплям 34,8 г 30% водного раствора пероксида водорода в течение 30 минут. В ходе добавления температура поднялась до 70°C. Смесь перемешивали в течение еще 20 минут, в ходе чего температура упала до 30°C. Реакционную смесь перелили в насыщенный водный раствор гидрокарбоната натрия и экстрагировали этилацетатом. Объединенные экстракты сначала промыли водой, затем насыщенным водным раствором бисульфита и насыщенным водным раствором хлорида натрия, высушили над сульфатом натрия и концентрировали на роторном испарителе в вакууме. Для очистки хроматографию осуществили с применением картриджа, содержащего 330 г силикагеля, и градиента от чистого циклогексана до циклогексан/этилацетат 90:10 (об./об.). Получили 46,1 г 2-хлор-4-гептафторизопропил-6-трифторметил-анилина.
Способ 2 Пример 4-гептафторизопропил-2-метил-6-трифторметил-анилин

В трехгорлой колбе, объемом 1000 мл, 25 г (91 ммоль) 4-гептафторизопропил-2-метил-анилина добавили к смеси 363,4 мл воды и 181,7 мл ацетонитрила. Затем добавили 27,3 мл (27,3 ммоль) водного 1 молярного раствора сульфата железа (II) и 31,19 г (200 ммоль) трифторметилсульфината натрия. Смесь аэрировали аргоном и затем добавили 35,1 г (273 ммоль) 70% водного раствора трет.-бутилгидропероксида с помощью шприцевого насоса в течение 4,5 часов без охлаждения. Температура поднялась до 34°C. После завершения добавления перемешивание продолжали в течение еще одного часа. Для обработки смесь перелили в 425 мл насыщенного водного раствора гидросульфита натрия и перемешивали в течение 15 минут. Затем добавили 425 мл насыщенного раствора гидрокарбоната натрия, и смесь трижды экстрагировали этилацетатом. Объединенные органические фазы сначала промыли водой и затем промыли насыщенным водным раствором хлорида натрия, высушили над сульфатом натрия и концентрировали на роторном испарителе в вакууме. Неочищенный продукт подвергли хроматографии за две части с применением картриджа, содержащего 120 г силикагеля, и градиента циклогексан/этилацетат от 95:5 до 85:15 (об./об.). Получили 19,5 г 4-гептафторизопропил-2-метил-6-трифторметил-анилина.
HPLC-MSa): logP=4,67
GC/MS: масса (m/z) = 343, время удерживания: 2,98 мин, индекс удерживания Ковача: 1089
(Agilent 6890 GC, НР5979 MSD, 10 м DB-1, iD=0.18 мм, FILM=0.4 мкм, Inj.: 250°C, непрерывный поток: 1.6 мм/мин Не, Det.: MSD: 280°C, FID: 320°C, печь: 50°C (1 мин) - 40°C/мин - 320°C (3.25 мин))
1H-ЯМР (AV400, 400 МГц, d3-Ацетонитрил): δ (ppm) = 7,50 (с, 1Н), 7,48 (с, 1H), 5,03 (с, 2Н, расширенный), 2,23 (с, 3Н).
Получение исходного вещества 2-хлор-6-этил-4-гептафторизопропил-анилина
Исходное вещество 2-хлор-6-этил-4-гептафторизопропил-анилин структуры (D-1b) еще не было описано в литературе. Оно может быть получено посредством известных способов хлорирования из 2-этил-4-гептафторизопропил-анилина, который известен из литературы (например, US 2002/198399).
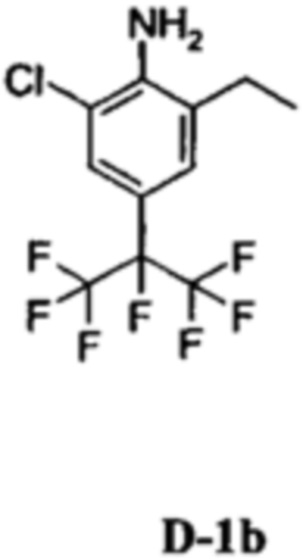
4,9 г (16,9 ммоль) 2-этил-4-гептафторизопропил-анилина (получен согласно US 2002/198399) загрузили в 100 мл хлороформа, смесь нагрели до 45-50°C, и затем медленно по каплям добавили 2,18 мл (26,7 ммоль) сульфурилхлорид, растворенного в 400 мл хлороформа. Смесь перемешивали при 50°C всю ночь, и затем добавили по каплям еще 0,34 мл (4,2 ммоль) сульфурилхлорида, растворенного в 2 мл хлороформа, и смесь перемешивали при 50°C в течение еще трех часов. После этого смесь охладили, и растворитель удалили на роторном испарителе при пониженном давлении. Остаток растворили в дихлорметане, сначала промыли гидросульфитом натрия и затее разбавленным раствором гидроксида натрия, высушили над сульфатом натрия, и растворитель отогнали на роторном испарителе в вакууме. Для очистки хроматографию осуществили с применением картриджа, содержащего 120 г силикагеля, и градиента от чистого циклогексана до циклогексан/этилацетат 90:10 (об./об.). Получили 4,25 г 2-хлор-6-этил-4-гептафторизопропил-анилина.
HPLC-MSa): logP=4,67, масса (m/z) = 324 [М+Н]+.
1Н-ЯМР (AV400, 400 МГц, d3-Ацетонитрил): δ (ppm) = 7,84 (с, 1Н), 7,82 (с, 1Н), 7,53-7,56 (с, 2Н, расширенный), 2,37 (кв, J=7,6 Гц, 2 Н), 1,06 (т, J=7,6 Гц, 3Н).
Получение исходного вещества 2-бром-6-метил-4-гептафторизопропил-анилин
Исходное вещество 2-бром-6-метил-4-гептафторизопропил-анилин структуры (D-1с) еще не было описано в литературе. Оно может быть получено посредством известных способов бромирования (например, US 2004/92762) из 2-метил-4-гептафторизопропил-анилина, который известен из литературы (например, ЕР 2319830, стр. 327).

3,4 г (12,356 ммоль) 2-метил-4-гептафторизопропил-анилина растворили в 27 мл диметилформамида, затем добавили 2,44 г (13,6 ммоль) N-бромсукцинимида, и смесь перемешивали при 60°C в течение одного часа. Смесь охладили, смешали с водой и трижды экстрагировали, каждый раз с помощью 15 мл н-гексана. Объединенные органические фазы промыли водой, высушили над сульфатом натрия и концентрировали на роторном испарителе в вакууме. С помощью хроматографии с применением 120 г картриджа с силикагелем и градиента от чистого циклогексана до циклогексан/этилацетат 90:10 (об./об.) получили 2,44 г 2-бром-6-этил-4-гептафторизопропил-анилина.
HPLC-MSa): logP=4,38, масса (m/z) = 354 [М+Н]+.
1Н-ЯМР (AV400, 400 МГц, d3-Ацетонитрил): δ (ppm) = 7,51 (с, 1Н), 7,23 (с, 1Н), 4,86 (с, 2Н, расширенный), 2,23 (с, 3Н).
Получение исходного соединения 2-(3,5-дихлор-4-гидразино-фенил)-1,1,1,3,3,3-гексафтор-пропан-2-ола

К раствору 2-(4-аминофенил)-1,1,1,3,3,3-гексафторпропан-2-ола (2.50 г, 9.64 ммоль) (получили, например, согласно W.A. Sheppard, J. Am. Chem. Soc. 1965, 87, 2410-2420) в ледяной уксусной кислоте (40 мл) добавили при комнатной температуре N-хлорсукцинимид (2.71 г, 20.2 ммоль). Смесь перемешивали при 75°C в течение 3 часов и затем при комнатной температуре в течение 14 часов. Затем смесь добавили в воду и экстрагировали с помощью EtOAc. Органическую фазу промыли водой и насыщенным водным раствором NaHCO3 и высушили над сульфатом магния. После удаления растворителя, остаток растворили в МТВЕ, и твердые вещества отфильтровали. Фильтрат концентрировали при пониженном давлении, и неочищенный продукт очистили посредством колоночной хроматографии на SiO2 (н-гексан/EtOAc градиент). Получили 2.89 г (91%) 2-(4-амино-3,5-дихлорфенил)-1,1,1,3,3,3-гексафторпропан-2-ола.
HPLC-MSa): logP=3.04, масса (m/z) = 328 [М+Н]+.
1Н-ЯМР (400 МГц, d3-Ацетонитрил): δ=5.13 (расширенный с, 2Н), 6.02 (расширенный с, 1Н), 7.51 (с, 2Н).

К раствору, нагретому до 55°C, 2-(4-амино-3,5-дихлорфенил)-1,1,1,3,3,3-гексафторпропан-2-ола (1.88 г, 5.73 ммоль) в 5 мл ледяной уксусной кислоты по каплям добавили раствор нитрита натрия (455 мг, 6.59 ммоль) в 2.5 мл серной кислоты, и смесь перемешивали при этой температуре в течение еще одного часа. Затем смесь охладили до 0°C, и по каплям добавили раствор хлорида олова (II) (3.37 г, 17.7 ммоль) в концентрированной. HCl (10 мл). Смесь перемешивали при 0°C в течение еще одного часа, затем добавили лед, подщелочили с помощью раствора хлорида натрия и экстрагировали с помощью EtOAc. Органическую фазу промыли насыщенным раствором хлорида натрия и высушили над сульфатом магния, и растворитель удалили при пониженном давлении. Получили 1.41 г (90%, 64% теоретический выход) 2-(3,5-дихлор-4-гидразинофенил)-1,1,1,3,3,3-гексафторпропан-2-ола.
HPLC-MSa): logP=1.92, масса (m/z)=343 [М+Н]+.
1Н-ЯМР (600 МГц, d3-Ацетонитрил): δ=4.14 (расширенный с, 2Н), 5.90 (расширенный с, 1Н), 6.50 (расширенный с, 1Н), 7.58 (с, 2Н).
Примеры I-T46-1

10 г (34,6 ммоль) 2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]анилина загрузили в 60 мл ледяной уксусной кислоты, и добавили 5,02 г (38,04 ммоль) 2,6-диметокси-тетрагидрофурана. Полученный раствор нагревали при 120°C в течение двух часов. Затем немного охладили, и летучие компоненты выпарили на роторном испарителе в вакууме. Остаток перемешали с водой, и твердые вещества отфильтровали с помощью отсасывания. Остаток на фильтре затем растворили в дихлорметане, и раствор высушили с помощью сульфата натрия и концентрировали на роторном испарителе в вакууме. Получили 10,38 г 1-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиррола.
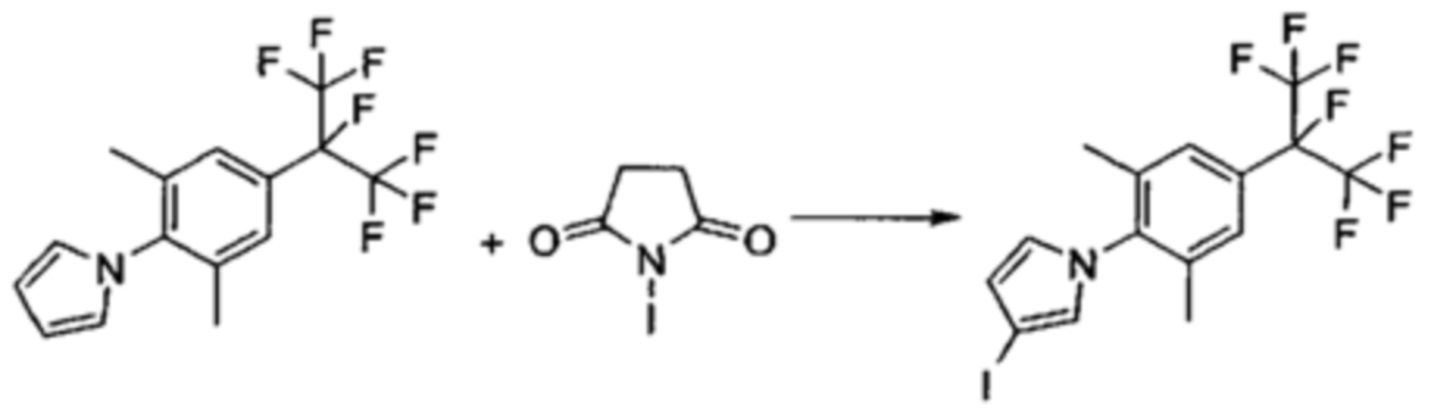
1,5 г (4,293 ммоль) 1-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиррола растворили в 60 мл н-гексана, и добавили 966 мг (4,3 ммоль) N-иодсукцинимида. Затем смеси позволили дойти до комнатной температуры, и перемешивали при комнатной температуре в течение 6 дней. Затем добавили еще 242 мг (1,1 ммоль) N-иодсукцинимида, и смесь перемешивали при комнатной температуре всю ночь. Затем добавили избыток водного раствора гидросульфита натрия и немного этилацетата. Органическую фазу удалили и сначала дважды промыли водным раствором гидросульфита натрия и затем насыщенным раствором хлорида натрия, высушили над сульфатом натрия и концентрировали. Для очистки хроматографию осуществили с применением картриджа, содержащего 120 г силикагеля, и градиента от чистого циклогексана до циклогексан/этилацетат 95:5 (об./об.). Получили 453 мг смеси 80% 1-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]-3-иод-пиррола и 16% 1-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]-2-иод-пиррола.

998 мг (1,696 ммоль) смеси 80% 1-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]-3-иод-пиррола и 16% 1-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]-2-иод-пиррола и 364 мг (1,7 ммоль) 4-хлор-3-(метоксикарбонил)фенилбороновой кислоты загрузили в 10 мл 2-пропанолат. После этого воздух заменили на аргон, и добавили 5,2 мл одномолярного водного раствора гидрокарбоната натрия и 98 мг (0,085 ммоль) тетракис-трифенилфосфин-палладия (0) в атмосфере аргона. Затем смесь нагревали с возвратом флегмы в течение 3 часов. Для обработки смесь немного охладили, затем смесь концентрировали на роторном испарителе в вакууме. Остаток распределили между этилацетатом и водой. Органическую фазу отделили, промыли насыщенным раствором хлорида натрия и концентрировали на роторном испарителе в вакууме. Получили 1,57 г неочищенного 2-хлор-5-[1-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиррол-3-ил]бензойной кислоты сложного метилового эфира.

416 мг (0,33 ммоль, около 40% чистота) неочищенного 2-хлор-5-[1-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиррол-3-ил]бензойной кислоты сложного метилового эфира загрузили в смеси 18 мл диоксана и 6 мл воды, и добавили 61 мг (1,46 ммоль) гидрата гидроксида лития. Смесь перемешивали при комнатной температуры до полного растворения, затем нагревали с возвратом флегмы в течение 2 часов. Смесь затем концентрировали на роторном испарителе в вакууме, остаток смешали с небольшим количеством воды, и довели значение pH до 1 с помощью концентрированной соляной кислоты. Смесь затем дважды экстрагировали этилацетатом, и объединенные экстракты промыли насыщенным раствором хлорида натрия, высушили над сульфатом натрия и концентрировали. В качестве остатка получили 207 мг неочищенной 2-хлор-5-[1-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиррол-3-ил]бензойной кислоты.

137 мг (0,11 ммоль, чистота около 38%) неочищенного 2-хлор-5-[1-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиррол-3-ил]бензойной кислоты растворили в 15 мл толуола, и добавили 230 мг (1,93 ммоль) тионилхлорида. Смесь нагревали с возвратом флегмы в течение 3 часов. После этого все летучие компоненты удалили на роторном испарителе в вакууме. Остаток растворили в 4 мл дихлорметана и по каплям добавили в смесь 82 мг (0,69 ммоль) 1-цианоциклопропиламин гидрохлорида и 98 мг (0,96 ммоль) триэтиламина в 2 мл дихлорметана при 0°C. Затем смесь перемешивали при комнатной температуре всю ночь. Для обработки смесь промыли 5% водным раствором дигидрофосфата натрия, затем насыщенным раствором хлорида натрия, и органическую фазу высушили над сульфатом натрия и концентрировали. Остаток подвергли хроматографии с применением картриджа, содержащего 15 г силикагеля, и циклогексан/этилацетат 85:15 (об./об.). Фракции, содержащие продукт, концентрировали и очистили с помощью препаративной ВЭЖХ (Zorbax Eclipse Plus C18 1,8 мкм, 50×4,6 мм в градиенте ацетонитрил/0,1% водная Н3РО4. Получили 13 мг 2-хлор-N-циклопропил-5-[1-[2,6-диметил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]пиррол-3-ил]бензамида (соединение I-T46-1).
HPLC-MSa): logP=4,90, масса (m/z) = 558 [М+Н]+.
1Н-ЯМР (400 МГц, d3-Ацетонитрил): δ=7,63-7,67 (м, 2Н), 7,56 (с (расширенный), 1Н (N-H)), 7,51 (с, 2Н), 7,41 (д, J=8,3 Гц, 1Н), 7,16-7,17 (м, 1Н), 6,75-6,77 (м, 1Н), 6,72-6,73 (м, 1Н), 2,14 (с, 6Н), 1,55-1,59 (м, 2Н), 1,32-1,39 (м, 2Н).










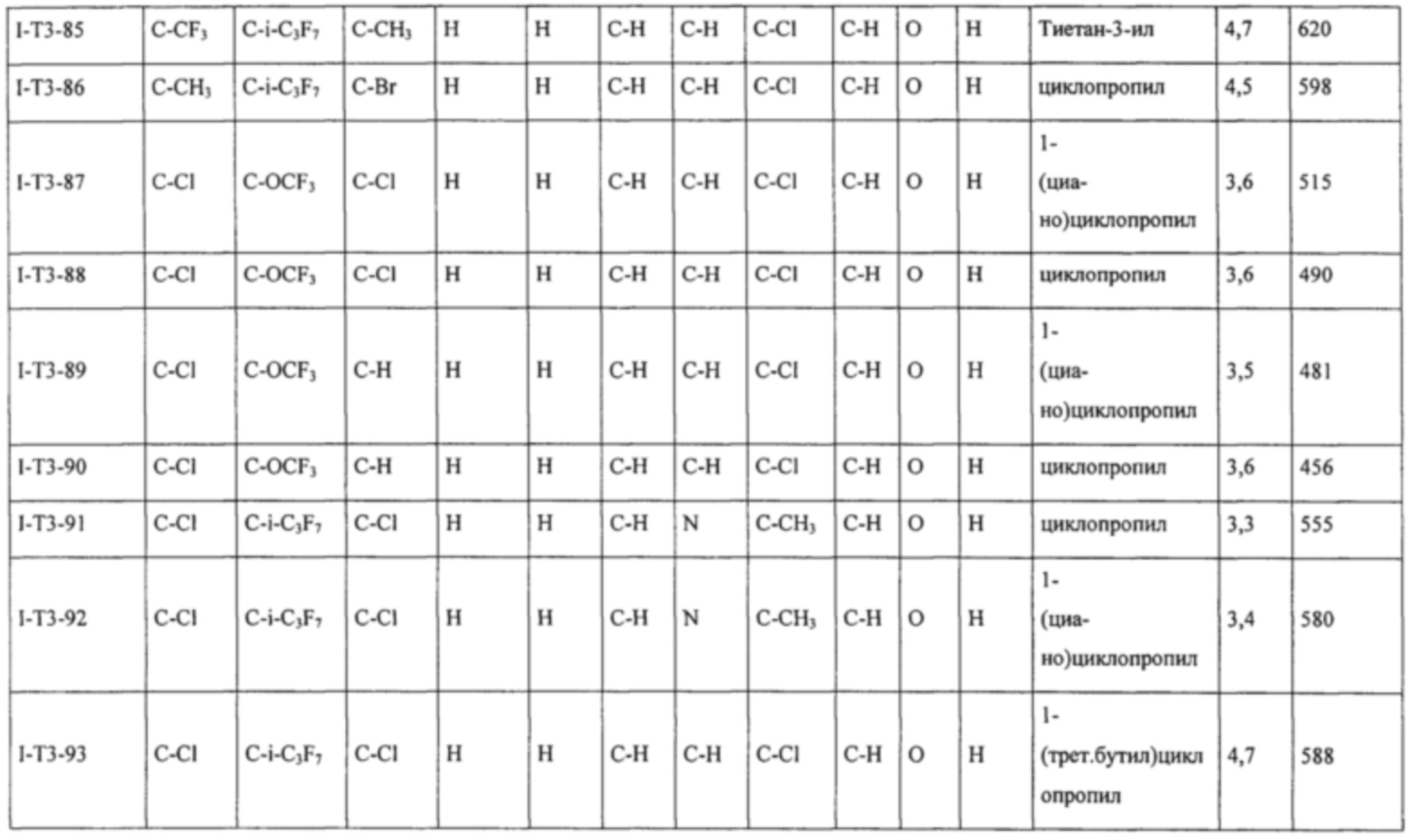
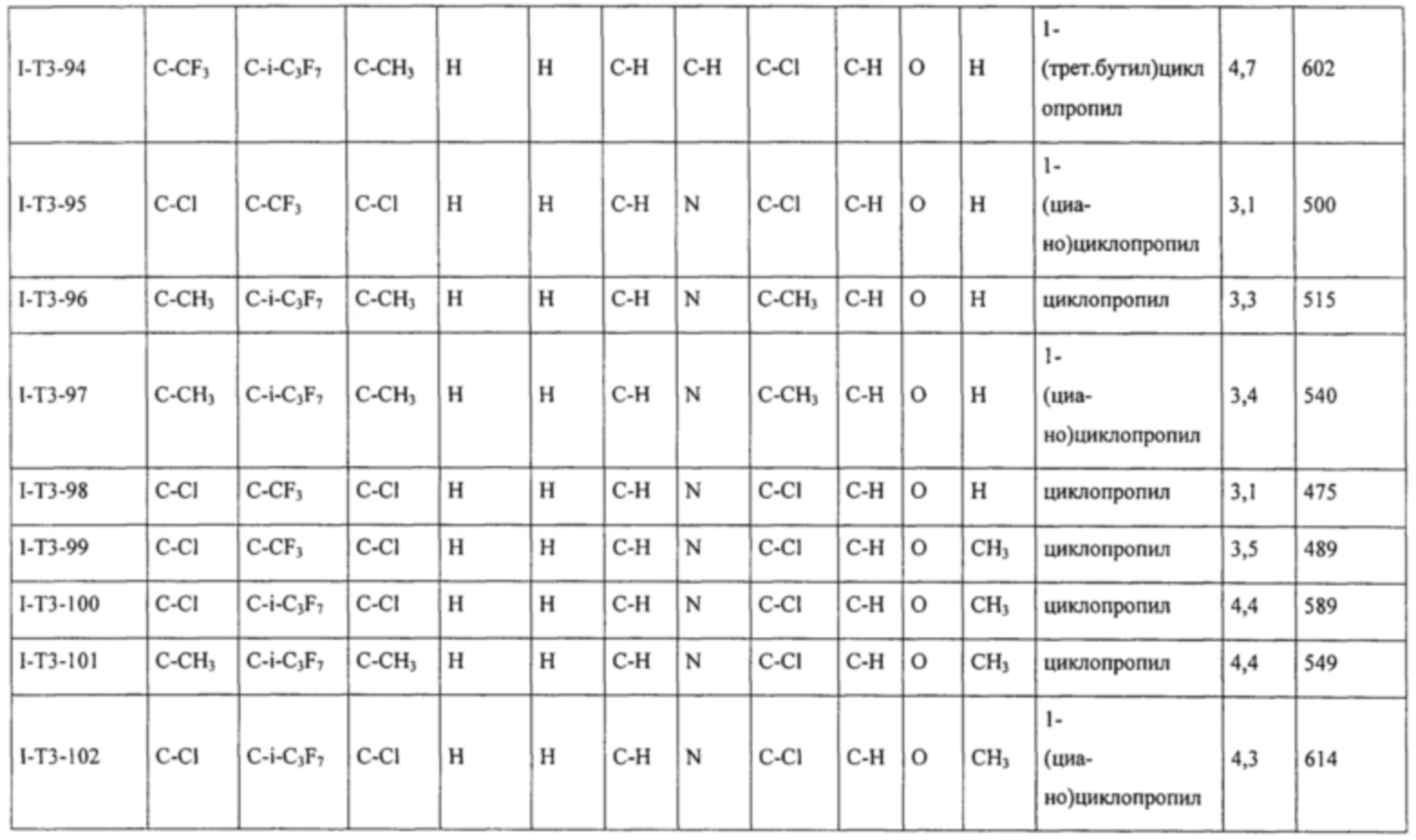












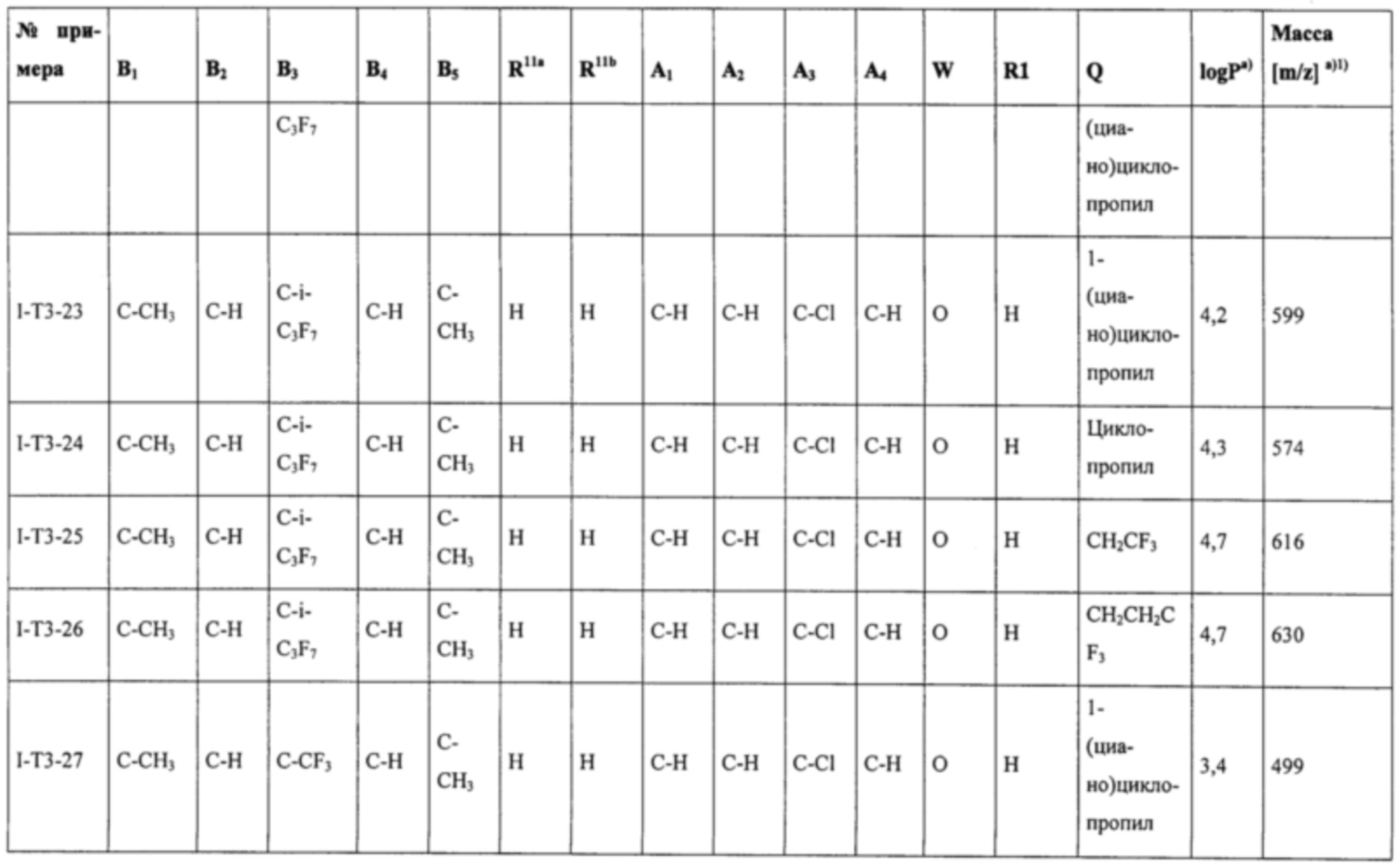




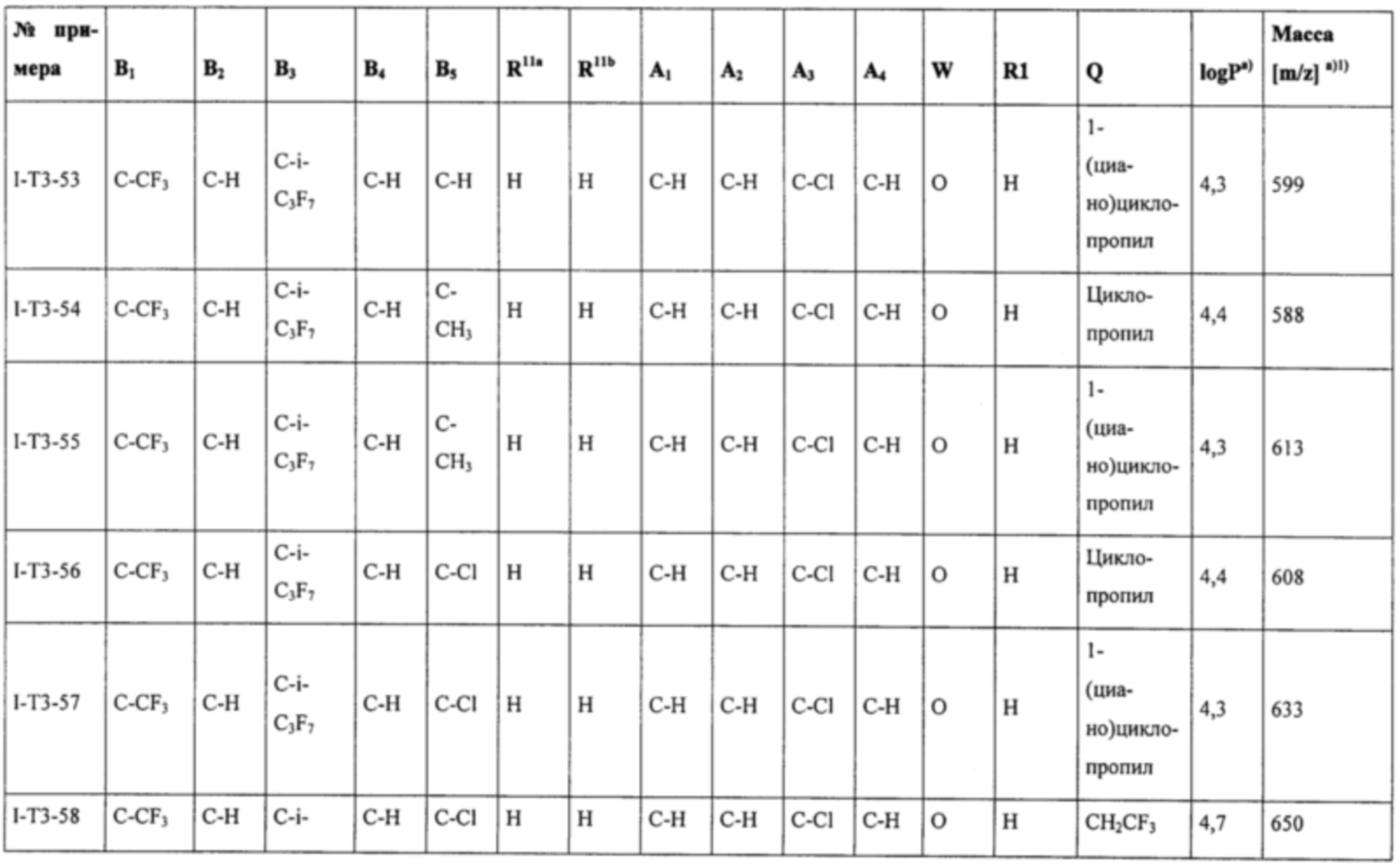












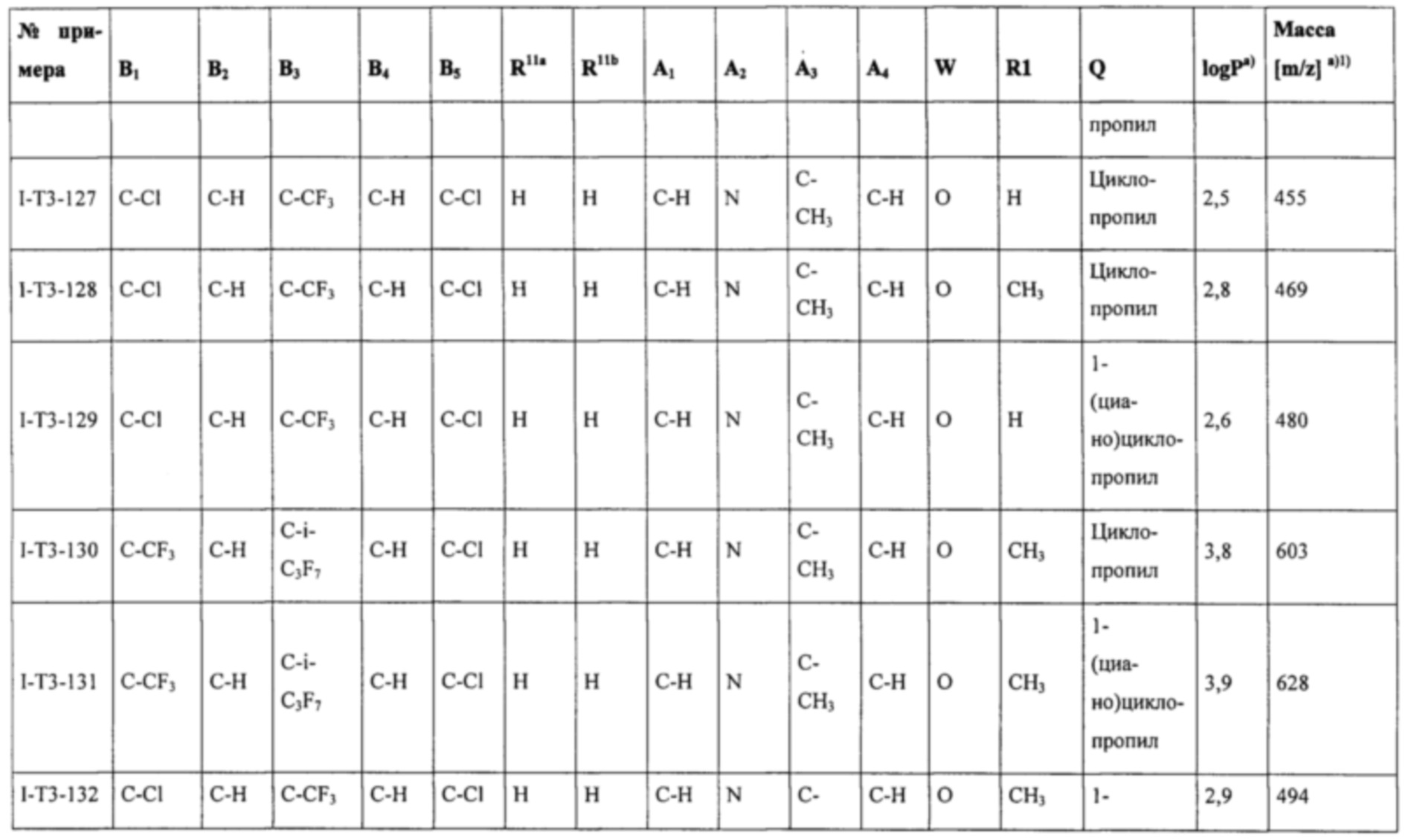





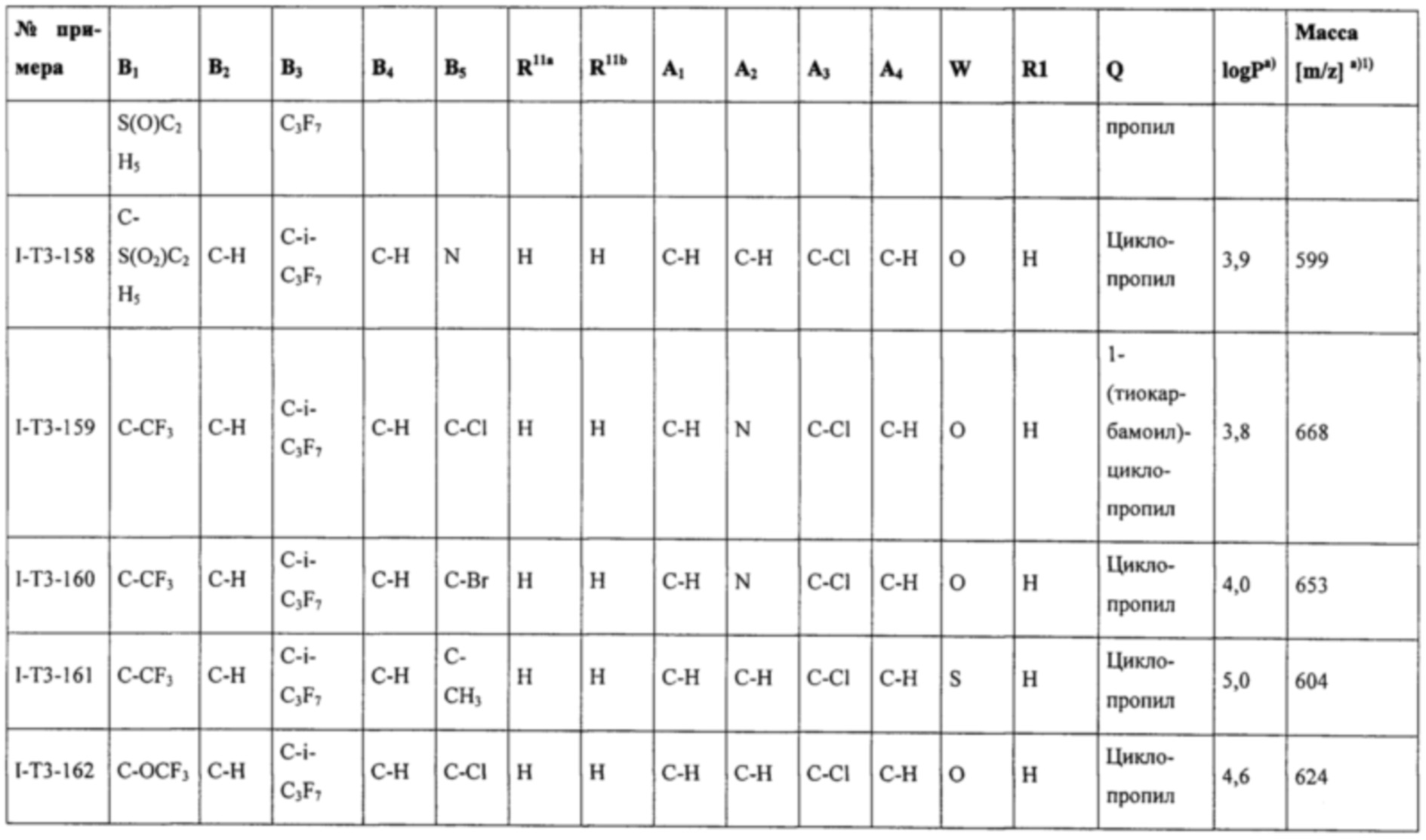









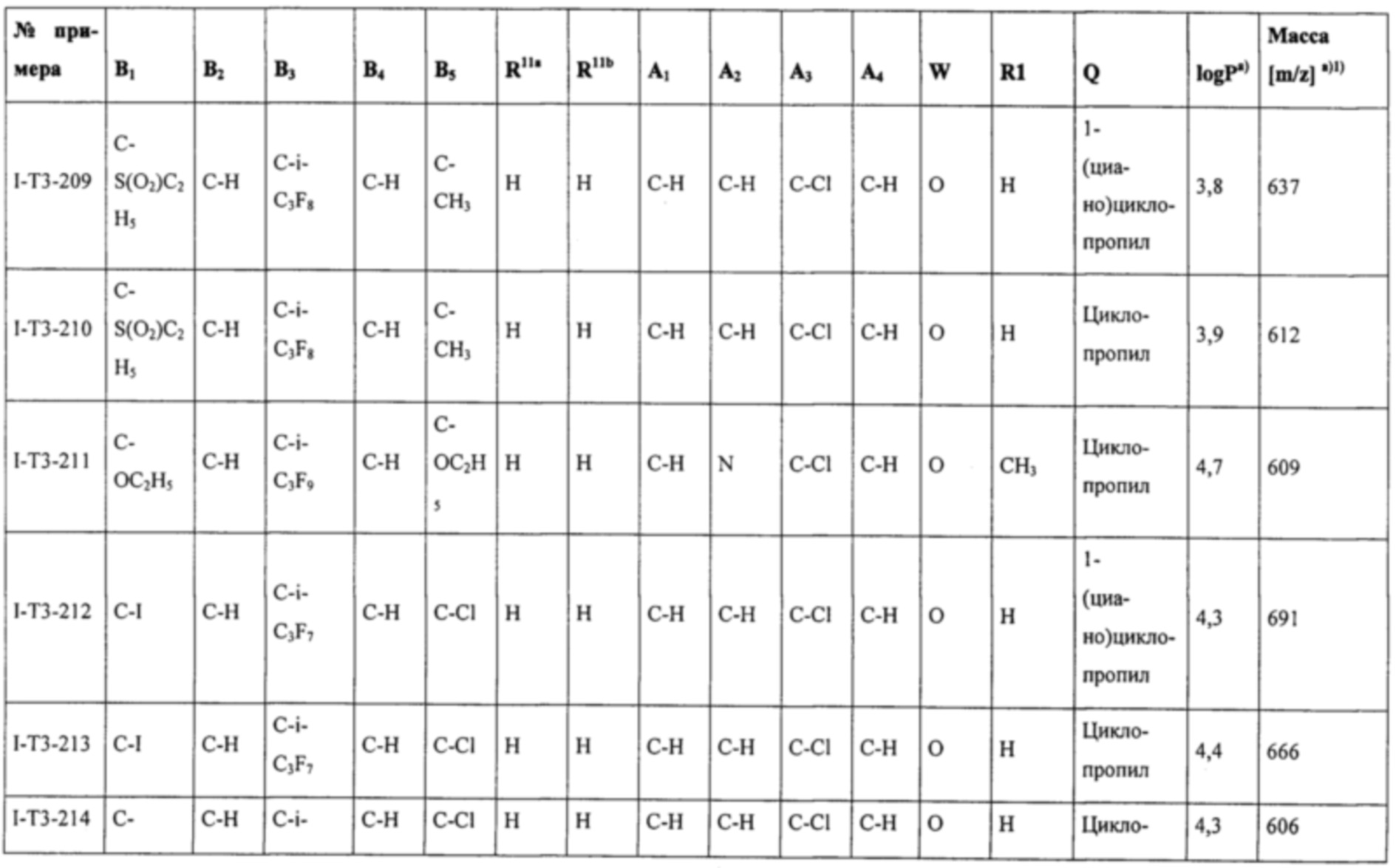









ЯМР-данные выбранных примеров
1H-ЯМР-данные выбранных примеров приводятся в форме перечня1Н-ЯМР-пиков. Для каждого сигнального пика сначала приводится первое значение δ в ppm и затем интенсивность сигнала в круглых скобках. Значения δ - пары чисел интенсивности сигнала для различных сигнальных пиков приводятся отделенными друг от друга точкой с запятой.
Поэтому перечень пиков для одного примера имеет форму:
δ1 (интенсивность1); δ2 (интенсивность2); …; δi (интенсивностьi); …; δn (интенсивностьn)
Интенсивность резких сигналов коррелирует с высотой сигналов в напечатанном примере спектра ЯМР в см и показывает истинные отношения интенсивностей сигналов. В случае широких сигналов, несколько пика или среднее сигнала и его относительная интенсивность могут быть показаны в сравнении с наиболее интенсивным сигналов в спектре.
Для калибровки химический сдвиг1Н-ЯМР спектров применяли тетраметилсилан и/или химический сдвиг растворителя, особенно в случае спектров, измеренных в DMSO. Поэтому пик тетраметилсилана может встречаться, но не обязательно, в перечне пиков ЯМР.
Перечни1Н-ЯМР пиков подобны стандартным отпечаткам1Н-ЯМР и, таким образом, как правило, содержат все пики, перечисленных в стандартных интерпретациях ЯМР.
Кроме того, подобно стандартным отпечаткам1Н-ЯМР, они могут показывать сигналы растворителя, сигналы стереоизомеров целевых соединений, которые, подобным образом, являются объектом настоящего изобретения, и/или пики примесей.
При сообщении сигналов соединения в дельта диапазоне растворителей и/или воды, перечни согласно настоящему изобретению 1Н-ЯМР пиков показывают пики обычных растворителей, например, пики DMSO в DMSO-D6 и пик воды, который, как правило, имеет в среднем высокую эффективность.
Пики стереоизомеров целевых соединений и/или пики примесей, как правило, имеют более низкую интенсивность в среднем, чем пики целевых соединений (например, при чистоте >90%).
Такие стереоизомеры и/или примеси могут быть типичными для конкретного способа получения. Их пики могут, таким образом, помочь в этом случае идентифицировать воспроизведение способ получения согласно настоящему изобретению со ссылкой "отпечатки побочных продуктов".
Специалист, вычисляющий пики целевых соединений известными способами (MestreC, ACD-симуляция, а также эмпирически вычисленные ожидаемые значения) может, если требуется, выделить пики целевых соединений, при необходимости с применением дополнительных фильтров интенсивности. Это выделение подобно релевантному пику, выявленному в стандартной интерпретации 1Н-ЯМР.
Более подробные перечни 1Н-ЯМР пиков можно найти в Research Disclosure Database Number 564025.













































Биологические примеры
Rhipicephalus sanguineus - in-vitro контактные тесты со взрослыми коричневыми клещами собачьими
Для покрытия пробирок, 9 мг активного ингредиента сначала растворили в 1 мл ацетона ч.д.а. и затем разбавили до желаемой концентрации с помощью ацетона ч.д.а., 250 мкл раствора распределили по гомогенно по внутренним стенкам и основанию пробирки объемом 25 мл посредством вращения и качания на орбитальном шейкере (вращение при встряхивании в течение 2 часов при 30 оборотах в минуту). При растворе активного соединения 900 частей на миллион и внутренней поверхности 44,7 см2 доза на площадь поверхности, равная 5 мкг/см2, достигается при гомогенном распределении.
После выпаривания растворителя, пробирки заселили 5-10 взрослыми клещами собачьими (Rhipicephalus sanguineus), запаяли перфорированной пластиковой крышкой и инкубировали в горизонтальном положении в темноте при комнатной температуре и влажности окружающей среды. Через 48 часов определили эффективность. В конце, клещи ударялись о дно пробирки, и инкубацию проводили на плитке при 45-50°C, самое большее, 5 мин. Клещи, которые остались неподвижными на дне, или двигались настолько нескоординированным образом, что не могли целенаправленно взлететь наверх, чтобы избежать нагрева, рассматриваются или оцениваются как умерщвленные.
Вещество показывает хорошую эффективность против Rhipicephalus sanguineus, если в этом тесте при норме нанесения 5 мкг/см2 достигается эффективность по меньшей мере 80%. Эффективность 100% означает, что все клещи погибли или умеряют. Эффективность 0% означает, что ни один клещ не погиб.
В этом тесте, например, следующие соединения из примеров получения показали эффективность 100% при норме нанесения 5 мкг/см2: I-T3-1, I-T3-3, I-T3-20, I-T3-21, I-T3-23, I-T3-24, I-T3-42, I-T3-44, I-T3-46, I-T3-47, I-T3-52, I-T3-53, I-T3-54, I-Т3-55, I-T3-56, I-T3-61, I-T3-63, I-T3-71, I-T3-72, I-T3-81, I-T3-90, I-T3-91, I-T3-96, I-T3-97, I-T3-98, I-T3-104, I-T3-106, I-T3-109, I-T3-110, I-T3-112, I-T3-117, I-T3-119, I-T3-148, I-T3-155, I-T3-160, I-T3-161, I-T3-162, I-T3-163, I-T3-165, I-T3-175, I-T3-176, I-T3-189, I-T3-196, I-T4-1, I-T4-2, I-T4-3, I-T4-4, I-T22-2, I-T22-1, I-T22-4, I-T22-5, I-T22-6, I-T22-7
В этом тесте, например, следующие соединения из примеров получения показали эффективность 80% при норме нанесения 5 мкг/см2: I-T3-38, I-T3-43, I-T3-80, I-Т3-88, I-T3-92, I-T3-143
В этом тесте, например, следующие соединения из примеров получения показали эффективность 100% при норме нанесения 1 мкг/см2: I-T3-108, I-T3-114, I-T3-141
В этом тесте, например, следующие соединения из примеров получения показали эффективность 80% при норме нанесения 1 мкг/см2: I-T3-94, I-T3-123
В этом тесте, например, следующие соединения из примеров получения показали эффективность 100% при норме нанесения 0,2 мкг/см2: I-T3-105
В этом тесте, например, следующие соединения из примеров получения показали эффективность 80% при норме нанесения 0,2 мкг/см2: I-T3-64
Ctenocephalides felis - in-vitro контактные тесты со взрослыми блохами кошек
Для покрытия пробирок, 9 мг активного ингредиента сначала растворили в 1 мл ацетона ч.д.а. и затем разбавили до желаемой концентрации с помощью ацетона ч.д.а., 250 мкл раствора распределили по гомогенно по внутренним стенкам и основанию пробирки объемом 25 мл посредством вращения и качания на орбитальном шейкере (вращение при встряхивании в течение 2 часов при 30 оборотах в минуту). При растворе активного соединения 900 частей на миллион и внутренней поверхности 44,7 см2 доза на площадь поверхности, равная 5 мкг/см2, достигается при гомогенном распределении.
После выпаривания растворителя, пробирки заселили 5-10 взрослыми блохами кошек (Ctenocephalides felis), запаяли перфорированной пластиковой крышкой и инкубировали в горизонтальном положении в темноте при комнатной температуре и влажности окружающей среды. Через 48 часов определили эффективность. В конце, блохи ударялись о дно пробирки, и инкубацию проводили на плитке при 45-50°C, самое большее, 5 мин. Блохи, которые остались неподвижными на дне, или двигались настолько нескоординированным образом, что не могли целенаправленно взлететь наверх, чтобы избежать нагрева, рассматриваются или оцениваются как умерщвленные.
Вещество показывает хорошую эффективность против Ctenocephalides felis, если в этом тесте при норме нанесения 5 мкг/см2 достигается эффективность по меньшей мере 80%. Эффективность 100% означает, что все блохи погибли или умеряют. Эффективность 0% означает, что ни одна блоха не погибла.
В этом тесте, например, следующие соединения из примеров получения показали эффективность 100% при норме нанесения 5 мкг/см2 (=500 г/га): I-T3-1, I-T3-3, I-Т3-7, I-T3-9, I-T3-17, I-T3-20, I-T3-21, I-T3-23, I-T3-24, I-T3-25, I-T3-27, I-T3-28, I-Т3-29, I-T3-30, I-T3-31, I-T3-42, I-T3-43, I-T3-44, I-T3-46, I-T3-54, I-T3-55, I-T3-56, I-T3-57, I-T3-61, I-T3-63, I-T3-64, I-T3-71, I-T3-72, I-T3-80, I-T3-81, I-T3-84, I-T3-85, I-T3-86, I-T3-87, I-T3-88, I-T3-91, I-T3-92, I-T3-93, I-T3-94, I-T3-95, I-T3-96, I-Т3-97, I-T3-98, I-T3-99, I-T3-100, I-T3-101, I-T3-102, I-T3-103, I-T3-106, I-T3-107, I-T3-108, I-T3-109, I-T3-110, I-T3-111, I-T3-112, I-T3-113, I-T3-114, I-T3-115, I-T3-116, I-T3-117, I-T3-118, I-T3-119, I-T3-120, I-T3-123, I-T3-124, I-T3-125, I-T3-127, I-T3-128, I-T3-129, I-T3-130, I-T3-131, I-T3-132, I-T3-133, I-T3-136, I-T3-137, I-T3-138, I-T3-143, I-T3-145, I-T3-147, I-T3-148, I-T3-155, I-T3-160, I-T3-162, I-T3-163, I-T3-165, I-T3-175, I-T3-176, I-T3-189, I-T3-196, I-T3-199, I-T4-2, I-T4-3, I-T4-4, I-Т22-1, I-T22-2, I-T22-3, I-T22-5, I-T22-7, I-T23-1, I-T23-2, I-T46-2
Amblyomma hebaraeum - тест
Растворитель: Диметилсульфоксид
Для получения подходящей композиции активного вещества, 10 мг активного вещества смешали с 0.5 мл диметилсульфоксида, и концентрат разбавили водой до желаемой концентрации
Личинки клещей (Amblyomma hebraeum) поместили в пластиковый стакан и покрыли при желаемой концентрации в течение одной минуты. Клещей перенесли на фильтровальной бумагу в чашке Петри и хранили в кабине с контролируемыми климатическими условиями.
Через 42 дня определяли смертность в %. При этом 100% означает, что все клещи погибли; 0% означает, что ни один клещ не погиб.
В этом тесте, например, следующие соединения из примеров получения показали эффективность 100% при норме нанесения 100 частей на миллион: I-T3-1, I-T3-3, I-T3-20, I-T3-21, I-T3-24, I-T3-28, I-T3-42, I-T3-43, I-T3-44, I-T3-54, I-T3-55, I-T3-56, I-T3-57, I-T3-63, I-T3-64, I-T3-71, I-T3-72, I-T3-81, I-T3-86, I-T3-91, I-T3-92, I-Т3-95, I-T3-96, I-T3-97, I-T3-98, I-T3-100, I-T3-104, I-T3-106, I-T3-107, I-T3-108, I-Т3-109, I-T3-110, I-T3-112, I-T3-114, I-T3-116, I-T3-117, I-T3-119, I-T3-124, I-T3-125, I-T3-131, I-T3-148, I-T3-155, I-T3-162, I-T3-163, I-T22-1, I-T22-2, I-T23-1, I-Т4-3, I-T4-4
В этом тесте, например, следующие соединения из примеров получения показали эффективность 95% при норме нанесения 100 частей на миллион: I-T3-101
В этом тесте, например, следующие соединения из примеров получения показали эффективность 90% при норме нанесения 100 частей на миллион: I-T3-102, I-T3-103
В этом тесте, например, следующие соединения из примеров получения показали эффективность 85% при норме нанесения 100 частей на миллион: I-T3-105
В этом тесте, например, следующие соединения из примеров получения показали эффективность 80% при норме нанесения 100 частей на миллион: I-T3-53, I-T3-61, I-T3-111, I-T3-123
Boophilus microplus - тест посредством инъекции
Растворитель: Диметилсульфоксид
Для получения подходящей композиции активного вещества, 10 мг активного вещества смешали с 0.5 мл диметилсульфоксида, и концентрат разбавили водой до желаемой концентрации
1 мкл раствора активного вещества инъецировали в брюшко 5 налившихся кровью взрослых самок клещей кольчатых (Boophilus microplus). Клещей перенесли на блюдца и хранили в комнате с контролируемыми климатическими условиями.
Эффективность оценивали через 7 дней после отложения оплодотворенных яиц. Яйца, оплодотворенность которых не заметна, хранили в кабинете с контролируемыми климатическими условиями, до выведения личинок через около 42 дня. Эффективность 100% означает, что ни один клещ не вывелся из оплодотворенных яиц, 0% означает, что все яйца являются оплодотворенными.
В этом тесте, например, следующие соединения из примеров получения показали эффективность 100% при норме нанесения 20 мкг/животное: I-T2-1, I-T2-2, I-T3-1, I-T3-2, I-T3-3, I-T3-4, I-T3-5, I-T3-6, I-T3-7, I-T3-8, I-T3-9, I-T3-10, I-T3-11, I-T3-12, I-T3-13, I-T3-15, I-T3-17, I-T3-18, I-T3-19, I-T3-20, I-T3-21, I-T3-23, I-T3-24, I-Т3-25, I-T3-26, I-T3-27, I-T3-28, I-T3-29, I-T3-30, I-T3-31, I-T3-32, I-T3-33, I-T3-34, I-T3-35, I-T3-36, I-T3-37, I-T3-38, I-T3-39, I-T3-40, I-T3-41, I-T3-42, I-T3-43, I-T3-44, I-T3-45, I-T3-46, I-T3-47, I-T3-48, I-T3-49, I-T3-50, I-T3-51, I-T3-52, I-T3-53, I-Т3-54, I-T3-55, I-T3-56, I-T3-57, I-T3-58, I-T3-59, I-T3-60, I-T3-61, I-T3-62, I-T3-63, I-T3-64, I-T3-65, I-T3-66, I-T3-67, I-T3-68, I-T3-69, I-T3-70, I-T3-71, I-T3-72, I-T3-73, I-T3-74, I-T3-76, I-T3-77, I-T3-78, I-T3-79, I-T3-80, I-T3-81, I-T3-82, I-T3-83, I-Т3-84, I-T3-85, I-T3-86, I-T3-87, I-T3-88, I-T3-89, I-T3-90, I-T3-91, I-T3-92, I-T3-93, I-T3-94, I-T3-95, I-T3-96, I-T3-97, I-T3-98, I-T3-99, I-T3-100, I-T3-101, I-T3-102, I-Т3-103, I-T3-104, I-T3-105, I-T3-106, I-T3-107, I-T3-108, I-T3-109, I-T3-110, I-T3-111, I-T3-112, I-T3-113, I-T3-114, I-T3-115, I-T3-116, I-T3-117, I-T3-118, I-T3-119, I-T3-120, I-T3-123, I-T3-124, I-T3-125, I-T3-126, I-T3-127, I-T3-128, I-T3-129, I-T3-130, I-T3-131, I-T3-132, I-T3-133, I-T3-136, I-T3-137, I-T3-145, I-T3-139, I-T3-140, I-T3-141, I-T3-142, I-T3-143, I-T3-144, I-T3-146, I-T3-148, I-T3-149, I-T3-150, I-T3-151, I-T3-155, I-T3-160, I-T3-161, I-T3-162, I-T3-163, I-T3-165, I-T3-168, I-T3-175, I-T3-176, I-T3-189, I-T4-1, I-T4-2, I-T4-3, I-T4-4, I-T22-1, I-T22-2, I-T22-3, I-T22-4, I-T22-5, I-T22-6, I-T22-7, I-T23-1, I-T23-2, I-T46-2
В этом тесте, например, следующие соединения из примеров получения показали эффективность 90% при норме нанесения 20 мкг/животное: I-T3-75
В этом тесте, например, следующие соединения из примеров получения показали эффективность 80% при норме нанесения 20 мкг/животное: I-T3-121
Boophilus microplus - тест погружением
Тестируемые животные: клещи кольчатые (Boophilus microplus) штамм Parkhurst, SP-резистентные
Растворитель: Диметилсульфоксид
10 мг активного вещества растворили в 0,5 мл диметилсульфоксида. В целях получения подходящей композиции, раствор активного вещества разбавили водой до концентрации, необходимой в каждом случае.
Эту композицию активного вещества перенесли пипеткой в пробирки. 8-10 налившихся кровью взрослых самок клещей кольчатых (Boophilus microplus) перенесли в другую пробирку с отверстиями. Пробирку поместили в композицию активного вещества, причем все клещи были смочены. После того, как жидкость стекла, клещей перенесли на фильтровальные диски в пластиковых чашках и хранили в комнате с контролируемыми климатическими условиями.
Эффективность оценивали через 7 дней после отложения оплодотворенных яиц. Яйца, оплодотворенность которых не заметна, хранили в кабинете с контролируемыми климатическими условиями, до выведения личинок через около 42 дня. Эффективность 100% означает, что ни один клещ не вывелся из оплодотворенных яиц, 0% означает, что все яйца являются оплодотворенными.
В этом тесте, например, следующие соединения из примеров получения показали эффективность 100% при норме нанесения 100 частей на миллион: I-T3-1, I-T3-3, I-T3-20, I-T3-21, I-T3-24, I-T3-28, I-T3-39, I-T3-42, I-T3-43, I-T3-44, I-T3-48, I-T3-53, I-T3-54, I-T3-55, I-T3-56, I-T3-57, I-T3-61, I-T3-63, I-T3-64, I-T3-71, I-T3-72, I-Т3-81, I-T3-86, I-T3-91, I-T3-92, I-T3-95, I-T3-96, I-T3-97, I-T3-98, I-T3-100, I-T3-101, I-T3-102, I-T3-103, I-T3-104, I-T3-106, I-T3-107, I-T3-108, I-T3-109, I-T3-110, I-T3-112, I-T3-113, I-T3-114, I-T3-115, I-T3-116, I-T3-117, I-T3-118, I-T3-119, I-T3-120, I-T3-123, I-T3-124, I-T3-125, I-T3-130, I-T3-131, I-T3-133, I-T3-148, I-T3-155, I-T3-160, I-T3-162, I-T3-163, I-T3-165, I-T3-175, I-T3-176, I-T4-3, I-T4-4, I-T22-1, I-Т22-2, I-T22-4, I-T22-5, I-T22-6, I-T22-7, I-T23-1
В этом тесте, например, следующие соединения из примеров получения показали эффективность 98% при норме нанесения 100 частей на миллион: I-T3-111
В этом тесте, например, следующие соединения из примеров получения показали эффективность 90% при норме нанесения 100 частей на миллион: I-T3-99
В этом тесте, например, следующие соединения из примеров получения показали эффективность 80% при норме нанесения 100 частей на миллион: I-T3-27, I-T3-80
Ctenocephalides felis - пероральный тест
Растворитель: Диметилсульфоксид
В целях получения подходящей композиции активного вещества 10 мг активного вещества смешали с 0,5 мл диметилсульфоксида. Разбавление цитрированной кровью скота дало желаемую концентрацию.
Около 20 некормленых взрослых блох кошачьих (Ctenocephalides felis) поместили в камеру, которая закрыта наверху и снизу тонкой сеткой. Металлический цилиндр, дно которого закрыто парафиновой пленкой, поместили на камеру. Цилиндр содержит препарат крови/активного вещества, который может поглощаться блохами через мембрану из парафиновой пленки.
Через 2 дня определили смертность в %. При этом 100% означает, что все блохи погибли; 0% означает, что ни одна блоха не погибла.
В этом тесте, например, следующие соединения из примеров получения показали эффективность 100% при норме нанесения 100 частей на миллион: I-T3-1, I-T3-2, I-T3-3, I-T3-4, I-T3-5, I-T3-7, I-T3-8, I-T3-9, I-T3-10, I-T3-12, I-T3-18, I-T3-20, I-T3-21, I-T3-23, I-T3-24, I-T3-25, I-T3-26, I-T3-27, I-T3-28, I-T3-29, I-T3-30, I-T3-31, I-Т3-32, I-T3-33, I-T3-34, I-T3-35, I-T3-38, I-T3-39, I-T3-40, I-T3-42, I-T3-43, I-T3-44, I-T3-46, I-T3-47, I-T3-48, I-T3-49, I-T3-50, I-T3-51, I-T3-52, I-T3-53, I-T3-54, I-T3-55, I-T3-56, I-T3-57, I-T3-58, I-T3-59, I-T3-61, I-T3-62, I-T3-63, I-T3-64, I-T3-65, I-Т3-66, I-T3-67, I-T3-68, I-T3-69, I-T3-71, I-T3-72, I-T3-73, I-T3-76, I-T3-77, I-T3-78, I-T3-80, I-T3-81, I-T3-84, I-T3-85, I-T3-86, I-T3-87, I-T3-88, I-T3-89, I-T3-90, I-T3-91, I-T3-92, I-T3-93, I-T3-94, I-T3-95, I-T3-96, I-T3-97, I-T3-98, I-T3-99, I-T3-100,1-Т3-101, I-T3-102, I-T3-103, I-T3-104, I-T3-105, I-T3-106, I-T3-107, I-T3-108, I-T3-109, I-T3-110, I-T3-111, I-T3-112, I-T3-113, I-T3-114, I-T3-115, I-T3-116, I-T3-117, I-T3-118, I-T3-119, I-T3-120, I-T3-123, I-T3-124, I-T3-125, I-T3-127, I-T3-128, I-T3-129, I-T3-130, I-T3-131, I-T3-132, I-T3-133, 1-Т3-135, I-T3-136, I-T3-137, I-T3-139, I-T3-140, I-T3-141, I-T3-143, I-T3-145, I-T3-146, I-T3-148, I-T3-149, I-T3-150, I-T3-151, I-T3-155, I-T3-160, I-T3-161, I-T3-162, I-T3-163, I-T3-165, I-T3-168, I-T3-175, I-T3-176, I-T3-189, I-T4-1, I-T4-2, I-T4-3, I-T4-4, I-T22-1, I-T22-2, I-T22-3, I-T22-4, I-T22-5, I-T22-7, I-T23-1, I-T23-2, I-T46-2
В этом тесте, например, следующие соединения из примеров получения показали эффективность 95% при норме нанесения 100 частей на миллион: I-T3-11, I-T3-17, I-T3-19, I-T3-41, I-T3-45, I-T3-70, I-T3-79, I-T3-82, I-T3-83, I-T22-6
В этом тесте, например, следующие соединения из примеров получения показали эффективность 90% при норме нанесения 100 частей на миллион: I-T3-15, I-T3-37, I-T3-60, I-T3-126, I-T3-144
В этом тесте, например, следующие соединения из примеров получения показали эффективность 80% при норме нанесения 100 частей на миллион: I-T3-13, I-T3-16, I-T3-36
Lucilia cuprina - тест
Растворитель: Диметилсульфоксид
Для получения подходящей композиции активного вещества, 10 мг активного вещества смешали с 0.5 мл диметилсульфоксида, и концентрат разбавили водой до желаемой концентрации
Около 20 L1 личинок австралийской мясной мухи зеленой (Lucilia cuprina) перенесли в тестовый сосуд, содержащий измельченную конину и препарат активного вещества желаемой концентрации.
Через 2 дня определили смертность в %. При этом 100% означает, что все личинки погибли; 0% означает, что ни одна личинка не погибла.
В этом тесте, например, следующие соединения из примеров получения показали эффективность 100% при норме нанесения 100 частей на миллион: I-T3-1, I-T3-2, I-T3-3, I-T3-4, I-T3-5, I-T3-6, I-T3-7, I-T3-8, I-T3-9, I-T3-10, I-T3-15, I-T3-17, I-T3-18, I-T3-20, I-T3-21, I-T3-23, I-T3-24, I-T3-25, I-T3-26, I-T3-27, I-T3-28, I-T3-29, I-Т3-30, I-T3-31, I-T3-32, I-T3-33, I-T3-34, I-T3-35, I-T3-36, I-T3-37, I-T3-38, I-T3-39, I-T3-40, I-T3-42, I-T3-43, I-T3-44, I-T3-45, I-T3-46, I-T3-47, I-T3-48, I-T3-49, I-T3-50, I-T3-51, I-T3-52, I-T3-53, I-T3-54, I-T3-55, I-T3-56, I-T3-57, I-T3-58, I-T3-59, I-Т3-61, I-T3-62, I-T3-63, I-T3-64, I-T3-65, I-T3-66, I-T3-67, I-T3-68, I-T3-70, I-T3-71, I-T3-72, I-T3-73, I-T3-77, I-T3-78, I-T3-80, I-T3-81, I-T3-82, I-T3-83, I-T3-84, I-T3-85, I-T3-86, I-T3-87, I-T3-88, I-T3-89, I-T3-90, I-T3-91, I-T3-92, I-T3-93, I-T3-94, I-Т3-96, I-T3-97, I-T3-98, I-T3-99, I-T3-100, I-T3-101, I-T3-102, I-T3-103, I-T3-104, I-Т3-105, I-T3-106, I-T3-107, I-T3-108, I-T3-109, I-T3-110, I-T3-111, I-T3-112, I-T3-113, I-T3-114, I-T3-115, I-T3-116, I-T3-117, I-T3-118, I-T3-119, I-T3-120, I-T3-123, I-T3-124, I-T3-125, I-T3-130, I-T3-131, I-T3-133, I-T3-136, I-T3-139, I-T3-140, I-T3-141, I-T3-143, I-T3-144, I-T3-145, I-T3-148, I-T3-149, I-T3-150, I-T3-151, I-T3-155, I-T3-160, I-T3-161, I-T3-162, I-T3-163, I-T3-165, I-T3-168, I-T3-175, I-T3-176, I-T3-189, I-T4-1, I-T4-2, I-T4-3, I-T4-4, I-T22-1, I-T22-2, I-T22-3, I-T22-5, I-T22-6, I-T22-7, I-T23-1, I-T23-2, I-T46-2
В этом тесте, например, следующие соединения из примеров получения показали эффективность 95% при норме нанесения 100 частей на миллион: I-T3-69
В этом тесте, например, следующие соединения из примеров получения показали эффективность 90% при норме нанесения 100 частей на миллион: I-T3-41, I-T3-60, I-T3-74, I-T3-76, I-T3-127, I-T3-146
В этом тесте, например, следующие соединения из примеров получения показали эффективность 80% при норме нанесения 100 частей на миллион: I-T3-12, I-T3-75, I-T3-79, I-T3-121, I-T3-137
Musca domestica - тест
Растворитель: Диметилсульфоксид
Для получения подходящей композиции активного вещества, 10 мг активного вещества смешали с 0.5 мл диметилсульфоксида, и концентрат разбавили водой до желаемой концентрации
Сосуды, содержащие спонж, обработанный сахарным раствором и композицией активного вещества желаемой концентрации, заселили 10 взрослыми комнатными мухами (Musca domestica).
Через 2 дня определили смертность в %. При этом 100% означает, что все мухи погибли; 0% означает, что ни одна муха не погибла.
В этом тесте, например, следующие соединения из примеров получения показали эффективность 100% при норме нанесения 100 частей на миллион: I-T3-1, I-T3-2, I-T3-3, I-T3-4, I-T3-5, I-T3-8, I-T3-20, I-T3-21, I-T3-23, I-T3-24, I-T3-25, I-T3-26, I-Т3-27, I-T3-29, I-T3-31, I-T3-34, I-T3-38, I-T3-42, I-T3-43, I-T3-46, I-T3-48, I-T3-52, I-T3-53, I-T3-54, I-T3-55, I-T3-56, I-T3-57, I-T3-58, I-T3-61, I-T3-62, I-T3-63, I-T3-64, I-T3-65, I-T3-71, I-T3-72, I-T3-73, I-T3-77, I-T3-80, I-T3-84, I-T3-85, I-T3-86, I-Т3-87, I-T3-89, I-T3-91, I-T3-92, I-T3-93, I-T3-94, I-T3-96, I-T3-97, I-T3-100, I-T3-101, I-T3-102, I-T3-103, I-T3-104, I-T3-106, I-T3-107, I-T3-108, I-T3-109, I-T3-110, I-T3-111, I-T3-112, I-T3-113, I-T3-114, I-T3-115, I-T3-116, I-T3-117, I-T3-118, I-T3-119, I-T3-120, I-T3-123, I-T3-124, I-T3-125, I-T3-130, I-T3-131, I-T3-133, I-T3-136, I-T3-137, I-T3-141, I-T3-143, I-T3-144, I-T3-148, I-T3-149, I-T3-150, I-T3-151, I-T3-155, I-T3-160, I-T3-161, I-T3-162, I-T3-163, I-T3-165, I-T3-175, I-T3-176, I-T3-189, I-T4-2, I-T22-1, I-T22-2, I-T22-3, I-T22-5, I-T22-7, I-T23-1, I-T23-2
В этом тесте, например, следующие соединения из примеров получения показали эффективность 95% при норме нанесения 100 частей на миллион: I-T3-51
В этом тесте, например, следующие соединения из примеров получения показали эффективность 90% при норме нанесения 100 частей на миллион: I-T3-30, I-T3-67, I-T3-76, I-T3-81, I-T3-90, I-T3-98, I-T3-99, I-T3-139, I-T3-145, I-T22-6
В этом тесте, например, следующие соединения из примеров получения показали эффективность 80% при норме нанесения 100 частей на миллион: I-T3-7, I-T3-66, I-T3-68, I-T3-79, I-T3-88, I-T3-105, I-T3-121, I-T3-129
В этом тесте, например, следующие соединения из примеров получения показали эффективность 80% при норме нанесения 20 частей на миллион: I-T3-28
В этом тесте, например, следующие соединения из примеров получения показали эффективность 80% при норме нанесения 4 частей на миллион: I-T3-35
Meloidogyne incognita- тест
Растворитель: 125,0 мас. частей ацетона
Для получения подходящей композиции активного вещества 1 мас. часть активного вещества смешали с установленным количеством растворителя, и концентрат разбавили водой до желаемой концентрации.
Сосуды заполнили песком, раствором активного вещества, суспензией яиц/личинок южных нематод корневого нароста (Meloidogyne incognita) и семенами салата-латука. Семена латука проросли, и растения развились. Галлы развились на корнях.
Через 14 дней нематицидную эффективность в % определили по образованию галл. При этом 100% означает, что ни одна галла не обнаружена; 0% означает, что число галл на обработанных растениях соответствует необработанному контролю.
В этом тесте, например, следующие соединения из примеров получения показали эффективность 90% при норме нанесения 20 частей на миллион: I-T3-27, I-T3-28, I-T3-184, I-T3-185
Myzus persicae - тест распылением
Растворитель: 78 мас. частей ацетона и 1,5 мас. частей диметилформамида
Эмульгатор: алкиларилполигликолевый простой эфир
Для получения подходящей композиции активного вещества 1 мас. часть растворили с применением установленных мас. частей растворителя, и разбавили водой, содержащей 1000 частей на миллион эмульгатора, до желаемой концентрации.
Для получения других тестовых концентраций, препарат разбавили водой, содержащей эмульгатор.
На диски листьев китайской капусты (Brassica pekinensis), на которых на всех стадиях паразитировала зеленая тля персиковая (Myzus persicae), распылили композицию активного вещества желаемой концентрации.
Через 6 дней эффективность определили в процентах. При этом 100% означает, что все особи тли погибли; 0% означает, что ни одна особь тли не погибла.
В этом тесте, например, следующие соединения из примеров получения показали эффективность 100% при норме нанесения 500 г/га: I-T3-7, I-T3-20, I-T3-43, I-T3-44, I-T3-46, I-T3-92, I-T3-100, I-T3-106, I-T3-107, I-T3-108, I-T3-110, I-T3-122, I-Т3-185, I-T3-187
В этом тесте, например, следующие соединения из примеров получения показали эффективность 90% при норме нанесения 500 г/га: I-T3-8, I-T3-21, I-T3-29, I-T3-30, I-T3-42, I-T3-91, I-T3-97, I-T3-103, I-T3-105, I-T3-109, I-T3-114, I-T3-117, I-T3-119, I-T3-120, I-T3-186
В этом тесте, например, следующие соединения из примеров получения показали эффективность 100% при норме нанесения 100 г/га: I-T3-1, I-T3-3, I-T3-27, I-T3-54, I-T3-55, I-T3-77, I-T3-88, I-T3-99, I-T3-101, I-T3-112, I-T3-113, I-T3-115, I-T3-116, I-T3-118, I-T3-123, I-T3-124, I-T3-125, I-T3-127, I-T3-128, I-T3-129, I-T3-130, I-T3-162, I-T3-165, I-T3-170, I-T3-174, I-T3-175, I-T3-176, I-T3-179, I-T3-184, I-T3-189, I-T22-1, I-T22-2, I-T22-5, I-T22-7
В этом тесте, например, следующие соединения из примеров получения показали эффективность 90% при норме нанесения 100 г/га: I-T3-28, I-T3-38, I-T3-39, I-T3-53, I-T3-64, I-T3-72, I-T3-76, I-T3-80, I-T3-81, I-T3-85, I-T3-87, I-T3-95, I-T3-96, I-Т3-98, I-T3-131, I-T3-132, I-T3-145, I-T3-160, I-T3-164, I-T3-163, I-T4-3
В этом тесте, например, следующие соединения из примеров получения показали эффективность 90% при норме нанесения 20 г/га: I-T3-182, I-T4-2
Phaedon cochleariae - тест распылением
Растворитель: 78,0 мас. частей ацетона и 1,5 мас. частей диметилформамида
Эмульгатор: алкиларилполигликолевый простой эфир
Для получения подходящей композиции активного вещества 1 мас. часть растворили с применением установленных мас. частей растворителя, и разбавили водой, содержащей 1000 частей на миллион эмульгатора, до желаемой концентрации. Для получения других тестовых концентраций, препарат разбавили водой, содержащей эмульгатор.
На диски листьев китайской капусты (Brassica pekinensis) распылили композицию активного вещества желаемой концентрации, и, после сушки, заселили личинками листоеда хреновый (Phaedon cochleariae).
Через 7 дней эффективность определили в процентах. При этом 100% означает, что все личинки листоеда погибли; 0% означает, что ни одна личинка листоеда не погибла.
В этом тесте, например, следующие соединения из примеров получения показали эффективность 100% при норме нанесения 500 г/га: I-T3-7, I-T3-8, I-T3-9, I-T3-10, I-T3-12, I-T3-15, I-T3-17, I-T3-18, I-T3-19, I-T3-20, I-T3-21, I-T3-22, I-T3-23, I-T3-24, I-T3-25, I-T3-26, I-T3-29, I-T3-30, I-T3-31, I-T3-34, I-T3-35, I-T3-36, I-T3-37, I-Т3-42, I-T3-43, I-T3-44, I-T3-45, I-T3-46, I-Т3-47, I-T3-65, I-T3-66, I-T3-67, I-T3-68, I-T3-69, I-T3-70, I-T3-73, I-T3-74, I-T3-75, I-T3-76, I-T3-77, I-T3-78, I-T3-79, I-T3-89, I-T3-90, I-T3-91, I-T3-92, I-T3-96, I-T3-97, I-T3-98, I-T3-100, I-T3-101, I-T3-102, I-T3-103, I-T3-104, I-T3-105, I-T3-106, I-T3-107, I-T3-108, I-T3-109, I-T3-110, I-T3-111, I-T3-112, I-T3-113, I-T3-114, I-T3-115, I-T3-116, I-T3-117, I-T3-118, I-T3-119, I-T3-120, I-T3-126, I-T3-184, I-T3-185, I-T3-186, I-T3-187, I-T3-188, I-T23-1, I-T23-2
В этом тесте, например, следующие соединения из примеров получения показали эффективность 100% при норме нанесения 100 г/га: I-T2-1, I-T2-2, I-T3-1, I-T3-2, I-T3-3, I-T3-4, I-T3-5, I-T3-6, I-T3-27, I-T3-28, I-T3-38, I-T3-39, I-T3-40, I-T3-41, I-Т3-48, I-T3-49, I-T3-50, I-T3-51, I-T3-52, I-T3-53, I-T3-54, I-T3-55, I-T3-56, I-T3-57, I-T3-58, I-T3-59, I-T3-61, I-T3-62, I-T3-63, I-T3-64, I-T3-71, I-T3-72, I-T3-80, I-T3-81, I-T3-82, I-T3-83, I-T3-84, I-T3-85, I-T3-86, I-T3-87, I-T3-88, I-T3-93, I-T3-94, I-Т3-95, I-T3-99, I-T3-123, I-T3-124, I-T3-125, I-T3-127, I-T3-128, I-T3-129, I-T3-130, I-T3-131, I-T3-132, I-T3-133, I-T3-136, I-T3-137, I-T3-139, I-T3-140, I-T3-141, I-T3-143, I-T3-144, I-T3-145, I-T3-148, I-T3-149, I-T3-151, I-T3-152, I-T3-153, I-T3-155, I-T3-160, I-T3-161, I-T3-162, I-T3-163, I-T3-164, I-T3-165, I-T3-168, I-T3-169, I-T3-170, I-T3-171, I-T3-172, I-T3-174, I-T3-175, I-T3-176, I-T3-177, I-T3-178, I-T3-179, I-T3-180, I-T3-181, I-T3-182, I-T3-183, I-T3-189, I-T3-190, I-T3-191, I-T3-192, I-T3-195, I-T3-197, I-T3-198, I-T3-220, I-T3-221, I-T3-222, I-T3-223, I-T4-1, I-T4-2, I-T4-3, I-T4-4, I-T22-1, I-T22-2, I-T22-3, I-T22-4, I-T22-5, I-T22-6, I-T22-7, I-T46-2, I-Т46-3, I-T46-4, I-T46-5, I-T46-6.
В этом тесте, например, следующие соединения из примеров получения показали эффективность 83% при норме нанесения 100 г/га: I-T3-138
Spodoptera frugiperda - тест распылением
Растворитель: 78,0 мас. частей ацетона и 1,5 мас. частей диметилформамида
Эмульгатор: алкиларилполигликолевый простой эфир
Для получения подходящей композиции активного вещества 1 мас. часть растворили с применением установленных мас. частей растворителя, и разбавили водой, содержащей 1000 частей на миллион эмульгатора, до желаемой концентрации.
Для получения других тестовых концентраций, препарат разбавили водой, содержащей эмульгатор.
На диски листьев кукурузы (Zea mays) распылили композицию активного вещества желаемой концентрации, и, после сушки, заселили гусеницами (Spodoptera frugiperda).
Через 7 дней эффективность определили в процентах. При этом 100% означает, что все гусеницы погибли; 0% означает, что ни одна гусеница не погибла.
В этом тесте, например, следующие соединения из примеров получения показали эффективность 100% при норме нанесения 500 г/га: I-T3-7, I-T3-8, I-T3-9, I-T3-10, I-T3-12, I-T3-17, I-T3-18, I-T3-19, I-T3-20, I-T3-21, I-T3-22, I-T3-23, I-T3-24, I-T3-25, I-T3-26, I-T3-29, I-T3-30, I-T3-31, I-T3-34, I-T3-42, I-T3-43, I-T3-44, I-T3-45, I-Т3-46, I-T3-47, I-T3-65, I-T3-66, I-T3-67, I-T3-68, I-T3-69, I-T3-70, I-T3-73, I-T3-74, I-T3-75, I-T3-76, I-T3-77, I-T3-78, I-T3-79, I-T3-89, I-T3-90, I-T3-91, I-T3-92, I-T3-96, I-T3-97, I-T3-98, I-T3-100, I-T3-102, I-T3-103, I-T3-104, I-T3-105, I-T3-106, I-Т3-107, I-T3-108, I-T3-109, I-T3-110, I-T3-111, I-T3-112, I-T3-113, I-T3-114, I-T3-115, I-T3-116, I-T3-117, I-T3-118, I-T3-119, I-T3-120, I-T3-126, I-T3-184, I-T3-185, I-T3-186, I-T3-187, I-T23-1, I-T23-2.
В этом тесте, например, следующие соединения из примеров получения показали эффективность 83% при норме нанесения 500 г/га: I-T3-101.
В этом тесте, например, следующие соединения из примеров получения показали эффективность 100% при норме нанесения 100 г/га: I-T2-2, I-T3-1, I-T3-2, I-T3-3, I-T3-4, I-T3-27, I-T3-28, I-T3-38, I-T3-39, I-T3-40, I-T3-41, I-T3-48, I-T3-52, I-T3-53, I-T3-54, I-T3-55, I-T3-56, I-T3-57, I-T3-58, I-T3-61, I-T3-62, I-T3-63, I-T3-64, I-T3-71, I-T3-72, I-T3-80, I-T3-81, I-T3-82, I-T3-83, I-T3-84, I-T3-85, I-T3-86, I-T3-87, I-Т3-88, I-T3-93, I-T3-94, I-T3-95, I-T3-99, I-T3-123, I-T3-124, I-T3-125, I-T3-130, I-Т3-131, I-T3-133, I-T3-136, I-T3-137, I-T3-138, I-T3-139, I-T3-140, I-T3-141, I-T3-143, I-T3-145, I-T3-148, I-T3-151, I-T3-152, I-T3-155, I-T3-160, I-T3-161, I-T3-162, I-T3-163, I-T3-164, I-T3-165, I-T3-170, I-T3-174, I-T3-175, I-T3-176, I-T3-189, I-T3-191, I-T3-192, I-T3-197, I-T3-198, I-T4-1, I-T4-2, I-T4-3, I-T4-4, I-T22-1, I-T22-2, I-Т22-3, I-T22-5, I-T22-7, I-T46-2, I-T46-3, I-T46-4, I-T46-5, I-T46-6.
В этом тесте, например, следующие соединения из примеров получения показали эффективность 83% при норме нанесения 100 г/га: I-T3-35, I-T3-50, I-T3-169, I-T3-177.
Terpanychus urticae - тест распылением, ОР - резистентность
Растворитель: 78,0 мас. частей ацетона и 1,5 мас. частей диметилформамида
Эмульгатор: алкиларилполигликолевый простой эфир
Для получения подходящей композиции активного вещества 1 мас. часть растворили с применением установленных мас. частей растворителя, и разбавили водой, содержащей 1000 частей на миллион эмульгатора, до желаемой концентрации. Для получения других тестовых концентраций, препарат разбавили водой, содержащей эмульгатор.
На диски листьев фасоли (Phaseolus vulgaris), зараженные на всех стадиях тепличным красным паутинным клещом (Tempanychus urticae, распылили композицию активного вещества желаемой концентрации.
Через 6 дней эффективность определили в процентах. При этом 100% означает, что все клещи погибли; 0% означает, что ни один клещ не погиб.
В этом тесте, например, следующие соединения из примеров получения показали эффективность 100% при норме нанесения 500 г/га: I-T3-7, I-T3-8, I-T3-9, I-T3-10, I-T3-20, I-T3-21, I-T3-22, I-T3-23, I-T3-24, I-T3-26, I-T3-29, I-T3-30, I-T3-31, I-T3-34, I-T3-42, I-T3-43, I-T3-44, I-T3-45, I-T3-46, I-T3-47, I-T3-69, I-T3-75, I-T3-76, I-Т3-77, I-T3-78, I-T3-91, I-T3-92, I-T3-96, I-T3-97, I-T3-98, I-T3-100, I-T3-101, I-T3-103, I-T3-106, I-T3-107, I-T3-108, I-T3-109, I-T3-110, I-T3-112, I-T3-113, I-T3-114, I-T3-115, I-T3-119, I-T3-120, I-T3-184, I-T3-185, I-T3-186, I-T3-187, I-T23-1, I-T23-2.
В этом тесте, например, следующие соединения из примеров получения показали эффективность 90% при норме нанесения 500 г/га: I-T3-25, I-T3-65, I-T3-70, I-T3-89, I-T3-90, I-T3-102, I-T3-104, I-T3-105, I-T3-116, I-T3-117, I-T3-118.
В этом тесте, например, следующие соединения из примеров получения показали эффективность 100% при норме нанесения 100 г/га: I-T3-1, I-T3-2, I-T3-3, I-T3-4, I-T3-27, I-T3-28, I-T3-38, I-T3-39, I-T3-41, I-T3-51, I-T3-53, I-T3-54, I-T3-55, I-T3-56, I-T3-57, I-T3-58, I-T3-61, I-T3-62, I-T3-63, I-T3-64, I-T3-72, I-T3-73, I-T3-80, I-Т3-81, I-T3-82, I-T3-83, I-T3-84, I-T3-85, I-T3-86, I-T3-87, I-T3-88, I-T3-93, I-T3-94, I-T3-95, I-T3-99, I-T3-124, I-T3-125, I-T3-127, I-T3-129, I-T3-130, I-T3-131, I-T3-132, I-T3-133, I-T3-139, I-T3-145, I-T3-146, I-T3-155, I-T3-160, I-T3-161, I-T3-162, I-T3-163, I-T3-164, I-T3-165, I-T3-168, I-T3-169, I-T3-170, I-T3-174, I-T3-175, I-T3-176, I-T3-177, I-T3-178, I-T3-179, I-T3-180, I-T3-181, I-T3-182, I-T3-183, I-T3-189, I-T3-190, I-T3-192, I-T3-197, I-T3-221, I-T3-222, I-T3-223, I-T4-1, I-T4-2, I-T4-3, I-Т4-4, I-T22-4, I-T22-5, I-T22-7, I-T46-4, I-T46-5, I-T46-6.
В этом тесте, например, следующие соединения из примеров получения показали эффективность 90% при норме нанесения 100 г/га: I-T3-50, I-T3-52, I-T3-71, I-T3-74, I-T3-111, I-T3-123, I-T3-137, I-T3-138, I-T3-147, I-T3-148, I-T3-151, I-T3-172, I-Т3-195, I-T22-1, I-T22-2, I-T22-3.
В этом тесте, например, следующие соединения из примеров получения показали эффективность 100% при норме нанесения 20 г/га: I-T3-49
Тест на малярийных комарах (ANPHGB поверхностная обработка)
Растворитель: Ацетон + 2000 частей на миллион сложного метилового эфира масла семян рапса (RME)
Для получения подходящей композиции активного вещества активное вещество растворили в растворителе (2 мг/мл). Композицию активного вещества перенесли с помощью пипетки на глазурованную черепицу, и, после сушки, взрослых москитов вида Anopheles gambiae штамм RSPH (homozygot kdr) поместили на обработанную черепицу. Время воздействия составило 30 минут.
Через 24 часа после контакта с обработанной поверхностью определяется смертность в процентах. При этом 100% означает, что все москиты погибли; 0% означает, что ни один москит не погиб.
В этом тесте, например, следующие соединения из примеров получения показали эффективность 90-100% при норме нанесения 100 мг/м2: I-T3-20, I-T3-24, I-T3-27, I-T3-28, I-T3-43, I-T3-52, I-T3-53, I-T3-54, I-T3-56, I-T3-57, I-T3-61, I-T3-100, I-T3-102, I-T3-112, I-T3-123, I-T3-130, I-T3-133, I-T3-134, I-T3-136, I-T3-145, I-T3-148, I-T3-155, I-T3-160, I-T3-162, I-T3-173, I-T3-189, I-T22-1.
В этом тесте, например, следующие соединения из примеров получения показали эффективность 90-100% при норме нанесения 20 мг/м2: I-T3-23, I-T3-24, I-T3-26, I-T3-27, I-T3-28, I-T3-43, I-T3-52, I-T3-53, I-T3-54, I-T3-57, I-T3-58, I-T3-61, I-T3-87, I-T3-91, I-T3-92, I-T3-100, I-T3-102, I-T3-106, I-T3-112, I-T3-116, I-T3-130; I-Т3-133, I-T3-134, I-T3-136, I-T3-137, I-T3-145, I-T3-148, I-T3-155, I-T3-159, I-T3-160, I-T3-162, I-T3-189, I-T22-2.
Тест на малярийных комарах (ANPHGB поверхностная обработка)
Растворитель: Ацетон + 2000 частей на миллион сложного метилового эфира масла семян рапса (RME)
Для получения подходящей композиции активного вещества активное вещество растворили в растворителе (2 мг/мл). Композицию активного вещества перенесли с помощью пипетки на глазурованную черепицу, и, после сушки, взрослых москитов вида Anopheles funestus штамм FUMOZ-R (Hunt et al., Med Vet Entomol. 2005 Sep; 19(3): 271-5) поместили на обработанную черепицу. Время воздействия составило 30 минут.
Через 24 часа после контакта с обработанной поверхностью определяется смертность в процентах. При этом 100% означает, что все москиты погибли; 0% означает, что ни один москит не погиб.
В этом тесте, например, следующие соединения из примеров получения показали эффективность 90-100% при норме нанесения 100 мг/м2: I-T3-24, I-T3-25, I-T3-38, I-T3-43, I-T3-46, I-T3-54, I-T3-56, I-T3-58, I-T3-63, I-T3-86, I-T3-92, I-T3-99, I-T3-100, I-T3-102, I-T3-107, I-T3-112, I-T3-113, I-T3-115, I-T3-123, I-T3-133, I-T3-134, I-T3-136, I-T3-145, I-T3-148, I-T3-155, I-T3-160, I-T3-162, I-T3-189, I-T22-1, I-T22-2.
В этом тесте, например, следующие соединения из примеров получения показали эффективность 90-100% при норме нанесения 20 мг/м2: I-T3-3, I-T3-24, I-T3-25, I-Т3-26, I-T3-38, I-T3-42, I-T3-43, I-T3-46, I-T3-52, I-T3-53, I-T3-54, I-T3-55, I-T3-57, I-T3-61, I-T3-63, I-T3-92, I-T3-93, I-T3-99, I-T3-100, I-T3-102, I-T3-107, I-T3-112,1-Т3-113, I-T3-116, I-T3-123, I-T3-134, I-T3-136, I-T3-145, I-T3-148, I-T3-155, I-T3-159, I-T3-160, I-T3-162, I-T3-189, I-T22-1, I-T22-2, I-T23-1, I-T23-2.
Тест на малярийных комарах (AEDSAE поверхностная обработка)
Растворитель: Ацетон + 2000 частей на миллион сложного метилового эфира масла семян рапса (RME)
Для получения подходящей композиции активного вещества активное вещество растворили в растворителе (2 мг/мл). Композицию активного вещества перенесли с помощью пипетки на глазурованную черепицу, и, после сушки, взрослых москитов вида Aedes aegypti штамм MONHEIM поместили на обработанную черепицу. Время воздействия составило 30 минут.
Через 24 часа после контакта с обработанной поверхностью определяется смертность в процентах. При этом 100% означает, что все москиты погибли; 0% означает, что ни один москит не погиб.
В этом тесте, например, следующие соединения из примеров получения показали эффективность 90-100% при норме нанесения 100 мг/м2: I-T3-1, I-T3-3, I-T3-8, I-Т3-20, I-T3-21, I-T3-23, I-T3-24, I-T3-25, I-T3-27, I-T3-28, I-T3-38, I-T3-42, I-T3-43, I-T3-46, I-T3-52, I-T3-53, I-T3-54, I-T3-55, I-T3-56, I-T3-57, I-T3-58, I-T3-61, I-T3-63, I-T3-64, I-T3-86, I-T3-87, I-T3-91, I-T3-92, I-T3-93, I-T3-96, I-T3-98, I-T3-99, I-Т3-100, I-T3-101, I-T3-102, I-T3-103, I-T3-106, I-T3-107, I-T3-108, I-T3-112, I-T3-113, I-T3-115, I-T3-117, I-T3-118, I-T3-120, I-T3-123, I-T3-130, I-T3-133, I-T3-134, I-T3-136, I-T3-145, I-T3-148, I-T3-155, I-T3-160, I-T3-162, I-T3-163, I-T3-173, I-T3-189, I-T22-1, I-T22-2, I-T23-1, I-T23-2.
В этом тесте, например, следующие соединения из примеров получения показали эффективность 90-100% при норме нанесения 20 мг/м2: I-T3-1, I-T3-3, I-T3-8, I-Т3-20, I-T3-21, I-T3-23, I-T3-24, I-T3-25, I-T3-27, I-T3-28, I-T3-38, I-T3-42, I-T3-43, I-T3-46, I-T3-52, I-T3-53, I-T3-54, I-T3-55, I-T3-56, I-T3-57, I-T3-58, I-T3-61, I-T3-63, I-T3-64, I-T3-86, I-T3-87, I-T3-91, I-T3-92, I-T3-93, I-T3-95, I-T3-96, I-T3-98, I-Т3-99, I-T3-100, I-T3-101, I-T3-102, I-T3-103, I-T3-106, I-T3-107, I-T3-108, I-T3-112, I-T3-113, I-T3-115, I-T3-116, I-T3-117, I-T3-118, I-T3-123, I-T3-130, I-T3-133, I-T3-134, I-T3-136, I-T3-145, I-T3-148, I-T3-155, I-T3-159, I-T3-160, I-T3-162, I-T3-163, I-T3-173, I-T3-189, I-T22-1, I-T22-2, I-T23-1, I-T23-2.
Реферат
Изобретение относится к соединениям формулы (I-T3), в которой Rпредставляет собой Н, Aпредставляет С-Н, Апредставляет CRили N, Апредставляет CR, Апредставляет С-Н, Bпредставляет CRили N, Впредставляет С-Н, Bпредставляет С-Н и Bпредставляет CRили N, причем заместители Bи Вне означают одновременно N, R, R, Rи Rнезависимо друг от друга представляют собой Н, галоген, циано, нитро, в каждом случае необязательно замещенный галогеном C-С-алкил, необязательно замещенный галогеном С-С-циклоалкил, необязательно замещенный галогеном C-С-алкокси, необязательно замещенный галогеном С-С-алкилсульфанил, необязательно замещенный галогеном C-С-алкилсульфинил, необязательно замещенный галогеном C-C-алкилсульфонил, необязательно замещенный галогеном N-С-С-алкиламино, необязательно замещенный галогеном N-С-С-алкокси-С-С-алкиламино или необязательно замещенный галогеном 1-пирролидинил; Rпредставляет собой замещенный фтором С-С-алкокси или замещенный фтором С-С-алкил; Rпредставляет собой Н; W представляет собой О или S; Q представляет собой C-С-алкил, циклопропил, 1-(циано)-циклопропил, 1-(перфторированный С-С-алкил)-циклопропил, 1-(С-С-алкил)-циклопропил, 1-(тиокарбамоил)-циклопропил, замещенный галогеном C-С-алкил, тиетан-3-ил, N-метил-пиразол-3-ил или 2-оксо-2(2,2,2-трифторэтиламино)этил. Соединения по изобретению предназначены в качестве инсектицидного средства. 2 н. и 2 з.п. ф-лы, 6 табл., 6 пр.
Формула

Документы, цитированные в отчёте о поиске
Гетероциклические амидные соединения как ингибиторы протеинкиназ

Комментарии