Гетероциклические соединения в качестве пестицидов - RU2641916C2
Код документа: RU2641916C2
Описание
Данная заявка относится к применению гетероциклических соединений для борьбы с животными вредителями, включая членистоногих, насекомых и нематод, к новым гетероциклическим соединениям, способам их получения и к промежуточным соединениям для получения гетероциклических соединений.
Гетероциклические соединения формул (W) и (W2) являются известными (см. для соединений формулы номера в реестре 1189645-25-7, 1189474-83-6, 1193202-69-5, 1172407-07-6, 1185158-40-0, 1185036-12-7, 1170986-74-9, 1193179-17-7, 1189458-68-1, 1189956-23-7, 1189915-26-1, 1170047-96-7). Применение этих соединений не было описано.
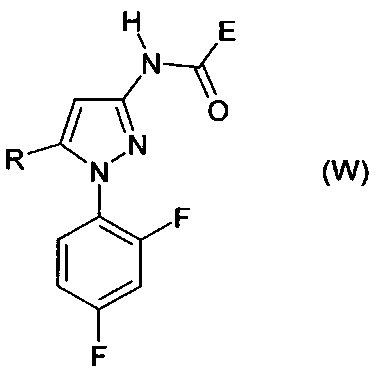

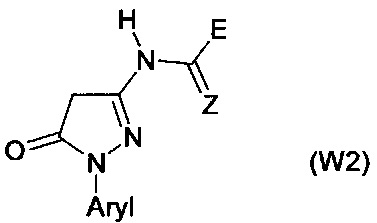

Производные пиразол-4-карбоксамидов известны из JP 2010-202649. Соединения, описанные в данном документе, имеют бактерицидное действие против бактерий, которые наносят вред растениям. Промежуточные соединения для их получения описаны в JP 2010-202648.
Средства защиты растений, которые также включают в себя пестициды, должны соответствовать многим требованиям, например, по отношению к эффективности, продолжительности и спектру их действия и возможного использования. Вопросы токсичности, сочетаемости с другими активными соединениями или вспомогательными добавками играют роль, равно как и вопрос о том, что требуется за счет синтеза активного соединения. Кроме того, может возникнуть сопротивление. По всем этим причинам, поиск новых средств защиты растений не может считаться законченным, и существует постоянная потребность в новых соединениях, обладающих свойствами, которые, по сравнению с известными соединениями, улучшены, по меньшей мере, в отношении отдельных аспектов.
Задачей настоящего изобретения является получение соединений, которые расширяют спектр пестицидов в различных аспектах.
Эта задача, и дополнительные задачи, которые явно не указаны, но которые можно различить или получить из соединений, описанных здесь, достигаются за счет использования новых и известных соединений формулы (I),

где
А представляет собой радикал из группы, которая состоит из:


где пунктирная линия обозначает связь с Q, и где А, кроме того, несет m заместители R2,
Q представляет собой радикал из группы, которая состоит из:


где азот является присоединенным к кольцу А, и стрелка в каждом случае представляет собой связь к D и
D представляет собой радикал формулы
где азот является присоединенным к Q, и стрелка обозначает связь с В,
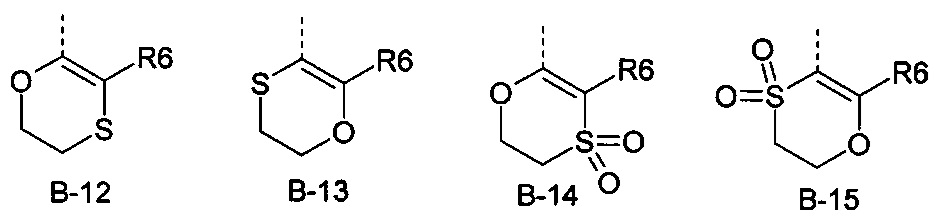
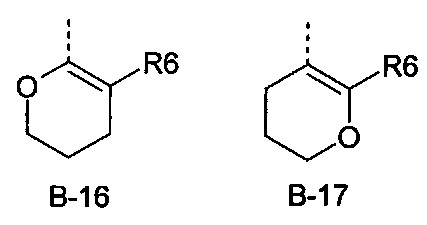
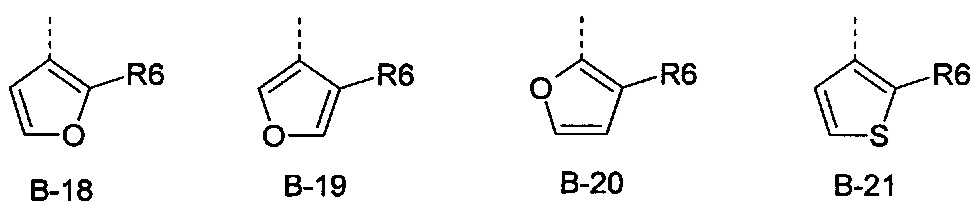
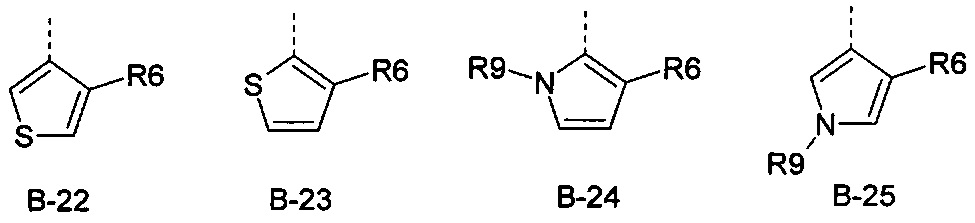
В представляет собой радикал из группы, которая состоит из
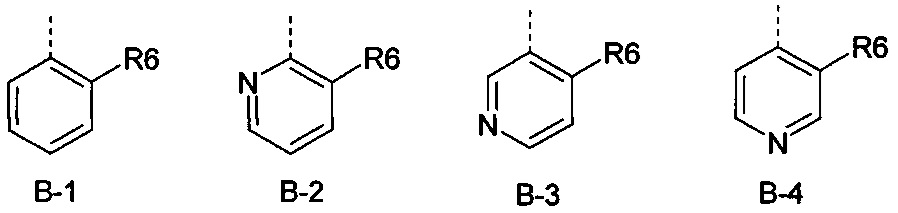
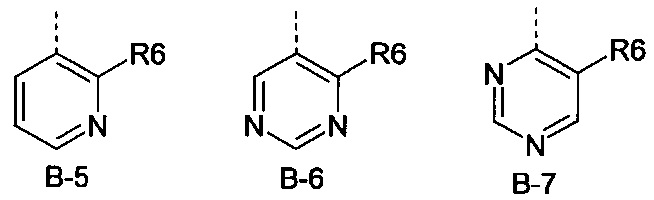



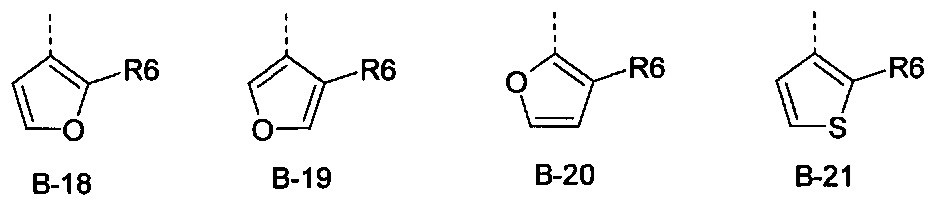
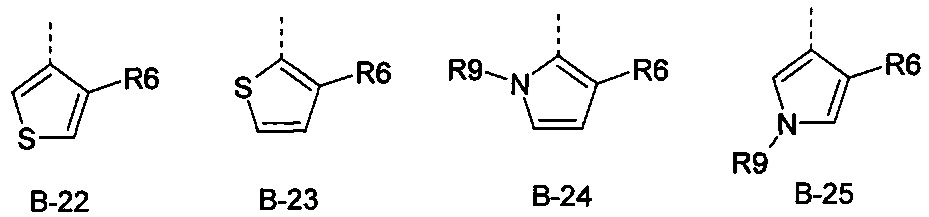







где пунктирная линия обозначает связь с D, и где В, кроме того, несет n заместители R7,
Y представляет собой CR8 или представляет собой азот,
Z представляет собой кислород или серу,
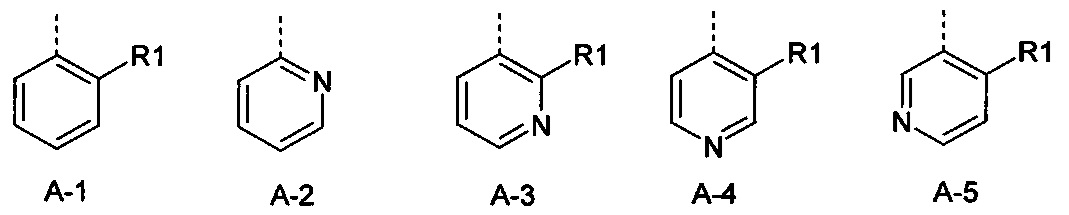
R1 представляет собой радикал из группы, которая состоит из следующих: галоген, циано, нитро, амино, гидрокси, представляет собой С1-С6-алкил, С2-С6-алкенил, С2-С6-алкинил, С3-С6-циклоалкил, С1-С6-алкокси, С3-С6-алкенилокси, С3-С6-алкинилокси, С3-С6-циклоалкилокси, С1-С6-алкилкарбонилокси, С2-С6-алкенилкарбонилокси, С2-С6-алкинилкарбонилокси, С3-С6-циклоалкилкарбонилокси, С1-С6-алкоксикарбонилокси, С1-С6-алкилсульфонилокси, С1-С6-алкиламино, С3-С6-алкениламино, С3-С6-алкиниламино, С3-С6-циклоалкиламино, С1-С6-алкилкарбониламино, С2-С6-алкенилкарбониламино, С2-С6-алкинилкарбониламино, С3-С6-циклоалкилкарбониламино, С1-С6-алкоксикарбониламино, С1-С6-алкилсульфониламино, С3-С6-алкилтио, С3-С6-алкенилтио, С3-С6-алкинилтио, С3-С6-циклоалкилтио, С1-С6-алкилсульфинил, С1-С6-алкилсульфонил, С1-С6-алкилкарбонил, С1-С6-алкоксиимино-С1-С6-алкил, С1-С6-алкоксикарбонил, аминокарбонил, С1-С6-алкиламинокарбонил, ди-(С1-С6-алкил)-аминокарбонил, аминотиокарбонил, С1-С6-алкиламиносульфонил, С1-С6-алкилсульфониламино, С1-С6-алкилкарбониламино, С1-С6-алкилтиокарбониламино, С4-С12-бициклоалкил, арил, арилокси, ариламино, арилтио, гетероарил, гетероарилокси, гетероариламино и гетероарилтио, каждый из которых является необязательно замещенным с помощью одного или более одинаковых или разных заместителей, где заместители независимо друг от друга являются выбранными из группы, которая состоит из следующих: галоген, циано, нитро, гидрокси, амино, С1-С6-алкил, С1-С6-алкокси, С3-С6-циклоалкил, С1-С6-галогеналкокси, С1-С6-алкилтио, арил, арилокси, арилтио, гетероарил, гетероарилокси и гетероарилтио,
R2 представляет собой радикал из группы, которая состоит из следующих: галоген, циано, нитро, амино, гидрокси, представляет собой С1-С6-алкил, С2-С6-алкенил, С2-С6-алкинил, С3-С6-циклоалкил, С1-С6-алкокси, С3-С6-алкенокси, С3-С6-алкинокси, С3-С6-циклоалкокси, С1-С6-алкилкарбонилокси, С2-С6-алкенилкарбонилокси, С2-С6-алкинилкарбонилокси, С3-С6-циклоалкилкарбонилокси, С1-С6-алкоксикарбонилокси, С1-С6-алкилсульфонилокси, С1-С6-алкиламино, ди-(С1-С6-алкил)-амино, С3-С6-алкениламино, С3-С6-алкиниламино, С3-С6-циклоалкиламино, С1-С6-алкилкарбониламино, С2-С6-алкенилкарбониламино, С2-С6-алкинилкарбониламино, С3-С6-циклоалкилкарбониламино, С1-С6-алкоксикарбониламино, С1-С6-алкилсульфониламино, С1-С6-алкилтио, С3-С6-алкенилтио, С3-С6-алкинилтио, С3-С6-циклоалкилтио, С1-С6-алкилсульфинил, С1-С6-алкилсульфонил, С1-С6-алкилкарбонил, С1-С6-алкоксиимино-С1-С6-алкил, С1-С6-алкоксикарбонил, аминокарбонил, С1-С6-алкиламинокарбонил, ди-(С1-С6-алкил)-аминокарбонил, аминотиокарбонил, С1-С6-алкиламиносульфонил, С1-С6-алкилсульфониламино, С1-С6-алкилкарбониламино, С1-С6-алкилтиокарбониламино, С4-С12-бициклоалкил, арил, арилокси, ариламино, арилтио, гетероарил, гетероарилокси, гетероариламино и гетероарилтио, каждый из которых является необязательно замещенным с помощью одного или более одинаковых или разных заместителей, где заместители независимо друг от друга являются выбранными из группы, которая состоит из следующих: галоген, циано, нитро, гидрокси, амино, С1-С6-алкил, С1-С6-алкокси, С3-С6-циклоалкил, С1-С6-галогеналкокси и С1-С6-алкилтио, арил, арилокси, арилтио, гетероарил, гетероарилокси и гетероарилтио,
R3 представляет собой радикал из группы, которая состоит из следующих: водород, галоген, циано, нитро, амино, гидрокси, С1-С6-алкил, С1-С6-алкокси, С1-С6-галогеналкил и С1-С6-галогеналкокси,
R4 представляет собой радикал из группы, которая состоит из следующих: водород, галоген, амино, гидрокси, С1-С6-алкил, С1-С6-алкокси, С1-С6-галогеналкил и С1-С6-галогеналкокси,
R5 представляет собой радикал из группы, которая состоит из следующих: водород, С1-С6-алкил, С3-С6-циклоалкил, С1-С6-галогеналкил, С2-С6-алкенил, С3-С6-алкинил, С3-С6-циклоалкил-С1-С6-алкил, циано-С1-С6-алкил, С1-С6-алкилкарбонил, С2-С6-алкенилкарбонил, С1-С6-галогеналкилкарбонил, С2-С6-галогеналкенилкарбонил, С1-С6-алкокси-С1-С6-алкил, С1-С6-алкоксикарбонил, С1-С6-алкилсульфонил и С1-С6-галогеналкилсульфонил или представляет собой С(=O)-В,
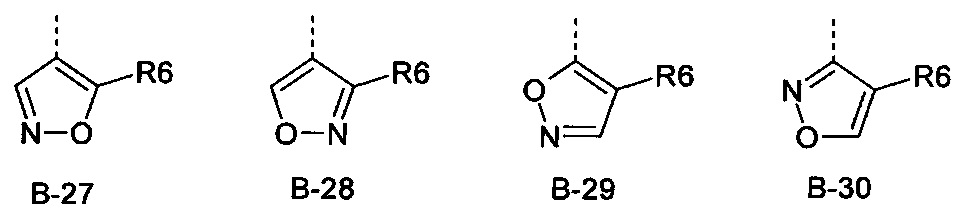
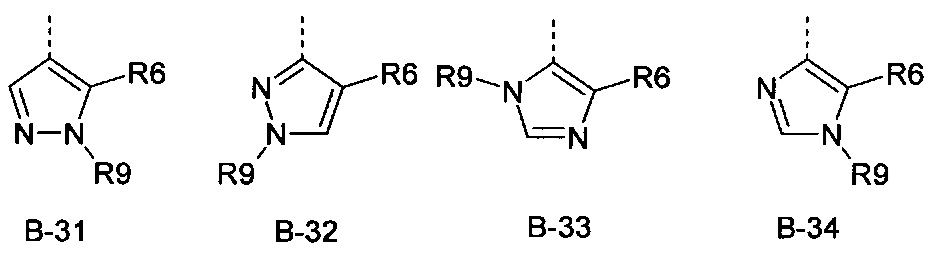
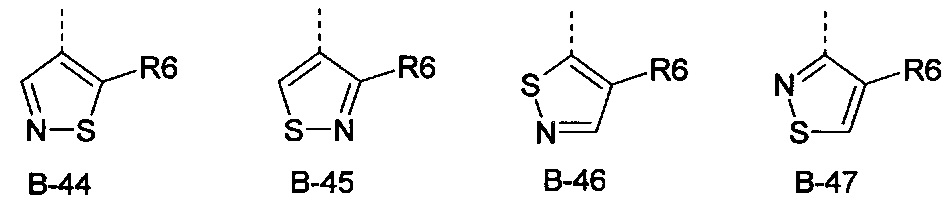
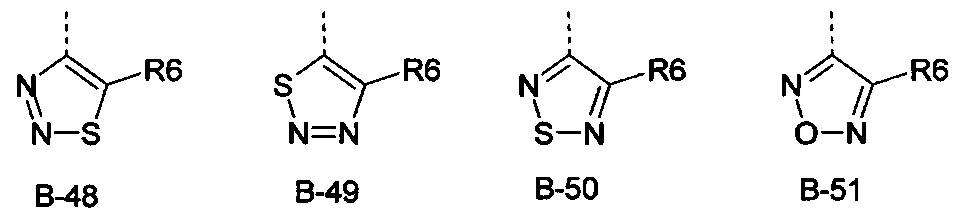
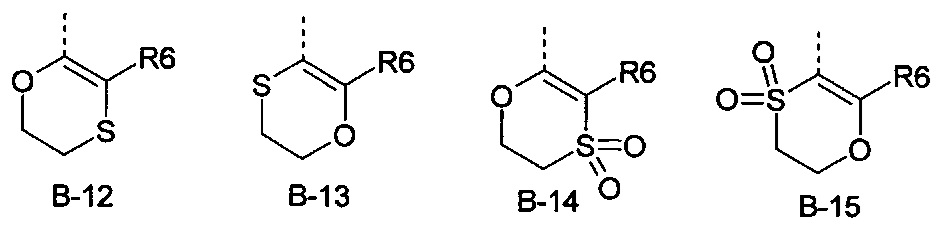
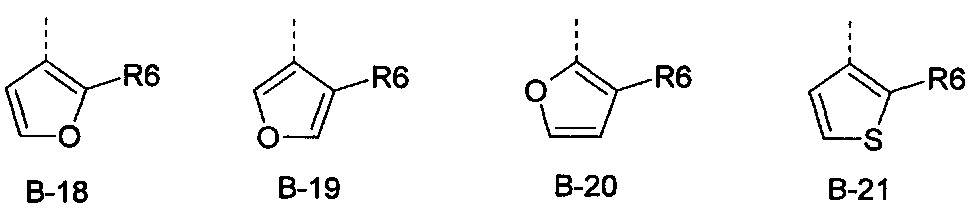
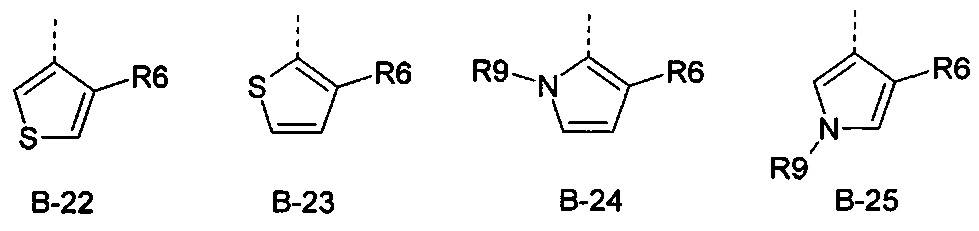
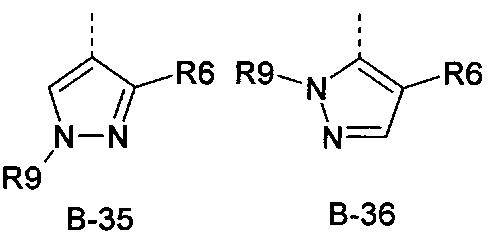
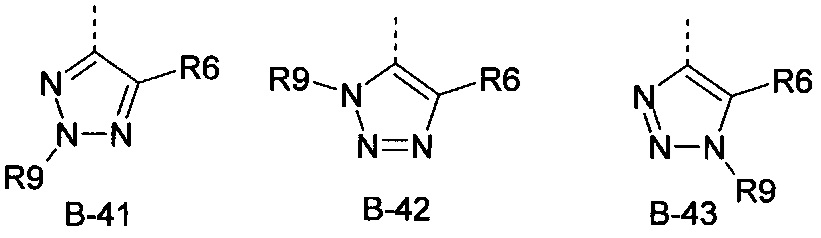
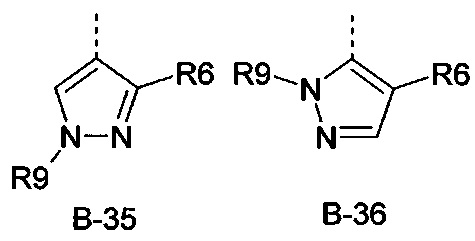
R6 представляет собой радикал из группы, которая состоит из следующих: водород (только в радикалах В-26, В-33, В-36 и В-42), галоген, циано, нитро, амино, гидрокси, карбоксил, представляет собой С1-С6-алкил, С2-С6-алкенил, С2-С6-алкинил, С3-С6-циклоалкил, С1-С6-алкокси, С3-С6-алкенокси, С3-С6-алкинокси, С3-С6-циклоалкокси, С1-С6-алкилкарбонилокси, С2-С6-алкенилкарбонилокси, С2-С6-алкинилкарбонилокси, С3-С6-циклоалкилкарбонилокси, С1-С6-алкоксикарбонилокси, С1-С6-алкилсульфонилокси, С1-С6-алкилкарбониламино, С2-С6-алкенилкарбониламино, С2-С6-алкинилкарбониламино, С3-С6-циклоалкилкарбониламино, С1-С6-алкоксикарбониламино, С1-С6-алкилсульфониламино, С1-С6-алкилтио, С1-С6-алкилсульфинил, С1-С6-алкилсульфонил, С1-С6-алкилкарбонил, С1-С6-алкоксиимино-С1-С6-алкил, С1-С6-алкоксикарбонил, аминокарбонил, С1-С6-алкиламинокарбонил, ди-(С1-С6-алкил)-аминокарбонил, аминотиокарбонил, С1-С6-алкиламиносульфонил, С1-С6-алкилсульфониламино, С1-С6-алкилкарбониламино, С1-С6-галогеналкилкарбониламино, С1-С6-алкилтиокарбониламино, С4-С12-бициклоалкил, арил, арилокси, гетероарил, гетероарилокси, каждый из которых является необязательно замещенным с помощью одного или более одинаковых или разных заместителей, где заместители независимо друг от друга являются выбранными из группы, которая состоит из следующих: галоген, циано, нитро, гидрокси, амино, С1-С6-алкил, С1-С6-алкокси, С3-С6-циклоалкил, С1-С6-галогеналкокси и С1-С6-алкилтио,
R7 представляет собой радикал из группы, которая состоит из следующих: галоген, нитро, циано, амино, гидрокси, представляет собой С1-С6-алкил, С2-С6-алкенил, С2-С6-алкинил, С3-С6-циклоалкил, С1-С6-алкокси, С3-С6-алкенокси, С3-С6-алкинокси, С3-С6-циклоалкокси, С1-С6-алкилкарбонилокси, С2-С6-алкенилкарбонилокси, С2-С6-алкинилкарбонилокси, С3-С6-циклоалкилкарбонилокси, С1-С6-алкоксикарбонилокси, С1-С6-алкилсульфонилокси, С1-С6-алкилкарбониламино, С2-С6-алкенилкарбониламино, С2-С6-алкинилкарбониламино, С3-С6-циклоалкилкарбониламино, С1-С6-алкоксикарбониламино, С1-С6-алкилсульфониламино, С1-С6-алкилтио, С1-Сб-алкилсульфинил, С1-С6-алкилсульфонил, С1-С6-алкилкарбонил, С1-С6-алкоксиимино-С1-С6-алкил, С1-С6-алкоксикарбонил, аминокарбонил, С1-С6-алкиламинокарбонил, ди-(С1-С6-алкил)-аминокарбонил, аминотиокарбонил, С1-С6-алкиламиносульфонил, С1-С6-алкилсульфониламино, С1-С6-алкилкарбониламино, С1-С6-алкилтиокарбониламино, арил, арилокси, гетероарил, гетероарилокси, С4-С12-бициклоалкил, каждый из которых является необязательно замещенным с помощью одного или более одинаковых или разных заместителей, где заместители независимо друг от друга являются выбранными из группы, которая состоит из следующих: галоген, циано, нитро, гидрокси, амино, С1-С6-алкил, С1-С6-алкокси, С3-С6-циклоалкил, С1-С6-галогеналкокси и С1-С6-алкилтио,
R8 представляет собой радикал из группы, которая состоит из следующих: водород, галоген, амино, гидрокси, С1-С6-алкил, С1-С6-алкокси, С1-С6-галогеналкил и С1-С6-галогеналкокси,
R9 представляет собой радикал из группы, которая состоит из следующих: водород, С1-С6-алкил, С3-С6-циклоалкил, галогеналкил, С3-С6-алкенил, С3-С6-алкинил, С3-С6-циклоалкил-С1-С6-алкил, циано-С1-С6-алкил, С1-С6-алкилкарбонил, С2-С6-алкенилкарбонил, С1-С6-галогеналкилкарбонил, С2-С6-галогеналкенилкарбонил, С1-С6-алкокси-С1-С6-алкил, С1-С6-алкоксикарбонил, С1-С6-алкилсульфонил и С1-С6-галогеналкилсульфонил,
m представляет собой число из группы, которая состоит из: 0, 1, 2 и 3, где для m>1 радикалы R2 могут быть одинаковыми или разными и
n представляет собой число из группы, которая состоит из: 0, 1, 2 и 3, где для n>1 радикалы R7 могут быть одинаковыми или разными, для борьбы с животными вредителями.
Было обнаружено, что известные и новые соединения формулы (I) обладают выраженными биологическими свойствами и являются особенно пригодными для борьбы с животными вредителями, в частности насекомыми, паукообразными и нематодами, которые встречаются в сельском хозяйстве, в лесах, при защите хранимой продукции и материалов, и в секторе гигиены.
Соединения формулы (I), могут, при необходимости, в зависимости от природы заместителей, быть в форме геометрических и/или оптически активных изомеров или соответствующей смеси изомеров различного состава. Изобретение относится как к использованию чистых изомеров, так и к смеси изомеров.
Предпочтительные заместители или диапазоны для радикалов, показанные в соединениях формулы (I) приведены ниже.
А представляет собой радикал из группы, которая состоит из:

где пунктирная линия обозначает связь с Q, и где А, кроме того, несет m заместители R2,
Q представляет собой радикал из группы, которая состоит из:


где азот является присоединенным к кольцу А, и стрелка в каждом случае представляет собой связь к D,
D представляет собой радикал формулы

где азот является присоединенным к Q, и стрелка обозначает связь с В.
В представляет собой радикал из группы, которая состоит из:









где пунктирная линия обозначает связь с D, и где В, кроме того, несет n заместители R7.
Y представляет собой CR8 или представляет собой азот.
Z представляет собой кислород или серу.
R1 представляет собой радикал из группы, которая состоит из следующих: галоген, циано, нитро, амино, гидрокси, С1С6-алкил, С1-С6-галогеналкил, циано-С1-С6-алкил, С2-С6-алкенил, С2-С6-алкинил, С3-С6-циклоалкил, С3-С6-циклоалкил-С1-С6-алкил, С1-С6-алкокси, С1-С6-галогеналкокси, С3-С6-алкенилокси, С3-С6-алкинилокси, С3-С6-циклоалкилокси, С1-С6-алкилкарбонилокси, С2-С6-алкенилкарбонилокси, С2-С6-алкинилкарбонилокси, С3-С6-циклоалкилкарбонилокси, С1-С6-алкоксикарбонилокси, С1-С6-алкилсульфонилокси, С1-С6-алкиламино, С3-С6-алкениламино, С3-С6-алкиниламино, С3-С6-циклоалкиламино, С1-С6-алкилтио, С1-С6-галогеналкилтио, С3-С6-алкенилтио, С3-С6-алкинилтио, С3-С6-циклоалкилтио, С3-С6-алкилсульфинил, С1-С6-алкилсульфонил, С1-С6-алкилкарбонил, С1-С6-алкоксиимино-С1-С6-алкил, С1-С6-алкоксикарбонил, аминокарбонил, С1-С6-алкиламинокарбонил, ди-(С1-С6-алкил)-аминокарбонил, аминотиокарбонил, С1-С6-алкиламиносульфонил, С1-С6-алкилсульфониламино, С1-С6-алкилкарбониламино, С1-С6-алкилтиокарбониламино, арил, арилокси, гетероарил и гетероарилокси.
R2 представляет собой радикал из группы, которая состоит из следующих: галоген, циано, нитро, амино, гидрокси, С1-С6-алкил, С1-С6-галогеналкил, циано- С1-С6-алкил, С2-С6-алкенил, С2-С6-алкинил, С3-С6-циклоалкил, С3-С6-циклоалкил-С1-С6-алкил, С1-С6-алкокси, С1-С6-галогеналкокси, С3-С6-алкенилокси, С3-С6-алкинилокси, С3-С6-циклоалкилокси, С1-С6-алкилкарбонилокси, С2-С6-алкенилкарбонилокси, С2-С6-алкинилкарбонилокси, С3-С6-циклоалкилкарбонилокси, С1-С6-алкоксикарбонилокси, С1-С6-алкилсульфонилокси, С1-С6-алкиламино, ди-(С1-С6-алкил)-амино, С3-С6-алкениламино, С3-С6-алкиниламино, С3-С6-циклоалкиламино, С1-С6-алкилтио, С1-С6-галогеналкилтио, С3-С6-алкенилтио, С3-С6-алкинилтио, С3-С6-циклоалкилтио, С1-С6-алкилсульфинил, С1-С6-алкилсульфонил, С1-С6-алкилкарбонил, С1-С6-алкоксиимино- С1-С6-алкил, С1-С6-алкоксикарбонил, аминокарбонил, С1-С6-алкиламинокарбонил, ди-(С1-С6-алкил)-аминокарбонил, аминотиокарбонил, С1-С6-алкиламиносульфонил, С1-С6-алкилсульфониламино, С1-С6-алкилкарбониламино, С1-С6-алкилтиокарбониламино, арил, арилокси, гетероарил и гетероарилокси.
R3 представляет собой радикал из группы, которая состоит из следующих: водород, галоген, циано, нитро, амино, С1-С6-алкил и С1-С6-галогеналкил.
R4 представляет собой радикал из группы, которая состоит из следующих: водород, галоген, амино, гидрокси, С1-С6-алкил, С1-С6-алкокси, С1-С6-галогеналкил и С1-С6-галогеналкокси.
R5 представляет собой радикал из группы, которая состоит из следующих: водород, С1-С6-алкил, С1-С6-галогеналкил, циано- С1-С6-алкил, С2-С6-алкенил, С3-С6-алкинил, С3-С6-циклоалкил, С3-С6-циклоалкил-С1-С6-алкил, С1-С6-алкилкарбонил, С2-С6-алкенилкарбонил, С1-С6-галогеналкилкарбонил, С2-С6-галогеналкенилкарбонил, С1-С6-алкокси-С1-С6-алкил, С1-С6-алкоксикарбонил, С1-С6-алкилсульфонил, С1-С6-галогеналкилсульфонил и С(=O)-В.
R6 представляет собой радикал из группы, которая состоит из следующих: водород (только в радикалах В-26, В-33, В-36 и В-42), галоген, циано, нитро, амино, гидрокси, карбоксил, С1-С6-алкил, С1-С6-галогеналкил, циано-С1-С6-алкил, С2-С6-алкенил, С2-С6-алкинил, С3-С6-циклоалкил, С3-С6-циклоалкил-С1-С6-алкил, С1-С6-алкокси, С1-С6-галогеналкокси, С3-С6-алкенилокси, С3-С6-алкинилокси, С3-С6-циклоалкилокси, С1-С6-алкилкарбонилокси, С2-С6-алкенилкарбонилокси, С2-С6-алкинилкарбонилокси, С3-С6-циклоалкилкарбонилокси, С1-С6-алкоксикарбонилокси, С1-С6-алкилсульфонилокси, С1-С6-алкиламино, С3-С6-алкениламино, С3-С6-алкиниламино, С3-С6-циклоалкиламино, С1-С6-алкилтио, С1-С6-галогеналкилтио, С3-С6-алкенилтио, С3-С6-алкинилтио, С3-С6-циклоалкилтио, С1-С6-алкилсульфинил, С1-С6-алкилсульфонил, С1-С6-алкилкарбонил, С1-С6-алкоксиимино-С1-С6-алкил, С1-С6-алкоксикарбонил, аминокарбонил, С1-С6-алкиламинокарбонил, ди-(С1-С6-алкил)-аминокарбонил, аминотиокарбонил, С1-С6-алкиламиносульфонил, С1-С6-алкилсульфониламино, С1-С6-алкилкарбониламино, С1-С4-галогеналкилкарбониламино, С1-С6-алкилтиокарбониламино, арил, арилокси, гетероарил и гетероарилокси.
R7 представляет собой радикал из группы, которая состоит из следующих: галоген, циано, нитро, амино, гидрокси, С1-С6-алкил, С1-С6-галогеналкил, циано- С1-С6-алкил, С2-С6-алкенил, С3-С6-алкинил, С3-С6-циклоалкил, С3-С6-циклоалкил-С1-С6-алкил, С1-С6-алкокси, С1-С6-галогеналкокси, С3-С6-алкенилокси, С3-С6-алкинилокси, С3-С6-циклоалкилокси, С1-С6-алкилкарбонилокси, С2-С6-алкенилкарбонилокси, С2-С6-алкинилкарбонилокси, С3-С6-циклоалкилкарбонилокси, С1-С6-алкоксикарбонилокси, С1-С6-алкилсульфонилокси, С1-С6-алкиламино, С3-С6-алкениламино, С3-С6-алкиниламино, С3-С6-циклоалкиламино, С1-С6-алкилтио, С1-С6-галогеналкилтио, С3-С6-алкенилтио, С3-С6-алкинилтио, С3-С6-циклоалкилтио, С1-С6-алкилсульфинил, С1-С6-алкилсульфонил, С1-С6-алкилкарбонил, С1-С6-алкоксиимино-С1-С6-алкил, С1-С6-алкоксикарбонил, аминокарбонил, С1-С6-алкиламинокарбонил, ди-(С1-С6-алкил)-аминокарбонил, аминотиокарбонил, С1-С6-алкиламиносульфонил, С1-С6-алкилсульфониламино, С1-С6-алкилкарбониламино, С1-С6-алкилтиокарбониламино, арил, арилокси, гетероарил и гетероарилокси.
R8 представляет собой радикал из группы, которая состоит из следующих: водород, галоген, амино, гидрокси, С1-С6-алкил, С1-С6-алкокси, С1-С6-галогеналкил и С1-С6-галогеналкокси.
R9 представляет собой радикал из группы, которая состоит из следующих: водород, С1-С6-алкил, С3-С6-циклоалкил, С1-С6-галогеналкил, С3-С6-алкенил, С3-С6-алкинил, С3-С6-циклоалкил-С1-С6-алкил, циано-С1-С6-алкил, С2-С6-алкилкарбонил, С1-С6-алкенилкарбонил, С2-С6-галогеналкилкарбонил, С1-С6-галогеналкенилкарбонил, С1-С6-алкокси-С1-С6-алкил, С1-С6-алкоксикарбонил, С1-С6-алкилсульфонил и С1-С6-галогеналкилсульфонил.
m представляет собой число из группы, которая состоит из следующих: 0, 1, 2 и 3, где для m>1 радикалы R2 могут быть одинаковыми или разными.
n представляет собой число из группы, которая состоит из следующих: 0, 1, 2 и 3, где для n>1 радикалы R7 могут быть одинаковыми или разными.
Особенно предпочтительные заместители или диапазоны для радикалов, показанных в соединениях формулы (I), приведены ниже.
А представляет собой радикал из группы, которая состоит из:

где пунктирная линия обозначает связь с Q, и где А, кроме того, несет m заместители R2.
Q представляет собой радикал из группы, которая состоит из:
где азот является присоединенным к кольцу А, и стрелка в каждом случае представляет собой связь к D.
D представляет собой радикал формулы

где азот является присоединенным к Q, и стрелка обозначает связь с В.
В представляет собой радикал из группы, которая состоит из:










где пунктирная линия обозначает связь с D, и где В, кроме того, несет n заместители R7.
Y представляет собой CR8 или представляет собой азот.
Z представляет собой кислород или серу.
R1 представляет собой радикал из группы, которая состоит из следующих: галоген, циано, нитро, С1-С6-алкил, С1-С6-галогеналкил, циано-С1-С6-алкил, С2-С6-алкенил, С2-С6-алкинил, С3-С6-циклоалкил, С3-С6-циклоалкил-С1-С6-алкил, С1-С6-алкокси, С1-С6-галогеналкокси, С3-С6-алкенилокси, С3-С6-алкинилокси, С3-С6-циклоалкилокси, С1-С6-алкилтио, С1-С6-галогеналкилтио, С1-С6-алкилсульфинил, С1-С6-алкилсульфонил, С1-С6-алкоксиимино-С1-С6-алкил, арил, арилокси, гетероарил и гетероарилокси.
R2 представляет собой радикал из группы, которая состоит из следующих: галоген, циано, нитро, амино, С1-С6-алкил, С1-С6-галогеналкил, циано-С1-С6-алкил, С2-С6-алкенил, С2-С6-алкинил, С3-С6-циклоалкил, С3-С6-циклоалкил-С1-С6-алкил, С1-С6-алкокси, С1-С6-галогеналкокси, С3-С6-алкенилокси, С3-С6-алкинилокси, С3-С6-циклоалкилокси, С1-С6-алкилтио, С1-С6-галогеналкилтио, С1-С6-алкилсульфинил, С1-С6-алкилсульфонил, С1-С6-алкилкарбонил, ди-(С1-С6-алкил)-амино, С1-С6-алкоксиимино-С1-С6-алкил, арил, арилокси, гетероарил и гетероарилокси.
R3 представляет собой радикал из группы, которая состоит из следующих: водород, галоген, циано, нитро, амино, С1-С6-алкил и С1-С6-галогеналкил.
R4 представляет собой радикал из группы, которая состоит из следующих: водород, галоген, амино, гидрокси, С1-С6-алкил, С1-С6-алкокси, С1-С6-галогеналкил и С1-С6-галогеналкокси.
R5 представляет собой радикал из группы, которая состоит из следующих: водород, С1-С6-алкил, С1-С6-галогеналкил, циано-С1-С6-алкил, С2-С6-алкенил, С3-С6-алкинил, С3-С6-циклоалкил, С3-С6-циклоалкил-С1-С6-алкил, С1-С6-алкилкарбонил, С2-С6-алкенилкарбонил, С1-С6-галогеналкилкарбонил, С2-С6-галогеналкенилкарбонил, С1-С6-алкокси-С1-С6-алкил, С1-С6-алкоксикарбонил, С1-С6-алкилсульфонил, С1-С6-галогеналкилсульфонил и С(=O)-В.
R6 представляет собой радикал из группы, которая состоит из следующих: водород (только в радикалах В-26, В-33, В-36 и В-42), галоген, циано, нитро, гидрокси, карбоксил, С1-С6-алкил, С1-С6-галогеналкил, циано-С1-С6-алкил, С1-С6-алкенил, С2-С6-алкинил, С3-С6-циклоалкил, С3-С6-циклоалкил-С1-С6-алкил, С1-С6-алкокси, С1-С6-галогеналкокси, С3-С6-алкенилокси, С3-С6-алкинилокси, С3-С6-циклоалкилокси, С1-С6-алкилсульфинил, С1-С6-алкилтио, С1-С6-галогеналкилтио, С1-С6-алкилсульфонил, С1-С6-алкилкарбонил, С1-С6-алкоксиимино-С1-С6-алкил, С1-С6-алкилкарбониламино, С1-С6-галогеналкилкарбониламино, арил, арилокси, гетероарил и гетероарилокси.
R7 представляет собой радикал из группы, которая состоит из следующих: галоген, циано, нитро, гидрокси, С1-С6-алкил, С1-С6-галогеналкил, циано-С1-С6-алкил, С2-С6-алкенил, С2-С6-алкинил, С3-С6-циклоалкил, С3-С6-циклоалкил-С1-С6-алкил, С1-С6-алкокси, С1-С6-галогеналкокси, С3-С6-алкенилокси, С3-С6-алкинилокси, С3-С6-циклоалкилокси, С1-С6-алкилтио, С1-С6-галогеналкилтио, С1-С6-алкилсульфинил, С1-С6-алкилсульфонил, С1-С6-алкоксиимино-С1-С6-алкил, арил, арилокси, гетероарил и гетероарилокси.
R8 представляет собой радикал из группы, которая состоит из следующих: водород, С1-С6-алкил, С1-С6-алкокси, С1-С6-галогеналкил и С1-С6-галогеналкокси.
R9 представляет собой радикал из группы, которая состоит из следующих: водород, С1-С6-алкил, С3-С6-циклоалкил и С1-С6-галогеналкил.
m представляет собой число из группы, которая состоит из следующих: 0, 1, 2 и 3, где для m>1 радикалы R2 могут быть одинаковыми или разными.
n представляет собой число из группы, которая состоит из следующих: 0, 1, 2 и 3, где для n>1 радикалы R7 могут быть одинаковыми или разными.
Очень особенно предпочтительные заместители или диапазоны радикалов, показанные в соединениях формулы (I), указаны ниже.
А представляет собой радикал из группы, которая состоит из:


где пунктирная линия обозначает связь с Q, и где А, кроме того, несет
m заместители R2.
Q представляет собой радикал из группы, которая состоит из:

где азот является присоединенным к кольцу А, и стрелка в каждом случае представляет собой связь к D
D представляет собой радикал формулы

где азот является присоединенным к Q, и стрелка обозначает связь с В.
В представляет собой радикал из группы, которая состоит из:





где пунктирная линия обозначает связь с D, и где В, кроме того, несет n заместители R7.
Z представляет собой кислород или серу.
R1 представляет собой радикал из группы, которая состоит из следующих: галоген, циано, нитро, С1-С4-алкил, С1-С4-галогеналкил, С1-С4-алкокси и С1-С4-алкилсульфонил.
R2 представляет собой радикал из группы, которая состоит из следующих: галоген, С1-С4-алкил и С1-С4-алкокси.
R3 представляет собой радикал из группы, которая состоит из следующих: водород и галоген.
R4 представляет собой радикал из группы, которая состоит из следующих: водород и С1-С4-алкил.
R5 представляет собой радикал из группы, которая состоит из следующих: водород, С1-С4-алкил, С3-С4-алкенил, С3-С4-алкинил, С3-С6-циклоалкил-С1-С4-алкил, С1-С4-алкилкарбонил, циано-С1-С4-алкил и С(=O)-В.
R6 представляет собой радикал из группы, которая состоит из следующих: галоген, нитро, гидрокси, С1-С4-алкил, С1-С4-алкокси, С1-С4-алкилтио, С1-С4-алкилсульфонил, С1-С4-галогеналкил, С1-С4-галогеналкокси, С1-С4-галогеналкилтио и гетероарил.
R7 представляет собой радикал из группы, которая состоит из следующих: галоген, С1-С4-алкил и С1-С4-галогеналкил.
R9 представляет собой радикал из группы, которая состоит из С1-С4-алкила.
m представляет собой число из группы, которая состоит из следующих: 0, 1, 2 и 3, где для m>1 радикалы R2 могут быть одинаковыми или разными.
n представляет собой число из группы, которая состоит из 0 и 1.
Дополнительная группа очень особенно предпочтительных заместителей или диапазонов радикалов, показанные в соединениях формулы (I) указаны ниже.
А представляет собой радикал из группы, которая состоит из:

где пунктирная линия обозначает связь с Q, и где А, кроме того, несет m заместители R2,
Q представляет собой радикал из группы, которая состоит из:
где азот является присоединенным к кольцу А, и стрелка в каждом случае представляет собой связь к D
D представляет собой радикал формулы

где азот является присоединенным к Q, и стрелка обозначает связь с В.
В представляет собой радикал из группы, которая состоит из





где пунктирная линия обозначает связь с D, и где В, кроме того, несет n заместители R7.
Z представляет собой кислород или серу.
R1 представляет собой радикал из группы, которая состоит из следующих: галоген, циано, нитро, С1-С4-алкил, С1-С4-галогеналкил, С1-С4-алкокси и С1-С4-алкилсульфонил.
R2 представляет собой радикал из группы, которая состоит из следующих: галоген, циано, нитро, амино, С1-С4-алкил, С1-С4-галогеналкил, С3-С6-циклоалкил, С1-С4-алкокси, ди-(С1-С6-алкил)-амино, ацетил, арил.
R3 представляет собой радикал из группы, которая состоит из следующих: водород, галоген, циано, нитро, С1-С4-алкил.
R4 представляет собой радикал из группы, которая состоит из следующих: водород, амино, С1-С4-алкил.
R5 представляет собой радикал из группы, которая состоит из следующих: водород, С1-С4-алкил, С3-С4-алкенил, С3-С4-алкинил, С3-С6-циклоалкил-С1-С4-алкил, С1-С4-алкилкарбонил, циано-С1-С4-алкил и С(=O)-В.
R6 представляет собой радикал из группы, которая состоит из следующих: водород (только в радикалах В-33 и В-36), галоген, циано, нитро, гидрокси, карбоксил, С1-С4-алкил, С1-С4-алкокси, С1-С4-алкилтио, С1-С4-алкилсульфонил, С1-С4-галогеналкил, С3-С6-циклоалкил, С1-С4-галогеналкокси, С1-С4-галогеналкилтио, ацетил, С1-С4-алкилкарбониламино, С1-С4-галогеналкилкарбониламино и гетероарил.
R7 представляет собой радикал из группы, которая состоит из следующих: галоген, циано, нитро, гидрокси, С1-С4-алкил, С1-С4-галогеналкил и С1-С4-алкокси.
R9 представляет собой радикал из группы, которая состоит из следующих: С1-С4-алкил и С1-С4-галогеналкил.
m представляет собой число из группы, которая состоит из следующих: 0, 1, 2 и 3, где для m>1 радикалы R2 могут быть одинаковыми или разными.
n представляет собой число из группы, которая состоит из следующих: 0, 1, 2 и 3, где для n>1 радикалы R7 могут быть одинаковыми или разными.
В предпочтительных определениях, если не указано иное,
галоген является выбранным из группы, которая состоит из фтора, хлора, брома и йода, предпочтительно, в свою очередь из группы, которая состоит из фтора, хлора и брома,
арил (в том числе в составе более большого звена, например, арилалкил) является выбранным из группы, которая состоит из фенила, нафтила, антрила, фенантренила, и предпочтительно, в свою очередь, фенила,
гетарил (имеет то же значение, что и гетероарил, так же, как часть сравнительно большого звена, такого как, например, гетероарилокси) является выбранным из группы, которая состоит из следующих: фурил, тиенил, пирролил, пиразолил, имидазолил, 1,2,3-триазолил, 1,2,4-триазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,3,4-оксадиазолил, 1,2,5-оксадиазолил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,3,4-тиадиазолил, 1,2,5-тиадиазолил, пиридил, пиримидинил, пиридазинил и пиразинил.
В особенно предпочтительных определениях, если не указано иное,
галоген является выбранным из группы, которая состоит из фтора, хлора, брома и йода, предпочтительно, в свою очередь из группы, которая состоит из фтора, хлора и брома,
арил (в том числе в составе более большого звена, например, арилалкил) является выбранным из группы, которая состоит из фенила, нафтила, антрила, фенантренила, и предпочтительно, в свою очередь фенила,
гет(еро)арил (также как часть сравнительно большого звена, такого как, например, гетероарилокси) является выбранным из группы, которая состоит из следующих: фурил, тиенил, пирролил, пиразолил, имидазолил, 1,2,3-триазолил, 1,2,4-триазолил, оксазолил, изоксазолил и тиазолил.
В очень особенно предпочтительных определениях, если не указано иное,
галоген является выбранным из группы, которая состоит из фтора, хлора, брома и йода, предпочтительно, в свою очередь из группы, которая состоит из фтора, хлора и брома, и
гет(еро)арил (также как часть сравнительно большого звена, такого как, например, гетероарилокси) представляет собой 1,2,4-триазолил.
Галоген-замещенные радикалы, например, галогеналкил, являются моно- или полигалогенированными, вплоть до максимального числа возможных заместителей. В случае полигалогенизации, атомы галогена могут быть одинаковыми или разными. Галоген обозначает фтор, хлор, бром и йод, в частности фтор, хлор и бром.
Насыщенные или ненасыщенные углеводородные радикалы, такие как алкил или алкенил, могут в каждом случае быть неразветвленными или разветвленными, насколько это возможно, в том числе в комбинации с гетероатомами, как, например, в алкокси.
Необязательно замещенные радикалы могут быть моно- или полизамещенными, причем заместители в случае полизамещения могут быть одинаковыми или разными.
Определения или разъяснения радикалов, приведенные выше, в общих чертах или в категории предпочтения относятся к конечным продуктам и соответственно к исходным соединениям и промежуточным соединениям. Эти определения радикалов могут быть объединены друг с другом, как это желательно, то есть включая комбинации между соответствующими предпочтительными диапазонами.
Предпочтение в соответствии с изобретением отдается применению соединений формулы (I), которые содержат комбинацию значений, перечисленных выше в качестве предпочтительных.
Особое предпочтение в соответствии с изобретением отдается применению соединений формулы (I), которые содержат комбинацию значений, перечисленных выше в качестве особенно предпочтительных.
Очень особое предпочтение в соответствии с изобретением отдается применению соединений формулы (I), которые содержат комбинацию значений, перечисленных выше в качестве очень особенно предпочтительных.
Настоящее изобретение также относится к новым соединениям формулы (I), в которой A, Q, D и В имеют значения, указанные выше, для соединений, за исключением W и W2, как описано выше, в частности, от W-1 до W-12, от W2-1 до W2-3, W2-5 и W2-6. Общие или предпочтительные определения или разъяснения радикалов, перечисленные выше, также применимы к новым соединениям формулы (I). Если соединения, которые используют в соответствии с изобретением, упомянуты в настоящей заявке, это включает в себя, если не указано иное, в каждом случае как соединения формулы (I), так и новые соединения формулы (I).
В группах соединений ниже, отдельные радикалы R и Z имеют значения, указанные выше.
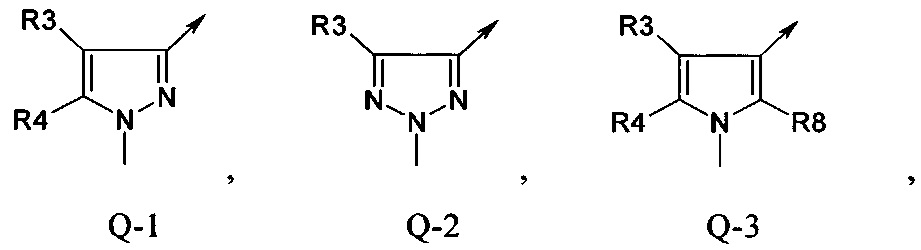
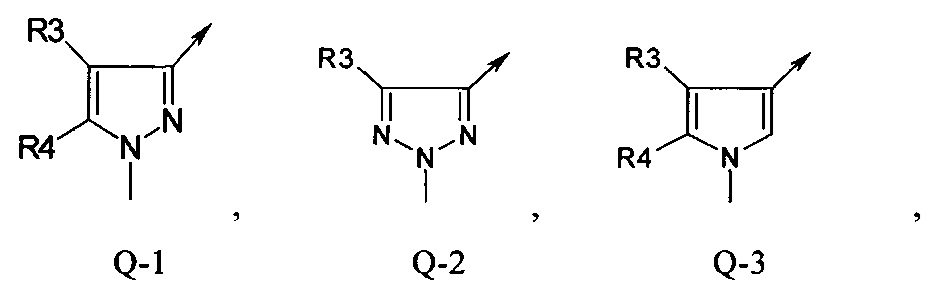
В отдельной группе соединений формулы (I), которые используют в соответствии с изобретением, Q представляет собой Q-1
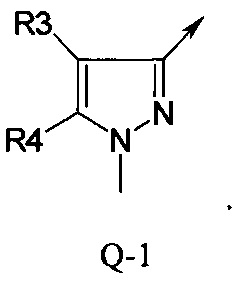
В другой определенной группе соединений формулы (I), которые используют в соответствии с изобретением, Q представляет собой Q-2
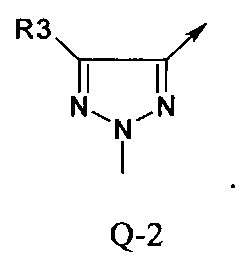
В другой определенной группе соединений формулы (I), которые используют в соответствии с изобретением, Q представляет собой Q-3

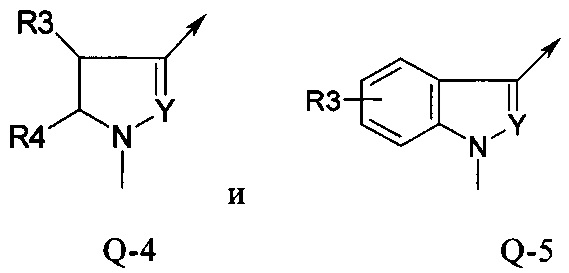
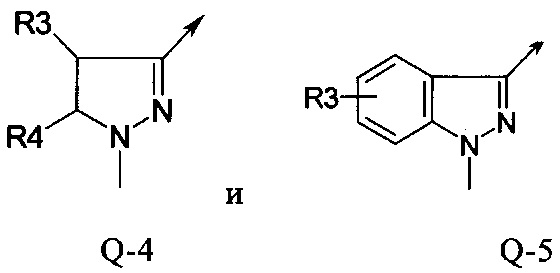
В другой определенной группе соединений формулы (I), которые используют в соответствии с изобретением, Q представляет собой Q-4

В другой определенной группе соединений формулы (I), которые используют в соответствии с изобретением, Q представляет собой Q-5

В другой определенной группе соединений формулы (I) которые используют в соответствии с изобретением, А представляет собой

где этот радикал несет m заместители R2.
В другой определенной группе соединений формулы (I), которые используют в соответствии с изобретением, А представляет собой

где этот радикал несет m заместители R2.
В другой определенной группе соединений формулы (I), которые используют в соответствии с изобретением, А представляет собой

где этот радикал несет m заместители R2.
В конкретных группах соединений формулы (I) ниже, все из которых представляют предпочтительные варианты осуществления, радикалы А и В могут нести дополнительные заместители R2 и R7, соответственно, как указано выше.
Определенная группа соединений формулы (I) представляет собой соединения формулы (А-1)-(Q-1)-D-(В-1)

Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-2)-(Q-1)-D-(В-1)

Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-1)-(Q-1)-D-(В-2)
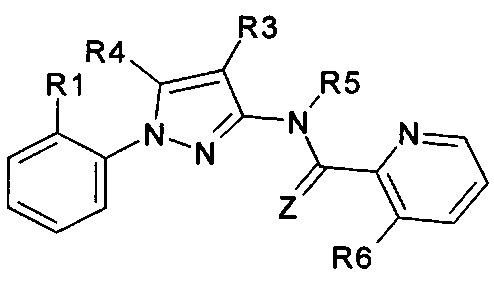
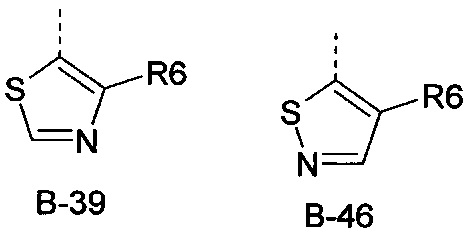
Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-1)-(Q-1)-D-(В-39)
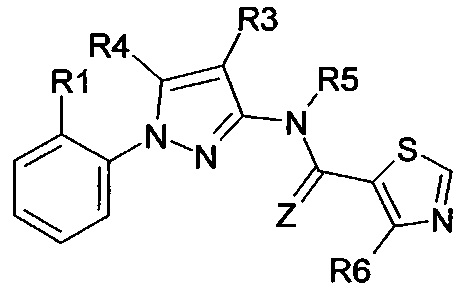
Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-1)-(Q-1)-D-(В-23)
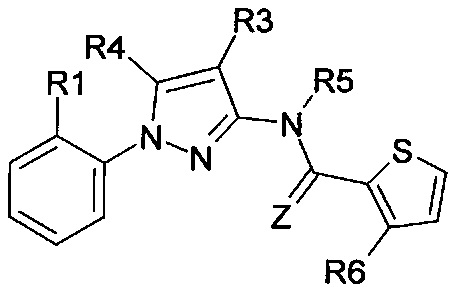
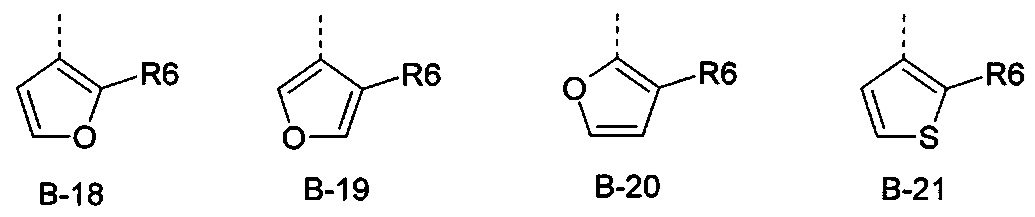
Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-1)-(Q-1)-D-(В-21)

Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-1)-(Q-1)-D-(В-18)
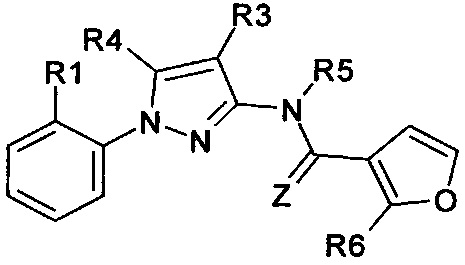
Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-1)-(Q-1)-D-(В-3)
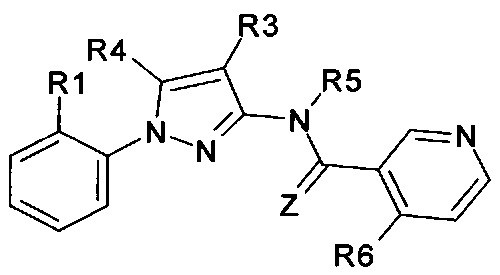
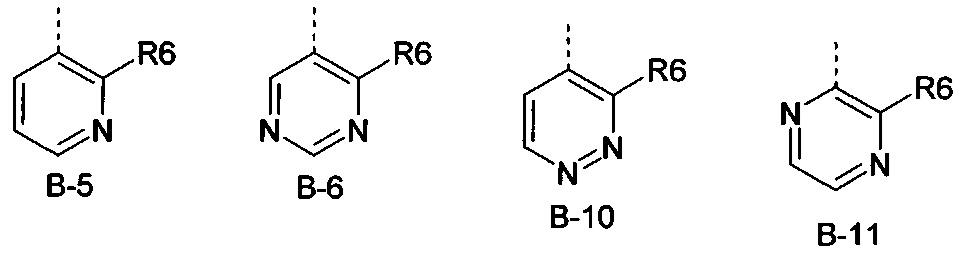
Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-1)-(Q-1)-D-(В-11)

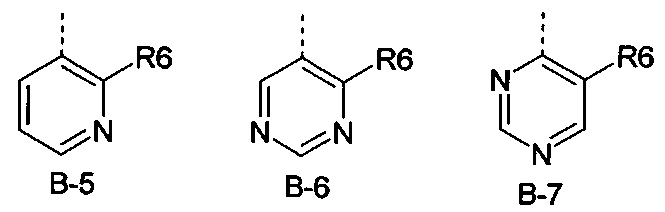
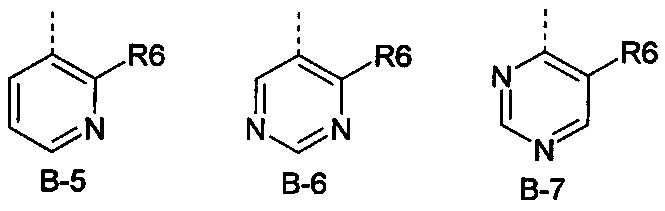
Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-1)-(Q-1)-D-(В-5)
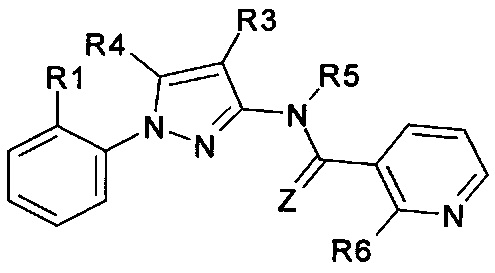
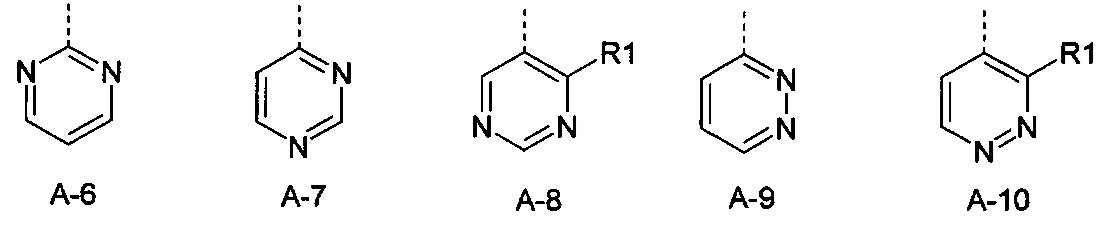
Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-6)-(Q-1)-D-(В-1)
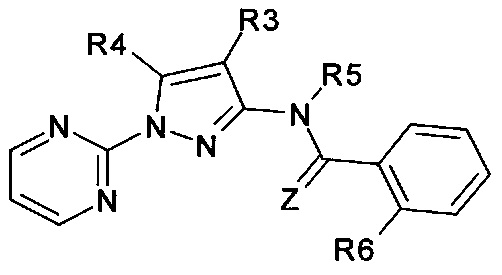
Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-2)-(Q-1)-D-(В-3)

Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-1)-(Q-4)-D-(В-1)

Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-1)-(Q-2)-D-(В-1)
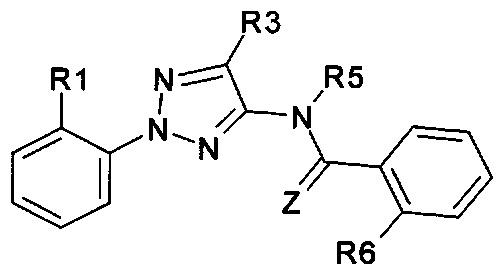
Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-1)-(Q-2)-D-(В-5)

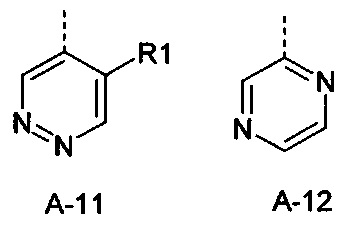
Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-2)-(Q-5)-D-(В-1)

Таким же образом, как для конкретных групп соединений выше, соответствующие структурные формулы могут быть построены простым способом для групп соединений ниже.
Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-3)-(Q-1)-D-(В-1).
Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-1)-(Q-1)-D-(В-36).
Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-1)-(Q-1)-D-(В-46).
Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-1)-(Q-1)-D-(В-1).
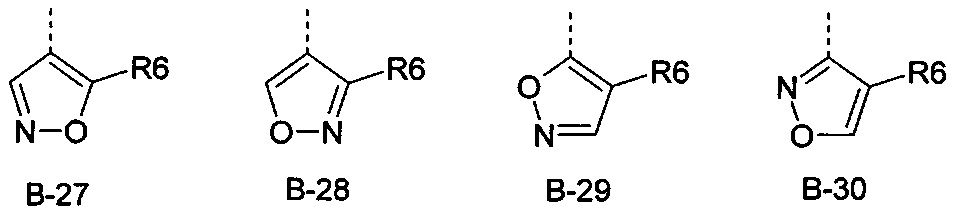
Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-1)-(Q-1)-D-(В-27).
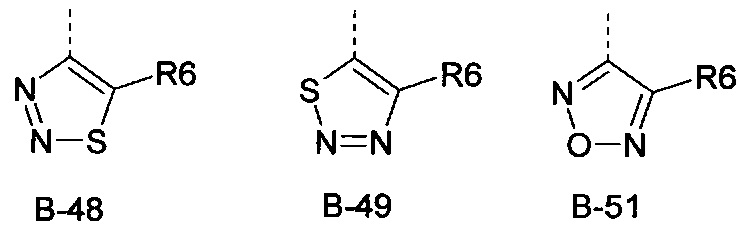
Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-1)-(Q-1)-D-(В-51).
Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-1)-(Q-1)-D-(В-4).
Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-1)-(Q-1)-D-(В-13).
Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-1)-(Q-1)-D-(В-31).
Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-1)-(Q-1)-D-(В-35).
Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-1)-(Q-1)-D-(В-27).
Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-1)-(Q-1)-D-(В-10).
Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-1)-(Q-1)-D-(В-51).
Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-12)-(Q-1)-D-(В-1).
Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-12)-(Q-1)-D-(В-2).
Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-2)-(Q-1)-D-(В-49).
Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-2)-(Q-1)-D-(В-46).
Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-2)-(Q-1)-D-(В-13).
Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-2)-(Q-1)-D-(В-4).
Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-2)-(Q-1)-D-(В-6).
Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-2)-(Q-1)-D-(В-25).
Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-2)-(Q-1)-D-(В-31).
Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-2)-(Q-1)-D-(В-35).
Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-2)-(Q-1)-D-(В-27).
Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-7)-(Q-1)-D-(В-1).
Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-9)-(Q-1)-D-(В-1).
Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-2)-(Q-1)-D-(В-31).
Еще одна определенная группа соединений формулы (I) представляет собой соединения формулы (А-2)-(Q-1)-D-(В-35).
Если R4 или R3 в группе Q-1 представляет собой гидрокси, Q-1 может также присутствовать в кето форме:

Кроме того, было обнаружено, что соединения формулы (I) могут быть получены способами, описанными ниже.
Таким образом, изобретение также относится к способам получения соединений формулы (I), где Z представляет собой О,
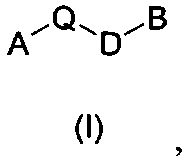
где А, Q, D и В имеют значения, описанные выше,
с помощью взаимодействия аминов формул (II-1) - (II-5)
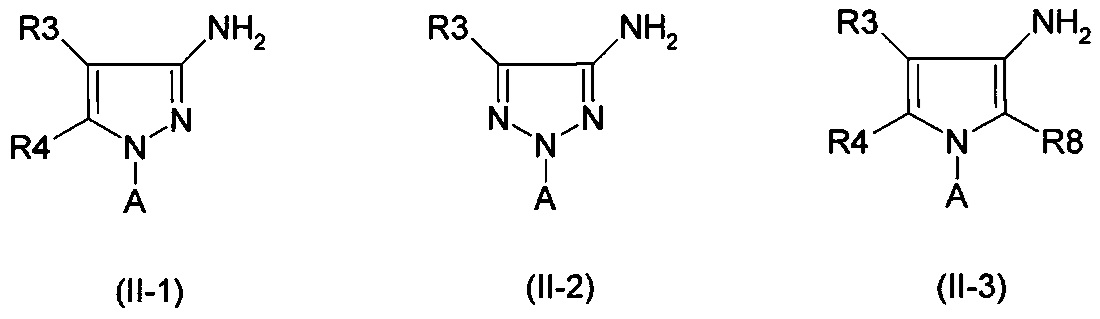

с карбоновыми кислотами или карбониловыми галогенидами формулы (III)

где
M представляет собой галоген, гидрокси, алкокси, алкилсульфанил, окси, сульфонилокси, N-гетероциклил (например, имидазолил) или представляет собой гидрокси,
В имеет значения, приведенные выше и
Z представляет собой О.
а) Здесь соединения формулы (III) могут быть предварительно активированы или быть активированы in situ. Соединения формулы (III) могут быть использованы, например, в качестве галогенангидридов кислот (например, M = хлор). В этом случае реакция преимущественно проводится в присутствии основания, такого как, например, триэтиламин или гидроксид натрия. Тем не менее также можно использовать карбоновые кислоты (М=ОН) в присутствии реагентов сочетания, таких как, например, дициклогексилкарбодиимид и добавки, такие как 1-гидрокси-1-Н-бензотриазол (W.

б) Соединения формулы (I), в которой Z представляет собой О (атом кислорода), тогда могут, необязательно быть подвергнуты взаимодействию с сульфурирующим агентом, таким как, дифосфор пентасульфид или реагент Лоуссона (см. С.P. Dell in Comprehensive Organic Functional Group Transformations, Vol. 5, eds.: A.L. Katritzky, O. Meth-Cohn, C.W. Rees, Pergamon, Oxford, 1995, S. 565; M. Jesberger, T.P. Davis, L. Barner, Synthesis 2003, 13, 1929), с получением соединений формулы (I) где Z представляет собой S (атом серы).
в) Соединения формул (I-1), (I-2) и (I-3)

в которых R3 представляет собой галоген, могут быть получены либо с помощью пути получения, описанного выше, из соответствующих аминов формул (II-1), (II-2) и (II-3), в которых R3 представляет собой галоген (F, Cl, Br или I), или быть синтезированы из амидов формул (I-1), (I-2) и (I-3), в которых R3 представляет собой H (водород) с помощью реакции с галогенизирующим агентом, таким как N-галосукцинимиды (см., например, WO 2008/092888, Z.-G-Zhao, Z.-X. Wang, Synth. Comm. 2007, 37, 137) или 1-хлорметил-4-фтордиазониабицикло[2.2.2]октанбис(тетрафторборат) (P.T. Nyffeler, S. Gonzalez

г) Соединения формул (I-1), (I-2) и (I-3), в которых R5 представляет собой водород, могут быть превращены в присутствии основания (например, гидрид натрия) и алкилирующего (например, метил йодид) или ацилирующего агента (например, уксусный ангидрид) в соединения формул (I-1), (I-2) и (I-3), где R5 представляет собой алкил или ацил (см, например, WO 2005/092863).
д) Соединения формулы (I-1) альтернативно могут также быть получены путем взаимодействия 1Н-пиразолов формулы (IV-1)
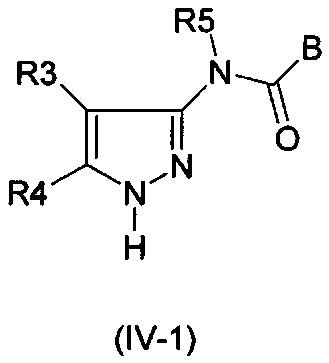
с ароматическими соединениями или гетероароматическими соединениями формулы (V)
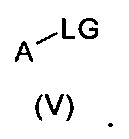
которые замещены с помощью подходящей группы LG. Реакцию можно проводить либо в присутствии основания (например, карбонат калия для, например, LG = фтор (см. WO 2011/060035) или необязательно катализатора (например, CuI/1,2-циклогександиамин, карбонат калия для, например, LG = бром (см. WO 2007/039146) или Cu (ОАс)2/пиридина для, например, LG=В(ОН)2 (см. WO 2005/092863)).
Амины формулы (II-1)

являются коммерчески доступными или известными из литературы, или они могут быть синтезированы с помощью методик, известных из литературы.
Примерами, которые могут быть указаны, являются:
1-(2-метилфенил)-1Н-пиразол-3-амин (WO 2004/037794),
1-(2-метоксифенил)-1Н-пиразол-3-амин (WO 2004/037794),
1-(2-(трифторметил)фенил)-1Н-пиразол-3-амин (коммерчески доступный),
1-(2-цианофенил)-1Н-пиразол-3-амин (коммерчески доступный),
1-(2-фторфенил)-1Н-пиразол-3-амин (WO 2004/037794),
1-(2-хлорфенил)-1Н-пиразол-3-амин (С. Albert, С. Tironi, FarmacoSci. 1964, 19, 618),
1-(2-хлорфенил)-5-метил-1Н-пиразол-3-амин (коммерчески доступный)
1-(2-бромфенил)-1Н-пиразол-3-амин (коммерчески доступный),
1-(2,4-дифторфенил)-1Н-пиразол-3-амин (коммерчески доступный),
1-(2,5-дихлорфенил)-1Н-пиразол-3-амин (коммерчески доступный),
1-(пиридин-2-ил)-1Н-пиразол-3-амин (WO 2004/037794),
1-(3-хлорпиридин-2-ил)-1Н-пиразол-3-амин (коммерчески доступный),
1-(3-фторпиридин-2-ил)-1Н-пиразол-3-амин (коммерчески доступный),
1-(пиримидин-2-ил)-1Н-пиразол-3-амин (коммерчески доступный),
1-(пиридазин-3-ил)-1Н-пиразол-3-амин (коммерчески доступный),
1-[2-(метилсульфонил)фенил]-1Н-пиразол-3-амин (коммерчески доступный),
1-(2,3-дифторфенил)-1Н-пиразол-3-амин (коммерчески доступный),
1-(2,4,5-трифторфенил)-1Н-пиразол-3-амин (коммерчески доступный),
1-(2,4-дихлорфенил)-1Н-пиразол-3-амин (коммерчески доступный),
1-(2,5-дифторфенил)-1Н-пиразол-3-амин (коммерчески доступный),
1-(2,4-дифторфенил)-5-этил-1Н-пиразол-3-амин (коммерчески доступный),
1-(2,4-дифторфенил)-5-метил-1Н-пиразол-3-амин (коммерчески доступный),
1-(2-нитрофенил)-1Н-пиразол-3-амин (коммерчески доступный),
1-[3-хлор-5-(трифторметил)пиридин-2-ил]-1Н-пиразол-3-амин (коммерчески доступный),
1-[3-(трифторметил)пиридин-2-ил]-1Н-пиразол-3-амин (коммерчески доступный),
1-(3,5-дихлорпиридин-2-ил)-1Н-пиразол-3-амин (коммерчески доступный),
1-(3-бромпиридин-2-ил)-1Н-пиразол-3-амин (коммерчески доступный),
2-(3-амино-1Н-пиразол-1-ил)никотинонитрил (коммерчески доступный),
3-(3-амино-1Н-пиразол-1-ил)пиразин-2-карбонитрил (коммерчески доступный),
2-(3-амино-1Н-пиразол-1-ил)-6-метилникотинонитрил (коммерчески доступный),
2-(3-амино-1Н-пиразол-1-ил)-4,6-диметилникотинонитрил (коммерчески доступный),
1-(5-фторпиридин-2-ил)-1Н-пиразол-3-амин (коммерчески доступный).
Новые 1Н-пиразол-3-амины формулы (II-1) могут быть получены, как показано в Схеме синтеза 1.
Схема синтеза 1
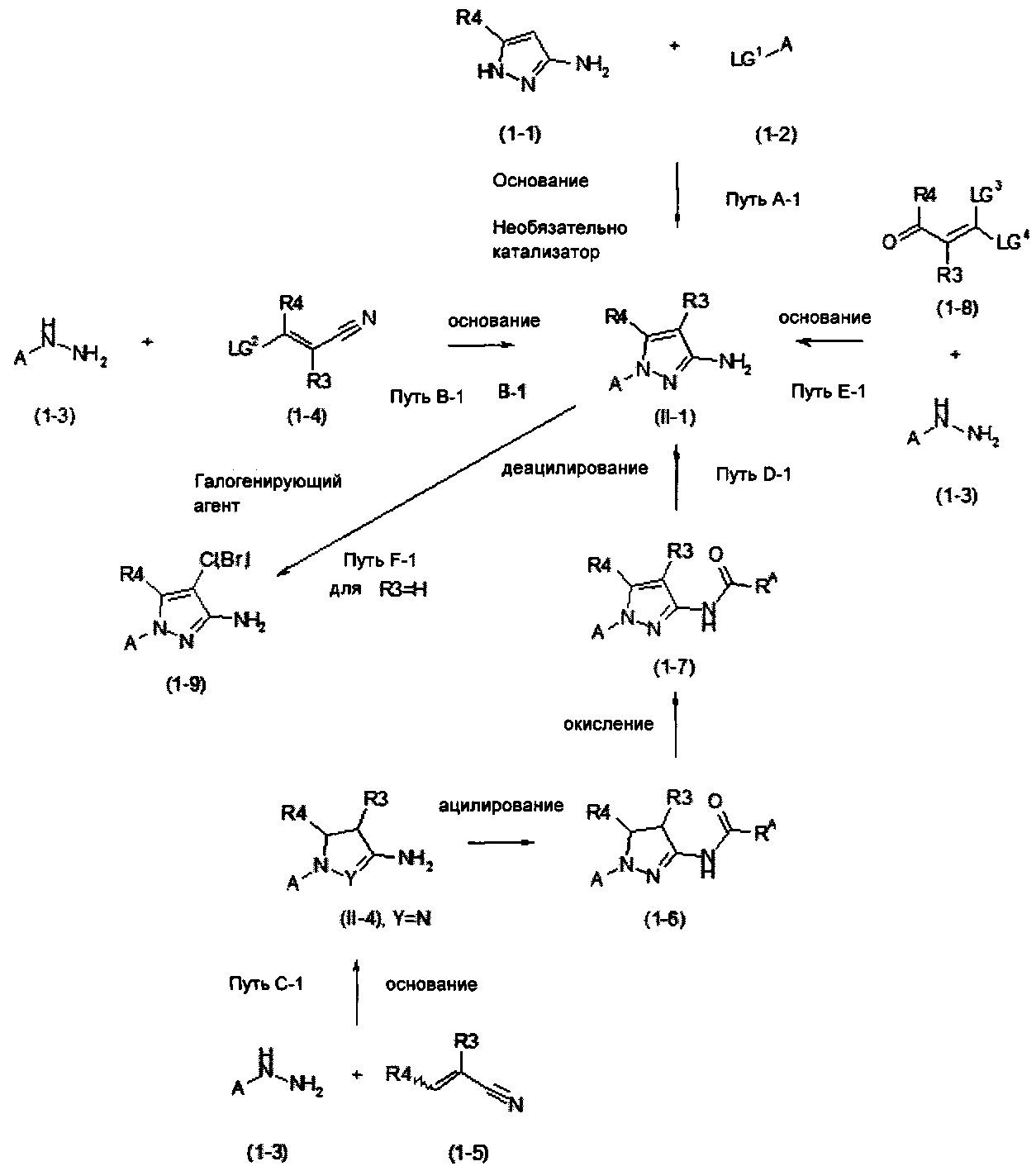
Согласно пути А-1, 1H-пиразол-3-амины формулы (1-1) могут быть подвергнуты взаимодействию с ароматическими соединениями или гетероароматическими соединениями формулы (1-2), замещенной подходящей группой LG1 с реакцией в присутствии основания (например, трет-бутоксид калия для, например, LG1 = хлор (см. WO 2009/012482) или, например, карбонат цезия для, например, LG1 = хлор (см. WO 2007/056155)) и, необязательно катализатора (например, CuI/N,N-диметилэтан-1,2-диамин, карбонат калия для, например, LG1 = йод (см. WO 2008/153042) или Pd2(dba)3/ксантфос, карбонат натрия для, например, LG1 = хлор (см. Z. Shen, Y. Hong, X. Не, W. Mo, В. Hu, N. Sun, X. Hu, Org. Lett. 2010, 12, 552)) с получением соединений формулы (II-1).
В альтернативном пути В-1, арил- или гетарилгидразин формулы (1-3), которые могут присутствовать в виде свободного гидразина или в виде соли (например, как гидрохлорид) могут быть подвергнуты взаимодействию с акрилонитрилом формулы (1-4), которая замещена уходящей группой LG2 (например, LG2 = или где R = алкил, ацил, сульфонил, и т.д.; LG2=SR, где R = алкил, ацил и т.п.; LG2=NHR или NR2, где R = алкил, ацил, сульфонил; LG2 = галогенилициано) в присутствии подходящего основания (например, этоксид натрия, см. например, WO 2004/037794 или трет-бутоксид калия, см. например, WO 2008/046527) с получением 1Н-пиразол-3-амина формулы (II-1).
4,5-дигидро-1Н-пиразол-3-амины формулы (II-4), в которой Y представляет собой N, могут быть получены через путь С-1 из арил- или гетарилгидразинов (1-3), которые могут присутствовать в виде свободных гидразинов или солей (например, как гидрохлориды) с использованием акрилонитрилов формулы (1-5) в присутствии подходящего основания (например, холин) (см. С. Albert, С. Tironi, Farmaco Sci. 1964, 19, 618). Соединения формулы (II-4), в которой Y представляет собой Н, можно подобным образом подвергнуть взаимодействию в последовательности ацилированию с соответствующим ацилирующим агентом (например, уксусный ангидрид для RA = метил), окислению с соответствующим окислителем (например, 2,3-дихлор-5,6-дициано-1,4-бензохинон) и удалению ацильной группы с помощью соответствующих методов (например, нагрева в соляной кислоте, см. Greene's protective groups in organic synthesis, 4th ed., P.G.M. Wuts, T.W. Greene, John Wiley & Sons, Inc., Hoboken, New Jersey, 2007), чтобы получить 1Н-пиразол-3-амины формулы (II-1).
Доступ к 1Н-пиразол-3-аминам формулы (II-1) также обеспечивается через путь Е-1, исходя из кето соединений формулы (1-8), что замещено уходящей группой LG3/4 (например, LG3/4 = или где R = алкил, ацил, сульфонил, и т.д.; LG3/4 = SR, где R = алкил, ацил и т.п.; LG3/4 = NHR или NR2, где R = водород, алкил, ацил, сульфонил; LG3/4 = галоген). Они изначально активированы аммиаком через β-енаминокетоны (LG3 = NH2/ LG4 = алкокси) (см. М. А. Р. Martins, W. Cunico, S. Brondani, R.L. Peres, N. Zimmermann, F.A. Rosa, G.F. Fiss, N. Zanatta, H.G. Bonacorso Synthesis 2006, 1485) и затем, в присутствии подходящих оснований (например, триэтиламин) которые вступают в реакцию со свободными гидразинами или их солями (например, гидрохлориды), чтобы обеспечить 1Н-пиразол-3-амины формулы (II-1).
1Н-пиразол-3-амины формулы (II-1) могут быть необязательно галогенизированы через путь F-1, если R3 представляет собой Н (водород), с использованием подходящих галогенизирующих агентов (например, N-галосукцинимиды) в положении 3 с получением соединений формулы (1-8), в которых R3 представляет собой атом хлора, брома или йода (см. J. Velcicky, R. Feifei, S. Hawtin, R. Heng, С. Huppertz, G. Koch, M. Kroemer, H. Moebitz, L. Revesz, C. Scheufler, A. Schlapbach Bioorg. Med. Chem. Letters 2010, 20, 1293).
Амины формулы (II-2)
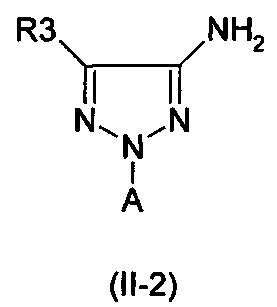
являются также коммерчески доступными. Примеры, которые можно указать, представляют собой следующие:
2-(2-бромфенил)-2Н-1,2,3-триазол-4-амин (коммерчески доступный)
2-(2-хлорфенил)-2Н-1,2,3-триазол-4-амин (коммерчески доступный)
2-(2-бромфенил)-5-хлор-2Н-1,2,3-триазол-4-амин (коммерчески доступный)
2-(3-хлорпиридин-2-ил)-2Н-1,2,3-триазол-4-амин (коммерчески доступный)
2-(3-бромпиридин-2-ил)-2Н-1,2,3-триазол-4-амин (коммерчески доступный)
5-хлор-2-(3-хлорпиридин-2-ил)-2Н-1,2,3-триазол-4-амин (коммерчески доступный)
Новые амины формулы (II-2) могут быть получены согласно Схеме синтеза 3:
Схема синтеза 3

Через путь А-3, ароматические гидразины формулы (3-1) могут быть подвергнуты взаимодействию, например, с нитрозокетонами (например, нитрозокетон для R3=Н, см. M. Begtrup, J. Holm J. Chem. Soc, Perkin Trans. 1, 1981, 503) и затем циклизированы с помощью конденсирующих агентов (например, уксусный ангидрид, см. D.L. Swartz, A.R. Karash, L.A. Berry, D.L. Jaeger J. Heterocyclic Chem. 1983, 20, 1561), чтобы обеспечить 2H-1,2,3-триазолы формулы (3-3). Окисление (например, с помощью хромата(VI) натрия см. Comprehensive Organic Transformations: A Guide to Functional Group Preparations; Larock, R. C, Ed.; Wiley-VCH: New York, 1999) (3-3) дает карбоновую кислоту (3-4), которую затем можно превратить в результате деградации Курциуса в 4-амино-2Н-1,2,3-триазол (II-2) (см. P. A. S. Smith Org. React. 1946, 337).
В качестве альтернативы путь В-3 также может быть задействован для получения 4-амино-2Н-1,2,3-триазолов (II-2) (см. V.M. Nikitin, А.V. Zavodov, L.I. Vereshchagin Zhurnal Organicheskoi Khimii l992, 28, 2334). С этой целью ароматический амин (3-5) диазотируют и соль диазония (3-6) подвергают взаимодействию, например, с метазоновой кислотой (для R3=Н). Полученный 4-нитро-2Н-1,2,3-триазол (3-7), может быть восстановлен, например, с помощью олово(II) хлорида с получением 4-амино-2Н-1,2,3-триазола (II-2).
Амины формулы (II-3)
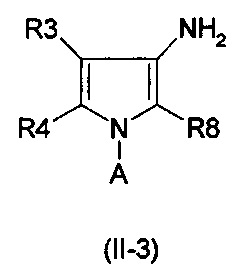
могут быть обеспечены с помощью Схемы синтеза 4.
Схема синтеза 4
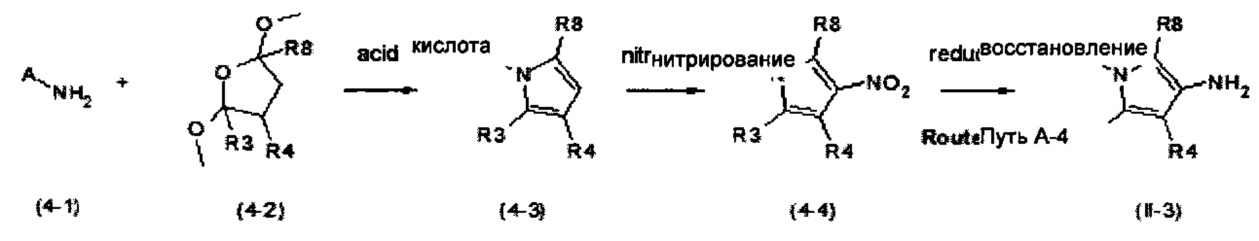
С этой целью, ароматические амины формулы (4-1) подвергают взаимодействию, например, с циклическими ацеталями формулы (4-2) в кислых условиях с получением пиррола (4-3) (например, FeCl3 см. N. Azizi, A. Khajeh-Amiria, Н. Ghafurib, М. Bolourtchiana, М.R. Saidi Synlett 2009, 14, 2245). Азотирование пиррола (4-3) до 3-нитро-1Н-пиррола (4-4) (например, с помощью ацетил нитрата, см. D. Korakas, G. Varvounis J. Heterocyclic Chem. 1996, 33, 611) и последующее восстановление (например, с помощью SnCl2, см. WO 2009/136995) дает 3-амино-1Н-пиррол (II-3).
Амины формулы (II-5)

также являются коммерчески доступными. Новые 1Н-индазол-3-амины формулы (II-5) могут быть получены согласно Схеме синтеза 2.
Схема синтеза 2

Так, соединения формулы (2-1) подвергают взаимодействию через путь А-2 с ароматическими соединениями или с гетероароматическими соединениями формулы (2-2), что замещено подходящей покидающей группой LG с реакцией в присутствии основания (например, гидрид натрия для, например, LG = хлор (см. WO 2008/068171)) и, необязательно катализатора (например, CuI/N, N-диметилэтан-1,2-диамин, карбонат калия для, например, LG = бром (см. WO 2010/098367) или Pd2(dba)3/Х-Phos, карбоната цезия для, например, LG = хлор (см. DE 102009/004245)), с получением соединений формулы (II-5). 1Н-индазол-3-амины формулы (2-1) и ароматические соединения или гетероароматические соединения формулы (2-2) являются коммерчески доступными или могут быть получены известными способами.
Через путь В-2, альтернативным способом можно подвергнуть взаимодействию орто-галобензонитрилы формулы (2-3) с гидразидами формулы (2-4) в присутствии катализатора и основания (например, медь(I), бромида/4-гидрокси-L-пролина; карбонат калия для X=Br или I и Ar = фенил, см. L. Xu, Y. Peng, Q. Pan, Y. Jiang, D. Ma J. Org. Chem. 2013, 78, 3400), чтобы получить 1H-индазол-3-амины формулы (II-5).
Методики в соответствии с изобретением для получения новых соединений формулы (I), предпочтительно осуществляют с использованием разбавителя. Полезные растворители для выполнения методик в соответствии с изобретением представляют собой равно как и воду, все инертные растворители. Примеры включают в себя: галогенуглеводороды (например, хлоруглеводороды, такие как тетрахлорэтилен, тетрахлорэтан, дихлорпропан, метилен хлорид, дихлорбутан, хлороформ, тетрахлорид углерода, трихлорэтан, трихлорэтилен, пентахлорэтан, дифторбензол, 1,2-дихлорэтан, хлорбензол, бромбензол, дихлорбензол, трихлорбензол, хлортоуол), спирты (например, метанол, этанол, изопропанол, бутанол), простые эфиры (например, этилпропиловый эфир, метилтрет-бутиловый эфир, анизол, фенетол, циклогексил метиловый эфир, диметиловый эфир, диэтиловый эфир, дипропиловый эфир, диизопропиловый эфир, ди-н-бутиловый эфир, диизобутиловый эфир, диизоамиловый эфир, этиленгликоль диметиловый эфир, тетрагидрофуран, 1,4-диоксан, дихлордиэтиловый эфир и полиэфиры этилен оксида и/или пропилен оксида), амины (например, триметил-, триэтил-, трипропил-, трибутиламин, N-метилморфолин, пиридин и тетраметилендиамин), нитроуглеводороды (например, нитрометан, нитроэтан, нитропропан, нитробензол, хлорнитробензол, о-нитротолуол); нитрилы (например, ацетонитрил, пропионитрил, бутиронитрил, изобутиронитрил, бензонитрил, м-хлорбензонитрил), тетрагидротиофен диоксид, диметилсульфоксид, тетраметилен сульфоксид, дипропилсульфоксид, бензил метилсульфоксид, диизобутилсульфоксид, дибутил сульфоксид, диизоамил сульфоксид, сульфоны (например, диметил, диэтил, дипропил, дибутил, дифенил, дигексил, метилэтил, этилпропил, этилизобутил и пентаметилен сульфон), алифатические, циклоалифатические или ароматические углеводороды (например, пентан, гексан, гептан, октан, нонан и технические углеводороды), а также то, что называют "уайт-спирит" с компонентами, имеющими температуру кипения в диапазоне от, например, 40°С до 250°С, кумол, нефтяные фракции в пределах диапазона кипения от 70°С до 190°С, циклогексан, метилциклогексан, петролейный эфир, лигроин, бензол, толуол, ксилол, сложные эфиры (например, метил, этил, бутил ацетат и изобутил, диметил, дибутил и этилен карбонат); амиды (например, гексаметилфосфорный триамид, формамид, N-метилформамид, N,N-диметилформамид, N,N-дипропилформамид, N,N-дибутилформамид, N-метилпирролидин, N-метилкапролактам, 1,3-диметил-3,4,5,6-тетрагидро-2(1Н)-пиримидин, октилпирролидон, октилкапролактам, 1,3-диметил-2-имидазолиндион, N-формилпиперидин, N,N'-диформилпиперазин) и кетоны (например, ацетон, ацетофенон, метилэтилкетон, метилбутилкетон).
Конечно, также возможно, осуществить методику в соответствии с изобретением в смесях разбавителей и указанных растворителей.
При выполнении процесса в соответствии с изобретением, температуру реакции можно варьировать в широких пределах. В общем, используемые температуры, находятся между -30°С и 150°С, предпочтительно от -10°С и +100°С.
Методика в соответствии с изобретением, как правило, осуществляется при атмосферном давлении. Тем не менее также возможно, выполнять методику в соответствии с изобретением при повышенном или пониженном давлении - как правило, при абсолютном давлении между 0,1 бар и 15 бар.
Для выполнения методики в соответствии с изобретением, исходные соединения, как правило, используются в примерно эквимолярных количествах. Тем не менее можно также использовать один из компонентов в относительно большом избытке. Реакцию обычно проводят в подходящем разбавителе в присутствии реакционного вспомогательного вещества, возможно, также в атмосфере защитного газа (например, под азотом, аргоном или гелием) и реакционную смесь перемешивают, как правило, при необходимой температуре в течение нескольких часов. Проработка осуществляется обычными методами (см. Примеры получения).
Основными реакционными вспомогательными веществами, используемыми для выполнения методик в соответствии с изобретением, могут быть все, связывающие кислоту соединения. Примеры включают: соединения щелочноземельных металлов или щелочных металлов (например, гидроксиды, гидриды, оксиды и карбонаты лития, натрия, калия, магния, кальция и бария), основание амидина или основание гуанидина (например, 7-метил-1,5,7-триазабицикло[4.4.0]дец-5-ен (MTBD); диазабицикло[4.3.0]нонен (DBN), диазабицикло[2.2.2]октан (DABCO), 1,8-диазабицикло[5.4.0]ундецен (DBU), циклогексилтетрабутилгуанидин (CyTBG), циклогексилтетраметилгуанидин (CyTMG), N,N,N,N-тетраметил-1,8-нафталендиамин, пентаметилпиперидин) и амины, особенно третичные амины (например, триэтиламин, триметиламин, трибензиламин, триизопропиламин, трибутиламин, трициклогексиламин, триамиламин, тригексиламин, N,N-диметиланилин, N,N-диметилтолуидин, диметил-п-аминопиридин, N-метилпирролидин, N-метилпиперидин, N-метилимидазол, N-метилпиразол, N-метилморфолин, N-метилгексаметилендиамин, пиридин, 4-пирролидинопиридин, 4-диметиламинопиридин, хинолин, 2-пиколин, 3-пиколин, пиримидин, акридин, N,N,N',N'-тетраметилендиамин, N,N,N',N'-тетраэтилендиамин, хиноксалин, N-пропилдиизопропиламин, N-этилдиизопропиламин, N,N'-диметилциклогексиламин, 2,6-лютидин, 2,4-лютидин или триэтилендиамин).
Вспомогательные вещества для кислотной реакции, используемые для выполнения методик в соответствии с изобретением включают все минеральные кислоты (например, галогенводородные кислоты, такие как гидрофторная кислота, соляная кислота, бромистоводородная кислота или йодистоводородна кислота, а также серная кислота, фосфорная кислота, фосфорная кислота, азотная кислота), кислоты Льюиса (например, алюминий(III) хлорид, трифторид бора или его этерат, титан(IV) хлорид, олово(IV) хлорид) и органические кислоты (например, муравьиная кислота, уксусная кислота, пропионовая кислота, малоновая кислота, молочная кислота, щавелевая кислота, фумаровая кислота, адипиновая кислота, стеариновая кислота, винная кислота, олеиновая кислота, метансульфоновая кислота, бензойная кислота, бензолсульфоновая кислота или пара-толуолсульфоновая кислота).
Активные соединения согласно изобретению или активные соединения, которые используют в соответствии с изобретением, имеют хорошую переносимость растений, благоприятную гомотермическую токсичность и хорошую экологическую совместимость, предназначены для защиты растений и органов растений, для повышения урожайности, улучшения качества собранного материала и для борьбы с животными вредителями, особенно насекомыми, паукообразными, гельминтами, нематодами и моллюсками, которые встречаются в сельском хозяйстве, в садоводстве, в животноводстве, в лесах, в садах и местах отдыха, в защите хранимой продукции и материалов, и в области гигиены. Они предпочтительно могут быть использованы в качестве средств защиты растений. Они активны в отношении обычно чувствительных и устойчивых видов и против всех или некоторых этапов развития. Указанные вредители включают:
вредителей от филума членистоногих, в частности из класса паукообразных, например, Acarus spp., Aceria sheldoni, Aculops spp., Aculus spp., Amblyomma spp., Amphitetranychus viennensis, Argas spp., Boophilus spp., Brevipalpus spp., Bryobia graminum, Bryobia praetiosa, Centruroides spp., Chorioptes spp., Dermanyssus gallinae, Dermatophagoides pteronyssinus, Dermatophagoides farinae, Dermacentor spp., Eotetranychus spp., Epitrimerus pyri, Eutetranychus spp., Eriophyes spp., Glycyphagus domesticus, Halotydeus destructor, Hemitarsonemus spp., Hyalomma spp., Ixodes spp., Latrodectus spp., Loxosceles spp., Metatetranychus spp., Neutrombicula autumnalis, Nuphersa spp., Oligonychus spp., Ornithodorus spp., Ornithonyssus spp., Panonychus spp., Phyllocoptruta oleivora, Polyphagotarsonemus latus, Psoroptes spp., Rhipicephalus spp., Rhizoglyphus spp., Sarcoptes spp., Scorpio maurus, Steneotarsonemus spp., Steneotarsonemus spinki, Tarsonemus spp., Tetranychus spp., Trombicula alfreddugesi, Vaejovis spp., Vasates lycopersici.;
из класса губоногих, например, Geophilus spp., Scutigera spp.;
из отряда или класса вилохвосток, например, Onychiurus armatus.;
из класса двупарноногих, например, Blaniulus guttulatus;
из класса насекомых, например, из отряда таракановых, например, Blattella asahinai, Blattella germanica, Blatta orientalis, Leucophaea maderae, Panchlora spp., Parcoblatta spp., Periplaneta spp., Supella longipalpa;
из отряда жесткокрылых, например, Acalymma vittatum, Acanthoscelides obtectus, Adoretus spp., Agelastica alni, Agriotes spp., Alphitobius diaperinus, Amphimallon solstitialis, Anobium punctatum, Anoplophora spp., Anthonomus spp., Anthrenus spp., Apion spp., Apogonia spp., Atomaria spp., Attagenus spp., Bruchidius obtectus, Bruchus spp., Cassida spp., Cerotoma trifurcata, Ceutorrhynchus spp., Chaetocnema spp., Cleonus mendicus, Conoderus spp., Cosmopolites spp., Costelytra zealandica, Ctenicera spp., Curculio spp., Cryptolestes ferrugineus, Cryptorhynchus lapathi, Cylindrocopturus spp., Dermestes spp., Diabrotica spp., Dichocrocis spp., Dicladispa armigera, Diloboderus spp., Epilachna spp., Epitrix spp., Faustinus spp., Gibbium psylloides, Gnathocerus cornutus, Hellula undalis, Heteronychus arator, Heteronyx spp., Hylamorpha elegans, Hylotrupes bajulus, Hypera postica, Hypomeces squamosus, Hypothenemus spp., Lachnosterna consanguinea, Lasioderma serricorne, Latheticus oryzae, Lathridius spp., Lema spp., Leptinotarsa decemlineata, Leucoptera spp., Lissorhoptrus oryzophilus, Lixus spp., Luperodes spp., Lyctus spp., Megascelis spp., Melanotus spp., Meligethes aeneus, Melolontha spp., Migdolus spp., Monochamus spp., Naupactus xanthographus, Necrobia spp., Niptus hololeucus, Oryctes rhinoceros, Oryzaephilus surinamensis, Oryzaphagus oryzae, Otiorrhynchus spp., Oxycetonia jucunda, Phaedon cochleariae, Phyllophaga spp., Phyllophaga helleri, Phyllotreta spp., Popillia japonica, Premnotrypes spp., Prostephanus truncatus, Psylliodes spp., Ptinus spp., Rhizobius ventralis, Rhizopertha dominica, Sitophilus spp., Sitophilus oryzae, Sphenophorus spp., Stegobium paniceum, Sternechus spp., Symphyletes spp., Tanymecus spp., Tenebrio molitor, Tenebrioides mauretanicus, Tribolium spp., Trogoderma spp., Tychius spp., Xylotrechus spp., Zabrus spp.;
из отряда двукрылых, например, Aedes spp., Agromyza spp., Anastrepha spp., Anopheles spp., Asphondylia spp., Bactrocera spp., Bibio hortulanus, Calliphora erythrocephala, Calliphora vicina, Ceratitis capitata, Chironomus spp., Chrysomyia spp., Chrysops spp., Chrysozona pluvialis, Cochliomyia spp., Contarinia spp., Cordylobia anthropophaga, Cricotopus sylvestris, Culex spp., Culicoides spp., Culiseta spp., Cuterebra spp., Dacus oleae, Dasyneura spp., Delia spp., Dermatobia hominis, Drosophila spp., Echinocnemus spp., Fannia spp., Gasterophilus spp., Glossina spp., Haematopota spp., Hydrellia spp., Hydrellia griseola, Hylemya spp., Hippobosca spp., Hypoderma spp., Liriomyza spp., Lucilia spp., Lutzomyia spp., Mansonia spp., Musca spp., Oestrus spp., Oscinella frit, Paratanytarsus spp., Paralauterborniella subcincta, Pegomyia spp., Phlebotomus spp., Phorbia spp., Phormia spp., Piophila casei, Prodiplosis spp., Psila rosae, Rhagoletis spp., Sarcophaga spp., Simulium spp., Stomoxys spp., Tabanus spp., Tetanops spp., Tipula spp.;
из отряда полужесткокрылых, например, Anasa tristis, Antestiopsis spp., Boisea spp., Blissus spp., Calocoris spp., Campylomma livida, Cavelerius spp., Cimex spp., Collaria spp., Creontiades dilutus, Dasynus piperis, Dichelops furcatus, Diconocoris hewetti, Dysdercus spp., Euschistus spp., Eurygaster spp., Heliopeltis spp., Horcias nobilellus, Leptocorisa spp., Leptocorisa varicornis, Leptoglossus phyllopus, Lygus spp., Macropes excavatus, Miridae, Monaionion atratum, Nezara spp., Oebalus spp., Pentomidae, Piesma quadrata, Piezodorus spp., Psallus spp., Pseudacysta persea, Rhodnius spp., Sahlbergella singularis, Scaptocoris castanea, Scotinophora spp., Stephanitis nashi, Tibraca spp., Triatoma spp.;
из отряда равнокрылых, например, Acizzia acaciaebaileyanae, Acizzia dodonaeae, Acizzia uncatoides, Acrida turrita, Acyrthosipon spp., Acrogonia spp., Aeneolamia spp., Agonoscena spp., Aleyrodes proletella, Aleurolobus barodensis, Aleurothrixus fioccosus, Allocaridara malayensis, Amrasca spp., Anuraphis cardui, Aonidiella spp., Aphanostigma piri, Aphis spp., Arboridia apicalis, Arytainilla spp., Aspidiella spp., Aspidiotus spp., Atanus spp., Aulacorthum solani, Bemisia tabaci, Blastopsylla occidentalis, Boreioglycaspis melaleucae, Brachycaudus helichrysi, Brachycolus spp., Brevicoryne brassicae, Cacopsylla spp., Calligypona marginata, Carneocephala fulgida, Ceratovacuna lanigera, Cercopidae, Ceroplastes spp., Chaetosiphon fragaefolii, Chionaspis tegalensis, Chlorita onukii, Chondracris rosea, Chromaphis juglandicola, Chrysomphalus ficus, Cicadulina mbila, Coccomytilus halli, Coccus spp., Cryptomyzus ribis, Cryptoneossa spp., Ctenarytaina spp., Dalbulus spp., Dialeurodes citri, Diaphorina citri, Diaspis spp., Drosicha spp., Dysaphis spp., Dysmicoccus spp., Empoasca spp., Eriosoma spp., Erythroneura spp., Eucalyptolyma spp., Euphyllura spp., Euscelis bilobatus, Ferrisia spp., Geococcus coffeae, Glycaspis spp., Heteropsylla cubana, Heteropsylla spinulosa, Homalodisca coagulata, Hyalopterus arundinis, Icerya spp., Idiocerus spp., Idioscopus spp., Laodelphax striatellus, Lecanium spp., Lepidosaphes spp., Lipaphis erysimi, Macrosiphum spp., Macrosteies facifrons, Mahanarva spp., Melanaphis sacchari, Metcalfiella spp., Metopolophium dirhodum, Monellia costalis, Monelliopsis pecanis, Myzus spp., Nasonovia ribisnigri, Nephotettix spp., Nettigoniclla spectra, Nilaparvata lugens, Oncometopia spp., Orthezia praelonga, Oxya chinensis, Pachypsylla spp., Parabemisia myricae, Paratrioza spp., Parlatoria spp., Pemphigus spp., Peregrinus maidis, Phenacoccus spp., Phloeomyzus passerinii, Phorodon humuli, Phylloxera spp., Pinnaspis aspidistrae, Planococcus spp., Prosopidopsylla flava, Protopulvinaria pyriformis, Pseudaulacaspis pentagona, Pseudococcus spp., Psyllopsis spp., Psylla spp., Pteromalus spp., Pyrilla spp., Quadraspidiotus spp., Quesada gigas, Rastrococcus spp., Rhopalosiphum spp., Saissetia spp., Scaphoideus titanus, Schizaphis graminum, Selenaspidus articulatus, Sogata spp., Sogatella furcifera, Sogatodes spp., Stictocephala festina, Siphoninus phillyreae, Tenalaphara malayensis, Tetragonocephela spp., Tinocallis caryaefoliae, Tomaspis spp., Toxoptera spp., Trialeurodes vaporariorum, Trioza spp., Typhlocyba spp., Unaspis spp., Viteus vitifolii, Zygina spp.;
из отряда перепончатокрылых, например, Acromyrmex spp., Athalia spp., Atta spp., Diprionspp., Hoplocampa spp., Lasius spp., Monomoriumpharaonis, Sirexspp., Solenopsisinvicta, Tapinoma spp., Urocerus spp., Vespa spp., Xeris spp.;
из отряда равноногих, например, Armadillidium vulgare, Oniscus asellus, Porcellio scaber;
из отряда термитов, например, Coptotermes spp., Cornitermes cumulans, Cryptotermes spp., Incisitermes spp., Microtermes obesi, Odontotermes spp., Reticulitermes spp.;
из отряда чешуекрылых, например, Achroia grisella, Acronicta major, Adoxophyes spp., Aedia leucomelas, Agrotis spp., Alabama spp., Amyelois transitella, Anarsia spp., Anticarsia spp., Argyroploce spp., Barathra brassicae, Borbo cinnara, Bucculatrix thurberiella, Bupalus piniarius, Busseola spp., Cacoecia spp., Caloptilia theivora, Capua reticulana, Carpocapsa pomonella, Carposina niponensis, Cheimatobia bramata, Chilo spp., Choristoneura spp., Clysia ambiguella, Cnaphalocerus spp., Cnaphalocrocis medinalis, Cnephasia spp., Conopomorpha spp., Conotrachelus spp., Copitarsia spp., Cydia spp., Dalaca noctuides, Diaphania spp., Diatraea saccharalis, Earias spp., Ecdytolopha aurantium, Elasmopalpus lignosellus, Eldana saccharina, Ephestia spp., Epinotia spp., Epiphyas postvittana, Etiella spp., Eulia spp., Eupoecilia ambiguella, Euproctis spp., Euxoa spp., Feltia spp., Galleria mellonella, Gracillaria spp., Grapholitha spp., Hedylepta spp., Helicoverpa spp., Heliothis spp., Hofmannophila pseudospretella, Homoeosoma spp., Homona spp., Hyponomeuta padella, Kakivoria flavofasciata, Laphygma spp., Laspeyresia molesta, Leucinodes orbonalis, Leucoptera spp., Lithocolletis spp., Lithophane antennata, Lobesia spp., Loxagrotis albicosta, Lymantria spp., Lyonetia spp., Malacosoma neustria, Maruca testulalis, Mamstra brassicae, Melanitis leda, Mocis spp., Monopis obviella, Mythimna separata, Nemapogon cloacellus, Nymphula spp., Oiketicus spp., Oria spp., Orthaga spp., Ostrinia spp., Oulema oryzae, Panolis flammea, Parnara spp., Pectinophora spp., Perileucoptera spp., Phthorimaea spp., Phyllocnistis citrella, Phyllonorycter spp., Pieris spp., Platynota stultana, Plodia interpunctella, Plusia spp., Plutella xylostella, Prays spp., Prodenia spp., Protoparce spp., Pseudaletia spp., Pseudaletia unipuncta, Pseudoplusia includens, Pyrausta nubilalis, Rachiplusia nu, Schoenobius spp., Scirpophaga spp., Scirpophaga innotata, Scotia segetum, Sesamia spp., Sesamia inferens, Sparganothis spp., Spodoptera spp., Spodoptera praefica, Stathmopoda spp., Stomopteryx subsecivella, Synanthedon spp., Tecia solanivora, Thermesia gemmatalis, Tinea cloacella, Tinea pellionella, Tineola bisselliella, Tortrix spp., Trichophaga tapetzella, Trichoplusia spp., Tryporyza incertulas, Tuta absoluta, Virachola spp.; из отряда прямокрылых или ортоптероидных, например, Acheta domesticus, Dichroplus spp., Gryllotalpa spp., Hieroglyphus spp., Locusta spp., Melanoplus spp., Schistocerca gregaria;
из отряда пухоедов, например, Damalinia spp., Haematopinus spp., Linognathus spp., Pediculus spp., Phylloera vastatrix, Phtirus pubis, Trichodectes spp.;
из отряда сеноедов, например, Lepinotus spp., Liposcelis spp.;
из отряда блох, например, Ceratophyllus spp., Ctenocephalides spp., Pulex irritans, Tunga penetrans, Xenopsylla cheopsis;
из отряда пузыреногих, например, Anaphothrips obscurus, Baliothrips biformis, Drepanothrips reuteri, Enneothrips flavens, Frankliniella spp., Heliothrips spp., Hercinothrips femoralis, Rhipiphorothrips cruentatus, Scirtothrips spp., Taeniothrips cardamomi, Thrips spp.;
из отряда щетинохвосток (= Thysanura), например, Ctenolepisma spp., Lepisma saccharina, Lepismodes inquilinus, Thermobia domestica;
из класса симфил, например, Scutigerella spp.;
вредители из филума моллюсков, в частности, из класса двустворчатых, например, Dreissena spp., а также из класса брюхоногих, например, Arion spp., Biomphalaria spp., Bulinus spp., Deroceras spp., Galba spp., Lymnaea spp., Oncomelania spp., Pomacea spp., Succinea spp.;
животные паразиты из филы плоских червей и нематод, например, Ancylostoma duodenale, Ancylostoma ceylanicum, Ancylostoma braziliensis, Ancylostoma spp., Ascaris spp., Brugia malayi, Brugia timori, Bunostomum spp., Chabertia spp., Clonorchis spp., Cooperia spp., Dicrocoelium spp., Dictyocaulus filaria, Diphyllobothrium latum, Dracunculus medinensis, Echinococcus granulosus, Echinococcus multilocularis, Enterobius vermicularis, Faciola spp., Haemonchus spp., Heterakis spp., Hymenolepis nana, Hyostrongulus spp., Loa Loa, Nematodirus spp., Oesophagostomum spp., Opisthorchis spp., Onchocerca volvulus, Ostertagia spp., Paragonimus spp., Schistosomen spp., Strongyloides fuelleborni, Strongyloides stercoralis, Strongyloides spp., Taenia saginata, Taenia solium, Trichinella spiralis, Trichinella nativa, Trichinella britovi, Trichinella nelsoni, Trichinella pseudopsiralis, Trichostrongulus spp., Trichuris trichuria, Wuchereria bancrofti;
вредители растений из филума нематод, то есть паразитирующие на растения нематоды, в частности Aphelenchoides spp., Bursaphelenchus spp., Ditylenchus spp., Globodera spp., Heterodera spp., Longidorus spp., Meloidogyne spp., Pratylenchus spp., Radopholus spp., Trichodorus spp., Tylenchulus spp., Xiphinema spp., Helicotylenchus spp., Tylenchorhynchus spp., Scutellonema spp., Paratrichodorus spp., Meloinema spp., Paraphelenchus spp., Aglenchus spp., Belonolaimus spp., Nacobbus spp., Rotylenchulus spp., Rotylenchus spp., Neotylenchus spp., Paraphelenchus spp., Dolichodorus spp., Hoplolaimus spp., Punctodera spp., Criconemella spp., Quinisulcius spp., Hemicycliophora spp., Anguina spp., Subanguina spp., Hemicriconemoides spp., Psilenchus spp., Pseudohalenchus spp., Criconemoides spp., Cacopaurus spp.
Кроме того, с суб-царства простейших, отряд кокцидий, например, Eimeria spp.могут поддаваться уничтожению.
Настоящее изобретение относится к композициям, и формам применения, полученным из них, как средствам защиты растений и/или пестицидам, таким как, например, растворы для полива, обработки капельным путем и распыления, содержащие, по меньшей мере, одно из активных соединений в соответствии с изобретением. В некоторых случаях, формы применения включают в себя дополнительные средства защиты растений и/или пестициды и/или адъюванты, которые улучшают действие, такие как проникающие вещества, например, растительные масла, например, рапсовое масло, подсолнечное масло, минеральные масла, например, парафиновые масла, алкильные эфиры растительных жирных кислот, например, сложный метиловый эфир рапсового масла или сложный метиловый эфир соевого масла, или алканол алкоксилаты, и/или удобрения, например, алкилсилоксаны, и/или соли, например, органические или неорганические соли аммония или фосфония, например, сульфат аммония или диаммоний гидрофосфат, и/или вещества, способствующие хранению, например, диоктилсульфосукцинат или гидроксипропил гуаровые полимеры, и/или увлажнители, например, глицерин, и/или удобрения, например, аммоний-, калий- или фосфорсодержащие удобрения.
Обычные препараты, например, водорастворимые жидкости (SL), эмульсионные концентраты (ЕС), эмульсии в воде (EW), концентраты суспензий (SC, SE, FS, OD), диспергируемые в воде гранулы (WG), гранулы (GR) и капсульные концентраты (CS); эти и еще возможные дополнительные типы препаратов описаны, например, в Crop Life International и в Pesticide Specifications, Manual on development и use of FAO and WHO specifications for pesticides, FAO Plant Production and Protection Papers - 173, подготовленные FAO/WHO Joint Meeting on Pesticide Specifications, 2004, ISBN: 9251048576. Препараты, в дополнение к одному или более активным соединениям в соответствии с изобретением, необязательно дополнительно содержат агрохимически активные соединения.
Эти препараты или формы применения предпочтительно содержат вспомогательные вещества, например, наполнители, растворители, ускорители стихийности, носители, эмульгаторы, диспергаторы, антифризы, биоциды, загустители и/или другие вспомогательные вещества, например, адъюванты. Адъювантом в данном контексте является компонент, который усиливает биологический эффект композиции, не сам компонент, имеющий биологический эффект. Примерами адъювантов являются агенты, которые способствуют удержанию, распространению, привязанности к поверхности листа или проникновению.
Эти препараты получают известным способом, например, путем смешивания активных соединений с вспомогательными соединениями, например, наполнители, растворители и/или твердые носители и/или другие вспомогательные вещества, например, поверхностно-активные вещества. Композиции получают либо в подходящих установках или еще до или во время нанесения.
Используемые вспомогательные вещества могут представлять собой вещества, способные обеспечить препарат активного соединения, или формы применения, полученные из этих препаратов (такие как готовые к использованию композиции защиты растений, например, такие как, аэрозольные растворы или растворы для протравливания семян) с особыми свойствами, такими как определенные физические, технические и/или биологические свойства.
Подходящие наполнители, например, вода, полярные и неполярные органические химические жидкости, например, из классов ароматических и неароматических углеводородов (такие как парафины, алкилбензолы, алкилнафталены, хлорбензолы), спирты и полиолы (которые, в случае необходимости, могут также быть замещены, этерифицированы и/или этерифицированы), кетоны (такие как ацетон, циклогексанон), сложные эфиры (в том числе жиры и масла) и (поли)эфиры, незамещенные и замещенные амины, амиды, лактамы (например, N-алкилпирролидоны) и лактоны, сульфоны и сульфоксиды (такие как диметилсульфоксид).
Если используемым наполнителем является вода, также можно использовать, например, органические растворители в качестве вспомогательных растворителей. Полезные жидкие растворители по существу представляют собой: ароматические углеводороды, например, ксилол, толуол или алкилнафталены, хлорированные ароматические и хлорированные алифатические углеводороды, такие как хлорбензолы, хлорэтилены или метилен хлорид, алифатические углеводороды, такие как парафины, циклогексан или например, фракции нефти, минеральные и растительные масла, спирты, такие как бутанол или гликоль и их простые и сложные эфиры, кетоны, такие как ацетон, метилэтилкетон, метилизобутилкетон или циклогексанон, сильно полярные растворители, такие как диметилформамид и диметилсульфоксид, а также вода.
В принципе, можно использовать все подходящие растворители. Примерами подходящих растворителей являются ароматические углеводороды, такие как ксилол, толуол или алкилнафталены, хлорированные ароматические или хлорированные алифатические углеводороды, такие как, хлорбензол, хлорэтилен или метилен хлорид, алифатические углеводороды, такие как циклогексан, парафины, нефтяные фракции, минеральные и растительные масла, спирты, такие как метанол, этанол, изопропанол, гликоль или бутанол и их простые и сложные эфиры, кетоны, такие как ацетон, метилэтил кетон, метилизобутилкетон или циклогексанон, сильно полярные растворители, такие как диметилсульфоксид, а также вода.
В принципе можно использовать все подходящие носители. Полезные носители включают, в частности: например, соли аммония и природные минералы, такие как каолины, глины, тальк, мел, кварц, аттапульгит, монтмориллонит или диатомовая земля, и измельченные синтетические материалы, такие как тонко измельченный диоксид кремния, оксид алюминия и природные или синтетические силикаты, смола, воски и/или твердые удобрения. Смеси таких носителей могут подобным образом использоваться. Полезные носители для гранул включают в себя: например, раздробленные и фракционированные природные горные породы, такие как кальцит, мрамор, пемза, сепиолит, доломит, и синтетические гранулы неорганических и органических пищевых материалов, а также гранулы органического материала, например, опилки, бумага, скорлупа кокосовых орехов, кукурузные початки и стебли табака.
Сжиженные газообразные наполнители или растворители также могут быть использованы. Особенно подходящие наполнители или носители представляют собой те, которые являются газообразными при температуре окружающей среды и при атмосферном давлении, например, аэрозольные пропелленты, такие как галогенированные углеводороды, а также бутан, пропан, азот, двуокись углерода.
Примерами эмульгаторов и/или пенообразующих средств, диспергаторов или смачивающих агентов с ионными или неионными свойствами, или смеси этих поверхностно-активных веществ, являются соли полиакриловой кислоты, соли лигносульфоновой кислоты, соли фенолсульфоновой кислоты или нафталенсульфоновой кислоты, продукты поликонденсации оксида этилена с жирными спиртами или с жирными кислотами, или с жирными аминами, с замещенными фенолами (предпочтительно, алкилфенолы или арилфенолы), соли сложных эфиров сульфоянтарной ксилоты, производные таурина (предпочтительно, алкил таураты), сложные эфиры фосфорной кислоты полиэтоксилированных спиртов или фенолов, сложные эфиры жирных кислот многоатомных спиртов, и производные соединения, содержащие сульфаты, сульфонаты и фосфаты, например, алкиларил эфиры, алкилсульфонаты, алкил сульфаты, арилсульфонаты, белковые гидролизаты, лигнинсульфит щелоки и метилцеллюлоза. Присутствие поверхностно-активного вещества выгодно, если одно из активных соединений и/или один из инертных носителей нерастворим в воде и когда применение происходит в воде.
Дополнительные вспомогательные вещества, которые могут присутствовать в композициях и формах применения, полученных из них, включают красители, такие как неорганические пигменты, например, оксид железа, оксид титана и берлинская лазурь, и органические красители, такие как ализариновые красители, азокрасители и металлические фталоцианиновые красители, и питательные вещества и микроэлементы, такие как соли железа, марганца, бора, меди, кобальта, молибдена и цинка.
Дополнительные компоненты могут представлять собой стабилизаторы, такие как холодные стабилизаторы, консерванты, антиоксиданты, светостабилизаторы, или другие вещества, которые улучшают химическую и/или физическую стабильность. Пенообразователи или пеногасители могут также присутствовать.
Адгезионные препараты, такие как карбоксиметилцеллюлоза и натуральные и синтетические полимеры в виде порошков, гранул или латексов, такие как гуммиарабик, поливиниловый спирт и поливинилацетат, или природные фосфолипиды, такие как лецитин и кефалины и синтетические фосфолипиды также могут присутствовать в качестве дополнительных вспомогательных веществ в препаратах и формах применения, полученных из них. Дополнительные вспомогательные вещества могут представлять собой минеральные и растительные масла.
При необходимости, препараты и формы применения, полученные из них, могут также содержать дополнительные вспомогательные вещества. Примеры таких добавок включают отдушки, защитные коллоиды, связующие агенты, адгезивы, загустители, тиксотропные агенты, вещества, способствующие проникновению, вещества, способствующие хранению, стабилизаторы, секвестранты, комплексообразующие агенты, увлажнители, вещества, повышающие смачивающую способность. В общем, активные соединения могут быть сочетаемы с любой твердой или жидкой добавкой, обычно используемой для целей препарата.
Полезные вещества, способствующие хранению, включают в себя все те вещества, которые уменьшают динамическое поверхностное натяжение, например, диоктилсульфосукцинат, или увеличивает вязкоупругость, например, гидроксипропилгуаровые полимеры.
Пенетранты, предусмотренные в настоящем контексте включают в себя все те вещества, которые обычно используются для содействия проникновению агрохимических активных соединений в растения. Пенетранты определены в данном контексте по их способности проникать из (как правило, водного) раствора для опрыскивания и/или распыления в кутикулу растений и тем самым повысить подвижность активных соединений в кутикуле. Способ, описанный в литературе (Baur et al., 1997, Pesticide Science 51, 131-152) может быть использован для целей определения этого качества. Примеры включают спиртовые алкоксилаты, такие как, кокосовой жирный этоксилат (10) или изотридециловый этоксилат (12), сложные эфиры жирных кислот, например, сложный метиловый эфир рапсового масла или сложный метиловый эфир соевого масла, жирные аминалкоксилаты, например, талловаминэтоксилат (15), или соли аммония и/или фосфония, например, сульфат аммония или диаммоний гидрофосфат.
Композиции содержат предпочтительно между 0.00000001% и 98% по массе активного соединения или более предпочтительно от 0,01% и 95% по массе активного соединения, более предпочтительно от 0,5% и 90% по массе активного соединения, в расчете на массу препарата.
Содержание активного соединения в формах применения (средства защиты растений), полученных из композиций может варьироваться в широких пределах. Концентрация активного соединения в формах применения обычно может находиться в пределах от 0.00000001% и 95% по массе активного соединения, предпочтительно от 0,00001% и 1% по массе в расчете на массу формы применения. Применение осуществляется обычным способом, соответствующим для форм применения.
Активные соединения согласно изобретению или активные соединения, которые используются в соответствии с изобретением могут быть использованы как таковые или в их композициях, в том числе в смеси с одним или несколькими подходящими фунгицидами, бактерицидами, акарицидами, моллюскицидами, нематоцидами, инсектицидами, микробиологическими веществами, полезными видами, удобрениями, репеллентами птиц, фитотониками, стерилизующими веществами, синергистами, антидотами, регуляторами и семиохимикатами и/или регуляторами роста растений, чтобы таким образом, например, расширить спектр действия, чтобы продлить срок действия, чтобы увеличить скорость действия, чтобы предотвратить отталкивание или предотвратить развитие устойчивости. Кроме того, такие комбинации биологически активных соединений могут улучшить рост растений и/или устойчивость к абиотическим факторам, например, высоким или низким температурам, к засухе или к повышенному содержанию воды или засоленности почвы. Это также может улучшить производительность цветения и плодоношения, оптимизировать емкость и развитие корневой всхожести, облегчить уборку и повысить урожайности, влиять на созревание, улучшить качество и/или пищевую ценность продуктов урожая, продлить хранения и/или улучшить технологичность продуктов урожая. Объединяя активные соединения в соответствии с изобретением или активные соединения, которые используют в соответствии с изобретением с партнерами смешения, достигаются синергетические эффекты, т.е. эффективность конкретной смеси выше, чем ожидалось на основании эффективностей отдельных компонентов. Как правило, можно использовать комбинации в премиксах, баковых смесях, или готовых смесях, а также в покрытии семян.
Активные соединения, выявленные здесь посредством их общих названий, которые известны и описаны, например, в справочнике пестицидов ("The Pesticide Manual" 14th Ed., British Crop Protection Council 2006). Или можно найти в Интернете (например, http://www.alanwood.net/pesticides).
Подходящие инсектициды/акарициды/нематициды в качестве компонентов смешивания представляют собой:
(1) Ингибиторы ацетилхолинэстеразы (AChE), например,
карбаматы, например, аланикарб, альдикарб, бендиокарб, бенфуракарб, бутокарбоксим, бутоксикарбоксим, карбарил, карбофуран, карбосульфан, этиофенкарб, фенобукарб, форметанат, фуратиокарб, изопрокарб, метиокарб, метомил, метолкарб, оксамил, пиримикарб, пропоксур, тиодикарб, тиофанокс, триазамат, триметакарб, ХМС, ксилилкарб; или
органофосфаты, например, ацефат, азаметифос, азинфос-этил, азинфос-метил, кадузафос, хлорэтоксифос, хлорфенвинфос, хлормефос, хлорпирифос, хлорпирифос-метил, кумафос, цианофос, деметон-S-метил, диазинон, дихлорвос/ДДВФ, дикротофос, диметоат, диметилвинфос, дисульфотон, EPN, этион, этопрофос, фамфур, фенамифос, фенитротион, фентион, фостиазат, гептенофос, имициафос, изофенфос, изопропил-О-(метоксиаминотиофосфорил)салицилат, изоксатион, малатион, мекарбам, метамидофос, метидатион, мевинфос, монокротофос, напед, ометоат, оксидеметон-метил, паратион, паратион-метил, фентоат, форат, фозалон, фосмет, фосфамидон, фосфокарб, фоксим, пиримифос-метил, профенофос, пропетамфос, протиофос, пираклофос, пиридафентион, квинальфос, сульфотеп, тебупиримфос, темефос, тербуфос, тетрахлорвинфос, тиометон, триазофос, трихлорфон, вамидотион;
(2) Антагонисты ГАМК-зависимых хлоридных каналов, например,
хлорорганические соединения циклодиена, например, хлордан и эндосульфан; или
фенилпиразолы (фипрол), например, этипрол и фипронил;
(3) Модулятотры натриевых каналов/зависимые от напряжения блокаторы натриевых каналов такие как, например,
пиретроиды, например, акринатрин, аллетрин, d-цис-трансаллетрин, d-трансаллетрин, бифентрин, биоаллетрин, S-циклопентильный изомер биоаллетрина, биоресметрин, циклопротрин, цифлутрин, цигалотрин,лямбда-цигалотрин, гамма-цигалотрин, циперметрин, альфа-циперметрин, бета-циперметрин, тета-циперметрин, зета-циперметрин, цифенотрин[(1R)-транс-изомер],дельтаметрин, эмпентрин[(EZ)-(1R)-изомер], эсфенвалерат, этофенпрокс, фенпропатрин, фенвалерат, флуцитринат флуметрин, тау-флувалинат, халфен-прокс, имипротрин, кадетрин, перметрин, фенотрин [(1R-транс-изомер)], праллетрин, пиретринс, (пиретрум), ресметрин, силафлуофен, тефлутрин, тетраметрин [(1R)-изомер)], тралометрин и трансфлутрин; или
ДДТ; или метоксихлор;
(4) Агонисты никотинергических рецепторов ацетилхолина (nAChR) такие как, например,
неоникотиноиды, например, ацетамиприд, клотианидин, динотефуран, имидаклоприд, нитенпирам, тиаклоприд и тиаметоксам; или
никотин; или
сульфоксафлор;
(5) Аллостерические активаторы никотинергических рецепторов ацетилхолина (nAChR) такие как, например,
спиносинс, например, спинеторам и спиносад;
(6) Активаторы хлоридных каналов, такие как, например,
авермектины/милбемицины, например, абамектин, эмамектинбензоат, лепимектин, мильбемицин;
(7) Имитаторы ювенильных гормонов такие как, например,
аналоги ювенильных гормонов, например, гидропрен, кинопрен и метопрен;
или
феноксикарб; или пирипроксифен;
(8) Активные соединение с неизвестным или неспецифическим механизмом действия, такие как, например,
алкил галогениды, например, метил бромид и другие алкил галогениды; или
хлорпикрин; или сульфурилфторид; или боракс; или рвотный камень;
(9) Селективные антифиданты, например, пиметрозин; или флоникамид.
(10) Ингибиторы роста клещей, например, клофентизин, гекситиазокс и дифловидазин; или этоксазол;
(11) Микробные разрушители мембраны тракта насекомого, например, Bacillus thuringiensis подвид israelensis, Bacillus thuringiensis подвид aizawai, Bacillus thuringiensis подвид kurstaki, Bacillus thuringiensis подвид tenebrionis и B.t. растительные белки: Cry1Ab, Cry1Ac, Cry1Fa, Cry1A.105, Cry2Ab, Vip3A, mCry3A, Cry3Ab, Cry3Bb, Cry34 Ab1/35Ab1; или
Bacillus sphaericus;
(12) Ингибиторы окислительного фосфорилирования, прерыватели АТФ, такие как, например, диафентиурон; или
оловорганические соединения, например, азоциклотин, цигексатин и фенбутанин оксид; или
пропаргит; или тетрадифон;
(13) Разобщители окислительного фосфорилирования в результате нарушения Н протонного градиента, такие как, например, хлорфенапир, DNOC и сульфурамид;
(14) Антагонисты никотинергических ацетилхолиновых рецепторов, такие как, например, бенсультап, картап гидрохлорид, тиоцилам, и тиосультам-натрий.
(15) Ингибиторы биосинтеза хитина, тип 0, такие как, например, бистрифлурон, хлофлуазурон, дифлубензурон, флуциклоксурон, флуфеноксурон, гексафлумурон, луфенурон, новалурон, новифлумуронтефлубензурон и трифлумурон;
(16) Ингибиторы биосинтеза хитина, тип 1, например, бупрофезин;
(17) Вещества-нарушители линьки двукрылых, такие как, например, циромазин;
(18) Агонисты рецепторов экдизона такие как, например, хромафенозид, галофенозид, метоксифенозид и тебуфенозид;
(19) Октопаминэргические агонисты, такие как, например, амитраз;
(20) Ингибиторы транспорта электронов в комплексе III, такие как, например, гидраметилнон; или ацеквиноцил; или флуакрипирим;
(21) Ингибиторы транспорта электронов в комплексе I, например,
METI акарициды, например, феназаквин, фенпироксимат, пиримидифен, пиридабен, тебуфенпирад и толфенпирад; или
Ротенон (Derris);
(22) Зависимые от напряжения блокаторы натриевых каналов, например, индоксакарб; или метафлумизон;
(23) Ингибиторы ацетил-KoA карбоксилазы, такие как, например, производные тетроновых и тетрамоновых кислот, например, спиродиклофен, спиромезифен и спиротетрамат;
(24) Ингибиторы транспорта электронов комплекса-IV, например, фосфины, например, фосфид аллюминия, фосфид кальция, фосфин и фосфид цинка; или
цианид;
(25) Ингибиторы транспорта электронов комплекса II, такие как, например, циенопирафен и цифлуметофен;
(28) Эффекторы рецепторов рианодина, такие как, например, диамиды, например, хлорантраилипрол, циантранилипрол и флубендиамид.
Дополнительные активные соединения, такие как, например, амидофлумет, азадирактин, бенклотиаз, бензоксимат, бифеназат, бромпропилат, хинометаонат, криолит, дикофол, дифловидазин, флуенсульфон, флуфенерим, флуфипрол, флуопирам, фуфенозид, имидаклотиз, ипродион, меперфлутрин, пиридалил, пирифлуквиназон, тетраметилфлутрин и йодметан; и дополнительные препараты на основе Bacillusfirmus (в частности штамм CNCMI-1582, например, VOTiVO™, BioNem), и следующие соединения:
3-бром-N-{2-бром-4-хлор-6-[(1-циклопропилэтил)карбамоил]фенил}-1-(3-хлорпиридин-2-ил)-1Н-пиразол-5-карбоксамид (известно из WO 2005/077934), 4-{[(6-бромпирид-3-ил)метил](2-фторэтил)амино}фуран-2(5Н)-он (известно из WO 2007/115644), 4-{[(6-фторпирид-3-ил)метил](2,2-дифторэтил)амино}фуран-2(5Н)-он (известно из WO 2007/115644), 4-{[(2-хлор-1,3-тиазол-5-ил)метил](2-фторэтил)амино}фуран-2(5Н)-он (известно из WO 2007/115644), 4-{[(6-хлорпирид-3-ил)метил](2-фторэтил)амино}фуран-2(5Н)-он (известно из WO 2007/115644), флупирадифурон, 4-{[(6-хлор-5-фторпирид-3-ил)метил](метил)амино}фуран-2(5Н)-он (известно из WO 2007/115643), 4-{[(5,6-дихлорпирид-3-ил)метил](2-фторэтил)амино}фуран-2(5Н)-он (известно из WO 2007/115646), 4-{[(6-хлор-5-фторпирид-3-ил)метил](циклопропил)амино}фуран-2(5Н)-он (известно из WO 2007/115643), 4-{[(6-хлорпирид-3-ил)метил](циклопропил)амино}фуран-2(5Н)-он (известно из ЕРА 0539588), 4-{[(6-хлорпирид-3-ил)метил](метил)амино}фуран-2(5Н)-он (известно из ЕРА 0539588), {[1-(6-хлорпиридин-3-ил)этил](метил)оксидо-λ4-сульфанилиден}цианамид (известно из WO 2007/149134) и его диастереомеры {[(1R)-1-(6-хлорпири дин-3-ил)этил](метил)оксидо-λ4-сульфанилиден}цианамид (А) и {[(1S)-1-(6-хлорпиридин-3-ил)этил](метил)оксидо-λ4-сульфанилиден}цианамид (В) (подобным образом известно из WO 2007/149134) и также диастереомеры[(R)-метил(оксидо){(1R)-1-[6-(трифторметил)пиридин-3-ил]этил}-λ4-сульфанилиден]цианамид(А1) и [(S)-метил(оксидо){(1S)-1-[6-(трифторметил)пиридин-3-ил]этил}-λ4-сульфанилиден]цианамид (А2), обозначено как диастереомерная группа А (известно из WO 2010/074747, WO 2010/074751), [(R)-метил(оксидо){(1S)-1-[6-(трифторметил)пиридин-3-ил]этил}-λ4-сульфанилиден]цианамид (В1) и [(S)-метил(оксидо){(1R)-1-[6-(трифторметил)пиридин-3-ил]этил}-λ4-сульфанилиден]цианамид (В2), обозначено как диастереомерная группа В (подобным образом известно из WO 2010/074747, WO 2010/074751) и 11-(4-хлор-2,6-диметилфенил)-12-гидрокси-1,4-диокса-9-азадиспиро[4.2.4.2]тетрадец-11-ен-10-он (известно из WO 2006/089633), 3-(4'-фтор-2,4-диметилбифенил-3-ил)-4-гидрокси-8-окса-1-азаспиро[4.5]дец-3-ен-2-он (известно из WO 2008/067911), 1-{2-фтор-4-метил-5-[(2,2,2-трифторэтил)сульфинил]фенил}-3-(трифторметил)-1Н-1,2,4-триазол-5-амин (известно из WO 2006/043635), афидопиропен (известно из 2008/066153), 2-циано-3-(дифторметокси)-N,N-диметилбензолсульфонамид (известно из WO 2006/056433), 2-циано-3-(дифторметокси)-N-метилбензолсульфонамид (известно из WO 2006/100288), 2-циано-3-(дифторметокси)-N-этилбензолсульфонамид (известно из WO 2005/035486), 4-(дифторметокси)-N-этил-N-метил-1,2-бензотиазол-3-амин 1,1-диоксид (известно из WO 2007/057407), N-[1-(2,3-диметилфенил)-2-(3,5-диметилфенил)этил]-4,5-дигидро-1,3-тиазол-2-амин (известно из WO 2008/104503), {1'-[(2Е)-3-(4-хлорфенил)проп-2-ен-1-ил]-5-фторспиро[индол-3,4'-пиперидин]-1(2Н)-ил}(2-хлорпиридин-4-ил)метанон (известно из WO 2003/106457), 3-(2,5-диметилфенил)-4-гидрокси-8-метокси-1,8-диазаспиро[4.5]дец-3-ен-2-он (известно из WO 2009/049851), 3-(2,5-диметилфенил)-8-метокси-2-оксо-1,8-диазаспиро[4.5]дец-3-ен-4-илэтилкарбонат (известно из WO 2009/049851), 4-(бут-2-ин-1-илокси)-6-(3,5-диметилпиперидин-1-ил)-5-фторпиримидин (известно из WO 2004/099160), (2,2,3,3,4,4,5,5-октафторпентил)(3,3,3-трифторпропил)малононитрил (известно из WO 2005/063094), (2,2,3,3,4,4,5,5-октафтор-пентил)(3,3,4,4,4-пенафторбутил)малононитрил(известно из WO 2005/063094), 8-[2-(циклопропилметокси)-4-(трифторметил)фенокси]-3-[6-(трифторметил)пиридазин-3-ил]-3-азабицикло[3.2.1]октан (известно из WO 2007/040280), флометоквин, PF1364 (CAS Reg. No. 1204776-60-2) (известно из JP 2010/018586), 5-[5-(3,5-дихлорфенил)-5-(трифторметил)-4,5-дигидро-1,2-оксазол-3-ил]-2-(1Н-1,2,4-триазол-1-ил)бензонитрил (известно из WO 2007/075459), 5-[5-(2-хлорпиридин-4-ил)-5-(трифторметил)-4,5-дигидро-1,2-оксазол-3-ил]-2-(1Н-1,2,4-триазол-1-ил)бензонитрил (известно из WO 2007/075459), 4-[5-(3,5-дихлорфенил)-5-(трифторметил)-4,5-дигидро-1,2-оксазол-3-ил]-2-метил-N-{2-оксо-2-[(2,2,2-трифторэтил)амино]этил}бензамид (известно из WO 2005/085216), 4-{[(6-хлорпиридин-3-ил)метил](циклопропил)амино}-1,3-оксазол-2(5Н)-он, 4-{[(6-хлорпиридин-3-ил)метил] (2,2-дифторэтил)амино}-1,3-оксазол-2(5Н)-он, 4-{[(6-хлорпиридин-3-ил)метил](этил)амино}-1,3-оксазол-2(5Н)-он, 4-{[(6-хлорпиридин-3-ил)метил](метил)амино}-1,3-оксазол-2(5Н)-он (все известны из WO 2010/005692), пифлубумид(известно из WO 2002/096882), метил 2-[2-({[3-бром-1-(3-хлорпиридин-2-ил)-1Н-пиразол-5-ил]карбонил}амино)-5-хлор-3-метилбензоил]-2-метилгидразинкарбоксилат (известно из WO 2005/085216), метил 2-[2-({[3-бром-1-(3-хлорпиридин-2-ил)-1Н-пиразол-5-ил]карбонил}амино)-5-циано-3-метилбензоил]-2-этилгидразинкарбоксилат (известно из WO 2005/085216), метил 2-[2-({[3-бром-1-(3-хлорпиридин-2-ил)-1Н-пиразол-5-ил]карбонил}амино)-5-циано-3-метилбензоил]-2-метилгидразинкарбоксилат (известно из WO 2005/085216), метил 2-[3,5-дибром-2-({[3-бром-1-(3-хлорпиридин-2-ил)-1Н-пиразол-5-ил]карбонил}амино)бензоил]-1,2-диэтилгидразинкарбоксилат (известно из WO 2005/085216), метил 2-[3,5-дибром-2-({[3-бром-1-(3-хлорпиридин-2-ил)-1Н-пиразол-5-ил]карбонил}амино)бензоил]-2-этилгидразинкарбоксилат (известно из WO 2005/085216), (5RS,7RS;5RS,7SR)-1-(6-хлор-3-пиридилметил)-1,2,3,5,6,7-гексагидро-7-метил-8-нитро-5-пропоксиимидазо[1,2-а]пиридин (известно из WO 2007/101369), 2-{6-[2-(5-фторпиридин-3-ил)-1,3-тиазол-5-ил]пиридин-2-ил}пиримидин (известно из WO 2010/006713), 2-{6-[2-(пиридин-3-ил)-1,3-тиазол-5-ил]пиридин-2-ил}пиримидин (известно из WO 2010/006713), 1-(3-хлорпиридин-2-ил)-N-[4-циано-2-метил-6-(метилкарбамоил)фенил]-3-{[5-(трифторметил)-1Н-тетразол-1-ил]метил}-1Н-пиразол-5-карбоксамид (известно из WO 2010/069502), 1-(3-хлорпиридин-2-ил)-N-[4-циано-2-метил-6-(метилкарбамоил)фенил]-3-{[5-(трифторметил)-2Н-тетразол-2-ил]метил}-1Н-пиразол-5-карбоксамид (известно из WO 2010/069502), N-[2-(трет-бутилкарбамоил)-4-циано-6-метилфенил]-1-(3-хлорпиридин-2-ил)-3-{[5-(трифторметил)-1Н-тетразол-1-ил]метил}-1Н-пиразол-5-карбоксамид (известно из WO 2010/069502), N-[2-(трет-бутилкарбамоил)-4-циано-6-метилфенил]-1-(3-хлорпиридин-2-ил)-3-{[5-(трифторметил)-2Н-тетразол-2-ил]метил}-1Н-пиразол-5-карбоксамид (известно из WO 2010/069502), (1Е)-N-[(6-хлорпиридин-3-ил)метил]-N'-циано-N-(2,2-дифторэтил)этанимидеамид(известно из WO 2008/009360), N-[2-(5-амино-1,3,4-тиадиазол-2-ил)-4-хлор-6-метилфенил]-3-бром-1-(3-хлорпиридин-2-ил)-1Н-пиразол-5-карбоксамид (известно из CN 102057925), метил 2-[3,5-дибром-2-({[3-бром-1-(3-хлорпиридин-2-ил)-1Н-пиразол-5-ил]карбонил}амино)бензоил]-2-этил-1-метилгидразинкарбоксилат (известно из WO 2011/049233), гптафлутрин, пириминостробин, флуфеноксистробин и 3-хлор-N2-(2-цианопропан-2-ил)-N1-[4-(1,1,1,2,3,3,3-гептафторпропан-2-ил)-2-метилфенил]фталамид (известно из WO 2012/034472).
Подходящие фунгициды в качестве компонентов смешивания представляют собой:
(1) Ингибиторы биосинтеза эргостерола: например, альдиморф, азаконазол, битертанол, бромуконазол, ципроконазол, диклобутразол, дифеноконазол, диниконазол, диниконазол-М, додеморф, додеморф ацетат, эпоксиконазол, этаконазол, фенаримол, фенбуконазол, фенгексамид, фенпропидин, фенпропиморф, флуквинконазол, флурпримидол, флусилазол, флутриафол, фурконазол, фурконазол-цис, гексаконазол, имазалил, имазалил сульфат, имибенконазол, ипконазол, метконазол, миклобутанил, нафтифин, нуаримол, окспоконазол, паклобутразол, пефуразоат, пенконазол, пипералин, прохлораз, пропиконазол, протиоконазол, пирибутикарб, пирифенокс, квинконазол, симеконазол, спироксамин, тебуконазол, тербинафин, тетраконазол, триадимефон, триадименол, тридеморф, трифлумизол, трифорин, тритиконазол, униконазол-п, виниконазол, вориконазол, 1-(4-хлорфенил)-2-(1Н-1,2,4-триазол-1-ил)циклогептанол, метил 1-(2,2-диметил-2,3-дигидро-1Н-инден-1-ил)-1Н-имидазол-5-карбоксилат, N'-{5-(дифторметил)-2-метил-4-[3-(триметилсилил)пропокси]фенил}-N-этил-N-метилимидоформамид, N-этил-N-метил-N'-{2-метил-5-(трифторметил)-4-[3-(триметил-силил)пропокси]фенил}имидоформамид и О- [1 -(4-метоксифенокси)-3,3-диметилбутан-2-ил] 1Н-имидазол-1-карботиоат;
(2) Ингибиторы дыхания (ингибиторы дыхательных цепей), например, биксафен, боскалид, карбоксин, дифлуметорим, фенфурам, флуопирам, флутоланил, флуксапироксад, фураметпир, фурмециклокс, изопиразам (смесь син-эпимерного рацемата 1RS,4SR,9RS с анти-эпимерным рацематом 1RS,4SR,9SR), изопиразам (анти-эпимерный рацемат), изопиразам (анти-эпимерный энантиомер 1R,4S,9S), изопиразам (анти-эпимерный энантиомер 1S,4R,9R), изопиразам (син-эпимерный рацемат 1RS,4SR,9RS), изопиразам (син-эпимерный энантиомер 1S,4R,9S), изопиразам (син-эпимерный энантиомер 1S,4R,9S), мепронил, оксикарбоксин, пенфлуфен, пентиопирад, седаксан, тифлузамид, 1-метил-N-[2-(1,1,2,2-тетрафторэтокси)фенил]-3-(трифторметил)-1Н-пиразол-4-карбоксамид, 3-(дифторметил)-1-метил-N-[2-(1,1,2,2-тетрафторэтокси)-фенил]-1Н-пиразол-4-карбоксамид, 3-(дифторметил)-N-[4-фтор-2-(1,1,2,3,3,3-гексафторпропокси)фенил]-1-метил-1Н-пиразол-4-карбоксамид, N-[1-(2,4-дихлорфенил)-1-метоксипропан-2-ил]-3-(дифторметил)-1-метил-1Н-пиразол-4-карбоксамид, 5,8-дифтор-N-[2-(2-фтор-4-{[4-(трифторметил)пиридин-2-ил]окси}фенил)этил]хиназолин-4-амин, N-[9-(дихлорметилен)-1,2,3,4-тетрагидро-1,4-метанонафталин-5-ил]-3-(дифторметил)-1-метил-1Н-пиразол-4-карбоксамид, N-[(1S,4R)-9-(дихлорметилен)-1,2,3,4-тетрагидро-1,4-метанонафталин-5-ил]-3-(дифторметил)-1-метил-1Н-пиразол-4-карбоксамид и N-[(1R,4S)-9-(дихлорметилен)-1,2,3,4-тетрагидро-1,4-метанонафталин-5-ил]-3-(дифторметил)-1-метил-1Н-пиразол-4-карбоксамид;
(3) Ингибиторы дыхания (ингибиторы дыхательных цепей) в комлексе III дыхательной цепи, например, аметоктрадин, амисулбром, азоксистробин, циазофамид, коуметоксистробин, коумоксистробин, димоксистробин, энестробурин, фамоксадон, фенамидон, феноксистробин, флуоксастробин, крезоксим-метил, метоминостробин, орисастробин, пикоксистробин, пираклостробин, пираметостробин, пираоксистробин, пирибенкарб, триклопирикарб, трифлоксистробин, (2Е)-2-(2-{[6-(3-хлор-2-метилфенокси)-5-фторпиримидин-4-ил]окси}фенил)-2-(метоксиимино)-N-метилэтанамид, (2Е)-2-(метоксиимино)-N-метил-2-(2-{[({(1Е)-1-[3-(трифторметил)фенил]этилиден}амино)окси]метил}-фенил)этанамид, (2Е)-2-(метоксиимино)-N-метил-2-{2-[(Е)-({1-[3-(трифторметил)фенил]этокси}имино)метил]фенил}этанамид, (2Е)-2-{2-[({[(1Е)-1-(3-{[(Е)-1-фтор-2-фенилэтенил]окси}фенил)этилиден]-амино}окси)метил]фенил}-2-(метоксиимино)-N-метилэтанамид, (2Е)-2-{2-[({[(2Е,3Е)-4-(2,6-дихлорфенил)бут-3-ен-2-илиден]амино}окси)-метил]фенил}-2-(метоксиимино)-N-метилэтанамид, 2-хлор-N-(1,1,3-триметил-2,3-дигидро-1Н-инден-4-ил)-пиридин-3-карбоксамид, 5-метокси-2-метил-4-(2-{[({(1Е)-1-[3-(трифторметил)фенил]этилиден}-амино)окси]метил}фенил)-2,4-дигидро-3Н-1,2,4-триазол-3-он, метил-(2Е)-2-{2-[({циклопропил[(4-метоксифенил)имино]метил}сульфанил)-метил]фенил}-3-метоксипроп-2-еноат, N-(3-этил-3,5,5-триметилциклогексил)-3-(формиламино)-2-гидроксибензамид, 2-{2-[(2,5-диметилфенокси)метил]фенил}-2-метокси-N-метилацетамид и (2R)-2-{2-[(2,5-диметилфенокси)метил]фенил}-2-метокси-N-метилацетамид;
(4) Ингибиторы митоза и деления клетки, например, беномил, карбендазим, хлорфеназол, диэтофенкарб, этабоксам, флуопиколид, фуберидазол, пенцикурон, тиабендазол, тиофанат-метил, тиофанат, зоксамид, 5-хлор-7-(4-метилпиперидин-1-ил)-6-(2,4,6-трифторфенил)[1,2,4]триазоло-[1,5-а]пиримидин и 3-хлор-5-(6-хлорпиридин-3-ил)-6-метил-4-(2,4,6-трифторфенил)пиридазин;
(5) Соединения с многопозиционной активностью, например, бордоская смесь, каптафол, каптан, хлороталонил, препараты меди, такие как гидроксид меди, нафтенат меди, оксид меди, оксихлорид меди, сульфат меди, дихлофлуанид, дитианон, додин, додин (свободное основание), фербам, флуорофолпет, фолпет, гуазатин, гуазатин ацетат, иминоктадин, иминоктадин альбесилат, иминоктадин триацетат, манкупфер, манкозеб, манеб, метирам, цинкметирам, медь-оксин, пропамидин, пропинеб, сера и препараты серы, например, полисульфид кальция, тирам, толилфлуанид, зинеб и зирам;
(6) Индукторы резистентности, например, ацибензолар-S-метил, изотианил, пробеназол и тиадинил;
(7) Ингибиторы биосинтеза аминокислот и белков, например, андоприм, бластицидин-S, ципродинил, касугамицин, касугамицин гидрохлорид гидрат, мепанипирим, пириметанил и 3-(5-фтор-3,3,4,4-тетраметил-3,4-дигидроизохинолин-1-ил)хинолин;
(8) Ингибиторы продуцирования АТФ, например, фентин ацетат, фентин хлорид, фентин гидроксид и силтиофам;
(9) Ингибиторы синтеза клеточной оболочки, например, бентиаваликарб, диметоморф, флуморф, ипроваликарб, мандипропамид, полиоксины, полиоксорим, валидамицин А и валифеналат;
(10) Ингибиторы синтеза липидов и мембран, например, бифенил, хлоронеб, диклоран, эдифенфос, этридиазол, йодокарб, ипробенфос, изопротиолан, пропамокарб, пропамокарб гидрохлорид, протиокарб, пиразофос, квинтоцен, текназен и толклофос-метил;
(11) Ингибиторы биосинтеза меланина, например, карпропамид, диклоцимет, феноксанил, фталид, пироквилон, трициклазол и 2,2,2-трифторэтил{3-метил-1-[(4-метилбензоил)амино]бутан-2-ил}карбамат;
(12) Ингибиторы синтеза нуклеиновых кислот, например, беналаксил, беналаксил-М (киралаксил), бупиримат, клозилакон, диметиримол, этиримол, фуралаксил, гимексазол, металаксил, металаксил-М (мефеноксам), офурак, оксадиксил и оксолиновая кислота;
(13) Ингибиторы сигнальной трансдукции, например, хлозолинат, фенпиклонил, флудиоксонил, ипродион, процимидон, хиноксифен и винклозолин;
(14) Прерыватели, например, бинапакрил, динокап, феримзон, флуазинам и мептилдинокап;
(15) Другие соединения, например, бентиазол, бетоксазин, капсимицин, карвон, хинометионат, пириофенон (хлазафенон), куфранеб, цифлуфенамид, цимоксанил, ципросульфамид, дазомет, дебакарб, дихлорофен, дикломезин, дифензокват, дифензокват метилсульфат, дифениламин, экомат, фенпиразамин, флуметовер, флуоромид, флусульфамид, флутианил, фосетил-алюминий, фосетил-кальций, фосетил-натрий, гексахлорбензол, ирумамицин, метасульфокарб, метилизотиоцианат, метрафенон, милдиомицин, натамицин, никель диметилдитиокарбамат, нитротал-изопропил, октилинон, оксамокарб, оксифентиин, пентахлорфенол и его соли, фенотрин, фосфорная кислота и ее соли, пропамокарб-фосетилат, пропаносин-натрий, прохиназид, пириморф, (2Е)-3-(4-трет-бутилфенил)-3-(2-хлорпиридин-4-ил)-1-(морфолин-4-ил)проп-2-ен-1-он, (2Z)-3-(4-трет-бутилфенил)-3-(2-хлорпиридин-4-ил)-1-(морфолин-4-ил)проп-2-ен-1-он, пирролнитрин, тебуфлохин, теклофталам, толнифанид, триазоксид, трихламид, зариламид, (3S,6S,7R,8R)-8-бензил-3-[({3-[(изобутирилокси)метокси]-4-метоксипиридин-2-ил}карбонил)амино]-6-метил-4,9-диоксо-1,5-диоксонан-7-ил 2-метилпропаноат, 1-(4-{4-[(5R)-5-(2,6-дифторфенил)-4,5-дигидро-1,2-оксазол-3-ил]-1,3-тиазол-2-ил}пиперидин-1-ил)-2-[5-метил-3-(трифторметил)-1Н-пиразол-1-ил]этанон, 1-(4-{4-[(5S)-5-(2,6-дифторфенил)-4,5-дигидро-1,2-оксазол-3-ил]-1,3-тиазол-2-ил}пиперидин-1-ил)-2-[5-метил-3-(трифторметил)-1Н-пиразол-1-ил]этанон, 1-(4-{4-[5-(2,6-дифторфенил)-4,5-дигидро-1,2-оксазол-3-ил]-1,3-тиазол-2-ил}пиперидин-1-ил)-2-[5-метил-3-(трифторметил)-1Н-пиразол-1-ил]этанон, 1-(4-метоксифенокси)-3,3-диметилбутан-2-ил 1Н-имидазол-1-карбоксилат, 2,3,5,6-тетрахлор-4-(метилсульфонил)пиридин, 2,3-дибутил-6-хлортиено[2,3-d]пиримидин-4(3Н)-он, 2,6-диметил-1Н,5Н-[1,4]дитиино[2,3-с:5,6-с']дипиррол-1,3,5,7(2Н,6Н)-тетрон, 2-[5-метил-3-(трифторметил)-1Н-пиразол-1-ил]-1-(4-{4-[(5R)-5-фенил-4,5-дигидро-1,2-оксазол-3-ил]-1,3-тиазол-2-ил}пиперидин-1-ил)этанон, 2-[5-метил-3-(трифторметил)-1Н-пиразол-1-ил]-1-(4-{4-[(5S)-5-фенил-4,5-дигидро-1,2-оксазол-3-ил]-1,3-тиазол-2-ил}пиперидин-1-ил)этанон, 2-[5-метил-3-(трифторметил)-1Н-пиразол-1-ил]-1-{4-[4-(5-фенил-4,5-дигидро-1,2-оксазол-3-ил)-1,3-тиазол-2-ил]пиперидин-1-ил}этанон, 2-бутокси-6-йод-3-пропил-4Н-хромен-4-он, 2-хлор-5-[2-хлор-1-(2,6-дифтор-4-метоксифенил)-4-метил-1Н-имидазол-5-ил]пиридин, 2-фенилфенол и его соли, 3-(4,4,5-трифтор-3,3-диметил-3,4-дигидроизохинолин-1-ил)хинолин, 3,4,5-трихлорпиридин-2,6-дикарбонитрил, 3-[5-(4-хлорфенил)-2,3-диметил-1,2-оксазолидин-3-ил]пиридин, 3-хлор-5-(4-хлорфенил)-4-(2,6-дифторфенил)-6-метилпиридазин, 4-(4-хлорфенил)-5-(2,6-дифторфенил)-3,6-диметилпиридазин, 5-амино-1,3,4-тиадиазол-2-тиол, 5-хлор-N'-фенил-N'-(проп-2-ин-1-ил)тиофен-2-сульфоногидразид, 5-фтор-2-[(4-фтор-бензил)окси]пиримидин-4-амин, 5-фтор-2-[(4-метилбензил)окси]пиримидин-4-амин, 5-метил-6-октил[1,2,4]триазоло[1,5-а]пиримидин-7-амин, этил (2Z)-3-амино-2-циано-3-фенилпроп-2-еноат, N'-(4-{[3-(4-хлорбензил)-1,2,4-тиадиазол-5-ил]окси}-2,5-диметилфенил)-N-этил-N-метилимидо-формамид, N-(4-хлорбензил)-3-[3-метокси-4-(проп-2-ин-1-илокси)фенил]пропанамид, N-[(4-хлорфенил)(циано)метил]-3-[3-метокси-4-(проп-2-ин-1-илокси)фенил]пропанамид, N-[(5-бром-3-хлорпиридин-2-ил)метил]-2,4-дихлорпиридин-3-карбоксамид, N-[1-(5-бром-3-хлорпиридин-2-ил)этил]-2,4-дихлорпиридин-3-карбоксамид, N-[1-(5-бром-3-хлорпиридин-2-ил)этил]-2-фтор-4-йодпиридин-3-карбоксамид, N-{(Е)-[(циклопропилметокси)имино][6-(дифторметокси)-2,3-дифторфенил]метил}-2-фенилацетамид, N-{(Z)-[(циклопропилметокси)имино][6-(дифторметокси)-2,3-дифторфенил]метил}-2-фенилацетамид, N'-{4-[(3-трет-бутил-4-циано-1,2-тиазол-5-ил)окси]-2-хлор-5-метилфенил}-N-этил-N-метилимидоформамид, N-метил-2-(1-{[5-метил-3-(трифтор-метил)-1Н-пиразол-1-ил]ацетил}пиперидин-4-ил)-N-(1,2,3,4-тетрагидронафтален-1-ил)-1,3-тиазол-4-карбоксамид, N-метил-2-(1-{[5-метил-3-(трифторметил)-1Н-пиразол-1-ил]ацетил}пиперидин-4-ил)-N-[(1R)-1,2,3,4-тетрагидронафтален-1-ил]-1,3-тиазол-4-карбоксамид, N-метил-2-(1-{[5-метил-3-(трифторметил)-1Н-пиразол-1-ил]ацетил}пиперидин-4-ил)-N-[(1S)-1,2,3,4-тетрагидронафтален-1-ил]-1,3-тиазол-4-карбоксамид, пентил {6-[({[(1-метил-1Н-тетразол-5-ил)(фенил)метил-иден]амино}окси)метил]пиридин-2-ил}карбамат, феназин-1-карбоновая кислота, хинолин-8-ол, хинолин-8-ол сульфат (2:1) и трет-бутил {6-[({[(1-метил-1Н-тетразол-5-ил)(фенил)метилен]амино}окси)метил]пиридин-2-ил}карбамат;
(16) Дополнительные соединения, например, 1-метил-3-(трифторметил)-N-[2'-(трифторметил)бифенил-2-ил]-1Н-пиразол-4-карбоксамид, N-(4'-хлорбифенил-2-ил)-3-(дифторметил)-1-метил-1Н-пиразол-4-карбоксамид, N-(2',4'-дихлорбифенил-2-ил)-3-(дифторметил)-1-метил-1Н-пиразол-4-карбоксамид, 3-(дифторметил)-1-метил-N-[4'-(трифторметил)бифенил-2-ил]-1Н-пиразол-4-карбоксамид, N-(2',5'-дифторбифенил-2-ил)-1-метил-3-(трифторметил)-1Н-пиразол-4-карбоксамид, 3-(дифторметил)-1-метил-N-[4'-(проп-1-ин-1-ил)бифенил-2-ил]-1Н-пиразол-4-карбоксамид, 5-фтор-1,3-диметил-N-[4'-(проп-1-ин-1-ил)бифенил-2-ил]-1Н-пиразол-4-карбоксамид, 2-хлор-N-[4'-(проп-1-ин-1-ил)бифенил-2-ил]пиридин-3-карбоксамид, 3-(дифторметил)-N-[4'-(3,3-диметилбут-1-ин-1-ил)бифенил-2-ил]-1-метил-1Н-пиразол-4-карбоксамид, N-[4'-(3,3-диметилбут-1-ин-1-ил)бифенил-2-ил]-5-фтор-1,3-диметил-1Н-пиразол-4-карбоксамид, 3-(дифторметил)-N-(4'-этинилбифенил-2-ил)-1-метил-1Н-пиразол-4-карбоксамид, N-(4'-этинилбифенил-2-ил)-5-фтор-1,3-диметил-1Н-пиразол-4-карбоксамид, 2-хлор-N-(4'-этинилбифенил-2-ил)пиридин-3-карбоксамид, 2-хлор-N-[4'-(3,3-диметилбут-1-ин-1-ил)бифенил-2-ил]пиридин-3-карбоксамид, 4-(дифторметил)-2-метил-N-[4'-(трифторметил)бифенил-2-ил]-1,3-тиазоле-5-карбоксамид, 5-фтор-N-[4'-(3-гидрокси-3-метилбут-1-ин-1-ил)бифенил-2-ил]-1,3-диметил-1Н-пиразол-4-карбоксамид, 2-хлор-N-[4'-(3-гидрокси-3-метилбут-1-ин-1-ил)бифенил-2-ил]пиридин-3-карбоксамид, 3-(дифторметил)-N-[4'-(3-метокси-3-метилбут-1-ин-1-ил)бифенил-2-ил]-1-метил-1Н-пиразол-4-карбоксамид, 5-фтор-N-[4'-(3-метокси-3-метилбут-1-ин-1-ил)бифенил-2-ил]-1,3-диметил-1Н-пиразол-4-карбоксамид, 2-хлор-N-[4'-(3-метокси-3-метилбут-1-ин-1-ил)бифенил-2-ил]пиридин-3-карбоксамид, (5-бром-2-метокси-4-метилпиридин-3-ил)(2,3,4-триметокси-6-метилфенил)метанон, N-[2-(4-{[3-(4-хлорфенил)проп-2-ин-1-ил]окси}-3-метоксифенил)этил]-N2-(метилсульфонил)валинамид, 4-оксо-4-[(2-фенил-этил)амино]бутановая кислота и бут-3-ин-1-ил {6-[({[(Z)-(1-метил-1Н-тетразол-5-ил)(фенил)метилен]амино}окси)метил]пиридин-2-ил}карбамат.
Все компоненты смешивания, упомянутые в классах (1)-(16) могут, если они способны, на основе их функциональных групп, необязательно образовывать соли с подходящими основаниями или кислотами.
Изобретение может быть использовано для лечения всех растений и частей растений. Растения в этом контексте следует понимать как все растения и популяции растений, такие как желаемые и нежелательные дикорастущие растения или культурные растения (в том числе, естественно появляющиеся культурные растения). Культурные растения могут представлять собой растения, которые могут быть получены с помощью обычных методов оптимизации разведения и/или биотехнологическими и генетическими инженерными методами или комбинации этих методов, включая трансгенные растения и включая сорта растений, которые могут быть защищены и не быть защищены правами селекционеров. Части растений следует понимать как все части и органы растений над и под землей, такие как побеги, листы, цветы и корни, примеры, приведенные здесь, представляют собой листья, иголки, стебли, ножки, цветы, плодовые тела, плоды и семена, а также клубни, корни и корневища. Части растений также включают урожайные растения и вегетативный и генеративный материал для размножения, например, черенки, клубни, корневища, срезы и семена.
Как уже упоминалось выше, можно обрабатывать все растения и их части в соответствии с изобретением. В предпочтительном варианте обрабатывают дикие растения и сорта растений, или полученные с помощью обычных биологических методов выращивания, таких как скрещивание или слияние протопластов, а также их части. В другом предпочтительном варианте осуществления рассматриваются трансгенные растения и сорта растений, полученные методами генной инженерии, при необходимости в сочетании с обычными методами (генетически модифицированные организмы), и их части. Термин "части" или "части растений" или "растительные части" был объяснен выше. Изобретение используется особенно предпочтительно для лечения растений соответствующих коммерчески обычных сортов или тех, которые находятся в использовании.
Сорта растений следует понимать как растения с новыми свойствами ("чертами") и которые были получены с помощью традиционной селекции, в результате мутагенеза или с помощью технологии рекомбинантной ДНК. Они могут представлять собой разновидности, сорта, био- или генотипы.
Обработка растений и частей растений с помощью активных соединений, комбинаций биологически активных соединений или композиций в соответствии с изобретением или активных соединений, комбинаций биологически активных соединений или композиций, которые используют в соответствии с изобретением осуществляется непосредственно или путем воздействия на их окружение, среду обитания или место для хранения, используя обычные методы обработки, например, путем окунания, распыления, мелкодисперсного разбрызгивания, полива, испарения, запыления, запотевания, посева вразброс, вспенивания, окрашивания, распространения, инжекции, полива (орошение), капельного орошения и, в случае материала для размножения, в частности в случае семян, кроме того, в виде порошка для сухой обработки семян, раствора для обработки семян, порошка растворимого в воде для обработки взвесью, путем покрытия коркой, путем нанесения одного или более покрытий, и т.п. Кроме того, можно применять активные соединения с помощью метода сверхнизкого объема или вводить препарат биологически активного соединения или само активное соединение в почву.
Одно предпочтительное прямое лечение растений представляет собой подкормку. Другими словами, активные соединения, комбинации активных соединений или композиции наносят на листву, где частота обработки и скорость применения могут быть скорректированы для давления на заражение конкретным патогеном, вредителями или сорняками.
В случае системно-активных соединений, активных соединений, комбинаций активных соединений или композиций, доступ к растению осуществляют через корневую систему. Растения затем обрабатывают под действием активных соединений, комбинаций биологически активных соединений или композиций на среду обитания растения. Это может быть осуществлено, например, путем пропитки, или путем смешивания в почву или питательного раствора, т.е. локус растений (например, почва или гидропонные системы) пропитывают жидкой формой активных соединений, комбинациями активных соединений или композициями, или путем внесения в почву, то есть активные соединения, комбинации активных соединений или композиции согласно изобретению вводят в твердой форме (например, в виде гранул) в локус растений. В случае культур риса-падди, это также может быть осуществлено путем дозирования изобретения в твердой форме применения (например, в виде гранул) в затопленном рисовом поле.
Контроль животных вредителей путем обработки семян растений, как известно, в течение длительного времени и является предметом постоянного улучшения. Тем не менее, обработка семян приводит к серии проблем, которые не всегда могут быть решены удовлетворительным образом. Таким образом, желательно разработать методы защиты семенного материала и прорастающих растений, которые могут обойтись без или, по меньшей мере, значительно уменьшить, дополнительное применение средств защиты растений во время хранения, после посева или после всхода растений. Кроме того, желательно оптимизировать количество активного соединения, используемого таким образом, чтобы обеспечить оптимальную защиту семян и прорастающих растений от нападения животных вредителей, но не повреждая само растение используемым активным соединением. В частности, в методах обработки семян следует также принимать во внимание внутренние инсектицидные или нематоцидные свойства резистентных или устойчивых к вредителям трансгенных растений для того, чтобы достичь оптимальной защиты семян и также всхожести растений с минимальным применением средств защиты растений.
Следовательно, настоящее изобретение, в частности, также относится к способу защиты семян и прорастающих растений, от нападения вредителей, путем обработки семян с помощью активного соединения в соответствии с изобретением или активного соединения для использования в соответствии с изобретением. Способ согласно настоящему изобретению для защиты семян и прорастающих растений от нападения вредителей включает способ, где семена обрабатывают одновременно в одной операции активным соединением формулы I и компонентом смешивания. Это также включает способ, где семена обрабатывают в различные моменты времени с помощью активного соединения формулы I и компонента смешивания.
Изобретение подобным образом относится к применению активных соединений в соответствии с изобретением для обработки семенного материала для защиты семенного материала и выращенного растения от животных вредителей.
Кроме того, настоящее изобретение относится к семенам, которые были обработаны с помощью активного соединения в соответствии с изобретением таким образом, чтобы обеспечивать защиту от животных вредителей. Изобретение также относится к семенам, которые были обработаны одновременно с помощью активного соединения формулы I и компонента смешивания. Кроме того, изобретение относится к семенам, которые был обработаны в разные периоды времени с помощью активного соединения формулы I и компонента смешивания. В случае семян, которые были обработаны в различные моменты времени с помощью активного соединения формулы I и компонента смешивания, отдельные композиции активных соединений согласно изобретению могут присутствовать на семенах в различных слоях. Таким образом, слои, содержащие активное соединение формулы (I) и компонент смешивания могут необязательно быть разделены промежуточным слоем. Изобретение также относится к семенам, где активное соединение формулы I и компонент смешивания были применены в качестве компонента или покрытия или в качестве дополнительного слоя или дополнительных слоев в дополнение к покрытию.
Кроме того, настоящее изобретение относится к семенам, которые, после обработки с помощью активного соединения формулы (I) или комбинации активного соединения, содержащей активное соединение формулы (I), были подвергнуты процессу нанесения пленочного покрытия для предотвращения попадания пыли на истирание семян.
Одним из преимуществ настоящего изобретения является то, что отдельные системные свойства композиций в соответствии с изобретением означают, что лечение семени с помощью этих композиций не только защищает само семя, но и в результате растения после всходов от животных вредителей. Таким образом, можно обойтись без непосредственной обработки урожая в момент посева или вскоре после этого.
Следует считать дополнительным преимуществом, что при обработке семян активным соединением формулы (I) или комбинацией биологически активных соединений, содержащей активное соединение формулы (I), прорастание и появление обработанного семени может быть повышено.
Аналогично стоит считать предпочтительным, чтобы активные соединения формулы (I), и комбинации указанных активных соединений, можно использовать, в частности, и для трансгенных семян.
Также может быть отмечено, что активные соединения формулы (I), могут быть использованы в сочетании с композициями сигнальной технологии, что ведет, например, к лучшей колонизации симбионтов, таких как, например, ризобии, микориза и/или эндофитные бактерии, и/или к оптимизированной фиксации азота.
Композиции согласно изобретению являются пригодными для защиты семян любого сорта растений, которые используются в сельском хозяйстве, в теплице, в лесах или в садоводстве. В частности, под этим следует понимать форму семян зерновых: (например, пшеница, ячмень, рожь, просо и овес), кукуруза, хлопок, соевые бобы, рис, картофель, подсолнечник, кофе, табак, рапс, масляный рапс, свекла (сахарная свекла, например, и кормовая свекла), арахис, овощи (например, помидоры, огурцы, бобовые, крестоцветные овощи, лук и салат), плодовые растения, газоны и декоративные растения. Обработка семян зерновых культур, таких как (таких как пшеница, ячмень, рожь и овес), кукуруза, соевые бобы, хлопок, рапс, масляный рапс и рис, имеет особое значение.
Как уже упоминалось выше, обработка трансгенных семян активными соединениями формулы (I) или комбинациями биологически активных соединений также имеет особое значение. Под этим следует понимать форму семян растений, которые, как правило, содержат, по меньшей мере, один гетерологичный ген, который регулирует экспрессию полипептида в частности с инсектицидными и/или нематоцидными свойствами. В этом контексте гетерологичные гены в трансгенных семенах могут быть получены из микроорганизмов, таких как Bacillus, Rhizobium, Pseudomonas, Serratia, Trichoderma, Clavibacter, Glomus или Gliocladium. Настоящее изобретение особенно подходит для обработки трансгенных семян, которые содержат, по меньшей мере, один гетерологичный ген, происходящий из Bacillus sp. Участвующий ген более предпочтительно представляет собой гетерологичный ген, который происходит из Bacillus Thuringiensis.
В контексте настоящего изобретения, активное соединение формулы (I), применяется к семенам отдельно (или в качестве комбинации биологически активных веществ) или в подходящей композиции. Предпочтительно, семена обрабатывают в состоянии, при котором они достаточно стабильны, чтобы избежать повреждения во время обработки. В общем, семена могут быть обработаны в любой момент времени между урожаем и посевом. Используемые семена, как правило, были отделены от растений и освобождены от початков, раковин, стеблей, покрытий, волосков или мякоти плодов. Например, можно использовать семенной материал, который был собран, очищен и высушен до содержания влаги менее 15% по массе. Альтернативно, можно также использовать семенной материал, который после сушки, например, был обработан водой и затем высушен снова.
При обработке семян, уход как правило, должен быть осуществлен - количество композиции согласно изобретению наносят на семена и/или количество других добавок выбирают таким образом, что прорастание семени не ухудшается, или что в результате растение не повреждено. Это должно быть обеспечено в частности, в случае активных соединений, которые могут проявлять фитотоксические эффекты при конкретных нормах расхода.
Композиции согласно изобретению могут быть применены непосредственно, т.е. без содержания каких-либо других компонентов и без разбавления. В общем, желательно применять композиции к семенам в виде подходящей композиции. Подходящие составы и методы обработки семян известны специалистам в данной области и описаны, например, в следующих документах: US 4,272,417 А, 4,245,432 А, US 4,808,430 А, US 5,876,739 А, US 2003/0176428 А1, WO 2002/080675 А1, WO 2002/028186 А2.
Активные соединения/комбинации биологически активных соединений, которые могут быть использованы в соответствии с изобретением могут быть переведены в обычные составы для протравливания семян, такие как растворы, эмульсии, суспензии, порошки, пены, жижи или другие композиции для покрытия семян, и также ULV препараты.
Эти препараты получают известным способом, путем смешивания активных соединений или комбинации активных соединений с обычными добавками, такими как, например, обычные наполнители и также растворители или разбавители, красители, смачивающие агенты, диспергаторы, эмульгаторы, пеногасители, консерванты, вторичные загустители, клеи, гиббереллины, а также вода.
Красители, которые могут присутствовать в композициях протравливания семян, которые могут быть использованы в соответствии с изобретением представляют собой все красители, которые являются обычными для таких целей. Можно использовать либо пигменты, которые плохо растворимы в воде, либо красители, которые растворимы в воде. Примеры включают в себя красители, известные под названиями Родамин В, С.I. Пигмент красный 112 и С.I.. Растворитель Красный 1.
Подходящие смачивающие агенты, которые могут присутствовать в композициях протравливания семян, которые могут быть использованы в соответствии с изобретением, представляют собой все вещества, которые способствуют смачиванию и которые обычно используют для выработки агрохимически активных соединений. Полезными с указанием предпочтения являются алкилнафталенсульфонаты, такие как диизопропил- или диизобутилнафталенсульфонаты.
Подходящие диспергаторы и/или эмульгаторы, которые могут присутствовать в композициях протравливания семян, которые могут быть использованы в соответствии с изобретением, представляют собой все неионогенные, анионные и катионные диспергаторы, обычно используемые для разработки агрохимически активных соединений. Неионные или анионные диспергаторы или смеси неионных или анионных диспергаторов могут использоваться с предпочтением. Подходящие неионные диспергаторы включают особенно этилен оксид/пропилен оксид блок-полимеры, алкилфенольные эфиры и эфиры тристририлфенола, и их фосфатированные или сульфатированные производные. Подходящие анионные диспергаторы представляют собой особенно лигносульфонаты, соли полиакриловой кислоты и конденсаты арилсульфоната/ формальдегида.
Пеногасители, которые могут присутствовать в композициях для протравливания семян, используемых в соответствии с изобретением, представляют собой все пено-ингибирующие вещества, обычно используемые для разработки агрохимически активных соединений. Предпочтительно могут быть использованы силиконовые пеногасители и стеарат магния.
Консерванты, которые могут присутствовать в композициях для протравливания семян, используемые в соответствии с изобретением, представляют собой все вещества, используемые для таких целей в агрохимических композициях. Примеры включают дихлорфен и гемиформаль бензилового спирта.
Вторичные загустители, которые могут присутствовать в композициях для протравливания семян, используемые в соответствии с изобретением, представляют собой все вещества, используемые для таких целей в агрохимических композициях. Предпочтительными являются производные целлюлозы, производные акриловой кислоты, ксантан, модифицированные глины и мелко измельченный кремнезем.
Адгезивы, которые могут присутствовать в композициях для протравливания семян, используемые в соответствии с настоящим изобретением, представляют собой все обычные адгезивы, которые можно использовать в препаратах протравливания семян. Поливинилпирролидон, поливинилацетат, поливиниловый спирт и тилозу можно назвать как предпочтительные.
Гиббереллины, которые могут присутствовать в композициях протравливания семян, которые могут быть использованы в соответствии с изобретением, предпочтительно представляют собой гиббереллины A1, A3 (= гиббереллиновая кислота), A4 и А7; использовать гибберелловую кислоту является особенно предпочтительным. Гиббереллины являются известными (см. R. Wegler "Chemie der Pflanzenschutz- и

Композиции для протравливания семян, используемые в соответствии с изобретением, могут быть использованы для лечения широкого спектра различных видов семян либо непосредственно или после предварительного разбавления водой. Например, концентраты или препараты, получаемые из них путем разбавления водой могут быть использованы, чтобы покрыть семена зерновых, таких как пшеница, ячмень, рожь, овес, тритикале, а также семена кукурузы, риса, рапса, гороха, фасоли, хлопка, подсолнечника, свеклы, или также широкого спектра различных семян овощей. Композиции для протравливания семян, используемые в соответствии с настоящим изобретением, или их разбавленные препараты, также могут быть использованы, чтобы покрыть семена трансгенных растений. В этом случае дополнительные синергетические эффекты могут возникать во взаимодействии с веществами, образованными путем экспрессии.
Для обработки семенного материала с помощью композиций для протравливания семян, используемых в соответствии с настоящим изобретением, или препаратов, приготовленных из них путем добавления воды, все смесительные блоки, используемые обычно для протравливания семян, могут быть применены. В частности, методика протравливания семян заключается в размещении семян в смесителях, добавлении особого нужного количества протравливающих композиций, либо как таковых, либо после предварительного разбавления водой, и смешение всего пока композиция не будет равномерно распределена по семенам. Если необходимо, за этим следует процесс сушки.
Норма применения протравливающих композиций, используемых в соответствии с настоящим изобретением, может изменяться в широких пределах. Ориентируются на конкретное содержание активного соединения(ий) в композициях и в семени. Нормы применения активных соединений/комбинаций биологически активных соединений, как правило, находятся от 0,001 и 50 г на килограмм семян, предпочтительно от 0,01 и 15 г на килограмм семян.
Известный уровень техники не раскрывает эффективны ли активные соединения формулы (I) против биотического стресса, факторов и/или абиотического стресса растений или в отношении роста растений.
Было обнаружено, что активные соединения формулы (I), в соответствии с изобретением являются подходящими для усиления защитных сил растений (борьба с патогенами на растениях).
Известно, что растения реагируют на природные условия стресса, такие как, например, холодные температуры, жара, засуха, травмы, нападение патогенов (вирусов, бактерий, грибков, насекомых) и т.д., но также на гербициды, с конкретными или неспецифическими защитными механизмами (Pflanzenbiochemie [Plant Biochemistry], pp. 393-462, Spektrum Akademischer Verlag, Heidelberg, Berlin, Oxford, Hans W. Heidt, 1996.; Biochemistry и Molecular Biology of Plants, pp. 1102-1203, American Society of Plant Physiologists, Rockville, Maryland, eds. Buchanan, Gruissem, Jones, 2000). В данном случае, например, компоненты клеточной стенки, травмы или специфические патогено-генерируемые сигнальные вещества служат индукторами цепей сигнала трансдукции растений, которые в конце концов приводят к образованию защитных молекул, направленных против фактора стресса. Они могут быть, например, (а) веществами с низкой молекулярной массой, такими как, например, фитоалексины, (б) не ферментативными белками, такими как патогенез-связанные белки (PR-белков), (в) ферментативными белками, такими как хитиназы, глюканазы, или (г) специфическими ингибиторами основных белков, такими как ингибиторы протеазы, ингибиторы ксиланазы, которые атакуют возбудителя непосредственно или препятствуют его распространению (Dangl and Jones, Nature 411, 826-833, 2001; Kessler и Baldwin, Annual Review of Plant Biology, 53, 299-328, 2003).
Дополнительным защитным механизмом является так называемая реакция гиперчувствительности (HR), которая опосредована с помощью окислительного стресса и вызывает гибель ткани растения в области центра инфекции, таким образом, предотвращая распространение патогенов растений, которые зависят от живых клеток (Pennazio, New Microbiol. 18, 229-240, 1995).
Во время прогрессирования инфекции, вещества, проводящие сообщение растению, передают сигналы в не инфицированных тканях, вызывая защитные реакции в этих тканях и предотвращающие вторичные инфекции (Systemic acquired resistance, SAR) (Ryals et al., The Plant Cell 8, 1809-1819, 1996).
Количество сигнальных веществ, которые являются эндогенными для растений и участвуют в стрессоустойчивости или защите от патогенов уже известны. Примеры в данном случае включают салициловую кислоту, бензойную кислоту, или этилен жасмоновую кислоту (Biochemistry и Molecular Biology of Plants, p. 850-929, American Society of Plant Physiologists, Rockville, Маrylаnd, eds. Buchanan, Gruissem, Jones, 2000). Некоторые из этих веществ или стабильные синтетические производные и их производные структуры, также эффективны для наружного применения к растениям или в протравливании семян, и активируют защитные реакции, которые вызывают повышенную устойчивость к стрессу или патоген-резистентность растений (Sembdner, Parthier, 1993, Ann. Rev. Plant Physiol. Plant Mol. Biol. 44, 569-589, 1993). Салицилат-опосредованная защита направлена, в частности, против фитопатогенных грибков, бактерий и вирусов (Ryals et al., The Plant Cell 8, 1809-1819, 1996).
Известный синтетический продукт, который имеет функцию, аналогичную салициловой кислоте может опосредовать защитный эффект против фитопатогенных грибков, бактерий и вирусов представляет собой бензотиадиазол (CGA 245704; общее название: ацибензолар-8-метил; торговое название: Bion®) (Achuo et al., Plant Pathology 53 (1), 65-72, 2004; Tamblyn et al., Pesticide Science 55 (6), 676-677, 1999; EP-OS [European Published Specification] 0313512).
Другие соединения, которые принадлежат к группе оксилипинов, например, жасмоновая кислота, и защитные механизмы которые они вызывают особенно эффективны против вредных насекомых (Walling, J. Plant Growth Regul. 19, 195-216, 2000).
Кроме того, известно, что обработка растений инсектицидами из группы неоникотиноидов (хлорникотинилы) приводит к повышенной устойчивости растения к абиотическим стрессам. Это относится, в частности, к имидаклоприду (Brown et al., Beltwide Cotton Conference Proceedings 2231-2237, 2004). Эта защита обусловлена изменениями физиологических и биохимических свойств клетки растений, например, путем улучшения стабильности мембран, увеличения концентрации углевода, увеличения концентрации полиола и антиоксидантной активности (Gonias et al., Beltwide Cotton Conference Proceedings 2225-2229, 2004).
Также известен эффект хлорникотинилов на биотические факторы стресса (Crop Protection 19 (5), 349-354, 2000; Journal of Entomological Science 37(1), 101-112, 2002; Annals of Biology (Hisar, India) 19 (2), 179-181, 2003). Инсектициды из группы неоникотиноидов (хлорникотинилы), например, приводят к повышенной экспрессии генов из группы патогенез-связанных белков (PR). PR-белки поддерживают растения, прежде всего, в защите от биотических стрессоров, таких как, например, фитопатогенные грибки, бактерии и вирусы (DE 102005045174 A; DE 102005022994 А и WO 2006/122662 A; Thielert Pflanzenschutz-Nachrichten Bayer, 59 (1), 73-86, 2006; Francis et al., European Journal of Plant Pathology, publ. online 23.1.2009).
Кроме того, известно, что лечение генетически модифицированных растений с помощью инсектицидов из группы неоникотиноидов (хлорникотинилы) приводит к улучшению резистентности стрессу растения (ЕР 1731037), например, также по отношению к гербициду глифосату (WO 2006/015697).
Таким образом, известно, что растения обладают несколькими эндогенными механизмами реакций, которые могут вызвать эффективную защиту против широкого спектра вредных организмов (биотический стресс) и/или абиотических стрессов.
Разведение здоровых молодых растений равномерного роста является необходимым условием для выращивания на больших площадях и экономического управления растениеводства сельскохозяйственных, садоводческих и лесных культур растений.
Многочисленные методы разведения молодых растений установлены в сельском хозяйстве, лесном хозяйстве и садоводстве. Здесь выращивание субстратов используется в дополнение к паровой почве, а также специальные субстраты на основе, в частности, торфяных мхов, кокосовых волокон каменной ваты, такие как Grodan®, пемза, керамзит, такие как Lecaton® или Lecadan®, гранулы глины, такие как Seramis®, пены, такие как Baystrat®, вермикулит, перлит, синтетическая почва, такая как Hygromull®, или комбинации этих субстратов, в которых семена, либо высевают покрытыми фунгицидами и/или инсектицидами, или непокрытыми.
В конкретных культурах, таких как табак, молодые растения больше выращивают методом на плаву или плавающим методом (Leal, R.S., The use of Confidor S in the float, a new tobacco seedlings production system in the South of Brazil. Pflanzenschutz-Nachrichten Bayer (German edition) (2001), 54(3), pages 337 to 352; Rudolph, R.D.; Rogers, W.D.; The efficacy of imidacloprid treatment for reduction in the severity of insect vectored virus diseases of tobacco. Pflanzenschutz-Nachrichten Bayer (German edition) (2001), 54(3), pages 311 to 336). В этом методе семена высевают в специальных контейнерах, например, таблетки пенопласта с отверстиями, в специальной почве для выращивания на основе культурального субстрата торфа, и затем культивируют в контейнерах с соответствующим питательным раствором, пока не будет достигнута нужного размера трансплантация (рисунок 1). Здесь, контейнеры могут плавать на питательном растворе, отсюда и название метода выращивания (Leal, 2001, смотри выше). В течение ряда лет, для борьбы с сосущими вредителями, инсектициды из класса неоникотиноидов (хлорникотинилы) были использованы в плавающем способе. Как правило, в методе на плаву растения опрыскивали неоникотиноидными (хлорникотинилы) инсектицидами незадолго до трансплантации, или их поливали неоникотиноидными (хлорникотинилы) инсектицидами непосредственно перед или во время трансплантации, процедура называется проливной (Leal, 2001, см. выше; Rudolph и Rogers, 2001, см. выше). Оба метода применения технически относительно сложные.
Так, чтобы защитить возникающие семена или посадочный материал против грибковых патогенов и вредителей, фунгициды и инсектициды используются до трансплантации. Здесь выбор средств защиты растений, расположение и выбор времени применения и нормы расхода композиций зависит прежде всего от типа грибковых заболеваний и вредителей, с которыми сталкиваются, от продолжительности действия конкретного способа и нормы расхода композиций и от их совместимости с растениями, и они могут, следовательно, быть приспособлены непосредственно к конкретным требованиям различных культур и регионов.
Здесь, независимо от какой-либо борьбы с насекомыми, активные соединения формулы (I), приводят к хорошей защите растений от повреждения грибковыми, бактериальными или вирусными патогенами.
Не желая быть привязанными к теории, в настоящее время предполагается, что защита от патогенов осуществляется индукцией PR-белков, в результате обработки, по меньшей мере, одним активным соединением формулы (I).
Описанные преимущества очевидны, в частности, при использовании в соответствии с изобретением в обработке семян, при обработке почв, в конкретных способах культивирования и выращивания (например, плавающая коробка, минеральная вата, гидропонный), но также и в обработке ствола и листвы. Комбинации активных соединений формулы (I) с, в частности, инсектицидами, фунгицидами, бактерицидами демонстрируют синергетические эффекты в контроле заболеваний растений. Кроме того, совместное использование активных соединений формулы (I) с генетически модифицированными сортами с целью повышения устойчивости к абиотическим стрессам приводит к синергетическому улучшению роста.
Наконец, в соответствии с изобретением, было также обнаружено, что активные соединения формулы (I), пригодны не только для повышения защиты растений от патогена, но и для улучшения роста растений и/или для повышения устойчивости растений к болезням растений вызванным грибками, бактериями, вирусами, MLO (микоплазма-подобными организмами) и/или RLO (риккетсия-подобными организмами), в частности, почвенным грибковым заболеваниям, и/или для повышения устойчивости растений к абиотическим стресс-факторам.
Абиотические стрессовые условия могут включать в себя, например, засуху, воздействие холодной температуры, воздействие тепла, осмотический стресс, заболачивание, засоление почвы, увеличение подверженности минералов, воздействие озона, воздействия яркого света, ограниченную доступность азотных питательных веществ, ограниченную доступность фосфорных питательных веществ или избежание тени.
Таким образом, настоящее изобретение обеспечивает, во-первых, использование, по меньшей мере, одного активного соединения формулы (I) для повышения естественной защиты растений и/или для улучшения роста растений и/или для повышения устойчивости растений к болезни растений, вызываемой грибками, бактериями и вирусами, MLO (микоплазма-подобными организмами) и/или RLO (риккетсия-подобными организмами), в частности, к почвенным грибковым заболеваниям, и/или для повышения устойчивости растений к абиотическим стресс-факторам.
В контексте настоящего изобретения, термин рост растений следует понимать как означающий различные преимущества растений, непосредственно не связанные с известной пестицидной активностью, предпочтительно инсектицидной активностью активных соединений формулы (I). Такие выгодные свойства представляют собой, например, улучшенные характеристики растений, упомянутые ниже: ускоренное прорастание и появление семян и саженцев, улучшение роста корней с учетом площади поверхности и глубины, повышенное образование столонов или отростков, более сильные и более производительные столоны и отростки, улучшение роста побегов, повышение устойчивости к полеганию, увеличенного диаметра основы побегов, увеличение площади листьев, зеленый цвет листьев, более высокие урожаи питательных веществ и компонентов, например, углеводов, жиров, масел, белков, витаминов, минералов, эфирных масел, красителей, волокон, лучшее качество волокна, более раннее цветение, повышенное количество цветов, пониженное содержание токсичных продуктов, таких как микотоксины, пониженное содержание отходов или невыгодных компонентов любого вида, или лучшую усвояемость, улучшенную стабильность при хранении растительного материала, повышенную устойчивость к невыгодным температурам, повышенную устойчивость к засухе и сухости, а также дефициту кислорода в результате переувлажнения, улучшенную устойчивость к повышенным содержаниям солей в почвах и воде, повышенную устойчивость к УФ-излучению, повышенную устойчивость к воздействию озонового стресса, улучшение совместимости по отношению к гербицидам и другим композициям для обработки других растений, улучшенное водопоглощение и процесс фотосинтеза, полезные свойства растений, например, ускорение созревания, более однородное созревание, большую привлекательность для полезных животных, улучшение опыления, или другие преимущества хорошо известные специалистам в данной области.
Как известно, различные преимущества для растений, которые были упомянуты выше, дополнительно могут быть объединены в части, и, как правило, применимые термины могут быть использованы для описания. Такие термины, например, представляют собой следующие понятия: фитотонический эффект, устойчивость к стрессовым факторам, меньший стресс растения, здоровье растений, здоровые растения, соответствие растения, хорошее здоровье растения, концепт растения, очевидный эффект, защитный стресс, защитный щит, здоровье культур, свойства здоровья урожая, товары для здоровья урожая, управление здоровьем урожая, терапия здоровья урожая, здоровье растений, полезные свойства растений, товары для здоровья растений, управления здоровьем растений, терапия здоровья растений, эффект озеленения или эффект нового озеленения, свежесть, или другие условия, с которыми специалисты в данной области хорошо знакомы.
Кроме того, было обнаружено, что активные соединения формулы (I), приводят к повышенной экспрессии генов из группы патогенез-связанных белков (PR белков). PR белки поддерживают растения, прежде всего, в защите биотических стрессоров, таких как фитопатогенные грибки, бактерии и вирусы. В результате, после нанесения активного соединения формулы (I) растения лучше защищены от инфекции от фитопатогенных грибков, бактерий и вирусов. В требуемом применении инсектицидов, фунгицидов и бактерицидов в смеси с активными соединениями формулы (I), а также в последовательном применении, действие последнего поддерживается.
В соответствии с изобретением, кроме того, было обнаружено, что применение, к растениям или к их среде, активных соединений формулы (I) в сочетании с удобрением, как определено ниже, имеет синергетический эффект усиления роста.
Удобрения, которые могут быть использованы в соответствии с изобретением вместе с активными соединениями или композициями, которые были объяснены более подробно выше, как правило, представляют собой органические и неорганические азотсодержащие соединения такие как, например, мочевины, мочевина/формальдегидные конденсаты, аминокислоты, соли аммония и нитраты аммония, соли калия (предпочтительно хлориды, сульфаты, нитраты), соли фосфорной кислоты и/или соли фосфорной кислоты (предпочтительно соли калия и соли аммония). В этом контексте особенно стоит указать удобрения NPK, т.е. удобрения, которые содержат азот, фосфор и калий, кальций нитрат аммония, т.е. удобрения, которые дополнительно содержат кальций, сульфат или нитрат аммония (общая формула (NH4)2SO4 NH4NO3), аммоний фосфат и сульфат аммония. Эти удобрения, как правило, известны специалистам в данной области; см. также например, Ullmann's Encyclopedia of Industrial Chemistry, 5th edition, Vol. A 10, pages 323 to 431, Verlagsgesellschaft, Weinheim, 1987.
Удобрения могут также содержать соли микроэлементов (предпочтительно кальций, сера, бор, марганец, магний, железо, медь, цинк, молибден и кобальт) и фитогормонов (например, витамин В1 и индол-3-уксусная кислоты (ИУК)) или их смеси. Удобрения, используемые в соответствии с изобретением, могут также содержать другие соли, такие как фосфат моноаммония (MAP), диаммоний фосфат (DAP), сульфат калия, сульфат калия или хлорид магния. Подходящие количества для вторичных питательных веществ или микроэлементы представляют собой количества от 0,5 до 5% по массе в расчете на общую массу удобрений. Другие возможные ингредиенты представляют собой средства защиты растений - инсектициды или фунгициды, регуляторы роста или их смеси. Это будет объяснено более подробно ниже.
Удобрения могут быть использованы, например, в виде порошков, гранул, дробинок или плотных единиц. Тем не менее, удобрения также могут быть использованы в жидком виде, растворенные в водной среде. В этом случае, разбавленный водный аммиак может также быть использован в качестве азотного удобрения. Другие возможные ингредиенты для удобрений описаны, например, в Ullmann's Encyclopedia of Industrial Chemistry, 5th edition, 1987, volume A 10, pages 363 to 401, DE-A 4128828, DE-A 1905834 и DE-A 19631764.
Общий состав удобрений, которые, в рамках настоящего изобретения, могут иметь форму простых и/или сложных удобрений, например, состоящих из азота, калия или фосфора, могут изменяться в широком диапазоне. В целом, содержание 1 до 30% по массе азота (предпочтительно от 5 до 20% по массе), от 1 до 20% по массе калия (предпочтительно от 3 до 15% по массе) и содержание 1 до 20% по массе фосфора (предпочтительно от 3 до 10% по массе) является предпочтительным. Содержание микроэлементов, как правило, в м.д. Диапазон, предпочтительно, в диапазоне от 1 до 1000 м.д.
В контексте настоящего изобретения, удобрение и активное соединение формулы (I), можно вводить одновременно, т.е. синхронно. Тем не менее также возможно сначала применить удобрение и затем активное соединение формулы (I), или сначала применить активное соединение формулы (I) и затем удобрение. В случае асинхронного применения активного соединения формулы (I) и удобрения, применение в рамках настоящего изобретения, однако, осуществляется в функциональной связи, в частности, в течение периода от в целом 24 часов, предпочтительно 18 часов, особенно предпочтительно 12 часов, в частности 6 часов, а более конкретно 4 часа, еще более конкретно в течение 2 часов. В очень конкретных вариантах осуществления настоящего изобретения, активные соединения общей формулы (I) согласно настоящему изобретению и удобрения применяются в сроки менее 1 часа, предпочтительно менее чем за 30 минут, более предпочтительно менее чем за 15 минут.
Кроме того, можно приготовить размерно стабильные смеси, например, в виде стержней, гранул, таблеток и т.д., исходя из, по меньшей мере, одного активного соединения которое используют в соответствии с изобретениями и, по меньшей мере, одно удобрение. Для приготовления соответствующей размерно стабильной смеси, соответствующие компоненты могут быть смешаны друг с другом и, необязательно, экструдированы, или, по меньшей мере, одно активное соединение формулы (I) которое используют в соответствии с изобретением может быть применено к удобрению. При необходимости, применение может также быть осуществлено из композиции вспомогательных веществ в стабильные по размерам смеси, например, наполнители или адгезивы, чтобы достичь размерной стабильности полученной смеси. В силу соответствующего стабильного размера, соответствующие смеси являются особенно подходящими для использования в области "Дом и Сад", то есть для частных пользователей или садовника, для которого это хобби, который может использовать размерно стабильную смесь или ее компоненты в предварительно определенном, очевидно определенном количестве и без особых средств.
Независимо от этого, смеси, содержащие, по меньшей мере, одно из активных соединений, которые используют в соответствии с изобретением и, по меньшей мере, одно удобрение может также присутствовать в форме жидкости, такой, что - например, в случае профессиональных пользователей в области сельского хозяйства - в результате смесь может быть применена в качестве баковой смеси.
Благодаря использованию, по меньшей мере, одного из активных соединений которые используют в соответствии с изобретением и, по меньшей мере, одного удобрения, можно добиться увеличения роста корней, которые, в свою очередь, позволяют большее поглощение питательных веществ и тем самым способствуют росту растений.
Активные соединения, которые используют в соответствии с изобретением, при необходимости в сочетании с удобрениями, предпочтительно могут быть использованы в следующих растениях, перечень которых не является ограничивающим.
Предпочтительными растениями являются те, которые из группы полезных растений, декоративных газонов, обычно используемых деревьев, которые используются в качестве декоративных растений в общественных и бытовых секторах, и деревья лесного хозяйства. Деревья лесного хозяйства включают деревья для производства древесины, целлюлозы, бумаги и изделий из частей деревьев.
Термин полезные растения, как используется в данном контексте, относится к культурным растениям, которые используются в установках для получения пищевых продуктов, кормов, топлива или для промышленных целей.
Полезные растения включают, например, следующие виды растений: газон, виноградники, зерновые, например, пшеница, ячмень, рожь, овес, тритикале, рис, кукуруза и просо/сорго; свекла, например, сахарная свекла и кормовая свекла; фрукты, например, семечковые плоды, косточковые и фрукты, например, яблоки, груши, сливы, персики, миндаль, вишня и ягоды, например, земляника, малина, ежевика; бобовые, например, фасоль, чечевица, горох и соевые бобы; масличные культуры, например, рапс, горчица, мак, олива, подсолнух, кокосы, клещевина, какао-бобы и арахис; тыквенные, например, тыква/сквош, огурцы и дыня; волокнистые растения, например, хлопок, лен, конопля и джут; цитрусовые, например, апельсины, лимоны, грейпфруты и мандарины; овощи, например, шпинат, салат, спаржа, виды капусты, морковь, лук, помидоры, картофель и сладкий перец; лавровые, например, авокадо, корица, камфора, или же растения такие как табак, орехи, кофе, баклажаны, сахарный тростник, чай, перец, виноград, хмель, бананы, латексные растения и декоративные цветы, например, кустарники, лиственные деревья и хвойные деревья, такие как хвойные. Этот перечень не является ограничением.
Особенно подходящие целевые культуры являются растениями ниже: хлопок, баклажан, торф, семечковые фрукты, косточковые плоды, ягоды, кукуруза, пшеница, ячмень, огурец, табак, виноград, рис, злаки, груша, фасоль, соевые бобы, рапс, помидоры, перец, дыня, капуста, картофель и яблоки.
Примеры деревьев включают: Abies sp., Eucalyptus sp., Picea sp., Pinus sp., Aesculus sp., Platanus sp., Tilia sp., Acer sp., Tsuga sp., Fraxinus sp., Sorbus sp., Betula sp., Crataegus sp., Ulmus sp., Quercus sp., Fagus sp., Salix sp., Populus sp.
Предпочтительные деревья, которые могут быть указаны, представляют собой породы деревьев Aesculus: A. hippocastanum, A. pariflora, A. carnea; породы деревьев Platanus: P. aceriflora, P. occidentalis, Р. racemosa; породы деревьев Picea: P. abies; породы деревьев Pinus: Р. radiate, Р. ponderosa, Р. contorta, P. sylvestre, Р. elliottii, P. montecola, P. albicaulis, Р. resinosa, Р. palustris, P. taeda, P. flexilis, Р. jeffregi, P. baksiana, P. strobes; породы деревьев Eucalyptus: E. grandis, E. globulus, E. camadentis, E. nitens, E. obliqua, E. regnans, E. pilularus.
Особенно предпочтительные деревья, которые могут быть указаны, представляют собой: породы деревьев Pinus: Р. radiate, Р. ponderosa, Р. contorta, Р. sylvestre, P. strobes; породы деревьев Eucalyptus: E. grandis, E. globulus, E. camadentis.
Очень особенно предпочтительные деревья, которые могут быть указаны, представляют собой: конский каштан, Platanaceae, липу, клен.
Настоящее изобретение также может быть применено к любой газонной траве, в том числе газонной траве холодного сезона и газонной траве теплого сезона. Примерами газонной травы холодного сезона являются мятник (Роа spp) например, мятлик луговой (Роа pratensis L.), мятлик обыкновенный (Роа trivialis L.), мятлик сплюснутый (Роа compressa L.), мятлик однолетний (Роа annua L.), мятлик горный (Роа glaucantha Gaudin), мятлик лесной (Роа nemoralis L.) и мятлик луковичный (Роа bulbosa L.); полевица (Agrostis spp.) такие как полевица болотная (Agrostis palustris Huds.), полевица тонкая (Agrostis tenuis Sibth.), полевица собачья (Agrostis canina L.), южно-немецкая смешанная полевица (Agrostis spp.включая Agrostis tenius Sibth., Agrostis canina L., и Agrostis palustris Huds.), и полевица белая (Agrostis alba L.);
Овсяницы (Festuca spp.), такие как овсяница красная (Festuca rubra L. spp. rubra), ползучая овсяница (Festuca rubra L.), скученная овсяница (Festuca rubra commutata Gaud.), овечья овсяница (Festuca ovina L.), жестковатая овсяница (Festuca longifolia Thuill.), аметистовая овсяница (Festucu capillata Lam.), тростниковая овсяница (Festuca arundinacea Schreb.) и луговая овсяница (Festuca elanor L.);
плевел (Lolium spp.), такой как жесткий плевел (Lolium multiflorum Lam.), многолетний плевел (Lolium perenne L.) и многоцветковой плевел (Lolium multiflorum Lam.);
и пырей (Agropyron spp.), такой как пустынный пырей (Agropyron cristatum (L.) Gaertn.), гребенчатый пырей (Agropyron desertorum (Fisch.) Schult.) и пырей Смита (Agropyron smithii Rydb.).
Примерами дополнительных видов газонной травы холодного сезона являются песколюбка (Ammophila breviligulata Fern.), кострец безостый (Bromus inermis Leyss.), рогоз, такой как рогоз тимоти (Phleum pratense L.), рогоз песчаный (Phleum subulatum L.), ежа сборная (Dactylis glomerata L.), бескильница (Puccinellia distans (L.) Parl.) и гребенник обыкновенный (Cynosurus cristatus L.).
Примерами видов газонной травы теплого сезона являются свинорой (Cynodon spp. L.С. Rich), цойсия японская (Zoysia spp. Willd.), августинова трава (Stenotaphrum secundatum Walt Kuntze), эремохлоа (Eremochloa ophiuroides Munro Hack.), аксонопус афинский (Axonopus affinis Chase), гречка заметная (Paspalum notatum Flugge), кикуйя (Pennisetum clandestinum Hochst, ex Chiov.), бизонова трава (Buchloe dactyloids (Nutt.) Engelm.), голубая бутелоуа (Bouteloua gracilis (H.B.K.) Lag. ex Griffiths), паспалум (Paspalum vaginatum Swartz) и бутелоуа коротконисходящая (Bouteloua curtipendula (Michx. Torr.). Газонные травы холодного сезона обычно предпочтительны для использования в соответствии с настоящим изобретением. Особое предпочтение отдается мятлику, полевице и полевице белой, овсяницам и плевелу. Полевицы является особенно предпочтительными.
Активные соединения формулы (I), и их композиции пригодны для борьбы с вредителями в сфере гигиены. В частности, изобретение может быть применено в бытовом секторе, в области гигиены и в защите хранящихся продуктов, особенно для борьбы с насекомыми, паукообразными и клещами, которые встречаются в закрытых помещениях, таких как жилые, производственные залы, офисы, кабины транспортных средств. Для борьбы с животными вредителями, активные соединения или композиции используют отдельно или в сочетании с другими биологически активными веществами и/или вспомогательными средствами. Они предпочтительно используются в отечественных продуктах инсектицидов. Активные соединения согласно изобретению являются эффективными против чувствительных и резистентных видов, и в отношении всех стадий развития.
Эти вредители включают, например, вредителей из класса Arachnida, из отрядов Scorpiones, Araneae и Opiliones, из классов Chilopoda и Diplopoda, из класса Inserta отряд Blattodea, из отрядов Coleoptera, Dermaptera, Diptera, Heteroptera, Hymenoptera, Isoptera, Lepidoptera, Phthiraptera, Psocoptera, Saltatoria или Orthoptera, Siphonaptera и Zygentoma и из класса Malacostraca отряд Isopoda.
Они используются, например, в аэрозолях, продуктах распыления без давления, например, насосные и распылительные спреи, автоматические системы туманообразования, увлажнители, пены, гели, продукты испарения с испарительными таблетками из целлюлозы или пластика, жидкие испарители, гелевые и мембранные испарители, винтовые испарители, не требующие заряда, или пассивные системы испарения, нафталиновые бумажки, нафталиновые пакетики и нафталиновые гели, в виде гранул или пыли, в приманках для распространения или в местах наживки.
Кроме того, активные соединения формулы (I), могут быть использованы для борьбы с множеством различных вредителей, в том числе, например, вредными сосущими насекомыми, кусающими насекомыми и другими вредителями, которые паразитируют на растении, вредителями хранящегося материала, вредителями, которые уничтожают промышленный материал, и гигиеническими вредителями, в том числе паразитами в секторе здоровья животных, и для борьбы с ними, например, их удаления и ликвидации. Настоящее изобретение, таким образом, также включает в себя способ для борьбы с вредителями.
В области здоровья животных, то есть в области ветеринарной медицины, активные соединения согласно настоящему изобретению являются активными против животных паразитов, в частности эктопаразитов или эндопаразитов. Термин включает в себя эндопаразитов, в частности, гельминтов и простейших, таких как кокцидии. Эктопаразиты, как правило, и предпочтительно представляют собой членистоногих, в частности насекомых и клещей.
В области ветеринарной медицины соединения согласно изобретению являются пригодными, с благоприятной гомотермичной токсичностью, для борьбы с паразитами, которые встречаются в животноводстве и животноводстве скота, разведенных, зоопарковых, лабораторных, экспериментальных и домашних животных. Они активны в отношении всех или определенных стадий развития паразитов.
Сельскохозяйственные животные включают, например, млекопитающих, таких как овцы, козы, лошади, ослы, верблюды, буйволы, кролики, олени, лань, и в частности крупный рогатый скот и свиней; или птиц, таких как индюки, утки, гуси, и в частности курей; или рыбу или ракообразных например, в области аквакультуры; или, в случае, могут быть насекомые, такие как пчелы.
Домашние животные включают, например, млекопитающих, таких как хомяки, морские свинки, крысы, мыши, шиншиллы, хорьки или, в частности, собаки, кошки; птицы клеточного содержания; рептилии; амфибии или аквариумные рыбки.
В соответствии с предпочтительным вариантом осуществления, соединения согласно настоящему изобретению вводят млекопитающим.
Согласно другому предпочтительному варианту осуществления изобретения соединения в соответствии с изобретением вводят птицам, а именно птицам клеточного содержания или домашней птице, в частности.
При использовании активных соединений в соответствии с изобретением для борьбы с животными паразитами, они предназначены для уменьшения или предотвращения болезни, случая гибели и снижения производительности (в случае мяса, молока, шерсти, кожи, яиц, меда и т.п.), так что более экономичное и простое содержание животных стало возможным и лучшее благополучие животного достижимо.
Термин "борьба" или "контроль", используемый здесь по отношению к области здоровья животных, означает, что активные соединения являются эффективными в снижении частоты соответствующего паразита в организме животного, инфицированного такими паразитами до безвредных уровней. Более конкретно, "борьба", как использовано здесь, означает, что активное соединение является эффективным в уничтожении соответствующего паразита, ингибировании его роста, или ингибировании его распространения.
Примеры членистоногих включают, без каких-либо ограничений:
из отряда Anoplurida, например, Haematopinus spp., Linognathus spp., Pediculus spp., Phtirus spp., Solenopotes spp.; из отряда Mallophagida и под-отрядов Amblycerina и Ischnocerina, например, Trimenopon spp., Menopon spp., Trinoton spp., Bovicola spp., Werneckiella spp., Lepikentron spp., Damalina spp., Trichodectes spp., Felicola spp.; из отряда Diptera и под-отрядов Nematocerina и Brachycerina, например, Aedes spp., Anopheles spp., Culex spp., Simulium spp., Eusimulium spp., Phlebotomus spp., Lutzomyia spp., Culicoides spp., Chrysops spp., Odagmia spp., Wilhelmia spp., Hybomitra spp., Atylotus spp., Tabanus spp., Haematopota spp., Philipomyia spp., Braula spp., Musca spp., Hydrotaea spp., Stomoxys spp., Haematobia spp., Morellia spp., Fannia spp., Glossina spp., Calliphora spp., Lucilia spp., Chrysomyia spp., Wohlfahrtia spp., Sarcophaga spp., Oestrus spp., Hypoderma spp., Gasterophilus spp., Hippobosca spp., Lipoptena spp., Melophagus spp., Rhinoestrus spp., Tipula spp.; из отряда Siphonapterida, например, Pulex spp., Ctenocephalides spp., Tunga spp., Xenopsylla spp., Ceratophyllus spp.; из отряда Geteropterida, например, Cimex spp., Triatoma spp., Rhodnius spp., Panstrongylus spp.; a также мешающие гигиене вредители из отряда Blattarida.
Кроме того, среди членистоногих, следующие клещи могут быть упомянуты в качестве примера, без каких-либо ограничений:
Из под-класса склещей (Acarina) и из отряда Metastigmata, например, из семейства Argasidae, как Argas spp., Ornithodorus spp., Otobius spp., из семейства Ixodidae, как Ixodes spp., Amblyomma spp., Rhipicephalus (Boophilus) spp Dermacentor spp., Haemophysalis spp., Hyalomma spp., Rhipicephalus spp. (оригинальный вид мульти-хоста клещей); из отряда mesostigmata, как Dermanyssus spp., Ornithonyssus spp., Pneumonyssus spp., Raillietia spp., Pneumonyssus spp., Sternostoma spp., Varroa spp., Acarapis spp.; из отряда Actinedida (Prostigmata), например, Acarapis spp., Cheyletiella spp., Ornithocheyletia spp., Myobia spp., Psorergates spp., Demodex spp., Trombicula spp., Neotrombiculla spp., Listrophorus spp.; и из отряда Acaridida (Astigmata), например, Acarus spp., Tyrophagus spp., Caloglyphus spp., Hypodectes spp., Pterolichus spp., Psoroptes spp., Chorioptes spp., Otodectes spp., Sarcoptes spp., Notoedres spp., Knemidocoptes spp., Cytodites spp., Laminosioptes spp.
Примеры паразитических простейших включают, без каких-либо ограничений:
Mastigophora (Flagellata), такие как, например, Trypanosomatidae, например, Trypanosoma b. brucei, T.b. gambiense, T.b. rhodesiense, T. congolense, T. cruzi, T. evansi, T. equinum, T. lewisi, Т. percae, T. simiae, T. vivax, Leishmania brasiliensis, L. donovani, L. tropica, такие как, например, Trichomonadidae, например, Giardia lamblia, G. canis.
Sarcomastigophora (Rhizopoda), такие как Entamoebidae, например, Entamoeba histolytica, Hartmanellidae, например, Acanthamoeba sp., Harmanella sp.
Apicomplexa (Sporozoa), такие как Eimeridae, например, Eimeria acervulina, E. adenoides, E. alabamensis, E. anatis, E. anserina, E. arloingi, E. ashata, E. auburnensis, E. bovis, E. brunetti, E. canis, E. chinchillae, E. clupearum, E. columbae, E. contorta, E. crandalis, E. debliecki, E. dispersa, E. ellipsoidales, E. falciformis, E. faurei, E. flavescens, E. gallopavonis, E. hagani, E. intestinalis, E. iroquoina, E. irresidua, E. labbeana, E. leucarti, E. magna, E. maxima, E. media, E. meleagridis, E. meleagrimitis, E. mitis, E. necatrix, E. ninakohlyakimovae, E. ovis, E. parva, E. pavonis, E. perforans, E. phasani, E. piriformis, E. praecox, E. residua, E. scabra, E. spec., E. stiedai, E. suis, E. tenella, E. truncata, E. truttae, E. zuernii, Globidium spec., Isospora belli, I. canis, I. felis, I. ohioensis, I. rivolta, I. spec., I. suis, Cystisospora spec., Cryptosporidium spec., в частности С. parvum; такие как Toxoplasmadidae, например, Toxoplasma gondii, Hammondia heydornii, Neospora caninum, Besnoitia besnoitii; такие как Sarcocystidae, например, Sarcocystis bovicanis, S. bovihominis, S. ovicanis, S. ovifelis, S. neurona, S. spec., S. suihominis, такие как Leucozoidae, например, Leucozytozoon simondi, такие как Plasmodiidae, например, Plasmodium berghei, P. falciparum, P. malariae, P. ovale, P. vivax, P. spec., такие как Piroplasmea, например, Babesia argentina, B. bovis, B. canis, B. spec., Theileria parva, Theileria spec., такие как Adeleina, например, Hepatozoon canis, H. spec.
Примеры патогенных эндопаразитов, которые представляют собой гельминты, включают плоские черви (например, моногенетические сосальщики, цестоды и трематоды), нематоды, скребни и щитники. Дополнительные примеры гельминтов включают, без ограничения следующие:
Моногенетические сосальщики: например,: Gyrodactylus spp., Dactylogyrus spp., Polystoma spp;
Ленточные черви: из отряда Pseudophyllidea например: Diphyllobothrium spp., Spirometra spp., Schistocephalus spp., Ligula spp., Bothridium spp., Diplogonoporus spp;
Из отряда Cyclophyllida, например: Mesocestoides spp., Anoplocephala spp., Paranoplocephala spp., Moniezia spp., Thysanosoma spp., Thysaniezia spp., Avitellina spp., Stilesia spp., Cittotaenia spp., Andyra spp., Bertiella spp., Taenia spp., Echinococcus spp., Hydatigera spp., Davainea spp., Raillietina spp., Hymenolepis spp., Echinolepis spp., Echinocotyle spp., Diorchis spp., Dipylidium spp., Joyeuxiella spp., Diplopylidium spp;
Трематоды: из класса Digenea например: Diplostomum spp., Posthodiplostomum spp., Schistosoma spp., Trichobilharzia spp., Ornithobilharzia spp., Austrobilharzia spp., Gigantobilharzia spp., Leucochloridium spp., Brachylaima spp., Echinostoma spp., Echinoparyphium spp., Echinochasmus spp., Hypoderaeum spp., Fasciola spp., Fasciolides spp., Fasciolopsis spp., Cyclocoelum spp., Typhlocoelum spp., Paramphistomum spp., Calicophoron spp., Cotylophoron spp., Gigantocotyle spp., Fischoederius spp., Gastrothylacus spp., Notocotylus spp., Catatropis spp., Plagiorchis spp., Prosthogonimus spp., Dicrocoelium spp., Eurytrema spp., Troglotrema spp., Paragonimus spp., Collyriclum spp., Nanophyetus spp., Opisthorchis spp., Clonorchis spp. Metorchis spp., Heterophyes spp., Metagonimus spp;
Нематоды: Trichinellida например: Trichuris spp., Capillaria spp., Trichomosoides spp., Trichinella spp;
Из отряда Tylenchida например: Micronema spp., Strongyloides spp;
Из отряда Rhabditina например: Strongylus spp., Triodontophorus spp., Oesophagodontus spp., Trichonema spp., Gyalocephalus spp., Cylindropharynx spp., Poteriostomum spp., Cycloсосеrсus spp., Cylicostephanus spp., Oesophagostomum spp., Chabertia spp., Stephanurus spp., Ancylostoma spp., Uncinaria spp., Bunostomum spp., Globocephalus spp., Syngamus spp., Cyathostoma spp., Metastrongylus spp., Dictyocaulus spp., Muellerius spp., Protostrongylus spp., Neostrongylus spp., Cystocaulus spp., Pneumostrongylus spp., Spicocaulus spp., Elaphostrongylus spp. Parelaphostrongylus spp., Crenosoma spp., Paracrenosoma spp., Angiostrongylus spp., Aelurostrongylus spp., Filaroides spp., Parafilaroides spp., Trichostrongylus spp., Haemonchus spp., Ostertagia spp., Marshallagia spp., Cooperia spp., Nematodirus spp., Hyostrongylus spp., Obeliscoides spp., Amidostomum spp., Ollulanus spp;
Из отряда Spirurida, например: Oxyuris spp., Enterobius spp., Passalurus spp., Syphacia spp., Aspiculuris spp., Heterakis spp.; Ascaris spp., Toxascaris spp., Тоxосаrа spp., Baylisascaris spp., Parascaris spp., Anisakis spp., Ascaridia spp.; Gnathostoma spp., Physaloptera spp., Thelazia spp., Gongylonema spp., Habronema spp., Parabronema spp., Draschia spp., Dracunculus spp.; Stephanofilaria spp., Parafilaria spp., Setaria spp., Loa spp., Dirofilaria spp., Litomosoides spp., Brugia spp., Wuchereria spp., Onchocerca spp;
Скребни: из отряда Oligacanthorhynchida, например: Macracanthorhynchus spp., Prosthenorchis spp.; из отряда Polymorphida, например: Filicollis spp.; из отряда Moniliformida, например: Moniliformis spp;
Из отряда Echinorhynchida, например, Acanthocephalus spp., Echinorhynchus spp., Leptorhynchoides spp.
Pentastoma: из отряда Porocephalida, например, Linguatula spp.
В области ветеринарии и содержании животных, введение активных соединений в соответствии с изобретением осуществляют способами, обычно известными в данной области, такими как: энтерально, парентерально, через кожу или через нос в виде подходящих препаратов. Введение может осуществляться профилактически или терапевтически.
Таким образом, один вариант осуществления настоящего изобретения относится к соединениям согласно настоящему изобретению для применения в качестве лекарственного средства.
Другой аспект относится к соединениям согласно изобретению для применения в качестве антиэндопаразитического агента, в частности гельминтицидного агента или антипротозойного агента. Например, соединения согласно настоящему изобретению для применения в качестве антиэндопаразитического агента, в частности гельминтицидного агента или антипротозойного агента, например, в животноводстве, в содержании животных, в удержании животных в помещениях, в области гигиены.
Еще один аспект относится к соединениям согласно изобретению для применения в качестве антиэктопаразитарного агента, в частности агента против членистоногих, такой как инсектицидный агент или акарицидный агент. Например, соединения согласно изобретению для применения в качестве антиэктопаразитарного агента, в частности агента против членистоногих, такой как инсектицидный агент или акарицидный агент, например, в животноводстве, в содержании животных, в удержании животных в помещениях, в области гигиены.
Активные соединения формулы (I) и композиции, содержащие их, являются подходящими для защиты промышленных материалов от атаки или разрушения насекомыми, например, из отрядов Coleoptera, Hymenoptera, Isoptera, Lepidoptera, Psocoptera и Zygentoma.
Промышленные материалы в данном контексте следует понимать как неодушевленные материалы, такие как предпочтительно пластмассы, клеи, емкости, бумаги и карты, кожаные, деревянные, обработанные лесоматериалы и покрытия. Использование изобретения для защиты древесины является особенно предпочтительным.
В одном варианте осуществления в соответствии с изобретением, композиции согласно изобретению содержат, по меньшей мере, один дополнительный инсектицид и/или, по меньшей мере, один фунгицид.
В дополнительном варианте осуществления, эта композиция согласно изобретению представляет собой композицию, готовую к использованию, то есть она может быть применена к материалу, о котором идет речь без дальнейших модификаций. Соответствующие дополнительные инсектициды или фунгициды представляют собой те, что упомянуты выше.
Неожиданно также было обнаружено, что активные соединения и композиции согласно изобретению могут быть использованы для защиты объектов, которые вступают в контакт с соленой или солоноватой водой, в частности корпусов, экранов, сеток, зданий, причалов и сигнальных систем против обрастания. Подобным образом, активные соединения и композиции согласно изобретению могут быть использованы отдельно или в комбинации с другими активными веществами в качестве противообрастающих композиций.
Получение и примеры применения, которые следуют далее, иллюстрируют изобретение, не ограничивая его.
Примеры получения
Пример синтеза 1
2-бром-N-[1-(2-метилфенил)-1Н-пиразол-3-ил]бензамид (соединение I-1-1 в таблице 1)

1-(2-метилфенил)-1Н-пиразол-3-амин (255 мг) изначально загружали в N,N-диметилформамид (2 мл), 2-(7-аза-1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилуроний гексафторфосфат (482 мг) и диизопропилэтиламин (0.59 мл) добавляли при комнатной температуре и смесь перемешивали в течение 1 часа. Раствор 2-бромбензойной кислоты (200 мг) в N,N-диметилформамиде (1 мл) затем добавляли, и смесь перемешивали в течение дополнительных 2 часов. Ледяную воду затем добавляли, и реакционную смесь экстрагировали с помощью дихлорметана. Объединенные органические фазы с избытком промывали с помощью раствора бикарбоната натрия, воды и насыщенного раствора хлорида натрия, сушили над сульфатом натрия и концентрировали до сухого состояния при сниженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле с использованием мобильной фазы петролейный эфир/этилацетат (изократически с 12% этилацетата в петролейном эфире). Это обеспечило 150 мг соединения, указанного в заголовке. ВЭЖХ-МС: logP=2.79; масс (m/z): 356.0 (М+Н)+;1Н-ЯМР (ДМСО-D6) 2.26 (s, 3Н), 6.87 (d, 1H), 7.32-7.42 (m, 5Н), 7.44-7.48 (m, 1Н), 7.52-7.54 (m, 1Н), 7.68-7.70 (m, 1Н), 7.98 (d, 1H), 11.13 (br. s, 1Н).
Пример синтеза 2
2-хлор-N-[1-(2,6-диметилфенил)-1Н-пиразол-3-ил]бензамид (соединение I-1-61 в Таблице 1)
Стадия 1: 1-(2,6-диметилфенил)-1Н-пиразол-3-амин (через путь В-1)

2,6-диметилфенилгидразин гидрохлорид (3.50 г) изначально загружали в этанол (30 мл), раствор метоксида натрия (3.29 г в 20 мл этанола) и 3-этоксиакрилонитрила (2.95 г) добавляли и смесь нагревали с обратным холодильником в течение 9 часов и затем перемешивали при комнатной температуре в течение ночи. Реакционную смесь затем концентрировали при сниженном давлении, разводили в этилацетате, промывали с помощью воды, сушили над сульфатом натрия и концентрировали до сухого состояния при сниженном давлении. Остаток изначально очищали с помощью колоночной хроматографии на силикагеле с использованием мобильной фазы циклогексан/этилацетат (градиент = 2 г от 100% циклогексан до 100% этилацетата) и затем подвергали хроматографированию с помощью препаративной ВЭЖХ с использованием мобильной фазы воды/ацетонитрила (градиент = 40 мин от 10% ацетонитрила в воде до 100% ацетонитрила). Это обеспечило 39 мг соединения, указанного в заголовке. ВЭЖХ-МС: logP=0.62; масс (m/z): 188.1 (М+Н)+;1Н-ЯМР (CD3CN) 2.00 (s, 6Н), 4.03 (br. s, 2Н), 5.57 (d, 1Н), 7.21-7.23 (m, 2H), 7.30-7.33 (m, 1H), 7.36 (d, 1H).
Стадия 2: 2-хлор-N-[1-(2,6-диметилфенил)-1Н-пиразол-3-ил]бензамид
1-(2,6-диметилфенил)-1Н-пиразол-3-амин (37 мг) изначально загружали в дихлорметан (2 мл), триэтиламин (0.14 мл) и раствор 2-хлорбензоил хлорида (35 мг) в дихлорметане (1 мл) добавляли при 0°С и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь затем разбавляли с помощью дихлорметана, промывали с помощью воды, сушили над сульфатом натрия и концентрировали до сухого состояния при сниженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле с использованием мобильной фазы циклогексан/этилацетат (градиент = 2 г от 100% циклогексана до 100% этилацетата). Это обеспечило 15 мг соединения, указанного в заголовке. ВЭЖХ-МС: logP=2.63; масс (m/z): 324.1 (М+Н)+;1Н-ЯМР (CD3CN) 1.96 (s, 6Н), 6.71 (d, 1H), 7.18-7.20 (m, 2H), 7.29-7.44 (m, 6H), 7.65-7.66 (d, 1H), 8.46 (br. s, 1H).
Пример синтеза 3
2-6ром-N-[1-(2,3-дифторфенил)-1Н-пиразол-3-ил]бензамид (соединение I-1-63 в таблице 1)
Стадия 1: 1-(2,3-дифторфенил)-1Н-пиразол-3-амин (через путь В-1)

2,3-дифторфенилгидразин гидрохлорид (5.00 г) изначально загружали в этанол (30 мл), раствор метоксида натрия (4.49 г в 20 мл этанола) и 3-этоксиакрилонитрил (4.03 г) добавляли и смесь нагревали с обратным холодильником в течение ночи. Реакционную смесь затем концентрировали при сниженном давлении, разводили в этилацетате, промывали с помощью воды, сушили над сульфатом натрия и концентрировали до сухого состояния при сниженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле с использованием мобильной фазы циклогексан/этилацетат (градиент = 2 г от 100% циклогексана до 100% этилацетата). Это обеспечило 1.79 г соединения, указанного в заголовке. ВЭЖХ-МС: logP=1.56; масс (m/z): 196.0 (М+Н)+;1Н-ЯМР (CD3CN) 4.26 (br. s, 2Н), 5.89 (d, 1Н), 7.05-7.12 (m, 1Н), 7.16-7.22 (m, 1Н), 7.54-7.59 (m, 1H), 7.82-7.84 (m, 1Н). 193 мг 1-(2-этокси-3-фторфенил)-1Н-пиразол-3-аминаполучали в форме побочного продукта: ВЭЖХ-МС: logP=2.04; масс (m/z): 222.1 (М+Н)+;1Н-ЯМР (CD3CN) 1.32 (t, 3Н), 4.08 (q, 2Н), 4.56 (br. s, 2Н), 4.65 (d, 1Н), 7.00-7.11 (m, 3Н), 7.46 (d, 1Н).
Стадия 2: 2-бром-N-[1-(2,3-дифторфенил)-1Н-пиразол-3-ил]бензамид
1-(2,3-дифторфенил)-1Н-пиразол-3-амин (100 мг) изначально загружали в дихлорметан (2 мл), триэтиламин (0.36 мл) и раствор 2-бромбензоил хлорида (113 мг) в дихлорметане (1 мл) добавляли при 0°С и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь затем разбавляли с помощью дихлорметана, промывали с помощью воды, сушили над сульфатом натрия и концентрировали до сухого состояния при сниженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле с использованием мобильной фазы циклогексан/этилацетат (градиент = 2 г от 100% циклогексана до 100% этилацетата). Это обеспечило 116 мг соединения, указанного в заголовке. ВЭЖХ-МС: logP=2.97; масс (m/z): 376.0 (М+Н)+;1Н-ЯМР (CD3CN) 7.03-7.04 (m, 1H), 7.20-7.29 (m, 2Н), 7.36-7.47 (m, 2Н), 7.53-7.58 (m, 2Н), 7.66-7.68 (m, 1Н), 8.03-8.04 (m, 1H), 9.30 (br. s, 1Н).
Пример синтеза 4
N-[1-(2,5-дифторфенил)-1Н-пиразол-3-ил]-5-фтор-1-метил-3-(трифторметил)-1Н-пиразол-4-карбоксамид (соединение I-1-72 в Таблице 1)
Стадия 1: 1-(2,5-дифторфенил)-1Н-пиразол-3-амин(через путь В-1)

2,5-дифторфенилгидразин (3.62 г) изначально загружали в этанол (10 мл), раствор метоксида натрия (4.07 г в 10 мл этанола) и 3-этоксиакрилонитрил (3.66 г) добавляли и смесь нагревали с обратным холодильником в течение ночи. Реакционную смесь затем концентрировали при сниженном давлении, разводили в этилацетате, промывали с помощью воды, сушили над сульфатом натрия и концентрировали до сухого состояния при сниженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле с использованием мобильной фазы циклогексан/этилацетат (градиент = 2 г от 100% циклогексана до 100% этилацетата). Это обеспечило 2.88 г соединения, указанного в заголовке. ВЭЖХ-МС: logP=1.58; масс (m/z): 196.1 (М+Н)+;1Н-ЯМР (CD3CN) 4.26 (br. s, 2Н), 5.87 (d, 1Н), 6.87-6.93 (m, 1Н), 7.21-7.28 (m, 1Н), 7.53-7.58 (m, 1H), 7.86-7.88 (m, 1Н).
Стадия 2: Н-[1-(2,5-дифторфенил)-1Н-пиразол-3-ил]-5-фтор-1-метил-3-(трифторметил)-1Н-пиразол-4-карбоксамид
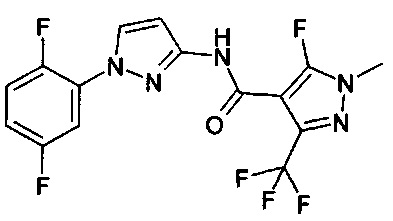
5-фтор-1-метил-3-(трифторметил)-1Н-пиразол-4-карбоновую кислоту (130 мг) изначально загружали в дихлорметан (4 мл), 1-этил-3-(3-диметиламинопропил)карбодиимид (147 мг) и 1-гидрокси-1-Н-бензотриазол (104 мг) добавляли при 0°С и смесь перемешивали в течение 30 мин. Раствор 1-(2,5-дифторфенил)-1Н-пиразол-3-амина (100 мг) в дихлорметане (1 мл) затем добавляли, и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь затем разбавляли с помощью дихлорметана, промывали с помощью воды, сушили над сульфатом натрия и концентрировали до сухого состояния при сниженном давлении. Остаток изначально очищали с помощью колоночной хроматографии на силикагеле с использованием мобильной фазы циклогексан/этилацетат (градиент = 2 г от 100% циклогексана до 100% этилацетата) и затем подвергали хроматографированию с помощью препаративной ВЭЖХ с использованием мобильной фазы вода/ацетонитрил (градиент = 40 мин от 10% ацетонитрила вводе до 100% ацетонитрила). Это обеспечило 16 мг соединения, указанного в заголовке. ВЭЖХ-МС: logP=2.93; масс (m/z): 390.1 (М+Н)+;1Н-ЯМР (CD3CN) 3.85 (s, 3Н), 6.97 (d, 1Н), 7.07-7.14 (m, 1H), 7.34-7.40 (m, 1H), 7.61-7.66 (m, 1H), 8.09-8.10 (m, 1H), 9.08 (br. s, 1H).
Пример синтеза 5
2-хлор-N-[1-(2-этокси-6-фторфенил)-1Н-пиразол-3-ил]бензамид (соединение I-1-117 в Таблице 1)
Стадия 1: 1-(2-этокси-6-фторфенил)-1Н-пиразол-3 -амин (через путь В-1)
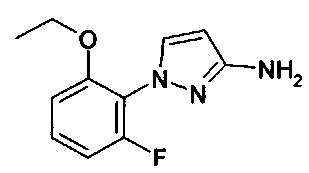
2,6-дифторфенилгидразин (5.00 г) изначально загружали в этанол (30 мл), раствор метоксида натрия (4.49 г в 20 мл этанола) и 3-этоксиакрилонитрила (4.03 г) добавляли и смесь нагревали с обратным холодильником в течение ночи. Реакционную смесь затем концентрировали при сниженном давлении, разводили в этилацетате, промывали с помощью воды, сушили над сульфатом натрия и концентрировали до сухого состояния при сниженном давлении. Остаток затем еще раз растворяли в этаноле (50 мл) и нагревали с обратным холодильником в течение последующей ночи. Реакционную смесь затем еще раз концентрировали при сниженном давлении, разводили в этилацетате, промывали с помощью воды, сушили над сульфатом натрия и концентрировали до сухого состояния при сниженном давлении. Остаток затем очищали с помощью колоночной хроматографии на силикагеле с использованием мобильной фазы циклогексан/этилацетат (градиент = 2 г от 100% циклогексана до 100% этилацетата). Это обеспечило 152 мг соединения, указанного в заголовке. ВЭЖХ-МС: logP=1.47; масс (m/z): 222.1 (М+Н)+;1Н-ЯМР (CD3CN) 1.27 (t, 3Н), 3.80-4.20 (m, 4H), 5.75 (d, 1H), 6.81-6.86 (m, 1H), 6.90-6.92 (m, 1H), 7.31-7.36 (m, 2H).
Стадия 2: 2-хлор-N-[1-(2-этокси-6-фторфенил)-1Н-пиразол-3-ил]бензамид

1-(2-этокси-6-фторфенил)-1Н-пиразол-3-амин (71 мг) изначально загружали в дихлорметан (2 мл), триэтиламин (0.22 мл) и раствор 2-хлорбензоил хлорида (56 мг) в дихлорметане (1 мл) добавляли при 0°С и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь затем разбавляли с помощью дихлорметана, промывали с помощью воды, сушили над сульфатом натрия и концентрировали до сухого состояния при сниженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле с использованием мобильной фазы циклогексан/этилацетат (градиент = 2 г от 100% циклогексана до 100% этилацетата). Это обеспечило 60 мг соединения, указанного в заголовке. ВЭЖХ-МС: logP=2.84; масс (m/z): 360.1 (М+Н)+;1Н-ЯМР (CD3CN) 1.30 (t, 3Н), 4.12 (q, 2Н), 6.89-7.00 (m, 3Н), 7.42-7.53 (m, 4Н), 7.61-7.62 (m, 1H), 7.66-7.67 (m, 1H), 9.31 (br. s, 1H).
Пример синтеза 6
2-бром-N-[1-(2,6-дифторфенил)-4,5-дигидро-1Н-пиразол-3-ил]бензамид (соединение I-4-2 в Таблице 2)
Стадия 1: 1-(2,6-дифторфенил)-4,5-дигидро-1Н-пиразол-3-амин (через путь С-1)

2,6-дифторфенилгидразин гидрохлорид (2.00 г) изначально загружали в этанол (20 мл), этоксид натрия (21%-ый в этаноле, 3.02 г) медленно добавляли по каплям при комнатной температуре, смесь перемешивали в течение 10 мин, акрилонитрил (0.80 мл) добавляли и смесь нагревали с обратным холодильником в течение ночи. Реакционную смесь затем концентрировали при сниженном давлении, разводили в дихлорметане, промывали с помощью воды, сушили над сульфатом натрия и концентрировали до сухого состояния при сниженном давлении. Осталось 1.40 г неочищенного вещества, которое использовали без дальнейшей очистки на следующей стадии.
Стадия 2: 2-бром-N-[1-(2,6-дифторфенил)-4,5-дигидро-1Н-пиразол-3-ил]бензамид

1-(2,6-дифторфенил)-4,5-дигидро-1Н-пиразол-3-амин (150 мг) изначально загружали в дихлорметан (2 мл), триэтиламин (0,32 мл) и раствор 2-бромбензоил хлорида (167 мг) в дихлорметане (1 мл) добавляли при 0°С и смесь перемешивали при 0°С в течение 6 часов и при комнатной температуре в течение ночи. Реакционную смесь затем разбавляли с помощью дихлорметана, промывали с помощью воды, сушили над сульфатом натрия и концентрировали до сухого состояния при сниженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле с использованием мобильной фазы циклогексан/этилацетат (градиент = 2 г от 100% циклогексана до 100% этилацетата). Это обеспечило 15 мг соединения, указанного в заголовке. ВЭЖХ-МС: logP=2.80; масс (m/z): 380.0 (М+Н)+;1Н-ЯМР (CD3CN) 3.45 (t, 2Н), 3.79 (t, 2Н), 6.93-7.01 (m, 2Н), 7.10-7.18 (m, 1H), 7.36-7.40 (m, 1H), 7.43-7.47 (m, 1H), 7.50-7.53 (m, 1H), 7.66-7.68 (m, 1H), 9.04 (br. s, 1H).
Пример синтеза 7
N-[1-(2,6-дифторфенил)-1Н-пиразол-3-ил]-3-(трифторметил)пиридин-2-карбоксамид (соединение I-1-91 в Таблице 1)
Стадия 1: N-[1-(2,6-дифторфенил)-4,5-дигидро-1Н-пиразол-3-ил]ацетамид
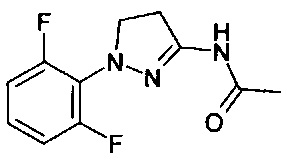
При охлаждении льдом, 1-(2,6-дифторфенил)-4,5-дигидро-1Н-пиразол-3-амин (1.40 г в виде неочищенной смеси из Примера синтеза 6, стадия 1) растворяли в уксусном ангидриде (6 мл) и перемешивали при комнатной температуре в течение ночи. Смесь затем разбавляли с помощью этилацетата, промывали с помощью воды, сушили над сульфатом натрия и концентрировали до сухого состояния при сниженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле с использованием мобильной фазы циклогексан/этилацетат (градиент = 2 г от 100% циклогексана до 100% этилацетата). Это обеспечило 537 мг соединения, указанного в заголовке. ВЭЖХ-МС: logP=1.46; масс (m/z): 240.0 (М+Н)+;1Н-ЯМР (ДМСО-D6) 1.99 (s, 3Н), 3.26 (t, 2Н), 3.65 (t, 2Н), 7.04-7.10 (m, 2Н), 7.11-7.18 (m, 1Н), 10.59 (br. s, 1Н).
Стадия 2: N-[1-(2,6-дифторфенил)-1Н-пиразол-3-ил]ацетамид

N-[1-(2,6-дифторфенил)-4,5-дигидро-1Н-пиразол-3-ил]ацетамид (200 мг) изначально загружали в 1,4-диоксан (1 мл), 2,3-дихлор-5,6-дициано-1,4-бензохинон (209 мг) добавляли и смесь перемешивали при комнатной температуре в течение 30 мин. Реакционную смесь фильтровали и фильтрат концентрировали до сухого состояния при сниженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле с использованием мобильной фазы циклогексан/этилацетат (градиент = 2 г от 100% циклогексана до 100% этилацетата). Это обеспечило 140 мг соединения, указанного в заголовке. ВЭЖХ-МС: logP=1.33; масс (m/z): 238.0 (М+Н)+;1Н-ЯМР (CD3CN) 2.07 (s, 3Н), 6.84 (d, 1Н), 7.14-7.20 (m, 2H), 7.47-7.53 (m, 1H), 7.65-7.66 (m, 1H), 8.76 (br. s, 1H).
Стадия 3: 1-(2,6-дифторфенил)-1Н-пиразол-3-амин (через путь D-1)
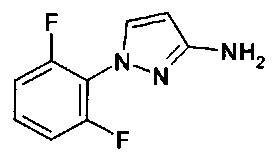
N-[1-(2,6-дифторфенил)-1Н-пиразол-3-ил]ацетамид (50 мг) изначально загружали в воду (1 мл), концентрированную соляную кислоту (0.07 мл) добавляли и смесь нагревали с обратным холодильником в течение 8 часов. Реакционную смесь затем подщелачивали с помощью концентрированного водного раствора гидроксида натрия и экстрагировали с помощью дихлорметана. Органическую фазу концентрировали до сухого состояния при сниженном давлении. Это обеспечило 25 мг соединения, указанного в заголовке. ВЭЖХ-МС: logP=1.13; масс (m/z): 196.1 (М+Н)+;1Н-ЯМР (CD3CN) 4.12 (br. s, 2Н), 5.83 (d, 1Н), 7.09-7.16 (m, 2H), 7.37-7.44 (m, 1H), 7.46-7.47 (m, 1H).
Стадия 4: N-[1-(2,6-дифторфенил)-1Н-пиразол-3-ил]-3-(трифторметил)пиридин-2-карбоксамид
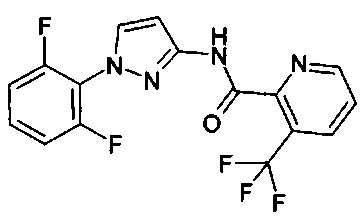
3-(трифторметил)пиридин-2-карбоновую кислоту (76 мг) изначально загружали в дихлорметан (2 мл), 1-этил-3-(3-диметиламинопропил)карбодиимид (95 мг) и 1-гидрокси-1Н-бензотриазол (67 мг) добавляли при 0°С и смесь перемешивали в течение 1 часа. Раствор 1-(2,6-дифторфенил)-1Н-пиразол-3-амина (66 мг) в дихлорметане (1 мл) затем добавляли, и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь затем разбавляли с помощью дихлорметана, промывали с помощью воды, сушили над сульфатом натрия и концентрировали до сухого состояния при сниженном давлении. Остаток изначально очищали с помощью колоночной хроматографии на силикагеле с использованием мобильной фазы циклогексан/этилацетат (градиент = 2 г от 100% циклогексана до 100% этилацетата) и затем подвергали хроматографированию с помощью препаративной ВЭЖХ с использованием мобильной фазы вода/ацетонитрил (градиент = 40 мин от 10% ацетонитрила в воде до 100% ацетонитрила). Это обеспечило 55 мг соединения, указанного в заголовке. ВЭЖХ-МС: logP=2.22; масс (m/z): 369.0 (М+Н)+;1Н-ЯМР (CD3CN) 6.98-6.99 (m, 1Н), 7.17-7.21 (m, 2H), 7.48-7.55 (m, 1H), 7.66-7.73 (m, 1H), 7.76-7.77 (m, 1H), 8.08-8.10 (m, 1H), 8.80-8.82 (m, 1H), 9.30 (br. s, 1H).
Пример синтеза 8
N-[1-(2,6-дихлорфенил)-1Н-пиразол-3-ил]-2-йодбензамид (соединение I-1-123 в Таблице 1)
Стадия 1: 1-(2,6-дихлорфенил)-1Н-пиразол-3-амин (через путь В-1)

2,6-дихлорфенилгидразин (10.0 г) изначально загружали в этанол (65 мл), раствор метоксида натрия (3.04 г в 35 мл этанола) и 3-этоксиакрилонитрил (6.82 г) добавляли, и смесь перемешивали при 80°С в течение 12 часов и при комнатной температуре в течение 2 дней. Реакционную смесь затем концентрировали при сниженном давлении, разводили в этилацетате, промывали с помощью воды, сушили над сульфатом натрия и концентрировали до сухого состояния при сниженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле с использованием мобильной фазы циклогексан/этилацетат (градиент = 2 г от 100% циклогексана до 100% этилацетата). Это обеспечило 832 мг соединения, указанного в заголовке. ВЭЖХ-МС: logP=1.47; масс (m/z): 228.1 (М+Н)+;1Н-ЯМР (CD3CN) 4.09 (br. s, 2Н), 5.81 (d, 1H), 7.35-7.43 (m, 2H), 7.51-7.53 (m, 2H).
Стадия 2: N-[1-(2,6-дихлорфенил)-1Н-пиразол-3-ил]-2-йодбензамид
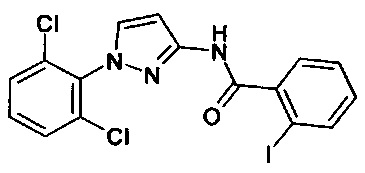
1-(2,6-дихлорфенил)-1Н-пиразол-3-амин (150 мг) изначально загружали в дихлорметан (2 мл), триэтиламин (0.28 мл) и раствор 2-йодбензоил хлорида (175 мг) в дихлорметане (1 мл) добавляли при 0°С и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь затем разбавляли с помощью дихлорметана, промывали с помощью воды, сушили над сульфатом натрия и концентрировали до сухого состояния при сниженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле с использованием мобильной фазы циклогексан/этилацетат (градиент = 2 г от 100% циклогексана до 100% этилацетата). Это обеспечило 150 мг соединения, указанного в заголовке. ВЭЖХ-МС: logP=3.04; масс (m/z): 457.9 (М+Н)+;1Н-ЯМР (CD3CN) 6.99-7.00 (m, 1Н), 7.18-7.23 (m, 1H), 7.46-7.52 (m, 3H), 7.56-7.58 (m, 2H), 7.66-7.67 (m, 1H), 7.94-7.96 (m, 1H), 9.16 (br. s, 1H).
Пример синтеза 9
N-[1-(3,5-дифторпиридин-2-ил)-1Н-пиразол-3-ил]-2,6-дифторбензамид (соединение I-1-146 в Таблице 1)
Стадия 1: 1-(3,5-дифторпиридин-2-ил)-1Н-пиразол-3-амин (через путь А-1)

1Н-пиразол-3-амин (1.80 г) изначально загружали в ацетонитрил (50 мл), 2,3,5-трифторпиридин (2.88 г) и карбонат калия (5.99 г) добавляли и смесь нагревали с обратным холодильником в течение ночи. Реакционную смесь затем концентрировали при сниженном давлении, разводили в дихлорметане, промывали с помощью воды, сушили над сульфатом натрия и концентрировали до сухого состояния при сниженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле с использованием мобильной фазы циклогексан/этилацетат (градиент = 2 г от 100% циклогексана до 100% этилацетата). Это обеспечило 610 мг соединения, указанного в заголовке. ВЭЖХ-МС: logP=0.81; масс (m/z): 197.1 (М+Н)+;1Н-ЯМР (CD3CN) 4.27 (br. s, 2Н), 5.88 (d, 1Н), 7.56-7.62 (m, 1H), 7.99-8.00 (m, 1Н), 8.17-8.18 (m, 1Н).
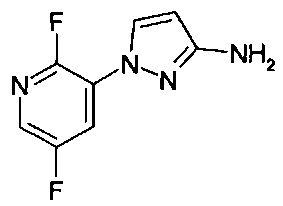
410 мг изомерного 1-(2,5-дифторпиридин-3-ил)-1Н-пиразол-3-амина отделяли в виде дополнительного вещества. ВЭЖХ-МС: logP=1.15; масс (m/z): 197.0 (М+Н)+;1H-ЯМР (CD3CN) 4.39 (br. s, 2Н), 5.92 (d, 1Н), 7.80-7.82 (m, 1Н), 7.94-7.95 (m, 1Н), 8.02-8.07 (m, 1Н).
Стадия 2: N-[1-(3,5-дифторпиридин-2-ил)-1Н-пиразол-3-ил]-2,6-дифторбензамид

1-(3,5-дифторпиридин-2-ил)-1Н-пиразол-3-амин (66 мг) изначально загружали в дихлорметан (2 мл), триэтиламин (0.14 мл) и раствор 2,6-дифторбензоил хлорида (59 мг) в дихлорметане (1 мл) добавляли при 0°С и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь затем разбавляли с помощью дихлорметана, промывали с помощью воды, сушили над сульфатом натрия и концентрировали до сухого состояния при сниженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле с использованием мобильной фазы циклогексан/этилацетат (градиент = 2 г от 100% циклогексана до 100% этилацетата). Это обеспечило 107 мг соединения, указанного в заголовке. ВЭЖХ-МС: logP=2.19; масс (m/z): 337.1 (М+Н)+;1Н-ЯМР (CD3CN) 7.02-7.03 (m, 1H), 7.06-7.12 (m, 2Н), 7.48-7.56 (m, 1Н), 7.65-7.70 (m, 1H), 8.21-8.22 (m, 1H), 8.26-8.27 (m, 1H), 9.51 (br. s, 1H).
Пример синтеза 10
2-бром-N-[1-(3,5,6-трифторпиридин-2-ил)-1Н-пиразол-3-ил]бензамид (соединение I-1-164 в Таблице 1)
Стадия 1: 1-(3,5,6-трифторпиридин-2-ил)-1Н-пиразол-3-амин (через путь А-1)

1Н-пиразол-3-амин (2.00 г) изначально загружали в ацетонитрил (75 мл), 2,3,5,6-тетрафторпиридин (3.64 г) и карбонат калия (6.65 г) добавляли и смесь нагревали с обратным холодильником в течение ночи. Реакционную смесь последовательно растирали с помощью трет-бутилметилового эфира и фильтровали. Фильтрат концентрировали до сухого состояния при сниженном давлении. Осталось 2.51 г соединения, указанного в заголовке. ВЭЖХ-МС: logP=1.15; масс (m/z): 215.1 (М+Н)+;1Н-ЯМР (ДМСО-D6) 5.35 (br. s, 2Н), 5.86 (d, 1Н), 8.00 (d, 1H), 8.40-8.45 (m, 1H).
Стадия 2: 2-бром-N-[1-(3,5,6-трифторпиридин-2-ил)-1Н-пиразол-3-ил]бензамид
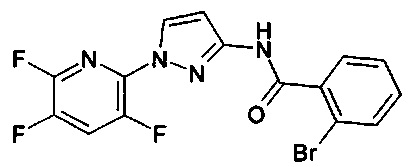
Аналогично примеру синтеза 9 стадия 2, 1-(3,5,6-трифторпиридин-2-ил)-1Н-пиразол-3-амин (150 мг) подвергали взаимодействию с 2-бромбензоил хлоридом (169 мг) и триэтиламином (0.29 мл) в дихлорметане. Очистка с помощью колоночной хроматографии обеспечила 145 мг соединения, указанного в заголовке. ВЭЖХ-МС: logP=2.68; масс (m/z): 396.9 (М+Н)+;1Н-ЯМР [ДМСО-D6] 7.02 (d, 1Н), 7.38-7.43 (m, 1H), 7.45-7.49 (m, 1Н), 7.53-7.55 (m, 1Н), 7.68-7.70 (m, 1Н), 8.32 (d, 1Н), 8.55-8.61 (m, 1Н), 11.41 (s, 1Н).
Пример синтеза 11
N-[1-(2-хлорпиридин-3-ил)-1Н-пиразол-3-ил]-2-йодбензамид (соединение I-1-139 в Таблице 1)
Стадия 1: 1-(2-хлорпиридин-3-ил)-1Н-пиразол-3-амин (через путь А-1)

1Н-пиразол-3-амин (2.00 г) изначально загружали в диметилсульфоксид (25 мл), 2-хлор-3-фторпиридин (3.17 г) и карбонат калия (6.65 г) добавляли и смесь перемешивали при 120°С в течение ночи. Реакционную смесь затем разбавляли с помощью дихлорметана, промывали с помощью воды, сушили над сульфатом натрия и концентрировали до сухого состояния при сниженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле с использованием мобильной фазы циклогексан/этилацетат (градиент = 2 г от 100% циклогексана до 100% этилацетата). Это обеспечило 2.16 г соединения, указанного в заголовке. ВЭЖХ-МС: logP=0.62; масс (m/z): 179.1 (М+Н)+;1Н-ЯМР (CD3CN) 4.23 (br. s, 2Н), 5.87 (d, 1H), 7.41-7.44 (m, 1H), 7.86 (d, 1H), 7.92-7.94 (m, 1H), 8.28-8.30 (m, 1H).
Стадия 2: N-[1-(2-хлорпиридин-3-ил)-1Н-пиразол-3-ил]-2-йодбензамид

Аналогично примеру синтеза 9 стадия 2, 1-(2-хлорпиридин-3-ил)-1Н-пиразол-3-амин (100 мг) подвергали взаимодействию с 2-йодбензоил хлоридом (137 мг) и триэтиламином (0.22 мл) в дихлорметане. Очистка с помощью колоночной хроматографии обеспечила 96 мг соединения, указанного в заголовке. ВЭЖХ-МС: logP=2.27; масс (m/z): 424.9 (М+Н)+; 1Н-ЯМР [CD3CN] 7.02 (d, 1Н), 7.19-7.24 (m, 1H), 7.49-7.52 (m, 3H), 7.94-7.96 (m, 2H), 8.00-8.01 (m, 1H), 8.42-8.44 (m, 1H), 9.21 (s, 1H).
Пример синтеза 12
N-[1-(5,6-дифторпиримидин-4-ил)-1Н-пиразол-3-ил]-2-(трифторметил)бензамид (соединение I-1-169 в Таблице 1)
Стадия 1: 1-(5,6-дифторпиримидин-4-ил)-1Н-пиразол-3-амин (через путь А-1)
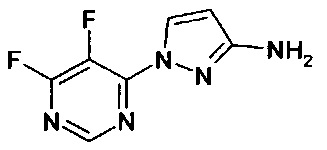
1Н-пиразол-3-амин (1.25 г) изначально загружали в ацетонитрил (75 мл), 4,5,6-трифторпиримидин (2.02 г) и карбонат калия (4.16 г) добавляли и смесь нагревали с обратным холодильником в течение ночи. Реакционную смесь затем разбавляли с помощью дихлорметана, промывали с помощью воды, сушили над сульфатом натрия и концентрировали до сухого состояния при сниженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле с использованием мобильной фазы циклогексан/этилацетат (градиент = 2 г от 100% циклогексана до 100% этилацетата). Это обеспечило 379 мг соединения, указанного в заголовке. ВЭЖХ-МС: logP=0.86; масс (m/z): 198.1 (М+Н)+;1Н-ЯМР (ДМСО-D6) 5.73 (br. s, 2Н), 6.01 (d, 1Н), 8.34 (d, 1H), 8.46 (s, 1H).
Стадия 2: N-[1-(5,6-дифторпиримидин-4-ил)-1Н-пиразол-3-ил]-2-(трифторметил)бензамид
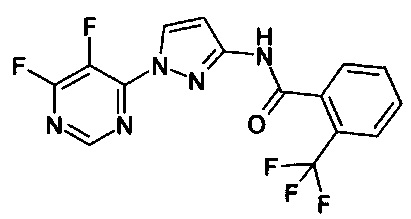
Аналогично примеру синтеза 9 стадия 2, 1-(5,6-дифторпиридин-3-ил)-1Н-пиразол-3-амин (62 мг) подвергали взаимодействию с 2-(трифторметил)бензоил хлоридом (66 мг) и триэтиламином (0.13 мл) в дихлорметане. Очистка с помощью колоночной хроматографии обеспечила 6 мг соединения, указанного в заголовке. ВЭЖХ-МС: logP=2.62; масс (m/z): 370.1 (М+Н)+;1Н-ЯМР [ДМСО-D6] 7.12 (d, 1Н), 7.69-7.84 (m, 4Н), 8.66-8.67 (m, 2Н), 11.69 (s, 1Н).
Пример синтеза 13
2-хлор-N-[1-(3-фторпиразин-2-ил)-1Н-пиразол-3-ил]бензамид (соединение I-1-174 в Таблице 1)
Стадия 1: 1-(3-фторпиразин-2-ил)-1Н-пиразол-3-амин (через путь А-1)

1Н-пиразол-3-амин (2.00 г) изначально загружали в ацетонитрил (75 мл), 2,3-дифторпиразин (2.79 г) и карбонат калия (6.65 г) добавляли и смесь нагревали с обратным холодильником в течение ночи. Реакционную смесь затем разбавляли с помощью дихлорметана, промывали с помощью воды, сушили над сульфатом натрия и концентрировали до сухого состояния при сниженном давлении. Остаток растирали с помощью трет-бутилметилового эфира и осажденное твердое вещество отделяли, промывали и сушили. Это обеспечило 2.24 г соединения, указанного в заголовке. ВЭЖХ-МС: logP=0.49; масс (m/z): 180.0 (М+Н)+;1Н-ЯМР [ДМСО-D6] 5.44 (br.s, 2Н), 5.92 (d, 1Н), 8.07-8.09 (m, 1H), 8.22 (d, 1H), 8.52-8.54 (s, 1H).
Стадия 2: 2-хлор-N-[1-(3-фторпиразин-2-ил)-1Н-пиразол-3-ил]бензамид

Аналогично примеру синтеза 9 стадия 2, 1-(3-фторпиразин-2-ил)-1Н-пиразол-3-амин (150 мг) подвергали взаимодействию с 2-хлорбензоил хлоридом (162 мг) и триэтиламином (0.35 мл) в дихлорметане. Очистка с помощью колоночной хроматографии обеспечила 188 мг соединения, указанного в заголовке. ВЭЖХ-МС: logP=2.03; масс (m/z): 318.1 (М+Н)+;1Н-ЯМР [ДМСО-D6] 7.08 (d, 1Н), 7.41-7.59 (m, 4Н), 8.30-8.31 (m, 1Н), 8.51 (d, 1Н), 8.54-8.55 (m, 1Н), 11.49 (s, 1Н).
Пример синтеза 14
2-хлор-N-[1-(2-хлорфенил)-1Н-пиразол-3-ил]бензамид (соединение I-1-20 в Таблице 1)
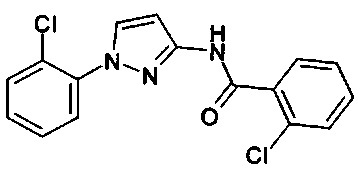
Аналогично примеру синтеза 9 стадия 2, 1-(2-хлорпиридин-3-ил)-1Н-пиразол-3-амин (300 мг) подвергали взаимодействию с 2-хлорбензоил хлоридом (271 мг) и триэтиламином (1.08 мл) в дихлорметане. Очистка с помощью колоночной хроматографии обеспечила 386 мг соединения, указанного в заголовке. ВЭЖХ-МС: logP=2.80; масс (m/z): 332.0 (М+Н)+;1Н-ЯМР (CD3CN) 6.97 (d, 1Н), 7.34-7.55 (m, 6H), 7.58-7.61 (m, 2H), 7.88 (d, 1H), 9.22 (br. s, 1H).
Пример синтеза 15
2-хлор-N-[1-(2-хлорфенил)-1Н-пиразол-3-ил]-N-метилбензамид (соединение I-1-21 в Таблице 1)
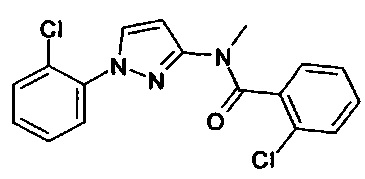
2-хлор-N-[1-(2-хлорфенил)-1Н-пиразол-3-ил]бензамид (100 мг) изначально загружали в тетрагидрофуран (2 мл), гидрид натрия (13 мг) добавляли при 0°С и смесь перемешивали с охлаждением в течение 30 мин. Йодметан (0.02 мл) затем добавляли, и смесь перемешивали при 0°С в течение последующих 6 часов и при комнатной температуре в течение ночи. Смесь затем разбавляли с помощью этилацетата, промывали с помощью воды, сушили над сульфатом натрия и концентрировали до сухого состояния при сниженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле с использованием мобильной фазы циклогексан/этилацетат (градиент = 2 г от 100% циклогексана до 100% этилацетата). Это обеспечило 84 мг соединения, указанного в заголовке. ВЭЖХ-МС: logP=3.14; масс (m/z): 346.0 (М+Н)+;1Н-ЯМР (CD3CN) (2 ротамеры около 2:1) 3.28; 3.46 (2 s, 3Н), 6.02; 7.94 (2 m, 1Н), 7.14-7.63 (m, 9Н).
Пример синтеза 16
2-хлор-N-[1-(2-хлорфенил)-4-фтор-1Н-пиразол-3-ил]бензамид (соединение I-1-27 в Таблице 1)

В атмосфере аргона, 2-хлор-N-[1-(2-хлорфенил)-1Н-пиразол-3-ил]бензамид (151 мг) изначально загружали в ацетонитрил (2 мл), Selectfluor (646 мг) добавляли и смесь перемешивали при комнатной температуре в течение 2 дней. Реакционную смесь затем растворили в дихлорметане и фильтровали, и фильтрат концентрировали до сухого состояния при сниженном давлении. Остаток изначально очищали с помощью колоночной хроматографии на силикагеле с использованием мобильной фазы циклогексан/этилацетат (градиент = 2 г от 100% циклогексана до 100% этилацетата) и затем подвергали хроматографированию с помощью препаративной ВЭЖХ с использованием мобильной фазы вода/ацетонитрил (градиент = 40 мин от 10% ацетонитрила вводе до 100% ацетонитрила). Это обеспечило 12 мг соединения, указанного в заголовке. ВЭЖХ-МС: logP=2.70; масс (m/z): 350.0 (М+Н)+;1Н-ЯМР (ДМСО-D6) 7.44-7.62 (m, 7Н), 7.68-7.71 (m, 1Н), 8.39 (d, 1Н), 10.73 (s, 1Н).
Пример синтеза 17
N-[4-хлор-1-(2-хлорфенил)-1Н-пиразол-3-ил]-2-(трифторметил)бензамид (соединение I-1-15 в Таблице 1)
Стадия 1: 4-хлор-1-(2-хлорфенил)-1Н-пиразол-3-амин (через путь F-1)
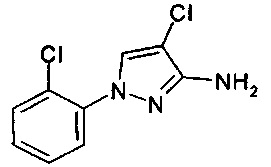
1-(2-хлорфенил)-1Н-пиразол-3-амин (266 мг) изначально загружали в тетрагидрофуран (9 мл), N-хлорсукцинимид (202 мг) добавляли и смесь перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь затем выливали на лед, энергично перемешивали и экстрагировали с помощью этилацетата. Органическую фазу сушили над сульфатом натрия и концентрировали до сухого состояния при сниженном давлении. Это обеспечило 413 мг неочищенного соединения, указанного в заголовке которое далее подвергали реакции без дополнительной очистки. ВЭЖХ-МС: logP=2.14; масс (m/z): 228.1 (М+Н)+;1Н-ЯМР (CD3CN) 7.34-7.43 (m, 2Н), 7.50-7.56 (m, 2Н), 7.83 (s, 1Н).
Стадия 2: N-[4-хлор-1-(2-хлорфенил)-1Н-пиразол-3-ил]-2-(трифторметил)бензамид
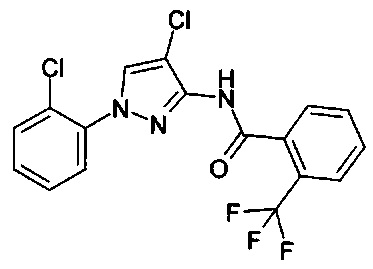
4-хлор-1-(2-хлорфенил)-1Н-пиразол-3-амин (66 мг) изначально загружали в толуол (2 мл), триэтиламин (0.28 мл) и раствор 2-(трифторметил)бензоил хлорида (140 мг) в толуоле (1 мл) добавляли при 0°С и смесь перемешивали при 80°С в течение ночи. Серебро(I) цианид (117 мг) затем добавляли, и смесь перемешивали при комнатной температуре в течение последующих 2 дней. Реакционную смесь последовательно разбавляли с помощью этилацетата, промывали с помощью воды, сушили над сульфатом натрия и концентрировали до сухого состояния при сниженном давлении. Остаток изначально очищали с помощью колоночной хроматографии на силикагеле с использованием мобильной фазы циклогексан/этилацетат (градиент = 2 г от 100% циклогексана до 100% этилацетата) и затем подвергали хроматографированию с помощью препаративной ВЭЖХ с использованием мобильной фазы вода/ацетонитрил (градиент = 40 мин от 10% ацетонитрила в воде до 100% ацетонитрила). Это обеспечило 16 мг соединения, указанного в заголовке. ВЭЖХ-МС: logP=3.06; масс (m/z): 399.9 (М+Н)+;1Н-ЯМР (CD3CN) 7.48-7.89 (m, 8Н), 8.05 (s, 1Н), 8.68 (br. s, 1H).
Пример синтеза 18
N-[4-бром-1-(2-хлорфенил)-1Н-пиразол-3-ил]-2-(трифторметил)бензамид (соединение I-1-16 в Таблице 1)
Стадия 1: 4-бром-1-(2-хлорфенил)-1Н-пиразол-3-амин (через путь F-1)
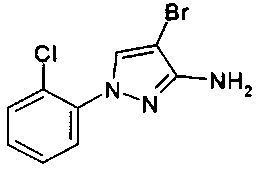
1-(2-хлорфенил)-1Н-пиразол-3-амин (266 мг) изначально загружали в тетрагидрофуран (7 мл), N-бромсукцинимид (269 мг) добавляли и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь затем выливали на лед, энергично перемешивали и экстрагировали с помощью этилацетата. Органическую фазу сушили над сульфатом натрия и концентрировали до сухого состояния при сниженном давлении. Это обеспечило 442 мг неочищенного соединения, указанного в заголовке которое далее подвергали реакции без дополнительной очистки. ВЭЖХ-МС: logP=2.23; масс (m/z): 272.0 (М+Н)+;1Н-ЯМР (CD3CN) 4.27 (br. s, 2Н), 7.35-7.43 (m, 2Н), 7.50-7.56 (m, 2Н), 7.83 (s, 1Н).
Стадия 2: N-[4-бром-1-(2-хлорфенил)-1Н-пиразол-3-ил]-2-(трифторметил)бензамид

4-бром-1-(2-хлорфенил)-1Н-пиразол-3-амин (165 мг) изначально загружали в толуол (2 мл), триэтиламин (0.25 мл) и раствор 2-(трифторметил)бензоил хлорида (126 мг) в толуоле (1 мл) добавляли при 0°С и смесь перемешивали при 80°С в течение ночи. Серебро(I) цианид (97 мг) затем добавляли, и смесь перемешивали при комнатной температуре в течение последующих 2 дней. Реакционную смесь последовательно разбавляли с помощью этилацетата, промывали с помощью воды, сушили над сульфатом натрия и концентрировали до сухого состояния при сниженном давлении. Остаток изначально очищали с помощью колоночной хроматографии на силикагеле с использованием мобильной фазы циклогексан/этилацетат (градиент = 2 г от 100% циклогексана до 100% этилацетата) и затем подвергали хроматографированию с помощью препаративной ВЭЖХ с использованием мобильной фазы вода/ацетонитрил (градиент = 40 мин от 10% ацетонитрила в воде до 100% ацетонитрила). Это обеспечило 18 мг соединения, указанного в заголовке. ВЭЖХ-МС: logP=3.11; масс (m/z): 444.0 (М+Н)+;1Н-ЯМР (CD3CN) 7.48-7.49 (m, 2Н), 7.57-7.58 (m, 1Н), 7.62-7.63 (m, 1H), 7.69-7.70 (m, 1H), 7.75-7.76 (m, 2H), 7.83-7.84 (m, 1H), 8.06 (s, 1H), 8.59 (br. s, 1H).
Пример синтеза 19
N-[4-йод-1-(2-хлорфенил)-1Н-пиразол-3-ил]-2-(трифторметил)бензамид (соединение I-1-17 в Таблице 1)
Стадия 1: 4-йод-1-(2-хлорфенил)-1Н-пиразол-3-амин (через путь F-1)

1-(2-хлорфенил)-1Н-пиразол-3-амин (266 мг) изначально загружали в тетрагидрофуран (7 мл), N-йодсукцинимид (340 мг) добавляли и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь затем выливали на лед, энергично перемешивали и экстрагировали с помощью этилацетата. Органическую фазу сушили над сульфатом натрия и концентрировали до сухого состояния при сниженном давлении. Это обеспечило 557 мг неочищенного соединения, указанного в заголовке, которое далее подвергали реакции без дополнительной очистки. ВЭЖХ-МС: logP=2.36; масс (m/z): 320.0 (М+Н)+;1Н-ЯМР (CD3CN) 7.35-7.42 (m, 2Н), 7.49-7.56 (m, 2Н), 7.81 (s, 1Н).
Стадия 2: N-[4-йод-1-(2-хлорфенил)-1Н-пиразол-3-ил]-2-(трифторметил)бензамид
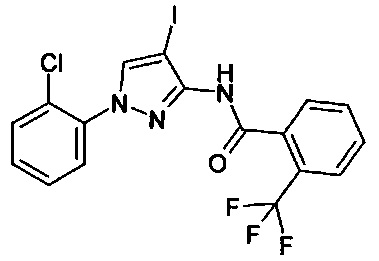
4-йод-1-(2-хлорфенил)-1Н-пиразол-3-амин (180 мг) изначально загружали в толуол (3 мл), триэтиламин (0.24 мл) и раствор 3-(трифторметил)бензоил хлорида (117 мг) в толуоле (2 мл) добавляли при 0°С и смесь перемешивали при 80°С в течение ночи. Серебро(I) цианид (91 мг) затем добавляли, и смесь перемешивали при комнатной температуре в течение последующих 2 дней. Реакционную смесь последовательно разбавляли с помощью этилацетата, промывали с помощью воды, сушили над сульфатом натрия и концентрировали до сухого состояния при сниженном давлении. Остаток изначально очищали с помощью колоночной хроматографии на силикагеле с использованием мобильной фазы циклогексан/этилацетат (градиент = 2 г от 100% циклогексана до 100% этилацетата) и затем подвергали хроматографированию с помощью препаративной ВЭЖХ с использованием мобильной фазы вода/ацетонитрил (градиент = 40 мин от 10% ацетонитрила в воде до 100% ацетонитрила). Это обеспечило 11 мг соединения, указанного в заголовке. ВЭЖХ-МС: logP=3.16; масс (m/z): 491.9 (М+Н)+;1H-ЯМР (CD3CN) 7.48-7.49 (m, 2Н), 7.56-7.57 (m, 1Н), 7.61-7.64 (m, 1H), 7.68-7.71 (m, 1H), 7.75-7.78 (m, 2H), 7.83-7.85 (m, 1H), 8.05 (s, 1H), 8.60 (br. s, 1H).
Новые 1Н-пиразол-3-амины формулы (II-1) ниже получали по аналогии с данными примерами синтеза: 1-(2,3-дихлорфенил)-1Н-пиразол-3-амин: аналогично примеру синтеза 3, стадия 1, исходя из 2,3-дихлорфенилгидразин гидрохлорида: ВЭЖХ-МС: logP=1.97; масс (m/z): 228.0 (М+Н)+;1Н-ЯМР (CD3CN) 4.16 (br. s, 2H), 5.84 (d, 1H), 7.39-7.41 (m, 1H), 7.50-7.52 (m, 1H), 7.59-7.60(m, 1H), 7.73 (d, 1H).
1-(3-хлор-2-фторфенил)-1Н-пиразол-3-амин: аналогично примеру синтеза 3, стадия 1, исходя из 3-хлор-2-фторфенилгидразин гидрохлорида: ВЭЖХ-МС: logP=1.90; масс (m/z): 212.0 (М+Н)+;1Н-ЯМР (ДМСО-D6) 5.22 (br.s, 2Н), 5.82 (d, 1Н), 7.25-7.30 (m, 1Н), 7.36-7.40 (m, 1H), 7.67-7.71 (m, 1Н), 7.90-7.10 (m, 1Н). 1-(3-хлор-2-этоксифенил)-1Н-пиразол-3-амин получали в качестве побочного продукта: ВЭЖХ-МС: logP=2.13; масс (m/z): 238.0 (М+Н)+;1Н-ЯМP (ДМСО-D6) 1.24 (t, 3Н), 3.78 (q, 2Н), 5.08 (br. s, 2Н), 5.78 (d, 1H), 7.17-7.21 (m, 1H), 7.30-7.33 (m, 1Н), 7.56-7.59 (m, 1Н), 7.97 (d, 1H).
1-(2-хлор-6-этоксифенил)-1Н-пиразол-3-амин: аналогично примеру синтеза 5, стадия 1, исходя из 2-хлор-6-фторфенилгидразин гидрохлорида: ВЭЖХ-МС: logP=2.13; масс (m/z): 238.0 (М+Н)+;1Н-ЯМР (ДМСО-D6) 1.34 (t, 3Н), 4.11 (q, 2Н), 4.99 (br. s, 2Н), 7.09-7.12 (m, 2Н), 7.24-7.33 (m, 3Н).
1-(2-хлор-4-метилфенил)-1Н-пиразол-3-амин: аналогично примеру синтеза 3, стадия 1, исходя из 2-хлор-4-метилфенилгидразин гидрохлорида: ВЭЖХ-МС: logP=1.85; масс (m/z): 208.1 (М+Н)+;1Н-ЯМР (CD3CN) 2.35 (s, 3Н), 4.08 (br. s, 2Н), 5.79 (d, 1Н), 7.19-7.20 (m, 1H), 7.36-7.38 (m, 2H), 7.64 (d, 1H).
1-(3,5-дифтор-6-метилпиридин-2-ил)-1Н-пиразол-3-амин: аналогично примеру синтеза 9, стадия 1, исходя из 2,3,5-трифтор-6-метилпиридина: ВЭЖХ-МС: logP=1.25; масс (m/z): 211.1 (М+Н)+;1Н-ЯМР (ДМСО-D6) 2.40-2.41 (m, 3Н), 5.18 (br. s, 2Н), 5.80 (d, 1Н), 7.97-8.02 (m, 2Н), 1-(2,5-дифтор-6-метилпиридин-3-ил)-1Н-пиразол-3-амин получали в качестве побочного продукта: ВЭЖХ-МС: logP=1.50; масс (m/z): 211.1 (М+Н)+;1Н-ЯМР (ДМСО-D6) 2.36-2.37 (m, 3Н), 5.34 (br. s, 2Н), 5.84 (d, 1Н), 7.92-7.98 (m, 2Н).
1-(5-хлорпиразин-2-ил)-1Н-пиразол-3-амин: аналогично примеру синтеза 13, стадия 1, исходя из 2,5-дихлорпиразина: ВЭЖХ-МС: (m/z): 196.1 (М+Н)+.
1-(6-фторпиразин-2-ил)-1Н-пиразол-3-амин: аналогично примеру синтеза 13, стадия 1, исходя из 2,6-дифторпиразина: ВЭЖХ-МС: logP=0.90; масс (m/z): 180.1 (М+Н)+;1Н-ЯМР (ДМСО-D6) 5.61 (br. s, 2Н), 5.94 (d, 1H), 8.18 (d, 1H), 8.36 (d, 1H), 8.78 (d, 1H).
1-(3-метоксипиразин-2-ил)-1Н-пиразол-3-амин: аналогично примеру синтеза 13, стадия 1, исходя из 2-хлор-3-метоксипиразина.
4-(3-амино-1Н-пиразол-1-ил)пиримидин-5-карбонитрил: аналогично примеру синтеза 12, стадия 1, исходя из 4-хлорпиримидин-5-карбонитрила: ВЭЖХ-МС: logP=0.59; масс (m/z): 187.1.
1-(5-хлор-3-фторпиридин-2-ил)-1Н-пиразол-3-амин: аналогично примеру синтеза 9, стадия 1, исходя из 5-хлор-2,3-дифторпиридина: ВЭЖХ-МС: logP=1.27; масс (m/z): 213.0 (М+Н)+;1H-ЯМР (ДМСО-D6) 5.30 (s, 2Н), 5.86 (d, 1Н), 8.12 (d, 1Н), 8.17-8.20 (m, 1Н), 8.31 (d, 1H).
1-(3-хлор-5-фторпиридин-2-ил)-1Н-пиразол-3-амин: аналогично примеру синтеза 9, стадия 1, исходя из 3-хлор-2,5-дифторпиридина: ВЭЖХ-МС: logP=0.98; масс (m/z): 213.0 (М+Н)+;1Н-ЯМР (ДМСО-D6) 5.11 (s, 2Н), 5.76-5.78 (m, 1Н), 7.91-7.92 (m, 1Н), 8.23-8.26 (m, 1Н), 8.47-8.48 (m, 1Н).
Пример синтеза 20
N-[2-(2-хлорфенил)-2Н-1,2,3-триазол-4-ил]-2-(трифторметил)бензамид (соединение I-2-1 в Таблице 3)
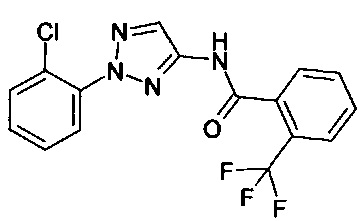
Аналогично примеру синтеза 9 стадия 2, 2-(2-хлорфенил)-2Н-1,2,3-триазол-4-амин (150 мг) подвергали взаимодействию с 2-(трифторметил)бензоил хлоридом (160 мг) и триэтиламином (0.32 мл) в дихлорметане. Очистка с помощью колоночной хроматографии и препаративной ВЭЖХ дала 171 мг соединения, указанного в заголовке. ВЭЖХ-МС: logP=3.02; масс (m/z): 367.0 (М+Н)+;1Н-ЯМР (CD3CN) 7.48-7.55 (m, 2Н), 7.60-7.66 (m, 2Н), 7.68-7.77 (m, 3Н), 7.83-7.85 (m, 1Н), 8.36 (s, 1H), 9.54 (br. s, 1H).
Пример синтеза 21
N-[2-(2,6-дифторфенил)-2Н-1,2,3-триазол-4-ил]-2-(трифторметил)бензамид (соединение I-2-35 в Таблице 5)

Схема синтеза для промежуточного соединения 2-(2,6-дифторфенил)-2Н-1,2,3-триазол-4-амина (IX) (через путь А-3)

Стадия 1: 2-[2-(2,6-дифторфенил)гидразинилиден]пропанальоксим (Пр. 21-II)
0.1 моль 2,6-дифторфенилгидразина (Пр. 21-I) и 0.12 моль изонитрозоацетона нагревали с обратным холодильником в этаноле в течение 3 часов. После охлаждения до комнатной температуры, осажденное твердое вещество отфильтровывали, промывали с помощью этанола и сушили. Это обеспечило 75% от теории гидразонового оксима (Пр. 21-II).
Стадия 2: 2-(2,6-дифторфенил)-4-метил-2Н-1,2,3-триазол (Пр. 21-III)
Раствор 0.1 моль гидразонового оксима (Пр. 21-II) в уксусном ангидриде нагревали медленно до 120°С и перемешивали пи такой температуре в течение 2 часов. Избыток уксусного ангидрида удаляли на роторном испарителе. Образовавшийся метилтриазол (Пр. 21-III) (65% от теории) далее применяли без дополнительной обработки.
Стадия 3: 2-(2,6-дифторфенил)-2Н-1,2,3-триазол-4-карбоновая кислота (Пр. 21-IV)
По немного за раз, 0.2 моль дихромата натрия добавляли к хорошо перемешиваемому раствору 0.1 моль метилтриазола (Пр. 21-III) в 66%-ой серной кислоты. Каждая отдельная порция дихромата была добавлена только после того, как желто-оранжевый цвет Cr6+ в колбе исчезал. Кроме этого, порции добавляли таким образом, что колба оставалась при температуре примерно 80-90°С. Смесь затем нагревали на паровой ванне в течение 1 часа. После охлаждения, смесь выливали в примерно то же самое количество льда и оставляли на ночь. Осажденную кислоту (Пр. 21-IV) отфильтровывали, промывали с помощью воды и сушили. Это обеспечило 50% от теории кислоты (Пр. 21-IV).
Стадия 4: Метил 2-(2,6-дифторфенил)-2Н-1,2,3-триазол-4-карбоксилат (Пр. 21-V)
Хлорид водорода барботировали в течение 2 часов через кипящий раствор кислоты (Пр. 21-IV) в метаноле. После охлаждения, белые кристаллы сложного эфира (Пр. 21-V) отфильтровывали (85% от теории).
Стадия 5: 2-(2,6-дифторфенил)-2Н-1,2,3-триазол-4-карбогидразид (Пр. 21-VI)
Сложный эфир (Пр. 21-V) варили с избытком 1.5 экв. гидразин гидрата в этаноле в течение 4 часов. После охлаждения, кристаллы гидразида (Пр. 21-VI) варили с водой и сушили. Это обеспечило 90% от теории.
Стадия 6: 2-(2,6-дифторфенил)-2Н-1,2,3-триазол-4-карбонил азид (Пр. 21-VII)
Водный раствор нитрита натрия добавляли к суспензии гидразида (Пр. 21-VI) в 20%-ной соляной кислоте. После дальнейшего перемешивания при 10°С, кристаллы ацил азида (Пр. 21-VII) отфильтровывали, промывали с помощью воды и сушили при комнатной температуре при сниженном давлении. Это обеспечило 75% от теории.
Стадия 7: 2-(2,6-дифторфенил)-2Н-1,2,3-триазол-4-карбонил изоцианат (Пр. 21-VIII)
Сухой ацил азид (Пр. 21-VII) варили в толуоле до тех пор, пока эволюция газа не закончилась (примерно 2 ч). Толуол затем удаляли на роторном испарителе и вязкий остаток изоцианата (Пр. 21-VIII) непосредственно подвергали взаимодействию без дополнительной очистки. Это обеспечило примерно 90% от теории.
Стадия 8: 2-(2,6-дифторфенил)-2Н-1,2,3-триазол-4-амин (Пр. 21-IX)
Изоцианат (Пр. 21-VIII) гидролизировали посредством 30 мин варки в соляной кислоте. Оставшиеся летучие вещества удаляли на роторном испарителе, и остаток обрабатывали с помощью раствора карбоната натрия. Осажденные кристаллы отфильтровывали, промывали с помощью воды и перекристаллизировали из гексана. Это обеспечило 70% от теории амина (Пр. 21-IX). ВЭЖХ-МС: logP=1.16; масс (m/z): 197.0 (М+Н)+;1Н-ЯМР (CD3CN) 5.46 (b, 2Н), 7.33-7.38 (m, 3Н), 7.56-7.64 (m, 1Н).
N-[2-(2,6-дифторфенил)-2Н-1,2,3-триазол-4-ил]-2-(трифторметил)бензамид (соединение I-2-35 в Таблице 5)
Аналогично примеру синтеза 9 стадия 2, 2-(2,6-дифторфенил)-2Н-1,2,3-триазол-4-амин (150 мг) подвергали взаимодействию с 2-(трифторметил)бензоил хлоридом (160 мг) и триэтиламином (0.21 мл) в 3.9 мл дихлорметана. Очистка с помощью колоночной хроматографии и препаративная ВЭЖХ обеспечила 143 мг соединения, указанного в заголовке. ВЭЖХ-МС: logP=2.80; масс (m/z): 369.1 (М+Н)+;1Н-ЯМР (CD3CN) 7.45-7.49 (m, 2Н), 7.70-7.77 (m, 4Н), 7.78-7.88 (m, 1Н), 8.45 (s, 1H), 11.83 (s, 1H).
Пример синтеза 22
Н-[1-(3,5-дифторпиридин-2-ил)-5-фтор-1Н-индазол-3-ил]-2-(трифторметил)бензамид (соединение I-5-2 в Таблице 4)
Стадия 1: 1-(3,5-дифторпиридин-2-ил)-5-фтор-1Н-индазол-3-амин (через путь А-2)

В атмосфере аргона, 5-фтор-1Н-индазол-3-амин (100 мг) изначально загружали в N,N-диметилформамид (1 мл), гидрид натрия (16 мг) добавляли и смесь перемешивали при комнатной температуре в течение 30 мин. Раствор 2,3,5-трифторпиридина (88 мг в 0.5 мл N,N-диметилформамида) добавляли по каплях, и смесь перемешивали при комнатной температуре в течение 2 дней. Реакционную смесь затем разводили в этилацетате, промывали с помощью воды, сушили над сульфатом натрия и концентрировали до сухого состояния при сниженном давлении. Это обеспечило 121 мг неочищенного соединения, указанного в заголовке, которое далее подвергали реакции без дополнительной очистки. ВЭЖХ-МС: logP=2.09; масс (m/z): 265.1 (М+Н)+;1Н-ЯМР (ДМСО-D6) 6.14 (br. s, 2Н), 7.31-7.39 (m, 1Н), 7.41-7.47 (m, 1Н), 7.63-7.71 (m, 1Н), 8.07-8.16 (m, 1Н), 8.20-8.22 (m, 1Н).
Стадия 2: N-[1-(3,5-дифторпиридин-2-ил)-5-фтор-1Н-индазол-3-ил]-2-(трифторметил)бензамид
1-(3,5-дифторпиридин-2-ил)-1Н-пиразол-3-амин (121 мг) изначально загружали в ацетонитрил (3 мл), карбонат калия (284 мг) и 2-(трифторметил)бензоил хлорид (287 мг) добавляли при комнатной температуре и смесь перемешивали в течение ночи. Реакционную смесь затем разбавляли с помощью этилацетата, промывали с помощью воды, сушили над сульфатом натрия и концентрировали до сухого состояния при сниженном давлении. Остаток хроматографировали с помощью препаративной ВЭЖХ с использованием мобильной фазы вода/ацетонитрил (градиент = 40 мин от 10% ацетонитрила в воде до 100% ацетонитрила). Это обеспечило 13 мг соединения, указанного в заголовке. ВЭЖХ-МС: logP=3.37; масс (m/z): 437.1 (М+Н)+;1H-ЯМР (ДМСО-D6) 7.47-7.52 (m, 1Н), 7.64-7.67 (m, 1Н), 7.74-7.77 (m, 1Н), 7.81-7.89 (m, 3Н), 7.98-8.05 (m, 1Н), 8.32-8.45 (m, 1Н), 8.57-8.58 (m, 1Н), 11.47 (s, 1H).
Пример синтеза 23
N-{1-[3-фтор-4-(4-фторфенил)пиридин-2-ил]-1Н-пиразол-3-ил}-2-(трифторметил)бензамид (соединение I-1-640 в Таблице 1)
Стадия 1: 1-(3-фтор-4-йодпиридин-2-ил)-1Н-пиразол-3-амин (через А-1)
Смесь 3-аминопиразола (0.50 г), 2,3-дифтор-4-йодпиридина (1.45 г), карбоната калия (3.3 г) и 10 мл безводного диметилсульфоксида перемешивали при 85°С в течение 48 часов. Для переработки, 100 мл воды добавляли при комнатной температуре и смесь экстрагировали с помощью этилацетата. Органическую фазу сушили с помощью сульфата магния и затем концентрировали полностью и хроматографировали на силикагеле с использованием градиента этилацетата/метанола. Это обеспечило 705 мг соединения, указанного в заголовке. ВЭЖХ-МС: logP=1.38; масс (m/z): 304.9 (М+Н)+;1Н-ЯМР (ДМСО-D6) 5.91 (m, 1H), 7.62 (m, 1Н), 7.85 (m, 1Н), 8.08 (m, 1Н).
Стадия 2: N-[1-(3-фтор-4-йодпиридин-2-ил)-1Н-пиразол-3-ил]-2-(трифторметил)бензамид (соединение I-1-576 в Таблице 1)

При охлаждении льдом, 2-(трифторметил)бензоил хлорид (412 мг) добавляли к раствору 1-(3-фтор-4-йодпиридин-2-ил)-1Н-пиразол-3-амина (600 мг) и триэтиламина (0.83 мл) в дихлорметане (12 мл), и смесь перемешивали при 0°С в течение одного часа и затем нагревали до комнатной температуры в течение ночи. Смесь концентрировали полностью и получившийся остаток распределяли между этилацетатом и полунасыщенным раствором бикарбоната натрия. Органическую фазу концентрировали и хроматографировали на силикагеле с использованием градиента метилен хлорид/метанол. Это обеспечило 650 мг соединения, указанного в заголовке. ВЭЖХ-МС: logP=2.96; масс (m/z): 476.9 (М+Н)+;1Н-ЯМР (CD3CN) 7.05 (m, 1Н), 7.6 (brm, 3Н), 7.76 (brm, 2H), 7.92 (m, 1H), 8.29 (m, 1H), 9.54 (brs, 1H).
Стадия 3: N-{1-[3-фтор-4-(4-фторфенил)пиридин-2-ил]-1Н-пиразол-3-ил}-2-(трифторметил)бензамид

Смесь N-[1-(3-фтор-4-йодпиридин-2-ил)-1Н-пиразол-3-ил]-2-(трифторметил)бензамида (200 мг), 4-фторбороновой кислоты (117 мг), карбоната натрия (170 мг), 1,1'-бис(дифенилфосфино)ферроценпалладий (II) хлорида (15 мг), 1,2-диметоксиэтана (3 мл) и воды (1 мл) нагревали при 85°С в течение 6 часов. Реакционную смесь концентрировали, остаток растирали с помощью этилацетата и отфильтровывали и фильтрат промывали с помощью воды, сушили и снова концентрировали. Полученный таким образом остаток хроматографировали на силикагеле с использованием градиента циклогексан/этилацетат.Это обеспечило 81 мг соединения, указанного в заголовке. ВЭЖХ-МС: logP=3.40; масс (m/z): 445.1 (М+Н)+;1Н-ЯМР (ДМСО-D6) 6.99 (m, 1Н), 7.42 (m, 2Н), 7.61-7.85 (m, 7Н), 8.42 (m, 2Н), 11.46 (s, 1Н).
Пример синтеза 24
2-{[1-(4-амино-2,6-дифторфенил)-1Н-пиразол-3-ил]карбамоил}бензойная кислота (соединение I-1-643 в Таблице 1)

Стадия 1: 2-{[1-(2,6-дифтор-4-нитрофенил)-1Н-пиразол-3-ил]карбамоил}бензойная кислота

В атмосфере аргона и при -20°С, 60% гидрид натрия (2.27 г) добавляли по чуть-чуть за раз к раствору 2-(1Н-пиразол-3-ил)-1Н-изоиндол-1,3(2Н)-диона (5.90 г) и 3,4,5-трифторнитробензола (5.05 г) в тетрагидрофуране (120 мл). Во время добавления, температура не превышала -5°С. По прошествии 6 часов, реакционной смеси позволили достигнуть комнатной температуры, перемешивали в 300 мл воды и экстрагировали с помощью этилацетата. После сушки, объединенные органические фазы сушили над сульфатом магния и фильтровали, и фильтрат полностью концентрировали. Это обеспечило 8.5 г соединения, указанного в заголовке. ВЭЖХ-МС: logP=1.85, масс (m/z): 389.0 (М+Н)+. Полученный таким образом остаток использовали на следующей стадии без дополнительной очистки.
Стадия 2: 2-{[1-(4-амино-2,6-дифторфенил)-1Н-пиразол-3-ил]карбамоил}бензойная кислота

В автоклаве, смесь вышеуказанной 2-{[1-(2,6-дифтор-4-нитрофенил)-1Н-пиразол-3-ил]карбамоил}бензойной кислоты (6.56 г), метанола (50 мл) и 250 мг Pd/C (10%) гидрогенизировали при давлении водорода в 4 бар при комнатной температуре в течение 4 дней. Удаление катализатора с помощью фильтрации и концентрация органической фазы с помощью упаривания дало 6.2 г соединения, указанного в заголовке с содержанием 70% от теории. ВЭЖХ-МС: logP=1.38, масс (m/z): 359.1 (М+Н)+;1Н-ЯМР (ДМСО-D6) 4.10 (m, 2Н), 6.07 (s, 2Н), 6.33 (m, 2Н), 6.85 (m, 1Н), 7.41 (m, 2Н), 7.67 (m, 1Н), 7.74 (m, 1Н), 7.77 (brs, 1Н)
Пример синтеза 25
N-[1-(3-цианопиридин-2-ил)-1Н-пиразол-3-ил]-2-(трифторметил)бензамид (соединение (I-1-575) в Таблице 1)

Стадия 1: N-(1Н-пиразол-3-ил)-2-(трифторметил)бензамид
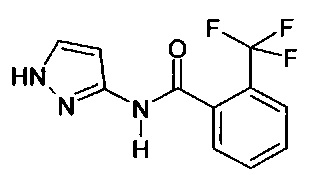
За исключением влаги, раствор 3-аминопиразола (43.9 г) и триэтиламина (52.4 г) в ацетонитриле (400 мл) перемешивали при 0°С в течение одного часа. Раствор 2-(трифторметил)бензоил хлорида (109.1 г) в ацетонитриле (50 мл) затем добавляли по каплях таким образом, что внутренняя температура не превышала 7°С. Реакционной смеси позволяли нагреться до комнатной температуры в течение ночи, разбавляли 600 мл воды и экстрагировали с помощью этилацетата. Объединенные органические фазы сушили над сульфатом магния, фильтровали и концентрировали. Полученный таким образом остаток растворяли в изопропаноле (500 мл) с нагреванием с обратным холодильником. После охлаждения до комнатной температуры, кристаллы которые, отделились, выделяли (48.6 г). Это являлось соединением, указанным в заголовке с одним молярным эквивалентом изопропанола кристаллизации. ВЭЖХ-МС: logP=1.33, масс (m/z): 255.9 (М+Н)+;1Н-ЯМР (ДМСО-D6) 1.03 (m, 6Н), 3.77 (m, 1Н), 4.33 (m, 1Н), 6.60 (m, 1Н), 7.60-7.81 (m, 5Н), 10.97 (s, 1Н), 12.41 (m, 1Н),
Стадия 2: N-[1-(3-цианопиридин-2-ил)-1Н-пиразол-3-ил]-2-(трифторметил)бензамид

Раствор N-(1Н-пиразол-3-ил)-2-(трифторметил)бензамида × изопропанола (222 мг) в 50 мл диметилформамида концентрировали до сухого состояния при сниженном давлении. Остаток разводили в безводном диметилформамиде (3 мл), добавляли карбонат калия и полученную смесь энергично перемешивали в течение 5 минут. 2-хлорникотинонитрил (88 мг) затем добавляли, смесь перемешивали в течение 6 часов при 50°С, воду (50 мл) затем добавляли при комнатной температуре, смесь экстрагировали с помощью этилацетата и объединенные органические фазы сушили над сульфатом магния и упаривали досуха. Хроматография на силикагеле с использованием градиента циклогексан/этилацетат обеспечила соединение, указанное в заголовке (149 мг). ВЭЖХ-МС: logP=2.55, масс (m/z): 358.0 (М+Н)+;1Н-ЯМР (ДМСО-D6) 7.06 (m, 1H), 7.53 (m, 1H), 7.69-7.84 (m, 4Н), 8.46 (m, 1Н), 7.60-7.81 (m, 4Н), 8.46 (m, 1Н), 8.60 (m, 1Н), 8.74 (m, 1Н), 11.61 (s, 1Н).
Новые 2-(трифторметил)бензамиды ниже были получены по аналогии с данными примерами синтеза:
Пример синтеза 26:
N-[1-(2,6-дифтор-4-нитрофенил)-1Н-пиразол-3-ил]-2-(трифторметил)бензамид (соединение (I-1-229) в Таблице 1)
Аналогично примеру синтеза 25, стадия 2, исходя из 3,4,5-трифторнитробензола: ВЭЖХ-МС: logP=2.86; масс (m/z): 413.0 (М+Н)+;1Н-ЯМР (CD3CN) 7.02 (m, 1Н), 7.60-7.95 (m, 4H), 8.13 (m, 1H), 8.36 (m, 1H), 11.45 (s, 1H).
Пример синтеза 27:
N-{1-[2,6-дифтор-4-(трифторметил)фенил]-1Н-пиразол-3-ил}-2-(трифторметил)бензамид (соединение (I-1-230) в Таблице 1)

Аналогично примеру синтеза 25, стадия 2, исходя из 1,2,3-трифтор-5-(трифторметил)бензола: ВЭЖХ-МС: logP=3.39; масс (m/z): 436.0 (М+Н)+;1Н-ЯМР (ДМСО-D6) 6.98 (m, 1Н), 7.68-7.14 (m, 2Н), 7.77 (m, 1Н), 7.81 (m, 1Н), 7.97 (m, 2Н), 8.14 (m, 1Н), 11.40 (s, 1H).
Пример синтеза 28:
N-[1-(4-циано-2,6-дифторфенил)-1Н-пиразол-3-ил]-2-(трифторметил)бензамид (соединение (I-1-228) в Таблице 1)
Аналогично примеру синтеза 25, стадия 2, исходя из 3,4,5-трифторбензонитрила: ВЭЖХ-МС: logP=2.66; масс (m/z): 393.0 (М+Н)+;1Н-ЯМР (ДМСО-D6) 6.99 (m, 1Н), 7.68-7.71 (m, 2Н), 7.75 (m, 1Н), 7.82 (m, 1Н), 8.09-8.14(m, 3Н), 11.41 (s, 1Н).
Пример синтеза 29:
N-[1-(2-циано-4,6-дифторфенил)-1Н-пиразол-3-ил]-2-(трифторметил)бензамид (соединение (I-1-393) в Таблице 1)
Аналогично примеру синтеза 25, стадия 2, исходя из 2,3,5-трифторбензонитрила: ВЭЖХ-МС: logP=2.65; масс (m/z): 393.0 (М+Н)+;1Н-ЯМР (ДМСО-D6) 7.00 (m, 1Н), 7.68-7.71 (m, 2Н), 7.75 (m, 1Н), 7.83 (m, 1H), 8.04-8.11 (m, 2Н), 8.17 (m, 1H), 11.44 (s, 1Н).
Пример синтеза 30:
N-[1-(4-ацетил-2,6-дифторфенил)-1Н-пиразол-3-ил]-2-(трифторметил)бензамид (соединение (I-1-584) в Таблице 1)
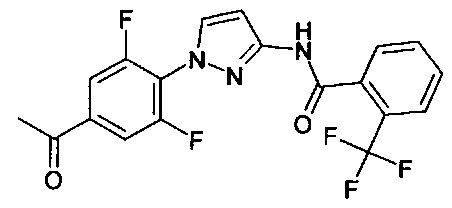
Аналогично примеру синтеза 25, стадия 2, исходя из 3,4,5-трифторацетофенона: ВЭЖХ-МС: logP=2.70; масс (m/z): 410.0 (М+Н)+;1Н-ЯМР (ДМСО-D6) 2.65 (s, 3Н), 6.99 (m, 1Н), 7.68-7.71 (m, 2Н), 7.75 (m, 1Н), 7.83 (m, 1Н), 7.90-7.93 (m, 2Н), 8.11 (m, 1Н), 11.44 (s, 1Н).
Пример синтеза 31:
N-{1-[3-циано-6-(трифторметил)пиридин-2-ил]-1Н-пиразол-3-ил}-2-(трифторметил)бензамид (соединение (I-1-569) в Таблице 1)
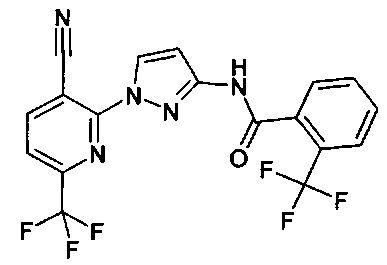
Аналогично примеру синтеза 25, стадия 2, исходя из 2-хлор-6-(трифторметил)никотинонитрила: ВЭЖХ-МС: logP=3.41; масс (m/z): 426.1 (М+Н)+;1Н-ЯМР (ДМСО-D6) 7.11 (m, 1H), 7.67-7.73 (m, 2Н), 7.77 (m, 1Н), 7.84 (m, 1H), 7.99 (m, 1Н), 8.60 (m, 1Н), 8.77 (m, 1Н), 11.71 (s, 1Н).
Пример синтеза 32:
N-{1-[3-циано-4-(4-фторфенил)пиридин-2-ил]-1Н-пиразол-3-ил}-2-(трифторметил)бензамид(соединение (I-1-641) в таблице 1)
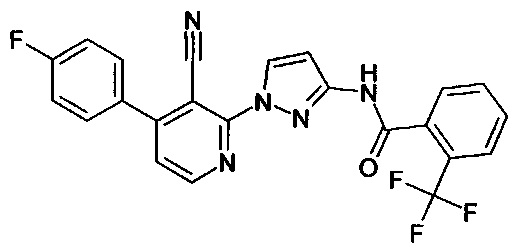
Аналогично примеру синтеза 25, стадия 2, исходя из 2-хлор-4-(4-фторфенил)никотинонитрила: ВЭЖХ-МС: logP=3.41; масс (m/z): 426.1 (М+Н)+;1Н-ЯМР (ДМСО-D6) 7.11 (m, 1H), 7.67-7.73 (m, 2H), 7.77 (m, 1H), 7.84 (m, 1H), 7.99 (m, 1H), 8.60 (m, 1H), 8.77 (m, 1H), 11.71 (s, 1H).
Пример синтеза 33:
N-{1-[3-циано-6-метил-4-(трифторметил)пиридин-2-ил]-1Н-пиразол-3-ил}-2-(трифторметил)бензамид (соединение (I-1-571) в Таблице 1)
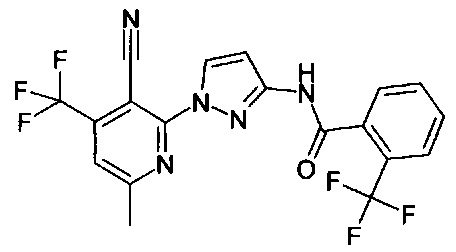
Аналогично примеру синтеза 25, стадия 2, исходя из 2-хлор-6-метил-4-(трифторметил)никотинонитрила: ВЭЖХ-МС: logP=3.49; масс (m/z): 440.0 (М+Н)+;1Н-ЯМР (ДМСО-D6) 2.70 (s, 3Н), 7.09 (m, 1H), 7.69-7.73 (m, 2Н), 7.76 (m, 1H), 7.83 (m, 1Н), 7.89 (m, 1Н), 8.62 (m, 1Н), 11.66 (s, 1H).
Пример синтеза 34:
N-[1-(6-хлор-3-цианопиридин-2-ил)-1Н-пиразол-3-ил]-2-(трифторметил)бензамид (соединение (I-1-607) в Таблице 1)

Аналогично примеру синтеза 25, стадия 2, исходя из 2,6-дихлорникотинонитрила: ВЭЖХ-МС: logP=3.14; масс (m/z): 392.0/394.1 (М+Н)+;1Н-ЯМР (ДМСО-D6) 7.08 (m, 1Н), 7.64 (m, 1Н), 7.69-7.72 (m, 2Н), 7.76 (m, 1Н), 7.82 (m, 1Н), 8.48 (m, 1Н), 8.55 (m, 1Н), 11.66 (s, 1H).
Пример синтеза 35:
N-[1-(6-хлор-5-цианопиридин-2-ил)-1Н-пиразол-3-ил]-2-(трифторметил)бензамид (соединение (I-1-608) в Таблице 1)

Аналогично примеру синтеза 25, стадия 2, подобным образом исходя из 2,6-дихлорникотинонитрила, в качестве смеси с примером синтеза 34: ВЭЖХ-МС: logP=3.17; масс (m/z): 392.0/394.1 (М+Н)+;1Н-ЯМР (ДМСО-D6) 7.06 (m, 1Н), 7.70-7.86 (m, 5Н), 8.54 (m, 1Н), 8.60 (m, 1Н), 11.62 (s, 1Н).
Пример синтеза 36:
N-{1-[3-циано-6-(диэтиламино)пиридин-2-ил]-1Н-пиразол-3-ил}-2-(трифторметил)бензамид (соединение (I-1-568) в Таблице 1)
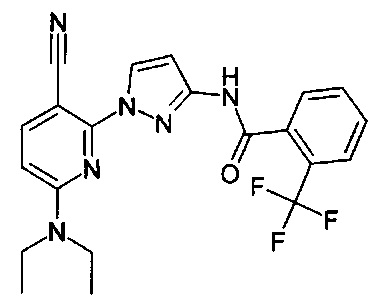
Аналогично примеру синтеза 25, стадия 2, исходя из 2-хлор-6-(диэтиламино)никотинонитрила: ВЭЖХ-МС: logP=3.76; масс (m/z): 429.1 (М+Н)+;1Н-ЯМР (ДМСО-D6) 1.17 (m, 6Н), 3.60 (br, 4Н), 6.66 (m, 1Н), 7.00 (m, 1H), 7.69 (m, 2Н), 7.76 (m, 1Н), 7.81 (m, 1Н), 7.86 (m, 1Н), 8.48 (m, 1Н), 11.52 (s, 1Н).
Пример синтеза 37:
N-[1-(2-хлор-3-цианопиридин-4-ил)-1Н-пиразол-3-ил]-2-(трифторметил)бензамид (соединение (I-1-585) в Таблице 1)

Аналогично примеру синтеза 25, стадия 2, исходя из 2,4-дихлорникотинонитрила: ВЭЖХ-МС: logP=2.67; масс (m/z): 391.9/394.0 (М+Н)+;1Н-ЯМР (ДМСО-D6) 7.15 (m, 1H), 7.71 (m, 2Н), 7.79 (m, 1H), 7.84 (m, 1Н), 7.95 (m, 1H), 8.67-8.70 (m, 2Н), 11.69 (s, 1Н).
Пример синтеза 38:
N-[1-(4-хлор-3-цианопиридин-2-ил)-1Н-пиразол-3-ил]-2-(трифторметил)бензамид (соединение (I-1-586) в Таблице 1)
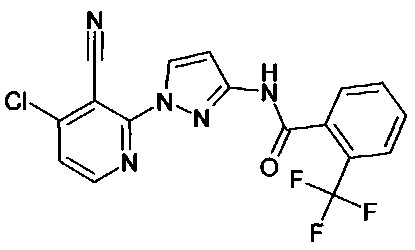
Аналогично примеру синтеза 25, стадия 2, подобным образом исходя из 2,4-дихлорникотинонитрила, образованного в качестве смеси с примером синтеза 36 и отделенным с помощью хроматографии на силикагеле с использованием градиента циклогексан/этилацетат: ВЭЖХ-МС: logP=2.67; масс (m/z): 391.9/394.0 (М+Н)+;1Н-ЯМР (ДМСО-D6) 7.08 (m, 1Н), 7.71 (m, 2Н), 7.78 (m, 1Н), 7.85 (m, 1Н), 8.58 (m, 1Н), 8.68 (m, 2Н), 11.66 (s, 1Н).
Пример синтеза 39:
N-[1-(3-циано-6-пропилпиридин-2-ил)-1Н-пиразол-3-ил]-2-(трифторметил)бензамид (соединение (I-1-573) в Таблице 1)

Аналогично примеру синтеза 25, стадия 2, исходя из 2-хлор-6-пропилникотинонитрила: ВЭЖХ-МС: logP=3.80; масс (m/z): 400.1 (М+Н)+;1Н-ЯМР (ДМСО-D6) 0.95 (m, 3Н), 1.77 (m, 2Н), 2.82 (m, 2Н), 7.05 (m, 1H), 7.40 (m, 1H), 7.70 (m, 2Н), 7.76 (m, 1Н), 7.83 (m, 1Н), 7.95 (m, 1Н), 8.32 (m, 1H), 8.58 (m, 1Н), 11.59 (s, 1Н).
Пример синтеза 40:
N-{1-[3-циано-6-циклопропил-4-(трифторметил)пиридин-2-ил]-1Н-пиразол-3-ил}-2-(трифторметил)бензамид (соединение (I-1-570) в Таблице 1)

Аналогично примеру синтеза 25, стадия 2, исходя из 2-хлор-6-циклопропил-4-(трифторметил)никотинонитрила: ВЭЖХ-МС: logP=3.99; масс (m/z): 466.1 (М+Н)+;1Н-ЯМР (ДМСО-D6) 1.24 (m, 4Н), 2.47 (m, 1H), 7.07 (m, 1H), 7.77 (m, 2H), 7.83 (m, 1H), 7.96 (s, 1H), 8.59 (m, 1H), 8.58 (m, 1H), 11.64 (s, 1H).
Пример синтеза 41:
N-[1-(4-амино-2,6-дифторфенил)-1Н-пиразол-3-ил]-2-(трифторметил)бензамид (соединение (I-1-227) в Таблице 1)
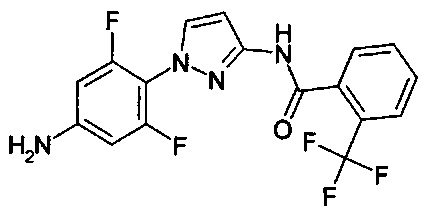
Аналогично примеру синтеза 24, стадия 2, исходя из N-[1-(2,6-дифтор-4-нитрофенил)-1Н-пиразол-3-ил]-2-(трифторметил)бензамида (пример синтеза 26, 1.00 г), 830 мг соединения, указанного в заголовке получали: ВЭЖХ-МС: logP=2.32; масс (m/z): 383.1 (М+Н)+;1Н-ЯМР (ДМСО-D6) 6.09 (m, 2Н), 6.33 (m, 2Н), 6.80 (m, 1Н), 7.68 (m, 2Н), 7.55 (m, 1H), 7.81 (m, 2Н), 11.18 (s, 1Н).
Пример синтеза 42:
N-[1-(4-ацетамидо-2,6-дифторфенил)-1Н-пиразол-3-ил]-2-(трифторметил)бензамид (соединение (I-1-583) в Таблице 1)
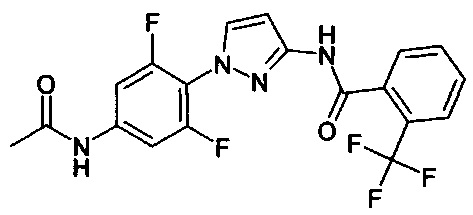
Смесь N-[1-(4-амино-2,6-дифторфенил)-1Н-пиразол-3-ил]-2-(трифторметил)бензамида (100 мг) и уксусного ангидрида (1 г) перемешивали при комнатной температуре в течение одного часа и разбавляли водой (30 мл), и соединение указанное в заголовке (98 мг) отделяли с помощью фильтрации: ВЭЖХ-МС: logP=2.28; масс (m/z): 425.1 (М+Н)+;1Н-ЯМР (ДМСО-D6) 2.11 (s, 3Н), 6.89 (m, 1H), 7.52 (m, 2Н), 7.69 (m, 2Н), 7.76 (m, 1H), 7.82 (m, 1H), 7.99 (m, 1Н), 10.51 (s, 1Н), 11.96 (s, 1Н).
Пример синтеза 43:
N-[1-(3-цианопиразин-2-ил)-1Н-пиразол-3-ил]-2-(трифторметил)бензамид (соединение (I-1-574) в Таблице 1)
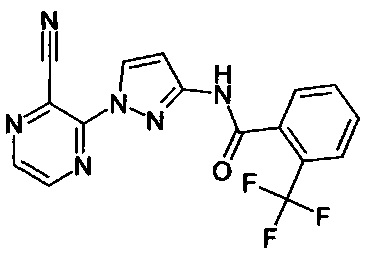
Аналогично примеру синтеза 25, стадия 2, исходя из 3-хлорпиразин-2-карбонитрила: ВЭЖХ-МС: logP=2.47; масс (m/z): 359.0 (М+Н)+;1Н-ЯМР (ДМСО-D6) 7.12 (m, 1H), 7.72 (m, 2Н), 7.78 (m, 1Н), 7.83 (m, 1Н), 8.63 (m, 1Н), 8.75 (m, 1Н), 8.85 (m, 1Н), 11.71 (s, 1Н).
Пример синтеза 44:
N-[1-(6-хлор-5-циано-3-фторпиридин-2-ил)-1Н-пиразол-3-ил]-2-(трифторметил)бензамид (соединение (I-1-606) в Таблице 1)

Аналогично примеру синтеза 25, стадия 2, исходя из 2,6-дихлор-5-фторникотинонитрила: ВЭЖХ-МС: logP=2.94; масс (m/z): 410.0/411.9 (М+Н)+;1Н-ЯМР (ДМСО-D6) 7.11 (m, 1Н), 7.70 (m, 2Н), 7.77 (m, 1Н), 7.83 (m, 1H), 8.52 (m, 1Н), 8.80 (m, 1Н), 8.85 (m, 1Н), 11.89 (s, 1Н).
Пример синтеза 45:
N-[2-(3,5-дифторпиридин-2-ил)-2Н-1,2,3-триазол-4-ил]-2-(трифторметил)бензамид (соединение (I-2-63) в Таблице 3)
Схема синтеза для промежуточного соединения 2-(3,5-дифторпиридин-2-ил)-2Н-1,2,3-триазол-4-амина (Пр-45-V) (через путь А-3)
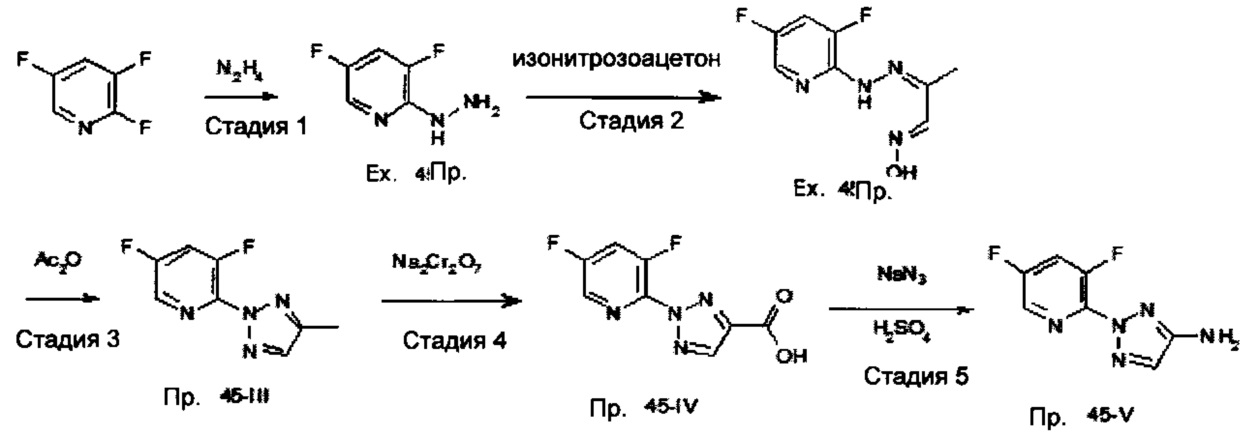
Стадия 1: 3,5-дифтор-2-гидразинопиридин (Пр. 45-I)
25 г 2,3,5-трифторпиридина вместе с избытком гидразин гидрата нагревали с обратным холодильником в течение 1 часа. Реакционную смесь затем подвергали паровой дистилляции, и примерно 1 л дистиллята собирали. Дистиллят экстрагировали 5 раз в каждом случае с помощью 250 мл дихлорметана, органические фазы сушили над сульфатом натрия и растворитель затем удаляли на роторном испарителе. Это обеспечило неочищенный гидразино-3,5-дифторпиридин (48% от теории), который подвергали взаимодействию на следующей стадии без дополнительной обработки.
Стадия 2: 2-[2-(3,5-дифторпиридин-2-ил)гидразинилиден]пропаналь оксим (Пр. 45-II)
Гидразино-3,5-дифторпиридин из первой стадии (Пр. 45-I) нагревали с обратным холодильником с 20%-ым избытком изонитроацетона в этаноле в течение 3 часов. После охлаждения, получали осадок, который отфильтровывали и промывали с помощью этанола. Это обеспечило неочищенный пропаналь оксим (65% от теории), который подвергали взаимодействию на следующей стадии без дополнительной обработки.
Стадия 3: 3,5-дифтор-2-(4-метил-2Н-1,2,3-триазол-2-ил) (Пр. 45-III)
Раствор 0.1 моль гидразон оксима (Пр. 45-II) в уксусном ангидриде медленно нагревали до 130°С и перемешивали при такой температуре в течение 2 часов. Избыток уксусного ангидрида удаляли на роторном испарителе, и образовавшийся метилтриазол (Пр. 45-III) (70% от теории) далее применяли без дополнительной обработки.
Стадия 4: 2-(3,5-дифторпиридин-2-ил)-2Н-1,2,3-триазол-4-карбоновая кислота (Пр. 45-IV)
Дихромат натрия (0.2 моль) добавляли в маленьких порциях к хорошо-перемешиваемому раствору метилтриазола (Пр. 45-III, 0.1 моль) 66%-ной серной кислоты. Каждую отдельную порцию дихромата добавляли только после того, как желто-оранжевый цвет Cr6+ в колбе исчезал. Кроме того, порции добавляли таким образом, что температура в колбе оставалась примерно 80-90°С. Смесь затем нагревали на паровой ванне в течение 1 часа. После охлаждения, смесь выливали в то же самое количество льда и оставляли на ночь. Осажденную кислоту отфильтровывали, промывали с помощью воды и сушили. Это обеспечило 50% от теории кислоты (Пр. 45-IV).
Стадия 5: 2-(3,5-дифторпиридин-2-ил)-2Н-1,2,3-триазол-4-амин (Пр. 45-V)
Азид натрия добавляли в маленьких порциях к перемешиваемой смеси кислоты из прекурсора (Пр. 45-IV) в 50 мл хлороформа и 50 мл конц. серной кислоты в течение периода в 2 ч. Реакцию перемешивали при 55°С в течение последующих 2 ч. После охлаждения, смесь выливали в примерно тоже самое количество льда и оставляли на ночь, твердые вещества затем отфильтровывали и исходное вещество подщелачивали с использованием раствора аммония. Осажденный амид отфильтровывали, промывали с помощью воды и сушили. Это обеспечило 70% от теории. ВЭЖХ-МС: logP=0.65; масс (m/z): 198.0 (М+Н)+;1Н-ЯМР (ДМСО-D6) 5.61 (s, 2Н), 7.38 (s, 1H), 8.21-8.25 (m, 1Н), 8.45 (s, 1Н).
N-[2-(3,5-дифторпиридин-2-ил)-2Н-1,2,3-триазол-4-ил]-2-(трифторметил)бензамид (соединение (I-2-63) в Таблице 3)

Аналогично примеру синтеза 9 стадия 2, 2-(3,5-дифторпиридин-2-ил)-2Н-1,2,3-триазол-4-амин (Пр. 45-V; 174 мг) подвергали взаимодействию с 2-(трифторметил)бензоил хлоридом (150 мг) и триэтиламином (0.23 мл) в 4 мл дихлорметана. Очистка с помощью колоночной хроматографии и препаративной ВЭЖХ обеспечила 207 мг соединения, указанного в заголовке. ВЭЖХ-МС: logP=2.38; масс (m/z): 370.0 (М+Н)+;1H-ЯМР (ДМСО-D6) 7.72-7.83 (m, 3Н), 8.35-8.40 (m, 1Н), 8.45-8.47 (m, 1Н), 8.57-8-58 (s, 1Н), 11.96-11-97 (d, 1Н).
Аналогично Пр. 45-V, новые промежуточные соединения ниже получали (через путь А-3):
2-(3-фторпиридин-2-ил)-2Н-1,2,3-триазол-4-амин:

ВЭЖХ-МС: logP=0.40; масс (m/z): 180.0 (М+Н)+;1Н-ЯМР (ДМСО-D6) 5.61 (s, 2Н), 7.39 (s, 1Н), 7.48-7.52 (m, 1Н), 7.95-8.00 (m, 1Н), 8.35-8.36 (m, 1H).
2-[5-(трифторметил)пиридин-2-ил]-2Н-1,2,3-триазол-4-амин:

ВЭЖХ-МС: logP=1.53; масс (m/z): 230.0 (М+Н)+;1Н-ЯМР (ДМСО-D6) 5.86 (s, 2Н), 7.48 (s, 1H), 7.91-7.94 (m, 1Н), 8.29-8.31 (m, 1Н), 8.8 (s, 1Н).
2-(3,5-дихлорпиридин-2-ил)-2Н-1,2,3-триазол-4-амин:
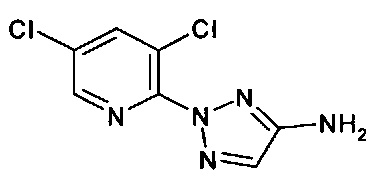
ВЭЖХ-МС: logP=1.38; масс (m/z): 229.9 (М+Н)+;1Н-ЯМР (ДМСО-D6) 5.60 (s, 2Н), 7.38 (s, 1Н), 8.48-8.49 (d, 1H), 8.58-8.59 (d, 1H).
2-[3-хлор-5-(трифторметил)пиридин-2-ил]-2Н-1,2,3-триазол-4-амин:
ВЭЖХ-МС: logP=1.74; масс (m/z): 263.9 (M+H)+;1Н-ЯМР (ДМСО-D6) 5.76 (s, 2H), 7.48 (s, 1H), 8.68-8.69 (d, 1H), 8.89-8.90 (d, 1H).
Пример синтеза 46
N-[1-(2,6-дифторфенил)-1Н-пиррол-3-ил]-2-(трифторметил)бензамид (соединение (I-3-1) в Таблице 5)
Схема синтеза для промежуточного соединения: 1-(2,6-дифторфенил)-1Н-пиррол-3-амин (Пр. 46-III) (через путь А-4)

Стадия 1: 1-(2,6-дифторфенил)-1Н-пиррол (Пр. 46-I)
При перемешивании, 0.39 моль 2,5-диметокситетрагидрофурана медленно добавляли по каплях к 0.39 моль 2,6-дифторанилина в 100 мл ледяной уксусной кислоты, и смесь перемешивали при 100°С в течение еще одного 1 ч. После охлаждения до комнатной температуры, ледяную уксусную кислоту удаляли на роторном испарителе и остаток неоднократно концентрировали с помощью толуола. Очистка остатка с помощью колоночной хроматографии, используя циклогексан/этилацетат (10:1 - 1:1) обеспечила 5.6 г, 78% от теории, желаемого пиррола с чистотой 96% (ЖХМС). ВЭЖХ-МС: logP=2.98;1Н-ЯМР (CD3CN) 6.28-6.29 (m, 2Н), 6.95-7.00 (m, 2Н), 7.30-7.35 (m, 2Н), 7.45-7.52 (m, 1Н).
Стадия 2: 1-(2,6-дифторфенил)-3-нитро-1Н-пиррол (Пр. 46-II)
При -10°С, 162 мл уксусного ангидрида аккуратно добавляли по каплях к 2 мл конц. азотной кислоты. При -40°С, эту смесь затем добавляли по каплях к раствору 5.4 г (0.31 моль) 1-(2,6-дифторфенил)-1Н-пиррола в 80 мл уксусного ангидрида Смесь затем перемешивали при такой температуре в течение дополнительных 2 часов. Реакционную смесь выливали на лед и экстрагировали три раза с помощью хлороформа. После сушки органической фазы над сульфатом натрия, растворитель удаляли на роторном испарителе. Очистка остатка с помощью колоночной хроматографии с использованием циклогексана/этилацетата (10:1 - 1:1) обеспечила, дополнительно к 2-нитро изомеру, 3.2 г (48% от теории) желаемого 3-нитропиррола с чистотой 99% (ЖХМС). ВЭЖХ-МС: logP=2.58; масс (m/z): 225.1 (М+Н)+;1Н-ЯМР (CD3CN) 6.60-6.62 (m, 1H), 7.37-7.42 (m, 2H), 7.55-7.58 (m, 2H), 7.62-7.70 (m, 1H).
Стадия 3: 1-(2,6-дифторфенил)-1Н-пиррол-3-амин (Пр. 46-III)
При 80°С, 575 мг (2.57 ммоль) 3-нитропиррола и 2.43 г (12.8 ммоль) хлорида олова в 17 мл этилацетата перемешивали в течение ночи. После охлаждения, смесь отфильтровывали и растворитель удаляли на роторном испарителе. Полученный таким образом остаток использовали непосредственно и без дополнительной обработки для следующей реакции.
N-[1-(2,6-дифторфенил)-1Н-пиррол-3-ил]-2-(трифторметил)бензамид (соединение (I-3-1) в Таблице 5)
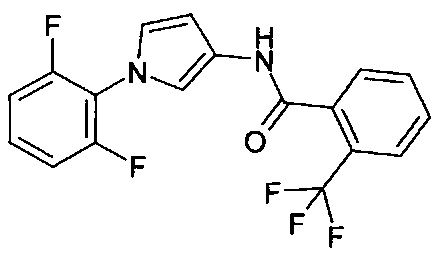
Аналогично примеру синтеза 9 стадия 2, неочищенный 1-(2,6-дифторфенил)-1Н-пиррол-3-амин (85 мг) подвергали взаимодействию с 2-(трифторметил)бензоилхлоридом (92 мг) и триэтиламином (0.12 мл) в 1.3 мл дихлорметана. Очистка с помощью колоночной хроматографии и препаративной ВЭЖХ обеспечила 26 мг соединения, указанного в заголовке. ВЭЖХ-МС: logP=2.96; масс (m/z): 367.0 (М+Н)+;1Н-ЯМР (ДМСО-D6) 6.31-6.32 (m, 1Н), 6.92-6.94 (m, 1Н), 7.31-7.39 (m, 3Н), 7.48-7.52 (m, 1Н), 7.66-7.84 (m, 4Н).
Пример синтеза 47
N-[1-(2-хлорфенил)-1Н-индазол-3-ил]-2-(трифторметил)бензамид (соединение (I-5-8) в Таблице 4)
Стадия 1: 1-(2-хлорфенил)-1Н-индазол-3-амин (через путь В-2)

В атмосфере аргона, 2-йодбензонитрил (500 мг), N'-(2-хлорфенил)бензогидразид (646 мг), карбонат калия (1207 мг), медь(I) бромид (31 мг) и транс-4-гидрокси-L-пролин (57 мг) перемешивали в диметилсульфоксиде (7.5 мл) при 90°С в течение 48 ч. После охлаждения, реакционную смесь разводили в этилацетате, промывали с помощью насыщенного раствора хлорида аммония и насыщенного раствора хлорида натрия, адсорбировали на силикагеле и очищали с помощью колоночной хроматографии на силикагеле с использованием мобильной фазы циклогексан/этилацетат. 226 мг соединения, указанного в заголовке получали. ВЭЖХ-МС: logP=2.32; масс (m/z): 244.0 (М+Н)+;1Н-ЯМР (ДМСО-D6) 5.83 (br. s, 2Н), 7.01-7.09 (m, 2Н), 7.31-7.35 (m, 1Н), 7.42-7.49 (m, 3Н), 7.67-7.69 (m, 1H), 7.82-7.84 (m, 1H).
Стадия 2: N-[1-(2-хлорфенил)-1Н-индазол-3-ил]-2-(трифторметил)бензамид (соединение I-5-8 в Таблице 4)

Аналогично примеру синтеза 9 стадия 2, 1-(2-хлорфенил)-1Н-индазол-3-амин
(174 мг) подвергали взаимодействию с 2-(трифторметил)бензоил хлоридом (47 мг) и триэтиламином (0.6 мл) в 4 мл дихлорметана. Очистка с помощью колоночной хроматографии и препаративной ВЭЖХ обеспечила 20 мг соединения, указанного в заголовке. ВЭЖХ-МС: logP=3.54; масс (m/z): 416.0 (М+Н)+;1Н-ЯМР (ДМСО-D6) 7.19-7.28 (m, 2Н), 7.45-7.49 (m, 1Н), 7.57-7.63 (m, 3Н), 7.65-7.95 (m, 6H), 11.31 (s, 1H).
Аналогично Пр. 47 стадия 1, 4-(3-амино-4-фтор-1Н-индазол-1-ил)-2,5-дифторбензонитрил может быть получен из 2-фтор-6-йодбензонитрила и N'-(4-циано-2,5-дифторфенил)бензогидразида.
Пример синтеза 48
N-[1-(3,5-дифтор-1-оксидопиридин-2-ил)-1Н-пиразол-3-ил]-2-(трифторметил)бензамид (соединение I-1-438 в Таблице 1)

N-[1-(3,5-дифторпиридин-2-ил)-1Н-пиразол-3-ил]-2-(трифторметил)бензамид (1-1-75 в Таблице 1; 150 мг) перемешивали с водородпероксидом-мочевиной (153 мг) в 3 мл дихлорметана в течение 30 мин. На ледяную ванну при 0-5°С, трифторуксусный ангидрид (342 мг) затем добавляли по каплях, и смесь перемешивали в течение ночи. Раствор сульфита натрия затем добавляли, и смесь промывали с помощью воды, сушили над сульфатом натрия и затем концентрировали на роторном испарителе. Очистка с помощью колоночной хроматографии и препаративной ВЭЖХ обеспечила 35 мг соединения, указанного в заголовке. ВЭЖХ-МС: logP=1.69; масс (m/z): 385.1 (М+Н)+;1Н-ЯМР (ДМСО-D6) 6.95-6.96 (d, 1Н), 7.68-7.78 (m, 4Н), 7.82-7.96 (m, 1Н), 8.05-8.06 (m, 1Н), 8.83-8.85 (m, 1Н), 11.33 (s, 1H).
Соединения для формул (I-1), (I-4), (I-2), (I-5) и (I-3) описанные в Таблицах 1-5 являются также предпочтительными соединениями, которые получали согласно или аналогично примерам синтеза, описанным выше.

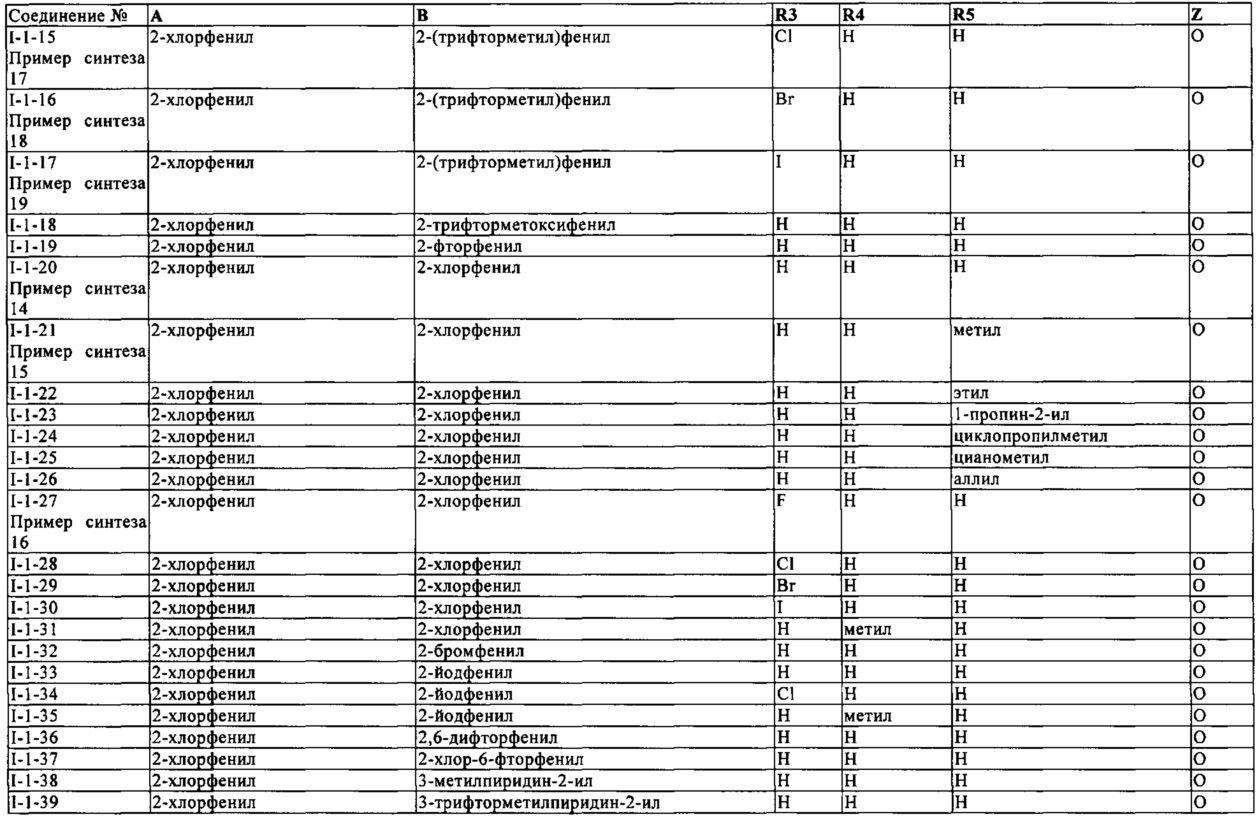
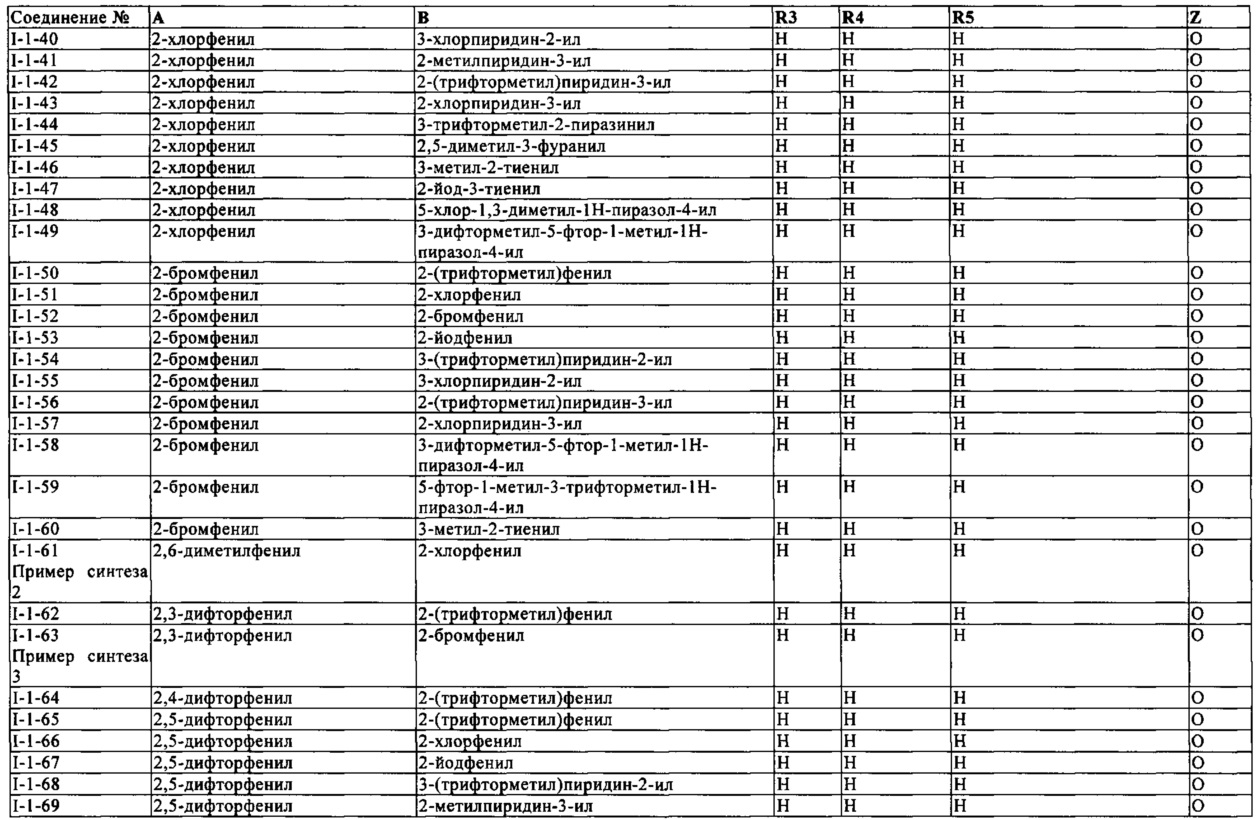
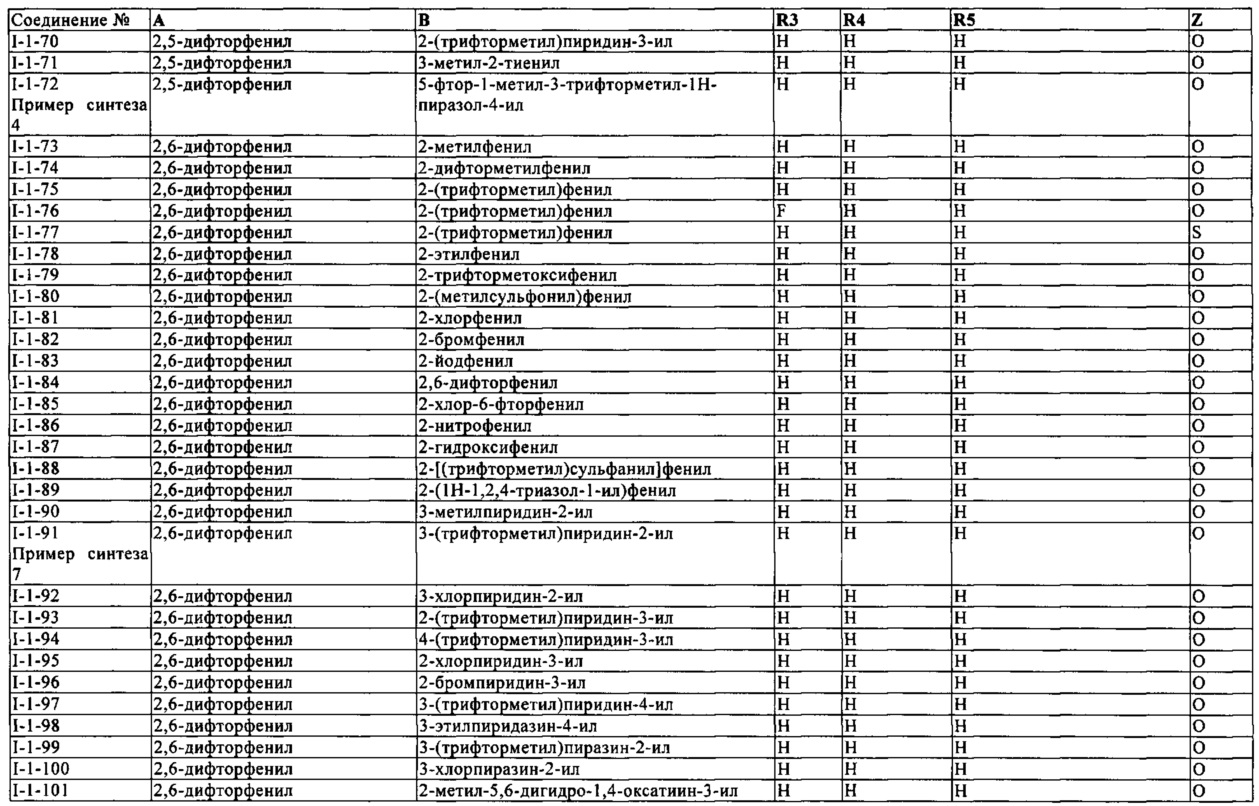
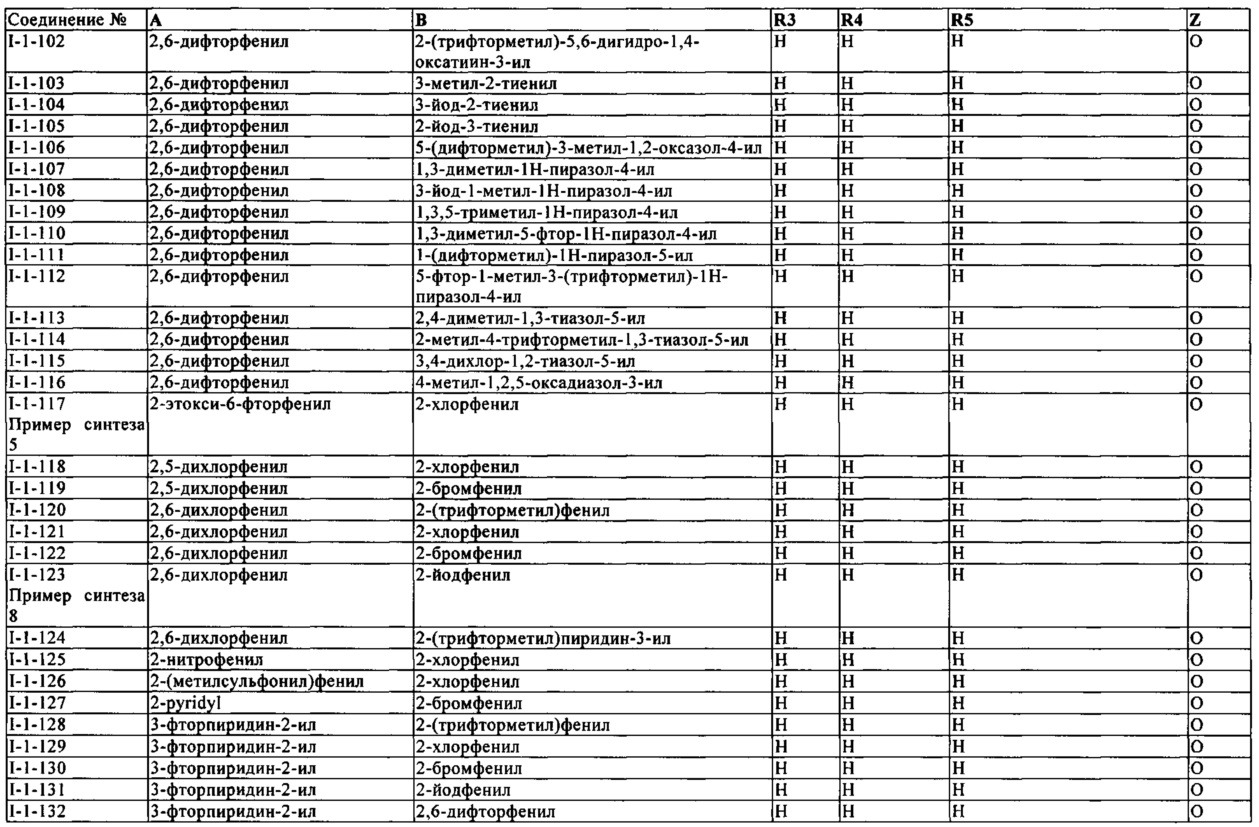
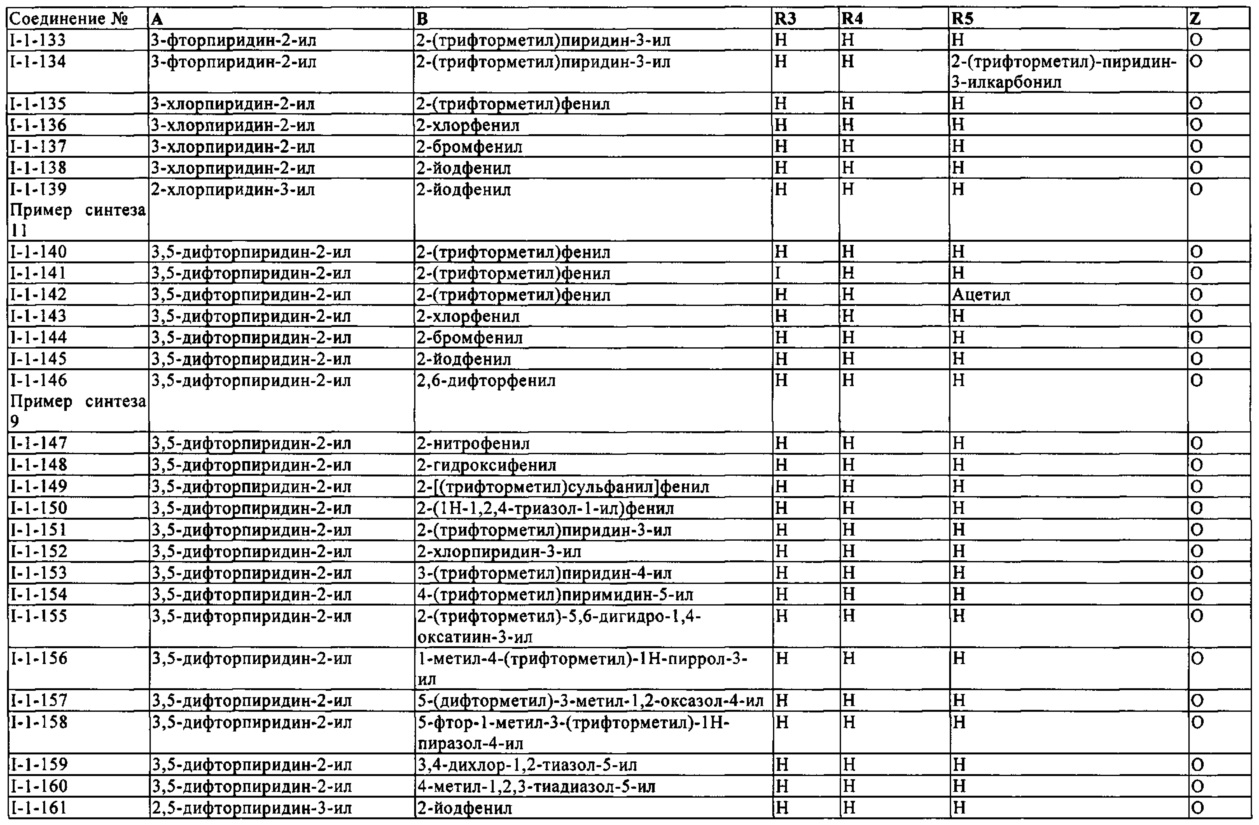


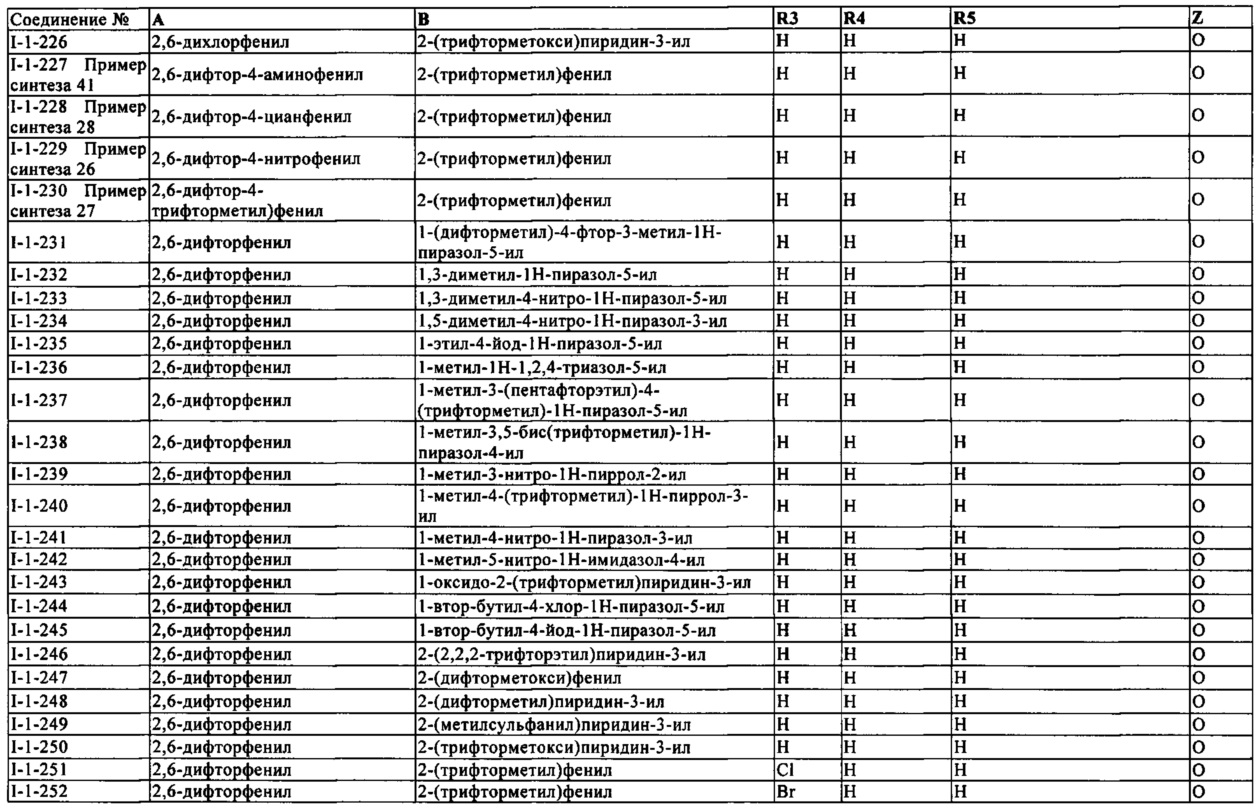

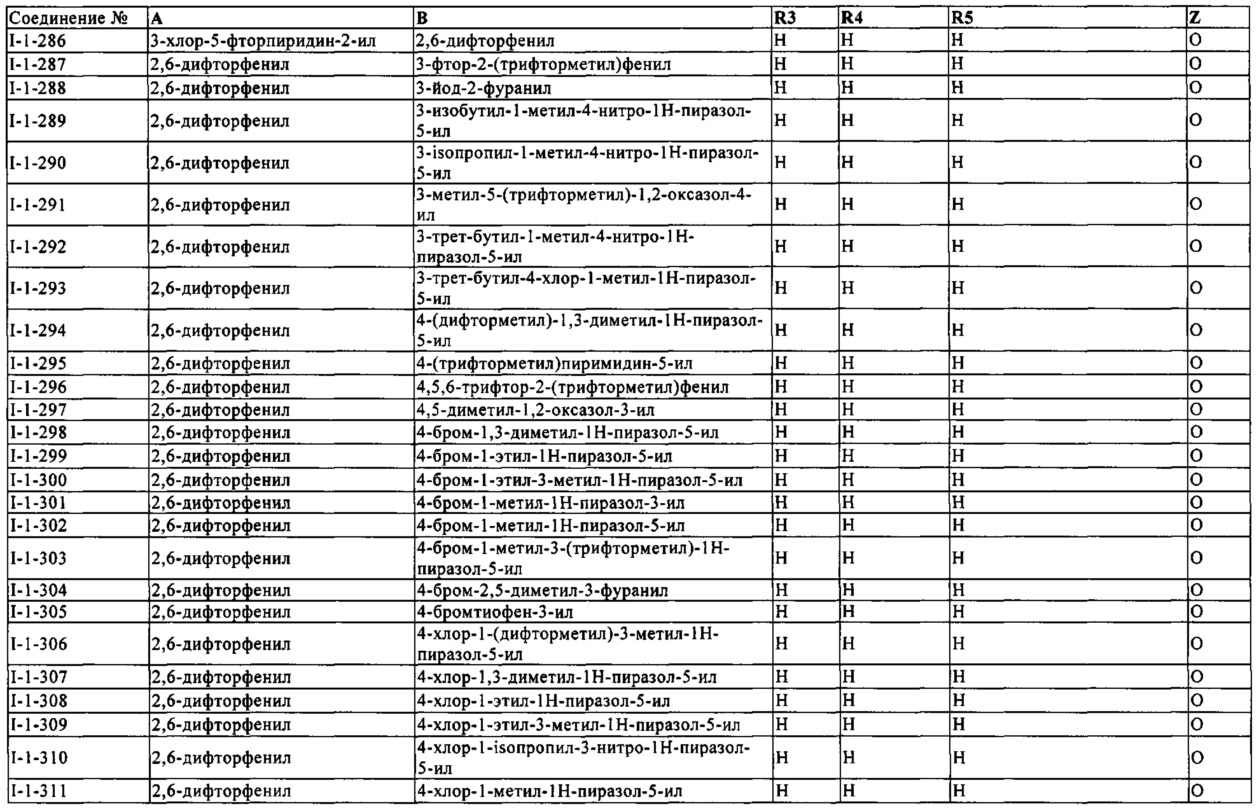
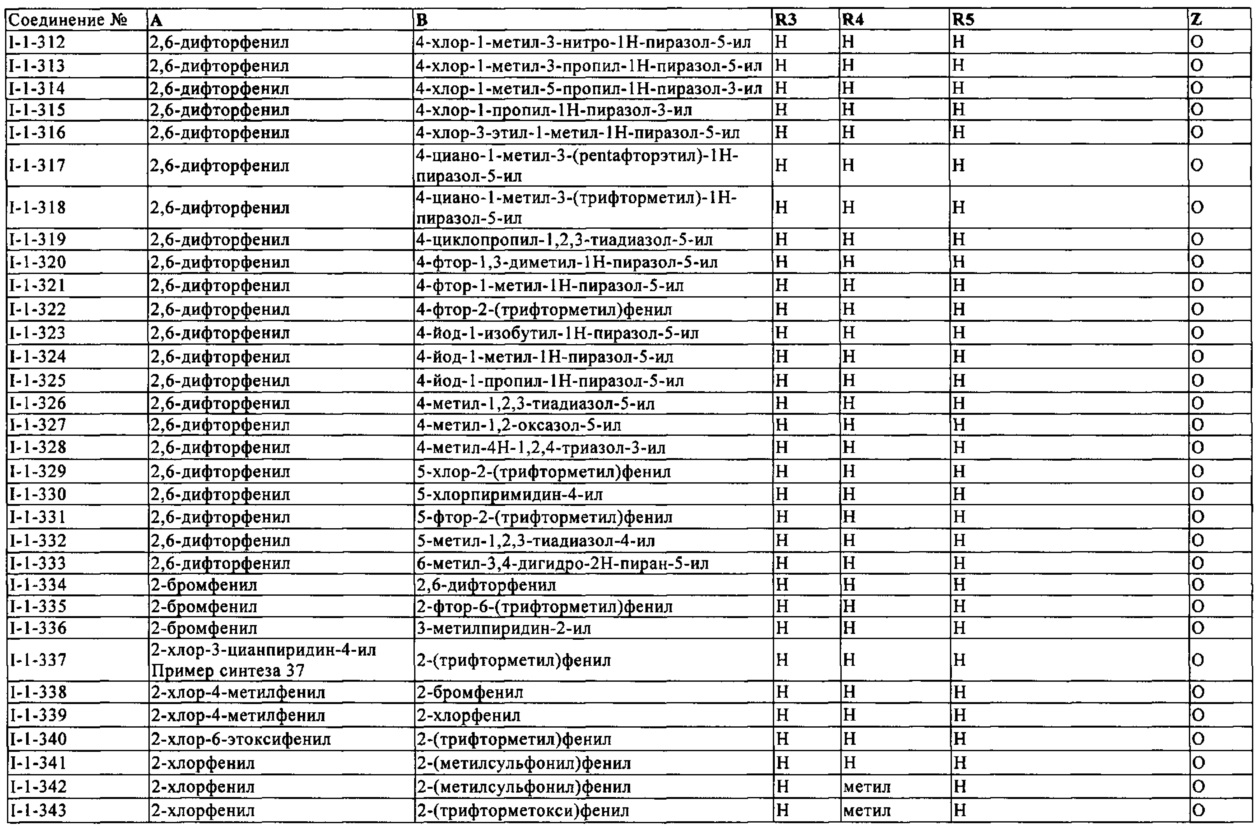

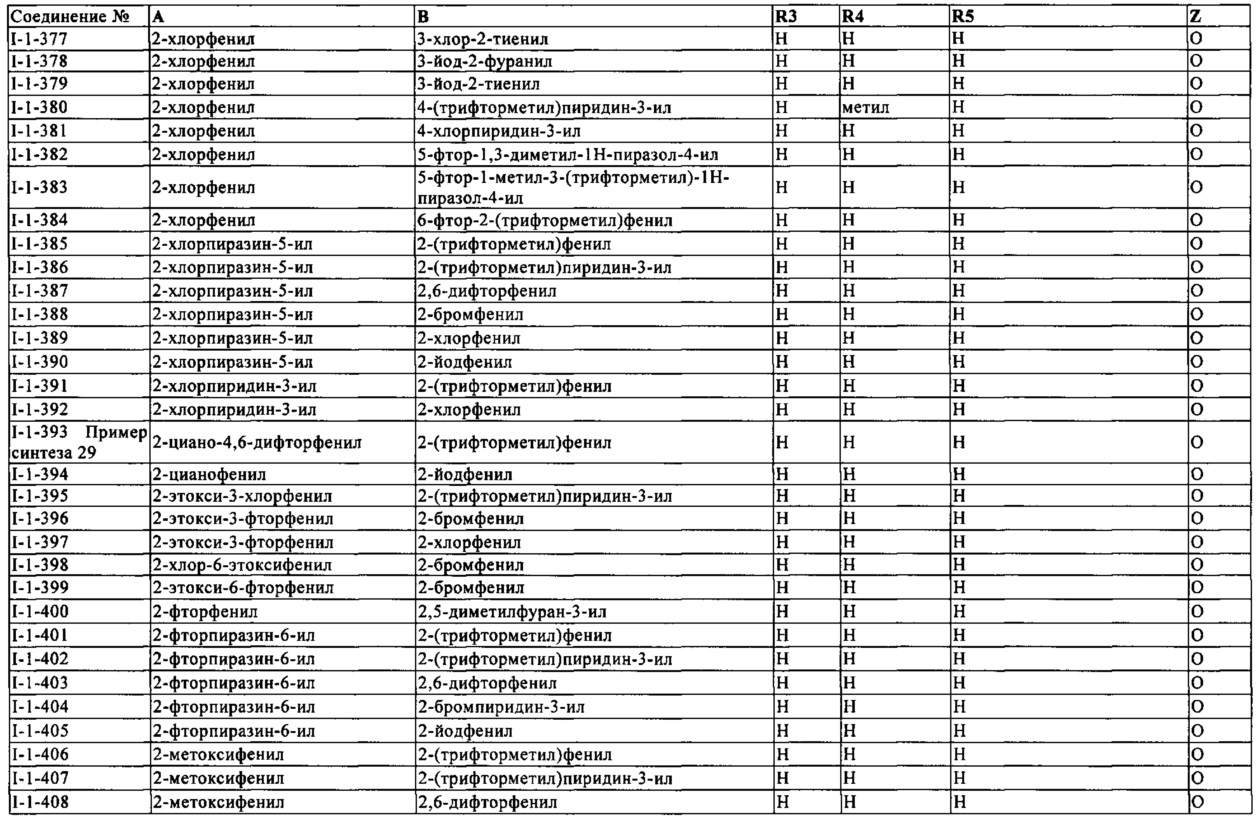
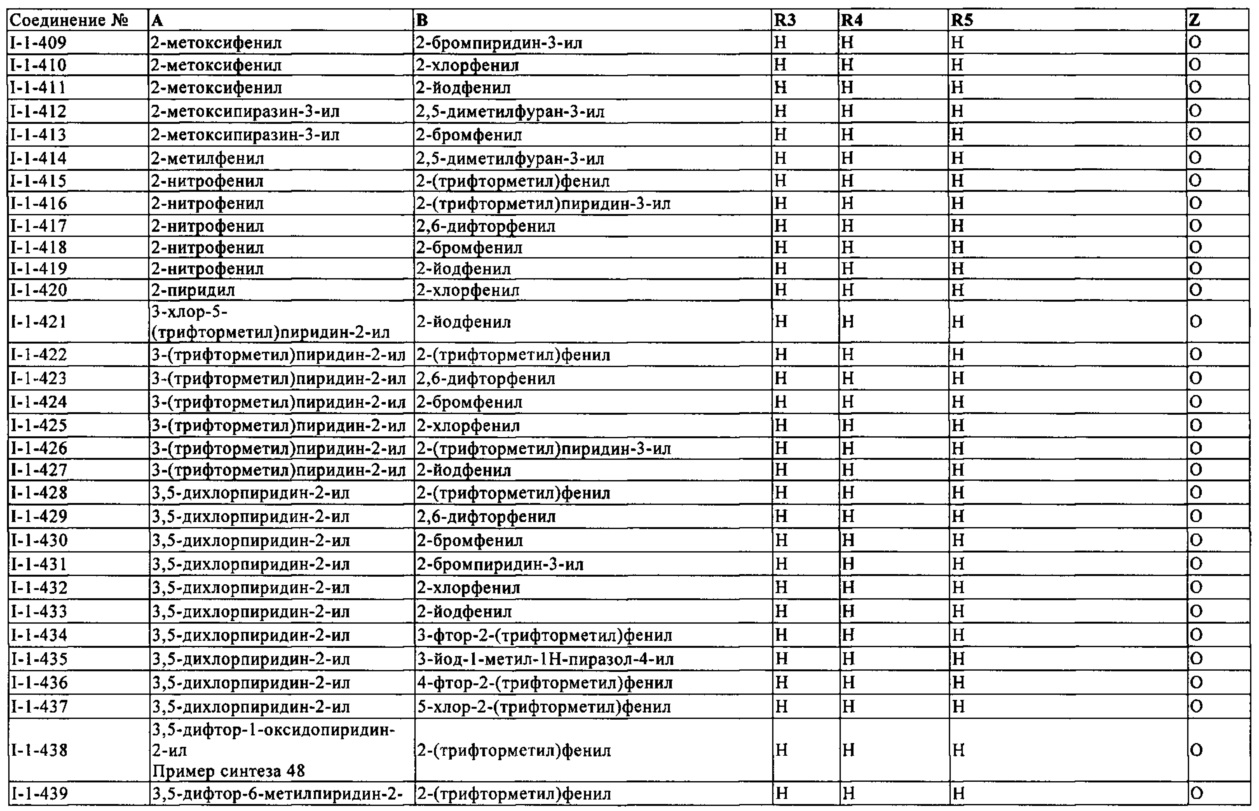
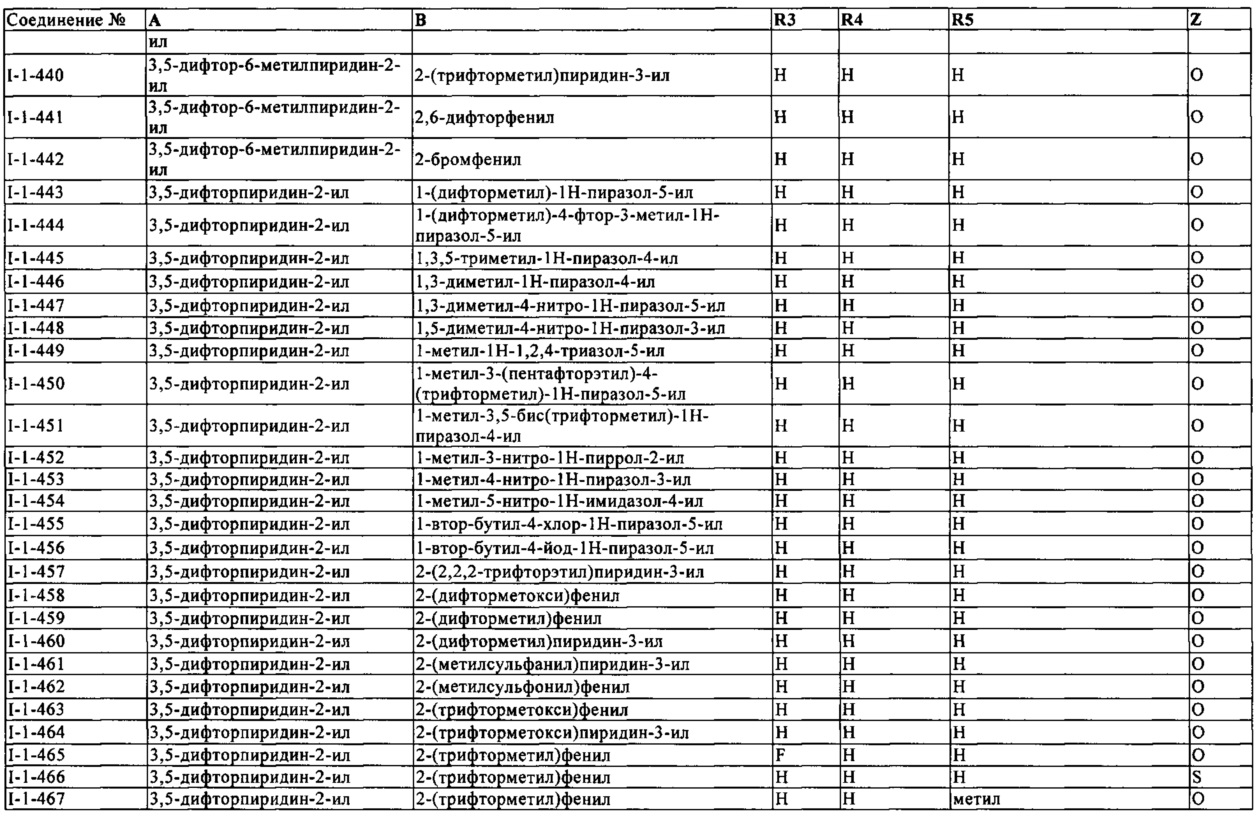
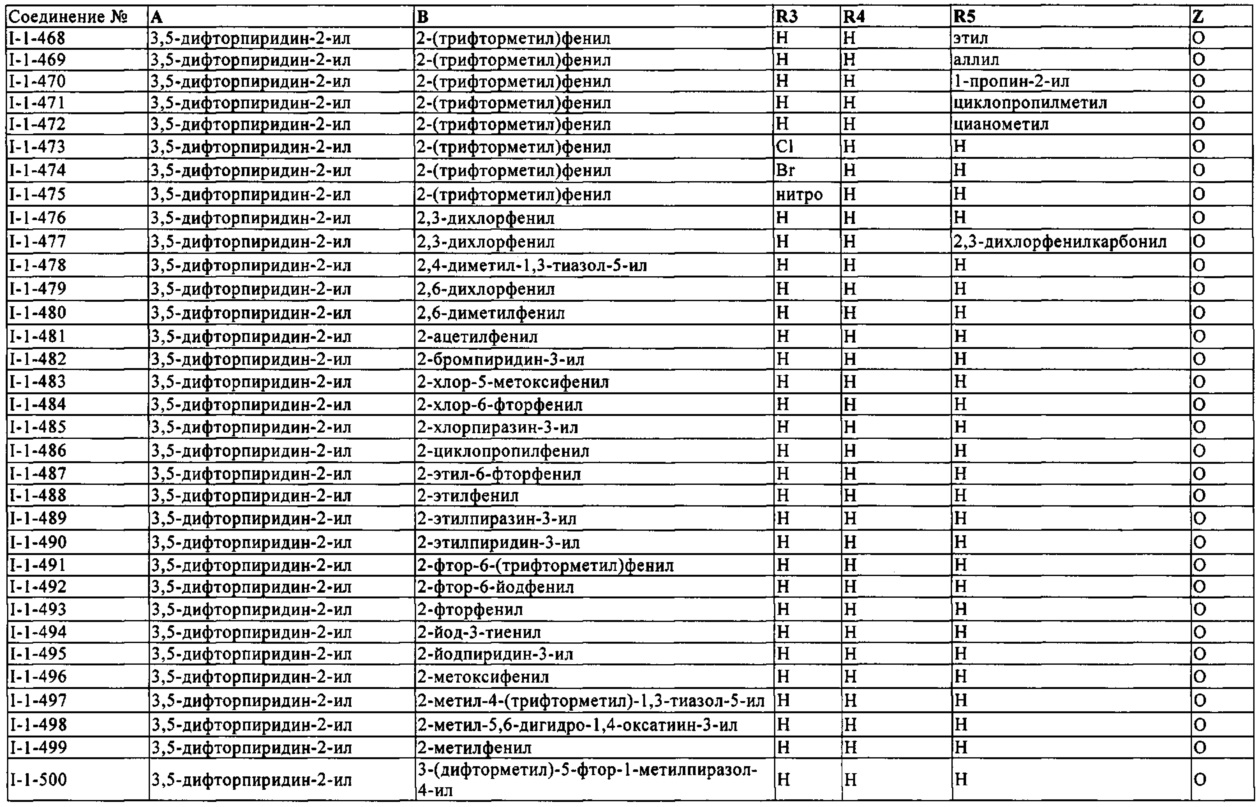
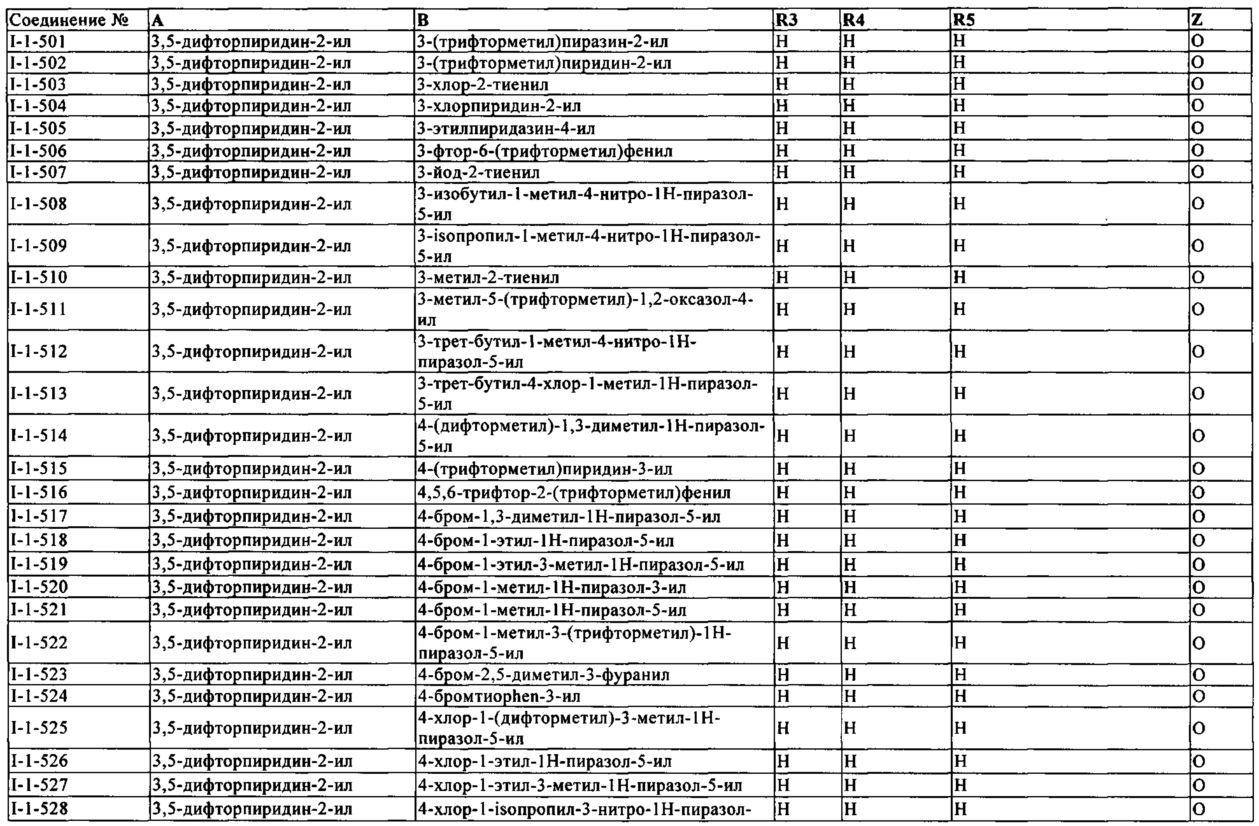
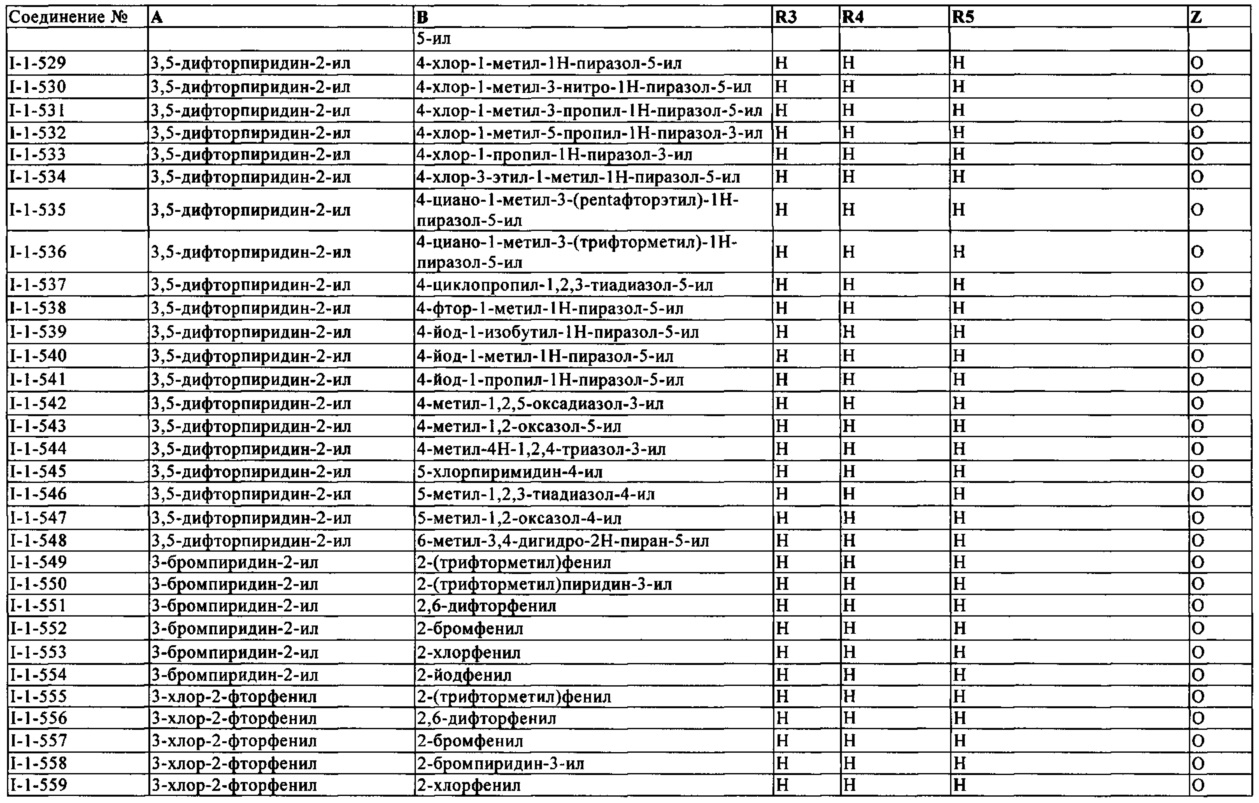

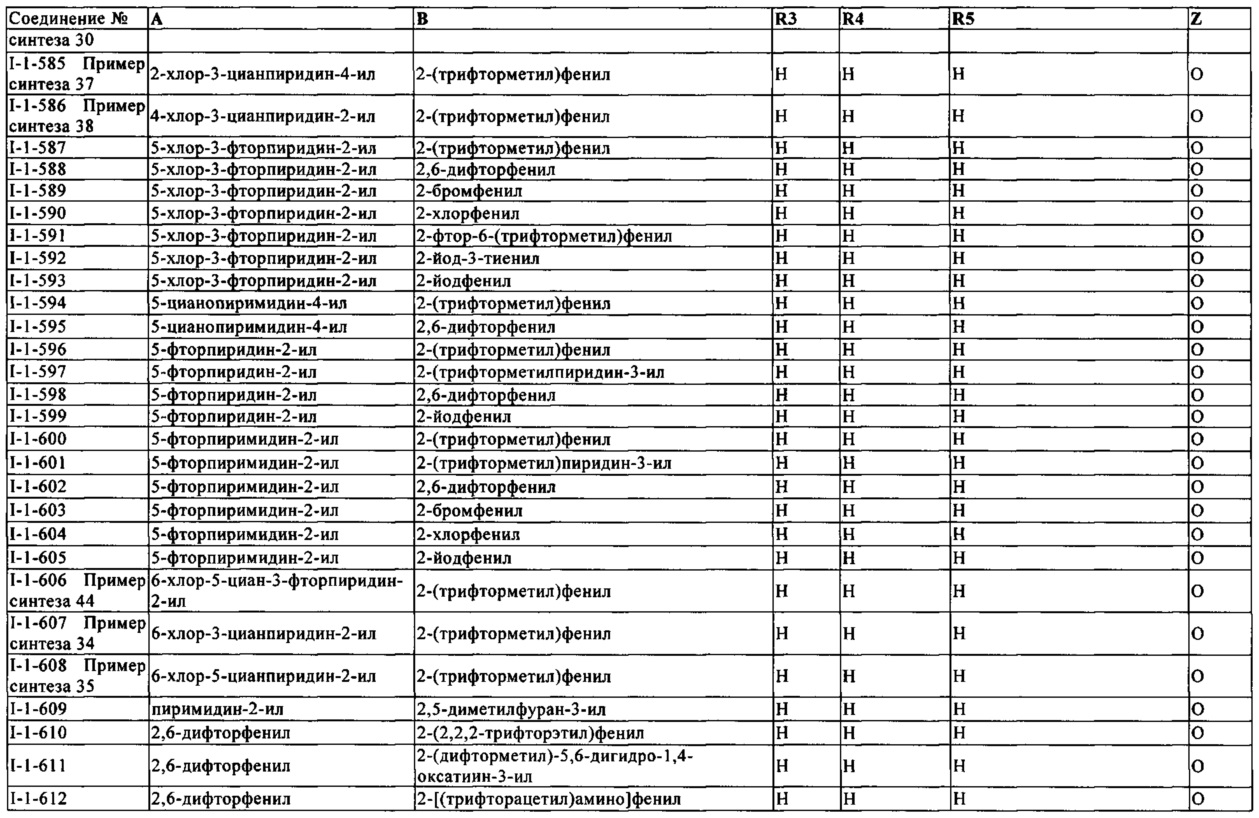
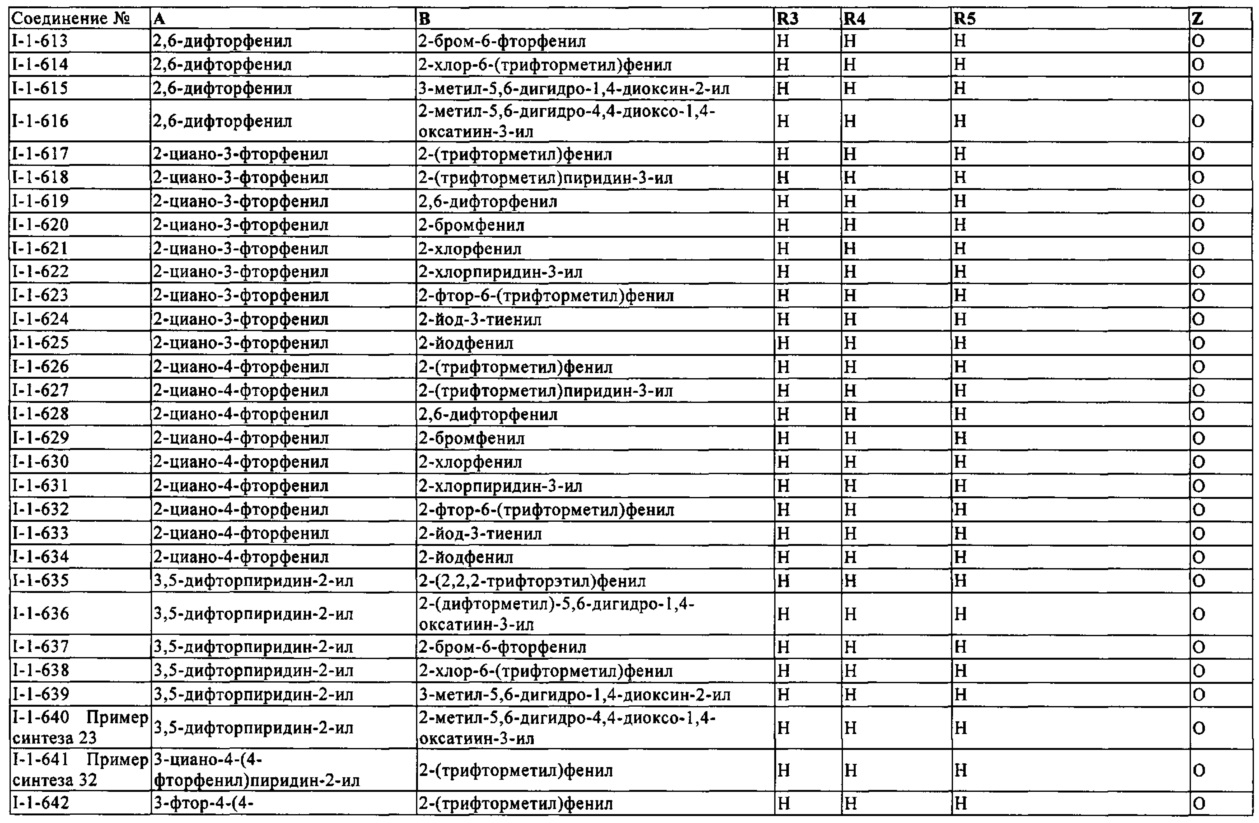

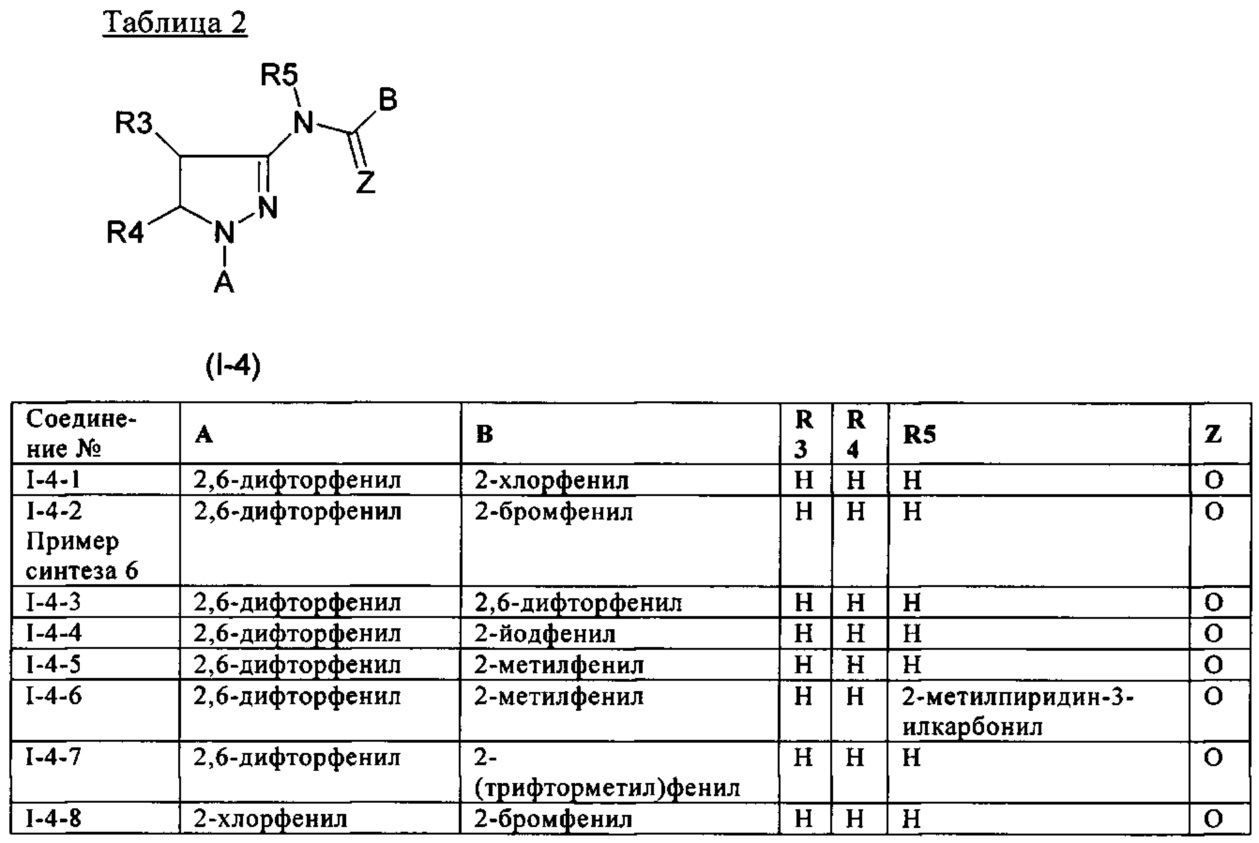


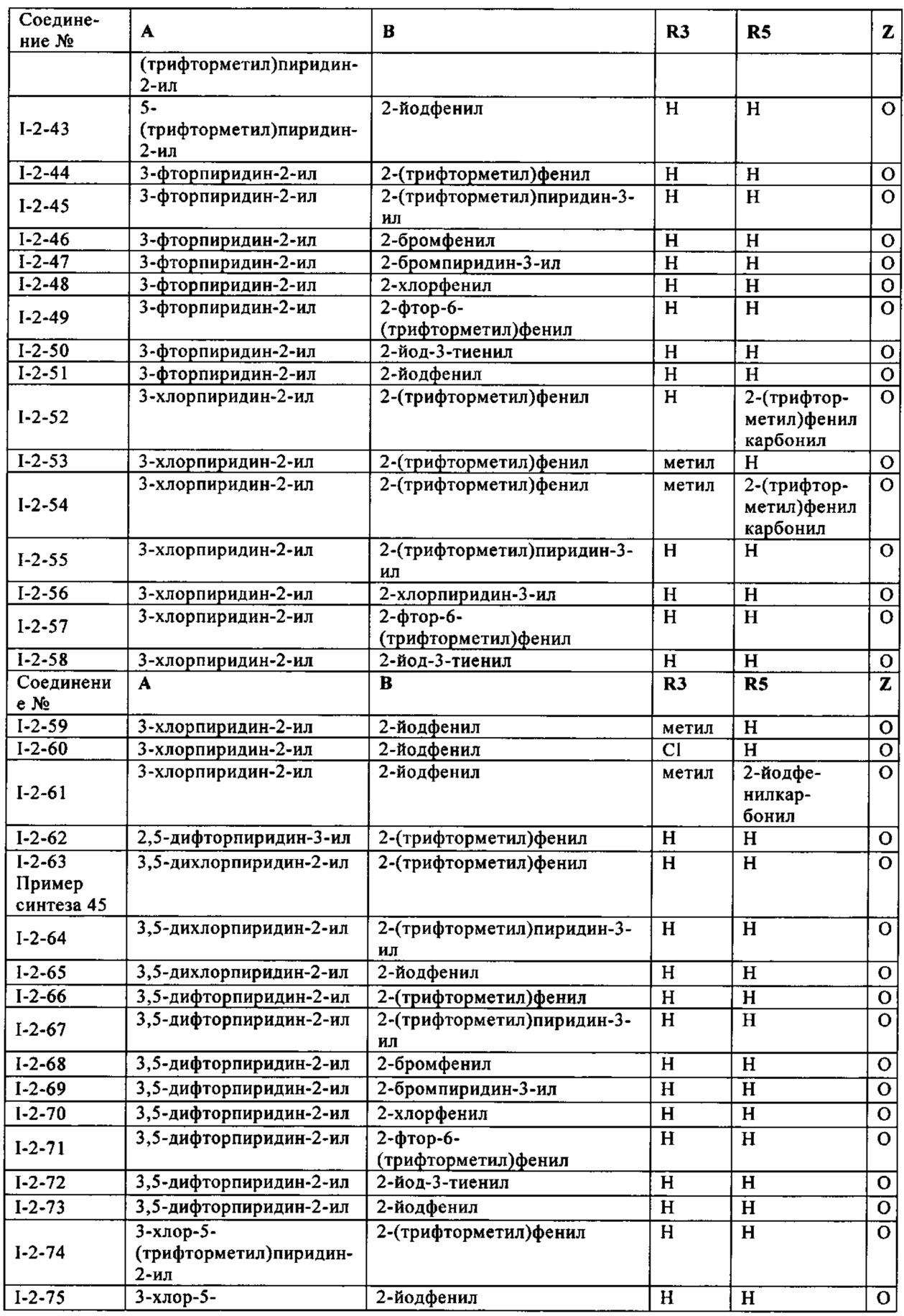


























































































































1) Описание метода для определения значений logP (метод муравьиной кислоты)
Значения logP, приведенные в таблице, были определены в соответствии с директивой ЕЭС 79/831 приложение V.A8 с помощью ВЭЖХ (высокоэффективной жидкостной хроматографии) с использованием обращенно-фазовой колонки (С18). Температура: 55°С.
Элюенты для определения в кислотном диапазоне (pH 3,4):
Элюент А: ацетонитрил + 1 мл муравьинной кислоты/литр. Элюент В: вода + 0.9 мл муравьиной кислоты/литр.
Градиент: от 10% элюент А / 90% элюент В до 95% элюент А / 5% элюент В через 4.25 мин.
Калибровку проводили с использованием неразветвленных алкан-2-онов (содержащие от 3 до 16 атомов углерода) с известными значениями logP (значения logP были определены по времени удерживания с использованием линейной интерполяции между двумя последовательными алканонами). Максимальные значения лямбда определяли в максимумах хроматографических сигналов, используя УФ спектры от 200 нм до 400 нм.
2) Измерение спектров ЯМР выбранных примеров
ЯМР-спектры были определены с использованием Bruker Avance 400, снабженного головкой зонда потока (объем 60 мкл). Используемые растворители представляли собой CD3CN или ДМСО-D6, и тетраметилсилан (0,00 м.д.) использовали в качестве ссылки. В отдельных случаях, спектры ЯМР были определены с использованием Bruker Avance II 600. Используемые растворители представляли собой CD3CN или ДМСО-D6, и тетраметилсилан (0,00 м.д.) использовали в качестве ссылки.
Данные ЯМР для выбранных примеров перечислены в традиционной форме (d величины, числа атомов водорода, мультиплет расщепление) или как перечни пиков ЯМР.
Расщепление сигналов было описано следующим образом: s (синглет), d (дублет), t (триплет), q (квартет), quin (квинтет), m (мультиплет).
Метод перечня пиков ЯМР
Когда данные1Н ЯМР для выбранных примеров отмечены в виде перечня пиков1Н ЯМР, сначала величина d в м.д. и затем интенсивность сигнала в круглых скобках указаны для каждого пика сигнала. Значение d - число пар интенсивность сигнала для различных пиков сигнала перечисленных с разделением друг от друга точкой с запятой.
Перечень пиков для одного примера, следовательно, принимает форму:
δ1 (интенсивность1); δ2 (интенсивность2); …; δi (интенсивностьi); …; δn (интенсивностьn)
Интенсивность острых сигналов коррелирует с высотой сигналов в печатном примере ЯМР спектра в см и показывает истинные отношения интенсивностей сигналов. В случае широких сигналов, несколько пиков или середина сигнала и их относительные интенсивности могут быть показаны в сравнении с наиболее интенсивным сигналом в спектре.
Для калибровки химического сдвига спектров1Н ЯМР использовали тетраметилсилан и/или химический сдвиг растворителя, в частности, в случае спектров, измеренных в ДМСО. Таким образом, пик тетраметилсилана может, но не обязательно появляться в перечнях пиков ЯМР.
Перечни пиков1Н ЯМР схожи со стандартными распечатками1Н ЯМР, и таким образом как правило, содержат все пики, перечисленные в стандартных интерпретациях ЯМР.
Кроме того, как стандартные распечатки1Н ЯМР, они могут демонстрировать сигналы растворителя, сигналы стереоизомеров целевых соединений, которые подобным образом, являются частью предмета изобретения, и/или пики примесей.
В отчетности сигналов соединения в дельта диапазоне растворителей и/или воды, перечни1Н ЯМР пиков показали обычные пики растворителя, например, пики ДМСО в ДМСО-d6 и пик воды, которые, как правило, имеют высокую интенсивность в среднем.
Пики стереоизомеров целевых соединений и/или пики примесей, как правило, имеют более низкую интенсивность, чем в среднем пики целевых соединений (например, с чистотой >90%).
Такие стереоизомеры и/или примеси могут быть типичными для конкретного процесса получения. Их пики могут, таким образом, помочь выявить воспроизведение нашего процесса получения со ссылкой на "побочный продукт отпечатков пальцев".
Эксперт, который расчитывает пики целевых соединений с помощью известных методов (MestReC, ACD моделирование, но также с эмпирически оцененными ожидаемыми значениями) могут, при необходимости, отделить пики целевых соединений, необязательно используя дополнительные фильтры интенсивности. Это отделение будет аналогичным соответствующей комплектации пика в обычной интерпретации1Н ЯМР.
Более подробная информация о перечнях пиков1H ЯМР можно найти в Research Disclosure Database Number 564025.
Примеры применения
Следующие примеры демонстрируют действие соединений согласно изобретению на насекомых, клещей и нематицидов. Указанные соединения согласно изобретению относятся к соединениям, перечисленным в Таблицах от 1 до 5 с соответствующими ссылочными номерами, например, I-1-1:
Пример 1:
Тест с Boophilus microplus (DIP)
Исследуемые животные: взрослые и сытые самки Boophilus microplus SP-устойчивые штамма Паркхерст
Растворитель: диметилсульфоксид
10 мг активного соединения растворяли в 0,5 мл диметилсульфоксида. С целью приготовления соответствующей композиции, раствор активного соединения разбавляли водой до требуемой концентрации в каждом случае.
Этот препарат биологически активного соединения с помощью пипетки переносили в пробирки. 8-10 клещей, переносили в дополнительную трубку с отверстиями. Трубку погружали в композицию активного соединения, и все клещи проходили полное смачивание. После того, как жидкость закончилась, клещей переносили на фильтровальные диски в пластиковые посудины и хранили в помещении с климат-контролем.
Активность оценивали через 7 дней с помощью откладки оплодотворенных яиц. Яйца, чья рождаемость не видна снаружи хранили в шкафу с климат-контролем до вылупления личинок. Эффективность в 100% означает, что ни один из этих клещей не отложил никаких плодородных яиц.
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали эффективность в 80% при норме применения 100 м.д.: I-1-32, I-1-82
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали эффективность в 90% при норме применения 100 м.д.: I-1-39, I-1-53, I-1-91
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали эффективность в 100% при норме применения 100 м.д.: I-1-5, I-1-33, I-1-48, I-1-83, I-1-96, I-1-99, I-2-1
Тест с Boophilus microplus (BOOPMI инжекция)
Растворитель: диметилсульфоксид
Для получения подходящего препарата активного соединения, 10 мг активного соединения смешивали с 0,5 мл растворителя, и полученный концентрат разбавляли растворителем до желаемой концентрации.
Раствор активного соединения вводили в брюшную полость (Boophilus microplus), и животные перемещали в посудины и хранили в помещении с климат-контролем.
Активность оценивали через 7 дней с помощью откладки оплодотворенных яиц. Яйца, чья рождаемость не видна снаружи хранили в шкафу с климат-контролем до вылупления личинок после примерно 42 дней. Эффективность в 100% означает, что ни один из этих клещей не отложил никаких плодородных яиц; 0% означает, что все яйца являются плодородными.
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали эффективность в 80% при норме применения 20 мкг/животное: I-1-55
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали эффективность в 100% при норме применения 20 мкг/животное:

Пероральный тест с Ctenocephalides felis (CTECFE)
Растворитель: 1 ч. по массе диметилсульфоксида
Для получения подходящего препарата активного соединения, 10 мг активного соединения, смешивали с 0,5 мл диметилсульфоксида. Часть концентрата разбавляли цитратной кровью скота, и получали желаемую концентрацию.
Около 20 некормленых взрослых блох (Ctenocephalides Felis) помещали в камеру, которая закрыта в верхней и нижней части марлей. Металлический цилиндр, нижний конец которого закрыт с помощью парафильма находится на камере. Цилиндр содержит кровь/препарат биологически активного соединения, которое может быть впитано блохами через мембрану парафильма.
Через 2 дня, смертность в % определяли. 100% означает, что все блохи были умерщвлены; 0% означает, что ни одна из блох не была умерщвлена.
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали эффективность в 80% при норме применения 100 м.д.: I-1-91, I-1-99
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали эффективность в 85% при норме применения 100 м.д.: I-1-128
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали эффективность в 90% при норме применения 100 м.д.: I-1-131, I-2-1, I-2-10
Тест с Lucilia cuprina (LUCICU)
Растворитель: диметилсульфоксид
Для получения подходящего препарата активного соединения, 10 мл мг активного соединения смешивали с 0,5 диметилсульфоксида, и концентрат разбавляли водой до желаемой концентрации.
Сосуды, содержащие конину, обрабатывали препаратом биологически активного соединения необходимой концентрации, заселяли около 20 личинок Lucilia cuprina.
Через 2 дня, смертность в % определяли. 100% означает, что все личинки были умерщвлены; 0% означает, что ни одна из личинок не была умерщвлена.
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали эффективность в 80% при норме применения 100 м.д.: I-1-63, I-1-186, I-2-2, I-3-1
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали эффективность в 90% при норме применения 100 м.д.: I-1-20, I-1-37, I-1-51, I-1-69, I-1-145
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали эффективность в 95% при норме применения 100 м.д.: I-1-82
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали эффективность в 100% при норме применения 100 м.д.:

Тест с Musca domestica (MUSCDO)
Растворитель: диметилсульфоксид
Для получения подходящего препарата активного соединения, 10 мл мг активного соединения смешивали с 0,5 диметилсульфоксида, и концентрат разбавляли водой до желаемой концентрации.
Сосуды, содержащие губку, обрабатывали препаратом биологически активного соединения необходимой концентрации заселяли взрослыми особями Musca domestica.
Через 2 дня, смертность в % определяли. 100% означает, что все мухи были умерщвлены; 0% означает, что ни одна из мух не была умерщвлена.
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали эффективность в 85% при норме применения 20 м.д.: I-1-91
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали эффективность в 90% при норме применения 20 м.д.: I-1-99
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали эффективность в 90% при норме применения 100 м.д.: I-1-562
Тест с Cooperia curticei (COOPCU)
Растворитель: диметилсульфоксид
Для получения подходящего препарата активного соединения, 10 мг активного соединения смешивали с 0,5 мл диметилсульфоксида, и концентрат разбавляли раствором Рингера до желаемой концентрации.
Сосуды, содержащие препарат активного соединения в нужной концентрации, заселяли около 40 личинок нематод (Cooperia curticei).
Через 5 дней, смертность в % определяли. 100% означает, что все личинки были умерщвлены; 0% означает, что ни одна из личинок не была умерщвлена.
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали эффективность в 80% при норме применения 4 м.д.: I-2-7, I-1-284
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали эффективность в 80% при норме применения 20 м.д.:


В этом исследовании, например, следующие соединения из примеров получения продемонстрировали эффективность в 80% при норме применения 100 м.д.: I-1-22, I-1-69, I-1-121, I-1-211
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали эффективность в 90% при норме применения 4 м.д.: I-1-221, I-1-555
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали эффективность в 90% при норме применения 20 м.д.:

В этом исследовании, например, следующие соединения из примеров получения продемонстрировали эффективность в 90% при норме применения 100 м.д.:
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали эффективность в 100% при норме применения 4 м.д.: I-2-1
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали эффективность в 100% при норме применения 20 м.д.:

В этом исследовании, например, следующие соединения из примеров получения продемонстрировали эффективность в 100% при норме применения 100 м.д.:
Тест с Haemonchus contortus (НАЕМСО)
Растворитель: диметилсульфоксид
Для получения подходящего препарата активного соединения, 10 мг активного соединения смешивали с 0,5 мл диметилсульфоксида, и концентрат разбавляли раствором Рингера до желаемой концентрации.
Сосуды, содержащие препарат активного соединения в нужной концентрации, заполняли около 40 личинок краснобрюхого червя (Haemonchus contortus).
Через 5 дней, смертность в % определяли. 100% означает, что все личинки были умерщвлены; 0% означает, что ни одна из личинок не была умерщвлена.
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали эффективность в 80% при норме применения 4 м.д.: I-2-1, I-2-51
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали эффективность в 80% при норме применения 20 м.д.:
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали эффективность в 80% при норме применения 100 м.д.:

В этом исследовании, например, следующие соединения из примеров получения продемонстрировали эффективность в 90% при норме применения 4 м.д.: I-1-221, I-2-49
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали эффективность в 90% при норме применения 20 м.д.:

В этом исследовании, например, следующие соединения из примеров получения продемонстрировали эффективность в 90% при норме применения 100 м.д.:
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали эффективность в 100% при норме применения 20 м.д.:

В этом исследовании, например, следующие соединения из примеров получения продемонстрировали эффективность в 100% при норме применения 100 м.д.:

Тест с Meloidogyne incognita (MELGIN)
Растворитель: 125.0 частей по массе ацетона
Чтобы приготовить подходящий препарат биологически активного соединения, 1 часть по массе активного соединения смешивали с указанным количеством растворителя и концентрат разбавляют водой до желаемой концентрации.
Сосуды заполняли песком, раствором активного соединения, суспензией яиц/ личинок галловой нематоды (Meloidogyne Incognita) и семенами салата. Семена салата прорастали и растения развивались. На корнях образовывались галлы.
Через 14 дней нематоцидный эффект в % определяли с помощью образования галлов. 100% означает, что ни одной галлы не обнаружено; 0% означает, что количество галлов на обработанных растениях соответствует необработанному контролю.
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали, при норме применения 20 м.д., эффект в 80%: I-1-137.
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали, при норме применения 20 м.д., эффект в 90%:


В этом исследовании, например, следующие соединения из примеров получения продемонстрировали, при норме применения 20 м.д., эффект в 100%:

Тест с распылением с Myzus persicae (MYZUPE)
Для получения подходящего препарата активного соединения, 1 часть по массе активного соединения смешивали с указанными количествами растворителей и эмульгатора, и концентрат разбавляли содержащей эмульгатор водой до желаемой концентрации.
Диски листьев китайской капусты (Brassica pekinensis) зараженные на всех этапах персиковой тлей (Myzus persicae) опрыскивали препаратом биологически активного соединения желаемой концентрации.
Через 6 дней, эффективность в % определяли. 100% в данном случае означает, что все особи тли умерщвлены; 0% означает, что ни одна особь тли не была умерщвлена.
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали эффективность в 80% при норме применения 500 г/га: I-1-25
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали эффективность в 90% при норме применения 500 г/га: I-1-63, I-1-80, I-1-133, I-1-145, I-1-280, I-2-39, I-2-58
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали эффективность в 90% при норме применения 20 г/га: I-1-86
Тест с распылением с Phaedon cochleariae (PHAECO)
Для получения подходящего препарата активного соединения, 1 часть по массе активного соединения смешивали с указанными количествами растворителей и эмульгатора, и концентрат разбавляли содержащей эмульгатор водой до желаемой концентрации.
Диски листьев китайской капусты (Brassica pekinensis) опрыскивали препаратом биологически активного соединения желаемой концентрации и, после сушки, заселяли личинками листоеда хренового (Phaedoncochleariae).
Через 7 дней, эффективность в % определяли. 100% в данном случае означает, что все личинки жука умерщвлены; 0% означает, что ни одна личинка жука не была умерщвлена.
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали эффективность в 83% при норме применения 500 г/га:

В этом исследовании, например, следующие соединения из примеров получения продемонстрировали эффективность в 100% при норме применения 500 г/га:

Тест с распылением с Spodoptera frugiperda (SPODFR)
Для получения подходящего препарата активного соединения, 1 часть по массе активного соединения смешивали с указанными количествами растворителей и эмульгатора, и концентрат разбавляли содержащей эмульгатор водой до желаемой концентрации.
Диски листьев кукурузы (Zea Mays) опрыскивали препаратом активного соединения желаемой концентрации и, после сушки, заселяли гусеницами совки (Spodoptera frugiperda).
После 7 дней, эффективность в % определяли. 100% означает, что все гусеницы были умерщвлены; 0% означает, что ни одна из гусениц не была умерщвлена.
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали эффективность в 83% при норме применения 100 г/га: I-1-118
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали эффективность в 83% при норме применения 500 г/га: I-1-17, I-1-29, I-1-34
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали эффективность в 100% при норме применения 500 г/га: I-1-35, I-1-75, I-1-136, I-1-259, I-1-403, I-2-41
Тест с распылением с Tetranychus urticae, ОР-устойчвость (TETRUR)
Для получения подходящего препарата активного соединения, 1 часть по массе активного соединения смешивали с указанными количествами растворителей и эмульгатора, и концентрат разбавляли содержащей эмульгатор водой до желаемой концентрации.
Диски листьев фасоли (Phaseolus Vulgaris), которые были заражены всех этапах парниковыми красными паутинными клещами (обыкновенный паутинный клещ) опрыскивали препаратом биологически активного соединения необходимой концентрации.
Через 6 дней, эффективность в % определяли. 100% означает, что все паутинные клещи были умерщвлены; 0% означает, что ни один из паутинных клещей не был умерщвлен.
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали, при норме применения 500 г/га, эффективность в 80%: I-1-10, I-1-18, I-1-39, I-1-248
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали, при норме применения 500 г/га, эффективность в 85%: I-1-598
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали, при норме применения 500 г/га, эффективность в 90%:
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали, при норме применения 100 г/га, эффективность в 90%: I-1-43
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали, при норме применения 500 г/га, эффективность в 95%: I-1-210, I-1-258, I-1-262, I-1-263, I-1-428, I-1-596
В этом исследовании, например, следующие соединения из примеров получения продемонстрировали, при норме применения 500 г/га, эффективность в 100%:

Реферат
Нетерапевтическое применение гетероциклических соединений формулы (I)для борьбы с животными вредителями, включая членистоногих, насекомых и нематод. Изобретение позволяет реализовать указанное назначение. 11 н. и 7 з.п. ф-лы, 5 табл., 48 пр.
Формула







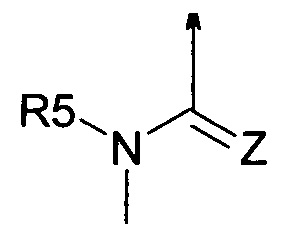
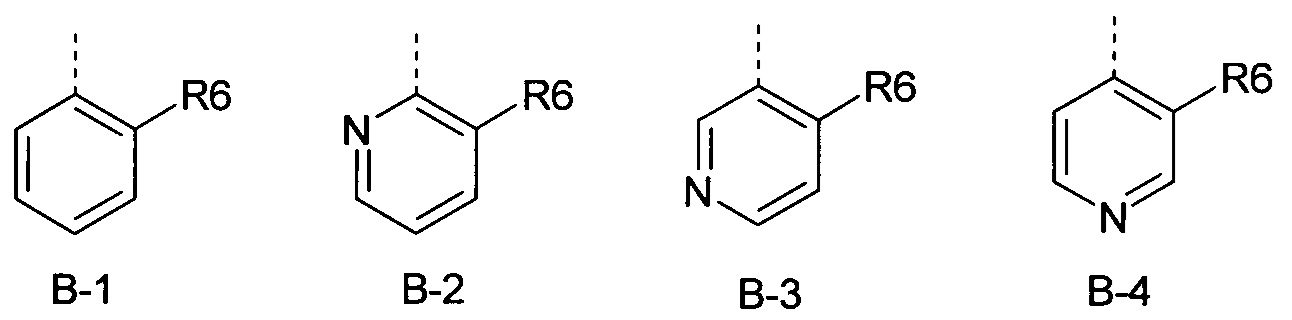
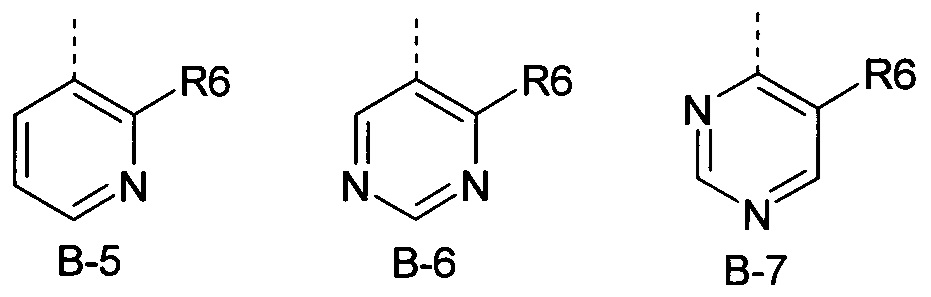
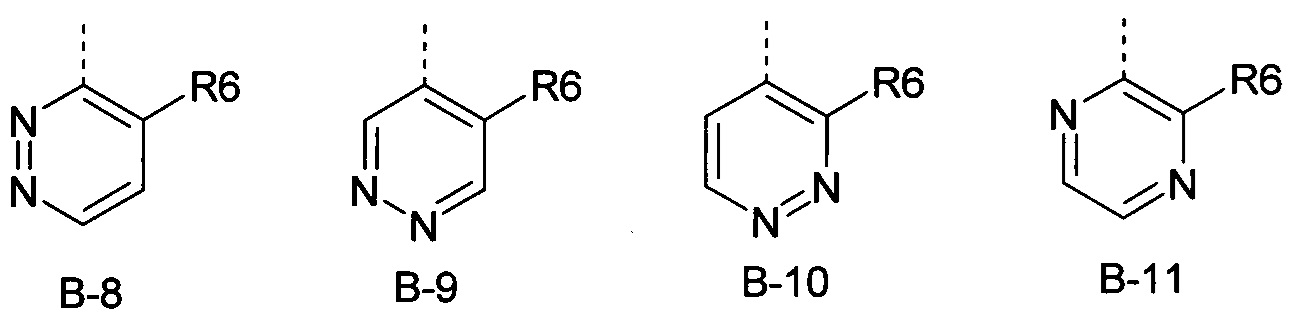
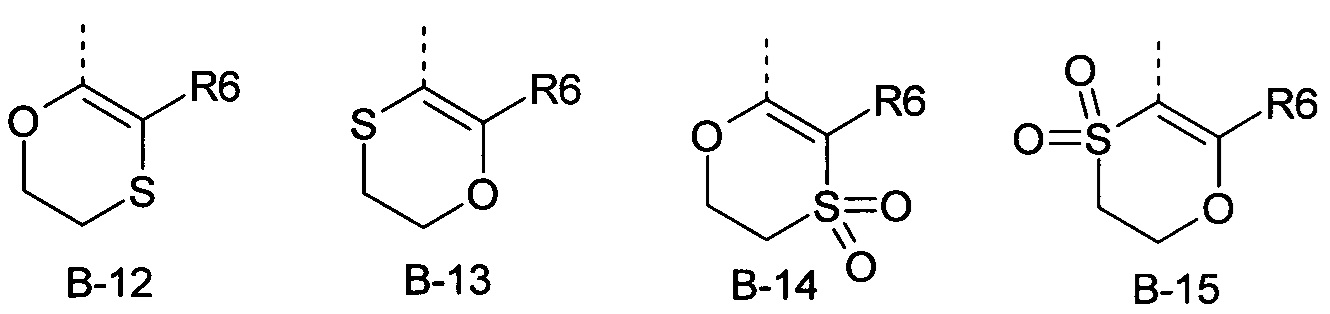


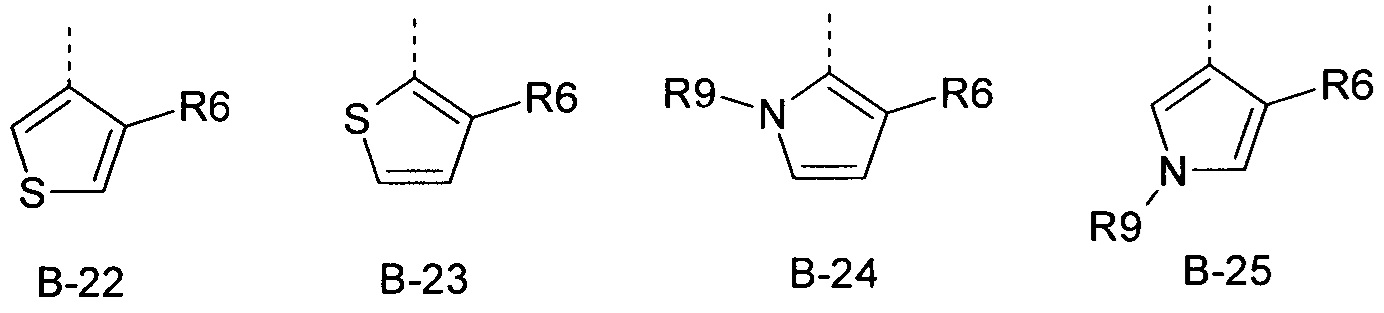
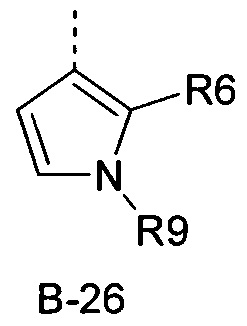

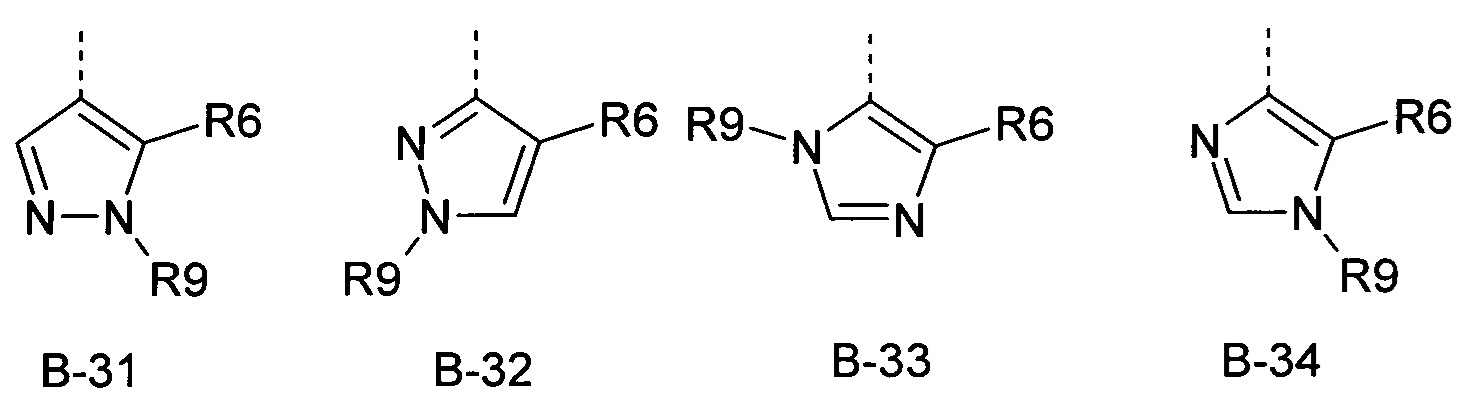
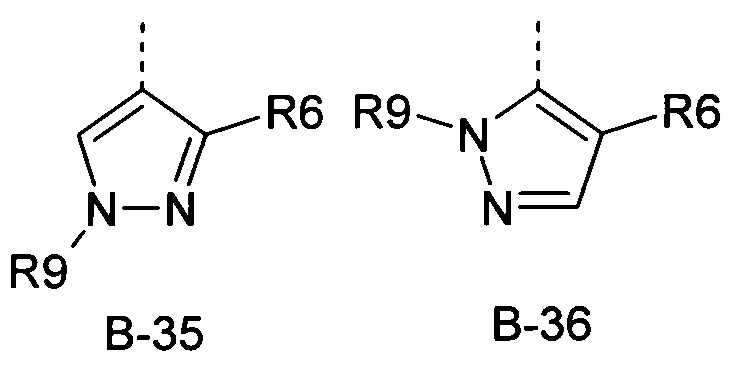

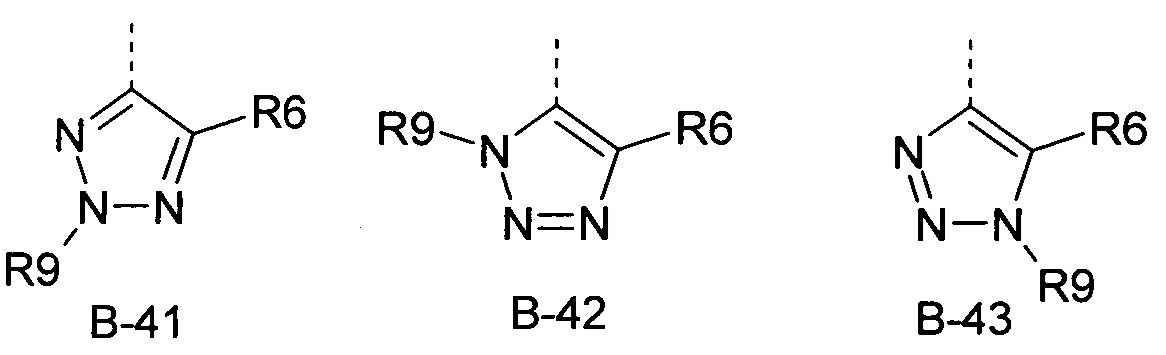
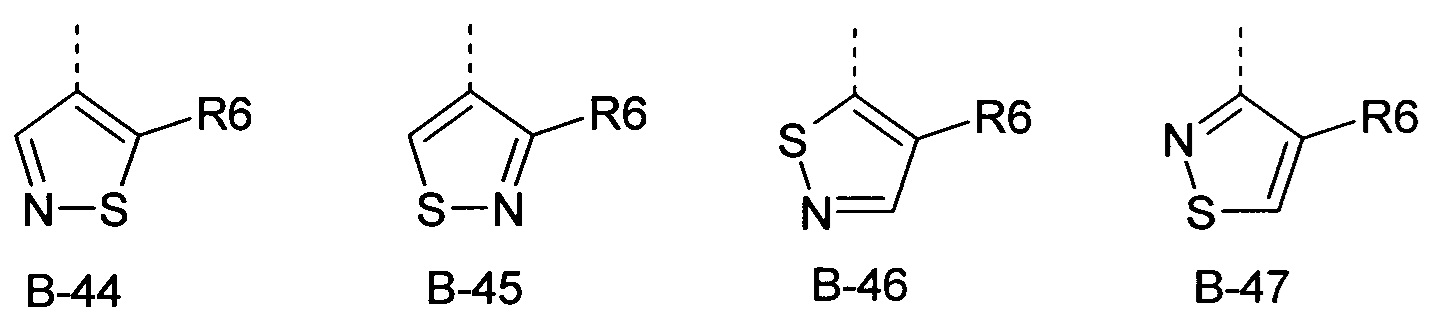
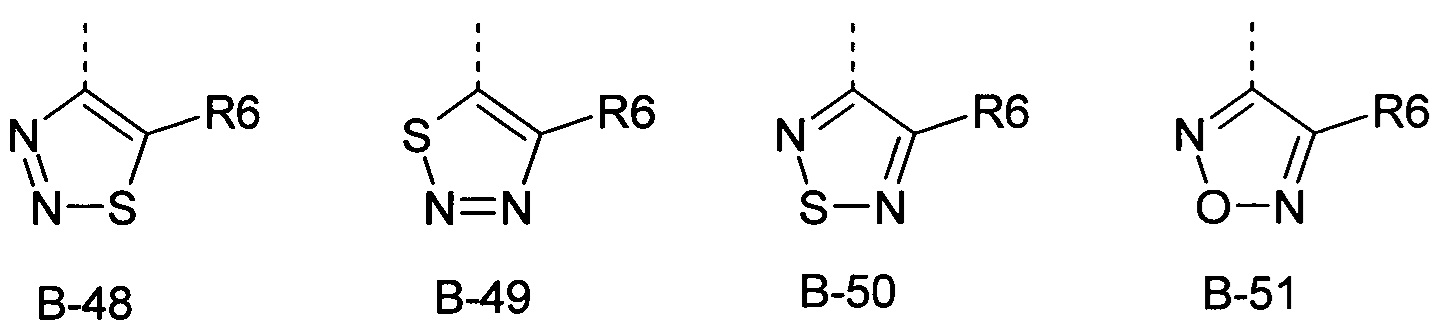

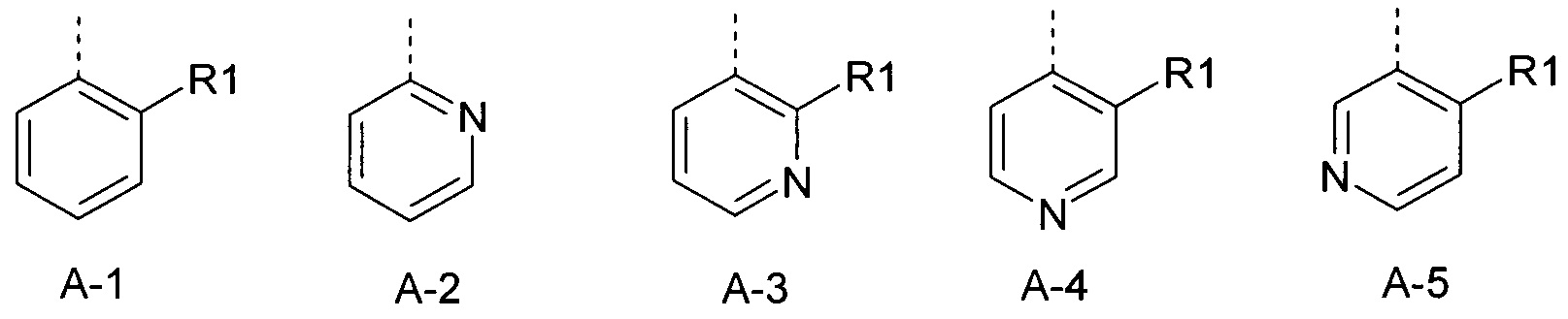
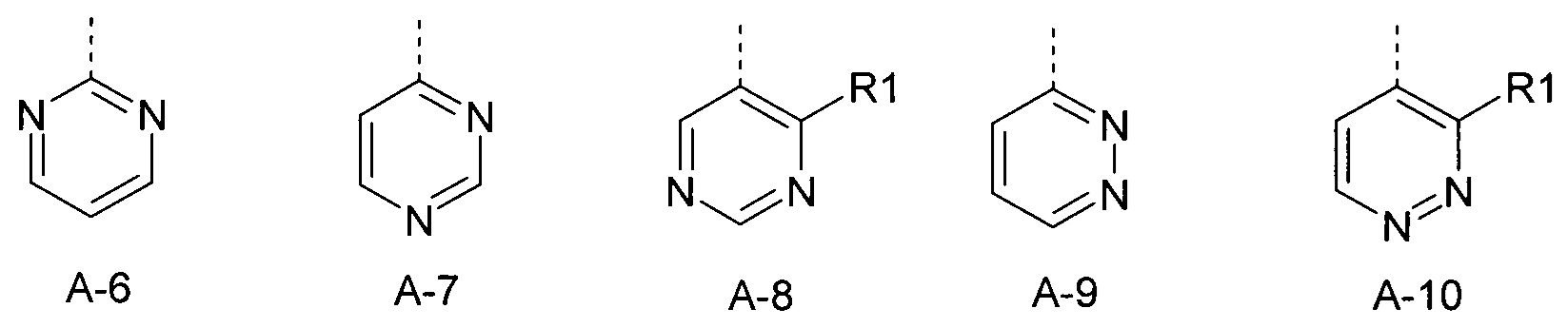
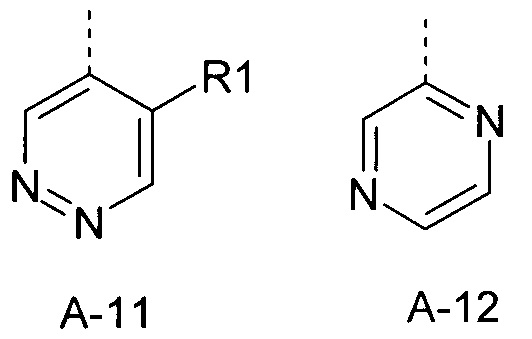

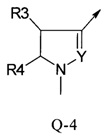
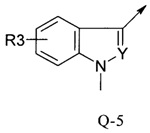


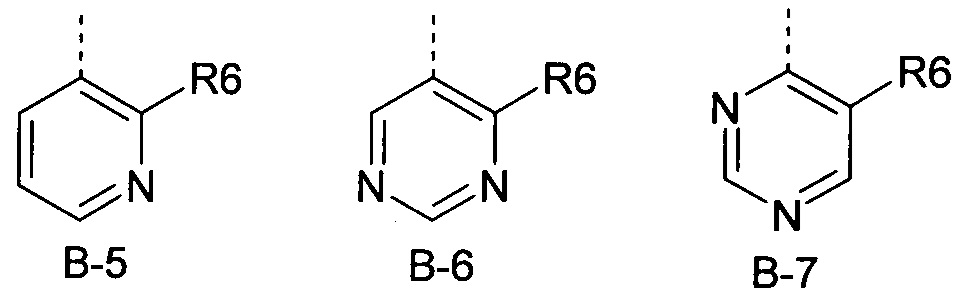





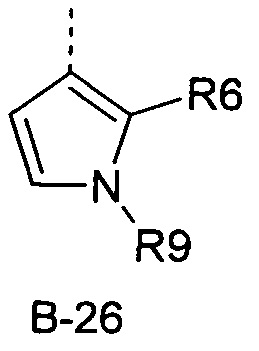


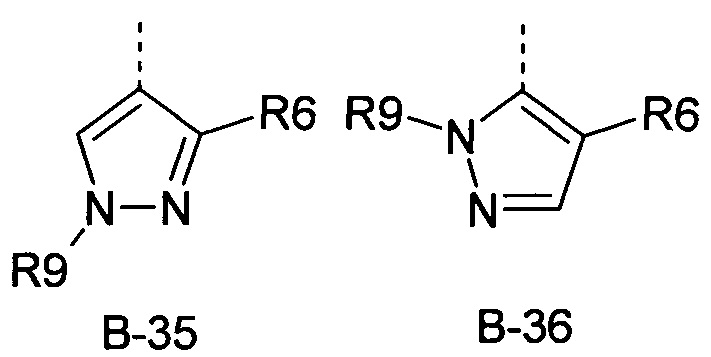

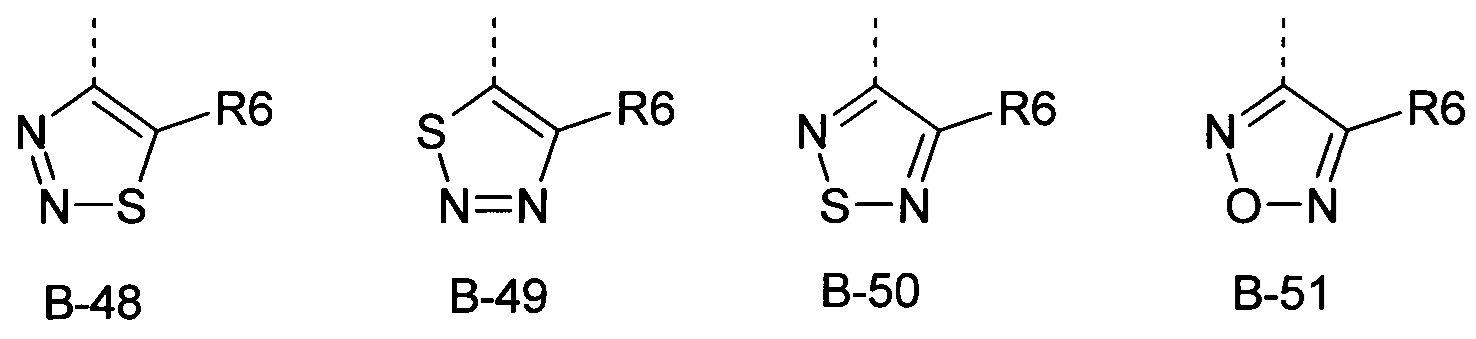
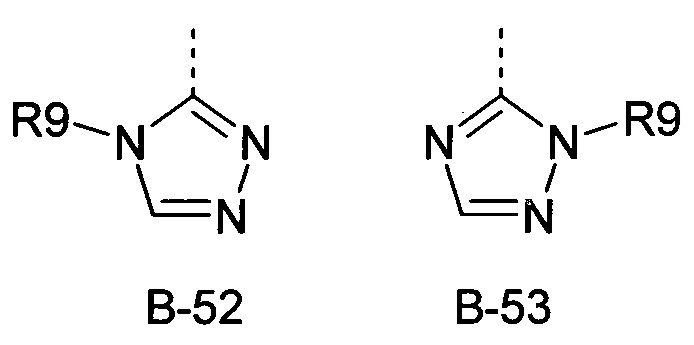


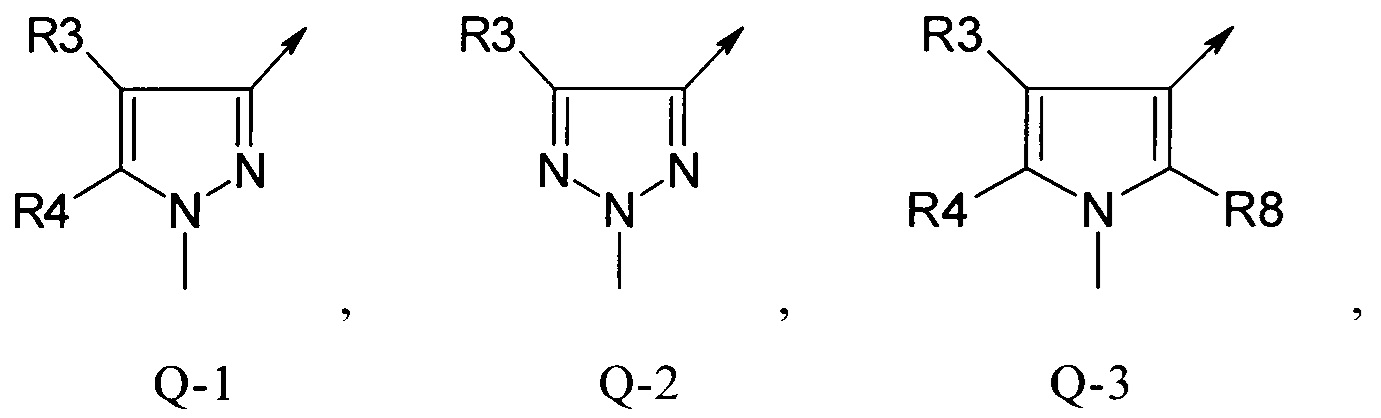
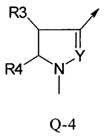
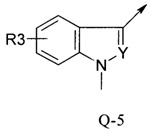

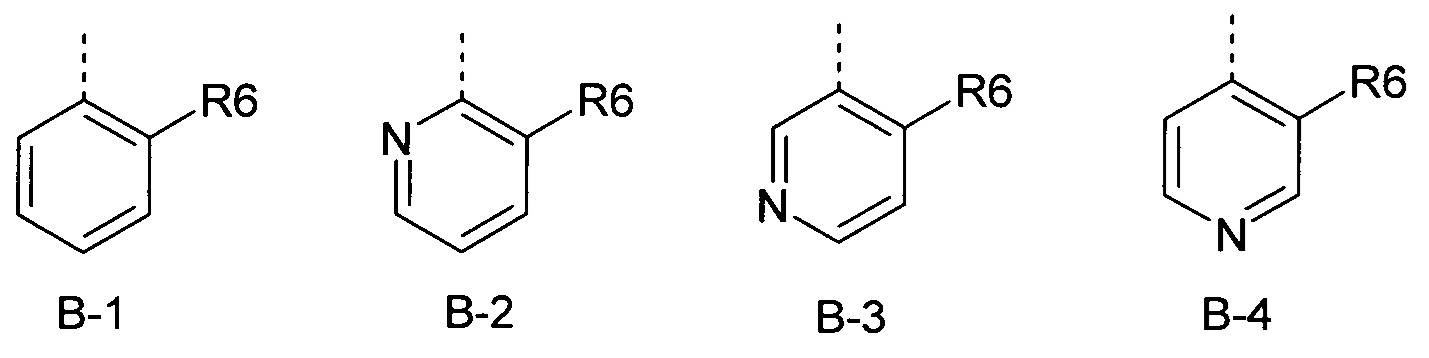




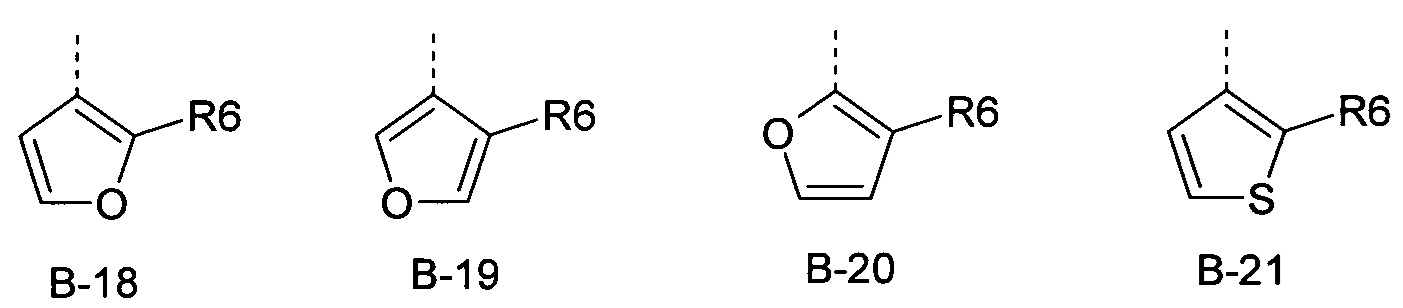

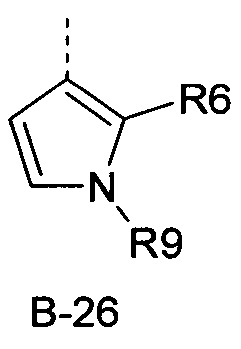


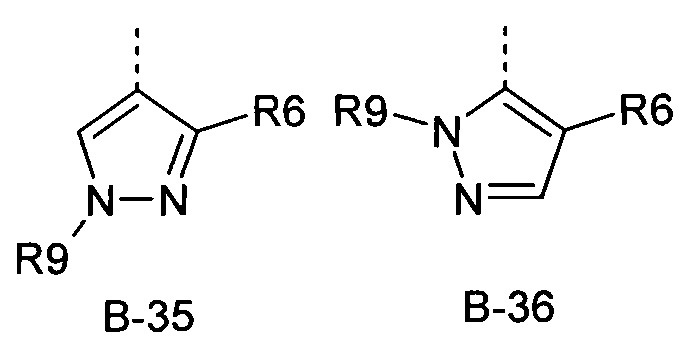



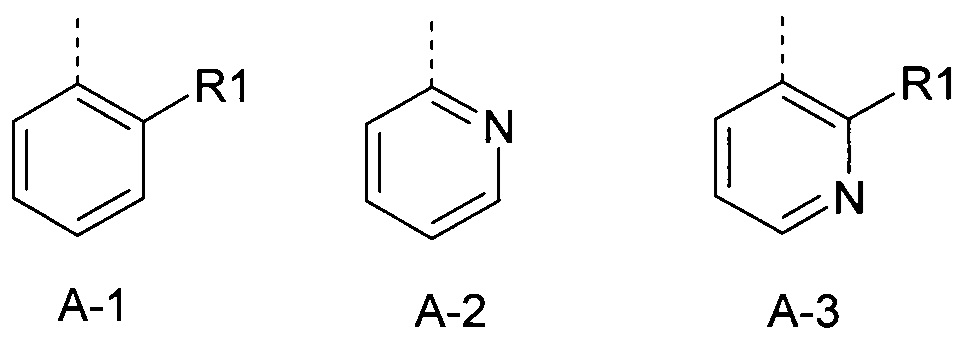



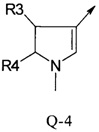


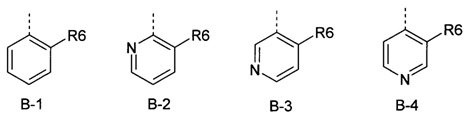



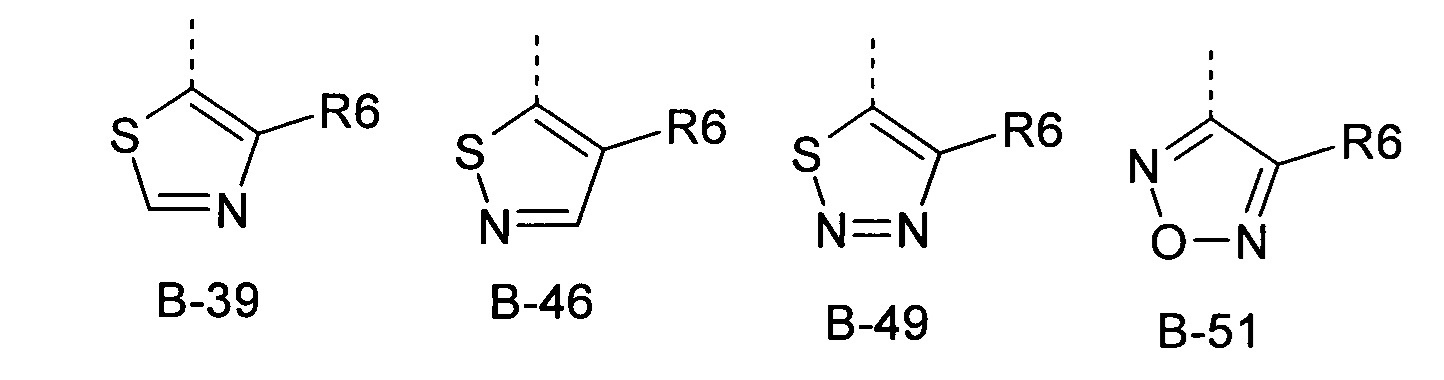
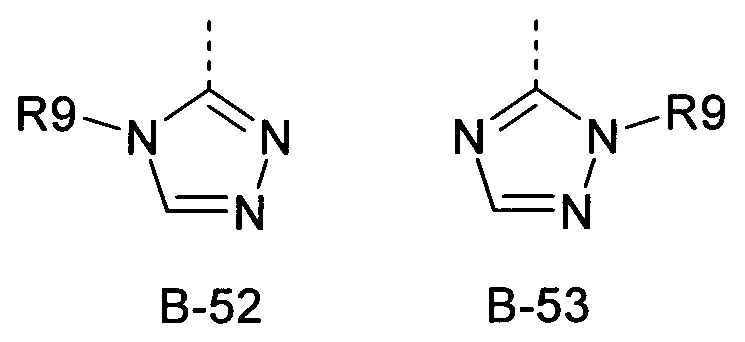
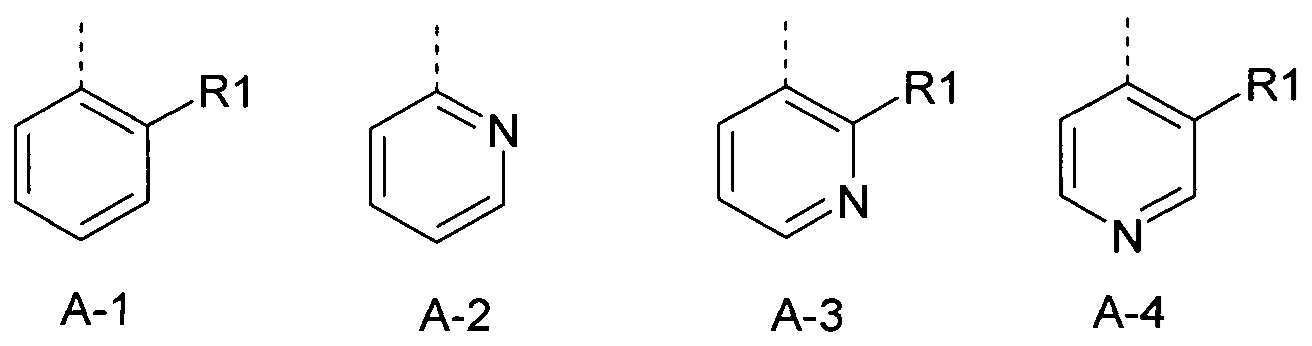
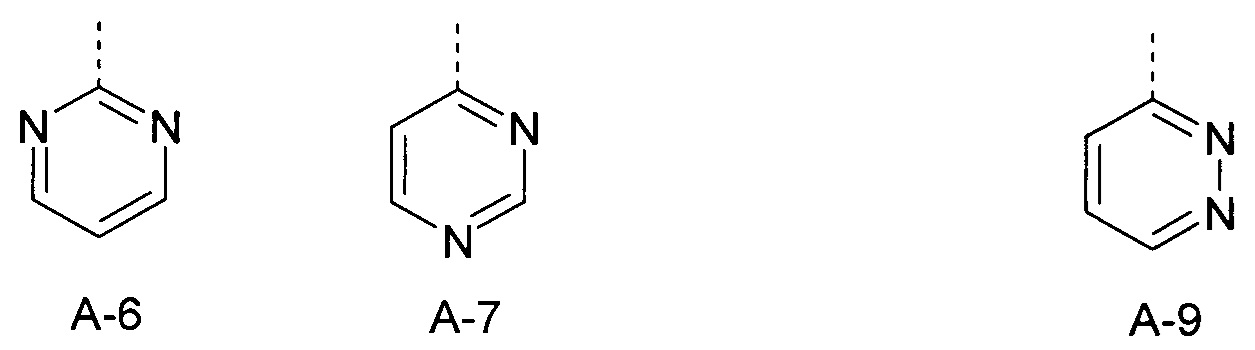


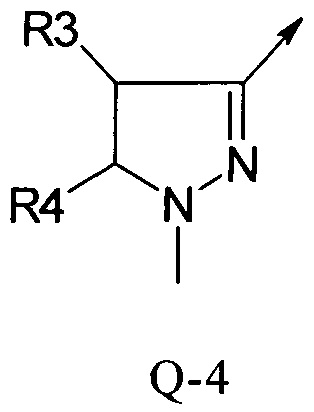


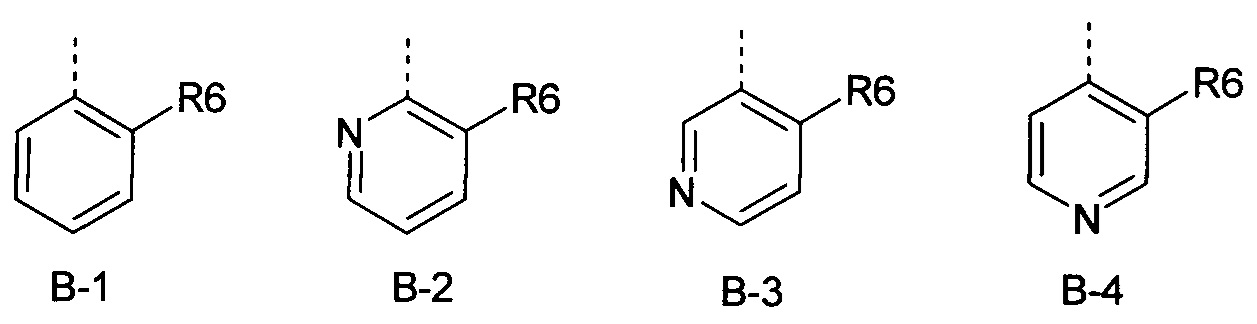







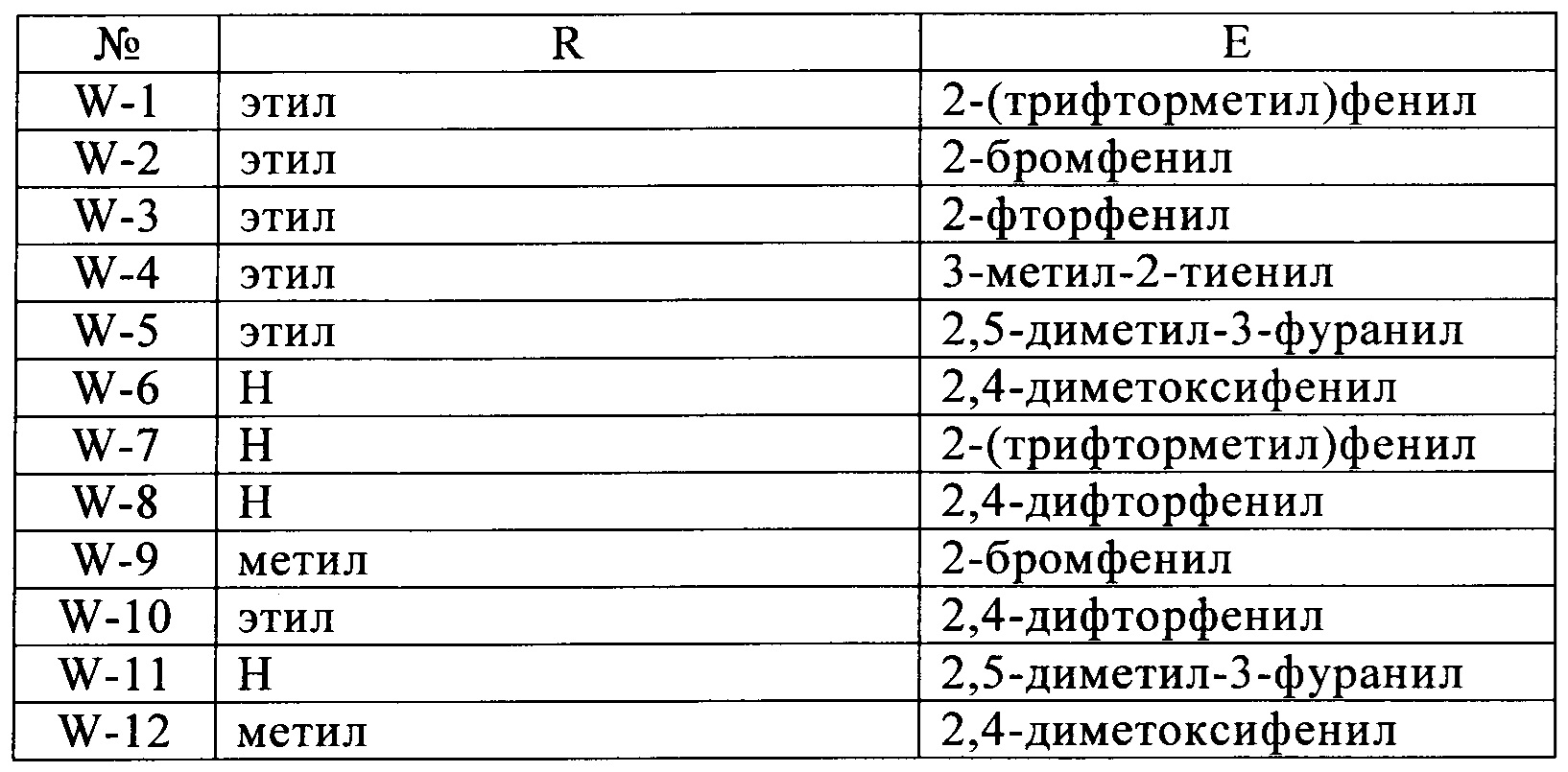
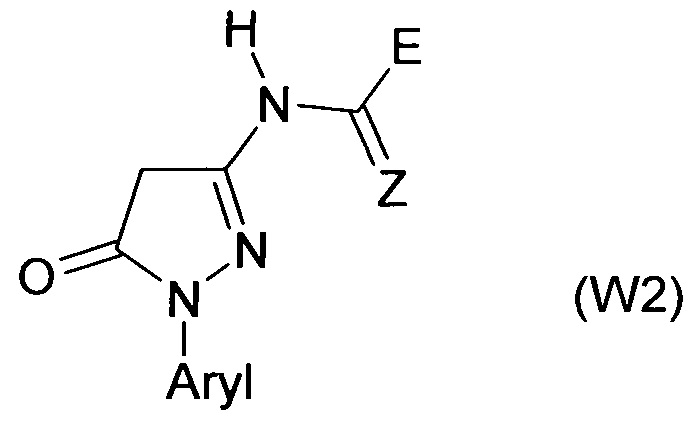
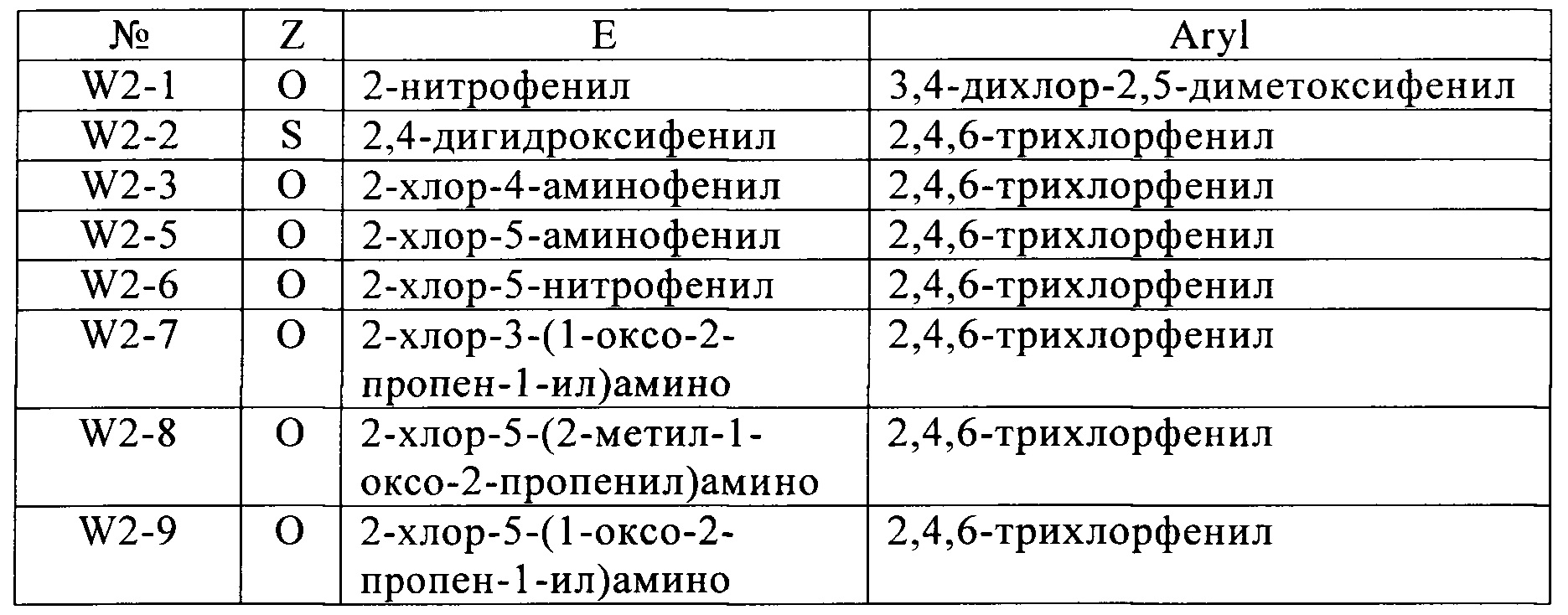

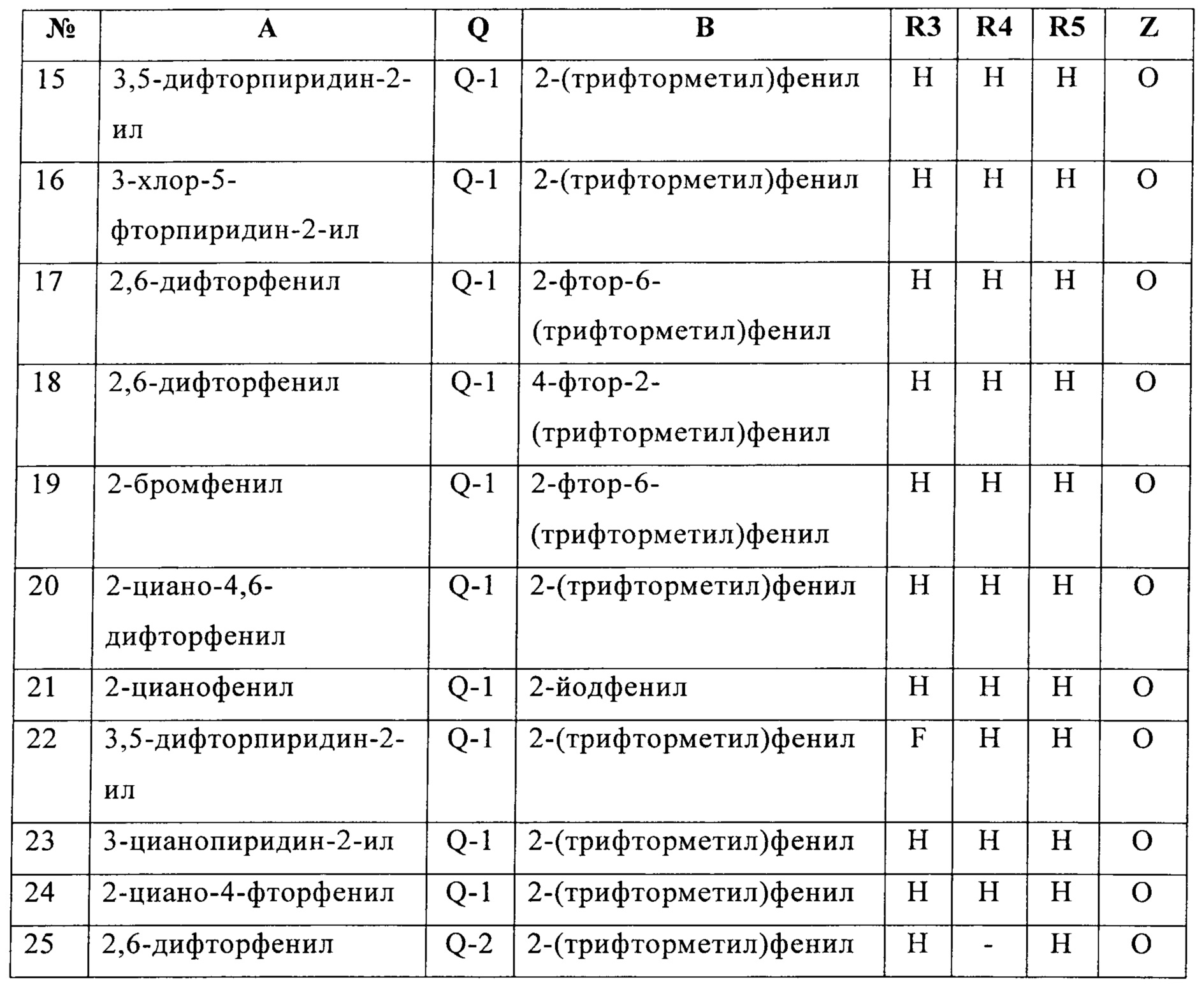

Комментарии