Производные иминопиридина и их применение в качестве микробиоцидов - RU2532135C2
Код документа: RU2532135C2
Описание
Настоящее изобретение относится к новым микробиоцидно активным, в частности, фунгицидно активным пиридиламидинам. Настоящее изобретение также относится к промежуточным продуктам, использующимся при получении этих соединений, к композициям, которые содержат эти соединения, и к их применению в сельском хозяйстве или садоводстве для борьбы с заражением растений фитопатогенными микроорганизмами, предпочтительно грибами, или его предупреждения.
Некоторые производные фениламидина предложены в литературе в качестве микробиоцидно активных ингредиентов в пестицидах. Например, в WO 00/46184 и WO 03/093224 раскрыты фениламидины, которые применимы в качестве фунгицидов. Однако биологические характеристики этих известных соединений не вполне удовлетворительны для борьбы с заражением растений фитопатогенными микроорганизмами или его предупреждения, поэтому необходимы новые соединения, которые обладают микробиоцидной способностью. Согласно изобретению, мы обнаружили новые пиридиламидины, обладающие микробиоцидной активностью.
Поэтому настоящее изобретение относится к соединениям формулы I

в которой
aa) R1 и R2 независимо друг от друга обозначают водород, цианогруппу, формил, нитрогруппу, С1-С7алкил, С2-С6алкенил, С2-С6алкинил, С2-С7алкилкарбонил, С3-С7алкенилкарбонил, С4-С9циклоалкилкарбонил, C1-С6алкокси-С1-С6алкил, С1-С6алкилтио-С1-С6алкил, С2-С7алкилкарбонил-С1-С6алкил, С3-С6алкенилокси-C1-С6алкил, С3-С6алкинилокси-C1-С6алкил, бензилокси-C1-С6алкил, С3-С8циклоалкил-С1-С6алкил, С2-С7алкилоксикарбонил, С4-С7алкенилоксикарбонил, С4-С7алкинилоксикарбонил, С4-С9циклоалкилоксикарбонил, C1-С6алкилсульфонил, C1-С6галогеналкилсульфонил, C1-С6алкилсульфинил или C1-С6галогеналкилсульфинил; или
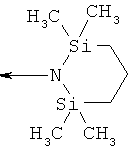
ab) R1 и R2 независимо друг от друга обозначают -Si(R51)(R52)(R53), где R51, R52, R53 независимо друг от друга обозначают галоген, цианогруппу, С1-С6алкил, С2-С6алкенил, С3-С8циклоалкил, С5-С8циклоалкенил, С2-С6алкинил, C1-С6алкоксигруппу, бензил или фенил; или
ac) R1 и R2 независимо друг от друга обозначают -Si(OR54)(OR55)(OR56), где R54, R55, R56 независимо друг от друга обозначают C1-С6алкил, С3-С6алкенил, С3-С8циклоалкил, С3-С6алкинил, бензил или фенил; или
ad) R1 и R2 независимо друг от друга обозначают фенилсульфонил, фенилсульфинил, фенилкарбонил, феноксикарбонил, бензил, бензилкарбонил или бензилоксикарбонил; или
ae) R1 и R2 независимо друг от друга обозначают фенилсульфонил, фенилсульфинил, фенилкарбонил, феноксикарбонил, бензил, бензилкарбонил, бензилоксикарбонил, моно- или полизамещенный
ae1) заместителями, независимо выбранными из группы, включающей гидроксигруппу, меркаптогруппу, галоген, цианогруппу, азидную группу, нитрогруппу, -SF5, аминогруппу, C1-С6алкил, C1-С6галогеналкил, С3-С8циклоалкил, С3-С8галогенциклоалкил, С2-С6алкенил, С2-С6галогеналкенил, С2-С6алкинил, С2-С6галогеналкинил, C1-С6алкоксигруппу, С1-С6галогеналкоксигруппу, С1-С6алкоксиС1-С6алкил, С1-С6алкилтиоС1-С6алкил, С3-С6алкенилоксигруппу, С3-С6галогеналкенилоксигруппу, С3-С6алкинилоксигруппу, C1-С6алкилтиогруппу, C1-С6галогеналкилтиогруппу, C1-С6алкилсульфинил, C1-С6галогеналкилсульфинил, C1-С6алкилсульфонил, C1-С6галогеналкилсульфонил, бензилоксигруппу, феноксигруппу, бензил и фенил, где бензилоксигруппа, феноксигруппа, бензил и фенил, в свою очередь, могут быть моно- или полизамещенными по фенильному кольцу заместителями, независимо выбранными из группы, включающей галоген, цианогруппу, гидроксигруппу, C1-С6алкил, C1-С6галогеналкил и C1-С6алкоксигруппу; или
ае2) заместителями, независимо выбранными из группы, включающей карбоксигруппу, -С(=O)-Cl, -C(=O)-F, С2-С7алкоксикарбонил, С2-С7алкилтиокарбонил, С2-С7галогеналкоксикарбонил, С3-С7алкенилоксикарбонил, С3-С7галогеналкенилоксикарбонил, С3-С7алкинилоксикарбонил, бензилоксикарбонил и феноксикарбонил, где бензилоксикарбонил и феноксикарбонил, в свою очередь, могут быть моно- или полизамещенными по фенильному кольцу заместителями, независимо выбранными из группы, включающей галоген, цианогруппу, гидроксигруппу, C1-С6алкил, C1-С6галогеналкил и C1-С6алкоксигруппу; или
ае3) заместителями, независимо выбранными из группы, включающей формил, С2-С7алкилкарбонил, С2-С7галогеналкилкарбонил, С3-С7алкенилкарбонил, фенилкарбонил и бензилкарбонил, где фенилкарбонил и бензилкарбонил, в свою очередь, могут быть моно- или полизамещенными по фенильному кольцу заместителями, независимо выбранными из группы, включающей галоген, цианогруппу, гидроксигруппу, C1-С6алкил, С1-С6галогеналкил и C1-С6алкоксигруппу; или
ае4) заместителями, независимо выбранными из группы, включающей аминосульфонил, C1-С6алкиламиносульфонил, N,N-ди(С1-С6алкил)-аминосульфонил, -C(=O)NR57R58, -C(=S)NR57R58 и -NR57R58, где R57 и R58 независимо друг от друга обозначают водород, С1-С6алкил, C1-С6галогеналкил, С3-С6алкенил, С3-С6галогеналкенил, С3-С6алкинил, С3-С8циклоалкил, С3-С8галогенциклоалкил, фенил или бензил, где фенил, бензил, в свою очередь, могут быть моно- или полизамещенными по фенильному кольцу заместителями, независимо выбранными из группы, включающей галоген, цианогруппу, гидроксигруппу, C1-С6алкил, C1-С6галогеналкил и C1-С6алкоксигруппу, или R57 и R58 вместе с соединяющим их атомом азота образуют азиридиновую группу, азетидиновую группу, пиразолиновую группу, пиразолидиновую группу, пирролиновую группу, пирролидиновую группу, имидазолиновую группу, имидазолидиновую группу, триазолиновую группу, тетразолиновую группу, пиперазиновую группу, пиперидиновую группу, морфолиновую группу, тиоморфолиновую группу, каждая из которых, в свою очередь, может быть моно- или полизамещенной заместителями, выбранными из группы, включающей метил, галоген, цианогруппу и нитрогруппу; и заместители у атомов азота в кольцевых системах не представляют собой галоген; или
af) R1 или R2 обозначает
af1) гидроксигруппу, аминогруппу, C1-С6алкоксигруппу, С3-С6алкенилоксигруппу, С3-С8циклоалкилоксигруппу, С3-С6алкинилоксигруппу или бензилоксигруппу; или
af2) C1-С6алкоксигруппу, С3-С6алкенилоксигруппу, С3-С8циклоалкилоксигруппу, С3-С6алкинилоксигруппу, бензилоксигруппу, моно- или полизамещенную заместителями, независимо выбранными из группы, включающей галоген, цианогруппу, гидроксигруппу, C1-С6алкил, С1-С6галогеналкил, C1-С6алкоксигруппу и C1-С6галогеналкоксигруппу; или
ag) R1 и R2 независимо друг от друга обозначают С1-С7алкил, С2-С6алкенил, С2-С6алкинил, С2-С7алкилкарбонил, С3-С7алкенилкарбонил, С4-С9циклоалкилкарбонил, С1-С6алкокси-С1-С6алкил, С1-С6алкилтио-С1-С6алкил, С3-С6алкенилокси-С1-С6алкил, С2-С6алкилкарбонил-С1-С6алкил, С3-С6алкинилокси-С1-С6алкил, бензилокси-С1-С6алкил, С3-С8циклоалкил-С1-С6алкил, С2-С7алкилоксикарбонил, С4-С7алкенилоксикарбонил, С4-С7алкинилоксикарбонил или С4-С9циклоалкилоксикарбонил, моно- или полизамещенный заместителями, независимо выбранными из группы, включающей галоген, цианогруппу, нитрогруппу, гидроксигруппу, меркаптогруппу, азидную группу, C1-С6алкил, C1-С6галогеналкил, C1-С6алкоксигруппу, C1-С6галогеналкоксигруппу, C1-С6алкилтиогруппу, C1-С6алкилсульфинил, C1-С6алкилсульфонил, С2-С7алкоксикарбонил, формил, С2-С7алкилкарбонил, -Si(R51)(R52)(R53) и -Si(OR54)(OR55)(OR56); или
ah) R1 и R2 независимо друг от друга обозначают группу А-;
где А обозначает 3-10-членную моноциклическую или конденсированную бициклическую кольцевую систему, которая может быть ароматической, частично ненасыщенной или полностью насыщенной и может содержать от 1 до 4 гетероатомов, выбранных из группы, включающей азот, кислород и серу, каждая кольцевая система не может содержать более 2 атомов кислорода и более 2 атомов серы и сама 3-10-членная кольцевая система может быть моно- или полизамещенной
А1) заместителями, независимо выбранными из группы, включающей галоген, цианогруппу, нитрогруппу, гидроксигруппу, меркаптогруппу, нитрогруппу, азидную группу, формил, карбоксигруппу, -С(=O)-Cl, =O, =S, -C(=O)-F, C1-С6алкил, С2-С6алкенил, С2-С6алкинил, С3-С8циклоалкил, C5-С8циклоалкенил, С5-С8циклоалкинил, C1-С6галогеналкил, С2-С6галогеналкенил, С2-С6галогеналкинил, С3-С8галогенциклоалкил, С5-С8галогенциклоалкенил, С5-С8галогенциклоалкинил, C1-С6алкоксигруппу, C1-С6галогеналкоксигруппу, С3-С6алкенилоксигруппу, С3-С6галогеналкенилоксигруппу, С3-С6алкинилоксигруппу, С3-С8циклоалкилоксигруппу, С3-С8галогенциклоалкилоксигруппу, С3-С8циклоалкенилоксигруппу, С3-С8галогенциклоалкенилоксигруппу, бензилоксигруппу и феноксигруппу, где бензилоксигруппа и феноксигруппа, в свою очередь, могут быть моно- или полизамещенными заместителями, независимо выбранными из группы, включающей галоген, цианогруппу, нитрогруппу, гидроксигруппу, меркаптогруппу, азидную группу, аминогруппу, -SF5, C1-С6алкил, C1-С6галогеналкил, C1-С6алкоксигруппу, C1-С6галогеналкоксигруппу, C1-С6алкоксиС1-С6алкил, C1-С6алкилтиогруппу, C1-С6алкилсульфинил и C1-С6алкилсульфонил; или
А2) заместителями, независимо выбранными из группы, включающей HC(=NOR59)-, (С1-С6алкил)С(=NOR59)-, (С1-С6галогеналкил)С(=NOR59)-, (C1-С6алкил)С(=NOR59)С1-С6алкил- и (С1-С6галогеналкил)C(=NOR59)C1-С6алкил-, где R59 обозначает водород, C1-С6алкил, C1-С6галогеналкил, С3-С6алкенил, С3-С6галогеналкенил, С3-С6алкинил, С3-С8циклоалкил, С3-С8галогенциклоалкил, бензил и фенил, и бензил и фенил, моно- или полизамещенный галогеном, цианогруппой, гидроксигруппой, C1-С6алкилом, C1-С6галогеналкилом или С1-С6алкоксигруппой; или
A3) заместителями, независимо выбранными из группы, включающей C1-С6алкилтиогруппу, C1-С6галогеналкилтиогруппу, C1-С6алкилсульфинил, C1-С6алкилсульфонил, (R14)S(=O)(=NR13)- и (R14)(R15)S(=O)=N-, где R13 обозначает водород, C1-С6алкил, C1-С6галогеналкил, С3-С6алкенил, С3-С6галогеналкенил, С3-С6алкинил, С3-С8циклоалкил, С3-С8галогенциклоалкил, фенил или бензил, или обозначает фенил или бензил, моно- или полизамещенный галогеном, цианогруппой, гидроксигруппой, C1-С6алкилом, C1-С6галогеналкилом или C1-С6алкоксигруппой, и R14 и R15 независимо друг от друга обозначают C1-С6алкил, С3-С8циклоалкил, C1-С6галогеналкил, С3-С8галогенциклоалкил, С2-С6алкенил, С2-С6галогеналкенил, С2-С6алкинил, бензил или фенил, или бензил или фенил, независимо друг от друга содержащие заместители, выбранные из группы, включающей галоген, цианогруппу, гидроксигруппу, C1-С6алкил, С1-С6галогеналкил и C1-С6алкоксигруппу; или
А4) заместителями, независимо выбранными из группы, включающей -NR57R58, -C(=O)NR57R58 и -C(=S)NR57R58; или
А5) заместителями, независимо выбранными из группы, включающей формил, С2-С7алкилкарбонил, С2-С7галогеналкилкарбонил, С3-С7алкенилкарбонил, С3-С7галогеналкенилкарбонил, С4-С9циклоалкилкарбонил, С4-С9галогенциклоалкилкарбонил, С2-С7алкоксикарбонил, С2-С7галогеналкоксикарбонил, С3-С7алкенилоксикарбонил, С3-С7алкинилоксикарбонил, С4-С9циклоалкоксикарбонил, С2-С7алкилтиокарбонил и бензилоксикарбонил, и бензилоксикарбонил, моно- или полизамещенный заместителями, независимо выбранными из группы, включающей галоген, цианогруппу, гидроксигруппу, C1-С6алкил, C1-С6галогеналкил и С1-С6алкоксигруппу; или
А6) заместителями, независимо выбранными из группы, включающей -Si(R51)(R52)(R53) и -Si(OR54)(OR55)(OR56); или
А7) заместителями, независимо выбранными из группы, включающей аминосульфинил, (С1-С6алкил)аминосульфонил, N,N-ди(С1-С6алкил)-аминосульфонил, ди(С1-С6алкил)аминогруппу, (С1-С6алкил)аминогруппу, фенил, феноксигруппу, бензил и бензилоксигруппу, где фенил, феноксигруппа, бензил и бензилоксигруппа, в свою очередь, могут быть моно- или полизамещенными по фенильному кольцу заместителями, независимо выбранными из группы, включающей галоген, цианогруппу, гидроксигруппу, аминогруппу, нитрогруппу, азидную группу, меркаптогруппу, формил, -SF5, C1-С6алкил, C1-С6галогеналкил, С2-С6алкенил, С2-С6галогеналкенил, С2-С6алкинил, C1-С6алкоксигруппу, C1-С6галогеналкоксигруппу, С1-С6алкилтиогруппу, С1-С6галогеналкилтиогруппу, С3-С6алкенилтиогруппу, С3-С6галогеналкенилтиогруппу, С3-С6алкинилтиогруппу, С1-С3алкокси-С1-С3алкилтиогруппу, С2-С6алкилкарбонил-С1-С3алкилтиогруппу, С2-С6алкоксикарбонил-С1-С6алкилтиогруппу, циано-С1-С6алкилтиогруппу, C1-С6алкилсульфинил, C1-С6галогеналкилсульфинил, C1-С6алкилсульфонил, C1-С6галогеналкилсульфонил, аминосульфонил, (C1-С6алкил)аминосульфонил, N,N-ди(С1-С6алкил)аминосульфонил, ди(С1-С6алкил)аминогруппу и (С1-С6алкил)аминогруппу; или
ai) R1 и R2 независимо друг от друга обозначают -C(=O)NR57R58; или
aj) R1 и R2 вместе образуют С2-С6алкиленовый мостик, который может быть моно- или полизамещенным галогеном, цианогруппой, C1-С6алкильной или C1-С6галогеналкильной группами; или
ak) R1 и R2 вместе с соединяющим их атомом азота образуют пиразолиновую группу, пиразолидиновую группу, пирролиновую группу, имидазолиновую группу, имидазолидиновую группу, триазолиновую группу, тетразолиновую группу, пиперазиновую группу, морфолиновую группу, тиоморфолиновую группу, каждая из которых независимо друг от друга может быть моно- или полизамещенной метильными группами, галогеном, цианогруппой и нитрогруппой; или
al) фрагмент











где каждый из указанных фрагментов может быть моно- или полизамещенным заместителями, независимо выбранными из группы, включающей галоген, цианогруппу, C1-С6алкил, C1-С6галогеналкил и C1-С6алкоксигруппу;
ba) R3, R4 и R7 независимо друг от друга обозначают
ba1) водород, галоген, цианогруппу, нитрогруппу, меркаптогруппу, гидроксигруппу, азидную группу, -SF5, -NR64R65, где R64 и R65 независимо друг от друга обозначают водород, C1-С6алкил, C1-С6галогеналкил, С3-С6алкенил, С3-С6галогеналкенил, С3-С6алкинил, С3-С8циклоалкил, С3-С8галогенциклоалкил, фенил или бензил, где фенил, бензил, в свою очередь, могут быть моно- или полизамещенными по фенильному кольцу заместителями, независимо выбранными из группы, включающей галоген, цианогруппу, гидроксигруппу, C1-С6алкил, C1-С6галогеналкил и C1-С6алкоксигруппу, или R64 и R65 вместе с соединяющим их атомом азота образуют азиридиновую группу, азетидиновую группу, пиразолиновую группу, пиразолидиновую группу, пирролиновую группу, пирролидиновую группу, имидазолиновую группу, имидазолидиновую группу, триазолиновую группу, тетразолиновую группу, пиперазиновую группу, пиперидиновую группу, морфолиновую группу, тиоморфолиновую группу, каждая из которых, в свою очередь, может быть моно- или полизамещенной заместителями, выбранными из группы, включающей метил, галоген, цианогруппу и нитрогруппу; и заместители у атомов азота в кольцевых системах не представляют собой галоген; или R3, R4 и R7 независимо друг от друга обозначают -C(=S)NH2, -N=C=O, -N=C=S, аминогруппу, (R51)(R52)(R53)Si-, (R51)(R52)(R53)Si-(С1-С6алкил)-, (R51)(R52)(R53)Si-(С2-С6алкинил)-, (OR54)(OR55)(OR56)Si- или (OR214)(OR215)(OR216)Si-(С1-С6алкил)-; где R214, R215 и R216 независимо друг от друга обозначают галоген, цианогруппу, C1-С6алкил, С2-С6алкенил, С3-С8циклоалкил, С5-С8циклоалкенил, С2-С6алкинил, бензил или фенил;
или R3, R4 и R7 независимо друг от друга обозначают
ba2) C1-С6алкилтиогруппу, С1-С6алкилсульфинил, С1-С6алкилсульфонил, С1-С6галогеналкилтиогруппу, С1-С6галогеналкилсульфинил, С1-С6галогеналкилсульфонил, аминосульфинил, аминосульфонил, C1-С6алкоксигруппу, C1-С6галогеналкоксигруппу, С3-С6алкенилоксигруппу, С3-С6галогеналкенилоксигруппу, С3-С6алкинилоксигруппу, (C1-С6алкил)аминосульфонил, ди(С1-С6алкил)аминосульфонил, С1-С6алкоксигруппу, С2-С6алкенилоксигруппу, С2-С6алкинилоксигруппу, С1-С6алкил-S(=O)(R14)=N-, (R14)S(=O)(=N-R13)-, (R14)(R15)S(=O)=N-, -S-С3-С6-алкенил, -S-С3-С6-алкинил, -S-С3-С8-циклоалкил, S-бензил или -S-С3-С6-алкенил, -S-С3-С6-алкинил, -S-С3-С8-циклоалкил или S-бензил; каждый из которых может быть моно- или полизамещенным заместителями, выбранными из группы, включающей галоген, цианогруппу, C1-С6-алкил, C1-С6-галогеналкил, C1-С6-алкоксигруппу;
или R3, R4 и R7 независимо друг от друга обозначают
ba3) C1-С6алкил, С2-С6алкенил или С2-С6алкинил, или C1-С6алкил, С2-С6алкенил или С2-С6алкинил, моно- или полизамещенный заместителями, независимо выбранными из группы, включающей галоген, гидроксигруппу, меркаптогруппу, цианогруппу, нитрогруппу, C1-С6алкил, C1-С6галогеналкил, С1-С6алкоксигруппу, C1-С6гидроксиалкил, три(алкил)силил, C1-С6галогеналкоксигруппу, С1-С6алкилтиогруппу, С1-С6галогеналкилтиогруппу, C1-С6алкилсульфинил, C1-С6галогеналкилсульфинил, C1-С6алкилсульфонил и С1-С6галогеналкилсульфонил;
или R3, R4 и R7 независимо друг от друга обозначают
ba4) формил, С2-С7алкоксикарбонил, С2-С7галогеналкоксикарбонил, С3-С7алкенилоксикарбонил, С3-С7галогеналкенилоксикарбонил, С2-С7алкилкарбонил, карбоксигруппу, -С(=O)-Cl, -C(=O)-F, C2-С7галогеналкилкарбонил, С3-С7алкенилкарбонил или С3-С7галогеналкенилкарбонил; или R3, R4 и R7 независимо друг от друга обозначают
ba5) фенил, феноксигруппу, бензил или бензилоксигруппу, или феноксигруппу, бензил или бензилоксигруппу, моно- или полизамещенную заместителями, независимо выбранными из группы, включающей галоген, цианогруппу, нитрогруппу, гидроксигруппу, меркаптогруппу, азидную группу, аминогруппу, -SF5, C1-С6алкил, C1-С6галогеналкил, C1-С6алкоксигруппу, С1-С6галогеналкоксигруппу, C1-С6алкилтиогруппу, C1-С6алкилсульфинил и C1-С6алкилсульфонил; или
bb) R3, R4 и R7 независимо друг от друга обозначают группы А-, А-O- или А-(С1-С6алкил)-, где группа А является такой, как определено выше в разделе ah);
са) R5 обозначает водород, С1-С12алкил, С2-С12алкенил, С2-С12алкинил, C1-С12алкилсульфонил, С2-С12алкенилсульфонил, фенилсульфонил или бензилсульфонил, или обозначает С1-С12алкил, С2-С12алкенил, С2-С12алкинил, С1-С12алкилсульфонил, С2-С12алкенилсульфонил, фенилсульфонил или бензилсульфонил, моно- или полизамещенный заместителями, независимо выбранными из группы, включающей галоген, цианогруппу, нитрогруппу, гидроксигруппу, меркаптогруппу, азидную группу, формил, С2-С7алкилкарбонил, С2-С7галогеналкилкарбонил, C1-С6алкил, C1-С6галогеналкил, C1-С6алкоксигруппу, C1-С6галогеналкоксигруппу, C1-С6алкилтиогруппу, С1-С6алкилсульфинил и C1-С6алкилсульфонил; или
cb1) R5 обозначает формил, С2-С12алкилкарбонил, С3-С12алкенилкарбонил, С3-С12алкинилкарбонил, С4-С12циклоалкилкарбонил, бензилкарбонил, фенилкарбонил, С2-С12алкоксикарбонил, С4-С12алкенилоксикарбонил, С4-С12алкинилоксикарбонил, С4-С12циклоалкоксикарбонил, бензилоксикарбонил или феноксикарбонил, или обозначает
cb2) С2-С12алкилкарбонил, С3-С12алкенилкарбонил, С3-С12алкинилкарбонил, С4-С12циклоалкилкарбонил, бензилкарбонил, фенилкарбонил, С2-С12алкоксикарбонил, С4-С12алкенилоксикарбонил, С4-С12алкинилоксикарбонил, С4-С12циклоалкоксикарбонил, бензилоксикарбонил или феноксикарбонил, моно- или полизамещенный заместителями, независимо выбранными из группы, включающей галоген, цианогруппу, C1-С6алкил, C1-С6галогеналкил и C1-С6алкоксигруппу; или
сс) R5 обозначает (R51)(R52)(R53)Si-, (R51)(R52)(R53)Si-(C1-С12алкил)-, (R51)(R52)(R53)Si-(С3-С8циклоалкил)-, (R54O)(R55O)(R56O)Si-, (R54O)(R55O)(R56O)Si-(С1-С12алкил)- или (R54O)(R55O)(R56O)Si-(С3-С8циклоалкил)-; или
cd) R5 обозначает С1-С6алкил-В-С1-С12алкил-, С2-С6алкенил-В-С1-С12алкил-, С2-С6алкинил-В-С1-С12алкил-, С3-С8циклоалкил-В-С1-С12алкил-, бензил-B-C1-С12алкил-, фенил-В-С1-С12алкил-, С1-С6алкил-В-С2-С12алкенил-, С2-С6алкенил-В-С2-С12алкенил-, С2-С6алкинил-В-С2-С12алкенил-, С3-С8циклоалкил-В-С2-С12алкенил-, бензил-В-С2-С12алкенил-, фенил-В-С2-С12алкенил-, C1-С6алкил-В-С2-С12алкинил-, С2-С6алкенил-В-С2-С12алкинил-, С2-С6алкинил-В-С2-С12алкинил-, С3-С8циклоалкил-В-С2-С12алкинил-, бензил-В-С2-С12алкинил-, фенил-В-С2-С12алкинил-, С1-С6алкил-В-С3-С8циклоалкил-, С2-С6алкенил-В-С3-С8циклоалкил-, С2-С6алкинил-В-С3-С8циклоалкил-, С3-С8циклоалкил-В-С3-С8циклоалкил-, бензил-В-С3-С12циклоалкил- или фенил-В-С3-С12циклоалкил-, где группа В обозначает -С(=O)-, -C(=S)-, -C(=NOR59)-, -C(R60)=NO-, -ON=С(R60)-, -O-С(=O)-, -С(=O)-O-, -O-, -S-, -S(=O)-, -S(=O)2-, -S(=O)(=NR13)-, -S(=O)(R14)=N-, -N=S(=O)(R14)-, -N(R62)-C=O)-, -C=O)-N(R62)-, -N(R62)-SO2- или -SO2-N(R62)-;
cd1) где R60 обозначает водород, C1-С6алкил, С3-С8циклоалкил, C1-С6галогеналкил, С3-С8галогенциклоалкил, С2-С6алкенил, С2-С6галогеналкенил, С2-С6алкинил, бензил или фенил, или бензил или фенил, моно- или полизамещенный заместителями, независимо выбранными из группы, включающей галоген, цианогруппу, гидроксигруппу, C1-С6алкил, C1-С6галогеналкил и C1-С6алкоксигруппу, и
cd2) R62 обозначает водород, C1-С6алкил, С3-С8циклоалкил, C1-С6галогеналкил, С3-С8галогенциклоалкил, С3-С6алкенил, С3-С6алкинил, бензил или фенил, или бензил или фенил, моно- или полизамещенный заместителями, независимо выбранными из группы, включающей галоген, цианогруппу, гидроксигруппу, C1-С6алкил, C1-С6галогеналкил и C1-С6алкоксигруппу; или
ce) R5 обозначает С1-С6алкил-В-С1-С12алкил-, С2-С6алкенил-В-С1-С12алкил-, С2-С6алкинил-В-С1-С12алкил-, С3-С8циклоалкил-В-С1-С12алкил-, бензил-В-С1-С12алкил-, фенил-В-С1-С12алкил-, С1-С6алкил-В-С2-С12алкенил-, С2-С6алкенил-В-С2-С12алкенил-, С2-С6алкинил-В-С2-С12алкенил-, С3-С8циклоалкил-В-С2-С12алкенил-, бензил-В-С2-С12алкенил-, фенил-В-С2-С12алкенил-, C1-С6алкил-В-С2-С12алкинил-, С2-С6алкенил-В-С2-С12алкинил-, С2-С6алкинил-В-С2-С12алкинил-, С3-С8циклоалкил-В-С2-С12алкинил-, бензил-В-С2-С12алкинил-, фенил-В-С2-С12алкинил-, С1-С6алкил-В-С3-С8циклоалкил-, С2-С6алкенил-В-С3-С8циклоалкил-, С2-С6алкинил-В-С3-С8циклоалкил-, С3-С8циклоалкил-В-С3-С8циклоалкил-, бензил-В-С3-С12циклоалкил-, фенил-В-С3-С12циклоалкил-, каждый из которых, в свою очередь, содержит заместители, независимо выбранные из группы, включающей галоген, цианогруппу, гидроксигруппу, меркаптогруппу, C1-С6галогеналкил, C1-С6алкоксигруппу, формил, С2-С6алкилкарбонил, C1-С6алкилтиогруппу, C1-С6алкилсульфинил и C1-С6алкилсульфонил; или
cf) R5 обозначает А-, А-(С1-С6алкил)-, А-O-(С1-С6алкил)-, А-(С2-С6алкенил)-, А-О-(С2-С6алкенил)-, А-(С2-С6-алкинил)-, А-О-(С2-С6алкинил)-, А-(С3-С8циклоалкил)- или А-О-(С3-С8циклоалкил)-; где группа А является такой, как определено выше в разделе ah); или
cg) R5 обозначает группу -N=C(R8)R9;
cg1) где R8 и R9 независимо друг от друга обозначают водород, галоген, цианогруппу, С1-С12алкил, С2-С12алкенил, С2-С12алкинил, С1-С12алкоксигруппу, формил, С2-С12алкилкарбонил, С3-С12алкенилкарбонил, карбоксигруппу, С2-С12алкоксикарбонил или С4-С12алкенилоксикарбонил, или C1-С12алкил, С2-С12алкенил, С2-С12алкинил, С1-С12алкоксигруппу, С2-С12алкилкарбонил, С3-С12алкенилкарбонил, С2-С12алкоксикарбонил или С4-С12алкенилоксикарбонил, моно- или полизамещенный заместителями, независимо выбранными из группы, включающей галоген, цианогруппу, нитрогруппу, гидроксигруппу, меркаптогруппу, C1-С6алкил, C1-С6галогеналкил, C1-С6алкоксигруппу, C1-С6галогеналкоксигруппу, C1-С6алкилтиогруппу, C1-С6алкилсульфинил и С1-С6алкилсульфонил; или
cg2) R8 и R9 вместе образуют С2-С8алкиленовый мостик, который необязательно может быть моно- или полизамещенным заместителями, независимо выбранными из группы, включающей галоген, цианогруппу, C1-С6алкил и C1-С6галогеналкил; или
cg3) R8 и R9 независимо друг от друга обозначают группы А-, А-О- или А-(C1-С6алкил)-; где группа А является такой, как определено выше в разделе ah);
d) R6 обозначает водород, галоген, цианогруппу, формил, C1-С6алкил, С1-С6галогеналкил, -SH, -S-C1-С6алкил, -S-C1-С6галогеналкил, -S-C1-С6галогеналкил, С2-С6алкенил, С2-С6галогеналкенил или С2-С6алкинил;
и к агрономически приемлемым солям/комплексам с металлами/комплексам с металлоидами/изомерам/структурным изомерам/стереоизомерам/диастереоизомерам/энантиомерам/таутомерам/N-оксидам этих соединений..
Заместителями у атома азота никогда не являются галогены. Гидрокси-, меркапто- или аминные заместители не находятся у атома углерода, находящегося в α-положении к гетероатому основного фрагмента.
Алкильные группы, содержащиеся в определениях заместителей, могут обладать линейной или разветвленной цепью и представляют собой, например, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, пентил, гексил, гептил и октил и их разветвленные изомеры. Алкоксильные, алкенильные и алкинильные радикалы образованы из указанных алкильных радикалов. Алкенильные и алкинильные группы могут быть моно- или полиненасыщенными.
Циклоалкильные группы, содержащиеся в определениях заместителей, представляют собой, например, циклопропил, циклобутил, циклопентил или циклогексил.
Галоген обычно означает фтор, хлор, бром или йод, предпочтительно фтор, бром или хлор. Это также относится к комбинациям галогена с другими значениями, таким как галогеналкил или галогеналкоксигруппа.
Галогеналкильные группы предпочтительно содержат в цепи от 1 до 4 атомов углерода. Галогеналкил представляет собой, например, фторметил, дифторметил, трифторметил, хлорметил, дихлорметил, трихлорметил, 2,2,2-трифторэтил, 2-фторэтил, 2-хлорэтил, пентафторэтил, 1,1-дифтор-2,2,2-трихлорэтил, 2,2,3,3-тетрафторэтил или 2,2,2-трихлорэтил; предпочтительно трихлорметил, дифторхлорметил, дифторметил, трифторметил или дихлорфторметил.
Подходящими галогеналкенильными группами являются алкенильные группы, которые моно- или полизамещены галогеном, галогеном является фтор, хлор, бром и йод, и предпочтительно фтор и хлор, например, 2,2-дифтор-1-метилвинил, 3-фторпропенил, 3-хлорпропенил, 3-бромпропенил, 2,3,3-трифторпропенил, 2,3,3-трихлорпропенил и 4,4,4-трифторбут-2-ен-1-ил.
Подходящими галогеналкинильными группами являются, например, алкинильные группы, которые моно- или полизамещены галогеном, галогеном является бром, йод, и предпочтительно фтор и хлор, например, 3-фторпропинил, 3-хлорпропинил, 3-бромпропинил, 3,3,3-трифторпропинил и 4,4,4-трифторбут-2-ин-1-ил.
Алкоксигруппа представляет собой, например, метоксигруппу, этоксигруппу, пропоксигруппу, изопропоксигруппу, н-бутоксигруппу, изобутоксигруппу, втор-бутоксигруппу и трет-бутоксигруппу; предпочтительно метоксигруппу и этоксигруппу. Галогеналкоксигруппа представляет собой, например, фторметоксигруппу, дифторметоксигруппу, трифторметоксигруппу, 2,2,2-трифторэтоксигруппу, 1,1,2,2-тетрафторэтоксигруппу, 2-фторэтоксигруппу, 2-хлорэтоксигруппу, 2,2-дифторэтоксигруппу и 2,2,2-трихлорэтоксигруппу; предпочтительно дифторметоксигруппу, 2-хлорэтоксигруппу и трифторметоксигруппу.
Алкоксикарбонил представляет собой, например, метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, н-бутоксикарбонил, изобутоксикарбонил, втор-бутоксикарбонил или трет-бутоксикарбонил; предпочтительно метоксикарбонил или этоксикарбонил. Галогеналкоксигруппы предпочтительно содержат в цепи от 1 до 6 атомов углерода. Галогеналкоксигруппа представляет собой, например, фторметоксигруппу, дифторметоксигруппу, трифторметоксигруппу, 2,2,2-трифторэтоксигруппу, 1,1,2,2-тетрафторэтоксигруппу, 2-фторэтоксигруппу, 2-хлорэтоксигруппу, 2,2-дифторэтоксигруппу и 2,2,2-трихлорэтоксигруппу; предпочтительно дифторметоксигруппу, 2-хлорэтоксигруппу и трифторметоксигруппу. Алкилтиогруппы предпочтительно содержат в цепи от 1 до 6 атомов углерода.
Алкоксиалкил представляет собой, например, метоксиметил, метоксиэтил, этоксиметил, этоксиэтил, н-пропоксиметил, н-пропоксиэтил, изопропоксиметил или изопропоксиэтил.
Алкилтиогруппа представляет собой, например, метилтиогруппу, этилтиогруппу, пропилтиогруппу, изопропилтиогруппу, н-бутилтиогруппу, изобутилтиогруппу, втор-бутилтиогруппу или трет-бутилтиогруппу, предпочтительно метилтиогруппу и этилтиогруппу. Алкилсульфинил представляет собой, например, метилсульфинил, этилсульфинил, пропилсульфинил, изопропилсульфинил, н-бутилсульфинил, изобутилсульфинил, втор-бутилсульфинил, трет-бутилсульфинил; предпочтительно метилсульфинил и этилсульфинил. Алкилсульфонил представляет собой, например, метилсульфонил, этилсульфонил, пропилсульфонил, изопропилсульфонил, н-бутилсульфонил, изобутилсульфонил, втор-бутилсульфонил или трет-бутилсульфонил; предпочтительно метилсульфонил или этилсульфонил.
С2-С6Алкилкарбонил представляет собой, например, метилкарбонил, этилкарбонил, пропилкарбонил, изопропилкарбонил, н-бутилкарбонил, изобутилкарбонил, втор-бутилкарбонил, трет-бутилкарбонил или н-пентилкарбонил и их разветвленные изомеры, предпочтительно метилкарбонил и этилкарбонил. Галогеналкилкарбонильные радикалы образованы из указанных алкильных радикалов.
В контексте настоящего изобретения выражения "моно- или полизамещенный", содержащиеся в определениях заместителей, в зависимости от химической структуры заместителей обычно означает от моно- до семикратнозамещенного, предпочтительно от моно- до пятикратнозамещенного, более предпочтительно моно-, ди- или тризамещенный.
В контексте настоящего изобретения 3-10-членная моноциклическая или конденсированная бициклическая кольцевая система, которая может быть частично насыщенной или полностью насыщенной, в зависимости от числа кольцевых элементов, например, выбрана из группы, включающей











циклопропил, циклобутил, циклопентил, циклогексил, где указанные циклоалкильные группы, в свою очередь, могут предпочтительно быть незамещенными или замещенными C1-С6алкилом или галогеном, или обозначает фенил, бензил, нафтил или следующие гетероциклические группы: пирролил; пиридил; пиразолил; пиримидил; пиразинил; имидазолил; тиадиазолил; хиназолинил; фурил; оксадиазолил; индолизинил; пиранил; изобензофуранил; тиенил; нафтиридинил; (1-метил-1Н-пиразол-3-ил)-; (1-этил-1Н-пиразол-3-ил)-; (1-пропил-1Н-пиразол-3-ил)-; (1H-пиразол-3-ил)-; (1,5-диметил-1Н-пиразол-3-ил)-; (4-хлор-1-метил-1Н-пиразол-3-ил)-; (1Н-пиразол-1-ил)-; (3-метил-1H-пиразол-1-ил)-; (3,5-диметил-1Н-пиразол-1-ил)-; (3-изоксазолил)-; (5-метил-3-изоксазолил)-; (3-метил-5-изоксазолил)-; (5-изоксазолил)-; (1Н-пиррол-2-ил)-; (1-метил-1Н-пиррол-2-ил)-; (1Н-пиррол-1-ил)-; (1-метил-1Н-пиррол-3-ил)-; (2-фуранил)-; (5-метил-2-фуранил)-; (3-фуранил)-; (5-метил-2-тиенил)-; (2-тиенил)-; (3-тиенил)-; (1-метил-1Н-имидазол-2-ил)-; (1Н-имидазол-2-ил)-; (1-метил-1Н-имидазол-4-ил)-; (1-метил-1Н-имидазол-5-ил)-; (4-метил-2-оксазолил)-; (5-метил-2-оксазолил)-; (2-оксазолил)-; (2-метил-5-оксазолил)-; (2-метил-4-оксазолил)-; (4-метил-2-тиазолил)-; (5-метил-2-тиазолил)-; (2-тиазолил)-; (2-метил-5-тиазолил)-; (2-метил-4-тиазолил)-; (3-метил-4-изотиазолил)-; (3-метил-5-изотиазолил)-; (5-метил-3-изотиазолил)-; (1-метил-1Н-1,2,3-триазол-4-ил)-; (2-метил-2Н-1,2,3-триазол-4-ил)-; (4-метил-2Н-1,2,3-триазол-2-ил)-; (1-метил-1Н-1,2,4-триазол-3-ил)-; (1,5-диметил-1Н-1,2,4-триазол-3-ил)-; (3-метил-1Н-1,2,4-триазол-1-ил)-; (5-метил-1Н-1,2,4-триазол-1-ил)-; (4,5-диметил-4Н-1,2,4-триазол-3-ил)-; (4-метил-4Н-1,2,4-триазол-3-ил)-; (4Н-1,2,4-триазол-4-ил)-; (5-метил-1,2,3-оксадиазол-4-ил)-; (1,2,3-оксадиазол-4-ил)-; (3-метил-1,2,4-оксадиазол-5-ил)-; (5-метил-1,2,4-оксадиазол-3-ил)-; (4-метил-3-фуразанил)-; (3-фуразанил)-; (5-метил-1,2,4-оксадиазол-2-ил)-; (5-метил-1,2,3-тиадиазол-4-ил)-; (1,2,3-тиадиазол-4-ил)-; (3-метил-1,2,4-тиадиазол-5-ил)-; (5-метил-1,2,4-тиадиазол-3-ил)-; (4-метил-1,2,5-тиадиазол-3-ил)-; (5-метил-1,3,4-тиадиазол-2-ил)-; (1-метил-1Н-тетразол-5-ил)-; (1Н-тетразол-5-ил)-; (5-метил-1Н-тетразол-1-ил)-; (2-метил-2Н-тетразол-5-ил)-; (2-этил-2Н-тетразол-5-ил)-; (5-метил-2Н-тетразол-2-ил)-; (2Н-тетразол-2-ил)-; (2-пиридил)-; (6-метил-2-пиридил)-; (4-пиридил)-; (3-пиридил)-; (6-метил-3-пиридазинил)-; (5-метил-3-пиридазинил)-; (3-пиридазинил)-; (4,6-диметил-2-пиримидинил)-; (4-метил-2-пиримидинил)-; (2-пиримидинил)-; (2-метил-4-пиримидинил)-; (2-хлор-4-пиримидинил)-; (2,6-диметил-4-пиримидинил)-; (4-пиримидинил)-; (2-метил-5-пиримидинил)-; (6-метил-2-пиразинил)-; (2-пиразинил)-; (4,6-диметил-1,3,5-триазин-2-ил)-; (4,6-дихлор-1,3,5-триазин-2-ил)-; (1,3,5-триазин-2-ил)-; (4-метил-1,3,5-триазин-2-ил)-; (3-метил-1,2,4-триазин-5-ил)-; (3-метил-1,2,4-триазин-6-ил)-;


























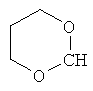



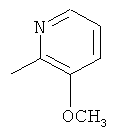
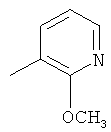









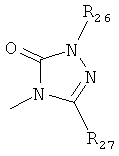
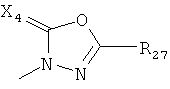


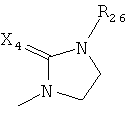
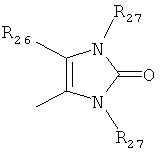



где каждый R26 обозначает метил, каждый R27 и каждый R28 независимо обозначают водород, C1-С3алкил, C1-С3алкоксигруппу, C1-С3алкилтиогруппу или трифторметил, Х4 обозначает кислород или серу и r=1, 2, 3 или 4.
Если в этих определениях не указана свободная валентность, например, как в


Предпочтительными соединениями являются такие, в которых
ba) R3, R4 и R7 независимо друг от друга обозначают
ba1) водород, галоген, цианогруппу, нитрогруппу, меркаптогруппу, гидроксигруппу, азидную группу, -SF5, -N=C=O, -N=C=S, аминогруппу, (R51)(R52)(R53)Si-, (R51)(R52)(R53)Si-(C1-С6алкил)-, (R51)(R52)(R53)Si-(C2-С6алкинил)-, (OR54)(OR55)(OR56)Si- или (OR214)(OR215)(OR216)Si-(C1-С6алкил)-, где R214, R215 и R216 независимо друг от друга обозначают галоген, цианогруппу, C1-С6алкил, С2-С6алкенил, С3-С8циклоалкил, С5-С8циклоалкенил, С2-С6алкинил, бензил или фенил; или R3, R4 и R7 независимо друг от друга обозначают
ba2) С1-С6алкилтиогруппу, С1-С6алкилсульфинил, С1-С6алкилсульфонил, С1-С6галогеналкилтиогруппу, С1-С6галогеналкилсульфинил, С1-С6галогеналкилсульфонил, аминосульфинил, (С1-С6алкил)аминосульфонил, ди(С1-С6алкил)аминосульфонил, C1-С6алкил-S(=O)(R14)=N-, (R14)S(=O)(=N-R13)- или (R14)(R15)S(=O)=N-; или R3, R4 и R7 независимо друг от друга обозначают
ba3) C1-С6алкил, С2-С6алкенил или С2-С6алкинил, или C1-С6алкил, С2-С6алкенил или С2-С6алкинил, моно- или полизамещенный заместителями, независимо выбранными из группы, включающей галоген, гидроксигруппу, меркаптогруппу, цианогруппу, нитрогруппу, C1-С6алкил, C1-С6галогеналкил, C1-С6алкоксигруппу, C1-С6гидроксиалкил, три(алкил)силил, С1-С6галогеналкоксигруппу, С1-С6алкилтиогруппу, С1-С6галогеналкилтиогруппу, C1-С6алкилсульфинил, C1-С6галогеналкилсульфинил, С1-С6алкилсульфонил и C1-С6галогеналкилсульфонил; или R3, R4 и R7 независимо друг от друга обозначают
ba4) формил, С2-С7алкоксикарбонил, С2-С7галогеналкоксикарбонил, С3-С7алкенилоксикарбонил, С3-С7галогеналкенилоксикарбонил, С2-С7алкилкарбонил, карбоксигруппу, -С(=O)-Cl, -C(=O)-F, C2-С7галогеналкилкарбонил, С3-С7алкенилкарбонил или С3-С7галогеналкенилкарбонил; или R3, R4 и R7 независимо друг от друга обозначают
ba5) фенил, феноксигруппу, бензил или бензилоксигруппу, или феноксигруппу, бензил или бензилоксигруппу, моно- или полизамещенную заместителями, независимо выбранными из группы, включающей галоген, цианогруппу, нитрогруппу, гидроксигруппу, меркаптогруппу, азидную группу, аминогруппу, -SF5, C1-С6алкил, C1-С6галогеналкил, C1-С6алкоксигруппу, C1-С6галогеналкоксигруппу, С1-С6алкилтиогруппу, C1-С6алкилсульфинил и C1-С6алкилсульфонил; или
bb) R3, R4 и R7 независимо друг от друга обозначают группы А-, А-O- или А-(С1-С6алкил)-, где группа А является такой, как определено выше в разделе ah);
d) R6 обозначает водород, галоген, цианогруппу, формил, C1-С6алкил, С1-С6галогеналкил, С2-С6алкенил, С2-С6галогеналкенил или С2-С6алкинил; и агрономически приемлемые соли/комплексы с металлами/комплексы с металлоидами/изомеры/структурные изомеры/стереоизомеры/диастереоизомеры/энантиомеры/таутомеры/N-оксиды этих соединений.
В предпочтительной группе соединений R1 и R2 независимо друг от друга обозначают водород, цианогруппу, C1-С6алкил, С3-С6циклоалкил, С2-С6алкенил, С2-С6алкинил, бензил или С2-С7алкилкарбонил, каждый из которых может быть моно- или полизамещенным заместителями, независимо выбранными из группы, включающей галоген, C1-С6алкил, C1-С6галогеналкил, C1-С6алкилтиогруппу и C1-С6алкоксигруппу; или R1 и R2 вместе образуют С2-С6алкиленовый мостик, который может быть моно- или полизамещенным метальными группами; или R1 и R2 вместе с соединяющим их атомом азота образуют пиразолиновую группу, пиразолидиновую группу, пирролиновую группу, имидазолиновую группу, имидазолидиновую группу, триазолиновую группу, тетразолиновую группу, пиперазиновую группу, морфолиновую группу, тиоморфолиновую группу, каждая из которых независимо друг от друга может быть моно- или полизамещенной метальными группами; или
R1 обозначает водород, цианогруппу, C1-С6алкил, С3-С6циклоалкил, С2-С6алкенил, С2-С6алкинил, бензил или С2-С7алкилкарбонил, каждый из которых может быть моно- или полизамещенным заместителями, независимо выбранными из группы, включающей галоген, C1-С6алкил, C1-С6галогеналкил, C1-С6алкилтиогруппу и C1-С6алкокси и R2 обозначает гидроксигруппу, аминогруппу, C1-С6алкоксигруппу, С3-С6алкенилоксигруппу, С3-С8циклоалкилоксигруппу или С3-С6алкинилоксигруппу; или
R2 обозначает водород, цианогруппу, C1-С6алкил, С3-С6циклоалкил, С2-С6алкенил, С2-С6алкинил, бензил или С2-С7алкилкарбонил, каждый из которых может быть моно- или полизамещенным заместителями, независимо выбранными из группы, включающей галоген, C1-С6алкил, C1-С6галогеналкил, C1-С6алкилтиогруппу и C1-С6алкокси и R1 обозначает гидроксигруппу, аминогруппу, C1-С6алкоксигруппу, С3-С6алкенилоксигруппу, С3-С8циклоалкилоксигруппу или С3-С6алкинилоксигруппу.
Другими предпочтительными соединениями формулы I являются такие, в которых
R6 обозначает водород, фтор, хлор, бром, цианогруппу, C1-С6алкил, C1-С6галогеналкил или СНО;
R7 обозначает водород, C1-С6-алкил, C1-С6-галогеналкил, галоген или цианогруппу;
R4 обозначает водород, C1-С6-алкил, C1-С6-галогеналкил, С3-С7циклоалкил, галоген, цианогруппу, гидроксигруппу, C1-С6алкоксигруппу, аминогруппу, азидную группу, меркаптогруппу, C1-С6алкилтиогруппу, C1-С6алкилсульфинил, C1-С6алкилсульфонил, СНО, С2-С7алкилкарбонил, азиридиновую группу, азетидиновую группу, пиразолиновую группу, пиразолидиновую группу, пирролиновую группу, пирролидиновую группу, имидазолиновую группу, имидазолидиновую группу, триазолиновую группу, тетразолиновую группу, пиперазиновую группу, пиперидиновую группу, морфолиновую группу, тиоморфолиновую группу; или азиридиновую группу, азетидиновую группу, пиразолиновую группу, пиразолидиновую группу, пирролиновую группу, пирролидиновую группу, имидазолиновую группу, имидазолидиновую группу, триазолиновую группу, тетразолиновую группу, пиперазиновую группу, пиперидиновую группу, морфолиновую группу, тиоморфолиновую группу, каждая из которых, в свою очередь, является моно- или полизамещенной заместителями, выбранными из группы, включающей метил, галоген; или R4 обозначает фенил или фенил, который является моно- или полизамещенным заместителями, независимо выбранными из группы, включающей галоген, цианогруппу, гидроксигруппу, C1-С6алкил, C1-С6галогеналкил и C1-С6алкоксигруппу;
R3 обозначает водород, C1-С6-алкил, С2-С6алкенил, С2-С6алкинил, С3-С7циклоалкил, галоген, цианогруппу, азидную группу, нитрогруппу, -N=C=O, -N=C=S, -C(=O)NH2, -C(=S)NH2, -C(=O)NH(CH3), -С(=S)NH(СН3), -С(=O)N(СН3)2, -SO2NH2, -SO2NH(СН3), -SO2N(СН3)2, -С(=S)N(СН3)2, -СООН, три(С1-С4алкил)силил, три-(С1-С4алкокси)силил, гидроксигруппу, С1-С6алкоксигруппу, аминогруппу, азидную группу, меркаптогруппу, C1-С6алкиламиногруппу, С2-С12диалкиламиногруппу, С3-С6алкениламиногруппу, С6-С12диалкениламиногруппу, C1-С6алкилС3-С6алкениламиногруппу, С1-С6алкилтиогруппу, C1-С6алкилсульфинил, C1-С6алкилсульфонил, C1-С6галогеналкилтиогруппу, C1-С6галогеналкилсульфинил, C1-С6галогеналкилсульфонил, СНО, С2-С7алкилкарбонил, С2-С6алкоксикарбонил, С3-С6алкенилоксикарбонил, С3-С6алкинилоксикарбонил, фенил, азиридиновую группу, азетидиновую группу, пиразолиновую группу, пиразолидиновую группу, пирролиновую группу, пирролидиновую группу, имидазолиновую группу, имидазолидиновую группу, триазолиновую группу, тетразолиновую группу, пиперазиновую группу, пиперидиновую группу, морфолиновую группу или тиоморфолиновую группу; или R3 обозначает азиридиновую группу, азетидиновую группу, пиразолиновую группу, пиразолидиновую группу, пирролиновую группу, пирролидиновую группу, имидазолиновую группу, имидазолидиновую группу, триазолиновую группу, тетразолиновую группу, пиперазиновую группу, пиперидиновую группу, морфолиновую группу, тиоморфолиновую группу, моно- или полизамещенную заместителями, независимо выбранными из группы, включающей метил, галоген и фенил, и фенил, моно- или полизамещенный заместителями, независимо выбранными из группы, включающей галоген, цианогруппу, гидроксигруппу, C1-С6алкил, C1-С6галогеналкил и C1-С6алкоксигруппу; или R3 обозначает C1-С6-алкил, С2-С6алкенил, С2-С6алкинил, С3-С7циклоалкил, C1-С6алкоксигруппу, С2-С7алкилкарбонил, С2-С6алкоксикарбонил, С3-С6алкенилоксикарбонил, С3-С6алкинилоксикарбонил или фенил, или обозначает фенил, моно- или полизамещенный заместителями, независимо выбранными из группы, включающей галоген, цианогруппу, нитрогруппу, C1-С6алкил, С1-С6галогеналкил, гидроксигруппу, C1-С6алкоксигруппу, C1-С6галогеналкоксигруппу и фенил, где фенил, в свою очередь, может быть моно- или полизамещенным заместителями, независимо выбранными из группы, включающей галоген, цианогруппу, гидроксигруппу, C1-С6алкил, C1-С6галогеналкил и C1-С6алкоксигруппу;
R5 обозначает фенил, фенил-С1-С12алкил, фенил-С3-С12циклоалкил, фенил-С3-С12алкенил, или фенил, фенил-С1-С12алкил, фенил-С3-С12циклоалкил, фенил-С3-С12алкенил, моно- или полизамещенный заместителями, независимо выбранными из группы, включающей галоген, цианогруппу, нитрогруппу, аминогруппу, азидную группу, гидроксигруппу, меркаптогруппу, триалкилсилил, триалкоксисилил, СНО, СООН, C1-С6алкил, C1-С6галогеналкил, C1-С6гидроксиалкил, С3-С8циклоалкил, С3-С8галогенциклоалкил, С2-С6алкенил, С2-С6галогеналкенил, С2-С6алкинил, С2-С6галогеналкинил, C1-С6алкоксигруппу, C1-С6галогеналкоксигруппу, С3-С6алкенилоксигруппу, С3-С6галогеналкенилоксигруппу, С3-С6алкинилоксигруппу, С3-С6циклоалкоксигруппу, С3-С6галогенциклоалкоксигруппу, C1-С6алкилтиогруппу, C1-С6алкилсульфинил, C1-С6алкилсульфонил, C1-С6галогеналкилтиогруппу, C1-С6галогеналкилсульфинил, C1-С6галогеналкилсульфонил, -C(=O)NH2, -C(=S)NH2, -С(=O)NH(CH3), -C(=S)NH(CH3), -С(=O)N(СН3)2, -SO2NH2, -SO2NH(СН3), -SO2N(CH3)2 и -С(=S)N(СН3)2.
Также следует особо отметить соединения формулы I, в которых
R5 обозначает водород, (R51)(R52)(R53)Si-(C1-С12алкил)-, триС1-С6алкилсилил, фенил-диС1-С6алкилсилил, С1-С12алкил, С3-С12алкенил, С3-С12алкинил, С3-С12циклоалкил, С3-С12циклоалкил-С1-С12алкил, С5-С12циклоалкенил, С1-С12алкокси-С1-С12алкил, С1-С12алкенилокси-С1-С12алкил, С1-С12алкинилокси-С1-С12алкил, С1-С12алкилтио-С1-С12алкил, C1-С12алкилсульфенил-С1-С12алкил, С1-С12алкилсульфонил-С0-С12алкил, С2-С12алкилкарбонил-С0-С12алкил, С3-С12алкенилкарбонил-С0-С12алкил, С2-С12алкоксилкарбонил-С0-С12алкил, С3-С12алкенилоксикарбонил-С0-С12алкил или С3-С12алкинилоксикарбонил-С0-С12алкил, или R5 обозначает С1-С12алкил, С3-С12алкенил, С3-С12алкинил, С3-С12циклоалкил, С3-С12циклоалкил-С1-С12алкил, С5-С12циклоалкенил, С1-С12алкокси-С1-С12алкил, С1-С12алкенилокси-С1-С12алкил, С1-С12алкинилокси-С1-С12алкил, С1-С12алкилтио-С1-С12алкил, C1-С12алкилсульфенил-С1-С12алкил, С1-С12алкилсульфонил-С0-С12алкил, С2-С12алкилкарбонил-С0-С12алкил, С3-С12алкенилкарбонил-С0-С12алкил, С2-С12алкоксилкарбонил-С0-С12алкил, С3-С12алкенилоксикарбонил-С0-С12алкил, С3-С12алкинилоксикарбонил-С0-С12алкил, моно- или полизамещенный заместителями, независимо выбранными из группы, включающей галоген, цианогруппу, нитрогруппу, аминогруппу, гидроксигруппу, меркаптогруппу, СНО, СООН, C1-С6триалкилсилил, триС1-С6алкоксисилил, C1-С6алкил, С1-С6галогеналкил, С3-С8циклоалкил, С3-С8галогенциклоалкил, C1-С6алкенил, С1-С6галогеналкенил, C1-С6алкоксигруппу, C1-С6галогеналкоксигруппу, C2-С7алкилкарбонил, С2-С7алкоксикарбонил, С2-С7алкенилоксикарбонил, С2-С7алкинилоксикарбонил, C1-С6алкилтиогруппу, C1-С6алкилсульфинил, C1-С6алкилсульфонил, -C(=O)NH2, -C(=S)NH2, -C(=O)NH(CH3), -С(=S)NH(CH3), -C(=O)N(CH3)2 и -C(=S)N(CH3)2, и R51, R52, и R53 являются такими, как определено выше.
Другая предпочтительная подгруппа представлена соединениями формулы I, в которой
R1 и R2 независимо друг от друга обозначают C1-С6алкил, С2-С6алкинил, водород или пиридин;
или R1 и R2 вместе с соединяющим их атомом азота образуют пирролиновую группу;
R3 обозначает водород, C1-С6галогеналкил, C1-С6алкил, галоген, цианогруппу, нитрогруппу, С1-С4алкоксигруппу, фенил, фенил, содержащий в качестве заместителей галоген, (R51)(R52)(R53)Si-(С2-С6алкинил)-, где R51, R52 и R53 являются такими, как определено выше; предпочтительно водород, С1-С6алкил, галоген, цианогруппу, нитрогруппу, С1-С4алкоксигруппу, фенил, фенил, содержащий в качестве заместителей галоген, (R51)(R52)(R53)Si-(C2-С6алкинил)-, где R51, R52 и R53 являются такими, как определено выше;
R4 обозначает водород, галоген, фенил, имидазолил, аминогруппу, C1-С6алкоксигруппу или C1-С6алкил;
R5 обозначает С1-С12алкил или группу А, где А обозначает 3-10-членную моноциклическую или конденсированную бициклическую кольцевую систему, которая может быть ароматической, частично ненасыщенной или полностью насыщенной и может содержать от 1 до 4 гетероатомов, выбранных из группы, включающей азот, кислород и серу, каждая кольцевая система не может содержать более 2 атомов кислорода и более 2 атомов серы и сама 3-10-членная кольцевая система может быть моно- или полизамещенной
заместителями, независимо выбранными из группы, включающей галоген, C1-С6алкил, C1-С6галогеналкил, C1-С6алкоксигруппу и C1-С6алкилтиогруппу;
R6 обозначает водород; и
R7 обозначает водород или C1-С6алкил.
В других предпочтительных соединениях формулы I R6 обозначает -SH, -S-C1-С6алкил или -S-C1-С6галогеналкил.
В особенно предпочтительной группе соединений формулы I
R1 и R2 независимо друг от друга обозначают С3-С7циклоалкил, C1-С6алкил, С2-С6алкинил, водород или пиридин;
или R1 и R2 вместе с соединяющим их атомом азота образуют пирролиновую группу;
предпочтительно R1 и R2 независимо друг от друга обозначают C1-С6алкил, С2-С6алкинил, водород или пиридин;
или R1 и R2 вместе с соединяющим их атомом азота образуют пирролиновую группу;
R3 обозначает водород, C1-С6алкил, C1-С6алкоксигруппу, C1-С6галогеналкил, галоген, цианогруппу, фенил, фенил, содержащий в качестве заместителей галоген, (R51)(R52)(R53)Si-(С2-С6алкинил)-, где R51, R52 и R53 являются такими, как определено выше;
предпочтительно водород, C1-С6алкил, галоген, цианогруппу, фенил, фенил, содержащий в качестве заместителей галоген, (R51)(R52)(R53)Si-(C2-С6алкинил)-, где R51, R52 и R53 являются такими, как определено выше;
R4 обозначает водород, галоген, C1-С6алкоксигруппу или C1-С6алкил;
предпочтительно водород или C1-С6алкил;
R5 обозначает C1-С6алкил, фенил или пиридил или C1-С6алкил, фенил или пиридил, моно- или дизамещенный галогеном, C1-С6алкилом, C1-С6галогеналкилом, C1-С6алкоксигруппой, C1-С6алкилтиогруппой,
предпочтительно C1-С6алкил, фенил или пиридил или фенил или пиридил, моно- или дизамещенный галогеном, C1-С6алкилом, C1-С6галогеналкилом, С1-С6алкоксигруппой, C1-С6алкилтиогруппой,
R6 обозначает водород; и
R7 обозначает водород или C1-С6алкил. Другими предпочтительными вариантами осуществления настоящего изобретения являются варианты осуществления Е1-Е151, которые определяются, как соединения формулы I, которые описываются одной формулой, выбранной из группы, включающей формулы Т1-Т151, описанные ниже, где в формулах T1-Т151 значениями заместителей R1, R2, R5 и R6 являются предпочтительные значения, указанные выше.
Например, вариант осуществления Е1 характеризуется соединениями формулы Т1

в которой
R1 и R2 независимо друг от друга обозначают водород, цианогруппу, C1-С6алкил, С3-С6циклоалкил, С2-С6алкенил, С2-С6алкинил, бензил или С2-С7алкилкарбонил, каждый из которых может быть моно- или полизамещенным заместителями, независимо выбранными из группы, включающей галоген, С1-С6алкил, C1-С6галогеналкил, C1-С6алкилтиогруппу и C1-С6алкоксигруппу; или R1 и R2 вместе образуют С2-С6алкиленовый мостик, который может быть моно- или полизамещенным метальными группами; или R1 и R2 вместе с соединяющим их атомом азота образуют пиразолиновую группу, пиразолидиновую группу, пирролиновую группу, имидазолиновую группу, имидазолидиновую группу, триазолиновую группу, тетразолиновую группу, пиперазиновую группу, морфолиновую группу, тиоморфолиновую группу, каждая из которых независимо друг от друга может быть моно- или полизамещенной метальными группами; или
R1 обозначает водород, цианогруппу, C1-С6алкил, С3-С6циклоалкил, С2-С6алкенил, С2-С6алкинил, бензил или С2-С7алкилкарбонил, каждый из которых может быть моно- или полизамещенным заместителями, независимо выбранными из группы, включающей галоген, C1-С6алкил, C1-С6галогеналкил, C1-С6алкилтиогруппу и C1-С6алкокси и R2 обозначает гидроксигруппу, аминогруппу, C1-С6алкоксигруппу, С3-С6алкенилоксигруппу, С3-С8циклоалкилоксигруппу или С3-С6алкинилоксигруппу; или R2 обозначает водород, цианогруппу, C1-С6алкил, С3-С6циклоалкил, С2-С6алкенил, С2-С6алкинил, бензил или С2-С7алкилкарбонил, каждый из которых может быть моно- или полизамещенным заместителями, независимо выбранными из группы, включающей галоген, C1-С6алкил, C1-С6галогеналкил, C1-С6алкилтиогруппу и C1-С6алкокси и R1 обозначает гидроксигруппу, аминогруппу, C1-С6алкоксигруппу, С3-С6алкенилоксигруппу, С3-С8циклоалкилоксигруппу или С3-С6алкинилоксигруппу;
R6 обозначает водород, фтор, хлор, бром, цианогруппу, C1-С6алкил, C1-С6галогеналкил или СНО; и
R5 обозначает фенил, фенил-С1-С12алкил, фенил-С3-С12циклоалкил, фенил-С3-С12алкенил, или фенил, фенил-С1-С12алкил, фенил-С3-С12циклоалкил, фенил-С3-С12алкенил, моно- или полизамещенный заместителями, независимо выбранными из группы, включающей галоген, цианогруппу, нитрогруппу, аминогруппу, азидную группу, гидроксигруппу, меркаптогруппу, триалкилсилил, триалкоксисилил, СНО, СООН, C1-С6алкил, C1-С6галогеналкил, C1-С6гидроксиалкил, С3-С8циклоалкил, С3-С8галогенциклоалкил, С2-С6алкенил, С2-С6галогеналкенил, С2-С6алкинил, С2-С6галогеналкинил, C1-С6алкоксигруппу, C1-С6галогеналкоксигруппу, С3-С6алкенилоксигруппу, С3-С6галогеналкенилоксигруппу, С3-С6алкинилоксигруппу, С3-С6циклоалкоксигруппу, С3-С6галогенциклоалкоксигруппу, C1-С6алкилтиогруппу, C1-С6алкилсульфинил, C1-С6алкилсульфонил, C1-С6галогеналкилтиогруппу, С1-С6галогеналкилсульфинил, C1-С6галогеналкилсульфонил, -C(=O)NH2, -C(=S)NH2, -С(=O)NH(СН3), -C(=S)NH(CH3), -С(=O)N(СН3)2, -SO2NH2, -SO2NH(СН3), -SO2N(CH3)2 и -C(=S)N(CH3)2.
Также следует особо отметить соединения варианта осуществления Е1, в которых
R5 обозначает водород, триС1-С6алкилсилил, фенил-диС1-С6алкилсилил, С1-С12алкил, С3-С12алкенил, С3-С12алкинил, С3-С12циклоалкил, С3-С12циклоалкил-С1-С12алкил, С5-С12циклоалкенил, C1-С12алкокси-C1-С12алкил, C1-С12алкенилокси-С1-С12алкил, С1-С12алкинилокси-С1-С12алкил, С1-С12алкилтио-С1-С12алкил, С1-С12алкилсульфенил-С1-С12алкил, С1-С12алкилсульфонил-С0-С12алкил, С2-С12алкилкарбонил-С0-С12алкил, С3-С12алкенилкарбонил-С0-С12алкил, С2-С12алкоксилкарбонил-С0-С12алкил, С3-С12алкенилоксикарбонил-С0-С12алкил или С3-С12алкинилоксикарбонил-С0-С12алкил, или R5 обозначает С1-С12алкил, С3-С12алкенил, С3-С12алкинил, С3-С12циклоалкил, С3-С12циклоалкил-С1-С12алкил, С5-С12циклоалкенил, С1-С12алкокси-С1-С12алкил, C1-С12алкенилокси-С1-С12алкил, С1-С12алкинилокси-С1-С12алкил, С1-С12алкилтио-С1-С12алкил, С1-С12алкилсульфенил-С1-С12алкил, С1-С12алкилсульфонил-С0-С12алкил, С2-С12алкилкарбонил-С0-С12алкил, С3-С12алкенилкарбонил-С0-С12алкил, С2-С12алкоксилкарбонил-С0-С12алкил, С3-С12алкенилоксикарбонил-С0-С12алкил, С3-С12алкинилоксикарбонил-С0-С12алкил, моно- или полизамещенный заместителями, независимо выбранными из группы, включающей галоген, цианогруппу, нитрогруппу, аминогруппу, гидроксигруппу, меркаптогруппу, СНО, СООН, C1-С6триалкилсилил, триС1-С6алкоксисилил, C1-С6алкил, C1-С6галогеналкил, С3-С8циклоалкил, С3-С8галогенциклоалкил, C1-С6алкенил, C1-С6галогеналкенил, C1-С6алкоксигруппу, C1-С6галогеналкоксигруппу, С2-С7алкилкарбонил, С2-С7алкоксикарбонил, С2-С7алкенилоксикарбонил, С2-С7алкинилоксикарбонил, C1-С6алкилтиогруппу, C1-С6алкилсульфинил, C1-С6алкилсульфонил, -C(=O)NH2, -C(=S)NH2, -С(=O)NH(СН3), -С(=S)NH(СН3), -C(=O)N(CH3)2 и -С(=S)N(СН3)2.
В другой предпочтительной группе соединений варианта осуществления Е1 R6 обозначает -SH, -S-C1-С6алкил или -S-C1-С6галогеналкил.
В особенно предпочтительной группе соединений варианта осуществления E1 R1 и R2 независимо друг от друга обозначают C1-С6алкил, С2-С6алкинил, водород или пиридин;
или R1 и R2 вместе с соединяющим их атомом азота образуют пирролиновую группу;
R5 обозначает C1-С6алкил, фенил или пиридил или фенил или пиридил, моно- или дизамещенный заместителями, выбранными из группы, включающей галоген, C1-С6алкил, C1-С6галогеналкил, C1-С6алкоксигруппу и С1-С6алкилтиогруппу; и R6 обозначает водород. Заместители R1, R2, R5 и R6 вариантов осуществления Е2-Е151 определяются соответствующим образом.
Соединения формулы I, а также использующиеся промежуточные продукты и реагенты можно получить по методикам, известным опытному химику, различными путями, или они имеются в продаже.
Соединения формулы I можно получить с помощью целого ряда хорошо известных методик из аминов формулы II. В число таких методик входят следующие:
a) Приведенная ниже схема 1: Амид формулы (R6)C(=O)-N(R1)(R2) или формамид формулы HC(=O)-N(R1)(R2) обрабатывают такими реагентами, как POCl3, PCl3, SOCl2, COCl2, Ph-SO2Cl, Me2N-SO2Cl, (CF3CO)2O, и затем амином формулы II.
b) Приведенная ниже схема 1: Взаимодействие аминопроизводного формулы II, в которой R3, R4, R5 и R7 являются такими, как определено выше для формулы I, с соединением формулы R6-C(OR)2-N(R1)(R2), где R1, R2 и R6 являются такими, как определено выше для формулы I, или с соединением формулы R6-C(OR)(NR1R2)2, где R предпочтительно обозначает алкильную или фенильную группу и R1, R2 и R6 являются такими, как определено выше для формулы I, или, для первого реагента, эти два R вместе образуют алкилиденовый фрагмент. Такие превращения описаны в литературе, например, в Bashkirskii Khimicheskii Zhurnal (2000), 7(2), 5-9; Indian Journal of Chemistry, Section В: Organic Chemistry Including Medicinal Chemistry (1981), 20B(12), 1075-7; ARKIVOC (Gainesville, FL, United States) (2004), (10), 20-38.
Схема 1

c) Приведенная ниже схема 2: Аминопроизводное формулы II можно превратить в амид и его, в свою очередь, в конечное соединение формулы I с помощью двустадийной последовательности: 1) активации (с помощью, например, PCl5 или Ph3PO вместе с (CF3SO2)2O, и затем 2) по реакции с амином формулы HN(R1)(R2), в которой R1 и R2 являются такими, как определено выше для формулы I.
Такие методики описаны в литературе, например, в Journal of Organic Chemistry (1989), 54(5), 1144-9; Zhurnal Organicheskoi Khimii (1989), 25(2), 357-67.
Схема 2

d) Приведенная ниже схема 3: Аминопроизводное формулы II сначала можно превратить в соответствующий изоцианат. Его, в свою очередь, затем вводят в реакцию с формамидом общей формулы HC(=O)-N(R1)(R2), в которой R1 и R2 являются такими, как определено выше для формулы I, и получают формамидин формулы I. Такие методики можно найти в литературе, например, в Journal of Pharmaceutical Sciences (1964), 53(12), 1539-40; Journal für Praktische Chemie (Leipzig) (1961), 13, 265-71.
Схема 3

e) Приведенная ниже схема 4: Соединения общих формул (Ie2) и (Ie1) являются подгруппами соединений, описывающихся общей формулой (I). Соединения общей формулы (Ie2) можно получить по реакции соединения общей формулы (Ie1) с амином формулы HN(R1e)(R2e) при подходящих условиях. Фрагменты формулы -N(R1e1)(R2e1) являются подгруппой фрагментов формулы -N(R1)(R2), и соединения формулы HN(R1e2)(R2e2) образуют подгруппу соединений формулы HNR1R2. Такие методики можно найти в литературе, например, в Tetrahedron Letters (1989), 30(1), 47-50; Khimicheskii Zhurnal (2000), 7(2), 5-9.
Схема 4
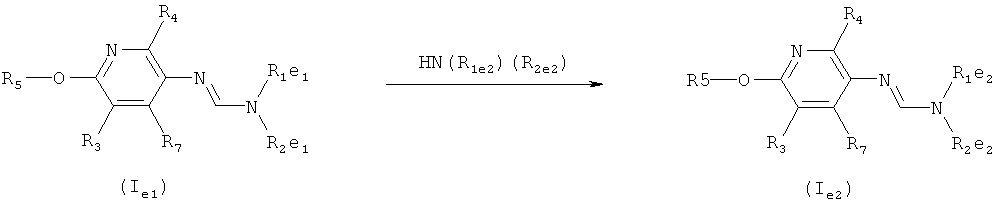
f) Приведенная ниже схема 5: Соединения общей формулы If, являющиеся подгруппой соединений формулы I, можно получить путем ацилирования или алкилирования соединений формулы If1. Такие методики можно найти в литературе, например, в Chemical & Pharmaceutical Bulletin (1983), 31(10), 3534-43; Zhurnal Organicheskoi Khimii (1989), 25(2), 357-67; Tetrahedron (2000), 56(39), 7811-7816; Journal of the Chemical Society, Transactions (1923), 123, 3359-75.
Схема 5

Заместители R и Rf в формулах - это подмножества заместителей R1 (или R2).
Соединения формулы II можно получить из соответствующих нитропроизводных формулы III по различным методикам восстановления.
g) Приведенная ниже схема 6: Методики восстановления включают превращение нитросоединения формулы III, в которой R3, R4, R5 и R7 являются такими, как определено выше для формулы I, в присутствии катализатора, например, катализаторов на основе Pd, Ni или Pt, и молекулярного водорода, в подходящем растворителе при температуре окружающей среды или при повышенных температурах, при нормальном или более высоком давлении, или восстановление можно провести с помощью одной из нескольких методик восстановления металлом, например, с использованием таких металлов, как Fe, Sn, Zn, или таких реагентов, как SnCl2 в кислой и/или протонной среде.
Схема 6

Нитросоединения формулы III можно получить различными путями. Они включают следующие:
h) Приведенная ниже схема 7: Соединения формулы III можно получить из соединений формулы IV, в которой R3, R4 и R7 являются такими, как определено выше для формулы I, содержащих отщепляющуюся группу R100, где R100 обозначает SH-, нитрогруппу, галоген, имидазолил, триазолил, С1-С6алкилтиогруппу, C1-С6алкилсульфенил или C1-С6алкилсульфонил, предпочтительно галоген, C1-С6алкилтиогруппу, C1-С6алкилсульфенил, С1-С6алкилсульфонил, более предпочтительно F, Cl, Br, I, MeS-, MeSO- или MeSO2-; или R100 обозначает имидазолил, триазолил, PhSO2, CF3SO2-O-, p-MeC6H4SO2O-, O2N-) по реакции с R5-OH, где R5 является таким, как определено выше для формулы I, в присутствии основания. Это превращение можно провести с использованием предварительно полученной соли R5OH.
Схема 7:
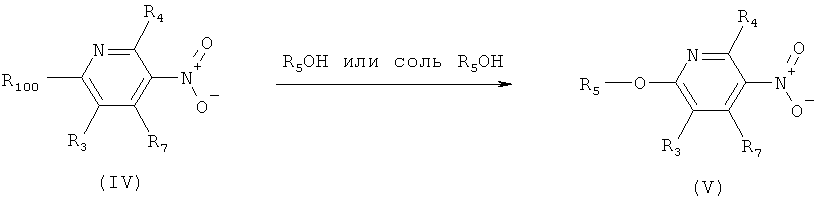
i) Приведенная ниже схема 8: Соединения формулы IIIi можно получить по реакции предшественника формулы IVi с электрофильным предшественником R5i-X, где R5i обозначает подходящую подгруппу R5 и Х обозначает отщепляющуюся группу, такую как галоген или MeSO2O или p-MeC6H4SO2O, реакцию предпочтительно проводят в присутствии основания. Или, альтернативно, соединение IVi можно ввести в реакцию со спиртом формулы R5i-OH при условиях проведения реакции Мицунобу, с использованием например, Ph3P, EtO-C-N=N-CO-OEt в растворителях, таких как диоксан, ТГФ или толуол. Такие методики описаны в литературе, например, в Journal of Medicinal Chemistry (2006), 49(15), 4455-4458; Tetrahedron Letters (2006), 47(28), 4897-4901.
Схема 8

j) Приведенная ниже схема 9: Нитросоединения формулы IIIj, являющиеся подгруппой соединений формулы III, также можно получить путем использования подходящего предшественника Vj с группой Y, например, галогеном или группой CF3SO2O, которую можно использовать для введения R3j, R3j, являющихся подгруппой R3. Для таких превращений разработаны и описаны в литературе большое количество надежных методик (например, реакции сочетания Судзуки, Судзуки-Мияура, Негиши, Стилле, или реакции Хека и Соногашира).
Схема 9

k) Приведенная ниже схема 10: Соединения формулы IIIk, являющиеся подгруппой соединений, описывающихся формулой III, можно получить, как показано на схеме 10, с помощью хорошо известных методик. К ним относятся, например, реакции сочетания Судзуки-Мияура и Стилле, в которых используются электрофильные реагенты (R3k1)-Х, Х обозначает отщепляющуюся группу, предпочтительно Cl, Br или I. В рамках определения, приведенного на схеме 10, R3k1 является частью многих молекулярных каркасов, которые обычно используют для проведения реакций, возможных в данном случае. (R3k1)-Х включает галогениды арил-, гетероарил- или винилсодержащих систем. Методика, описанная в настоящем изобретении, также включает реакции с предшественником (R5k2)-H, с образованием нуклеофильных систем, которые при подходящих условиях присоединяются с основному пиридиновому фрагменту (Vk). К последним классам относятся, например, реакции аминирования или реакции с предшественником карбонильного соединения (содержащего кислую группу СН в α-положении к карбонилу). В обоих случаях имеется много каталитических систем, описанных в литературе для проведения превращения.
Схема 10

1) Приведенная ниже схема 11: Соединения формулы IIIL, являющиеся подгруппой соединений формулы III, можно получить по реакции электрофильных соединений формулы (R3La)-Х (X обозначает отщепляющуюся группу, такую как галоген или MeSO2O) с анионом, образованным из соединений формулы VL, с основанием при подходящих условиях, которые описаны в литературе.
Схема 11

m) Приведенная ниже схема 12: Соединения формулы IIIm, являющиеся подгруппой соединений формулы III, также можно получить путем превращения функциональной группы R3m1 предшественника в группу R3m. Фрагменты формулы R3m, являющиеся подгруппой фрагментов, определенных формулой R3, и предшественник фрагмента формулы R3ma являются такими, что определения формулы R3m сохраняются после проведения превращения. Например: (R3m1)- может представлять собой НСО-, который можно превратить в F2CH- с использованием таких реагентов, как (диэтиламино)сератрифторид или SF4, или (R3m1)-) может представлять собой Н3С-H2C-S-, который можно превратить в Н3С-Н2С-S(=O)- и Н3С-Н2С-S(=O)2- путем окисления по стандартным методикам, которые подробно описаны в литературе; или (R3m1-) может представлять собой -C=S)NH2, который можно превратить в необязательно замещенный тиазолильный фрагмент по стандартным методикам, описанным в литературе.
Схема 12

n) Методики, описанные выше в разделах j)-m), для введения и превращения заместителя R3, также можно использовать в случае заместителей R4 И R7.
о) Приведенная ниже схема 13: Методики, указанные выше в разделах j)-m), в соответствующем виде также можно использовать для обработки соединений формулы IIIo, представляющих собой соединения подгруппы соединений формулы III. В этом случае подходящий заместитель R5o1 превращают в заместитель R5o, заместители R5o являются подгруппой заместителей R5.
Схема 13
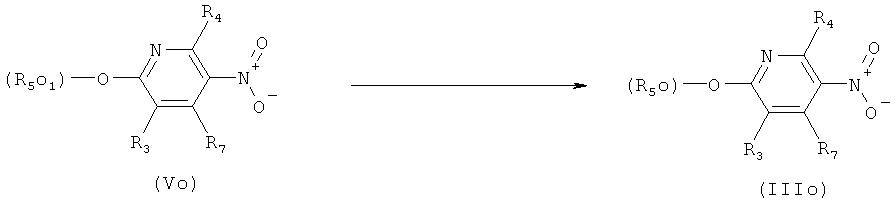
p) Приведенная ниже схема 14: Методики, описанные выше в разделах g)-о), также применимы в случаях, когда нитрогруппу заменяют водородом или аминогруппой, или соответствующим образом защищенной аминогруппой (такой как, например, -NH-С(=O)-СН3, -NH-С(=O)-трет-бутил, -NH-бензоил, -N(С(=O)-СН3)2, -фталоил, -N(бензил)2, -NH-С(=O)-O-трет-бутил), или какой-либо амидиновой группой -N=C(R6)-N(R1)(R2). Однако специалист в данной области техники знает, что это не является общим подходом и применимо в случаях наличия совместимых функциональных групп. Например, такой подход представлен на схеме 14 для превращений, описанных в разделе m) выше в случае, когда вместо нитрогруппы содержится амидиновая группа (формула X). См. определения R3m1 и R3m в разделе m) выше и определения R100 в разделе h) выше. Соединения формулы X, в которой R1, R2, R3, R4, R6 и R7 являются такими, как определено для формулы I в разделе I, и R100 обозначает SH-, нитрогруппу, галоген, имидазолил, триазолил, C1-С6алкилтиогруппу, C1-С6алкилсульфенил или C1-С6алкилсульфонил являются новыми и поэтому образуют еще один объект настоящего изобретения.
Схема 14

q) Приведенная ниже схема 15: Соединения формулы III можно получить путем прямого нитрования подходящего предшественника при условии, что использующаяся методика нитрования применима для исходного вещества. Это нитрование можно выполнить различными хорошо известными путями. Например, с использованием смеси кислот HNO3 и H2SO4. При такой методике предшественник можно сначала растворить в H2SO4 и ввести в реакцию со смесью кислот или его можно прямо обработать смесью кислот при различных условиях. Кроме того, нитрование можно провести в системе инертных растворителей с использованием таких нитрующих реагентов, как BF4NO4. Нитрование также можно провести с использованием HNO3 в подходящем растворителе, таком как H2O, АсОН, ангидрид уксусной кислоты. Эти же методики также можно использовать для подходящего предшественника формулы VII и получить соединение формулы IV. Х обозначает отщепляющуюся группу, определенную выше в разделе h).
Схема 15

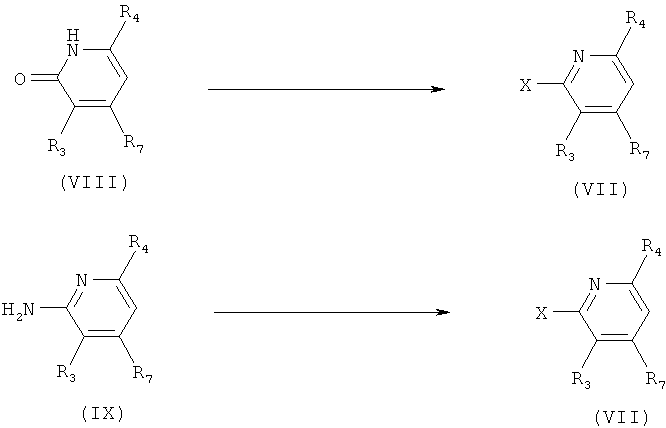
r) Приведенная ниже схема 16: Соединения формулы VII можно синтезировать с помощью целого ряда хорошо известных методик. Предпочтительно, путем превращения предшественников формул VIII или IX. Х обозначает отщепляющуюся группу, определенную выше в разделе h).
r1) Если соединение формулы VIII является предшественником, то методика включает превращение в соединение, в котором Х обозначает Cl, с использованием таких реагентов, как PCl5, POCl3, SOCl2 или ClCO-COCl, обычно при нагревании в инертном растворителе, без присутствия или в присутствии подходящего основания. Если Х обозначает Br, то предпочтительные реагенты включают POBr3, PBr3 и NBS вместе с Ph3P. Если Х обозначает CF3SO2O, в предпочтительных методиках синтеза используют такие реагенты, как (CF3SO2)2O в присутствии основания, например, Et3N или 2,6-лутидина.
r2) Если соединение формулы (IX) является предшественником, то предпочтительные методики включают следующие. Если Х обозначает Cl или Br, то можно использовать методику типа Зандмейера, т.е. диазотирование с последующей реакцией с хлоридом или бромидом меди(I). Или, если Х обозначает F, то после диазотирования получают диазонийфторборат, который затем превращают во фторпроизводное. Фторборат также можно получить с использованием органического нитрита и эфирата BF3.
Схема 16
s) Приведенная ниже схема 17: Большое количество соединений формул VIII и IX или соединений, являющихся их возможными предшественниками, имеется в продаже. Кроме того, существует много путей синтеза пиридиновых структурных элементов общих формул VIII и IX, в большом количестве описанных в литературе. Например, отметим следующие 3 синтеза соединений, соответствующих общему определению соединений формулы IX, которые представлены ниже на схемах 18-20.
Схема 17

Схема 18

Journal of Organic Chemistry (2005), 70(4), 1364-1368
Схема 19

Journal of Heterocyclic Chemistry (1977), 14(2), 203-5
Схема 20
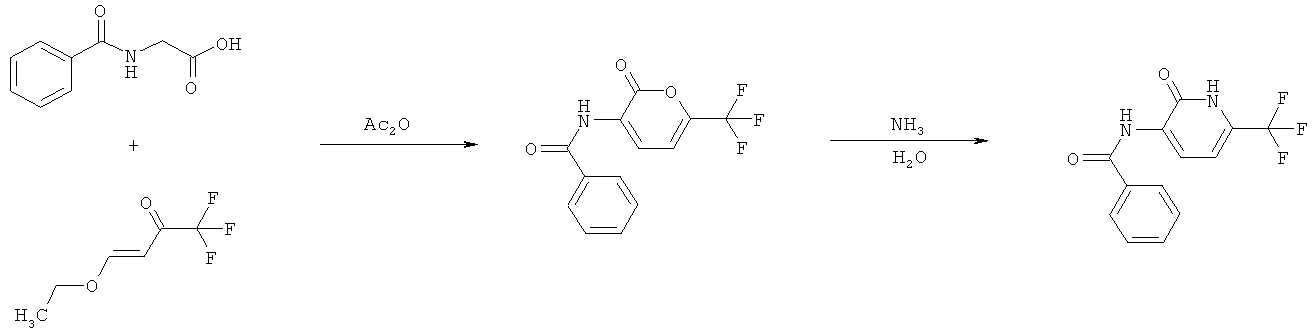
Synthesis (2005), (8), 1269-1278
Реакции, приводящие к соединениям формулы I, предпочтительно проводят в апротонных инертных органических растворителях. Такими растворителями являются углеводороды, такие как бензол, толуол, ксилол или циклогексан, хлорированные углеводороды, такие как дихлорметан, трихлорметан, тетрахлорметан или хлорбензол, простые эфиры, такие как диэтиловый эфир, диметиловый эфир этиленгликоля, диметиловый эфир диэтиленгликоля, тетрагидрофуран или диоксан, нитрилы, такие как ацетонитрил или пропионитрил, амиды, такие как N,N-диметилформамид, диэтилформамид или N-метилпирролидинон. Температура проведения реакции предпочтительно составляет от -20 до +120°С. Обычно реакции является немного экзотермичными и как правило их можно проводить при комнатной температуре. Для сокращения длительности проведения реакции или для инициирования реакции смесь можно кратковременно нагреть до температуры кипения реакционной смеси. Длительности проведения реакции также можно сократить путем прибавления нескольких капель основания, как катализатора реакции. Подходящими основаниями являются, в частности, третичные амины, такие как триметиламин, триэтиламин, хинуклидин, 1,4-диазабицикло[2.2.2]октан, 1,5-диазабицикло[4.3.0]нон-5-ен или 1,5-диазабицикло[5.4.0]ундец-7-ен. Однако в качестве оснований можно использовать неорганические основания, такие как гидриды, например, гидрид натрия или гидрид кальция, гидроксиды, например, гидроксид натрия или гидроксид калия, такие как карбонат натрия и карбонат калия, или гидрокарбонаты, такие как гидрокарбонат калия и гидрокарбонат натрия. Основания можно использовать сами по себе или с прибавлением каталитических количеств межфазного катализатора, например, краун-эфира, в частности 18-краун-6, или соли тетраалкиламмония.
Соединения формулы I можно выделить обычным образом путем концентрирования и/или путем выпаривания растворителя и очистить посредством перекристаллизации растирания твердого остатка с растворителями, в которых они плохо растворимы, такими как простые эфиры, ароматические углеводороды или хлорированные углеводороды.
Соединения формулы I и, если это целесообразно, их таутомеры могут содержаться в форме одного из изомеров, который является возможным, или в виде их смеси, например, в виде чистых изомеров, таких как антиподы и/или диастереоизомеры, или в виде смесей изомеров, таких как смеси структурных изомеров, стереоизомеров, диастереоизомеров и энантиомеров, например, рацематы, смеси диастереоизомеров или смеси рацематов в зависимости от количества, абсолютной или относительной конфигурации асимметрических атомов углерода, которые содержатся в молекуле, и/или в зависимости от конфигурации неароматических двойных связей, которые содержатся в молекуле; настоящее изобретение относится к чистым изомерам, а также ко всем смесям изомеров, которые являются возможными, и в каждом случае выше и ниже в настоящем изобретении, их следует понимать в таком смысле, даже если в каждом случае не указаны подробности стереохимии.
Смеси диастереоизомеров или смеси рацематов соединений I, которые можно получить в зависимости от того, какие исходные вещества и методики выбраны, по известным методикам можно разделить на чистые диастереоизомеры или рацематы на основании различий физико-химических характеристик компонентов, например, путем фракционной кристаллизации, перегонки и/или хроматографии.
Смеси энантиомеров, такие как рацематы, которые можно получить аналогичным образом, можно разделить на оптические антиподы по известным методикам, например, путем перекристаллизации из оптически активного растворителя, с помощью хроматографии на хиральных сорбентах, например, с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) на ацетилцеллюлозе, с помощью подходящих микроорганизмов, путем расщепления с помощью специфических иммобилизованных ферментов, путем образования соединений включения, например, с использованием хиральных краун-эфиров, с которыми образует комплекс только один энантиомер, или путем превращения в соли диастереоизомеров, например, по реакции рацемата основного конечного продукта с оптически активной кислотой, такой как карбоновая кислота, например, камфорная, винная или яблочная кислота, или сульфоновая кислота, например, камфорсульфоновая кислота, и разделения смеси диастереоизомеров, которые можно получит таким образом, например, с помощью фракционной кристаллизации, основанной на различии их растворимостей, с получением диастереоизомеров, из которых можно выделить искомый энантиомер путем обработки подходящими реагентами, например, основными реагентами.
Чистые диастереоизомеры или энантиомеры в контексте настоящего изобретения можно получить не только путем разделения подходящих смесей изомеров, но и по общеизвестным методикам диастереоселективного или энантиоселективного синтеза, например, путем осуществления способа. предлагаемого в настоящем изобретении, с исходными материалами, обладающими подходящей стереохимической конфигурацией.
В каждом случае предпочтительно выделять или синтезировать биологический более эффективный изомер, например, энантиомер или диастереоизомер, или смесь изомеров, например, смесь энантиомеров или смесь диастереоизомеров, если отдельные компоненты обладают разной биологической активностью.
Соединения I и, если это целесообразно, их таутомеры, также можно, если это целесообразно получить в форме гидратов и/или в форме, включающей другие растворители, например, те, которые могли использоваться для кристаллизации соединений, которые находятся в твердой форме.
Согласно изобретению было установлено, что соединения формулы I, предлагаемые в настоящем изобретении, с практической точки зрения обладают очень привлекательным спектром активности для защиты полезных растений от болезней, которые вызываются фитопатогенными микроорганизмами, такими как грибы, бактерии и вирусы.
Настоящее изобретение относится к способу борьбы с заражением полезных растений фитопатогенными микроорганизмами или его предупреждения, в котором соединение формулы I наносят в качестве активного ингредиента на растения, на их части или место их произрастания. Соединения формулы I, предлагаемые в настоящем изобретении, отличаются превосходной эффективностью при низких нормах расхода, хорошо переносятся растениями и они являются экологически безопасными. Они обладают очень полезными лечебными, предупредительными и системными характеристиками и применяются для защиты многочисленных культурных растений. Соединения формулы I можно использовать для подавления или уничтожения вредителей, находящихся на растениях или частях растений (плодах, цветках, листьях, стеблях, клубнях, корнях) различных культур полезных растений и одновременно для защиты также и тех частей растений, которые вырастают позднее, например, от фитопатогенных микроорганизмов. Соединения формулы I также можно использовать в качестве протравливающих агентов для материала для размножения растений, например, семян (плоды, клубни, зерна) и саженцев растений (например, риса), для защиты от грибковых инфекций, а также фитопатогенных грибов, встречающихся в почве.
Кроме того, соединения, предлагаемые в настоящем изобретении, можно использовать для борьбы с грибами в смежных отраслях, например, для защиты технических материалов, включая древесину и изготовленные с использованием древесины технические продукты, при хранении пищевых продуктов, при гигиенических мероприятиях.
Соединения формулы I например, эффективны против фитопатогенных грибов следующих классов: Fungi imperfecti (например, Botrytis, Pyricularia, Helminthosporium, Fusarium, Septoria, Cercospora и Alternaria) и базидиомицеты (например, Rhizoctonia, Hemileia, Puccinia). Кроме того, они также эффективны против классов аскомицетов (например, Venturia и Erysiphe, Podosphaera, Monilinia, Uncinula) и классов оомицетов (например, Phytophthora, Pythium, Plasmopara). Обнаружена чрезвычайно высокая активность по отношению к настоящей мучнистой росе (Erysiphe spp.). Кроме того, новые соединения формулы I эффективны против фитопатогенных бактерий и вирусов (например, против Xanthomonas spp, Pseudomonas spp, Erwinia amylovora, а также против вируса табачной мозаики). Обнаружена хорошая активность по отношению к азиатской соевой ржавчине (Phakopsora pachyrhizi).
В объеме настоящего изобретения полезные растения, подлежащие защите, обычно включают следующие виды растений: злаки (пшеница, ячмень, рожь, овес, рис, кукуруза, сорго и родственные виды); свеклу (сахарная свекла и кормовая свекла); яблоки, косточковые и ягоды (яблоки, груши, сливы, персики, миндаль, вишни, земляника, малина и черная смородина); бобовые растения (бобы, чечевица, горох, соя); масличные растения (рапс, горчица, мак, оливы, подсолнечник, кокос, клещевина, какао-бобы, земляной орех); огуречные растения (тыквы, огурцы, дыни); волокнистые растения (хлопок, лен, конопля, джут); цитрусовые фрукты (апельсины, лимоны, грейпфруты, мандарины); овощи (шпинат, латук, спаржа, капуста, морковь, луки, томаты, картофель, красный перец); лавровые (авокадо, корица, камфара) и такие растения, как табак, орехи, кофе, баклажаны, сахарный тростник, чай, перец, виноград, хмель, бананы и натуральные каучуконосные растения, а также декоративные растения.
Термин "полезные растения" следует понимать, как включающий и полезные растения, которым придана стойкость к гербицидам, таким как бромоксинил, или к или классам гербицидов (таким как, например, ингибиторы HPPD, ингибиторы ALS, например, примисульфурон, просульфурон и трифлоксисульфурон, ингибиторы EPSPS (5-енолпировилшикимат-3-фосфатсинтаза), ингибиторы ГС (глутаминсинтетаза) с помощью обычных методик селекции или генной инженерии. Примером культуры, которой с помощью обычных методик селекции (мутагенеза) придана стойкость, например, к имидазолинонам, например, имазамоксу, является сурепица Clearfield® (канола). Примерами культур, которым с помощью методик генной инженерии придана стойкость к гербицидам или классам гербицидов, являются сорта кукурузы, стойкие, например, к глифозату или глюфозинату, которые имеются в продаже под торговыми названиями RoundupReady® и LibertyLink®.
Термин "полезные растения" следует понимать, как включающий и полезные растения, которые путем использования методики на основе рекомбинантной ДНК изменены таким образом, что они способны синтезировать один или большее количество оказывающих селективное воздействие токсинов, таких как, для которых известно, например, что они вырабатываются продуцирующими токсины бактериями, в особенности рода Bacillus.
Трансгенные растения, содержащие один или большее количество генов, которые кодируют стойкость к насекомым и экспрессируют один или большее количество токсинов, известны и некоторые из них имеются в продаже. Примерами таких растений являются: YieldGard® (сорт кукурузы, который экспрессирует токсин CryIA(b)); YieldGard Rootworm® (сорт кукурузы, который экспрессирует токсин CryIIIB(b1)); YieldGard Plus® (сорт кукурузы, который экспрессирует токсины CryIA(b) и CryIIIB(b1)); Starlink® (сорт кукурузы, который экспрессирует токсин Cry9(c)); Herculex I® (сорт кукурузы, который экспрессирует токсин CryIF(a2) и фермент фосфинотрицин-N-ацетилтрансферазу (PAT) для придания стойкости к гербициду глуфосинат-аммонию); NuCOTN 33В® (сорт хлопка, который экспрессирует токсин CryIA(c)); Bollgard I® (сорт хлопка, который экспрессирует токсин CryIA(c)); Bollgard II® (сорт хлопка, который экспрессирует токсины CryIA(c) и CryIIA(b)); VIPCOT® (сорт хлопка, который экспрессирует токсин VIP); NewLeaf® (сорт картофеля, который экспрессирует токсин CryIIIA); NatureGard®, Agrisure® GT Advantage (GA21 стойкий к глифосату), Agrisure® CB Advantage (Bt11 стойкий к мотыльку кукурузному (CB)) и Protecta®.
Термин "полезные растения" следует понимать, как включающий и полезные растения, которые путем использования методики на основе рекомбинантной ДНК изменены таким образом, что они способны синтезировать оказывающие селективное воздействие противопатогенные вещества, таких как, например, так называемые "связанные с патогенезом белки" (PRP, см., например, ЕР-А-0392225). Примеры таких противопатогенных веществ и трансгенных растений, способных синтезировать такие противопатогенные вещества, приведены, например, в ЕР-А-0392225, WO 95/33818, ЕР-А-0353191. Методики получения таких трансгенных растений обычно известны специалисту в данной области техники и описаны, например, в указанных выше публикациях.
Термин "место произрастания" полезного растения при использовании в настоящем изобретении означает место, на котором произрастают полезные растения, на котором высеяны материалы для размножения полезных растений или на котором будут помещены в почву материалы для размножения полезных растений. Примером такого места произрастания является поле, на котором произрастают культурные растения.
Термин "материал для размножения растений" следует понимать, как означающий все генеративные части растения, такие как семена, которые можно применять для размножения последних, и вегетативный материал, такой как черенки и клубни, например, картофель. Например, можно отметить семена (в строгом смысле слова), корни, плоды, клубни, луковицы, корневища, части растений. Также можно отметить проросшие растения или рассаду, которые необходимо пересадить после прорастания или появления всходов из почвы. Эту рассаду можно защитить до пересадки путем полной или частичной обработки, проводимой путем погружения. Следует понимать, что предпочтительный "материал для размножения растений" означает семена.
Соединения формулы I применяются в неизмененном виде или, предпочтительно, совместно с носителями и вспомогательными веществами, обычно применяющимися для приготовления препаратов.
Поэтому настоящее изобретение также относится к композициям для борьбы с фитопатогенными микроорганизмами и защиты от них, включающим соединение формулы I и инертный носитель, и к способу борьбы с заражением полезных растений фитопатогенными микроорганизмами и его предупреждения, в котором композицию, включающую соединение формулы I в качестве активного ингредиента и инертный носитель, наносят на растения, на их части или на место их произрастания.
Для этого соединения формулы I и инертные носители обычно приготавливают известным образом в виде эмульгирующихся концентратов, паст для нанесения, непосредственно распрыскиваемых или разбавляемых растворов, разбавленных эмульсий, смачивающихся порошков, растворимых порошков, дустов, гранулятов, а также форм, капсулированных, например, в полимерных веществах. Как и тип композиции, методики внесения, такие как опрыскивание, атомизация, опыление, разбрасывание, нанесение слоя или полив, выбираются в соответствии с назначением и превалирующими обстоятельствами. Композиции также могут содержать другие вспомогательные вещества, такие как стабилизаторы, противопенные вещества, регуляторы вязкости, связующие или вещества, придающие липкость, а также удобрения, источники питательных микроэлементов или другие композиции, предназначенные для обеспечения специальных эффектов.
Подходящие носители и вспомогательные вещества могут быть твердыми или жидкими и являются веществами, применяющимися в технологии приготовления препаратов, например, натуральные или регенерированные минеральные вещества, растворители, диспергирующие вещества, смачивающие агенты, вещества, придающие липкость, загустители, связующие или удобрения. Такие носители, например, описаны в WO 97/33890.
Соединения формулы I или композиции, содержащие соединение формулы I в качестве активного ингредиента, и инертный носитель, можно наносить на место выращивания или на обрабатываемое растение одновременно или последовательно с дополнительными соединениями. Этими дополнительными соединениями могут быть, например, удобрения или источники микроэлементов или другие препараты, которые влияют на рост растений. Ими также могут быть селективные гербициды, а также инсектициды, фунгициды, бактерициды, нематоциды, моллюскоциды или смеси нескольких из этих препаратов, при необходимости вместе с дополнительными носителями, поверхностно-активными веществами или вспомогательными веществами, улучшающими нанесение, обычно применяющимися в области приготовления препаратов.
Предпочтительным способом внесения соединения формулы I или композиции, включающей соединение формулы I в качестве активного ингредиента и инертный носитель, является некорневое внесение. Частота внесения и норма расхода зависят от опасности заражения соответствующим патогеном. Однако соединения формулы I также могут проникать в растение через корни из почвы (системное воздействие) при дождевании места произрастания растений жидким препаратом или при внесении соединений в почву в твердом виде, например, в гранулированном виде (почвенное внесение). Под затопляемые культуры, такие как рис, такие грануляты можно вносить на залитое рисовое поле. Соединения формулы I также можно наносить на семена (в виде покрытия) путем пропитывания семян или клубней жидким препаратом фунгицида или нанесения на них покрытия из твердого препарата.
Препарат, т.е. композицию, содержащую соединение формулы I и при необходимости твердое или жидкое вспомогательное вещество, готовят по известным методикам, обычно путем тщательного смешивания и/или размола соединения с наполнителями, например, растворителями, твердыми носителями и необязательно поверхностно-активными веществами.
Агрохимические препараты обычно содержат от 0,1 до 99 мас.%, предпочтительно от 0,1 до 95 мас.% соединения формулы I, от 99,9 до 1 мас.%, предпочтительно от 99,8 до 5 мас.% твердого или жидкого вспомогательного вещества и от 0 до 25 мас.%, предпочтительно от 0,1 до 25 мас.% поверхностно-активного вещества.
В то время как коммерческие продукты предпочтительно готовить в виде концентратов, конечный пользователь обычно будет использовать разбавленные препараты.
Предпочтительные норм расхода обычно составляют от 5 г до 2 кг активного ингредиента (АИ) на гектар (га), предпочтительно от 10 г до 1 кг АИ/га, наиболее предпочтительно от 20 г до 600 г АИ/га. При использовании в качестве средства для замачивания семян обычные дозы составляют от 10 мг до 1 г активного вещества на 1 кг семян. Норму расхода для обеспечения необходимого воздействия можно определить экспериментально. Она зависит, например, от типа воздействия, стадии развития полезного растения и от нанесения (участка, временного режима, методики внесения) и в зависимости от этих параметров меняется в широких пределах.
Указанные способы являются особенно эффективными для борьбы с фитопатогенными микроорганизмами царства грибы, типа базидиомицеты, класса Uredinomycetes, подкласса Urediniomycetidae и отряда Uredinales (обычно называющихся ржавчинами). Виды ржавчины, особенно сильно влияющие на сельскохозяйственные культуры, включают виды семейства Phakopsoraceae, в особенности виды рода Phakopsora, например, Phakopsora pachyrhizi, которая также называется азиатской соевой ржавчиной, и виды семейства Pucciniaceae, в особенности виды рода genus Puccinia, такие как Puccinia graminis, также известная, как стеблевая ржавчина или черная ржавчина, которая является опасной болезнью злаков, и Puccinia recondita, также известная, как бурая ржавчина.
Вариантом осуществления указанного способа является способ защиты культур полезных растений от нашествия фитопатогенных микроорганизмов и/или лечения культур полезных растений, зараженных фитопатогенными микроорганизмами, указанный способ включает одновременное нанесение глифосата, включая его соли или сложные эфиры, и по меньшей мере одного соединения формулы I, которое обладает активностью по отношению к фитопатогенным микроорганизмам, по меньшей мере на один объект, выбранный из группы, включающей растение, часть растения и место его произрастания.
Согласно изобретению неожиданно было установлено, что соединения формулы I или их фармацевтические соли, описанные выше, также обладают спектром активности, подходящим для устранения и/или предупреждения микробной инфекции у животного.
"Животным" может быть любое животное, например, насекомое, млекопитающее, рептилия, рыба, амфибия, предпочтительно млекопитающее, наиболее предпочтительно человек. "Лечение" означает применение к животному, у которого имеется микробная инфекция, для уменьшения, или ослабления, или остановки усиления или распространения инфекции, или для ослабления инфекции, или для устранения инфекции. "Предупреждение" означает применение к животному, у которого отсутствуют видимые признаки микробной инфекции, для предупреждения какой-либо будущей инфекции, или для уменьшения, или ослабления усиления или распространения какой-либо будущей инфекции.
Поэтому настоящее изобретение относится к применению соединения формулы I для приготовления лекарственного средства, предназначенного для устранения и/или предупреждения микробной инфекции у животного. Настоящее изобретение также относится к применению соединения формулы I в качестве лекарственного средства. Настоящее изобретение также относится к применению соединения формулы I в качестве противомикробного средства для лечения животного. Настоящее изобретение также относится к фармацевтической композиции, включающей в качестве активного ингредиента соединение формулы I или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель или разбавитель. Эту композицию можно применять для устранения и/или предупреждения микробной инфекции у животного. Эта фармацевтическая композиция может находиться в форме, подходящей для перорального введения, такой как таблетка, лепешки, твердые капсулы, водные суспензии, масляные суспензии, эмульсии, диспергирующиеся порошки, диспергирующиеся гранулы, сиропы и эликсиры. Альтернативно, эта фармацевтическая композиция может находиться в форме, подходящей для местного нанесения, такой как спрей, крем или лосьон. Альтернативно, эта фармацевтическая композиция может находиться в форме, подходящей для парентерального введения, например, инъекции. Альтернативно, эта фармацевтическая композиция может находиться в ингаляционной форме, такой как распыляемый аэрозоль.
Соединения формулы I могут быть эффективными для борьбы с микроорганизмами разных видов, которые могут привести к микробной инфекции у животного. Примерами таких видов микроорганизмов являются те, которые вызывают аспергиллез, такие как Aspergillus fumigatus, A.flavus, A.terrus, A.nidulans и A.niger; которые вызывают бластомикоз, такие как Blastomyces dermatitidis; которые вызывают кандидоз, такие как Candida albicans, С.glabrata, С.tropicalis, С.parapsilosis, С.krusei и С.lusitaniae; которые вызывают кокцидиоидомикоз, такие как Coccidioides immitis; которые вызывают криптококкоз, такие как Cryptococcus neoformans; которые вызывают гистоплазмоз, такие как Histoplasma capsulatum и которые вызывают зиготомикоз, такие как Absidia corymbifera, Rhizomucor pusillus и Rhizopus arrhizus. Другими примерами являются Fusarium Spp, такие как Fusarium oxysporum и Fusarium solani и Scedosporium Spp, такие как Scedosporium apiospermum и Scedosporium prolificans. Дополнительными примерами являются Microsporum Spp, Trichophyton Spp, Epidermophyton Spp, Mucor Spp, Sporothorix Spp, Phialophora Spp, Cladosporium Spp, Petriellidium spp, Paracoccidioides Spp и Histoplasma Spp.
Приведенные ниже неограничивающие примеры более подробно иллюстрируют настоящее изобретение, описанное выше, не налагая на него ограничения.
Примеры получения соединений:
Пример Р1: Получение N'-[6-(4-хлор-3-трифторметилфенокси)-5-(4-фторфенил)-2-метилпиридин-3-ил]-N-этил-N-метилформамидина:
а) Получение 3,5-дибром-6-метилпиридин-2-ола:
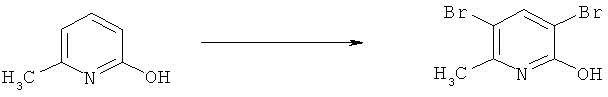
В пятигорлой реакционной колбе объемом 1,5 л, снабженной механической мешалкой и защищенной от солнечного света алюминиевой фольгой, 30,0 г 6-метилпиридин-2-ола суспендируют в 300 мл сухого ацетонитрила и перемешивают при температуре окружающей среды. При охлаждении в охлаждающей бане из воды со льдом в течение 25 мин порциями медленно добавляют 97,9 г N-бромсукцинимида (NBS). Наблюдается незначительное выделение тепла (температура поднимается до 29°С). Поскольку суспензию трудно перемешивать, повторно добавляют 300 мл сухого ацетонитрила и перемешивание продолжают при температуре окружающей среды в течение 1,75 ч. Затем суспензию фильтруют, отфильтрованный осадок тщательно промывают метанолом для удаления сукцинимида и сушат и получают 64,1 г соединения в виде белого твердого вещества (Т.пл. (температура плавления) >225°С).
b) Получение 3-бром-6-метилпиридин-2-ола:

В пятигорлой реакционной колбе объемом 1,5 л (высушенная пламенем) 63,1 г 3,5-дибром-6-метилпиридин-2-ола суспендируют в 300 мл сухого ТГФ и перемешивают в атмосфере аргона при температуре окружающей среды. Реакционную смесь охлаждают до температуры, равной от -78 до -80°С (охлаждающая баня со смесью Et2O/твердый диоксид углерода). В течение 2,5 ч добавляют 295 мл 1,6 М раствора н-бутиллития в гексане, в результате чего наблюдают повышение температуры до -74°С (желто-оранжевая суспензия). Перемешивание продолжают при температуре от -78 до -80°С в течение 1 ч. Затем в течение 15 мин медленно добавляют 42,6 мл воды. После перемешивания при -78°С в течение 20 мин реакционной смеси в течение ночи дают нагреться до температуры окружающей среды. На следующий день смесь концентрируют в вакууме и получают влажное желтое твердое вещество. После добавления 200 мл водного раствора NaCl смесь экстрагируют с помощью AcOEt при значении рН, равном 9, и после сушки органической фазы над сульфатом натрия, фильтрования и концентрирования в вакууме получают 37,2 г смолообразного вещества. Концентрирование водной фазы в вакууме дает 70,1 г твердого вещества. Объединенные партии, полученные таким образом, очищают с помощью флэш-хроматографии [силикагель (колонка: высота = 25 см, ⌀=12 см) и трет-бутилметиловый эфир с 1 об.% АсОН]. Фракции, в основном содержащие искомое соединение, объединяют (всего 29,7 г) и суспендируют в Et2O при температуре окружающей среды, смесь перемешивают, затем фильтруют, отфильтрованный осадок промывают с помощью Et20 и после высушивания получают 14,7 г соединения в виде белого твердого вещества (Т.пл.=212-213°С).
1Н ЯМР (400 МГц, CDCl3): δ 2,35 (s, 3Н), 5,97 (d, 1H), 7,71 (d, 1H), 12,35 (широкий, 1H).
c): Получение 3-бром-6-метил-5-нитропиридин-2-ола:

В одногорлую круглодонную колбу объемом 500 мл добавляют 230 мл 65% водного раствора HNO3 и перемешивают при охлаждении (охлаждающая баня со смесью лед/вода). При температуре окружающей среды порциями добавляют 7,00 г 3-бром-6-метилпиридин-2-ола. Перемешивание продолжают при температуре окружающей среды в течение 3,5 ч. Смесь выливают в 200 мл смеси лед/вода (рН 1), затем водную фазу экстрагируют с помощью AcOEt. Органическую фазу дважды промывают водой со значением рН, доведенным до 4, путем добавления водного раствора NaOH (рН измеряют рН-метром), затем сушат над сульфатом натрия, фильтруют и концентрируют в вакууме и получают 7,52 г желтого твердого вещества. Неочищенное вещество суспендируют в диэтиловом эфире и перемешивают при температуре окружающей среды в течение 1 ч, фильтруют, промывают тем же растворителем и сушат и получают 3,89 г соединения в виде желто-оранжевого твердого вещества (Т.пл. >220°С).
1Н ЯМР (400 МГц, CDCl3): δ 2,86 (s, 3Н), 8,66 (s, 1H), 12,75 (широкий, 1H).
d) Получение 3-бром-2-хлор-6-метил-5-нитропиридина:

В одногорлой круглодонной колбе объемом 100 мл, снабженной холодильником, 4,36 г пиридона добавляют к 17 мл оксихлорида фосфора (коричневая суспензия). Затем эту смесь перемешивают при кипячении с обратным холодильником в течение 7 ч. После охлаждения смеси до температуры окружающей среды ее концентрируют в вакууме при 50°С, затем 3 раза добавляют толуол и концентрируют в вакууме и получают коричневое маслянистое смолообразное вещество. Это смолообразное вещество обрабатывают льдом, затем избытком насыщенного водного раствора бикарбоната натрия. Смесь экстрагируют с помощью AcOEt. Органическую фазу сушат над сульфатом натрия, фильтруют и концентрируют в вакууме и получают 3,79 г коричневого твердого вещества. Очистка твердого вещества с помощью флэш-хроматографии с использованием картриджа с силикагелем (50 г, 150 мл) и смеси гептан/этилацетат 95:5 (об.:об.) дает 3,32 г соединения в виде светло-желтого твердого вещества (Т.пл. = 76-78°С).
1Н ЯМР (400 МГц, CDCl3): δ 2,82 (s, 3H), 8,55 (s, 1H).
e) Получение 3-бром-2-(4-хлор-3-трифторметилфенокси)-6-метил-5-нитропиридина:

В одногорлой круглодонной колбе объемом 50 мл 1,21 г 4-хлор-3-трифторметилфенола растворяют в 0,13 мл гексаметилдисилазана и перемешивают в атмосфере аргона при температуре окружающей среды в 3,0 мл сухого диоксана. К этой смеси осторожно добавляют 270 мг 55% суспензии гидрида натрия (выделение газа) и перемешивание продолжают в течение 30 мин. Затем шприцем по каплям добавляют раствор 1,55 г 3-бром-2-хлор-6-метил-5-нитропиридина в 4,0 мл сухого диоксана и перемешивание продолжают при температуре окружающей среды в течение 22 ч. Реакцию останавливают путем добавления избытка разбавленного водного раствора NaOH (pH водной фазы = 12) и смесь экстрагируют циклогексаном. Органическую фазу сушат над сульфатом натрия, фильтруют и концентрируют в вакууме и получают оранжевое масло. Очистка с помощью флэш-хроматографии с использованием картриджа с силикагелем (50 г, 150 мл) и смеси гептан/этилацетат 95:5 (об.:об.) в качестве элюента дает 480 мг соединения в виде влажного твердого вещества.
1Н ЯМР (400 МГц, CDCl3): δ 2,65 (s, 3Н), 7,07 (dd, 1H), 7,55 (d, 1H), 7,58 (d, 1H), 8,65 (s, 1H).
f) Получение 2-(4-хлор-3-трифторметилфенокси)-3-(4-фторфенил)-6-метил-5-нитропиридина:

В одногорлой круглодонной колбе объемом 50 мл, снабженной холодильником, 260 мг 3-бром-2-(4-хлор-3-трифторметилфенокси)-6-метил-5-нитропиридина и 97 мг п-фторфенилбороновой кислоты растворяют в 1,7 мл диоксана и перемешивают в атмосфере аргона при температуре окружающей среды (желтый раствор). Затем добавляют 228 мг K3PO4, растворенного в 0,85 мл H2O. Затем смесь дегазируют путем перемешивания в атмосфере аргона в течение 15 мин. Затем добавляют 4,3 мг трициклогексилфосфина и 3,6 мг бис(бензилиденацетон)палладия. Затем раствор энергично перемешивают при 100°С в течение 6,5 ч. Затем темно-коричневую суспензию охлаждают до температуры окружающей среды, затем добавляют 10 мл насыщенного водного раствора NH4Cl. Эту смесь экстрагируют с помощью AcOEt. Органическую фазу сушат над Na2SO4, фильтруют и концентрируют в вакууме и получают 340 мг темно-коричневого масла. После очистки остатка с помощью флэш-хроматографии [картридж с силикагелем (20 г, 60 мл) и смесь гептан/этилацетат 95:5 (об.:об.), затем 9:1 (об./об.)] получают 120 мг соединения в виде желтого масла.
ТСХ (тонкослойная хроматография): Пластины: Merck DC-Plates, силикагель F254, насыщенная атмосфера в камере для проявления, УФ-детектирование, элюент: гептан/этилацетат 2:1 (об.:об.); Rf соединения = 0,50.
g) Получение 6-(4-хлор-3-трифторметилфенокси)-5-(4-фторфенил)-2-метилпиридин-3-иламина:

В одногорлой круглодонной колбе объемом 50 мл, снабженной холодильником, 120 мг исходного вещества перемешивают в 0,50 мл метанола (светло-желтая суспензия). При охлаждении льдом шприцем по каплям добавляют 0,50 мл водного раствора концентрированной HCl (выпадение дополнительного количества осадка). Баню со льдом удаляют и медленно добавляют 270 мг безводного SnCl2 (светло-желтая суспензия). Перемешивание продолжают при кипячении с обратным холодильником в течение 6,5 ч (светло-желтый раствор). Затем полученную смесь концентрируют в вакууме и получают влажное бежевое твердое вещество. После добавления AcOEt добавляют 5 мл 4 М водного раствора NaOH. После экстракции органическую фазу сушат над Na2SO4, фильтруют (фильтр из пористого стекла) и растворитель удаляют в вакууме и получают 110 мг неочищенного соединения (светло-желто-коричневое масло). Очистку остатка проводят с помощью флэш-хроматографии (картридж с силикагелем (20 г, 60 мл) и смесь гептан/этилацетат 2:1 (об.:об.)) и получают 60 мг соединения в виде желтого масла. ОФ ВЭЖХ (высокоэффективная жидкостная хроматография с обращенной фазой): Время удерживания соединения: 2,10 мин
h) Получение N'-[6-(4-хлор-3-трифторметилфенокси)-5-(4-фторфенил)-2-метилпиридин-3-ил]-N-этил-N-метилформамидина:

В одногорлой круглодонной колбе объемом 25 мл при температуре окружающей среды 30 мг этилметилформамида растворяют в 0,5 мл сухого дихлорметана (бесцветный раствор). Шприцем при перемешивании по каплям добавляют 50 мг оксихлорида фосфора. Перемешивание при температуре окружающей среды продолжают в течение 1,5 ч, в результате чего образуется розово-оранжевый раствор. Затем шприцем по каплям добавляют 60 мг исходного вещества, растворенного в 1 мл сухого дихлорметана, и получают желтый раствор. Перемешивание продолжают при температуре окружающей среды в течение 2 ч. Затем смесь выливают в смесь лед/вода (рН водной фазы = 2). Затем для создания рН, равного примерно 11, добавляют 2 М водный раствор NaOH и перемешивание продолжают в течение 5 мин. Затем смесь экстрагируют двумя порциями диэтилового эфира по 10 мл. Затем объединенные органические фазы сушат над сульфатом натрия, фильтруют и растворитель удаляют в вакууме и получают 80 мг неочищенного соединения в виде желтого масла. ОФ ВЭЖХ: Время удерживания соединения: 1,55 мин.
Пример Р2: Получение N'-[5-бром-6-(4-хлор-3-трифторметилфенокси)-2-метилпиридин-3-ил]-N-этил-N-метилформамидина:
а) Получение 5-бром-6-(4-хлор-3-трифторметилфенокси)-2-метилпиридин-3-иламина:

В одногорлой круглодонной колбе объемом 50 мл, снабженной холодильником, 140 мг неочищенного 3-бром-2-(4-хлор-3-трифторметилфенокси)-6-метил-5-нитропиридина перемешивают в 0,50 мл метанола (желтая суспензия). При охлаждении в бане из воды со льдом шприцем по каплям добавляют 0,50 мл концентрированного водного раствора HCl (выпадение осадка). Баню со льдом удаляют и порциями добавляют 322 мг безводного SnCl2. Перемешивание при кипячении с обратным холодильником продолжают в течение 4,5 ч (желтый раствор). После охлаждения смеси до температуры окружающей среды ее концентрируют в вакууме и получают желтое масло. После добавления AcOEt добавляют 5 мл 4 М водного раствора NaOH (рН 12). После экстракции фазу, содержащую AcOEt, сушат над Na2SO4, фильтруют и растворитель удаляют в вакууме и получают 150 мг желтого масла. Очистку остатка проводят с помощью флэш-хроматографии [картридж с силикагелем (20 г, 60 мл) и смесь гептан/этилацетат 2:1 (об.:об.)] и получают 80 мг соединения в виде светло-желтого твердого вещества. ОФ ВЭЖХ: Время удерживания соединения: 2,04 мин.
b) Получение N'-[5-бром-6-(4-хлор-3-трифторметилфенокси)-2-метилпиридин-3-ил]-N-этил-N-метилформамидина:

В одногорлой круглодонной колбе объемом 25 мл 36,5 мг этилметилформамида при температуре окружающей среды растворяют в 0,5 мл сухого дихлорметана (бесцветный раствор). Шприцем при перемешивании по каплям добавляют 0,038 мл оксихлорида фосфора. Перемешивание при температуре окружающей среды продолжают в течение 1,75 ч, в результате чего образуется розово-оранжевый раствор. К этому раствору шприцем по каплям добавляют 80 мг 5-бром-6-(4-хлор-3-трифторметилфенокси)-2-метилпиридин-3-иламина, растворенного в 1,0 мл сухого дихлорметана, и получают желтый раствор. Перемешивание продолжают при температуре окружающей среды в течение 45 мин. Затем смесь выливают в смесь лед/вода (рН водной фазы = 2). Затем для создания рН, равного примерно 11, добавляют 2 М водный раствор NaOH и перемешивание продолжают в течение 10 мин. Затем смесь экстрагируют двумя порциями диэтилового эфира по 10 мл. Затем объединенные органические фазы сушат над сульфатом натрия, фильтруют и растворитель удаляют в вакууме и получают 80 мг неочищенного соединения в виде желтого масла. (смесь Е- и Z-изомеров).
1Н ЯМР (400 МГц, CDCl3): δ 1,15-1,35 (широкий, 3Н), 2,34 (s, 3Н), 3,03 (s, 3Н), 3,25-3,60 (широкий, 2Н), 7,16 и 7,19 (dd, 1H), 7,35 (s, 1H), 7,42 (m, 1H), 7,45 (m, 1H), 7,30-7,55 (широкий, 1Н).
ТСХ: Пластины: Merck DC-Plates, силикагель F254, насыщенная атмосфера в камере для проявления, УФ-детектирование, элюент: гептан/этилацетат 2:1 (об.:об.); Rf соединения = 0,27.
Пример Р3: Получение N'-[6-(4-хлор-3-трифторметилфенокси)-2-метил-5-триметилсиланилэтинилпиридин-3-ил]-N-этил-N-метилформамидина:
a) Получение 2-(4-хлор-3-трифторметилфенокси)-6-метил-5-нитро-3-триметилсиланилэтинилпиридина:
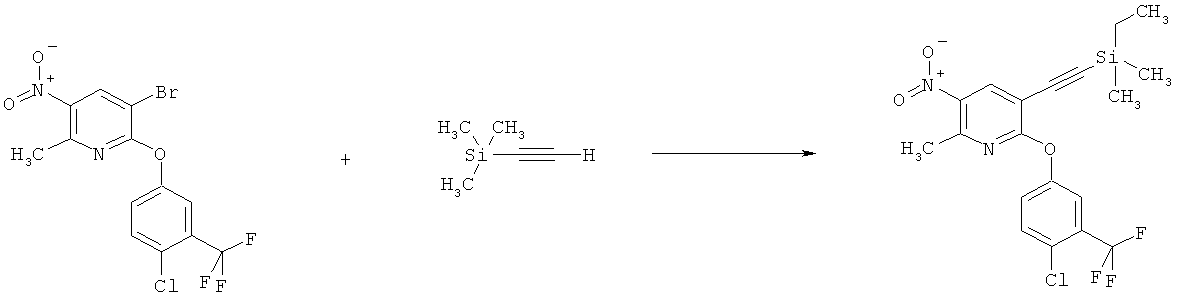
В одногорлой круглодонной колбе объемом 50 мл, снабженной холодильником, 220 мг 3-бром-2-(4-хлор-3-трифторметилфенокси)-6-метил-5-нитропиридина растворяют в 4,0 мл диизопропиламина и раствор перемешивают в атмосфере аргона при температуре окружающей среды. Через 20 мин добавляют 15 мг йодида меди и 56 мг бис(трифенилфосфин)палладийдихлорида. Затем по каплям добавляют 0,081 мл этинилтриметилсилана. Полученный таким образом красный раствор перемешивают при 70°С в течение 5 ч. После охлаждения смеси до температуры окружающей среды ее концентрируют в вакууме и получают 490 мг коричневого твердого вещества. Очистку этого неочищенного продукта проводят с помощью флэш-хроматографии с использованием картриджа с силикагелем (20 г; 60 мл) и смеси гептан/этилацетат 98:2 (об.:об.) и получают 40 мг соединения в виде коричневого масла.
ТСХ: Пластины: Merck DC-Platten, силикагель F254, насыщенная атмосфера в камере для проявления, УФ-детектирование, элюент: гептан/этилацетат 2:1 (об.:об.); Rf соединения = 0,63.
b) Получение 6-(4-хлор-3-трифторметилфенокси)-5-этинил-2-метилпиридин-3-иламина:

В одногорлой круглодонной колбе объемом 50 мл, снабженной холодильником, 35 мг 2-(4-хлор-3-трифторметилфенокси)-6-метил-5-нитро-3-триметилсиланилэтинилпиридина перемешивают в 0,50 мл метанола. При охлаждении в бане из воды со льдом шприцем по каплям добавляют 0,50 мл концентрированного водного раствора HCl (наблюдается выпадение небольшого количества осадка). Баню со льдом удаляют и порциями добавляют 77 мг безводного SnCl2. Перемешивание при кипячении с обратным холодильником продолжают в течение 2 ч. После охлаждения смеси до температуры окружающей среды ее концентрируют в вакууме и получают коричневое твердое вещество. После добавления AcOEt добавляют 5 мл 4 М водного раствора NaOH (рН 12). После экстракции фазу, содержащую AcOEt, сушат над Na2SO4, фильтруют и растворитель удаляют в вакууме и получают 30 мг коричневого масла. Очистку остатка проводят с помощью флэш-хроматографии [картридж с силикагелем (5 г, 20 мл) и смесь гептан/этилацетат 3:1 (об.:об.)] и получают 7 мг фракции 1, 6-(4-хлор-3-трифторметилфенокси)-2-метил-5-триметилсиланилэтинилпиридин-3-иламин), и 15 мг фракции 2, искомое соединение в виде коричневого твердого вещества. ОФ ВЭЖХ: Время удерживания соединения: 1,87 мин.
с) Получение N'-[6-(4-хлор-3-трифторметилфенокси)-2-метил-5-триметилсиланилэтинилпиридин-3-ил]-N-этил-N-метилформамидина:

В одногорлой круглодонной колбе объемом 10 мл 3,1 мг этилметилформамида при температуре окружающей среды растворяют в 0,25 мл сухого дихлорметана (бесцветный раствор). Шприцем при перемешивании по каплям добавляют 0,0032 мл оксихлорида фосфора. Перемешивание при температуре окружающей среды продолжают в течение 1,0 ч, в результате чего образуется розово-оранжевый раствор. К этому раствору шприцем по каплям добавляют 7,0 мг 6-(4-хлор-3-трифторметилфенокси)-2-метил-5-триметилсиланилэтинилпиридин-3-иламина, растворенного в 0,75 мл сухого дихлорметана, и получают желтый раствор. Перемешивание продолжают при комнатной температуре в течение 2,5 ч. Затем смесь выливают в смесь лед/вода (рН водной фазы = 2). Затем для создания рН, равного примерно 11, добавляют 2 М водный раствор NaOH и перемешивание продолжают в течение 15 мин. Затем смесь экстрагируют двумя порциями диэтилового эфира по 10 мл. Затем объединенные органические фазы сушат над сульфатом натрия, фильтруют и растворитель удаляют в вакууме и получают 6,0 мг соединения в виде желтого масла. ОФ ВЭЖХ: Время удерживания соединения: 1,61 мин.
Пример Р4: Получение N'-[5-бром-2-метил-6-(4-метилпентилокси)пиридин-3-ил]-N-этил-N-метилформамидина:
а) Получение 3-бром-6-метил-2-(4-метилпентилокси)-5-нитропиридина:

В одногорлой круглодонной колбе объемом 50 мл 1,00 г 3-бром-6-метил-5-нитропиридин-2-ола растворяют в 4,50 мл сухого диоксана и перемешивают в атмосфере аргона при температуре окружающей среды (желто-оранжевая суспензия). Добавляют 0,593 мл 4-метил-1-пентанола и 2,354 г трифенилфосфина. Затем шприцем в течение 10 мин по каплям добавляют 0,801 мл диэтилазодикарбоксилата (ДЭАД), во время добавления наблюдается умеренное выделение тепла. Перемешивание продолжают при температуре окружающей среды в течение 4,5 ч. Затем реакцию останавливают путем добавления 10 мл воды (рН=5-6), затем смесь экстрагируют пентаном (3×20 мл). Объединенные органические фазы сушат над сульфатом натрия, фильтруют и растворитель удаляют в вакууме и получают 1,87 г соединения в виде желто-оранжевого масла.
ТСХ: Пластины: Merck DC-Platten, силикагель F254, насыщенная атмосфера в камере для проявления, УФ-детектирование, элюент: гептан/этилацетат 1:1 (об.:об.); Rf соединения = 0,72.
b) Получение 5-бром-2-метил-6-(4-метилпентилокси)пиридин-3-иламина:

В одногорлой круглодонной колбе объемом 50 мл, снабженной холодильником, 1,36 г неочищенного 3-бром-6-метил-2-(4-метилпентилокси)-5-нитропиридина растворяют в 3,15 мл метанола и полученный раствор перемешивают. При охлаждении в бане из воды со льдом шприцем по каплям добавляют 3,15 мл концентрированного водного раствора HCl (наблюдается выпадение осадка). Баню со льдом удаляют и порциями добавляют 2,23 г безводного SnCl2. Перемешивание при кипячении с обратным холодильником продолжают в течение 5,5 ч (желтая суспензия). После охлаждения этой смеси до температуры окружающей среды ее концентрируют в вакууме и получают желтое твердое вещество. После добавления дихлорметана добавляют 10 мл 4 М водного раствора NaOH (pH 12). После экстракции органическую фазу сушат над Na2SO4, фильтруют и растворитель удаляют в вакууме и получают 1,62 г желтого масла. Очистку остатка проводят с помощью флэш-хроматографии [картридж с силикагелем (50 г, 150 мл) и смесь гептан/этилацетат 4:1 (об.:об.)] и получают 490 мг соединения в виде желтого масла. ОФ ВЭЖХ: Время удерживания соединения: 2,12 мин.
c) Получение N'-[5-бром-2-метил-6-(4-метилпентилокси)пиридин-3-ил]-N-этил-N-метилформамидина:

В одногорлой круглодонной колбе объемом 50 мл 182 мг этилметилформамида растворяют в 3,0 мл сухого дихлорметана (бесцветный раствор). Шприцем при перемешивании при температуре окружающей среды по каплям добавляют 0,191 мл оксихлорида фосфора. Перемешивание при температуре окружающей среды продолжают в течение 1,75 ч, в результате чего образуется розово-оранжевый раствор. Затем шприцем по каплям добавляют 300 мг 5-бром-2-метил-6-(4-метилпентилокси)пиридин-3-иламина, растворенного в 1,50 мл сухого дихлорметана, раствор становится желтым. Перемешивание продолжают при температуре окружающей среды в течение 5 ч. Затем раствор выливают в смесь лед/вода (рН водной фазы = 2). Для создания рН, равного примерно 11, добавляют 2 М водный раствор NaOH и смесь перемешивают в течение 10 мин. Затем смесь экстрагируют двумя порциями диэтилового эфира по 10 мл. Объединенные эфирные фазы сушат над сульфатом натрия, фильтруют и растворитель удаляют в вакууме и получают 380 мг соединения в виде желтого масла.
1Н ЯМР (400 МГц, CDCl3): δ 0,91 (d, 6Н), 1,15-1,40 (m, m, 5H), 1,61 (m, 1H), 1,78 (m, 2H), 2,38 (s, 3H), 3,04 (широкий, 3Н), 3,25-3,60 (широкий, 2Н), 4,30 (t, 2Н), 7,28 (s, 1H), 7,30-7-50 (широкий, 1H).
ТСХ: Пластины: Merck DC-Plates, силикагель F254, насыщенная атмосфера в камере для проявления, УФ-детектирование, элюент: гептан/этилацетат 1:1 (об.:об.); Rf соединения = 0,48.
Пример Р5: Получение N'-[5-(4-хлорфенил)-2-метил-6-(4-метилпентилокси)пиридин-3-ил]-N-этил-N-метилформамидина:

В одногорлой круглодонной колбе объемом 10 мл, снабженной холодильником (прибор высушен пламенем), 160 мг неочищенного N'-[5-бром-2-метил-6-(4-метилпентилокси)пиридин-3-ил]-N-этил-N-метилформамидина и 167,5 мг п-хлорфенилбороновой кислоты растворяют в 1,20 мл диоксана. К этому раствору в атмосфере аргона при температуре окружающей среды добавляют 162 мг K3PO4 в 0,60 мл воды. Полученную двухфазную смесь дегазируют в атмосфере аргона в течение 20 мин, затем добавляют 3,0 мг трициклогексилфосфина и 2,6 мг бис(бензилиденацетон)палладия. Полученную суспензию энергично перемешивают при температуре 100°С в течение 5 ч. Смеси дают нагреться до температуры окружающей среды, затем добавляют 5,0 мл насыщенного водного раствора NH4Cl. Водную фазу экстрагируют с помощью AcOEt. Органическую фазу сушат над сульфатом натрия, фильтруют и растворитель удаляют в вакууме и получают 220 мг желтого масла. Очистка остатка с помощью флэш-хроматографии с использованием картриджа с силикагелем (20 г; 60 мл) и смеси гептан/этилацетат 9:1, затем 4:1, затем 3:2 (об.:об.) дает 80 мг соединения в виде желтого масла.
1Н ЯМР (400 МГц, CDCl3): δ 0,88 (d, 6Н); 1,20 (t, 3H), 1,23 (m, 2H), 1,58 (m, 1H), 1,72 (m, 2H), 2,44 (s, 3H), 3,02 (s, 3H), 3,15-3,60 (широкий, 2H), 4,29 (t, 2H), 7,06 (s, 1H), 7,34 (d, 2H), 7,42 (широкий, 1H), 7,52 (d, 2H).
Пример Р6: Получение N-этил-N-метил-N'-[2-метил-6-(4-метилпентилокси)пиридин-3-ил]-формамидина:

В одногорлой круглодонной колбе объемом 50 мл (высушенная пламенем) 150 мг N'-[5-бром-2-метил-6-(4-метилпентилокси)пиридин-3-ил]-N-этил-N-метилформамидина растворяют в 1,0 мл абсолютного ТГФ и перемешивают в атмосфере аргона. Раствор охлаждают до -82°С (охлаждающая баня со смесью твердый диоксид углерода/ацетон). Шприцем при перемешивании по каплям добавляют 0,263 мл 1,6 М раствора н-бутиллития в гексане. Перемешивание продолжают при -82°С в течение 45 мин. Затем шприцем по каплям добавляют 0,091 мл триметилхлорсилана и перемешивание продолжают при -82°С в течение 3 ч. После этого реакционной смеси дают нагреться до температуры окружающей среды. Затем реакцию останавливают путем добавления 0,020 мл АсОН, затем 5,0 мл воды. Водную фазу экстрагируют диэтиловым эфиром и полученную органическую фазу сушат над сульфатом натрия, фильтруют и растворитель удаляют в вакууме и получают 30 мг желтого масла. Затем значение рН водной фазы доводят до 7 путем добавления 10 мл насыщенного водного раствора NaHCO3. Затем смесь экстрагируют диэтиловым эфиром, органическую фазу сушат, фильтруют и концентрируют в вакууме и получают 90 мг желтого масла. Две маслообразные фракции объединяют и очищают с помощью флэш-хроматографии [картридж с силикагелем (20 г, 60 мл) и смесь гептан/этилацетат 95:5, затем 9:1, затем 4:1 (об.:об.)] и получают 30 мг соединения в виде желтого масла.
1Н ЯМР (400 МГц, CDCl3): δ 0,90 (d, 6H), 1,20 (t, 3H), 1,33 (m, 2H), 1,60 (m, 1H); 1,76 (m, 2H), 2,41 (s, 3H), 2,99 (s, 3H), 3,20-3,50 (широкий, 1Н), 3,35 (широкий, 1H), 4,18 (t, 2H), 6,46 (d, 1H), 7,01 (d, 1H), 7,38 (широкий, 1H).
ОФ ВЭЖХ: Время удерживания соединения: 1,26 мин.
Пример Р7: Получение N'-[6-(4-хлор-3-трифторметилфенокси)-5-метилпиридин-3-ил]-N-этил-N-метилформамидина:
а) Получение 2-хлор-3-метил-5-нитропиридина:

В трехгорлую круглодонную колбу объемом 350 мл, снабженную магнитной мешалкой, термометром, капельной воронкой и обратным холодильником, помещают 3-метил-5-нитропиридин-2-ол (23,1 г) и 1,2-дихлорэтан (150 мл). По каплям добавляют оксихлорид фосфора (17 мл). К этой смеси при комнатной температуре по каплям добавляют ДМФ (диметилформамид) (11,5 мл). Реакционную смесь при перемешивании нагревают при 70°С в течение 0,5 ч. После охлаждения смеси до температуры окружающей среды ее концентрируют в вакууме при 50°С и получают коричневое маслянистое смолообразное вещество. Очистка этого смолообразного вещества с помощью флэш-хроматографии на силикагеле при использовании смеси гексан/этилацетат 7:3 (об.:об.) дает 23,34 г соединения в виде светло-желтого твердого вещества (Т.пл.: 40-42°С).
1Н ЯМР (400 МГц, CDCl3): δ 2,55 (s, 3H, СН3), 8,35 (d, 1H), 9,11 (d, 1H).
b) Получение 2-(4-хлор-3-трифторметилфенокси)-3-метил-5-нитропиридина:

В двугорлую круглодонную колбу объемом 250 мл, снабженную магнитной мешалкой, термометром и обратным холодильником, помещают ДМФ (50 мл), 4-хлор-3-трифторметилфенол (4,6 г), 2-хлор-3-метил-5-нитропиридин (4,0 г) и карбонат калия (6,4 г). Реакционную смесь нагревают при 100°С в течение 2,5 ч. После охлаждения смеси до комнатной температуры ее выливают в воду (200 мл). Затем смесь экстрагируют этилацетатом (2×40 мл). Объединенные органические слои сушат над сульфатом натрия, фильтруют и растворитель удаляют в вакууме и получают 6,10 г соединения в виде желтого твердого вещества (Т.пл.: 95-97°С).
1Н ЯМР (400 МГц, CDCl3): δ 2,50 (s, 3H, СН3), 7,30 (d×d, 1H), 7,49 (d, 1H), 7,55 (d, 1H), 8,35 (d, 1H), 8,80 (d, 1H).
c) Получение 6-(4-хлор-3-трифторметилфенокси)-5-метилпиридин-3-иламина:

В двугорлую круглодонную колбу объемом 250 мл, снабженную мешалкой KPG, термометром и обратным холодильником, помещают этанол (100 мл), воду (10 мл), железо (3,11 г) и 37% раствор хлористоводородной кислоты (0,3 мл). Реакционную смесь нагревают при 50°С. Порциями добавляют 2-(4-хлор-3-трифторметилфенокси)-3-метил-5-нитропиридин (5,81 г). Смесь кипятят с обратным холодильником в течение 2 ч. После охлаждения смеси до 50°С ее фильтруют через целит. Фильтрат выливают в воду (200 мл) и экстрагируют этилацетатом (2×50 мл). Объединенные органические слои промывают рассолом (100 мл), сушат над сульфатом натрия, фильтруют и растворитель удаляют в вакууме и получают 4,20 г соединения в виде желтого твердого вещества (Т.пл.: 92-94°С).
1Н ЯМР (400 МГц, CDCl3): δ 2,25 (s, 3Н, СН3), 3,55 (sbr, 2H, NH2), 6,98 (d, 1H), 7,14 (d×d, 1H), 7,38 (d, 1H), 7,45 (d, 1H), 7,52 (d, 1H).
d) Получение N'-[6-(4-хлор-3-трифторметилфенокси)-5-метилпиридин-3-ил]-N-этил-N-метилформамидина:
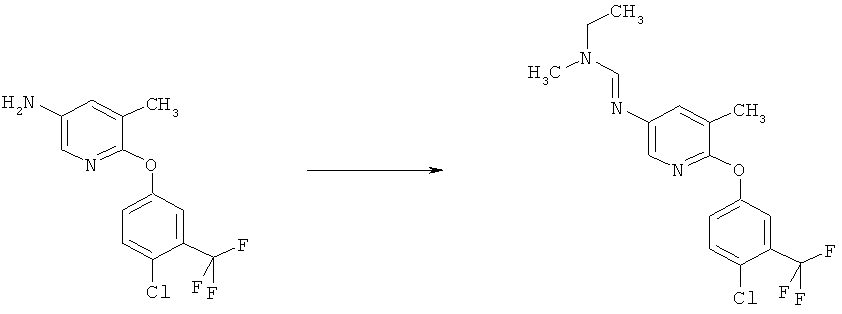
В одногорлой круглодонной колбе объемом 25 мл этилметилформамида (350 мг) при температуре окружающей среды растворяют в сухом дихлорметане (4 мл) (бесцветный раствор). Шприцем при перемешивании по каплям добавляют оксихлорид фосфора (0,4 мл). Перемешивание при температуре окружающей среды продолжают в течение 1 ч, в результате чего образуется розово-оранжевый раствор. К этому раствору шприцем по каплям добавляют 6-(4-хлор-3-трифторметилфенокси)-5-метилпиридин-3-иламин (0,6 г), растворенный в 1,0 мл сухого дихлорметана, и получают желтый раствор. Перемешивание продолжают при температуре окружающей среды в течение 1 ч. Затем смесь выливают в смесь лед/вода (рН водной фазы = 2). Затем для создания рН, равного примерно 11, добавляют 2 М водный раствор NaOH и перемешивание продолжают в течение 10 мин. Затем смесь экстрагируют дихлорметаном (2×50 мл). Затем объединенные органические фазы сушат над сульфатом натрия, фильтруют и растворитель удаляют в вакууме. Очистка этого смолообразного вещества с помощью флэш-хроматографии на силикагеле с использованием смеси гексан/этилацетат 1:2 (об.:об.) дает 0,52 г соединения в виде желтого масла.
1Н ЯМР (400 МГц, CDCl3): δ 1,19-1,24 (t, 3, СН3), 2,28 (s, 3H, СН3), 3,00 (s, 3Н, СН3), 3,28-3,53 (m, 2Н, CH2), 7,15-7,26 (m, 2H), 7,40 (d, 1H), 7,46 (d, 1H), 7,55 (sbr, 1H), 7,65 (d, 1H).
Пример Р8: Получение N'-[6-(4-хлор-3-трифторметилфенокси)-5-метилпиридин-3-ил]-N-этил-N-пиридин-2-илформамидина:

В одногорлой круглодонной колбе объемом 25 мл N-метил-N-пиридин-2-илформамид (0,5 мл) при температуре окружающей среды растворяют в сухом дихлорметане (4 мл) (бесцветный раствор). Шприцем при перемешивании по каплям добавляют оксихлорид фосфора (0,4 мл). Перемешивание при температуре окружающей среды продолжают в течение 1 ч. К этому раствору шприцем по каплям добавляют 6-(4-хлор-3-трифторметилфенокси)-5-метилпиридин-3-иламин (0,6 г), растворенный в 1,0 мл сухого дихлорметана, и получают желтый раствор. Перемешивание продолжают при температуре окружающей среды в течение 1 ч. Затем смесь выливают в смесь лед/вода (рН водной фазы = 2). Затем для создания рН, равного примерно 11, добавляют 2 М водный раствор NaOH и перемешивание продолжают в течение 10 мин. Затем смесь экстрагируют дихлорметаном (2×50 мл). Затем объединенные органические фазы сушат над сульфатом натрия, фильтруют и растворитель удаляют в вакууме. Очистка этого смолообразного вещества с помощью флэш-хроматографии на силикагеле с использованием смеси гексан/этилацетат 1:1 (об.:об.) дает 0,33 г соединения в виде желтого масла.
1Н ЯМР (400 МГц, CDCl3): δ 2,34 (t, 3, СН3), 3,53 (s, 3H, СН3), 6,96 (d, 1H), 7,00 (d×d, 1H), 7,21 (d×d, 1H), 7,38 (d, 1H), 7,45-7,51 (m, 2H), 7,68-7,72 (m, 1H), 7,79 (d, 1H), 8,33 (d×d, 1H), 9,11 (s, 1H).
Пример Р9: Получение [6-(4-хлор-3-трифторметилфенокси)-5-метилпиридин-3-ил]-(1-пирролидин-1-метилиден)-амина:

В одногорлой круглодонной колбе объемом 25 мл пирролидин-1-карбальдегид (0,4 мл) при температуре окружающей среды растворяют в сухом дихлорметане (4 мл) (бесцветный раствор). Шприцем при перемешивании по каплям добавляют оксихлорид фосфора (0,4 мл). Перемешивание при температуре окружающей среды продолжают в течение 1 ч. К этому раствору шприцем по каплям добавляют 6-(4-хлор-3-трифторметилфенокси)-5-метилпиридин-3-иламин (0,6 г), растворенный в 1,0 мл сухого дихлорметана, и получают желтый раствор. Перемешивание продолжают при температуре окружающей среды в течение 1 ч. Затем смесь выливают в смесь лед/вода (рН водной фазы = 2). Затем для создания рН, равного примерно 11, добавляют 2 M водный раствор NaOH и перемешивание продолжают в течение 10 мин. Затем смесь экстрагируют дихлорметаном (2×50 мл). Затем объединенные органические фазы сушат над сульфатом натрия, фильтруют и растворитель удаляют в вакууме. Очистка этого смолообразного вещества (0,7 г) с помощью флэш-хроматографии на силикагеле с использованием этилацетата дает 0,59 г соединения в виде желтого масла.
1Н ЯМР (400 МГц, CDCl3): δ 1,95 (mbr, 4Н, 2×СН2), 2,28 (s, 3H, СН3), 3,50-3,55 (m, 4Н, 2×СН2), 7,17 (d×d, 1H), 7,23 (d, 1H), 7,39 (d, 1H), 7,55 (d, 1H), 7,64 (d, 1H), 7,75 (s, 1H).
Пример Р10: Получение N'-[6-(3-третбутилфенокси)-5-метилпиридин-3-ил]-N-этил-N-метилформамидина:
a) Получение 2-(3-третбутилфенокси)-3-метил-5-нитропиридина:

В двугорлую круглодонную колбу объемом 50 мл, снабженную магнитной мешалкой, термометром и обратным холодильником, помещают ДМФ (50 мл), 3-трет-бутилфенол (1,5 г), 2-хлор-3-метил-5-нитропиридин (1,73 г) и карбонат калия (2,76 г). Реакционную смесь нагревают при 60°С в течение 2 ч. После охлаждения смеси до комнатной температуры ее выливают в воду (200 мл). Затем смесь экстрагируют этилацетатом (2×40 мл). Объединенные органические слои сушат над сульфатом натрия, фильтруют и растворитель удаляют в вакууме. Очистка этого неочищенного вещества с помощью флэш-хроматографии на силикагеле с использованием смеси гексан/этилацетат 4:1 (об.:об.) дает 2,55 г соединения в виде желтого масла.
1Н ЯМР (400 МГц, CDCl3): δ 1,30 (s, 9H, 3×СН3), 2,48 (s, 3H, СН3), 6,95 (d×d, 1H), 7,18 (m, 1H), 7,30-7,41 (m, 2H), 8,30 (d, 1H), 8,85 (d, 1H).
b) Получение 6-(3-третбутилфенокси)-5-метилпиридин-3-иламина:

В двугорлую круглодонную колбу объемом 100 мл, снабженную мешалкой KPG, термометром и обратным холодильником, помещают этанол (50 мл), воду (5 мл), железо (1,43 г) и 37% раствор хлористоводородной кислоты (0,2 мл). Реакционную смесь нагревают при 50°С. Порциями добавляют 2-(3-третбутилфенокси)-3-метил-5-нитропиридин (2,26 г). Смесь кипятят с обратным холодильником в течение 3 ч. После охлаждения смеси до 50°С ее фильтруют через целит. Фильтрат выливают в воду (200 мл) и экстрагируют этилацетатом (2×50 мл). Объединенные органические слои промывают рассолом (100 мл), сушат над сульфатом натрия, фильтруют и растворитель удаляют в вакууме. Очистка с помощью флэш-хроматографии на силикагеле с использованием смеси гексан/этилацетат 1:1 (об.:об.) дает 1,10 г соединения в виде коричневатого твердого вещества (Т.пл.: 83-84°С).
1Н ЯМР (400 МГц, CDCl3): δ 1,32 (s, 9Н, 3×СН3), 2,25 (s, 3Н, СН3), 3,35 (sbr, 2Н, NH2), 6,75 (d×d, 1H), 6,80 (d, 1H), 7,07-7,15 (m, 2H), 7,23 (d, 1H), 7,55 (d, 1H).
с) Получение N'-[6-(3-третбутилфенокси)-5-метилпиридин-3-ил]-N-этил-N-метилформамидина:

В одногорлой круглодонной колбе объемом 25 мл этилметилформамида (350 мг) при температуре окружающей среды растворяют в сухом дихлорметане (4 мл) (бесцветный раствор). Шприцем при перемешивании по каплям добавляют оксихлорид фосфора (0,4 мл). Перемешивание при температуре окружающей среды продолжают в течение 0,5 ч, в результате чего образуется розово-оранжевый раствор. К этому раствору шприцем по каплям добавляют 6-(3-третбутилфенокси)-5-метилпиридин-3-иламин (0,51 г), растворенный в 5,0 мл сухого дихлорметана, и получают желтый раствор. Перемешивание продолжают при температуре окружающей среды в течение 2 ч. Затем смесь выливают в смесь лед/вода (рН водной фазы = 2). Затем для создания рН, равного примерно 11, добавляют 2 М водный раствор NaOH и перемешивание продолжают в течение 10 мин. Затем смесь экстрагируют дихлорметаном (2×50 мл). Затем объединенные органические фазы сушат над сульфатом натрия, фильтруют и растворитель удаляют в вакууме. Очистка этого смолообразного вещества с помощью флэш-хроматографии на силикагеле с использованием этилацетата дает 0,56 г соединения в виде коричневого масла.
1Н ЯМР (400 МГц, CDCl3): δ 1,19-1,24 (t, 3, СН3), 1,30 (s, 9H, 3×СН3), 2,28 (s, 3H, СН3), 3,00 (s, 3Н, СН3), 3,25-3,35 (mbr, 2Н, СН2), 6,80 (d×d, 1H), 7,08-7,12 (m, 2Н), 7,20-7,27 (m, 2Н), 7,53 (sbr, 1H), 7,67 (d, 1H).
Пример Р11: Получение N'-[6-(3,4-дихлорфенокси)-2,4-диизопропилпиридин-3-ил]-N,N-диметилформамидина:

В одногорлую круглодонную колбу объемом 25 мл, снабженную обратным холодильником, помещают диметилформамиддиметилацетат (1,6 г), ДМФ (10 мл) и 6-(3,4-дихлорфенокси)-2,4-диизопропилпиридин-3-иламин (1,70 г). Реакционную смесь кипятят с обратным холодильником и метанол отгоняют в течение 2,5 ч. Затем смесь концентрируют в вакууме при 50°С. Неочищенное вещество кристаллизуют из смеси гексан/толуолацетат 4:1 (об.:об.) и получают 1,41 г соединения в виде белого твердого вещества (Т.пл.: 102-103°С).
1Н ЯМР (400 МГц, CDCl3): δ 1,11-1,17 (2q, 12H, 4×СН3), 3,20 (s, 6H, 2×СН3), 3,08-3,20 (m, 2Н), 6,08 (s, 1H), 6,85 (d×d, 1H), 7,14 (s, 1H), 7,28 (d, 1H), 7,37 (d, 1H).
Пример Р12: Получение N'-[6-(2,4-дихлорфенокси)пиридин-3-ил]-N-этил-N-метилформамидина:

В одногорлой круглодонной колбе объемом 25 мл этилметилформамида (350 мг) при температуре окружающей растворяют в сухом дихлорметане (4 мл) среды (бесцветный раствор). Шприцем при перемешивании по каплям добавляют оксихлорид фосфора (0,4 мл). Перемешивание при температуре окружающей среды продолжают в течение 1 ч. К этому раствору шприцем по каплям добавляют 6-(2,4-дихлорфенокси)пиридин-3-иламин (0,5 г), растворенный в 1,0 мл сухого дихлорметана, и получают желтый раствор. Перемешивание продолжают при температуре окружающей среды в течение 1 ч. Затем смесь выливают в смесь лед/вода (рН водной фазы = 2). Затем для создания рН, равного примерно 11, добавляют 2 М водный раствор NaOH и перемешивание продолжают в течение 10 мин. Затем смесь экстрагируют дихлорметаном (2×50 мл). Затем объединенные органические фазы сушат над сульфатом натрия, фильтруют и растворитель удаляют в вакууме. Очистка с помощью флэш-хроматографии на силикагеле с использованием смеси гексан/этилацетат 3:4 (об.:об.) дает 0,31 г соединения в виде желтого масла.
1Н ЯМР (400 МГц, CDCl3): δ 1,18-1,23 (t, 3Н, СН3), 2,98 (s, 3H, СН3), 3,25-3,51 (mbr, 2Н, СН2), 6,84-6,89 (d, 1Н), 7,09 (d, 1H), 7,23 (d×d, 1H), 7,35 (d×d, 1H), 7,45 (d, 1H), 7,50 (sbr, 1H), 7,75 (d, 1H).
Пример Р13: Получение N'-[6-(4-хлор-3-трифторметилфенокси)-4-метилпиридин-3-ил]-N-этил-N-метилформамидина:
а) Получение 2-хлор-4-метил-5-нитропиридина:

В трехгорлую круглодонную колбу объемом 100 мл, снабженную магнитной мешалкой, термометром, капельной воронкой и обратным холодильником, помещают 4-метил-5-нитропиридин-2-ол (5,0 г), и 1,2-дихлорэтан (30 мл). По каплям добавляют оксихлорид фосфора (3,6 мл). К этой смеси при температуре окружающей среды по каплям добавляют ДМФ (2,5 мл). При перемешивании реакционную смесь нагревают при 70°С в течение 0,5 ч. После охлаждения смеси до температуры окружающей среды ее концентрируют в вакууме при 50°С и получают коричневое маслянистое смолообразное вещество. Очистка этого смолообразного вещества с помощью флэш-хроматографии на силикагеле с использованием смеси гексан/этилацетат 7:3 (об.:об.) дает 4,91 г соединения в виде светло-желтого твердого вещества (Т.пл.: 35-38°С).
1Н ЯМР (400 МГц, CDCl3): δ 2,68 (s, 3Н, СН3), 7,38 (d, 1H), 8,98 (d, 1H).
b) Получение 2-(4-хлор-3-трифторметилфенокси)-4-метил-5-нитропиридина:

В двугорлую круглодонную колбу объемом 250 мл, снабженную магнитной мешалкой, термометром и обратным холодильником, помещают ДМФ (30 мл), 4-хлор-3-трифторметилфенол (4,5 г), 2-хлор-4-метил-5-нитропиридин (4,0 г) и карбонат калия (6,4 г). Реакционную смесь перемешивают при температуре окружающей среды в течение 1 ч, выливают в воду (300 мл), подкисленную 5 М раствором HCl (15 мл), и затем экстрагируют этилацетатом (4×50 мл). Объединенные органические слои промывают рассолом (100 мл), сушат над сульфатом натрия, фильтруют и растворитель удаляют в вакууме. Очистка с помощью флэш-хроматографии на силикагеле с использованием смеси гексан/этилацетат 7:3 (об.:об.) дает 7,03 г соединения в виде красного твердого вещества (Т.пл.: 75-80°С).
1Н ЯМР (400 МГц, CDCl3): δ 2,70 (s, 3Н, СН3), 6,93 (s, 1H), 7,28 (d×d, 1H), 7,49 (d, 1H), 7,56 (d, 1H), 8,35 (s, 1H).
c) Получение 6-(4-хлор-3-трифторметилфенокси)-4-метилпиридин-3-иламина:

В двугорлую круглодонную колбу объемом 100 мл, снабженную мешалкой KPG, термометром и обратным холодильником, помещают этанол (50 мл), воду (5 мл), железо (1,29 г) и 37% раствор хлористоводородной кислоты (0,2 мл). Реакционную смесь нагревают при 50°С. Порциями добавляют 2-(4-хлор-3-трифторметилфенокси)-4-метил-5-нитропиридин (2,4 г). Смесь кипятят с обратным холодильником в течение 1 ч. После охлаждения смеси до 50°С ее фильтруют через целит. Фильтрат выливают в воду (100 мл) и экстрагируют этилацетатом (2×50 мл). Объединенные органические слои промывают рассолом (100 мл), сушат над сульфатом натрия, фильтруют и растворитель удаляют в вакууме. Очистка с помощью флэш-хроматографии на силикагеле с использованием смеси гексан/этилацетат 1:1 (об.:об.) дает 1,90 г соединения в виде коричневатого твердого вещества (Т.пл.: 105-107°С).
1H ЯМР (400 МГц, CDCl3): δ 2,23 (s, 3Н, СН3), 3,50 (sbr, 2Н, NH2), 6,75 (s, 1Н), 7,18 (d×d, 1H), 7,40 (d, 1H), 7,43 (d, 1H), 7,63 (d, 1H).
d) Получение N'-[6-(4-хлор-3-трифторметилфенокси)-4-метилпиридин-3-ил]-N-этил-N-метилформамидина:

В одногорлой круглодонной колбе объемом 25 мл этилметилформамида (349 мг) при температуре окружающей среды растворяют в сухом дихлорметане (4 мл) (бесцветный раствор). Шприцем при перемешивании по каплям добавляют оксихлорид фосфора (0,37 мл). Перемешивание при температуре окружающей среды продолжают в течение 1 ч, в результате чего образуется розово-оранжевый раствор. К этому раствору шприцем по каплям добавляют 6-(4-хлор-3-трифторметилфенокси)-4-метилпиридин-3-иламин (605 мг), растворенный в 1,0 мл сухого дихлорметана, и получают желтый раствор. Перемешивание продолжают при температуре окружающей среды в течение 1 ч. Затем смесь выливают в смесь лед/вода (рН водной фазы = 2). Затем для создания рН, равного примерно 11, добавляют 2 М водный раствор NaOH и перемешивание продолжают в течение 10 мин. Затем смесь экстрагируют дихлорметаном (2×50 мл). Затем объединенные органические фазы сушат над сульфатом натрия, фильтруют и растворитель удаляют в вакууме. Очистка этого смолообразного вещества с помощью флэш-хроматографии на силикагеле с использованием смеси гексан/этилацетат 1:1 (об.:об.) дает 0,67 г соединения в виде коричневатого масла.
1Н ЯМР (400 МГц, CDCl3): δ 1,19-1,24 (t, 3, СН3), 2,30 (s, 3H, СН3), 3,00 (s, 3Н, СН3), 3,28-3,53 (m, 2H, СН2), 6,78 (s, 1H), 7,19 (d×d, 1H), 7,39-7,45 (m, 3H), 7,54 (s, 1H).
Пример Р14: Получение N'-[6-(4-хлор-3-трифторметилфенокси)-4-метилпиридин-3-ил]-N-метил-N-(1-метилпроп-2-инил)-формамидина:
a) Получение N-метил-N-(1-метилпроп-2-инил)формамида:
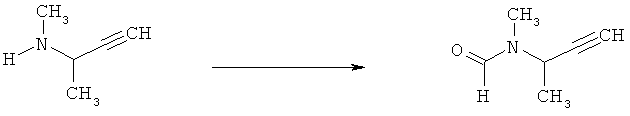
В трехгорлую круглодонную колбу объемом 350 мл, снабженную магнитной мешалкой, термометром, прибором Дина-Штарка для отделения воды и обратным холодильником, помещают метил-(1-метилпроп-2-инил)-амин (8,31 г) и толуол (100 мл). По каплям добавляют муравьиную кислоту (6,9 г). Реакционную смесь кипятят с обратным холодильником в течение 2 ч. После охлаждения смеси до температуры окружающей среды ее концентрируют в вакууме при 50°С и получают коричневую жидкость. Очистка с использованием силикагеля и смеси гексан/этилацетат 1:1 (об.:об.) дает 4,83 г соединения в виде коричневатой жидкости.
1Н ЯМР (400 МГц, CDCl3): δ 1,38+1,49 (2d, 3Н, СН3), 2,30+2,43 (2d, 1H, CH), 2,90+2,98 (2s, 3Н, СН3), 4,62+5,38 (2m, 1H, CH), 6,78 (s, 1H), 7,99+8,16 (2s, 1H).
b) Получение N'-[6-(4-хлор-3-трифторметилфенокси)-4-метилпиридин-3-ил]-N-метил-N-(1-метилпроп-2-инил)-формамидина:

В одногорлой круглодонной колбе объемом 25 мл N-метил-N-(1-метилпроп-2-инил)-формамид (223 мг) при температуре окружающей среды растворяют в сухом дихлорметане (4 мл) (бесцветный раствор). Шприцем при перемешивании по каплям добавляют смесь оксихлорида фосфора (0,18 мл) и дихлорметана (1 мл). Перемешивание при температуре окружающей среды продолжают в течение 1 ч. К этому раствору шприцем по каплям добавляют 6-(4-хлор-3-трифторметилфенокси)-4-метилпиридин-3-иламин (303 мг), растворенный в 10 мл сухого дихлорметана, и получают желтый раствор. Перемешивание продолжают при температуре окружающей среды в течение 3 ч. Затем смесь выливают в смесь лед/вода (рН водной фазы = 2). Затем для создания рН, равного примерно 11, добавляют 2 М водный раствор NaOH и перемешивание продолжают в течение 10 мин. Затем смесь экстрагируют дихлорметаном (2×50 мл). Затем объединенные органические фазы сушат над сульфатом натрия, фильтруют и растворитель удаляют в вакууме. Очистка этого смолообразного вещества с помощью флэш-хроматографии на силикагеле с использованием смеси гексан/этилацетат 3:2 (об.:об.) дает 198 мг соединения в виде коричневатого масла.
1Н ЯМР (400 МГц, CDCl3): δ 1,38+1,48 (2d, 3H, СН3), 2,20 (s, 3H, СН3), 2,30+2,40 (2d, 1Н, CH), 2,89+2,98 (2s, 3H, СН3), 4,43+5,38 (2m, 1H, CH), 6,72 (s, 1H), 7,15 (d×d, 1H), 7,38 (d, 1H), 7,42 (d, 1H), 7,62 (s, 1H), 7,98+8,15 (2s, 1H).
Методика ОФ ВЭЖХ
Прибор ВЭЖХ фирмы Agilent: квадратичный насос для ВЭЖХ HP1100, детектор с переменной длиной волны НР1100, термостатируемый блок колонки HP1100 и устройство дегазирования растворителя НР1100.
А = вода с 0,04% НСООН, В = ацетонитрил/метанол (4:1, об./об.) + 0,05% НСООН
Колонка: Phenomenex Gemini С18, размер частиц 3 мкм, 110 ангстрем, 30×3 мм,
температура: 60°С.
При использовании градиентного режима вводили следующие смеси:
Пример Р15: Получение 2-(4-метилпентилокси)-5-нитропиридина

В пятигорлой реакционной колбе объемом 350 мл (механическая мешалка, капельная воронка и термометр) 3-гидрокси-1Н-пиридин-2-он [СА регистрационный №626-06-2] (35,0 г) при температуре окружающей среды суспендируют в воде (120 мл). В течение 10 мин при перемешивании порциями добавляют гидроксид натрия (13,48 г), при этом наблюдается экзотермическая реакция. Затем для достижения температуры, равной 0°С, смесь помещают в охлаждающую баню (обычная соль/дробленый лед). Затем в течение 15 мин добавляют диметилсульфат (41,72 г) в то время как охлаждение и перемешивание продолжают. Затем охлаждающую баню удаляют и смесь перемешивают при комнатной температуре в течение ночи. Затем смесь экстрагируют этилацетатом. Органическую фазу сушат над сульфатом натрия, фильтруют и растворитель удаляют в вакууме и получают темно-коричневое вязкое вещество.
Это вещество переносят в 112 мл концентрированной серной кислоты и смесь помещают в пятигорлую реакционную колбу объемом 350 мл. После перемешивания и охлаждения в бане из воды со льдом в течение 1,5 ч по каплям добавляют свежеприготовленный раствор смеси кислот [свежеприготовленный из серной кислоты (31,7 мл) и дымящей азотной кислоты (31,8 мл)], поддерживая температуру ниже 15°С. Перемешивание продолжают при температуре ниже 10°С в течение еще 45 мин. Затем смесь осторожно переносят в лед и затем добавляют воду (всего получают 700 мл водной фазы). Образовавшийся осадок перемешивают в течение 40 мин, затем фильтруют и отфильтрованный осадок промывают водой и после высушивания получают 19,6 г оранжевого твердого вещества.
В пятигорлой реакционной колбе объемом 350 мл, снабженной холодильником, суспензию этого промежуточного продукта (5,00 г) в сухом диоксане (30,0 мл) перемешивают при комнатной температуре. Сначала добавляют 1-бром-4-метилпентан (5,82 г), затем оксид серебра (13,62 г). Полученную суспензию перемешивают при кипячении с обратным холодильником в течение 13,5 ч. После охлаждения до комнатной температуры добавляют этилацетат (50 мл) и смесь фильтруют через слой Hyflo и промывают этилацетатом (50 мл). Органическую фазу промывают водой и рассолом, затем сушат над сульфатом натрия, фильтруют и растворитель удаляют в вакууме и получают 4,00 г оранжевого масла. Этот неочищенный продукт очищают с помощью хроматографии на силикагеле (элюент: гексаны/этилацетат 9:1 (об.:об.)). Таким образом получают 1,49 г искомого соединения в виде желтого твердого вещества (Т.пл.: 48-49°С).
1Н ЯМР (400 МГц, CDCl3): δ 0,92 (d, 6H), 1,32 (m, 2H), 1,62 (m, 1H), 1,86 (m, 2H), 3,96 (s, 3Н), 4,48 (t, 2H), 7,76 (d, 1H), 7,68 (d, 1H).
ЖХ: УФ-детектирование: 220 нм; Rt=2,08 мин.
ТСХ: Пластины: Merck DC-Plates, силикагель F254, насыщенная атмосфера в камере для проявления, УФ-детектирование, элюент: гептан/этилацетат 1:1 (об.:об.); Rf искомого соединения = 0,63.
Пример Р16: Получение 2-бром-5-метокси-6-(4-метилпентилокси)пиридин-3-иламина:

В пятигорлой реакционной колбе объемом 50 мл, снабженной холодильником, 5-метокси-6-(4-метилпентилокси)пиридин-3-иламин (70 мг) растворяют в сухом ацетонитриле (0,50 мл) и перемешивают при комнатной температуре. При перемешивании добавляют N-бромсукцинимид (55 мг). Перемешивание при кипячении с обратным холодильником продолжают в течение 1,25 ч. Затем добавляют 2 М водный раствор гидроксида натрия (20 мл, рН 10) и смесь экстрагируют эфиром (3 раза по 20 мл). Органический слой промывают 10% водным раствором бисульфита натрия (20 мл). Послу сушки над сульфатом натрия органический слой фильтруют и растворитель удаляют в вакууме и получают 40 мг коричневого смолообразного вещества. После хроматографии на силикагеле (элюент: гексаны/этилацетат 2:1 (об.:об.) получают 6,3 мг искомого соединения в виде красного масла.
1Н ЯМР (400 МГц, CDCl3): δ 0,90 (d, 6H), 1,29 (m, 2H), 1,60 (m, 1H), 1,79 (m, 2H), 3,67 (s, 3H), 3,81 (s, 3H), 4,26 (t, 2H), 6,61 (s, 1H).
ЖХ: УФ-детектирование: 220 нм; Rt=1,94 мин.
ТСХ: Пластины: Merck DC-Plates, силикагель F254, насыщенная атмосфера в камере для проявления, УФ-детектирование, элюент: гептан/этилацетат 1:2 (об.:об.); Rf искомого соединения = 0,47.
Пример Р17: Получение 6-(4-метилпентилокси)-3-нитропиридин-2-иламина:

A) В трехгорлой круглодонной колбе объемом 100 мл, снабженной холодильником и термометром, гидрид натрия (2,51 г 55% суспензии в минеральном масле) суспендируют в сухом тетрагидрофуране (15 мл) и добавляют гексаметилдисилазан (0,60 мл) и смесь перемешивают в атмосфере аргона при комнатной температуре в течение 20 мин. Шприцем при перемешивании по каплям в течение 10 мин добавляют 4-метил-1-пентанол (7,23 мл), в результате чего образуется газ и наблюдается повышение температуры до 31°С. Перемешивание продолжают в течение еще 50 мин.
B) В пятигорлой реакционной колбе объемом 200 мл, снабженной механической мешалкой, капельной воронкой, холодильником и термометром, 6-хлор-3-нитропиридин-2-иламин (5,00 г, см. регистрационный №27048-04-0) в атмосфере аргона при комнатной температуре суспендируют в сухом тетрагидрофуране (15 мл). При перемешивании в течение 15 мин небольшими порциями добавляют суспензию, полученную так, как описано в пункте А). Для поддержания температуры ниже 30°С время от времени используют охлаждающую баню со смесью лед/вода. Для облегчения перемешивания повторно добавляют сухой тетрагидрофуран (20 мл). Перемешивание продолжают в течение 3,5 ч. Затем реакцию останавливают путем осторожного добавления избытка воды (50 мл). Затем смесь экстрагируют эфиром (2 раза по 60 мл). Органическую фазу промывают рассолом, сушат над сульфатом натрия и фильтруют. Затем растворитель удаляют в вакууме и получают 10,78 г желто-коричневого масла. Последующая хроматография на силикагеле (элюент: гексаны/этилацетат 97:3 (об.:об.)) дает 6,89 г искомого соединения в виде желтого твердого вещества (Т.пл.: 57-58°С).
1Н ЯМР (400 МГц, CDCl3): δ 0,91 (d, 6H), 1,28 (m, 2H), 1,60 (m, 1H), 1,75 (m, 2H), 4,28 (t, 2H), 4,90-8,20 (широкий, 2Н), 6,11 (d, 1H), 8,28 (d, 1H).
ЖХ: УФ-детектирование: 220 нм; Rt=1,97 мин.
ТСХ: Пластины: Merck DC-Plates, силикагель F254, насыщенная атмосфера в камере для проявления, УФ-детектирование, элюент: гептан/этилацетат 9:1 (об.:об.); Rf искомого соединения = 0,22.
Пример Р18: Получение 5-бром-6-(4-метилпентилокси)-3-нитропиридин-2-иламина:

В трехгорлой круглодонной колбе объемом 50 мл, снабженной холодильником, 6-(4-метилпентилокси)-3-нитропиридин-2-иламин (1,83 г) растворяют в сухом ацетонитриле (8,00 мл) и перемешивают в атмосфере аргона при комнатной температуре. При перемешивании добавляют N-бромсукцинимид (1,36 г). Перемешивание при кипячении с обратным холодильником продолжают в течение 3,5 ч. Затем добавляют воду (30 мл) и смесь экстрагируют эфиром (2 раза по 60 мл). Органический слой промывают 10% раствором бисульфита натрия (40 мл). Послу сушки над сульфатом натрия органический слой фильтруют и растворитель удаляют в вакууме и получают 2,41 г темно-красного масла. После хроматографии на силикагеле (элюент: гексаны/этилацетат 94:6 (об.:об.) получают 1,87 г искомого соединения в виде темно-красного масла.
1Н ЯМР (400 МГц, CDCl3): δ 0,92 (d, 6H), 1,33 (m, 2H), 1,62 (m, 1H), 1,81 (m, 2H), 4,34 (t, 2H), 4,70-8,40 (широкий, 2Н), 8,52 (s, 1H).
ЖХ: УФ-детектирование: 220 нм; Rt=2,16 мин.
ТСХ: Пластины: Merck DC-Plates, силикагель F254, насыщенная атмосфера в камере для проявления, УФ-детектирование, элюент: гептан/этилацетат 9:1 (об.:об.); Rf искомого соединения = 0,20.
Получение 5-хлор-6-(4-метилпентилокси)-3-нитропиридин-2-иламина:
Это соединение можно получить аналогичным образом из 6-(4-метилпентилокси)-3-нитропиридин-2-иламина с использованием N-хлорсукцинимида.
1Н ЯМР (400 МГц, CDCl3): δ 0,92 (d, 6H), 1,32 (m, 2H), 1,61 (m, 1H), 1,81 (m, 2H), 4,36 (t, 2H), 4,80-8,30 (широкий, 2H), 8,37 (s, 1H).
ЖХ: УФ-детектирование: 220 нм; Rt=2,13 мин.
ТСХ: Пластины: Merck DC-Plates, силикагель F254, насыщенная атмосфера в камере для проявления, УФ-детектирование, элюент: гептан/этилацетат 9:1 (об.:об.); Rf искомого соединения = 0,18.
Т.пл.: 53-54°С.
Пример Р19: Получение 2,5-дибром-6-(4-метилпентилокси)-3-нитропиридина:

А) В одногорлой круглодонной колбе объемом 25 мл 1,41 мл 48% водного раствора бромистоводородной кислоты при перемешивании и охлаждении в бане из воды со льдом для поддержания температуры, равной примерной комнатной, по каплям добавляют к диметилсульфоксиду (7,40 мл).
В) В трехгорлой реакционной колбе объемом 50 мл, снабженной холодильником, 5-бром-6-(4-метилпентилокси)-3-нитропиридин-2-иламин (1,00 г) растворяют в диметилсульфоксиде (3,70 мл). При перемешивании добавляют нитрит калия (1,07 г) и бромид меди (I) (90 мг). При перемешивании температуру поддерживают равной от 35 до 38°С и в течение 5 мин по каплям добавляют раствор, полученный так, как описано в пункте А). Перемешивание продолжают в том же диапазоне температур в течение еще 18 ч, в результате чего получают темно-коричневую суспензию. После охлаждения до комнатной температуры суспензию переносят в насыщенный водный раствор карбоната натрия (70 мл, рН 8). Смесь экстрагируют эфиром (3 раза по 40 мл). Объединенные органические фазы сушат над сульфатом натрия и затем фильтруют через слой диоксида кремния (помещенный на поверхность дискового фильтра из пористого стекла). После промывания эфиром объединенный эфирные фазы концентрируют в вакууме и получают 790 мг искомого соединения в виде желтого масла.
1Н ЯМР (400 МГц, CDCl3): δ 0,93 (d, 6Н), 1,35 (m, 2H), 1,63 (m, 1H), 1,84 (m, 2H), 4,47 (t, 2H), 8,43 (s, 1H).
TCX: Пластины: Merck DC-Plates, силикагель F254, насыщенная атмосфера в камере для проявления, УФ-детектирование, элюент: гептан/этилацетат 9:1 (об.:об.); Rf искомого соединения = 0,56.
Пример Р20: Получение 3-бром-2-(4-метилпентилокси)-5-нитро-6-фенилпиридина:

В трехгорлой круглодонной колбе объемом 50 мл, снабженной холодильником, 2,5-дибром-6-(4-метилпентилокси)-3-нитропиридин (200 мг) в атмосфере аргона растворяют в смеси толуола (6,00 мл) и этанола (0,75 мл). При перемешивании добавляют карбонат калия (159 мг) в воде (0,95 мл), в результате чего получают двухфазную желтую смесь. Добавляют фенилбороновую кислоту (63,8 мг). Перемешивание при комнатной температуре продолжают в течение 15 мин, пропуская через смесь ток аргона. Затем добавляют тетракис(трифенилфосфин)палладий (18,1 мг) и раствор перемешивают при кипячении с обратным холодильником в течение 3,5 ч. Затем смесь перемешивают при комнатной температуре в течение ночи. Затем добавляют насыщенный водный раствор хлорида аммония (25 мл) и смесь экстрагируют эфиром (2 раза по 30 мл). Органическую фазу сушат над сульфатом натрия, фильтруют и растворитель удаляют в вакууме и получают 220 мг желтого масла. После очистки на силикагеле (элюент: гексаны/этилацетат, градиентный режим от 100:0 до 98:2) получают 140 мг желтого масла, содержащего смесь искомого соединения (43%) с двумя следующими побочными продуктами:
Эту смесь без обработки используют на следующей стадии восстановления для получения соответствующих анилинов.
Пример Р21: Получение 5-бром-6-(4-метилпентилокси)-2-фенилпиридин-3-иламина:
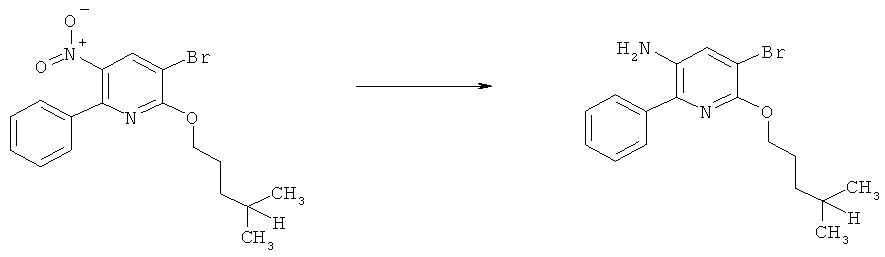
В трехгорлой реакционной колбе объемом 25 мл, снабженной холодильником, полученную выше смесь (140 мг) (смесь содержит 3-бром-2-(4-метилпентилокси)-5-нитро-6-фенилпиридин (43%), 6-(4-метилпентилокси)-3-нитро-2-фенилпиридин (35%) и 2-(4-метилпентилокси)-5-нитро-3,6-дифенилпиридин (21%)) растворяют в метаноле (0,50 мл). При перемешивании и охлаждении в бане из воды со льдом по каплям добавляют 37% водный раствор хлористоводородной кислоты (0,15 мл). После удаления охлаждающей бани добавляют порошкообразное олово (88 мг). Полученную суспензию перемешивают при кипячении с обратным холодильником в течение 3,25 ч. Затем смеси дают нагреться до комнатной температуры и метанол удаляют в вакууме. К полученному оранжевому смолообразному веществу добавляют 2 М водный раствор гидроксида натрия (10 мл). Смесь экстрагируют этилацетатом (2 раза по 20 мл). Органический слой сушат над сульфатом натрия, фильтруют и растворитель удаляют в вакууме и получают 130 мг желтого смолообразного вещества. Неочищенное вещество очищают с помощью хроматографии на силикагеле (элюент: гексаны/этилацетат 97:3 (об.:об.)). Получают 50 мг искомого соединения в виде желтого масла.
1Н ЯМР (400 МГц, CDCl3): δ 0,91 (d, 6H), 1,33 (m, 2H), 1,61 (m, 1H), 1,79 (m, 2H), 3,56 (s, 3H), 4,31 (t, 2H), 7,33 (s, 1H), 7,37 (tt, 1H), 7,46 (td, 2H), 7,71 (dt, 2H).
ЖХ: УФ-детектирование: 220 нм; Rt=2,30 мин.
ТСХ: Пластины: Merck DC-Plates, силикагель F254, насыщенная атмосфера в камере для проявления, УФ-детектирование, элюент: гептан/этилацетат 3:1 (об.:об.); Rf искомого соединения = 0,35.
Кроме того, также выделяют смесь двух следующих соединений в виде желтого масла (53 мг).
Эту смесь непосредственно используют на следующей стадии.
Пример Р22: Получение N-этил-N-метил-N'-[6-4-метилпентилокси]-2,5-дифенилпиридин-3-ил]-формамидина:

В реакционном сосуде Supelco объемом 8 мл (закрытый мембраной) этилметилформамид (13,7 мг) при температуре окружающей среды растворяют в сухом дихлорметане (3,00 мл) (бесцветный раствор). Шприцем при перемешивании по каплям добавляют оксихлорид фосфора (0,37 мл). Перемешивание при температуре окружающей среды продолжают в течение 1,5 ч, в результате чего получают светло-оранжевый раствор. К этому раствору шприцем по каплям добавляют 36,2 мг смеси двух полученных выше побочных продуктов [смесь состоит из 6-(4-метилпентилокси)-2,5-дифенилпиридин-3-иламина и 6-(4-метилпентилокси)-2-фенилпиридин-3-иламина] в виде раствора в сухом дихлорметане (2,00 мл) и получают светло-коричневый раствор. Перемешивание продолжают при температуре окружающей среды в течение 3,5 ч. Затем смесь выливают в смесь лед/вода. Затем для создания рН, равного примерно 12, добавляют 2 М водный раствор NaOH (10 мл) и перемешивание продолжают в течение 10 мин. Затем смесь экстрагируют дихлорметаном (2×20 мл). Затем объединенные органические фазы сушат над сульфатом натрия, фильтруют и растворитель удаляют в вакууме. Очистка желтого смолообразного вещества с помощью флэш-хроматографии на силикагеле с использованием смеси гексан/этилацетат 4:1 (об.:об.) дает 17,1 мг искомого соединения в виде желтого масла (66%).
1Н ЯМР (400 МГц, CDCl3): δ 0,90 (d, 6H), 1,15 (t, 3Н), 1,33 (m, 2H), 1,59 (m, 1H), 1,79 (m, 2H), 2,98 (s, 3Н), 3,10-3,70 (широкий, 2H), 4,41 (t, 2H), 7,33 (mm, 8H), 7,67 (dd, 2H), 8,18 (dd, 2H).
ЖХ: УФ-детектирование: 220 нм; Rt=1,61 мин.
ТСХ: Пластины: Merck DC-Plates, силикагель F254, насыщенная атмосфера в камере для проявления, УФ-детектирование, элюент: гептан/этилацетат 3:1 (об.:об.); Rf искомого соединения = 0,18.
Пример Р23: Получение 2-бром-5-хлор-6-(4-метилпентилокси)-3-нитропиридина:

A) В одногорлой круглодонной колбе объемом 25 мл 1,40 мл 48% водного раствора бромистоводородной кислоты при перемешивании и охлаждении в бане из воды со льдом для поддержания температуры равно примерной комнатной температуре по каплям добавляют к диметилсульфоксиду (7,30 мл).
B) В трехгорлой реакционной колбе объемом 50 мл, снабженной холодильником, 5-хлор-6-(4-метилпентилокси)-3-нитропиридин-2-иламин (850 мг) при комнатной температуре растворяют в диметилсульфоксиде (3,70 мл). При перемешивании добавляют нитрит калия (1,06 г) и бромид меди (I) (89 мг). При перемешивании температуру поддерживают равной от 35 до 38°С и в течение 6 мин по каплям добавляют раствор, полученный так, как описано в пункте А). Перемешивание продолжают в том же диапазоне температур в течение еще 20 ч, в результате чего получают темно-коричневый раствор. После охлаждения до комнатной температуры суспензию переносят в насыщенный водный раствор карбоната натрия (50 мл, рН 9). Смесь экстрагируют эфиром (3 раза по 50 мл). Объединенные органические фазы сушат над сульфатом натрия и затем фильтруют через слой диоксида кремния (помещенный на поверхность дискового фильтра из пористого стекла). После промывания эфиром объединенный эфирные фазы концентрируют в вакууме и получают 810 мг искомого соединения в виде желтого масла. После очистки с помощью хроматографии на силикагеле (элюент: гексаны/этилацетат 95:5 (об.:об.)) получают 870 мг искомого соединения в виде желтого масла.
1Н ЯМР (400 МГц, CDCl3): δ 0,93 (d, 6Н), 1,35 (m, 2H), 1,63 (m, 1H), 1,85 (m, 2H), 4,48 (t, 2H), 8,28 (s, 1H).
TCX: Пластины: Merck DC-Plates, силикагель F254, насыщенная атмосфера в камере для проявления, УФ-детектирование, элюент: гептан/этилацетат 9:1 (об.:об.); Rf искомого соединения = 0,55.
Пример Р24: Получение 5-метокси-6-(4-метилпентилокси)пиридин-3-иламина:

В трехгорлой реакционной колбе объемом 25 мл, снабженной холодильником, 3-метокси-2-(4-метилпентилокси)-5-нитропиридин растворяют в метаноле (2,00 мл). При перемешивании и охлаждении в бане из воды со льдом добавляют 37% водный раствор хлористоводородной кислоты (0,82 мл). После удаления охлаждающей бани добавляют порошкообразное олово (470 мг). Затем полученную суспензию перемешивают при кипячении с обратным холодильником в течение 3,5 ч. Затем смеси дают нагреться до комнатной температуры и метанол удаляют в вакууме. К полученному желтому смолообразному веществу добавляют 2 М водный раствор гидроксида натрия (25 мл). Смесь экстрагируют этилацетатом (2 раза по 30 мл). Органический слой сушат над сульфатом натрия, фильтруют и растворитель удаляют в вакууме и получают 350 мг коричневого масла. Неочищенное вещество очищают с помощью хроматографии на силикагеле (элюент: гексаны/этилацетат 2:1 (об.:об.)). Получают 170 мг искомого соединения (38,5%) в виде красного масла.
1Н ЯМР (400 МГц, CDCl3): δ 0,90 (d, 6Н), 1,30 (m, 2H), 1,59 (m, 1H), 1,81 (m, 2H), 3,36 (s, 2H), 3,82 (s, 3Н), 4,27 (t, 2H), 6,56 (d, 1H), 7,21 (d, 1H).
ЖХ: УФ-детектирование: 220 нм; Rt=1,47 мин.
ТСХ: Пластины: Merck DC-Plates, силикагель F254, насыщенная атмосфера в камере для проявления, УФ-детектирование, элюент: гептан/этилацетат 1:1 (об.:об.); Rf искомого соединения = 0,15.
Кроме того, также выделяют 70 мг смеси двух побочных продуктов в виде коричневого масла. Эту смесь разделяют с помощью повторной хроматографии на силикагеле (элюент: толуол/ацетон 97:3 (об.:об.)) и получают следующие соединения:
Пример Р25: Получение 2-(4-метилпентилокси)-5-нитро-3,6-бис-трифторметилпиридина:

В одногорлой круглодонной колбе объемом 10 мл, снабженной холодильником, 2,5-дибром-6-(4-метилпентилокси)-3-нитропиридин (150 мг) растворяют в сухом дихлорметане (1,00 мл). К полученному желтому раствору добавляют метил-2,2-дифтор-2-(фторсульфонил)-ацетат (377 мг), йодид меди (I) (90 мг) и гексаметилфосфорамид (ГМФА) (350 мг). Полученную суспензию перемешивают при кипячении с обратным холодильником в течение 6 ч. За протеканием реакции следят с помощью19F-ЯМР (CDCl3). Перемешивание продолжают при температуре окружающей среды в течение ночи. Затем добавляют насыщенный раствор хлорида аммония (30 мл) и смесь экстрагируют эфиром (2×20 мл). Затем объединенные органические фазы сушат над сульфатом натрия, фильтруют и растворитель удаляют в вакууме. Очистка полученного желтого масла (120 мг) с помощью флэш-хроматографии на силикагеле с использованием смеси гексан/этилацетат 98:2 (об.:об.) дает 100 мг искомого соединения в виде желтого масла.
1Н ЯМР (400 МГц, CDCl3): δ 0,92 (d, 6Н), 1,34 (m, 2H), 1,63 (m, 1H), 1,85 (m, 2H), 4,59 (t, 2H), 8,49 (s, 1H).
ТСХ: Пластины: Merck DC-Plates, силикагель F254, насыщенная атмосфера в камере для проявления, УФ-детектирование, элюент: гептан; Rf искомого соединения = 0,11.
Пример Р26: Получение 5-хлор-6-(4-метилпентилокси)-3-нитропиридин-2-карбонитрила:

В одногорлой круглодонной колбе объемом 10 мл, снабженной эффективным холодильником, 2-бром-5-хлор-6-(4-метилпентилокси)-3-нитропиридин (200 мг) растворяют в сухом ацетонитриле (3,00 мл). К полученному желтому раствору добавляют цианид меди (I) (109 мг). Полученную суспензию перемешивают при кипячении с обратным холодильником в течение 6 ч, в результате чего получают коричневый раствор. За протеканием реакции следят с помощью ГХ-МС (газовая хроматография-масс-спектрометрия). Смеси дают нагреться до температуры окружающей среды. Затем добавляют насыщенный раствор хлорида аммония (20 мл) с небольшим количеством льда и смесь экстрагируют эфиром (2×20 мл). Затем объединенные органические фазы сушат над сульфатом натрия, фильтруют и растворитель удаляют в вакууме и получают 150 мг искомого соединения в виде желтого масла (89%).
1Н ЯМР (400 МГц, CDCl3): δ 0,93 (d, 6Н), 1,36 (m, 2H), 1,63 (m, 1H), 1,87 (m, 2H), 4,54 (t, 2H), 8,53 (s, 1H).
TCX: Пластины: Merck DC-Plates, силикагель F254, насыщенная атмосфера в камере для проявления, УФ-детектирование, элюент: гептан/этилацетат 9:1 (об.:об.); Rf искомого соединения = 0,28.
Пример Р27: Получение 3-хлор-2-(4-метилпентилокси)-5-нитро-6-трифторметилпиридина:

В одногорлой круглодонной колбе объемом 10 мл, снабженной эффективным холодильником, 2-бром-5-хлор-6-(4-метилпентилокси)-3-нитропиридин (150 мг) растворяют в сухом диметилформамиде (1,20 мл). К полученному желтому раствору добавляют метил-2,2-дифтор-2-(фторсульфонил)-ацетат (256 мг), йодид меди (I) (102 мг) и гексаметилфосфорамид (ГМФА) (400 мг). Полученную суспензию перемешивают и нагревают при 100°С в течение 2 ч. За протеканием реакции следят с помощью ГХ-МС. Реакционной смеси дают нагреться до комнатной температуры. Затем добавляют насыщенный раствор хлорида аммония (30 мл, рН равно примерно 3) и смесь экстрагируют эфиром (2×30 мл). Затем объединенные органические фазы сушат над сульфатом натрия, фильтруют через слой силикагеля и растворитель удаляют в вакууме. Очистка полученного желтого масла (120 мг) с помощью флэш-хроматографии на силикагеле с использованием смеси гексан/этилацетат 98:2 (об.:об.) дает 120 мг искомого соединения в виде желтого масла (83%).
1Н ЯМР (400 МГц, CDCl3): δ 0,93 (d, 6H), 1,35 (m, 2H), 1,62 (m, 1H), 1,86 (m, 2H), 4,52 (t, 2H), 8,26 (s, 1H).
TCX: Пластины: Merck DC-Plates, силикагель F254, насыщенная атмосфера в камере для проявления, УФ-детектирование, элюент: гептан; Rf искомого соединения = 0,11.
Пример Р28: Получение 6-хлор-2-метокси-3-нитропиридина:

А) В трехгорлой круглодонной колбе объемом 10 мл, снабженной холодильником и термометром, гидрид натрия (2,26 г 0,55% дисперсии в минеральном масле) в атмосфере аргона суспендируют в сухом диоксане (10 мл). Затем добавляют гексаметилдисилазан (0,81 мл). Шприцем при перемешивании по каплям добавляют сухой метанол (2,10 мл) (пенообразование, выделение газа). Температуру поддерживают ниже 34°С в бане из воды со льдом. После добавления перемешивание продолжают при температуре окружающей среды в течение 50 мин. Для облегчения последующего переноса суспензии (в другую колбу) повторно добавляют диоксан (10 мл).
В) В пятигорлой реакционной колбе объемом 200 мл, снабженной холодильником, механической мешалкой, капельной воронкой и термометром, 2,6-дихлор-3-нитропиридин [СА регистрационный №136901-10-5] (10,0 г), растворенный в сухом диоксане (40 мл), перемешивают в атмосфере аргона. В течение 12 мин медленно добавляют свежеприготовленную суспензию, полученную так, как описано в пункте А) (повторное пено- и газообразование). Для поддержания температуры ниже 32°С используют охлаждающую баню со смесью лед/вода. Перемешивание при температуре окружающей продолжают в течение 2 ч. За протеканием реакции следят с помощью тонкослойной хроматографии (см. ниже). Затем добавляют воду (50 мл, рН равно примерно 8-9) и смесь экстрагируют эфиром (2×50 мл). Затем объединенные органические фазы сушат над сульфатом натрия, фильтруют и растворитель удаляют в вакууме и получают 10,45 г светло-желтого твердого вещества. Очистка полученного желтого масла (120 мг) с помощью флэш-хроматографии на силикагеле с использованием смеси гексан/этилацетат 97:3 (об.:об.) дает 8,00 г искомого соединения в виде светло-желтого твердого вещества (Т.пл.: 73-74°С, выход: 82%).
1Н ЯМР (400 МГц, CDCl3): δ 4,14 (s, 3Н), 7,05 (d, 1H), 8,28 (d, 1H).
TCX: Пластины: Merck DC-Plates, силикагель F254, насыщенная атмосфера в камере для проявления, УФ-детектирование, элюент: гексаны/этилацетат 9:1 (об.:об.); Rf искомого соединения = 0,33, Rf исходного вещества = 0,21.
Обнаружены только небольшие количества изомера искомого соединения и бис-метоксипиридина.
Пример Р29: Получение 2-метокси-6-(4-метилпентилокси)-3-нитропиридина:

A) В пятигорлой реакционной колбе объемом 100 мл, снабженной холодильником, механической мешалкой, капельной воронкой и термометром, гидрид натрия (1,16 г 0,55% дисперсии в минеральном масле) в атмосфере аргона суспендируют в сухом диоксане (20 мл). Затем добавляют гексаметилдисилазан (0,44 мл) и перемешивание продолжают в течение 15 мин. Шприцем при перемешивании в течение 5 мин по каплям добавляют 4-метил-1-пентанол (3,33 мл) (пенообразование, выделение газа, незначительное выделение тепла). Температура не поднимается выше 25°С. Перемешивание продолжают в течение 60 мин при температуре окружающей среды, в результате чего получают светло-желтую суспензию.
B) Затем в течение 8 мин добавляют 6-хлор-2-метокси-3-нитропиридин, растворенный в сухом диоксане (10 мл) (пено- и газообразование). Для поддержания температуры ниже 28°С используют охлаждающую баню со смесью лед/вода. Повторно добавляют диоксан (10 мл) и суспензию перемешивают при температуре окружающей среды в течение ночи. За протеканием реакции следят путем исследования образца с помощью1Н-ЯМР (получают путем обработки небольшого образца так, как описано ниже), который показывает наличие 30% исходного вещества. Для дальнейшего проведения реакции дважды добавляют спиртовой раствор 4-метил-1-пентанола по методике, описанной в пункте А): В первый раз добавляют количество, составляющее половину количества, указанного в пункте А), и перемешивание продолжают в течение 1 ч. Во второй раз добавляют количество равное 0,3 × количество, указанное в пункте А), и перемешивание продолжают в течение 2,5 ч. Затем добавляют воду (50 мл, рН равно примерно 10) и смесь экстрагируют эфиром (2×80 мл). Затем объединенные органические фазы сушат над сульфатом натрия, фильтруют и растворитель удаляют в вакууме и получают 6,70 г оранжево-коричневого масла. Очистка с помощью флэш-хроматографии на силикагеле с использованием смеси гексан/этилацетат 98:2 (об.:об.) дает 2,70 г смеси искомого соединения (15%) и 6-метокси-2-(4-метилпентилокси)-3-нитропиридина (85%, структура приведена ниже). Смесь в таком виде используют для последующего восстановления нитрогруппы и получения соответствующих производных анилина.
1Н ЯМР (400 МГц, CDCl3) искомого соединения: δ 0,92 (d, 6H), 1,37 (m, 2H), 1,62 (m, 1H), 1,85 (m, 2H), 4,10 (s, 3Н), 4,37 (t, 2H), 6,35 (d, 1H), 8,33 (d, 1H).
1H ЯМР (400 МГц, CDCl3) изомера: δ 0,92 (d, 6H), 1,37 (m, 2H), 1,62 (m, 1H), 1,85 (m, 2H), 3,99 (s, 3Н), 4,48 (t, 2H), 6,34 (d, 1H), 8,32 (d, 1H).
ЖХ: УФ-детектирование: 220 нм; Rt=2,12 мин (оба компонента).
ТСХ: Пластины: Merck DC-Plates, силикагель F254, насыщенная атмосфера в камере для проявления, УФ-детектирование, элюент: гептан/этилацетат 9:1 (об.:об.); Rf искомого соединения и изомера = 0,35, Rf исходного вещества = 0,33.
Пример Р30: Получение 2-метокси-6-(4-метилпентилокси)пиридин-3-иламина и 6-метокси-2-(4-метилпентилокси)пиридин-3-иламина:

В одногорлой круглодонной колбе объемом 10 мл, снабженной холодильником, 400 мг смеси, состоящей из 2-метокси-6-(4-метилпентилокси)-3-нитропиридина (15%) и 6-метокси-2-(4-метилпентилокси)-3-нитропиридина (85%), суспендируют в метаноле (1,50 мл). При перемешивании и охлаждении в бане из воды со льдом добавляют 37% водный раствор хлористоводородной кислоты (0,66 мл). После удаления охлаждающей бани добавляют порошкообразное олово (280 мг). Затем полученную суспензию перемешивают при кипячении с обратным холодильником в течение 3,5 ч. Затем смеси дают нагреться до комнатной температуры и метанол удаляют в вакууме. К полученному темно-зеленому смолообразному веществу добавляют 2 М водный раствор гидроксида натрия (10 мл, рН равно примерно 12). Смесь экстрагируют этилацетатом (2×20 мл). Органический слой сушат над сульфатом натрия, фильтруют и растворитель удаляют в вакууме и получают 310 мг желтого масла. Неочищенное вещество очищают с помощью хроматографии на силикагеле (элюент: гексаны/этилацетат, градиентный режим от 1:0 до 98:2 (об.:об.)). Получают 30 мг искомого соединения (8,5%) в виде коричневого масла.
Искомое соединение
1Н ЯМР (400 МГц, CDCl3): δ 0,90 (d, 6Н), 1,31 (m, 2H), 1,60 (m, 1H), 1,75 (m, 2H), 3,37 (широкий, 2H), 3,95 (s, 3Н), 4,14 (t, 2H), 6,15 (d, 1H), 6,93 (d, 1H).
ЖХ: УФ-детектирование: 220 нм; Rt=1,69 мин.
ТСХ: Пластины: Merck DC-Plates, силикагель F254, насыщенная атмосфера в камере для проявления, УФ-детектирование, элюент: гептан/этилацетат 9:1 (об.:об.); Rf искомого соединения = 0,10, Rf исходного вещества = 0,35.
Помимо искомого соединения также выделяют 250 мг изомера, 6-метокси-2-(4-метилпентилокси)пиридин-3-иламина, в виде оранжево-коричневого масла (71%).
1Н ЯМР (400 МГц, CDCl3): δ 0,91 (d, 6Н), 1,33 (m, 2H), 1,61 (m, 1H), 1,79 (m, 2H), 3,38 (широкий, 2H), 3,82 (s, 3Н), 4,32 (t, 2H), 6,14 (d, 1H), 6,94 (d, 1H).
ЖХ: УФ-детектирование: 220 нм; Rt=1,72 мин.
ТСХ: Пластины: Merck DC-Plates, силикагель F254, насыщенная атмосфера в камере для проявления, УФ-детектирование, элюент: гептан/этилацетат 9:1 (об.:об.); Rf=0,15.
Пример Р31: Получение 3-хлор-6-метокси-2-(4-метилпентилокси)-5-нитропиридина и 3-хлор-2-метокси-6-(4-метилпентилокси)-5-нитропиридина:

В трехгорлой круглодонной колбе объемом 10 мл, снабженной холодильником, 2-метокси-6-(4-метилпентилокси)-3-нитропиридин (15%) и 6-метокси-2-(4-метилпентилокси)-3-нитропиридин (85%) (250 мг) растворяют в сухом ацетонитриле (1,00 мл) и перемешивают при комнатной температуре. При перемешивании добавляют N-хлорсукцинимид (131 мг). Перемешивание при кипячении с обратным холодильником продолжают в течение 3,5 ч. После охлаждения до комнатной температуры добавляют воду (5 мл, рН равно примерно 6) и смесь экстрагируют эфиром (2×10 мл). Органический слой промывают 10% водным раствором бисульфита натрия (10 мл). После сушки над сульфатом натрия органический слой фильтруют и растворитель удаляют в вакууме и получают 250 мг желтого твердого вещества. После хроматографии на силикагеле (элюент: гексаны/этилацетат 99:1 (об.:об.)) получают 230 мг темно-красного масла следующего состава:
1Н ЯМР (400 МГц, CDCl3) искомого соединения: δ 0,92 (d, 6H), 1,36 (m, 2H), 1,62 (m, 1H), 1,85 (m, 2H), 4,10 (s, 3Н), 4,46 (t, 2H), 8,42 (s, 1H).
1H ЯМР (400 МГц, CDCl3) 3-хлор-2-метокси-6-(4-метилпентилокси)-5-нитропиридина: δ 0,92 (d, 6H), 1,36 (m, 2H), 1,62 (m, 1H), 1,85 (m, 2H), 4,08 (s, 3Н), 4,47 (t, 2H), 8,41 (s, 1H).
TCX: Пластины: Merck DC-Plates, силикагель F254, насыщенная атмосфера в камере для проявления, УФ-детектирование, элюент: гептан/этилацетат 9:1 (об.:об.); Rf искомого соединения и 3-хлор-2-метокси-6-(4-метилпентилокси)-5-нитропиридина = 0,43, Rf исходного вещества = 0,35.
Пример Р32: Получение 5-хлор-2-метокси-6-(4-метилпентилокси)пиридин-3-иламина, 5-хлор-6-метокси-2-(4-метилпентилокси)пиридин-3-иламина и 6-метокси-2-(4-метилпентилокси)пиридин-3-иламина:

В одногорлой круглодонной колбе объемом 50 мл, снабженной холодильником, 220 мг смеси, состоящей из 3-хлор-6-метокси-2-(4-метилпентилокси)-5-нитропиридина (11%), 3-хлор-2-метокси-6-(4-метилпентилокси)-5-нитропиридина (84%) и 6-метокси-2-(4-метилпентилокси)-3-нитропиридина (5%), суспендируют в метаноле (1,50 мл). При перемешивании и охлаждении в бане из воды со льдом добавляют 37% водный раствор хлористоводородной кислоты (0,32 мл). После удаления охлаждающей бани добавляют порошкообразное олово (181 мг). Затем полученную суспензию перемешивают при кипячении с обратным холодильником в течение 2,5 ч. За протеканием реакции следят с помощью тонкослойной хроматографии, которая показывает отсутствие исходного вещества. Затем смеси дают нагреться до комнатной температуры и метанол удаляют в вакууме. К полученному желтому твердому веществу добавляют 2 М водный раствор гидроксида натрия (5 мл, рН равно примерно 12). Смесь экстрагируют этилацетатом (2×10 мл). Органический слой сушат над сульфатом натрия, фильтруют и растворитель удаляют в вакууме и получают 170 мг желтого масла. Неочищенное вещество очищают с помощью хроматографии на силикагеле (элюент: гексаны/этилацетат 97:3 (об.:об.)). Очистка дает 170 мг чистого 5-хлор-6-метокси-2-(4-метилпентилокси)пиридин-3-иламина и 20 мг смеси 5-хлор-2-метокси-6-(4-метилпентилокси)пиридин-3-иламина (62%) и 6-метокси-2-(4-метилпентилокси)пиридин-3-иламина (38%). Смесь в таком виде используют для реакции получения соответствующих производных амидина.
Искомое соединение (5-хлор-6-метокси-2-(4-метилпентилокси)пиридин-3-иламин):
1Н ЯМР (400 МГц, CDCl3): δ 0,91 (d, 6H), 1,33 (m, 2H), 1,61 (m, 1H), 1,78 (m, 2H), 3,42 (широкий, 2H), 3,91 (s, 3H), 4,31 (t, 2H), 6,99 (s, 1H).
ЖХ: УФ-детектирование: 220 нм; Rt=2,07 мин.
ТСХ: Пластины: Merck DC-Plates, силикагель F254, насыщенная атмосфера в камере для проявления, УФ-детектирование, элюент: гептан/этилацетат 9:1 (об.:об.); Rf изомера = 0,28, Rf исходного вещества = 0,43.
Смесь, состоящая из следующих соединений:
5-хлор-2-метокси-6-(4-метилпентилокси)пиридин-3-иламин (62%)
1Н ЯМР (400 МГц, CDCl3): δ 0,91 (d, 6H), 1,32 (m, 2H), 1,61 (m, 1H), 1,79 (m, 2H), 3,40 (широкий, 2H), 3,93 (s, 3H), 4,27 (t, 2H), 6,98 (s, 1H).
ЖХ: УФ-детектирование: 220 нм; Rt=2,09 мин.
ТСХ: Пластины: Merck DC-Plates, силикагель F254, насыщенная атмосфера в камере для проявления, УФ-детектирование, элюент: гептан/этилацетат 9:1 (об.:об.); Rf искомого соединения = 0,18, Rf исходного вещества = 0,43.
6-метокси-2-(4-метилпентилокси)пиридин-3-иламин (38%)
1Н ЯМР (400 МГц, CDCl3): δ 0,91 (d, 6H), 1,33 (m, 2H), 1,61 (m, 1H), 1,79 (m, 2H), 3,40 (широкий, 2H), 3,82 (s, 3H), 4,32 (t, 2H), 6,14 (d, 1H), 6,94 (d, 1H).
ЖХ: УФ-детектирование: 220 нм; Rt=1,72 мин.
ТСХ: Пластины: Merck DC-Plates, силикагель F254, насыщенная атмосфера в камере для проявления, УФ-детектирование, элюент: гептан/этилацетат 9:1 (об.:об.); Rf искомого соединения = 0,15, Rf исходного вещества = 0,35.
Пример Р33: Получение 3-нитро-2-фенилпиридина:

В одногорлой круглодонной колбе объемом 250 мл, снабженной холодильником, 10,0 г 2-хлор-3-нитропиридина (СА регистрационный №5470-18-8) в атмосфере аргона растворяют в 75,0 мл толуола и 9,3 мл этанола. Затем добавляют 19,18 г карбоната калия в 12,0 мл воды, затем 7,69 г фенилбороновой кислоты. Смесь перемешивают в токе аргона в течение 15 мин, затем добавляют 2,19 г тетракис(трифенилфосфин)палладия. Затем смесь перемешивают при кипячении с обратным холодильником в течение 20 ч. Затем темно-коричневую смесь охлаждают до температуры окружающей среды, затем добавляют 100 мл насыщенного водного раствора NH4Cl. Эту смесь экстрагируют с помощью AcOEt (2×100 мл). Органическую фазу сушат над Na2SO4, фильтруют и концентрируют в вакууме и получают 15,26 г темно-коричневого масла. После очистки остатка с помощью флэш-хроматографии [картридж с силикагелем (20 г, 60 мл) и смесь гексан/этилацетат 3:2 (об.:об.)], 12,23 г получают искомого соединения в виде коричневого масла.
Искомое соединение получают в виде коричневого масла.
1Н ЯМР (400 МГц, CDCl3): δ 7,46 (m, 4Н), 7,56 (m, 2H), 8,13 (dd, 1H), 8,85 (dd, 1H).
ЖХ: УФ-детектирование: 220 нм; Rt=1,54 мин.
ТСХ: Пластины: Merck DC-Plates, силикагель F254, насыщенная атмосфера в камере для проявления, УФ-детектирование, элюент: гептан/этилацетат 1:1 (об.:об.); Rf искомого соединения = 0,44, Rf исходного вещества = 0,44.
Пример Р34: Получение 3-нитро-2-фенилпиридин-1-оксида:

В трехгорлой круглодонной колбе объемом 250 мл, снабженной термометром, капельной воронкой и холодильником, 11,62 г 3-нитро-2-фенилпиридина растворяют в 58,0 мл дихлорметана. Затем добавляют 13,65 г аддукта H2O2 с мочевиной. При охлаждении в бане из воды со льдом в течение 25 мин по каплям добавляют 16,40 мл ангидрида трифторуксусной кислоты (температура ниже 12°С). После перемешивания при 10°С в течение 45 мин охлаждающую баню удаляют и смесь перемешивают при температуре окружающей среды в течение 18 ч. Затем добавляют 150 мл воды (рН равно примерно 1) и смесь экстрагируют дихлорметаном (3×100 мл). После промывания органической фазы 10% водным раствором сульфита натрия ее сушат над Na2SO4. После очистки с помощью хроматографии через слой силикагеля (элюент: сначала дихлорметан, затем этилацетат) получают 9,45 г искомого соединения в виде желто-зеленого твердого вещества (Т.пл.: 116-117°С).
1Н ЯМР (400 МГц, CDCl3): δ 7,42 (m, 3H), 7,50 (m, 3H), 7,64 (dd, 1H), 8,50 (dd, 1H).
ЖХ: УФ-детектирование: 220 нм; Rt=1,12 мин.
ТСХ: Пластины: Merck DC-Plates, силикагель F254, насыщенная атмосфера в камере для проявления, УФ-детектирование, элюент: гептан/этилацетат 1:1 (об.:об.); Rf искомого соединения = 0,05, Rf исходного вещества = 0,44.
Пример Р35: Получение 6-хлор-3-нитро-2-фенилпиридина:

В трехгорлой круглодонной колбе объемом 100 мл, снабженной холодильником, 5,00 г 3-нитро-2-фенилпиридин-1-оксида растворяют в 25,0 мл сухого 1,2-дихлорэтана. Осторожно добавляют оксихлорид фосфора (3,18 мл) (желто-оранжевый раствор). Затем эту смесь перемешивают при кипячении с обратным холодильником в течение 17 ч. После охлаждения смеси до температуры окружающей среды добавляют смесь лед/вода. Смесь экстрагируют дихлорметаном (2×50 мл). После промывания рассолом органическую фазу сушат над сульфатом натрия, фильтруют и концентрируют в вакууме. Очистка остатка с помощью флэш-хроматографии с использованием картриджа с силикагелем (25 г, 150 мл) и смеси гексан/этилацетат 4:1 (об.:об.) дает 2,61 г искомого соединения в виде желтого масла.
1Н ЯМР (400 МГц, CDCl3): δ 7,46 (m, 4H), 7,56 (m, 2H), 8,10 (d, 1H).
ЖХ: УФ-детектирование: 220 нм; Rt=1,78 мин.
ТСХ: Пластины: Merck DC-Plates, силикагель F254, насыщенная атмосфера в камере для проявления, УФ-детектирование, элюент: гептан/этилацетат 1:1 (об.:об.); Rf искомого соединения = 0,59, Rf исходного вещества = 0,05.
Пример Р36: Получение 2-хлор-6-метил-5-нитроникотинонитрила:

В пятигорлой реакционной колбе объемом 200 мл, снабженной механической мешалкой, капельной воронкой, термометром и холодильником, 10,00 г 6-метил-2-оксо-1,2-дигидропиридин-3-карбонитрила (СА регистрационный №: 4241-27-4) медленно добавляют к 75,0 мл концентрированной серной кислоты (выделение тепла). При перемешивании и охлаждении в бане из воды со льдом в течение 10 мин по каплям добавляют кислотную смесь (свежеприготовленная из 5,0 мл концентрированной серной и 3,40 мл дымящей азотной кислот). Смеси сначала дают нагреться до 25°С и затем ее перемешивают примерно при этой температуре (в начале время от времени охлаждая в бане из воды со льдом) в течение 4 ч. Затем смесь осторожно выливают в лед и затем добавляют воду (общий объем 250 мл). Начинается выпадение осадка. После фильтрования, промывания водой и сушки выделяют 750 мг желтого твердого вещества, представляющего собой смесь 6-метил-5-нитро-2-оксо-1,2-дигидропиридин-3-карбонитрила (39%) и амида 6-метил-5-нитро-2-оксо-1,2-дигидропиридин-3-карбоновой кислоты (61%). Эту смесь непосредственно используют на следующей стадии.
В одногорлой круглодонной колбе объемом 50 мл, снабженной холодильником, полученную выше смесь суспендируют в 3,80 мл оксихлорида фосфора. Эту смесь при перемешивании кипятят с обратным холодильником в течение 23,5 ч (темно-коричневый раствор). После охлаждения смеси до температуры окружающей среды ее концентрируют в вакууме при 50°С. Полученное смолообразное вещество обрабатывают льдом, затем избытком насыщенного водного раствора бикарбоната натрия. Смесь экстрагируют с помощью AcOEt (3×20 мл). Органическую фазу сушат над сульфатом натрия, фильтруют и концентрируют в вакууме и получают 600 мг коричневого твердого вещества. Очистка остатка с помощью флэш-хроматографии с использованием картриджа с силикагелем (20 г, 60 мл) и смеси гексан/этилацетат 9:1 (об.:об.) дает 510 мг искомого соединения в виде светло-желтого твердого вещества (Т.пл.: 94-95°С).
1Н ЯМР (400 МГц, CDCl3): δ 2,95 (s, 3H), 8,60 (s, 1H).
TCX: Пластины: Merck DC-Plates, силикагель F254, насыщенная атмосфера в камере для проявления, УФ-детектирование, элюент: гептан/этилацетат 1:4 (об.:об.); Rf искомого соединения = 0,68, Rf исходного вещества = 0.
Пример Р37: Получение 2-(4-хлор-3-трифторметилфенокси)-6-метил-5-нитроникотинонитрила:
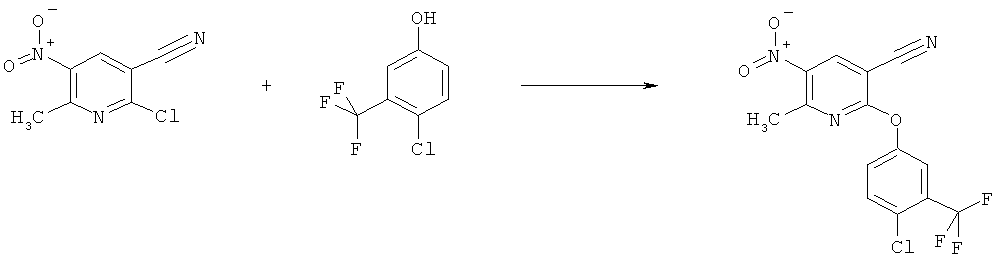
В одногорлой круглодонной колбе объемом 50 мл 990 мг 4-хлор-3-трифторметилфенола растворяют в 5,00 мл сухого диоксана. Затем при перемешивании добавляют 1,73 мл основания Хюнига, затем 1,00 г 2-хлор-6-метил-5-нитроникотинонитрила и перемешивание продолжают при температуре окружающей среды в течение 24 ч (темно-фиолетовая суспензия). Затем смесь фильтруют через слой силикагеля на дисковом фильтре из пористого стекла, затем промывают дихлорметаном. Объединенные органические фазы концентрируют в вакууме и получают 2,32 г темно-фиолетового смолообразного вещества. После очистки с помощью хроматографии [картридж с силикагелем (50 г, 150 мл), элюент: гексаны/этилацетат 4:1 (об.:об.)] получают 1,53 г искомого соединения в виде оранжевого твердого вещества (Т.пл.: 110-111°С).
1Н ЯМР (400 МГц, CDCl3): δ 2,77 (s, 3H), 7,34 (dd, 1H), 7,60 (m, 2H), 8,72 (s, 1H).
ЖХ: УФ-детектирование: 220 нм; Rt=2,08 мин.
TCX: Пластины: Merck DC-Plates, силикагель F254, насыщенная атмосфера в камере для проявления, УФ-детектирование, элюент: гептан/этилацетат 2:1 (об.:об.); Rf искомого соединения = 0,54, Rf исходного вещества = 0,52.
Пример Р38: Получение 6-метил-2-(4-метилпентилокси)-5-нитроникотинонитрила:

В реакционном сосуде Supelco объемом 8 мл к 0,95 мл 4-метилпентан-1-ола добавляют 1,00 г 2-хлор-6-метил-5-нитроникотинонитрила. Реакционный сосуд закрывают мембраной и смесь перемешивают при кипячении с обратным холодильником (температура масляной бани 130°С). За протеканием реакции следят с помощью тонкослойной хроматографии. Через 46 ч повторно добавляют 0,53 мл 4-метилпентан-1-ола и перемешивание продолжают в тех же условиях. После нагревания в совокупности в течение 118 ч смеси дают нагреться до температуры окружающей среды. Затем летучие компоненты удаляют в вакууме при температуре 50°С и получают 1,08 г коричневого масла. После очистки с помощью хроматографии [картридж с силикагелем (50 г, 100 мл), элюент: гексаны/этилацетат 95:5 (об.:об.)], 690 мг искомого соединения получают в виде желтого масла.
1Н ЯМР (400 МГц, CDCl3): δ 0,93 (d, 6Н), 1,34 (m, 2H), 1,62 (m, 1H), 1,85 (m, 2H), 2,87 (s, 3H), 4,52 (t, 2H), 8,59 (s, 1H).
TCX: Пластины: Merck DC-Plates, силикагель F254, насыщенная атмосфера в камере для проявления, УФ-детектирование, элюент: гептан/этилацетат 2:1 (об.:об.); Rf искомого соединения = 0,59, Rf исходного вещества = 0,52.
Пример Р39: Получение 3-бром-4-метил-5-нитро-1Н-пиридин-2-она:

В трехгорлой круглодонной колбе объемом 1000 мл 5,00 г 4-метил-5-нитро-1H-пиридин-2-она (СА регистрационный №: 21901-41-7) суспендируют в 500 мл воды. Смесь при перемешивании выдерживают при температуре 40°С, в то время как по каплям добавляют 1,83 мл элементарного брома. Перемешивание продолжают при 40°С в течение еще 4 ч. Затем смесь охлаждают до 10°С и полученный осадок собирают фильтрованием и промывают водой (4×). После сушки получают 6,65 г искомого соединения в виде бежевого твердого вещества (Т.пл.: 237-240°С).
Пример Р40: Получение 3-бром-2-хлор-4-метил-5-нитропиридина:

В одногорлой круглодонной колбе объемом 25 мл к 1,72 мл оксихлорида фосфора, выдерживаемого при температуре 5°С, последовательно добавляют 0,857 мл хинолина и 3,40 г 3-бром-4-метил-5-нитро-1Н-пиридин-2-она. Полученную бежевую суспензию перемешивают при нагревании при 120°С, в результате чего получают коричневый раствор. Перемешивание продолжают в течение 2 ч. Затем раствор охлаждают до температуры окружающей среды и выливают в воду. Полученный осадок собирают фильтрованием, отфильтрованный осадок промывают водой (4×) и сушат и получают 3,15 г искомого соединения в виде коричневого твердого вещества (Т.пл.: 60-62°С).
Пример Р41: Получение 3-бром-2-(4-хлор-3-трифторметилфенокси)-4-метил-5-нитропиридина:

В трехгорлой круглодонной колбе объемом 250 мл 4,00 г 4-хлор-3-трифторметилфенола растворяют в 80 мл сухого метилэтилкетона. Добавляют 3,85 г карбоната калия, затем 4,70 г 3-бром-2-хлор-4-метил-5-нитропиридина. Полученную коричневую суспензию при перемешивании нагревают при 80°С в течение 3 ч. Затем зеленой суспензии дают нагреться до температуры окружающей среды и затем ее выливают в воду. Смесь экстрагируют этилацетатом (3×50 мл). Объединенные органические фазы промывают рассолом, сушат над сульфатом натрия, фильтруют и растворитель удаляют в вакууме. После очистки неочищенного продукта с использованием силикагеля и смеси циклогексан/этилацетат 19:1 (об.:об.) получают 7,36 г искомого соединения в виде светло-желтого смолообразное вещество, которое при выдерживании затвердевает (Т.пл.: 73-74°С).
Пример Р42: Получение 2-(4-хлор-3-трифторметилфенокси)-3,4-диметил-5-нитропиридина:

Пример Р43: Получение метилового эфира N-[5-бром-2-метил-6-(4-метилпентилокси)пиридин-3-ил]-имидомуравьиной кислоты:

В одногорлой круглодонной колбе объемом 50 мл 3,00 г 5-бром-2-метил-6-(4-метилпентилокси)пиридин-3-иламина растворяют в 10 мл триметилортоформиата. При перемешивании раствор кипятят с обратным холодильником в течение 8 ч. Затем реакционной смеси дают нагреться до температуры окружающей среды и летучие компоненты удаляют в вакууме при 50°С и получают 3,38 г искомого соединения в виде коричневого масла.
1Н ЯМР (400 МГц, CDCl3): δ 0,91-0,94 (d, 6H, СН3), 1,31-1,41 (m, 2H, CH2), 1,56-1,73 (m, 1H, СН), 1,76-1,80 (m, 2H, СН2), 2,35 (s, 3Н, СН3), 4,28 (s, 3Н, СН3), 4,33-4,36 (t, 2H, СН2), 7,26 (s, 1H), 7,75 (s, 1H).
ТСХ: Пластины: Merck DC-Platten, силикагель F254, насыщенная атмосфера в камере для проявления, УФ-детектирование, элюент: циклогексан/этилацетат 1:1 (об.:об.); Rf искомого соединения = 0,73.
Пример Р44: Получение N-[5-бром-2-метил-6-(4-метилпентилокси)-пиридин-3-ил]-N'-этилформамидина:

В одногорлой круглодонной колбе объемом 50 мл 540 мг метилового эфира N-[5-бром-2-метил-6-(4-метилпентилокси)пиридин-3-ил]-имидомуравьиной кислоты растворяют в 6,60 мл сухого дихлорметана. При перемешивании при температуре окружающей среды добавляют 214 мг этиламингидрохлорида и 0,45 мл основания Хюнига. Перемешивание продолжают при комнатной температуре в течение 20 ч. Затем летучие компоненты удаляют в вакууме при 50°С. После очистки на силикагеле (элюент: гептан/этилацетат 8:1 (об.:об.) с 5% триэтиламина) получают 530 мг искомого соединения в виде коричневого масла.
1Н ЯМР (400 МГц, CDCl3): δ 0,88-0,89 (d, 6H, СН3),1,22-1,28 (t, 3H, СН3) 1,30-1,36 (m, 2H, СН2), 1,57-1,68 (m, 1H, СН), 1,75-1,82 (m, 2H, CH2), 3,32-3,40 (широкий, 2H, СН2) 2,35 (s, 3H, СН3), 4,30-4,34 (t, 2H, СН2), 4,34-4,71 (широкий, 1H, NH) 7,28 (s, 1H), 7,45 (s, 1H).
TCX: Пластины: Merck DC-Platten, силикагель F254, насыщенная атмосфера в камере для проявления, УФ-детектирование, элюент: циклогексан/этилацетат 1:1 (об.:об.) + 5% триэтиламина; Rf искомого соединения = 0,24.
Пример Р45: Получение N'-[5-бром-2-метил-6-(4-метилпентилокси)-пиридин-3-ил]-N,N-диэтилформамидина:

В одногорлой круглодонной колбе объемом 50 мл 540 мг метилового эфира N-[5-бром-2-метил-6-(4-метилпентилокси)пиридин-3-ил]-имидомуравьиной кислоты растворяют в 6,60 мл сухого дихлорметана. При перемешивании при температуре окружающей среды добавляют 0,273 мл диэтиламина. Перемешивание продолжают при температуре окружающей среды в течение 44 ч. ЖХ образца показывает, что в смеси все еще присутствует 40% исходного вещества. Повторно добавляют диэтиламин и перемешивание продолжают в течение еще 24 ч. Затем летучие компоненты удаляют в вакууме при 50°С. После очистки на силикагеле (элюент: гептан/этилацетат 8:1 (об.:об.) с 5% триэтиламина) получают 530 мг искомого соединения в виде желтого масла.
1Н ЯМР (400 МГц, CDCl3): δ 0,92-0,0,94 (d, 6H, СН3), 1,20-1,25 (t, 6H, СН3) 1,31-1,39 (m, 2Н, СН2), 1,57-1,67 (m, 1Н, CH), 1,74-1,82 (m, 2H, CH2), 2,34 (s, 3Н, СН3) 3,19-3,49 (широкий, 4Н, СН2), 4,28-4,34 (t, 2H, СН2), 7,30 (s, 1Н), 7,36 (s, 1Н).
ТСХ: Пластины: Merck DC-Platten, силикагель F254, насыщенная атмосфера в камере для проявления, УФ-детектирование, элюент: циклогексан/этилацетат 1:1 (об.:об.); Rf искомого соединения = 0,66.
Пример Р46: Получение 3-бром-5-изотиоцианато-6-метил-2-(4-метилпентилокси)пиридина:

В одногорлой круглодонной колбе объемом 50 мл 800 мг 5-бром-2-метил-6-(4-метилпентилокси)пиридин-3-иламина растворяют в 1,00 мл сухого дихлорметана (светло-желтый раствор). При перемешивании при температуре ниже 5°С (баня со смесью лед/вода) сначала по каплям добавляют триэтиламин (46,6 мл) затем тиофосген (ClCSCl) (28,5 мл). Перемешивание продолжают при такой же температуре в течение 1,25 ч. Затем добавляют воду (10 мл) и смесь экстрагируют диэтиловым эфиром (2×10 мл). После промывания рассолом органическую фазу сушат над сульфатом натрия, фильтруют и концентрируют в вакууме и получают 130 мг желтого масла. Вещество в таком виде используют на следующей стадии.
Пример Р47: Получение 3-[5-бром-2-метил-6-(4-метилпентилокси)пиридин-3-ил]-1-изопропил-1-метилтиомочевины:

В одногорлой круглодонной колбе объемом 50 мл 920 мг 3-бром-5-изотиоцианато-6-метил-2-(4-метилпентилокси)пиридиноксида растворяют в 1,00 мл сухого хлороформа. При температуре окружающей среды при перемешивании по каплям добавляют изопропилэтиламин (20,4 мг). Перемешивание продолжают при такой же температуре в течение 45 мин. Затем к полученному оранжевому раствору добавляют 5,00 мл воды. Смесь экстрагируют диэтиловым эфиром (2×10 мл). После промывания рассолом органическую фазу сушат над сульфатом натрия, фильтруют и концентрируют в вакууме и получают 140 мг коричневого масла. Очистка остатка с помощью флэш-хроматографии с использованием картриджа с силикагелем (20 г, 60 мл) и смеси гексан/этилацетат 95:5 (об.:об.) дает 60,0 мг искомого соединения в виде желтого масла.
1Н ЯМР (400 МГц, CDCl3): δ 0,92 (d, 6H), 1,24 (d, 6H), 1,34 (m, 2H), 1,63 (m, 1H), 1,80 (m, 2H), 2,34 (s, 3Н), 3,08 (s, 3H), 4,34 (t, 2H), 5,48 (широкий, 1Н), 6,70 (широкий, 1H), 7,70 (s, 1H).
ЖХ: УФ-детектирование: 220 нм; Rt=2,19 мин.
ТСХ: Пластины: Merck DC-Plates, силикагель F254, насыщенная атмосфера в камере для проявления, УФ-детектирование, элюент: гептан/этилацетат 4:1 (об.:об.); Rf искомого соединения = 0,22, Rf исходного вещества = 0,67.
Пример Р48: Получение 5-амино-2-имидазол-1-ил-6-метилникотинонитрила:
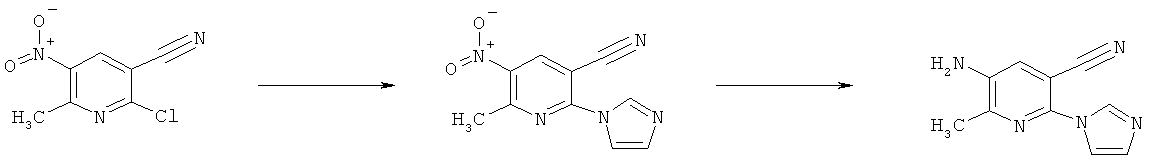
В реакционном сосуде Supelco объемом 8 мл 200 мг 2-хлор-6-метил-5-нитроникотинонитрила (140 мг) растворяют в сухом диоксане (1,00 мл). После добавления 138 мг имидазола смесь перемешивают при температуре окружающей среды в течение 70 ч. Затем суспензию фильтруют через слой силикагеля, отфильтрованный осадок промывают этилацетатом и объединенные органические фазы концентрируют в вакууме и получают 240 мг оранжево-коричневого твердого вещества. В одногорлой круглодонной колбе объемом 50 мл это твердое вещество (240 мг) растворяют в метаноле (1,00 мл). При перемешивании и охлаждении в бане из воды со льдом по каплям добавляют 1,00 моль 27% водного раствора хлористоводородной кислоты. После удаления охлаждающей бани добавляют порошкообразное олово (186 мг). Серо-зеленую суспензию перемешивают при кипячении с обратным холодильником в течение 2,45 ч. Затем нагревающую баню удаляют и смесь перемешивают при температуре окружающей среды в течение ночи. Затем летучие компоненты удаляют в вакууме и добавляют 20 мл 4 М водного раствора гидроксида натрия. Смесь экстрагируют этилацетатом (3×15 мл). Органический слой сушат над сульфатом натрия, фильтруют и растворитель удаляют в вакууме и получают 160 мг оранжево-коричневого твердого вещества.
МС: ЭР+ (электрораспыление): 200 (М+Н)+; ЭР-: 198 (M-Н)+
Используют следующие методики для ЖХ
Методика 1
Прибор ВЭЖХ HP1100 фирмы Agilent: устройство дегазирования растворителя, квадратичный насос, термостатируемый блок колонки и детектор на диодной матрице.
Колонка: Phenomenex Gemini C18, размер частиц 3 мкм, 110 ангстрем, 30×3 мм,
температура: 60°С
ДДМ (детектор на диодной матрице) диапазон длин волн (нм): от 200 до 500
Градиентный режим растворителя: (единый для всех методик)
А = вода + 0,05% НСООН
В = ацетонитрил/метанол (4:1, об./об.) + 0,04% НСООН
Методика 3
Прибор ВЭЖХ HP1100 фирмы Agilent: устройство дегазирования растворителя, сдвоенный насос, термостатируемый блок колонки и детектор на диодной матрице.
Колонка: Phenomenex Gemini C18, размер частиц 3 мкм, 110 ангстрем, 30×3 мм, температура: 60°С, ДДМ диапазон длин волн (нм): от 200 до 500.
Градиентный режим растворителя: (такой, как описано выше).
Методика 4
Прибор ВЭЖХ HP1100 фирмы Agilent: устройство дегазирования растворителя, сдвоенный насос, термостатируемый блок колонки и детектор длины волны.
Колонка: Phenomenex Gemini C18, размер частиц 3 мкм, 110 ангстрем, 30×3 мм, температура: 60°С.
Градиентный режим растворителя: (такой, как описано выше).
МС. Спектры снимают на спектрометре ZMD (Micromass, Manchester UK) или на спектрометре ZQ (Waters Corp. Milford, MA, USA), снабженном источником электрораспыления (ИЭР); температура источника от 80 до 100°С; температура десольватации от 200 до 250°С; напряжение на конусе 30 В; скорость газа на конусе 50 л/ч, скорость газа при десольватации от 400 до 600 л/ч, диапазон масс: от 150 до 1000 Да).
Соединения, приведенные в представленных ниже таблицах, можно получить аналогичным образом. Приведенные ниже примеры предназначены для иллюстрации настоящего изобретения и являются предпочтительными соединениями формулы I и X.
В таблице А приведены 526 наборов значений переменных R1, R2, R5 и R6 в соединении формулы I.
В приведенных ниже таблицах T1-Т151 описаны предпочтительные соединения формулы I.
Таблица 1: В этой таблице описаны 526 соединений Т1.1.1-T1.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А. Например, конкретное соединение Т1.1.13 является соединением формулы Т1, в которой каждая из переменных R1, R2, R5 и R6 в которой каждая из переменных обладает конкретным значением, указанным в строке А.1.13 таблицы А:

По такой же системе и все остальные 511 конкретных соединений, описанных в таблице 1, а также все конкретные соединения, приведенные в таблицах 2 - Т151, описаны аналогичным образом.
Таблица 2: В этой таблице описаны 526 соединений Т2.1.1-Т2.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 3: В этой таблице описаны 526 соединений Т3.1.1-Т3.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 4: В этой таблице описаны 526 соединений Т4.1.1-Т4.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 5: В этой таблице описаны 526 соединений Т5.1.1-Т5.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 6: В этой таблице описаны 526 соединений Т6.1.1-Т6.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 7: В этой таблице описаны 526 соединений Т7.1.1-Т7.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 8: В этой таблице описаны 526 соединений Т8.1.1-Т8.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 9: В этой таблице описаны 526 соединений Т9.1.1-Т9.1.526 формулы
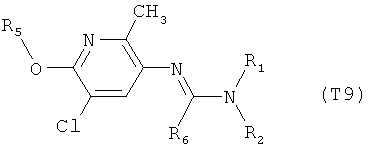
в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 10: В этой таблице описаны 526 соединений Т10.1.1-Т10.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 11: В этой таблице описаны 526 соединений Т11.1.1-T11.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 12: В этой таблице описаны 526 соединений Т12.1.1-Т12.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 13: В этой таблице описаны 526 соединений Т13.1.1-Т13.1.526 формулы
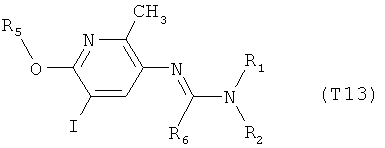
в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 14: В этой таблице описаны 526 соединений Т14.1.1-Т14.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 15: В этой таблице описаны 526 соединений Т15.1.1-Т15.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 16: В этой таблице описаны 526 соединений Т16.1.1-Т16.1.526 формулы
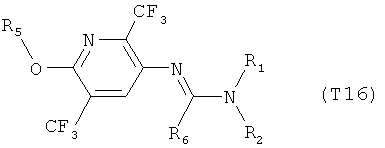
в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 17: В этой таблице описаны 526 соединений Т17.1.1-Т17.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 18: В этой таблице описаны 526 соединений Т18.1.1-Т18.1.526 формулы
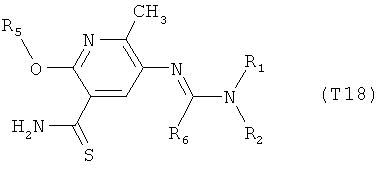
в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 19: В этой таблице описаны 526 соединений Т19.1.1-Т19.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 20: В этой таблице описаны 526 соединений Т20.1.1-Т20.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 21: В этой таблице описаны 526 соединений Т21.1.1-Т21.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 22: В этой таблице описаны 526 соединений Т22.1.1-Т22.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 23: В этой таблице описаны 526 соединений Т23.1.1-Т23.1.526 формулы
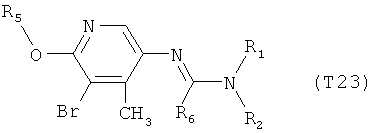
в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 24: В этой таблице описаны 526 соединений Т24.1.1-Т24.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 25: В этой таблице описаны 526 соединений Т25.1.1-Т25.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 26: В этой таблице описаны 526 соединений Т26.1.1-Т26.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 27: В этой таблице описаны 526 соединений Т27.1.1-Т27.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 28: В этой таблице описаны 526 соединений Т28.1.1-Т28.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 29: В этой таблице описаны 526 соединений Т29.1.1-Т29.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 30: В этой таблице описаны 526 соединений Т30.1.1-Т30.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 31: В этой таблице описаны 526 соединений Т31.1.1-Т31.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 32: В этой таблице описаны 526 соединений Т32.1.1-Т32.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 33: В этой таблице описаны 526 соединений Т33.1.1-Т33.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 34: В этой таблице описаны 526 соединений Т34.1.1-Т34.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 35: В этой таблице описаны 526 соединений Т35.1.1-Т35.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 36: В этой таблице описаны 526 соединений Т36.1.1-Т36.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 37: В этой таблице описаны 526 соединений Т37.1.1-Т37.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 38: В этой таблице описаны 526 соединений Т38.1.1-Т38.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 39: В этой таблице описаны 526 соединений Т39.1.1-Т39.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 40: В этой таблице описаны 526 соединений Т40.1.1-Т40.1.526 формулы
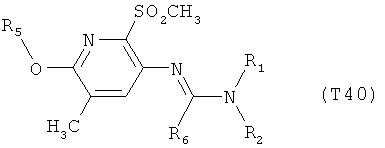
в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 41: В этой таблице описаны 526 соединений Т41.1.1-Т41.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 42: В этой таблице описаны 526 соединений Т42.1.1-Т42.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 43: В этой таблице описаны 526 соединений Т43.1.1-Т43.1.526 формулы
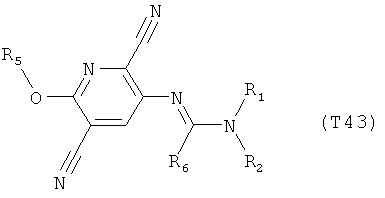
в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 44: В этой таблице описаны 526 соединений Т44.1.1-Т44.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 45: В этой таблице описаны 526 соединений Т45.1.1-Т45.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 46: В этой таблице описаны 526 соединений Т46.1.1-Т46.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 47: В этой таблице описаны 526 соединений Т47.1.1-Т47.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 48: В этой таблице описаны 526 соединений Т48.1.1-Т48.1.526 формулы
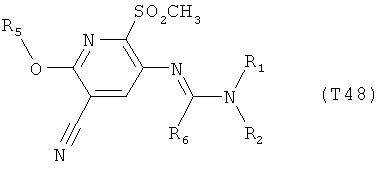
в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 49: В этой таблице описаны 526 соединений Т49.1.1-Т49.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 50: В этой таблице описаны 526 соединений Т50.1.1-Т50.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 51: В этой таблице описаны 526 соединений Т51.1.1-Т51.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 52: В этой таблице описаны 526 соединений Т52.1.1-Т52.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 53: В этой таблице описаны 526 соединений Т53.1.1-Т53.1.526 формулы
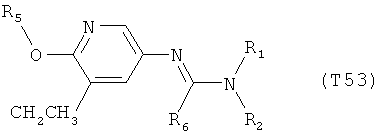
в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 54: В этой таблице описаны 526 соединений Т54.1.1-Т54.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 55: В этой таблице описаны 526 соединений Т55.1.1-Т55.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 56: В этой таблице описаны 526 соединений Т56.1.1-Т56.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 57: В этой таблице описаны 526 соединений Т57.1.1-Т57.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 58: В этой таблице описаны 526 соединений Т58.1.1-Т58.1.526 формулы
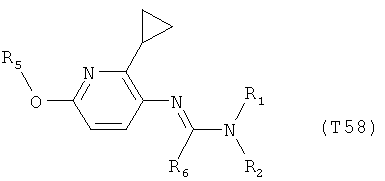
в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 59: В этой таблице описаны 526 соединений Т59.1.1-Т59.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 60: В этой таблице описаны 526 соединений Т60.1.1-Т60.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 61: В этой таблице описаны 526 соединений Т61.1.1-Т61.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 62: В этой таблице описаны 526 соединений Т62.1.1-Т62.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 63: В этой таблице описаны 526 соединений Т63.1.1-Т63.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 64: В этой таблице описаны 526 соединений Т64.1.1-Т64.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 65: В этой таблице описаны 526 соединений Т65.1.1-Т65.1.526 формулы
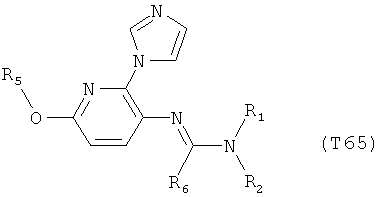
в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 66: В этой таблице описаны 526 соединений Т66.1.1-Т66.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 67: В этой таблице описаны 526 соединений Т67.1.1-Т67.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 68: В этой таблице описаны 526 соединений Т68.1.1-Т68.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 69: В этой таблице описаны 526 соединений Т69.1.1-Т69.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 70: В этой таблице описаны 526 соединений Т70.1.1-Т70.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 71: В этой таблице описаны 526 соединений Т71.1.1-Т71.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 72: В этой таблице описаны 526 соединений Т72.1.1-Т72.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 73: В этой таблице описаны 526 соединений Т73.1.1-Т73.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 74: В этой таблице описаны 526 соединений Т74.1.1-Т74.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 75: В этой таблице описаны 526 соединений Т75.1.1-Т75.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 76: В этой таблице описаны 526 соединений Т76.1.1-Т76.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 77: В этой таблице описаны 526 соединений Т77.1.1-Т77.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 78: В этой таблице описаны 526 соединений Т78.1.1-Т78.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 79: В этой таблице описаны 526 соединений Т79.1.1-Т79.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 80: В этой таблице описаны 526 соединений Т80.1.1-Т80.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 81: В этой таблице описаны 526 соединений Т81.1.1-Т81.1.526 формулы
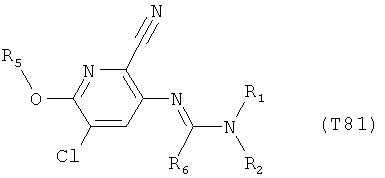
в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 82: В этой таблице описаны 526 соединений Т82.1.1-Т82.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 83: В этой таблице описаны 526 соединений Т83.1.1-Т83.1.526 формулы
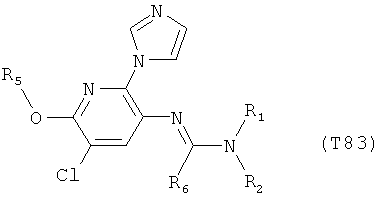
в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 84: В этой таблице описаны 526 соединений Т84.1.1-Т84.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 85: В этой таблице описаны 526 соединений Т85.1.1-Т85.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 86: В этой таблице описаны 526 соединений Т86.1.1-Т86.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 87: В этой таблице описаны 526 соединений Т87.1.1-Т87.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 88: В этой таблице описаны 526 соединений Т88.1.1-Т88.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 89: В этой таблице описаны 526 соединений Т89.1.1-Т89.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 90: В этой таблице описаны 526 соединений Т90.1.1-Т90.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 91: В этой таблице описаны 526 соединений Т91.1.1-Т91.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 92: В этой таблице описаны 526 соединений Т92.1.1-Т92.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 93: В этой таблице описаны 526 соединений Т93.1.1-Т93.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 94: В этой таблице описаны 526 соединений Т94.1.1-Т94.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 95: В этой таблице описаны 526 соединений Т95.1.1-Т95.1.526 формулы
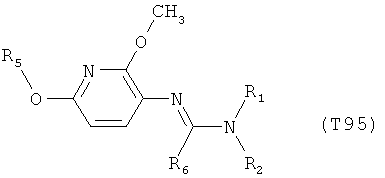
в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 96: В этой таблице описаны 526 соединений Т96.1.1-Т96.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 97: В этой таблице описаны 526 соединений Т97.1.1-Т97.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 98: В этой таблице описаны 526 соединений Т98.1.1-Т98.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 99: В этой таблице описаны 526 соединений Т99.1.1-Т99.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 100: В этой таблице описаны 526 соединений Т100.1.1-Т100.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 101: В этой таблице описаны 526 соединений Т101.1.1-Т101.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 102: В этой таблице описаны 526 соединений Т102.1.1-Т102.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 103: В этой таблице описаны 526 соединений Т103.1.1-Т103.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 104: В этой таблице описаны 526 соединений Т104.1.1-Т104.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 105: В этой таблице описаны 526 соединений Т105.1.1-Т105.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 106: В этой таблице описаны 526 соединений Т106.1.1-Т106.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 107: В этой таблице описаны 526 соединений Т107.1.1-Т107.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 108: В этой таблице описаны 526 соединений Т108.1.1-Т108.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 109: В этой таблице описаны 526 соединений Т109.1.1-Т109.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 110: В этой таблице описаны 526 соединений Т110.1.1-T110.1.526 формулы
в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 111: В этой таблице описаны 526 соединений T111.1.1-T111.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 112: В этой таблице описаны 526 соединений Т112.1.1-Т112.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 113: В этой таблице описаны 526 соединений Т113.1.1-Т113.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 114: В этой таблице описаны 526 соединений Т114.1.1-T114.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 115: В этой таблице описаны 526 соединений Т115.1.1-Т115.1.526 формулы
в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 116: В этой таблице описаны 526 соединений Т116.1.1-Т116.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 117: В этой таблице описаны 526 соединений Т117.1.1-Т117.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 118: В этой таблице описаны 526 соединений Т118.1.1-Т118.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 119: В этой таблице описаны 526 соединений Т119.1.1-Т119.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 120: В этой таблице описаны 526 соединений Т120.1.1-Т120.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 121: В этой таблице описаны 526 соединений Т121.1.1-Т121.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 122: В этой таблице описаны 526 соединений Т122.1.1-Т122.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 123: В этой таблице описаны 526 соединений Т123.1.1-Т123.1.526 формулы
в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 124: В этой таблице описаны 526 соединений Т124.1.1-Т124.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 125: В этой таблице описаны 526 соединений Т125.1.1-Т125.1.526 формулы
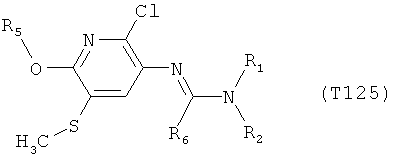
в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 126: В этой таблице описаны 526 соединений Т126.1.1-Т126.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 127: В этой таблице описаны 526 соединений Т127.1.1-Т127.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 128: В этой таблице описаны 526 соединений Т128.1.1-Т128.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 129: В этой таблице описаны 526 соединений Т129.1.1-Т129.1.526 формулы
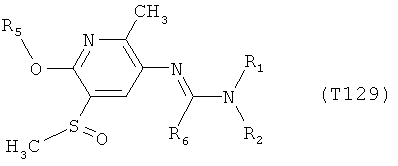
в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 130: В этой таблице описаны 526 соединений Т130.1.1-Т130.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 131: В этой таблице описаны 526 соединений Т131.1.1-Т131.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 132: В этой таблице описаны 526 соединений Т132.1.1-Т132.1.526 формулы
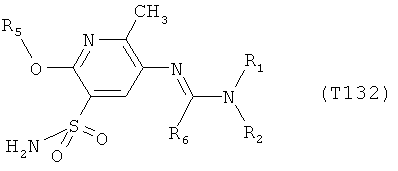
в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 133: В этой таблице описаны 526 соединений Т133.1.1-Т133.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 134: В этой таблице описаны 526 соединений Т134.1.1-Т134.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 135: В этой таблице описаны 526 соединений Т135.1.1-Т135.1.526 формулы
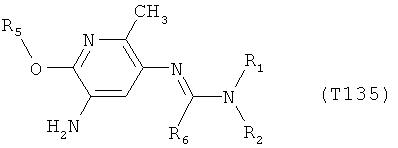
в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 136: В этой таблице описаны 526 соединений Т136.1.1-Т136.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 137: В этой таблице описаны 526 соединений Т137.1.1-Т137.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 138: В этой таблице описаны 526 соединений Т138.1.1-Т138.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 139: В этой таблице описаны 526 соединений Т139.1.1-Т139.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 140: В этой таблице описаны 526 соединений Т140.1.1-Т140.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 141: В этой таблице описаны 526 соединений Т141.1.1-Т141.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 142: В этой таблице описаны 526 соединений Т142.1.1-Т142.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 143: В этой таблице описаны 526 соединений Т143.1.1-Т143.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 144: В этой таблице описаны 526 соединений Т144.1.1-Т144.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 145: В этой таблице описаны 526 соединений Т145.1.1-Т145.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 146: В этой таблице описаны 526 соединений Т146.1.1-Т146.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 147: В этой таблице описаны 526 соединений Т147.1.1-Т147.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 148: В этой таблице описаны 526 соединений Т148.1.1-Т148.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 149: В этой таблице описаны 526 соединений Т149.1.1-Т149.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 150: В этой таблице описаны 526 соединений Т150.1.1-Т150.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Таблица 151: В этой таблице описаны 526 соединений Т151.1.1-Т151.1.526 формулы

в которой для каждого из этих конкретных 526 соединений каждая из переменных R1, R2, R5 и R6 обладает конкретным значением, указанным в соответствующей строке, соответственно выбранной из 526 строк A.1.1-А.1.526 таблицы А.
Примеры препаратов соединений формулы I:
Примеры F-1.1-F-1.3: Эмульгирующиеся концентраты
Из этих концентратов путем разбавления водой можно получить эмульсии любой необходимой концентрации.
Пример F-2: Эмульгирующийся концентрат
Из этого концентрата путем разбавления водой можно получить эмульсии любой необходимой концентрации.
Примеры F-3.1-F-3.4: Растворы
Эти растворы пригодны для применения в виде микрокапелек.
Примеры F-4.1-F-4.4: Грануляты
Новое соединение растворяют в дихлорметане, раствор разбрызгивают на носитель и затем растворитель удаляют путем отгонки в вакууме.
Примеры F-5.1 и F-5.2: Дусты
Готовые для применения дусты получают тщательным смешиванием всех компонентов.
Примеры F-6.1-F-6.3: Смачивающиеся порошки
Все компоненты смешивают и смесь тщательно размалывают на подходящей мельнице и получают смачивающиеся порошки, которые можно разбавить водой и получить суспензии необходимой концентрации.
Пример F7: Текучий концентрат для обработки семян
Тонкоизмельченный активный ингредиент тщательно смешивают со вспомогательными веществами и получают концентрат суспензии, из которого путем разбавления водой можно получить суспензии любого необходимого разведения. С помощью таких разбавленных систем живые растения, а также материал для размножения растений можно обработать и защитить от заражения микроорганизмами путем опрыскивания, полива или погружения.
Активность композиций, предлагаемых в настоящем изобретении, можно значительно расширить и изменить в соответствии с преобладающими условиями путем прибавления других инсектицидно, акарицидно и/или фунгицидно активных ингредиентов. Смеси соединений формулы I с другими инсектицидно, акарицидно и/или фунгицидно активными ингредиентами также могут обладать дополнительными неожиданными преимуществами, которые в широком смысле можно описать, как синергетическую активность. Например, они могут характеризоваться лучшей переносимостью растениями, сниженной фитотоксичностью, тем, что насекомых можно уничтожать на разных стадиях развития, или они будут обладать лучшими характеристиками во время приготовления, например, во время размола или смешивания, во время их хранения или во время их применения.
Подходящими добавками к предлагаемым в настоящем изобретении активным ингредиентам являются, например, представители следующих классов активных ингредиентов: фосфорорганические соединения, производные нитрофенола, тиомочевины, ювенильные гормоны, формамидины, производные бензофенона, мочевины, производные пиррола, карбаматы, пиретроиды, хлорированные углеводороды, ацилмочевины, производные пиридилметиленамина, макролиды, неоникотиноиды и препараты Bacillus thuringiensis.
Предпочтительными являются следующие смеси соединений формулы I с активными ингредиентами (аббревиатура "ТХ" означает "одно соединение, выбранное из группы, включающей соединения, приведенные в таблице Р, и соединения, описывающиеся формулами Т1-Т151, приведенные в таблицах 1-151, представленных в настоящем изобретении"):
вспомогательное вещество, выбранное из группы веществ, включающей минеральные масла (альтернативное название) (628) + ТХ,
акарицид, выбранный из группы веществ, включающей 1,1-бис(4-хлорфенил)-2-этоксиэтанол (название по номенклатуре ИЮПАК) (910) + ТХ, 2,4-дихлорфенилбензолсульфонат (название по номенклатуре ИЮПАК/Chemical Abstracts) (1059) + ТХ, 2-фтор-N-метил-N-1-нафтилацетамид (название по номенклатуре ИЮПАК) (1295) + ТХ, 4-хлорфенилфенилсульфон (название по номенклатуре ИЮПАК) (981) + ТХ, абамектин (1) + ТХ, ацехиноцил (3) + ТХ, ацетопрол [CCN] + ТХ, акринатрин (9) + ТХ, альдикарб (16) + ТХ, альдоксикарб (863) + ТХ, альфа-циперметрин (202) + ТХ, амидитион (870) + ТХ, амидофлумет [CCN] + ТХ, амидотиоат (872) + ТХ, амитон (875) + ТХ, амитонгидрооксалат (875) + ТХ, амитраз (24) + ТХ, арамит (881) + ТХ, триоксид мышьяка (882) + ТХ, AVI 382 (код соединения) + ТХ, AZ 60541 (код соединения) + ТХ, азинфос-этил (44) + ТХ, азинфос-метил (45) + ТХ, азобензол (название по номенклатуре ИЮПАК) (888) + ТХ, азоциклотин (46) + ТХ, азотоат (889) + ТХ, беномил (62) + ТХ, беноксафос (альтернативное название) [CCN] + ТХ, бензоксимат (71) + ТХ, бензилбензоат (название по номенклатуре ИЮПАК) [CCN] + ТХ, бифенизат (74) + ТХ, бифентрин (76) + ТХ, бинапакрил (907) + ТХ, брофенвалерат (альтернативное название) + ТХ, бромоциклен (918) + ТХ, бромофос (920) + ТХ, бромофос-этил (921) + ТХ, бромпропилат (94) + ТХ, бупрофезин (99) + ТХ, бутокарбоксим (103) + ТХ, бутоксикарбоксим (104) + ТХ, бутилпиридабен (альтернативное название) + ТХ, полисульфид кальция (название по номенклатуре ИЮПАК) (111) + ТХ, камфехлор (941) + ТХ, карбанолат (943) + ТХ, карбарил (115) + ТХ, карбофуран (118) + ТХ, карбофенотион (947) + ТХ, CGA 50'439 (научно-исследовательский код) (125) + ТХ, хинометионат (126) + ТХ, хлорбензид (959) + ТХ, хлордимеформ (964) + ТХ, хлордимеформгидрохлорид (964) + ТХ, хлорфенапир (130) + ТХ, хлорфенетол (968) + ТХ, хлорфенсон (970) + ТХ, хлорфенсульфид (971) + ТХ, хлорфенвинфос (131) + ТХ, хлорбензилат (975) + ТХ, хлормебуформ (977) + ТХ, хлорметиурон (978) + ТХ, хлорпропилат (983) + ТХ, хлорпирифос (145) + ТХ, хлорпирифос-метил (146) + ТХ, хлортиофос (994) + ТХ, цинерин I (696) + ТХ, цинерин II (696) + ТХ, цинерины (696) + ТХ, клофентезин (158) + ТХ, клозантел (альтернативное название) [CCN] + ТХ, кумафос (174) + ТХ, кротамитон (альтернативное название) [CCN] + TX, кротоксифос (1010) + ТХ, куфранеб (1013) + ТХ, циантоат (1020) + ТХ, цифлуметофен (CAS Reg. No.: 400882-07-7) + ТХ, цигалотрин (196) + ТХ, цигексантин (199) + ТХ, циперметрин (201) + ТХ, DCPM (1032) + ТХ, ДДТ (219) + ТХ, демефион (1037) + ТХ, демефион-O (1037) + ТХ, демефион-S (1037) + ТХ, деметон (1038) + ТХ, деметон-метил (224) + ТХ, деметон-O (1038) + ТХ, деметон-O-метил (224) + ТХ, деметон-S (1038) + ТХ, деметон-S-метил (224) + ТХ, деметон-S-метилсульфон (1039) + ТХ, диафентиурон (226) + ТХ, диалифос (1042) + ТХ, диазинон (227) + ТХ, дихлофлуанид (230) + ТХ, дихлорвос (236) + ТХ, диклифос (альтернативное название) + ТХ, дикофол (242) + ТХ, дикротофос (243) + ТХ, диенохлор (1071) + ТХ, димефокс (1081) + ТХ, диметоат (262) + ТХ, динактин (альтернативное название) (653) + ТХ, динекс (1089) + ТХ, динекс-диклексин (1089) + ТХ, динобутон (269) + ТХ, динокап (270) + ТХ, динокап-4 [CCN] + ТХ, динокап-6 [CCN] + ТХ, диноктон (1090) + ТХ, динопентон (1092) + ТХ, диносульфон (1097) + ТХ, динотербон (1098) + ТХ, диоксатион (1102) + ТХ, дифенилсульфон (название по номенклатуре ИЮПАК) (1103) + ТХ, дисульфирам (альтернативное название) [CCN] + ТХ, дисульфотон (278) + ТХ, DNOC (282) + ТХ, дофенапин (1113) + ТХ, дорамектин (альтернативное название) [CCN] + ТХ, эндосульфан (294) + ТХ, эндотион (1121) + ТХ, EPN (297) + ТХ, эприномектин (альтернативное название) [CCN] + ТХ, этион (309) + ТХ, этоат-метил (1134) + ТХ, этоксазол (320) + ТХ, этримфос (1142) + ТХ, феназафлор (1147) + ТХ, феназахин (328) + ТХ, фенбутаноксид (330) + ТХ, фенотиокарб (337) + ТХ, фенпропатрин (342) + ТХ, фенпирад (альтернативное название) + ТХ, фенпироксимат (345) + ТХ, фензон (1157) + ТХ, фентрифанил (1161) + ТХ, фенвалерат (349) + ТХ, фипронил (354) + ТХ, флуакрипирим (360) + ТХ, флуазурон (1166) + ТХ, флубензимин (1167) + ТХ, флуциклоксурон (366) + ТХ, флуцитринат (367) + ТХ, флуенетил (1169) + ТХ, флуфеноксурон (370) + ТХ, флуметрин (372) + ТХ, фторбензид (1174) + ТХ, флувалинат (1184) + ТХ, FMC 1137 (научно-исследовательский код) (1185) + ТХ, форметанат (405) + ТХ, форметанатгидрохлорид (405) + ТХ, формотион (1192) + ТХ, формпаранат (1193) + ТХ, гамма-НСН (430) + ТХ, глиодин (1205) + ТХ, галфенпрокс (424) + ТХ, гептенофос (432) + ТХ, гексадецилциклопропанкарбоксилат (название по номенклатуре ИЮПАК/Chemical Abstracts) (1216) + ТХ, гексилтиазокс (441) + ТХ, йодметан (название по номенклатуре ИЮПАК) (542) + ТХ, изокарбофос (альтернативное название) (473) + ТХ, изопропил O-(метоксиаминотиофосфорил)салицилат (название по номенклатуре ИЮПАК) (473) + ТХ, ивермектин (альтернативное название) [CCN] + ТХ, жасмолин I (696) + ТХ, жасмолин II (696) + ТХ, йодфенфос (1248) + ТХ, линдан (430) + ТХ, луфенурон (490) + ТХ, малатион (492) + ТХ, малонобен (1254) + ТХ, мекарбам (502) + ТХ, мефосфолан (1261) + ТХ, месульфен (альтернативное название) [CCN] + ТХ, метакрифос (1266) + ТХ, метамидофос (527) + ТХ, метидатион (529) + ТХ, метиокарб (530) + ТХ, метомил (531) + ТХ, метилбромид (537) + ТХ, метолкарб (550) + ТХ, мевинфос (556) + ТХ, мексакарбат (1290) + ТХ, милбемектин (557) + ТХ, милбемициноксим (альтернативное название) [CCN] + ТХ, мипафокс (1293) + ТХ, монокротофос (561) + ТХ, морфотион (1300) + ТХ, моксидектин (альтернативное название) [CCN] + ТХ, налед (567) + ТХ, NC-184 (код соединения) + ТХ, NC-512 (код соединения) + ТХ, нифлуридид (1309) + ТХ, никкомицины (альтернативное название) [CCN] + ТХ, нитрилакарб (1313) + ТХ, комплекс нитрилакарб:хлорид цинка состава 1:1 (1313) + ТХ, NNI-0101 (код соединения) + ТХ, NNI-0250 (код соединения) + ТХ, ометоат (594) + ТХ, оксамил (602) + ТХ, оксидепрофос (1324) + ТХ, оксидисульфотон (1325) + ТХ, пп'-ДДТ (219) + ТХ, паратион (615) + ТХ, перметрин (626) + ТХ, минеральные масла (альтернативное название) (628) + ТХ, фенкаптон (1330) + ТХ, фентоат (631) + ТХ, форат (636) + ТХ, фосалон (637) + ТХ, фосфолан (1338) + ТХ, фосмет (638) + ТХ, фосфамидон (639) + ТХ, фоксим (642) + ТХ, пиримифос-метил (652) + ТХ, полихлортерпены (традиционное название) (1347) + ТХ, полинактины (альтернативное название) (653) + ТХ, проклонол (1350) + ТХ, профенофос (662) + ТХ, промацил (1354) + ТХ, пропаргит (671) + ТХ, пропетамфос (673) + ТХ, пропоксур (678) + ТХ, протидатион (1360) + ТХ, протоат (1362) + ТХ, пиретрин I (696) + ТХ, пиретрин II (696) + ТХ, пиретрины (696) + ТХ, пиридабен (699) + ТХ, пиридафентион (701) + ТХ, пиримидифен (706) + ТХ, пиримитат (1370) + ТХ, хиналфос (711) + ТХ, хинтиофос (1381) + ТХ, R-1492 (научно-исследовательский код) (1382) + ТХ, RA-17 (научно-исследовательский код) (1383) + ТХ, ротенон (722) + ТХ, шрадан (1389) + ТХ, себуфос (альтернативное название) + ТХ, селамектин (альтернативное название) [CCN] + ТХ, SI-0009 (код соединения) + ТХ, софамид (1402) + ТХ, спиродиклофен (738) + ТХ, спиромезифен (739) + ТХ, SSI-121 (научно-исследовательский код) (1404) + ТХ, сульфирам (альтернативное название) [CCN] + ТХ, сульфлурамид (750) + ТХ, сульфотеп (753) + ТХ, серу (754) + ТХ, SZI-121 (научно-исследовательский код) (757) + ТХ, тау-флувалинат (398) + ТХ, тебуфенпирад (763) + ТХ, ТЕРР (1417) + ТХ, тербам (альтернативное название) + ТХ, тетрахлорвинфос (777) + ТХ, тетрадифон (786) + ТХ, тетранактин (альтернативное название) (653) + ТХ, тетрасул (1425) + ТХ, тиафенокс (альтернативное название) + ТХ, тиокарбоксим (1431) + ТХ, тиофанокс (800) + ТХ, тиометон (801) + ТХ, тиохинокс (1436) + ТХ, турингенсин (альтернативное название) [CCN] + ТХ, триамифос (1441) + ТХ, триаратен (1443) + ТХ, триазофос (820) + ТХ, триазурон (альтернативное название) + ТХ, трихлорфон (824) + ТХ, трифенофос (1455) + ТХ, тринактин (альтернативное название) (653) + ТХ, вамидотион (847) + ТХ, ванилипрол [CCN] и YI-5302 (код соединения) + ТХ,
альгицид, выбранный из группы веществ, включающей бетоксазин [CCN] + ТХ, диоктаноат меди (название по номенклатуре ИЮПАК) (170) + ТХ, сульфат меди (172) + ТХ, цибутрин [CCN] + ТХ, дихлон (1052) + ТХ, дихлорофен (232) + ТХ, эндотал (295) + ТХ, фентин (347) + ТХ, гашеную известь [CCN] + ТХ, набам (566) + ТХ, хинокламин (714) + ТХ, хинонамид (1379) + ТХ, симазин (730) + ТХ, трифенилоловоацетат (название по номенклатуре ИЮПАК) (347) и трифенилоловогидроксид (название по номенклатуре ИЮПАК) (347) + ТХ,
антигельминтик, выбранный из группы веществ, включающей абамектин (1) + ТХ, круфомат (1011) + ТХ, дорамектин (альтернативное название) [CCN] + ТХ, эмамектин (291) + ТХ, эмамектинбензоат (291) + ТХ, эприномектин (альтернативное название) [CCN] + ТХ, ивермектин (альтернативное название) [CCN] + ТХ, милбемициноксим (альтернативное название) [CCN] + ТХ, моксидектин (альтернативное название) [CCN] + ТХ, пиперазин [CCN] + ТХ, селамектин (альтернативное название) [CCN] + ТХ, спиносад (737) и тиофанат (1435) + ТХ,
авицид, выбранный из группы веществ, включающей хлоралозу (127) + ТХ, эндрин (1122) + ТХ, фентион (346) + ТХ, пиридин-4-амин (название по номенклатуре ИЮПАК) (23) и стрихнин (745) + ТХ,
бактерицид, выбранный из группы веществ, включающей 1-гидрокси-1Н-пиридин-2-тион (название по номенклатуре ИЮПАК) (1222) + ТХ, 4-(хиноксалин-2-иламино)бензолсульфонамид (название по номенклатуре ИЮПАК) (748) + ТХ, 8-гидроксихинолинсульфат (446) + ТХ, бронопол (97) + ТХ, диоктаноат меди (название по номенклатуре ИЮПАК) (170) + ТХ, гидроксид меди (название по номенклатуре ИЮПАК) (169) + ТХ, крезол [CCN] + ТХ, дихлорофен (232) + ТХ, дипиритион (1105) + ТХ, додицин (1112) + ТХ, фенаминосульф (1144) + ТХ, формальдегид (404) + ТХ, гидраргафен (альтернативное название) [CCN] + ТХ, касугамицин (483) + ТХ, касугамицингидрохлоридгидрат (483) + ТХ, бис(диметилдитиокарбамат) никеля (название по номенклатуре ИЮПАК) (1308) + ТХ, нитрапирин (580) + ТХ, октилинон (590) + ТХ, оксолиновую кислоту (606) + ТХ, окситетрациклин (611) + ТХ, гидроксихинолинсульфат калия (446) + ТХ, пробеназол (658) + ТХ, стрептомицин (744) + ТХ, стрептомицинсесквисульфат (744) + ТХ, теклофталам (766) + ТХ, и тиомерсал (альтернативное название) [CCN] + ТХ,
биологический агент, выбранный из группы веществ, включающей Adoxophyes orana GV (альтернативное название) (12) + ТХ, Agrobacterium radiobacter (альтернативное название) (13) + ТХ, Amblyseius spp. (альтернативное название) (19) + ТХ, Anagrapha falcifera NPV (альтернативное название) (28) + ТХ, Anagrus atomus (альтернативное название) (29) + ТХ, Aphelinus abdominalis (альтернативное название) (33) + ТХ, Aphidius colemani (альтернативное название) (34) + ТХ, Aphidoletes aphidimyza (альтернативное название) (35) + ТХ, Autographa californica NPV (альтернативное название) (38) + ТХ, Bacillus firmus (альтернативное название) (48) + ТХ, Bacillus sphaericus Neide (научное название) (49) + ТХ, Bacillus thuringiensis Berliner (научное название) (51) + ТХ, Bacillus thuringiensis подвид aizawai (научное название) (51) + ТХ, Bacillus thuringiensis подвид israelensis (научное название) (51) + ТХ, Bacillus thuringiensis подвид japonensis (научное название) (51) + ТХ, Bacillus thuringiensis подвид kurstaki (научное название) (51) + ТХ, Bacillus thuringiensis подвид tenebrionis (научное название) (51) + ТХ, Beauveria bassiana (альтернативное название) (53) + ТХ, Beauveria brongniartii (альтернативное название) (54) + ТХ, Chrysoperla cornea (альтернативное название) (151) + ТХ, Cryptolaemus montrouzieri (альтернативное название) (178) + ТХ, Cydia pomonella GV (альтернативное название) (191) + ТХ, Dacnusa sibirica (альтернативное название) (212) + ТХ, Diglyphus isaea (альтернативное название) (254) + ТХ, Encarsia formosa (научное название) (293) + ТХ, Eretmocerus eremicus (альтернативное название) (300) + ТХ, Helicoverpa zea NPV (альтернативное название) (431) + ТХ, Heterorhabditis bacteriophora и H.megidis (альтернативное название) (433) + ТХ, Hippodamia convergens (альтернативное название) (442) + ТХ, Leptomastix dactylopii (альтернативное название) (488) + ТХ, Macrolophus caliginosus (альтернативное название) (491) + ТХ, Mamestra brassicae NPV (альтернативное название) (494) + ТХ, Metaphycus helvolus (альтернативное название) (522) + ТХ, Metarhizium anisopliae разновидность acridum (научное название) (523) + ТХ, Metarhizium anisopliae разновидность anisopliae (научное название) (523) + ТХ, Neodiprion sertifer NPV и N.lecontei NPV (альтернативное название) (575) + ТХ, Orius spp. (альтернативное название) (596) + ТХ, Paecilomyces fumosoroseus (альтернативное название) (613) + ТХ, Phytoseiulus persimilis (альтернативное название) (644) + ТХ, Spodoptera exigua, мультикапсидный вирус ядерного полигидроза (научное название) (741) + ТХ, Steinernema bibionis (альтернативное название) (742) + ТХ, Steinernema carpocapsae (альтернативное название) (742) + ТХ, Steinernema feltiae (альтернативное название) (742) + ТХ, Steinernema glaseri (альтернативное название) (742) + ТХ, Steinernema riobrave (альтернативное название) (742) + ТХ, Steinernema riobravis (альтернативное название) (742) + ТХ, Steinernema scapterisci (альтернативное название) (742) + ТХ, Steinernema spp. (альтернативное название) (742) + ТХ, Trichogramma spp. (альтернативное название) (826) + ТХ, Typhlodromus occidentalis (альтернативное название) (844) и Verticillium lecanii (альтернативное название) (848) + ТХ,
почвенный стерилизатор, выбранный из группы веществ, включающей йодметан (название по номенклатуре ИЮПАК) (542) и метилбромид (537) + ТХ,
химический стерилизатор, выбранный из группы веществ, включающей афолат [CCN] + ТХ, бисазир (альтернативное название) [CCN] + ТХ, бусульфан (альтернативное название) [CCN] + ТХ, дифлубензурон (250) + ТХ, диматиф (альтернативное название) [CCN] + ТХ, хемель [CCN] + ТХ, хемпа [CCN] + ТХ, метепа [CCN] + ТХ, метиотепа [CCN] + ТХ, метилафолат [CCN] + ТХ, морзид [CCN] + ТХ, пенфлурон (альтернативное название) [CCN] + ТХ, тепа [CCN] + ТХ, тиохемпа (альтернативное название) [CCN] + ТХ, тиотепа (альтернативное название) [CCN] + ТХ, третамин (альтернативное название) [CCN] и уредепа (альтернативное название) [CCN] + ТХ,
феромон насекомых, выбранный из группы веществ, включающей (E)-дец-5-ен-1-илацетат с (Е)-дец-5-ен-1-олом (название по номенклатуре ИЮПАК) (222) + ТХ, (E)-тридец-4-ен-1-илацетат (название по номенклатуре ИЮПАК) (829) + ТХ, (E)-6-метилгепт-2-ен-4-ол (название по номенклатуре ИЮПАК) (541) + ТХ, (Е + ТХ, Z)-тетрадека-4 + ТХ, 10-диен-1-илацетат (название по номенклатуре ИЮПАК) (779) + ТХ, (2)-додец-7-ен-1-илацетат (название по номенклатуре ИЮПАК) (285) + ТХ, (Z)-гексадец-11-еналь (название по номенклатуре ИЮПАК) (436) + ТХ, (Z)-гексадец-11-ен-1-илацетат (название по номенклатуре ИЮПАК) (437) + ТХ, (Z)-гексадец-13-ен-11-ин-1-илацетат (название по номенклатуре ИЮПАК) (438) + ТХ, (Z)-икоз-13-ен-10-он (название по номенклатуре ИЮПАК) (448) + ТХ, (Z)-тетрадец-7-ен-1-аль (название по номенклатуре ИЮПАК) (782) + ТХ, (Z)-тетрадец-9-ен-1-ол (название по номенклатуре ИЮПАК) (783) + ТХ, (Z)-тетрадец-9-ен-1-илацетат (название по номенклатуре ИЮПАК) (784) + ТХ, (7E + ТХ, 9Z)-додека-7 + ТХ, 9-диен-1-илацетат (название по номенклатуре ИЮПАК) (283) + ТХ, (9Z + ТХ, 11Е)-тетрадека-9 + ТХ, 11-диен-1-илацетат (название по номенклатуре ИЮПАК) (780) + ТХ, (9Z + ТХ, 12E)-тетрадека-9 + ТХ, 12-диен-1-илацетат (название по номенклатуре ИЮПАК) (781) + ТХ, 14-метилоктадец-1-ен (название по номенклатуре ИЮПАК) (545) + ТХ, 4-метилнонан-5-ол с 4-метилнонан-5-оном (название по номенклатуре ИЮПАК) (544) + ТХ, альфа-мультистриатин (альтернативное название) [CCN] + ТХ, бревикомин (альтернативное название) [CCN] + ТХ, кодлелур (альтернативное название) [CCN] + ТХ, кодлемон (альтернативное название) (167) + ТХ, куелур (альтернативное название) (179) + ТХ, диспарлур (277) + ТХ, додец-8-ен-1-илацетат (название по номенклатуре ИЮПАК) (286) + ТХ, додец-9-ен-1-илацетат (название по номенклатуре ИЮПАК) (287) + ТХ, додека-8 + ТХ, 10-диен-1-илацетат (название по номенклатуре ИЮПАК) (284) + ТХ, доминикалур (альтернативное название) [CCN] + ТХ, этил-4-метилоктаноат (название по номенклатуре ИЮПАК) (317) + ТХ, эвгенол (альтернативное название) [CCN] + ТХ, фронталин (альтернативное название) [CCN] + ТХ, госсиплур (альтернативное название) (420) + ТХ, грандлур (421) + ТХ, грандлур I (альтернативное название) (421) + ТХ, грандлур II (альтернативное название) (421) + ТХ, грандлур III (альтернативное название) (421) + ТХ, грандлур IV (альтернативное название) (421) + ТХ, гексалур [CCN] + ТХ, ипсдиенол (альтернативное название) [CCN] + ТХ, ипсенол (альтернативное название) [CCN] + ТХ, джапонилур (альтернативное название) (481) + ТХ, линеатин (альтернативное название) [CCN] + ТХ, литлур (альтернативное название) [CCN] + ТХ, лоплур (альтернативное название) [CCN] + ТХ, медлур [CCN] + ТХ, мегатомоевую кислоту (альтернативное название) [CCN] + ТХ, метилэвгенол (альтернативное название) (540) + ТХ, мускалур (563) + ТХ, октадека-2 + ТХ, 13-диен-1-илацетат (название по номенклатуре ИЮПАК) (588) + ТХ, октадека-3 + ТХ, 13-диен-1-илацетат (название по номенклатуре ИЮПАК) (589) + ТХ, орфралур (альтернативное название) [CCN] + ТХ, орикталур (альтернативное название) (317) + ТХ, острамон (альтернативное название) [CCN] + ТХ, сиглур [CCN] + ТХ, сордидин (альтернативное название) (736) + ТХ, сулкатол (альтернативное название) [CCN] + ТХ, тетрадец-11-ен-1-илацетат (название по номенклатуре ИЮПАК) (785) + ТХ, тримедлур (839) + ТХ, тримедлур А (альтернативное название) (839) + ТХ, тримедлур B1 (альтернативное название) (839) + ТХ, тримедлур В2 (альтернативное название) (839) + ТХ, тримедлур С (альтернативное название) (839) и trunc-call (альтернативное название) [CCN] + ТХ,
репеллент для насекомых, выбранный из группы веществ, включающей 2-(октилтио)этанол (название по номенклатуре ИЮПАК) (591) + ТХ, бутопироноксил (933) + ТХ, бутокси(полипропиленгликоль) (936) + ТХ, дибутиладипат (название по номенклатуре ИЮПАК) (1046) + ТХ, дибутилфталат (1047) + ТХ, дибутилсукцинат (название по номенклатуре ИЮПАК) (1048) + ТХ, диэтилтолуамид [CCN] + ТХ, диметилкарбат [CCN] + ТХ, диметилфталат [CCN] + ТХ, этилгександиол (1137) + ТХ, гексамид [CCN] + ТХ, метохин-бутил (1276) + ТХ, метилнеодеканамид [CCN] + ТХ, оксамат [CCN] и пикардин [CCN] + ТХ,
инсектицид, выбранный из группы веществ, включающей 1 + ТХ, 1-дихлор-1-нитроэтан (название по номенклатуре ИЮПАК/Chemical Abstracts) (1058) + ТХ, 1 + ТХ, 1-дихлор-2 + ТХ, 2-бис(4-этилфенил)этан (название по номенклатуре ИЮПАК) (1056) + ТХ, 1 + ТХ, 2-дихлорпропан (название по номенклатуре ИЮПАК/Chemical Abstracts) (1062) + ТХ, 1 + ТХ, 2-дихлорпропан с 1 + ТХ, 3-дихлорпропен (название по номенклатуре ИЮПАК) (1063) + ТХ, 1-бром-2-хлорэтан (название по номенклатуре ИЮПАК/Chemical Abstracts) (916) + ТХ, 2 + ТХ, 2 + ТХ, 2-трихлор-1-(3 + ТХ, 4-дихлорфенил)этилацетат (название по номенклатуре ИЮПАК) (1451) + ТХ, 2 + ТХ, 2-дихлорвинил-2-этилсульфинилэтилметилфосфат (название по номенклатуре ИЮПАК) (1066) + ТХ, 2-(1 + ТХ, 3-дитиолан-2-ил)фенилдиметилкарбамат (название по номенклатуре ИЮПАК/Chemical Abstracts) (1109) + ТХ, 2-(2-бутоксиэтокси)этилтиоцианат (название по номенклатуре ИЮПАК/Chemical Abstracts) (935) + ТХ, 2-(4 + ТХ, 5-диметил-1 + ТХ, 3-диоксолан-2-ил)фенилметилкарбамат (название по номенклатуре ИЮПАК/Chemical Abstracts) (1084) + ТХ, 2-(4-хлор-3 + ТХ, 5-ксилилокси)этанол (название по номенклатуре ИЮПАК) (986) + ТХ, 2-хлорвинилдиэтилфосфат (название по номенклатуре ИЮПАК) (984) + ТХ, 2-имидазолидон (название по номенклатуре ИЮПАК) (1225) + ТХ, 2-изовалерилиндан-1 + ТХ, 3-дион (название по номенклатуре ИЮПАК) (1246) + ТХ, 2-метил(проп-2-инил)аминофенилметилкарбамат (название по номенклатуре ИЮПАК) (1284) + ТХ, 2-тиоцианатоэтиллаурат (название по номенклатуре ИЮПАК) (1433) + ТХ, 3-бром-1-хлорпроп-1-ен (название по номенклатуре ИЮПАК) (917) + ТХ, 3-метил-1-фенилпиразол-5-илдиметилкарбамат (название по номенклатуре ИЮПАК) (1283) + ТХ, 4-метил(проп-2-инил)амино-3 + ТХ, 5-ксилилметилкарбамат (название по номенклатуре ИЮПАК) (1285) + ТХ, 5 + ТХ, 5-диметил-3-оксоциклогекс-1-енилдиметилкарбамат (название по номенклатуре ИЮПАК) (1085) + ТХ, абамектин (1) + ТХ, ацефат (2) + ТХ, ацетамиприд (4) + ТХ, асэтион (альтернативное название) [CCN] + ТХ, ацетопрол [CCN] + ТХ, акринатрин (9) + ТХ, акрилонитрил (название по номенклатуре ИЮПАК) (861) + ТХ, аланикарб (15) + ТХ, альдикарб (16) + ТХ, альдоксикарб (863) + ТХ, альдрин (864) + ТХ, аллетрин (17) + ТХ, аллосамидин (альтернативное название) [CCN] + ТХ, алликсикарб (866) + ТХ, альфа-циперметрин (202) + ТХ, альфа-экдизон (альтернативное название) [CCN] + ТХ, фосфид алюминия (640) + ТХ, амидитион (870) + ТХ, амидотиоат (872) + ТХ, аминокарб (873) + ТХ, амитон (875) + ТХ, амитонгидрооксалат (875) + ТХ, амитраз (24) + ТХ, анабазин (877) + ТХ, атидатион (883) + ТХ, AVI 382 (код соединения) + ТХ, AZ 60541 (код соединения) + ТХ, азадирахтин (альтернативное название) (41) + ТХ, азаметифос (42) + ТХ, азинфос-этил (44) + ТХ, азинфос-метил (45) + ТХ, азотоат (889) + ТХ, дельта-эндотоксины Bacillus thuringiensis (альтернативное название) (52) + ТХ, гексафторсиликат бария (альтернативное название) [CCN] + ТХ, полисульфид бария (название по номенклатуре ИЮПАК/Chemical Abstracts) (892) + ТХ, бартрин [CCN] + ТХ, Bayer 22/190 (научно-исследовательский код) (893) + ТХ, Bayer 22408 (научно-исследовательский код) (894) + ТХ, бендиокарб (58) + ТХ, бенфуракарб (60) + ТХ, бенсултап (66) + ТХ, бета-цифлутрин (194) + ТХ, бета-циперметрин (203) + ТХ, бифентрин (76) + ТХ, биоаллетрин (78) + ТХ, S-циклопентенильный изомер биоаллетрина (альтернативное название) (79) + ТХ, биоэтанометрин [CCN] + ТХ, биоперметрин (908) + ТХ, биоресметрин (80) + ТХ, бис(2-хлорэтиловый) эфир (название по номенклатуре ИЮПАК) (909) + ТХ, бистрифлурон (83) + ТХ, буру (86) + ТХ, брофенвалерат (альтернативное название) + ТХ, бромфенвинфос (914) + ТХ, бромоциклен (918) + ТХ, бром-ДДТ (альтернативное название) [CCN] + ТХ, бромофос (920) + ТХ, бромофос-этил (921) + ТХ, буфенкарб (924) + ТХ, бупрофезин (99) + ТХ, бутакарб (926) + ТХ, бутатиофос (927) + ТХ, бутокарбоксим (103) + ТХ, бутонат (932) + ТХ, бутоксикарбоксим (104) + ТХ, бутилпиридабен (альтернативное название) + ТХ, кадусафос (109) + ТХ, арсенат кальция [CCN] + ТХ, цианид кальция (444) + ТХ, полисульфид кальция (название по номенклатуре ИЮПАК) (111) + ТХ, камфехлор (941) + ТХ, карбанолат (943) + ТХ, карбарил (115) + ТХ, карбофуран (118) + ТХ, дисульфид углерода (название по номенклатуре ИЮПАК/Chemical Abstracts) (945) + ТХ, тетрахлорид углерода (название по номенклатуре ИЮПАК) (946) + ТХ, карбофенотион (947) + ТХ, карбосульфан (119) + ТХ, картап (123) + ТХ, картапгидрохлорид (123) + ТХ, цевадин (альтернативное название) (725) + ТХ, хлорбициклен (960) + ТХ, хлордан (128) + ТХ, хлордекон (963) + ТХ, хлордимеформ (964) + ТХ, хлордимеформгидрохлорид (964) + ТХ, хлорэтоксифос (129) + ТХ, хлорфенапир (130) + ТХ, хлорфенвинфос (131) + ТХ, хлорфлуазурон (132) + ТХ, хлормефос (136) + ТХ, хлороформ [CCN] + ТХ, хлорпикрин (141) + ТХ, хлорфоксим (989) + ТХ, хлорпразофос (990) + ТХ, хлорпирифос (145) + ТХ, хлорпирифос-метил (146) + ТХ, хлортиофос (994) + ТХ, хромафенозид (150) + ТХ, цинерин I (696) + ТХ, цинерин II (696) + ТХ, цинерины (696) + ТХ, цис-ресметрин (альтернативное название) + ТХ, цисметрин (80) + ТХ, клоцитрин (альтернативное название) + ТХ, клоэтокарб (999) + ТХ, клозантел (альтернативное название) [CCN] + ТХ, клотианидин (165) + ТХ, ацетоарсенит меди [CCN] + ТХ, арсенат меди [CCN] + ТХ, олеат меди [CCN] + ТХ, кумафос (174) + ТХ, кумитоат (1006) + ТХ, кротамитон (альтернативное название) [CCN] + ТХ, кротоксифос (1010) + ТХ, круфомат (1011) + ТХ, криолит (альтернативное название) (177) + ТХ, CS 708 (научно-исследовательский код) (1012) + ТХ, цианофенфос (1019) + ТХ, цианофос (184) + ТХ, циантоат (1020) + ТХ, циклетрин [CCN] + ТХ, циклопротрин (188) + ТХ, цифлутрин (193) + ТХ, цигалотрин (196) + ТХ, циперметрин (201) + ТХ, цифенотрин (206) + ТХ, циромазин (209) + ТХ, цитиоат (альтернативное название) [CCN] + ТХ, d-лимонен (альтернативное название) [CCN] + ТХ, d-тетраметрин (альтернативное название) (788) + ТХ, DAEP (1031) + ТХ, дазомет (216) + ТХ, ДДТ (219) + ТХ, декарбофуран (1034) + ТХ, дельтаметрин (223) + ТХ, демефион (1037) + ТХ, демефион-O (1037) + ТХ, демефион-S (1037) + ТХ, деметон (1038) + ТХ, деметон-метил (224) + ТХ, деметон-O (1038) + ТХ, деметон-O-метил (224) + ТХ, деметон-S (1038) + ТХ, деметон-S-метил (224) + ТХ, деметон-S-метилсульфон (1039) + ТХ, диафентиурон (226) + ТХ, диалифос (1042) + ТХ, диамидафос (1044) + ТХ, диазинон (227) + ТХ, дикаптон (1050) + ТХ, дихлофентион (1051) + ТХ, дихлорвос (236) + ТХ, диклифос (альтернативное название) + ТХ, дикрезил (альтернативное название) [CCN] + ТХ, дикротофос (243) + ТХ, дицикланил (244) + ТХ, диэльдрин (1070) + ТХ, диэтил-5-метилпиразол-3-илфосфат (название по номенклатуре ИЮПАК) (1076) + ТХ, дифлубензурон (250) + ТХ, дилор (альтернативное название) [CCN] + ТХ, димефлутрин [CCN] + ТХ, димефокс (1081) + ТХ, диметан (1085) + ТХ, диметоат (262) + ТХ, диметрин (1083) + ТХ, диметилвинфос (265) + ТХ, диметилан (1086) + ТХ, динекс (1089) + ТХ, динекс-диклексин (1089) + ТХ, динопроп (1093) + ТХ, диносам (1094) + ТХ, диносеб (1095) + ТХ, динотефуран (271) + ТХ, диофенолан (1099) + ТХ, диоксабензофос (1100) + ТХ, диоксакарб (1101) + ТХ, диоксатион (1102) + ТХ, дисульфотон (278) + ТХ, дитикрофос (1108) + ТХ, DNOC (282) + ТХ, дорамектин (альтернативное название) [CCN] + ТХ, DSP (1115) + ТХ, экдистерон (альтернативное название) [CCN] + ТХ, EI 1642 (научно-исследовательский код) (1118) + ТХ, эмамектин (291) + ТХ, эмамектинбензоат (291) + ТХ, ЕМРС (1120) + ТХ, эмпентрин (292) + ТХ, эндосульфан (294) + ТХ, эндотион (1121) + ТХ, эндрин (1122) + ТХ, ЕРВР (1123) + ТХ, EPN (297) + ТХ, эпофенонан (1124) + ТХ, эприномектин (альтернативное название) [CCN] + ТХ, эсфенвалерат (302) + ТХ, этафос (альтернативное название) [CCN] + ТХ, этиофенкарб (308) + ТХ, этион (309) + ТХ, этипрол (310) + ТХ, этоат-метил (1134) + ТХ, этопрофос (312) + ТХ, этилформиат (название по номенклатуре ИЮПАК) [CCN] + ТХ, этил-DDD (альтернативное название) (1056) + ТХ, этилендибромид (316) + ТХ, этилендихлорид (химическое название) (1136) + ТХ, этиленоксид [CCN] + ТХ, этофенпрокс (319) + ТХ, этримфос (1142) + ТХ, EXD (1143) + ТХ, фампур (323) + ТХ, фенамифос (326) + ТХ, феназафлор (1147) + ТХ, фенхлорофос (1148) + ТХ, фенэтакарб (1149) + ТХ, фенфлутрин (1150) + ТХ, фенитротион (335) + ТХ, фенобукарб (336) + ТХ, феноксакрим (1153) + ТХ, феноксикарб (340) + ТХ, фенпиритрин (1155) + ТХ, фенпропатрин (342) + ТХ, фенпирад (альтернативное название) + ТХ, фенсульфотион (1158) + ТХ, фентион (346) + ТХ, фентион-этил [CCN] + ТХ, фенвалерат (349) + ТХ, фипронил (354) + ТХ, флоникамид (358) + ТХ, флубендиамид (регистрационный № CAS: 272451-65-7) + ТХ, флукофурон (1168) + ТХ, флуциклоксурон (366) + ТХ, флуцитринат (367) + ТХ, флуенетил (1169) + ТХ, флуфенерим [CCN] + ТХ, флуфеноксурон (370) + ТХ, флуфенпрокс (1171) + ТХ, флуметрин (372) + ТХ, флувалинат (1184) + ТХ, FMC 1137 (научно-исследовательский код) (1185) + ТХ, фонофос (1191) + ТХ, форметанат (405) + ТХ, форметанатгидрохлорид (405) + ТХ, формотион (1192) + ТХ, формпаранат (1193) + ТХ, фосметилан (1194) + ТХ, фоспират (1195) + ТХ, фостиазат (408) + ТХ, фостиетан (1196) + ТХ, фуратиокарб (412) + ТХ, фуретрин (1200) + ТХ, гамма-цигалотрин (197) + ТХ, гамма-НСН (430) + ТХ, гуазатин (422) + ТХ, гуазатинацетаты (422) + ТХ, GY-81 (научно-исследовательский код) (423) + ТХ, галфенпрокс (424) + ТХ, галофенозид (425) + ТХ, НСН (430) + ТХ, HEOD (1070) + ТХ, гептахлор (1211) + ТХ, гептенофос (432) + ТХ, гетерофос [CCN] + ТХ, гексафлумурон (439) + ТХ, HHDN (864) + ТХ, гидраметилнон (443) + ТХ, цианид водорода (444) + ТХ, гидропрен (445) + ТХ, хиквинкарб (1223) + ТХ, имидаклоприд (458) + ТХ, имипротрин (460) + ТХ, индоксакарб (465) + ТХ, йодметан (название по номенклатуре ИЮПАК) (542) + ТХ, IPSP (1229) + ТХ, изазофос (1231) + ТХ, изобензан (1232) + ТХ, изокарбофос (альтернативное название) (473) + ТХ, изодрин (1235) + ТХ, изофенфос (1236) + ТХ, изолан (1237) + ТХ, изопрокарб (472) + ТХ, изопропил O-(метоксиаминотиофосфорил)салицилат (название по номенклатуре ИЮПАК) (473) + ТХ, изопротиолан (474) + ТХ, изотиоат (1244) + ТХ, изоксатион (480) + ТХ, ивермектин (альтернативное название) [CCN] + ТХ, жасмолин I (696) + ТХ, жасмолин II (696) + ТХ, йодфенфос (1248) + ТХ, ювенильный гормон I (альтернативное название) [CCN] + ТХ, ювенильный гормон II (альтернативное название) [CCN] + ТХ, ювенильный гормон III (альтернативное название) [CCN] + ТХ, келеван (1249) + ТХ, кинопрен (484) + ТХ, лямбда-цигалотрин (198) + ТХ, арсенат свинца [CCN] + ТХ, лепимецитин (CCN) + ТХ, лептофос (1250) + ТХ, линдан (430) + ТХ, лиримфос (1251) + ТХ, луфенурон (490) + ТХ, литидатион (1253) + ТХ, м-куменилметилкарбамат (название по номенклатуре ИЮПАК) (1014) + ТХ, фосфид магния (название по номенклатуре ИЮПАК) (640) + ТХ, малатион (492) + ТХ, малонобен (1254) + ТХ, мазидокс (1255) + ТХ, мекарбам (502) + ТХ, мекарфон (1258) + ТХ, меназон (1260) + ТХ, мефосфолан (1261) + ТХ, хлорид ртути (I) (513) + ТХ, месульфенфос (1263) + ТХ, метафлумизон (CCN) + ТХ, метам (519) + ТХ, метам-калий (альтернативное название) (519) + ТХ, метам-натрий (519) + ТХ, метакрифос (1266) + ТХ, метамидофос (527) + ТХ, метансульфонилфторид (название по номенклатуре ИЮПАК/Chemical Abstracts) (1268) + ТХ, метидатион (529) + ТХ, метиокарб (530) + ТХ, метокротофос (1273) + ТХ, метомил (531) + ТХ, метопрен (532) + ТХ, метохин-бутил (1276) + ТХ, метотрин (альтернативное название) (533) + ТХ, метоксихлор (534) + ТХ, метоксифенозид (535) + ТХ, метилбромид (537) + ТХ, метилизотиоцианат (543) + ТХ, метилхлороформ (альтернативное название) [CCN] + ТХ, метиленхлорид [CCN] + ТХ, метофлутрин [CCN] + ТХ, метолкарб (550) + ТХ, метоксадиазон (1288) + ТХ, мевинфос (556) + ТХ, мексакарбат (1290) + ТХ, милбемектин (557) + ТХ, милбемициноксим (альтернативное название) [CCN] + ТХ, мипафокс (1293) + ТХ, мирекс (1294) + ТХ, монокротофос (561) + ТХ, морфотион (1300) + ТХ, моксидектин (альтернативное название) [CCN] + ТХ, нафталофос (альтернативное название) [CCN] + ТХ, налед (567) + ТХ, нафталин (название по номенклатуре ИЮПАК/Chemical Abstracts) (1303) + ТХ, NC-170 (научно-исследовательский код) (1306) + ТХ, NC-184 (код соединения) + ТХ, никотин (578) + ТХ, никотинсульфат (578) + ТХ, нифлуридид (1309) + ТХ, нитенпирам (579) + ТХ, нитиазин (1311) + ТХ, нитрилакарб (1313) + ТХ, комплекс нитрилакарб:хлорид цинка состава 1:1 (1313) + ТХ, NNI-0101 (код соединения) + ТХ, NNI-0250 (код соединения) + ТХ, норникотин (традиционное название) (1319) + ТХ, новалурон (585) + ТХ, новифлумурон (586) + ТХ, O-5-дихлор-4-йодфенил-O-этилэтилфосфонотиоат (название по номенклатуре ИЮПАК) (1057) + ТХ, O,O-диэтил-O-4-метил-2-оксо-2Н-хромен-7-илфосфоротиоат (название по номенклатуре ИЮПАК) (1074) + ТХ, O,O-иэтил-O-6-метил-2-пропилпиримидин-4-илфосфоротиоат (название по номенклатуре ИЮПАК) (1075) + ТХ, O,O,O',O'-тетрапропилдитиопирофосфат (название по номенклатуре ИЮПАК) (1424) + ТХ, олеиновую кислоту (название по номенклатуре ИЮПАК) (593) + ТХ, ометоат (594) + ТХ, оксамил (602) + ТХ, оксидеметон-метил (609) + ТХ, оксидепрофос (1324) + ТХ, оксидисульфотон (1325) + ТХ, пп'-ДДТ (219) + ТХ, пара-дихлорбензол [CCN] + ТХ, паратион (615) + ТХ, паратион-метил (616) + ТХ, пенфлурон (альтернативное название) [CCN] + ТХ, пентахлорнитрофенол (623) + ТХ, пентахлорфениллаурат (название по номенклатуре ИЮПАК) (623) + ТХ, перметрин (626) + ТХ, минеральные масла (альтернативное название) (628) + ТХ, РН 60-38 (научно-исследовательский код) (1328) + ТХ, фенкаптон (1330) + ТХ, фенотрин (630) + ТХ, фентоат (631) + ТХ, форат (636) + ТХ, фосалон (637) + ТХ, фосфолан (1338) + ТХ, фосмет (638) + ТХ, фоснихлор (1339) + ТХ, фосфамидон (639) + ТХ, фосфин (название по номенклатуре ИЮПАК) (640) + ТХ, фоксим (642) + ТХ, фоксим-метил (1340) + ТХ, пириметафос (1344) + ТХ, пиримикарб (651) + ТХ, пиримифос-этил (1345) + ТХ, пиримифос-метил (652) + ТХ, изомеры полихлордициклопентадиена (название по номенклатуре ИЮПАК) (1346) + ТХ, полихлортерпены (традиционное название) (1347) + ТХ, арсенит калия [CCN] + ТХ, тиоцианат калия [CCN] + ТХ, праллетрин (655) + ТХ, прекоцен I (альтернативное название) [CCN] + ТХ, прекоцен II (альтернативное название) [CCN] + ТХ, прекоцен III (альтернативное название) [CCN] + ТХ, примидофос (1349) + ТХ, профенофос (662) + ТХ, профлутрин [CCN] + ТХ, промацил (1354) + ТХ, промекарб (1355) + ТХ, пропафос (1356) + ТХ, пропетамфос (673) + ТХ, пропоксур (678) + ТХ, протидатион (1360) + ТХ, протиофос (686) + ТХ, протоат (1362) + ТХ, протрифенбут [CCN] + ТХ, пиметрозин (688) + ТХ, пираклофос (689) + ТХ, пиразофос (693) + ТХ, пиресметрин (1367) + ТХ, пиретрин I (696) + ТХ, пиретрин II (696) + ТХ, пиретрины (696) + ТХ, пиридабен (699) + ТХ, пиридалил (700) + ТХ, пиридафентион (701) + ТХ, пиримидифен (706) + ТХ, пиримитат (1370) + ТХ, пирипроксифен (708) + ТХ, кассия (альтернативное название) [CCN] + ТХ, хиналфос (711) + ТХ, хиналфос-метил (1376) + ТХ, хинотион (1380) + ТХ, хинтиофос (1381) + ТХ, R-1492 (научно-исследовательский код) (1382) + ТХ, рафоксанид (альтернативное название) [CCN] + ТХ, ресметрин (719) + ТХ, ротенон (722) + ТХ, RU 15525 (научно-исследовательский код) (723) + ТХ, RU 25475 (научно-исследовательский код) (1386) + ТХ, риания (альтернативное название) (1387) + ТХ, рианодин (традиционное название) (1387) + ТХ, сабадилла (альтернативное название) (725) + ТХ, шрадан (1389) + ТХ, себуфос (альтернативное название) + ТХ, селамектин (альтернативное название) [CCN] + ТХ, SI-0009 (код соединения) + ТХ, SI-0205 (код соединения) + ТХ, SI-0404 (код соединения) + ТХ, SI-0405 (код соединения) + ТХ, силафлуофен (728) + ТХ, SN 72129 (научно-исследовательский код) (1397) + ТХ, арсенит натрия [CCN] + ТХ, цианид натрия (444) + ТХ, фторид натрия (название по номенклатуре ИЮПАК/Chemical Abstracts) (1399) + ТХ, гексафторсиликат натрия (1400) + ТХ, пентахлорфеноксид натрия (623) + ТХ, селенат натрия (название по номенклатуре ИЮПАК) (1401) + ТХ, тиоцианат натрия [CCN] + ТХ, софамид (1402) + ТХ, спиносад (737) + ТХ, спиромезифен (739) + ТХ, спиротетрмат (CCN) + ТХ, сулкофурон (746) + ТХ, сулкофурон-натрий (746) + ТХ, сульфлурамид (750) + ТХ, сульфотеп (753) + ТХ, сульфурилфторид (756) + ТХ, сульпрофос (1408) + ТХ, смоляные масла (альтернативное название) (758) + ТХ, тау-флувалинат (398) + ТХ, тазимкарб (1412) + ТХ, TDE (1414) + ТХ, тебуфенозид (762) + ТХ, тебуфенпирад (763) + ТХ, тебупиримфос (764) + ТХ, тефлубензурон (768) + ТХ, тефлутрин (769) + ТХ, темефос (770) + ТХ, ТЕРР (1417) + ТХ, тераллетрин (1418) + ТХ, тербам (альтернативное название) + ТХ, тербуфос (773) + ТХ, тетрахлорэтан [CCN] + ТХ, тетрахлорвинфос (777) + ТХ, тетраметрин (787) + ТХ, тета-циперметрин (204) + ТХ, тиаклоприд (791) + ТХ, тиафенокс (альтернативное название) + ТХ, тиаметоксам (792) + ТХ, тикрофос (1428) + ТХ, тиокарбоксим (1431) + ТХ, тиоциклам (798) + ТХ, тиоцикламгидрооксалат (798) + ТХ, тиодикарб (799) + ТХ, тиофанокс (800) + ТХ, тиометон (801) + ТХ, тионазин (1434) + ТХ, тиосултап (803) + ТХ, тиосултап-натрий (803) + ТХ, турингенсин (альтернативное название) [CCN] + ТХ, толфенпирад (809) + ТХ, тралометрин (812) + ТХ, трансфлутрин (813) + ТХ, трансперметрин (1440) + ТХ, триамифос (1441) + ТХ, триазамат (818) + ТХ, триазофос (820) + ТХ, триазурон (альтернативное название) + ТХ, трихлорфон (824) + ТХ, трихлорметафос-3 (альтернативное название) [CCN] + ТХ, трихлоронат (1452) + ТХ, трифенофос (1455) + ТХ, трифлумурон (835) + ТХ, триметакарб (840) + ТХ, трипрен (1459) + ТХ, вамидотион (847) + ТХ, ванилипрол [CCN] + ТХ, вератридин (альтернативное название) (725) + ТХ, вератрин (альтернативное название) (725) + ТХ, ХМС (853) + ТХ, ксилилкарб (854) + ТХ, YI-5302 (код соединения) + ТХ, зета-циперметрин (205) + ТХ, зетаметрин (альтернативное название) + ТХ, фосфид цинка (640) + ТХ, золапрофос (1469) и ZXI 8901 (научно-исследовательский код) (858) + ТХ,
моллюскоцид, выбранный из группы веществ, включающей бис(трибутилолово)оксид (название по номенклатуре ИЮПАК) (913) + ТХ, бромацетамид [CCN] + ТХ, арсенат кальция [CCN] + ТХ, клоэтокарб (999) + ТХ, ацетоарсенит меди [CCN] + ТХ, сульфат меди (172) + ТХ, фентин (347) + ТХ, фосфат железа (II) (название по номенклатуре ИЮПАК) (352) + ТХ, метальдегид (518) + ТХ, метиокарб (530) + ТХ, никлосамид (576) + ТХ, нитрозамид-оламин (576) + ТХ, пентахлорнитрофенол (623) + ТХ, пентахлорфеноксид натрия (623) + ТХ, тазимкарб (1412) + ТХ, тиодикарб (799) + ТХ, трибутилоловооксид (913) + ТХ, трифенморф (1454) + ТХ, триметакарб (840) + ТХ, трифенилоловоацетат (название по номенклатуре ИЮПАК) (347) и трифенилоловогидроксид (название по номенклатуре ИЮПАК) (347) + ТХ,
нематоцид, выбранный из группы веществ, включающей AKD-3088 (код соединения) + ТХ, 1 + ТХ, 2-дибром-3-хлорпропан (название по номенклатуре ИЮПАК/Chemical Abstracts) (1045) + ТХ, 1 + ТХ, 2-дихлорпропан (название по номенклатуре ИЮПАК/Chemical Abstracts) (1062) + ТХ, 1 + ТХ, 2-дихлорпропан с 1 + ТХ, 3-дихлорпропен (название по номенклатуре ИЮПАК) (1063) + ТХ, 1 + ТХ, 3-дихлорпропен (233) + ТХ, 3 + ТХ, 4-дихлортетрагидротиофен 1 + ТХ, 1-диоксид (название по номенклатуре ИЮПАК/Chemical Abstracts) (1065) + ТХ, 3-(4-хлорфенил)-5-метилроданин (название по номенклатуре ИЮПАК) (980) + ТХ, 5-метил-6-тиоксо-1 + ТХ, 3 + ТХ, 5-тиадиазинан-3-илуксусную кислоту (название по номенклатуре ИЮПАК) (1286) + ТХ, 6-изопентиламинопурин (альтернативное название) (210) + ТХ, абамектин (1) + ТХ, ацетопрол [CCN] + ТХ, аланикарб (15) + ТХ, альдикарб (16) + ТХ, альдоксикарб (863) + ТХ, AZ 60541 (код соединения) + ТХ, бенклотиаз [CCN] + ТХ, беномил (62) + ТХ, бутилпиридабен (альтернативное название) + ТХ, кадусафос (109) + ТХ, карбофуран (118) + ТХ, дисульфид углерода (945) + ТХ, карбосульфан (119) + ТХ, хлорпикрин (141) + ТХ, хлорпирифос (145) + ТХ, клоэтокарб (999) + ТХ, цитокинины (альтернативное название) (210) + ТХ, дазомет (216) + ТХ, DBCP (1045) + ТХ, DCIP (218) + ТХ, диамидафос (1044) + ТХ, дихлофентион (1051) + ТХ, диклифос (альтернативное название) + ТХ, диметоат (262) + ТХ, дорамектин (альтернативное название) [CCN] + ТХ, эмамектин (291) + ТХ, эмамектинбензоат (291) + ТХ, эприномектин (альтернативное название) [CCN] + ТХ, этопрофос (312) + ТХ, этилендибромид (316) + ТХ, фенамифос (326) + ТХ, фенпирад (альтернативное название) + ТХ, фенсульфотион (1158) + ТХ, фостиазат (408) + ТХ, фостиетан (1196) + ТХ, фурфураль (альтернативное название) [CCN] + ТХ, GY-81 (научно-исследовательский код) (423) + ТХ, гетерофос [CCN] + ТХ, йодметан (название по номенклатуре ИЮПАК) (542) + ТХ, изамидофос (1230) + ТХ, изазофос (1231) + ТХ, ивермектин (альтернативное название) [CCN] + ТХ, кинетин (альтернативное название) (210) + ТХ, мекарфон (1258) + ТХ, метам (519) + ТХ, метам-калий (альтернативное название) (519) + ТХ, метам-натрий (519) + ТХ, метилбромид (537) + ТХ, метилизотиоцианат (543) + ТХ, милбемициноксим (альтернативное название) [CCN] + ТХ, моксидектин (альтернативное название) [CCN] + ТХ, композиция Myrothecium verrucaria (альтернативное название) (565) + ТХ, NC-184 (код соединения) + ТХ, оксамил (602) + ТХ, форат (636) + ТХ, фосфамидон (639) + ТХ, фосфонокарб [CCN] + ТХ, себуфос (альтернативное название) + ТХ, селамектин (альтернативное название) [CCN] + ТХ, спиносад (737) + ТХ, тербам (альтернативное название) + ТХ, тербуфос (773) + ТХ, тетрахлортиофен (название по номенклатуре ИЮПАК/Chemical Abstracts) (1422) + ТХ, тиафенокс (альтернативное название) + ТХ, тионазин (1434) + ТХ, триазофос (820) + ТХ, триазурон (альтернативное название) + ТХ, ксиленолы [CCN] + ТХ, YI-5302 (код соединения) и зеатин (альтернативное название) (210) + ТХ,
ингибитор нитрификации, выбранный из группы веществ, включающей этилксантат калия [CCN] и нитрапирин (580) + ТХ,
активатор растений, выбранный из группы веществ, включающей ацибензолар (6) + ТХ, ацибензолар-S-метил (6) + ТХ, пробеназол (658) и экстракт Reynoutria sachalinensis (альтернативное название) (720) + ТХ,
родентицид, выбранный из группы веществ, включающей 2-изовалерилиндан-1 + ТХ, 3-дион (название по номенклатуре ИЮПАК) (1246) + ТХ, 4-(хиноксалин-2-иламино)бензолсульфонамид (название по номенклатуре ИЮПАК) (748) + ТХ, альфа-хлоргидрин [CCN] + ТХ, фосфид алюминия (640) + ТХ, анту (880) + ТХ, триоксид мышьяка (882) + ТХ, карбонат бария (891) + ТХ, бистиосеми (912) + ТХ, бродифакум (89) + ТХ, бромадиолон (91) + ТХ, брометалин (92) + ТХ, цианид кальция (444) + ТХ, хлоралозу (127) + ТХ, хлорофацинон (140) + ТХ, холекальциферол (альтернативное название) (850) + ТХ, кумахлор (1004) + ТХ, кумафурил (1005) + ТХ, куматетралил (175) + ТХ, кримидин (1009) + ТХ, дифенакум (246) + ТХ, дифетиалон (249) + ТХ, дифацинон (273) + ТХ, эргокальциферол (301) + ТХ, флокумафен (357) + ТХ, фторацетамид (379) + ТХ, флупропадин (1183) + ТХ, флупропадингидрохлорид (1183) + ТХ, гамма-НСН (430) + ТХ, НСН (430) + ТХ, цианид водорода (444) + ТХ, йодметан (название по номенклатуре ИЮПАК) (542) + ТХ, линдан (430) + ТХ, фосфид магния (название по номенклатуре ИЮПАК) (640) + ТХ, метилбромид (537) + ТХ, норбормид (1318) + ТХ, фосацетим (1336) + ТХ, фосфин (название по номенклатуре ИЮПАК) (640) + ТХ, фосфор [CCN] + ТХ, пиндон (1341) + ТХ, арсенит калия [CCN] + ТХ, пиринурон (1371) + ТХ, сциллирозид (1390) + ТХ, арсенит натрия [CCN] + ТХ, цианид натрия (444) + ТХ, фторацетат натрия (735) + ТХ, стрихнин (745) + ТХ, сульфат таллия [CCN] + ТХ, варфарин (851) и фосфид цинка (640) + ТХ,
синергетик, выбранный из группы веществ, включающей 2-(2-бутоксиэтокси)этилпиперонилат (название по номенклатуре ИЮПАК) (934) + ТХ, 5-(1 + ТХ, 3-бензодиоксол-5-ил)-3-гексилциклогекс-2-енон (название по номенклатуре ИЮПАК) (903) + ТХ, фарнезол с неролидолом (альтернативное название) (324) + ТХ, МВ-599 (научно-исследовательский код) (498) + ТХ, MGK 264 (научно-исследовательский код) (296) + ТХ, пиперонилбутоксид (649) + ТХ, пипротал (1343) + ТХ, изомер пропила (1358) + ТХ, S421 (научно-исследовательский код) (724) + ТХ, сезамекс (1393) + ТХ, сезасмолин (1394) и сульфоксид (1406) + ТХ,
репеллент для животных, выбранный из группы веществ, включающей антрахинон (32) + ТХ, хлоралозу (127) + ТХ, нафтенат меди [CCN] + ТХ, оксихлорид меди (171) + ТХ, диазинон (227) + ТХ, дициклопентадиен (химическое название) (1069) + ТХ, гуазатин (422) + ТХ, гуазатинацетаты (422) + ТХ, метиокарб (530) + ТХ, пиридин-4-амин (название по номенклатуре ИЮПАК) (23) + ТХ, тирам (804) + ТХ, триметакарб (840) + ТХ, нафтенат цинка [CCN] и зирам (856) + ТХ,
вируцид, выбранный из группы веществ, включающей иманин (альтернативное название) [CCN] и рибавирин (альтернативное название) [CCN] + ТХ,
протравитель ран растений, выбранный из группы веществ, включающей оксид ртути (II) (512) + ТХ, октилинон (590) и тиофанат-метил (802) + ТХ,
инсектицид, выбранный из группы, включающей соединения формулы А-1





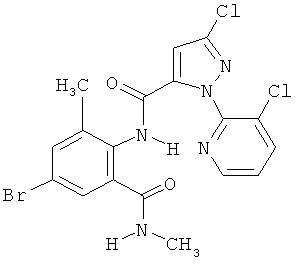







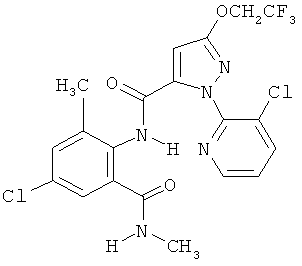










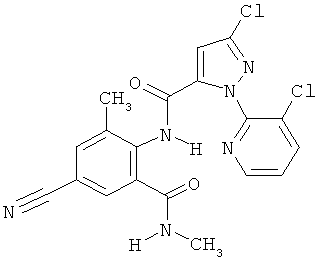

и биологически активные соединения, выбранные из группы, включающей глифосат [1071-83-6] и его соли (диаммониевая [69254-40-6]) изопропиламмониевая [38641-94-0], моноаммониевая [40465-66-5], калиевая [70901-20-1], сесквинатриевая [70393-85-0], тримезиевая[81591-81-3]), глуфосинат [52676-47-2] и его соли (например, аммониевая [77182-82-2]), азаконазол (60207-31-0] + ТХ, битертанол [70585-36-3] + ТХ, бромуконазол [116255-48-2] + ТХ, ципроконазол [94361-06-5] + ТХ, дифеноконазол [119446-68-3] + ТХ, диниконазол [83657-24-3] + ТХ, эпоксиконазол [106325-08-0] + ТХ, фенбуконазол [114369-43-6] + ТХ, флухинконазол [136426-54-5] + ТХ, флусилазол [85509-19-9] + ТХ, флутриафол [76674-21-0] + ТХ, гексаконазол [79983-71-4] + ТХ, имазалил [35554-44-0] + ТХ, имибенконазол [86598-92-7] + ТХ, ипконазол [125225-28-7] + ТХ, метконазол [125116-23-6] + ТХ, миклобутанил [88671-89-0] + ТХ, перфуразоат [101903-30-4] + ТХ, пенконазол [66246-88-6] + ТХ, протиоконазол [178928-70-6] + ТХ, пирифенокс [88283-41-4] + ТХ, прохлораз [67747-09-5] + ТХ, пропиконазол [60207-90-1] + ТХ, симеконазол [149508-90-7] + ТХ, тебуконазол [107534-96-3] + ТХ, тетраконазол [112281-77-3] + ТХ, триадимефон [43121-43-3] + ТХ, триадименол [55219-65-3] + ТХ, трифлумизол [99387-89-0] + ТХ, тритиконазол [131983-72-7] + ТХ, анцимидол [12771-68-5] + ТХ, фенаримол [60168-88-9] + ТХ, нуаримол [63284-71-9] + ТХ, бупиримат [41483-43-6] + ТХ, диметиримол [5221-53-4] + ТХ, этиримол [23947-60-6] + ТХ, додеморф [1593-77-7] + ТХ, фенпропидин [67306-00-7] + ТХ, фенпропиморф [67564-91-4] + ТХ, спироксамин [118134-30-8] + ТХ, тридеморф [81412-43-3] + ТХ, ципродинил [121552-61-2] + ТХ, мепанипирим [110235-47-7] + ТХ, пириметанил [53112-28-0] + ТХ, фенпиклонил [74738-17-3] + ТХ, флудиоксонил [152641-86-1] + ТХ, беналаксил [71626-11-4] + ТХ, фуралаксил [57646-30-7] + ТХ, металаксил [57837-19-1] + ТХ, R-металаксил [70630-17-0] + ТХ, офурац [58810-48-3] + ТХ, оксадиксил [77732-09-3] + ТХ, беномил [17804-35-2] + ТХ, карбендазим [10605-21-7] + ТХ, дебакарб [62732-91-6] + ТХ, фуберидазол [3878-19-1] + ТХ, тиабендазол [148-79-8] + ТХ, хлозолинат [84332-86-5] + ТХ, дихлозолин [24201-58-9] + ТХ, ипродион [36734-19-7] + ТХ, миклозолин [54864-61-8] + ТХ, процимидон [32809-16-8] + ТХ, винклозолин [50471-44-8] + ТХ, боскалид [188425-85-6] + ТХ, карбоксин [5234-68-4] + ТХ, фенфурам [24691-80-3] + ТХ, флутоланил [66332-96-5] + ТХ, мепронил [55814-41-0] + ТХ, оксикарбоксин [5259-88-1] + ТХ, пентиопирад [183675-82-3] + ТХ, тифлузамид [130000-40-7] + ТХ, гуазатин [108173-90-6] + ТХ, додин [2439-10-3] [112-65-2] (free base) + ТХ, иминоктадин [13516-27-3] + ТХ, азоксистробин [131860-33-8] + ТХ, димоксистробин [149961-52-4] + ТХ, энестробурин {Proc. ВСРС, Int. Congr., Glasgow, 2003, 1, 93} + ТХ, флуоксастробин [361377-29-9] + ТХ, крезоксим-метил [143390-89-0] + ТХ, метоминостробин [133408-50-1] + ТХ, трифлоксистробин [141517-21-7] + ТХ, орисастробин [248593-16-0] + ТХ, пикоксистробин [117428-22-5] + ТХ, пираклостробин [175013-18-0] + ТХ, фербам [14484-64-1] + ТХ, манкозеб [8018-01-7] + ТХ, манеб [12427-38-2] + ТХ, метирам [9006-42-2] + ТХ, пропинеб [12071-83-9] + ТХ, тирам [137-26-8] + ТХ, зинеб [12122-67-7] + ТХ, зирам [137-30-4] + ТХ, каптафол [2425-06-1] + ТХ, каптан [133-06-2] + ТХ, дихлофлуанид [1085-98-9] + ТХ, фторимид [41205-21-4] + ТХ, фолпет [133-07-3] + ТХ, толилфлуанид [731-27-1] + ТХ, бордосскую жидкость [8011-63-0] + ТХ, гидроксид меди [20427-59-2] + ТХ, оксихлорид меди [1332-40-7] + ТХ, сульфат меди [7758-98-7] + ТХ, оксид меди [1317-39-1] + ТХ, манкоппер [53988-93-5] + ТХ, оксинат меди [10380-28-6] + ТХ, динокап [131-72-6] + ТХ, нитротал-изопропил [10552-74-6] + ТХ, эдифенфос [17109-49-8] + ТХ, ипробенфос [26087-47-8] + ТХ, изопротиолан [50526-35-1] + ТХ, фосдифен [36519-00-3] + ТХ, пиразофос [13457-18-6] + ТХ, толклофос-метил [57018-04-9] + ТХ, ацибензолар-8-метил [135158-54-2] + ТХ, анилазин [101-05-3] + ТХ, бентиаваликарб [413615-35-7] + ТХ, бластицидин-S [2079-00-7] + ТХ, хинометионат [2439-01-2] + ТХ, хлоронеб [2675-77-6] + ТХ, хлороталонил [1897-45-6] + ТХ, цифлуфенамид [526409-60-3] + ТХ, цимоксанил [57966-95-7] + ТХ, дихлон [117-80-6] + ТХ, диклоцимет [139920-32-4] + ТХ, дикломезин [62865-36-5] + ТХ, диклоран [99-30-9] + ТХ, диэтофенкарб [87130-20-9] + ТХ, диметоморф [110488-70-5] + ТХ, SYP-LI90 (флуморф) [211867-47-9] + ТХ, дитианон [3347-22-6] + ТХ, этабоксам [162650-77-3] + ТХ, этридиазол [2593-15-9] + ТХ, фамоксадон [135267-57-3] + ТХ, фенамидон [161326-34-7] + ТХ, феноксанил [11585 2-48-7] + ТХ, фентин [668-34-8] + ТХ, феримзон [89269-64-7] + ТХ, флуазинам [79622-59-6] + ТХ, флуопиколид [239110-15-7] + ТХ, флусульфамид [106917-52-6] + ТХ, фенгексамид [126833-17-8] + ТХ, фосетил-алюминий [39148-24-8] + ТХ, гимексазол [10004-44-1] + ТХ, ипроваликарб [140923-17-7] + ТХ, IKF-916 (циазофамид) [120116-88-3] + ТХ, касугамицин [6980-18-3] + ТХ, метасульфокарб [66952-49-6] + ТХ, метрафенон [220899-03-6] + ТХ, пенцикурон [66063-05-6] + ТХ, фталид [27355-22-2] + ТХ, полиоксины [11113-80-7] + ТХ, пробеназол [27605-76-1] + ТХ, пропамокарб [25606-41-1] + ТХ, проквиназид [189278-12-4] + ТХ, пирохилон [57369-32-1] + ТХ, хиноксифен [124495-18-7] + ТХ, квинтоцен [82-68-8] + ТХ, сера [7704-34-9] + ТХ, тиадинил [223580-51-6] + ТХ, триазоксид [72459-58-6] + ТХ, трициклазол [41814-78-2] + ТХ, трифорин [26644-46-2] + ТХ, валидамицин [37248-47-8] + ТХ, зоксамид (RH7281) [156052-68-5] + ТХ, мандипропамид [374726-62-2] + ТХ, соединение формулы F-1

в которой Ra5 обозначает трифторметил или дифторметил (WO 2004/058723) + ТХ, соединение формулы F-2

в которой Ra6 обозначает трифторметил или дифторметил (WO 2004/058723) + ТХ, рацемическое соединение формулы F-3 (син)

в которой Ra7 обозначает трифторметил или дифторметил (WO 2004/035589) + ТХ,
рацемическая смесь формулы F-4 (анти)

в которой Ra7 обозначает трифторметил или дифторметил (WO 2004/035589) + ТХ, соединение формулы F-5
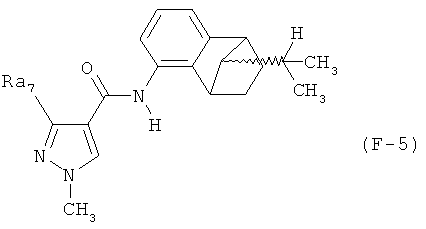
которое представляет собой эпимерную смесь рацемических соединений формул F-3 (син) и F-4 (анти), где отношение количеств рацемических соединений формулы F-3 (син) к количеству рацемических соединений формулы F-4 (анти) составляет от 1000:1 до 1:1000 и в которой Ra7 обозначает трифторметил или дифторметил (WO 2004/035589) + ТХ, соединение формулы F-6

в которой Ra8 обозначает трифторметил или дифторметил (WO 2004/035589) + ТХ,
рацемическое соединение формулы F-7 (транс)

в которой Ra9 обозначает трифторметил или дифторметил (WO 03/074491) + ТХ, рацемическое соединение формулы F-8 (цис)
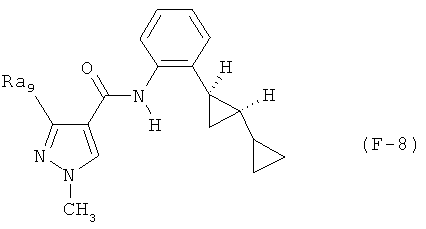
в которой Ra9 обозначает трифторметил или дифторметил (WO 03/074491) + ТХ, соединение формулы F-9

которое представляет собой смесь рацемических соединений формул F-7 (транс) и F-8 (цис), где отношение количества рацемического соединения формулы F-7 (транс) к количеству рацемического соединения формулы F-8 (цис) составляет от 2:1 до 100:1; и в которой Ra9 обозначает трифторметил или дифторметил (WO 03/074491) + ТХ,
соединение формулы F-10
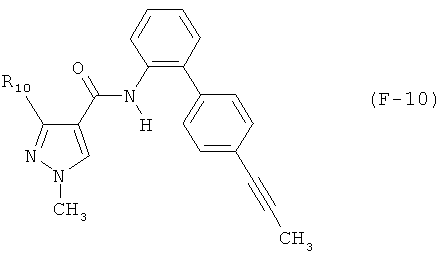
в которой R10 обозначает трифторметил или дифторметил (WO 2004/058723) + ТХ, рацемическое соединение формулы F-11 (транс)
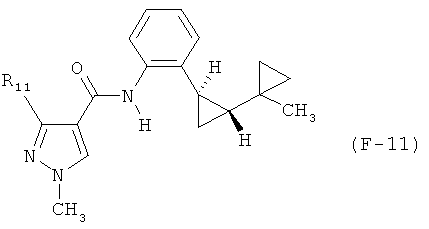
в которой R11 обозначает трифторметил или дифторметил (WO 03/074491) + ТХ, рацемическое соединение формулы F-12 (цис)

в которой R11 обозначает трифторметил или дифторметил (WO 03/074491) + ТХ, соединение формулы F-13

которое представляет собой рацемическую смесь формул F-11 (транс) и F-12 (цис), и в которой R11 обозначает трифторметил или дифторметил (WO 03/074491) + ТХ, соединение формулы F-14

(WO 2004/058723) + ТХ, и соединение формулы F-15

+ TX.
Ссылки в квадратных скобках после активных ингредиентов, например, [3878-19-1] означают регистрационный номер Chemical Abstracts. Соединения формул А-1-А-26 описаны в WO 03/015518 или в WO 04/067528. Указанные выше компоненты для смешивания являются известными. Если активные ингредиенты включены в публикацию "The Pesticide Manual" [The Pesticide Manual - A World Compendium; Thirteenth Edition; Editor: C.D.S.Tomlin; The British Crop Protection Council], то выше в настоящем изобретении они описаны с указанием в круглых скобках номера позиции для конкретного соединения; например, соединение "абамектин" описано с указанием номера позиции (1). Если выше в настоящем изобретении для конкретного соединения указано "[CCN]", то рассматриваемое соединение включено в публикацию "Compendium of Pesticide Common Names", с которой можно ознакомиться в Интернете [А.Wood; Compendium of Pesticide Common Names, Copyright © 1995-2004]; например, соединение "ацетопрол" описано в Интернете по адресу http://www.alanwood.net/pesticides/acetoprole.html.
Для большинства активных ингредиентов, описанных выше, в настоящем изобретении приведено так называемое "общепринятое название", в отдельных случаях используется соответствующее "общепринятое название ISO" или другое "общепринятое название". Если приведенное название не является "общепринятым названием", то характеристика названия, использованного вместо него для конкретного соединения, указана в круглых скобках; в этом случае используется название по номенклатуре ИЮПАК, название по номенклатуре ИЮПАК/Chemical Abstracts, "химическое название", "традиционное название", "название соединения" или "научно-исследовательский код" или, если не используется ни одно из этих названий и не используется "общепринятое название", то используется выражение "альтернативное название". "CAS Reg. No" означает регистрационный номер Chemical Abstracts.
Смесь активных ингредиентов - соединений формулы I, выбранных из таблиц T1-Т151, с активными ингредиентами, описанными выше, включает соединение, выбранное из таблиц T1-Т151, и активный ингредиент, описанный выше, предпочтительно в соотношении смешивания, составляющем от 100:1 до 1:6000, предпочтительно от 50:1 до 1:50, более предпочтительно в соотношении, составляющем от 20:1 до 1:20, еще более предпочтительно от 10:1 до 1:10, еще более предпочтительно от 5:1 до 1:5, особое предпочтение отдается соотношению, составляющему от 2:1 до 1:2, и соотношение, составляющее от 4:1 до 2:1, также является предпочтительным, прежде всего соотношение, составляющее 1:1, или 5:1, или 5:2, или 5:3, или 5:4, или 4:1, или 4:2, или 4:3, или 3:1, или 3:2, или 2:1, или 1:5, или 2:5, или 3:5, или 4:5, или 1:4, или 2:4, или 3:4, или 1:3, или 2:3, или 1:2, или 1:600, или 1:300, или 1:150, или 1:35, или 2:35, или 4:35, или 1:75, или 2:75, или 4:75, или 1:6000, или 1:3000, или 1:1500, или 1:350, или 2:350, или 4:350, или 1:750, или 2:750, или 4:750. Следует понимать, что эти соотношения смешивания включают, с одной стороны, массовые соотношения, а также, с другой стороны, молярные соотношения.
Смеси, включающие соединение формулы I, выбранное из таблиц T1-Т151, и один или большее количество активных ингредиентов, описанных выше, можно использовать например, в виде одной готовой к применению смеси, в виде комбинированной смеси для опрыскивания, составленной из отдельных препаратов активных ингредиентов поодиночке, такой как баковая смесь, и относится к комбинированному применению активных ингредиентов поодиночке при их нанесении последовательно, т.е. одного за другим через достаточно непродолжительный промежуток времени, такой как составляющий несколько часов или дней. При практическом осуществлении настоящего изобретения порядок внесения соединений формулы I, выбранных из таблиц T1-Т151, и активных ингредиентов, описанных выше, не является существенным.
Биологические примеры: фунгицидное воздействие
Пример В-1: Plasmopara viticola: Ложная мучнистая роса виноградной лозы, предупредительное исследование:
Plasmopara viticola (ложная мучнистая роса виноградной лозы): Диски листьев виноградной лозы помещали на агар в многолуночный планшет (24-луночный) и опрыскивали приготовленными исследуемыми растворами (2% диметилсульфоксид, 0,025% Tween 20). После сушки диски листьев инокулировали суспензией спор грибов (80000 конидий/мл). После соответствующего инкубационного периода предупредительную фунгицидную активность соединения оценивали через 6 дней после инокуляции, как вызванное болезнью повреждение дисков листьев, и рассчитывали, как выраженную в процентах эффективность по сравнению с необработанным инфицированным контрольным образцом. (0 = не происходит уничтожения Plasmopara viticola, 100% = полное уничтожение). В этом исследовании соединения, перечисленные в таблице Р, приведенной выше, обнаруживают хорошую активность. В частности соединение Р.10 обнаруживает активность, превышающую 50%, при норме расхода, равной 200 част./млн.
Пример В-2 Botrytis cinerea: Серая гниль, предупредительное исследование:
Botrytis cinerea (серая гниль): Диски листьев бобов помещали на агар в многолуночный планшет (24-луночный) и опрыскивали приготовленными исследуемыми растворами (2% диметилсульфоксид, 0,025% Tween 20). После сушки диски листьев инокулировали суспензией спор грибов (60000 конидий/мл). После соответствующего инкубационного периода предупредительную фунгицидную активность соединения оценивали через 3 дня после инокуляции, как вызванное болезнью повреждение дисков листьев, и рассчитывали, как выраженную в процентах эффективность по сравнению с необработанным инфицированным контрольным образцом. (0 = не происходит уничтожения Botrytis cinerea, 100% = полное уничтожение). В этом исследовании соединения, перечисленные в таблице Р, приведенной выше, обнаруживают хорошую активность. В частности соединение Р.29 обнаруживает активность, превышающую 50%, при норме расхода, равной 200 част./млн.
Пример В-3: Erysiphe graminis f.sp. tritici: Настоящая мучнистая роса пшеницы, предупредительное исследование:
Erysiphe graminis f.sp. tritici (настоящая мучнистая роса пшеницы): Сегменты листьев пшеницы помещали на агар в многолуночный планшет (24-луночный) и опрыскивали приготовленными исследуемыми растворами (2% диметилсульфоксид, 0,025% Tween 20). После сушки диски листьев инокулировали спорами грибов (50 конидий/мм2). После соответствующего инкубационного периода предупредительную фунгицидную активность соединения оценивали через 7 дней после инокуляции, как вызванное болезнью повреждение дисков листьев, и рассчитывали, как выраженную в процентах эффективность по сравнению с необработанным инфицированным контрольным образцом. (0 = не происходит уничтожения Erysiphe graminis f.sp. tritici, 100% = полное уничтожение). В этом исследовании соединения, перечисленные в таблице Р, приведенной выше, обнаруживают хорошую активность. В частности соединения Р.07, Р.09, Р.21, Р.22, Р.26, Р.28, Р.29, Р.30, Р.35, Р.59, Р.61, Р.62, Р.63, Р.64, Р.68, Р.69, Р.73, Р.76, Р.77, Р.78 и Р.82 обнаруживают активность, превышающую 50%, при норме расхода, равной 200 част./млн.
Пример В-4: Erysiphe graminis f.sp. hordei: Настоящая мучнистая роса ячменя, исследование излечивания:
Erysiphe graminis f.sp. hordei (настоящая мучнистая роса ячменя): Сегменты листьев ячменя помещали на агар в многолуночный планшет (24-луночный). Диски листьев инокулировали спорами грибов (120 конидий/мм2). Через 24 ч диски листьев опрыскивали приготовленными исследуемыми растворами (2% диметилсульфоксид, 0,025% Tween 20). После соответствующего инкубационного периода излечивающую фунгицидную активность соединения оценивали через 7 дней после инокуляции, как вызванное болезнью повреждение дисков листьев, и рассчитывали, как выраженную в процентах эффективность по сравнению с необработанным инфицированным контрольным образцом (0 = не происходит уничтожения Erysiphe graminis f.sp. hordei, 100% = полное уничтожение). В этом исследовании соединения, перечисленные в таблице Р, приведенной выше, обнаруживают хорошую активность. В частности соединения Р.01, Р.03, Р.04, Р.06, Р.07, Р.08, Р.11, Р.14, Р.15, Р.16, Р.17 и Р.19 обнаруживают активность, превышающую 50%, при норме расхода, равной 200 част./млн.
Пример В-5: Puccinia recondita: Бурая ржавчина пшеницы, предупредительное исследование:
Puccinia recondita (бурая ржавчина): Сегменты листьев пшеницы помещали на агар в многолуночный планшет (24-луночный) и опрыскивали приготовленными исследуемыми растворами (2% диметилсульфоксид, 0,025% Tween 20). После сушки диски листьев инокулировали суспензией спор грибов (45000 конидий/мл). После соответствующего инкубационного периода предупредительную фунгицидную активность соединения оценивали через 8 дней после инокуляции, как вызванное болезнью повреждение дисков листьев, и рассчитывали, как выраженную в процентах эффективность по сравнению с необработанным инфицированным контрольным образцом (0 = не происходит уничтожения Puccinia recondita, 100% = полное уничтожение). В этом исследовании соединения, перечисленные в таблице Р, приведенной выше, обнаруживают хорошую активность. В частности соединения Р.07, P.11, P.26, Р.28, Р.29, Р.31, Р.35, Р.51, Р.58, Р.59, Р.61, Р.62, Р.64, Р.70, Р.73, Р.76, Р.77, Р.79 и Р.82 обнаруживают активность, превышающую 50%, при норме расхода, равной 200 част./млн.
Пример В-6: Puccinia recondita: Бурая ржавчина пшеницы, исследование излечивания:
Описание методики исследования Puccinia recondita (бурая ржавчина):
Сегменты листьев пшеницы помещали на агар в многолуночный планшет (24-луночный). Затем диски листьев инокулировали суспензией спор грибов (45000 конидий/мл). Через день после инокуляции наносили приготовленный исследуемый раствор (2% диметилсульфоксид, 0,025% Tween 20). После соответствующего инкубационного периода излечивающую фунгицидную активность соединения оценивали через 8 дней после инокуляции, как вызванное болезнью повреждение дисков листьев, и рассчитывали, как выраженную в процентах эффективность по сравнению с необработанным инфицированным контрольным образцом (0 = не происходит уничтожения Puccinia recondita, 100% = полное уничтожение). В этом исследовании соединения, перечисленные в таблице Р, приведенной выше, обнаруживают хорошую активность. В частности соединения Р.26, Р.28, Р.29, Р.31, Р.35, Р.36, Р.41, Р.58, Р.59, Р.61, Р.62, Р.64, Р.69, Р.70.Р.73, Р.76, Р.77, Р.81 и Р.82 обнаруживают активность, превышающую 50%, при норме расхода, равной 200 част./млн.
Пример В-7: Phaeosphaeria nodorum: Пятнистость колосковой чешуи пшеницы, предупредительное исследование:
Описание методики исследования Phaeosphaeria nodorum (синонимы Septoria nodorum, Leptosphaeria nodorum), септориоз колосковой чешуи пшеницы (септориозная пятнистость листьев): Сегменты листьев пшеницы помещали на агар в многолуночный планшет (24-луночный) и опрыскивали приготовленными исследуемыми растворами (2% диметилсульфоксид, 0,025% Tween 20). После сушки диски листьев инокулировали суспензией спор грибов (500000 конидий/мл). После соответствующего инкубационного периода предупредительную фунгицидную активность соединения оценивали через 4 дня после инокуляции, как вызванное болезнью повреждение дисков листьев, и рассчитывали, как выраженную в процентах эффективность по сравнению с необработанным инфицированным контрольным образцом (0 = не происходит уничтожения Phaeosphaeria nodorum, 100% = полное уничтожение). В этом исследовании соединения, перечисленные в таблице Р, приведенной выше, обнаруживают хорошую активность. В частности соединения Р.04 и Р.29 обнаруживают активность, превышающую 50%, при норме расхода, равной 200 част./млн.
Пример В-8: Magnaporthe grisea: Пирикуляриоз риса, предупредительное исследование:
Описание методики исследования Magnaporthe grisea (синоним Pyricularia oryzae), пирикуляриоз риса. Сегменты листьев риса помещали на агар в многолуночный планшет (24-луночный) и опрыскивали приготовленными исследуемыми растворами (2% диметилсульфоксид, 0,025% Tween 20). После сушки диски листьев инокулировали суспензией спор грибов (90'000 конидий/мл). После соответствующего инкубационного периода предупредительную фунгицидную активность соединения оценивали через 5 дней после инокуляции, как вызванное болезнью повреждение дисков листьев, и рассчитывали, как выраженную в процентах эффективность по сравнению с необработанным инфицированным контрольным образцом (0 = не происходит уничтожения Magnaporthe grisea, 100% = полное уничтожение). В этом исследовании соединения, перечисленные в таблице Р, приведенной выше, обнаруживают хорошую активность. В частности соединения Р.05, Р.08 и Р.09 обнаруживают активность, превышающую 50%, при норме расхода, равной 200 част./млн.
Пример В-9: Pyrenophora teres: Сетчатая пятнистость ячменя, предупредительное исследование:
Описание методики исследования Pyrenophora teres (сетчатая пятнистость): Сегменты листьев ячменя помещали на агар в многолуночный планшет (24-луночный) и опрыскивали приготовленными исследуемыми растворами (2% диметилсульфоксид, 0,025% Tween 20). После сушки диски листьев инокулировали суспензией спор грибов (25000 конидий/мл). После соответствующего инкубационного периода предупредительную фунгицидную активность соединения оценивали через 4 дня после инокуляции, как вызванное болезнью повреждение дисков листьев, и рассчитывали, как выраженную в процентах эффективность по сравнению с необработанным инфицированным контрольным образцом (0 = не происходит уничтожения Pyrenophora teres, 100% = полное уничтожение). В этом исследовании соединения, перечисленные в таблице Р, приведенной выше, обнаруживают хорошую активность. В частности соединения Р.05, Р.08, Р.09, Р.46, Р.62, Р.64, Р.69 и Р.73 обнаруживают активность, превышающую 50%, при норме расхода, равной 200 част./млн.
Реферат
Изобретение относится к способу борьбы с заражением полезных растений фитопатогенными микроорганизмами или его предупреждения, в котором соединение формулы I или композицию, включающую это соединение в качестве активного ингредиента, наносят на растения, на их части или место их произрастания, где соединение формулы I представляет собойзаместители являются такими, как определено в пункте 1 формулы изобретения. 4 н. и 22 з.п. ф-лы, 2 табл., 8 пр.
Формула

в которой
aa) R1 и R2 независимо друг от друга обозначают водород, C1-С7алкил, C2-С6алкенил; или
af) или R1 или R2 обозначает
af1) C1-С6алкоксигруппу; или
ah) R1 и R2 независимо друг от друга обозначают группу A-;
где A обозначает 3-10-членную моноциклическую или конденсированную бициклическую кольцевую систему, которая может быть ароматической, частично ненасыщенной или полностью насыщенной и может содержать от 1 до 4 гетероатомов, выбранных из группы, включающей азот, и сама 3-10-членная кольцевая система может быть моно- или полизамещенной
A1) заместителями, независимо выбранными из группы, включающей галоген, =O, C1-С6алкил и C1-С6алкоксигруппу; или
A3) заместителями, независимо выбранными из группы, включающей C1-С6алкилсульфинил; или
aj) R1 и R2 вместе образуют C2-С6алкиленовый мостик; или
ak) R1 и R2 вместе с соединяющим их атомом азота образуют пирролиновую группу;
ba) R3, R4 и R7 независимо друг от друга обозначают
ba1) водород, галоген, цианогруппу или нитрогруппу; или R3, R4 и R7 независимо друг от друга обозначают (R51)(R52)(R53)Si- или (R51)(R52)(R53)Si-(C1-С6алкил)-; где R51, R52 и R53 независимо друг от друга обозначают C1-С6алкил;
или R3, R4 и R7 независимо друг от друга обозначают
ba2) C1-С6алкилсульфинил;
или R3, R4 и R7 независимо друг от друга обозначают
ba3) C1-С6алкил, C2-С6алкенил или C2-С6алкинил, или C1-С6алкил, C2-С6алкенил или C2-С6алкинил, моно- или полизамещенный заместителями, независимо выбранными из группы, включающей галоген и C1-С6алкоксигруппу;
или R3, R4 и R7 независимо друг от друга обозначают
ba5) фенил или бензил или бензил моно- или полизамещенный заместителями, независимо выбранными из группы, включающей галоген и C1-С6алкил; или
bb) R3, R4 и R7 независимо друг от друга обозначают группу A-, где группа A является такой, как определено выше в разделе ah);
ca) R5 обозначает водород, C1-С12алкил, C2-С12алкенил или C2-С12алкинил, или обозначает C1-С12алкил или C2-С12алкенил моно- или полизамещенный заместителями, независимо выбранными из группы, включающей галоген, гидроксигруппу, формил, C2-С7алкилкарбонил и C1-С6алкоксигруппу; или
cb1) R5 обозначает C2-С12алкилкарбонил или C2-С12алкоксикарбонил; или
cc) R5 обозначает (R51)(R52)(R53)Si- или (R51)(R52)(R53)Si-(C1-С12алкил)-; или
cd) R5 обозначает C1-С6алкил-B-С1-С12алкил-, где группа B обозначает -C(=NOR59)-, где R59 обозначает водород или C1-С6алкил; или
cf) R5 обозначает A-, А-(C1-С6алкил)-, А-(C2-С6алкенил)-, А-(C2-C6-алкинил)- или А-(C3-С8циклоалкил)-; где группа A обозначает 3-10-членную моноциклическую или конденсированную бициклическую кольцевую систему, которая может быть ароматической, частично ненасыщенной или полностью насыщенной и может содержать от 1 до 4 гетероатомов, выбранных из группы, включающей азот, кислород и серу, каждая кольцевая система не может содержать более 2 атомов кислорода и более 2 атомов серы и сама 3-10-членная кольцевая система может быть моно- или полизамещенной
A1) заместителями, независимо выбранными из группы, включающей галоген, цианогруппу, гидроксигруппу, =O, C1-С6алкил, C2-С6алкенил, C1-С6галогеналкил, C2-С6галогеналкенил, C1-С6алкоксигруппу и C3-С6алкенилоксигруппу; или
A2) заместителями, независимо выбранными из группы, включающей (C1-С6алкил)C(=NOR59)-, где R59 обозначает водород или C1-С6алкил; или
A3) заместителями, независимо выбранными из группы, включающей C1-С6алкилтиогруппу, C1-С6алкилсульфинил и C1-С6алкилсульфонил; или
A4) заместителями, независимо выбранными из группы, включающей - NR57R58, где R57 и R58 независимо друг от друга обозначают водород или C1-С6алкил; или
A5) заместителями, независимо выбранными из группы, включающей C2-С7алкилкарбонил и C2-С7алкоксикарбонил; или
A7) заместителями, независимо выбранными из группы, включающей, фенил, феноксигруппу и бензил, где фенил, феноксигруппа и бензил, в свою очередь, могут быть моно- или полизамещенными по фенильному кольцу заместителями, независимо выбранными из группы, включающей галоген;
d) R6 обозначает водород, -SH;
и агрономически приемлемые соли / N-оксиды этих соединений;
в которой, если
R1 и R2 независимо друг от друга обозначают водород, C3-С7циклоалкил, C1-С6алкил, C2-С6алкинил, водород или пиридин;
или R1 и R2 вместе с соединяющим их атомом азота образуют пирролиновую группу;
R3 обозначает водород, C1-С6галогеналкил, C1-С6алкил, галоген, цианогруппу, нитрогруппу, C1-С4алкоксигруппу, фенил, фенил, замещенный галогеном, (R51)(R52)(R53)Si-(C2-С6алкинил)-, где R51, R52 и R53 независимо друг от друга обозначают галоген, цианогруппу, C1-С6алкил, C2-С6алкенил, C3-С8циклоалкил, C5-С8циклоалкенил, C2-С6алкинил, C1-С6алкоксигруппу, бензил или фенил;
R4 обозначает водород, галоген, фенил, имидазолил, аминогруппу, C1-С6алкоксигруппу или C1-С6алкил;
R5 обозначает группу A, где A обозначает 3-10-членную монокарбоциклическую или конденсированную бикарбоциклическую кольцевую систему, которая может быть ароматической, частично ненасыщенной или полностью насыщенной, где эта 3-10-членная кольцевая система может быть моно- или полизамещенной заместителями, независимо выбранными из группы, включающей галоген, C1-С6алкил, C1-С6галогеналкил, C1-С6алкоксигруппу и C1-С6алкилтиогруппу;
R6 обозначает водород; и
R7 обозначает водород или C1-С6алкил, то группа A должна быть моно- или полизамещенной заместителями, отличными от галогена, C1-С6алкила, C1-С6галогеналкила, C1-С6алкоксигруппы и C1-С6алкилтиогруппы.
R1 и R2 независимо друг от друга обозначают водород, C3-С7циклоалкил, C1-С6алкил или пиридин;
или R1 и R2 вместе с соединяющим их атомом азота образуют пирролиновую группу;
R3 обозначает водород, C1-С6галогеналкил, C1-С6алкил, галоген, цианогруппу, нитрогруппу, фенил или фенил, содержащий в качестве заместителей галоген;
R4 обозначает водород, галоген, фенил, имидазолил или C1-С6алкил;
R5 обозначает C1-С12алкил или группу A, где
A обозначает 3-10-членную моноциклическую или конденсированную бициклическую кольцевую систему, которая может быть ароматической, частично ненасыщенной или полностью насыщенной и может содержать от 1 до 4 гетероатомов, выбранных из группы, включающей азот, кислород и серу, каждая кольцевая система не может содержать более 2 атомов кислорода и более 2 атомов серы и сама 3-10-членная кольцевая система может быть моно- или полизамещенной
заместителями, независимо выбранными из группы, включающей галоген, C1-С6алкил, C1-С6галогеналкил, C1-С6алкоксигруппу и C1-С6алкилтиогруппу;
R6 обозначает водород; и
R7 обозначает водород или C1-С6алкил.
R1 и R2 независимо друг от друга обозначают C1-С6алкил, C3-С7циклоалкил, водород или пиридин;
или R1 и R2 вместе с соединяющим их атомом азота образуют пирролиновую группу;
R3 обозначает водород, C1-С6алкил, C1-С6галогеналкил, галоген, цианогруппу, фенил или фенил, содержащий в качестве заместителей галоген;
R4 обозначает водород, галоген или C1-С6алкил;
R5 обозначает C1-С6алкил, фенил или C1-С6алкил, пиридил или фенил или пиридил, моно- или дизамещенный заместителями, выбранными из группы, включающей галоген, C1-С6алкил, C1-С6галогеналкил, C1-С6алкоксигруппу и C1-С6алкилтиогруппу;
R6 обозначает водород; и
R7 обозначает водород или C1-С6алкил.
R1 и R2 независимо друг от друга обозначают C1-С6алкил, водород или пиридин;
или R1 и R2 вместе с соединяющим их атомом азота образуют пирролиновую группу;
R3 обозначает водород, C1-С6алкил, галоген, цианогруппу, фенил или фенил, содержащий в качестве заместителей галоген;
R4 обозначает водород или C1-С6алкил;
R5 обозначает C1-С6алкил, фенил или пиридил или фенил или пиридил, моно- или дизамещенный заместителями, выбранными из группы, включающей галоген, C1-С6алкил, C1-С6галогеналкил, C1-С6алкоксигруппу и C1-С6алкилтиогруппу.

в которой
aa) R1 и R2 независимо друг от друга обозначают водород, C1-С7алкил или C2-С6алкенил; или
af) или R1 или R2 обозначает
af1) C1-С6алкоксигруппу; или
ah) R1 и R2 независимо друг от друга обозначают группу A-;
где A обозначает 3-10-членную моноциклическую или конденсированную бициклическую кольцевую систему, которая может быть ароматической, частично ненасыщенной или полностью насыщенной и может содержать от 1 до 4 гетероатомов, выбранных из группы, включающей азот, и сама 3-10-членная кольцевая система может быть моно- или полизамещенной
A1) заместителями, независимо выбранными из группы, включающей галоген, =O, C1-С6алкил и C1-С6алкоксигруппу; или
A3) заместителями, независимо выбранными из группы, включающей C1-С6алкилсульфинил; или
aj) R1 и R2 вместе образуют C2-С6алкиленовый мостик; или
ak) R1 и R2 вместе с соединяющим их атомом азота образуют пирролиновую группу;
ba) R3, R4 и R7 независимо друг от друга обозначают
ba1) водород, галоген, цианогруппу или нитрогруппу; или R3, R4 и R7 независимо друг от друга обозначают (R51)(R52)(R53)Si- или (R51)(R52)(R53)Si-(C1-С6алкил)-; где R51, R52 и R53 независимо друг от друга обозначают C1-С6алкил;
или R3, R4 и R7 независимо друг от друга обозначают
ba2) C1-С6алкилсульфинил;
или R3, R4 и R7 независимо друг от друга обозначают
ba3) C1-С6алкил, C2-С6алкенил или C2-С6алкинил, или C1-С6алкил, C2-С6алкенил или C2-С6алкинил, моно- или полизамещенный заместителями, независимо выбранными из группы, включающей галоген и C1-С6алкоксигруппу;
или R3, R4 и R7 независимо друг от друга обозначают
ba5) фенил или бензил или бензил моно- или полизамещенный заместителями, независимо выбранными из группы, включающей галоген и C1-С6алкил; или
bb) R3, R4 и R7 независимо друг от друга обозначают группу A-, где группа A является такой, как определено выше в разделе ah);
ca) R5 обозначает водород, C2-С12алкенил или C2-С12алкинил, или обозначает C1-С12алкил или C2-С12алкенил моно- или полизамещенный заместителями, независимо выбранными из группы, включающей галоген, гидроксигруппу, формил, C2-С7алкилкарбонил и C1-С6алкоксигруппу; или
cb1) R5 обозначает C2-С12алкилкарбонил или C2-С12алкоксикарбонил; или
cc) R5 обозначает (R51)(R52)(R53)Si- или (R51)(R52)(R53)Si-(C1-С12алкил)-; или
cd) R5 обозначает C1-С6алкил-B-C1-С12алкил-, где группа B обозначает -C(=NOR59)-, где R59 обозначает водород или C1-С6алкил; или
cf) R5 обозначает A-, A-(C1-С6алкил)-, А-(C2-С6алкенил)-, А-(C2-C6-алкинил)- или A-(C3-С8циклоалкил)-; где группа A обозначает 3-10-членную моноциклическую или конденсированную бициклическую кольцевую систему, которая может быть ароматической, частично ненасыщенной или полностью насыщенной и может содержать от 1 до 4 гетероатомов, выбранных из группы, включающей азот, кислород и серу, каждая кольцевая система не может содержать более 2 атомов кислорода и более 2 атомов серы и сама 3-10-членная кольцевая система может быть моно- или полизамещенной
A1) заместителями, независимо выбранными из группы, включающей галоген, цианогруппу, гидроксигруппу, =O, C1-С6алкил, C2-С6алкенил, C1-С6галогеналкил, C2-С6галогеналкенил, C1-С6алкоксигруппу и C3-С6алкенилоксигруппу; или
A2) заместителями, независимо выбранными из группы, включающей (C1-С6алкил)C(=NOR59)-, где R59 обозначает водород или C1-С6алкил; или
A3) заместителями, независимо выбранными из группы, включающей C1-С6алкилтиогруппу, C1-С6алкилсульфинил и C1-С6алкилсульфонил; или
A4) заместителями, независимо выбранными из группы, включающей -NR57R58, где R57 и R58 независимо друг от друга обозначают водород или C1-С6алкил; или
A5) заместителями, независимо выбранными из группы, включающей C2-С7алкилкарбонил и C2-С7алкоксикарбонил; или
A7) заместителями, независимо выбранными из группы, включающей, фенил, феноксигруппу и бензил, где фенил, феноксигруппа и бензил, в свою очередь, могут быть моно- или полизамещенными по фенильному кольцу заместителями, независимо выбранными из группы, включающей галоген;
d) R6 обозначает водород;
и агрономически приемлемые соли / N-оксиды этих соединений;
в которой, если R1 и R2 обозначает метил и каждый из R3, R4 и R7 обозначает водород, то R5 не может быть 5-хлор-пирид-3-илом;
в которой, если
R1 и R2 независимо друг от друга обозначают водород, C3-С7циклоалкил, C1-С6алкил, C2-С6алкинил, водород или пиридин;
или R1 и R2 вместе с соединяющим их атомом азота образуют пирролиновую группу;
R3 обозначает водород, C1-С6галогеналкил, C1-С6алкил, галоген, цианогруппу, нитрогруппу, C1-С4алкоксигруппу, фенил, фенил, замещенный галогеном, (R51)(R52)(R53)Si-(C2-С6алкинил)-, где R51, R52 и R53 независимо друг от друга обозначают галоген, цианогруппу, C1-С6алкил, C2-С6алкенил, C3-С8циклоалкил, C5-С8циклоалкенил, C2-С6алкинил, C1-С6алкоксигруппу, бензил или фенил;
R4 обозначает водород, галоген, фенил, имидазолил, аминогруппу, C1-С6алкоксигруппу или C1-С6алкил;
R5 обозначает группу A, где A обозначает 3-10-членную монокарбоциклическую или конденсированную бикарбоциклическую кольцевую систему, которая может быть ароматической, частично ненасыщенной или полностью насыщенной, где эта 3-10-членная кольцевая система может быть моно- или полизамещенной заместителями, независимо выбранными из группы, включающей галоген, C1-С6алкил, C1-С6галогеналкил, C1-С6алкоксигруппу и C1-С6алкилтиогруппу;
R6 обозначает водород; и
R7 обозначает водород или C1-С6алкил, то группа A должна быть моно- или полизамещенной заместителями, отличными от галогена, C1-С6алкила, C1-С6галогеналкила, C1-С6алкоксигруппы и C1-С6алкилтиогруппы.
R1 и R2 независимо друг от друга обозначают водород, C3-С7циклоалкил, C1-С6алкил или пиридин;
или R1 и R2 вместе с соединяющим их атомом азота образуют пирролиновую группу;
R3 обозначает водород, C1-С6галогеналкил, C1-С6алкил, галоген, цианогруппу, нитрогруппу, фенил или фенил, содержащий в качестве заместителей галоген;
R4 обозначает водород, галоген, фенил, имидазолил или C1-С6алкил;
R5 обозначает группу A, где
A обозначает 3-10-членную моноциклическую или конденсированную бициклическую кольцевую систему, которая может быть ароматической, частично ненасыщенной или полностью насыщенной и может содержать от 1 до 4 гетероатомов, выбранных из группы, включающей азот, кислород и серу, каждая кольцевая система не может содержать более 2 атомов кислорода и более 2 атомов серы и сама 3-10-членная кольцевая система может быть моно- или полизамещенной
заместителями, независимо выбранными из группы, включающей галоген, C1-С6алкил, C1-С6галогеналкил, C1-С6алкоксигруппу и C1-С6алкилтиогруппу;
R6 обозначает водород; и
R7 обозначает водород или C1-С6алкил.
R1 и R2 независимо друг от друга обозначают C1-С6алкил, C3-С7циклоалкил, водород или пиридин;
или R1 и R2 вместе с соединяющим их атомом азота образуют пирролиновую группу;
R3 обозначает водород, C1-С6алкил, C1-С6галогеналкил, галоген, цианогруппу, фенил или фенил, содержащий в качестве заместителей галоген;
R4 обозначает водород, галоген или C1-С6алкил;
R5 обозначает фенил или C1-С6алкил, пиридил или фенил или пиридил, моно- или дизамещенный заместителями, выбранными из группы, включающей галоген, C1-С6алкил, C1-С6галогеналкил, C1-С6алкоксигруппу и C1-С6алкилтиогруппу;
R6 обозначает водород; и
R7 обозначает водород или C1-С6алкил.
R1 и R2 независимо друг от друга обозначают C1-С6алкил, водород или пиридин;
или R1 и R2 вместе с соединяющим их атомом азота образуют пирролиновую группу;
R3 обозначает водород, C1-С6алкил, галоген, цианогруппу, фенил или фенил, содержащий в качестве заместителей галоген;
R4 обозначает водород или C1-С6алкил;
R5 обозначает фенил или пиридил или фенил или пиридил, моно- или дизамещенный заместителями, выбранными из группы, включающей галоген, C1-С6алкил, C1-С6галогеналкил, C1-С6алкоксигруппу и C1-С6алкилтиогруппу.

в которой R1, R2, R3, R4, R6 и R7 являются такими, как определено для формулы I в п.1, и
R100 обозначает галоген или имидазолил.

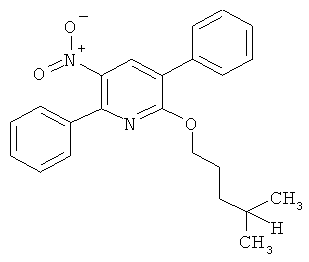





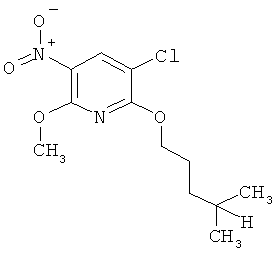










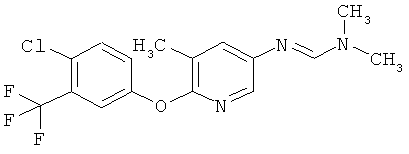








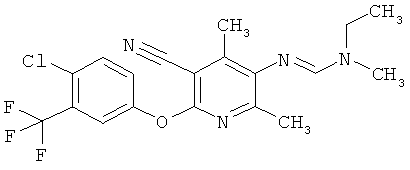

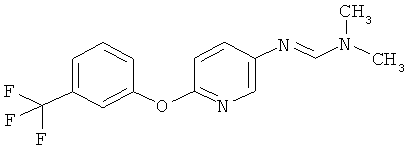






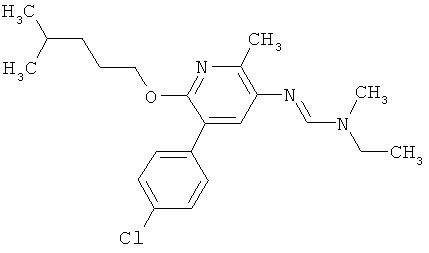

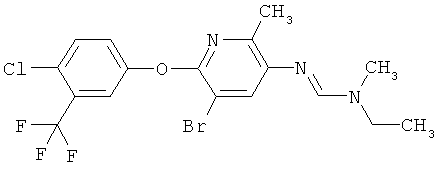

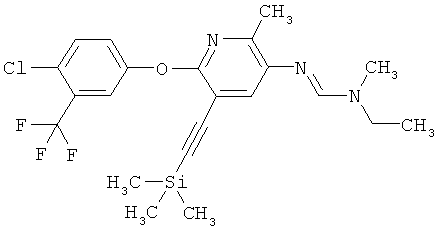
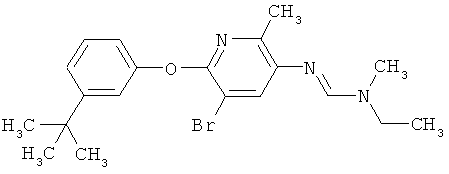

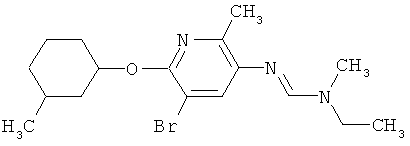









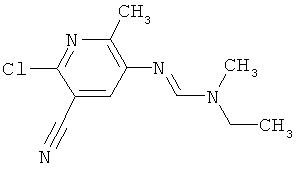




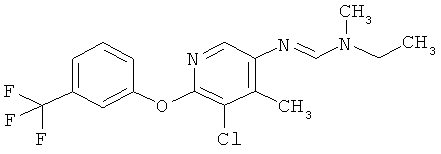
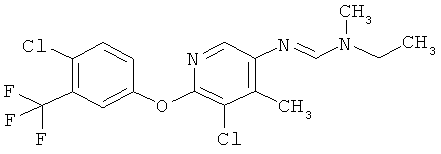


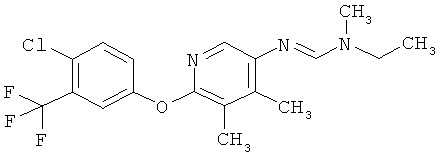








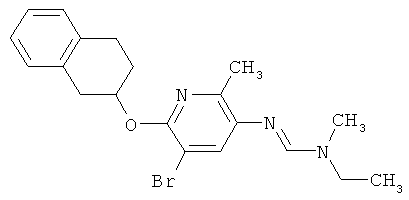





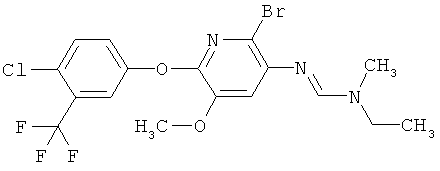
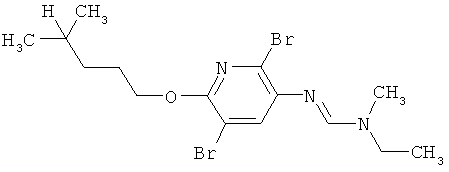
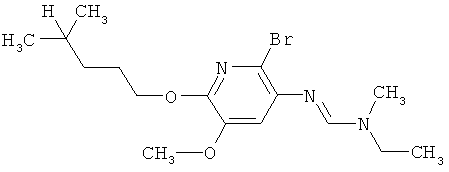

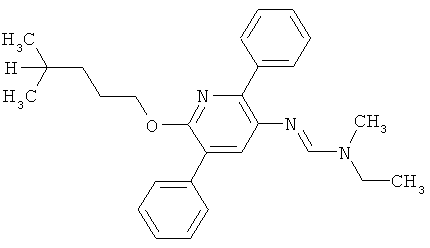





















































































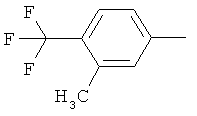











































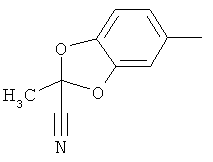
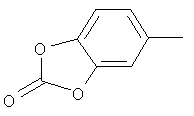


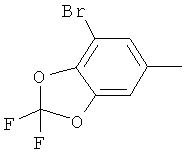




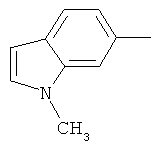







































































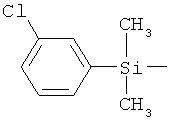
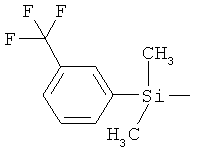


















































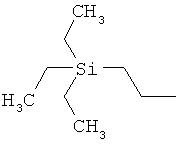





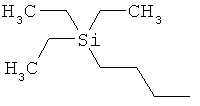



























































































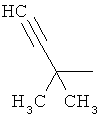
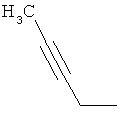






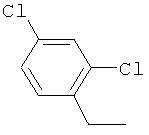








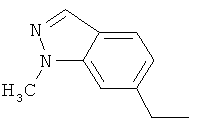






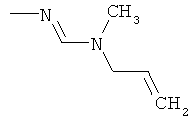

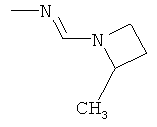


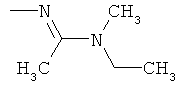















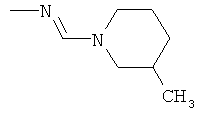

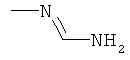



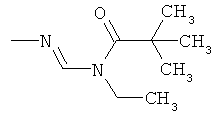








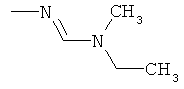




















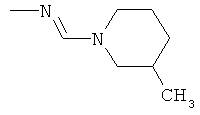


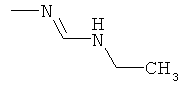
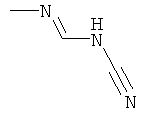




















Комментарии