Замещенные арилпиразолы в качестве агентов для уничтожения паразитов - RU2381218C2
Код документа: RU2381218C2
Чертежи
Описание
Настоящее изобретение относится к производным пиразола, имеющим противопаразитарные свойства. Представляющие интерес соединения являются фторированными циклопропиларилпиразолами и, более конкретно, настоящее изобретение относится к 1-арил-4-циклопропилпиразолам, в которых присутствует по меньшей мере один атом фтора, присоединенный к циклопропильному кольцу.
В публикации международной заявки на патент WO 9824767, публикациях заявок на европейский патент ЕР933363 и ЕР957094 описаны 4-циклопропиларилпиразолы, обладающие противопаразитарными свойствами для борьбы с членистоногими.
Соединения из уровня техники не всегда демонстрируют хорошую активность или длительное время действия против паразитов. Аналогично, некоторые противопаразитарные агенты полезны только в отношении узкого ряда паразитов. Цель настоящего изобретения заключается в том, чтобы преодолеть различные недостатки или улучшить свойства соединений из уровня техники. Таким образом, цель настоящего изобретения заключается в том, чтобы предложить арилпиразол, который имеет улучшенную активность против паразитов по сравнению с соединениями из уровня техники. Соединения по настоящему изобретению обладают особенно хорошей способностью контролировать широкий ряд членистоногих, как видно из результатов тестов, демонстрирующих их активность и эффективность. В частности, соединения по изобретению гораздо более активны в отношении блох, чем аналогичные соединения из уровня техники.
Еще одной целью является предложение соединений с длительным временем действия. Наиболее предпочтительно, соединения сдерживают инвазию членистоногими паразитами в течение периода времени по меньшей мере двадцать восемь суток. Пролонгированное действие обычно относится к пролонгированному периоду полувыведения соединения in vivo в хозяине-млекопитающем.
Также нужно, чтобы соединения по настоящему изобретению имели улучшенный фармакокинетический профиль, улучшенную безопасность, улучшенную устойчивость и улучшенную растворимость.
Таким образом, согласно настоящему изобретению предложено соединение формулы (I):
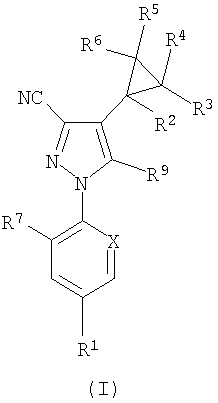
где
R1 представляет собой CF3, OCF2H, ОСF3, -SCF3, -SOCF3, -SО2СF3 или SF5;
R2 представляет собой Н, фторо или С1-4алкил, возможно замещенный 1-5 атомами галогена, независимо выбранными из хлоро и фторо;
R3, R4, R5 и R6 независимо представляют собой Н, С1-4алкил, возможно замещенный 1-5 галогеновыми группами, независимо выбранными из хлоро и фторо либо хлоро или фторо;
R7 представляет собой Cl или фторо;
Х представляет собой CR8 или N, где R8 представляет собой Cl или фторо; и
R9 представляет собой NRaRb;
Ra выбран из водорода, C1-6алкила, С2-6алкенила, С3-8циклоалкила, группы С(O)ОС1-6алкил и С1-6алканоила, где каждая из вышеуказанных групп может включать, где это химически возможно, один или более чем один возможный заместитель, независимо выбранный из галогено, het, фенила, гидрокси, групп -С(O)ОН, -С(O)ОС1-6алкила, C1-6алкила, C1-6галогеналкила, С3-8циклоалкила, С1-6алкокси, С1-6галогеналкокси, амино, С1-6алкиламино и ди-С1-6алкиламино;
Rb выбран из водорода, С1-6алкила, С2-6алкенила, С1-6алканоила и группы С(O)ОС1-6алкила, где каждая из вышеуказанных групп может включать, где это химически возможно, один или более чем один возможный заместитель, независимо выбранный из галогено, фенила, гидрокси, групп -СООН, -С(O)ОС1-6алкил, С1-6алкила, С1-6галогеналкила, С3-8циклоалкила, С1-6алкокси, С1-6галогеналкокси, амино, С1-6алкиламино и ди-С1-6алкиламино;
или Ra и Rb вместе с атомом N, к которому они присоединены, могут образовывать 3-7-членное гетероциклическое кольцо, содержащее один или более чем один дополнительный атом N, О или S, и где указанное гетероциклическое кольцо может нести один или более чем один возможный заместитель, выбранный из оксо, галогено, het, фенила, гидрокси, групп -СООН, -С(O)ОС1-6алкил, С1-6алкила, С1-6галогеналкила, С3-8циклоалкила, С1-6алкокси, С1-6галогеналкокси, амино, С1-6алкиламино и ди-С1-6алкиламино; и
het представляет собой 4-7-членную гетероциклическую группу, которая является ароматической или неароматической и которая содержит один или более чем один гетероатом, выбранный из азота, кислорода, серы и их смесей, и где указанное гетероциклическое кольцо возможно замещено, где это позволяет валентность, одним или более заместителями, выбранными из галогено, циано, нитро, С1-6алкила, С1-6галогеналкила, С1-6алкокси, групп ОС(O)С1-6алкил, С(O)С1-6алкил, С(O)ОС1-6алкил и NRcRd, где Rc и Rd независимо выбраны из водорода, С1-6алкила и С2-6алкенила, причем каждая из вышеуказанных групп может включать, где это химически возможно, один или более чем один возможный заместитель, независимо выбранный из галогено, фенила, гидрокси, группы -СООН, С(O)ОС1-6алкил, С1-6алкила, С1-6галогеналкила, С3-8циклоалкила, С1-6алкокси, С1-6галогеналкокси, амино, С1-6алкиламино и ди-С1-6алкиламино; или его фармацевтически приемлемую соль или пролекарство;
при условии, что по меньшей мере один из R2, R3, R4, R5 или R6представляет собой фторо.
В соединениях формулы (I) С1-6галогеналкил или С1-6галогеналкокси означает С1-6алкил или С1-6алкокси, замещенный 1-5 группами хлоро или фторо, выбранными независимо. Также "галогено" означает группу, выбранную из фторо, бромо, хлоро, бромо или йодо.
Подходящим образом R1 представляет собой СF3 или SF5, предпочтительно СF3.
Подходящим образом R2 представляет собой СF3 или CHF2, предпочтительно СF3. В альтернативном подходящем воплощении R2представляет собой фторо.
Подходящим образом R3, R4, R5 и R6 независимо представляют собой Н или фторо.
Предпочтительно R2 представляет собой СF3, и R3, R4, R5 и R6независимо представляют собой 2, 3 или 4 группы фторо, более предпочтительно 2 группы фторо, наиболее предпочтительно на R3, и R4, и R5 и R6 представляют собой Н.
Также предпочтительно R2 представляет собой CHF2, и R3, R4, R5 и R6независимо представляют собой 2, 3 или 4 группы фторо, более предпочтительно 2 группы фторо, наиболее предпочтительно на R3, и R4, и R5 и R6 представляют собой Н.
Также предпочтительно R2 представляет собой фторо, и R3, R4, R5 и R6 независимо представляют собой 2, 3 или 4 группы фторо, более предпочтительно оба R3 и R4 представляют собой фторо, и R5 и R6представляют собой Н, или все из R3, R4, R5 и R6 представляют собой фторо.
Предпочтительно Х представляет собой CR8. Более предпочтительно R8представляет собой хлоро.
Другими предпочтительными соединениями являются те, в которых R7 и R8 одинаковые. Более предпочтительно оба R7 и R8 представляют собой Cl.
Подходящим образом R3 представляет собой С(O)ОС1-6алкил, например этил, пропил или изопропил, с возможным замещением, выбранным из групп фторо в количестве от одной до пяти, например с образованием 2,2,2-трифторэтила, ди-С1-6алкиламино, например диметиламино, и net, например, пирролидинил, пиридил и имидазолил. Более подходящим образом R3 представляет собой этоксикарбонил, диметиламиноэтоксикарбонил, 2,2,2-трифторэтоксикарбонил, изопропоксикарбонил, 4-пиридилметоксикарбонил, 3-пиридилметоксикарбонил, 2-пиридилметоксикарбонил, 1Н-имидазол-5-илметоксикарбонил или 2-пирролидин-1-илэтоксикарбонил.
Также подходящим образом Ra представляет собой С1-6алкил, например метил, с возможным замещением, выбранным из групп фторо в количестве от одной до пяти, например с образованием трифторметила, С3-8циклоалкил, например циклогексил, фенил и net, например пиридил, например 4-пиридил, пиперидинил, морфолинил, пирролидинил или пиперазинил. Более подходящим образом Ra представляет собой метил или 4-пиридилметил.
Также подходящим образом Ra и Rb вместе с атомом N, к которому они присоединены, образуют пирролидинил, пиперидинил, пиперазинил, морфолинил или 2-оксо-оксазолидинил, например группу 2-оксо-1,3-оксазолидин-3-ил, более подходящим образом группу 2-оксо-1,3-оксазолидин-3-ил.
Подходящим образом Rb представляет собой водород.
Предпочтительно или альтернативно R9 выбран из NH2, С1-6алкоксикарбониламино, с возможным замещением по группе алкокси одной-пятью группами фторо, ди-С1-6алкиламино и het, и С1-6 алкиламино, с возможным замещением по алкильной группе одной-пятью группами фторо, С3-8циклоалкилом, фенилом и het. Наиболее предпочтительно R9 представляет собой NН2.
Предпочтительные индивидуальные соединения по изобретению выбраны из:
5-амино-1-[2,6-дихлор-4-пентафтортиофенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Н-пиразол-3-карбонитрила;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Н-пиразол-3-карбонитрила;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-(1,2,2-трифторциклопропил)-1H-пиразол-3-карбонитрила;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-(пентафторциклопропил)-1Н-пиразол-3-карбонитрила;
5-амино-4-(2,2-дихлор-1-фторциклопропил)-1-[2,6-дихлор-4-(трифторметил)фенил]-1Н-пиразол-3-карбонитрила;
5-амино-1-[2,6-дихлор-4-пентафтортиофенил]-4-(пентафторциклопропил)-1H-пиразол-3-карбонитрила;
5-амино-1-[2,6-дихлор-4-пентафтортиофенил]-4-(1,2,2-трифторциклопропил)-1H-пиразол-3-карбонитрила;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[1-(дифторметил)-2,2-дифторциклопропил]-1Н-пиразол-3-карбонитрила;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-(2,2-дифторциклопропил)-1Н-пиразол-3-карбонитрила;
5-амино-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1-[2,6-дифтор-4-(трифторметил)фенил]-1Н-пиразол-3-карбонитрила;
5-амино-1-[2,6-дихлор-4-пентафтортиофенил]-4-[1-(дифторметил)-2,2-дифторциклопропил]-1Н-пиразол-3-карбонитрила;
5-aминo-4-{1-[xлop(фтop)метил]-2,2-дифтopциклoпpoпил}-1-[2,6-диxлop-4-(трифторметил)фенил]-1H-пиразол-3-карбонитрила;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[1-(дифторметил)-2,2,3,3-тетрафторциклопропил]-1Н-пиразол-3-карбонитрила;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2,3,3-тетрафтор-1-(трифторметил)циклопропил]-1Н-пиразол-3-карбонитрила;
1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-5-(метиламино)-1H-пиразол-3-карбонитрила;
5-амино-1-[2,6-дихлор-4-(трифторметокси)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1H-пиразол-3-карбонитрила;
5-амино-1-[2,6-дихлор-4-(трифторметокси)фенил]-4-[1-(дифторметил)-2,2,3,3-тетрафторциклопропил]-1H-пиразол-3-карбонитрила;
5-амино-1-[2,6-дихлор-4-(трифторметокси)фенил]-4-[1-(дифторметил)-2,2-дифторциклопропил]-1H-пиразол-3-карбонитрила;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(фторметил)циклопропил]-1Н-пиразол-3-карбонитрила;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-(2,2-дифтор-1-метилциклопропил)-1Н-пиразол-3-карбонитрила;
5-амино-1-{2,6-дихлор-4-[(трифторметил)тио]фенил}-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1H-пиразол-3-карбонитрила;
этил-3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1H-пиразол-5-илкарбамата;
1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-5-(2-оксо-1,3-оксазолидин-3-ил)-1Н-пиразол-3-карбонитрила;
5-амино-1-[3-хлор-5-(трифторметил)пиридин-2-ил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Н-пиразол-3-карбонитрила;
2-(диметиламино)этил-3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1H-пиразол-5-илкарбамата;
2,2,2-трифторэтил-3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1H-пиразол-5-илкарбамата;
5-амино-1-{2,6-дихлор-4-[(трифторметил)сульфонил]фенил}-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1H-пиразол-3-карбонитрила;
1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-5-[(пиридин-4-илметил)амино]-1Н-пиразол-3-карбонитрила;
5-амино-1-[2,6-дихлор-4-(дифторметокси)фенил]-4-[2,2-дифтор-1 -(трифторметил)циклопропил]-1Н-пиразол-3-карбонитрила;
5-амино-1-[2,6-дихлор-4-пентафтортиофенил]-4-[1-(дифторметил)-2,2,3,3-тетрафторциклопропил]-1Н-пиразол-3-карбонитрила;
изопропил-3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Н-пиразол-5-илкарбамата;
пиридин-4-илметил-3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1H-пиразол-5-илкарбамата;
пиридин-3-илметил-3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Н-пиразол-5-ил]-карбамата;
пиридин-2-илметил-3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Н-пиразол-5-илкарбамата;
1Н-имидазол-5-илметил-3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1H-пиразол-5-илкарбамата;
2-пирролидин-1-илэтил-3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1H-пиразол-5-илкарбамата; и
5-амино-4-{1-[хлор(дифтор)метил]-2,2-дифторциклопропил}-1-[2,6-дихлор-4-(трифторметил)фенил]-1Н-пиразол-3-карбонитрила; или их фармацевтически приемлемой соли или пролекарства.
Более предпочтительные индивидуальные соединения по настоящему изобретению выбраны из:
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1H-пиразол-3-карбонитрила;
(-)-5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Н-пиразол-3-карбонитрила;
5-aминo-1-[2,6-диxлop-4-(тpифтopмeтил)фeнил]-4-[1-(дифтopмeтил)-2,2-дифторциклопропил]-1H-пиразол-3-карбонитрила;
5-амино-1-[2,6-дихлор-4-пентафтортиофенил]-4-[1-(дифторметил)-2,2-дифторциклопропил]-1Н-пиразол-3-карбонитрила;
5-aминo-4-{1-[хлор(фтор)метил]-2,2-дифтopциклoпpoпил}-1-[2,6-диxлop-4-(трифторметил)фенил]-1Н-пиразол-3-карбонитрила;
5-aминo-1-[2,6-диxлop-4-(тpифтopмeтил)фeнил]-4-[1-(дифтopмeтил)-2,2,3,3-тетрафторциклопропил]-1Н-пиразол-3-карбонитрила; и
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2,3,3-тетрафтор-1-(трифторметил)циклопропил]-1Н-пиразол-3-карбонитрила;
или их фармацевтически приемлемой соли или пролекарства.
В объем изобретения входят так называемые "пролекарства" соединений формулы (I). Так, некоторые производные соединений формулы (I), которые сами могут обладать незначительной фармакологической активностью или не обладать ею, могут, при введении на или в организм, превращаться в соединения формулы (I), обладающие нужной активностью, например посредством гидролитического расщепления. Такие производные упоминаются как "пролекарства". Понятно, что некоторые соединения формулы (I) сами могут действовать как пролекарства других соединений формулы (I). Дополнительную информацию по применению пролекарств можно найти в 'Pro-drugs as Novel Delivery Systems, Vol.14, ACS Symposium Series (T Higuchi и W Stella) и 'Bioreversible Carriers in Drug Design', Pergamon Press, 1987 (ed. E В Roche, American Pharmaceutical Association).
Пролекарства в соответствии с настоящим изобретением могут, например, быть получены путем замещения 5-амино-заместителя на пиразольном кольце в соединениях формулы (I) определенными группировками, известными специалисту в данной области техники как "пролекарственные группировки", как описано, например, в "Design of Prodrugs" Н Bundgaard (Elsevier, 1985); "Design и application of prodrugs," Textbook of Drug Design и Discovery, (3rd Edition), 2002, 410-458, (Taylor и Francis Ltd., London); и ссылках, приведенных в них.
Подходящие пролекарства могут иметь N-содержащую группу в положении 5 пиразольного кольца формулы (I) и присоединяться к кольцу через N. 5-N-группа может быть одно- или двузамещенной. Примеры заместителей включают: алкиламины, ариламины, амиды, мочевины, карбаматы, циклические карбаматы, имины, енамины, имиды, циклические имиды, сульфенамиды и сульфонамиды. Углеводородная часть этих групп содержит С1-6алкил, фенил, гетероарил, такой как пиридил, С2-6алкенил и С3-8циклоалкил; где каждая из вышеперечисленных групп, где это химически возможно, может включать один или более чем два возможных заместителя, независимо выбранных из: галогено; гидрокси; С1-6алкила и С1-6алкокси.
Дополнительные примеры замещающих групп в соответствии с вышеприведенными примерами и примерами других типов пролекарств можно найти в вышеуказанных ссылках.
Пролекарство согласно изобретению может быть легко идентифицировано посредством введения его подопытному животному и отбора пробы жидкости тела на соединение формулы (I).
В дополнительном аспекте в настоящем изобретении предложены способы получения соединения формулы (I) или его приемлемой фармацевтически, ветеринарно или в сельском хозяйстве соли, или его приемлемого фармацевтически, ветеринарно или в сельском хозяйстве сольвата (включая гидрат) любой категории, как проиллюстрировано ниже.
Специалисту в данной области техники понятно, что для чувствительных функциональных групп может требоваться защита и снятие защиты в ходе синтеза соединений по изобретению. Этого можно достичь обычными способами, например, как описано в "Protective Groups in Organic Synthesis" TW Greene и PGM Wuts, John Wiley & Sons Inc (1999), и ссылках, приведенных там.
Таким образом, следующие способы иллюстрируют общие процессы синтеза, которые могут быть адаптированы с целью получения соединений по изобретению.
1. Соединение формулы (I) можно получить циклопропанированием алкена формулы (II):
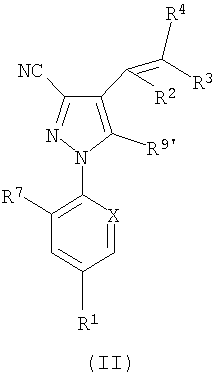
где R1, R2, R3, R4, R7 и Х являются такими, как определено ранее для формулы (I), и R9′ представляет собой R9 или N-защищенный R9, с последующим снятием защиты, когда это необходимо. Подходящая защита включает имидоформамидную защиту, например с использованием N,N-диметилимидоформамида, которая может быть снята в стандартных условиях. Соединения формулы (II) могут взаимодействовать с карбеноидной частицей, :C5R6, в которой R5 и R6 являются такими, как определено ранее для формулы (I), которая может быть образована in situ. Например, когда R5=R6=F, реакционноспособная частица, такая как триметилсилилдифтор(фторсульфонил)ацетат (TFDA), может взаимодействовать с соединением формулы (II), где R9′ представляет собой N-защищенный R9, с возможным неполярным растворителем при повышенной температуре в присутствии фторида натрия с получением продукта формулы (I) после снятия защиты. Другие конкретные способы включают обработку хлороформа основанием, предпочтительно в условиях катализа фазового перехода, термолиз подходящего металлорганического предшественника, такого как арилтрифторметильное, трихлорметильное или фенил(трифторметил)ртутное производное, или обработку диазоалканом в присутствии катализатора - переходного металла и обработку диазоалканом в отсутствии катализатора - переходного металла с последующим термолизом промежуточного пиразолина, или получение из илида серы.
Соединение формулы (II), где R9′ представляет собой N-защищенную группу, может быть получено из соединения формулы (IV):
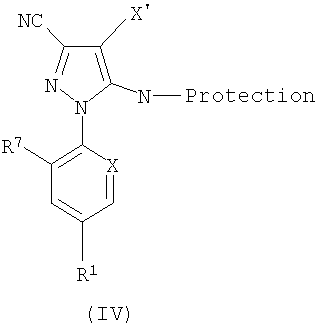
где X' представляет собой бромо или йод, и R1, R7 и Х являются такими, как определено ранее для формулы (11а), например посредством реакции кросс-сочетания (IV), катализируемой переходным металлом, с подходящим реагентом винилирования в подходящем, возможно дегазированном растворителе. Подходящим образом переходный металл представляет собой палладий, а реагент для винилирования представляет собой оловоорганическое производное, бороновоорганическую кислоту или цинкорганическое производное. Альтернативно, (IV) можно нагревать с обратным холодильником с алкенилбороновыми кислотами, замещенными подходящим образом, в присутствии тетракис(трифенилфосфин)палладия(0) и гидрокарбоната натрия в подходящем растворителе. Альтернативно, (IV) может быть обработано цинкорганическим соединением, например активированным цинком (таким как цинк Райка (Rieke)), в атмосфере инертного газа с подходящим бромалкеном, таким как бромтрифторэтилен или бромдифторэтилен, в апротонном растворителе в присутствии палладиевого(0) продукта, такого как тетракис(трифенилфосфин)палладий(0) при повышенной температуре. Альтернативно, (IV) может быть обработано активированным цинком (цинк Райка) в апротонном растворителе с получением органического цинката, который затем может быть подвергнут кросс-сочетанию с галогеналкеном в присутствии палладиевого(II) продукта, такого как дихлорбис(трифенилфосфин)палладий(II), и восстановителя, такого как диизобутилалюминийгидрид, при нагревании с обратным холодильником в апротонном растворителе.
Соединения формулы (IV) могут быть полезны для получения промежуточных соединений формулы (V).
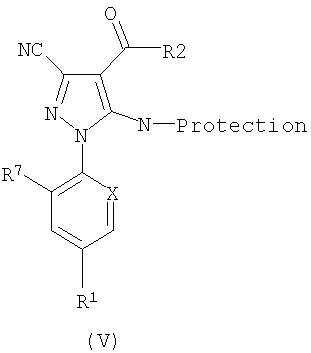
Таким образом, соединение формулы (IV) может быть обработано реагентом Гриньяра, таким как изопропилмагния хлорид, в атмосфере инертного газа с использованием апротонного растворителя при пониженной температуре, затем обработано хлорангидридом или ангидридом хлоралкановой кислоты, при нагревании до комнатной температуры получают нужный кетонный продукт, представленную формулой (V).
Соединения формулы (V) можно использовать для получения соединений формулы (II), где R3 и R4 представляют собой Н, и R9 является N-защищенным. Таким образом, соединение формулы (V) может быть метиленировано при обработке реагентом Виттига в атмосфере инертного газа при пониженной температуре в растворителе, таком как тетрагидрофуран.
Соединения формулы (II), где R9 является N-защищенным, могут также быть получены из соединений формулы (V), путем обработки галогеналкеном, таким как дибромдифторметан, в присутствии трифенилфосфина и цинка Райка в апротонном растворителе.
Альтернативно, соединения формулы (II), где R9 является N-защищенным, могут быть получены из соединений формулы (IV) через соответствующий третичный спирт с последующими стандартными операциями хлорирования-дегидрохлорирования.
Соединение формулы (IV) может быть получено из соединения формулы (VI), где R1, R7 и Х такие, как ранее определено для формулы (I):
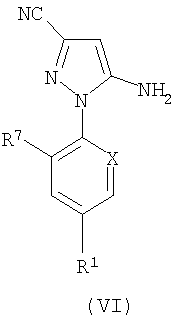
за две стандартные стадии бромирования/иодирования и защиты, любая из которых может быть осуществлена первой. Соединения формулы (VI) могут быть легко защищены, например в виде имидоформамида, и затем могут быть превращены непосредственно в соединения формулы (V) путем взаимодействия с реакционноспособным ангидридом кислоты в аполярном растворителе.
2. Соединение формулы (I) также можно получить путем получения требуемого карбеноидного продукта из пиразолсодержащего предшественника и обработки его соответствующим алкеном. Например, алкилметаллическую соль, предпочтительно литиевую соль, соединения формулы (VII):
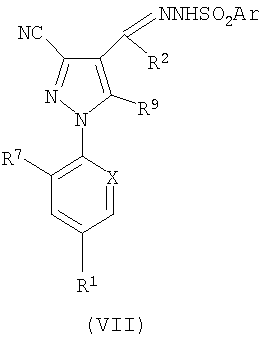
где Аr представляет собой фенил или нафтил, любой из которых возможно замещен С1-С4алкилом, С1-С4алкокси или галогено, и R1, R2, R7, R9 и Х являются такими, как определено ранее, можно термически разложить в присутствии катализатора - переходного металла, такого как ацетат родия(II), и алкена формулы (VIII):
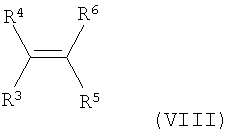
где R3, R4, R5 и R6 являются такими, как определено ранее для формулы (I), возможно в подходящем растворителе, таком как дихлорметан, и возможно под давлением, с получением соединения формулы (I).
3. Соединения формулы (I) можно получить посредством реакции Яппа-Клингеманна. Эта реакция описана в Org. React, 1959, 10, 143-178. Она обычно необходима для осуществления дальнейших стадий синтеза для образования 3,4,5-тризамещенных пиразолов с более разнообразными 4-заместителями. Кроме того, группы, которые можно ввести таким способом, ограничены группами, производными от первоначально введенного 4-заместителя. Однако авторы изобретения обнаружили способ, которым можно получить 3,4,5-тризамещенные 1-арилпиразолы непосредственно в ходе реакции, которая включает сочетание частиц арилдиазония с соответствующим образом замещенным предшественником, несущим нужный заместитель. Нужный заместитель вводят одновременно в положение С-4 в способе, который не включает в себя какую-либо перегруппировку. Кроме того, в реакции получается непосредственно тризамещенный пиразол. Отпадает необходимость в длинной процедуре синтеза и необходимости нескольких обработок промежуточных продуктов, и приводит к хорошему выходу. Значительным преимуществом этого способа является то, что С-4 заместитель может быть встроен в исходное тетразамещенное этановое производное, которое является одним из исходных веществ и которое взаимодействует с частицами арилдиазония с образованием пиразола. Контроль положения заместителя на полученном в результате пиразольном кольце, таким образом, в данной реакции является абсолютным. Более того, удобно и прямо может быть введен очень широкий ряд 4-заместителей.
Таким образом, соединение формулы (I), в котором R9 представляет собой NH2, можно получить путем взаимодействия соединения формулы (IX)
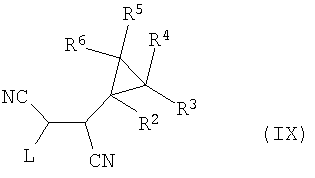
с соединением формулы (X)
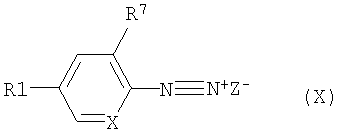
возможно в присутствии кислоты, где:
R1-R8 являются такими, как определено выше в отношении соединений формулы (I);
L представляет собой активирующую группу; и
Z представляет собой совместимый противоион
с последующим удалением группы L.
Противоион Z- может представлять собой любой подходящий противоион, обычно обнаруживаемый в диазореакциях. Предпочтительно, Z- представляет собой галоген, HSO4- или тетрафторборат, и наиболее предпочтительно тетрафторборат.
Группа L представляет собой электроноакцепторную группу, которая стабилизирует анионное промежуточное соединение в данном способе. Таким образом, предпочтительно L представляет собой группу, которая способна стабилизировать отрицательный заряд на соседнем атоме углерода. Группа L также должна быть удаляемой. L может быть удалена в щелочных условиях, например посредством щелочного гидролиза, или может быть удалена посредством восстановления и/или отщепления. Группа L является важной, так как служит для управления взаимодействием частиц диазония с соединением формулы (IX), но затем удаляется на последующих стадиях реакции. Предпочтительно L представляет собой сложноэфирную группу или группу COR10. Более предпочтительно L представляет собой группу, выбранную из: -S(O)pR11, где р равно 1 или 2, (R11O)2PO, COOR11 и
-COR10, где R10 выбран из: С1-8алкила, ди-С1-8алкиламино, С1-8алкилтио, С3-8циклоалкила, (CH2)nPh и (СН2)nгетероарила, где n=0, 1 или 2, причем каждая из этих групп может быть возможно замещена по любому атому углерода одной или более группами, независимо выбранными из: галогена, гидрокси, циано, нитро, С1-4алкокси, С1-4галогеналкокси, С1-4алканоила, С1-4галогеналканоила, С1-4алкилсульфинила, С1-4галогеналкилсульфинила, С1-4алкилсульфонила, С1-4галогеналкилсульфонила, С3-8циклоалкила и С3-8галогеноциклоалкила; и R10может быть водородом; и где R11 выбран из: С1-8алкила, C3-8циклоалкила, (CH2)nPh и (СН2)nгетероарила, где n=0, 1 или 2, причем каждая из этих групп может быть возможно замещена по любому атому углерода одной или более группами, независимо выбранными из: галогена, гидрокси, циано, нитро, С1-4алкокси, С1-4галогеналкокси, С1-4алканоила, С1-4галогеналканоила, С1-4алкилсульфинила, С1-4галогеналкилсульфинила, С1-4алкилсульфонила, С1-4галогеналкилсульфонила,
С3-8циклоалкила и С3-8галогеноциклоалкила; и R11 может быть водородом. Предпочтительно L представляет собой группу, выбранную из COR10 и COOR11. Наиболее предпочтительно L представляет собой -СООМе или -COOEt.
В определенных случаях природа уходящей группы L подразумевает, что полученное в результате промежуточное соединение находится в неправильном окислительном состоянии. Таким образом, где это необходимо, могут быть добавлены одна или несколько стадий, чтобы гарантировать, что перед циклизацией с получением арилпиразола достигнуто правильное окислительное состояние.
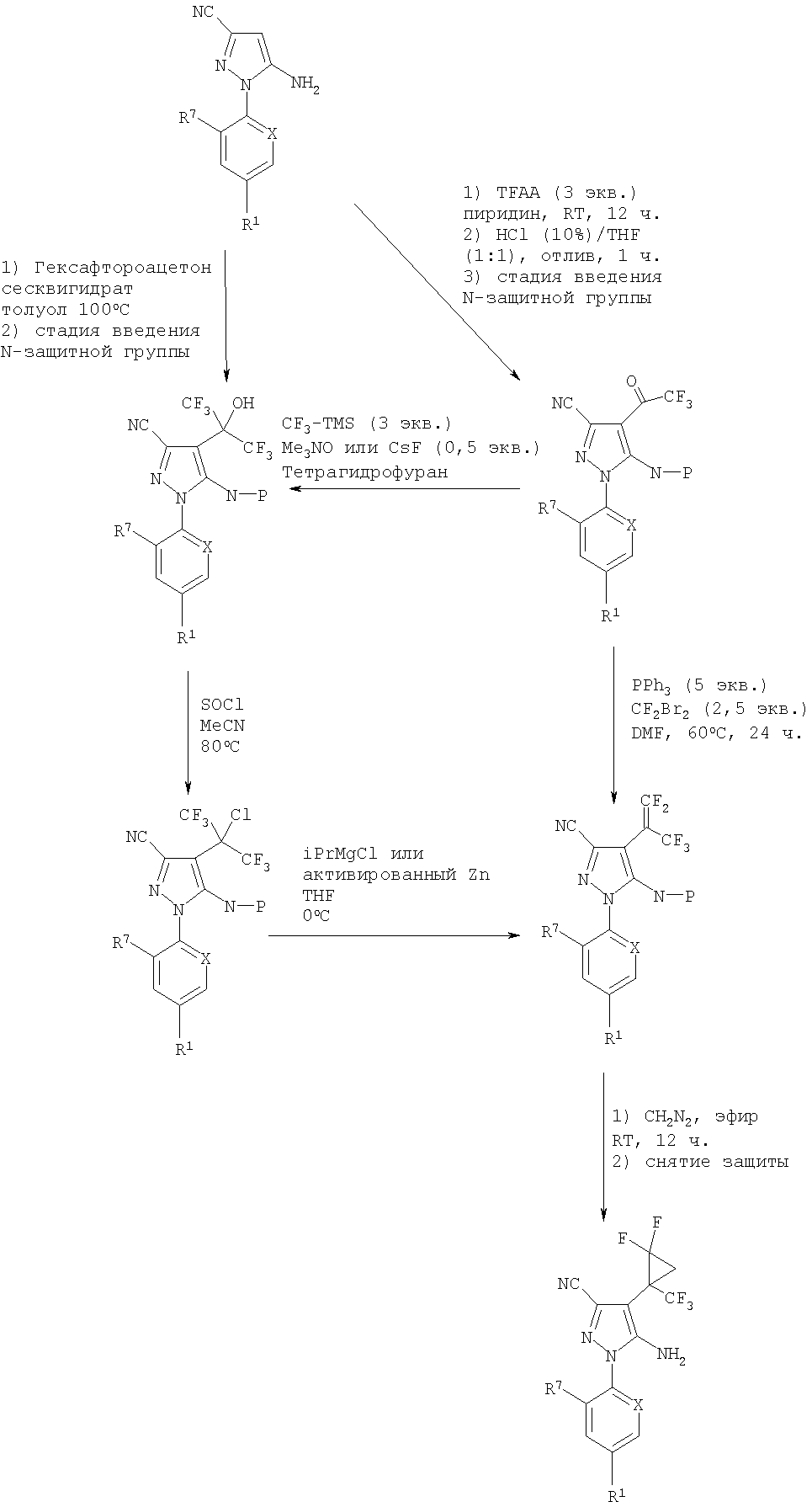
Вышеупомянутый способ сочетания может быть использован для получения любого из соединений формулы (I). Например, Схемы 1 и 2 ниже иллюстрируют общие способы, которые используются при получении 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)-циклопропил]-1Н-пиразол-3-карбонитрила.
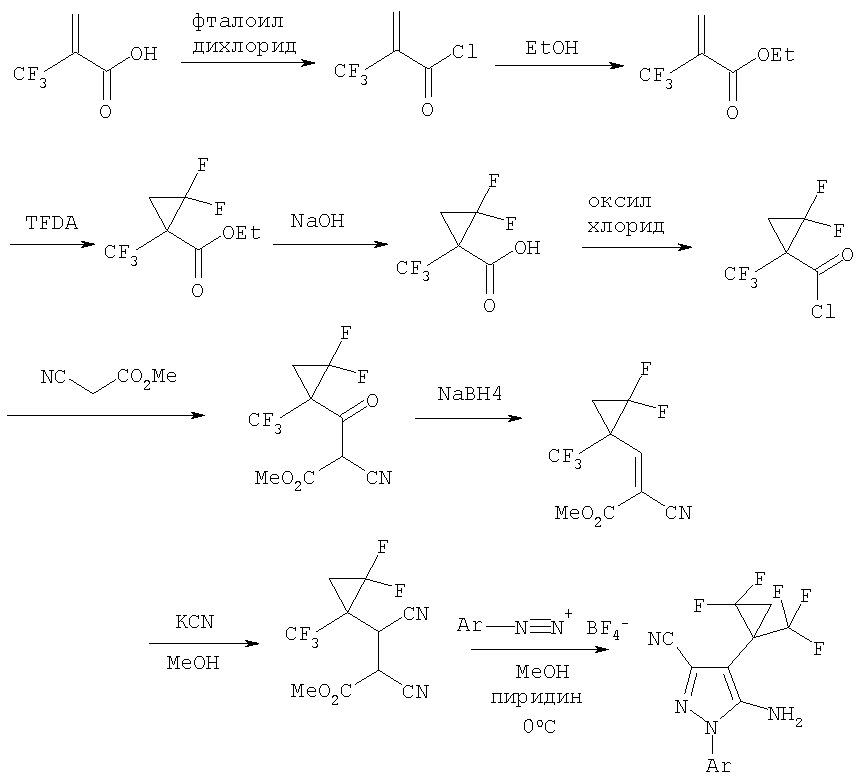
Схема 1
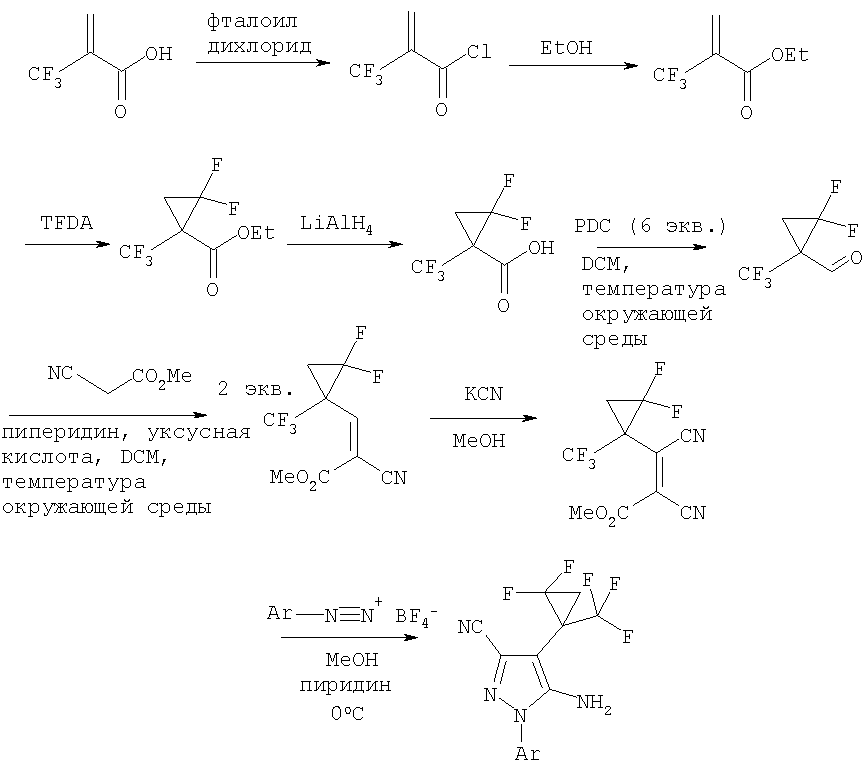
Схема 2
Идеально для реакции сочетания с получением соединения формулы (I), растворитель должен быть полярным растворителем, который не взаимодействует ни с солью или катионом диазония, ни с соединением формулы (IX). Реакция может быть возможно проведена в мягких кислых условиях.
Диазониевая соль формулы (X) может быть получена обычными способами и может быть получена in situ с целью дальнейшего взаимодействия или может быть выделена и использована на следующей стадии реакции.
Конкретные примеры соединений формулы (IX) и (XI) показаны на Схеме 1 и 2. Альтернативные соединения формулы (IX) могут быть аналогичным образом получены из соединений формулы (XI), где R2, R3, R4, R5, R6 и L являются такими, как определено выше, например посредством обработки соединения формулы (XI) источником цианид-ионов.
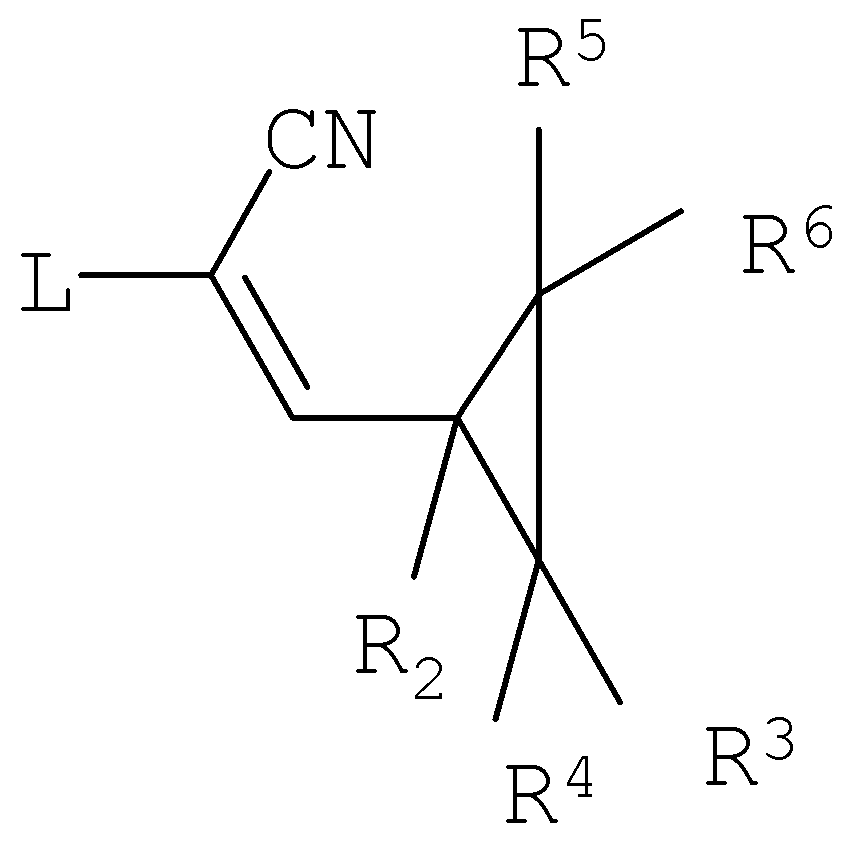
Соединения формулы (XI) могут быть получены восстановлением и затем дегидратированием соединения формулы (XII).
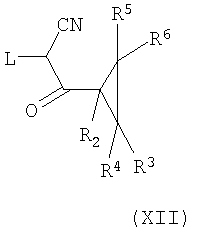
Соединения формулы (XII) можно получить, например, конденсацией алкилцианоалканоата, например метилцианоацетата, с хлориангидридом в апротонном растворителе, таком как дихлорметан, в присутствии кислоты Льюиса, такой как хлорид магния, и мягкого основания, такого как триэтиламин, при пониженной температуре.
Альтернативно, как показано на Схеме 1, соединения формулы (XI) могут быть получены конденсацией Кневенагеля подходящего альдегида с алкилалканоатом, таким как метилцианоацетат.
Эффективные условия для получения циклопропилзамещенных соединений с использованием триметилсилил-2,2-дифтор-2-(фторсульфонил)ацетата (TFDA), источника дифторкарбена, описаны в Dolbier et al., J. Fluor Chem., 2004, 125, 459.
Соединения формулы (XIII) также могут быть использованы в реакции Яппа-Клингеманна при взаимодействии с соединениями формулы (X) с целью синтеза соединений формулы (VI) по аналогии с вышеописанными условиями.
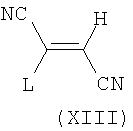
Соединения формулы (XIII), где L=СO2С1-С6алкил, синтезируют, медленно добавляя гликолонитрила, возможно при повышенной температуре, к С1-С6алкилцианоацетату, в апротонном растворителе, таком как диметилформамид, с последующим добавлением основания, такого как карбонат калия.
Промежуточные соединения формул (VIII), (XI) и (XII) также могут быть получены либо аналогично Схемам 1 и 2, либо с использованием обычных синтетических способов в соответствии со стандартными руководствами органической химии или предшествующей литературой, из легкодоступных исходных веществ с использованием соответствующих реагентов и условий реакции.
4. В другом аспекте изобретения предложены способы получения соединений формулы (I) из альтернативных соединений формулы (I). Например, соединения, в которых R9=NRaRb, где Ra и Rb являются такими, как определено в формуле (I), могут быть получены путем стандартных взаимодействий из соединения формулы (I), где R9 представляет собой NH2.
Соединения формулы (VI) могут быть получены из соединений формулы (XIV)
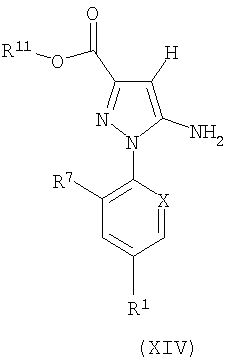
где CO2R11 представляет собой подходящую сложноэфирную группу, путем превращения сложного эфира в амид (XV) с последующим восстановлением оксихлоридом фосфора при повышенной температуре.
Соединения формулы (XIV) могут быть получены взаимодействием подходящего сложного эфира 3-циано-2-оксопропионовой кислоты, например этилового эфира, с подходящим образом замещенным гидразином соединения (XVII) в спиртовом растворителе при повышенной температуре с последующим добавлением основания, такого как карбонат натрия, и дальнейшим нагреванием.
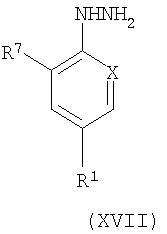
Соединения формулы (XVII) легко получить, используя стандартные условия, например, путем замещения соответствующего фторпроизводного гидразиновым реагентом, таким как гидразина моногидрат, при дефлегмации в спиртовом растворителе, таком как этанол.
Соединение формулы (I), где R2 представляет собой CF3, R3 и R4представляют собой фторо, R5 и R6 представляют собой водород и R9представляет собой NH2, можно легко получить согласно следующей Схеме 3.
Схема 3
N-защитная группа представляет собой подходящую кислотолабильную защитную группу, например группу диметиламидоформамидо, которая может быть включена в соответствии со способами, описанным здесь, и удалена в кислых условиях, таких как соляная кислота в метаноле и диоксане при повышенной температуре. Описанные здесь превращения хорошо известны специалистам в данной области техники и частично описаны здесь более подробно.
Специалистам в данной области техники будет понятно, что существуют вариации и альтернативы описанным здесь способам, которые позволяют получить соединения формулы (I).
Специалистам в данной области техники также будет понятно, что в рамках некоторых описанных способов порядок используемых стадий синтеза может меняться и будет зависеть, среди прочего, от таких факторов, как природа других функциональных групп, присутствующих в конкретном субстрате, доступность ключевых промежуточных соединений и применяемая стратегия защитных групп (если имеются). Несомненно, такие факторы будут также влиять на выбор используемого реагента на указанных стадиях синтеза.
Специалисту понятно, что соединения по изобретению могут быть получены способами, отличными от описанных здесь, путем адаптации способов, описанных здесь, и/или с помощью адаптации способов, известных из уровня техники, например уровня техники, описанного здесь, или с использованием стандартных руководств, таких как "Comprehensive Organic Transformations - A Guide to Functional Group Transformations", RC Larock, Wiley-VCH (1999 или более поздние издания).
Понятно, что способы синтетической трансформации, упомянутые здесь, являются только примерами и могут быть осуществлены в различных других последовательностях с тем, чтобы эффективно получать нужные соединения. Опытный химик будет использовать свое мнение и опыт в отношении наиболее эффективной последовательности реакций для синтеза данного целевого соединения.
Настоящее изобретение также относится к промежуточным соединениям формулы (IA) ниже:
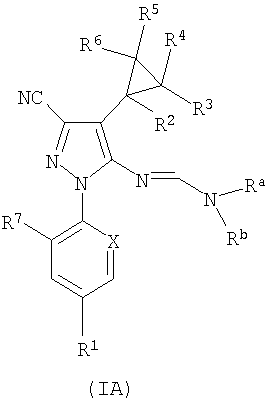
где R1-R7, X и Ra и Rb являются такими, как определено в отношении соединений формулы (I) и где предпочтительные значения, относящиеся к R1-R7 и X, равным образом относятся к формуле (IA). Со ссылкой на формулу (IA), подходящим образом Ra=Rb=метил.
Понятно, что соединения формулы (I) могут содержать один или более асимметрических атомов углерода, таким образом, соединения по изобретению могут существовать в виде двух или более стереоизомеров.
В объем настоящего изобретения входят все стереоизомеры, такие как энантиомеры и диастереомеры, все геометрические изомеры и таутомерные формы соединений формулы (I), включая соединения, проявляющие больше чем один тип изомерии, и смеси одного или более из них. Также включены соли присоединения кислоты или основания, в которых противоион является оптически активным, например D-лактат или L-лизин, или рацематы, например L-тартрат или DL-аргинин.
Геометрические изомеры могут быть выделены обычными методами, хорошо известными специалисту в данной области техники, например хроматографией или фракционной кристаллизацией.
Удобные методы получения/выделения индивидуальных энантиомеров включают хиральный синтез из подходящего оптически чистого предшественника или растворение рацемата (или рацемата соли или производного) с использованием, например, хиральной высокоэффективной жидкостной хроматографии (HPLC).
Альтернативно, рацемат (или рацемический предшественник) может быть подвергнут взаимодействию с подходящим оптически активным соединением, например спиртом, или в случае, когда соединение формулы (I) содержит кислую или основную группировку, кислотой или основанием, таким как винная кислота или 1-фенилэтиламин. Полученная диастереомерная смесь может быть разделена при помощи хроматографии и/или фракционной кристаллизации, и один или оба диастереоизомера превращены в соответствующий(е) чистый(е) энантиомер(ы) способами, хорошо известными специалисту в данной области техники.
Хиральные соединения по изобретению (и их хиральные предшественники) можно получить в энантиомернообогащенной форме, используя хроматографию, обычно ВЭЖХ, на асимметрической смоле с подвижной фазой, состоящей из углеводорода, обычно гептана или гексана, содержащей от 0 до 50% изопропанола, обычно от 2 до 20% и от 0 до 5% алкиламина, обычно 0,1% диэтиламина. Концентрирование элюата позволяет получить обогащенную смесь.
Стереоизомерные конгломераты можно разделить обычными методами, известными специалисту в данной области техники, - смотри, например, "Stereochemistry of Organic Compounds" E L Eliel (Wiley, New York, 1994).
Соли присоединения кислоты определенных соединений формулы (I), приемлемые фармацевтически, ветеринарно и в сельском хозяйстве, можно также получить обычным способом. Например, раствор свободного основания можно обработать соответствующей кислотой, либо неразбавленной, либо в растворителе, и полученную в результате соль выделить либо фильтрацией, либо выпариванием при пониженном давлении из растворителя реакционной смеси. Обзора подходящих солей смотри в "Handbook of Pharmaceutical Salts: Properties, Selection, и Use" Stahl и Wermuth (Wiley-VCH, Weinheim, Germany, 2002).
Соединения по изобретению может существовать как в несольватированных, так и сольватированных формах. Термин "сольват" используется здесь для обозначения молекулярного комплекса, включающего молекулы соединения по изобретению и одного или более фармацевтически приемлемых растворителей, например этанола. Термин "гидрат" используют, когда указанный растворитель представляет собой воду.
Соединения по изобретению, т.е. соединения формулы (I), обладают противопаразитарной активностью у людей, животных и растений. Они особенно полезны при лечении наружных паразитов.
Что касается применения соединений по изобретению у млекопитающих, предложены:
фармацевтическая противопаразитарная композиция, содержащая соединение формулы (I) или его фармацевтически приемлемую соль, или фармацевтически приемлемый сольват любого из них, вместе с фармацевтически приемлемым разбавителем или носителем, которая адаптирована для перорального, парентерального или местного введения;
соединение формулы (I) или его фармацевтически приемлемая соль, или фармацевтически приемлемый сольват любого из них, или фармацевтическая композиция, содержащая любое из вышеперечисленного, для применения в качестве лекарственного средства;
применение соединения формулы (I) или его фармацевтически приемлемой соли, или фармацевтически приемлемого сольвата любого из них, или фармацевтической композиции, содержащей любое из вышеперечисленного, для изготовления лекарственного средства для лечения паразитарной инвазии; и
способ лечения паразитарной инвазии у млекопитающего, который включает лечение указанного млекопитающего эффективным количеством соединения формулы (I) или его фармацевтически приемлемой соли, или фармацевтически приемлемого сольвата любого из них, или фармацевтической композиции, содержащей любое из вышеперечисленного.
Согласно еще одному аспекту настоящего изобретения предложен способ борьбы с паразитами: членистоногими, растительной нематодой или гельминтами в очаге поражения, который включает обработку очага поражения (например, путем нанесения или введения) эффективным количеством соединения общей формулы 1 или его пестицидно приемлемой соли.
Настоящее изобретение включает все фармацевтически приемлемые меченые изотопом соединения формулы (I), в которых один или более чем один атом замещен атомами, имеющими такой же атомный номер, но атомную массу или массовое число, отличную от атомной массы или массового числа, обычно встречающихся в природе.
Примеры изотопов, пригодных для включения в соединения по изобретению, включают изотопы водорода, такие как2H и3H, углерода, такие как11С,13С и14С, хлора, такой как36Cl, фтора, такой как18F, йода, такие как123I и125I, азота, такие как13N и15N, кислорода, такие как15О,17O и18О, фосфора, такой как32Р, и серы, такой как35S.
Соединения по изобретению также могут быть смешаны с одним или более биологически активными соединениями или агентами, включая инсектициды, акарициды, антигельминтные средства, фунгициды, нематоциды, антипротозойные средства, бактерицидные средства, регуляторы роста, энтомопатогенные бактерии, вирусы или грибы, с образованием многокомпонентного пестицида, обладающего более широким спектром фармацевтического, ветеринарного или сельскохозяйственного применения. Таким образом, настоящее изобретение также относится к композиции, содержащей биологически эффективное количество соединения по изобретению и эффективное количество по меньшей мере одного дополнительного биологически активного соединения или агента, и которая дополнительно может содержать один или более чем один из сурфактанта, твердого разбавителя или жидкого разбавителя. Конкретные дополнительные активные соединения включают соединения, которые описаны в заявке на патент Великобритании № GB 0406137.0, страницы 37-41.
Следующий список биологически активных соединений, вместе с которыми можно использовать соединения по изобретению, предназначен для того, чтобы иллюстрировать возможные комбинаций, но не налагает каких-либо ограничений.
Например, соединения по настоящему изобретению могут быть совместно введены или использованы в комбинации с антигельминтными агентами. Такие антигельминтные агенты включают соединения, выбранные из соединений класса макроциклических лактонов, таких как производные ивермектина, авермектина, абамектина, эмамектина, эприномектина, дорамектина, селамектина, моксидектина, немадектина и милбемицина, как описано в ЕР-357460, ЕР-444964 и ЕР-594291. Дополнительные антигельминтные агенты включают полусинтетические и биосинтетические производные авермектина/милбемицина, например как описанные в US-5015630, WO-9415944 и WO-9522552. Дополнительные антигельминтные агенты включают бензимидазолы, такие как альбендазол, камбендазол, фенбендазол, флубендазол, мебендазол, оксфендазол, оксибендазол, парбендазол и другие члены этого класса. Дополнительные антигельминтные агенты включают имидазотиазолы и тетрагидропиримидины, такие как тетрамизол, левамизол, пирантела памоат, оксантел или морантел. Дополнительные антигельминтные агенты включают трематоциды, такие как триклабендазол и клорсулон, и цестоциды, такие как празиквантел и эпсипрантел.
Соединения по этому изобретению также можно использовать в комбинации с производными и аналогами парагерквамидного/макфортинового (paraherquamide/marcfortine) класса антигельминтных агентов, а также противопаразитарными оксазолинами, например раскрытыми в US-5478855, US-4639771 и DE-19520936.
Соединения по настоящему изобретению могут быть совместно введены или использованы в комбинации с производными и аналогами общего класса диоксоморфолиновых противопаразитарных агентов, как описано в WO-9615121 и также с антигельминтными активными циклическими депсипептидами, например описанными в WO-9611945, WO-9319053, WO-9325543, ЕР-626375, ЕР-382173, WO-9419334, ЕР-382173 и ЕР-503538.
Соединения по настоящему изобретению могут быть совместно введены или использованы в комбинации с другими противоэктопаразитарными агентами; например фипронилом; пиретроидами; фосфорорганическими соединениями; регуляторами роста насекомых, такими как луфенурон; агонистами экдизона, такими как тебуфенозид и подобные; неоникотиноидами, такими как имидаклоприд и подобные.
Соединения по изобретению могут быть совместно введены или использованы в комбинации с терпеновыми алкалоидами, например, такими, как описаны в публикациях международный заявок на патент WO 95/19363 или WO 04/72086, особенно с соединениями, раскрытыми в них.
Другие примеры таких биологически активных соединений включают, без ограничения ими, следующие:
Фосфорорганические соединения: ацефат, азаметифос, азинфос-этил, азинфос-метил, бромофос, бромофос-этил, кадусафос, хлорэтоксифос, хлопирифос, хлорфенвинфос, хлормефос, деметон, деметон-S-метил, деметон-S-метилсульфон, диалифос, диазинон, дихлорвос, дикротофос, диметоат, дисульфотон, этион, этопрофос, этримфос, фамфур, фенамифос, фенитротион, фенсульфотион, фентион, флупиразофос, фонофос, формотион, фостиазат, гептенофос, исазофос, изотиоат, изоксатион, малатион, метакрифос, метамидофос, метидатион, метил-паратион, мевинфос, монокротофос, налед, ометоат, оксидеметон-метил, параоксон, паратион, паратион-метил, фентоат, фосалон, фосфолан, фосфокарб, фосмет, фосфамидон, форат, фоксим, пиримифос, пиримифос-метил, профенофос, пропафос, проэтамфос, протиофос, пираклофос, пиридапентион, хиналфос, сульпрофос, темефос, тербуфос, тебупиримфос, тетрахлорвинфос, тиметон, триазофос, трихлорфон, вамидотион.
Карбаматы: аланикарб, альдикарб, 2-втор-бутилфенил-метилкарбамат, бенфуракарб, карбарил, карбофуран, карбосульфан, клоэтокарб, этиофенкарб, феноксикарб, фентиокарб, фуратиокарб, HCN-801, изопрокарб, индоксакарб, метиокарб, метомил, 5-метил-мета-куменилбутирил(метил)карбамат, оксамил, пиримикарб, пропоксур, тиодикарб, тиофанокс, триазамат, UC-51717.
Пиретроиды: акринатин, аллетрин, альфаметрин, 5-бензил-3-фурилметил-(Е)-(1R)-цис-2,2-диметил-3-(2-оксотиолан-3-илиденметил)-циклопропанкарбоксилат, бифентрин, β-цифлутрин, цифлутрин, α-циперметрин, β-циперметрин, биоаллетрин, биоаллетрин((S)-циклопентилизомер), биоресметрин, бифентрин, NCl-85193, циклопротрин, цигалотрин, цититрин, цифенотрин, дельтаметрин, эмпентрин, эсфенвалерат, этофенпрокс, фенфлутрин, фенпропатрин, фенвалерат, флуцитринат, флуметрин, флувалинат (D-изомер), имипротрин, цигалотрин, λ-цигалотрин, перметрин, фенотрин, праллетрин, пиретрины (природные продукты), ресметрин, тетраметрин, трансфлутрин, тета-циперметрин, силафлуофен, τ-флувалинат, тефлутрин, тралометрин, Зета-циперметрин.
Регуляторы роста членистоногих: а) ингибиторы синтеза хитина: бензоилмочевины: хлорфлуазурон, дифлубензурон, флуазурон, флуциклоксурон, флуфеноксурон, гексафлумурон, луфенурон, новалурон, тефлубензурон, трифлумурон, бупрофезин, диофенолан, гекситиазокс, этоксазол, хлорфентазин; б) антагонисты экдизона: галофенозид, метоксифенозид, тебуфенозид; в) ювеноиды: пирипроксифен, метопрен, феноксикарб; г) ингибиторы биосинтеза липидов: спиродиклофен.
Другие противопаразитарные агенты: ацехиноцил, амитраз, AKD-1022, ANS-118, азадирахтин, Bacillus thuringiensis, бенсультап, бифеназат, бинапакрил, бромопропилат, BTG-504, BTG-505, камфехлор, картап, хлорбензилат, хлордимеформ, хлорфенапир, хромафенозид, клотианидин, циромазин, диаклоден, диафентиурон, DBI-3204, динактин, дигидроксиметилдигидроксипирролидин, динобутон, динокап, эндосульфан, этипрол, этофенпрокс, феназаквин, флумит, MTI-800, фенпироксимат, флуакрипирим, флубензимин, флуброцитринат, флуфензин, флуфенпрокс, флупроксифен, галофенпрокс, гидраметилнон, IKI-220, канемит, NC-196, ним гуард (neem guard), нидинортерфуран, нитенпирам, SD-35651, WL-108477, пиридарил, пропаргит, протрифенбут, пиметрозин, пиридабен, пиримидифен, NC-1111, R-195, RH-0345, RH-2485, RYI-210, S-1283, S-1833, SI-8601, силафлуофен, силомадин, спиносад, тебуфенпирад, тетрадифон, тетранактин, тиаклоприд, тиоциклам, тиаметоксам, толфенпирад, триазамат, триэтоксиспиносин, тринактин, вербутин, верталек, YI-5301.
Фунгициды: ацибензолар, альдиморф, ампропилфос, андоприм, азаконазол, азоксистробин, беналаксил, беномил, биалафос, бластицидин-S, бордосская жидкость, бромуконазол, бупиримат, капропамид, каптафол, каптан, карбендазим, хлорфеназол, хлоронеб, хлоропикрин, хлороталонил, хлозолинат, оксихлорид меди, соли меди, цифлуфенамид, цимоксанил, ципроконазол, ципродинил, ципрофурам, RH-7281, диклоцимет, диклобутразол, дикломезин, диклоран, дифеноконазол, RP-407213, диметоморф, домоксистробин, диниконазол, диниконазол-М, додин, эдифенфос, эпоксиконазол, фамоксадон, фенамидон, фенаримол, фенбуконазол, фенкарамид, фенпиклонил, фенпродипин, фенпропиморф, фентина ацетат, флуазинам, флудиоксонил, флуметовер, флуморф/флуморлин, фентина гидроксид, флуоксастробин, флухинконазол, флусилазол, флутоланил, флутриафол, фолпет, фосетил-алюминий, фуралаксил, фураметапир, гексаконазол, ипконазол, ипробенфос, ипродион, изопротиолан, касугамицин, крезоксим-метил, манкозеб, манеб, мефеноксам, мепронил, металаксил, метконазол, метоминостробин/феноминостробин, метрафенон, миклобутанил, нео-асозин, никобифен, оризастробин, оксадиксил, пенконазол, пенцикурон, пробеназол, проклораз, пропамокарб, пропиоконазол, проквиназид, протиоконазол, пирифенокс, пираклостробин, пириметанил, пироквилон, хиноксифен, спироксамин, сера, тебуконазол, тетраконазол, тиабендазол, тифлузамид, тиофанат-метил, тирам, тиадинил, триадимефон, триадименол, трициклазол, трифлоксистробин, тритиконазол, валидамицин, винклозин.
Биологические агенты: Bacillus thuringiensis ssp aizawai, kurstaki, Bacillus thuringiensis дельта эндотоксин, бакуловирус, энтомопатогенные бактерии, вирусы и грибы.
Бактерициды: хлортетрациклин, окситетрациклин, стрептомицин.
Подходящая комбинация согласно настоящему изобретению включает соединение формулы (I), более подходяще соединение формулы (I) из примеров, еще более подходяще предпочтительное индивидуальное соединение, как упомянуто в списке выше, наиболее подходяще 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)-циклопропил]-1H-пиразол-3-карбонитрил в комбинации с одним или более, предпочтительно с одним из активных соединений, перечисленных выше, подходяще с антигельминтным агентом, таким как соединение, выбранное из соединений класса макроциклических лактонов, таких как ивермектин, авермектин, абамектин, эмамектин, эприномектин, дорамектин, селамектин, моксидектин и немадектин, более подходяще дорамектин или селамектин.
Соединения по изобретению, предназначенные для фармацевтического применения, могут быть введены в виде кристаллических или аморфных продуктов. Они могут быть получены, например, в виде твердых масс (plugs), порошков или пленок такими способами, как осаждение, кристаллизация, лиофильная сушка, или распылительная сушка, или сушка выпариванием. Сушка с помощью микроволн или радиоволн также может быть использована для этих целей.
Они могут быть введены сами по себе или в комбинации с одним или более другими соединениями по изобретению или в комбинации с одним или более другими лекарственными средствами (или в виде любой их комбинации). Обычно их вводят в виде препарата вместе с одним или более фармацевтически приемлемыми эксципиентами. Термин "эксципиент" используют здесь для обозначения ингредиента, отличного от соединения(й) по изобретению. Выбор эксципиента будет в значительной степени зависеть от таких факторов, как конкретный способ введения, влияние эксципиента на растворимость и стабильность и природа дозированной формы.
Фармацевтические композиции, пригодные для доставки соединений по настоящему изобретению, и способы их получения очевидны специалисту в данной области техники. Такие композиции и способы их получения можно найти, например, 'Remington's Pharmaceutical Sciences', 19th Edition (Mack Publishing Company, 1995).
Что касается их применения у млекопитающих, соединения могут быть введены сами по себе или в виде препарата, подходящего для конкретного рассматриваемого применения, конкретного вида хозяина-млекопитающего, которого лечат, и поражающего паразита.
Способы, посредством которых могут быть введены данные соединения, включают пероральное введение с помощью капсулы, болюса, таблетки, порошков, лепешек, жевательных форм, мульти- и наночастиц, гелей, твердых растворов, пленок, спреев или жидких препаратов. Жидкие формы включают суспензии, растворы, сиропы, микстуры и эликсиры. Такие препараты могут быть использованы в качестве наполнителей мягких или твердых капсул и обычно содержат носитель, например воду, этанол, полиэтиленгликоль, пропиленгликоль, метилцеллюлозу или подходящее масло, и один или более чем один эмульгирующий агент и/или суспендирующий агент. Жидкие препараты также можно приготовить путем растворения твердого вещества, например из саше. Пероральные микстуры обычно готовят путем растворения или суспендирования активного ингредиента в подходящей среде.
Таким образом, композиции, пригодные для перорального введения, могут быть приготовлены посредством смешивания активного ингредиента с подходящим мелкоизмельченным разбавителем и/или разрыхлителем, и/или связующим веществом, и/или смазывающим веществом и т.д. Другие возможные агенты включают антиоксиданты, красители, ароматизаторы, консерванты и вкусомаскирующие агенты.
Для пероральных лекарственных форм, в зависимости от дозы, лекарственное средство может составлять от 1 мас.% до 80 мас.% от дозированной формы, более типично 5 мас.% до 60 мас.% дозированной формы. Примеры разрыхлителей включают натрия крахмала гликолят, натрий-карбоксиметилцеллюлозу, кальций-карбоксиметилцеллюлозу, кросскармелозу натрия, кросповидон, поливинилпирролидон, метилцеллюлозу, микрокристаллическую целлюлозу, гидроксипропилцеллюлозу, замещенную низшими алкилами, крахмал, предварительно клейстеризованный крахмал и альгинат натрия. Обычно разрыхлитель составляет от 1 мас.% до 25 мас.%, предпочтительно от 5 мас.% до 20 мас.% от лекарственной формы.
Связующие вещества обычно используют для придания когезионных свойств таблеточному препарату. Подходящие связующие агенты включают микрокристаллическую целлюлозу, желатин, сахара, полиэтиленгликоль, природные и синтетические смолы, поливинилпирролидон, предварительно клейстеризованный крахмал, гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу. Примеры разбавителей включают лактозу (моногидрат, высушенный распылением моногидрат, безводную и подобные), маннит, ксилит, декстрозу, сахарозу, сорбит, микрокристаллическую целлюлозу, крахмал и дигидрат гидроортофосфата кальция.
Пероральные препараты возможно могут включать поверхностно-активные агенты, такие как натрия лаурилсульфат и полисорбат 80, и смазывающие вещества, такие как диоксид кремния и тальк. Если они присутствуют, поверхносто-активные агенты могут составлять от 0,2 мас.% до 5 мас.% от таблетки, и смазывающие вещества могут составлять от 0,2 мас.% до 1 мас.% от таблетки.
Смазывающие вещества включают стеарат магния, стеарат кальция, стеарат цинка, стеарилфумарат натрия и смеси стеарата магния и лаурилсульфата натрия. Смазывающие вещества обычно составляют от 0,25 мас.% до 10 мас.%, предпочтительно от 0,5 мас.% до 3 мас.% от таблетки.
Типичные таблетки содержат вплоть до примерно 80% лекарственного средства, от примерно 10 мас.% до примерно 90 мас.% связующего вещества, от примерно 0 мас.% до примерно 85 мас.% разбавителя, от примерно 2 мас.% до примерно 10 мас.% разрыхлителя и от примерно 0,25 мас.% до примерно 10 мас.% смазывающего вещества.
Препараты в виде таблеток обсуждаются в "Pharmaceutical Dosage Forms: Tablets, Vol.1", H. Lieberman and L. Lachman, Marcel Dekker, N.Y., N.Y., 1980 (ISBN 0-8247-6918-X).
Соединения можно вводить местно на кожу или слизистую, то есть дермально или трансдермально. Обычные препараты для этих целей включают орошающее средство, средство для местного нанесения, средство для погружения, спрей, мусс, шампунь, порошкообразный препарат, гели, гидрогели, лосьоны, растворы, кремы, мази, присыпки, повязки, пенки, пленки, кожные пластыри, брикеты, имплантаты губки, волокна, бандажи и микроэмульсии. Также можно использовать липосомы. Типичные носители включают спирт, воду, минеральное масло, вазелиновое масло, медицинский вазелин, глицерин, полиэтиленгликоль и пропиленгликоль. Можно включать вещества, улучшающие проникновение - см., например, J Pharm Sci, 88 (10), 955-958 Finnin and Morgan (October 1999). Препараты для орошения и местного нанесения можно приготовить путем растворения активного инфедиента в приемлемом жидком носителе, таком как бутил-диэтиленгликоль, вазелиновое масло или нелетучий сложный эфир, возможно с добавлением летучего компонента, такого как пропан-2-ол. Альтернативно, препараты для орошения, местного нанесения или спрея можно приготовить инкапсулированием, чтобы оставить остаток активного агента на поверхности животного. Инъекционные препараты могут быть приготовлены в форме стерильного раствора, который может содержать другие вещества, например достаточное количество солей или глюкозы, чтобы сделать раствор изотоничным крови. Приемлемые жидкие носители включают растительные масла, такие как кунжутное масло, глицериды, такие как триацетин, сложные эфиры, такие как бензилбензоат, изопропилмиристат, и производные жирных кислот и пропиленгликоля, а также органические растворители, такие как пирролидин-2-он и глицеринформаль. Препараты готовят путем растворения или суспендирования активного ингредиента в жидком носителе, так чтобы конечный препарат содержал от 0,01 до 10% по массе активного ингредиента.
Альтернативно, соединения можно вводить парентерально или путем инъекции непосредственно в кровоток, мышцу или во внутренний орган. Подходящие способы для парентерального введения включают внутривенный, внутриартериальный, внутрибрюшинный, интратекальный, внутрижелудочковый, интрауретральный, интрастернальный, внутричерепной, внутримышечный и подкожный. Подходящие устройства для парентерального введения включают игольные (в том числе микроигольные) шприцы, безыгольные шприцы и инфузионную аппаратуру. Парентеральные препараты обычно представляют собой водные растворы, которые могут содержать эксципиенты, такие как соли, углеводы и буферные агенты (предпочтительно до значения рН от 3 до 9), но для некоторых случаев применения они могут быть подходящим образом приготовлены в виде стерильного неводного раствора или в виде порошкообразной высушенной формы для применения вместе с подходящим носителем, стерильная апирогенная вода. Приготовление парентеральных препаратов в стерильных условиях, например посредством лиофилизации, может быть легко осуществлено с использованием стандартных фармацевтических методов, известных специалисту в данной области техники. Растворимость соединений формулы (I), используемых в приготовлении парентеральных растворов, может быть повышена путем применения подходящих методик приготовления препаратов, таких как включение агентов, улучшающих растворимость.
Такие препараты готовят обычным способом в соответствии со стандартной медицинской или ветеринарной практикой.
Эти препараты будут отличаться в отношении массы содержащегося активного соединения в зависимости от вида животного-хозяина, которое подлежит лечению, тяжести и типа инфекции и массы тела хозяина. Для парентерального, местного и перорального введения обычная доза активного ингредиента находится в диапазоне от 0,01 до 100 мг на кг массы тела животного. Предпочтительно диапазон составляет от 0,1 до 10 мг на кг.
Препараты могут представлять собой препараты с немедленным и/или модифицированным контролируемым высвобождением. Препараты с контролируемым высвобождением включают препараты с модифицированным высвобождением, включая препараты с отсроченным, замедленным, пульсирующим, контролируемым, нацеленным или запрограммированным высвобождением. Подходящие препараты с модифицированным высвобождением для целей по изобретению описаны в патенте США 6106864. Подробные описания других подходящих технологий высвобождения, таких как высокоэнергетические дисперсии и осмотические и покрытые оболочкой частицы, могут быть найдены в Verma et al, Pharmaceutical Technology On-line, 25(2), 1-14 (2001). Применение жевательной резинки для достижения контролируемого высвобождения описано в WO 00/35298. Альтернативно, соединения по изобретению могут быть приготовлены в виде твердой, полутвердой или тиксотропной жидкости для введения в виде имплантируемого депо, обеспечивающего модифицированное высвобождение активного соединения. Примеры таких препаратов включают стенты, покрытые лекарственным средством, и PGLA (полисополимер гликолевой и молочной кислоты) микросферы.
Альтернативно, соединения можно вводить животным, не являющимся человеком, вместе с кормом и с этой целью может быть приготовлена концентрированная кормовая добавка или премикс для смешивания с обычным кормом для животных.
Соединения по изобретению применяют для борьбы с членистоногими паразитами. В частности, их можно использовать в области ветеринарной медицины, животноводства и здравоохранения: против членистоногих, которые паразитируют внутри и снаружи у позвоночных, в частности у теплокровных позвоночных, включая человека и домашних животных, таких как собаки, кошки, крупный рогатый скот, овцы, козы, лошади, свиньи, птица и рыба. Также их можно использовать для борьбы с вредителями растений, вредителями, обитающими в почве, и другими вредителями, находящимися в окружающей среде.
Жидкие композиции по изобретению, кроме обычного сельскохозяйственного применения, можно использовать, например, для обработки субстратов или мест, инвазированных или подверженных инвазии членистоногими (или другими вредителями, контролируемыми соединениями по настоящему изобретению), включая здания, площади для хранения или обработки внутри помещения или под открытым небом, контейнеры или оборудование или стоячую или проточную воду.
Все эти водные дисперсии или эмульсии, или смеси для распыления можно применять, например, на сельскохозяйственных культурах любым удобным способом, главным образом путем распылением, обычно с расходом порядка от примерно 100 до примерно 1200 литров распыляемой жидкости на гектар, но может быть выше или ниже (например, малый или ультрамалый объем) в зависимости от необходимости или способа применения. Соединения или композиции по изобретению удобно применять на растительности и, в частности, на корнях или листьях, имеющих паразитов, которых нужно удалить. Другой способ применения соединений или композиций согласно изобретению представляет собой внесение химических агентов, то есть добавление препарата, содержащего активный ингредиент, в оросительную воду. Такое орошение может представлять собой орошение из дождевальной установки для лиственных пестицидов или может представлять собой почвенное орошение или подпочвенное орошение для почвенных или системных пестицидов.
Концентрированные суспензии, которые можно применять путем распыления, приготавливают так, чтобы получить стабильный текучий продукт, который не оседает (тонкое измельчение) и обычно содержит от примерно 10 до примерно 75% по массе активного ингредиента, от примерно 0,5 до примерно 30% поверхностно-активных агентов, от примерно 0,1 до примерно 10% тиксотропных агентов, от примерно 0 до примерно 30% подходящих добавок, таких как пеногасители, ингибиторы коррозии, стабилизаторы, смачивающие агенты, адгезивы и в качестве носителя воду или органическую жидкость, в которой активный ингредиент плохо растворим или нерастворим. Некоторые органические твердые вещества или неорганические соли могут быть растворены в носителе для предотвращения осаждения или в качестве антифризов для воды.
Смачиваемые порошки (или порошки для распыления) обычно готовят таким образом, чтобы они содержали от примерно 10 до примерно 80% по массе активного ингредиента, от примерно 20 до примерно 90% твердого носителя, от примерно 0 до примерно 5% смачивающего агента, от примерно 3 до примерно 10% диспергирующего агента и, если необходимо, от примерно 0 до примерно 80% одного или более стабилизаторов и/или других добавок, таких как смачивающие агенты, адгезивы, агенты, предотвращающие слеживание, красители или подобные. Для получения таких смачиваемых порошков активный(е) ингредиент(ы) тщательно смешивают в подходящем блендере с дополнительными веществами, которые могут импрегнировать пористый наполнитель, и быть измельченными с использованием мельницы или другого подходящего измельчителя. Таким образом получают смачиваемые порошки, преимуществом которых является смачиваемость и суспендируемость. Их можно суспендировать в воде с получением любой желаемой концентрации, и эту суспензию можно использовать с большой пользой, в частности, для применения на листве растений.
"Диспергируемые в воде гранулы (WG)" (гранулы, которые легко диспергируются в воде) имеют состав, который по существу близок к составу смачиваемых порошков. Они могут быть получены гранулированием композиций, описанных для смачиваемых порошков, либо влажным способом (посредством контакта мелко дисперсного активного ингредиента с инертным наполнителем и небольшим количеством воды, например 1-20% по массе, или с водным раствором диспергирующего агента или связующего вещества с последующим высушиванием и просеиванием), либо сухим способом (прессование с последующим измельчением и просеиванием).
Расходы и концентрации композиций, приготовленных в виде препаратов, могут меняться в зависимости от способа применения или природы композиций или их применения. Вообще говоря, композиции для применения для борьбы с членистоногими, нематодами растений, гельминтами или простейшими паразитами обычно содержат от примерно 0,00001% до примерно 95%, более конкретно от примерно 0,0005% до примерно 50% по массе одного или более соединений формулы (I) или их пестицидно приемлемых солей, или общего количества активных ингредиентов (то есть соединение формулы (I) или его пестицидно приемлемая соль вместе с: другими веществами, токсичными для членистоногих или нематод растений, антигельминтными агентами, антикокцидиальными агентами, синергистами, микроэлементами или стабилизаторами). Фактические используемые композиции и их расход при использовании будут выбраны для достижения желаемого(ых) эффекта(ов) фермером, животноводом, медицинским или ветеринарным работником, специалистом по борьбе с вредителями или другим специалистом в данной области техники.
Соединения по изобретению также применяются для борьбы с членистоногими вредителями растений. Активное соединение обычно наносят на участок, на котором следует контролировать инвазию членистоногими, с расходом от примерно 0,005 кг до примерно 25 кг активного соединения на гектар (га) обрабатываемой территории, предпочтительно от 0,02 до 2 кг/га. В идеальных условиях, в зависимости от контролируемого паразита, адекватная степень защиты может быть достигнута при более низком расходе. С другой стороны, при неблагоприятных погодных условиях и других факторах может требоваться применение более высокого содержания активного ингредиента. Для применения на листьях можно использовать расход от 0,01 до 1 кг/га.
Предпочтительно, участок представляет собой поверхность растения или почву вокруг обрабатываемого растения.
Соединения по изобретению особенно полезны в борьбе с членистоногими, которые являются вредными или распространяют заболевания, или действуют как переносчики заболеваний для людей и домашних животных, например упомянутых здесь выше, и более конкретно в борьбе с клещами и клещиками, вшами, блохами, мошками и кусающимися, надоедливыми и миазными мухами. Они особенно полезны в борьбе с членистоногими, присутствующими внутри домашних животных или питающимися в или на коже, или сосущими кровь животного, для этих целей их можно вводить перорально, парентерально, чрескожно или местно.
Они также являются полезными в защите лесоматериалов (леса на корню, срубленных, хранящихся на складе или конструкционных) от нападения пилильщиков, или жуков, или термитов. Они также применяются для защиты хранящихся продуктов, таких как зерно, фрукты, орехи, специи и табак, цельных, молотых или в составе продуктов, от нападения моли, жуков и клещей. Также они защищают хранящиеся животные продукты, такие как шкуры, мех, шерсть и перья в естественном или обработанном виде (например, в виде ковров или текстильных изделий) от нападения моли и жуков, а также хранящееся мясо и рыбу от нападения жуков, клещей и мух. Твердые и жидкие композиции для местного применения для лесоматериалов, хранящихся продуктов или хозяйственных товаров обычно содержат от примерно 0,00005% до примерно 90%, более конкретно от примерно 0,001% до примерно 10% по массе, одного или более соединений формулы (I) или их пестицидно приемлемых солей.
Настоящее изобретение также относится к способу чистки здоровых животных, включающий нанесение на животного соединения формулы (I) или ветеринарно приемлемой соли. Цель такой чистки заключается в том, чтобы уменьшить или исключить инвазию людей паразитами, переносимыми животными, и улучшить среду обитания человека.
Соединения по изобретению пригодны для борьбы с членистоногих вредителями. В частности, их можно использовать в областях ветеринарии, животноводства и здравоохранения: против членистоногих, которые являются внутренними и внешними паразитами позвоночных, в частности теплокровных позвоночных, включая человека и домашних животных, таких как собаки, кошки, крупный рогатый скот, овцы, козы, лошади, свиньи, домашняя птица и рыба, таких как Acarina, включая клещей (например, Ixodes spp., Boophilus spp., например, Boophilus microplus, Amblyomma spp., Hyalomma spp., Rhipicephalus spp., например, Rhipicephalus appendiculatus, Haemaphysalis spp., Dermacentor spp., Ornithodorus spp.(например, Omithodorus moubata), клещей (например, Damalinia spp., Dermanyssus gallinae, Sarcoptes spp., например, Sarcoptes scabiei, Psoroptes spp., Chorioptes spp., Demodex spp., Eutrombicula spp.); двукрылых (Deptera) (например, Aedes spp., Anopheles spp., Muscidae spp., например Stomoxys calcitrans и Haematobia irritans, Hypoderma spp., Gastrophilus spp., Simulium spp.); полужесткокрылых (Hemiptera) (например, Triatoma spp.); пухоедовых (Phtiraptera) (например, Damalinia spp., Linognathus spp.); блох (Siphonaptera) (например, Ctenocephalides spp.); тараканообразных (Dictyoptera) (например, Periplaneta spp., Blatella spp.) и перепончатокрылых (Hymenoptera) (например, Monomorium pharaonis);
Во избежание сомнений "лечение" в данном описании изобретения означает куративное, паллиативное и профилактическое лечение, термин "бороться" (с паразитами и/или вредителями т.д.) означает уничтожать, отгонять, изгонять, временно поражать, отпугивать, ликвидировать, облегчать, минимизировать, истреблять.
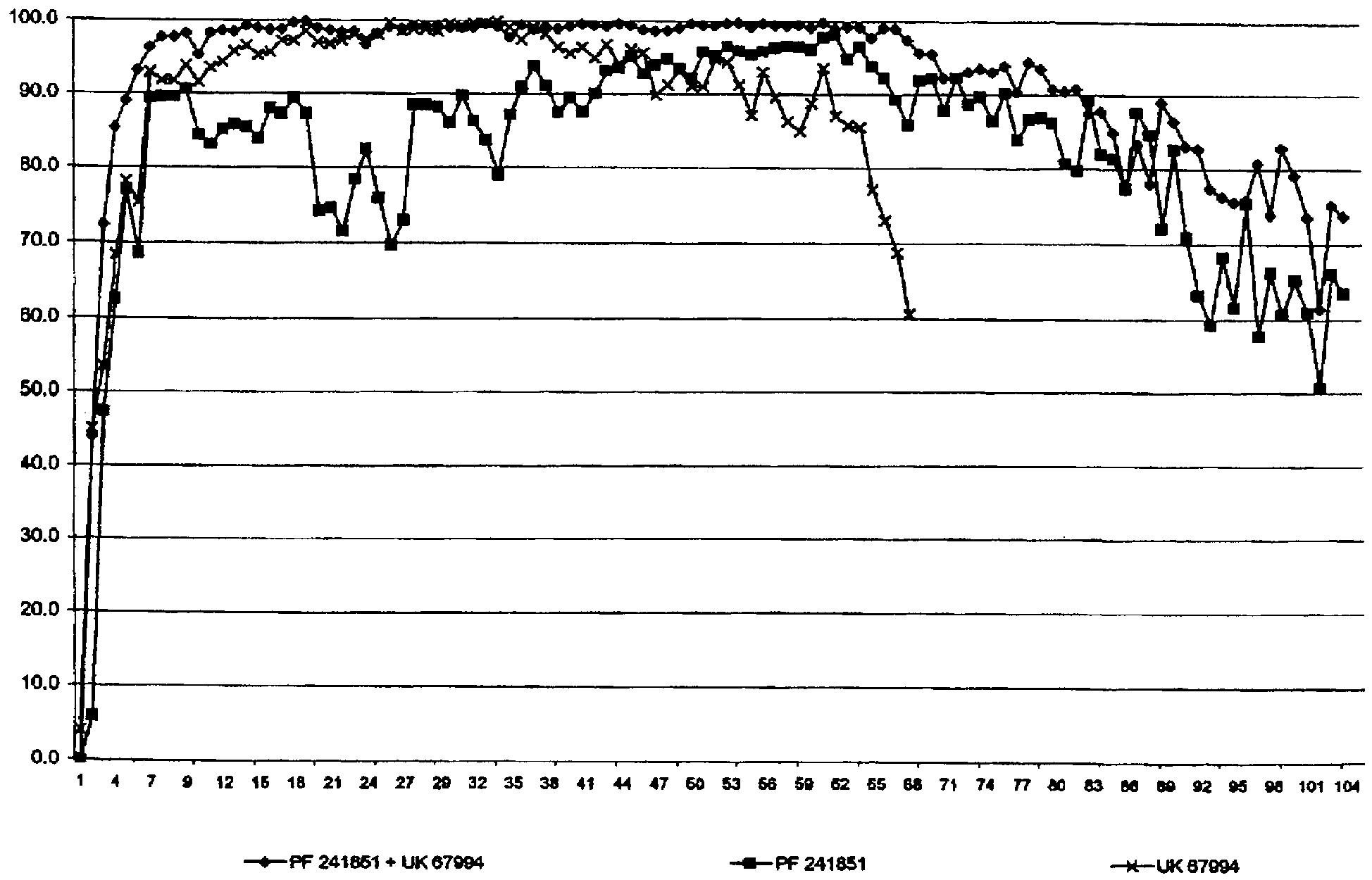
Для измерения биологических активностей заявленных соединений используют мембранный кормовой скрининг блох. Анализ включает in vitro тестирование в отношении Ctenocephalides felis, проводимое согласно следующей общей методике.
Блох выращивают in vitro, используя собачью кровь. Отбирали 25-30 взрослых Ctenocephalides felis (кошачья блоха) и помещали их в тестовую камеру (50 мл полистироловая трубка с мелкой нейлоновой сетью, закрывающей конец). Цитратную собачью кровь готовили путем добавления водного раствора цитрата натрия (10 мл, 20% масс./об., 20 г цитрата натрия в 100 мл воды) к собачьей крови (250 мл). Тестируемые соединения растворяли в диметилсульфоксиде с получением рабочего исходного раствора с концентрацией 4 мг/мл. Исходный раствор (12,5 мкл) добавляли к цитратной собачьей крови (5 мл) с получением начальной тестовой концентрации 10 мкг/мл. Для тестирования с концентрацией 30 мкг/мл готовили исходные растворы 12 мг/мл.
Цитратную собачью кровь, содержащую тестируемое соединение (5 мл, 10 мкг/мл), помещали в крышку от пластиковой чашки Петри, которую содержали при 37°С на нагревателе. Над открытой верхней частью натягивали парафильм с образованием натянутой мембраны для кормления через нее блох. Тестовую камеру, содержащую блох, аккуратно помещали на парафильмовую мембрану, и блохи начинали питаться.
Блохам давали возможность питаться в течение 2 часов, затем тестовые камеры удаляли и содержали в течение ночи при комнатной температуре.
Блох просматривали и записывали процент убитых блох. Соединения, активные при 10 мкг/мл, тестировали при более низких дозах. Для активных молекул повторяли определение ответов на дозу в 4 точках (10, 3, 1, 0,3, 0,1, мкг/мл) n=5. Данные наносили на график с получением значений ED80.
Все соединения из примеров по настоящему изобретению, которые были протестированы, имеют значения ED80 в отношении блох менее или равные 3 по сравнению с релевантными сравнительными соединениями из уровня техники, например, 3-циано-5-амино-арилпиразольными соединениями, в которых присутствует атом галогена на 4-циклопропильном кольце, описанными в WO 98/24767. Например, 5-амино-3-циано-4-(2,2-дибромциклопропил)-1-(2,6-дихлорфенил-4-трифторметил)пиразол при 30 мкг/мл был неактивен в ED80 скрининге на блохах, описанном выше.
В следующих подробных экспериментальных данных спектральные данные ядерного магнитного резонанса были получены с использованием спектрометров Varian Inova 300, Varian Inova 400, Varian Mercury 400, Varian Unityplus 400, Bruker AC 300МГц, Bruker AM 250МГц или Varian T60 МГц, при этом наблюдаемые химические сдвиги согласовывались с предложенными структурами. Масс-спектрометрические данные были получены на Finnigan Masslab Navigator, Fisons Instrument Trio 1000 или спектрометре Hewlett Packard GCMS System Model 5971. Приведенные рассчитанные и наблюдаемые ионы относятся к изотопной композиции с самой низкой массой. ВЭЖХ означает высокоэффективную жидкостную хроматографию. Комнатная температура означает от 20 до 25°С.
Пример 1
5-амино-1-[2,6-дихлор-4-пентафтортиофенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1H-пиразол-3-карбонитрил
К раствору Подготовительного примера 1 (62 мг, 0,12 ммоль) в метаноле (10 мл) добавляли пара-толуолсульфоновую кислоту (0,5 г, 2,63 ммоль), и реакционную смесь нагревали с обратным холодильником в течение ночи. Реакционную смесь выливали в насыщенный раствор гидрокарбоната натрия (50 мл) и полученную смесь экстрагировали этилацетатом (2×20 мл). Объединенные экстракты сушили (MgSO4) и концентрировали в вакууме. Неочищенный продукт растворяли в ацетонитриле (1,5 мл) и воде (0,9 мл) и раствор очищали при помощи автоматической препаративной жидкостной хроматографии (система Gilson, 150 мм × 30 мм Phenomenex LUNA C18(2) колонка) с использованием градиента вода:ацетонитрил [от 45:55 до 5:95]. Соответствующие фракции объединяли и концентрировали в вакууме с получением рацемического указанного в заголовке соединения (22 мг).
MS (ES): M/Z [MH+] 523,2; предполагаемая масса для C14H6Cl2F10N4S+Н составляет 523,0
1H-ЯМР (CDCl3): 2.05-2.20 (1H), 2.42-2.53 (1Н), 3.83-3.99 (2Н), 7.87-7.93 (2Н)
Рацемический Пример 1 растворяли в смеси этанол/гексан (2:3), и энантиомеры разделяли при помощи автоматической препаративной жидкостной хроматографии (система Gilson, 250×20 мм внутр. диам. Chiralcel OD, 10 мкм колонка) с использованием смеси этанол/гексан [5:95] в качестве подвижной фазы. Соответствующие фракции объединяли и концентрировали с получением двух энантиомерно обогащенных продуктов, Примера 1а и Примера 1б.
Пример 1а: MS (ES): MH+ 523,0, C14H6Cl2F10N4S+Н соответствует 523,0
HPLC: (система Gilson, 250×20 мм внутр. диам. Chiralcel OD, 10 мкм колонка), этанол/гексан [5:95], время удерживания 10,73 мин, энантиомерная чистота 100%
Пример 1б: MS (ES): MH+ 523,0, C14H6Cl2F10N4S+Н соответствует 523,0
HPLC: (система Gilson, 250×20 мм внутр. диам. Chiralcel OD, 10 мкм колонка), этанол/гексан [5:95], время удерживания 12,23 мин, энантиомерная чистота 100%
Пример 2
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1H-пиразол-3-карбонитрил
К раствору Подготовительного примера 2 (234 мг, 0,45 ммоль) в метаноле (10 мл) добавляли пара-толуолсульфоновую кислоту (500 мг, 2,63 ммоль) и реакционную смесь нагревали с обратным холодильником в течение ночи. К реакционной смеси добавляли этилацетат (100 мл) и органическую фазу отделяли, промывали насыщенным водным раствором гидрокарбоната натрия (2×100 мл), сушили (MgSO4) и концентрировали в вакууме. Остаток очищали колоночной хроматографией (силикагель, 20 г), элюируя смесью дихлорметан/пентан [2:1]. Соответствующие фракции объединяли и концентрировали с получением рацемического указанного в заголовке соединения (160 мг) в виде бледно-желтого твердого вещества.
MS (ES): M/Z [MH+] 465,1; предполагаемая масса для С15Н6Сl2F8N4+Н составляет 465,0
1H-ЯМР (CDCl3): 2.05-2.20 (1H), 2.42-2.53 (1H), 3.86-3.95 (2Н), 7.74-7.79 (2Н)
Рацемический Пример 2 растворяли в смеси этанол/гексан (1:1), и энантиомеры разделяли при помощи автоматической препаративной жидкостной хроматографии (система Gilson, 250×20 мм внутр. диам. Chiralcel OD, 10 мкм колонка) с использованием смеси этанол/гексан [1:9] в качестве подвижной фазы. Соответствующие фракции объединяли и концентрировали с получением двух энантиомерно обогащенных продуктов Примера 2а и Примера 26.
Пример 2а: MS (ES): МН+ 464,8, C15H6Cl2F8N4+Н соответствует 465,0
HPLC: (система Gilson, 250×20 мм внутр. диам. Chiralcel OD, 10 мкм колонка), этанол/гексан [1:9], время удерживания 12,09 мин, энантиомерная чистота 99%, (-) изомер.
Пример 2б: MS (ES): MH+ 464.8, С15Н6Сl2F8N4+Н соответствует 465,0
HPLC: (система Gilson, 250×20 мм внутр. диам. Chiralcel OD, 10 мкм колонка), этанол/гексан [1:9], время удерживания 14,63 мин, энантиомерная чистота 100%, (+) изомер.
Аналогичным образом были получены:
Пример 3
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-(1,2,2-трифторциклопропил)-1Н-пиразол-3-карбонитрил; из соединения Подготовительного примера 3 (22 мг, 0,047 ммоль) с получением указанного в заголовке соединения (9,4 мг).
MS (ES): M/Z [MH+] 415,1; предполагаемая масса для С14Н6Сl2F6N4+Н составляет 415,0
1H-ЯМР (CDCl3): 2.16-2.27 (2Н), 4.02-4.12 (2Н), 7.76-7.80 (2Н)
Пример 4
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-(пентафторциклопропил)-1Н-пиразол-3-карбонитрил; из соединения Подготовительного примера 4 (32 мг, 0,063 ммоль) с получением указанного в заголовке соединения (10 мг).
MS (ES): M/Z [MH+] 451,1; предполагаемая масса для C14H4Cl2F8N4+Н составляет 451,0
1H-ЯМР (CDCl3): 4.16-4.24 (2Н), 7.77-7.81 (2Н)
Пример 5
5-амино-4-(2,2-дихлор-1-фторциклопропил)-1-[2,6-дихлор-4-(трифторметил)фенил]-1H-пиразол-3-карбонитрил; из соединения Подготовительного примера 5 (29 мг, 0,06 ммоль) с получением указанного в заголовке соединения (5 мг) в виде белого твердого вещества.
MS (ES): M/Z [MH+] 446,8; предполагаемая масса для C14H6Cl4F4N4+Н составляет 447,0
1H-ЯМР (CDCl3): 2.25-2.34 (1Н), 2.41-2.47 (1Н), 4.09-4.18 (2Н), 7.75-7.80 (2Н)
Пример 6
5-амино-1-[2,6-дихлор-4-пентафтортиофенил]-4-(пентафторциклопропил)-1H-пиразол-3-карбонитрил; из соединения Подготовительного примера 6 (40 мг, 0,07 ммоль) с получением указанного в заголовке соединения (20 мг) в виде белого твердого вещества.
MS (ES): M/Z [MH+] 509,2; предполагаемая масса для C13H4Cl2F10N4S+Н составляет 509,0
1H-ЯМР (CDCl3): 4.16-4.22 (2Н), 7.91-7.93 (2Н)
Пример 7
5-амино-1-[2,6-дихлор-4-пентафтортиофенил]-4-(1,2,2-трифторциклопропил)-1H-пиразол-3-карбонитрил; из соединения Подготовительного примера 7 (92 мг, 0,17 ммоль) с получением указанного в заголовке соединения (46 мг).
MS (ES): M/Z [MH+] 472,9; предполагаемая масса для C13H6Cl2F8N4S+Н составляет 473,0
1H-ЯМР (CDCl3): 2.14-2.27 (2Н), 4.05-4.14 (2Н), 7.89-7.92 (2Н)
Пример 8
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[1-(дифторметил)-2,2-дифторциклопропил]-1Н-пиразол-3-карбонитрил
К раствору Подготовительного примера 23 (4,0 г, 8,0 ммоль) в 1,4-диоксане (50 мл) добавляли метанол (5 мл) и соляную кислоту (10% в воде, 5 мл). Реакционную смесь затем нагревали с обратным холодильником в течение 4 ч.
В реакционную смесь добавляли насыщенный водный раствор гидрокарбоната натрия и водную фазу отделяли и экстрагировали этилацетатом (3×20 мл). Объединенные органические фазы затем сушили (МgSО4) и концентрировали в вакууме. Остаток очищали колоночной хроматографией (силикагель, 70 г) с градиентным элюированием, петролейный эфир: диэтиловый эфир [от 1:0 до 0:1]. Соответствующие фракции объединяли и концентрировали с получением рацемического Примера 8 (3,2 г).
MS (ES): M/Z [MH+] 448,9; предполагаемая масса для C15H7Cl2F7N4+Н составляет 447,0
1H-ЯМР (CDCl3): 2.04-2.11 (1Н), 2.13-2.20 (1Н), 3.82-3.90 (2Н), 5.63-5.89 (1Н), 7.73-7.79 (2Н)
Рацемический Пример 8 (88 мг) растворяли в смеси этанол/гексан (1:1), и энантиомеры разделяли при помощи автоматической препаративной жидкостной хроматографии (система Gilson, 250×20 мм внутр. диам. Chiralcel OD, 10 мкм колонка) с использованием смеси этанол/гексан [2:8] в качестве подвижной фазы. Соответствующие фракции объединяли и концентрировали с получением Примера 8а (40 мг) и Примера 8б (40 мг).
Пример 8а: MS (ES): MH+446,8, C15H7Cl2F7N4+Н соответствует 447,0
HPLC: (система Gilson, 250×20 мм внутр. диам. Chiralcel OD, 10 мкм колонка), этанол/гексан [2:8], время удерживания 7,3 мин, энантиомерная чистота 100%.
Пример 8б: MS (ES): MH+446,8, C15H7Cl2F7N4+Н соответствует 447,0
HPLC: (система Gilson, 250×20 мм внутр. диам. Chiralcel OD, 10 мкм колонка), этанол/гексан [2:8], время удерживания 17,4 мин, энантиомерная чистота 100%.
Пример 9
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-(2,2-дифторциклопропил)-1H-пиразол-3-карбонитрил
К раствору Подготовительного примера 31 (560 мг, 1,40 ммоль) и фторида натрия (4,0 мг, 0,12 ммоль) в толуоле (0,8 мл) при 100°С добавляли триметилсилил-2,2-дифтор-2-(фторсульфонил)ацетат (700 мг, 2,8 ммоль) в течение 1 ч, используя шприц. Реакционную смесь затем нагревали с обратным холодильником в течение 1 ч.
К охлажденной реакционной смеси добавляли диоксид кремния и раствор концентрировали в вакууме. Смесь продукт/диоксид кремния частично очищали колоночной хроматографией, элюируя смесью диэтиловый эфир/гексан [1:1], и фракции, содержащие продукт, концентрировали в вакууме. К остатку добавляли метанол (5 мл) и соляную кислоту (2 н, 5 мл) и реакционную смесь нагревали с обратным холодильником в течение 6 ч. Реакционную смесь концентрировали в вакууме и остаток разделяли между диэтиловым эфиром и водой (20 мл). Два слоя разделяли, и органический слой сушили (МgSО4) и концентрировали в вакууме.
Остаток очищали колоночной хроматографией с градиентом элюирования, диэтиловый эфир: гексан [от 1:2 до 1:1]. Соответствующие фракции объединяли и концентрировали с получением Примера 9 (96 мг) в виде белого твердого вещества.
MS (ES): M/Z [MH+] 397,1; предполагаемая масса для c14H7Сl2F5N4+Н составляет 397,0
1H-ЯМР (CDCl3): 1.74-1.83 (1Н), 1.95-2.05 (1Н), 2.44-2.56 (1Н), 3.72-3.84 (2Н), 7.76-7.81 (2Н)
Аналогичным образом, как в Примере 2, был получен:
Пример 10
5-амино-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1-[2,6-дифтор-4-(трифторметил)фенил]-1H-пиразол-3-карбонитрил; из соединения Подготовительного примера 10 (250 мг, 0,51 ммоль) с получением указанного в заголовке соединения (11 мг).
MS (ES): M/Z [MH+] 433,0; предполагаемая масса для C15H6F10N4+Н составляет 433,1
1H-ЯМР (CDCl3): 2.02-2.09 (2Н), 2.29-2.42 (1Н), 4.63-4.76 (1Н), 7.30-7.37 (2Н)
Аналогичным образом, как в Примере 8, были получены:
Пример 11
5-амино-1-[2,6-дихлор-4-пентафтортиофенил]-4-[1-(дифторметил)-2,2-дифторциклопропил]-1Н-пиразол-3-карбонитрил; из соединения Подготовительного примера 11 (655 мг, 1,17 ммоль) с получением рацемического указанного в заголовке соединения (284 мг).
MS (ES): M/Z [MH+] 504,9; предполагаемая масса для C14H7Cl2F9N4S+Н составляет 505,0
1H-ЯМР (CDCl3): 2.00-2.09 (1H), 2.12-2.20 (1H), 3.87-3.96 (2H), 5.61-5.90 (1H), 7.88-7.91 (2H)
Рацемический Пример 11 растворяли в смеси этанол/гексан (1:1), и энантиомеры разделяли при помощи автоматической препаративной жидкостной хроматографии (система Gilson, 250×20 мм внутр. диам. Chiralcel OD, 10 мкм колонка) с использованием смеси этанол/гексан [2:8] в качестве подвижной фазы. Соответствующие фракции объединяли и концентрировали с получением двух энантиомерно обогащенных продуктов, Примера 11а и Примера 11б.
Пример 11а: MS (ES): МН+504,9, C14H7Cl2F9N4S+Н соответствует 505,0
HPLC: (система Gilson, 250×20 мм внутр. диам. Chiralcel OD, 10 мкм колонка), этанол/гексан [2:8], время удерживания 6,40 мин, энантиомерная чистота 100%.
Пример 11б: MS (ES): MH+504,9, C14H7Cl2F9N4S+Н соответствует 505,0
HPLC: (система Gilson, 250×20 мм внутр. диам. Chiralcel OD, 10 мкм колонка), этанол/гексан [2:8], время удерживания 13,89 мин, энантиомерная чистота 100%
Пример 12
5-амино-4-{1-[хлор(фтор)метил]-2,2-дифторциклопропил}-1-[2,6-дихлор-4-(трифторметил)фенил]-1Н-пиразол-3-карбонитрил; из соединения Подготовительного примера 12 (100 мг, 0,19 ммоль) с получением рацемического указанного в заголовке соединения (20 мг).
MS (ES): M/Z [MH+] 462,8; предполагаемая масса для С15Н7Сl3F6N4+Н составляет 463,0
1H-ЯМР (CDCl3): 2.03-2.11 (1H), 2.16-2.25 (1H), 3.84-3.95 (2H), 6.02-6.16 (1H), 7.73-7.80 (2H)
Рацемический Пример 12 растворяли в смеси этанол/гексан (1:1), и энантиомеры разделяли автоматической препаративной жидкостной хроматографией (система Gilson, 250×20 мм внутр. диам. Chiralcel OD, 10 мкм колонка) с использованием смеси этанол/гексан [2:8] в качестве подвижной фазы. Соответствующие фракции объединяли и концентрировали с получением двух энантиомерно обогащенных продуктов, Примера 12а и Примера 12б.
Пример 12а: MS (ES): MH+ 462,9, C15H7Cl3F6N4+Н соответствует 463,0
HPLC: (система Gilson, 250×20 мм внутр. диам. Chiralcel OD, 10 мкм колонка), этанол/гексан [2:8], время удерживания 7,07 мин, энантиомерная чистота 99%
Пример 12б: MS (ES): МН+ 462,9, С15Н7Сl3F6N4+Н соответствует 463,0
HPLC: (система Gilson, 250×20 мм внутр. диам. Chiralcel OD, 10 мкм колонка), этанол/гексан [2:8], время удерживания 21,4 мин, энантиомерная чистота 100%
Пример 13
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[1-(дифторметил)-2,2,3,3-тетрафторциклопропил]-1Н-пиразол-3-карбонитрил; из соединения Подготовительного примера 13 (48 мг, 0,09 ммоль) с получением указанного в заголовке соединения (17 мг).
MS (ES): M/Z [MH+] 482,7; предполагаемая масса для C15H5Cl2F9N4+Н составляет 483,0
1H-ЯМР (CDCl3): 3.84-3.91 (2Н), 5.95-6.24 (1Н), 7.76-7.79 (2Н)
Пример 14
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2,3,3-тетрафтор-1-(трифторметил)циклопропил]-1H-пиразол-3-карбонитрил; из соединения Подготовительного примера 14 (7 мг, 0,01 ммоль) с получением указанного в заголовке соединения (4 мг).
MS (ES): M/Z [MH+] 500,9; предполагаемая масса для C15H4Cl2F10N4+Н составляет 501,0
Пример 15
1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1 -(трифторметил)циклопропил]-5-(метиламино)-1H-пиразол-3-карбонитрил
К раствору Примера 2 (500 мг, 1,08 ммоль) в триэтилортоформиате (13,4 мл) добавляли концентрированную соляную кислоту (несколько капель). Реакционную смесь затем нагревали с обратным холодильником в течение 2,5 ч. Реакционную смесь концентрировали в вакууме и остаток повторно растворяли в толуоле и повторно концентрировали (x 2). К раствору остатка в этаноле (10 мл) при 0°С добавляли боргидрид натрия (90 мг, 2,37 ммоль). Реакционную смесь затем перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли уксусную кислоту (0,5 мл) и воду (10 мл), и смесь экстрагировали этилацетатом (3×10 мл). Объединенные органические фазы сушили (МgSO4) и концентрировали в вакууме. Остаток очищали колоночной хроматографией (силикагель), загружая в толуоле и элюируя толуолом. Соответствующие фракции объединяли и концентрировали с получением рацемического Примера 15 (323 мг).
MS (ES): M/Z [MH+] 478,8; предполагаемая масса для С16Н8Сl2F8N4+Н составляет 479,0
1H-ЯМР (CDCl3): 2.07-2.23 (1Н), 2.42-2.58 (1Н), 2.71-2.76 (3Н), 3.51-3.66 (1Н), 7.73-7.77 (2Н)
Рацемический Пример 15 растворяли в смеси этанол/гексан (1:1), и энантиомеры разделяли при помощи автоматической препаративной жидкостной хроматографии (система Gilson, 250×20 мм внутр. диам. Chiralcel OD, 10 мкм колонка) с использованием смеси этанол/гексан [1:9] в качестве подвижной фазы. Соответствующие фракции объединяли и концентрировали с получением двух энантиомерно обогащенных продуктов Примера 15а и Примера 15б.
Пример 15а: MS (ES): MH+ 478,9, C16H8Cl2F8N4+Н соответствует 479,0
HPLC: (система Gilson, 250×20 мм внутр. диам. Chiralcel OD, 10 мкм колонка), этанол/гексан [1:9], время удерживания 8,67 мин, энантиомерная чистота 100%
Пример 15б: MS (ES): МН+ 478,9, C16H8CI2F8N4+Н соответствует 479,0
HPLC: (система Gilson, 250×20 мм внутр. диам. Chiralcel OD, 10 мкм колонка), этанол/гексан [1:9], время удерживания 11,26 мин, энантиомерная чистота 100%
Аналогично Примеру 8 были получены:
Пример 16
5-амино-1-[2,6-дихлор-4-(трифторметокси)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1H-пиразол-3-карбонитрил; из соединения Подготовительного примера 15 (1,0 г, 1,86 ммоль) с получением рацемического указанного в заголовке соединения (630 мг).
MS (ES): M/Z [MH+] 480,9; предполагаемая масса для C15H6Cl2F8N4O+Н составляет 481,0
1H-ЯМР (CDCl3): 2.05-2.18 (1H), 2.41-2.52 (1H), 3.87-3.95 (2H), 7.37-7.40 (2H)
Рацемический Пример 16 растворяли в смеси этанол/гексан (1:1), и энантиомеры разделяли при помощи автоматической препаративной жидкостной хроматографии (система Gilson, 250×20 мм внутр. диам. Chiralcel OD, 10 мкм колонка) с использованием смеси этанол/гексан [5:95] в качестве подвижной фазы. Соответствующие фракции объединяли и концентрировали с получением двух энантиомерно обогащенных продуктов Примера 16а и Примера 16б.
Пример 16а: MS (ES): MH+ 480,9, С15Н6Сl2F8N4О+Н соответствует 481,0
HPLC: (система Gilson, 250×20 мм внутр. диам. Chiralcel OD, 10 мкм колонка), этанол/гексан [5:95], время удерживания 8,86 мин, энантиомерная чистота 99%
Пример 16б: MS (ES): MH+ 480,9, C15H6CI2F8N4O+Н соответствует 481,0
HPLC: (система Gilson, 250×20 мм внутр. диам. Chiralcel OD, 10 мкм колонка), этанол/гексан [5:95], время удерживания 9,91 мин, энантиомерная чистота 100%
Пример 17
5-амино-1-[2,6-дихлор-4-(трифторметокси)фенил]-4-[1-(дифторметил)-2,2,3,3-тетрафторциклопропил]-1Н-пиразол-3-карбонитрил; из соединения Подготовительного примера 16 (50 мг, 0,09 ммоль) с получением указанного в заголовке соединения (10 мг).
MS (ES): M/Z [MH+] 498,9; предполагаемая масса для C15H5Cl2F9N4O+Н составляет 499,0
1H-ЯМР (CDCl3): 3.86-3.91 (2H), 5.95-6.23 (1H), 7.38-7.40 (2H)
Пример 18
5-амино-1-[2,6-дихлор-4-(трифторметокси)фенил]-4-[1-(дифторметил)-2,2-дифторциклопропил]-1H-пиразол-3-карбонитрил; из соединения Подготовительного примера 17 (3,6 г, 7,0 ммоль) с получением рацемического указанного в заголовке соединения (3,0 г).
MS (ES): M/Z [MH+] 463,0; предполагаемая масса для C15H7Cl2F7N4O+Н составляет 463,0
1H-ЯМР (CDCl3): 2.00-2.08 (1H), 2.10-2.19 (1H), 3.82-4.00 (2H), 5.60-5.90 (1H), 7.35-7.40 (2H)
Рацемический Пример 18 растворяли в смеси этанол/гексан (1:2), и энантиомеры разделяли при помощи автоматической препаративной жидкостной хроматографии (система Gilson, 250×20 мм внутр. диам. Chiralcel OD, 10 мкм колонка) с использованием смеси этанол/гексан [1:9] в качестве подвижной фазы. Соответствующие фракции объединяли и концентрировали с получением двух энантиомерно обогащенных продуктов Примера 18а и Примера 18б.
Пример 18а: MS (ES): MH+ 463,0, C15H7Cl2F7N4O+H соответствует 463,0
HPLC: (система Gilson, 250×20 мм внутр. диам. Chiralcel OD, 10 мкм колонка), этанол/гексан [1:9], время удерживания 13,35 мин, энантиомерная чистота 99%
Пример 18б: MS (ES): MH+ 463,0, C15H7Cl2F7N4O+H соответствует 463,0
HPLC: (система Gilson, 250×20 мм внутр. диам. Chiralcel OD, 10 мкм колонка), этанол/гексан [1:9], время удерживания 31,58 мин, энантиомерная чистота 100%
Пример 19
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(фторметил)циклопропил]-1Н-пиразол-3-карбонитрил; из соединения Подготовительного примера 18 (100 мг, 0,21 ммоль) с получением рацемического указанного в заголовке соединения (17 мг).
MS (ES): M/Z [MH+] 428,9; предполагаемая масса для C15H8Cl2F6N4+Н составляет 429,0
1H-ЯМР (CDCl3): 1.84-1.93 (1H), 1.93-2.02 (1H), 3.68-4.06 (2H), 4.42-4.82 (2H), 7.73-7.78 (2H)
Рацемический Пример 19 растворяли в смеси этанол/гексан (1:1), и энантиомеры разделяли при помощи автоматической препаративной жидкостной хроматографии (система Gilson, 250×20 мм внутр. диам. Chiralcel OD, 10 мкм колонка) с использованием смеси этанол/гексан [1:9] в качестве подвижной фазы. Соответствующие фракции объединяли и концентрировали с получением двух энантиомерно обогащенных продуктов Примера 19а и Примера 19б.
Пример 19а: MS (ES): МН+ 429,0, С15Н8Сl2F6N4+Н соответствует 429,0
HPLC: (система Gilson, 250×20 мм внутр. диам. Chiralcel OD, 10 мкм колонка), этанол/гексан [1:9], время удерживания 14,99 мин, энантиомерная чистота 100%
Пример 19б: MS (ES): MH+ 429,0, C15H8Cl2F6N4+Н соответствует 429,01
HPLC: (система Gilson, 250×20 мм внутр. диам. Chiralcel OD, 10 мкм колонка), этанол/гексан [1:9], время удерживания 20,89 мин, энантиомерная чистота 100%
Пример 20
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-(2,2-дифтор-1-метилциклопропил)-1H-пиразол-3-карбонитрил; из соединения Подготовительного примера 19 (80 мг, 0,17 ммоль) с получением указанного в заголовке соединения (56 мг).
MS (ES); M/Z [MH+] 411,0; предполагаемая масса для C15H9Cl2F5N4+Н составляет 411,0
1H-ЯМР (CDCl3): 1.46-1.50 (3Н), 1.56-1.63 (1Н), 1.69-1.78 (1Н), 3.62-3.76 (2Н), 7.72-7.77 (2Н)
Пример 21
5-амино-1-{2,6-дихлор-4-[(трифторметил)тио]фенил}-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1H-пиразол-3-карбонитрил; из соединения Подготовительного примера 20 (1,8 г, 3,3 ммоль) с получением указанного в заголовке соединения (1,1 г).
MS (ES): M/Z [MH+] 496,9; предполагаемая масса для C15H6Cl2F8N4S+Н составляет 496,9
1H-ЯМР (CDCl3): 2.05-2.18 (1Н), 2.42-2.52 (1Н), 3.86-3.97 (2Н), 7.75-7.80 (2Н)
Пример 22
Этил-3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1H-пиразол-5-илкарбамат
К раствору Примера 2а (100 мг, 0,20 ммоль) в N,N-диметилформамиде (3 мл) добавляли гидрид натрия (10 мг, 0,20 ммоль), затем 1-хлорэтил-этил-карбонат (37 мг, 0,24 ммоль). Реакционную смесь затем перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали в вакууме и остаток растворяли в ацетонитриле (2 мл). Раствор очищали при помощи автоматической препаративной жидкостной хроматографии (система Gilson, 150 мм × 30 мм LUNA II C18 10 мкм колонка) с использованием градиента ацетонитрил: вода [от 60:40 до 95:5]. Соответствующие фракции объединяли и концентрировали с получением Примера 22 (50 мг).
MS (ES): M/Z [MH+] 536,9; предполагаемая масса для C18H10Cl2F8N4O2+Н составляет 537,0
1H-ЯМР (CDCl3): 1.07-1.14 (3Н), 2.09-2.19 (1Н), 2.48-2.57 (1Н), 3.99-4.06 (2Н), 6.16-6.24 (1Н), 7.71-7.76 (2Н)
Аналогичным образом получали:
Пример 23
1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-5-(2-оксо-1,3-оксазолидин-3-ил)-1H-пиразол-3-карбонитрил; из соединения Примера 2а (135 мг, 0,30 ммоль) и 2-бромэтил-хлорформиата (60 мг, 0,33 ммоль) с получением указанного в заголовке соединения (47 мг).
MS (ES): M/Z [MH+] 534,9; предполагаемая масса для C18H8Cl2F8N4O2+Н составляет 535,0
1H-ЯМР (CDCl3): 2.31-2.39 (1Н), 2.54-2.64 (1Н), 4.00-4.10 (2Н), 4.43-4.50 (2Н), 7.75-7.78 (2Н)
Аналогично Примеру 8 получали:
Пример 24
5-амино-1-[3-хлор-5-(трифторметил)пиридин-2-ил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Н-пиразол-3-карбонитрил; из соединения Подготовительного примера 22 (164 мг, 0,34 ммоль) с получением указанного в заголовке соединения (60 мг).
MS (ES): M/Z [MH+] 432,0; предполагаемая масса для C14H6CIF8N5+Н составляет 432,0
1H-ЯМР (CDCl3): 2.02-2.19 (1Н), 2.40-2.54 (1Н), 5.13-5.22 (2Н), 8.19-8.23 (1Н), 8.63-8.67 (1Н)
Пример 25
Гидрохлорид 2-(диметиламино)этил-3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Н-пиразол-5-илкарбамата
К раствору Примера 2а (100 мг, 0,22 ммоль) в безводной смеси дихлорметан/толуол (3:2, 2 мл) добавляли пиридин (40 мкл, 0,50 ммоль) и молекулярные сита (4А). Этот раствор добавляли к фосгену (20% в толуоле, 1,7 н., 300 мкл, 0,50 ммоль) при 0°С и в атмосфере азота, и реакционную смесь оставляли стоять в течение 1 ч. Добавляли 2-(диметиламино)этанол (1 мл) и реакционную смесь оставляли стоять в течение ночи, затем концентрировали в вакууме. Остаток растворяли в ацетонитриле (1,8 мл) и раствор очищали при помощи автоматической препаративной жидкостной хроматографии (система Gilson, 150 мм × 30 мм LUNA II С 18 10 мкм колонка) с использованием градиента ацетонитрил:0,1%-ная трифторуксусная кислота [от 35:65 до 95:5]. Соответствующие фракции объединяли и концентрировали и к остатку добавляли соляную кислоту с получением Примера 25 (100 мг).
MS (ES): M/Z [MH+] 580,0; предполагаемая масса для C20H15Cl2F8N5O2+Н составляет 580,1
1H-ЯМР (CDCl3): 2.21-2.30 (1Н), 2.47-2.56 (2Н), 2.84-2.88 (6Н), 3.19-3.24 (2Н), 4.27-4.39 (2Н), 7.71-7.74 (2Н)
Аналогичным образом получали:
Пример 26
2,2,2-трифторэтил-3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1H-пиразол-5-илкарбамат; из соединения Примера 2а (100 мг, 0,22 ммоль) и 2,2,2-трифторэтанола с получением указанного в заголовке соединения (100 мг).
MS (ES): M/Z [MH+] 590,9; предполагаемая масса для C18H7Cl2F11N4O2+Н составляет 591,0
1H-ЯМР (DMSO): 2.61-2.71 (1Н), 2.89-2.99 (1Н), 4.62-4.73 (2Н), 8.26-8.29 (2Н), 10.89-10.97 (1Н)
Пример 27
5-амино-1-{2,6-дихлор-4-[(трифторметил)сульфонил]фенил}-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Н-пиразол-3-карбонитрил
Смесь Примера 21 (600 мг, 1,2 ммоль) и 3-хлорпероксибензойной кислоты (929 мг, 5,4 ммоль) в дихлорметане (20 мл) перемешивали при комнатной температуре в течение 48 ч. Реакционную смесь промывали водным раствором гидроксида натрия, затем водой и рассолом. Органическую фазу сушили и концентрировали в вакууме. Остаток очищали флэш-хроматографией (силикагель) с градиентом элюирования толуол: дихлорметан [от 1:0 до 0:1]. Соответствующие фракции объединяли и концентрировали в вакууме.
Остаток растворяли в смеси ацетонитрил/вода (1 мл) и раствор очищали при помощи автоматической препаративной жидкостной хроматографии (система Gilson, 150 мм × 30 мм LUNA II С18 10 мкм колонка) с использованием градиента ацетонитрил: вода [от 60:40 до 95:5]. Соответствующие фракции объединяли и концентрировали с получением Примера 27 (27 мг).
MS (ES): M/Z [MH+] 529,0; предполагаемая масса для С15Н6Сl2F8N4O2S+Н составляет 529,0
1H-ЯМР (DMSO): 2.11-2.22 (1Н), 2.59-2.70 (1Н), 6.68-6.73 (2Н), 8.55-8.59 (2Н)
Пример 28
1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-5-[(пиридин-4-илметил)амино]-1H-пиразол-3-карбонитрил
К раствору Подготовительного примера 25 (200 мг, 0,36 ммоль) в безводном метаноле (10 мл)) в атмосфере азота и при 0°С добавляли боргидрид натрия (34 мг, 0,90 ммоль). Реакционную смесь затем перемешивали при комнатной температуре в течение 2 ч. К реакционной смеси добавляли воду и смесь доводили до значения рН 2 добавлением соляной кислоты (4 н.). Затем смесь нейтрализовали добавлением насыщенного водного раствора карбонат натрия, экстрагировали этилацетатом (3×10 мл) и объединенные экстракты сушили (MgSO4) и концентрировали в вакууме. Остаток растворяли в смеси ацетонитрил/вода (3,6 мл), раствор при помощи очищали автоматической препаративной жидкостной хроматографии (система Gilson, 150×30 мм, LUNA II С18 10 мкм колонка) с использованием градиента ацетонитрил:вода [от 55:45 до 95:5]. Соответствующие фракции концентрировали с получением Примера 28 (34 мг).
MS (ES): M/Z [MH+] 556,0; предполагаемая масса для C21H11Cl2F6N5+Н составляет 556,0
1H-ЯМР (CDCl3): 2.20-2.34 (1Н), 2.53-2.67 (1Н), 4.10-4.17 (1Н), 4.18-4.28 (2Н), 7.01-7.05 (2Н), 7.60-7.63 (2Н), 8.44-8.48 (2Н)
Аналогично Примеру 2 получали:
Пример 29
5-амино-1-[2,6-дихлор-4-(дифторметокси)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1 Н-пиразол-3-карбонитрил; из соединения Подготовительного примера 26 (110 мг, 0,21 ммоль) с получением указанного в заголовке соединения (48 мг).
MS (ES): M/Z [MH+] 463,0; предполагаемая масса для C15H7Cl2F7N4O+Н составляет 463.0
1H-ЯМР (CDCl3): 2.01-2.19 (1Н), 2.38-2.51 (1Н), 3.83-3.98 (2Н), 6.38-6.77 (1Н), 7.27-7.32 (2Н)
Пример 30
5-амино-1-[2,6-дихлор-4-пентафтортиофенил]-4-[1-(дифторметил)-2,2,3,3-тетрафторциклопропил]-1H-пиразол-3-карбонитрил; из соединения Подготовительного примера 27 (138 мг, 0,23 ммоль) с получением указанного в заголовке соединения (100 мг).
MS (ES): M/Z [MH+] 541,0; предполагаемая масса для C14H5Cl2F11N4S+Н составляет 541,0
1H-ЯМР (DMSO): 6.51-6.71 (1Н), 6.73-6.76 (2Н), 8.43-8.46 (2Н)
Аналогично Примеру 25 получали:
Пример 31
Изопропил 3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1 Н-пиразол-5-илкарбамат; из соединения Примера 2а (50 мг, 0,11 ммоль) и 2-пропанола с получением указанного в заголовке соединения (44 мг).
MS (ES): M/Z [MH+] 551,0; предполагаемая масса для C19H12Cl2F8N4O2+Н составляет 551,0
1H-ЯМР (DMSO): 0.96-1.04 (6Н), 2.61-2,71 (1Н), 2.87-2.99 (1Н), 4.59-4.67 (1Н), 8.28-8.32 (2Н), 10.15-10.22 (1Н)
Пример 32
Гидрохлорид пиридин-4-илметил-3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Н-пиразол-5-илкарбамата; из соединения Примера 2а (50 мг, 0,11 ммоль) и пиридин-4-метанола с получением указанного в заголовке соединения (5 мг).
MS (ES): M/Z [MH+] 600,0; предполагаемая масса для C22H11Cl2F8N5O2+Н составляет 600,0
1H-ЯМР (CD3OD): 2.24-2.35 (1Н), 2.55-2.65 (1Н), 5.21-5.23 (2Н), 7.65-7.68 (2Н), 7.92-7.94 (2Н), 8.64-8.68 (2Н)
Пример 33
Гидрохлорид пиридин-3-илметил-3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Н-пиразол-5-ил]-карбамата; из соединения Примера 2а (50 мг, 0,11 ммоль) и пиридин-3-метанола с получением указанного в заголовке соединения (24 мг).
MS (ES): M/Z [MH+] 600,0; предполагаемая масса для С22Н11Сl2F8N5O2+Н составляет 600,0.
1H-ЯМР (DMSO): 2.63-2.73 (1Н), 2.84-2.95 (1Н), 5.11-5.16 (2Н), 7.68-7.74 (1Н), 7.95-8.01 (1Н), 8.20-8.26 (2Н), 8.61-8.64 (1Н), 8.68-8.73 (1Н), 10.55-10.68(1Н)
Пример 34
Гидрохлорид пиридин-2-илметил-3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1H-пиразол-5-илкарбамата; из соединения Примера 2а (50 мг, 0,11 ммоль) и пиридин-2-метанола с получением указанного в заголовке соединения (31 мг).
MS (ES): M/Z [MH+] 600,0; предполагаемая масса для C22H11Cl2F8N5O2+Н составляет 600,0
1H-ЯМР (DMSO): 2.65-2.75 (1Н), 2.86-2.97 (1Н), 5.05-5.11 (2Н), 7.11-7.16 (1Н), 7.31-7.37 (1Н), 7.77-7.82 (1Н), 8.21-8.28 (2Н), 8.46-8.51 (1Н), 10.56-10.70 (1Н)
Пример 35
Гидрохлорид 1H-имидазол-5-илметил-3-циано-1 -[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Н-пиразол-5-илкарбамата; из соединения Примера 2а (50 мг, 0,11 ммоль) и 5-(гидроксиметил)имидазола с получением указанного в заголовке соединения (2 мг).
MS (ES): M/Z [MH+] 589,0; предполагаемая масса для С20Н10Сl2F8N6O2+Н составляет 589,0.
Пример 36
Гидрохлорид 2-пирролидин-1-илэтил-3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Н-пиразол-5-илкарбамата; из соединения Примера 2а (50 мг, 0,11 ммоль) и 1-(2-гидроксиэтил)пиридина с получением указанного в заголовке соединения (10 мг).
MS (ES): M/Z [MH+] 606,1; предполагаемая масса для C22H17Cl2F8N5O2+Н составляет 606,1
1H-ЯМР (CD3OD): 1.93-2.01 (4Н), 2.31-2.38 (1Н), 2.56-2.64 (1Н), 3.18-3.23 (4Н), 3.30-3.35 (2Н), 4.21-4.26 (2Н), 7.95-7.99 (2Н)
Аналогично Примеру 8 получали:
Пример 37
5-амино-4-{1-[хлор(дифтор)метил]-2,2-дифторциклопропил}-1-[2,6-дихлор-4-(трифторметил)фенил]-1Н-пиразол-3-карбонитрил; из соединения Подготовительного примера 55 (124 мг, 0,23 ммоль) с получением указанного в заголовке соединения (17 мг).
MS (ES): M/Z [MH+] 480,9; предполагаемая масса для С15Н6Сl3F7N4+Н составляет 480,96
1H-ЯМР (CDCl3): 2.08-2.24 (1Н), 2.46-2.61 (1Н), 3.87-4.00 (2Н), 7.75 -7.79 (2Н)
Рацемический Пример 37 растворяли в смеси этанол/гексан (1:4) и энантиомеры разделяли автоматической препаративной жидкостной хроматографией (система Gilson, 250×20 мм внутр. диам. Chiralcel IA, 5 мкм колонка) с использованием смеси этанол/гексан [5:95] в качестве подвижной фазы. Соответствующие фракции объединяли и концентрировали с получением одного энантиомерно чистого продукта, Примера 37а и нескольких смешанных фракций.
Пример 37а: MS (ES): MH+ 481,0, С15Н6Сl3F7N4+Н соответствует 481,0
HPLC: (система Gilson, 250×20 мм внутр. диам. Chiralcel OD, 10 мкм колонка), этанол/гексан [5:95], время удерживания 10,55 мин, энантиомерная чистота 98%.
Следующие Подготовительные примеры иллюстрируют синтез определенных промежуточных соединений, использованных в получении предшествующих Примеров.
Подготовительный пример 1
N'-{3-Циано-1-[2,6-дихлор-4-(пентафтортио)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1H-пиразол-5-ил}-N,N-диметилимидоформамид
Смесь Подготовительного примера 32 (264 мг, 0,5 ммоль), метилбензоата (100 мкл) и фторида натрия (6 мг) нагревали при 105°С в атмосфере азота. Триметилсилил-2,2-дифтор-2-(фторсульфонил)ацетат (197 мкл, 1,0 ммоль) добавляли по каплям в течение 1 ч и реакционную смесь перемешивали при 105°С. Еще одну порцию триметилсилил-2,2-дифтор-2-(фторсульфонил)ацетата (700 мкл, 3,6 ммоль) добавляли в течение 7 ч, поддерживая температуру реакционной смеси 105°С. К реакционной смеси добавляли дихлорметан (15 мл) и раствор промывали насыщенным водным гидрокарбонатом натрия. Органическую фазу отделяли, сушили (МgSO4) и концентрировали в вакууме. Остаток очищали, используя картридж Isolute™ (силикагель, 20 г), элюируя толуолом. Соответствующие фракции объединяли и концентрировали с получением Подготовительного примера 1 (62 мг) в виде не совсем белого твердого вещества.
MS (ES): M/Z [MH+] 578,3; предполагаемая масса для С17Н11Cl2F10N5S+Н составляет 578,0
1H-ЯМР (CDCl3): 2.15-2.20 (1Н), 2.45-2.55 (1Н), 2.79-2.81 (3H), 3.01 -3.03 (3H), 7.79-7.81 (2Н), 7.88-7.90 (1Н)
Аналогичным образом получали:
Подготовительный пример 2
N'-{3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1H-пиразол-5-ил}-N,N-диметилимидоформамид; из соединения Подготовительного примера 33 (160 мг, 0,34 ммоль) с получением указанного в заголовке соединения (94 мг) в виде бледно-желтого твердого вещества.
MS (ES): M/Z [MH+] 520,2; предполагаемая масса для C18H11CI2F8N5+Н составляет 520,0
1H-ЯМР (CDCl3): 1.99-2.31 (2H), 2.74-2.80 (3H), 2.99-3.00 (3H), 7.64 -7.69 (2H), 7.82-8.02 (1H)
Подготовительный пример 3
N'-{3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[(1R)-1,2,2-трифторциклопропил]-1Н-пиразол-5-ил}-N,N-диметилимидоформамид
К раствору Подготовительного примера 34 (11 мг, 0,026 ммоль) в толуоле (0,2 мл) в атмосфере азота добавляли фенил(трифторметил)-ртуть (45 мг, 0,13 ммоль) и иодид натрия (59 мг, 0,39 ммоль). Реакционную смесь затем нагревали при 85°С в течение 18 ч. К реакционной смеси добавляли толуол (5 мл) и раствор фильтровали через Arbocel для удаления любых остатков Hg. Фильтрат концентрировали в вакууме с получением Подготовительного примера 3 (22 мг).
MS (ES): M/Z [MH+] 470,2; предполагаемая масса для C17H11CI2F6N5+Н составляет 470,0
1H-ЯМР (CDCl3): 2.08-2.31 (2H), 2.81-2.84 (3H), 3.04-3.08 (3H), 7.65-7.69 (2H), 7.85-7.88 (1H)
Аналогичным образом получали:
Подготовительный пример 4
N'-[3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-(пентафторциклопропил)-1H-пиразол-5-ил]-N,N-диметилимидоформамид; из соединения Подготовительного примера 35 (46 мг, 0,1 ммоль) с получением указанного в заголовке соединения (35 мг) в виде белого твердого вещества.
MS (ES): M/Z [MH+] 506.2; предполагаемая масса для C17H9CI2F8N5+Н составляет 506,0
1H-ЯМР (CDCl3): 2.85-2.87 (3H), 3.07-3.09 (3H), 7.67-7.69 (2H), 7.69-7.71 (1H)
Подготовительный пример 5
N'-{3-циано-4-(2,2-дихлор-1-фторциклопропил)-1-[2,6-дихлор-4-(трифторметил)фенил]-1Н-пиразол-5-ил}-N,N-диметилимидоформамид; из соединения Подготовительного примера 34 (42 мг, 0,1 ммоль) и фенил(трихлорметил)ртути (40 мг, 0,1 ммоль) с получением указанного в заголовке соединения (29 мг) в виде белого твердого вещества.
1H-ЯМР (CDCl3): 2.31-2.34 (1H), 2.35-2.38 (1H), 2.82-2.86 (3H), 3.09 -3.13 (3H), 7.66-7.69 (2H), 7.99-8.03 (1H)
Подготовительный пример 6
N'-[3-циано-1-[2,6-дихлор-4-(пентафтортио)фенил]-4-(пентафторциклопропил)-1Н-пиразол-5-ил]-N,N-диметилимидоформамид
К раствору Подготовительного примера 37 (102 мг, 0,20 ммоль) в метилбензоате (4 мл) добавляли фторид натрия (3 мг). Смесь нагревали до 130°С и добавляли триметилсилил-2,2-дифтор-2-(фторсульфонил)ацетат (1 мл, 0,33 ммоль) в течение 10 ч.
Реакционную смесь концентрировали в вакууме и остаток очищали колоночной хроматографией (силикагель, 10 г), элюируя толуолом. Соответствующие фракции объединяли и концентрировали с получением Подготовительного примера 6 (75 мг) в виде бледно-желтого твердого вещества.
MS (ES): M/Z [MH+] 564,2; предполагаемая масса для С16Н9Сl2F10N5S+Н составляет 564,0
1H-ЯМР 2.86-2.90 (3H), 3.07-3.10 (3H), 7.69-7.72 (1H), 7.80-7.85 (2H)
Аналогично Подготовительному примеру 3 получали:
Подготовительный пример 7
N'-[3-циано-1-[2,6-дихлор-4-(пентафтортио)фенил]-4-(1,2,2-трифторциклопропил)-1H-пиразол-5-ил]-N,N-диметилимидоформамид; из соединения Подготовительного примера 38 (100 мг, 0,21 ммоль) с получением указанного в заголовке соединения (90 мг) в виде белого твердого вещества.
MS (ES): M/Z [MH+] 527,9; предполагаемая масса для C16H11Cl2F8N5S+Н составляет 528,0
1H-ЯМР (CDCl3): 2.09-2.29 (2H), 2.82-2.86 (3H), 3.04-3.09 (3H), 7.79 -7.83 (2H), 7.85-7.88 (1H)
Подготовительный пример 8
N'-{3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[1-(дифторметил)винил]-1H-пиразол-5-ил}-N,N-диметилимидоформамид
К суспензии метилтрифенилфосфония бромида (8,9 г, 25,0 ммоль) в тетрагидрофуране (80 мл) при -10°С добавляли по каплям бутиллитий (1,6 М в гексане, 16 мл, 25,0 ммоль). Смесь перемешивали при комнатной температуре в течение 20 мин, затем добавляли Подготовительный пример 39 (7,6 г, 16,7 ммоль) в тетрагидрофуране (16,5 мл). Реакционную смесь затем перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом (2×50 мл). Объединенные органические фазы разделяли и концентрировали на силикагеле. Смесь силикагель/продукт очищали колоночной хроматографией, элюируя дихлорметаном. Соответствующие фракции затем объединяли и концентрировали с получением Подготовительного примера 8 (5,2 г).
MS (ES): M/Z [MH+] 454,0; предполагаемая масса для C17H12CI2F5N5+Н составляет 452,1.
1H-ЯМР (CDCl3): 2.74-2.76 (3Н), 2.91-2.94 (3Н), 5.77-5.79 (1Н), 5.91 -5.94 (1Н), 6.16-6.45 (1Н), 7.62-7.64 (1Н), 7.65-7.68 (2Н)
Подготовительный пример 9
Этиловый эфир 3-циано-2-оксопропионовой кислоты может быть получен согласно Achmatowicz, О., Jr; Szymoniak, J. Tetrahedron (1982), 38(9), 1299-1302
Аналогично Подготовительному примеру 1 получали:
Подготовительный пример 10
N'-{3-циано-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1-[2,6-дифтор-4-(трифторметил)фенил]-1H-пиразол-5-ил}-N,N-диметилимидоформамид; из соединения Подготовительного примера 40 (250 мг, 0,57 ммоль) с получением указанного в заголовке соединения (250 мг).
MS (ES): M/Z [MH+] 488,1; предполагаемая масса для C18H11F10N5+Н составляет 488,1.
Аналогично Подготовительному примеру 3 получали:
Подготовительный пример 11
N'-{3-циано-1-[2,6-дихлор-4-(пентафтортиофенил]-4-[1-(дифторметил)-2,2-дифторциклопропил]-1H-пиразол-5-ил}-N,N-диметилимидоформамид; из соединения Подготовительного примера 41 (820 мг, 1,61 ммоль) с получением указанного в заголовке соединения (655 мг).
MS (ES): M/Z [MH+] 559,9; предполагаемая масса для C17H12CI2F9N5S+Н составляет 560,0
1H-ЯМР (CDCl3): 1.81-1.90 (1Н), 2.03-2.12 (1Н), 2.76-2.79 (3H), 2.99-3.01 (3H), 5.64-5.93 (1Н), 7.78-7.81 (2Н), 7.87-7.89 (1Н)
Подготовительный пример 12
N'-{4-{1[хлор(фтор)метил]-2,2-дифтopциклoпpoпил}-3-циaнo-1-[2,6-дихлор-4-(трифторметил)фенил]-1H-пиразол-5-ил}-N,N-диметилимидоформамид; из соединения Подготовительного примера 42 (150 мг, 0,32 ммоль) с получением указанного в заголовке соединения (100 мг).
MS (ES): M/Z [MH+] 517,9; предполагаемая масса для C18H12Cl3F6N5+Н составляет 518,0
1H-ЯМР (CDCl3): 1.86-1.97 (1Н), 2.05-2.15 (1Н), 2.73-2.80 (3H), 2.95-3.01 (3H), 6.06-6.22 (1Н), 7.63-7.71 (2Н), 7.88-7.94 (1Н)
Подготовительный пример 13
N'-{3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[1-(дифторметил)-2,2,3,3-тетрафторциклопропил]-1H-пиразол-5-ил}-N,N-диметилимидоформамид;
из соединения Подготовительного примера 43 (200 мг, 0,41 ммоль) с получением указанного в заголовке соединения (48 мг).
MS (ES): M/Z [MH+] 537,8; предполагаемая масса для C18H10Cl2F9N5+Н составляет 538,0
Подготовительный пример 14
N'-{3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2,3,3-тетрафтор-1-(трифторметил)циклопропил]-1Н-пиразол-5-ил}-N,N-диметилимидоформамид; из соединения Подготовительного примера 44 (28 мг, 0,06 ммоль) с получением указанного в заголовке соединения (7 мг).
MS (ES): M/Z [MH+] 555,8; предполагаемая масса для C18H9Cl2F10N5+Н составляет 556,0
1H-ЯМР (CDCl3): 2.79-2.81 (3H), 2.99-3.00 (3H), 7.65-7.67 (1Н), 7.67-7.69 (2Н)
Подготовительный пример 15
N'-{3-циано-1-[2,6-дихлор-4-(трифторметокси)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Н-пиразол-5-ил}-N,N-диметилимидоформамид
Используя набор Diazald®, раствор из Diazald® в диэтиловом эфире (45 мл) добавляли по каплям к раствору гидроксида калия (1 М, 89 мл) в воде и этаноле (10 мл) при температуре приблизительно 50°С. Ловушку охлаждали до -30°С и после завершения добавления Diazald® к смеси добавляли диэтиловый эфир (10 мл). Перегонку продолжали, пока дистиллят не обесцвечивался, и диазометановый раствор добавляли к Подготовительному примеру 45 (1,0 г, 1,92 ммоль) в диэтиловом эфире (30 мл). Реакционную смесь затем оставляли стоять при комнатной температуре в течение ночи. Избыток диазометана нейтрализовали добавлением уксусной кислоты и реакционную смесь оставляли выпариваться с получением Подготовительного примера 15 (1,0 г).
MS (ES): M/Z [MH+] 536,0; предполагаемая масса для C18H11Cl2F8N5O+Н составляет 536,0.
Аналогично Подготовительному примеру 3 получали:
Подготовительный пример 16
N'-{3-циано-1-[2,б-дихлор-4-(трифторметокси)фенил]-4-[1-(дифторметил)-2,2,3,3-тетрафторциклопропил]-1H-пиразол-5-ил}-N,N-диметилимидоформамид; из соединения Подготовительного примера 47 (650 мг, 1,3 ммоль) в толуоле с получением указанного в заголовке соединения (50 мг) в виде смеси продуктов.
MS (ES): M/Z [MH+] 553,9; предполагаемая масса для C18H10Cl2F9N5O+Н составляет 554,0
Подготовительный пример 17
N'-{3-циано-1-[2,6-дихлор-4-(трифторметокси)фенил]-4-[1-(дифторметил)-2,2-дифторциклопропил]-1H-пиразол-5-ил}-N,N-диметилимидоформамид; из соединения Подготовительного примера 48 (3,60 г, 7,7 ммоль) с получением указанного в заголовке соединения (3,6 г).
MS (ES): M/Z [MH+] 518,1; предполагаемая масса для C18H12Cl2F7N5O+Н составляет 518,0
1H-ЯМР (CDCl3): 1.82-1.91 (1Н), 2.02-2.11 (1Н), 2.74-2.79 (3H), 2.97-3.00 (3H), 5.64-5.93 (1Н), 7.26-7.31 (2Н), 7.83-7.87 (1Н)
Подготовительный пример 18
N'-{3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(фторметил)циклопропил]-1H-пиразол-5-ил}-N,N-диметилимидоформамид; из соединения Подготовительного примера 49 (100 мг, 0,23 ммоль) с получением указанного в заголовке соединения (100 мг).
MS (ES): M/Z [MH+] 484,0; предполагаемая масса для С18Н13Сl2F6N5+Н составляет 484,1
Подготовительный пример 19
N'-[3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-(2,2-дифтор-1-метилциклопропил)-1H-пиразол-5-ил]-N,N-диметилимидоформамид; из соединения Подготовительного примера 50 (137 мг, 0,33 ммоль) с получением указанного в заголовке соединения (80 мг).
MS (ES): M/Z [MH+] 466,0; предполагаемая масса для C18H14Cl2F5N5+Н составляет 466,1
Аналогично Подготовительному примеру 15 получали:
Подготовительный пример 20
N'-{3-циано-1-{2,6-дихлор-4-[(трифторметил)тио]фенил}-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Н-пиразол-5-ил}-N,N-диметилимидоформамид; из соединения Подготовительного примера 51 (2,50 г, 4,6 ммоль) с получением указанного в заголовке соединения (1,8 г).
MS (ES): M/Z [MH+] 552,9; предполагаемая масса для C18H11Cl2F8N5S+Н составляет 552,0
Подготовительный пример 21
(2,6-дифтор-4-трифторметилфенил)-гидразин
Смесь 1,2,3-трифтор-5-(трифторметил)бензола (300 г, 1,5 ммоль) и гидразина моногидрата (300 г, 6,0 ммоль) в этаноле (1200 мл) нагревали с обратным холодильником в течение ночи. Реакционную смесь концентрировали в вакууме и остаток перекристаллизовали из 2-пропанола с получением Подготовительного примера 21 (194 г).
MS (ES): M/Z [MH+] 213,2; предполагаемая масса для C7H5F5N2+Н составляет 213,1
1H-ЯМР (CDCl3): 3.81-4.08 (2H), 5.23-5.41 (1Н), 7.03-7.14 (2Н)
Аналогично Подготовительному примеру 3 получали:
Подготовительный пример 22
N'-{1-[3-хлор-5-(трифторметил)пиридин-2-ил]-3-циано-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Н-пиразол-5-ил}-N,N-диметилимидоформамид; из соединения Подготовительного примера 52 (800 мг, 1,83 ммоль) с получением указанного в заголовке соединения (260 мг).
MS (ES): M/Z [MH+] 487,2; предполагаемая масса для C17H11ClF8N6+Н составляет 487,1
Подготовительный пример 23
N'-{3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[1-(дифторметил)-2,2-дифторциклопропил]-1H-пиразол-5-ил}-N,N-диметилимидоформамид; из соединения Подготовительного примера 8 (4,52 г, 10,0 ммоль) с получением указанного в заголовке соединения (4,0 г).
MS (ES): M/Z [MH+] 501,92; предполагаемая масса для C18H12Cl2F7N5+Н составляет 502,04
1H-ЯМР (CDCl3): 1.82-1.91 (1Н), 2.03-2.11 (1Н), 2.73-2.78 (3H), 2.97-3.01 (3H), 5.66-5.93 (1Н), 7.63-7.69 (2Н), 7.85-7.89 (1Н)
Подготовительный пример 24
Этил-2,3-дицианопропаноат может быть получен согласно Hainzl, D.; Cole, L. M.; Casida, J. E. Chemical Research in Toxicology (1998), 11(12), 1529-1535
Подготовительный пример 25
1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-5-{[(1Е)-пиридин-4-илметилен]амино}-1H-пиразол-3-карбонитрил
К Примеру 2а (120 мг, 0,26 ммоль) и 4А молекулярным ситам в толуоле (10 мл) добавляли изоникотинальдегид (550 мкл, 6,71 ммоль) и пара-толуолсульфоновую кислоту (каталитическое количество, 5 мг). Реакционную смесь затем нагревали с обратным холодильником, используя аппарат Дина-Старка в течение 9 суток. К реакционной смеси добавляли воду и смесь доводили до значения рН 2 добавлением соляной кислоты (4 н.). Смесь затем нейтрализовали добавлением насыщенного водного раствора карбоната натрия, экстрагировали этилацетатом (3×20 мл) и объединенные экстракты сушили (MgSO4) и концентрировали в вакууме с получением Подготовительного примера 25 (200 мг).
MS (ES): M/Z [MH+] 554,0; предполагаемая масса для C21H9Cl2F8N5+Н составляет 554,0
Аналогично Подготовительному примеру 15 получали:
Подготовительный пример 26
N'-{3-циано-1-[2,6-дихлор-4-(дифторметокси)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1H-пиразол-5-ил}-N,N-диметилимидоформамид; из Подготовительного примера 53 (104 мг, 0,21 ммоль) с получением указанного в заголовке соединения (110 мг).
MS (ES): M/Z [MH+] 518,0; предполагаемая масса для C18H12Cl2F7N5O+Н составляет 518,0
1H-ЯМР (CDCl3): 2.05-2.21 (1H), 2.41-2.55 (1Н), 2.77-2.81 (3H), 2.98-3.00 (3H), 6.36-6.72 (1H), 7.18-7.21 (2Н), 7.22-7.24 (1H)
Аналогично Подготовительному примеру 3 получали:
Подготовительный пример 27
N'-{3-циано-1-[2,6-дихлор-4-пентафтортиофенил]-4-[1-(дифторметил)-2,2,3,3-тетрафторциклопропил]-1H-пиразол-5-ил}-N,N-диметилимидоформамид; из соединения Подготовительного примера 54 (618 мг, 1,13 ммоль) с получением указанного в заголовке соединения (138 мг).
MS (ES): M/Z [MH+] 596,1; предполагаемая масса для C17H10Cl2F11N5S+Н составляет 596,0
1H-ЯМР (CDCl3): 2.78-2.81 (3H), 2.99-3.02 (3H), 5.95-6.24 (1H), 7.76-7.79 (1H), 7.79-7.82 (2Н)
Подготовительный пример 28
2,6-дихлор-4-дифторметокси-анилин
К раствору 4-[(дифторметокси)метил]анилина (15,0 г, 94,3 ммоль) в ацетонитриле (150 мл) добавляли N-хлорсукцинимид (25,2 г, 18,9 ммоль) и реакционную смесь перемешивали в атмосфере азота в течение 2 ч. Реакционную смесь концентрировали в вакууме и остаток разделяли между диэтиловым эфиром (500 мл) и водой (125 мл). Органический слой отделяли, промывали водным раствором тиосульфата натрия, водой и рассолом, сушили (MgSO4) и обрабатывали углем. Раствор затем фильтровали и концентрировали в вакууме. Остаток экстрагировали гексаном (2×300 мл) и объединенные экстракты концентрировали в вакууме с получением Подготовительного примера 28 (13,8 г).
MS (ES): M/Z [MH+] 228; предполагаемая масса для С7Н5Сl2F2NО+Н составляет 227,98
Подготовительный пример 29
Этил-5-амино-1-[2,6-дифтор-4-(трифторметил)фенил]-1Н-пиразол-3-карбоксилат
К раствору Подготовительного примера 9 (92,6 г, 0,66 ммоль) в этаноле (2 л) добавляли Подготовительный пример 21 (95,0 г, 0,45 ммоль) и реакционную смесь нагревали с обратным холодильником в течение ночи. Реакционную смесь охлаждали и добавляли гидрокарбонат натрия (36,0 г, 0,43 ммоль). Смесь затем нагревали с обратным холодильником в течение ночи. Реакционную смесь концентрировали в вакууме и к остатку добавляли диэтиловый эфир (1 л). Раствор фильтровали, промывали водой, соляной кислотой и снова водой, сушили и концентрировали в вакууме. Остаток очищали колоночной хроматографией (силикагель, 70 г), элюируя толуолом. Соответствующие фракции объединяли и концентрировали с получением Подготовительного примера 29 (40 г).
MS (ES): M/Z [MH+] 336,1; предполагаемая масса для C13H10F5N3O2+Н составляет 336,1
Подготовительный пример 30
5-Амино-1-(2,6-дихлор-4-дифторметоксифенил)-1Н-пиразол-3-карбонитрил
К серной кислоте (концентрированная, 21 мл) при 15°С добавляли нитрит натрия (4,8 г, 69,6 ммоль). После перемешивания в течение 1 ч добавляли ледяную уксусную кислоту (17,3 мл), затем по каплям Подготовительный пример 28 (13,8 г, 60,3 ммоль) в уксусной кислоте (33,8 мл), поддерживая температуру смеси ниже 25°С. Раствор нагревали при 50°С в течение 1 ч, охлаждали и добавляли по каплям к смеси Подготовительного примера 24 (10,6 г, 69,6 ммоль), уксусной кислоты (42,8 мл) и смеси лед/вода (55 мл) при 0°С. Реакционную смесь затем перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли дихлорметан (300 мл) и смесь перемешивали. Два слоя разделяли и органический слой промывали водой. К органическому слою добавляли гидроксид аммония (концентрированный, 125 мл) и лед и смесь перемешивали при 5°С в течение 4 ч. Органический слой снова разделяли и перемешивали в течение ночи с активированным углем. Смесь фильтровали через Celite® и фильтрат концентрировали в вакууме. Остаток очищали колоночной хроматографией (Biotope, силикагель, 90 г), элюируя дихлорметаном. Соответствующие фракции объединяли и концентрировали с получением Подготовительного примера 30 (3,1 г).
MS (ES): M/Z [MH+] 319,0; предполагаемая масса для C11H6Cl2F2N4O+Н составляет 319,0
1H-ЯМР (CDCl3): 3.60-3.88 (2Н), 6.38-6.75 (1Н), 7.22-7.23 (1Н), 7.27-7.29 (2Н)
Подготовительный пример 31
N'-{3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-винил-1H-пиразол-5-ил}-N,N-диметилимидоформамид
Раствор Подготовительного примера 57 (500 мг, 1,44 ммоль) в N,N-диметилформамида диметилацетале (6 мл) нагревали с обратным холодильником в течение 1 ч.
Реакционную смесь охлаждали и концентрировали в вакууме. К остатку добавляли диэтиловый эфир (10 мл), затем гексан, пока не выпадал осадок. Раствор затем концентрировали под током азота с получением неочищенного продукта. Неочищенный продукт промывали гексаном и сушили в вакууме с получением Подготовительного примера 31 (560 мг) в виде бледно-желтого твердого вещества.
MS (ES): M/Z [MH+] 402,2; предполагаемая масса для C16H12Cl2F3N5+Н составляет 402,1
1H-ЯМР (CDCl3): 2.81-2.87 (3H), 3.00-3.05 (3H), 5.29-5.36 (1Н), 5.91-6.00 (1Н), 6.35-6.46 (1Н), 7.64-7.67 (1Н), 7.68-7.72 (2Н)
Подготовительный пример 32
N'-{3-циано-1-[2,6-дихлор-4-(пентафтортио)фенил]-4-[1-(трифторметил)винил]-1H-пиразол-5-ил}-N,N-диметилимидоформамид
Смесь Подготовительного примера 58 (4,0 г, 7,1 ммоль), Подготовительного примера 59 (3,0 г, 14,0 ммоль), водного раствора гидрокарбоната натрия (1 М, 40 мл), толуола (100 мл) и метанола (40 мл) дегазировали и помещали в атмосферу азота. К смеси добавляли тетракис(трифенилфосфин)палладий(0) (360 мг) и реакционную смесь дегазировали и нагревали с обратным холодильником в течение 8 ч. Реакционную смесь разделяли между водой (50 мл) и диэтиловым эфиром (75 мл). Два слоя разделяли и водный слой повторно экстрагировали диэтиловым эфиром (3×50 мл). Объединенные органические фазы сушили (Na2SO4) и концентрировали в вакууме. Остаток очищали, используя картридж Isolute™ (силикагель, 25 г) с градиентом элюирования этилацетат: циклогексан [от 1:3 до 1:1]. Соответствующие фракции объединяли и концентрировали и остаток повторно хроматографировали, используя картридж Isolute™ (силикагель, 70 г), элюируя толуолом. Фракции, содержащие продукт, концентрировали с получением Подготовительного примера 32 (1,34 г).
MS (ES): M/Z [MH+] 528,0; предполагаемая масса для C18H11Cl2F8N5S+Н составляет 528,0
1H-ЯМР (CDCl3): 2.74-2.78 (3Н), 2.92-2.97 (3H), 5.85-5.89 (1Н), 6.20-6.24 (1Н), 7.63-7.66 (1Н), 7.79-7.82 (2Н)
Аналогично Подготовительному примеру 31 получали:
Подготовительный пример 33
N'-{3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[1-(трифторметил)винил]-1H-пиразол-5-ил}-N,N-диметилимидоформамид; из соединения Подготовительного примера 60 (170 мг, 0,41 ммоль) с получением указанного в заголовке соединения (140 мг) в виде белого твердого вещества.
MS (ES): M/Z [MH+] 470,2; предполагаемая масса для C17H11CI2F6N5+Н составляет 470,0
1H-ЯМР (CDCl3): 2.76-2.80 (3H), 2.96-3.00 (3H), 5.90-5.92 (1Н), 6.23-6.26 (1Н), 7.66-7.68 (1Н), 7.69-7.72 (2Н)
Подготовительный пример 34
N'-[3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-(1-фторвинил)-1Н-пиразол-5-ил]-N,N-диметилимидоформамид
К раствору Подготовительного примера 62 (2,9 г, 5,7 ммоль) и Подготовительного примера 61 (2,5 г, 7,5 ммоль) в N,N-диметилформамиде (50 мл) в атмосфере азота добавляли тетракис(трифенилфосфин)палладий(0) (330 мг, 0,3 ммоль). Реакционную смесь затем нагревали при 80°С в течение 4 ч. К реакционной смеси добавляли воду (150 мл) и смесь экстрагировали этилацетатом (150 мл). Объединенные экстракты промывали водой (2×100 мл) и насыщенным раствором рассола (100 мл), сушили (MgSO4) и концентрировали в вакууме. Остаток растирали с гексаном и осадок собирали фильтрацией и сушили с получением Подготовительного примера 34 (2,35 г) в виде коричневого твердого вещества.
1H-ЯМР (CDCl3): 2.76-2.78 (3H), 2.99-3.01 (3H), 4.92-5.10 (2Н), 7.66-7.68 (2Н), 7.70-7.73 (1Н)
Подготовительный пример 35
N'-[3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-(трифторвинил)-1H-пиразол-5-ил]-N,N-диметилимидоформамид
К суспензии дихлорбис(трифенилфосфин)палладия II (70 мг) в тетрагидрофуране (2 мл) добавляли диизобутилалюминия гидрид (1,5 М в толуоле, 133 мкл). К этому раствору добавляли бромфторэтилен (200 ммоль), затем Подготовительный пример 64 (1,0 ммоль) и реакционную смесь нагревали с обратным холодильником в атмосфере азота в течение ночи. Реакционную смесь разделяли между этилацетатом (50 мл) и водой и органическую фазу отделяли, промывали рассолом, сушили (MgSO4) и концентрировали в вакууме. Остаток очищали, используя колонку Isolute™ (силикагель, 20 г), элюируя дихлорметаном. Соответствующие фракции объединяли и концентрировали и остаток растворяли в гексане. Полученный в результате осадок отделяли и сушили с получением Подготовительного примера 35 (200 мг) в виде кристаллического твердого вещества.
MS (ES): M/Z [MH+] 456,2; предполагаемая масса для C16H9Cl2F6N5+Н составляет 456,0
1H-ЯМР (CDCl3): 2.77-2.80 (3H), 3.02-3.05 (3H), 7.67-7.69 (2Н), 7.74-7.77 (1Н)
Подготовительный пример 36
2,6-дихлор-4-трифторметилтио-анилин
К раствору Подготовительного примера 97 (4,8 г, 25,0 ммоль) в ацетонитриле (50 мл) при 50°С добавляли N-хлорсукцинимид (6,7 г, 50,0 ммоль). Реакционную смесь затем перемешивали при 50°С в течение 1 ч. К реакционной смеси добавляли воду (150 мл) и смесь экстрагировали дихлорметаном (100 мл). Объединенные экстракты сушили (МgSО4) и концентрировали в вакууме с получением Подготовительного примера 36 (1,0 г).
Подготовительный пример 37
N'-[3-циано-1-[2,6-дихлор-4-(пентафтортио)фенил]-4-(трифторвинил)-1H-пиразол-5-ил]-N,N-диметилимидоформамид
Суспензию цинка Райка (Rieke™) в тетрагидрофуране (5%, 26 мл, 20 ммоль) перемешивали в атмосфере азота. Атмосферу азота меняли на бромтрифторэтилен (примерно 40 ммоль) и раствор перемешивали в течение еще 3 ч. Азот пропускали сквозь раствор и избытку цинка давали осесть, оставляя в супернатантном растворе нужный цинковый реагент. К раствору Подготовительного примера 58 (2,24 г, 4,0 ммоль) и тетракис(трифенилфосфин)палладия(0) (231 мг) в тетрагидрофуране (5 мл) добавляли раствор цинкового реагента (12 мл, примерно 5,0 ммоль). Реакционную смесь затем нагревали с обратным холодильником в атмосфере азота в течение 5 ч. К реакционной смеси добавляли избыток водной уксусной кислоты (разбавленной) и смесь экстрагировали дихлорметаном (150 мл). Экстракты промывали рассолом, сушили (MgSO4) и концентрировали в вакууме. Остаток очищали, используя колонку Isolute™ (силикагель, 50 г), элюируя толуолом. Соответствующие фракции объединяли и концентрировали с получением Подготовительного примера 37 (913 мг).
MS (ES): M/Z [MH+] 514,2; предполагаемая масса для C15H9Cl2F8N5S+Н составляет 514,0
1H-ЯМР (CDCl3): 2.79-2.82 (3Н), 3.03-3.06 (3Н), 7.75-7.77 (1Н), 7.80-7.83 (2Н)
Аналогично Подготовительному примеру 34 получали:
Подготовительный пример 38
N'-[3-циано-1-[2,6-дихлор-4-пентафтортиофенил]-4-(1-фторвинил)-1H-пиразол-5-ил]-N,N-диметилимидоформамид; из соединений Подготовительного примера 58 (380 мг, 0,68 ммоль) и Подготовительного примера 61 (295 мг, 0,88 ммоль) с получением указанного в заголовке соединения (85 мг).
MS (ES): M/Z [MH+] 477,9; предполагаемая масса для C15H11Cl2F6N5S+Н составляет 478,0
1H-ЯМР (CDCl3): 2.77-2.81 (3H), 2.99-3.03 (3H), 4.92-5.09 (2Н), 7.70-7.73 (1Н), 7.79-7.82 (2Н)
Подготовительный пример 39
N'-[3-Циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-(дифторацетил)-1Н-пиразол-5-ил]-N,N-диметилимидоформамид
К раствору Подготовительного примера 62 (12,5 г, 25,0 ммоль) в тетрагидрофуране (50 мл) при -30°С по каплям добавляли изопропилмагния хлорид (2Мв тетрагидрофуране, 13,75 мл, 27,5 ммоль). Реакционную смесь перемешивали при -30°С в течение 30 мин, затем добавили хлорангидрид дифторуксусной кислоты (2 М в тетрагидрофуране, 18,75, 37,5 ммоль). Реакционную смесь затем оставляли нагреваться до комнатной температуры. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали этилацетатом (×3). Объединенные органические фазы промывали насыщенным раствором хлорида натрия, сушили (МgSO4) и концентрировали в вакууме. Остаток перекристаллизовали из диэтилового эфира путем добавлением петролейного эфира с получением Подготовительного примера 39 (7,6 г).
1H-ЯМР (CDCl3): 2.78-2.82 (3Н), 3.08-3.12 (3Н), 6.41-6.69 (1Н), 7.67-7.71 (2Н), 8.49-8.52 (1Н)
Подготовительный пример 40
N'-{3-циано-1-[2,6-дифтор-4-(трифторметил)фенил]-4-[1-(трифторметил)винил]-1Н-пиразол-5-ил}-N,N-диметилимидоформамид
К Подготовительному примеру 66 (2,0 г, 4,26 ммоль) и тетракис(трифенилфосфин)палладию(0) (246 мг, 0,21 ммоль) в N,N-диметилформамиде (70 мл) добавляли раствор Подготовительного примера 65 в тетрагидрофуране (15,75 мл, 6,3 ммоль). Реакционную смесь затем нагревали при 110°С в течение ночи в аппарате, снабженном ловушкой Дина-Старка. Реакционную смесь концентрировали в вакууме и остаток очищали флэш-хроматографией (силикагель), элюируя толуолом. Соответствующие фракции объединяли и концентрировали с получением Подготовительного примера 40 (1,5 г).
MS (ES): M/Z [MH+] 438,0; предполагаемая масса для C17H11F8N5+Н составляет 438,1
1H-ЯМР (CDCl3): 2.78-2.81 (3H), 2.95-2.99 (3H), 5.84-5.87 (1Н), 6.20-6.23 (1Н), 7.28-7.33 (2Н), 7.64-7.68 (1Н)
Подготовительный пример 41
N'-{3-Циано-1-[2,6-дихлор-4-пентафтортиофенил]-4-[1-(дифторметил)винил]-1Н-пиразол-5-ил}-N,N-диметилимидоформамид
К раствору бромида метилтрифенилфосфония (1,80 г, 5,05 ммоль) в тетрагидрофуране (20 мл) с помощью шприца при 0°С добавляли н-бутиллитий (1,6 н. в гексане, 3,2 мл, 5,05 ммоль). После перемешивания в течение 15 мин добавляли Подготовительный пример 67 (1,72 г, 3,37 ммоль) в тетрагидрофуране (10 мл) и реакционную смесь перемешивали при комнатной температуре в течение 2,5 ч. К реакционной смеси добавляли воду (50 мл) и смесь экстрагировали этилацетатом (3×30 мл). Объединенные органические фазы сушили (МgSO4) и концентрировали в вакууме. Остаток очищали колоночной хроматографией (силикагель) с градиентом элюирования этилацетат: гексан [от 1:4 до 1:2]. Соответствующие фракции объединяли и концентрировали с получением Подготовительного примера 41 (1,40 г).
MS (ES): M/Z [MH+] 509,9; предполагаемая масса для C16H12Cl2F7N5S+Н составляет 510,0
1H-ЯМР (CDCl3): 2.75-2.78 (3Н), 2.91-2.95 (3Н), 5.76-5.78 (1Н), 5.91-5.94 (1Н), 6.14-6.43 (1Н), 7.63-7.65 (1Н), 7.79-7.82 (2Н)
Аналогично Подготовительному примеру 41 получали:
Подготовительный пример 42
N'-{4-{1-[хлор(фтор)метил]винил}-3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-1Н-пиразол-5-ил}-N,N-диметилимидоформамид; из соединения Подготовительного примера 68 (800 мг, 1,70 ммоль) с получением указанного в заголовке соединения (800 мг).
MS (ES): M/Z [MH+] 468,1; предполагаемая масса для C17H12Cl2F4N5+Н составляет 468,0
1H-ЯМР (CDCl3): 2.75-2.78 (3Н), 2.91-2.94 (3Н), 5.67-5.70 (1Н), 5.91-5.95 (1Н), 6.72-6.86 (1Н), 7.65-7.68 (2Н), 7.70-7.73 (1Н)
Подготовительный пример 43
N'-{3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[1-(дифторметил)-2,2-дифторвинил]-1Н-пиразол-5-ил}-N,N-диметилимидоформамид
К раствору трифенилфосфина (524 мг, 2,0 ммоль) в N,N-диметилформамиде (5 мл) в атмосфере азота добавляли дибромдифторметан (420 мг, 2,0 ммоль). Смесь перемешивали при комнатной температуре в течение 30 мин, затем добавляли Подготовительный пример 39 (454 мг, 1,0 ммоль) в N,N-диметилформамиде (1 мл). К смеси добавляли цинк Райка (Rieke®) (130 мг, 2,0 ммоль) и реакционную смесь перемешивали в течение 1 ч. Реакционную смесь концентрировали в вакууме и остаток очищали флэш-хроматографией (силикагель), элюируя дихлорметаном. Соответствующие фракции объединяли и концентрировали с получением Подготовительного примера 43 (410 мг).
MS (ES): M/Z [MH+] 487,8; предполагаемая масса для C17H10CI2F7N5+Н составляет 488,0
1H-ЯМР (CDCl3): 2.74-2.77 (3Н), 2.95-2.98 (3H), 6.43-6.72 (1Н), 7.66-7.68 (2Н), 7.69-7.70 (1Н)
Подготовительный пример 44
N'-{3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)винил]-1Н-пиразол-5-ил}-N,N-диметилимидоформамид
Суспензии цинка Райка (Rieke®) в тетрагидрофуране (15,6 мл, 12,0 ммоль) давали осесть и удаляли как можно больше тетрагидрофурана. К цинку Райка (Rieke®) затем добавляли безводный N,N-диметилформамид (25 мл) и раствор перемешивали в атмосфере азота. 2-Бромпентафторпропен (1,05 г, 5,0 ммоль) конденсировали в охлажденном сосуде в атмосфере азота и медленно добавляли к раствору цинка с помощью шприца. Реакционную смесь затем перемешивали при комнатной температуре в течение 12 ч. К Подготовительному примеру 62 (1,04 г, 2.0 ммоль) и тетракис(трифенилфосфин)палладию(0) (120 мг) в атмосфере азота добавляли раствор цинкового реагента в N,N-диметилформамиде (12 мл, примерно 4,0 ммоль). Реакционную смесь перемешивали при 90°С в течение 3 ч и затем при 100°С в течение 6 ч. Реакционную смесь разделяли между этилацетатом и разбавленной соляной кислотой. Органический слой отделяли, сушили (MgSO4) и концентрировали в вакууме. Остаток очищали, используя колонку Isolute™ (силикагель, 50 г), элюируя толуолом. Фракции, содержащие продукт, концентрировали и остаток растворяли в смеси ацетонитрил/вода/диметилсульфоксид (12:1:3, 1,6 мл). Этот раствор затем очищали при помощи автоматической препаративной жидкостной хроматографии (система Gilson, 150×30 мм Luna C18 5 мкм колонка), используя градиент ацетонитрил:вода [от 65:35 до 95:5]. Соответствующие фракции концентрировали в вакууме с получением Подготовительного примера 44 (28 мг).
MS (ES): M/Z [MH+] 506,0; предполагаемая масса для C17H9Cl2F8N5+Н составляет 506,0
1H-ЯМР (CDCl3): 2.74-2.81 (3Н), 2.96-3.02 (3Н), 7.62-7.66 (1Н), 7.66-7.71 (2Н)
Подготовительный пример 45
N'-{3-Циано-1-[2,6-дихлор-4-(трифторметокси)фенил]-4-[2,2-дифтор-1-(трифторметил)винил]-1Н-пиразол-5-ил}-N,N-диметилимидоформамид
К раствору Подготовительного примера 71 (6,7 г, 13,7 ммоль) в N,N-диметилформамиде (60 мл) добавляли трифенилфосфин (21,6 г, 82,3 ммоль) и дибромдифторметан (8,6 г, 41,2 ммоль). Реакционную смесь затем перемешивали в атмосфере азота при комнатной температуре в течение 5 суток. Реакционную смесь концентрировали в вакууме и остаток очищали флэш-хроматографией (силикагель), с градиентом элюирования толуол: дихлорметан [от 1:0 до 1:2]. Соответствующие фракции объединяли и концентрировали с получением Подготовительного примера 45 (2,8 г).
MS (ES): M/Z [MH+] 522,0; предполагаемая масса для C17H9Cl2F8N5O+Н составляет 522,0
Подготовительный пример 46
Этил-2,3-дицианопропаноат
К раствору этилцианоацетата (916,0 г, 8,10 моль) в N,N-диметилформамиде (2,5 л) медленно добавляли гликолонитрил (700,0 г, 6,75 моль) в воде (55%-ый раствор). К смеси добавляли карбонат калия (932,7 г, 6,75 моль) в течение 1,5 ч, следя затем, чтобы температура реакции не превышала 30°С. Реакционную смесь затем перемешивали при комнатной температуре в течение ночи. Реакционную смесь фильтровали и фильтрат доводили до значения рН 3 добавлением кислоты. Органическую фазу отделяли и частично концентрировали в вакууме. К концентрату добавляли диэтиловый эфир (1 л) и раствор промывали водой (5×1 л), сушили (MgSO4) и концентрировали в вакууме с получением Подготовительного примера 46 (803 г).
1H-ЯМР (CDCl3): 1.28-1.34 (3Н), 2.95-3.01 (2Н), 3.84-3.89 (1Н), 4.27-4.33 (2Н)
Аналогично Подготовительному примеру 43 получали:
Подготовительный пример 47
N'-{3-циано-1-[2,6-дихлор-4-(трифторметокси)фенил]-4-[1-(дифторметил)-2,2-дифторвинил]-1Н-пиразол-5-ил}-N,N-диметилимидоформамид; из соединения Подготовительного примера 72 (1,1 г, 2,3 ммоль) с получением указанного в заголовке соединения (650 мг).
1H-ЯМР (CDCl3): 2.74-2.78 (3Н), 2.93-2.98 (3Н), 6.42-6.71 (1Н), 7.28-7.31 (2Н), 7.65-7.69 (1Н)
Подготовительный пример 48
N'-{3-циано-1-[2,6-дихлор-4-(трифторметокси)фенил]-4-[1-(дифторметил)винил]-1Н-пиразол-5-ил}-N,N-диметилимидоформамид
Смесь трет-бутилата калия (1 М раствор, 11,7 мл, 11.7 ммоль) и метилтрифенилфосфония бромида (3,91 г, 14,0 ммоль) в циклогексане (50 мл) перемешивали при 50°С в течение 45 мин и затем охлаждали до 10°С. Добавляли раствор Подготовительного примера 72 (4,40 г, 9,36 ммоль) в дихлорметане (20 мл) и реакционную смесь оставляли нагреваться до комнатной температуры. Реакционную смесь концентрировали в вакууме и остаток очищали флэш-хроматографией (силикагель) с градиентом элюирования толуолгдихлорметан [1:0 до 0:1]. Соответствующие фракции объединяли и концентрировали с получением Подготовительного примера 48 (3,6 г).
MS (ES): M/Z [MH+] 468,0; предполагаемая масса для C17H12Cl2F5N5O+Н составляет 468,0
1H-ЯМР (CDCl3): 2.74-2.78 (3H), 2.90-2.95 (3H), 5.76-5.80 (1Н), 5.89-5.93 (1Н), 6.16-6.46 (1Н), 7.27-7.31 (2Н), 7.58-7.62 (1Н)
Аналогично получали:
Подготовительный пример 49
N'-{3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[1-(фторметил)винил]-1H-пиразол-5-ил}-N,N-диметилимидоформамид; из соединения Подготовительного примера 73 (370 мг, 0,85 ммоль) с получением указанного в заголовке соединения (242 мг).
MS (ES): M/Z [MH+] 434,0; предполагаемая масса для C17H13Cl2F4N5+Н составляет 434,1
1H-ЯМР (CDCl3): 2.78-2.81 (3Н), 2.92-2.95 (3Н), 4.95-4.98 (1Н), 5.07-5.10 (1Н), 5.61-5.64 (2Н), 7.61-7.64 (1 Н), 7.65-7.68 (2Н)
Подготовительный пример 50
N'-{3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-изопропенил-1H-пиразол-5-ил}-N,N-диметилимидоформамид
К раствору тетрабутиламмония хлорида (204 мг, 0,69 ммоль) в ацетонитриле (7 мл) добавляли молекулярные сита (4А, 3,0 г). Через 30 мин раствор декантировали и добавляли к Подготовительному примеру 74 (100 мг, 0,23 ммоль). Эту смесь охлаждали до -10°С и добавляли по каплям тионилхлорид (33,5 мкл, 0,46 ммоль). После перемешивания в течение 15 мин добавляли метилмеркаптид натрия (32 мг, 0,46 ммоль) и реакционную смесь оставляли нагреваться до комнатной температуры в течение ночи. Реакционную смесь концентрировали в вакууме и к остатку добавляли дихлорметан (50 мл). Раствор промывали водой (3×35 мл), сушили (MgSO4) и концентрировали в вакууме. Остаток пропускали через патрон из силикагеля, элюируя дихлорметаном. Фильтрат концентрировали в вакууме с получением Подготовительного примера 50 (137 мг).
MS (ES): M/Z [MH+] 416,0; предполагаемая масса для С17Н14Cl2F3N5+Н составляет 416,1
1H-ЯМР (CDCl3): 2.01-2.03 (3Н), 2.76-2.78 (3Н), 2.93-2.97 (3Н), 5.20-5.22 (1Н), 5.30-5.33 (1Н), 7.59-7.60 (1Н), 7.64-7.67 (2Н)
Аналогично Подготовительному примеру 43 получали:
Подготовительный пример 51
N'-{3-циано-1-[2,6-дихлор-4-(трифторметокси)фенил]-4-[1-(дифторметил)винил]-1Н-пиразол-5-ил}-N,N-диметилимидоформамид; из соединения Подготовительного примера 75 (6,50 г, 12,9 ммоль) с получением указанного в заголовке соединения (2,5 г).
MS (ES): M/Z [MH+] 537,9; предполагаемая масса для C17H9Cl2F8N5S+Н составляет 538,0
1H-ЯМР (CDCl3): 2.74-2.77 (3H), 2.96-2.99 (3H), 7.60-7.63 (1Н), 7.68-7.72 (2Н)
Аналогично Подготовительному примеру 48 получали:
Подготовительный пример 52
N'-{1-[3-хлор-5-(трифторметил)пиридин-2-ил]-3-циано-4-[1-(трифторметил)винил]-1Н-пиразол-5-ил}-N,N-диметилимидоформамид; из соединения Подготовительного примера 76 (1,00 г, 2,3 ммоль) с получением указанного в заголовке соединения (820 мг).
MS (ES): M/Z [MH+] 437,0; предполагаемая масса для C16H11CIF6N6+Н составляет 437,1
1H-ЯМР (CDCl3): 2.89-2.91 (3H), 2.98-3.01 (3H), 5.96-5.98 (1H), 6.26-6.28 (1H), 7.65-7.68 (1H), 8.14-8.16 (1H), 8.69-8.71 (1H)
Аналогично Подготовительному примеру 43 получали:
Подготовительный пример 53
N'-{3-циано-1-[2,6-дихлор-4-(дифторметокси)фенил]-4-[2,2-дифтор-1-(трифторметил)винил]-1H-пиразол-5-ил}-N,N-диметилимидоформамид; из соединения Подготовительного примера 77 (425 мг, 0,9 ммоль) с получением указанного в заголовке соединения (107 мг).
MS (ES): M/Z [MH+] 504,0; предполагаемая масса для C17H10Cl2F7N5O+Н составляет 504,0
1H-ЯМР (CDCl3): 2.77-2.80 (3H), 2.96-2.99 (3H), 6.36-6.72 (1H), 7.20-7.22 (2H), 7.58-7.60 (1H)
Подготовительный пример 54
N'-{3-циано-1-[2,6-дихлор-4-пентафтортиофенил]-4-[1-(дифторметил)-2,2-дифторвинил]-1H-пиразол-5-ил}-N,N-диметилимидоформамид; из соединения Подготовительного примера 67 (1,02 г, 2,0 ммоль) с получением указанного в заголовке соединения (612 мг).
MS (ES): M/Z [MH+] 546,1; предполагаемая масса для C16H10Cl2F9N5S+Н составляет 546,0
Аналогично Подготовительному примеру 3 получали:
Подготовительный пример 55
N'-{4-{1-[хлор(дифтop)мeтил]-2,2-дифтopциклoпpoпил}-3-циaнo-1-[2,6-дихлор-4-(трифторметил)фенил]-1H-пиразол-5-ил}-N,N-диметилимидоформамид; из соединения Подготовительного примера 78 (100 мг, 0,2 ммоль) с получением указанного в заголовке соединения (124 мг).
MS (ES): M/Z [MH+] 535,9; предполагаемая масса для С18Н11Сl3F7N5+Н составляет 536,0
Подготовительный пример 56
5-амино-1-[2,6-дифтор-4-(трифторметил)фенил]-1Н-пиразол-3-карбоксамид
Смесь Подготовительного примера 29 (600 мг, 1,79 ммоль), метанола (5 мл) и гидроксида аммония (5 мл) нагревали при 50°С в течение 5 ч. Реакционную смесь концентрировали в вакууме и остаток очищали колоночной хроматографией (силикагель), элюируя смесью дихлорметан/этилацетат [1:1]. Соответствующие фракции объединяли и концентрировали с получением указанного в заголовке соединения (210 мг).
MS (ES): M/Z [MH+] 307,1; предполагаемая масса для C11H7F5N4O+Н составляет 307,06
1H-ЯМР (CD3OD): 5.93-5.95 (1Н), 7.58-7.64 (2Н)
Подготовительный пример 57
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-винил-1H-пиразол-3-карбонитрил может быть получен согласно ЕР 933363 А1, WO 9824767 или WO 9804530.
Аналогично Подготовительному примеру 31 получали:
Подготовительный пример 58
N'-{3-циано-1-[2,6-дихлор-4-(пентафтортио)фенил]-4-иодо-1Н-пиразол-5-ил}-N,N-диметилимидоформамид; из соединения Подготовительного примера 79 (52 г, 103 ммоль) с получением указанного в заголовке соединения (45 г) в виде светло-коричневого твердого соединения.
1H-ЯМР (CDCl3): 2.77-2.81 (3Н), 3.02-3.05 (3Н), 7.78-7.81 (2Н), 8.21-8.24 (1Н)
Подготовительный пример 59
1-(трифторметил)винилбороновая кислота
К магниевой стружке (5,83 г, 0,24 моль) в тетрагидрофуране (400 мл) по каплям добавляли триметилборат (68,13 мл, 0,6 моль). Реакционную смесь охлаждали до 0°С и по каплям добавляли 2-бром-3,3,3-трифторпропен (20,75 мл, 0,2 моль). Реакционную смесь затем оставляли нагреваться до комнатной температуры и перемешивали в атмосфере азота в течение ночи. Реакционную смесь затем снова охлаждали до 0°С и по каплям добавляли соляную кислоту (5 М, 200 мл), следя за тем, чтобы температура раствора оставалась ниже 10°С. Реакционную смесь затем перемешивали в атмосфере азота в течение 48 ч. К реакционной смеси добавляли диэтиловый эфир (100 мл) и воду (200 мл) с получением двух фаз. Водный слой отделяли и экстрагировали диэтиловым эфиром (100 мл). Объединенные органические фазы промывали водой (100 мл), сушили (MgSO4) и концентрировали в вакууме. К остатку добавляли циклогексан (50 мл), что приводило к образованию осадка. Осадок отделяли декантированием раствора, промывали циклогексаном и сушили в вакууме с получением Подготовительного примера 59 (2,62 г, 0,02 моль) в виде белого твердого вещества.
1H-ЯМР (DMSO): 5.50-5.57 (1Н), 5.80-5.88 (1Н), 6.22-6.36 (2Н)
Подготовительный пример 60
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[1-(трифторметил)винил]-1H-пиразол-3-карбонитрил
К смеси Подготовительного примера 82 (223 мг, 0,5 ммоль) и Подготовительного примера 59 (212 мг, 1,0 ммоль) в атмосфере азота добавляли дегазированный раствор тетракис(трифенилфосфин)палладия(0) (2 мол.%, 23 мг) в толуоле (10 мл) и метаноле (2 мл). К этой смеси добавляли водный раствор карбоната натрия (1 М, 2 мл) и двухфазную реакционную смесь нагревали в атмосфере азота, при 85°С, в течение 22 ч. Реакционную смесь охлаждали, разбавляли диэтиловым эфиром и органический слой отделяли. Затем его промывали водой (2×5 мл), сушили (MgSO4) и концентрировали в потоке азота. Остаток очищали, используя картридж Isolute™ (силикагель, 10 г) с градиентом элюирования циклогексакдихлорметан [от 3:2 до 1:1]. Соответствующие фракции объединяли и концентрировали с получением Подготовительного примера 60 (138 мг).
MS (ES): M/Z [MH+] 415,1; предполагаемая масса для С14Н6Сl2F6N4+Н составляет 415,0
1H-ЯМР (CDCl3): 3.90-3.98 (2Н), 5.96-5.99 (1Н), 6.25-6.28 (1Н), 7.80-7.82 (2Н)
Подготовительный пример 61
Трибутил(1-фторвинил)станнан
К раствору Подготовительного примера 83 (4,7 г, 19,4 ммоль) в безводном N,N-диметилформамиде (50 мл) в атмосфере азота добавляли бис(трибутилолово)оксид (6 мл, 11,7 ммоль) и фторид цезия (500 мг, 1,94 ммоль). Реакционную смесь затем перемешивали в течение ночи при комнатной температуре. Реакционную смесь разбавляли водой (100 мл) и экстрагировали смесью гексана и диэтилового эфира (3:1, 150 мл). Экстракты промывали водой (2×50 мл) и насыщенным рассолом (50 мл), сушили (MgSO4) и концентрировали в вакууме с получением Подготовительного примера 61 (5,1 г) в виде бесцветного масла.
1H-ЯМР (CDCl3): 0.85-0.89 (9Н), 0.91-1.06 (6Н), 1.27-1.35 (7Н), 1.40-1.63 (6Н), 4.41-4.64 (1 Н), 5.14-5.43 (1 Н)
Аналогично Подготовительному примеру 31 получали:
Подготовительный пример 62
N'-{3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-йод-1H-пиразол-5-ил}-N,N-диметилимидоформамид; из соединения Подготовительного примера 82 (0,5 г, 1,12 ммоль) с получением указанного в заголовке соединения в виде желтого кристаллического твердого вещества.
MS (ES): M/Z [MH+] 502,1; предполагаемая масса для C14H9Cl2F3IN5+Н составляет 501,9
1H-ЯМР (CDCl3): 2.78-2.82 (3Н), 3.03-3.08 (3Н), 7.67-7.71 (2Н), 8.23-8.27 (1Н)
Подготовительный пример 63
N'-{3-Циано-1-[2,6-дихлор-4-(дифторметокси)фенил]-1Н-пиразол-5-ил}-N,N-диметилимидоформамид; из соединения Подготовительного примера 30 (3,1 г, 9,7 ммоль) с получением указанного в заголовке соединения (3,5 г).
MS (ES): M/Z [МН+] 374,0; предполагаемая масса для С14Н11Сl2F2N5О+Н составляет 374,0
1H-ЯМР (CDCl3): 2.76-2.80 (3Н), 2.99-3.03 (3Н), 6.14-6.17 (1Н), 6.35-6.72 (1Н), 7.11-7.15 (1Н), 7.21-7.24 (1Н), 7.70-7.73 (1Н)
Подготовительный пример 64
(3-Циано-1-[2,6-дихлор-4-(трифторметил)фенил]-5-{[(1E)-(диметиламино)метилен]амино}-1H-пиразол-4-ил)(йод)цинк
К раствору Подготовительного примера 62 (5,02 г, 10,0 ммоль) в тетрагидрофуране (24 мл) в атмосфере азота добавляли цинк Райка (Rieke® (1,31 г, 20,0 ммоль) в виде суспензии в тетрагидрофуране (26 мл). Реакционную смесь затем перемешивали в течение ночи при комнатной температуре. Давали возможность осесть избытку металлического цинка и раствор, содержащий Подготовительный пример 64 (0,2 моль на литр), использовали непосредственно на следующей стадии.
Подготовительный пример 65
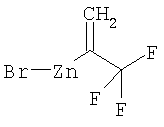
К раствору цинка Райка (Rieke®) (5% в тетрагидрофуране, 7,8 г, 157 мл, 120,0 ммоль) в тетрагидрофуране (43 мл) в атмосфере азота добавляли 2-бром-3,3,3-трифторпроп-1-ен (14,0 г, 80,0 ммоль). Реакционную смесь перемешивали в течение ночи и раствор Подготовительного примера 65 использовали без дополнительной очистки.
Аналогично Подготовительному примеру 31 получали:
Подготовительный пример 66
N'-{3-Циано-1-[2,6-дифтор-4-(трифторметил)фенил]-4-йод-1Н-пиразол-5-ил}-N,N-диметилимидоформамид; из соединения Подготовительного примера 84 (2,2 г, 5,3 ммоль) с получением указанного в заголовке соединения (2,3 г).
1H-ЯМР (CDCl3): 2.79-2.82 (3Н), 3.03-3.06 (3Н), 7.27-7.33 (2Н), 8.22-8.25 (1Н)
Аналогично Подготовительному примеру 39 получали:
Подготовительный пример 67
N'-[3-циано-1-[2,6-дихлор-4-пентафтортиофенил]-4-(дифторацетил)-1Н-пиразол-5-ил]-N,N-диметилимидоформамид; из соединения Подготовительного примера 58 (2,50 г, 4,47 ммоль) изопропилмагния (1,72 г).
MS (ES): M/Z [MH+] 511,8; предполагаемая масса для C15H10Cl2F7N5OS+Н составляет 512,0
1H-ЯМР (CDCl3): 2.81-2.83 (3Н), 3.09-3.13 (3Н), 6.41-6.69 (1Н), 7.82-7.85 (2Н), 8.51-8.54(1Н)
Подготовительный пример 68
N'-{4-[хлор(фтор)ацетил]-3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-1Н-пиразол-5-ил}-N,N-диметилимидоформамид; из соединения Подготовительного примера 62 (1,0 г, 1,99 ммоль) изопропилмагния (800 мг).
MS (ES): M/Z [MH+] 470,0; предполагаемая масса для С16Н10Сl3F4N5О+Н составляет 470,0
1H-ЯМР (CDCl3): 2.79-2.84 (3Н), 3.07-3.12 (3Н), 7.20-7.24 (1Н), 7.67-7.71 (2Н), 8.45-8.48 (1Н)
Подготовительный пример 69
5-Амино-1-(3-хлор-5-трифторметилпиридин-2-ил)-1Н-пиразол-3-карбонитрил
Может быть получен согласно ЕР 500209.
Подготовительный пример 70 5-амино-1-{2,6-дихлор-4-[(трифторметил)тио]фенил}-1H-пиразол-3-карбонитрил
Нитрит натрия (224 мг, 3,25 ммоль) осторожно добавляли к серной кислоте (концентрированная, 1 мл), следя за тем, чтобы температура не поднималась выше 30°С. После перемешивания при 15°С в течение 1 ч добавляли уксусную кислоту (2 мл), затем Подготовительный пример 36 (850 мг, 3,24 ммоль) в уксусной кислоте (3 мл). Реакционную смесь затем нагревали при 50°С в течение 1 ч и охлаждали до комнатной температуры. К раствору Подготовительного примера 24 (500 мг, 3,29 ммоль) в уксусной кислоте (5 мл) добавляли ледяную воду (5 мл), затем при 0°С по каплям добавляли раствор диазониевой соли. После завершения добавления добавляли гидроксид аммония (6 мл) и реакционную смесь перемешивали в течение ночи при комнатной температуре.
Реакционную смесь фильтровали через Arbocel® и фильтрат концентрировали в вакууме. Остаток разделяли между дихлорметаном и водой и органическую фазу отделяли, сушили (Na2SO4) и концентрировали в вакууме с получением Подготовительного примера 70 (1,0 г).
MS (ES): M/Z [MH+] 353,0; предполагаемая масса для С11H5Сl2F3N4S+Н составляет 353,0
1H-ЯМР (CDCl3): 6.01-6.03 (1Н), 7.75-7.78 (2Н)
Подготовительный пример 71
N'-[3-циано-1-[2,6-дихлор-4-(трифторметокси)фенил]-4-(трифторацетил)-1Н-пиразол-5-ил]-N,N-диметилимидоформамид
К раствору Подготовительного примера 87 (6,0 г, 15,3 ммоль) в пиридине (75 мл) по каплям добавляли трифторуксусный ангидрид (4,32 мл, 6,4 г, 30,6 ммоль). Реакционную смесь затем перемешивали при комнатной температуре в атмосфере азота в течение ночи. Реакционную смесь концентрировали в вакууме и остаток очищали флэш-хроматографией (силикагель), элюируя толуолом. Соответствующие фракции объединяли и концентрировали с получением смеси защищенного продукта и продукта со снятой защитой. К остатку добавляли дихлорметан, затем N,N-диметилформамида диметилацеталь (5 мл). Смесь перемешивали в течение ночи при комнатной температура и затем концентрировали в вакууме с получением Подготовительного примера 71 (6,7 г).
MS (ES): M/Z [MH+] 488,0; предполагаемая масса для C16H9CI2F6N5O2+Н составляет 488,0
1H-ЯМР (CDCl3): 2.80-2.84 (3Н), 3.09-3.13 (3Н), 7.30-7.33 (2Н), 8.30-8.34 (1Н)
Аналогично Подготовительному примеру 39 получали:
Подготовительный пример 72
N'-[3-циано-1-[2,6-дихлор-4-(трифторметокси)фенил]-4-(дифторацетил)-1Н-пиразол-5-ил]-N,N-диметилимидоформамид; из соединения Подготовительного примера 89 (6,20 г, 12,0 ммоль) изопропилмагния (4,4 г).
MS (ES): M/Z [MH+] 470,0; предполагаемая масса для C16H10Cl2F5N5O2+Н составляет 470,0
1H-ЯМР (CDCl3): 2.79-2.83 (3H), 3.08-3.12 (3H), 6.41-6.69 (1Н), 7.30-7.33 (2Н), 8.46-8.49 (1Н)
Подготовительный пример 73
N'-[3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-(фторацетил)-1H-пиразол-5-ил]-N,N-диметилимидоформамид
К Подготовительному примеру 91 (550 мг, 1,44 ммоль) в дихлорметане (10 мл) добавляли N,N-диметилформамида диметилацеталь (190 мг, 1,59 ммоль) и реакционную смесь перемешивали при 35°С в течение 1 ч. Реакционную смесь концентрировали в вакууме и остаток пропускали через патрон из силикагеля, элюируя дихлорметаном. Фильтрат концентрировали в вакууме с получением Подготовительного примера 73 (370 мг).
1H-ЯМР (CDCl3): 2.77-2.79 (3H), 3.08-3.11 (3H), 5.43-5.46 (1Н), 5.55-5.57 (1Н), 7.67-7.70 (2Н), 8.63-8.66 (1Н)
Подготовительный пример 74
N'-[3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-(1-гидрокси-1-метилэтил)-1Н-пиразол-5-ил]-N,N-диметилимидоформамид
К раствору Подготовительного примера 62 (1,0 г, 2,0 ммоль) в тетрагидрофуране (15 мл), при -30°С и в атмосфере азота, добавляли по каплям изопропилмагния хлорид (2 М в тетрагидрофуране, 1,2 мл, 2,4 ммоль). После перемешивания в течение 1 ч с помощью шприца добавляли ацетон (5 мл) и реакционную смесь оставляли нагреваться до комнатной температуры. К реакционной смеси добавляли воду (7 мл) и твердый карбонат натрия (примерно 20 г). Смесь перемешивали в течение 15 мин, фильтровали и остаток промывали дихлорметаном. Органическую фазу затем отделяли, сушили и концентрировали в вакууме. Остаток пропускали через патрон из диоксида кремния, элюируя дихлорметаном, затем диэтиловым эфиром. Фильтрат концентрировали в вакууме с получением указанного в заголовке соединения (280 мг).
MS (ES): M/Z [MH+] 434,0; предполагаемая масса для C17H16Cl2F3N5O+Н составляет 434,1
1H-ЯМР (CDCl3): 1.65-1.69 (6Н), 2.79-2.82 (3H), 2.85-2.88 (3H), 3.36-3.41 (1Н), 7.40-7.42 (1Н), 7.65-7.69 (2Н)
Подготовительный пример 75
N'-[3-циано-1-{2,6-дихлор-4-[(трифторметил)тио]фенил}-4-(трифторацетил)-1Н-пиразол-5-ил]-N,N-диметилимидоформамид
К раствору Подготовительного примера 92 (8,50 г, 20,8 ммоль) в безводном пиридине (100 мл) по каплям добавляли трифторуксусный ангидрид (8,75 г, 41,6 ммоль). Реакционную смесь затем перемешивали в течение ночи при комнатной температура. Реакционную смесь концентрировали в вакууме и остаток очищали флэш-хроматографией (силикагель) с градиентом элюирования, толуол: дихлорметан [от 1:0 до 1:1]. Соответствующие фракции объединяли и концентрировали с получением Подготовительного примера 75 (7,1 г).
MS (ES): M/Z [MH+] 504,0; предполагаемая масса для С16Н9Сl2F6N5OS+Н составляет 504,0
1H-ЯМР (CDCl3): 2.78-2.81 (3H), 3.09-3.12 (3H), 7.70-7.73 (2Н), 8.34-8.37 (1Н)
Аналогично Подготовительному примеру 31 получали:
Подготовительный пример 76
N'-[1-[3-хлор-5-(трифторметил)пиридин-2-ил]-3-циано-4-(трифторацетил)-1H-пиразол-5-ил]-N,N-диметилимидоформамид; из соединения Подготовительного примера 93 (5,98 г, 15,6 ммоль) с получением указанного в заголовке соединения (6,3 г).
MS (ES): M/Z [MH+] 439,0; предполагаемая масса для C15H9ClF6N6O+Н составляет 439,1
1H-ЯМР (CDCl3): 2.83-2.86 (3Н), 3.11-3.14 (3H), 8.13-8.15 (1Н), 8.33-8.35 (1Н), 8.76-8.79 (1Н)
Аналогично Подготовительному примеру 39 получали:
Подготовительный пример 77
N'-[3-циано-1-[2,6-дихлор-4-(дифторметокси)фенил]-4-(трифторацетил)-1Н-пиразол-5-ил]-N,N-диметилимидоформамид; из соединения Подготовительного примера 94 (0,50 г, 1,0 ммоль) с получением указанного в заголовке соединения (425 мг).
MS (ES): M/Z [MH+] 470,0; предполагаемая масса для C16H10Cl2F5N5O2+Н составляет 470,0
Аналогично Подготовительному примеру 48 получали:
Подготовительный пример 78
N′-{4-{1-[хлор(дифтор)метил]винил}-3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-1Н-пиразол-5-ил}-N,N-диметилимидоформамид; из соединения Подготовительного примера 96 (1,20 г, 2,5 ммоль) с получением указанного в заголовке соединения (1,1 г).
MS (ES): M/Z [MH+] 485,9; предполагаемая масса для С17Н11Сl3F5N5+Н составляет 486,0
1H-ЯМР (CDCl3): 2.72-2.75 (3H), 2.93-2.95 (3H), 5.76-5.78 (1Н), 6.18-6.20 (1Н), 7.66-7.68 (2Н), 7.74-7.77 (1Н)
Подготовительный пример 79
5-амино-1-[2,6-дихлор-4-(пентафтортио)фенил]-4-йод-1H-пиразол-3-карбонитрил
К раствору Подготовительного примера 95 (40,0 г, 106 ммоль) в ацетонитриле (400 мл) добавляли N-йодсукцинимид (26.4 g, 117 ммоль) и реакционную смесь перемешивали при комнатной температура в течение ночи. Реакционную смесь разбавляли этилацетатом (1 л) и промывали водным раствором тиосульфата натрия (10%, 3×500 мл) и рассолом (500 мл). Органическую фазу сушили (MgSO4) и концентрировали в вакууме с получением Подготовительного примера 79 (53 г) в виде коричневого твердого вещества.
1H-ЯМР (CDCl3): 3.87-3.94 (2Н), 7.88-7.90 (2Н)
Подготовительный пример 80
5-Амино-4-(2-бромацетил)-1-(2,6-дихлор-4-трифторметилфенил)-1Н-пиразол-3-карбонитрил может быть получен согласно US 6069157 или ЕР 846686
Аналогично Подготовительному примеру 79 получали:
Подготовительный пример 81
5-Амино-1-(2,6-дихлор-4-трифторметоксифенил)-4-йод-1Н-пиразол-3-карбонитрил; из соединения Подготовительного примера 88 (5,0 г, 14,8 ммоль) с получением указанного в заголовке соединения (6,8 г).
MS (ES): M/Z [MH+] 462.8; предполагаемая масса для С11Н4Сl2F3IN4О+Н составляет 462,9
Подготовительный пример 82
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-йод-1H-пиразол-3-карбонитрил может быть получен согласно US 6069157, ЕР 933363, WO 9828278
Подготовительный пример 83
(1-фторвинил)(метил)дифенилсилан
К раствору литиевой проволоки (2,08 г, 300 ммоль) в сухом тетрагидрофуране (150 мл) добавляли метилдифенилсилилхлорид (15,8 мл, 75 ммоль) и каталитическое количество йода. Реакционную смесь обрабатывали ультразвуком в течение 40 мин и затем перемешивали в течение ночи при комнатной температуре. Реакционную смесь охлаждали до -78°С и через смесь в течение 30 мин пропускали 1,1-дифторэтилен (примерно 225 ммоль). Смесь перемешивали при -78°С в течение 2 ч и затем нагревали до комнатной температуры.
Реакционную смесь гасили насыщенным раствором хлорида аммония и экстрагировали циклогексаном (×2). Объединенные экстракты промывали рассолом, сушили (MgSO4) и концентрировали в вакууме. Остаток очищали колоночной хроматографией (силикагель, 1 кг), элюируя гексан, затем циклогексаном. Соответствующие фракции объединяли и концентрировали с получением Подготовительного примера 83 (7 г) в виде бесцветного масла.
1H-ЯМР (CDCl3): 0.76-0.81 (3H), 4.82-5.01 (1H), 5.48-5.60 (1H), 7.39-7.51 (6H), 7.61-7.71 (4H)
Аналогично Подготовительному примеру 79 получали:
Подготовительный пример 84
5-Амино-1-(2,6-дифтор-4-трифторметилфенил)-4-йод-1Н-пиразол-3-карбонитрил; из соединения Подготовительного примера 90 (2,00 г, 6,9 ммоль) с получением указанного в заголовке соединения (2,2 г).
1H-ЯМР (CDCl3): 3.89-4.04 (2Н), 7.39-7.45 (2Н)
Подготовительный пример 85
Дифторацетилхлорид
К дифторуксусной кислоте (6,0 г, 3,93 мл, 62,5 ммоль) при -10°С добавляли пентахлорид фосфора (14,3 г, 68,8 ммоль). Реакционную смесь перемешивали при 0°С в течение 10 мин и затем нагревали до 80°С.
Реакционную смесь перегоняли и собирали фракцию продукта при-78°С с получением Подготовительного примера 85 (30 г) [точка кипения 25-30°С].
1H-ЯМР (CDCl3): 5.76-6.07 (1H)
Подготовительный пример 86
Хлорфторацетилхлорид
К пентахлориду фосфора (10,2 г, 49,1 ммоль) добавляли по каплям хлорфторуксусную кислоту (5,0 г, 44,6 ммоль) при 0°С.
Реакционную смесь оставляли нагреваться до комнатной температуры и перегоняли при атмосферном давлении (×2) с получением Подготовительного примера 86 (5,0 г, точка кипения 65°С).
1H-ЯМР (CDCl3): 6.29-6.44 (1H)
Аналогично Подготовительному примеру 31 получали:
Подготовительный пример 87
N'-{3-циано-1-[2,6-дихлор-4-(трифторметокси)фенил]-1Н-пиразол-5-ил}-N,N-диметилимидоформамид; из соединения Подготовительного примера 88 (7,0 г, 20,8 ммоль) с получением указанного в заголовке соединения (6,2 г).
MS (ES): M/Z [MH+] 392,0; предполагаемая масса для С14Н10Сl2F3N5О+Н составляет 392,0
1H-ЯМР (CDCl3): 2.77-2.82 (3H), 3.00-3.04 (3H), 6.15-6.17 (1H), 7.27-7.31 (2Н), 7.70-7.75 (1H)
Подготовительный пример 88
5-Амино-1-(2,6-дихлор-4-трифторметоксифенил)-1Н-пиразол-3-карбонитрил
К серной кислоте (18М, 54 мл) добавляли нитрит натрия (13,9 г, 201,2 ммоль), и раствор перемешивали при 15°С в течение 1 ч. К раствору добавляли уксусную кислоту (200 мл), затем 2,6-дихлор-4-(трифторметокси)анилин (45,0 г, 182,9 ммоль) в уксусной кислоте (90 мл) следя за тем, чтобы температура раствора не поднималась выше 20°С. После завершения добавления смесь нагревали при 50°С в течение 1 ч, охлаждали до комнатной температуры и добавляли по каплям к раствору Подготовительного примера 46 (27,8 г, 182,9 ммоль) в уксусной кислоте (115 мл) и ледяной воде (145 мл). Реакционную смесь затем перемешивали в течение ночи при комнатной температуре. К реакционной смеси добавляли дихлорметан (500 мл) и смесь перемешивали в течение 10 мин. Две фазы разделяли и органическую фазу промывали водой (200 мл) и добавляли по каплям аммиак (0,88, 400 мл), поддерживая температуру смеси ниже 10°C. Эту смесь перемешивали в течение ночи при комнатной температуре и органическую фазу отделяли и концентрировали в вакууме.
Остаток перекристаллизовали из смеси толуол/пентан [2:1] с получением Подготовительного примера 88 (22,4 г).
MS (ES): M/Z [MH+] 337,0; предполагаемая масса для C11H5Cl2F3N4O+Н составляет 337,0
1H-ЯМР (CDCl3): 3.66-3.82 (2Н), 5.99-6.01 (1Н), 7.35-7.38 (2Н)
Аналогично Подготовительному примеру 31 получали:
Подготовительный пример 89
N'-{3-циано-1-[2,6-дихлор-4-(трифторметокси)фенил]-4-йод-1Н-пиразол-5-ил}-N,N-диметилимидоформамид; из соединения Подготовительного примера 81 (6,8 г, 14,7 ммоль) с получением указанного в заголовке соединения (6,2 г).
1H-ЯМР (CDCl3): 2.76-2.79 (3H), 3.01-3.04 (3H), 7.27-7.30 (2Н), 8.17-8.20 (1Н)
Подготовительный пример 90
5-Амино-1-(2,6-дифтор-4-трифторметилфенил)-1Н-пиразол-3-карбонитрил
Раствор Подготовительного примера 56 (400 мг, 1,19 ммоль) в оксихлориде фосфора (20 мл) нагревали с обратным холодильником в течение 1 ч. Реакционную смесь гасили добавлением воды и полученную смесь экстрагировали дихлорметаном. Объединенные экстракты затем сушили (MgSO4) и концентрировали в вакууме. Остаток очищали колоночной хроматографией (силикагель), элюируя дихлорметаном. Соответствующие фракции объединяли и концентрировали с получением Подготовительного примера 90 (250 мг).
MS (ES): M/Z [MH+] 289,0; предполагаемая масса для C11H5F5N4+Н составляет 289,1
1H-ЯМР (CDCl3): 3.76-3.87 (2Н), 6.02-6.04 (1Н), 7.37-7.43 (2Н)
Подготовительный пример 91
5-Амино-1-(2,6-дихлор-4-трифторметилфенил)-4-(2-фторацетил)-1Н-пиразол-3-карбонитрил
К раствору Подготовительного примера 80 (800 мг, 1,80 ммоль) в толуоле (20 мл) добавляли 18-Краун-6 (85,6 мг, 3,24 ммоль) и фторид калия (безводный, 210 мг, 3,60 ммоль) в толуоле (20 мл). Реакционную смесь затем нагревали при 90°С в течение 2 суток.
Реакционную смесь концентрировали в вакууме и остаток пропускали через патрон из диоксид кремния, элюируя диэтиловым эфиром. Фильтрат концентрировали в вакууме с получением Подготовительного примера 91 (500 мг).
MS (ES): M/Z [MH+] 380,9; предполагаемая масса для С13Н6Сl2F4N4O+Н составляет 381,0
1H-ЯМР (CDCl3): 5.38-5.40 (1Н), 5.50-5.52 (1Н), 5.84-5.90 (2Н), 7.79-7.81 (2Н)
Аналогично Подготовительному примеру 31 получали:
Подготовительный пример 92
N'-(3-циано-1-{2,6-дихлор-4-[(трифторметил)тио]фенил}-1H-пиразол-5-ил)-N,N-диметилимидоформамид; из соединения Подготовительного примера 70 (1,0 г, 2,93 ммоль) с получением указанного в заголовке соединения (720 мг).
MS (ES): M/Z [MH+] 408,0; предполагаемая масса для C14H10Cl2F3N5S+Н составляет 408,0
1H-ЯМР (CDCl3): 2.80-2.84 (3H), 3.01-3.06 (3H), 6.18-6.22 (1Н), 7.68-7.70 (2Н), 7.71-7.73(1Н)
Подготовительный пример 93
5-Амино-1-(3-хлор-5-трифторметилпиридин-2-ил)-4-(2,2,2-трифторацетил)-1Н-пиразол-3-карбонитрил
К раствору Подготовительного примера 69 (4,50 г, 15,6 ммоль) в пиридине (45 мл) при 0°С добавляли по каплям трифторуксусный ангидрид (8,8 мл, 62,6 ммоль). Реакционную смесь затем перемешивали при комнатной температуре в течение 3 ч.
Реакционную смесь концентрировали в вакууме, и к остатку добавляли тетрагидрофуран (20 мл) и соляную кислоту (10%, 20 мл). Реакционную смесь затем нагревали с обратным холодильником в течение 1,5 ч.
К реакционной смеси добавляли этилацетат и два слоя разделяли. Водный слой экстрагировали этилацетатом (3×30 мл) и объединенные органические фазы промывали соляной кислотой (10%, 2×30 мл) и водным раствором гидрокарбоната натрия (3×30 мл), сушили (MgSO4) и концентрировали в вакууме с получением Подготовительного примера 93 (6,1 г).
MS (ES): M/Z [MH+] 383,9; предполагаемая масса для С12Н4СlF6N5O+Н составляет 384,0
1H-ЯМР (CDCl3): 7.54-7.64 (2Н), 8.24-8.27 (1Н), 8.67-8.69 (1Н)
Аналогично Подготовительному примеру 79 получали:
Подготовительный пример 94
N'-{3-циано-1-[2,6-дихлор-4-(дифторметокси)фенил]-4-йод-1Н-пиразол-5-ил}-N,N-диметилимидоформамид; из соединения Подготовительного примера 63 (2,44 г, 6,5 ммоль) с получением указанного в заголовке соединения (3,1 г).
MS (ES): M/Z [MH+] 500,0; предполагаемая масса для C14H10Cl2F2IN5O+Н составляет 499,9
Подготовительный пример 95
5-амино-1-[2,6-дихлор-4-(пентафтортио)фенил]-1Н-пиразол-3-карбонитрил
может быть получен согласно WO 9306089, ЕР605469.
Аналогично Подготовительному примеру 39 получали:
Подготовительный пример 96
N'-{4-[хлор(дифтор)ацетил]-3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-1Н-пиразол-5-ил}-N,N-Диметилимидоформамид; из соединения Подготовительного примера 62 (5,0 г, 10,0 ммоль) с получением указанного в заголовке соединения (2,9 г).
MS (ES): M/Z [MH+] 487,9; предполагаемая масса для C16H9CI3F5N5O+Н составляет 488,0
1H-ЯМР (CDCl3): 2.80-2.83 (3H), 3.09-3.13 (3H), 7.68-7.71 (2Н), 8.28-8.31 (1Н)
Подготовительный пример 97
4-Трифторметилтио-анилин может быть получен согласно ЕР 546391 А2
Подготовительный пример 98
5-Амино-1-(2,6-дихлор-4-трифторметилфенил)-4-(1-гидрокси-2,2,2-трифтор-1-трифторметилэтил)-1Н-пиразол-3-карбонитрил
5-Амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил)пиразол, смотри ЕР295117 (15 г, 46 ммоль, 1 экв.) растворяли в полуторагидрате гексафторацетона и реакционную смесь нагревали при 100°С. Через 2 часа ЖХ-МС анализ показал завершение реакции (единственный пик [487]). После охлаждения до КТ добавляли этилацетат (500 мл) и все неочищенное вещество промывали водой (50 мл), затем рассолом (2×50 мл), затем сушили над сульфатом магния, фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения в виде коричневого твердого вещества, содержащего следы растворителя (22 г), которое использовали как таковое на следующей стадии.
Подготовительный пример 99
N'-[4-(1-Гидрокси-2,2,2-трифтор-1-трифторметилэтил)-5-циано-2-(2,6-дихлор-4-трифторметилфенил)-2Н-пиразол-3-ил]-N,N-диметилформамидин
Соединение из Подготовительного примера 99 (22 г неочищенного продукта из вышеописанного примера, примерно 46 ммоль, 1 экв.) суспендировали в дихлорметане (DCM) в атмосфере азота. Затем к реакционной смеси медленно (за 1 мин) добавляли диметилформамида диметоксиацеталь (99+, 7 г, 8 мл, 56 ммоль, 1,2 экв.). Реакционную смесь нагревали до 40°С и оставляли перемешиваться в течение одного часа. Неочищенную смесь затем концентрировали в вакууме и разбавляли эфиром (600 мл), затем промывали водой (2×50 мл) и сушили над порошкообразным MgSO4, фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения в виде коричневого твердого вещества (20,5 г).
Подготовительный пример 100
N'-[4-(1-Хлор-2,2,2-трифтор-1-трифторметилэтил)-5-циано-2-(2,6-дихлор-4-трифторметилфенил)-2Н-пиразол-3-ил]-N,N-диметилформамидин Соединение из Подготовительного примера 99 (20,5 г, 37 ммоль, 1 экв.) растворяли в безводном ацетонитриле и медленно с помощью шприца добавляли тионилхлорид (44 г, 27 мл, 370 ммоль, 10 экв.). Реакционную смесь нагревали до 85°С в течение двух часов до завершения реакции, затем к охлажденной смеси добавляли 200 мл циклогексана и отфильтровывали бледно-желтый порошок (9 г). Оставшийся неочищенный продукт затем адсорбировали на силикагель, сушили и элюировали на подушке из силикагеля с помощью DCM. Нужные фракции объединяли и концентрировали с получением бледно-желтого масла, которое затвердевало при стоянии (11 г) с получением указанного в заголовке соединения с суммарным выходом 20 г.
LCMS (сочетание жидкостной хроматографии и масс-спектрометрии) [561]
Подготовительный пример 101
N'-[5-Циано-2-(2,6-дихлор-4-трифторметилфенил)-4-(2,2-дифтор-1-трифторметилвинил)-2Н-пиразол-3-ил]-N,N-диметилформамидин Соединение из Подготовительного примера 100 (20 г, 35 ммоль) растворяли в 500 мл безводного THF и добавляли 150 мл суспензии 5 г/100 мл цинка Райка (7,5 г, 110 ммоль, 3 экв.). Через 3 часа LCMS анализ показал количественное превращение в перфторизопропенильное соединение (единственный пик [506]). Неочищенную смесь фильтровали через подушку из целита и затем адсорбировали на силикагеле. Силикагелевую подушку затем элюировали толуолом с получением указанного в заголовке соединения в виде белого твердого вещества (16 г)
Подготовительный пример 102
N'-[5-Циано-2-(2,6-дихлор-4-трифторметилфенил)-4-(2,2-дифтор-1-трифторметилциклопропил)-2Н-пиразол-3-ил]-N,N-диметилформамидин
Диазометан получали, используя набор Aldrich Diazald kit (процедура AL-180) на 15 грамм диазальда. Свежеприготовленный раствор диазометана смешивают с соединением из Подготовительного примера 101 (16 г, 31 ммоль, растворенный в безводном THF) и полученный желтый раствор оставляют стоять в течение 2 часов при КТ. LCMS анализ показал полное превращение (91% указанного в заголовке соединения [520], 5% побочного продукта, предположительно соответствующего пиразолину [548], и 4% неизвестного побочного продукта). После концентрирования в вакууме полученное желтое твердое соединение (17 г) использовали без дополнительной очистки на следующей стадии.
Данные по биологической активности
Новое противоэктопаразитарное средство, PF241851, представляющее собой 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-(2,2-дифтор-1-трифторметилциклопропил)-1Н-пиразол-3-карбонитрил, вводили крупному рогатому скоту само по себе и в комбинации с дорамектином (UK-67994), чтобы оценить эффективность против всех паразических стадий Rhipicephalus (Boophilus) microplus. В исследовании участвовали 4 группы, каждая из которых включала 6 коров.
Группа 1 получала однократную дозу 1,0 мг/кг PF241851 (5,0%) и 0,6 мг/кг дорамектина (3,0%). Группа 2 получала 1 мг/кг PF241851 (5%). Группа 3 получала 0,6 мг/кг дорамектина (3%). Группа 4 являлась контрольной. Все дозы готовили в смеси касторове масло/этилолеат (60/40). Коров помещали по отдельности в решетчатые загоны. Начиная с 23 суток коров заражали паразитами в количестве десять раз по 5000 личинок в течение 3 недель до начала лечения. Животных случайным образом распределяли на группы лечения и контрольную группу на основании подсчета упавших взрослых самок клещей в сутки -3, -2 и -1. В сутки 0, до лечения, всех животных взвешивали. Лечение проводили в виде однократной болюсной подкожной инъекции в область шеи справа с величиной дозы 1 мл/50 кг массы тела (1,0 мг РР241851/кг и 0,6 мг дорамектина/кг). Начиная с суток 3 ежесуточно собирали всех налившихся кровью взрослых самок клещей, падающих с животных. Для оценки эффективности у коров поддерживали заражение паразитами два раза в неделю, начиная с 5000 особей в сутки 1, так чтобы противоакарицидную активность можно было определить по истечении 21 суток после лечения. Эффективность экспериментальных препаратов рассчитывали на основании следующей формулы:
процент эффективности=[1-(Та×Cb)/(Tb×Са)]×100
где
Та = среднее количество налившихся кровью самок клещей, собранных с группы лечения после введения дозы;
Тb = среднее количество налившихся кровью самок клещей, собранных с группы лечения за трое суток до введения дозы;
Са = среднее количество налившихся кровью самок клещей, собранных с контрольных животных за период после лечения;
Сb = среднее количество налившихся кровью самок клещей, собранных с контрольных животных за трое суток до введения дозы;
Данные по эффективности, выраженные в процентах, представлены в таблице ниже и на чертеже .
Начало эффективной активности (больше или равной 90%) для комбинации наступало несколько быстрее, чем для соединений, вводимых по отдельности. Комбинация демонстрировала постоянную повышенную эффективность в течение по меньшей мере 15 суток и на 25 суток дольше, чем соединение формулы 1 и дорамектин по отдельности.
Реферат
Изобретение относится к комбинированному продукту, содержащему соединение формулы (I): ! ! где R1 и R2 представляют собой СF3; R3 и R4 представляют собой фторо; R5 и R6 представляют собой водород; R7 представляет собой Сl; Х представляет собой CR8, где R8 представляет собой Сl; и R9 представляет собой NH2; или его ветеринарно приемлемую соль, и б) дорамектин. Изобретение также относится к противопаразитарной ветеринарной композиции на основе указанного комбинированного продукта. Технический результат - получение комбинированного продукта, который может быть использован в ветеринарии для лечения паразитарной инфекции у млекопитающих. 4 н.п. ф-лы, 1 ил., 1 табл.
Формула
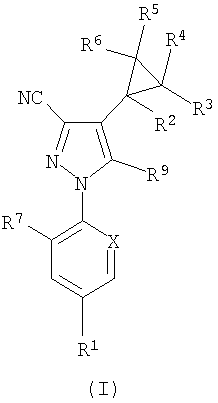
где R1 и R2 представляют собой СF3;
R3 и R4 представляют собой фторо;
R5 и R6 представляют собой водород;
R7 представляет собой Сl;
Х представляет собой CR8, где R8 представляет собой С1; и
R9 представляет собой NH2; или его ветеринарно приемлемую соль,
и б) дорамектин.
Документы, цитированные в отчёте о поиске
Производные n-фенилпиразола

Комментарии