Производные бензилиденазолилметилциклоалкана или алкена, способ их получения, промежуточные соединения и фунгицидная композиция на их основе - RU2096406C1
Код документа: RU2096406C1
Чертежи

Описание
Изобретение относится к новым соединениям для фитосанитарного использования с группами бензилиденазолилметилциклоалкан или циклоалкен. Оно относится также к способам получения указанных соединений и к продуктам, которые в известных случаях могут использоваться в качестве промежуточных. Оно относится к использованию этих соединений в качестве фунгицидов, к фунгицидным композициям на базе этих соединений к способам борьбы с фунгицидными болезнями культур с использованием этих соединений. Оно относится также к продукту размножения культивированных растений, подвергшихся защитной обработке соединением изобретения.
Известны многие продукты с триазольными группами, в частности фунгициды. По европейским заявкам на патент N 152084, 246982, 121979, 89100 известны триазольные фунгициды с тетрагидрофурановым циклом. По европейским заявкам на патент N 272895, 267778, ФРГ N 3 630 840, Бельгии N 867245 известны триазольные фунгициды с циклопентановым циклом. По европейской заявке на патент N 324646 и по заявке США N 4684396 известны триазольные фунгициды с циклоалкановой группой. По патенту США N 4160838 известны триазольные фунгициды с диоксолановым циклом.
Таким образом, с учетом этого уровня техники целью настоящего изобретения является предложение других фунгицидных соединений широкого спектра, полезных, в частности, при лечении болезней корня типа грибковой болезни полегания злаковых или листа типа бидиума, септориоза, пирикулариоза, фузариозов, ринхоспориоза, болезней, вызванных патогенными грибками, такими как Botrytis, Phoma, Ascochyta, в различных культурах, таких как, например, зерновые культуры, виноград, рис, кукуруза, соя.
Эти соединения
отличаются тем, что они отвечают нижеприведенным формулам IA или IB:
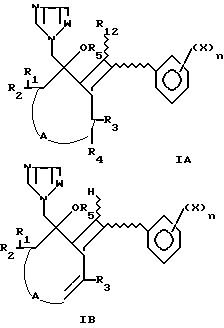
в которых: А означает -CR6R7- или -CR6R7CR8CR9-, или -CR6R7CR8R9CR10R11-
A1 означает CR7= -CR6R7-CR9= -CR6R7-CR8R9-CR11=
тo есть циклоалкан может быть циклопентаном или циклогексаном или циклогептаном, или циклопентеном, циклогексеном или циклогептеном;
X галогенатом, предпочтительно фтор, бром, хлор или группа циано или нитро, или группа C1-C4-алкил или C1-C4-алкокси, в известных случаях галогенированная;
n целое положительное или нулевое число, меньше 6, при этом группы X могут быть одинаковыми или разными, когда n больше, чем 1;
W представляет трехвалентную группу, образованную либо из группыCH-, либо из атома азотаN-.
R1, R2, одинаковые или разные, представляют атом водорода или радикал C1-C4-алкил, в известных случаях замещенный /например, одним или несколькими атомами или радикалами, такими как галогенатомы, радикалы C1-C4-алкокси, моно- или полигало-C1-C4-алкокси, C2-C4-алкилен, C2-C4-алкинил, моно- или полигало-C2-C4- алкилен, моно- или полигало-C2-C4-алкинил/, C1-C4-алкокси, в известных случаях замещенный /например одним или несколькими атомами или радикалами, такими как галогенатомы, радикалы C1-C4-алкокси, моно- или полигало-C1-C4-алкокси, C2-C4-алкилен, C2-C4-алкинил, моно- или полигало-C2-C4-алкилен, моно или полигало-C2-C4-алкинил/, радикалы C3-C7-циклоалкил, C6-C10-арил /в частности, фенил/, C7-C11-аралкил /в частности, бензил/, причем эти различные радикалы могут быть в известных случаях замещены /например, одним или несколькими атомами или радикалами, такими как галогенатомы, радикалы C1-C4-алкил, радикалы моно- или полигало-C1-C4-алкил, радикалы C1 -C4-алкокси и радикалы моно- или полигало-C1-C4-алкокси/, R1, R2, вместе, могут образовывать углеводородную цепочку C2-C5, составляющую цикл с углеродом, с которым связаны R1, R2, причем эта цепочка может быть замещена, как это указано для вышеуказанных радикалов C6-C10-арил, или R1, R2 вместе могут образовывать диоксолановую углеводородную цепочку C2-C5 с углеродом, с которым связаны R1, R2, причем эта цепочка может быть замещена, как это указано для вышеуказанных радикалов C6-C10.
R3, R6-R11, одинаковые или разные, представляют атом водорода или радикал C1-C4-алкил, в известных случаях замещенный /например, одним или несколькими атомами или радикалами, такими как галогенатомы, радикалы C1 -C4-алкокси, моно- или полигало-C1-C4-алкокси/, радикалы C3-C7-циклоалкил, C6-C10-арил /в частности, фенил/, C7 -C11-аралкил /в частности, бензил/, причем эти различные радикалы могут быть замещены /например, одним или несколькими атомами или радикалами, такими как галогенатомы, радикалы C1 -C4-алкил, радикалы моно- или полигало-C1-C4-алкил, радикалы C1-C4-алкокси и радикалы моно- или полигало-C1-C4-алкокси/, или же два смежных радикала цепочки A вместе образуют с атомами A, с которыми они связаны, цикл фенил, привязанный к циклоалкану.
R5 представляет атом водорода, радикал C1-C4-алкил, в известных случаях замещенный /например, одним или несколькими атомами или радикалами, такими как галогенатомы, радикалы C1-C4-алкокси, моно- или полигало-C1-C4-алкокси, C2-C4-алкилен, C2-C4-алкинил, моно- или полигало-C2-C4-алкилен, моно- или полигало-C1-C4-алкинил/, радикалы C3-C7-циклоалкил, C6-C10-арил /в частности, фенил/, C7-C11-аралкил /в частности, бензил/, причем эти различные радикалы могут быть замещены /например, одним или несколькими атомами или радикалами, такими как галогенатомы, радикалы C1-C4-алкил, радикалы моно- или полигало-C1-C4-алкил, радикалы C1-C4-алкокси и радикалы моно- или полигало-C1-C4-алкокси/, или R5 представляет группу С/=O/-R13, причем R13 представляет радикал C1-C4-алкил, в известных случаях замещенный /например, одним или несколькими атомами или радикалами, такими как галогенатомы, радикалы C1-C4-алкокси, моно- или полигало-C1-C4-алкокси, C2-C4-алкилен, C2-C4-алкинил, моно- или полигало-C2-C4-алкилен, моно- или полигало-C2-C4-алкинил/, радикалы C3-C7-циклоалкил, C6-C10-арил /в частности, фенил/, C7-C11-аралкил /в частности, бензил/, причем эти различные радикалы могут быть замещены /например, одним или несколькими атомами или радикалами, такими как галогенатомы, радикалы C1-C4-алкил, радикалы моно- или полигало-C1-C4-алкил, радикалы C1-C4-алкокси и радикалы моно- или полигало-C1 -C4алкокси/, радикал C2-C4-этинил, C2-C4-ацетинил, моно- или полигало-C2-C4-этинил, моно- или полигало-C2-C4-ацетинил.
R12 имеет одно из значений R5, за исключением C/=O/-R13.
R4 представляет атом водорода, галогенатом, в частности атом хлора или брома, радикал C1-C4-алкил, в известных случаях замещенный /например, одним или несколькими атомами или радикалами, такими как галогенатомы, радикалы C1-C4-алкокси, моно- или полигало-C1-C4-алкокси, C2-C4-алкилен, C2-C4-алкинил, моно- или полигало-C2 -C4-алкилен, моно- или полигало-C2-C4-алкинил/, радикалы C3-C7-циклоалкил, C6-C10-арил /в частности, фенил/, C7 -C11-аралкил /в частности, бензил/, причем эти различные радикалы могут быть замещены /например, одним или несколькими атомами или радикалами, такими как галогенатомы, радикалы C1 -C4-алкил, радикалы моно- или полигало-C1-C4-алкил, радикалы C1-C4-алкокси и радикалы моно- или полигало-C1-C4-алкокси/.
Изобретение относится также к солевым формам соединений согласно изобретению. Солевыми формами являются формы, приемлемые в сельском хозяйстве, среди которых можно назвать: хлоргидрат, сульфат, оксалат, нитрат или арилсульфонат, а также аддитивные комплексные соединения этих соединений с металлическими солями и, в частности, с солями железа, хрома, меди, марганца, цинка, кобальта, олова, магния и алюминия.
Например, комплексные соединения с цинком могут быть получены путем реакции соединения формулы I с хлоридом цинка.
В настоящем тексте подразумевается, что когда не приводится никакого уточнения, соответствующие радикалы могут быть разветвленными или линейными. Термин "в известных случаях галогенированный" означает моно- или полигалогенированный.
В формуле IA или IB символ:

означает, что стереохимия двойной связи может быть E или Z, или их смесь. С учетом стерических напряжений наибольшей будет форма, в которой R12 находится в положении E по отношению к R3, R4. Форма E является практически единственной получаемой формой, когда R12 означает H.
Соединения формулы I и соединения, которые могут использоваться в качестве промежуточных в способах получения и которые будут определены при описании этих способов, могут существовать в одной или в нескольких изомерных формах в зависимости от числа асимметрических центров молекулы. Следовательно, изобретение относится также ко всем оптическим изомерам, к их рацемическим смесям и к соответствующим диастереоизомерам соответствующего ряда. Разделение диастереоизомеров и/или оптических изомеров может осуществляться само по себе известными методами.
В отношении фунгицидных применений было найдено, что предпочтительно использовать соединения формулы IA или IB, в которой n 1, 2 или 3 и, предпочтительно, X галоген, выбранный среди хлора, брома или фтора.
Было также найдено, что предпочтительно использовать соединения формулы IA или IB, в которой n 1 или 2, а X галогенатом, находящийся в параположении, если n 1 и в мета-, пара- или орто-, пара положении, если n 2, предпочтительно n 1, X находится в параположении.
Предпочтительно, чтобы X являлся атомом хлора.
С учетом вышеуказанных уточнений, взятых раздельно или в совокупности, было найдено, что предпочтительно использовать в качестве
фунгицида соединения формулы I, в которой W означаетN=
С учетом или без учета вышеопределенных ограничений предпочтительно использовать в качестве фунгицида соединения формулы IA или IB, в
которой R3, R6, R8, R10 являются атомами водорода и, предпочтительно, R4, R7, R9, R11 являются атомами водорода
или радикалом C1-C4-алкил.
С учетом вышеизложенного также предпочтительными являются в качестве фунгицида соединения формулы IA или IB, в которой R1 и
R2 выбирают среди радикалов:
метил, этил, или атом водорода;
или соединения, в которых R5 является атомом водорода или C1-C4-алкилом,
очень преимущественно R5 является атомом водорода;
или соединения, в которых R12 является атомом водорода;
или соединения формулы IA, предпочтительно, в которой
A означает CR6R7 или -CR6R7CR8R9.
Предпочтительно для листовой активности /в частности, по отношению к Botrytis/ и/или для отсутствия фитотоксичности, что позволяет применять их для обработки семян, используют триазолы формулы IA, в которой A означает CR6R7, R2 выбирают из метила или этила; R3, R5-R7, R12 означают атом водорода, R4 означает метил, этил, н-пропил, изопропил или атом водорода, или A означает CR6R7CR8R9, a R1, R2 выбирают из радикалов метил, этил или атома водорода, R3, R5-R9, R12 атом водорода, R4 метил, этил, н-пропил, изопропил или атом водорода.
Предпочитают следующие соединения:
- 2-/4-хлорбензилиден/-5-метил-5-этил-1-/1H-1,2,
4-триазол-1-илметил/-1-циклопентанол;
2-/4-хлорбензилиден/-5,5-диметил-1-/1H-1,2,4-триазол-1- илметил/-1-циклопентанол;
- 2-/4-хлорбензилиден/-6-метил-1-/1H-1,2,
4-триазол-1-илметил/-1-циклогексанол;
- 2-/4-хлорбензилиден/-6,6-диметил-1-/1H-1,2,4-триазол-1-илметил/-1-циклогексанол;
2-/4-хлорбензилиден/-1-/1H-1,2,
4-триазол-1-илметил/-1-циклогексанол.
Настоящее изобретение относится также к способам получения соединений согласно изобретению.
В нижеприведенном изложении нижеописанные заместители имеют вышеуказанные значения, если нет другого указания.
A. Получение соединений формулы IA
Этот способ заключается во взаимодействии хлорида
омегаалкеноловой кислоты формулы:

в которой R1, R2 не могут быть радикалом C1-C4-алкил, замещенным одним или несколькими радикалами C2-C4-алкилен, C2-C4-алкинил, моно- или полигало-C2 -C4-алкилен, моно- или полигало-C2-C4-алкинил, или радикал C1-C4-алкокси, в присутствии хлорида алюминия в инертном растворителе типа дихлорметан или дисульфид углерода, или нитрометан для получения смеси циклоалканона и циклоалкенона формулы:

В соединении формулы IV A1H соответствует группам -CR7H или -CR6R7-CR9H, или -CR6R7-CR8R9 -CR11H.
В случае, когда хотят получить соединение формулы V, в которой R4 атом водорода, соединение формулы III подвергают затем каталитической гидрогенизации для
получения соединения V:

В случае, когда хотят получить вышеуказанное соединение формулы V, в которой R4 отлично от галогенатома или водорода, проводят реакцию магнийорганического соединения формулы R4M /M MgHal/, полученного известным способом посредством реакции, например, соединения формулы R8I с магнием в присутствии простого эфира, с циклоалкеноном формулы III в присутствии каталитического количества йодида меди при низкой температуре в полярном растворителе. Затем к смеси добавляют воду для выделения соединения формулы V.
Полученный таким образом циклоалканон формулы V, в которой R1, R2 имеют то же
значение, что и в общей формуле II, R4 имеет то же значение, что и в общей формуле IA или IB, за исключением того, что он не может быть галогенатомом, R3, R6, R7 имеют вышеуказанные значения, подвергают реакции альдольной конденсации- кротонизации путем конденсации с бензальдегидом формулы:

для получения соединений формулы VII, в которой R12 атом водорода:

Для получения соединения формулы VII, в которой R12 отлично от атома водорода, проводят реакцию силилированного простого эфира формулы XI:

с кеталем формулы XII:
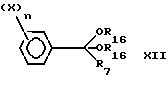
в которой R16 радикал C1-C4-алкил,
путем предварительного смешивания кеталя формулы XII с тетрахлоридом титана в галогенированном растворителе типа дихлорметана при примерно 0oC, затем добавляют силилированный эфир формулы XI примерно при 0oC и последовательно гидролизуют с HCl, как описано в работе T.Nukaiyana (J. Am. Chem. Soc. 1974, v.96, 7503).
Для получения соединения формулы VII, в которой R1 в известных случаях замещенная группа алкил или аралкил, определенная в общей формуле I, R2 отличается от водорода или от радикала C1-C4-алкил, замещенного одним или несколькими радикалами C2-C4-алкилен, C2-C4-алкинил, моно- или полигало-C2-C4-алкинил, осуществляют реакцию одного из кетонов формул III, V, VII, полученных как указано выше, в которых R1 атом водорода, а R2 отличен от атома водорода или от радикала C1-C4-алкил, замещенного одним или несколькими радикалами C2-C4-алкилен, C2-C4-алкинил, моно- или полигало-C2-C4-алкинил, с агентом алкилирования R1-Y, в котором R1 в известных случаях замещенная группа алкил или аралкил, определенная в общей формуле, а Y - удаляемая группа, например такая, как галоген, сульфонат или сульфат, в присутствии органического или минерального основания, предпочтительно гидроокиси, алкоголятов и гидридов щелочных или щелочноземельных металлов в растворителе или смеси протонных или апротонных растворителей, таких как насыщенные, ненасыщенные или ароматические углеводороды, в известных случаях - галогенированные, спирты, амиды, нитрилы, растворители, производные кислородсодержащих сульфидов, такие как ДМСО или сульфолан. Таким образом, получают другие кетоны формул III, V, VII. В случае получения кетонов формулы III или V согласно одному из вышеуказанных путей их затем превращают указанным выше методом в кетоны формулы VII.
Для получения соединения формулы VII, в которой одинаковые R1, R2 являются группой алкил или аралкил, определенной в общей формуле I, другой способ заключается в реакции кетона формул III, V, VII, полученного, как указано выше, в котором R1, R2 атом водорода, с агентом алкилирования R1-Y, в котором R1 группа алкил или аралкил, определенная в общей формуле I, а Y удаляемая группа, такая как галоген, сульфонат или сульфат, например, в присутствии органического или минерального основания, предпочтительно -гидроокиси, алкоголятов и гидридов щелочных или щелочноземельных металлов, в растворителе или в смеси протонных или апротонных растворителей, таких как насыщенные, ненасыщенные или ароматические углеводороды, в известных случаях галогенированные, спирты, амиды, нитрилы, растворители, производные сульфидов, такие как ДМСО или сульфолан. Иногда можно выделить промежуточный продукт, в котором только один из R1, R2 является вышеопределенной группой алкил или аралкил. В этом случае можно также использовать соединения VII для получения соединений I согласно описанным способам. В случае получения кетонов формулы III или V согласно одному из вышеуказанных методов их затем преобразуют для получения кетонов формулы VIII указанным выше способом.
В случае, когда R1, R2 образуют углеводородную цепочку C2-C5, проводят реакцию указанным выше методом соединения формулы Y-R9-Y, причем R9 углеводородный радикал C2-C5, в известных случаях замещенный /например, одним или несколькими атомами или радикалами, такими как галогенатомы, радикалы C1 -C4-алкил, радикалы моно- или полигало-C1-C4-алкил, радикалы C1-C4- алкокси и радикалы моно- или полигало-C1-C4-алкокси/, с кетоном формул III, V, VII, в которой R1, R2 атом водорода согласно вышеуказанному способу.
В случае, когда R1 и/или R2 являются группой аллил, другой способ получения заключается в реакции кетона формулы V, в которой R1, R2 атом водорода, с 2 молями аллилового спирта, 1 молем 2,2-диметоксипропана в присутствии каталитического количества паратолуолсульфоновой кислоты и в инертном растворителе типа толуола для получения соответствующего моноаллилированного кетона (Howard W.L. Lorette N.B. //Org. Synth. 1964, v.42, 34). Затем этот кетон подвергают реакции с вышеуказанным соединением формулы VI и вводят другой радикал аллил по вышеуказанному методу алкилирования.
В случае, когда R1 и/или R2 радикал C1-C4-алкокси, представляется преимущественным исходить из циклоалканона формулы V, в которой радикал/радикалы алкокси предварительно вводят по известному специалистам методу /например, реакция альфа-бромированных кетонов с щелочными алкоголятами/.
Другой общий способ получения кетонов VII, в которых по меньшей мере один из R1, R2 является водородом, заключается в получении энамина из циклоалканона V, в котором по меньшей мере один из R1 и R2 является водородом (McKusick B.C. Nurpord F.E. //Org. Synth. Coll. vol. V, 808), и в его конденсации с бензальдегидом VI (Birkoffer L. Kim S.M. Enjrls H.D //Chem. Ber. 1962, 95, 1495. Кислый гидролиз согласно этой статье приводит к получению кетонов VII, в которых по меньшей мере одна из групп R1, R2 является водородом).
Указанное соединение формулы VII подвергают реакции с илидом сульфония
(Corey E. J. Chaykovsky M. //J. Am. Chem. Soc. 1965, v. 87, 1313) для получения оксиранов формулы:
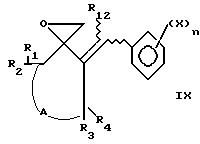
Затем проводят реакцию оксирана формулы IX с незамещенным имидазолом или триазолом в присутствии органического или минерального основания, например пиридина, триэтиламина, щелочи натрия, щелочи калия, карбонатов и бикарбонатов щелочных или щелочноземельных металлов и гидридов щелочных металлов, и в соответствующем растворителе, таком как, например, спирты, кетоны, амиды, нитрилы, ароматические углеводороды, в известных случаях галогенированные, при температуре от 80oС и до рефлюкса растворителя и при молярном соотношении соединение IX имидазол или триазол, предпочтительно составляющем 1,1-0,2, что приводит к получению соединений формулы I, в которой R3 - атом водорода, а R4 отличен от галогенатома, причем другие заместители имеют то же значение, что и значение, указанное в общей формуле.
Соединения формулы I, в которой R4 представляет галогенатом, a R5 атом водорода, получают путем аллилового галогенирования соединений формулы I, в которой R4, R5 атом водорода, с NBS /N-бромсукцинимид/, NCS /N-хлорсукцинимид/, трет-бутоксихлорид в тетрахлориде углерода в присутствии перекисей или ультрафиолетового света (Horner L. Winkelmann E.H //Angew. Chem. 1959, 71, 349).
Соединения формулы I, в которой R5 отлично от атома водорода, а R4 отлично от галогенатома, получают путем этерификации соединений формулы I, в которой R5 атом водорода, а R4 отлично от галогенатома, согласно обычным методам, хорошо известным специалистам: так, простые эфиры могут быть получены путем обработки щелочной соли спирта формулы I /например, соли лития или натрия/ с соответствующим галогенидом формулы R5Hal. Сложные эфиры могут быть получены путем обработки соли щелочного металла формулы I соответствующим хлоридом кислоты формулы R6C= OCl или соответствующим ангидридом формулы /R6/2 O2C=O.
Соединения формулы I, в которой R4 -галогенатом, а R5 отлично от атома водорода, получают на первом этапе путем этерификации, описанной выше, соединения формулы I, в которой R5, R4 являются атомом водорода, затем путем галогенирования полученного соединения формулы I, как это описывалось выше, посредством, например, NBS.
Соединения формул XI и XII получают известным специалисту способом. Например, можно ацетализировать соответствующий бензофенон в кислой среде спиртом R10OH в случае соединения формулы XII. Можно добавить к соответствующему циклопентанону триметилсилилхлорид в присутствии диметилформамида и триэтиламина в случае соединения формулы XII.
B. Получение соединений формулы IB
Циклический кетон формулы IV подвергают хорошо известной реакции альдольной конденсации/кротонизации путем конденсации с бензальдегидом формулы
VI для получения соединения формулы VIII:
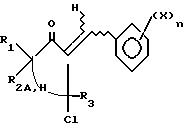
Указанное соединение формулы VIII подвергают реакции с илидом сульфония (Corey E. J. Chaykovsky M. //J. Am. Chem. Soc. 1965, v.87, 1313) для получения оксирана формулы X:

Проводят реакцию оксирана формулы X с незамещенным имидазолом или триазолом в присутствии органического или минерального основания, например пиридина, триэтиламина, щелочи натрия, щелочи калия, карбонатов и бикарбонатов щелочных металлов, и в соответствующем растворителе, например, таком как спирты, кетоны, амиды, нитрилы, ароматические углеводороды, возможно, галогенированные, при температуре от 80oC до рефлюкса растворителя, и при молярном соотношении соединение IX имидазол или триазол, предпочтительно составляющем 1,1-0,2, что приводит к получению соединений формулы IB:
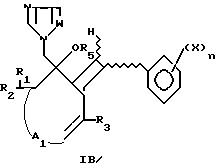
в которой R5 H.
Вышеуказанные методы для алкилирования или аллилирования положения α гидрокси /R1, R2/ также используют для получения соединения, в котором R5 отличается от H.
Разумеется, могут также быть пригодными другие способы получения.
Предметом изобретения являются также соединения, которые в известных случаях могут использоваться в качестве промежуточных продуктов в вышеописанных способах получения продуктов формул III, IV, V, VII, VIII, IX, X, в которых заместители A, A1, X, n, R1-R5, R8, R12 имеют то же значение, что и в основном пункте I.
Настоящее изобретение относится также к использованию соединений формулы I в качестве фунгицидов.
Соединения согласно изобретению могут использоваться для борьбы как профилактической, так и антигрибковой, в частности против грибков типа базадиомицеты, аскомицеты, аделомицеты или фунгиимперфекти, в частности ржавчины, оидиума, грибковой болезни полегания злаков, фузариозы, fusarium roseum, fusarium nivale, гельминтоспориозы, ринхоспориозы, септориозы, ризоктонии растений и культур вообще, и, в частности, зерновых культур, таких как пшеница, ячмень, рожь, овес и их гибриды, а также рис и кукуруза. Соединения согласно изобретению являются активными, в частности, по отношению к грибкам типа базидиомицеты, аскомицеты, аделомицеты или фунгиимперфекти типа Botrytis cinerea, Erysiphe graminis, Puccinia recondita, Piricularia oryzae, Cercospora beticola, Puccinia striiformis, Erysiphe cichoracearum, Fusarium oxysporum (melonis), Pyrenophora avenae, Septoria tritici, Venturia inaequalis, Whetzelinia sclerotiorum, Monilia laxa, Mycosphaerella fijiensis, Marssonina panettoniana, Alternaria solani, Aspergillus niger, Cercospora arachidicola, Cladosporium herbarum, Helminthosporiun oryzae, Penicillium expansum, Pestalozzia sp. Phialophora cinerescens, Phoma betae, Phoma foveata, Phoma lingam, Ustilago maydis, Verticillium dahliae, Ascochyta pisi, Buignardia bidwellii, Corticium rolfsii, Phonopsis viticola, Sclerotinia sclerotiorum, Sclerotinia minor, Corineum cardinale, Rhizoctonia solania.
Они также являются активными по отношению к следующим грибкам: Acrostalagmus koningi, Alternaria, Colletotrichum, Corticium rolfsii, Diplodia natalensis, Jaenmannoymyce graminis, Libberella fujikuroi, Harmodendron cladosporioides, Lentinus degener или tigrinus, Lenzites quereina, Memnoniella echinata, Myrothecium verrucaria, Paecylomyces varioti, Pallicularia sasakii, Phellinus megaloporus, Polystictus sanguineus, Poria vaporaria, Sclerotium rolfsii, Stachybotris atra, Stereum, Stilbum sp. Trametes trabea, Trichodermapseudonohingi, Trichothecium roseum.
Соединения изобретения являются особенно интересными по их широкому спектру на уровне болезней зерновых культур /оидиум, ржавчина, грибковая болезнь полегания, гельминтоспориозы, септориозы и фузариозы/. Они представляют также большой интерес по причине их активности по отношению к серой гнили /Botrytis/ и церкоспорозам, и вследствие этого они могут наноситься на такие разнообразные культуры, как виноградник, овощные культуры, древовидные и тропические культуры, такие как арахис, банан, кофейное дерево, орех.
Вследствие отсутствия фитотоксичности соединения могут использоваться для защиты "продуктов размножения" растений от болезней, вызываемых грибками.
Следовательно, изобретение относится, кроме того, к продукту размножения культивированных растений, которые подвергаются защитной обработке соединением изобретения.
Названием "продукт размножения" обозначаются все воспроизводящие части растения, которые можно использовать для его размножения. Назовем, например, семена, корни, плоды, клубни, луковицы, корневища, части стебля, саженцы /ростки/ и другие части растений. Назовем также проросшие растения и молодые саженцы, которые должны быть пересажены после прорастания или после выхода из земли. Эти молодые саженцы могут быть защищены перед пересадкой путем общей или частичной обработки погружением.
В основном, эти соединения наносятся из расчета 0,1-500 г на центнер семян.
Таким образом, эти соединения могут использоваться для обработки семян /например, зерновых культур, хлопчатника, свеклы, рапса, фуражного зерна, овощных семян/, например, в виде дражирования или нанесения пленки. В патенте США N 3989501 можно найти форму нанесения. То же самое относится к патенту Франции N А-2 588442. Можно также использовать концентрированные суспензии.
В основном, эти соединения уже известны (Catalogue of pesticide formulationtypes and international coding system. JIFAP, техническая монография N 2, с. 12-14).
Кроме вышеописанных применений, продукты согласно изобретению
обладают отличной биоцидной активностью по отношению ко многим другим разновидностям микроорганизмов, среди которых можно назвать, без ограничения, грибки следующих видов:
Pullularia рода P.
pullulans;
Chaetomium рода C. globosum;
Aspergillus рода A. aspergillus;
Coniophora рода C. puteana.
По причине их биоцидной активности продукты изобретения позволяют эффективно бороться с микроорганизмами, размножение которых создает много проблем в сельском хозяйстве и промышленности. Они особенно пригодны для защиты растений или промышленных изделий, таких как древесина, кожа, краски, бумага, такелаж, пластмассы, промышленные водные сети.
Особенно они пригодны для защиты лигноцеллюлозных изделий и, в частности, древесины, независимо от того, идет ли речь об отделочной, строевой древесины или древесины, подверженной влиянию погодных условий, такой как изгородь из древесины, колья для виноградников, железнодорожные шпалы.
Соединения согласно изобретению использующиеся раздельно или в форме вышеопределенных композиций при обработке древесины, обычно используются с органическими растворителями и могут в известных случаях соединяться с одним или несколькими известными биоцидными продуктами, такими как пентахлорфенол, металлические соли, в частности меди, марганца, кобальта, хрома, цинка, производные минеральных или карбоновых кислот /гептановая, октановая, гексагидробензойная кислоты/; органические комплексные соединения олова, меркаптобензотиазол, инсектициды, такие как пиретроиды или хлорорганические соединения.
Изобретение относится также к способу обработки зараженных культур или культур, которые могут быть заражены фунгицидными болезнями, отличающемуся тем, что на листву наносят эффективную дозу соединения согласно изобретению.
Преимущественно соединения применяются в дозах 0,002-5 кг/га и, более специфически, 0,005-1 кг/га.
Для их практического применения соединения согласно изобретению редко используются по отдельности. Чаще всего они являются частью композиций. Эти композиции, которые могут использоваться для защиты растений от фунгицидных болезней или в композициях для регулирования роста растений, содержат в качестве активного вещества вышеописанное соединение согласно изобретению в соединении с твердыми или жидкими подложками, приемлемыми в сельском хозяйстве, и/или поверхностно-активными веществами, также приемлемыми в сельском хозяйстве. В частности, могут использоваться инертные обычные подложки и обычные поверхностно-активные вещества.
Эти композиции обычно содержат 0,5-95% соединения согласно изобретению.
В настоящем изложении термином "подложка" обозначается органическое или минеральное, природное или синтетическое вещество, в котором соединяется активное вещество для облегчения его нанесения на растение, на семена или на почву. Следовательно, эта подложка обычно является инертной, и она должна быть приемлемой в сельском хозяйстве, в частности на обработанном растении. Подложка может быть твердой /глины, природные или синтетические силикаты, двуокись кремния, смолы, воски, твердые удобрения и т.д./ или жидкой /вода, спирты, кетоны, нефтяные фракции, ароматические или парафиновые углеводороды, хлорированные углеводороды, сжиженные газы и т.д./.
Поверхностно-активное вещество может быть эмульгатором, диспергатором или смачивателем ионного или анионного типа. Можно назвать, например, соли акриловых /полиакриловых/ кислот, соли лигносульфоновых кислот, соли фенолсульфоновых или нафталинсульфоновых кислот, поликонденсаты окиси этилена на спиртах жирного ряда или на кислотах жирного ряда, или на аминах жирного ряда, замещенные фенолы /в частности, алкилфенолы или арилфенолы/, соли сложных эфиров сульфоянтарных кислот, производные таурина /в частности, алкилтаураты/, сложные фосфорные эфиры спиртов или полиоксиэтилированных фенолов. Наличие по меньшей мере одного поверхностно-активного вещества обычно является необходимым, когда активное вещество и/или инертная подложка не растворимы в воде, а векторным агентом нанесения является вода.
Эти композиции могут также содержать любые другие ингредиенты, такие как, например, защитные коллоиды, адгезивы, сгустители, тиксотропные агенты, агенты, способствующие проникновению, стабилизаторы, вещества, образующие внутрикомплексные соединения и т.д. а также другие активные вещества, известные своими пестицидными свойствами /в частности, инсектициды или фунгициды/ или свойствами, способствующими росту растений /в частности, удобрения/, или свойствами регулирования роста растений. В более общем плане, соединения согласно изобретению могут соединяться со всеми твердыми или жидкими добавками, соответствующими обычной технике формирования.
Для их применения композиции формулы I обычно находятся, следовательно, в виде композиций; сами эти композиции согласно изобретению имеют различные формы твердые или жидкие.
В качестве форм твердых композиций можно назвать порошки для опудривания или дисперсию /с содержанием соединения формулы I, которое может доходить до 100%/ и гранулы, в частности гранулы, полученные посредством экструзии, уплотнения, пропитки гранулированной подложки, гранулирования порошка /содержание соединения формулы I в этих гранулах составляет 1-80% для этих последних случаев/.
Согласно примеру композиции из гранул, используют
следующие компоненты:
Пример F9
Активное вещество 50 г
Эпихлоргидрин 2,3 г
Эфир цетила и полигликоля 2,5 г
Полиэтиленгликоль 35 г
Каолин
(гранулометрия: 0,3-0,9 мм) 910 г
В этом отдельном случае смешивают активное вещество с эпихлоргидрином и растворяют в 60 г ацетона, затем добавляют полиэтиленгликоль и эфир цетила и
полигликоля. Смачивают каолин полученным раствором, и затем выпаривают ацетон в вакууме. Такую микрогранулу преимущественно используют для борьбы с грибками почвы.
Соединения формулы I можно еще использовать в виде порошка для опудривания; можно также использовать композицию, содержащую 50 г активного вещества и 950 г талька; можно также использовать композицию, содержащую 20 г активного вещества, 10 г тонко размельченной двуокиси кремния и 970 г талька; эти компоненты измельчают, смешивают, и смесь наносят путем опудривания.
В качестве форм жидких композиций или композиций, предназначенных для образования жидких композиций при нанесении, можно назвать растворы, в частности растворимые в воде концентраты, эмульгирующиеся концентраты, эмульсии, концентрированные суспензии, аэрозоли, смачивающиеся порошки /или распыляемый порошок/, пасты.
Эмульгирующиеся или растворимые концентраты содержат чаще всего 10-80% активного вещества, причем сами готовые к нанесению эмульсии или растворы содержат 0,01-20% активного вещества.
Например, кроме растворителя, эмульгирующиеся концентраты могут содержать, когда это необходимо, 2-20% соответствующих добавок, таких как стабилизаторы, поверхностно-активные вещества, вещества, способствующие проникновению, ингибиторы коррозии, красители или вышеуказанные адгезивы.
В качестве примера приводится композиция из нескольких концентратов:
Пример F1
Активное вещество 400 г/л
Щелочной додецилбензолсульфонат 24 г/л
Оксиэтилированный нонилфенол с 10 молекулами окиси этилена 16 г/л
Циклогексанон 200 г/л
Ароматический растворитель в количестве, достаточном для 1 литра
Согласно
другой формулы эмульгирующегося концентрата используют:
Пример F2
Активное вещество 250 г
Эпоксидное растительное масло 25 г
Смесь алкиларилсульфоната, эфира
полигликоля и спиртов жирного ряда 100 г
Диметилформамид 50 г
Ксилен 575 г
Из этих концентратов можно получать путем разбавления водой эмульсии любой заданной концентрации,
которые особенно пригодны для нанесения на листья.
Концентрированные суспензии, которые также могут применяться путем распыления, получают в виде стабильного, неразлагающегося продукта, и они обычно содержат 10-75% активного вещества, 0,5-15% поверхностно-активных веществ, 0,1-10% тиксотропных агентов, 0-10% соответствующих добавок, таких как противовспениватели, ингибиторы коррозии, стабилизаторы, вещества, способствующие проникновению, и адгезивы, и в качестве подложки вода или органическая жидкость, в которых активное вещество не растворяется или слабо растворяется: некоторые твердые органические вещества или минеральные соли могут растворяться в подложке для препятствования седиментации или в качестве антифриза для воды.
Смачивающиеся порошки /или порошок для распыления/ обычно приготавливают таким образом, чтобы они содержали 20-95% активного вещества, и они обычно содержат, кроме твердой подложки, 0-5% смачивателя, 3-10% диспергатора и, когда это необходимо, 0-10% одного или нескольких стабилизаторов, и/или добавки, такие как вещества, способствующие проникновению, адгезивы или агенты противокомкования, красители и т.д.
В
качестве примера приводятся различные композиции смачивающихся порошков:
Пример F3
Активное вещество 50%
Лигносульфонат кальция (дефлокулянт) 5%
Изопропилнафталинсульфонат (анионный смачиватель) 1%
Двуокись кремния в качестве агента противокомкования 5%
Каолин (наполнитель) 39%
В другой композиции 70%-ного порошка
для распыления используют следующие компоненты:
Пример F4
Активное вещество 700 г
Дибутилнафтилсульфонат натрия 50 г
Продукт конденсации в пропорциональном
содержании 3/2/1 нафталинсульфоновой кислоты, фенолсульфоновой кислоты и формальдегида 30 г
Каолин 100 г
Полевой мел 120 г
В другой композиции из 40%-ного порошка для
распыления используют следующие компоненты:
Пример F5
Активное вещество 400 г
Лигносульфонат натрия 50 г
Дибутилнафталинсульфонат натрия 10 г
Двуокись
кремния 540 г
В другой композиции из 25%-ного порошка для распыления используют следующие компоненты:
Пример F6
Активное вещество 250 г
Лигносульфонат кальция 45
г
Смесь равного веса полевого мела и оксиэтилцеллюлозы 19 г
Дибутилнафталинсульфонат натрия 15 г
Двуокись кремния 195 г
Полевой мел 195 г
Каолин 281 г
В другой композиции 25%-ного порошка для распыления используют следующие компоненты:
Пример F7
Активное вещество 250 г
Изооктилфеноксиполиоксиэтиленэтанол 25 г
Смесь равного веса полевого мела и оксиэтилцеллюлозы 17 г
Алюмосиликат натрия 543 г
Кизельгур 165 г
В другой композиции из 10%-ного порошка для распыления используют
следующие компоненты:
Пример F8
Активное вещество 100 г
Смесь натриевых солей сульфатов насыщенных кислот жирного ряда 30 г
Продукт конденсации нафталенсульфоновой
кислоты и формальдегида 50 г
Каолин 820 г
Для получения порошков для распыления или смачивающихся порошков интенсивно смешивают активные вещества в соответствующих смесителях с
дополнительными материалами и измельчают в соответствующих мельницах или дробилках. Тем самым получают порошки для распыления с преимущественными смачиваемостью и переводом в суспензию; их можно
переводить в суспензию с водой при любой заданной концентрации, преимущественно эти суспензии могут использоваться для нанесения на листья растений.
Вместо смачивающихся порошков можно выполнять пасты. Условия и способы получения этих паст и их использования подобны условиям и способам получения и использования смачивающихся порошков или порошков для распыления.
Как уже было указано, водные дисперсии и эмульсии, например композиции, полученные путем разбавления водой смачивающегося порошка или эмульгирующегося концентрата, согласно изобретению входят в общие рамки настоящего изобретения. Эмульсии могут быть типа эмульсий вода-в-масле или масло-в-воде, и они могут иметь густую консистенцию типа майонеза.
Дозы применения в случае использования в качестве фунгицидов соединений согласно изобретению могут изменяться в очень широких пределах, в частности в зависимости от вирулентности грибков и климатических условий.
В основном, хорошо подходят композиции, содержащие 0,5-5000 ppm активного вещества; эти значения указаны для готовых к нанесению композиций. Ppm означает "частей на миллион". Диапазон 0,
5-5000 ppm соответствует диапазону 5•10-5 при 0,5%
Что касается композиций, пригодных к хранению и транспортировке, они преимущественно содержат 0,5-95 мас. активного
вещества.
Следовательно, композиции для сельскохозяйственного применения согласно изобретению могут содержать активные вещества согласно изобретению в очень широких пределах от 5•10-5 до 95 мас.
В примерах номенклатура соединений указана по французским стандартам, а нумерация заместителей ставится перед самими заместителями.
Пример I. Получение 2-/4-хлорбензилиден/-5,5-диметил-1-/1H-1,2,4-триазол-1-илметил/-1-циклопентанола
К смеси 10 г 2,2-диметилциклопентанона и 13,8 г 4-хлорбензальдегида в 100 мл этанола при
0oC добавляют 100 мл водного раствора 10%-ного едкого натра. После 30 минут густую пульпу фильтруют, а твердое вещество промывают, затем высушивают. Получают 12,5 г 2,
2-диметил-5-/4-хлорбензилиден/-1-циклопентанона с точкой плавления 120oC. Это соединение, растворенное в 50 мл тетрагидрофурана, добавляют к раствору, образованному следующим образом: 1,9 г
гидрида натрия /80%-ная дисперсия в минеральном масле/ в 50 мл безводного ДМСО нагревают до 80oC до полного растворения твердого. Затем раствор разбавляют посредством 100 мл
тетрагидрофурана, затем охлаждают до -10oC. К смеси добавляют за 10 минут раствор 11,5 г триметилсульфониййодида в 80 мл диметилсульфоксида, и смесь перемешивают в течение 15 минут при
-10oC. Затем раствор 11,8 г 2,2-диметил-4-хлор-5-/4-хлорбензилиден/-1-циклопентанона добавляют в 100 мл тетрагидрофурана.
Полученную таким образом смесь оставляют при температуре окружающей среды, затем выливают в воду и экстрагируют эфиром, промывают водой, высушивают, дистиллируют. Получают 7-/4-хлор-бензилиден/-4,4-диметил-1-оксаспиро-/2,4/-гептан, непосредственно использующийся на следующем этапе.
Смесь 5 г продукта с 2,8 г 1,2,4-триазола и 11 г карбоната калия нагревают в 40 мл N,N-диметилформамида в течение 4 часов. Смесь выливают в воду и экстрагируют этилацетатом. Органическую фазу промывают, высушивают, рекристаллизируют для получения заданного продукта с точкой плавления 154oC /соединение N 1/.
Таким же образом получают следующие соединения:
2-/4-фторбензилиден/-5,5-диметил-1-/1H-1,2,4-триазол-1-илметил/-1-циклопентанол /точка плавления 147oC/, соединение N 2;
2-/2,4-дихлорбензилиден/-5,5-диметил-1-/1H-1,2,4-триазол-1-илметил/-1-циклопентанол /точка плавления 130oC/, соединение N 3;
2-/4-трифторметилбензилиден/-5,
5-диметил-1-/1H-1,2,4-триазол-1-илметил/-1-циклопентанол /точка плавления 152oC/, соединение N 4;
2-/4-хлорбензилиден/-1-/1H-1,2,4-триазол-1-илметил/-1-циклопентанол /масло/,
соединение N 5;
2-бензилиден-1-/1H-1,2,4-триазол-1-илметил/-1-циклопентанол /масло/, соединение N 6;
2-/4-бромбензилиден/-5,5-диметил-1-/1H-1,2,4-триазол-1-илметил/-1-циклопентанол
/точка плавления 152oC/, соединение N 7;
2-бензилиден-5,5-диметил-1-/1H-1,2,4-триазол-1-илметил/-1-циклопентанол /точка плавления 137oC/, соединение N 8;
2-/3,
4-дихлорбензилиден/-5,5-диметил-1-/1H-1,2,4-триазол-1-илметил/-1-циклопентанол /точка плавления 157oC/, соединение N 9;
2-/4-хлорбензилиден/-5-метил-1-/1H-1,2,
4-триазол-1-илметил/-1-циклопентанол /масло/, соединение N 10;
2-/2-хлорбензилиден/-5,5-диметил-1-/1H-1,2,4-триазол-1-илметил/-1-циклопентанол /масло/, соединение N 11;
2-/4-фенилбензилиден/-5,5-диметил-1-/1H-1,2,4-триазол-1-илметил/-1-циклопентанол /точка плавления 167oC/, соединение N 12;
2-/4-хлорбензилиден/-5-метил-5-этил 1-/1H-1,2,
4-триазол-1-илметил/-1-циклопентанол /точка плавления- 144oC/, соединение N 13;
2-/4-хлорбензилиден/-5,5-диметил-1-/1H-1,2,4-триазол-1-илметил/-1- метоксициклопентан /точка
плавления -84oC/, соединение N 14;
2-/4-хлорбензилиден/-4,5,5-триметил-1-/1H-1,2,4-триазол-1-илметил/-1-циклопентанол /точка плавления 148oC/, соединение N 15;
2-/4-хлорбензилиден/-5-метил-5-метоксиметил-1-/1H-1,2,4-триазол-1-илметил/-1-циклопентанол /точка плавления 109oC/, соединение N 16;
2-/4-хлорбензилиден/-5,5-ди-н-пропил-1-/1H-1,2,
4-триазол-1-илметил/-1-циклопентанол /точка плавления 123oC/, соединение N 17;
2-/4-хлорбензилиден/-5,5-диэтил-1-/1H-1,2,4-триазол-1-илметил/-1-циклопентанол /точка плавления
171oC/, соединение N 18;
2-/4-фторбензилиден/-5,5-диэтил-1-/1H-1,2,4-триазол-1-илметил/-1-циклопентанол /точка плавления 166oC/, соединение N 19;
2-/4-фторбензилиден/-5,5-ди-н-пропил 1-/1H-1,2,4-триазол-1-илметил/-1-циклопентанол /точка плавления 127oC/, соединение N 20;
2-/4-цианобензилиден/-5,5-диметил-1-/1H-1,2,
4-триазол-1-илметил/-1-циклопентанол /точка плавления 137oC/, соединение N 21;
2-/4-хлорбензилиден/-5,5-диметил-3-этил-1-/1H-1,2,4-триазол-1-илметил/-1-циклопентанол /точка
плавления 58oC/, соединение N 22;
2-/4-парахлорфеноксибензилиден/-5,5-диметил-1-/1H-1,2,4-триазол-1-илметил/-1-циклопентанол /точка плавления 112oC/ соединение N 23;
2-/4-хлорбензилиден/-3-изопропил-5,5-диметил-1-/1H-1,2,4-триазол-1-илметил/-1-циклопентанол /масло/, соединение N 24.
Пример II. Получение 2-/4-хлорбензилиден/-5,
5-диметил-1-/1H-имидазолилметил/-1-циклопентанола
Смесь 5 г 7-/4-хлорбензилиден/-4,4-диметил-1-оксаспиро/2,4/гептана, полученного по предыдущему примеру, с 2,8 г имидазола и 11 г карбоната
калия нагревают в 40 мл N,N-диметилформамида в течение 4 часов. Смесь выливают в воду и экстрагируют этилацетатом. Органическую фазу промывают, высушивают, рекристаллизируют для получения заданного
продукта с точкой плавления 174oC, соединение N 25.
Таким же образом получают следующие соединения:
2-/4-фторбензилиден/-5,
5-диметил-1-/1H-имидазолилметил/-1-циклопентанол /точка плавления 160oC/, соединение N 26;
2-/2,4-дихлорбензилиден/-5,5-диметил-1-/1H-имидазолилметил/-1-циклопентанол /точка
плавления 134oC/, соединение N 27;
2-/4-трифторметилбензилиден/-5,5-диметил-1-/1H-имидазолилметил/-1-циклопентанол /точка плавления 171oC/, соединение N 28.
Пример III. Получение 2-/4-фторбензилиден/-5,5-диметил-1-/1H-1,2,4-триазол-1-илметил/-1-гидрокси-3-циклопентена
К смеси 10 г 2,2-диметил-4-хлор-1-циклопентанона и 8,4 г
4-фторбензальдегида в 100 мл этанола при 0oC добавляют 50 мл водного раствора 10%-ного едкого натра. После 30 минут густую пульпу фильтруют, твердое вещество промывают, затем высушивают.
Получают 11,8 г 2,2-диметил-4-хлор-5-/4-фторбензилиден/-1-циклопентанона с точкой плавления 69oC. 3,1 г гидрида натрия /80% -ная дисперсия в минеральном масле/ в 50 мл безводного ДМСО
нагревают до 80oC до полного растворения твердого. Затем раствор разбавляют посредством 100 мл тетрагидрофурана с последующим охлаждением до -10oC. К смеси добавляют за 10 минут
раствор 11,5 г триметилсульфониййодида в 80 мл диметилсульфоксида, и смесь перемешивают в течение 15 минут при -10oC. Затем раствор 11,8 г 2,
2-диметил-4-хлор-5-/4-фторбензилиден/-1-циклопентанона добавляют в 100 мл тетрагидрофурана. Полученную таким образом смесь оставляют при температуре окружающей среды, затем выливают в воду и
экстрагируют эфиром, промывают водой, высушивают, дистиллируют. Получают 7-/4-фторбензилиден/-4,4-диметил-1-оксаспиро-/2,4-/-5-гептен, непосредственно использующийся на следующем этапе.
Смесь 5,5 г полученного продукта с 2 г 1,2,4-триазола и 6,6 г карбоната калия нагревают в 50 мл N,N-диметилформамида в течение 4 часов. Смесь выливают в воду и экстрагируют этилацетатом. Органическую фазу промывают, высушивают, рекристаллизируют для получения 2,4 г заданного продукта с точкой плавления 168oC, соединение N 29.
Таким же образом получают следующие
соединения:
2-/4-хлорбензилиден/-5,5-диметил-1-/1H-1,2,4-триазол-1-илметил/-1-гидрокси-3-циклопентен /точка плавления 203oC/, соединение N 30;
2-/2,4-дихлорбензилиден/-5,
5-диметил-1-/1H-1,2,4-триазол-1-илметил/-1-гидрокси-3-циклопентен /точка плавления -182oC/, соединение N 31;
Пример IV. Получение 2-/4-фторбензилиден/-5,
5-диметил-1-/1H-имидазолилметил/-1-гидрокси-3-циклопентена
Смесь 5,5 г 7-/4-фторбензилиден/-4,4-диметил-1-оксаспиро-/2,4/5-гептена, полученного по предыдущему примеру, с 2 г имидазола и 6,6 г
карбоната калия нагревают в 50 мл N,N-диметилформамида в течение 4 часов. Смесь выливают в воду и экстрагируют этилацетатом. Органическую фазу промывают, высушивают, рекристаллизируют для получения
заданного продукта с точкой плавления 172oC, соединение N 32.
Пример V. Получение 2-/4-хлорбензилиден/-3,5,5-триметил-1-/1H-1,2,4-триазол-1-илметил/-1-циклопентанола
Смесь 2,3 г гидрида натрия и 120 мл ДМСО нагревают до 75oC до растворения твердого. Добавляют 120 мл тетрагидрофурана, и раствор охлаждают до -5oC. Добавляют 16 г йодида
триметилсульфония в 50 мл ДМСО, выдерживая температуру ниже 0oC. Добавляют 15,8 г 2-/4-хлорбензилиден/-3,5,5-триметилциклопентанона, растворенного в 20 мл тетрагидрофурана, и раствор
оставляют при температуре окружающей среды.
Раствор триазолилнатрия получают из 5,3 г 1H-1,2,4-триазола, добавляют 2,3 г гидрида натрия в 100 мл ДМСО, затем смесь нагревают до 130oC в течение 2 часов. Раствор промывают водой, экстрагируют этилацетатом, высушивают, очищают на двуокиси кремния. Получают 2,4 г желтого твердого вещества. Точка плавления 148oC.
2-/4-хлорбензилиден/-3,5,5-триметилциклопентанон получают следующим образом. К 2,7 г магния в 50 мл эфира добавляют 7 мл метилйодида. При образовании магнийорганического соединения раствор охлаждают до -5oC и добавляют 1 г монойодида меди. Добавляют 10 г 5,5-диметил-2-циклопентанона в 30 мл эфира, выдерживая температуру ниже 0oC. Затем добавляют 14 г хлорбензальдегида в эфире. Добавляют 50 мл концентрированной хлористоводородной кислоты, затем 50 мл воды. Затем водную фазу экстрагируют эфиром. Органическую фазу промывают, высушивают, очищают на колонне двуокиси кремния. Получают 15,8 г маслянистого продукта. 5,5-диметил-2-циклопентенон получают известным способом.
Пример VI. Получение 2-/4-хлорбензилиден/-5,5-диаллил-1-/1H-1,
2,4-триазол-1-илметил/-1-циклопентанола
Смесь 2,7 г гидрида натрия и 120 мл ДМСО нагревают до 75oC до растворения. Добавляют 120 мл тетрагидрофурана, и раствор охлаждают до -5oC. Добавляют 12,6 г йодида триметилсульфония в 50 мл ДМСО, выдерживая температуру ниже 0oC. Добавляют 16,5 г 2-/4-хлорбензилиден/-5,5-диаллилциклопентанона в 20 мл тетрагидрофурана,
и раствор оставляют при температуре окружающей среды.
Раствор триазолилнатрия получают из 8,3 г 1Н 1,2,4-триазола, добавляют 4,8 г гидрида натрия в 100 мл ДМСО, затем смесь нагревают до 80oC в течение 2 часов. Раствор промывают водой, экстрагируют этилацетатом, высушивают, очищают на колонне двуокиси кремния. Получают 6,2 г желтого твердого вещества. Точка плавления 128oC, соединение N 33.
2-/4-хлорбензилиден/-5,5-диаллилциклопентанон получают следующим образом. 2,5 г гидрида натрия промывают 50 мл гептана. Добавляют 100 мл толуола и 6, 7 мл третичного амилового спирта и нагревают до 50oC. После остановки выделения водорода добавляют 15 г 2-/4-хлорбензилиден/-5-аллилциклопентанона и 8,1 мл аллилхлорида. Раствор нагревают в рефлюксе, охлаждают, промывают водой. Высушивают органическую фазу. После выпаривания получают 16,5 г жидкого продукта, 5-аллилциклопентанон получают по работе W.L.Howard, N.B.Lorette (Org. Synth. v.42, 34).
Таким же образом получают 2-/4-фторбензилиден/-5,5-диаллил-1-/1H-1,2,4-триазол-1-илметил/-1-циклопентанол. Точка плавления 112oC, соединение N 34.
Пример VII. Получение 2-/4-хлорбензилиден/-5,5-диметил-1-/1H-1,2,4-триазол-1-илметил/-1-метоксициклопентанола
4,2 г гидроокиси калия в порошке и 5,2 г 2-/4-хлорбензилиден/-5,5-диметил-1-/1H-1,
2,4-триазолметил/-циклопентан-1-ола в 32 мл ДМСО перемешивают при температуре окружающей среды. Добавляют 2 мл метилйодида, и смесь перемешивают. Раствор выливают в воду и экстрагируют этилацетатом.
Органическую фазу снова промывают водой и высушивают. После очистки на колонне двуокиси кремния получают 4,9 г чистого продукта. Точка плавления 84oC.
2-/4-хлорбензилиден/-5, 5-диметил-1-/1H 1,2,4-триазолметил/циклопентан-1-ол получают следующим образом. К смеси 10 г 2,2-диметилциклопентанона и 13,8 г 4-хлорбензальдегида в 100 мл этанола при 0oC добавляют 100 мл водного раствора 10% -ного едкого натра. После 10 минут густую пульпу фильтруют, а твердое вещество промывают, затем высушивают. Получают 12,5 г 2,2-диметил-5-/4-хлорбензилиден/-1-циклопентанона с точкой плавления 120oC.
Это соединение, растворенное в 50 мл тетрагидрофурана, добавляют в раствор, образованный следующим образом. 1,9 г гидрида натрия /80%-ная дисперсия в минеральном масле/ в 50 мл ДМСО /безводный/ нагревают до 80oC до полного растворения твердого. Раствор разбавляют посредством 100 мл тетрагидрофурана, затем охлаждают до -10oC. В смесь добавляют за 10 минут раствор 11,5 г триметилсульфониййодида в 80 мл диметилсульфоксида, и смесь перемешивают в течение 15 мин при -10oC. Затем в 100 мл тетрагидрофурана добавляют раствор 11,8 г 2,2-диметил-4-хлор-5-/4-хлорбензилиден/-1-циклопентанона. Полученную таким образом смесь оставляют при температуре окружающей среды, затем выливают в воду, экстрагируют эфиром, промывают водой, высушивают, дистиллируют. Получают 7-/4-хлорбензилиден/-4,4-диметил-1-оксаспиро/2,4/гептан, непосредственно использующийся на следующем этапе. Смесь 5 г продукта с 2,8 г 1,2, 4-триазола и 11 г карбоната калия нагревают в 40 мл N,N-диметилформамида в течение 4 часов. Смесь выливают в воду и экстрагируют этилацетатом. Органическую фазу промывают, высушивают, рекристаллизируют для получения заданного продукта с точкой плавления 154oC, соединение N 1.
Ниже приводятся точки плавления следующих соединений:
2,
2-диметил-4-хлор-5-/4-фторбензилиден/-1-циклопентанон 69oC;
2,2-диметил-4-хлор-5-/4-хлорбензилиден/-1-циклопентанон 68oC;
2,2-диметил-4-хлор-5-/2,
4-дихлорбензилиден/-1-циклопентанон 68oC;
2,2-диметил-5-/4-фторбензилиден/-1-циклопентанон 69oC;
2,2-диметил-4-хлор-5-/4-хлорбензилиден/-1-циклопентанон 120oC;
2,2-диметил-5-/4-трифторметилбензилиден/-1-циклопентанон -107oC;
2,2-диметил-5-/2,4-дихлорбензилиден/-1-циклопентанон является маслом;
2,
2-диметил-4-хлор-5-/4-хлорбензилиден/-1-циклопентанон 60oC;
2-/4-хлорбензилиден/-1-циклопентанон 63oC;
2-бензилиден-1-циклопентанон является маслом;
2-/4-бромбензилиден/-1-циклопентанон 97oC;
2,2-диметил-5-бензилиден-1-циклопентанон является маслом;
2,2-диметил-5-/3,4-дихлорбензилиден/-1-циклопентанон является маслом;
2-/3,4-дихлорбензилиден/-1-циклопентанон является маслом;
2-метил-5-/4-хлорбензилиден/-1-циклопентанон 107oC;
2-метил-5-/2-хлорбензилиден/-1-циклопентанон
является маслом;
2,2-диметил-5-/2-хлорбензилиден/-1-циклопентанон является маслом;
2-фенилбензилиден-1-циклопентанон 146oC;
2,
2-диметил-5-фенилбензилиден-1-циклопентанон 120oC;
2-этил-2-метил-5-/4-хлорбензилиден/-1-циклопентанон 85oC;
2-аллил-5-/4-хлорбензилиден/-1-циклопентанон 60oC;
2,2-диаллил-5-/4-хлорбензилиден/-1-циклопентанон является маслом;
2,2,4-триметил-5-/4-хлорбензилиден/-1-циклопентанон является маслом;
2-метил-2-метоксиметил-5-/4-хлорбензилиден/-1-циклопентанон является маслом;
2-аллил-5-/4-фторбензилиден/-1-циклопентанон 111oC;
2,
2-диаллил-5-/4-фторбензилиден/-1-циклопентанон является маслом;
2,2-диэтил-5-/4-хлорбензилиден/-1-циклопентанон является маслом;
2,2-диэтил-5-/4-фторбензилиден/-1-циклопентанон
является маслом;
2-/4-цианобензилиден/-1-циклопентанон является маслом;
2,2-диметил-5-/4-цианобензилиден/-1-циклопентанон является маслом;
2,
2-диметил-4-этил-5-/4-хлорбензилиден/-1-циклопентанон является маслом;
2-/4-парахлорфеноксибензилиден/-1-циклопентанон 92oC;
2,
2-диметил-5-/4-парахлорфеноксибензилиден/-1-циклопентанон является маслом;
2,2-диметил-4-изопропил-5-/4-хлорбензилиден/-1-циклопентанон является маслом;
2,
2-диметил-5-/4-хлорбензилиден/-1-циклопентанон 60oC;
2,2-диметил-5-/2,4-дихлорбензилиден/-1-циклопентанон 68oC;
2,2-диметил-5-/4-фторбензилиден/-1-циклопентанон
69oC.
Пример VIII. Получение 2-/4-хлорбензилиден/-6-метил-1- /1H-1,2,4-триазол-1-илметил/-1-циклогексанолов
К смеси 22,4 г 2-метилциклогексанона и 28,1 г
парахлорбензальдегида в 250 мл этанола при 0oC добавляют 100 мл водного раствора 10%-ного едкого натра. После 15 часов перемешивания среду разбавляют водой и экстрагируют этилацетатом.
Концентрируют органическую фазу, высушенную над Na2SO4, а осадок хроматографируют на двуокиси кремния с элюантом гептан/этилацетат 90: 10. Получают желтое масло. Его
кристаллизируют в пентане, и получают бледножелтый порошок /17,1 г/ 2-/4-хлор-бензилиден/-6-метилциклогексанона с точкой плавления 59oC. Добавляют 3,8 г этого соединения в растворе в ТГФ
/безводном/ /33 мл/ в реакционную среду при -5oC, полученную следующим образом.
0,8 г гидрида натрия /60%-ная дисперсия/ нагревают до 70oC в 26 мл ДМСО /сухого/, затем добавляют 33 мл безводного ТГФ. Смесь, охлажденную до -5oC, обрабатывают йодидом триметилсульфония /3,9 г/ в растворе в сухом ДМСО /20 мл/. Образовавшийся, таким образом, после 1 часа при -5oC 8-/4-хлорбензилиден/-4-метил-1-оксаспиро/2,5/октан обрабатывают триазолом /2,2 г/ и триазолнатрием /0,28 г/.
Среду нагревают до 93oC в течение 1 часа 30 минут после дистилляции 30 мл ТГФ и добавления ДМФ /50 мл/.
После разбавления водой /1 л/, продукты экстрагируют дихлорметаном, а полученный путем выпаривания осадок очищают хроматографией /элюант гептан/этилацетат 1:1/.
Получают сначала находящийся в большем количестве диастереоизомер, который имеет заместитель метил и гидроксил в относительном положении цис, который плавится при 139oC /соединение N 36/, затем диастереоизомер в меньшем количестве, который имеет заместитель метил и гидроксил в относительном положении транс в виде меда /соединение N 36/.
Стереохимию определяют посредством ядерного магнитного резонанса по уже известной для специалистов технологии.
Пример IX. Получение
2-/4-хлорбензилиден/-6,6-диметил-1-/1H-1,2,4-триазол-1-илметил/-1-циклогексанола
К реакционной среде, полученной из толуола /25 мл/, третичного амилового спирта /3,6 мл/ и гидрида натрия /1,
35 г 60%-ной дисперсии в масле/ и нагретой до 45oC, последовательно добавляют вышеполученный 2-/4-хлорбензилиден/-6-метилциклогексанон /7,0 г/, затем метилйодид /5,1 г/. Смесь доводят до
рефлюкса /1 час/, выливают в воду и экстрагируют этилацетатом. После высушивания и концентрации осадок рекристаллизируют из метанола для получения 2-/4-хлорбензилиден/-6,6-диметилциклогексанона /4,7
г/, плавящегося при 92oC. Затем 4 г этого кетона обрабатывают согласно примеру I для получения после хроматографии заданного продукта, плавящегося при 179oC /соединение N 37/.
Таким же образом получают следующие соединения:
2-/4-фторбензилиден/-6,6-диметил-1-/1H-1,2,4-триазол-1-илметил/-1-циклогексанол. Изомер A, соединение N 38, точка плавления
154oC;
2-/4-хлорбензилиден/-1-/1H-1,2,4-триазол-1-илметил/-1-циклогексанол. Изомер A, соединение N 39, точка плавления 117oC;
2-/4-хлорбензилиден/-6-циклогексил-1-/1H-1,2,4-триазол-1-илметил/-1-циклогексанол. Изомер B, соединение N 41, точка плавления 197oC;
2-/4-хлорбензилиден/-6-циклогексил-1-/1H-1,2,
4-триазол-1-илметил/-1-циклогексанол. Изомер A, соединение N 40, т.пл. 260oC;
2-/4-хлорбензилиден/-6-трет-бутил-1-/1H-1,2,4-триазол-1-илметил/-1-циклогексанол. Изомер A, соединение
N 42, точка плавления 144oC;
2-/4-хлорбензилиден/-6-втор-бутил-1-/1H-1,2,4-триазол-1-илметил/-1-циклогексанол. Изомеры A + B, соединение N 43, точка плавления 171oC;
2-/4-хлорбензилиден/-6-втор-бутил-1-/1H-1,2,4-триазол-1-илметил/-1-циклогексанол. Изомеры C + D, соединение N 44, точка плавления 148oC;
2-/4-хлорбензилиден/-6-метил-6-фенил-1-/1H-1,2,4-триазол-1-илметил/-1-циклогексанол. Изомер A, соединение N 45, точка плавления 177oC;
2-/4-хлорбензилиден/-6-метил-6-фенил-1-/1H-1,
2,4-триазол-1-илметил/-1-циклогексанол. Изомер B, соединение N 46, точка плавления 133oC;
2-/4-хлорбензилиден/-6-метил-6-этил-1-/1H-1,2,4-триазол-1-илметил/-1-циклогексанол.
Изомеры A + B, соединение N 47, точка плавления 175oC;
2-/4-хлорбензилиден/-6-метил-6-изопропил-1-/1H-1,2,4-триазол-1-илметил/-1-циклогексанол. Изомер A, соединение N 48, точка
плавления 154oC;
2-/4-хлорбензилиден/-6-метил-6-изобутил-1-/1H-1,2,4-триазол-1-илметил/-1-циклогексанол. Изомер A, соединение N 49, точка плавления 163oC;
2-/4-хлорбензилиден/-6-метил-6-изобутил-1-/1H-1,2,4-триазол-1-илметил/-1-циклогексанол. Изомер B, соединение N 50, точка плавления 184oC:
2-/4-хлорбензилиден/-1-/1H-1,2,
4-триазол-1-илметил/-1-циклогептанол. Соединение N 54, точка плавления 104oC;
2-/4-хлорбензилиден/-7,7-диметил-1-/1H-1,2,4-триазол-1-илметил/-1-циклогептанол. Соединение N 55,
точка плавления 143oC;
2/4-фторбензилиден/-1-/1H-1,2,4-триазол-1-илметил/-1-циклогептанол. Соединение N 56, точка плавления 91oC;
2-/4-хлорбензилиден/-7-метил-1-/1H-1,2,4-триазол-1-илметил/-1-циклогептанол. Соединение N 57, точка плавления 166oC.
Ниже приводятся характеристики некоторых исходных циклоалканонов. Общие методы получения этих соединений указаны в литературе: DOS 2245518; Whitiny D. A. //J. Chem. Soc. 1971, 3396; Le Juillanion J. //Bull. Soc. Chim. 1969, 2871; PAL PER JESI //Chem. Ber. 1987, 120, 1449; Conia J.M. //Bull. Soc. Chim. 1970, 2972.
2-/4-фторбензилиден/-1-циклогексанон с точкой кипения при 0,02 мм рт.ст. 140oC;
2-/4-хлорбензилиден/-1-циклогексанон с точкой плавления 54oC;
2-метил-6-/4-хлорбензилиден/-1-циклогексанон с точкой плавления 59oC;
2,
2-диметил-6-/4-хлорбензилиден/-1-циклогексанон с точкой плавления 92oC;
2,2-диметил-6-/4-фторбензилиден/-1-циклогексанон с точкой плавления 51oC;
2-циклогексил-6-/4-хлорбензилиден/-1-циклогексанон с точкой плавления 97oC;
2-трет-бутил-6-/4-хлорбензилиден/-1-циклогексанон с точкой кипения при 0,06 мм рт.ст. 180oC;
2-втор-бутил-6-/4-хлорбензилиден/-1-циклогексанон с точкой плавления 46oC;
2-фенил-6-/4-хлорбензилиден/-1-циклогексанон с точкой плавления 121oC;
2-метил-2-фенил-6-/4-хлорбензилиден/-1-циклогексанон с точкой плавления 77oC;
1,1-диметил-3-/4-хлорбензилиден/-2-тетралон является маслом;
2-метил-2-этил-6-/4-хлорбензилиден/-1-циклогексанон с точкой плавления 70oC;
2-метил-2-изобутил-6-/4-хлорбензилиден/-1-циклогексанон является маслом;
2-метил-2-изопропил-6-/4-хлорбензилиден/-1-циклогексанон является маслом;
6-/4-хлорбензилиден/спиро/4,5/ декан-5-он является маслом;
2-/4-фторбензилиден/-1-циклогептанон с точкой
плавления 62oC;
2-/4-хлорбензилиден/-1-циклогептанон с точкой плавления 75oC;
2-метил-7-/4-хлорбензилиден/-1-циклогептанон с точкой плавления 74oC;
2,2-диметил-7-/4-хлорбензилиден/-1-циклогептанон с точкой плавления 63oC;
2,2-диметил-7-/4-хлорбензилиден/-1-циклогексанон с точкой плавления 63oC;
В
нижеприведенных примерах, иллюстрирующих фунгицидное применение соединений согласно изобретению, пульверизации растворов или суспензий активных веществ осуществляются в таких условиях, что
пульверизация раствора или суспензии с концентрацией, равной 1 г/л, соответствует в среднем нанесению примерно 2 мкг активного вещества на см2 листа растения.
В условиях по примерам X-XVI, показанные соединения не обладают фитотоксичностью.
В этих примерах считается, что продукт предоставляет полную защиту от фунгицидной болезни, когда защита составляет по меньшей мере 95% Защита считается хорошей, когда она составляет по меньшей мере 80% /но менее 95%/, достаточно хорошей, когда она составляет по меньшей мере 70% /но менее 80%/, средней, когда она составляет по меньшей мере 50% /но менее 70%/.
В настоящем изложении проценты, за исключением противоположного указания и процентов, относящихся к выходу, являются массовыми процентами. В случае, когда проценты выражены по отношению к стехиометрии, речь идет о молярных процентах. Что касается концентраций, некоторые из них выражены в ppm /частей на миллион/, что соответствует мг/л.
Опыты проводились при дозах 1 г/л или 0,3 г/л независимо от самих продуктов.
Пример X. Тест in vivo на Botrytis cinerea на листе томата
Подготавливают посредством тонкого измельчения водную эмульсию тестируемого активного вещества следующего состава: тестируемое активное вещество 60 мг; Твин 80 /поверхностно-активное вещество/,
состоящее из олеата полиоксиэтиленового производного сорбитана, разбавленного до 10%-ной концентрации в воде 0,3 мл; дополняют водой до 60 мл. Затем эту водную эмульсию разбавляют водой для получения
заданной концентрации.
Томаты, выращенные в теплице /сорт Марманд/, возраст 30-40 дней, обрабатывают посредством пульверизации водными эмульсиями /называемыми пульпами/, которые определены выше, и с различными концентрациями тестируемого соединения. С каждой концентрацией испытание повторяют дважды.
После 24 или 48 часов листы отрезают и помещают в 2 чашки Петри /диаметр 14 см/, на дне которых предварительно помещают диск из влажного бумажного фильтра /5 листочков на чашку/. Затем с помощью шприца наносят прививку путем нанесения капель /3 капли на листочек/ суспензии спор. Эту суспензию спор Botrytis cinerea получают из культуры возрастом 15 дней, переведенной в суспензию в питательном растворе /100000 единиц/см3/.
Контроль осуществляют на третий и шестой дни после заражения путем сравнения с необработанным контрольным образцом.
В этих условиях наблюдают по истечении 6 дней при дозе 1 г/л хорошую или полную защиту при использовании соединений 1, 3, а при дозе 0,3 г/л - хорошую или полную защиту при использовании соединений 2, 15, 16, 35, 38, 39.
Пример XI. Тест in vivo
на Erysiphe graminis на ячмене /оидиум ячменя/
Ячмень в горшках, посеянный на подложке торф-пуццолан 50/50, обрабатывают на стадии 10 см высотой путем пульверизации вышеуказанной водной
эмульсией /называемой пульпой/ с нижеуказанной концентрацией. Испытание повторяют два раза. По истечении 24 часов саженцы ячменя посыпают спорами Erysiphe graminis, причем посыпание осуществляют с
помощью больных саженцев.
Проверку осуществляют через 8-14 дней после заражения.
В этих условиях наблюдают следующие результаты: при дозе 1 г/л хорошую или полную защиту при использовании соединений 1, 2, 3, 14, 26, а при дозе 0,3 г/л при использовании соединений 4, 11, 38, 53, 55.
При дозе 1 г/л достаточно хорошую или среднюю защиту наблюдают при использовании соединений 10, 25, 33, а при дозе 0,3 г/л при использовании соединений 8, 15, 22, 29, 39.
Пример XII. Тест in vivo на "Puccina recondita", ответственной за ржавчину
пшеницы
Пшеницу в горшках, посеянную на подложке торф-пуццолан 50/50, обрабатывают на стадии 10 см высотой путем пульверизации водными эмульсиями /называемыми пульпами/ того же состава, что и
состав, описанный в примере A, и с различными концентрациями тестируемого соединения. Испытание повторяют два раза с каждой концентрацией.
По истечении 24 часов на пшеницу путем
пульверизации наносят водную суспензию спор /50000 единиц/см3/; эту суспензию получают от зараженных саженцев. Затем пшеницу помещают на 48 часов в инкубационную камеру с температурой
примерно 18oC и с относительной влажностью 100%
По истечении этих 2 дней относительную влажность доводят до 60% Проверку состояния саженцев осуществляют между 11-м и 15-м днями
после заражения путем сравнения с необработанным контрольным образцом.
При дозе 1 г/л хорошую или полную защиту наблюдают при использовании соединений 1, 2, 3, 10, 14, 25, 26, 27, 33, a при дозе 0,3 г/л при использовании соединений 4, 7, 9, 13, 14, 15, 18, 19, 28, 34, 35, 37, 38, 43, 47, 53.
При дозе 2 г/л достаточно хорошую или среднюю защиту наблюдают при использовании соединения 5, а при дозе 0,3 г/л при использовании соединений 8, 10, 11, 20, 22, 42, 44, 49.
Пример XIII. Тест in vivo "Puricullaria oryzae", ответственной за
Пирикулариоз риса (Rice blast)
Рис в горшках, посеянный в смесь 50/50 обогащенного торфа и пуццолана, обрабатывают на стадии 10 см высотой путем пульверизации вышеопределенной водной эмульсии
/называемой пульпой/ с нижеуказанной концентрацией. Испытание повторяют два раза. По истечении 48 часов обрабатывают путем нанесения на листья суспензией спор, полученных из чистой культуры.
Проверку осуществляют через 8 дней после заражения. В этих условиях наблюдают следующие результаты: при дозе 1 г/л хорошую или полную защиту при использовании соединений 1, 2, 4, 25, 28, а при дозе 0,3 г/л при использовании соединений 7, 9, 11, 12, 13, 14, 22, 29, 30, 33, 34, 38, 39, 43, 44, 47.
При дозе 1 г/л достаточно хорошую или среднюю защиту наблюдают при использовании соединений 5, 26, 27, а при дозе 0,3 г/л при использовании соединений 15, 16, 18, 23, 31, 32, 42, 48, 49.
Пример XIV. Тест in vivo "Puccinia recondita" при обработке
семян
Семена пшеницы сорта "Талант" обрабатывают пульпой по предыдущему примеру при дозе 75 г/ц, посеянные в субстрат, состоящий из смеси торфа и пуццолана 50/50. Через 15 дней после посева
проростки заражают спорами Puccinia recondita по способу, описанному в примере XII. Проверку результатов осуществляют через 30 и 45 дней после посева.
При указанных дозах при
использовании соединений N 1, 2, 3, 4, 13, 28, 29, 30, 31, 32, 35 и 37 процент заражения является нулевым через 30 дней после посева, а необработанные проростки зерен заражены на 100%
Пример
XV. Тест in vivo на Fusarium roseum при обработке семян
Семена пшеницы сорта "Талант", зараженные естественным путем спорами Fusarium roseum, обрабатывают пульпой, определенной в примере X,
при дозах 10, 25, 50, 100 г на 100 кг семян. В числе 50 г обработанных семян 200 семян помещают на среду, содержащую агар-агар и солод с концентрациями, соответственно, 2% и 1% Семена хранят в течение
10 дней при температуре 20oC. Контроль за состоянием семян осуществляют путем сравнения с необработанным контрольным образцом, в котором развились колонии Fusarium roseum.
При указанных дозах наблюдают хорошую или полную защиту при использовании соединений 1, 2, 3, 4, 13, 15, 28, 29, 30, 31, 32, 35, 37, 52 и 54.
Нижеприведенный пример иллюстрирует отсутствие фитотоксичности соединений согласно изобретению по отношению к росту семян.
Пример XVI. Семена пшеницы сорта "Талант" обрабатывают пульпой при дозах 2.5, 10, 25, 50, 100, 200, 400 г/ц. Семена помещают на пропитанный водой бумажный фильтр. Через 15 дней инкубационного периода при температуре 25oC измеряют длину первых листов для соединений N 1, 13, 15, 35 и 37. Ниже представлены результаты.
Доза, г/ц Длина первых листов, см
0 13
12 13
25 13
50 13
100 12
200 13
400 12
Каждое вышеуказанное значение является средним для сорока проростков.
Биологичесикие испытания
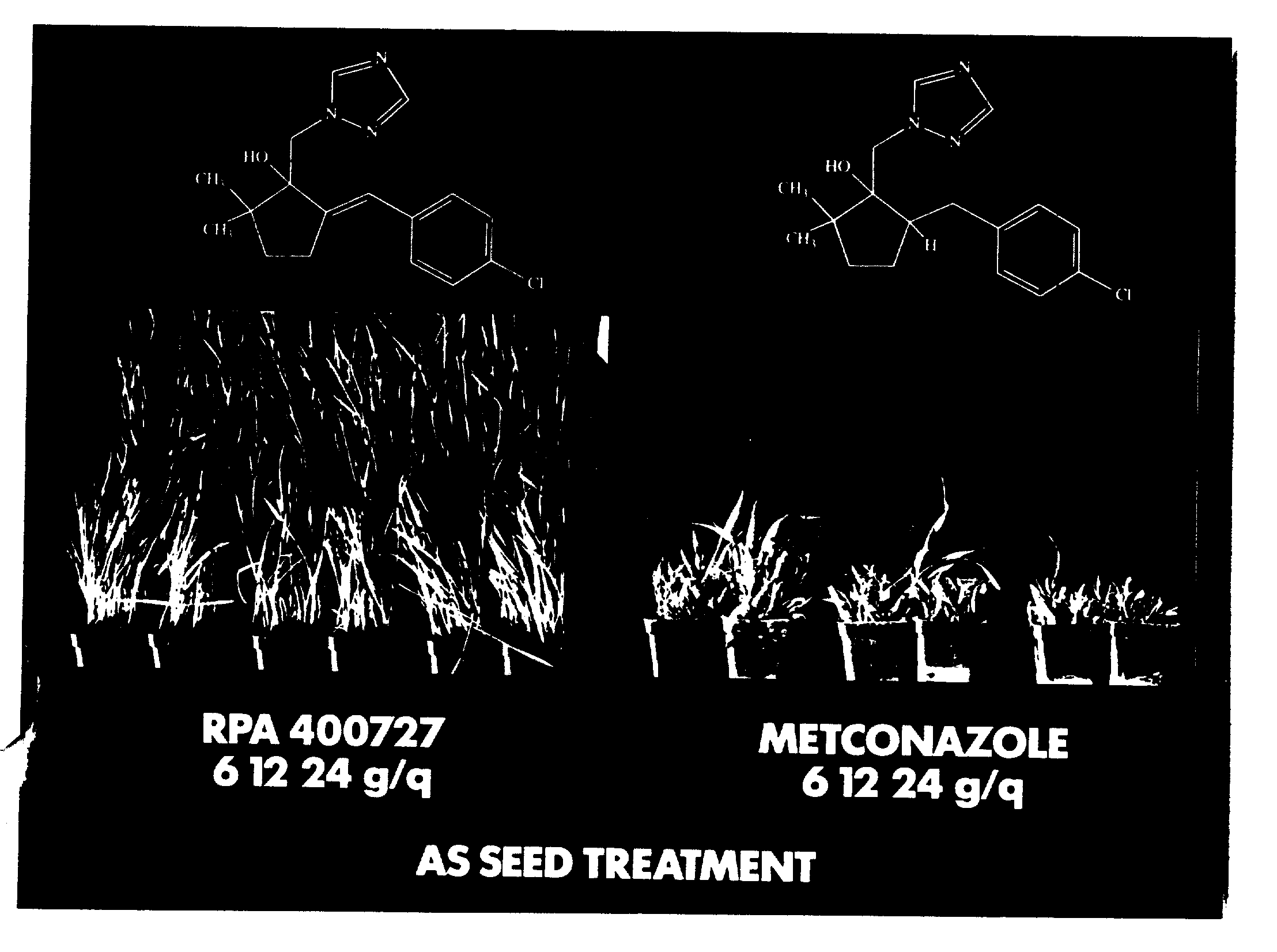
Сравнение проводится между нашим соединением /a/ 2-/4-хлорбензилиден/-5,
5-диметил-1/1H-1,2,4-триазол-1-илметил/-1-циклопентанол /соединение N 1/ и соединением /b/ 2-/4-хлорбензил/-5,5-диметил-1-/1H-1,2,4-триазол-1-илметил/-1-циклопентанол, описанным в европейской заявке
на патент ЕП 0267778 на имя Куреха.
Испытание осуществляется следующим образом. Зерна пшеницы сорта Talent обрабатываются раствором соединений /a/ или /b/ так, чтобы получить 6, 12 или 24 г активного вещества на центнер зерен. Обработанные таким образом зерна засеиваются в смеси, состоящей из торфа и пуццолана, и выдерживаются при температуре 18-20oC. Затем осуществляют заражение посева.
1. Испытание по отношению к бурой ржавчине на пшенице
Заражение проводится спустя 7 дней после посева при помощи суспензии спор указанной
болезни /120 000 спор/мл/ путем распыления на поверхность листьев. Инкубация проводится в течение 24 часов при температуре 20oC и при насыщающей влажности. Показания снимаются спустя 9 дней
после заражения.
2. Испытание по отношению к оидиуму на пшенице
Заражают посев в возрасте 16 дней путем прямого опудривания указанной болезнью. Снимают показания по
эффективности спустя 7 дней после такого заражения.
Для двух этих испытаний используются посевы-свидетели, т.е. посевы, проведенные исходя из зерен, не обработанных соединениями /a/ или /b/, но которые заражаются определенной болезнью /ржавчиной или оидиумом/. Получают результаты, приведенные в таблице.
Примечания к таблице: шкала фитотоксичности: 0 отсутствует фитотоксичность: 4 сильная фитотоксичность /нанизм/.
Можно констатировать, что в терминах эффективности соединение /a/ слегка превышает соединение по известному уровню техники, однако большая разница обусловлена эффектом фитотоксичности, который очень четко ниже для соединения заявителя, как это подтверждает приложенная фотография.
Реферат
Использование: в качестве фунгицидов. Сущность изобретения: производные бензилиденазолилметилциклоалкана или алкена I:

радикалы R5, X, n имеют соответствующие значения. Способ их получения взаимодействия II с III

Фунгицидная композиция, содержащая производное бензилиденазолилметилциклоалкана или алкена I в количестве 5-70 мас.%, целевые добавки - остальное. 4 с. и 14 з.п.ф-лы, 1 табл., 1 ил.
Формула

где W группаCH- илиN-;
R5 Н, С1 С4-алкил;
X атом галогена CN, C1 C4-галогеналкил;
n 0, 1, 2;
символ
означает одну из следующих групп:
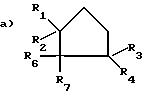
или

где R1 и R2 одинаковые или различные, Н, С1 - С4-алкил;
R3 H;
R4 H или С1 С4-алкил;
R6 H или С1 С4-алкил;
R7 H;
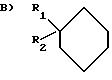
где R1 и R2, одинаковые или различные, означают Н или С1 С4-алкил;
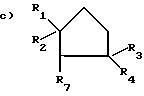
где R1 и R2, одинаковые или различные, означают С1 - С4-алкил, замещенный С2 С4-алкенилом, R3, R4 , R7 означают Н;
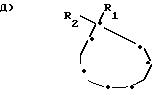
где R1 и R2, одинаковые или различные, означают Н или С1 С4-алкил,
или их соли.
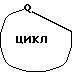
означает группу а.

означает группу в.
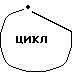
означает группу с.
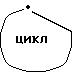
означает группу d.

где X, n и символ

имеют указанные значения, подвергают взаимодействию с илидом сульфония с получением оксирана общей формулы III
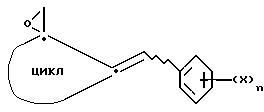
где X, n и символ
имеют вышеуказанные значения, и полученное соединение подвергают взаимодействию с имидазолом или с незамещенным триазолом в присутствии основания.

где X, n и символ
имеют вышеуказанные значения.
29.12.88 п.2.

Комментарии