Офтальмическая композиция на основе полиненасыщенных жирных кислот омега-3 и омега-6 - RU2545675C2
Код документа: RU2545675C2
Чертежи
Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к офтальмическим композициям на основе полиненасыщенных жирных кислот омега-3 и омега-6. Более конкретно, изобретение касается препаратов местного действия для предотвращения и лечения глазных патологий, в частности, воспалительных кератитов и конъюнктивитов и синдрома сухого глаза, содержащих в качестве активных ингредиентов полиненасыщенные жирные кислоты типа омега-3 и омега-6, объединенные в стабильную композицию в гидрогеле. Предложенные композиции особенно показаны для использования в качестве искусственных слез.
Уровень техники
Как известно, преокулярная слезная пленка это сложная жидкая структура, которая покрывает открытую поверхность глазного яблока, а также конъюнктиву глазного яблока и век. Такая структура образуется при взаимодействии твердого слоя, образованного комплексом эпителия роговицы и гликокаликса (т.е. гликопротеинового покрытия эпителиальных клеток, состоящего из их секрета), с жидким слоем, собственно, со слезной пленкой. Твердый слой служит для обеспечения адгезии жидкой части слезной пленки к поверхности глаза, а жидкий слой образован, в свою очередь, тремя перекрывающимися слоями, слизистым слоем, водным слоем и липидным слоем.
Внутренний слизистый слой слезной пленки состоит из смеси вязкоэластичных гидратированных гликопротеинов (муцин), которые адгезируют к упомянутому твердому слою и образуют гидрофобную поверхность. Водный слой - это промежуточная часть слезной пленки, которая распространяется по упомянутой гидрофобной поверхности и образована, главным образом, из воды, органических и неорганических солей, сахаров, белков, ферментов и других биополимеров сложной структуры (таких как сами муцины). Соединения в растворе в этом слое выполняют структурную, осмотическую, буферную и питательную функции и определяют защитное действие слезной пленки на ткани глазной поверхности. Тонкий наружный липидный слой образован восками, жирными кислотами и сложными эфирами холестерина и служит для стабилизации слезной пленки, контролируя потерю воды при испарении.
Описанная трехслойная структура создает сложную физиологическую систему, основная функция которой защищать глазную поверхность, поддерживать гидратацию, смазку и чистоту поверхности роговицы и взаимодействовать при обеспечении правильного зрения. Совершенный баланс и постоянная сменяемость слезной пленки являются необходимыми условиями для выполнения ею своих функций. В частности, должно происходить постоянное, но не избыточное испарение воды из слезной жидкости, чтобы поддерживать ее осмолярность на физиологическом уровне, и слезная пленка должна постоянно перераспределяться по поверхности роговицы при моргании.
В результате аномалий или разбаланса одного или большего числа описанных слоев может возникнуть состояние, известное как синдром сухого глаза (keratoconjunctivitis sicca), которое является хроническим заболеванием, наблюдаемым, главным образом, у пожилых женщин. Сухой глаз - это мультифакторная патология, характеризующаяся изменениями качественного и количественного состава слезной пленки, что проявляется в ощущении инородного тела, симптомах раздражения (дискомфорта), нарушениях зрения и нестабильности слезной пленки с возможным повреждением поверхности глаза и сопровождается гиперосмолярностью слезной пленки. Действительно, у больных, страдающих от этой патологии, наблюдается повышенное испарение и сниженное перемещение слезной жидкости и, как следствие, повышение осмолярности пленки, которая достигает 330-340 мОсм/л, при том, что нормальное значение составляет около 300 мОсм/л. Известно также, что синдром сухого глаза часто сопровождается воспалительными явлениями, которые распространяются от поверхности глаза к слезной железе и к мейбомиевым железам.
Синдром сухого глаза обычно сильно влияет на качество жизни страдающего от него пациента и на значительные общественные затраты из-за того, что симптомы носят хронический характер, что снижено зрение как при работе, так и в повседневной деятельности (чтение, просмотр ТВ (TV), вождение), что необходимо часто проходить обследование у офтальмолога и прибегать к медицинской терапии. Учитывая постоянное увеличение среднего возраста человеческой популяции, это заболевание будет приобретать все возрастающее значение в будущем.
Терапия синдрома сухого глаза сосредоточена, главным образом, на восстановлении слезной пленки, например, используя медленно высвобождающие глазные вкладыши, вставленные в конъюнктивальный мешок, и, прежде всего, с жидкими офтальмическими препаратами, обычно называемыми «искусственные слезы», которые закапывают по капле, для замены или усиления естественного образования слез. В простейшем случае такие препараты имеют только увлажняющее действие, поскольку они состоят из нейтральных и изотонических относительно слезной жидкости растворов физиологического раствора на основе одного хлорида натрия или сбалансированных смесей различных электролитов. В других случаях для преодоления погрешности сниженной задержки в конъюнктивальном мешке, для смазки тканей и более эффективного предотвращения образования сухих областей эпителия роговицы, состав заменителей слез обогащают высокомолекулярными компонентами, имеющими функцию загустителей. Такие компоненты в норме являются водорастворимыми полимерами синтетической, полусинтетической или естественной природы, многие из которых, такие как гиалуроновая кислота и производные целлюлозы, широко применяются для рассматриваемых целей.
Следует отметить, что в случае изменений или недостаточности наружного липидного слоя слезной пленки постоянное взаимодействие пленки и внешней среды может приводить к испарению водной компоненты, экспозиции поверхности глаза с инфекционными агентами и последующему воспалению поверхности глаза. Эти механизмы лежат в основе клинических симптомов и признаков синдрома сухого глаза, но могут наблюдаться и у здоровых лиц в условиях низкой влажности и при слабом потоке воздуха.
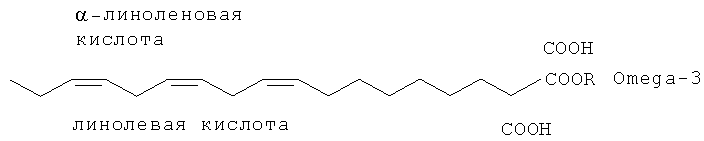
Благодаря воспалительным компонентам, которые обычно присутствуют при синдроме сухого глаза, такие соединения, как полиненасыщенные жирные кислоты, в частности типа омега-3 и омега-6, очень интересны для возможного включения их в препараты, заменяющие слезы. Как известно, полиненасыщенные жирные кислоты, или PUFA, являются карбоксильными соединениями с алифатической цепью, имеющей две или более двойных связи в цепи, которая характеризуется позицией первой двойной связи, считая от терминального атома цепи (ω позиция). Среди полиненасыщенных жирных кислот омега-3 (или PUFA, n=3) и омега-6 (или PUFA, n=6) представляют группу незаменимых жирных кислот, незаменимых для правильного функционирования организма. Примеры жирных кислот типа омега-3 включают α-линоленовую кислоту (С 18:3, n-3; ALA), эйкозапентаеновую кислоту (С20:5 n-3; EPA) и докозагексаеновую кислоту (С22:6, n-3; DHA); примеры жирных кислот типа омега-6 включают линолевую кислоту (С18:2, n-6; LA) и γ-линоленовую кислоту (С18:3, n-6; GLA).

В литературе сообщается (N.L.J.Verbey, N.J.van Haeringen, P.T.V. M. de Jong. Current Eye Research, 1988, 7(6) 549-556), что местное лечение поверхности глаза ненасыщенными жирными кислотами типа омега-3 и омега-6 эффективно ингибирует различные процессы, такие как инфильтрация лейкоцитов, неоваскуляризация и отек роговицы, причем все они являются проявлениями феномена воспаления. Было показано, что наиболее активными жирными кислотами являются эйкозапентаеновая кислота (ЕРА, omega-3) и γ-линоленовая кислота (GLA, omega-6). Механизм действия этих кислот связан с механизмом действия арахидоновой кислоты в воспалительном каскаде: действительно, они конкурируют с арахидоновой кислотой, ингибируя образование простагландинов E1 (PGE1) и провоспалительных лейкотриенов.
Пищевые добавки на основе полиненасыщенных жирных кислот, обогащенные жирными кислотами типа омега-3 из рыбьего жира (особенно жиров лосося и сельди) и жирными кислотами типа омега-6, главным образом, растительного происхождения (черная смородина, бурачник) широко применяют из-за их положительного действия на сердечно-сосудистую, иммунную и нервную системы, а также, конкретно, для применения в качестве добавок при лечении сухого глаза. В сущности, последние работы показали, что как ЕРА, так и GLA проявляют заметную терапевтическую активность при синдроме сухого глаза. (Aragona, P., et. al., Systemic omega-6 essential fatty acid treatment and PGE1 tear content in Sjogren's syndrome patients. Invest. Ophthalmol. Vis. Sci., 2005. 46(12): 4474-9; Barabino, S., et. al., Systemic linoleic and gamma-linolenic acid therapy in dry eye syndrome with an inflammatory component. Cornea, 2003. 22(2):97-101; Creuzot-Gracher, С., et. al., Improvement of dry eye symptoms with polyunsaturated fatty acids. J. Fr. Ophthalmol., 2006 29(8):868-73). Следует отметить, что рассматриваемые продукты в случае офтальмических проявлений также являются продуктами для перорального введения.
Хотя около двух десятилетий прошло с тех пор, когда было показано, что местное применение жирных кислот омега-3 и омега-6 оказывает положительное действие при заболеваниях поверхности глаза, в настоящее время в продаже нет глазных капель, содержащих упомянутые жирные кислоты. Очевидно, что их доступность имела бы значительные преимущества для лечения синдрома сухого глаза, в первую очередь, из-за лучшей переносимости местного офтальмического препарата по сравнению с препаратом для перорального введения, применение которого влияет на желудочно-кишечный тракт. Отсутствие такого препарата следует объяснить трудностью разработки рецептур с применением жирных кислот типа ЕРА и GLA, в первую очередь, из-за плохой растворимости в воде и низкой химической стабильности этих активных ингредиентов.
Таким образом, в настоящее время полиненасыщенные жирные кислоты, будучи сильно липофильными и плохо растворимыми в воде молекулами, бросают вызов исследователям, ищущим новые водорастворимые офтальмические препараты для местного введения.
Липидные эмульсии, давно используемые для парентерального применения, исследовали с целью разработки рецептуры нескольких липофильных активных ингредиентов и повышения их офтальмической биодоступности (T.F.Vandamme, Microemulsions as ocular drug delivery systems: recent developments and future challenges, Prog. Retin. Eye Res. 21 (2002) 15-34; S.Tamilvanan, R.N. et. al., Emulsion-based delivery systems for enhanced drug absorption, Pharm. Tech. 131 (2002) 156-161). Как известно, эмульсии представляют собой дисперсные системы, образованные двумя несмешивающимися жидкими фазами, приготовленные механическим перемешиванием. Благодаря разнице взаимного притяжения между разными молекулами двух жидких фаз, в каждой точке соприкосновения двух жидкостей генерируется межфазное натяжение, и из-за упомянутого натяжения две фазы стремятся отделиться друг от друга, чтобы минимизировать контактирующую поверхность. Межфазное натяжение может быть значительно снижено добавлением амфифильных молекул или поверхностно активных агентов, растворимых, по меньшей мере, в одной из двух фаз, образующих эмульсию. Таким образом, добавление подходящего поверхностно-активного агента позволяет избежать отделения водной фазы от масляной фазы или, по меньшей мере, замедлить его развитие.
Липидные эмульсии для использования в качестве медицинских препаратов, в частности, фармацевтических композиций, состоящие из эмульсий типа масло-в-воде для использования в качестве переносчиков липофильных активных ингредиентов, описаны в документе ЕР 0391369 (Yissum Resarch Development Company of the Hebrew University of Jerusalem, inventors B.Simon and L.Menashe). Такие композиции содержат и масляный носитель, состоящий из триглицеридов средней цепи (МСТ), в некоторых случаях объединенный с растительным маслом, таким как, например, соевое масло, вместе с фосфолипидами (например, пектинами, или соевыми фосфолипидами) и поверхностно-активными агентами в частности неионными сурфактантами (такими, например, как полисорбат 80 или Твин 80) и ионными сурфактантами (в частности, холиевая и дезоксихолиевая кислоты).
Относительно композиций, описанных в цитированном документе, сообщается, что они образуют эмульсии с высокой стабильностью и предлагаются для перорального, парентерального, а также местного офтальмического введения липофильных активных ингредиентов. В их числе примеры описывают амфотерицин и основание миконазола.
В контексте выполненного заявителем исследования, предназначенного для получения офтальмического продукта в форме глазных капель на основе полиненасыщенных жирных кислот, изучали возможность приготовления композиции, содержащей эйкозапентаеновую кислоту (ЕРА) и γ-линоленовую кислоту (GLA) в качестве активных ингредиентов, используя модель липидной эмульсии патента ЕР 0391369. Результаты такого исследования, изложенные далее (см. сравнительный пример 1), показали, что эмульсии на основе жирных кислот типа омега-3 и омега-6, полученные таким способом, совершенно не стабильны с физической точки зрения, поскольку они стремятся эволюционировать в направлении разделения фаз и, кроме того, они не стабильны с химической точки зрения, поскольку содержание двух активных ингредиентов заметно снижалось уже после одного месяца хранения в условиях холодильника (при температуре 4°С), очень вероятно, из-за окисления
Поскольку основные продукты деградации, ответственные за уменьшение концентрации ЕРА и GLA, в выполненном исследовании это продукты окисления, была сделана также попытка приготовить такую эмульсию в азотной среде, барботируя азот на этапе эмульсификации и в присутствии антиоксидантов (таких как витамин Е и Тролокс, его водорастворимое производное). Однако в этом случае эмульсия также становилась химически нестабильной, и после одного месяца хранения при комнатной температуре концентрация ЕРА и GLA уменьшалась до неудовлетворительных значений (см. сравнительный пример 2). Полученные экспериментальные результаты доказывают невозможность хранения этого препарата глазных капель в течение интервалов времени, необходимых для фармацевтических препаратов как при комнатной температуре, так и в условиях холодильника.
Позднее в Международной заявке на патент, опубл. N WO 2006/007510 (R.Dana et аl., приписанной к Schepens Eye Research и Johnson & Johnson Vision Care, Inc.), сообщалось об офтальмических композициях местного действия на основе жирных кислот омега-6 и омега-3 в качестве активных ингредиентов, начиная с известной противовоспалительной активности этих агентов и с оценки, согласно которой давно используемое пероральное их введение может быть плохо переносимо или нежелательно.
В препаратах, приведенных в качестве примеров в этом документе, омега-3 и омега-6 непосредственно эмульгированы подходящими сурфактантами, такими как, например, полиэтоксилированные сорбитановые эфиры жирных кислот (а именно, полисорбаты, такие как «Твин») и полиэтоксилированные метилгликозиды (такие как «Глюкам»). Конкретно, в описанном процессе приготовления первый сурфактант добавляли к забуференному физиологическому раствору, и смесь выдерживали при размешивании при комнатной температуре в течение времени, достаточном для получения прозрачного раствора, затем добавляли второй сурфактант и вслед за этим, после дальнейшего периода перемешивания, очень медленно добавляли жирную кислоту (или жирные кислоты, если их больше, чем одна). Наконец, добавляли каплю витамина Е (обладающего функцией антиоксиданта), и эмульсию выдерживали при размешивании еще несколько часов.
Эта же группа исследоватепей (S.Rashid et al., Topical Omega-3 and Omega-6 Fatty Acids for Treatment of Dry Eye, Arch. Ophthalmol. 126(2) (2008) 219-225) недавно опубликовала результаты клинических испытаний эффективности местного введения препаратов α-линоленовой кислоты (ALA) и линолевой кислоты (LA) при лечении сухого глаза, где исследуемые препараты получали эмульгированием активных ингредиентов Твином-80 (2,6%) и Глюкамом Е-20 (2,6%) в водном растворе, как сообщалось в цитированном патентном документе.
Однако ни в патентной публикации WO 2006/007510, ни в соответствующей научной статье ничего не сообщалось ни о физической стабильности полиненасыщенных жирных кислот в таких офтальмических препаратах, ни об их химической стабильности. Заявитель дополнительно сообщал (см. сравнительный пример 3), что препараты на основе ЕРА, DHA и GLA, полученные в виде эмульсии в соответствии с указаниями этого документа, подвержены окислительным повреждениям, аналогичным тем, которые наблюдались с ранее описанными препаратами в фосфолипидной эмульсии.
Затрудненная физическая стабильность эмульсий, полученных с использованием только значительных количеств поверхностно-активных агентов (которые считаются токсичными для поверхности роговицы) и, кроме того, химическая нестабильность рассматриваемых полиненасыщенных кислот требуют новых фармацевтических систем, альтернативных по отношению к рассмотренным выше со ссылкой на известный уровень техники.
Раскрытие изобретения
В рамках исследований, выполненных в связи с настоящим изобретением, учитывали, что водные гидрогели, образованные гидрофильными полимерами, способны улавливать и удерживать в суспензии сильно гидрофобные активные ингредиенты без необходимости прибегать к эмульсионным технологиям. Было обнаружено, согласно настоящему изобретению, что можно инкорпорировать некоторые специфические полиненасыщенные жирные кислоты типа омега-3 и омега-6 или их подходящие производные в растворы с антиоксидантом семейства витамина Е (т.е. токоферолами и их фармацевтически приемлемыми эфирами), в структуру трехмерной сети гидрогеля, причем получающиеся препараты стабильны при хранении как в условиях холодильника, так и при комнатной температуре, легко вводятся в форме глазных капель и очень хорошо переносятся глазом.
В настоящее время на рынке имеется несколько медикаментов, которые выпускают в виде геля для местного применения, например, такие как Тимоптол ХЕ (Merck Sharp & Dohme) на основе малеата тимолола, обладающего гелеобразующей системой, содержащей камедь, и Nyogel (Новартис), также содержащий в качестве активного ингредиента малеат тимолола, заключенный в ПВА (поливинилалкоголь, PVA) гель и Карбомер 974 (относящийся к семейству карбоксивиниловых полимеров, известных так же как «Карбополы»). Однако сегодня эти системы используются с единственной целью улучшения биодоступности гидрофильных активных ингредиентов, таких как собственно малеат тимолола, так чтобы получить системы доставки с замедленным высвобождением, при использовании которых количество ежедневных введений препарата может быть снижено, а не с целью улучшения стабильности липофильных активных ингредиентов.
Предложенный согласно данному изобретению офтальмический препарат состоит в процессе синтеза из микрометрической дисперсии масел, которые являются источниками жирных кислот омега-3 и омега-6, с витамином Е, предпочтительно в ацетатной форме, в водной среде, причем упомянутая дисперсия получена с использованием подходящих гельобразующих полимеров. Как будет более понятно со ссылкой на экспериментальный раздел, представленный далее, гидрогели, содержащие токоферил ацетат вместе с полиненасыщенными жирными кислотами в качестве переносимых активных ингредиентов, становятся удивительно стабильными при хранении и сохраняют содержание активных ингредиентов практически неизмененными в течение длительного времени.
Следует отметить, что офтальмические продукты в геле согласно изобретению не только действуют как переносчики противовоспалительных продуктов, но используются, чтобы защитить и объединить тонкий липидный слой слезной пленки, поскольку активные ингредиенты, о которых идет речь, состоят из липидных молекул. Объединение липидных компонент позволяет уменьшить избыточное испарение слезной жидкости, восстанавливая защитную функцию внешней липидной пленки. Как известно, последняя в случае воспалительных явлений и особенно при воспалении мейбомиевых желез подвергается изменениям и не может влиять на повышенное испарение водного слоя (что часто наблюдается у пациентов, страдающих от кератоконъюнктивита (keratoconjunctivitis sicca).
Таким образом, настоящее изобретение относится к офтальмической композиции местного применения, содержащей в качестве активного ингредиента одну или более омега-3 полиненасыщенных жирных кислот и одну или более омега-6, полиненасыщенных жирных кислот, причем упомянутые жирные кислоты имеют алифатическую цепь от 16 до 24 атомов углерода или их фармацевтически приемлемые производные, выбранные из их эфиров с C1-С6 алкильными группами, их триглицеридами и их фосфолипидами в растворе с витамином Е или его фармацевтически приемлемым эфиром, причем упомянутый раствор находится в диспергированной форме в гидрогеле на основе водного переносчика, содержащего один или более гельобразующих полимеров.
В препаратах согласно настоящему изобретению, витамин Е может быть представлен одной из восьми компонент семейства α-, β-, γ-, δ- токоферола и α-, β-, γ-, δ-токотриенола, но α-токоферол предпочтителен из-за его большей диффузии. Среди соответствующих эфиров, кроме сукцината или эфиров длинноцепочечной кислоты, наиболее подходящим и распространенным продуктом является ацетат. Предпочтительный антиоксидант для процедур настоящего изобретения - α-токоферилацетат, который по сравнению с соответствующим α-токоферолом лучше переносим при местном офтальмическом введении.
Важно отметить, что в предложенной здесь рецептуре α-токоферилацетат может применяться в больших количествах, в отличие от применяемых в классической рецептуре эмульсий, где эмульгируемые количества очень малы. На поверхности глаза α-токоферилацетат образует при гидролизе α-токоферол (витамин Е), который, обладая, кроме того, сильным антиоксидантным действием, является ингибитором циклооксигеназы-2 (СОХ-2), ответственной за синтез простагландина E2(PGE2). Последний, как известно, играет важную роль в воспалении. Кроме того, витамин Е способен ингибировать образование интерлейкина-1, который ответственен за уменьшение слезоотделения.
Согласно некоторым специфическим приложениям данного изобретения каждая из упомянутых жирных кислот омега-3 и омега-6 имеет алифатическую цепь с двумя или большим числом двойных связей и длину от 18 до 22 атомов углерода, а также карбоксильный конец формулы COOR, где R может быть водородом или линейной, или разветвленной алкильной группой C1-С6. Кроме того, атомы углерода R группы могут быть хиральными.
Концевую группу R выбирают предпочтительно из этила, пропила и изобутила, и образующиеся соединения, таким образом, - это этиловые, пропиловые или изобутиловые эфиры соответствующей полиненасыщенной жирной кислоты.
Конкретно, предпочтительная композиция, согласно данному изобретению, содержит или омега-3 активные ингредиенты в растворе α-токоферил-ацетата, в свою очередь, диспергированного в растворе гидрогеля, эйкозапентаноевой кислоты (ЕРА), докозагексаеновой кислоты или их смеси, или одного или обоих соответствующих C1-С6 алкильных эфиров, или одного или обоих соответствующих триглицеридов, или одного или обоих соответствующих фосфолипидов.
Аналогично, согласно другому предпочтительному приложению данного изобретения, предложенная композиция содержит или омега-6 активный ингредиент в растворе α-токоферил-ацетата, в свою очередь, диспергированного в растворе гидрогеля, γ-линоленовой кислоты (GLA) или C1-С6 ее алкильных эфиров, или ее соответствующих триглицеридов или фосфолипидов.
Предпочтительно, офтальмическая композиция согласно данному изобретению, содержит в качестве активных ингредиентов ЕРА, DHA и GLA, или их этиловые эфиры, их триглицериды или их фосфолипиды.
Источники полиненасыщенных жирных кислот, обогащенных кислотами семейства омега-6 (такими как GLA), могут быть выбраны из группы растительных масел, включая:
льняное масло, масло бурачника, масло из проростков пшеницы, конопляное масло, оливковое масло, арахисовое масло, масло черной смородины и соевое масло.
Источники полиненасыщенных жирных кислот, обогащенных кислотами семейства омега-3 (такими как as ЕРА и DHA), могут быть легко найдены в высоких концентрациях в рыбьем жире и могут быть выбраны из
жира лосося, жира макрели, жира жирной рыбы (например, анчоусов и сардин), жира криля и их смесей.
В частности, жир криля - это жир, экстрагированный из крошечных ракообразных, являющихся частью зоопланктона, в особенности одного вида криля, который обитает в заметных концентрациях в приполярных и холодных водах. Такой жир особенно обогащен жирными кислотами омега-3, как и рыбий жир, и жирными кислотами омега-3, конъюгированными с фосфолипидами, главным образом, с фосфатидилхолином (который по этой причине часто относят к классу пищевых добавок под названием морской лецитин).
Жирные кислоты семейства омега-3 обычно содержатся в таких жирах в процентах, изменяющихся от 40 до 50%, и присутствуют также в растительных маслах, упомянутых выше в качестве источника жирных кислот омега-6.
В частности, фармацевтическое применение ЕРА, GLA и DHA может быть внедрено в практику с помощью исходных материалов высокой степени чистоты. Это требует отделения упомянутых жирных кислот от смесей жирных кислот рыбьего жира и/или растительных масел до достижения чистоты 90% и 70% для ЕРА и GLA соответственно. Известные в настоящее время процессы, применяемые для этой цели, включают экстракцию, молекулярную дистилляцию и низкотемпературную кристаллизацию.
Таким образом, согласно предпочтительным вариантам данного изобретения, полиненасыщенные жирные кислоты омега-3 и омега-6, содержащиеся в препаратах в качестве активных ингредиентов, содержатся в одном или большем числе растительных масел и/или в одном или большем числе рыбьих жиров, смешанных, в свою очередь, с антиоксидантом токоферолом, в котором они растворимы, и смесь диспергируют до микронных капель в водном геле. Предпочтительно растительные масла выделяют из льняного масла, масла бурачника, масла из зародышей пшеницы, конопляного масла, оливкового масла, арахисового масла, масла черной смородины и соевого масла, а рыбьи жиры выделяют из жира лосося, жира макрели, жира жирных рыб и их смесей.
Согласно данному изобретению, отношение омега-3 к омега-6 может изменяться от 20:1 до 1:20, предпочтительно от 1:10 до 10:1. В особо предпочтительных композициях весовое отношение (EPA+DHA) к GLA находится между 4:1 и 1:4.
Как будет более очевидно из ссылок на следующие примеры, количество витамина Е в масляной смеси омега-3 и омега-6 предпочтительно не менее 50% по весу, и в некоторых предпочтительных рецептурах его содержание между 50% и 75% по весу. Препарат, основанный на необязательно этерифицированном витамине Е, содержащий полиненасыщенные жирные кислоты, может быть легко распределен в гидрогеле, где он стабильно диспергирован без какого-либо разделения фаз и, кроме того, он продолжает сохранять целостность как раствор и стабильность, а также химический состав. Удивительно, что дисперсия раствора ацетата витамина Е, содержащего полиненасыщенные жирные кислоты омега 3 и 6, может осуществляться до 25% веса упомянутого масляного раствора по отношению к весу всего препарата. В соответствии с предложениями настоящего изобретения α-токоферил-ацетат предварительно смешивали с источником омега-3 и омега-6 при соотношении между ними в интервале от 4:1 до 1:4, предпочтительно от 3:1 до 1:3 и еще более предпочтительно от 3:1 до 1:1 и при конечной концентрации в препарате, которая может изменяться от 0,1% до 20%.
Гельобразующие полимеры, предложенные для приготовления гидрогеля в соответствии с данным изобретением, - это, предпочтительно, продукты, уже применяемые в общей клинической практике, в частности, как компоненты заменителей слез. Такие компоненты выбирают из продуктов, которые не изменяют качественный состав слезной пленки и, кроме того, могут иметь дополнительное действие, кроме противовоспалительного действия полиненасыщенных жирных кислот.
Из гельобразующих полимеров, которые могут применяться в офтальмической композиции по данному изобретению, в том числе, в сочетании друг с другом, следует рассмотреть предпочтительно карбоксивинильные полимеры (известные как Каропол или Карбомер), гиалуроновую кислоту и их соли щелочных и щелочно-земельных металлов, простые и сложные эфиры целлюлозы (такие как гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза и т.д.), ксантановая смола, альгиновая кислота, альгинаты и камеди. Однако для целей данного изобретения могут использоваться также другие гельобразующие полимеры, применяемые в разработке искусственных слез, пригодные для предотвращения избыточного испарения водного слезного слоя.
В предпочтительных воплощениях офтальмической композиции согласно данному изобретению упомянутый гельобразующий полимер относится к семейству разнообразно поперечно сшитых полимеров, известных как Карбопол (или карбомер). В частности, в композициях на основе ЕРА и GLA или ЕРА, DHA и GLA в качестве основных активных ингредиентов, некоторые примеры которых представлены здесь, применение Карбопола 980 или Карбопола 974 имело особенные преимущества при концентрациях в интервале от 0,01% до 5% от полного веса композиции, предпочтительно около 0,2% от веса.
В соответствии с данным изобретением, композиция может также содержать один или более полимерных эмульгирующих агентов, выбранных, например, из полимеров акриловой кислоты (таких, как продукт, известный под коммерческим названием «Пемулен», высокомолекулярный сополимер акриловой кислоты и длинноцепочечного алкилметакрилата, поперечно сшитого с аллильными эфирами пентаэритритола) и полоксамерами (блок-сополимерами полиоксиэтилен - полиоксипропилен, такими как продукты, известные как “Плуроник”. В предпочтительных композициях в соответствии с данным изобретением на основе ЕРА и GLA или ЕРА, DHA и GLA Пермулен предпочтительно применяется в концентрациях, содержащихся между 0,001% и 2% полного веса препарата, причем предпочтительная концентрация составляет 0,007% веса.
Предложенные композиции могут также содержать, как правило, рН стабилизаторы, буферы и комплексоны, такие как ЭДТА (EDTA), и осмотически активные агенты, выбранные из тех, которые в настоящее время применяются в фармацевтической технологии. В предпочтительных композициях в соответствии с данным изобретением применяют такой осмотически активный агент, как глицерин, в количестве, пригодном для получения слегка гипотонического препарата, причем это свойство нужно, чтобы противодействовать функциональному и анатомическому дискомфорту эпителия глазной поверхности. Действительно, в случаях избыточного испарения или сниженного слезообразования увеличение концентрации соли приводит к повышению осмотичности слезной пленки, влияя таким образом на поверхность глаза.
Наконец, согласно некоторым специфическим воплощениям данного изобретения офтальмические препараты полиненасыщенных жирных кислот в соответствии с данным изобретением могут содержать также один или более других дополнительных к токоферил ацетату антиоксидантных агентов.
Что касается процесса приготовления, известно, что последовательность различных добавлений наполнителей и активных ингредиентов в процессе приготовления гидрогеля может влиять на многие физические и химические характеристики самой композиции, такие как вязкость, размер частиц, степень дисперсии активных ингредиентов, а также гомогенность системы. Среди различных возможных технологических процедур следующие оказались наилучшими:
- растворение гельобразующего полимера (например, Карбопола);
- добавление осмотически активного агента;
- возможное растворение полимерного эмульгатора (например, Пемулена);
- добавление смеси полиненасыщенных жирных кислот, уже смешанных с витамином Е предпочтительно в форме ацетатного эфира
- добавление буфера (например, фосфатного буфера);
- гелеобразование добавлением NaOH.
Все добавления должны выполняться при механическом размешивании, предпочтительно при 200 об/мин (rpm).
Как указывалось ранее, офтальмические композиции полиненасыщенных жирных кислот, растворенных в витамине Е и диспергированных в гидрогеле в соответствии с данным изобретением, оказываются значительно более стабильными при хранении, чем композиции в эмульсии в соответствии с известным уровнем техники. Со ссылкой на приготовление в соответствии с предпочтительным воплощением данного изобретения, содержащим этиловый эфир ЕРА и этиловый эфир GLA в качестве активных ингредиентов и α-токоферил ацетат в качестве антиоксиданта, Карбопол в качестве гельобразующего полимера и глицерин в качестве осмотически активного агента, исследование продемонстрировало неожиданную стабильность при хранении такого продукта.
В тех же экспериментальных условиях приготовление ЕРА и GLA в эмульсии демонстрировало быструю кинетику деградации, приводящую уже через месяц к значению концентрации активных ингредиентов в среднем 95%, несмотря на то, что приготовление выполняли в атмосфере азота и в присутствии антиоксидантов. Удивительно также, что эмульсии, приготовленные в соответствии с известным уровнем техники при хранении в условиях низких температур (4°С), менее стабильны, чем гидрогель, приготовленный в соответствии с данным изобретением, хранившийся при 25°С.
Считается, что лучшая стабильность жирных кислот омега-3 и омега-6, растворенных в витамине Е, и диспергированных в гидрогеле по отношению к стабильности эмульсий, приготовленных в соответствии с известным уровнем техники, объясняется тем, что поверхность диспергированной масляной фазы, подвергающейся окислению, в тысячи раз больше в случае капель эмульсии (нанометровый размер) по сравнению с поверхностью, подвергающейся окислению в продукте настоящего изобретения. Размешивание, необходимое для образования этого продукта, действительно, может быть отрегулировано для получения капель размером в среднем около 3 мкм и предпочтительно не менее 1 мкм. Ниже этой величины проявления деградации становятся существенными из-за высокого значения поверхности, которую растворы полиненасыщенных жирных кислот в витамине Е экспонируют при взаимодействии с гидрогелем. Таким образом, средний размер капли диспергированной фазы в полимерном гидрогеле должен быть больше 1 мкм и предпочтительно в интервале от 2 до 5 мкм.
Композиции, предложенные в соответствии с данным изобретением, могут применяться как таковые в форме гидрогеля или они могут быть включены в раствор или переносчик, состоящий из геля, мазь, крем или липосомы или в любую подходящую матрицу для местного офтальмического приготовления или офтальмического введения, то-есть с условием, что такая система сохраняет и не нарушает гомогенность раствора жирных кислот омега-3 и омега-6 в ацетате витамина Е.
Специфические признаки данного изобретения, а также его преимущества проявятся с большей очевидностью со ссылками на детальное описание с помощью представленных далее примеров вместе с результатами исследований, выполненных в связи с данным изобретением, и сравнения с известным уровнем техники. Некоторые экспериментальные результаты представлены также в приложенных чертежах, где
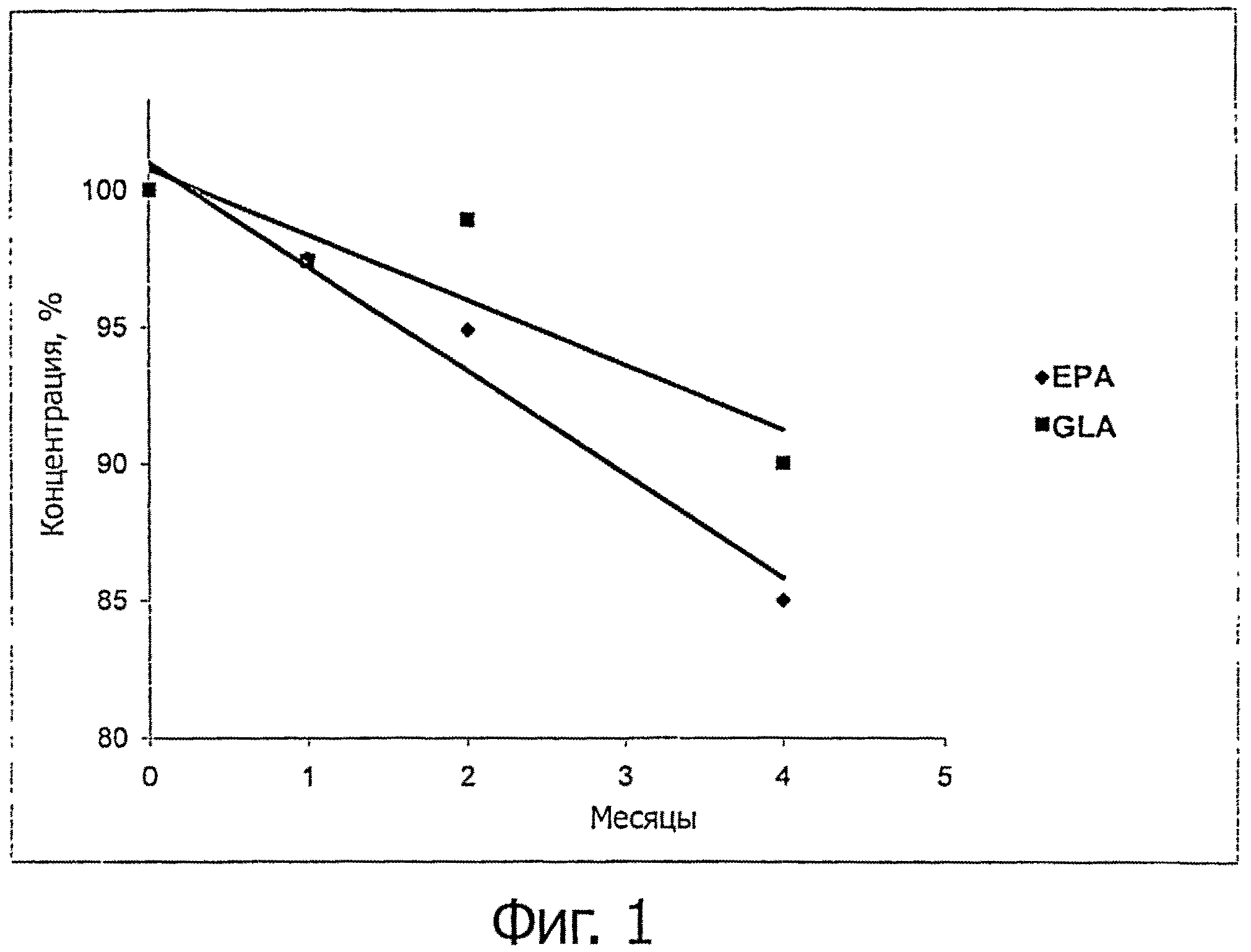
фгура 1 демонстрирует в виде диаграммы результаты исследования химической стабильности, выполненного при приготовлении ЕРА и GLA в фосфолипидной эмульсии, сохраняющейся в условиях холодильника (4°С);
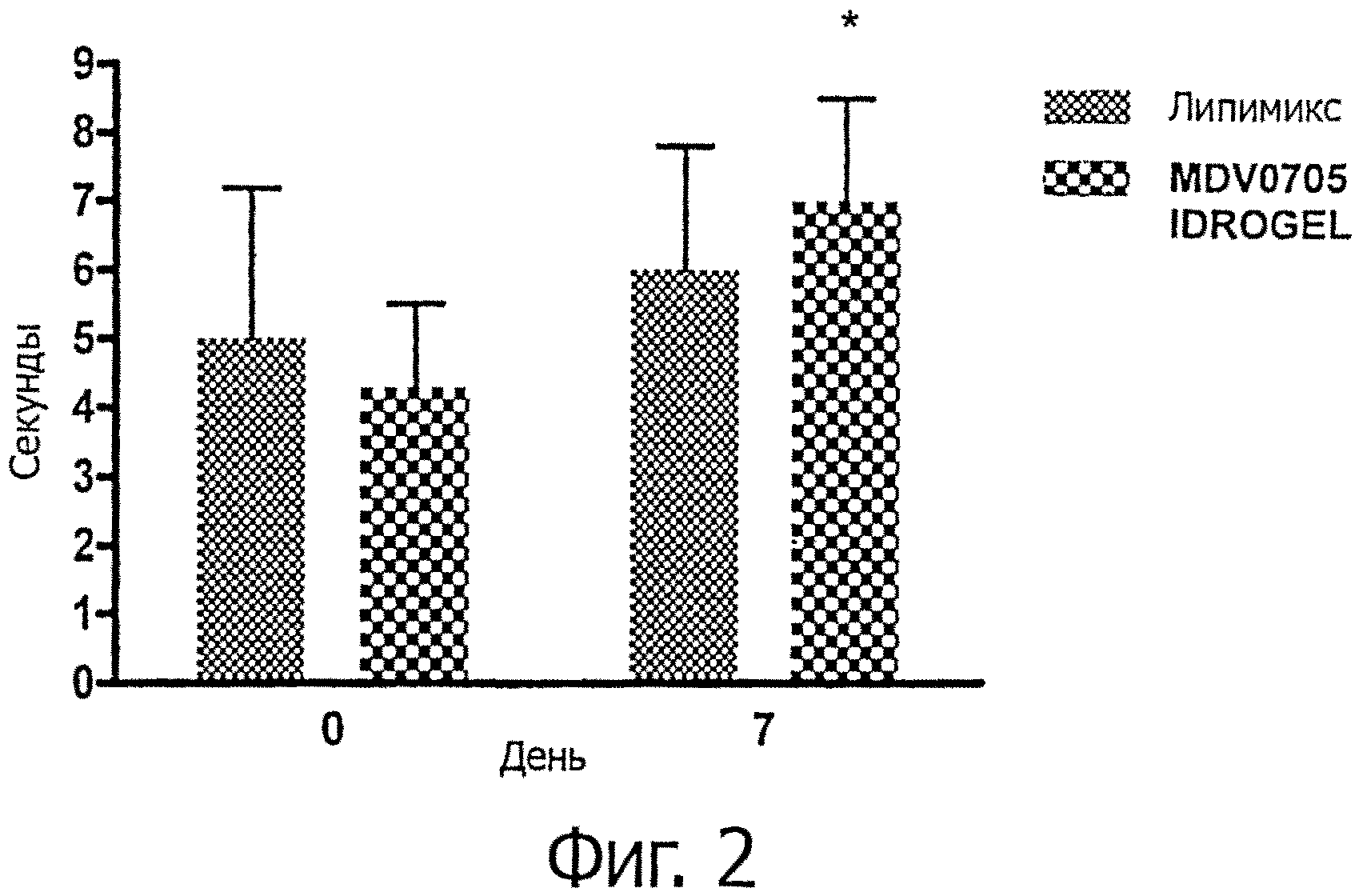
фигура 2 демонстрирует время разрыва слезной пленки (BUT) в нулевой день и на 7-й день у пациентов, получавших лечение препаратом гидрогеля в соответствии с данным изобретением, в сравнении с коммерческим заменителем слез в фосфолипидной эмульсии, например, Липимиксом (Tubilux, Italy);
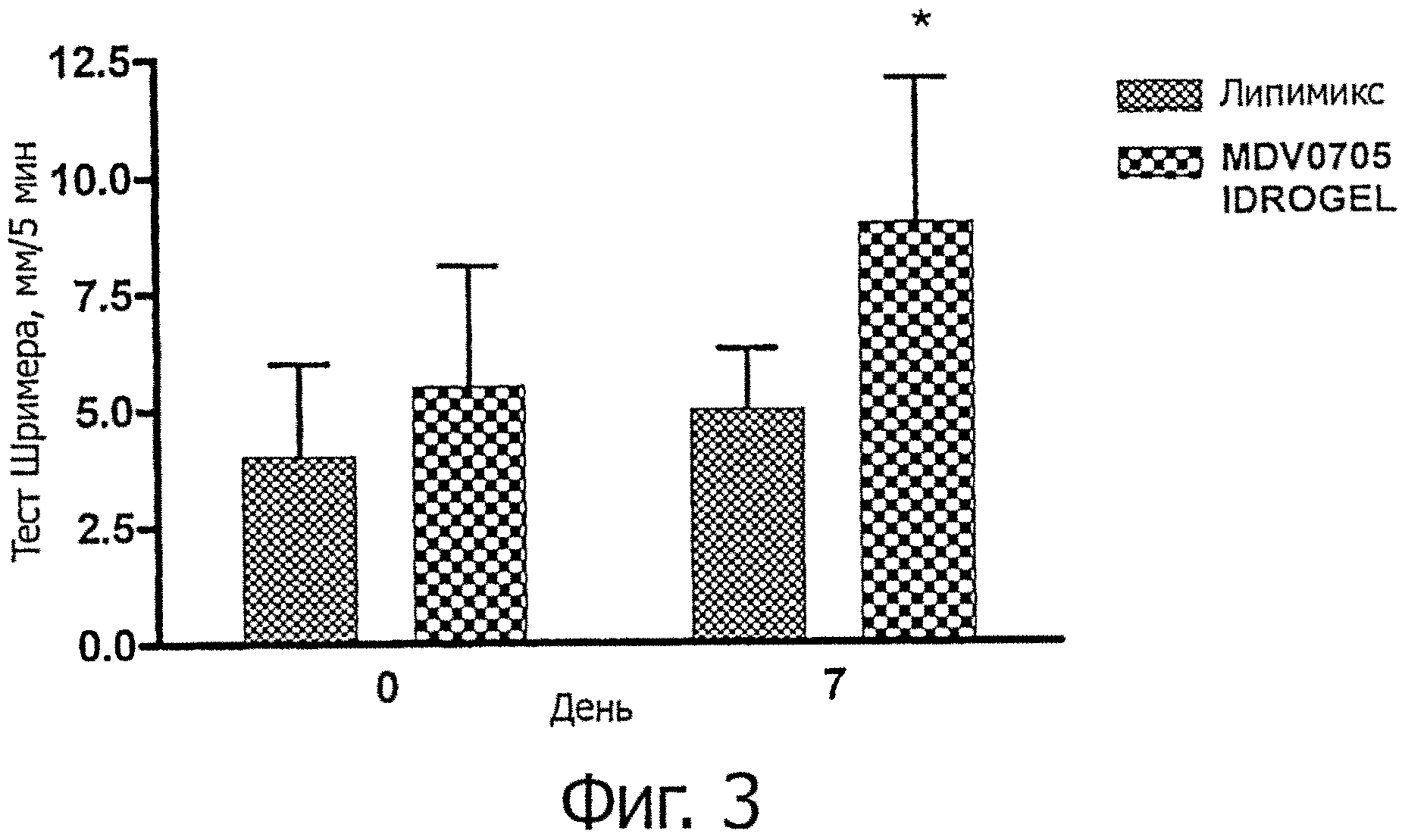
фигура 3 демонстрирует слезоотделение, измеренное с помощью Schirmer I теста в нулевой день и на 7-й день у пациентов, получавших лечение препаратом гидрогеля в соответствии с данным изобретением, в сравнении с коммерческим продуктом (заменителем слез в фосфолипидной эмульсии) фигуры 2.
Примеры, где жирные кислоты омега-3 и омега-6 в виде соответствующих этиловых эфиров (ЭЭ) введены в гидрогельную систему в соответствии с настоящим изобретением, представлены ниже.
ПРИМЕР 1
Гидрогель с ЕРА и GLA
В препарате, приготовленном в соответствии с данным изобретением, использовали как ЕРА с чистотой 90%, так и GLA с чистотой 70% в виде этилатов. Использовали следующие ингредиенты:
рН 6.90 мОсм=155
Приготовление выполняли согласно описанной выше процедуре.
ПРИМЕР 2
Гидрогель с ЕРА и GLA с добавлением Пемулена
Для приготовления выполняли ту же процедуру, что и в предыдущем примере.
Для приготовления выполняли ту же процедуру, что и в предыдущем примере.
рН 6,96 мОсм-165
ПРИМЕРЫ 3-7
Гидрогель с ЕРА, DHA и GLA с добавлением Пемулена
В следующих примерах в препаратах использовали омега-3 полиненасыщенные жирные кислоты ЕРА и DHA и омега-6 полиненасыщенную кислоту GLA, все в форме соответствующих этиловых эфиров. Они оказались способны смешиваться в любых пропорциях с ацетатом витамина Е и соединялись в разных отношениях в масляной фазе.
Соответственно, растворы жирных кислот в ацетате витамина Е распределяли в различных пропорциях в гидрогеле Карбопол 980/Пемулен согласно описанной ранее процедуре, удостоверившись, что масляный раствор оказывается диспергированным в геле без разделения фаз и продолжает сохранять целостность раствора, диспергированного в геле на капли микронной величины.
Различные полные композиции, содержащие 1% по весу масляной фазы в гидрогеле, имели рН=7, осмолярность=155 мОсм/кг и средний размер масляных капель 3 мкм.
ФИЗИЧЕСКИЕ ХАРАКТЕРИСТИКИ И ИССЛЕДОВАНИЕ СТАБИЛЬНОСТИ
Водная фаза может быть диспергирована в геле и стабильно может оставаться в этих условиях, если вязкость среды достаточно велика, чтобы препятствовать взаимопроникновению масляных капель. Исследования, выполненные в рамках настоящего изобретения, продемонстрировали, что гель способен «улавливать» полезные количества масляной фазы, состоящей из полиненасыщенных омега-3/омега-6 жирных кислот, растворенных в ацетате α-токоферила, и сохранять их стабильность как физическую, так и химическую.
Разработанные гели, описанные в примерах 1-7, при центрифугировании в течение 15 минут и силе центрифугирования 11200 g не обнаруживали признаков разделения фаз между фазой диспергированного масла и фазой диспергирующего гидрогеля. Оптические измерения, предпринятые для доказательства возможного разделения фаз, также подтвердили удивительную физическую стабильность этой системы.
Химическая стабильность
После одного месяца хранения при температуре 25°С ЕРА и GLA, содержащиеся в продукте Примера 1, продемонстрировали концентрации 100% и 101% соответственно. Удивительно, что после трех месяцев хранения при тех же экспериментальных условиях концентрации оставались существенно неизменными, как показано в следующей таблице.
Сравнительный пример 1
Чтобы сравнить характеристики препарата, полученного согласно данному изобретению, с препаратами в эмульсии типа, описанного в соответствии с известным уровнем техники, со специальной ссылкой на документ ЕР 0391369, готовили эмульсию, содержащую жирные кислоты омега-3 и омега-6, используя МСТ (триглицериды средней длины) как масляный и полиоксиэтилен сорбитан моноолеат (Твин 80) в качестве поверхностно активного агента, как показано ниже.
Пример EPA-GLA препарата в фосфолипидной эмульсии
Приготовление осуществляли, следуя указаниям цитированного патентного документа.
Полученную эмульсию исследовали для оценки ее химико-физической стабильности.
Физическую стабильность эмульсии оценивали в экспериментах по светорассеянию, используя лазерный He-Ne источник (633 нм) с мощностью 10 mw. Показано, что средний гидродинамический радиус частиц в эмульсии (r) равен 110 нм, а полидисперсность равна 0,07%. Измеряя электрофоретическую подвижность, оценивали Z потенциал, который был равен 39±3 мв. Это означает, что частицы, обладающие отрицательно заряженной поверхностью, отталкивают друг друга, избегая таким образом, явлений слияния и агрегации.
Через один месяц после приготовления эти значения остаются существенно не измененными, свидетельствуя о том, что эмульсионная система имеет хорошую физическую стабильность, но эксперименты, выполненные в течение второго месяца, показывают, что Z-потенциал становился гораздо менее отрицательным, и что размер частиц существенно возрастает (таблица 2).
Все показанное выше демонстрирует эволюцию эмульсии в направлении разделения фаз.
Для изучения стабильности эмульсии с химической точки зрения измеряли концентрации ЕРА и GLA газовой хроматографией. Как показано в следующей таблице 3, а также в виде диаграммы на фигуре 1, измерение концентраций после хранения лекарственных форм при температуре 4°С демонстрирует после первого месяца значительное уменьшение концентраций ЕРА и GLA, равных соответственно 97,5% и 97,4% от концентрации в нулевой момент. Тенденция к деградации подтверждалась в следующие месяцы, как видно из таблицы 3 и соответствующей диаграммы.
В заключение, исследуемая композиция оказалась нестабильной с физической точки зрения.
Сравнительный пример 2
Поскольку основные продукты деградации, ответственные за уменьшение концентрации ЕРА и GLA в сравнительном примере 1, это продукты окисления, тот же препарат производили таким образом, чтобы ограничить окисляемость продукта, пропуская азот на этапе эмульгирования и действуя в присутствии антиоксидантов.
Анализировали химическую стабильность полученного таким образом препарата фосфолипидной эмульсии с помощью тех же процедурно и в предыдущем примере. Как показано в следующей таблице, после одного месяца хранения при температуре 25°С ЕРА и GLA имели концентрации 96% и примерно 95,2% относительно нулевого момента соответственно.
Несмотря на приготовление в атмосфере азота и присутствие добавочных антиоксидантов, данные по химической стабильности этого препарата разочаровывают. Эти данные свидетельствуют о невозможности хранить глазные капли для возможного коммерческого использования ни при комнатной температуре, ни в условиях холодильника.
Сравнительный пример 3
Эмульсии полиненасыщенных омега-3 и омега-6 жирных кислот, непосредственно полученные с помощью сурфактантов в соответствии с сообщением документа WO 2006/007510, были протестированы в лабораториях Заявителя.
В частности, определяли минимальную концентрацию сурфактанта, применяемую для создания препаратов активных ингредиентов, и было установлено, что значения меньше 1% недостаточны для получения эмульсии, стабильной с физической точки зрения. Препараты с более высоким содержанием сурфактантов во всяком случае были бы нежелательны, поскольку известно, что они очень часто ответственны за токсические проблемы в тканях глаза и особенно не подходят в случае хронической терапии.
Показано, что с химической точки зрения такие препараты имеют окислительные проблемы, аналогичные таковым, наблюдавшимся в сравнительных примерах 1 и 2. Действительно, показано, что после одного месяца хранения композиции при температуре 25°С ЕРА и GLA имеют концентрации 96,5% и 97,0% соответственно, свидетельствуя о быстрой деградации со временем обоих «активных ингредиентов» и в этом типе препарата, как показано в следующей таблице.
Для большей безопасности примеры композиций, описанных в таблице 1 WO 2006/007510, воспроизведенные ниже в таблице 6, были повторены с использованием ЕРА и DHA как омега-3, в виде как этиловых эфиров, так и соответствующих триглицеридов (ЕРА ЭЭ, DHA ЭЭ ЕРА ТГ, DHA ТГ) (ЕРА ЕЕ, DHA ЕЕ, ЕРА TG, DHA TG), и GLA, как омега-6, в виде как этиловых эфиров, так и соответствующих триглицеридов (СLА ЭЭ, GLA ТГ) (GLA ЕЕ, GLA TG).
Результаты измерения стабильности, полученные для каждого из четырех препаратов, и для каждой из трех протестированных жирных кислот как в форме этилового эфира, так и триглицерида, при 4°С или при 25°С, представлены в нижеследующих таблицах 7-10.
Вышеизложенные данные дополнительно подтверждают, что полиненасыщенные жирные кислоты омега-3 и омега-6, объединенные в эмульсию для местного применения, быстро деградируют как в том случае, когда они включены в препарат в виде этилового эфира, так и в том случае, когда используют соответствующие триглицериды. Такая нестабильность характерна и для других эмульсионных систем, приготовленных согласно известному уровню техники и, вообще говоря, подтверждает литературные данные, касающиеся химической стабильности полиненасыщенных жирных кислот.
Исследования стабильности композиций из примеров 3-7
Для осуществления точного сравнения между стабильностью композиций, приготовленных по известному уровню техники, и стабильностью офтальмических препаратов по данному изобретению, сначала оценивали химическую стабильность масляных фаз композиций, описанных в примерах 3-7. Соответствующие данные приведены в следующей таблице.
Приведенные данные показывают, что композиции с полной концентрацией полиненасыщенных жирных кислот до 50% в ацетате α-токоферила обнаруживают удивительную стабильность. Только при концентрациях жирных кислот выше 50%, если ацетат витамина Е менее 50%, становится заметной небольшая деградация. Кроме того, жирные кислоты омега-3 и омега-6 как в форме триглицеридов, так и в форме фосфолипидов (особенно, в жире криля) демонстрировали даже большую стабильность. Таким образом, предшествующая таблица демонстрирует «наихудшую» стабильность в случае этиловых эфиров омега-3 и омега-6.
Будучи чрезвычайно стабильными, препараты полиненасыщенных жирных кислот в ацетате витамина Е мало пригодны для офтальмических препаратов из-за плохой переносимости, однако их можно хранить в неизменном состоянии длительное время, большее, чем при той же стабильности чистых ПНЖК (PUFA).
Исходя из описанных масляных смесей, достаточно добавить Карбопол 980 и Пемулен и соответственно образовать полимерный гидрогель, чтобы получить прекрасную переносимость и обеспечить стабильность композиции. Ниже представлены результаты тестов на стабильность полных препаратов из примеров 3-6 (таблица, примеры 3-7).
ТЕСТЫ НА ПЕРЕНОСИМОСТЬ И АКТИВНОСТЬ
Острая глазная переносимость глазных капель, приготовленных согласно данному изобретению
Глазную переносимость глазных капель в гидрогеле примера 1 (MDV0705 IDROGEL) оценивали после трех закапываний в глаза кроликов через 2 часа одно после другого. Две капли продукта закапывали в правый глаз каждого животного всего 3 раза в день с интервалом 2 часа. Группа кроликов состояла из 8 животных (4 самца, 4 самки).
Состояние глазных тканей оценивали в соответствии с тестом Draize.
Исследование выполняли после третьего закапывания в день лечения и повторно через 24, 48 и 72 часа после первого закапывания, присваивая условные индексы различным показателям конъюнктивы, радужной оболочки и роговицы.
Не наблюдалось заметных признаков покраснения конъюнктивы за весь период тестирования ни в глазах, обработанных MDV0705 IDROGEL, ни в глазах, обработанных плацебо.
Не отмечалось отека или помутнения на уровне роговицы. Кроме того, не было отмечено вовлечения радужной оболочки.
Присутствие дренажного материала оставалось на нормальном уровне.
Полученные результаты показывают, что офтальмический препарат в гидрогеле, приготовленный согласно данному изобретению, хорошо переносится при повторных закапываниях (три за 6 часов), и нет доказательств различий по сравнению с плацебо.
Клинические тесты на переносимость
Закапывание глазных капель MDV0705 IDROGEL группе здоровых лиц без признаков патологии на поверхности глаза и с нормальным слезоотделением не вызывало заметных нежелательных эффектов.
В частности, лицам, получавшим тестируемые глазные капли, раздавали вопросник из 2 вопросов, на которые они должны были ответить через 1, 5, 10 и 60 минут. На вопрос 1 («Чувствуете ли вы боль после закапывания глазных капель?») 100% лиц отвечали «нет» при каждой проверке; на вопрос 2 («Чувствуете ли вы неудобство после закапывания глазных капель?») 100% лиц отвечали «нет» при каждой проверке.
Оценка активности препарата в гидрогеле по данному изобретению при лечении синдрома сухого глаза.
Принимая во внимание, что препарат MDV0705 IDROGEL, содержащий жирные кислоты омега-3 и омега-6, обладает свойствами защиты глазной поверхности и уменьшения воспаления, и убедившись ранее в его переносимости, была установлена его активность при лечении пациентов, страдающих от синдрома сухого глаза. Этот продукт сравнивали с коммерческим заменителем слез, состоящим из липидной эмульсии, то есть с глазными каплями Липимикс (Tubilux, Италия), единственным в настоящее время на рынке заменителем слез, содержащим липиды.
Активность MDV0705 IDROGEL оценивали в группе пациентов (n=5) с синдромом сухого глаза и использовали контрольных (n=5) пациентов с синдромом сухого глаза, леченных Липимиксом. Пациентам закапывали MDV0705 IDROGEL и Липимикс 3 раза в день в оба глаза, и измерения проводили после 7 дней лечения. Для статистического анализа результатов использовали правый глаз.
Пациентов с синдромом сухого глаза отбирали согласно международно согласованному критерию включения (Определение и классификация болезни сухого глаза. Подкомитет Международной рабочей группы сухого глаза, Ocul, Surf, 2007; 5:75-92) и точнее:
- По симптомам глазной сухости, определенным с помощью соответствующего опросника с кодифицированной системой проставления оценки (Shiffman RM, Dale Christianson M, Jacobsen G, Hirsch JD, Reis BL, Reliability and validity of the Ocular Surface Disease Index (OSDI), Arch, Ophthalmol, 2000; 118:615-21);
- По прокрашиванию флуоресцеином роговицы, измеренному согласно NEI/Industry workshop Scale>3 (Lemp MA, Report of the National Eye Institute/Industry workshop on clinical trials in dry eyes, CLAO J, 1995; 21:221-232);
- По времени разрыва (BUT)<10 секунд;
- По тесту Ширмера I<8 мм за 5 минут.
Критерии исключения: инфекционные кератоконъюнктивиты, положительный анамнез для глазной аллергии, оперативное вмешательство на глазах или веках в течение 3 месяцев, предшествующих исследованию, риниты, применение глазных капель на основе стероидов в течение 4 недель, предшествующих исследованию, диабет, противоглаукомные глазные капли.
Для оценки активности MDV 0705 IDROGEL по сравнению с контролем использовали следующие параметры:
Симптомы сухости глаза (обнаруженные с помощью соответствующего опросника)
- Время разрыва слезной пленки (BUT)
- Тест Ширмера I
- Процедуры для оценки времени разрыва слезной пленки (BUT)
BUT считают индикатором стабильности слезной пленки. Тест состоит из наблюдения поверхности пленки после закапывания флуоресцеина с помощью щелевой лампы с синим кобальтовым фильтром. В процессе тестирования пациент держит глаза открытыми, не моргая и глядя прямо перед собой, и измеряют уменьшение времени между последним морганием и образованием небольших сухих площадей (которые выглядят темнее) на поверхности роговицы, вычисляя затем среднее из трех последовательных определений.
Тест Ширмера I
- Тест Ширмера I дает информацию о секреции слезной жидкости. Его выполняют в слабо освещенной комнате, помещая бумажную полоску с наружной стороны нижнего свода конъюнктивы и измеряя ее пропитывание через 5 минут. Тест следует выполнять в соответствии со стандартизированными процедурами, поскольку существует много разных переменных, участвующих в определении этой величины. Самая важная переменная возникает из-за того факта, что на абсорбцию абсорбирующей бумажной полоской и на длину влажной части влияют капиллярная сила и смачиваемость целлулезных волокон. Поэтому важно выполнять тест проверенными бумажными полосками.
- Результаты исследований по данным наблюдений, касающихся BUT и теста Ширмера I, представлены на фигурах 2 и 3 приложенных чертежей. Результаты на 7 день свидетельствуют о значительном улучшении симптомов и характеристик глазной поверхности у пациентов с синдромом сухого глаза, леченных MDV0705 IDROGEL, по сравнению с исходными значениями (день 0). Кроме того, на 7 день у пациентов, леченных MDV0705 IDROGEL, наблюдалось значительное улучшение (р<0,05) симптомов по сравнению с контрольной группой.
Время разрыва слезной пленки (BUT) (фигура 2) на 7 день демонстрировало значительное увеличение по сравнению с исходными условиями (день 0) только в группе пациентов, леченных MDV 0705 IDROGEL.
Секреция слезной жидкости (фигура 3), измеренная с помощью теста Ширмера I, демонстрировала значительное увеличение по сравнению с исходными условиями в группе пациентов, леченных MDV 0705 IDROGEL, в то время как в группе пациентов, леченных Липимиксом, продемонстрировано незначительное увеличение слезообразования через 7 дней. Сравнение на 7 день между пациентами, леченными MDV0705 IDROGEL и Липимиксом, продемонстрировало значительное увеличение в первой группе по сравнению со второй.
В заключение, подтверждено, что возможность использования жирных кислот омега-3 и омега-6 в глазных каплях представляет важное нововведение для лечения пациентов, страдающих от синдрома сухого глаза, как уменьшая симптомы, сообщаемые пациентами, так и улучшая стабильность глазной пленки, а следовательно, характеристики глазной поверхности. Такое эффективное терапевтическое средство легко доступно с фармацевтической точки зрения благодаря улучшенным возможностям хранения композиций в гидрогеле в соответствии с данным изобретением.
Настоящее изобретение было изложено с конкретными ссылками на некоторую специфику его осуществления, однако следует понимать, что возможны модификации и изменения лицами, сведущими в данной области техники, без выхода за рамки данного изобретения, как это определено в приложенной формуле изобретения.
Реферат
Изобретение относится к композициям местного применения для предотвращения и лечения глазных патологий, в особенности воспалительных кератитов и конъюнктивитов и синдрома сухого глаза, содержащим в качестве активных ингредиентов полиненасыщенные жирные кислоты типа омега-3 и омега-6 и, конкретно, ЕРА (эйкозапентаеновую кислоту), DHA (докозагексаеновую кислоту) и GLA (γ-линоленовую кислоту), смешанные с ацетатом витамина Е и объединенные в стабильную композицию в гидрогеле, то есть в дисперсную форму в водном растворе, содержащем один или более гелеобразующих полимеров. Предложенные композиции особенно показаны для использования в качестве искусственных слез. Изобретение обеспечивает повышение эффективности предотвращения и лечения глазных патологий. 14 з.п. ф-лы, 15 табл., 3 ил., 7 пр.
Формула
- 0,40% ЕРА сложного этилового эфира;
- 0,10% GLA сложного этилового эфира;
- 0,50% α-токоферил ацетата; и
- 0,20% Carbopol 980;
- 1,1% глицерина;
- 0,07% NaOH;
- 0,10% фосфата натрия; и
- вода для инъекций до 100%,
где эти этиловые эфиры находятся в форме этилатов.

Комментарии