Использование альгинатных олигомеров в борьбе с биопленками - RU2527894C2
Код документа: RU2527894C2
Чертежи




Описание
Настоящее изобретение относится к способу борьбы с биопленками. В частности, настоящее изобретение относится к использованию конкретного класса альгинатов и, в частности, некоторых альгинатных олигомеров в борьбе с биопленками как на биотических, так и на абиотических поверхностях. Таким образом, предлагаются как медицинские, так и немедицинские применения и способы для борьбы с биопленочной инфекции или для борьбы с образованием биопленки на неживых поверхностях, например для целей дезинфекции и очистки. Изобретение основано на неожиданном обнаружении того, что некоторые альгинатные олигомеры способны взаимодействовать с биопленкой и оказывать на нее воздействие.
В общих выражениях биопленка представляет собой совокупность или сообщество микроорганизмов в окружении матрицы из внеклеточных полимеров (также известных в данной области техники как гликокаликс). Эти внеклеточные полимеры обычно представляют собой полисахариды, особенно полисахариды, продуцируемые самими организмами, но они также могут содержать другие биополимеры. Биопленка обычно прикрепляется к поверхности, которая может быть инертной или живой, но, кроме того, наблюдали, что биопленки могут образоваться из микроорганизмов, прикрепленных друг к другу или к любой поверхности раздела. Таким образом, в общем случае биопленка характеризуется как высокоорганизованное многоклеточное сообщество микроорганизмов, заключенных во внеклеточную полимерную матрицу, обычно полисахаридную матрицу, или окруженное ею, и обычно в тесной связи с поверхностью или поверхностью раздела. Такой характер роста является защитным для микроорганизмов и делает трудным их удаление или уничтожение (например, как дополнительно рассматривается ниже, стойкость или устойчивость к противомикробным агентам, или иммунной защите хозяина, или механизмам очищения). Считается, согласно настоящему изобретению, что альгинатные олигомеры могут взаимодействовать с полимерной матрицей биопленки, и таким образом ослаблять биопленку. Как дополнительно рассматривается ниже, биопленки вызывают значительные коммерческие, промышленные и медицинские проблемы, в части инфекций, заражения, загрязнения и повреждения, и, таким образом, настоящее изобретение обеспечивает значительное преимущество в обеспечении возможности или облегчения борьбы с такими биопленками, включая как уменьшение или предупреждение их образования, так и перевод их в состояние более чувствительное к удалению или уменьшению, например более чувствительное к действию противомикробных агентов (включая дезинфицирующие средства или антибиотики) или же, в случае инфекции, к иммунному ответу инфицированного хозяина. Таким образом, может быть усилена эффективность противомикробных агентов как терапевтических, так и нетерапевтических и включая, в частности, антибиотики.
Биопленки обнаруживаются повсеместно на большом множестве поверхностей или поверхностей раздела (например, поверхности раздела вода/твердое вещество и вода/газ (например, вода/воздух)), если существуют условия, способствующие микробной колонизации. По существу биопленка будет образовываться повсюду, где присутствуют микроорганизмы и поверхность раздела или поверхность, в частности поверхность, подвергающаяся воздействию воды или влажности, и биопленки в настоящее время признаны в качестве естественного состояния микробного роста на таких поверхностях или поверхностях раздела. В сущности, как отмечалось выше, биопленка представляет собой комплекс и организованное расположение микробных колоний на поверхности, или на поверхности раздела, которое может иметь место, в частности, в присутствии воды или влажности. Организация таких колоний является результатом способности микроорганизмов продуцировать организованную внеклеточную матрицу, в которую «внедрены» клетки. Такая матрица образуется из биополимеров, продуцируемых микроорганизмами, причем основным полимером являются полисахариды.
Микроорганизмы в биопленочном сообществе проявляют свойства на клеточном уровне (фенотип), которые не имеют их планктонные (свободноплавающие) эквиваленты. Действительно, полагают что микроорганизмы в биопленке сильно отличаются от планктонных свободноплавающих клеток. Дополнительные различия также можно наблюдать на уровне сообщества, и они относятся к эффектам внеклеточной матрицы. Возможно, наиболее примечательным является обычно наблюдаемое явление, что микроорганизмы в биопленочном окружении не проявляют такой же чувствительности к противомикробным агентам, например антибиотикам, противогрибковым и бактерицидным средствам, и иммунной защите хозяина или механизмам очистки. Считается, что данная устойчивость обусловлена барьерным эффектом внеклеточной матрицы и/или фенотипическим изменением в самих микроорганизмах. Например, когда образуются биопленки, антитела более не связываются с микроорганизмами (например, бактериями) в биопленке. Эксперименты показали, что антитела плотно покрывают биопленку снаружи, но их нет в самой биопленке. Исследования активности лейкоцитов против биопленок продемонстрировали похожие результаты. Токсинообразование также может отличаться у планктонного микроорганизма и его эквивалента, находящегося в биопленочной колонии, наводя на мысль о фенотипических изменениях у микроорганизмов. Кроме того, полагают, что микроорганизмы в биопленках могут расти медленнее и в результате медленнее поглощать противомикробные агенты.
Биопленки легко образуются на водных окружающих поверхностях и сформировавшаяся микробная колония на любой поверхности, подверженной действию воды (любая "влажная" поверхность), будет почти обязательно существовать в виде биопленочной структуры. Кроме того, в настоящее время становится очевидным и во все большей степени задокументировано, что биопленки также могут образовываться в случае микробных инфекций, то есть внутри инфицированного хозяина или на нем. Таким образом образование биопленок также может иметь место на "физиологической" или "биологической" поверхности, то есть на живой или биотической поверхности, или поверхности на инфицированном организме-хозяине или в нем (например, человека или животном субъекте, отличном от человека), например на внутренней или внешней поверхности организма или ткани. Во все большей степени считается, что такое образование биопленки (или инфекция) на тканях организма участвует в различных инфекционных заболеваниях, включая, например, врожденный эндокардит сердечного клапана (митральный, аортальный, правый атриовентикулярный, легочный сердечные клапаны), острый средний отит (среднее ухо), хронический бактериальный простатит (простата), муковисцидоз (легкие), пневмонию (дыхательные пути), периодонтит (ткани, поддерживающие зубы, например десна, периодонтальная связка, альвеолярная кость). Конечно, обе эти биопленочные ниши присутствуют при имплантации медицинских устройств, и образование биопленки на таких имплантированных ("встроенных") устройствах может вызвать клинические проблемы с инфекцией на таких участках, такой как эндокардит искусственного клапана и инфекция, связанная с устройством, например с внутриматочными устройствами, контактными линзами, протезами (например, протезным суставам), и в участках катетеризации, например при наличии центрального венозного или мочевого катетеров.
Значительная проблема и риск при наличии таких биопленочных инфекций заключаются в том, что микроорганизмы (или более конкретно микроколонии) могут оторваться или отделиться от биопленки и проникнуть в другие ткани, включая в значительной мере кровообращение. Такие циркулирующие микроорганизмы из биопленки могут быть причиной дополнительных инфекций и вызывать значительные клинические проблемы, особенно в виду того, что отделившиеся циркулирующие микроорганизмы могут иметь все характеристики устойчивости родительского сообщества.
Биопленочная инфекция обычно развивается постепенно, и явные симптомы могут проявляться медленно. Однако, после образования биопленки, как отмечалось выше, трудны для очищения, и биопленочная инфекция обычно является устойчивой и редко разлагается посредством иммунитета хозяина или иммунных механизмов даже у лиц со здоровыми врожденными и адаптивными иммунными ответами. Активные хозяйские ответы в действительности могут быть губительными, например клеточно-опосредованный иммунитет (например, инвазивные нейтрофилы) может вызывать сопутствующее повреждение соседней здоровой ткани хозяина. Биопленочные инфекции реагируют только кратковременно на терапию антибиотиками. Таким образом, в то время как планктонные микробные клетки могут быть ликвидированы с помощью антител или фагоцитов и они более чувствительны к противомикробным средствам, микроорганизмы в биопленках проявляют устойчивость к антителам, фагоцитам и противомикробным средствам. Фагоциты прикрепляются к биопленке, но фагоцитоз не завершается. Фагоцитарные ферменты однако высвобождаются и могут повреждать ткань вокруг биопленки. Планктонные бактерии могут высвобождаться из биопленки, и такое высвобождение может вызывать их распространение и острую инфекцию в соседней ткани.
Поверхности организма или ткани, которые являются погибшими или поврежденными (например, некротические или воспаленные), особенно подвержены биопленочной инфекции. Раны являются подверженными инфекции, и в ранах, которые за короткое время не зажили, может иметь место образование биопленки. Раны являются идеальной средой для образования биопленок вследствие их подверженности бактериальной колонизации, доступности субстрата и поверхности для прикрепления биопленки. Проблематично то, что инфицирование раны часто дополнительно задерживает заживление и таким образом делает рану более подверженной образованию биопленки и образовавшейся инфекции. Раны, заживление которых задерживается (так называемые хронические раны), являются объектами особого внимания в отношении образования биопленки. Хроническая рана находится в воспалительном состоянии, с повышенными уровнями провоспалительных цитокинов. Эффектом таких цитокинов является создание области скопления иммунных клеток (нейтрофилов и макрофагов). Если такая система защиты из-за чего-либо запаздывает (как в хронических ранах), бактерии или другие микроорганизмы имеют время, чтобы прикрепиться к поверхности и войти в биопленочную стадию роста. Все больше растут свидетельства того, что как хронические, так и кратковременные раны могут являться областями биопленочной инфекции, с доказательством присутствия разнообразных микробных сообществ или популяций в ранах, особенно в хронических ранах, включая анаэробные бактерии в хронических ранах. Хронические раневые инфекции имеют два общих важных признака с другими биопленочными инфекциями: устойчивую инфекцию, которая не устраняется иммунной системой хозяина даже у лиц со здоровыми врожденными и адаптивными иммунными реакциями, и повышенную устойчивость к системным и местным противомикробным агентам. Таким образом, биопленочную инфекцию очень трудно лечить и биопленочное заражение очень трудно ликвидировать. Частая санация является одним из наиболее клинически эффективных лечений для облегчения заживления хронических ран. Это представляет собой эффективное лечение отчасти в виду того, что оно физически удаляет биопленку из раны. Это похоже, в принципе, на разрушение инфекций из колонизированных биопленками медицинских устройств «введенного» (например, катетеров), где антибиотическая терапия является неэффективной, наиболее эффективный подход представляет собой удаление или замена инфицированного биопленкой устройства.
Хронические раны представляют собой значительную проблему для здоровья во всем мире и требуют значительного расхода клинических ресурсов. Три основных типа хронических ран представляют собой язвы диабетической стопы, язвы венозных ног и пролежни, хотя и другие раны, включая хирургические раны, могут стать хроническими. Уход за такими ранами требует огромных материальных затрат и терпения, и вследствие этого эффективное антибиопленочное лечение или фактически любое лечение, которое содействует или облегчает лечение биопленок и таким образом ускоряет или облегчает заживление раны, будет иметь большое значение.
В более широком смысле, при таком широком распространении биопленок и медицинских, связанных с окружающей средой, промышленных или других коммерческих проблем, которые они вызывают, любые способы улучшения или облечения борьбы с биопленкам будут очень важными как с клинической, так и с коммерческой точки зрения.
Следовательно, существует потребность в новых способах борьбы с биопленкам как в клинических, так и в промышленных или коммерческих ситуациях, и настоящее изобретение направлено на удовлетворение этой потребности.
В частности, и как отмечалось выше, было обнаружено, что конкретный класс альгинатов, а именно некоторые альгинатные олигомеры, является эффективным в качестве антибиопленочных агентов. Альгинатные олигомеры могут взаимодействовать с внеклеточными полимерами биопленки и тем самым ослаблять ее, делая возможным или облегчая ее удаление или разрушение (или деструкцию), и/или облегчая доступ к биопленке противомикробных агентов, тем самым усиливая их эффективность против биопленки. Таким образом, согласно настоящему изобретению предлагается новый способ или средства борьбы с биопленкой, включающие использование альгинатных олигомеров.
Альгинаты представляют собой линейные полимеры (1-4)-связанной β-D-маннуроновой кислоты (М) и/или ее С5-эпимера, α-L-гулуроновой кислоты (G). Первичная структура альгинатов может значительно варьироваться. Остатки М и G могут быть организованы в виде гомополимерных блоков соседних М или G остатков, в виде блоков чередующихся М- и G-остатков и в промежутках таких блочных структур можно обнаружить единичные М- или G- остатки. Молекула альгината может содержать некоторые или все такие структуры, и такие структуры могут быть неравномерно распределены по всему полимеру. В предельном случае существует гомополимер гулуроновой кислоты (полигулуронат) или гомополимер маннуроновой кислоты (полиманнуронат).
Альгинаты были выделены из морских бурых водорослей (например некоторых видов Durvillea, Lessonia и Laminaria) и бактерий, таких как Pseudomonas aeruginosa и Azotobacter vinelandii. Другие псевдомонады (например, Pseudomonas fluorescens, Pseudomonas putida и Pseudomonas mendocina) сохраняют генетическую способность продуцировать альгинаты, но в природе они не продуцируют обнаруживаемых уровней альгината. Посредством мутации такие непродуцирующие псевдомонады можно побудить вырабатывать стабильно большие количества альгината.
Альгинат синтезируется в виде полиманнуроната, и G-остатки образуются под действием эпимераз (особенно С5-эпимераз) на М-остатки в полимере. В случае альгинатов, экстрагированных из водорослей, G-остатки в основном организованы в виде G-блоков, так как ферменты, вовлеченные в биосинтез альгината в водорослях, преимущественно вводят G в соседнее положение с другим G, таким образом превращая участки М-остатков в G-блоки. Понимание таких биосинтетических систем позволяет продуцировать альгинаты с конкретными первичными структурами (WO 94/09124, Gimmestad, М et al, Journal of Bacteriology, 2003, Vo1 185(12) 3515-3523 и WO 2004/011628).
Альгинаты обычно выделяют из естественных источников в виде больших высокомолекулярных полимеров (например, средняя молекулярная масса в интервале от 300000 до 500000 Да). Известно, однако, что такие большие альгинатные полимеры могут быть разрушены или расщеплены, например, посредством химического или ферментного гидролиза с получением альгинатных структур с меньшей молекулярной массой. Альгинаты, которые используются в промышленном масштабе, обычно имеют среднюю молекулярную массу в интервале от 100000 до 300000 Да (то есть такие альгинаты все еще считаются большими полимерами), хотя и альгинаты со средней молекулярной массой приблизительно 35000 Да использовали в фармацевтических средствах.
Было обнаружено, что альгинатные олигомеры способны влиять на внеклеточную матрицу биопленок. Без желания быть связанным какой-либо конкретной теорией полагают, что такое влияние вызывает разрушение внеклеточной матрицы биопленки, и это, таким образом, приводит к физической деструкции биопленки. Кроме того, разрушение усиливает воздействие на микроорганизмы в биопленке (или их иммуногенные компоненты, например LPS и пептидогликановые структуры) иммунной защиты инфицированного хозяина и/или каких-либо противомикробных агентов, которые применялись или будут применяться. Кроме того, разрушение уменьшает тесную связь между внеклеточной матрицей и микроорганизмами, и это приводит к увеличению чувствительности микроорганизма к противомикробным агентам на фенотипическом уровне.
Таким образом, в изобретении предложен способ борьбы с биопленкой, включающий взаимодействие указанной биопленки с альгинатным олигомером.
Как отмечалось выше, альгинаты обычно существуют в виде полимеров со средней молекулярной массой по меньшей мере 35000 Да, то есть приблизительно 175-190 мономерных остатков, хотя обычно гораздо более высокой, и альгинатный олигомер по настоящему изобретения можно определить как вещество, полученное фракционированием (то есть уменьшением размера) альгинатного полимера, обычно природного альгината. Альгинатный олигомер можно рассматривать как альгинат со средней молекулярной массой менее 35000 Да (то есть менее чем приблизительно 190 или менее 175 мономерных остатков), в частности альгинат со средней молекулярной массой менее 30000 Да (то есть менее чем приблизительно 175 или менее 150 мономерных остатков), более конкретно со средней молекулярной массой менее 25000 или 20000 Да (то есть менее чем приблизительно 135 или 125 мономерных остатков или менее чем приблизительно 110 или 100 мономерных остатков).
Альтернативно, олигомер в основном содержит 2 или более единицы или остатка, и альгинатный олигомер для применения по изобретению обычно содержит от 2 до 100 мономерных остатков, предпочтительно от 2 до 75, предпочтительно от 2 до 50, более предпочтительно от 2 до 40, от 2 до 35 или от 2 до 30, то есть альгинатный олигомер для применения по изобретению обычно имеет среднюю молекулярную массу от 350 до 20000 Да, предпочтительно от 350 до 15000 Да, предпочтительно от 350 до 10000 Да и более предпочтительно от 350 до 8000 Да, от 350 до 7000 Да или от 350 до 6000 Да.
Альтернативно, альгинатный олигомер может иметь степень полимеризации (DP), или среднечисловую степень полимеризации (DPn) от 2 до 100, предпочтительно от 2 до 75, предпочтительно от 2 до 50, более предпочтительно от 2 до 40, от 2 до 35 или от 2 до 30.
Как указано выше, биопленки обычно образуются на поверхностях или поверхностях раздела, и биопленка, которую обрабатывают согласно настоящему изобретению, может находиться на любой поверхности или поверхности раздела. Таким образом, в способе по изобретению биопленка может находиться на любой живой или неживой (или биотической или абиотической) поверхности, то есть на любой живой поверхности или поверхности, происходящей из живого вещества (например, мертвой или поврежденной ткани, например некротической ткани), (термин "живой" используют в данном описании изобретения как включающий любую живую поверхность или любую поверхность, происходящую из живого вещества, в частности живую поверхность, которая умерла), или любой инертной или неживой поверхности (поверхности, которая в прошлом не была живой или оживленной).
Термин "приведение в контакт" охватывает любые способы доставки альгинатного олигомера к биопленке, как непосредственно, так и косвенно, и таким образом любые способы нанесения альгинатного олигомера на биопленку или подвергание биопленки воздействию альгинатного олигомера, например нанесение альгинатного олигомера непосредственно на биопленку, или введение альгинатного олигомера субъекту с биопленочной инфекцией. Следовательно, следует понимать, что включены как in vitro, так и in vivo способы.
Более конкретно биопленка будет контактировать с эффективным количеством альгинатного олигомера, более конкретно с количеством альгинатного олигомера, эффективным для борьбы с биопленкой.
Альгинатный олигомер, как отмечалось выше, включает (или содержит) остатки или единицы гулуроната или гулуроновой кислоты (G), и/или маннуроната или маннуроновой кислоты (М). Альгинатный олигомер по изобретению предпочтительно состоит из одних или по существу одних (то есть по существу состоит из них) остатков уроната/урониевой кислоты, более конкретно одних или по существу одних G и/или М-остатков. Выражаясь альтернативно, в альгинатном олигомере для применения в настоящем изобретении по меньшей мере 80%, более конкретно по меньшей мере 85, 90, 95 или 99% мономерных остатков, могут представлять собой остатки уроната/урониевой кислоты, или, более конкретно, G- и/или М-остатки. Другими словами, предпочтительно альгинатный олигомер не содержит другие остатки или единицы (например, другие сахаридные остатки, или, более конкретно, другие остатки урониевой кислоты/уроната).
Альгинатный олигомер предпочтительно представляет собой линейный олигомер.
Более конкретно, в предпочтительном воплощении по меньшей мере 30% мономерных остатков альгинатного олигомера представляют собой G-остатки (то есть гулуронат или гулуроновую кислоту). Другими словами, альгинатный олигомер содержит по меньшей мере 30% остатков гулуроната (или гулуроновой кислоты). Конкретные воплощения, таким образом, включают альгинатные олигомеры (например, содержащие) от 30 до 70% G-(гулуронатных) остатков или от 70 до 100% G (гулуронатных) остатков. Таким образом, типичный альгинатный олигомер для применения по настоящему изобретению может содержать по меньшей мере 70% G-остатков (то есть по меньшей мере 70% мономерных остатков альгинатного олигомера являются G-остатками).
Предпочтительно по меньшей мере 60%, более конкретно по меньшей мере 70% или 75%, еще более конкретно по меньшей мере 80, 85, 95 или 99% мономерных остатков представляют собой гулуронат. В одном воплощении альгинатный олигомер может представлять собой олигогулуронат (то есть гомоолигомер G или 100% G)
В еще одном предпочтительном воплощении описанные выше альгинаты по изобретению имеют первичную структуру, где большинство G-остатков находятся в так называемых G-блоках, предпочтительно по меньшей мере 50%, более предпочтительно по меньшей мере 70 или 75% и наиболее предпочтительно по меньшей мере 80, 85, 90 или 95% единичных G-остатков находятся в G-блоках. G-блок представляет собой непрерывную последовательность из по меньшей мере двух G-остатков, предпочтительно по меньшей мере 3 соседних G-остатков, более предпочтительно по меньшей мере 4 или 5 соседних G-остатков, наиболее предпочтительно по меньшей мере 7 соседних G-остатков.
В частности по меньшей мере 90% G-остатков соединены связью 1-4 с другим G-остатком. Более конкретно по меньшей мере 95%, более предпочтительно по меньшей мере 98% и наиболее предпочтительно по меньшей мере 99% G-остатков альгината соединены связью 1-4 с другим G-остатком.
Альгинатный олигомер для применения по изобретения предпочтительно является 3-35-мерным, более предпочтительно 3-28-мерным, в частности 4-25-мерным, особенно 6-22-мерным, в частности 8-20-мерным, особенно 10-15-мерным, например имеющим молекулярную массу в интервале от 350 до 6400 Да или от 350 до 6000 Да, предпочтительно от 550 до 5500 Да, предпочтительно от 750 до 5000 Да и особенно от 750 до 4500 Да.
Он может представлять собой одно соединение или может представлять собой смесь соединений, например с интервалом степеней полимеризации. Как отмечалось выше, мономерные остатки в альгинатном олигомере могут быть одинаковыми или разными, и не все должны нести электрически заряженные группы, хотя предпочтительно, чтобы большинство (например,по меньшей мере 60%, предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 90%) несло их. Предпочтительно, чтобы существенное большинство, например по меньшей мере 80%, более предпочтительно по меньшей мере 90% заряженных групп имели одинаковую полярность. В альгинатном олигомере отношение гидроксильных групп к заряженным группам предпочтительно составляет по меньшей мере 2:1, более конкретно по меньшей мере 3:1.
Альгинатный олигомер по изобретениюможет иметь степень полимеризации (DP) или среднечисловую степень полимеризации (DPn) 3-28, 4-25, 6-22, 8-20 или 10-15, или от 5 до 18, или от 7 до 15, или от 8 до 12, особенно 10.
Распределение молекулярной массы предпочтительно такое, при котором не более 5 мол.% имеют DP в два раза выше соответствующего верхнего предела для DPn. Аналогично, предпочтительно, чтобы не более 5 мол.% имело DP ниже числа в два раза меньшего соответствующего нижнего предела для DPn. Подходящие альгинатные олигомеры описаны в WO 2007/039754, WO 2007/039760 и WO 2008/125828, описания которых прямо включены посредством ссылки в данное описание изобретения во всей их полноте.
Типичные подходящие альгинатные олигомеры имеют DPn в интервале 5-30, фракцию гулуроната/галактуроната (FG) по меньшей мере 0,80, фракцию маннуроната (Fм) не более 0,20 и по меньшей мере 95 мол.% с DP не более 25.
Кроме того, подходящие альгинатные олигомеры имеют среднечисловую степень полимеризации в интервале 7-15 (предпочтительно 8-12), фракцию гулуроната/галактуроната (FG) по меньшей мере 0,85 (предпочтительно по меньшей мере 0,90), фракцию маннуроната (Fм) не более 0,15 (предпочтительно не более 0,10) и имеют по меньшей мере 95 мол.% со степенью полимеризации менее 17 (предпочтительно менее 14).
Кроме того, подходящие альгинатные олигомеры имеют среднечисловую степень полимеризации в интервале 5-18 (особенно 7-15), фракцию гулуроната/галактуроната (FG) по меньшей мере 0,80 (предпочтительно по меньшей мере 0,85, особенно по меньшей мере 0,92), фракцию маннуроната (Fм) не более 0.20 (предпочтительно не более 0,15, особенно не более 0,08) и имеют по меньшей мере 95 мол.% со степенью полимеризации менее 20 (предпочтительно менее 17).
Кроме того, подходящие альгинатные олигомеры имеют среднечисловую степень полимеризации в интервале 5-18, фракцию гулуроната/галактуроната (FG) по меньшей мере 0,92, фракцию маннуроната (Fм) не более 0,08 и имеют по меньшей мере 95 мол.% со степенью полимеризации менее 20. Кроме того, подходящие альгинатные олигомеры имеют среднечисловую степень полимеризации в интервале 5-18 (предпочтительно 7-15, более предпочтительно 8-12, особенно примерно 10), фракцию гулуроната/галактуроната (FG) по меньшей мере 0,80 (предпочтительно по меньшей мере 0,85, более предпочтительно по меньшей мере 0,90, в частности по меньшей мере 0,92, особенно по меньшей мере 0,95), фракцию маннуроната (Fм) не более 0,20 (предпочтительно не более 0,15, более предпочтительно не более 0,10, в частности не более 0,08, особенно не более 0,05) и имеют по меньшей мере 95 мол.% со степенью полимеризации менее 20 (предпочтительно менее 17, более предпочтительно менее 14).
Кроме того, подходящие альгинатные олигомеры имеют среднечисловую степень полимеризации в интервале 7-15 (предпочтительно 8-12), фракцию гулуроната/галактуроната (FG) по меньшей мере 0,92 (предпочтительно по меньшей мере 0,95), фракцию маннуроната (Fм) не более 0,08 (предпочтительно не более 0,05) и имеют по меньшей мере 95 мол.% со степенью полимеризации менее 17 (предпочтительно менее 14).
Кроме того? подходящие альгинатные олигомеры имеют среднечисловую степень полимеризации в интервале 5-18, фракцию гулуроната/галактуроната (FG) по меньшей мере 0,80, фракцию маннуроната (Fм) не более 0,20 и имеют по меньшей мере 95 мол.% со степенью полимеризации менее 20.
Кроме того,подходящие альгинатные олигомеры имеют среднечисловую степень полимеризации в интервале 7-15, фракцию гулуроната/галактуроната (FG) по меньшей мере 0,85, фракцию маннуроната (Fм) не более 0,15 и имеют по меньшей мере 95 мол.% со степенью полимеризации менее 17.
Кроме того, подходящие альгинатные олигомеры имеют среднечисловую степень полимеризации в интервале 7-15, фракцию гулуроната/галактуроната (FG) по меньшей мере 0,92, фракцию маннуроната (Fм) не более 0,08 и имеют по меньшей мере 95 мол.% со степенью полимеризации менее 17.
Альгинатный олигомер обычно несет заряд и, следовательно, противоионы для альгинатного олигомера могут представлять собой любой физиологически приемлемый ион, особенно те, которые обычно используют для заряженных лекарственных веществ, например натрий, калий, аммоний, хлорид, мезилат, меглумин и так далее. Также можно использовать ионы, которые способствуют гелеобразованию альгината, например ионы металлов 2 группы.
Хотя альгинатный олигомер может представлять собой синтетическое вещество, образованное полимеризацией подходящего количества остатков гулуроната и маннуроната, альгинатные олигомеры для применения по изобретению можно удобно получать, продуцировать или производить из естественных источников, таких как источники, указанные выше, а именно вещества - источники природного альгината.
Расщепление полисахарида до олигосахарида для получения альгинатного олигомера, используемого согласно настоящему изобретению, можно выполнять используя обычные методы лизиса полисахаридов, такие как ферментативное расщепление и кислотный гидролиз. Затем олигомеры можно хроматографически отделить от продуктов разрушения полисахаридов, используя ионообменную смолу или посредством фракционного осаждения, или солюбилизации, или фильтрации. В US 6121441 и WO 2008/125828, которые прямо включены посредством ссылки в данное описание изобретения во всей их полноте, описан способ, подходящий для получения альгинатных олигомеров для применения по изобретению. Дополнительную информацию и обсуждение можно найти, например, в "Handbooks of Hydrocolloids", Ed. Phillips и Williams, CRC, Boca Raton, Florida, USA, 2000, которое прямо включено в данное описание изобретения посредством ссылки во всей его полноте.
Альгинатные олигомеры также могут быть химически модифицированными, включая, но не ограничиваясь модификацией для добавления заряженных групп (таких как карбоксилированные или карбоксиметилированные гликаны), и альгинатные олигомеры, модифицированные с целью изменения пластичности (например, с помощью окисления периодатом).
Альгинатные олигомеры (например, олигогулуроновые кислоты), подходящие для применения по изобретению, можно удобно получать посредством кислотного гидролиза альгиновой кислоты из Laminaria hyperbora и Lesson/a nigrescens, но не ограничиваясь ими, путем растворения при нейтральном рН, добавления неорганической кислоты для снижения рН до 3,4 для осаждения альгинатного олигомера (олигогулуроновой кислоты), промывания слабой кислотой, ресуспендирования при нейтральном рН и сушки вымораживанием.
Альгинаты для получения альгинатных олигомеров по изобретению также могут быть получены непосредственно из подходящих бактериальных источников, например Pseudomonas aeruginosa или Azotobacter vinelandii, хотя ожидается, что водорослевые источники являются наиболее подходящими в связи с тем, что альгинаты, продуцируемые этими организмами, обычно имеют первичные структуры, в которых большинство G-остатков организованы в G-блоки, а не находятся в виде отдельных остатков.
Был клонирован и описан молекулярный аппарат, участвующий в биосинтезе альгината у Pseudomonas fluorescens и Azotobacter vinelandii (WO 94/09124; Ertesvag, H., et al., Metabolic Engineering, 1999, Vol. 1, 262-269; WO 2004/011628; Gimmestad, M., et al (смотри выше); Remminghorst and Rehm, Biotechnology Letters, 2006, Vol. 28, 1701-1712; Gimmestad, M. et al., Journal of Bacteriology, 2006, Vol. 188(15), 5551-5560), и альгинаты с заданными первичными структурами могут быть легко получены посредством управления такими системами.
Содержание G в альгинатах (например, веществе - источнике альгината) можно увеличить посредством эпимеризации, например с помощью С5-эпимераз маннурана из A.vinelandii или других эпимеразных ферментов. Таким образом, например, эпимеризацию in vitro можно выполнять с помощью эпимераз, выделенных из Pseudomonas или Azotobacter, например AlgG из Pseudomonas fluorescens или Azotobacter vinelandii, или ферментов AlgE (от AlgE1 до AlgE7) из Azotobacter vinelandii. Использование эпимераз из других организмов, которые обладают способностью продуцировать альгинат, в частности водорослей, также конкретно рассмотрено. In vitro эпимеризация альгинатов с низким содержанием G при помощи AlgE эпимераз Azotobacter vinelandii подробно описана в Ertesvag et al. (смотри выше) и Strugala et al. (Gums and Stabilisers for the Food Industry, 2004, 12, The Royal Society of Chemistry, 84-94). Предпочтительной является эпимеризация при помощи одной или более эпимераз AlgE Azotobacter vinelandii, отличных от AlgE4, так как данные ферменты способны продуцировать G-блочные структуры. Мутантные варианты или гомологи из других организмов также специально рассмотрены как полезные для применения. В WO 94/09124 описаны рекомбинантные или модифицированные ферменты С5-эпимеразы маннуронана (ферменты AlgE), например кодируемые эпимеразными последовательностями, в которых последовательности ДНК, кодирующие разные домены или модули эпимераз, были перемещены или удалены и рекомбинированы. Альтернативно, можно использовать мутанты природных эпимеразных ферментов (AlgG или AlgE), полученные например посредством сайт-направленного или случайного мутагенеза генов AlgG или AlgE.
Другим подходом является создание организмов Pseudomonas и Azotobacter, которые подвергнуты мутации в некоторых или всех их эпимеразных генах таким образом, чтоб эти мутанты продуцируют альгинаты с требуемой структурой продукта альгинатного олигомера, или даже альгинатные олигомеры с требуемой структурой и размером (или молекулярной массой). Создание ряда организмов Pseudomonas fluorescens с мутантными генами AlgG подробно описано в WO 2004/011628 и Gimmestad, M., et al., 2003 (смотри выше). Создание ряда организмов Azotobacter vinelandii с мутантными генами AlgE раскрыто в Gimmestad, M., et al., 2006 (смотри выше). Специалист может использовать данное руководство для создания новых мутантов, которые могли бы вырабатывать альгинатные олигомеры по изобретению без больших издержек.
Еще один подход состоит в удалении или инактивации эндогенных эпимеразных генов из организма Azotobacter или Pseudomonas и затем введения одного или более экзогенных эпимеразных генов, которые могут быть или могут не быть мутированными (то есть могут быть дикого типа или модифицированными) и экспрессию которых можно контролировать, например, путем использования индуцибельных или других "управляемых промоторов". Выбирая подходящие комбинации генов, можно продуцировать альгинаты с заданной первичной структурой.
Еще одним подходом может стать введение некоторого или всех механизмов биосинтеза альгината у Pseudomonas и/или Azotobacter в непродуцирующий альгинат организм (например, Е соli) и индукция продуцирования альгината этими генетически модифицированными организмами.
При использовании таких систем на основе культуры на первичную структуру альгината или альгинатного олигомера можно оказывать влияние с помощью условий культивирования. В рамках квалификации специалиста можно скорректировать параметры культивирования, такие как температура, осмолярность, уровни/источники питательных веществ и атмосферные параметры, чтобы манипулировать первичной структурой альгинатов, продуцируемых конкретным организмом.
Ссылки на "С-остатки/О" и "М-остатки/М", или на гулуроновую кислоту, или маннуроновую кислоту, или гулуронат, или маннуронат следует понимать взаимозаменяемо как ссылки на гулуроновую кислоту/гулуронат и маннуроновую кислоту/маннуронат (конкретно α-L-гулуроновую кислоту/гулуронат и P-D- маннуроновую кислоту/маннуронат) и также включают их производные, в которых одна или более из доступных боковых цепей или групп была модифицирована, не приводя к тому, что антибиопленочная активность становится по существу ниже, чем у немодифицированного полимера. Обычные группы, модифицирующие сахарид, могут включать группы ацетил, сульфат, амино, дезокси, спиртовые, альдегидные, кетонные, эфирные и ангидро. Альгинатный олигомеры также можно химически модифицировать с целью добавления заряженных групп (таких как карбоксилированные или карбоксиметилированные гликаны) и для изменения пластичности (например, с помощью окисления периодатом). Специалисту известны дополнительные химические модификации, которые можно осуществлять на моносахаридных субъединицах олигосахаридов и которые можно применять к альгинатам по изобретению.
Под "биопленкой" подразумевается сообщество микроорганизмов, характеризующееся превалированием сессильных клеток, которые прикреплены к основе, или к поверхности раздела, или друг к другу (также могут присутствовать некоторые подвижные клетки) и которые внедрены в матрицу из внеклеточных полимеров (более конкретно, внеклеточных полимеров, которые они продуцируют), отличающееся тем, что микроорганизмы данной колонии демонстрируют измененный фенотип в отношении скорости роста и транскрипцией генов (например, по сравнению с их "небиопленочными" или свободно плавающими или планктонными аналогами).
Термин "борьба с биопленкой" широко используют в данном описании изобретения и включает любой эффект разрушения, уменьшения или деструкции биопленки (то есть "нападения" на существующую биопленку) или приведения ее в состояние, более чувствительное к действию противомикробного агента или иммунного ответа хозяина, а также подавления, уменьшения, задерживания или предупреждения образования биопленки. Таким образом, "борьба" включает любую обработку биопленки, которая оказывает отрицательное воздействие на биопленку.
"Борьба с биопленкой", таким образом, включает как предупредительные, так и противодействующие меры или обработки. Борьба с биопленкой, следовательно, включает предупреждение образования биопленки, ликвидацию биопленки, уменьшение размера биопленки, уменьшение количества микроорганизмов в биопленочной колонии, уменьшение или прекращение скорости роста биопленки, уменьшение или прекращение скорости увеличения числа микроорганизмов в биопленочной колонии, уменьшение физической целостности биопленки, увеличение чувствительности микроорганизмов в биопленочной колонии к противомикробному агенту или механизму иммунной защиты хозяина и увеличение проницаемости биопленки для противомикробного агента или механизма иммунной защиты хозяина.
Таким образом, способ по изобретению можно использовать клинически, например в лечении биопленочной инфекции, или его можно использовать в очистке или обеззараживании любой поверхности, например коммерческой или промышленной поверхности.
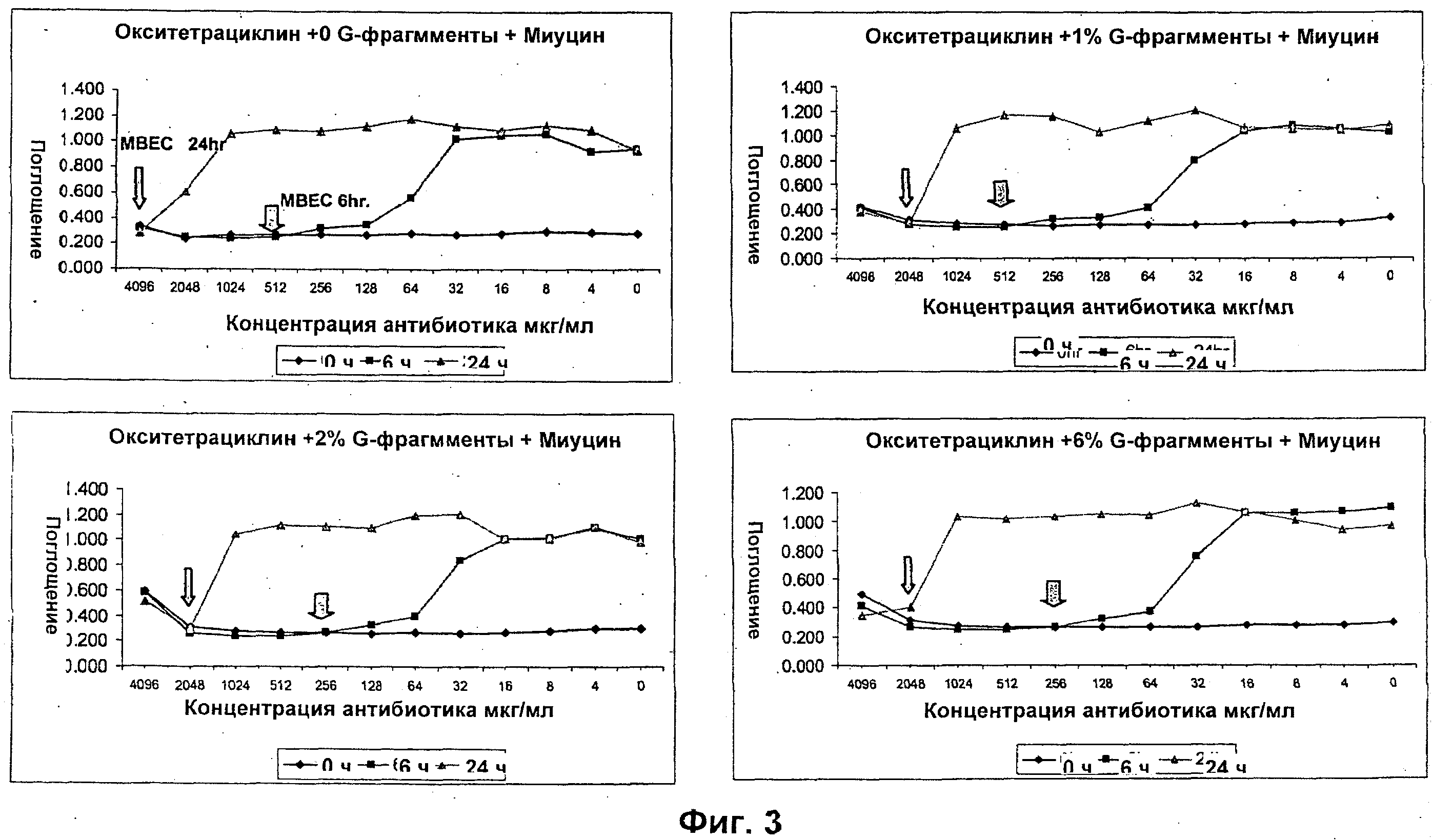
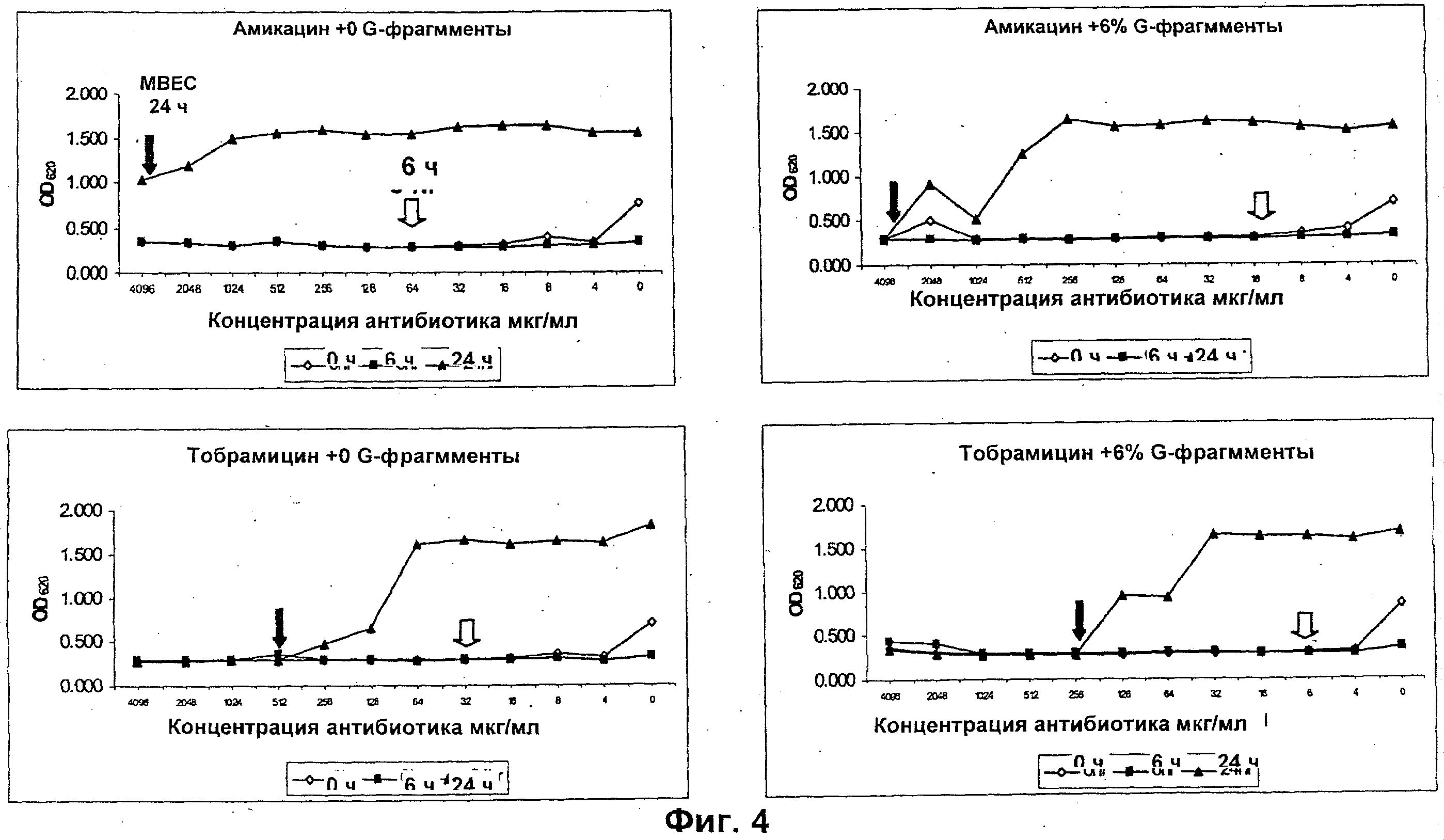
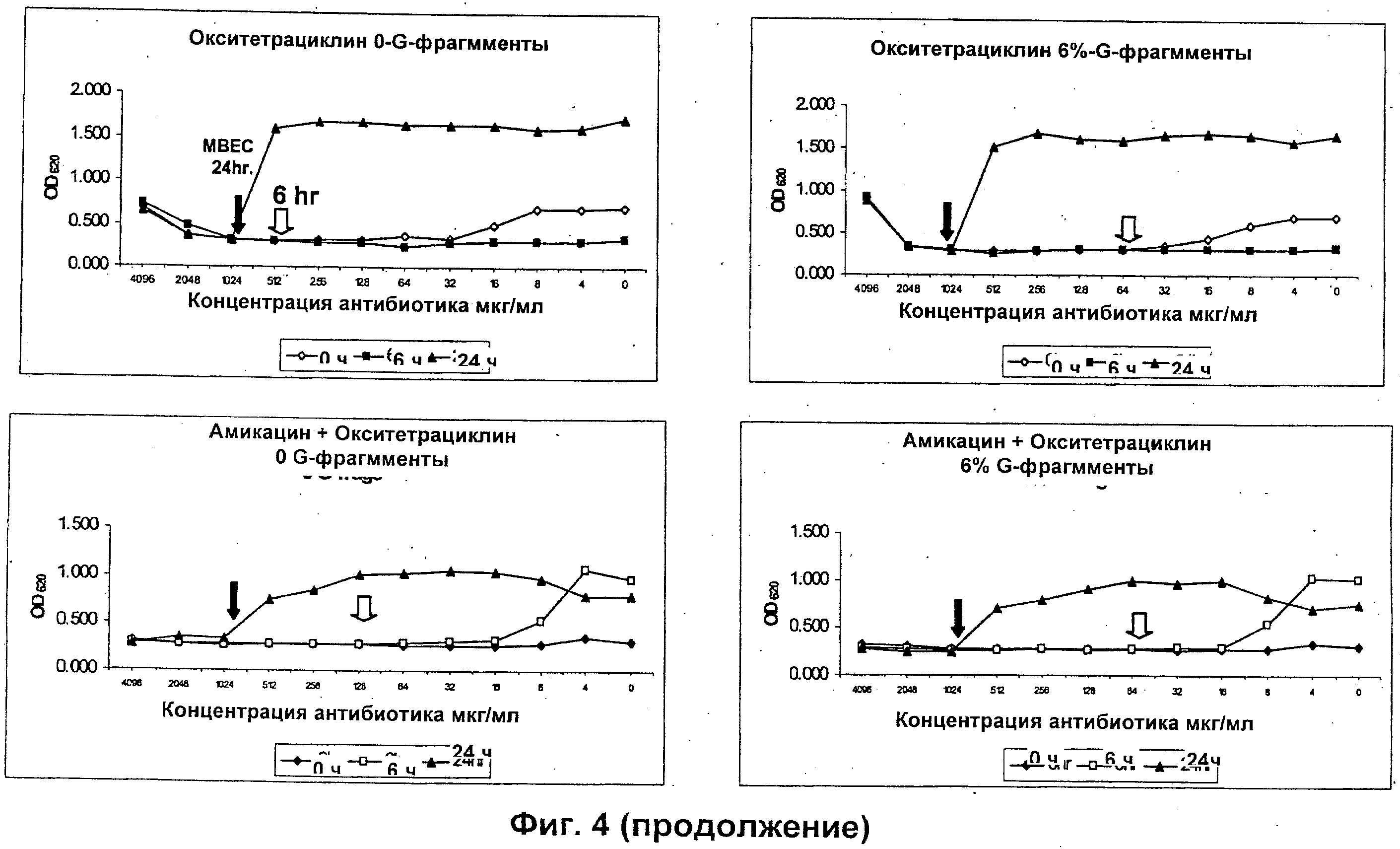
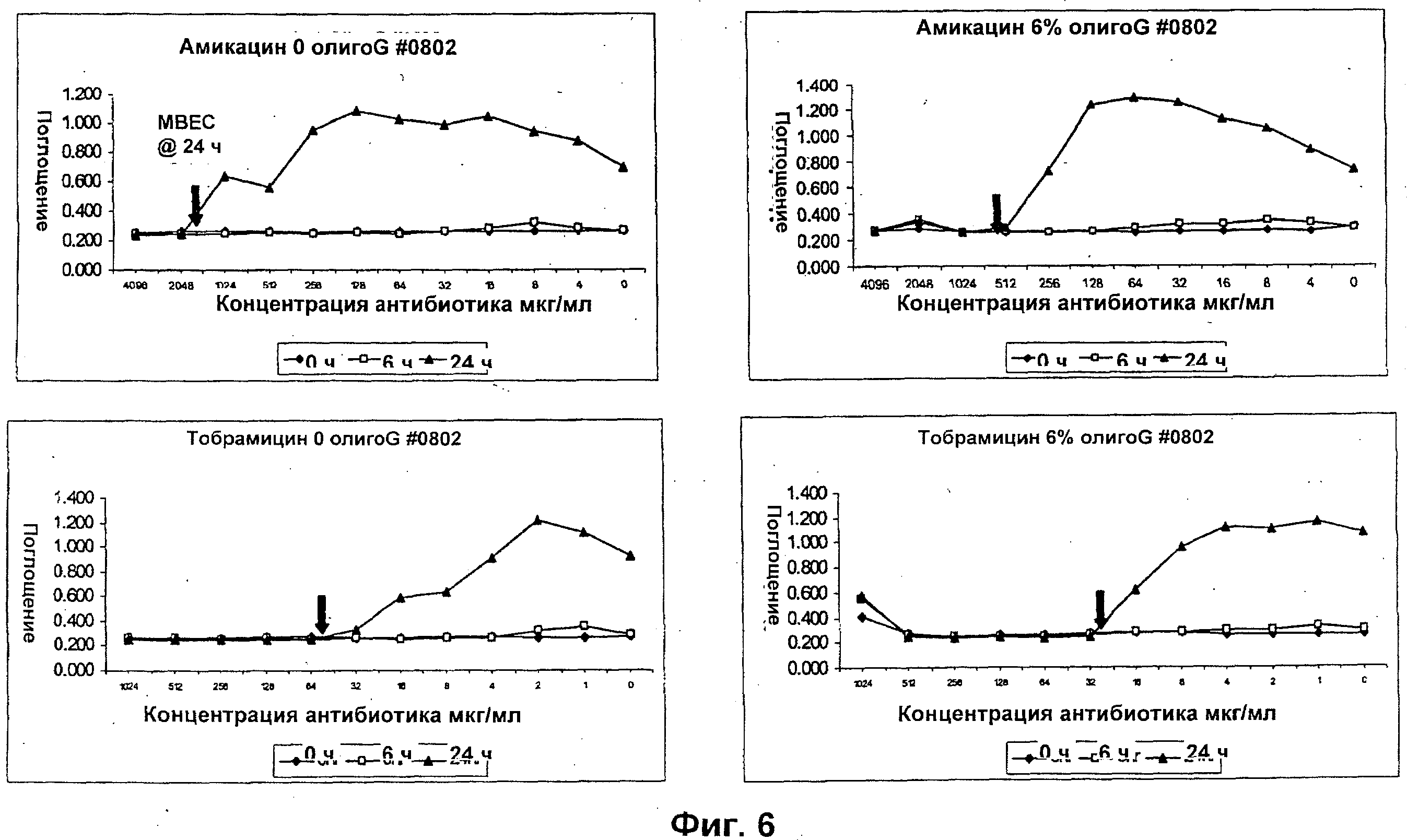
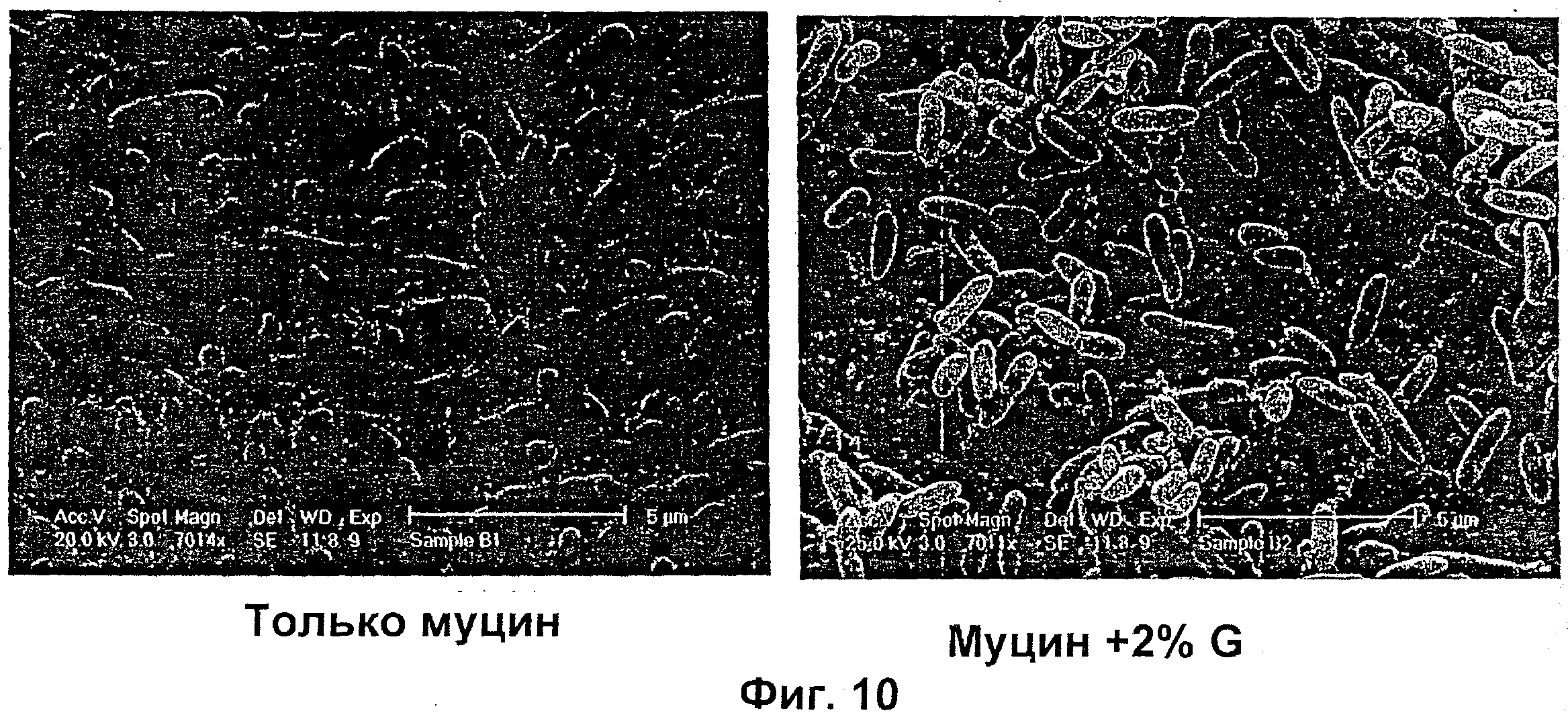
Размер, структуру, целостность и количество микроорганизмов в биопленке можно исследовать любым удобным способом. Например, для оценки размера, целостности и структуры биопленки часто используют сканирующую и трансмиссионную электронную микроскопию. Гистохимическое окрашивание микроорганизмов и/или компонентов внеклеточной матрицы также является рутинным (например, краситель 630/650-Х SE BODIPY™ для компонентов матрицы из биопленок Pseudomonas и краситель FM™ 1-43 для клеточных мембран Pseudomonas) и может быть использовано для оценки числа микроорганизмов и структуры и целостности биопленки визуально или при помощи устройств для сортировки клеток, конфокальных микроскопов или эпифлуоресцентных микроскопов. Анализ МВЕС (минимальной концентрации эрадикации биопленки), Moskowitz SM, et a) (2004) J Clin Microbiol, 42: 1915-1922, и описанный более подробно в Примерах, можно использовать для оценки чувствительности микроорганизмов в биопленке к противомикробному агенту. Donlan and Costerton, 2002, Clin. Mic. Rev, Vol. 15(2), 167-193 предложили дополнительные примеры.
Биопленки, с которыми можно бороться согласно изобретению, не ограничены с точки зрения микроорганизмов в биопленках, поскольку альгинатный олигомер по изобретения, среди прочего, нацелен на внеклеточную матрицу. Соответственно, биопленка может содержать любой класс, род или виды микроорганизма, а именно любой микроорганизм, который может образовывать биопленку. Такие микроорганизмы обычно включают бактерии, охватывая любые роды или виды бактерий. Таким образом, бактерии могут быть грамположительными или грамотрицательными, или неподверженными окрашиванию по Грамму. Они могут быть аэробными или анаэробными. Бактерии могут быть патогенными или непатогенными, или вызывающими гниение или индикаторными бактериями.
Примеры родов или видов бактерий включают Abiotrophia, Achromobacter, Acidaminococcus, Acidovorax, Acinetobacter, Actinobacillus, Actinobaculum, Actinomadura, Actinomyces, Aerococcus, Aeromonas, Afipia, Agrobacterium, Alcaligenes, Alloiococcus, Alteromonas, Amycolata, Amycolatopsis, Anaerobospirillum, Anaerorhabdus, Arachnia, Arcanobacterium, Arcobacter, Arthrobacter, Atopobium, Aureobacterium, Bacteroides, Balneathx, Bartonella, Bergeyella, Bifidobactehum, Bilophila Branhamella, Borrelia, Bordetella, Brachyspira, Brevibacillus, Brevibacterium, Brevundimonas, Brucella, Burkholderia, Buttiauxella, Butyrivibrio, Calymmatobacterium, Campylobacter, Capnocytophaga, Cardiobacterium, Catonella, Cedecea, Ceilulomonas, Centipeda, Chlamydia, Chlamydophila, Chromobacterium, Chyseobacterium, Chryseomonas, Citrobacter, Clostridium, Collinsella, Comamonas, Corynebacterium, Coxielta, Cryptobacterium, Delftia, Dermabacter, Dermatophilus, Desulfomonas, Desulfovibrio, Dialister, Dichelobacter, Dolosicoccus, Dolosigranulum, Edwardsiella, Eggerthella, Ehrlichia, Eikenella, Empedobacter, Enterobacter, Enterococcus, Erwinia, Erysipelothrix, Escherichia, Eubacterium, Ewingella, Exiguobacterium, Facklamia, Fili factor, Flavimonas, Flavobacterium, Francisella, Fusobacterium, Gardnerella, Gtobicatella, Gemella, Gordona, Haemophilus, Hafnia, Helicobacter, Helococcus, Holdemania, Ignavigranum, Johnsonella, Kingella, Klebsiella, Kocuria, Koserella, Kurthia, Kytococcus, Lactobacillus, Lactococcus, Lautropia, Leclercia, Legionella, Leminorella, Leptospira, Leptotrichia, Leuconostoc, Listeria Listonella Megasphaera, Methylobacterium, Microbactehum, Micrococcus, Mitsuokella, Mobiluncus, Moellerella, Moraxella, Morganella, Mycobacterium, Mycoplasma, Myroides, Neisseria, Nocardia, Nocardiopsis, Ochrobactrum, Oeskovia, Oligella, Orientia, Paenibacillus, Pantoea, Parachlamydia, Pasteurelia, Pediococcus, Peptococcus, Peptostreptococcus, Photobacterium, Photorhabdus, Plesiomonas, Porphyrimonas, Prevotella, Propionibacterium, Proteus, Providencia, Pseudomonas, Pseudonocardia, Pseudoramibacter, Psychrobacter, Rahnella, Ralstonia, Rhodococcus, Rickettsia Rochaiimaea Roseomonas, Rothia, Ruminococcus, Salmonella, Selenomonas, Serpulina, Serratia, Shewenella, Shigella, Simkania, Slackia, Sphingobacterium, Sphingomonas, Spirillum, Staphylococcus, Stenotrophomonas, Stomatococcus, Streptobacillus, Streptococcus, Streptomyces, Succinivibrio, Sutterella, Suttonella, Tatumella, Tissierella, Trabutsiella, Treponema, Tropheryma, Tsakamurella, Turicella, Ureaplasma, Vagococcus, Veillonella, Vibrio, Weeksella, Wolinelia, Xanthomonas, Xenorhabdus, Yersinia, и Yokenella; например грамположительные бактерии, такие как М. tuberculosis, M. bovis, М. typhimurium, М. bovis штамм BCG, субштаммы BCG, М. avium, M. intracellulare, М. afhcanum, M. kansasii, М. marinum, М. ulcerans, M. avium подвид paratuberculosis, Staphylococcus aureus, Staphylococcus epidermidis, Staphylococcus equi, Streptococcus pyogenes, Streptococcus agalactiae, Listeria monocytogenes, Listeria ivanovii, Bacillus anthracis, B. subtilis, Nocardia asteroides, Actinomyces israelii, Propionibacterium acnes, и виды Enterococcus, и грамотрицательные бактерии, такие как Closthdium tetani, Closthdium perfringens, Clostridium botulinum, Pseudomonas aeruginosa, vibrio cholerae, Actinobacillus pleuropneumoniae, Pasteurelia haemolytica, Pasteurelia multocida, Legionella pneumophila, Salmonella typhi, Brucella abortus, Chlamydi trachomatis, Chlamydia psittaci, Coxiella burnetti, Escherichia соli, Neiserria meningitidis, Neiserria gonorrhea, Haemophilus influenzae, Haemophilus ducreyi, Yersinia pestis, Yersinia enterolitica, Escherichia coli, E. hirae, Burkholderia cepacia, Burkholderia pseudomallei, Francisella tularensis, Bacteroides fragilis, Fusobascterium nucleatum, Cowdria ruminantium, но не ограничиваются ими.
Таким образом, в качестве типичного примера, биопленка может содержать бактерии рода Staphylococcus, Pseudomonas, Legionella, Mycobacterium, Proteus, Klebsiella, Fusobacterium или другие кишечные или колиформные бактерии.
Биопленки также могут содержать грибы, включая, например, грибы рода Candida, Aspergillus, Pneumocystis, Penicillium и Fusanum. Типичные грибковые виды включают Candida albicans, Candida dubliniensis, Cryptococcus neoformans, Histoplama capsulatum, Aspergillus fumigatus, Coccidiodes immitis, Paracoccidiodes brasiliensis, Blastomyces dermitidis, Pneomocystis camii, Penicillium marneffi, Altemaria alternate, но не ограничиваются ими.
Кроме того, в биопленке могут содержаться водоросли, и типичные виды водорослей включают Chaetophora, Chlorella protothecoides, Coleochaete scutata, Coleochaete soluta, Cyanidioschyzon merolae Aphanochaete, Gloeotaenium, Oedogonium, Oocystis, Oscillatoria, Paradoxia multisitia, Phormidium, Chroococcus, Aphanothece, Fragillaria, Cocconis, Navicula, Cymbelia, Phaeodactylum, а также цианобактерии (сине-зеленые водоросли) и диатомовые водоросли, такие как Nitzschia palea.
Биопленки также могут содержать другие организмы, такие как, например, паразиты, например простейшие, такие виды как Toxoplasma, например Toxoplasma gondii, виды Plasmodium, такие как Plasmodium falciparum, Plasmodium vivax, Plasmodium malariae. Trypanosoma brucei, Trypanosoma cruzi, виды Leishmania, такие как Leishmania major, Schistosoma, такие как Schistosoma mansoni и Entamoeba histolytica.
Обычно биопленка содержит смешанную колонию микроорганизмов, и таким образом биопленка, подвергающаяся воздействию альгинатных олигомеров по изобретению, может содержать любое количество вышеупомянутых видов. Предпочтительно по меньшей мере два, более предпочтительно по меньшей мере 5 и наиболее предпочтительно по меньшей мере 10.
Предпочтительно биопленочная колония содержит микроорганизмы по меньшей мере одного из следующих родов: Citrobacter, Enterobacter, Escherichia, Hafnia, Serratia, Yersinia, Peptostreptococcus, Bactehodes, Pseudomonas, Legionella, Staphylococcus, Enterococcus, Streptococcus, Klebsiella, Candida, Proteus, Burkholderia, Fusobacterium и Mycobacterium, например Staphylococcus aureus, Staphylococcus epidermidis, Legionella pneumophila, Candida albicans, Pseudomonas aeruginosa, Burkholderia cepacia и Streptococcus Pyogenes.
Как отмечалось выше, биопленка может присутствовать на поверхности. Поверхность не ограничена и включает любую поверхность, на которой может встречаться микроорганизм, в частности, как отмечалось выше, поверхность, подверженная воздействию воды или влажности. Поверхность может быть биотической или абиотической, и неживые (или абиотические) поверхности включают любую такую поверхность, которая может подвергаться воздействию микробного контакта или заражения. Таким образом, конкретно включены поверхности оборудования, в частности промышленного оборудования, или любая поверхность, подверженная воздействию водной окружающей среды (например, морская техника, или корабли или лодки, или их части или компоненты), или любая поверхность, подверженная воздействию любой части окружающей среды, например трубы или корпуса.
Такие неживые поверхности, подверженные воздействию микробного контакта или заражения, включают, в частности, любую часть: механизма или оборудования для переработки, приготовления, хранения или дозирования пищевых продуктов или напитков, установки кондиционирования воздуха, промышленных механизмов, например в химических или биотехнологических перерабатывающих производствах, резервуаров для хранения и медицинского или хирургического оборудования. Любая установка или оборудование для перемещения, или транспортировки, или доставки веществ, которая может быть подвержена действию воды или влажности, подвержена образованию биопленки. Такие поверхности включают, в частности, трубы (этот термин широко используется в данном описании изобретения и включает любой трубопровод или линию). Типичные неживые или абиотические поверхности включают, без ограничения, оборудование или поверхности для переработки, хранения, дозирования или приготовления пищевых продуктов, резервуары, транспортеры, полы, канализацию, холодильники, морозильные камеры, поверхности оборудования, стенки, клапаны, ремни, трубы, трубопроводы для кондиционирования воздуха, холодильные установки, линии дозирования пищевых продуктов или напитков, теплообменники, корпуса судов или любую часть судовой структуры, которая подвергается воздействию воды, стоматологический технический водопровод, трубопроводы для бурения нефтяных скважин, контактные линзы и контейнеры для хранения.
Как отмечалось выше, медицинское или хирургическое оборудование или устройства представляют собой особый класс поверхности, где может образовываться биопленка. Он может включать любой вид линий, включая катетеры (например, центральные венозные и мочевые катетеры), протезные устройства, например сердечные клапаны, искусственные суставы, искусственные зубы, зубные коронки, зубные прокладки и импланты для мягких тканей (например, импланты для молочной железы, ягодиц и губ). Включен любой вид имплантируемого (или "введенного") медицинского устройства (например, стенты, внутриматочные устройства, ритмоводители, трубки для интубации, протезы или протезные устройства, линии или катетеры). "Введенное" медицинское устройство может включать устройство, в котором какая-либо его часть содержится внутри тела, то есть устройство может быть полностью или частично «введено».
Поверхность может быть изготовлена из любого материала. Например, он может представлять собой металл, например алюминий, сталь, нержавеющую сталь, хром, титан, железо, их сплавы и тому подобное. Также поверхность может представлять собой пластик, например полиолефин (например, полиэтилен, полиэтилен сверхвысокой молекулярной массы, полипропилен, полистирол, поли(мет)акрилат, акрилонитрил, бутадиен, ABS (акрилнитрилбутадиенстирол), акрилонитрил-бутадиен и так далее.), полиэстер (например полиэтилентерефталат и так далее) и полиамид (например, нейлон), их комбинации и тому подобное. Другие примеры включают ацеталевый сополимер, полифенилсульфон, полисульфон, политермид, поликарбонат, полиэфирэфиркетон, поливинилиденфторид, поли(метилметакрилат) и поли(тетрафторэтилен). Кроме того, поверхность может представлять собой кирпич, черепицу, керамику, фарфор, дерево, винил, линолеум или ковровое покрытие, их комбинации и тому подобное. Кроме того, поверхности могут представлять собой пищу, например говядину, домашнюю птицу, свинину, овощи, фрукты, рыбу, моллюски, их комбинации и тому подобное.
Биотическая или живая поверхность может включать любую поверхность или поверхность раздела в организме или на организме. Таким образом, как отмечалось выше, ее можно рассматривать как "физиологическую" или "биологическую" поверхность. Она может представлять собой любую внутреннюю или наружную поверхность тела, включая любую ткань, которая может включать гематологическую или гематопоэтическую ткань (например, кровь). Как отмечалось выше, мертвая, или умирающая (например, некротическая), или поврежденная (например, воспаленная или разрушенная или разорванная) ткань особенно подвержены росту биопленки, и такая ткань охвачена термином "живая" или "биотическая". Поверхность может представлять собой слизистую или неслизистую поверхность.
Типичные биотические поверхности включают, без ограничения ими, любую поверхность в полости рта, например зубы, десны, десневые борозды, периодонтальный карман, репродуктивные пути (например, шейку матки, матку, фаллопиевы трубы), брюшину, среднее ухо, предстательную железу, мочевые пути, внутреннюю оболочку сосудов, слизистую оболочку глаза, ткань роговицы, дыхательные пути, легочную ткань (например, бронхиальную и альвеолярную), сердечные клапаны, желудочно-кишечный тракт, кожу, кожу волосистой части головы, ногти и внутреннюю часть ран, особенно хронических ран, которые могут быть местными или внутренними ранами.
В одном аспекте поверхность не является слизистой или, более конкретно, не имеет покрытия слизью с повышенной вязкостью. Специалист способен определить, когда слизистая на данной поверхности обладает повышенной вязкостью. В одном воплощении поверхность не является поверхностью, секретирующей слизь ткани. Более конкретно, в таком воплощении поверхность не является поверхностью ткани, покрытой слизью. Специалисту из области общих знаний известны ткани, которые секретируют слизь, и ткани, которые покрыты слизью.
Соответственно, можно видеть, что в изобретении предлагаются медицинские применения альгинатных олигомеров, которые определены в данном описании изобретения, для лечения или предупреждения биопленочной инфекции у субъекта (например, биопленочной инфекции любого микроорганизма, включая бактерии, вирусы, грибы или паразиты, такие как простейшие). Инфекция может представлять собой патогенную инфекцию. Типичные примеры микроорганизмов, которые могут вызывать инфекцию, описаны выше. Следует отметить инфекции, вызванные Citrobacter, Enterobacter, Escherichia, Hafnia, Serratia, Yersinia, Peptostreptococcus, Bacteriodes, Pseudomonas, Legionella, Sfaphylococcus, Enterococcus, Streptococcus, Kiebsiella, Candida, Proteus, Burkholderia, Fusobacterium и Mycobacterium, например Staphylococcus aureus, Staphylococcus epidermidis, Legionella pneumophila, Candida albicans, Pseudomonas aeruginosa, Burkholdeha cepacia и Streptococcus pyogenes. Следует особо отметить инфекции, вызванные Pseudomonas, например Pseudomonas aeruginosa.
Термин "у субъекта" широко используется в данном описании изобретения и включает биопленочную инфекцию, которая имеет место внутри субъекта или на субъекте, например на наружной поверхности тела. Биопленочная инфекция может быть хронической (то есть может представлять собой хроническую биопленочную инфекцию), например инфекция, которая сохраняется в течение по меньшей мере 5 или по меньшей мере 10 суток, в частности по меньшей мере 20 суток, более конкретно по меньшей мере 30 суток, наиболее конкретно по меньшей мере 40 суток. Хронические инфекции часто проявляются в виде биопленочных инфекций, но биопленочная инфекция может и не быть хронической инфекцией, как она определена в данном описании изобретения.
В данном аспекте изобретения биопленочная инфекция может иметь место на поверхности внутри субъекта или на субъекте (то есть биотической поверхности, как отмечалось выше) и/или на поверхности медицинского устройства, в частности имплантируемого или «введенного» медицинского устройства.
Таким образом, в данном аспекте изобретения предложен альгинатный олигомер (который может представлять собой любой альгинатный олигомер, как он определен в данном описании изобретения) для применения в лечении или предупреждении биопленочной инфекции у субъекта.
Альтернативно, в данном аспекте изобретения предлагается применение альгинатного олигомера для изготовления лекарственного средства для применения в лечении или предупреждении биопленочной инфекции у субъекта.
В данном аспекте изобретения также предложен способ лечения или предупреждения биопленочной инфекции у субъекта, включающий введение фармацевтически эффективного количества альгинатного олигомера субъекту, нуждающемуся в этом.
Кроме того, предлагается применение альгинатного олигомера в лечении или предупреждении биопленочной инфекции у субъекта.
Субъект может являться любым человеком или животным субъектом, не являющимся человеком, но, более конкретно, может представлять собой позвоночное, например млекопитающий субъект, птицу, рыбу или пресмыкающееся. Субъекты-люди являются предпочтительными, но субъект может представлять собой, например, любой домашний скот или домашнее животное или, например, животное в зоопарке. Таким образом, типичные животные включают собак, кошек, кроликов, мышей, морских свинок, хомяков, лошадей, свиней, овец, коз, коров, птиц и рыб. Таким образом, охватываются применения изобретения в ветеринарии. Субъекта можно рассматривать в качестве пациента.
Биопленочная инфекция может встречаться у любого субъекта, но некоторые субъекты являются более подверженными инфекции, чем другие. Субъекты, которые являются подверженными биопленочной инфекции, включают, без ограничения ими, субъекты, чей эпителиальный и/или эндотелиальный барьер ослаблен или нарушен, субъекты, чьи основанные на секреции механизмы защиты от инфицирования микроорганизмами ликвидированы, нарушены, ослаблены или подорваны, и субъекты, которые имеют иммунные нарушения, иммунодефицит или подавленный иммунитет (то есть субъекты, у которых какая-либо часть иммунной системы не работает нормально или работает недостаточно нормально, другими словами, у которых какая-либо часть иммунного ответа или иммунная активность снижена или ослаблена либо вследствие заболевания, либо клинического воздействия или другого лечения, или другим образом).
Типичные примеры субъектов, подверженных к биопленочной инфекции, включают, но без ограничения ими, субъекты с ранее развившейся инфекцией (например, посредством бактерий, вирусов, грибов или паразитов, таких как простейшие), особенно субъектов с ВИЧ, субъектов с сепсисом и субъектов с септическим шоком; субъектов с иммуннодефицитом, например субъектов, подготавливаемых к, подвергающихся или выздоравливающих от химиотерапии и/или радиотерапии, субъектов (включая пациентов с аутотрансплантатом, аллотрансплантатом и ксенотрансплантатом) с трансплантацией органа (например, костного мозга, печени, легких, сердца, сердечного клапана, почек и так далее), субъектов со СПИД; субъектов, находящихся в учреждении здравоохранения, например госпитале, главным образом субъектов в реанимации или в критическом состоянии (то есть в подразделениях, имеющих отношение к системам жизнеобеспечения или поддержания органа пациентов); субъектов, страдающих от травмы; субъектов с ожогами, субъектов с острыми и/или хроническими ранами; новорожденных субъектов; субъектов пожилого возраста; субъектов с раковым заболеванием (широко определяемым в данном описании изобретения и включающим любое неопластическое состояние как злокачественное, так или незлокачественное), особенно пациентов с раковыми заболеваниями иммунной системы (например, лейкемиями, лимфомами и другими гематологическими видами рака); субъектов, страдающих аутоиммунными состояниями, такими как ревматоидный артрит, сахарный диабет 1 типа, болезнь Крона, особенно субъектов, проходящих иммуносупрессивное лечение этих заболеваний; субъектов с пониженной или ликвидированной эпителиальной или эндотелиальной секрецией (например, слизи, слез, слюны) и/или клиренсом секретов (например, субъектов со слабофункционирующими ресничками на слизистой ткани), и/или пациентов со слизью повышенной вязкости (например, курильщиков) и субъектов с ХОБЛ (хронической обструктивной болезнью легких), бронхитом, муковисцидозом, эмфиземой, раком легких, астмой, пневмонией или синуситом) и субъектов с установленным медицинским устройством.
Таким образом, субъекты, у которых, в частности, с биопленочной инфекцией можно бороться согласно настоящему изобретению, включают пациентов, которые остаются ослабленными или вследствие слабой перфузии, повторной травмы, недостаточного питания, недостаточной оксигенации или дисфункции лейкоцитов.
Особенно следует отметить субъекты, которые перенесли физическую травму. Травма сама по себе может вызывать ослабление или нарушение нормального функционирования эпителиального и/или эндотелиального барьера субъекта или иммунитет субъекта может стать ослабленным в ответ на травму (шоковый ответ). Термин "травма" в широком смысле относится к повреждению клеток инородными телами и/или физическому повреждению клетки. В инородные тела включены микроорганизмы, частицы вещества, химические агенты и тому подобное. В физические повреждения включены механические повреждения; термические повреждения, такие как полученные от перегрева или переохлаждения; электрические повреждения, такие как вызванные контактом с источниками электрического напряжения; и радиационное повреждение, вызыванное, например, длительным экстенсивным воздействием инфракрасного, ульрафиолетового или ионизирующего облучений.
Также следует отметить субъектов с ожогом. Любой ожог, особенно тяжелый ожог, оказывает значительное воздействие на целостность эпителиального и/или эндотелиального барьера субъекта, и субъект часто становится иммунокомпроментированным в ответ на ожог (шоковый ответ).
Типичные вызывающие ожог агенты представляют собой экстремальные значения температуры (например, огонь и жидкости и газы при экстремальной температуре), электричество, едкие химические вещества, трение и облучение. Степень и длительность воздействия вместе с интенсивностью/силой агента приводят к ожогам различной тяжести. Обваривание (то есть травма, связанная с высокотемпературными жидкостями и/или газами) считается ожогом.
Тяжесть эпидермального ожога обычно классифицируют двумя способами. Наиболее известной является классификация по степени. Ожоги первой степени обычно ограничиваются эритемой (покраснением) в основной области травмы и белым пятном гемолиза в месте травмы. Клеточная травма таких ожогов распространяется только на глубину эпидермиса. Ожоги второй степени также проявляются как эритема в основной области травмы, но с поверхностными волдырями на эпидермисе. Клеточная травма ожогов второй степени охватывает поверхностную (папиллярную) дерму и может также охватывать глубокий (сетчатый) слой дермы. Ожоги третьей степени представляют собой ожоги, в которых эпидермис утрачен с повреждением гиподермы. Повреждение обычно предельное, включающее обугливание. Иногда присутствует ожоговый струп (сухая, черная некротическая ткань). Ожоги третьей степени могут требовать пересадки ткани. В ожогах четвертой степени имеет место гибельное повреждение гиподермы, например полностью утрачена гиподерма, и повреждение распространяется на лежащую ниже мышечную, сухожильную и связочную ткань. Наблюдаются обугливание и ожоговый струп. Пересадка ткани требуется, если ожог не оказался фатальным.
Еще одна известная система классификации представляет собой классификацию по толщине. Ожоги "поверхностной толщины" соответствуют ожогам первой степени. Спектр ожогов второй степени охвачен двумя классами ожогов "неполной толщины". "Неполной толщины-поверхностными" являются ожоги, которые поражают эпидермис только на глубину папиллярной дермы. "Неполной толщины-глубокими" являются ожоги, которые поражают дерму на глубину ретикулярной дермы. "Полной толщины" ожоги соответствуют ожогам третьей и четвертой степени.
Некоторые физические повреждения, например некоторые ожоги, и клеточные повреждения инородными телами приводят к образованию раны. Более конкретно, рану можно считать разрывом в ткани или обнажением ткани. Раны также могут быть вызваны самопроизвольно образованным очагом поражения, таким как кожная язва (например венозная, диабетическая язва или пролежень), анальная фиссура или язва рта.
Раны обычно определены или как острые, или как хронические. Острые раны представляют собой раны, которые правильно развиваются через три узнаваемые стадии процесса заживления (то есть воспалительную стадию, пролиферативную стадию и фазу ремоделирования) без пролонгированной динамики. Хронические раны, однако, представляют собой те раны, которые не выполняют упорядоченную последовательность биохимических событий процесса заживления, так как рана останавливается на одной из стадий заживления. Обычно хронические раны останавливаются в воспалительной фазе. Согласно конкретному аспекту настоящего изобретения хроническая рана представляет собой рану, которая не заживляется в течение по меньшей мере 40 суток, особенно по меньшей мере 50 суток, более конкретно по меньшей мере 60 суток, наиболее конкретно по меньшей мере 70 суток.
Как отмечалось выше, раны являются идеальной средой для инфекции, включая биопленочную инфекцию, и особенно хроническую биопленочную инфекцию, вследствие дефекта эпителиального барьера, и доступности субстрата, и поверхности для колонизации и прикрепления биопленки. Проблематично, что инфицирование раны часто дополнительно задерживает заживление и таким образом приводит к тому, что рана становятся более подверженной к образованию биопленки и образовавшейся инфекции. Альгинаты по изобретению, таким образом, являются эффективными в лечении и предупреждении биопленочного инфицирования ран, и лечение хронических ран представляет собой один предпочтительный аспект настоящего изобретения.
Таким образом, в одном воплощении изобретения предложен способ лечения или предупреждения биопленочной инфекции, в частности хронической биопленочной инфекции у вышеупомянутых субъектов, в частности у субъектов с респираторными заболеваниями или расстройствами, например муковисцидозом, ранами, ожогами и/или травмами, включающий введение субъекту фармацевтически эффективного количества альгинатного олигомера, как он определен в данном описании изобретения.
В одном аспекте особой важности альгинатные олигомеры можно использовать для лечения или предупреждения биопленочной инфекции в ранах, например ожогах, например в лечении инфицированных ран, например ожогов.
Ввиду способности лечить и предупреждать биопленочную инфекцию ран альгинатные олигомеры, определенные в данном описании изобретения, могут устранять одно из препятствий заживления раны, и таким образом альгинатные олигомеры, определенные выше, также являются эффективными в стимулировании заживления острых и хронических ран.
Под стимулированием заживления понимают, что лечение ускоряет процесс заживления раны, о которой идет речь (то есть прохождение раны через три узнаваемые стадии процесса заживления). Ускорение процесса заживления может проявляться в виде увеличения скорости прохождения через одну, две или все стадии заживления (то есть воспалительную стадию, пролиферативную стадию и/или фазу ремоделирования). Если рана представляет собой хроническую рану, которая остановилась на одной из стадий заживления, ускорение может проявляться в виде возобновления после остановки линейного последовательного процесса заживления. Другими словами, лечение сдвигает рану из незатягивающегося состояния в состояние, где рана начинает развиваться через стадии заживления. Такое развитие после возобновления может происходить с обычной скоростью или даже с более медленной скоростью по сравнению со скоростью обычного заживления острой раны.
Альгинатные олигомеры можно использовать для лечения биопленочных инфекций повсюду, где бы они не имели место в организме или на теле. Таким образом, в еще одном воплощении биопленочная инфекция может представлять собой инфекцию медицинского устройства, в частности «введенного» медицинского устройства.
Как отмечалось выше, биопленки встречаются на зубах, например в форме зубного налета. Альгинатные олигомеры можно использовать согласно настоящему изобретению в качестве пероральных лечебных агентов, например в борьбе с зубным налетом, например в удалении его или уменьшении его или для предупреждения, уменьшения или задержки его развития. Также они могут использоваться в лечении и предупреждении инфекций или инфекционного заболевания, которое может иметь место в ротовой полости, например гингивита и периодонтита.
Как отмечалось выше, в то время как лечение биопленочных инфекций легких и дыхательных путей и всех областей организма в основном охвачено настоящим изобретением, в одном воплощении медицинские применения по изобретению не направлены на лечение (1) биопленок в дыхательных путях пациентов, страдающих от ХОБЛ (хронических обструктивных заболеваний легких), в частности носовых пазух, и легких, в частности в лечении муковисцидоза, хронических обструктивных легочных заболеваний, эмфиземы, бронхита и синусита; (2) среднего уха пациентов, страдающих от экссудативного отита; или (3) репродуктивных путей пациентов-женщин с нарушенной способностью к зачатию; или (4) пищеварительного пути пациентов с нарушением функции пищеварительного тракта (например, запором).
В конкретных воплощениях изобретения альгинатные олигомеры можно использовать в лечении врожденного эндокардита клапана, острого отита среднего уха, хронического бактериального простатита, пневмонии, зубного налета, периодонтита, биопленочных инфекций в респираторных заболеваниях, которые могут включать муковисцидоз и астму, и инфекций, связанных с устройством, ассоциированных с имплантируемыми или протезными медицинскими устройствами, например эндокардита искусственного клапана, или инфекций линий, или катетеров, или искусственных суставов, или замещений ткани.
"Фармацевтически эффективное" количество альгината представляет собой количество альгината, которое обеспечивает измеряемое воздействие на целевую биопленку (как определено выше) и/или измеряемое воздействие на целевое состояние. Это количество можно определить согласно традиционным методикам определения дозировок, и специалист способен обнаружить свидетельство успешного лечения на основании своего опыта и с помощью общепринятых тестов, доступных ему, которые разработаны для наблюдения за размером, структурой, целостностью биопленки и количеством колоний (например, описанных выше), и тестов, разработанных для наблюдения за целевым состоянием.
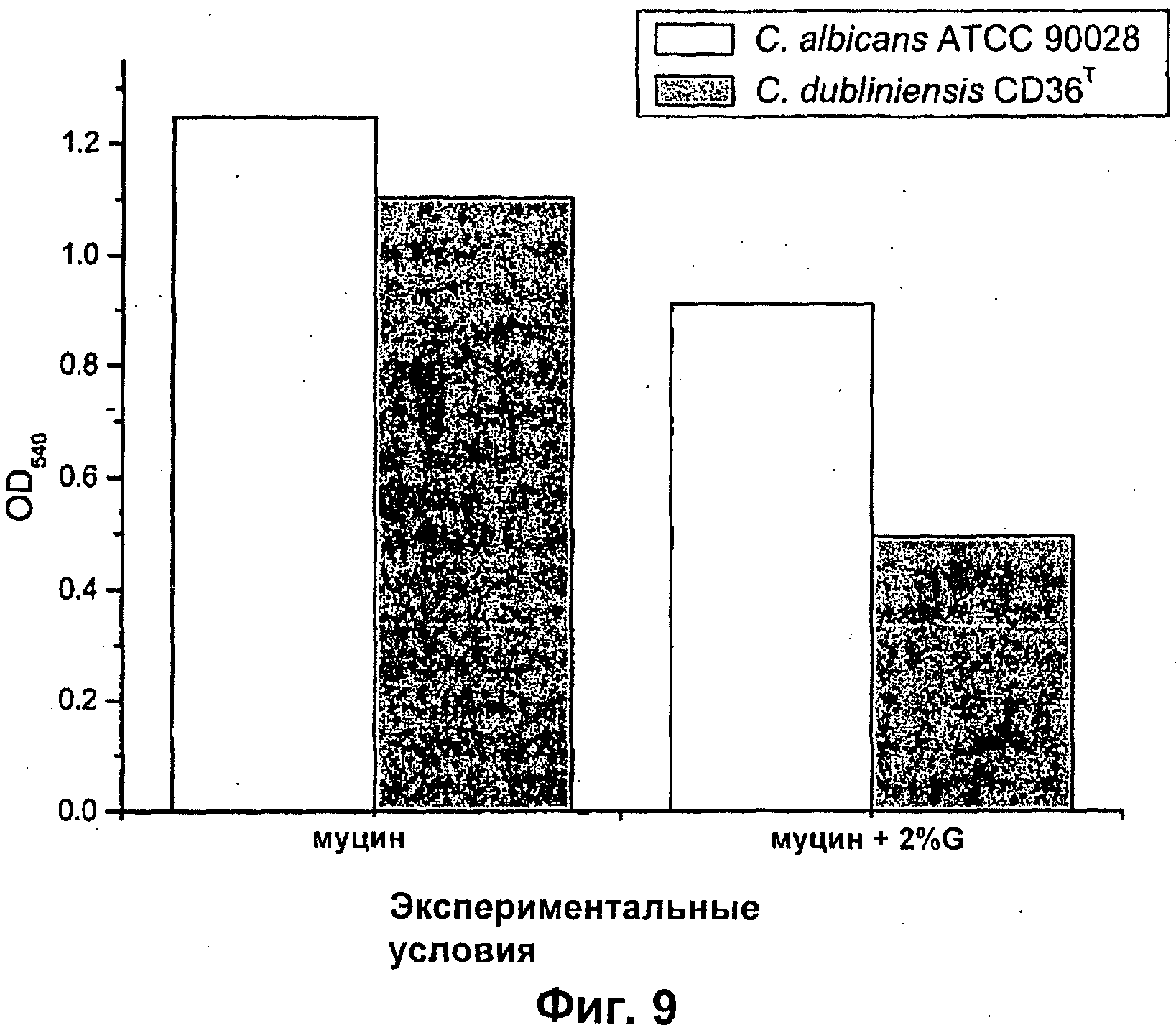
Подходящие дозы альгината будут варьироваться от субъекта к субъекту и могут быть определены терапевтом или практикующим ветеринаром в соответствии с массой, возрастом и полом субъекта, тяжестью состояния, способом введения, а также выбранным конкретным альгинатным олигомером. Обычно альгинатные олигомеры по изобретению применяют к биопленке в локальной концентрации вплоть до 10%, предпочтительно вплоть до 6%, более предпочтительно вплоть до 4% и наиболее предпочтительно вплоть до 2%.
"Лечение", при использовании в отношении биопленочной инфекции (то есть в отношении к лечению медицинского состояния/инфекции у субъекта в противоположность тому, которое используют в отношении самой биопленки), широко используется в данном описании изобретения и включает любой терапевтический эффект, то есть любое положительное влияние на состояние или в отношении биопленочной инфекции. Таким образом, включены не только ликвидация или уничтожение инфекции, или исцеление субъекта или инфекции, но также улучшение в инфицировании или состоянии субъекта. Таким образом, включено, например, улучшение любого симптома или признака инфекции, или любого клинически приемлемого индикатора инфекции/состояния (например, уменьшение размера раны или ускорение времени заживления). Лечение, таким образом, включает как куративную, так и паллиативную терапию, например ранее развившейся или диагностированной инфекции/состояния, то есть противодействующие лечению.
"Предупреждение", при использовании в данном описании изобретения, относится к любому профилактическому воздействию. Таким образом, оно включает задерживание, ограничение, уменьшение или предупреждение состояния или начала состояния, или одного, или более его симптомов, например в отношении состояния или симптома перед профилактическим лечением. Профилактика, таким образом, прямо включает как абсолютное предупреждение появления или развития состояния, или его симптома, так и любую задержку начала или развития состояния или симптома, или уменьшение или ограничение развития или прогрессирования состояния или симптома.
Конкретно, альгинаты по изобретению могут быть выбраны в качестве профилактического лечения, например для предупреждения или по меньшей мере сведения минимизации риска биопленочной инфекции (например, под влиянием патогена). Данный аспект изобретения особенно полезен при уходе за госпитализированными пациентами, так как риск контактирования с внутрибольничной инфекцией (обычно известной как больничная/приобретенная инфекция или инфекция, связанная с медицинским учреждением), например Staphylococcus aureus, устойчивый к метициллину Staphylococcus aureus (MRSA), Pseudomonas aeruginosa, Acinetobacter baumannii, Stenotrophomonas maltophilia, Clostridium difficile, Mycobacterium tuberculosis и устойчивый к ванкомицину Enterococcus, может быть минимизирован с помощью профилактического режима альгинатных олигомеров, описанных в данном описании изобретения. Данный аспект изобретения также особенно полезен в уходе за субъектами, страдающими от травмы, субъектами с ожогами и субъектами с ранами, все из которых, как отмечалось выше, являются более подверженными патогенной инфекции, чем субъект, который не поражен подобным образом.
В основном, субъектов, нуждающихся в лечении или профилактике согласно изобретению, диагностируют как страдающих от или с риском целевого состояния, или идентифицируют как имеющих биопленочную инфекцию или с риском развития биопленочной инфекции.
Конкретно, альгинатные олигомеры по изобретению могут быть выбраны в качестве профилактического лечения для предупреждения или по меньшей мере минимизации риска развития биопленочной инфекции, включая, например, инфицирование ран, врожденный эндокардит клапана, острый отит среднего уха, хронический бактериальный простатит, периодонтит, инфекции дыхательные пути и легких (например, муковисцидоз или другие дыхательные заболевания, зубной налет, пневмония) или инфицирование медицинского (например, «введенного») медицинского устройства.
В одном предпочтительном воплощении изобретения альгинатные олигомеры можно использовать вместе или в комбинации с противомикробным агентом. В контексте медицинского применения такой агент может представлять собой любой клинически полезный противомикробный агент и, в частности, антибиотик. В контексте неклинических применений противомикробный агент опять же может представлять собой любой противомикробный агент, используемый для таких целей, например любой дезинфицирующий, или антисептический, или чистящий, или стерилизующий агент. Агенты можно использовать по отдельности или вместе в одной композиции, одновременно, или последовательно, или раздельно, например с любым нужным интервалом времени.
Таким образом, в качестве типичного примера противомикробный агент можно использовать после альгинатного олигомера, но в некоторых обстоятельствах может быть полезным предшествующее или одновременное применение.
Можно использовать любой противомикробный агент, который нацелен по меньшей мере на один из микроорганизмов в биопленке-мишени. Выбор противомикробного агента конечно должен быть подходящим для поверхности, проходящей обработку, но, например, можно использовать противомикробные агенты, например антибиотики, противогрибковые средства, антисептики и/или стерилизующие условия, такие как облучение (например, ультрафиолетовое, рентгеновское, гамма), экстремальные значения температуры и экстремальные значения рН.
Типичный антибиотики включают, без ограничения ими, аминогликозиды (например, амикацин, гентамицин, канамицин, неомицин, нетилмицин, стрептомицин, тобрамицин); карбецефемы (например, лоракарбеф); цефалоспорины 1-ого поколения (например, цефадроксил, цефазолин, цефалексин); цефалоспорины 2-ого поколения (например, цефаклор, цефамандол, цефалексин, цефокситин, цефпрозил, цефуроксим); цефалоспорины 3-го поколения (например, цефиксим, цефдинир, цефдиторен, цефоперазон, цефотаксим, цефподоксим, цефтазидим, цефтибутен, цефтизоксим, цефтриаксон); цефалоспорины 4-ого поколения (например цефепим); макролиды (например, азитромицин, кларитромицин, диритромицин, эритромицин, тролеандомицин); монобактамы (например, азтреонам); пенициллины (например, амоксициллин, ампициллин, карбенициллин, клоксациллин, диклоксациллин, нафциллин, оксациллин, пенициллин G, пенициллин V, пиперациллин, тикарциллин); полипептидные антибиотики (например, бацитрацин, колистин, полимиксин В); хинолоны (например, ципрофлоксацин, эноксацин, гатифлоксацин, левофлоксацин, ломефлоксацин, моксифлоксацин, норфлоксацин, офлоксацин, тровафлоксацин); сульфонамиды (например, мафенид, сульфацетамид, сульфаметизол, сульфасалазин, сульфизоксазол, триметоприм-сульфаметоксазол); тетрациклины (например, демеклоциклин, доксициклин, миноциклин, окситетрациклин, тетрациклин); карбапенемы (например, имипенем, меропенем, эртапенем, дорипенем, панипенем/бетамипрон, биапенем, PZ-601); хлорамфеникол; клиндамицин, этамбутол; фосфомицин; изониазид; линезолид; метронидазол; нитрофурантоин; пиразинамид; хинупристин/далфопристин; рифампин; спектиномицин; и ванкомицин. Антибиотики ванкомицин, тобрамицин, меропенем, ципрофлоксацин, пиперациллин, колистин, азтреонам ципрофлоксацин и азитромицин являются предпочтительными.
Типичные антисептики включают, но без ограничения ими, хлорсодержащий отбеливатель (натрия гипохлорит), четвертичные аммониевые соединения (например, бензалкония хлорид, цетилтриметиламмония бромид, цетилпиридиния хлорид), перекись водорода, фенольные соединения (например, TCP (трихлорфениол)), спирты (например этанол), Virkon™, соединения йода (например, повидон-йод), соединения серебра (например, нано/микрочастицы элементарного серебра).
Типичные противогрибковые вещества включают, но без ограничения ими, полиены (например, натамицин, римоцидин, филипин, нистатин, амфотерицин В, кандицин); имидазолы (например, миконазол, кетоконазол, клотримазол, эконазол, бифоназол, бутоконазол, фентиконазол, изоконазол, оксиконазол, сертаконазол, сульфоназол, тиоконазол); триазолы (например, флуконазол, интраконазол, изавуконазол, равуконазол, посаконазол, вориконазол, терконазол); аллиламины (например, тербинафин, аморолфин, нафтифин, бутенафин); и эхинокандины (например, анидулафунгин, каспофунгин, микафунгин).
Противомикробный агент можно удобно применять до, одновременно с альгинатом, или после него. Удобно применять противомикробный агент по существу в то же самое время, что и альгинат, или сразу после него. Например, противомикробный агент применяют по меньшей мере через 1 час, предпочтительно по меньшей мере 3 часа, более предпочтительно по меньшей мере 5 и наиболее предпочтительно по меньшей мере 6 часов после введения альгинатного олигомера. Для оптимизации противомикробного эффекта противомикробного агент, его можно давать (например, вводить или доставлять) повторно в моменты времени, подходящие для используемого агента. Специалист способен разработать подходящее дозировки или схему приема. При долговременных лечениях альгинат также можно использовать повторно. Его можно использовать так же часто, как противомикробный агент, но обычно реже. Нужная частота будет зависеть от локализации биопленочной инфекции, состава колонии и используемого противомикробного агента, и специалист способен оптимизировать дозировку или характер использования для оптимизации результатов.
В предпочтительном воплощении противомикробный агент можно использовать или применять после физического удаления или уменьшения (например, обработки) биопленки с поверхности.
Вслед за удалением или попыткой удаления биопленки поверхность можно привести в контакт с альгинатными олигомерами в течение 0-24 часов, в частности 2-12 часов, более конкретно 4-8 часов, наиболее конкретно 5-7 часов, например 6 часов. После этого, при желании можно использовать противомикробный агент. Такой сценарий может быть желательным или особенно применимым в клинических условиях. В случае ран, инфицированных биопленкой, продолжительность инкубирования может быть удобно спланирована так, чтобы соответствовать заменам по графику раневой повязки.
Физическое удаление биопленки можно выполнять при помощи любых подходящих хирургических, механических или химических средств. Можно удобно использовать жидкие, гелевые, гелиево-золевые, полутвердые композиции или газ, применяемый под давлением к биопленке, обработку ультразвуком, лазером или при помощи абразивного устройства. Композиция, используемая для удаления, сама по себе или в виде моющего раствора перед, во время или после удобно может содержать альгинатный олигомер.
Таким образом, в одном конкретном воплощении предлагается очищающая или моющая композиции, например раствор для ран, содержащий альгинатный олигомер, в частности любой альгинатный олигомер, как он определен в данном описании изобретения. Такая очищающая композиция обычно представляет собой стерильный раствор, в частности водный стерильный раствор или стерильный раствор на основе масла, и может дополнительно содержать протеолитические ферменты (например, коллагеназу, трипсин, пепсин, эластазу), абразивную твердую фазу (например, коллоидный кремний, молотую пемзу, молотую растительную или животную скорлупу).
Может быть полезным применение в комбинации или вместе с другими агентами, разрушающими биопленку. Деструкторы биопленки включают, но без ограничения ими, протеазы, например сериновые протеазы, металлопротеазы и цистеиновые протеазы (примеры этих типов протеаз перечислены в ЕР0590746, полное содержание которых включено в данное описание изобретения посредством ссылки); нуклеазы, например ДНКаза I и II, РНКаза А, Н, I, II, III, P, PhyM, R; липазы и ферменты, способные разрушать полисахариды, гельсолин, тиольный восстановитель, ацетилцистеин, незаряженный низкомолекулярный полисахарид (например, декстран), или анионную полиаминокислоту (например, поли-ASP или поли-GLU).
Можно особо упомянуть альгинат-лиазу, и комбинированное применение ее с альгинатным олигомером, как он определен в данном описании изобретения, представляет собой одно возможное конкретное воплощение данного аспекта изобретения.
Использование в комбинации или вместе с иммуностимулирующими агентами также может быть полезным в обработке биопленок в клинических условиях. Такие иммуностимулирующие агенты можно удобно использовать в моменты времени, соответствующие описанным выше в отношении противомикробных агентов, и возможно можно использовать в комбинации с альгинатным олигомером и противомикробным агентом. Подходящие иммуностимулирующие агенты включают, но не ограничены ими, цитокины, например TNF, IL-1, IL-6, IL-8, и иммуностимулирующие альгинаты, такие как альгинаты с высоким содержанием М, как описано, например, в патенте США 5169840, WO 91/11205 и WO 03/045402, которые прямо включены посредством ссылки в данное описание изобретения во всей их полноте, но включая любой альгинат с иммуностимулирующими свойствами.
Применение альгинатных олигомеров в комбинации или вместе с факторами роста, например PDGF (тромбоцитарный фактор роста), FGF (фактор роста фибробластов), EGF (эпидермальный фактор роста), TGF (трансформирующий фактор роста), hGF и ферментами также может быть полезным в медицинских применениях по изобретению. Типичные примеры подходящих ферментов включают, но без ограничения ими, протеазы, например сериновые протеазы, металлопротеазы и цистеиновые протеазы (примеры данных типов протеаз перечислены в ЕР 0590746, полное содержание которого включено в данное описание изобретения посредством ссылки); нуклеазы, например ДНКазы I и II, РНКазы А, Н, I1 II, III, P, PhyM, R; липазы и ферменты, способные разрушать полисахариды.
Использование альгинатных олигомеров в комбинации или вместе с физиологически приемлемым агентом, понижающим мукозальную вязкость, также может быть полезным, например фермент, расщепляющий нуклеиновую кислоту (например, ДНКаза, такая как ДНКаза I), гельсолин, тиольный восстановитель, ацетилцистеин, натрия хлорид, незаряженный низкомолекулярный полисахарид (например декстран), аргинин (или другие предшественники или стимуляторы синтеза окиси азота) или анионная полиаминокислота (например, поли-ASP или поли-GLU), амброксол, ромгексин, карбоцистеин, домиодол, эпразинон, эрдостеин, летостеин, месна, нелтенексин, собрерол, степронин, тиопронин являются известными конкретными муколитиками. Использование ДНКазы является особенно предпочтительным.
Как отмечалось выше, альгинатные олигомеры возможно можно использовать с любым другим терапевтически активным агентом, который желательно использовать, например противовоспалительным агентом. Комбинированное применение альгинатного олигомера с дополнительным терапевтически активным агентом (например, противомикробным или противовоспалительным агентом) предпочтительно может обеспечить уменьшение дозы (например, обычной или нормальной дозы) дополнительного терапевтически активного агента, например его можно использовать в его нормальной или обычной дозе, или в более низкой дозе, например вплоть до 50% (или 50%) от его нормальной дозы.
Данное изобретение включает применение одного альгинатного олигомера или смеси (многообразие/множество) разных альгинатных олигомеров. Таким образом, например, можно использовать комбинацию разных альгинатных олигомеров (например, двух или более).
В случае медицинского применения альгинаты по изобретения можно вводить субъекту в любой подходящей форме или любыми подходящими способами, например местным, пероральным, парентеральным, энтеральным, парентеральными путями или посредством ингаляции. Предпочтительно альгинат вводят местным, пероральным или парентеральным способом или посредством ингаляции.
Специалист способен приготовить альгинаты по изобретению в виде фармацевтических композиций, которые адаптированы для данных путей введения согласно любым общепринятым способам, известным в данной области техники, и широко описаны в литературе. Исключительно в качестве руководства в Примерах 11 и 12 описаны две возможные композиции (местная композиции и жидкость для очистки).
В настоящем изобретении, таким образом, также предлагается фармацевтическая композиция для применения в лечении или предупреждении биопленочной инфекции, содержащая альгинатный олигомер, как он определен в данном описании изобретения, вместе с по меньшей мере одним фармацевтически приемлемым носителем, разбавителем или эксципиентом.
Активный ингредиент может включать, возможно вместе с другими активными агентами, с одним или более обычными носителями, разбавителями и/или эксципиентами, с получением обычных галеновых препаратов, таких как таблетки, пилюли, порошки (например, ингаляционные порошки), пастилки, саше, крахмальные облатки, эликсиры, суспензии, эмульсии, растворы, сиропы, аэрозоли (в виде твердого вещества или в жидкой среде), спреи (например, назальные спреи), композиции для применения в небулайзерах, мази, мягкие и твердые желатиновые капсулы, суппозитории, стерильные инъекционные растворы, стерильные упакованные порошки и тому подобное.
Примеры подходящих носителей, эксципиентов и разбавителей представляют собой лактозу, декстрозу, сахарозу, сорбитол, маннитол, крахмалы, аравийскую камедь, фосфат кальция, инертные альгинаты, трагакант, желатин, силикат кальция, микрокристаллическую целлюлозу, поливинилпирролидон, целлюлозу, водный сироп, воду, смесь вода/этанол, вода/гликоль, вода/полиэтилен, гипертоническую соленую воду, гликоль, пропиленгликоль, метилцеллюлозу, метилгидроксибензоаты, пропилгидроксибензоаты, тальк, стеарат магния, вазелиновое масло или жировые вещества, такие как твердый жир, или их подходящие смеси. Предпочтительными эксципиентами и разбавителями являются маннитол и гипертоническая соленая вода (солевой раствор).
Композиции могут дополнительно включать смазывающие агенты, увлажняющие агенты, эмульгирующие агенты, суспендирующие агенты, консерванты, подсластители, ароматизаторы и тому подобное.
Как отмечалось выше, альгинатные олигомеры, предлагаемые для применения по изобретению, можно использовать в комбинации с другими терапевтическими агентами, например вводить вместе, в одном фармацевтическом препарате или композиции, или отдельно (то есть для раздельного, последовательного или одновременного введения). Таким образом, альгинаты по изобретению можно объединять со вторым (или дополнительным) терапевтически активным агентом, например в фармацевтическом наборе или в виде комбинированного продукта ("комбинация").
Таким образом, в дополнительном аспекте настоящего изобретения предлагается продукт, содержащий альгинатный олигомер, как он определен в данном описании изобретения, и второй активный агент, в виде комбинированного препарата для раздельного, одновременного или последовательного применения к биопленке и/или введения субъекту для применения в борьбе с биопленкой, и/или лечения или предупреждения биопленочной инфекции у субъекта или любого состояния, определенного в данном описании изобретения,
Дополнительные терапевтически активные агенты могут быть включены в фармацевтические композиции, как отмечалось в отношении комбинированных терапий выше.
Парентерально вводимые формы, например внутривенные растворы, должны быть стерильными и свободными от физиологичи неприемлемых агентов и должны иметь низкую осмолярность, чтобы минимизировать раздражение или другие побочные эффекты при введении, и, таким образом, растворы предпочтительно должны быть изотоническими или слегка гипертоническими, например гипертонической соленой водой (солевой раствор). Подходящие носители включают водные носители, обычно используемые для введения парентеральных растворов, такие как хлорид натрия для инъекции, раствор Рингера для инъекции, декстроза для инъекции, декстроза и хлорид натрия для инъекции, раствор Рингера лактата для инъекции и другие растворы, такие как описанные в Remington's Pharmaceutical Sciences, 15th ed., Easton: Mack Publishing Co, 1405-1412 и 1461-1487 (1975) и The National Formulary XIV, 14th ed., Washington: American Pharmaceutical Association (1975). Растворы могут содержать консерванты, противомикробные агенты, буферы и антиоксиданты, обычно используемые для парентеральных растворов, эксципиенты и другие вспомогательные вещества, которые совместимы с биополимерами и которые не будут мешать изготовлению, хранению или использованию продуктов.
Для местного введения альгинатный олигомер можно вводить в кремы, мази, гели, трансдермальные пластыри и тому подобное. Альгинатные олигомеры также можно вводить в медицинские повязки, например раневые повязки, например тканые (например, тканевые) повязки или нетканые повязки (например, гели или повязки с гелевым компонентом). Известно применение альгинатных полимеров в повязках, и такие повязки или в сущности любые повязки могут дополнительно включать альгинатные олигомеры по изобретения.
Таким образом, в дополнительном конкретном воплощении изобретения дополнительно предлагается раневая повязка, содержащая альгинатный олигомер (который может представлять собой любой альгинатный олигомер, как он определен в данном описании изобретения).
Кроме того, местные системы, которые, как предполагаются, являются подходящими, представляют собой системы доставки лекарственного средства in situ, например гели, где твердые, полутвердые, аморфные или жидкие, кристаллические гелевые матрицы образуются in situ, и которые могут содержать альгинатный олигомер. Такие матрицы могут быть удобно разработаны, чтобы регулировать высвобождение альгинатного олигомера из матрицы, например высвобождение может быть задержанным и/или непрерывным в течение выбранного периода времени. Такие системы могут образовывать гели только при контакте с биологическими тканями или жидкостями. Обычно гели являются биоадгезивными. Доставка в любой участок организма, которая может сохранять или быть адаптирована, чтобы сохранять предгелевую композицию, может быть нацелена посредством такой методики доставки. Такие системы описаны в WO 2005/023176.
Для нанесения на пероральную, буккальную и дентальную поверхность конкретно отмечены зубные пасты и растворы для промывания полости рта. Таким образом, в один конкретный аспект включены композиции для ухода за полостью рта или для гигиены полости рта, содержащие альгинатный олигомер (который может представлять собой любой альгинатный олигомер как определено в данном описании изобретения), в частности жидкость для полоскания рта или зубная паста.
Как отмечалось выше, предпочтительная композиция по изобретению представляет собой композицию для очищения, которую используют в процессе очищения для удаления биопленки, например из ткани. Обычно такая композиция представляет собой жидкость, но можно использовать гелевые, гелиево-золевые или полутвердые композиции. Композицию можно использовать для очищения раны от биопленки (например, нанесения на ткань под давлением) и/или можно использовать для промывания ткани до, во время и/или после очищения другими способами, такими как хирургические, механические или химические способы. Специалист способен легко приготовить композиции для очищения в соответствии с изобретением.
В случае биопленок на неживой поверхности альгинатный олигомер может быть нанесен на поверхность, подлежащую обработке, в любой подходящей композиции или препарате, или любым подходящим способом. Так, альгинатный олигомер может находиться в жидкой, гелевой, гелиево-золевой, полутвердой или твердой форме (например, растворах, суспензиях, гомогенатах, эмульсиях, пастах, порошках, аэрозолях, парах). Обычно композиции для обработки таких биопленок на неживой поверхности будут представлять собой фармацевтически неприемлемую композицию. Выбор формы композиции будет диктоваться структурой биопленки, составом и локализацией колонии. Например, если биопленка локализована в трубопроводе для жидкости, может быть удобно применять жидкую композицию. Также может быть предпочтительно использовать композицию, которая сохраняется на поверхности, подлежащей обработке, но которая не будет вымываться в жидкость при обычном применении, например адгезивный гель. Специалист способен легко приготовить подходящие композиции исходя из общих знаний. Например, альгинатный олигомер можно добавлять в композицию краски и наносить на поверхность, подлежащую обработке, например корпуса судна или другую часть конструкции судна, которая подвержена действию воды, или на строение или любую его часть, резервуар (например, резервуар для хранения или переработки) или практически на любую часть любого промышленного механизма. Такие композиции также могут удобно содержать противомикробный агент, как описано выше, например хлорсодержащий отбеливатель, TCP, этанол, Virkon™, повидон-йод, соединения серебра и так далее. Так как композиции могут и не быть фармацевтически приемлемыми, более жесткие противомикробные средства могут быть рассмотрены с точки зрения повреждения поверхности, загрязнения окружающей среды, безопасности пользователя и загрязнения обрабатываемой поверхности, и взаимодействия с другими компонентами композиции.
Композиции по изобретению можно приготовить в виде препарата так, чтобы обеспечить быстрое, замедленное или отсроченное высвобождение активного ингредиента после введения субъекту/на поверхность с использованием способов, хорошо известных в данной области техники. Адгезивные композиции также являются предпочтительными. Адгезивные композиции, композиции для замедленного и/или отсроченного высвобождения могут быть особенно подходящими.
В дополнительном аспекте изобретения предложены продукты, подверженные биопленочной колонизации, чьи подверженные колонизации поверхности были предварительно обработаны альгинатным олигомером, как определено в данном описании изобретения. Неограничивающие примеры продуктов и поверхностей, подверженных биопленочной колонизации, описаны выше. Особенно следует отметить оборудование для переработки, хранения или дозирования продуктов питания и напитков и медицинские устройства. Предварительную обработку можно выполнять любыми подходящими способами, например посредством любого нанесения альгинатного олигомера на поверхность, особенно нанесение на поверхность покрытия, например посредством распылительной сушки, полимерное покрытие полимером, включающим альгинатный олигомер, и окрашивание, глянцевание или лакирование с помощью красящих, глянцующих или лакирующих композиций, содержащих альгинатный олигомер. Такая "покрывающая" композиция (например, краска, средство для глянцевания или лак), содержащая альгинатный олигомер, представляет собой дополнительный аспект настоящего изобретения. Альтернативно, альгинатный олигомер можно вводить в вещество при изготовлении поверхности. Такой подход подходит к поверхностям, изготовленным из полимеров, таких как пластики и силиконы, например медицинских устройств, описанных выше.
Изобретение дополнительно описано со ссылкой на следующие неограничивающие Примеров, в которых:
На Фиг.1 показан бактериальный рост в биопленках Pseudomonas, образованных в течение ночи и затем обработанных муцином (2,5 г/л) и G-фрагментами (0, 1%, 2% или 6%) в течение ночи, в 0 ч, 6 ч и 24 ч после обработки амикацином в течение ночи (4096-0 мкг/мл).
На Фиг.2 показан бактериальный рост в биопленках Pseudomonas, образованных в течение ночи и затем обработанных муцином (2,5 г/л) и G-фрагментами (0, 1%, 2% или 6%) в течение ночи, в 0 ч, 6 ч и 24 ч после обработки окситетрациклином в течение ночи (4096-0 мкг/мл).
На Фиг.3 показан бактериальный рост в биопленках Pseudomonas, образованных в присутствии муцина (2,5 г/л) и G-фрагментов (0, 1%, 2% или 6%) в течение ночи, в 0 ч, 6 ч и 24 ч после обработки окситетрациклином в течение ночи (4096-0 мкг/мл).
На Фиг.4 показан бактериальный рост в биопленках Pseudomonas, образованных в присутствии муцина (2,5 г/л) в течение 6 ч и затем обработанных муцином (2,5 г/л) и G- фрагментами (0 или 6%) в течение ночи, в 0, 6 и 24 ч после обработки в течение ночи амикацином, тобрамицином, окситетрациклином или «амикацином+окситетрациклином» (4096-0 мкг/мл).
На Фиг.5 показан бактериальный рост в биопленках Pseudomonas PAО1, образованных в течение 6 ч без муцина и затем обработанных G-фрагментами (О или 6%) без муцина, в 0 ч, 6 ч и 24 ч после обработки в течение ночи амикацином (4096-0 мкг/мл) или тобрамицином (1024-0 мкг/мл).
На Фиг.6 показан бактериальный рост в биопленках Pseudomonas PAО1, образованных в присутствии муцина (2,5 г/л) в течение 6 ч и затем обработанных муцином (2,5 г/л) и «G-блоком #0802» (0 или 6%) в течение ночи, в 0, 6 и 24 ч после обработки в течение ночи амикацином (4096-0 мкг/мл) или тобрамицином (1024-0 мкг/мл).
На Фиг.7 показан бактериальный рост в биопленках штамма Staphylococcus aureus ATCC 6538, образованных в присутствии муцина (2,5 г/л) в течение 6 ч и затем обработанных муцином (2,5 г/л) и G-фрагментами (0 или 6%) в течение ночи, в 0, 6 и 24 ч после ночной обработки окситетрациклином (4096-0 мкг/мл).
На Фиг.8 показан бактериальный рост в биопленках раневого изолята «1103» MRSA, образованных в присутствии муцина (2,5 г/л) в течение 6 ч и затем обработанных муцином (2,5 г/л) и G-фрагментами (0 или 6%) с добавлением в течение ночи, в 0 ч, 6 ч и 24 ч после обработки в течение ночи тобрамицином (1024-0 мкг/мл).
На Фиг.9 показано действие G-фрагментов и муцина на прикрепление Candida albicans ATCC 90028 и Candida dubliniensis СВ361 в биопленках, образованных при помощи муцина (2,5 г/л) и G-фрагментов в концентрации О или 2% в течение ночи.
На Фиг.10 представлены электронные микроснимки биопленок Pseudomonas, образованных в присутствии муцина (2,5 г/л) в течение 6 ч и затем обработанных муцином (2,5 г/л) и G-фрагментами при 0 или 2% в течение 24 ч.
ПРИМЕРЫ
Пример 1 - Вещества и стандартные методы
Бактериальные штаммы.
Два штамма из коллекции культур, Pseudomonas aeruginosa PAО1 (ATCC 15682, раневый изолят) и Staphylococcus aureus (ATCC 6538), использовали для анализа МВЕС (анализ минимальной концентрации эрадикации биопленки) вместе с клиническим изолятом из хронической венозной язвы ноги, S. aureus (MRSA) «1103». Два типа штамма Candida, С.albicans ATCC 90028 и С.dubliniensis СD36т использовали для анализа прикрепления.
Химические вещества и бактериальные среды.
Бактериальные колонии выращивали на основании из кровяного агара №2 (ВА; Lab15, LabM, Bury, UK) с добавление 5% бараньей крови и использовали для инокулирования триптон-соевого бульона (TSB, CM0129, Oxoid, Basingstoke, UK) для роста в течение ночи. Биопленки образовывались в сбалансированном по катионному составу бульоне Миллера-Хинтон (САМНВ; Lab114, LabM). Все использованные антибиотики были фармацевтически чистыми (Sigma-Aldrich, Gillingham, UK) и включали амикацин, окситетрациклин и тобрамицином. Гликопротеин муцин желудочной слизи свиньи (очищенный при помощи Jeff Pearson, Newcastle University) и альгинатные олигомеры CF-5/20 ("G-фрагменты"; 2600 Да, %G 90-95) и G-блок #0802 (6400 Да, %G 91) были предоставлены Algipharma AS, Sandvika, Norway.
Анализ минимальной концентрацииэрадикации биопленки (МВЕС).
Использованный способ МВЕС являлся адаптацией Moskowitz SM, et al. (2004) J Clin Microbiol 42: 1915-1922. После излечения с хранения при -80°С бактериальные изоляты выращивали на ВА и затем выращивали в течение ночи в TSB. После разбавления бактериальных культур до 0,5 по McFarland в САМНВ в присутствии или в отсутствие муцина (2,5 г/л) 100 мкл переносили в лунки плоскодонного 96-луночного микротитрационного планшета. В Примере 3 бактериальные культуре разбавляли до 0,5 по McFarland в САМНВ с муцином (2,5 г/л) и альгинатом и 100 мкл переносили в лунки плоскодонного 96-луночного микротитрационного планшета.
Планшеты затем заворачивали в парафильм для предупреждения потери влаги и инкубировали при 37°С, позволяя образоваться биопленке. Время инкубирования и условия варьировались, как описано ниже.
После образования биопленки планктонные клетки и надосадочную жидкость удаляли и каждую лунку затем промывали стерильным фосфатно-солевым буферным раствором (PBS). После промывания клетки обрабатывали комбинациями альгинатов и/или антибиотиков в присутствии или в отсутствие муцина (2,5 г/л) в 100 мкл САМНВ.
Планшеты затем заворачивали в парафильм и инкубировали при 37°С с осторожным покачиванием. Время инкубирования и условия варьировались, как описано ниже. Использованные антибиотики и диапазоны концентрации показаны ниже.
Лунки промывали PBS и 100 мкл каждой концентрации последовательного разбавления антибиотика в САМНВ затем добавляли в двух параллелях. Планшеты еще раз заворачивали в парафильм и инкубировали при 37°С с осторожным покачиванием в течение ночи.
Во всех анализах МВЕС конечное количество клеток определяли следующим образом. Лунки промывали PBS, и биопленки ресуспендировали в 100 мкл САМНВ посредством интенсивного пипетирования. Оптическую плотность измеряли при 620 нм (OD620) на микропланшетном ридере (FLUOstar OPTIMA, BMG LABTECH) сразу же (0 ч) и после инкубирования при 37°С в 6 ч и 24 ч.
Значение МВЕС представляют собой такую концентрацию антибиотика, которая ингибирует любой рост бактерий в исследуемом образце. Бактериальный рост измеряют как увеличение поглощения света образцом. Следовательно, снижение значения МВЕС является показателем того, что чувствительность образца к антибиотику возросла (то есть требуется меньшее количество антибиотика, чтобы предупредить бактериальный рост).
Используемые антибиотики и интервалы концентрации
Анализ минимальной концентрации эрадикации биопленки (МВЕС) без муцина.
Pseudomonas aeruginosa PAО1 (АТСС 15682) использовали для определения значений МВЕС без добавления муцина. Руководствовались протоколом МВЕС, который описан выше, но без добавления муцина к ростовой среде. Испытывали два антибиотика: амикацин и тобрамицин.
Анализ прикрепления дрожжей.
Использованный анализ прикрепления представлял собой адаптированный вариант Djordjevic et al., (2002) Appl Environ Microbiol 68: 2950-2958. С.albicans АТСС 90028 и С.dubliniensis CD36т представляли собой штаммы Candida, использованные для анализа прикрепления. Candida выращивали на агаре Сабуро с декстрозой (Lab33, LabM) и ночные бульонные культуры выращивали в жидкой питательной среде Сабуро (Lab9, LabM). После добавления 5 мкл ночной культуры, 95 мкл САМНВ с добавлением муцина (2,5 г/л) и G-фрагментов (с концентрациями 0, 2%, 6% или 10%) добавляли в лунки. Планшеты заворачивали в парафильм и инкубировали при 37°С в течение ночи, позволяя образоваться биопленке.
Планктонные клетки и надосадочную жидкость удаляли из лунок перед промыванием полученных биопленок (3х) стерильной dH2O. Затем планшеты сушили при 56°С в течение 45 мин. Затем каждую лунку окрашивали 150 мкл 1% (об./об.) кристаллического фиолетового (в воде) в течение 45 мин. Планшеты еще раз промывали (3х) dh20, затем добавляли 200 мкл 95% этанола. Через 5 мин 100 мкл из каждой лунки переносили в новый микротитрационный планшет. OD затем измеряли на планшетном ридере при 540 нм.
Рост биопленок для визуализации.
После извлечения с хранения при -80°С бактериальные изоляты выращивали на ВА и затем выращивали в течение ночи в TSB. После разбавления бактериальных культур до 0,5 по McFariand в САМНВ с муцином (2,5 г/л) 100 мкл переносили в лунки плоскодонного 96-луночного микротитрационного планшета. Планшеты затем заворачивали в парафильм для предупреждения потери влаги и инкубировали при 37°С в течение 6 ч, чтобы обеспечить образование биопленки. После образования биопленки планктонные клетки и надосадочную жидкость удаляли и каждую лунку затем промывали стерильным фосфатно-солевым буферным раствором (PBS). После промывания клетки обрабатывали G-фрагментами и муцином (2,5 г/л) в 100 мкл САМНВ. Затем планшеты заворачивали в парафильм и инкубировали при 37°С в течение 24 ч с осторожным покачиванием.
Сканирующая электронная микроскопия (SEM) биопленок Pseudomonas.
Глутаральдегид (2%) добавляли к биопленкам, обработанным G-фрагментами, и фиксировали при комнатной температуре в течение 24 часов. Образцы обезвоживали в последовательности ступенчатых концентраций этанола, сушили в устройстве для сушки в критической точке (Balzers CPD 030, Germany), устанавливали на алюминиевые выступы, покрывали золотом в устройстве для напыления в вакууме (EMscope model AE 1231, UK) и затем рассматривали на сканирующем электронном микроскопе (FEI-Philips XL-20, The Netherlands).
Конфокальная микроскопия неразрушенных биопленок с использованием BODIPY® 630/650-Х SE
Биопленки, обработанные G-фрагментами, промывали стерильной дистиллированной водой и окрашивали красителем BODIPY® 630/650-Х SE (BODIPY® 630/650-Х SE, Invitrogen Ltd), который избирательно окрашивает матричные компоненты (EPS) в биопленках Pseudomonas.
BODIPY® 630/650-Х SE добавляли (100 мкл (10 мкг/мл)) к каждому образцу биопленки. Препарат инкубировали в темноте в течение 1 часа и затем анализировали при помощи CLSM.
Пример 2 - Измерение значений IVJBEC для ночных биопленок Pseudomonas aerug'snosa, предварительно обработанных G-фрагментами
Руководствовались анализом МВЕС, описанным выше. Биопленки генерировали в планшетах в течение ночи без муцина. После промывания PBS биопленки инкубировали с 0, 1, 2 или 6% G-фрагментов и муцином в течение ночи. После промывания PBS клетки инкубировали в течение ночи с антибиотиками (амикацин или окситетрациклин) и без муцина. Результаты графически представлены на Фиг.1 и 2 и приведены в Таблицах 2 и 3 ниже. Как можно видеть, предварительная, в течение ночи, обработка биопленки G-фрагментами вызывала снижения в 6 ч и 24 ч значениях МВЕС для амикацина или окситетрациклина. 6 ч значения МВЕС для амикацина и окситетрациклина уменьшались наполовину с помощью 1% G-фрагментов и составляли одну четвертую с 2 и 6% G-фрагментов. 24 ч значения МВЕС для окситетрациклина уменьшались наполовину всеми концентрациями G-фрагментов. 24 ч значения МВЕС для амикацина уменьшались, хотя было невозможно количественно определить данное уменьшение. Это означает, что предварительная обработка в течение ночи G-фрагментами увеличивает чувствительность Pseudomonas aeruginosa в биопленках к данным антибиотикам.
Таблица 2 - Обобщенные значения МВЕС в 6 часов после воздействия антибиотиков в течение ночи. Биопленки Pseudomonas генерировали в течение ночи. Муцин (2,5 г/л) и G-фрагменты в концентрациях 0, 1, 2 или 6% добавляли к образовавшимся биопленкам. Значения выражали как мкг/мл антибиотика.

Таблица 3 - Обобщенные значения МВЕС в момент времени 24 часа после воздействия антибиотиков в течение ночи. Биопленки Pseudomonas генерировали в течение ночи. Муцин (2,5 г/л) и G-фрагменты в концентрациях 0, 1%, 2% или 6% добавляли к образовавшимся биопленкам. Значения выражали в виде мкг/мл антибиотика.
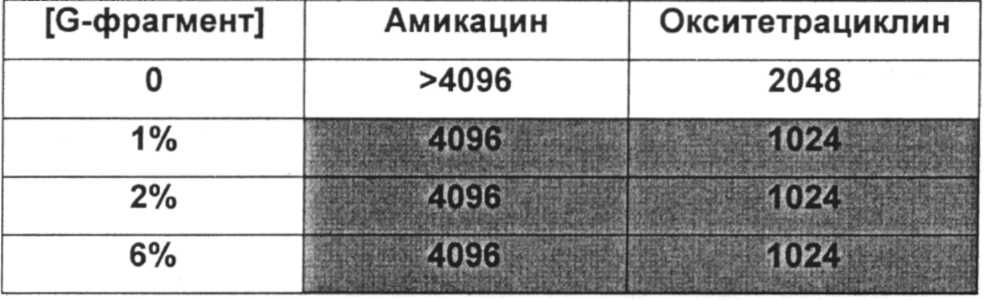
Ключ

Пример 3 - Измерение значений МВЕС для биопленок Pseudomonas aeruginosa, образованных в присутствии G-фрагментов
Руководствовались анализом МВЕС, описанным выше. Биопленки генерировали в планшетах в течение ночи в присутствии муцина и 0, 1,2 или 6% G-фрагментов. После промывания биопленки подвергали воздействию окситетрациклина (без муцина) в течение ночи. Результаты представлены графически на Фиг.3 и приведены в Таблицах 4 и 5 ниже. Как можно видеть, при всех концентрациях испытываемых G-фрагментов, генерирование биопленок в присутствии G-фрагментов наполовину уменьшало 24-часовые значения МВЕС. 6-часовые значения МВЕС уменьшались наполовину, когда использовали 2% и 6% G-фрагментов. 1% G-фрагменты не вызывали уменьшение. Эти данные показывают, что Pseudomonas aeruginosa в биопленках, сгенерированных в присутствии G-фрагментов, более чувствительны к окситетрациклину, чем Pseudomonas aeruginosa в биопленках, сгенерированных в отсутствие G-фрагментов.
Таблица 4 - Обобщение значений МВЕС в 6 ч после воздействия антибиотика в течение ночи. Биопленки Pseudomonas, генерированные с муцином (2,5 г/л) и G-фрагментами в концентрациях 0, 1, 2 или 6%. Значения выражены как мкг/мл антибиотика
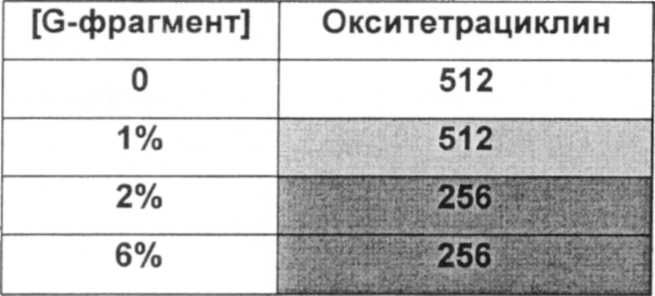
Таблица 5 - Обобщение значений МВЕС в 24 ч после воздействия антибиотика в течение ночи. Биопленки Pseudomonas, генерированные с муцином (2,5 г/л) и G-фрагментами в концентрациях 0, 1, 2 или 6%. Значения выражены в виде мкг/мл антибиотика
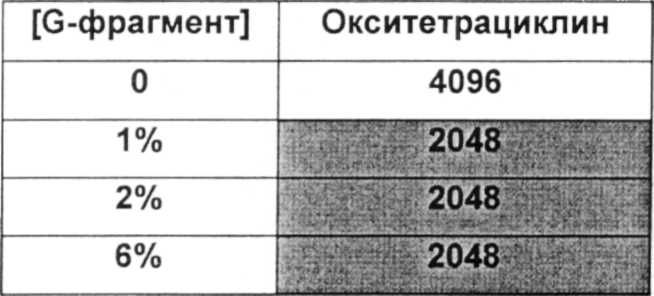
Ключ

Пример 4 - Измерение значений МВЕС для биопленок Pseudomonas aeruginosa, сгенерированных за 6 ч и предварительно обработанных G-фрагментами
Руководствовались анализом МВЕС, описанным выше, с муцином, присутствующим на протяжении всего анализа. Биопленки генерировали в присутствии муцина в течение 6-часового инкубирования, промывали и инкубировали с G-фрагментами и муцином в течение ночи. После промывания с PBS культуры подвергали воздействию антибиотиков (амикацина, тобрамицина, окситетрациклина или комбинации амикацина и окситетрациклина) без муцина. Результаты графически представлены на Фиг.4 и в таблицах 6 и 7. Как можно видеть, предварительная обработка 6 ч биопленок 6% G-фрагментами приводит к тому, что 6 ч значения МВЕС для всех испытываемых антибиотиков равнялись по меньшей мере одной четверти, то есть чувствительность Pseudomonas aeuroginosa в такой биопленке к данным антибиотикам была увеличена по меньшей мере в четыре раза. В действительности 6% G-фрагментов вызывали спад до 1/8 контрольного значения 6 ч значения МВЕС для окситетрациклина. 24-часовые значения МВЕС для амикацина и тобрамицина уменьшались вдвое. 24-часовое значение МВЕС для окситетрациклина и смеси амикацин/окситетрациклин показало отсутствие изменения значений МВЕС.
Таблица 6 - Обобщение значения МВЕС в 6 ч после воздействия антибиотика в течение ночи. Биопленки Pseudomonas генерировали в среде с добавленным муцином в течение 6 ч, подвергали воздействию 0 или 6% G-фрагментов в течение ночи и затем подвергали воздействию антибиотиков. Значения выражали в виде мкг/мл антибиотика

Таблица 7 - Обобщенные значения МВЕС в 24 ч после воздействия антибиотика в течение ночи. Биопленки Pseudomonas генерировали в среде с добавленным муцином в течение 6 ч, подвергали воздействию 0 или 6% G-фрагментов в течение ночи и затем подвергали воздействию антибиотиков. Значения выражены как мкг/мл антибиотика

Ключ

Пример 5 - Измерение значений МВЕС для биопленок Pseudomonas aeruginosa, образованных в течение 6 ч без муцина и предварительно обработанных G-фрагментами без муцина
Протокол Примера 4 повторяли, используя тобрамицин и амикацин, но без добавления муцина. Результаты показаны на Фиг.5. Как можно видеть, в отсутствие муцина G-фрагменты по-прежнему были способны вдвое уменьшать все значения МВЕС кроме 24 ч значений МВЕС для амикацина. Это является показателем того, что муцин не играет значительной роли в эффектах, наблюдаемых в Примерах выше.
Пример 6 - Измерение значений МВЕС для биопленок Pseudomonas aeruginosa, образованных в течение 6 ч и предварительно обработанных разными альгинатными олигомерами
Анализ МВЕС, описанный в Примере 4, повторяли с альтернативным альгинатным олигомером, G-блок (#0802) (молекулярная масса 6400 по сравнению с G-фрагментами CF-5/20, молекулярная масса 2600) и используя тобрамицин и амикацин. Значение МВЕС в 24 ч для амикацина уменьшалось в четыре раза при предварительной обработке биопленки 6% G-блока (#0802). Такая же обработка приводила к уменьшению наполовину 24 ч значения МВЕС для тобрамицина. Эти данные показывают, что еще один альгинатный олигомер может вызывать увеличение чувствительности Pseudomonas aeruginosa РА01 в биопленках к тобрамицину и амикацину.
Пример 7 - Измерение значений МВЕС для 6 ч биопленок, содержащих другие бактерии, предварительно обработанные G-фрагментами
Воздействие G-фрагментов на биопленки Staphylococcus aureus изучали, используя анализ МВЕС, описанный в Примере 4, и окситетрациклин. Как можно видеть на Фиг.7, предварительная обработка биопленок, содержащих S. aureus АТСС 6538, 6% G-фрагментов, вдвое уменьшала значения МВЕС в 6 и 24 ч для окситетрациклина. Как можно видеть на Фиг.8, предварительная обработка биопленок, содержащих раневый изолят «1103» MRSA, 6% G фрагментов, вдвое уменьшала значение МВЕС в 24 ч для тобрамицина. Эти данные показывают, что другие бактерии, обычно обнаруживаемые в биопленках, можно сделать более чувствительными к окситетрациклину и тобрамицину путем предварительной обработки таких биопленок G-фрагментами.
Пример 8 - Влияние G-фрагментов на прикрепление дрожжей в биопленке
Влияние G-фрагментов на прикрепление Candida albicans и Candida dubliniensis в биопленке изучали используя анализ прикрепления, описанный выше. Уменьшение прикрепления обоих видов Candida наблюдалось, когда биопленки, содержащие данные дрожжи, образовывались в присутствии 2% G-фрагментов и муцина по сравнению с одним муцином в качестве контроля (Фиг.9). Эти данные показывают, что G-фрагменты могут влиять на прикрепление дрожжевых клеток в развивающихся биопленках.
Пример 9 - Микроскопический анализ структуры биопленки Pseudomonas и влияния G-фрагментов
Общую структуру биопленок Pseudomonas отслеживали используя сканирующую электронную микроскопию (SEM). На Фиг.10 показано воздействие 2% G-фрагментов на биопленочную структуру. Внеклеточный полисахарид (EPS), покрывающий клеточные поверхности, оказывается нарушенным в присутствии 2% G-фрагментов.
Пример 10 - Микроскопический анализ структуры биопленки Pseudomonas и влияния G-фрагментов
Влияние G-фрагментов на структуру биопленочной матрицы Pseudomonas изучали используя конфокальную микроскопию неразрушенных биопленок, меченных флуоресцентным красителем BODIPY® 630/650-Х SE. Этот краситель избирательно окрашивает компоненты матрицы (EPS) в биопленках Pseudomonas. Едва различимая фрагментация биопленочной матрицы становилась видимой при увеличении концентрации G-фрагментов по сравнению с контролем «только муцин».
Пример 11 - Местная композиция, содержащая альгинатный олигомер
Пример местной композиции (увлажняющий лосьон для ухода за кожей тела), содержащей альгинатный олигомер, получают со следующими ингредиентами.
Пример 12 - Композиция для очищения, содержащая альгинатный олигомер
Пример жидкой композиции для очищения, содержащей альгинатный олигомер, получают со следующими ингредиентами, %:
Пример 13 - Композиция в виде стерильного водного раствора, содержащая, %:
Альгинатный олигомер по изобретению 10
Указанный раствор получают путем смешивания компонентов в соответствии с известными способами изготовления.
Примеры 14-15 - Наборы, содержащие альгинатный олигомер
Пример 14
1 флакон, содержащий стерильный водный раствор альгинатного олигомера по Примеру 13; и
1 флакон, содержащий стерильный водный раствор азитромицина.
Указанные растворы получали путем смешивания компонентов в соответствии с известными способами изготовления.
Пример 15
1 флакон, содержащий стерильный раствор альгинатного олигомера на основе масла по Примеру 12; и
1 флакон, содержащий стерильный водный раствор хлорида бензалкония.
Указанные растворы получали путем смешивания компонентов в соответствии с известными способами изготовления.
Реферат
Группа изобретений относится к биотехнологии. Предложен in vitro способ борьбы с биопленкой, содержащей грамотрицательные бактерии, грамположительные бактерии или дрожжи, включающий приведение указанной биопленки в контакт с альгинатным олигомером. Альгинатный олигомер имеет среднюю молекулярную массу менее 20000 Дальтон и по меньшей мере 80% остатков G, в частности α-L-гулуроновой кислоты. Указанный альгинатный олигомер может быть использован для изготовления лекарственного средства для применения в лечении или предупреждении биопленочной инфекции у субъекта. Для борьбы с биопленкой, в том числе биопленочной инфекцией, указанный альгинатный олигомер также может быть использован в составе набора или очищающей композиции в сочетании с другими компонентами, а также в качестве покрытия абиотических поверхностей. 11 н. и 77 з.п. ф-лы, 10 ил., 7 табл., 15 пр.
Формула
(1) противомикробным агентом; или
(2) еще одним разрушающим биопленку агентом и/или понижающим мукозальную вязкость агентом.
(1) противомикробным агентом;
(2) еще одним разрушающим биопленку агентом и/или понижающим мукозальную вязкость агентом; или
(3) дополнительным терапевтически активным агентом.
(1) противомикробный агент;
(2) еще один разрушающий биопленку агент и/или понижающий мукозальную вязкость агент;
(3) иммуностимулирующий агент;
(4) фактор роста; или
(5) противовоспалительный агент.
(1) альгинатный олигомер, имеющий среднюю молекулярную массу менее 20000 Да и по меньшей мере 80% остатков G; и
(2) по меньшей мере один протеолитический фермент и/или по меньшей мере одну абразивную твердую фазу,
где указанная композиция является стерильным водным раствором или стерильным раствором на основе масла.
Документы, цитированные в отчёте о поиске
Препарат для уменьшения и/или блокирования адгезии патогенных веществ и организмов, применение антиадгезивных углеводов

Комментарии