Пестицидная композиция, способ контроля вредителей, способ контроля эндопаразитов, эктопаразитов или обоих и способ усиления жизнестойкости растений - RU2576316C2
Код документа: RU2576316C2
Чертежи






























































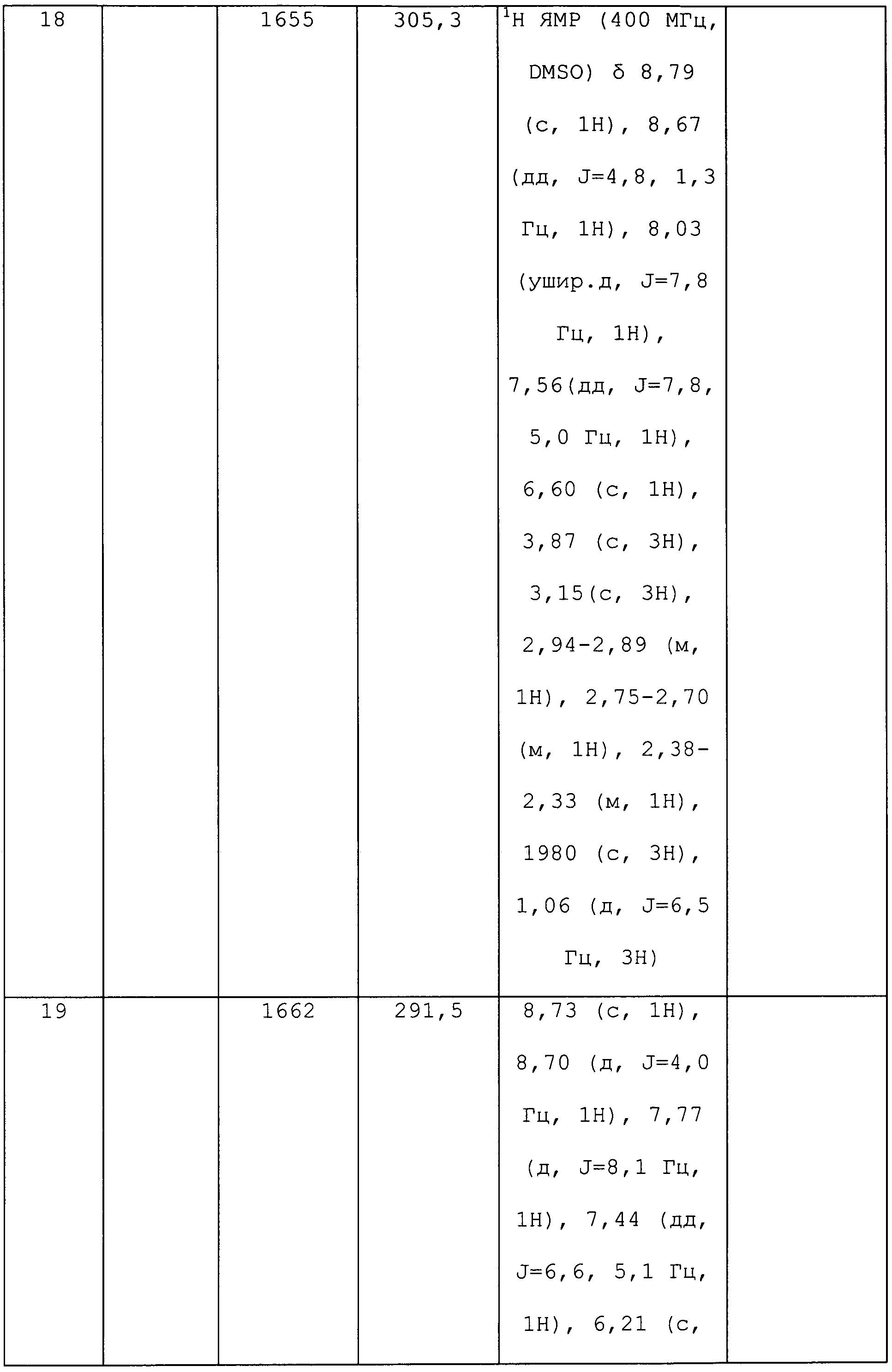









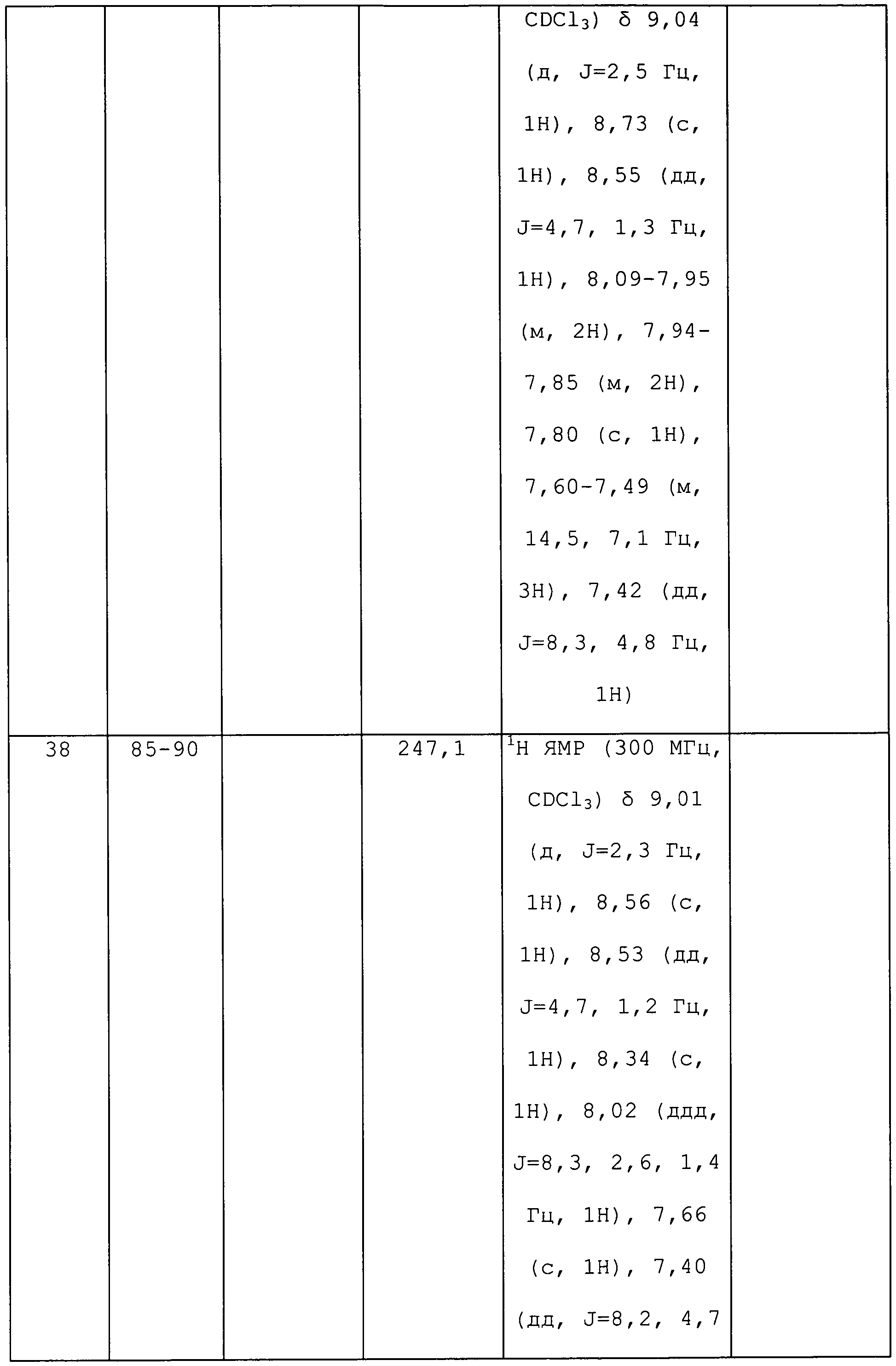























































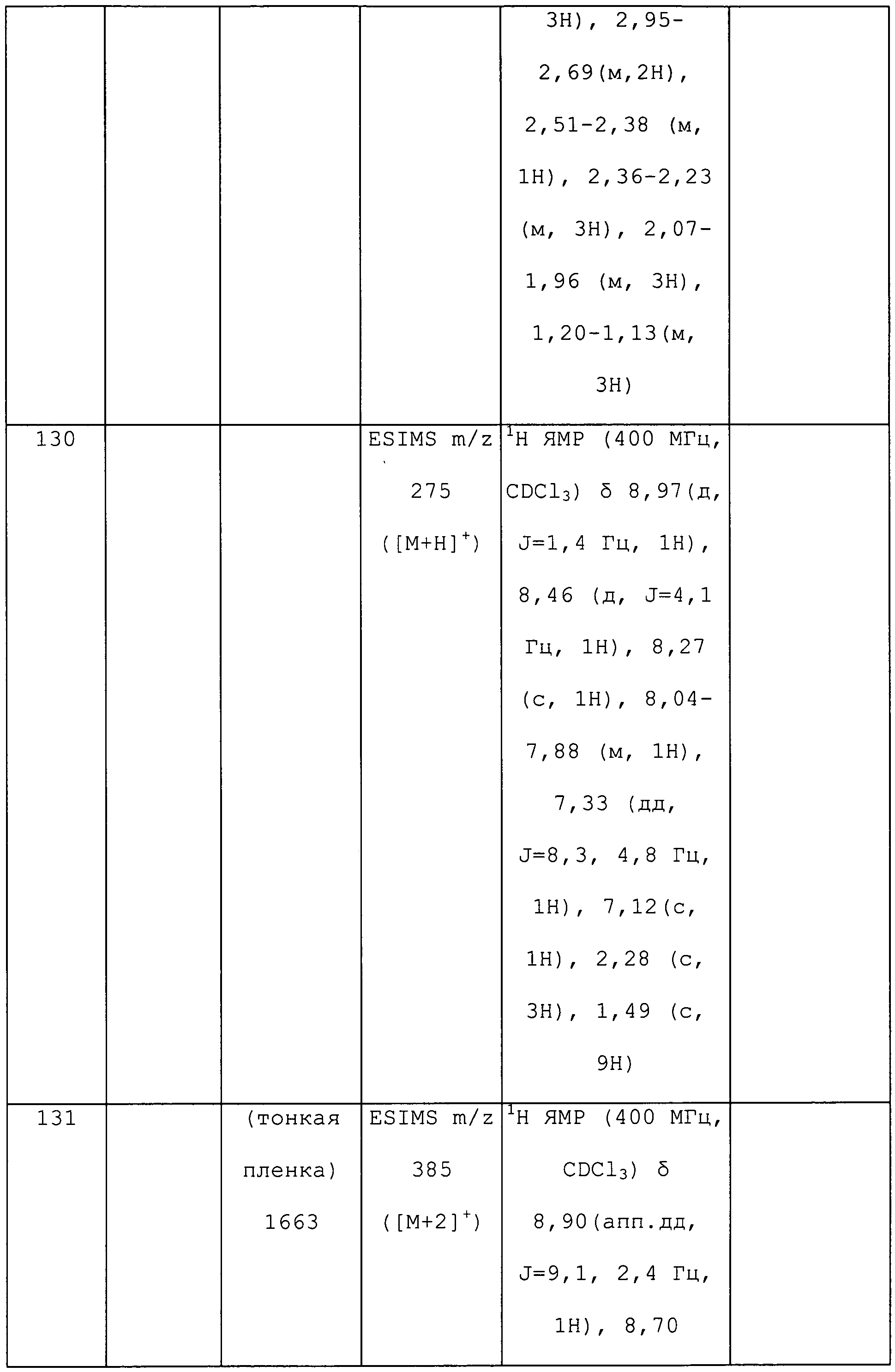


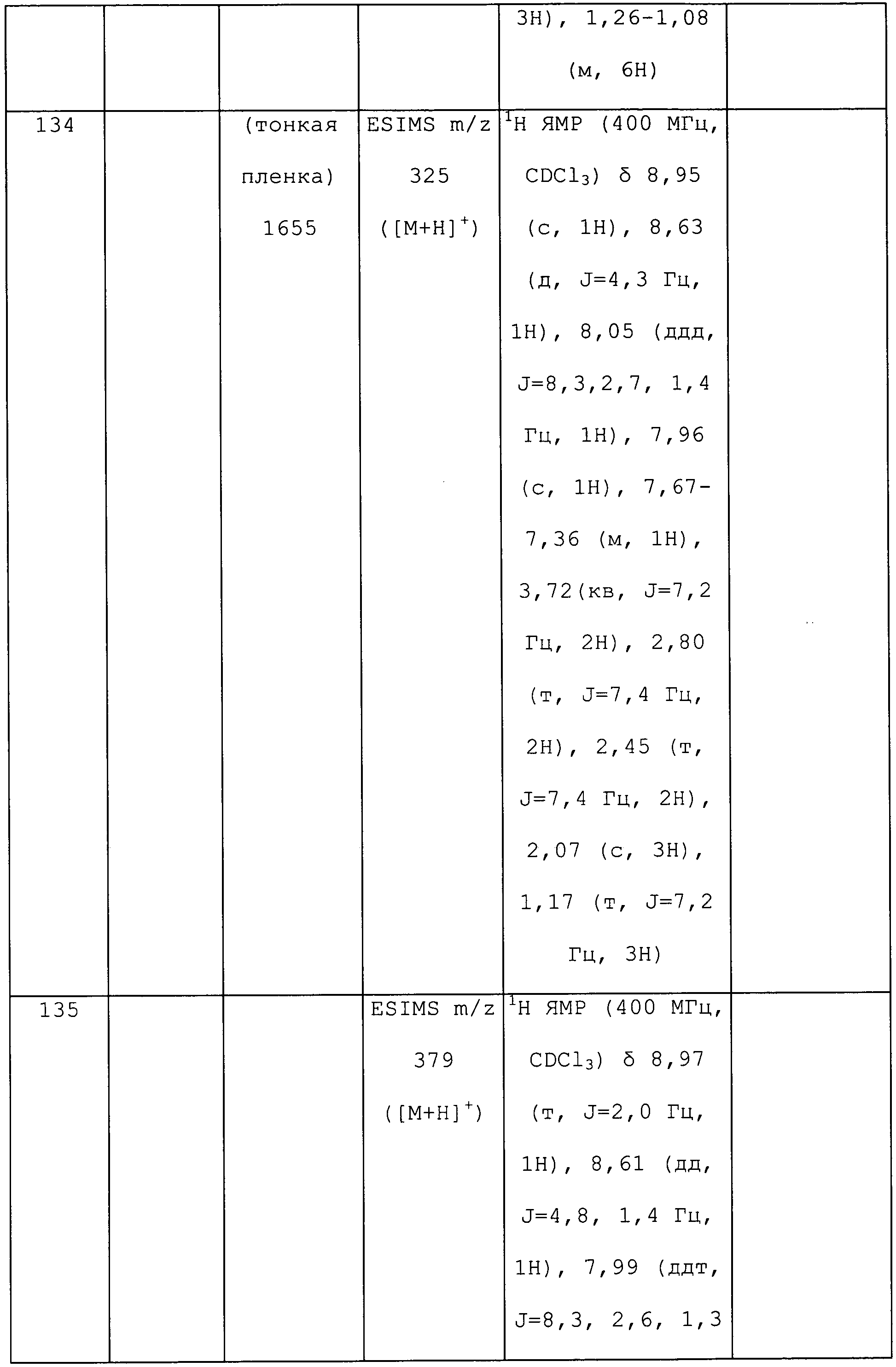










































































































































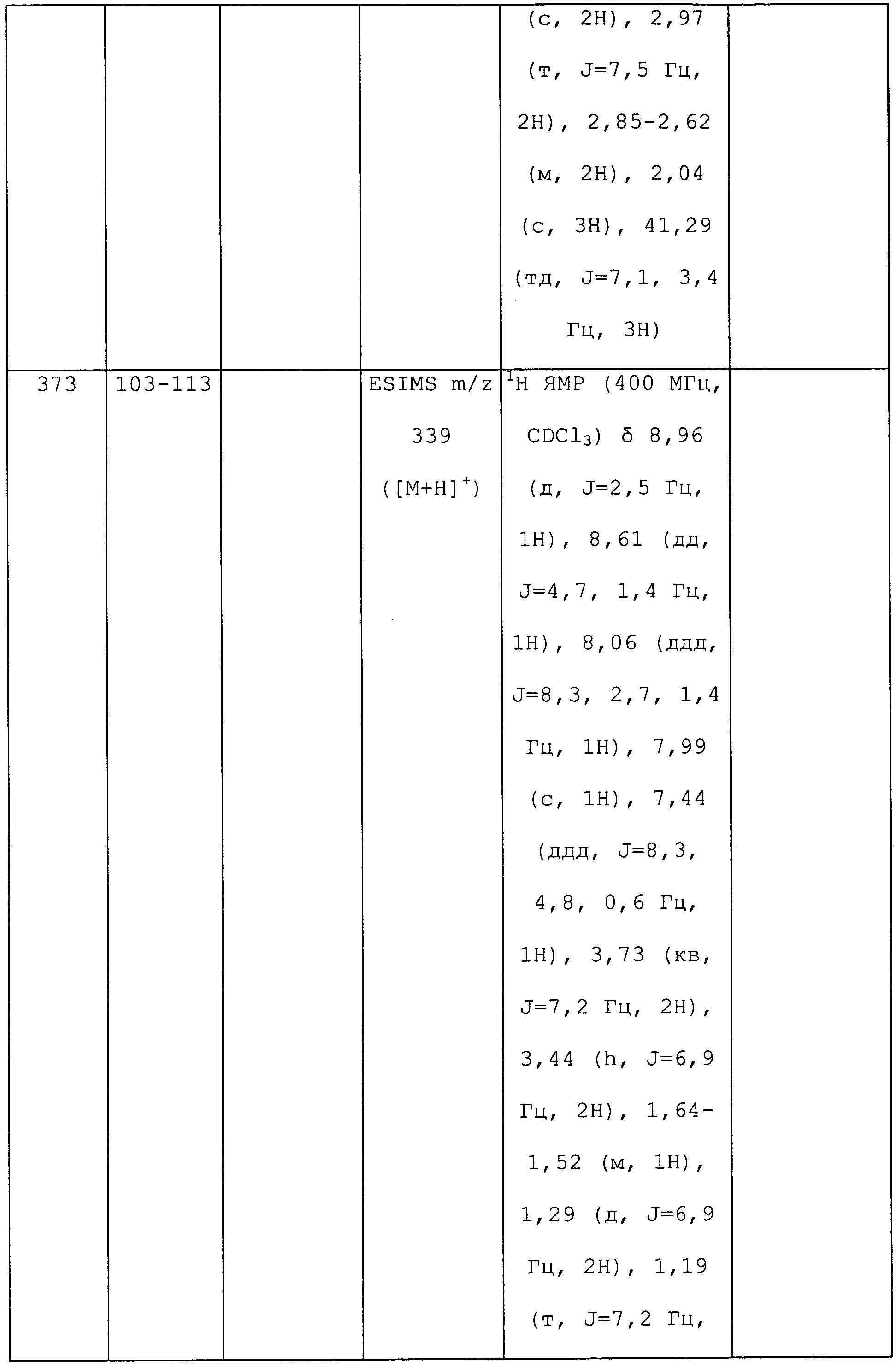












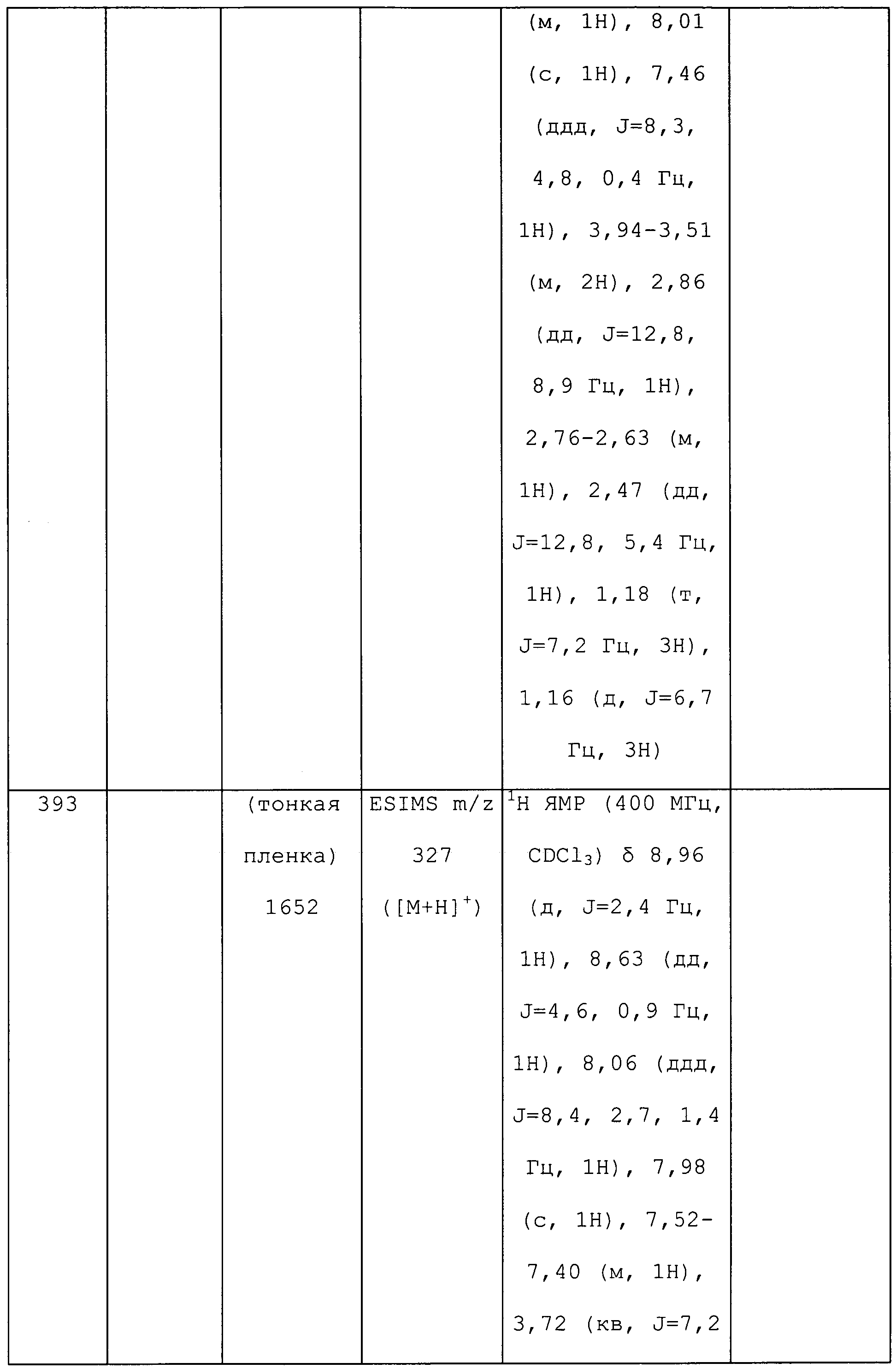



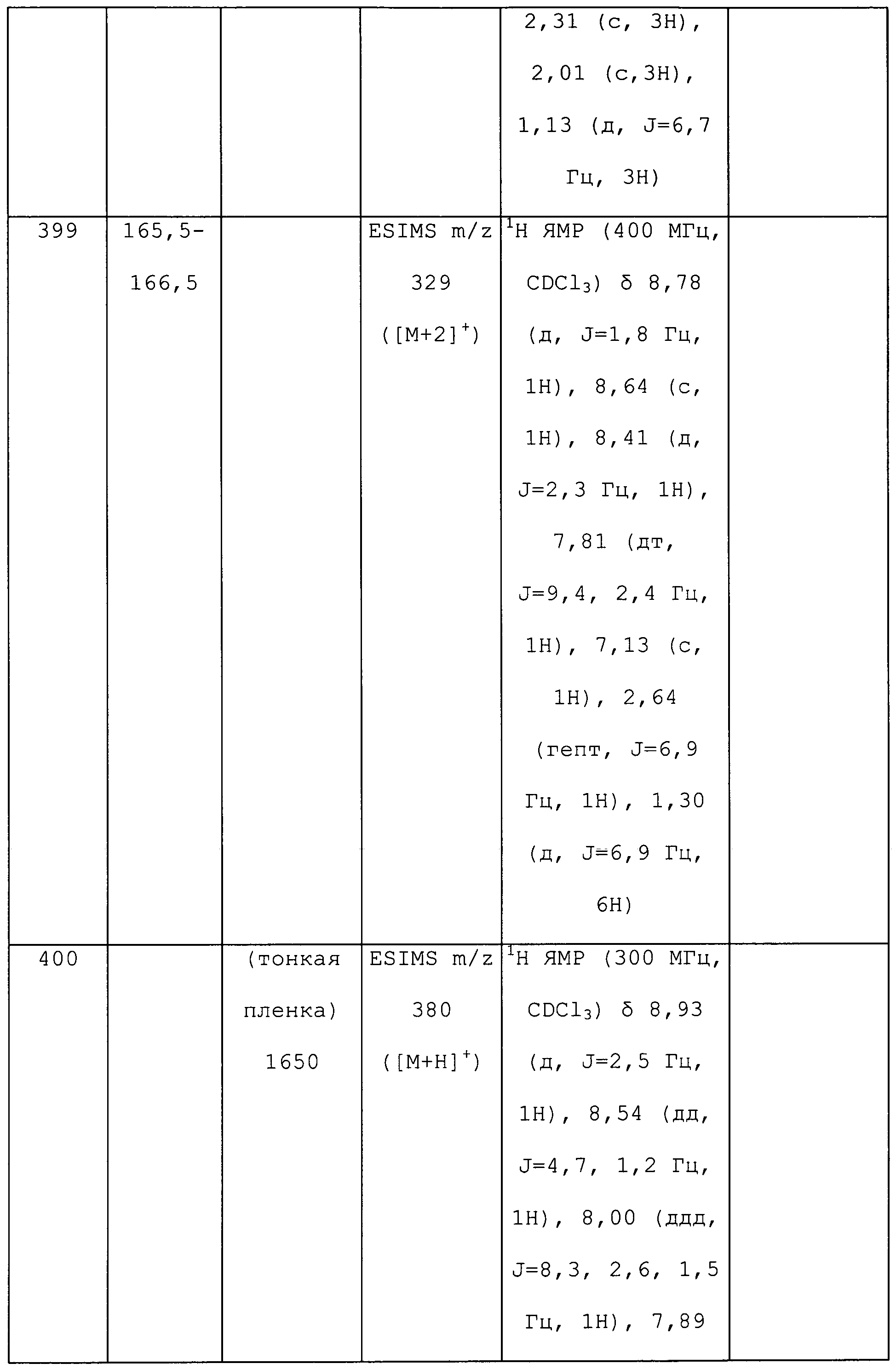




































































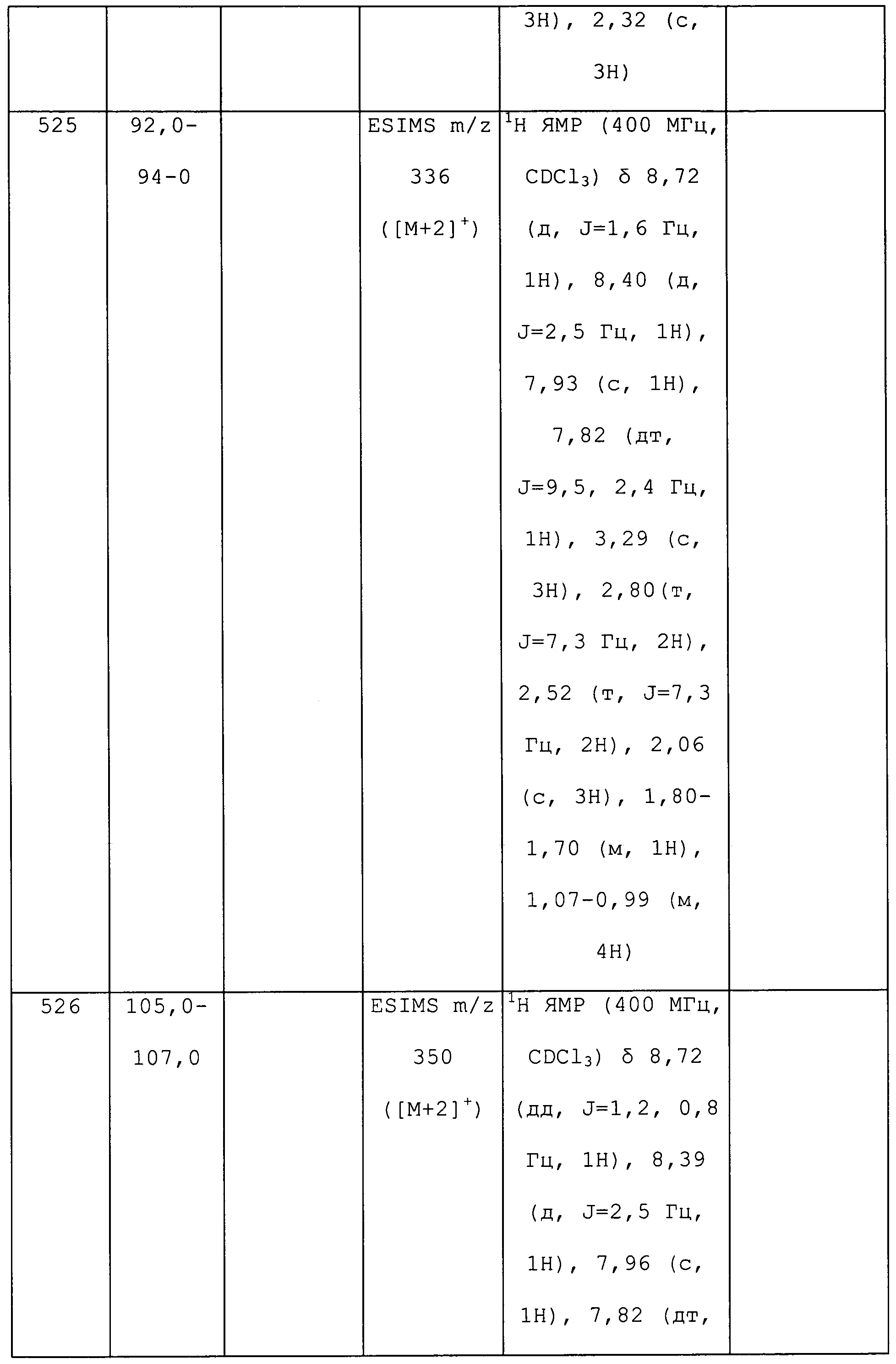






















































Описание
Перекрестная ссылка на ранее поданную заявку по данной заявке испрашивается приоритет в соответствии с предварительной заявкой на выдачу патента США №61/409702, поданной 03 ноября 2010 года, полное содержание которой включено в настоящий документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее раскрытие относится к способам получения молекул, которые применимы в качестве пестицидов (например, акарициды, инсектициды, моллюскоциды и нематоциды), к таким молекулам и к способам применения таких молекул для контроля вредителей.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Каждый год вредители служат причиной смерти миллионов людей во всем мире. Кроме того, существует более десяти тысяч видов вредителей, которые служат причиной убытков в сельском хозяйстве. Каждый год убытки в сельском хозяйстве составляют во всем мире миллиарды долларов США.
Термиты наносят ущерб всем видам частных и общественных сооружений. Каждый год убытки в результате вызванного термитами ущерба составляют во всем мире миллиарды долларов США.
Вредители запасов продовольствия поедают и ухудшают качество запасов продовольствия. Каждый год убытки запасов продовольствия составляют во всем мире миллиарды долларов США, но что более важно, лишают людей необходимой пищи.
Существует острая потребность в новых пестицидах. У некоторых вредителей развивается резистентность к используемым внастоящее время пестицидам. Сотни видов вредителей являются резистентными к одному или нескольким пестицидам. Хорошо известно развитие резистентности к некоторым из более ранних пестицидов, таким как DDT, карбаматы и органофосфаты. Но резистентность выработалась уже даже к некоторым из новых пестицидов.
Таким образом, по многим причинам, включая приведенные выше причины, существует потребность в новых пестицидах.
ОПРЕДЕЛЕНИЯ
Примеры, представленные в определениях, как правило, не являются исчерпывающими и не должны истолковываться как ограничивающие изобретение, раскрытое в настоящем документе. Следует понимать, что заместитель должен соответствовать правилам химического связывания и стерическим ограничениям на совместимость в отношении конкретной молекулы, к которой он присоединен.
«Алкенил» означает ациклический ненасыщенный (по меньшей мере, одна двойная углерод-углеродная связь) разветвленный или неразветвленный заместитель, состоящий из углерода или водорода, например, винил, аллил, бутенил, пентенил и гексенил.
«Алкенилокси» означает алкенил, дополнительно содержащий простую углерод-кислородную связь, например, аллилокси, бутенилокси, пентенилокси, гексенилокси.
«Алкокси» означает алкил, дополнительно содержащий простую углерод-кислородную связь, например, метокси, этокси, пропокси, изопропокси, бутокси, изобутокси и трет-бутокси.
«Алкил» означает ациклический насыщенный разветвленный или неразветвленный заместитель, состоящий из углерода и водорода, например, метил, этил, (C3)алкил, который представляет собой н-пропил и изопропил, (C4)алкил, который представляет собой н-бутил, втор-бутил, изобутил и трет-бутил.
«Алкинил» означает ациклический ненасыщенный (по меньшей мере, одна тройная углерод-углеродная связь) разветвленный или неразветвленный заместитель, состоящий из углерода и водорода, например, этинил, пропаргил, бутинил и пентинил.
«Алкинилокси» означает алкинил, дополнительно содержащий простую углерод-кислородную связь, например, пентинилокси, гексинилокси, гептинилокси и октинилокси.
«Арил» означает циклический ароматический заместитель, состоящий из водорода и углерода, например, фенил, нафтил и бифенил.
«(Cx-Cy)», где подстрочные индексы «x» и «y» представляют собой целые числа, такие как 1, 2 или 3, означает диапазон атомов углерода для каждого отдельного заместителя, например, (C1-C4)алкил означает метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил и трет-бутил.
«Циклоалкенил» означает моноциклический или полициклический ненасыщенный (по меньшей мере, одна двойная углерод-углеродная связь) заместитель, состоящий из углерода и водорода, например, циклобутенил, циклопентенил, циклогексенил, норборненил, бицикло[2.2.2]октенил, тетрагидронафтил, гексагидронафтил и октагидронафтил.
«Циклоалкенилокси» означает циклоалкенил, дополнительно содержащий простую углерод-кислородную связь, например, циклобутенилокси, циклопентенилокси, норборненилокси и бицикло[2.2.2]октенилокси.
«Циклоалкил» означает моноциклический или полициклический насыщенный заместитель, состоящий из углерода и водорода, например, циклопропил, циклобутил, циклопентил, норборнил, бицикло[2.2.2]октил и декагидронафтил.
«Циклоалкокси» означает циклоалкил, дополнительно содержащий простую углерод-кислородную связь, например, циклопропилокси, циклобутилокси, циклопентилокси, норборнилокси и бицикло[2.2.2]октилокси.
«Галоген» означает фтор, хлор, бром и йод.
«Галогеналкокси» означает алкокси, дополнительно содержащий от одного до максимально возможного числа одинаковых или различных атомов галогена, например, фторметокси, трифторметокси, 2,2-дифторпропокси, хлорметокси, трихлорметокси, 1,1,2,2-тетрафторэтокси и пентафторэтокси.
«Галогеналкил» означает алкил, дополнительно содержащий от одного до максимально возможного числа одинаковых или различных атомов галогена, например, фторметил, трифторметил, 2,2-дифторпропил, хлорметил, трихлорметил и 1,1,2,2-тетрафторэтил.
«Гетероциклил» означает циклический заместитель, который может быть полностью насыщенным, частично ненасыщенным или полностью ненасыщенным, где циклическая структура содержит, по меньшей мере, один атом углерода и, по меньшей мере, один гетероатом, причем указанный гетероатом представляет собой азот, серу или кислород. В случае серы этот атом может быть в других степенях окисления, таких как сульфоксид и сульфон. Примеры ароматических гетероциклилов включают без ограничения бензофуранил, бензоизотиазолил, бензоизоксазолил, бензоксазолил, бензотиенил, бензотиазолил, циннолинил, фуранил, имидазолил, индазолил, индолил, изоиндолил, изохинолинил, изотиазолил, изоксазолил, оксадиазолил, оксазолинил, оксазолил, фталазинил, пиразинил, пиразолинил, пиразолил, пиридазинил, пиридил, пиримидинил, пирролил, хиназолинил, хинолинил, хиноксалинил, тетразолил, тиазолинил, тиазолил, тиенил, триазинил и триазолил. Примеры полностью насыщенных гетероциклилов включают без ограничения пиперазинил, пиперидинил, морфолинил, пирролидинил, оксетанил, тетрагидрофуранил, тетрагидротиенил и тетрагидропиранил. Примеры частично ненасыщенных гетероциклилов включают без ограничения 1,2,3,4-тетрагидрохинолинил, 4,5-дигидрооксазолил, 4,5-дигидро-1H-пиразолил, 4,5-дигидроизоксазолил и 2,3-дигидро-[1,3,4]-оксадиазолил. Дополнительные примеры включают следующие:

ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
В настоящем документе раскрыты молекулы, характеризующиеся следующей формулой («формула один»):
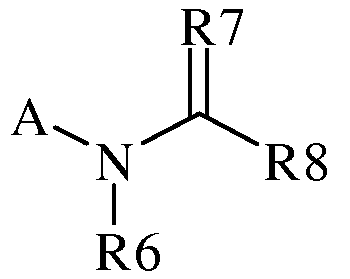
где
(a) A представляет собой либо

(b) R1 представляет собой H, F, Cl, Br, I, CN, NO2, замещенный или незамещенный C1-С6алкил, замещенный или незамещенный C2-С6алкенил, замещенный или незамещенный C1-С6алкокси, замещенный или незамещенный C2-С6алкенилокси, замещенный или незамещенный C3-С10циклоалкил, замещенный или незамещенный C3-С10циклоалкенил, замещенный или незамещенный C6-С20арил, замещенный или незамещенный C1-С20гетероциклил, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, SR9, S(O)nOR9, S(O)nN(R9)2 или R9S(O)nR9,
причем каждый указанный R1, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-С6алкила, C2-С6алкенила, C1-С6галогеналкила, C2-С6галогеналкенила, C1-С6галогеналкилокси, C2-С6галогеналкенилокси, C3-С10циклоалкила, C3-С10циклоалкенила, C3-С10галогенциклоалкила, C3-С10галогенциклоалкенила, OR9, S(O)nOR9, C6-С20арила или C1-С20гетероциклила (каждый из которых, возможный к замещению, может быть необязательно замещен R9);
(c) R2 представляет собой H, F, Cl, Br, I, CN, NO2, замещенный или незамещенный C1-С6алкил, замещенный или незамещенный C2-С6алкенил, замещенный или незамещенный C1-С6алкокси, замещенный или незамещенный C2-С6алкенилокси, замещенный или незамещенный C3-С10циклоалкил, замещенный или незамещенный C3-С10циклоалкенил, замещенный или незамещенный C6-С20арил, замещенный или незамещенный C1-С20гетероциклил, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, SR9, S(O)nOR9 или R9S(O)nR9,
причем каждый указанный R2, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-С6алкила, C2-С6алкенила, C1-С6галогеналкила, C2-С6галогеналкенила, C1-С6галогеналкилокси, C2-С6галогеналкенилокси, C3-С10циклоалкила, C3-С10циклоалкенила, C3-С10галогенциклоалкила, C3-С10галогенциклоалкенила, OR9, S(O)nOR9, C6-С20арила или C1-С20гетероциклила (каждый из которых, возможный к замещению, может быть необязательно замещен R9);
(d) R3 представляет собой H, F, Cl, Br, I, CN, NO2, замещенный или незамещенный C1-С6алкил, замещенный или незамещенный C2-С6алкенил, замещенный или незамещенный C1-С6алкокси, замещенный или незамещенный C2-С6алкенилокси, замещенный или незамещенный C3-С10циклоалкил, замещенный или незамещенный C3-С10циклоалкенил, замещенный или незамещенный C6-С20арил, замещенный или незамещенный C1-С20гетероциклил, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, SR9, S(O)nOR9 или R9S(O)nR9,
причем каждый указанный R3, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-С6алкила, C2-С6алкенила, C1-С6галогеналкила, C2-С6галогеналкенила, C1-С6галогеналкилокси, C2-С6галогеналкенилокси, C3-С10циклоалкила, C3-С10циклоалкенила, C3-С10галогенциклоалкила, C3-С10галогенциклоалкенила, OR9, S(O)nOR9, C6-С20арила или C1-С20гетероциклила (каждый из которых, возможный к замещению, может быть необязательно замещен R9);
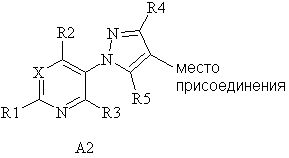
(e) если A представляет собой
(1) A1, то A1 представляет собой либо
(a) A11

где R4 представляет собой H, NO2, замещенный или незамещенный C1-С6алкил, замещенный или незамещенный C2-С6алкенил, замещенный или незамещенный C1-С6алкокси, замещенный или незамещенный C3-С10циклоалкил, замещенный или незамещенный C3-С10циклоалкенил, замещенный или незамещенный C6-С20арил, замещенный или незамещенный C1-С20гетероциклил, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, S(O)nOR9 или R9S(O)nR9,
причем каждый указанный R4, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-С6алкила, C2-С6алкенила, C1-С6галогеналкила, C2-С6галогеналкенила, C1-С6галогеналкилокси, C2-С6галогеналкенилокси, C3-С10циклоалкила, C3-С10циклоалкенила, C3-С10галогенциклоалкила, C3-С10галогенциклоалкенила, OR9, S(O)nOR9, C6-С20арила или C1-С20гетероциклила (каждый из которых, возможный к замещению, может быть необязательно замещен R9), либо
(b) A12
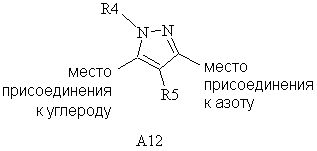
где R4 представляет собой C1-С6алкил,
(2) A2, то R4 представляет собой H, F, Cl, Br, I, CN, NO2, замещенный или незамещенный C1-С6алкил, замещенный или незамещенный C2-С6алкенил, замещенный или незамещенный C1-С6алкокси, замещенный или незамещенный C2-С6алкенилокси, замещенный или незамещенный C3-С10циклоалкил, замещенный или незамещенный C3-С10циклоалкенил, замещенный или незамещенный C6-С20арил, замещенный или незамещенный C1-С20гетероциклил, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, SR9, S(O)nOR9 или R9S(O)nR9,
причем каждый указанный R4, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-С6алкила, C2-С6алкенила, C1-С6галогеналкила, C2-С6галогеналкенила, C1-С6галогеналкилокси, C2-С6галогеналкенилокси, C3-С10циклоалкила, C3-С10циклоалкенила, C3-С10галогенциклоалкила, C3-С10галогенциклоалкенила, OR9, S(O)nOR9, C6-С20арила или C1-С20гетероциклила (каждый из которых, возможный к замещению, может быть необязательно замещен R9);
(f) R5 представляет собой H, F, Cl, Br, I, CN, NO2, замещенный или незамещенный C1-С6алкил, замещенный или незамещенный C2-С6алкенил, замещенный или незамещенный C1-С6алкокси, замещенный или незамещенный C2-С6алкенилокси, замещенный или незамещенный C3-С10циклоалкил, замещенный или незамещенный C3-С10циклоалкенил, замещенный или незамещенный C6-С20арил, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, SR9, S(O)nOR9 или R9S(O)nR9,
причем каждый указанный R5, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-С6алкила, C2-С6алкенила, C1-С6галогеналкила, C2-С6галогеналкенила, C1-С6галогеналкилокси, C2-С6галогеналкенилокси, C3-С10циклоалкила, C3-С10циклоалкенила, C3-С10галогенциклоалкила, C3-С10галогенциклоалкенила, OR9, S(O)nOR9 или C6-С20арила (каждый из которых, возможный к замещению, может быть необязательно замещен R9);
(g)
(1) если A представляет собой A1, то R6 представляет собой замещенный или незамещенный C1-С6алкил, замещенный или незамещенный C2-С6алкенил, замещенный или незамещенный C1-С6алкокси, замещенный или незамещенный C2-С6алкенилокси, замещенный или незамещенный C3-С10циклоалкил, замещенный или незамещенный C3-С10циклоалкенил, замещенный или незамещенный C6-С20арил, замещенный или незамещенный C1-С20гетероциклил, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, SR9, S(O)nOR9, R9S(O)nR9, C1-С6алкилС6-С20арил (где алкил и арил независимо могут быть замещенными или незамещенными), C(=X2)R9, C(=X1)X2R9, R9X2C(=X1)R9, R9X2R9, C(=O)(C1-С6алкил)S(O)n(C1-С6алкил), C(=O)(C1-С6алкил)C(=O)O(C1-С6алкил), (C1-С6алкил)OC(=O)(C6-С20арил), (C1-С6алкил)OC(=O)(C1-С6алкил), C1-С6алкил-(C3-С10циклогалогеналкил) или (C1-С6алкенил)C(=O)O(C1-С6алкил) или R9X2C(=X1)X2R9,
причем каждый указанный R6, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-С6алкила, C2-С6алкенила, C1-С6галогеналкила, C2-С6галогеналкенила, C1-С6галогеналкилокси, C2-С6галогеналкенилокси, C3-С10циклоалкила, C3-С10циклоалкенила, C3-С10галогенциклоалкила, C3-С10галогенциклоалкенила, OR9, S(O)nOR9, C6-С20арила или C1-С20гетероциклила, R9арила (каждый из которых, возможный к замещению, может быть необязательно замещен R9),
необязательно R6 и R8 могут быть соединены в циклическую структуру, причем такая циклическая структура, соединяющая R6 и R8, может необязательно содержать один или несколько гетероатомов, выбранных из O, S или N, и
(2) если A представляет собой A2, то R6 представляет собой H, замещенный или незамещенный C1-С6алкил, замещенный или незамещенный C2-С6алкенил, замещенный или незамещенный C1-С6алкокси, замещенный или незамещенный C2-С6алкенилокси, замещенный или незамещенный C3-С10циклоалкил, замещенный или незамещенный C3-С10циклоалкенил, замещенный или незамещенный C6-С20арил, замещенный или незамещенный C1-С20гетероциклил, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, SR9, S(O)nOR9, R9S(O)nR9, C1-С6алкил C6-С20арил (причем алкил и арил независимо могут быть замещенными или незамещенными), C(=X2)R9, C(=X1)X2R9, R9X2C(=X1)R9, R9X2R9, C(=O)(C1-С6алкил)S(O)n(C1-С6алкил), C(=O)(C1-С6алкил)C(=O)O(C1-С6алкил), (C1-С6алкил)OC(=O)(C6-С20арил), (C1-С6алкил)OC(=O)(C1-С6алкил), C1-С6алкил-(C3-С10циклогалогеналкил) или (C1-С6алкенил)C(=O)O(C1-С6алкил) или R9X2C(=X1)X2R9,
причем каждый указанный R6, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-С6алкила, C2-С6алкенила, C1-С6галогеналкила, C2-С6галогеналкенила, C1-С6галогеналкилокси, C2-С6галогеналкенилокси, C3-С10циклоалкила, C3-С10циклоалкенила, C3-С10галогенциклоалкила, C3-С10галогенциклоалкенила, OR9, S(O)nOR9, C6-С20арила или C1-С20гетероциклила, R9арила, (каждый из которых, возможный к замещению, может быть необязательно замещен R9),
необязательно R6 и R8 могут быть соединены в циклическую структуру, причем такая циклическая структура, соединяющая R6 и R8, может необязательно содержать один или несколько гетероатомов, выбранных из O, S, или N;
(h) R7 представляет собой O, S, NR9 или NOR9;
(i) R8 представляет собой замещенный или незамещенный C1-С6алкил, замещенный или незамещенный C2-С6алкенил, замещенный или незамещенный C1-С6алкокси, замещенный или незамещенный C2-С6алкенилокси, замещенный или незамещенный C3-С10циклоалкил, замещенный или незамещенный C3-С10циклоалкенил, замещенный или незамещенный C6-С20арил, замещенный или незамещенный C1-С20гетероциклил OR9, OR9S(O)nR9, C(=X1)R9, C(=X1)OR9, R9C(=X1)OR9, R9X2C(=X1)R9X2R9, C(=X1)N(R9)2, N(R9)2, N(R9)(R9S(O)nR9), N(R9)C(=X1)R9, SR9, S(O)nOR9, R9S(O)nR9 или R9S(O)n(NZ)R9,
причем каждый указанный R8, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-С6алкила, C2-С6алкенила, C1-С6галогеналкила, C2-С6галогеналкенила, C1-С6галогеналкилокси, C2-С6галогеналкенилокси, C3-С10циклоалкила, C3-С10циклоалкенила, C3-С10галогенциклоалкила, C3-С10галогенциклоалкенила, N(R9)S(O)nR9, оксо, OR9, S(O)nOR9, R9S(O)nR9, S(O)nR9, C6-С20арила или C1-С20гетероциклила (каждый из которых, возможный к замещению, может быть необязательно замещен R9);
(j) R9 (каждый независимо) представляет собой H, CN, замещенный или незамещенный C1-С6алкил, замещенный или незамещенный C2-С6алкенил, замещенный или незамещенный C1-С6алкокси, замещенный или незамещенный C2-С6алкенилокси, замещенный или незамещенный C3-С10циклоалкил, замещенный или незамещенный C3-С10циклоалкенил, замещенный или незамещенный C6-С20арил, замещенный или незамещенный C1-С20гетероциклил, S(O)nC1-С6алкил, N(C1-С6алкил)2,
причем каждый указанный R9, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-С6алкила, C2-С6алкенила, C1-С6галогеналкила, C2-С6галогеналкенила, C1-С6галогеналкилокси, C2-С6галогеналкенилокси, C3-С10циклоалкила, C3-С10циклоалкенила, C3-С10галогенциклоалкила, C3-С10галогенциклоалкенила, OC1-С6алкила, OC1-С6галогеналкила, S(O)nC1-С6алкила, S(O)nOC1-С6алкила, C6-С20арила или C1-С20гетероциклила;
(k) n равно 0, 1 или 2;
(l) X представляет собой N или CRn1, где Rn1 представляет собой H, F, Cl, Br, I, CN, NO2, замещенный или незамещенный C1-С6алкил, замещенный или незамещенный C2-С6алкенил, замещенный или незамещенный C1-С6алкокси, замещенный или незамещенный C2-С6алкенилокси, замещенный или незамещенный C3-С10циклоалкил, замещенный или незамещенный C3-С10циклоалкенил, замещенный или незамещенный C6-С20арил, замещенный или незамещенный C1-С20гетероциклил, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, SR9, S(O)nR9, S(O)nOR9 или R9S(O)nR9,
причем каждый указанный Rn1, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-С6алкила, C2-С6алкенила, C1-С6галогеналкила, C2-С6галогеналкенила, C1-С6галогеналкилокси, C2-С6галогеналкенилокси, C3-С10циклоалкила, C3-С10циклоалкенила, C3-С10галогенциклоалкила, C3-С10галогенциклоалкенила, OR9, S(O)nOR9, C6-С20арила или C1-С20гетероциклила (каждый из которых, возможный к замещению, может быть необязательно замещен R9);
(m) X1 (каждый независимо) представляет собой O или S;
(n) X2 (каждый независимо) представляет собой O, S, =NR9 или =NOR9; и
(o) Z представляет собой CN, NO2, C1-С6алкил(R9), C(=X1)N(R9)2; и
(p) при следующих условиях:
(1) что R6 и R8 не могут оба представлять собой C(=O)CH3,
(2) что если A1 представляет собой A11, то R6 и R8 вместе не образуют конденсированные кольцевые системы,
(3) что R6 и R8 не соединены в циклическую структуру только с -CH2-,
(4) что если A представляет собой A2, то R5 не представляет собой C(=O)OH,
(5) что если A представляет собой A2, и R6 представляет собой H, то R8 не представляет собой -(C1-С6алкил)-O-(замещенный арил), и
(6) что если A представляет собой A2, то R6 не представляет собой -(С1алкил)(замещенный арил).
Согласно другому варианту осуществления настоящего изобретения, A представляет собой A1.
Согласно другому варианту осуществления настоящего изобретения, A представляет собой A2.
Согласно другому варианту осуществления настоящего изобретения, R1 представляет собой H.
Согласно другому варианту осуществления настоящего изобретения, R2 представляет собой H.
Согласно другому варианту осуществления настоящего изобретения, R3 выбирают из H или замещенного или незамещенного C1-С6алкила.
Согласно другому варианту осуществления настоящего изобретения, R3 выбирают из H или CH3.
Согласно другому варианту осуществления настоящего изобретения, если A представляет собой A1, то A1 представляет собой A11.
Согласно другому варианту осуществления настоящего изобретения, если A представляет собой A1, и A1 представляет собой A11, то R4 выбирают из H, замещенного или незамещенного C1-С6алкила или замещенного или незамещенного C6-С20арила.
Согласно другому варианту осуществления настоящего изобретения, если A представляет собой A1, и A1 представляет собой A11, то R4 выбирают из CH3, CH(CH3)2 или фенила.
Согласно другому варианту осуществления настоящего изобретения, если A представляет собой A1, и A1 представляет собой A12, то R4 представляет собой CH3.
Согласно другому варианту осуществления настоящего изобретения, если A представляет собой A2, то R4 выбирают из H, замещенного или незамещенного C1-С6алкила, замещенного или незамещенного C2-С6алкенила, замещенного или незамещенного C3-С10циклоалкила, замещенного или незамещенного C6-С20арила, причем каждый указанный R4, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br или I.
Согласно другому варианту осуществления настоящего изобретения, если A представляет собой A2, то R4 представляет собой H или C1-С6алкил.
Согласно другому варианту осуществления настоящего изобретения, если A представляет собой A2, то R4 представляет собой H, CH3, CH2CH3, CH=CH2, циклопропил, CH2Cl, CF3 или фенил.
Согласно другому варианту осуществления настоящего изобретения, если A представляет собой A2, то R4 представляет собой Cl.
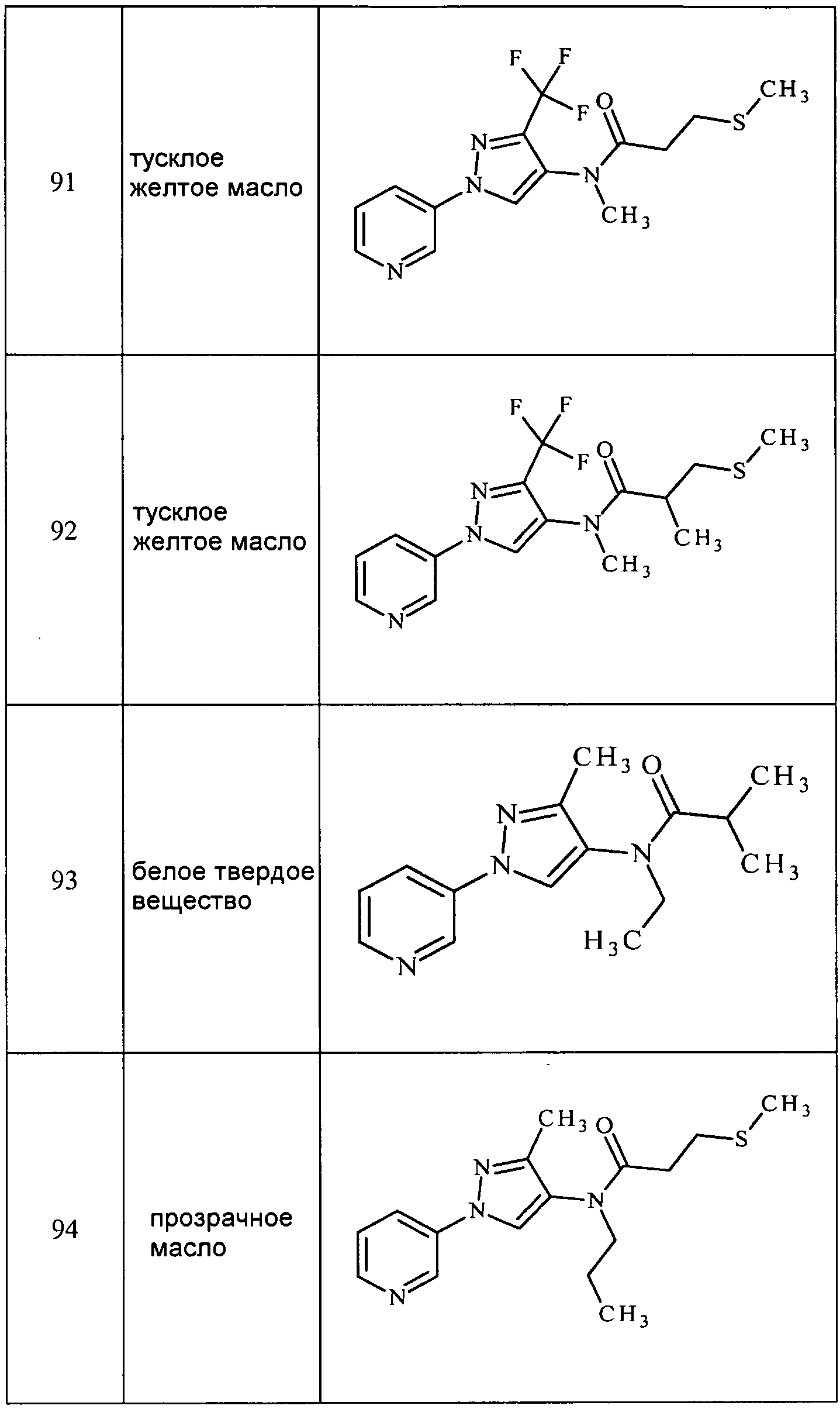
Согласно другому варианту осуществления настоящего изобретения, R5 представляет собой H, F, Cl, Br, I, замещенный или незамещенный C1-С6алкил или замещенный или незамещенный C1-С6алкокси.
Согласно другому варианту осуществления настоящего изобретения, R5 представляет собой H, OCH2CH3, F, Cl, Br или CH3.
Согласно другому варианту осуществления настоящего изобретения, если A представляет собой A1, то R6 представляет собой замещенный или незамещенный C1-С6алкил.
Согласно другому варианту осуществления настоящего изобретения, если A представляет собой A2, то R6 выбирают из замещенного или незамещенного C1-С6алкила, замещенного или незамещенного C2-С6алкенила, замещенного или незамещенного C3-С10циклоалкила, C(=X1)R9, C(=X1)X2R9, R9X2R9, C(=O)(C1-С6алкил)S(O)n(C1-С6алкил), (C1-С6алкил)OC(=O)(C6-С20арил), (C1-С6алкил)OC(=O)(C1-С6алкил) или R9X2C(=X1)X2R9.
Согласно другому варианту осуществления настоящего изобретения, если A представляет собой A2, то R6 и R8 соединены в циклическую структуру, причем такая циклическая структура, соединяющая R6 и R8, может необязательно содержать один или несколько гетероатомов, выбранных из O, S или N.
Согласно другому варианту осуществления настоящего изобретения, R6 представляет собой C1-С6алкил или C1-С6алкилфенил.
Согласно другому варианту осуществления настоящего изобретения, R6 представляет собой H, CH3, CH2CH3, CH2CH2CH3, CH(CH3)2, СН2фенил, CH2CH(CH3)2, СН2циклопропил, C(=O)CH2CH2SCH3, C(=O)OC(CH3)3, CH2CH=CH2, C(=O)OCH2CH3, C(=O)CH(CH3)CH2SCH3, циклопропил, CD3, CH2OC(=O)фенил, C(=O)CH3, C(=O)CH(CH3)2, CH2OC(=O)CH(CH3)2, CH2OC(=O)CH3, C(=O)фенил, CH2OCH3, CH2OC(=O)CH2OCH2CH3, CH2CH2OCH3, CH2OC(=O)OCH(CH3)2, CH2CH2OCH2OCH3, CH2CH2OCH3, CH2CH2OC(=O)CH3, CH2CN.
Согласно другому варианту осуществления настоящего изобретения, R6 представляет собой метил или этил.
Согласно другому варианту осуществления настоящего изобретения, R7 представляет собой O или S.
Согласно другому варианту осуществления настоящего изобретения, R8 выбирают из замещенного или незамещенного C1-С6алкила, замещенного или незамещенного C2-С6алкенила, замещенного или незамещенного C3-С10циклоалкила, замещенного или незамещенного C6-С20арила, замещенного или незамещенного C1-С20гетероциклила, R9C(=X1)OR9, SR9, S(O)nOR9, R9S(O)nR9 или R9S(O)n(NZ)R9.
Согласно другому варианту осуществления настоящего изобретения, R8 представляет собой CH(CH3)CH2SCH3, CH(CH3)2, C(CH3)2CH2SCH3, CH2CH2SCH3, CH2CF3, CH2CH2C(=O)OCH3, N(H)(CH2CH2SCH3), OCH2CH2SCH3, CH(CH2SCH3)(СН2фенил), тиазолил, оксазолил, изотиазолил, замещенный фуранил, CH3, C(CH3)3, фенил, CH2CH2OCH3, пиридил, CH2CH(CH3)SCH3, OC(CH3)3, C(CH3)2CH2SCH3, CH(CH3)CH(CH3)SCH3, CH(CH3)CF3, CH2CH2-тиенил, CH(CH3)SCF3, CH2CH2Cl, CH2CH2CH2CF3, CH2CH2S(=O)CH3, CH(CH3)CH2S(=O)CH3, CH2CH2S(=O)2CH3, CH(CH3)CH2S(=O)2CH3, NCH2CH3, N(H)(CH2CH2CH3), C(CH3)=C(H)(CH3), N(H)(CH2CH=CH2), CH2CH(CF3)SCH3, CH(CF3)CH2SCH3, тиетанил, CH2CH(CF3)2, CH2CH2CF(OCF3)CF3, CH2CH2CF(CF3)CF3, CF(CH3)2, CH(CH3)фенил-Cl, CH(CH3)фенил-F, CH(CH3)фенил-OCF3, CH2N(CH3)(S(=O)2N(CH3)2, CH(CH3)OCH2CH2SCH3, CH(CH3)OCH2CH2OCH3, OCH3, CH(CH3)SCH3, CH2SCH3, N(H)CH3, CH(Br)CH2Br или CH(CH3)CH2SCD3.
Согласно другому варианту осуществления настоящего изобретения, R8 выбирают из (замещенный или незамещенный C1-С6алкил)-S(O)n-(замещенный или незамещенный C1-С6алкил), причем указанные заместители на указанных замещенных алкилах выбирают из F, Cl, Br, I, CN, NO2, N(R9)S(O)nR9, OR9, S(O)nOR9, R9S(O)nR9, S(O)nR9, C6-С20арила или C1-С20гетероциклила (каждый из которых, возможный к замещению, может быть необязательно замещен R9).
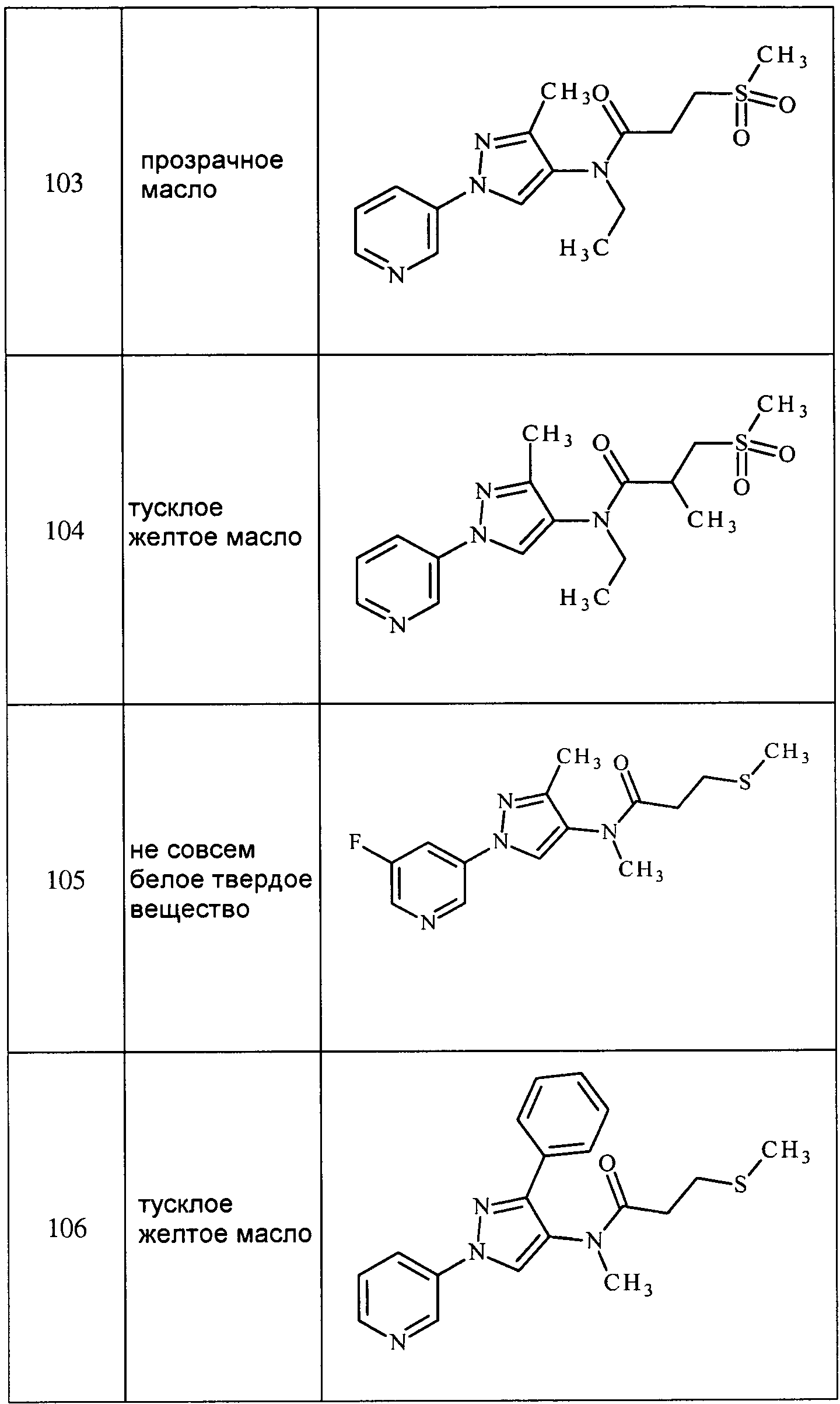
Согласно другому варианту осуществления настоящего изобретения, X представляет собой CRn1, где Rn1 представляет собой H или галоген.
Согласно другому варианту осуществления настоящего изобретения, X представляет собой CRn1, где Rn1 представляет собой H или F.
Согласно другому варианту осуществления настоящего изобретения, X1 представляет собой O.
Согласно другому варианту осуществления настоящего изобретения, X2 представляет собой O.
Хотя указанные варианты осуществления и являются прямо определенными, предусмотрены комбинации указанных вариантов осуществления. Кроме того, возможны другие варианты осуществления и комбинации прямо определенных вариантов осуществления и других вариантов осуществления.
Молекулы формулы один, как правило, характеризуются молекулярной массой приблизительно от 100 Да приблизительно до 1200 Да. Однако, как правило, предпочтительно, если молекулярная масса составляет приблизительно от 120 Да приблизительно до 900 Да, и, как правило, еще более предпочтительно, если молекулярная масса составляет приблизительно от 140 Да приблизительно до 600 Да.
На следующих схемах представлены подходы к получению аминопиразолов. На стадии a схемы I, соединение формулы III получают путем обработки 3-ацетопиридина или 5-ацетопиримидина формулы II, где R1, R2, R3 и X определены ранее, дисульфидом углерода и йодметаном в присутствии основания, такого как гидрид натрия, и в растворителе, таком как диметилсульфоксид. На стадии b схемы I, соединение формулы III может быть обработано амином или гидрохлоридом амина в присутствии основания, такого как триэтиламин, в растворителе, таком как этиловый спирт, с получением соединения формулы IV, где R1, R2, R3, R6 и X определены ранее. Соединение формулы IV может быть преобразовано в аминопиразол формулы Va, где R5=H, как представлено на стадии c схемы I, или как описано в Peruncheralathan, S. et al. J. Org. Chem. 2005, 70, 9644-9647, путем осуществления взаимодействия с гидразином, таким как метилгидразин, в полярном протонном растворителе, таком как этиловый спирт.
Схема I
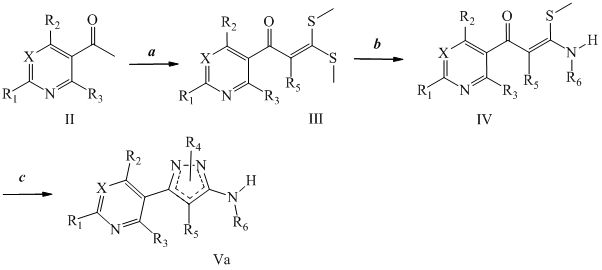
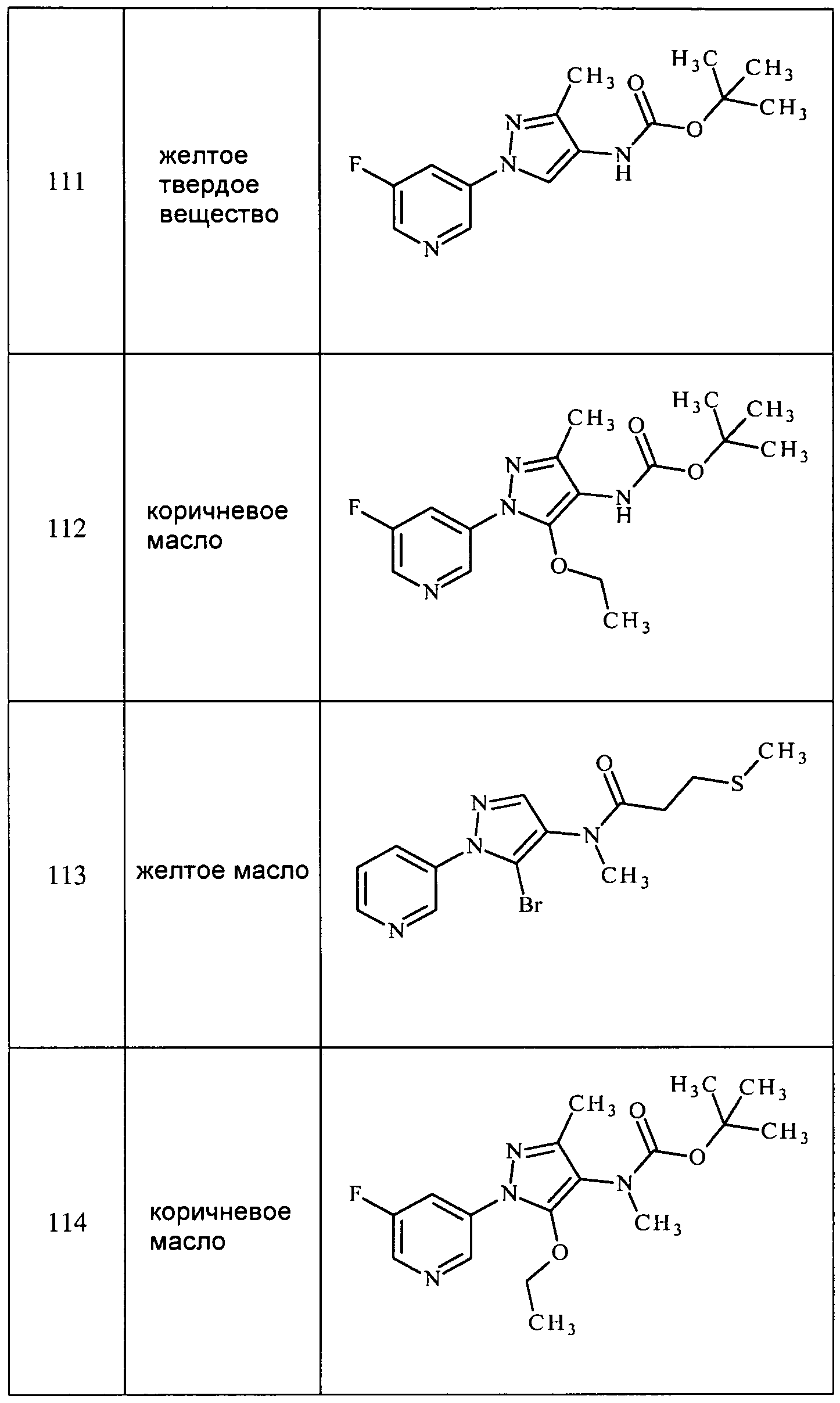
Другой подходы к получению аминопиразолов представлен на схеме II. На стадии a, нитрил формулы VI, где X, R1, R2 и R3 определены ранее, и R5 представляет собой водород, конденсируют, как представлено в Dhananjay, B. Kendre et al. J. Het Chem 2008, 45, (5), 1281-86, с гидразином формулы VII, таким как метилгидразин, с получением смеси аминопиразолов формулы Vb, где R5 и R6=H, причем оба эти компонента разделены.
Схема II

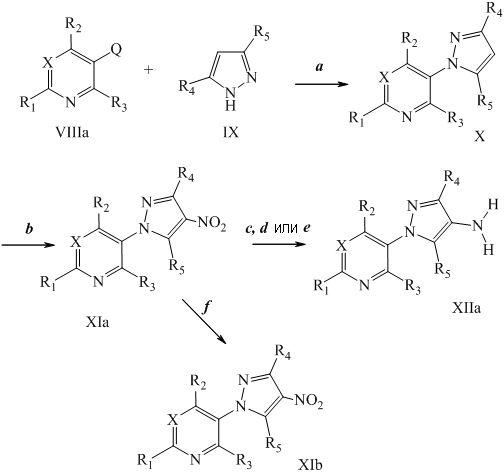
Получение аминопиразолов, например, формулы XIIA, представлено на схеме III. Соединение формулы X, представленное на стадии a и в Cristau, Henri-Jean et al. Eur. J. Org. Chem. 2004, 695-709, может быть получено путем N-арилирования пиразола формулы IX соответствующим арилгалогенидом формулы VIIIa, где Q представляет собой бром, в присутствии основания, такого как карбонат цезия, медного катализатора, такого как оксид меди(II), и лиганда, такого как салицилальдоксим, в полярном апротонном растворителе, таком как ацетонитрил. Представленные на схеме III соединения формулы IX, где R4=Cl и R5=H, могут быть получены, как описано в Pelcman, B. et al, WO 2007/045868 A1. Соединения формулы XIa получают нитрированием пиридилпиразола формулы X, представленной на стадии b схемы III и в Khan, Misbanul Ain et al. J. Heterocyclic Chem. 1981, 18, 9-14, путем осуществления взаимодействия с азотной кислотой и серной кислотой. Амин формулы XIIa, представленной на стадии c схемы III, получают путем восстановления функциональных нитрогрупп соединений формулы XIa в присутствии водорода с катализатором, таким как 5% Pd/C, в полярном апротонном растворителе, таком как тетрагидрофуран. Как представлено на стадии d схемы III, амин формулы XIIa, где R5=H, а также амин формулы XIIa, где R5=OEt, получают путем восстановления функциональных нитрогрупп соединений формулы XIa, где R1, R2, R3, R4 и X определены ранее, и R5=H, в присутствии водорода с катализатором, таким как 10% Pd/C, в полярном протонном растворителе, таком как этанол. Как представлено на стадии e схемы III, соединения формулы XIa, где R1, R2, R3, R5 и X определены ранее и R4=Cl, могут быть восстановлены в присутствии восстановителя, такого как железо, в смеси полярных протонных растворителей, таких как уксусная кислота, вода и этанол, с получением аминов формулы XIIa, где R1, R2, R3, R5 и X определены ранее, R4=Cl. Как представлено на стадии f схемы III, соединения формулы XIa, где R1, R2, R3, R5 и X определены ранее и R4=Cl, могут быть оставлены для осуществления взаимодействия при условиях сочетания по Судзуки с бороновой кислотой, такой как фенилбороновая кислота, в присутствии катализатора, такого как тетракис(трифенилфосфин)палладий, основания, такого как 2M водный карбонат калия, и в системе смешанных растворителей, таких как этанол и толуол, с получением пиразолов формулы XIb с поперечными связями.
Схема III
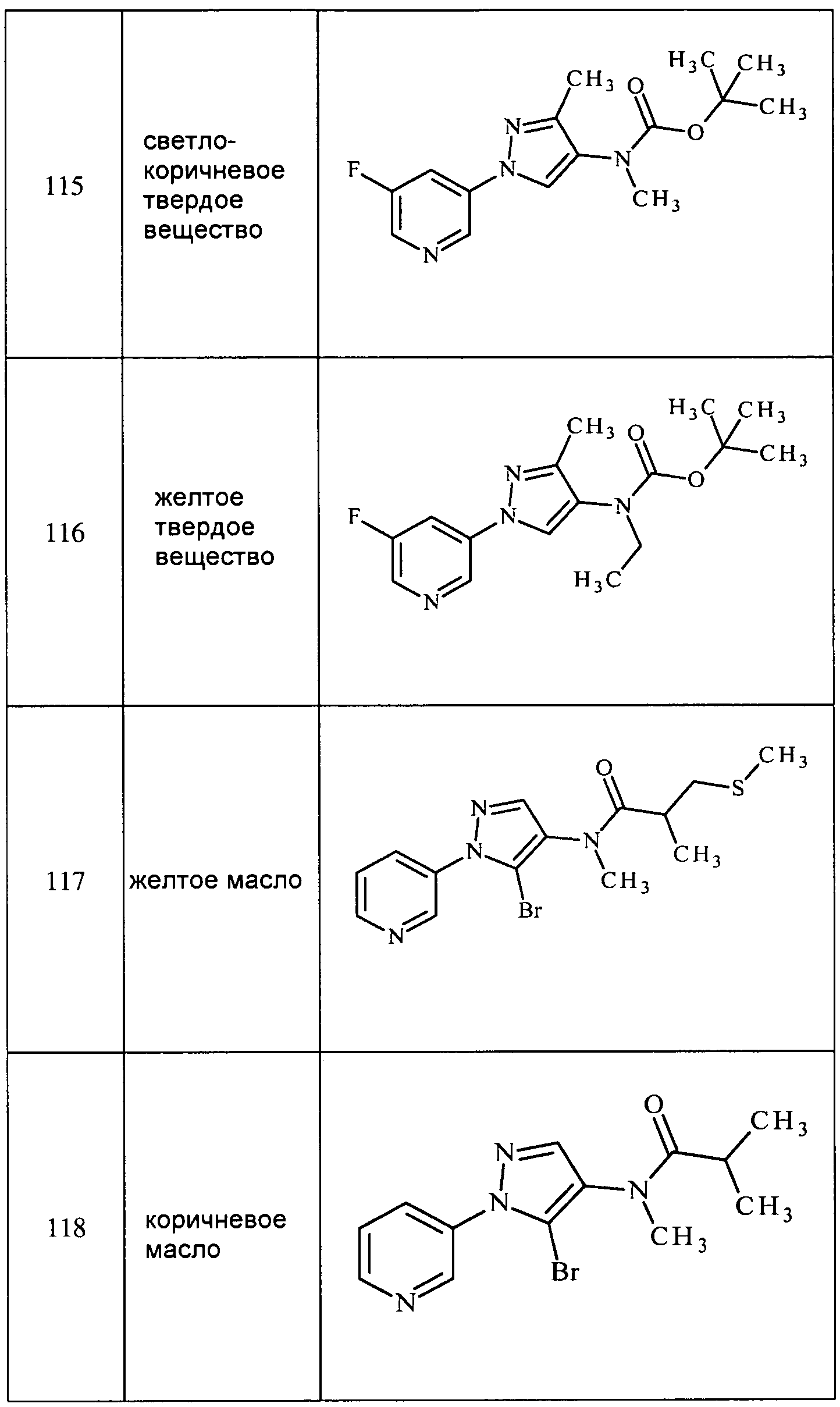
На стадии a схемы IV соединения формулы XIIb могут быть обработаны триэтилортоформиатом и кислотой, такой как трифторуксусная кислота. Соединение формулы XIIIa, где R6=метил, получают с последующим добавлением восстановителя, такого как боргидрид натрия, в полярном протонном растворителе, таком как этанол.
На стадии b схемы IV соединение формулы XIIb может быть обработано ацетоном в растворителе, таком как изопропилацетат, и кислотой, такой как трифторуксусная кислота, и триацетоксиборгидридом натрия с получением соединений формулы XIIIa, где R6=изопропил.
На стадии c схемы IV соединения формулы XIIb могут быть ацилированы хлорангидридом, таким как ацетилхлорид, в полярном апротонном растворителе, таком как дихлорметан, с применением представленных на схеме V условий. Соединения формулы XIIIa, где R6=этил, получают путем восстановления амида восстановителем, таким как алюмогидрид лития, в полярном апротонном растворителе, таком как тетрагидрофуран.
В качестве альтернативы, на стадии d схемы IV, соединения формулы XIIb могут быть обработаны бензотриазолом и альдегидом в этаноле, а затем восстановлены с использованием, например, боргидрида натрия, с получением соединений формулы XIIIa. На стадии e схемы IV, соединения формулы XIIb могут быть обработаны альдегидом, таким как пропиональдегид, и триацетоксиборгидридом натрия, в полярном апротонном растворителе, таком как дихлорметан, с получением соединений формулы XIIIa, где R6=пропил. Как и на стадии f, соединения формулы Ia, где R1, R2, R3, R4, R5, R6, R8 и X определены ранее, получают ацилированием соединений формулы XIIIa согласно схеме IV с использованием представленных в схеме IX условий.
Схема IV

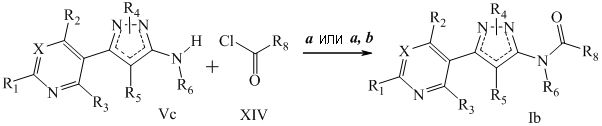
На стадии a схемы V, соединения формулы Vc, где R1, R2, R3, R4, R5 и R6 и X определены ранее, могут быть обработаны хлорангидридом формулы XIV в присутствии основания, такого как триэтиламин или N,N-диметиламинопиридин, в полярном апротонном растворителе, таком как дихлорэтан (DCE), с получением соединений формулы Ib, где R8 определен ранее. Кроме того, если R6=H, то 2º амид может быть впоследствии алкилирован на стадии b схемы V алкилгалогенидом, таким как йодэтан, в присутствии основания, такого как гидрид натрия, и полярного апротонного растворителя, такого как N,N-диметилформамид (DMF), с получением необходимых соединений формулы Ib. Используемые в этих реакциях ацилирования хлорангидриды или являются коммерчески доступными, или могут быть синтезированы специалистами в данной области техники.
Схема V
Как представлено на стадии a схемы VI и в Sammelson et al. Bioorg. Med. Chem. 2004, 12, 3345-3355, аминопиразолы формулы Vd, где R1, R2, R3, R4, R6 и X определены ранее, и R5=H, могут быть галогенированы при помощи источника галогена, такого как N-хлорсукцинимид или N-бромсукцинимид, в полярном апротонном растворителе, таком как ацетонитрил, с получением R5-замещенного пиразола. На стадии b, соединение формулы Ic, где R1, R2, R3, R4, R5, R6, R8 и X определены ранее, получают ацилированием этого соединения с применением описанных на схеме V условий.
Схема VI

На стадии a схемы VII, из аминопиразолов формулы Ve получают мочевины и карбаматы. Соединения формулы Ve, где X, R1, R2, R3, R4, R5 и R6 определены ранее, оставляют для осуществления взаимодействия с фосгеном с получением промежуточного карбамоилхлорида, который затем обрабатывают амином, как представлено на стадии b, или спиртом, как представлено на стадии c, соответственно, с получением мочевины формулы Id или карбамата формулы Ie, соответственно, где R9 определен ранее.
Схема VII

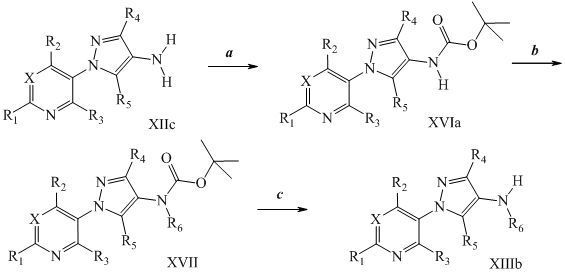
На стадии a схемы VIII, соединения формулы XIIc, где X, R1, R2, R3, R4 и R5 определены ранее, могут быть обработаны ди-трет-бутилдикарбонатом (Boc2O) и основанием, таким как триэтиламин, в полярном апротонном растворителе, таком как дихлорметан (DCM), с получением соединений формулы XVIa. Как представлено на стадии b схемы VIII, где R6 определен ранее, за исключением случая, когда R6 представляет собой водород, карбаматы формулы XVII получают путем обработки карбаматных функциональных групп алкилгалогенидом, таким как йодметан или Boc-ангидрид, в присутствии основания, такого как гидрид натрия, и в полярном апротонном растворителе, таком как DMF. Boc-группа может быть удалена в хорошо известных из данной области техники условиях, например, в кислых условиях, таких как трифторуксусная кислота (TFA) в полярном апротонном растворителе, таком как дихлорметан, с получением соединений формулы XIIIb, как представлено на стадии c.
Схема VIII
На стадиях a, b и c схемы IX соединения формулы XIIIc, где X, R1, R2, R3, R4, R5 и R6 определены ранее, могут быть обработаны соединением формулы XVIII, где R8 определен ранее, и R10 представляет собой OH, OR9 или O(C=O)OR9, с получением соединения формулы Id. Если R10=OH, то соединения формулы XIIIc могут быть преобразованы в соединения формулы Id в присутствии агента сочетания, такого как гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDC·HCl), и основания, такого как N,N-диметиламинопиридин (DMAP), в полярном апротонном растворителе, таком как дихлорэтан (DCE), как представлено на стадии a. Если R10=OR9, то соединения формулы XIIIc могут быть преобразованы в соединения формулы Id в присутствии 2,3,4,6,7,8-гексагидро-1H-пиримидо[1,2-a]пиримидина в полярном апротонном растворителе, таком как 1,4-диоксан, при повышенной температуре, как представлено на стадии b. Если R10=O(C=O)OR9, то соединения формулы XIIIc могут быть преобразованы в соединения формулы Id в полярном апротонном растворителе, таком как дихлорметан (DCM), как представлено на стадии c. Имиды формулы Ie получают путем ацилирования амидов формулы Id, если R6=H, хлорангидридом в присутствии основания, такого как диизопропилэтиламин, в полярном апротонном растворителе, таком как дихлорэтан (DCE), как представлено на стадии d. Кроме того, алкилированные амиды формулы Ie получают путем алкилирования амидов формулы Id, если R6=H, алкилгалогенидом в присутствии основания, такого как гидрид натрия, в полярном апротонном растворителе, таком как N,N-диметилформамид (DMF), как представлено на стадии e. Галогенированные пиразолы формулы Ie, где R5=галоген, получают путем галогенирования соединений формулы Id, где R1, R2, R3, R4, R6, R8 и X определены ранее и R5=H, при помощи источника галогена, такого как N-бромсукцинимид, в полярном апротонном растворителе, таком как DCE, или источника галогена, такого как N-хлорсукцинимид, в полярном апротонном растворителе, таком как DCE или ацетонитрил, или источника галогена, такого как Selectfluor®, в смеси полярных апротонных растворителей, таких как ацетонитрил и DMF, как представлено на стадии f схемы IX. Амиды формулы Id могут быть преобразованы в тиоамиды формулы If в присутствии тионирующего агента, такого как реагент Лавессона, в полярном апротонном растворителе, таком как дихлорэтан (DCE), как представлено на стадии g.
Схема IX
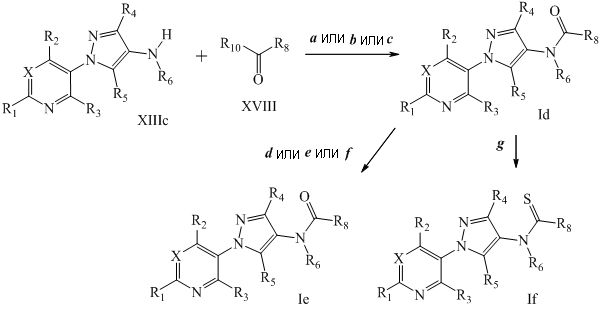
На стадии a схемы X, соединения формулы XIIId, где X, R1, R2, R3, R4, R5 и R6 определены ранее, могут быть обработаны соединениями формулы XIX, где R8 определен ранее, в полярном апротонном растворителе, таком как дихлорэтан (DCE), с получением соединений формулы XX. Кроме того, если R6=H и R8 содержит галоген, то соединения формулы XX могут быть обработаны основанием, таким как гидрид натрия, в полярном апротонном растворителе, таком как THF, с получением соединений формулы XXI, где m представляет собой целое число, выбранное из 1, 2, 3, 4, 5 или 6, как представлено на стадии b схемы X.
Схема X

Окисление сульфида до сульфоксида или сульфона проводят, как описано в схеме XI, где (~S~) может представлять собой любой ранее определенный сульфид в пределах объема R8 согласно настоящему изобретению. Как представлено на стадии a схемы XI, сульфид формулы XXIIa, где X, R1, R2, R3, R4, R5 и R6 определены ранее, обрабатывают окислителем, таким как тетрагидрат пербората натрия, в полярном протонном растворителе, таком как ледяная уксусная кислота, с получением сульфоксида формулы XXIII. В качестве альтернативы, как представлено на стадии d схемы XI, сульфид формулы XXIIa может быть окислен окислителем, таким как пероксид водорода, в полярном протонном растворителе, таком как гексафторизопропанол, с получением сульфоксида формулы XXIII. Как представлено на стадии c схемы XI, сульфоксид формулы XXIII может быть дополнительно окислен до сульфона формулы XXIV тетрагидратом пербората натрия в полярном протонном растворителе, таком как ледяная уксусная кислота. В качестве альтернативы, как представлено на стадии b схемы XI, сульфон формулы XXIV может быть получен в одну стадию из сульфида формулы XXIIa с использованием вышеупомянутых условий более чем с 2 эквивалентами тетрагидрата пербората натрия.
Схема XI

Окисление сульфида до сульфоксимина проводят, как представлено на схеме XII, где (~S~) может представлять собой любой ранее определенный сульфид в пределах объема R8 согласно настоящему изобретению. Сульфид формулы XXIIb, где X, R1, R2, R3, R4, R5 и R6 определены ранее, окисляют, как описано на стадии a, диацетатом йодбензола в присутствии цианамида в полярном апротонном растворителе, таком как метиленхлорид (DCM), с получением сульфилимина формулы XXV. Как представлено на стадии b схемы XII, сульфилимин формулы XXV может быть дополнительно окислен до сульфоксимина формулы XXVI окислителем, таким как мета-хлорпероксибензойная кислота (mCPBA), в присутствии основания, такого как карбонат калия, в системе протонных полярных растворителей, таких как этанол и вода.
Схема XII

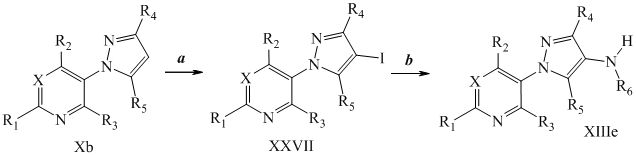
Йодирование пиразола формулы Xb, как представлено на стадии a схемы XIII и в Potapov, A. et al. Russ. J. Org. Chem. 2006, 42, 1368-1373, завершают путем осуществления взаимодействия с йодирующим агентом, таким как йод, в присутствии кислот, таких как йодная кислота и серная кислота, в полярном протонном растворителе, таком как уксусная кислота, с получением соединений формулы XXVII. Как представлено на стадии b схемы XIII и в Wang, D. et al. Adv. Synth. Catal. 2009, 351, 1722-1726, аминопиразолы формулы XIIIe могут быть получены из йодпиразолов формулы XXVII посредством реакций кросс-сочетания с соответствующим амином в присутствии основания, такого как карбонат цезия, медного катализатора, такого как бромид меди (I), и лиганда, такого как 1-(5,6,7,8-тетрагидрохинолин-8-ил)этанон, в полярном апротонном растворителе, таком как DMSO.
Схема XIII
На стадии a схемы XIV, соединения формулы XXIX, где R4 представляет собой Cl, R5 представляет собой H и X- представляет собой Cl-, могут быть получены способами, описанными в Tolf, Bo-Ragnar and Dahlbom, Acta. Pharm. Suec. 22, 147-156 (1985). По аналогии, соединения формулы XXIX, где R4 представляет собой Br, X- представляет собой Br- и R5 определен ранее, могут быть получены путем обработки соединений формулы XXVIII газообразным водородом в присутствии металлического катализатора, такого как 5% Pd на оксиде алюминия, и раствора 50% водного HBr в таком растворителе, как этанол. В качестве альтернативы, как представлено на стадии a схемы XIV, соединения формулы XXIX, где R4 представляет собой Cl или Br, X-представляет собой Cl- или Br- и R5 определен ранее, могут быть получены путем обработки соединений формулы XXVIII, где R5 определен ранее, гидросиланом, таким как триэтилсилан, в присутствии металлического катализатора, такого как 5% Pd на оксиде алюминия, и кислоты, такой как HCl или HBr, соответственно, в таком растворителе, как этанол.
Как представлено на стадии b схемы XIV, соединения формулы XXX, где R4 представляет собой Cl или Br и R5 определен выше, могут быть получены путем обработки соединений формулы XXIX, где R4 представляет собой Cl или Br, X-представляет собой Cl- или Br- и R5 определен ранее, ди-трет-бутилбикарбонатом (Boc2O) в присутствии смеси растворителей, таких как THF и вода, и основания, такого как бикарбонат натрия.
Как представлено на стадии c схемы XIV, соединения формулы XVIa, где X, R1, R2, R3 и R5 определены ранее, и R4 представляет собой Cl или Br, могут быть получены путем обработки соединений формулы XXX, где R4 представляет собой Cl или Br, и R5 определен ранее, соединениями формулы VIIIb, где X, R1, R2 и R3 определены ранее, и Q представляет собой бром или йод, в присутствии каталитического количества соли меди, такой как CuCl2, производного этан-1,2-диамина, такого как N1,N2-диметилэтан-1,2-диамин, и основания, такого как K3PO4, в полярном апротонном растворителе, таком как ацетонитрил, при подходящей температуре.
Как представлено на стадии d схемы XIV, Boc-группа соединений формулы XVIa может быть удалена в условиях, которые хорошо известны в данной области техники, например, в кислых условиях, таких как TFA в полярном апротонном растворителе, таком как дихлорметан, с получением соединения формулы XIId.
Схема XIV

Как представлено на стадии a схемы XV, бромпиразолы формулы XXXI, где R1, R2, R3, R5, R8 и X определены ранее, могут быть оставлены для осуществления взаимодействия в условиях сочетания по Сузуки со сложным эфиром бороновой кислоты, таким как сложный пинаколиновый эфир винилбороновой кислоты или сложный пинаколиновый эфир циклопропилбороновой кислоты, в присутствии катализатора, такого как тетракис(трифенилфосфин)палладия, основания, такого как 2 M водный карбонат калия, и в системе смешанных растворителей, таких как этанол и толуол, с получением соединений формулы XXXII.
Схема XV

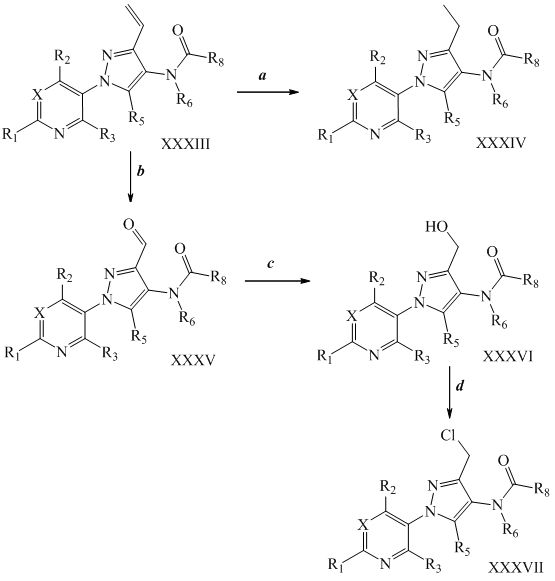
Как представлено на стадии a схемы XVI, винильная группа соединений формулы XXXIII, где R1, R2, R3, R5, R6, R8 и X определены ранее, может быть восстановлена в присутствии водорода и катализатора, такого как 10% Pd/C, в полярном протонном растворителе, таком как метанол, с получением соединений формулы XXXIV. Как представлено на стадии b схемы XVI, соединения формулы XXXV получают путем окисления винильной группы соединений формулы XXXIII с использованием окислителя, такого как тетраоксид осмия, в присутствии перйодата натрия в смеси полярного протонного растворителя, такого как вода, и полярного апротонного растворителя, такого как THF. Соответствующий спирт формулы XXXVI получают путем восстановления альдегида соединений формулы XXXV, как представлено на стадии c схемы XVI, восстановителем, таким как борогидрид натрия, в полярном протонном растворителе, таком как метанол. Как представлено на стадии d схемы XVI, соединения формулы XXXVII получают путем обработки соединений формулы XXXVI хлорирующим агентом, таким как тионилхлорид, в полярном апротонном растворителе, таком как дихлорметан.
Схема XVI
Как представлено на стадии a схемы XVII, α,β-ненасыщенная кислота XXXVIII может быть обработана нуклеофилом, таким как тиометоксид натрия, в полярном протонном растворителе, таком как метанол, с получением кислоты XXXIX.
Схема XVII

ПРИМЕРЫ
Примеры представлены с иллюстративными целями и не должны истолковываться как ограничивающие настоящее изобретение, раскрытое в этом документе, лишь вариантами осуществления, раскрытыми в указанных примерах.
Исходные вещества, реагенты и растворители, которые были получены из коммерческих источников, использовали без дополнительной очистки. Безводные растворители приобретали в виде Sure/Seal™ производства Aldrich и использовали как есть. Значения точки плавления получали на приборе для определения точки плавления капиллярным способом Thomas Hoover Unimelt или на автоматизированной системе для определения точки плавления OptiMelt производства Stanford Research Systems и не корректировали. Молекулам присваивали их известные названия, полученные в соответствии с программами присвоения имен в составе ISIS Draw, ChemDraw или ACD Name Pro. Если такие программы были не способны присвоить название, то молекулу именовали с использованием общепринятых правил наименования. Все ЯМР-сдвиги представлены в м.д. (δ) и регистрировали при 300, 400 или 600 МГц, если иное не указано особо.
Пример 1, стадия 1: Получение 3,3-бис-метилсульфанил-1-пиридин-3-илпропенона
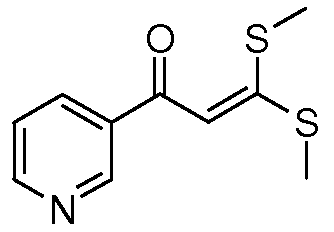
К находящейся при комнатной температуре суспензии гидрида натрия (NaH, 60% суспензия в минеральном масле; 4,13 г, 86 ммоль) в безводном диметилсульфоксиде (DMSO, 60 мл) в атмосфере азота (N2) по каплям в течение 30 минут (мин) добавляли 3-ацетилпиридин (5,00 г, 41,3 ммоль). Смесь перемешивали еще в течение 30 минут при той же температуре. При энергичном перемешивании по каплям добавляли дисульфид углерода (CS2; 3,27 г, 43 ммоль), а затем по каплям в течение 45 мин добавляли йодметан (12,21 г, 86 ммоль). Продолжали перемешивание еще в течение 18 часов (ч) в атмосфере N2. Реакционную смесь гасили добавлением холодной воды (H2O, 50 мл). Темное твердое вещество фильтровали и промывали ледяным этиловым спиртом (EtOH) до обесцвечивания смывов. Не совсем белый твердый продукт сушили в условиях вакуума при 60°C с получением 3,3-бис-метилсульфанил-1-пиридин-3-илпропенона в виде коричневого твердого вещества (4,8 г, 51%):1H ЯМР (300 МГц, CDCl3) δ 9,13 (д, J=1,8 Гц, 1H), 8,72 (дд, J=4,8, 1,6 Гц, 1H), 8,23 (ддд, J=7,9, 2, 2 Гц, 1H), 7,40 (дд, J=7,9, 4,8 Гц, 1H), 6,73 (с, 1H), 2,58 (д, J=9,4 Гц, 6H); MS m/z 226,2 (M+1).
1-(5-Фторпиридин-3-ил)-3,3-бис(метилтио)проп-2-ен-1-он получали, как описано для стадии 1 примера 1: т.пл. 150-152°C;
1H ЯМР (400 МГц, CDCl3) δ 8,93 (т, J=1,6 Гц, 1H), 8,58(д, J=2,8 Гц, 1H),7,94 (ддд, J=8,9, 2,8, 1,7 Гц, 1H), 6,69 (с, 1H), 2,60 (с, 3H), 2,57 (с, 3H).
Пример 1, стадия 2: Получение (Z)-3-метиламино-3-метилсульфанил-1-пиридин-3-илпропенона

Раствор 3,3-бис-метилсульфанил-1-пиридин-3-илпропенона (18,6 г, 82,5 ммоль) в абсолютном спирте (400 мл) в атмосфере N2 обрабатывали гидрохлоридом метиламина (27,86 г, 412 ммоль), а затем триэтиламином (Et3N; 58,5 мл, 412 ммоль). Смесь нагревали до температуры возгонки в течение 3 ч, охлаждали до комнатной температуры и концентрировали в условиях пониженного давления. Твердый остаток растворяли в этилацетате (EtOAc; 150 мл). Раствор промывали H2O (2×50 мл) и солевым раствором (50 мл), сушили над Na2SO4, концентрировали в условиях пониженного давления и очищали методом хроматографии на силикагеле, элюируя 10% EtOAc в петролейном эфире, с получением (Z)-3-метиламино-3-метилсульфанил-1-пиридин-3-илпропенона в виде бледно-желтого твердого вещества (8,6 г, 50%):1H ЯМР (300 МГц, CDCl3) δ 11,8 (ушир.с, 1H), 9,06 (с, 1H); 8,67 (д, J=3,9 Гц, 1H), 8,26 (д, J=8,0 Гц 1H), 7,46 (дд, J=7,6, 4,9 Гц 1H), 5,62 (с, 1H), 3,10 (д, J=5,2 Гц, 3H), 2,52 (с, 3H); MS (m/z) 209,2 [M+1].
(Z)-3-(этиламино)-3-(метилтио)-1-(пиридин-3-ил)проп-2-ен-1-он получали, как описано для стадии 2 примера 1:
1H ЯМР (400 МГц, CDCl3) δ 11,81 (ушир.с, 1H), 9,04 (дд, J=2,2, 0,7 Гц, 1H), 8,64 (дд, J=4,8, 1,7 Гц, 1H), 8,29-7,98 (м, 1H), 7,35 (ддд, J=7,9, 4,8, 0,9 Гц, 1H), 3,45 (кв, J=7,2, 5,6 Гц, 2H), 2,50 (с, 3H), 1,35 (т, J=7,2 Гц, 3H).
(Z)-3-(циклопропилметил)амино-3(метилтио)-1-(пиридин-3-ил)проп-2-ен-1-он получали, как описано для стадии 2 примера 1:1H ЯМР (400 МГц, CDCl3) δ 9,00 (с, 1H), 9,05 (дд, J=2,2, 0,7 Гц, 1H), 8,64 (дд, J=4,8, 1,7 Гц, 1H), 8,16 (дт, J=7,9, 2,0 Гц, 1H), 7,35 (ддд, J=7,9, 4,8, 0,8 Гц, 1H), 5,62 (с, 1H), 3,27 (дд, J=7,0, 5,5 Гц, 2H), 2,50 (с, 3H), 1,20-1,07 (м, 1H), 0,73-0,49 (м, 2H), 0,41-0,17 (м, 2H).
Пример 1, стадия 3: Получение метил(2-метил-5-пиридин-3-пиразол-3-ил)амина
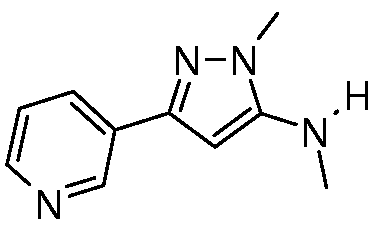
Раствор (Z)-3-метиламино-3-метилсульфанил-1-пиридин-3-илпропенона (3,00 г, 14 ммоль) и метилгидразина (729 мг, 15,4 ммоль) в абсолютном EtOH (64 мл) перемешивали с обратным холодильником в течение 18 ч в атмосфере N2, охлаждали до комнатной температуры и упаривали в условиях пониженного давления. Остаток растворяли в EtOAc (50 мл), и органический слой промывали H2O (2×30 мл) и солевым раствором (30 мл), сушили над Na2SO4, концентрировали в условиях пониженного давления и очищали методом хроматографии на силикагеле, элюируя градиентом 0-1% EtOH в EtOAc, с получением региоизомеров в соотношении 1:2, причем основной региоизомер представлял собой коричневое твердое вещество (1,0 г, 27%):1H ЯМР (300 МГц, CDCl3) δ 8,97 (д, J=1,3 Гц, 1H), 8,51 (дд, J=3,6, 1,0 Гц, 1H), 8,07 (ддд, J=5,9, 1,4, 1,4 Гц, 1H), 7,30 (дд, J=5,9, 3,6 Гц, 1H), 5,82 (с, 1H), 3,69 (с, 3H), 2,93 (с, 3H); MS (m/z) 188,6 [M+1].
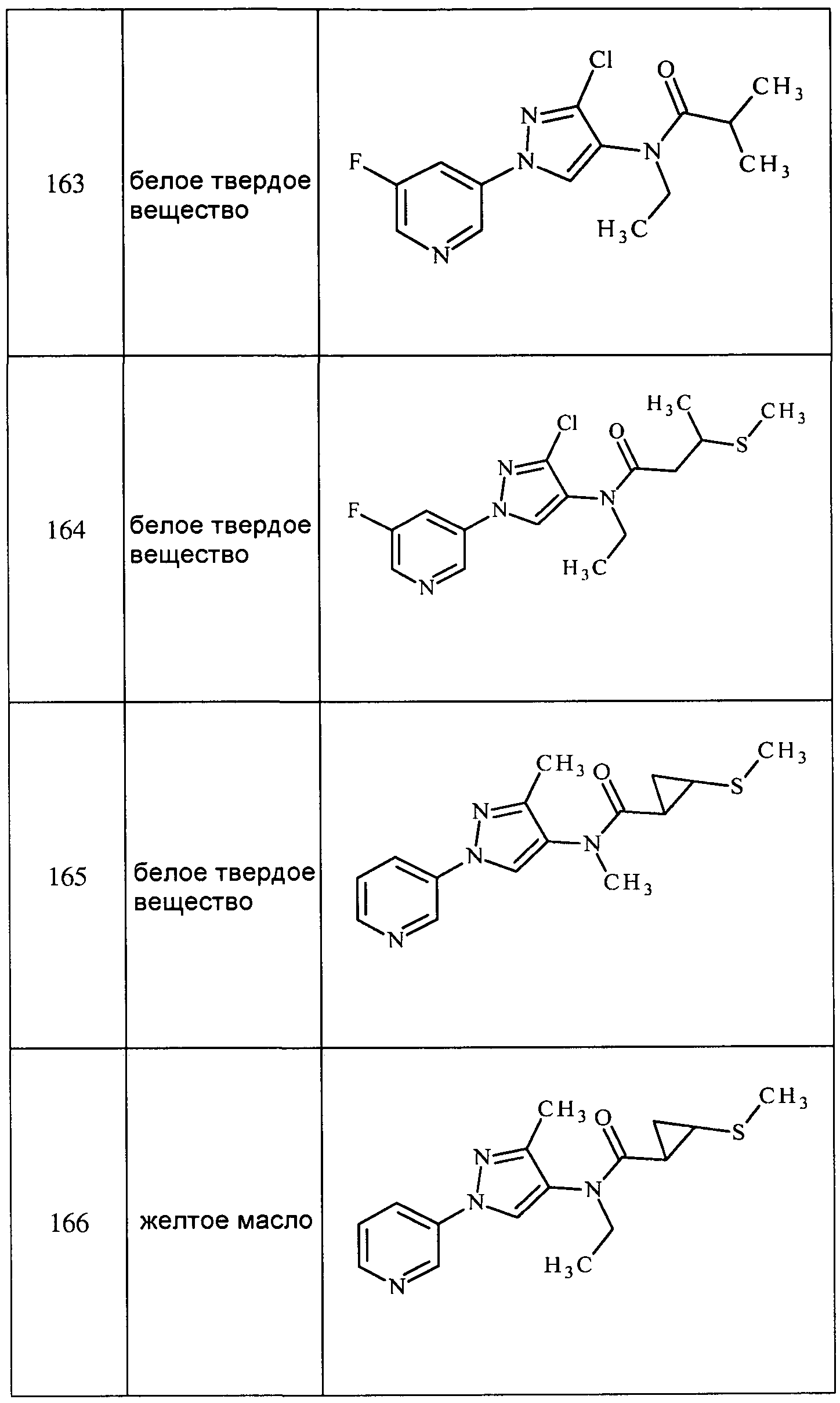
1-Этил-N-метил-3-(пиридин-3-ил)-1H-пиразол-5-амин получали, как описано для стадии 3 примера 1: ESIMS m/z 204 ([M+2H]).
N-Этил-1-метил-3-(пиридин-3-ил)-1H-пиразол-5-амин получали, как описано для стадии 3 примера 1: ESIMS m/z 203 ([M+H]).
N-Метил-1-фенил-3-(пиридин-3-ил)-1H-пиразол-5-амин получали, как описано для стадии 3 примера 1: ESIMS m/z 252 ([M+2H]).
N-(Циклопропилметил)-1-метил-3-(пиридин-3-ил)-1H-пиразол-5-амин получали, как описано для стадии 3 примера 1: ESIMS m/z 230 ([M+2H]).
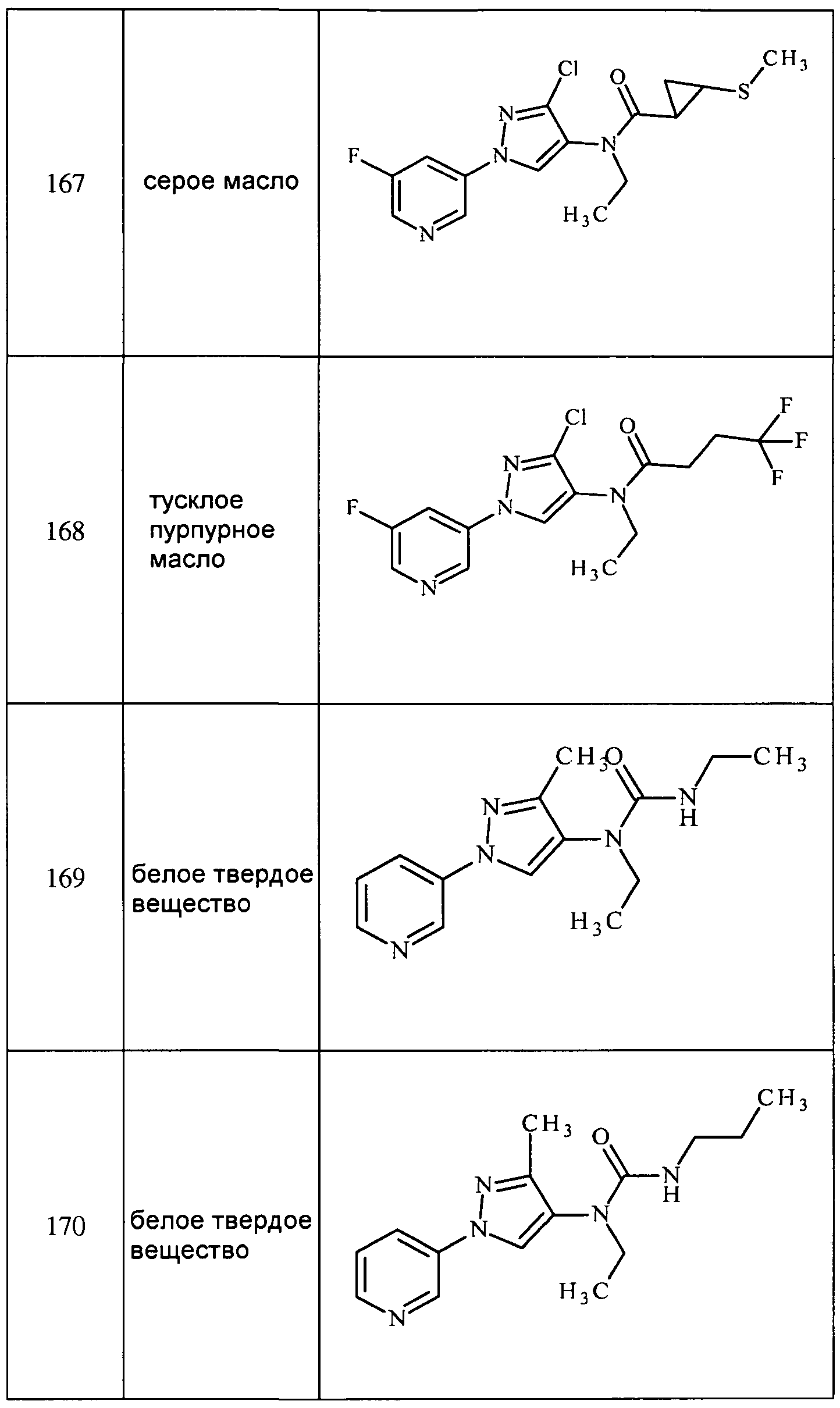
1-Изопропил-N-метил-3-пиридин-3-ил)-1H-пиразол-5-амин получали, как описано для стадии 3 примера 1:
1H ЯМР (300 МГц, CDCl3) δ 8,53 (с, 1H), 8,06-7,90 (м, J=7,2 Гц, 2H), 7,13 (дд, J=7,9, 5,6 Гц, 1H), 5,33 (с, 1H), 3,70 (ушир.с, 1H), 3,65 (дт, J=13,2, 6,6 Гц, 1H), 2,31 (с, 3H), 0,88 (д, J=6,6 Гц, 6H); ESIMS m/z 217 ([M+H]).
3-(5-Фторпиридин-3-ил)-N,1-диметил-1H-пиразол-5-амин получали, как описано для стадии 3 примера 1:
1H ЯМР (300 МГц, CDCl3) δ 8,28 (с, 1H), 7,87 (т, J=1,3 Гц, 1H), 7,60 (м, 1H), 6,66 (с, 1H), 5,28 (ушир.с, 2H), 3,12 (с, 3H), 2,34 (с, 3H); ESIMS m/z 206 ([M+H]).
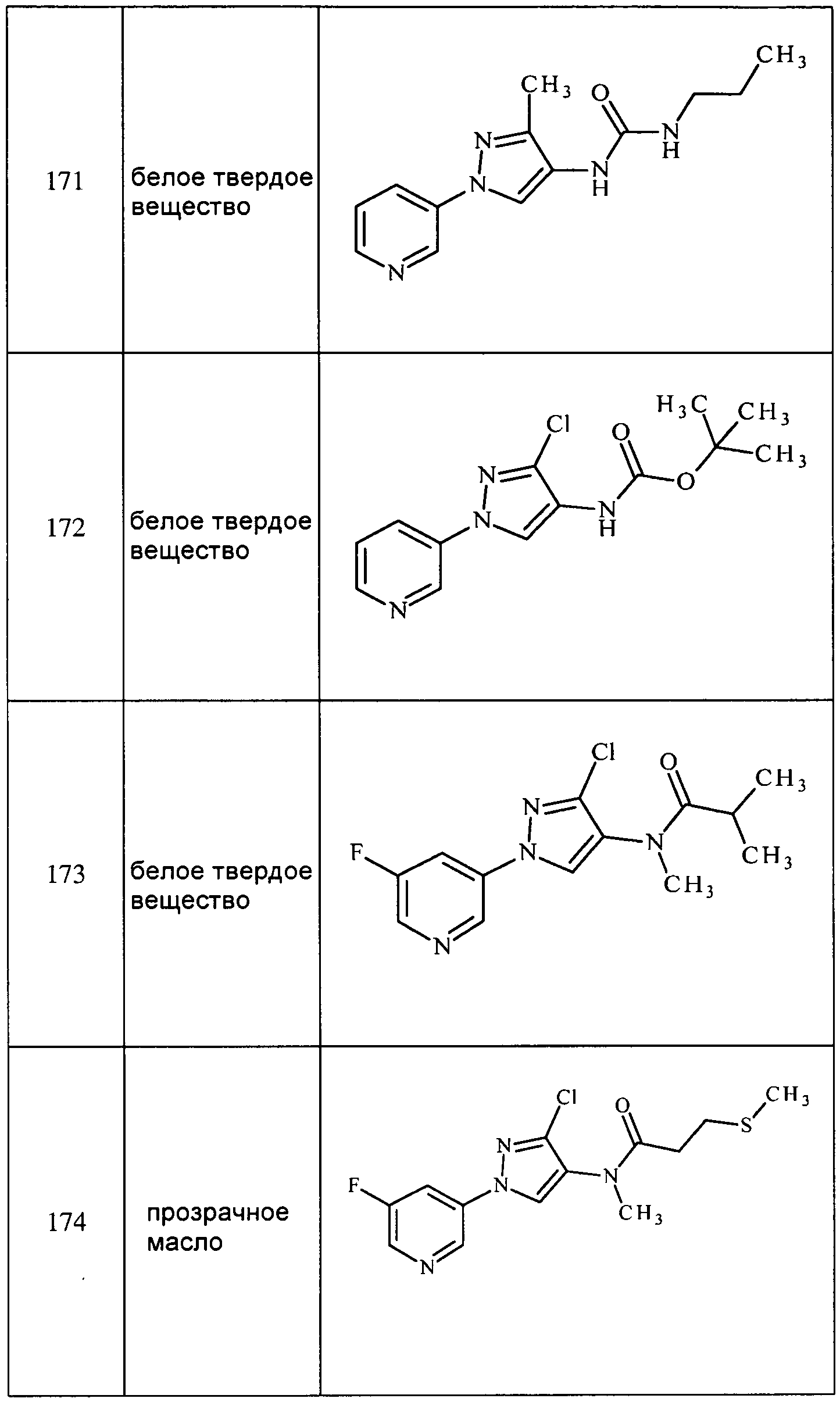
Пример 2: Получение (4-хлор-2-метил-5-пиридин-3-ил-2H-пиразол-3-ил)метиламина
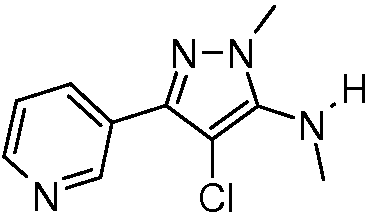
Смесь метил(2-метил-5-пиридин-3-ил-2H-пиразол-3-ил)амина (0,35 г, 1,8 ммоль) и N-хлорсукцинимида (0,273 г, 2 ммоль) объединяли в ацетонитриле (3 мл), перемешивали при комнатной температуре в течение 30 минут, концентрировали в условиях пониженного давления и очищали методом хроматографии на силикагеле, элюируя градиентом EtOAc в гексанах, с получением указанного в заголовке соединения в виде желтого масла (0,096 г, 23%): ИК (тонкая пленка) 1581,6 см-1;1H ЯМР (400 МГц, CDCl3) δ 9,12 (д, J=1,5 Гц, 1H), 8,57 (дд, J=4,8, 1,3 Гц, 1H), 8,15 (ддд, J=7,8, 2,0, 2,0 Гц, 1H), 7,33 (дд, J=8,1, 5,1 Гц, 1H), 3,80 (с, 3H), 2,91 (д, J=5,8 Гц, 3H); ESIMS (m/z) 225,6 [M+2].
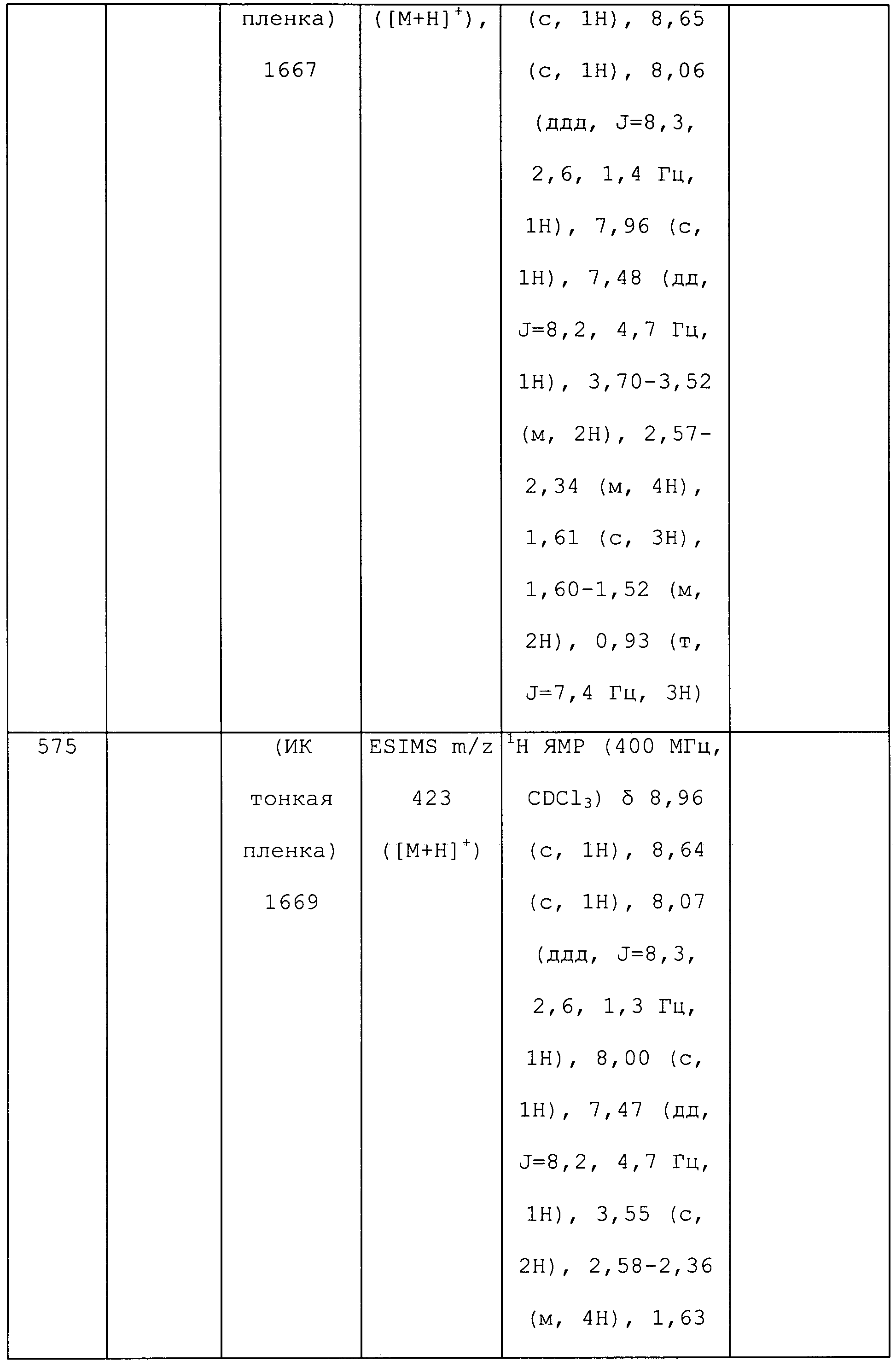
В реакции также получали 4-хлор-2-метил-5-пиридин-3-ил-2H-пиразол-3-иламин в виде зеленого клейкого вещества (0,046 г, 13%): ИК (тонкая пленка) 1720,5 см-1.;
1H ЯМР (CDCl3, 400 МГц) δ 9,13 (ушир.с, 1H), 8,57 (ушир.с, 1H), 8,16 (дт, J=8,0, 2,0 Гц, 1H), 7,33 (дд, J=7,8, 4,8 Гц, 1H), 3,76 (с, 3H); ESIMS (m/z) 207,0 [M-1]/
Пример 3: Получение 2,N-диметил-N-(2-метил-5-пиридин-3-ил-2H-пиразол-3-ил)-3-метилсульфанилпропионамида (соединение 1)

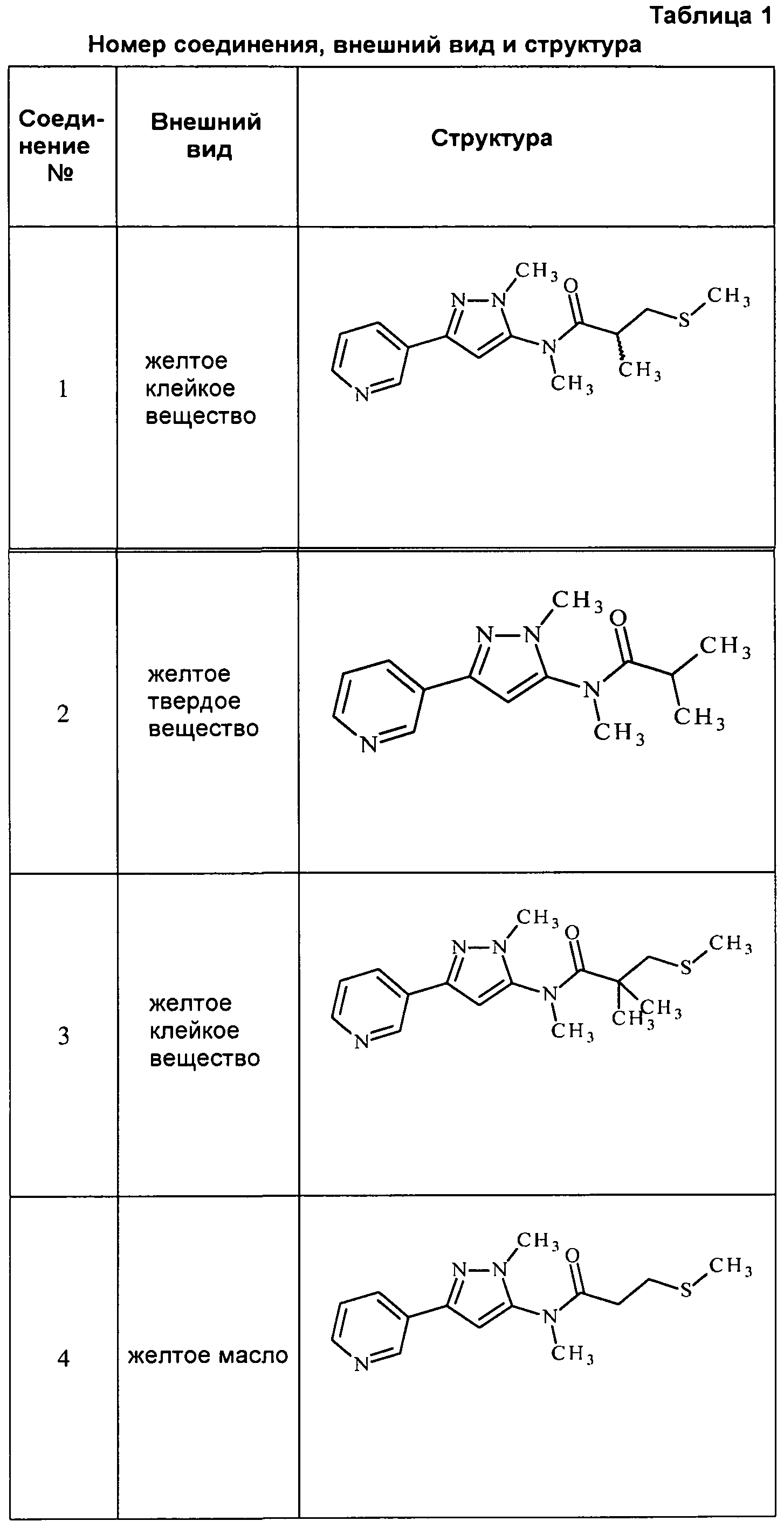
К раствору метил(2-метил-5-пиридин-3-ил-2H-пиразол-3-ил)амина (150 мг, 0,8 ммоль) в ледяном дихлорэтане (DCE; 2 мл) в атмосфере N2 по каплям пипеткой добавляли раствор 2-метил-3-метилсульфанилпропионилхлорида (146 мг, 0,9 ммоль) в DCE (1,5 мл). После перемешивания в течение 10 минут (мин), по каплям добавляли раствор 4-N,N-диметиламинопиридина (DMAP; 107 мг, 0,9 ммоль) в DCE (2 мл). Спустя 30 мин водяную баню удаляли, и перемешивали смесь при комнатной температуре в течение 90 мин, а затем при нагревании с обратным холодильником в течение 14 ч. Смесь концентрировали в условиях пониженного давления и очищали методом хроматографии на силикагеле, элюируя градиентом EtOAc в гексане. Продукт, 2,N-диметил-N-(2-метил-5-пиридин-3-ил-2H-пиразол-3-ил)-3-метилсульфанилпропионамид, выделяли в виде желтого полутвердого вещества (44 мг, 24%):1H ЯМР (400 МГц, CDCl3) δ 9,00 (с, 1H), 8,58 (с, 1H), 8,08 (ушир.д, J=7,0 Гц, 1H), 7,35 (ушир.дд, J=7,3, 4,8 Гц, 1H), 6,58 (ушир.с, 0,5 H), 6,49 (ушир.с, 0,5 H), 3,89-3,79 (м, 3H), 3,25 (с, 3H), 2,96-2,80 (м, 1H), 2,42-2,40 (м, 1H), 2,02-1,99 (м, 3H), 2,62 (м, 1H), 1,15 (д, J=6,0 Гц, 3H); MS (m/z) 305,0 [M+1].
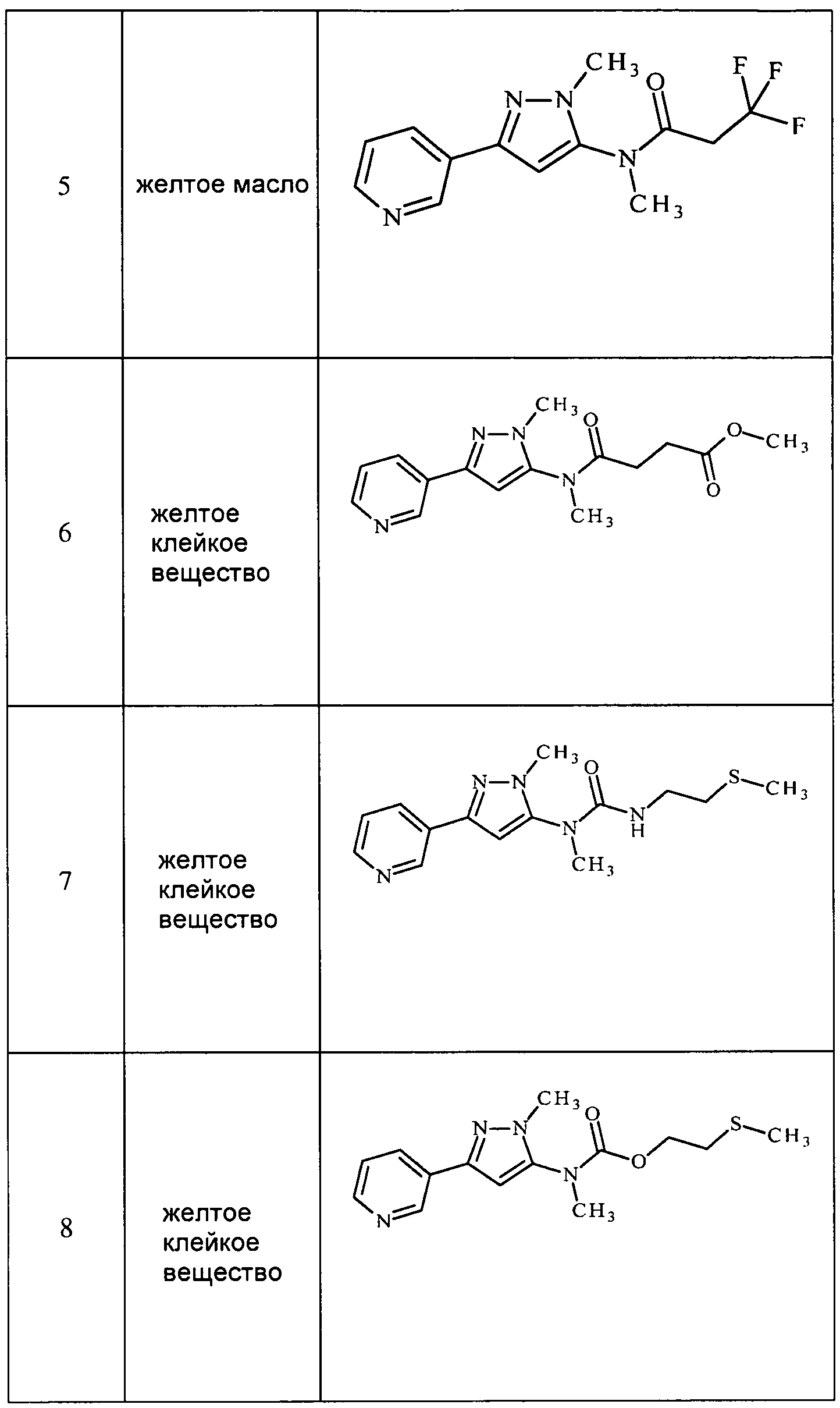
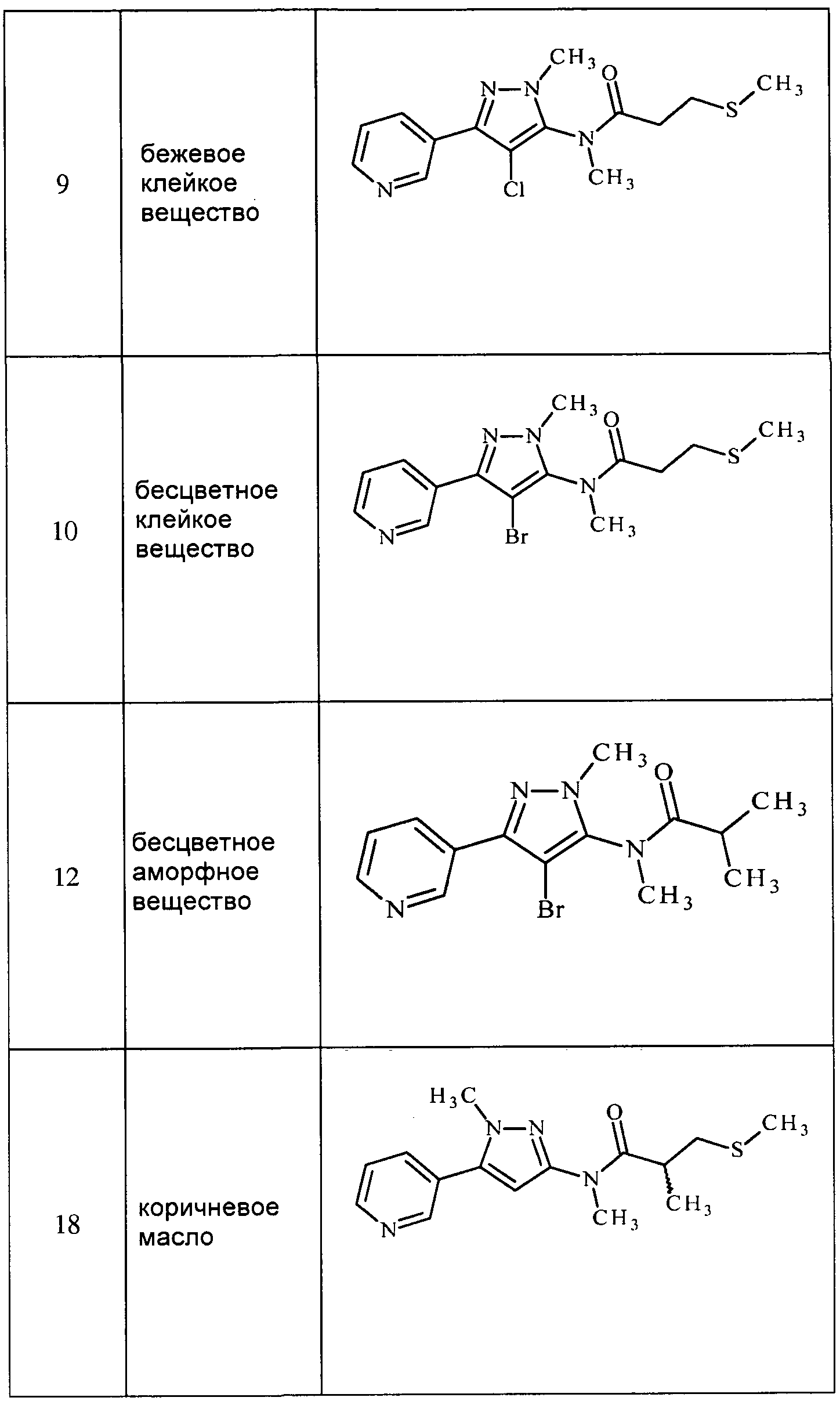
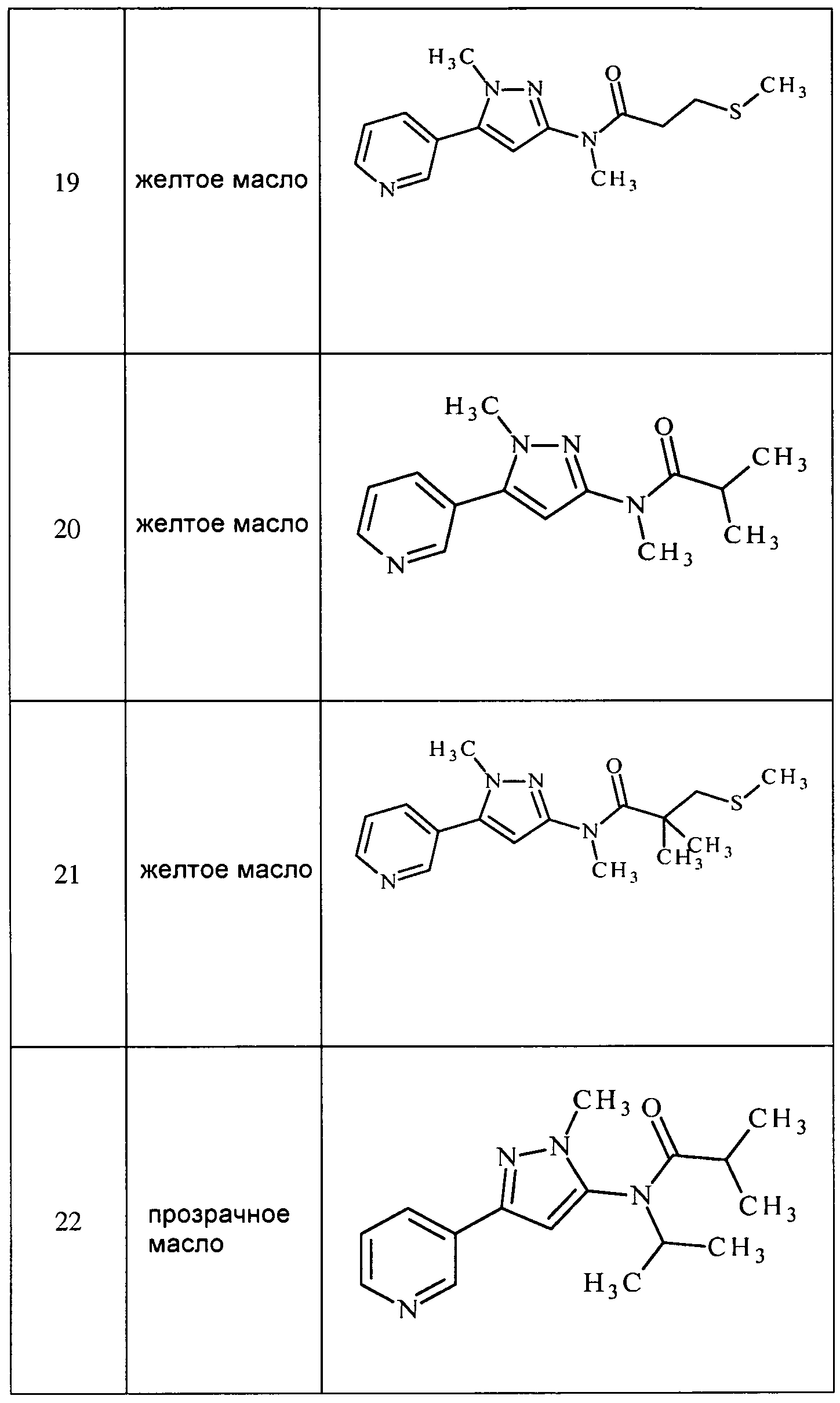
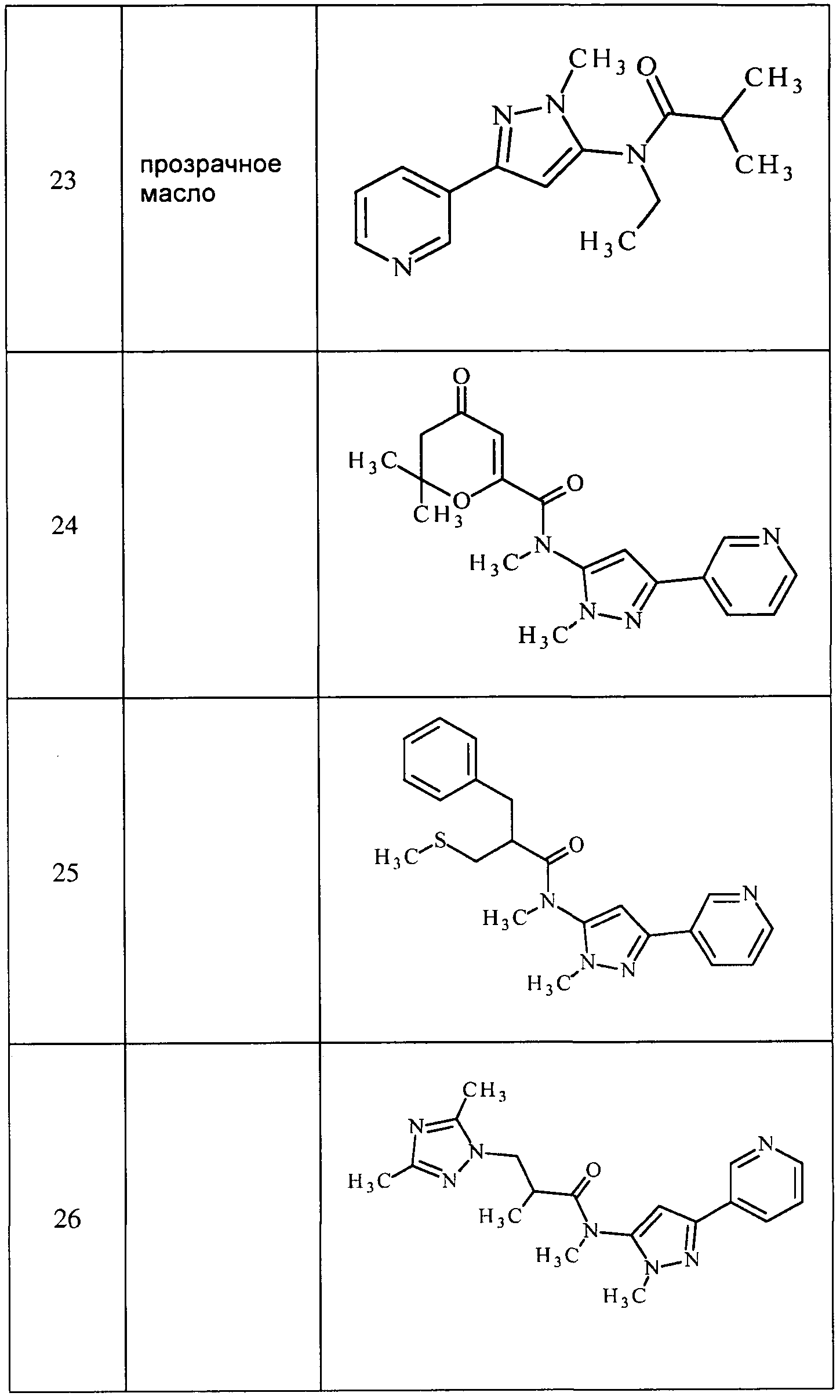
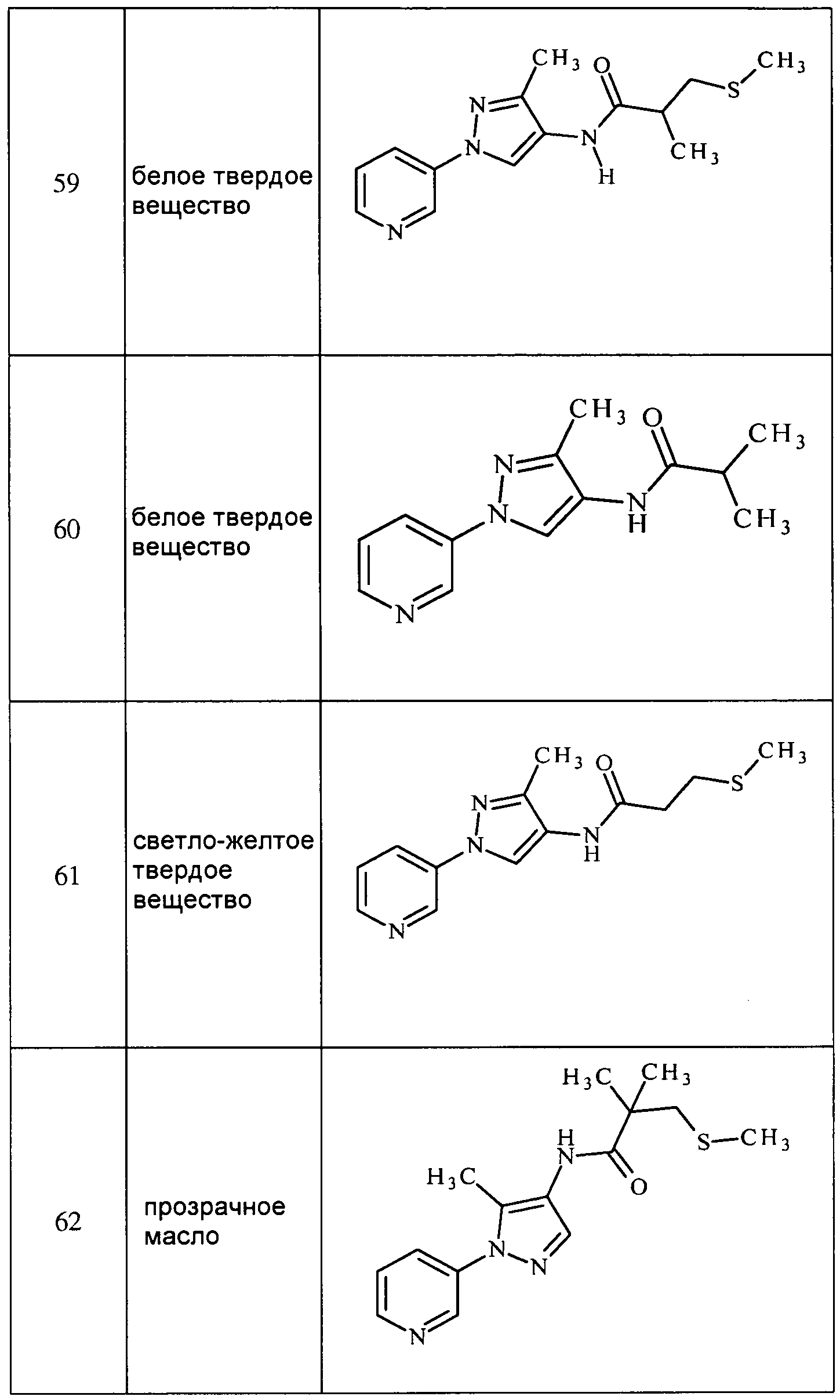
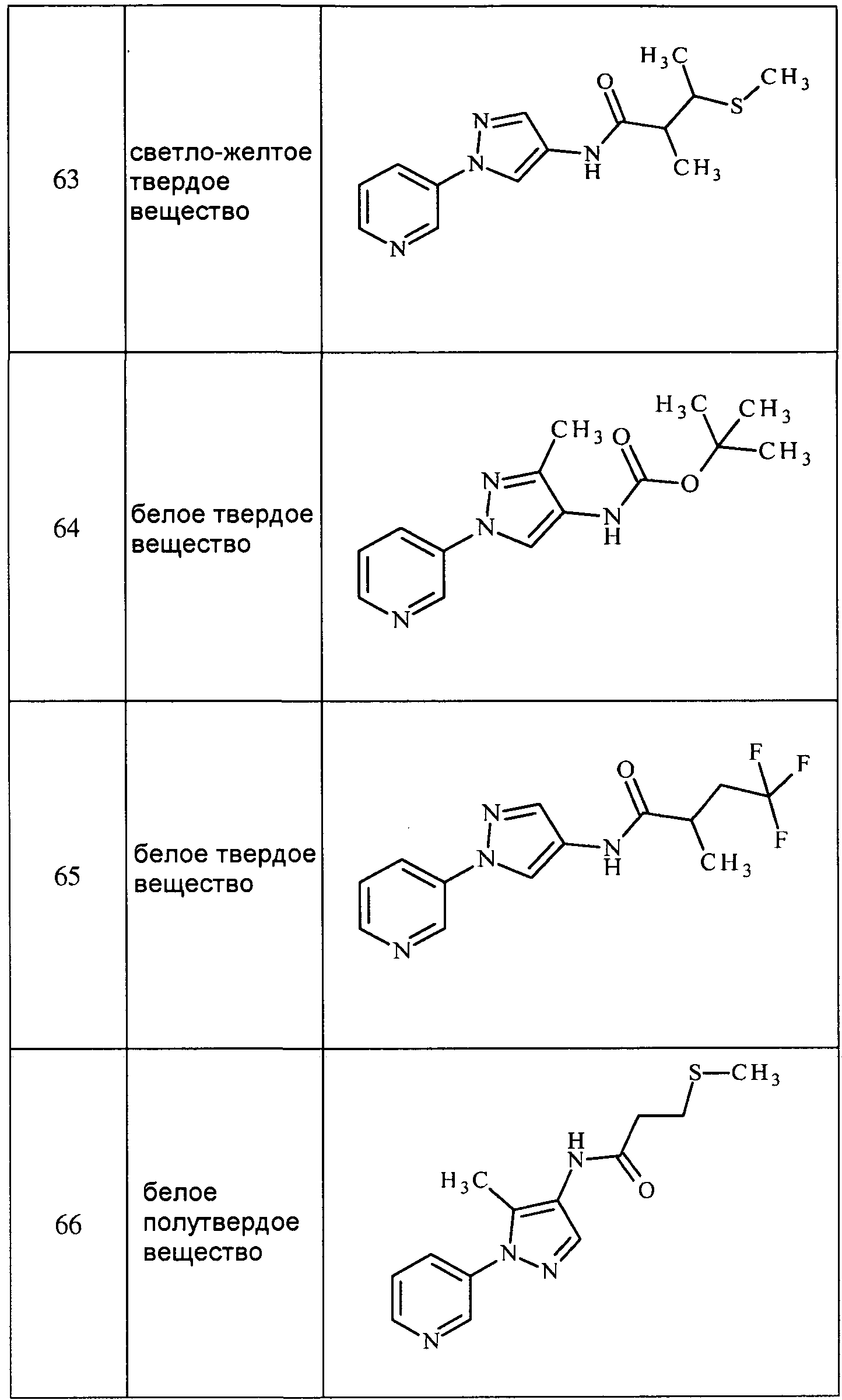
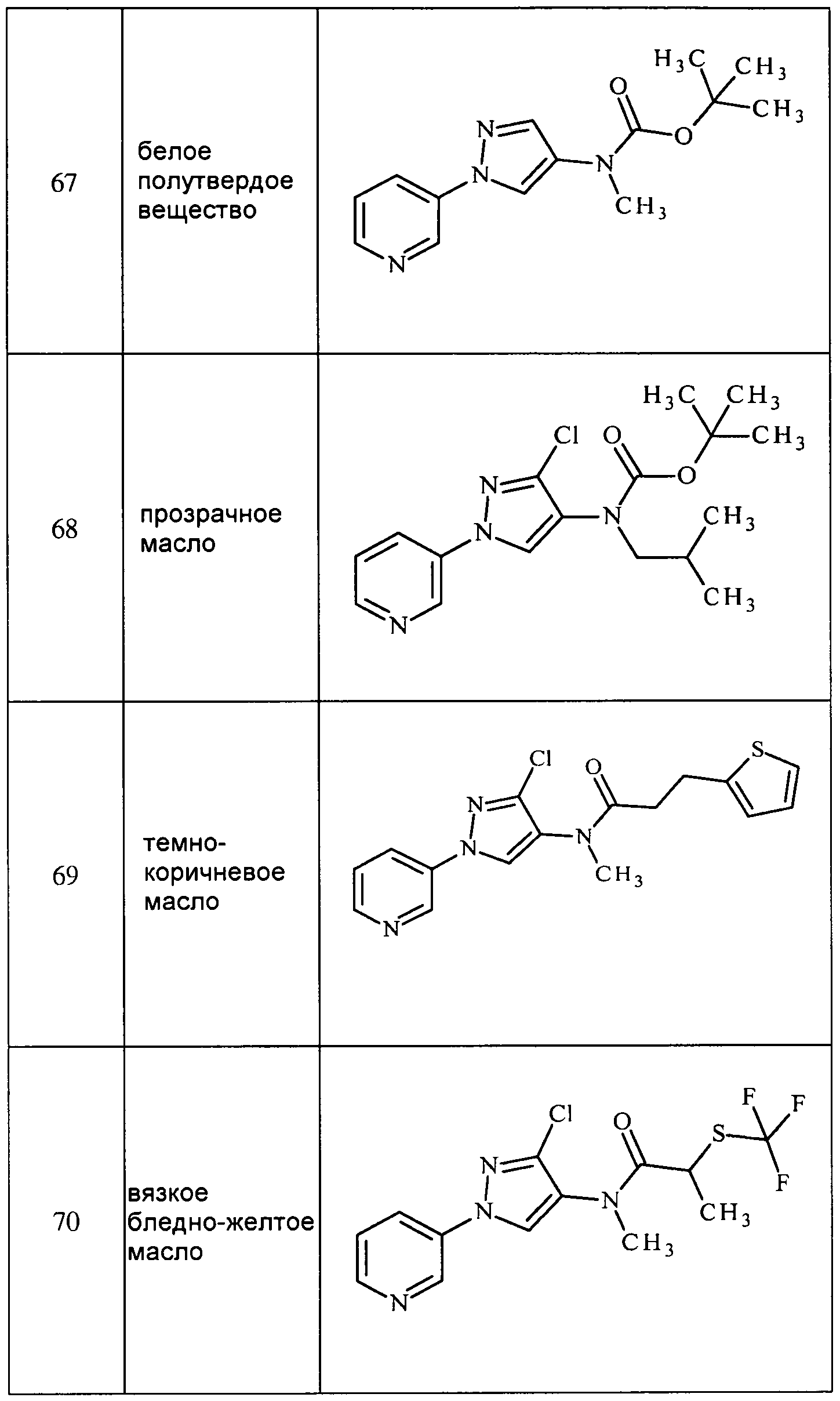
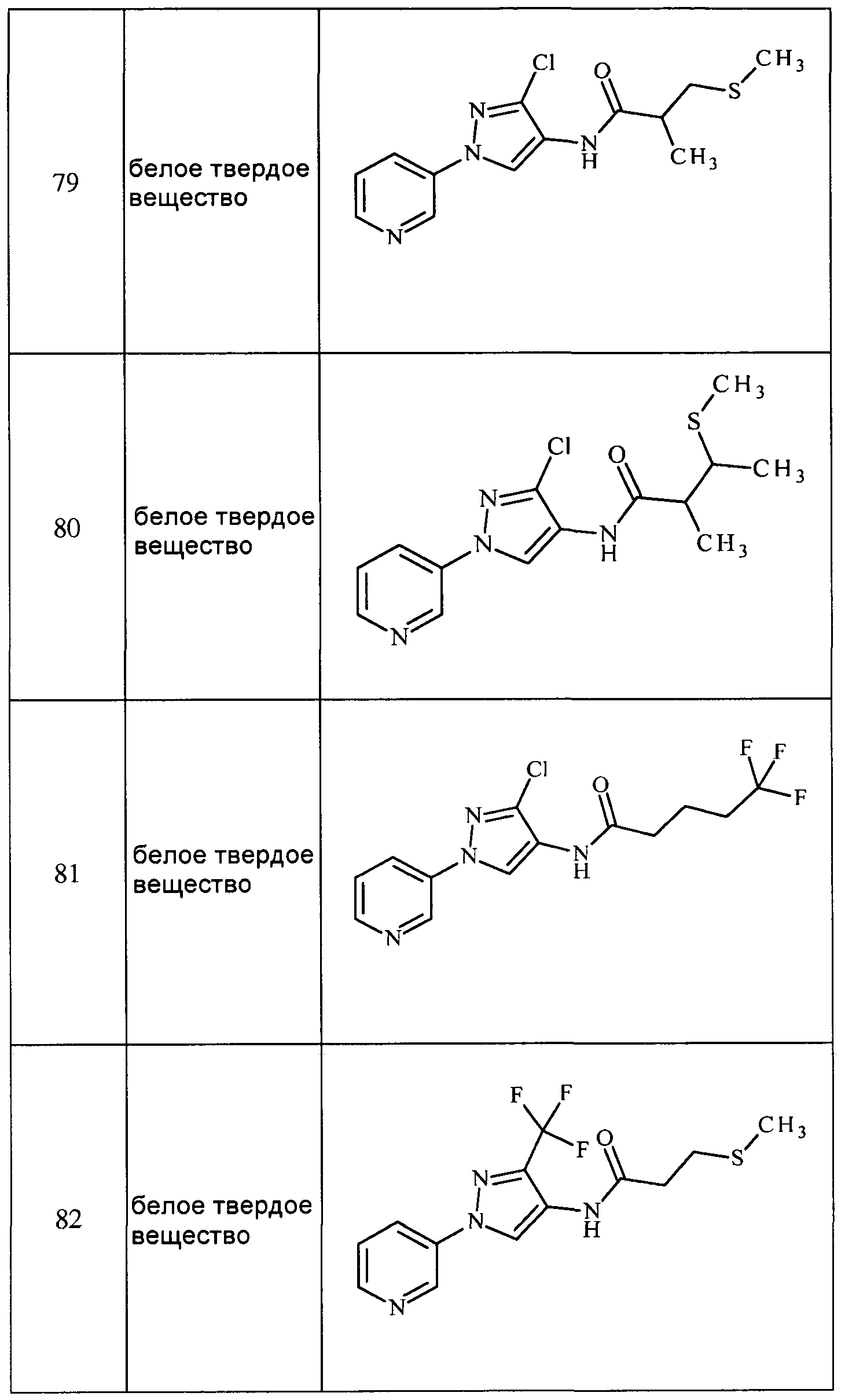
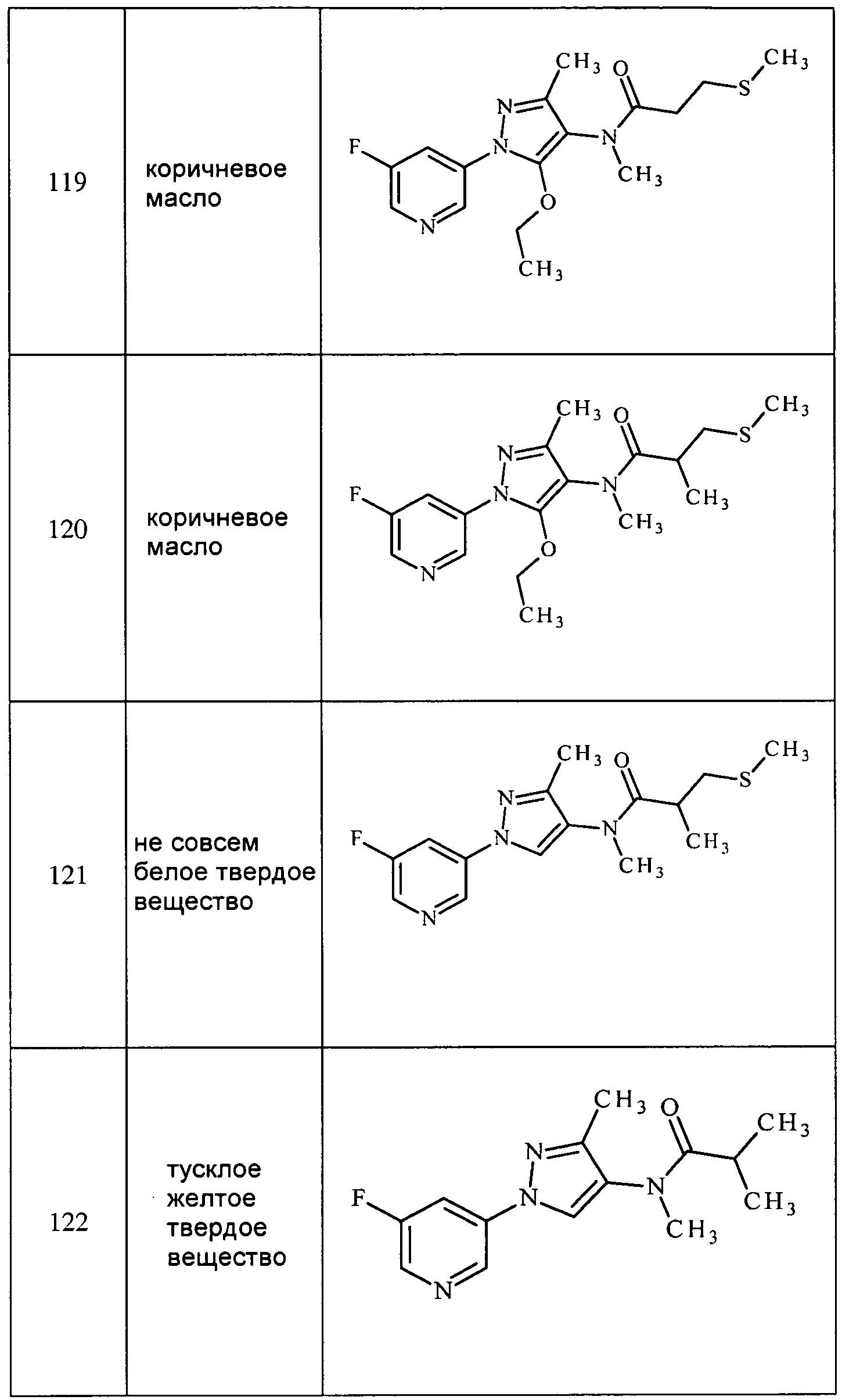
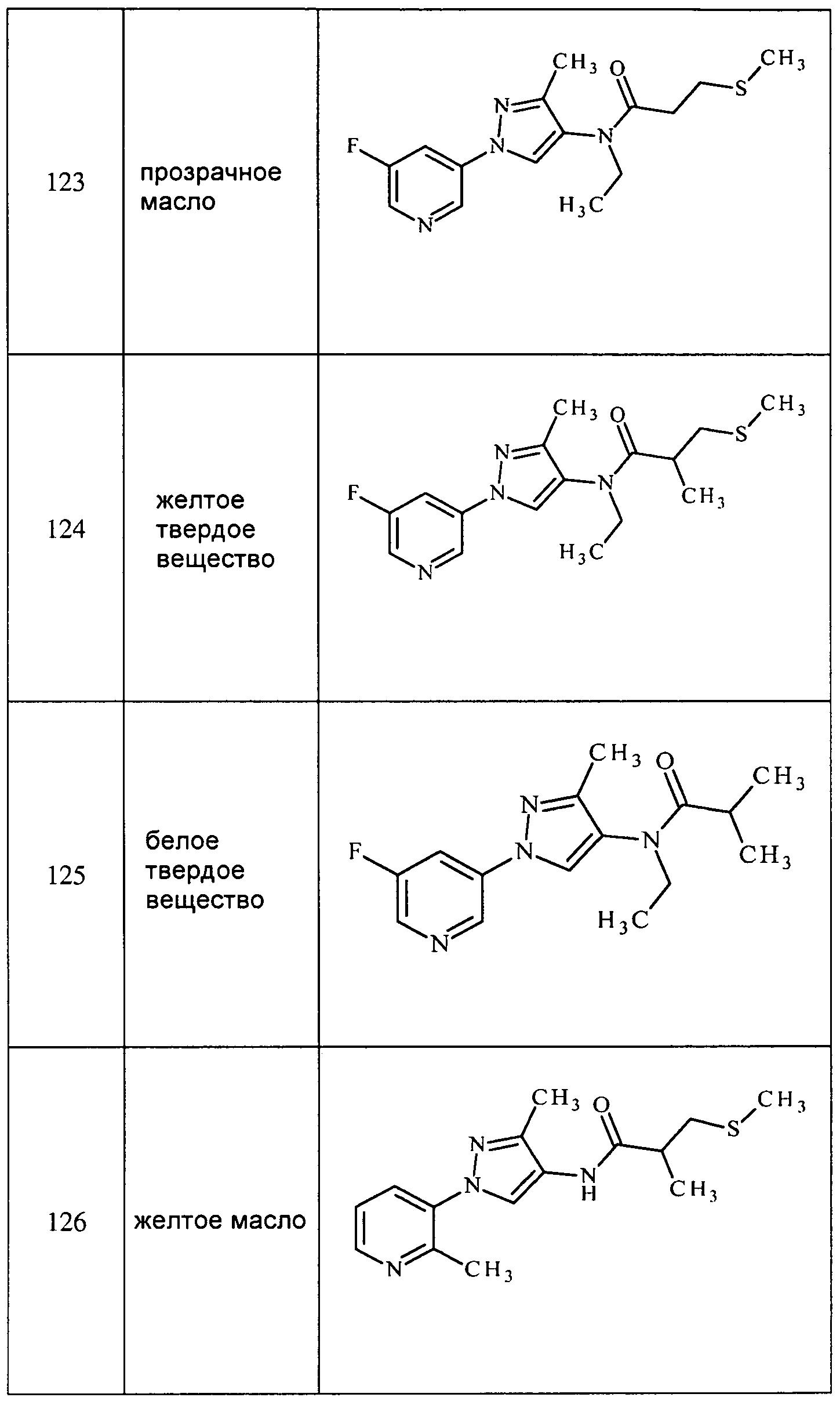
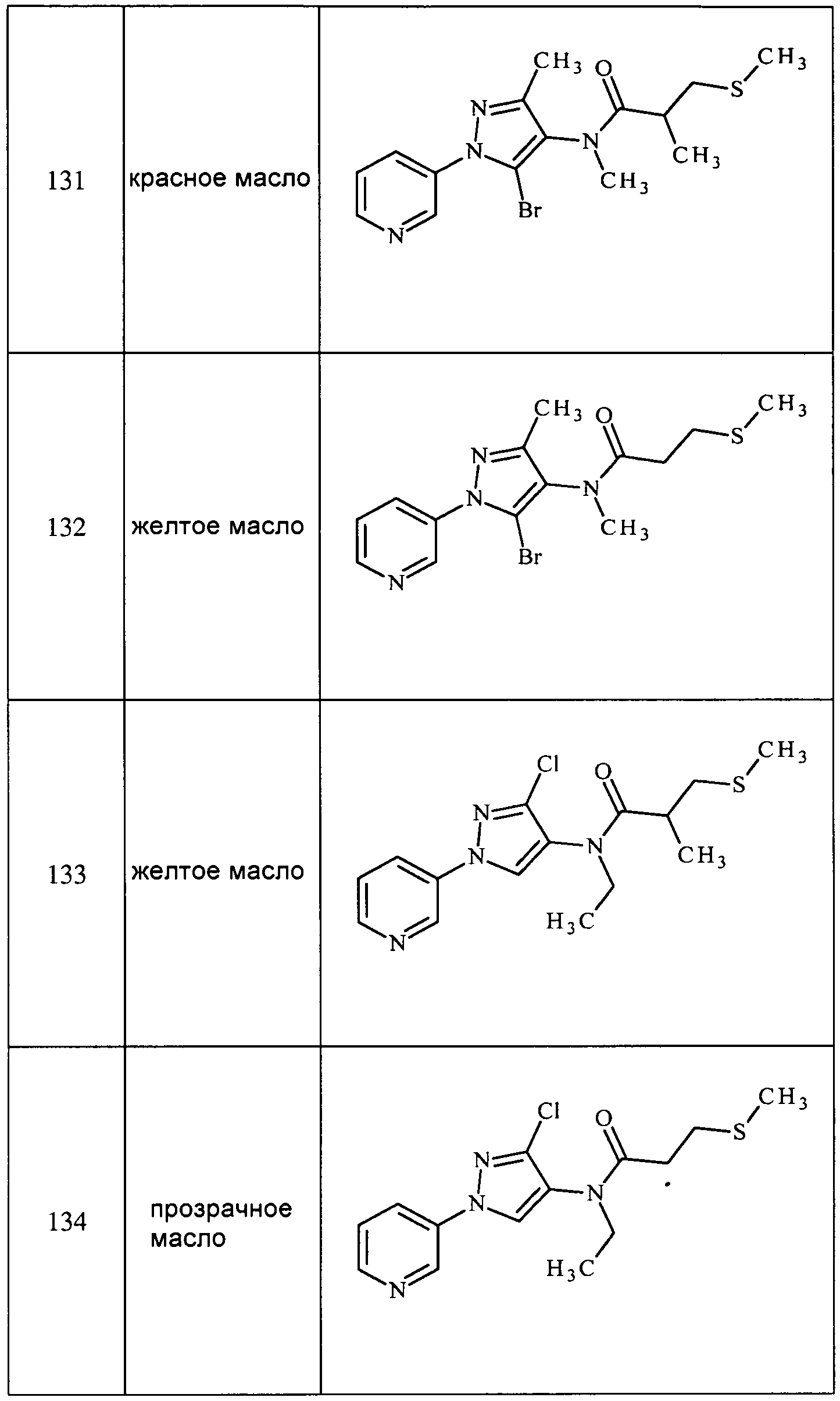
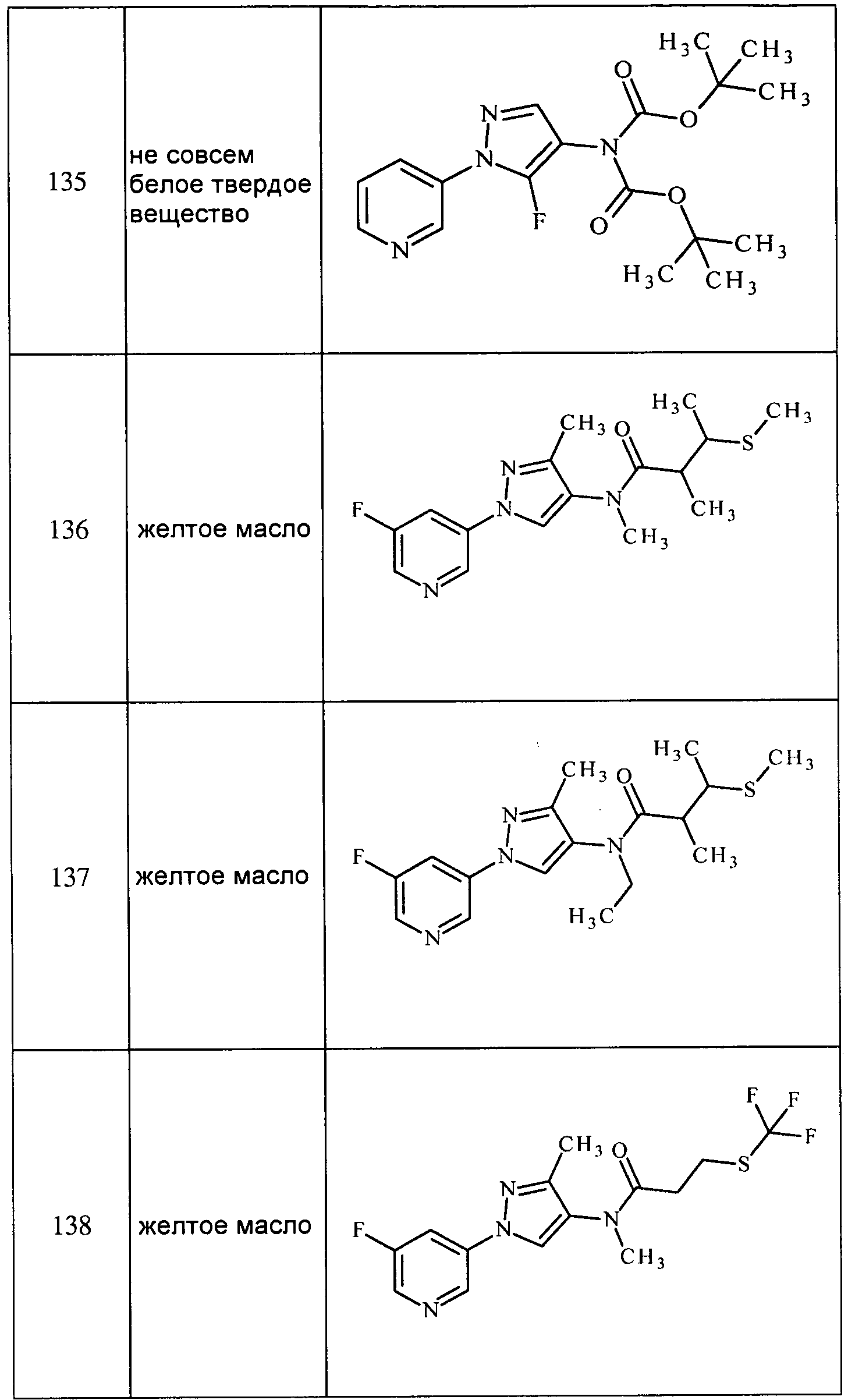
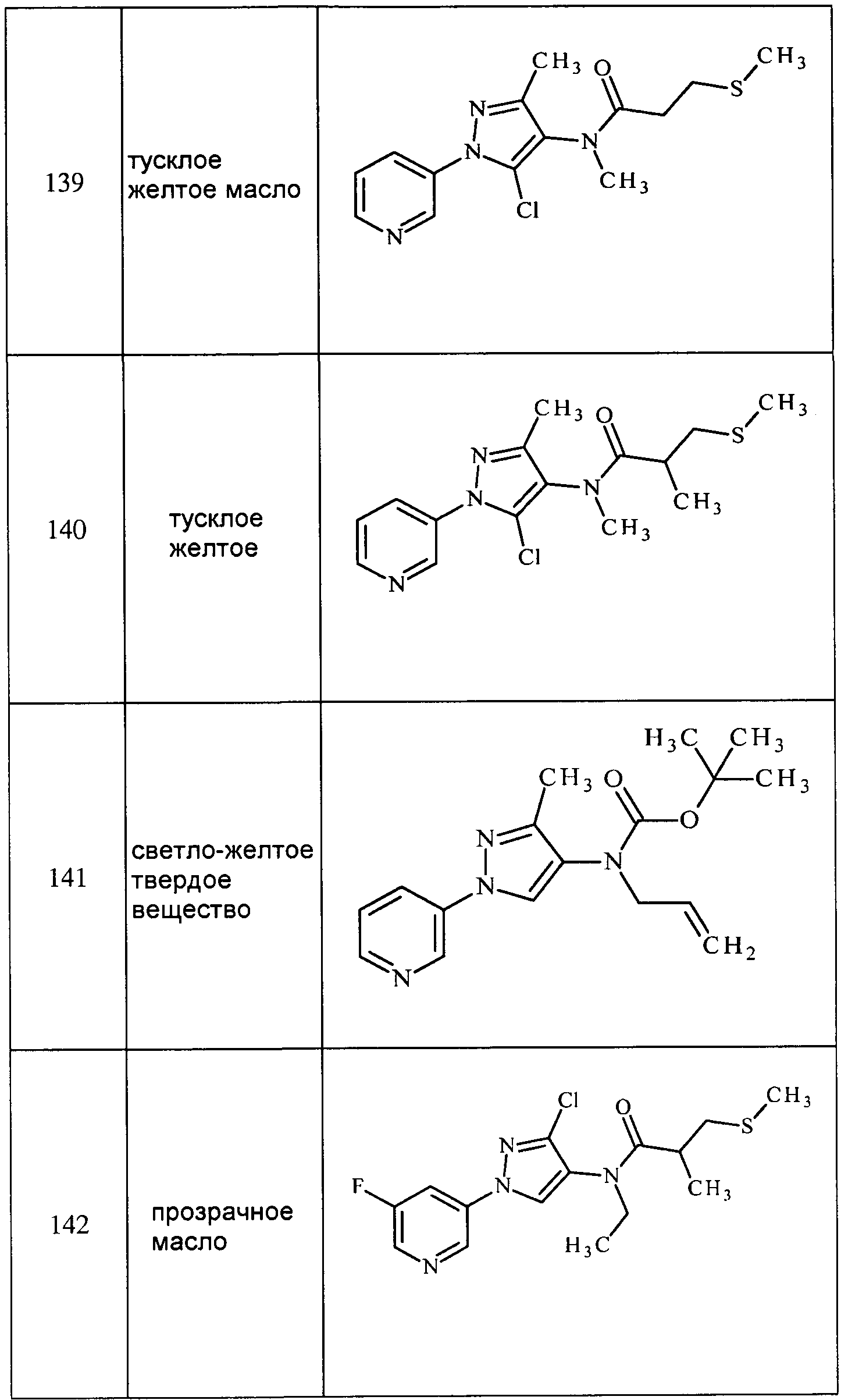
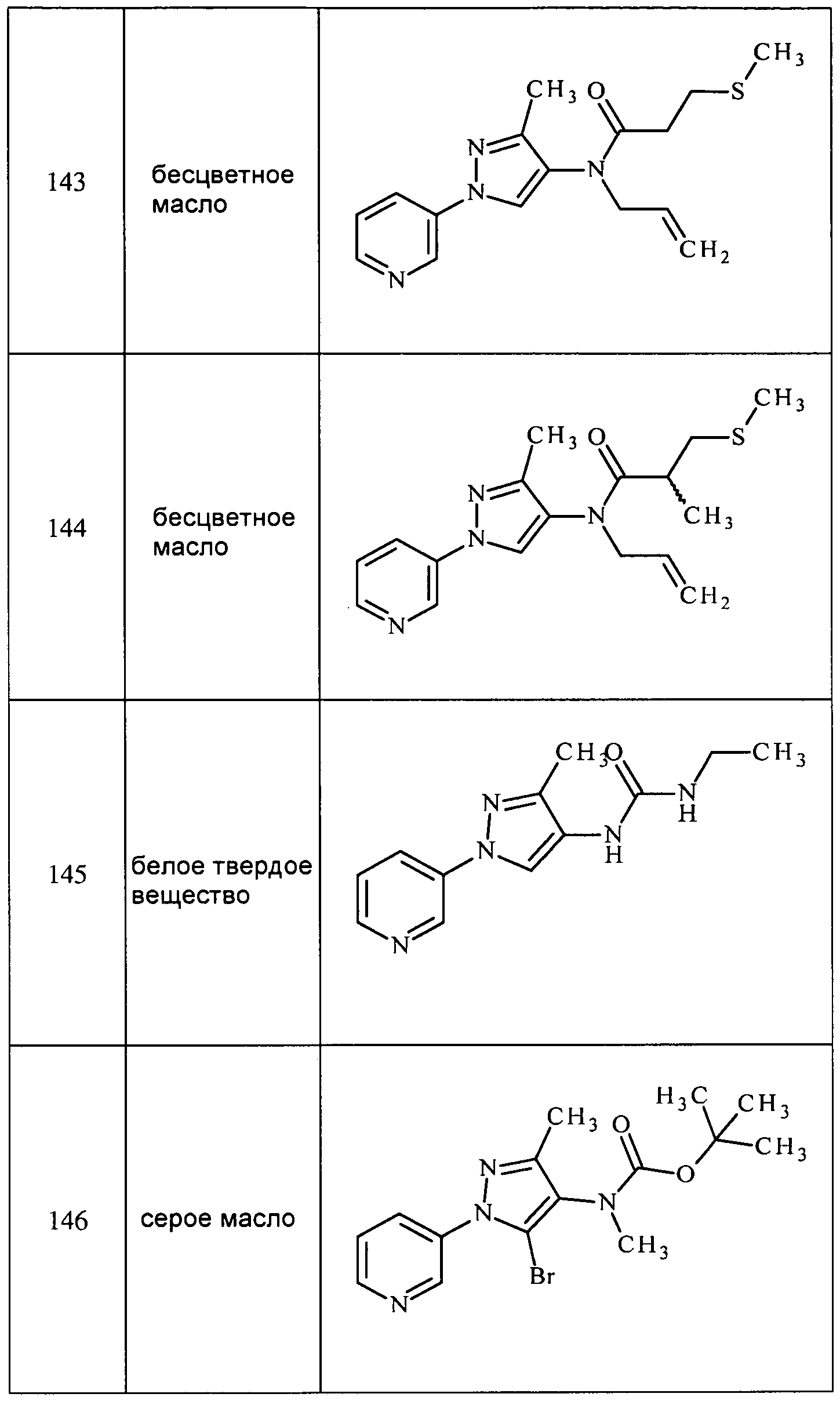
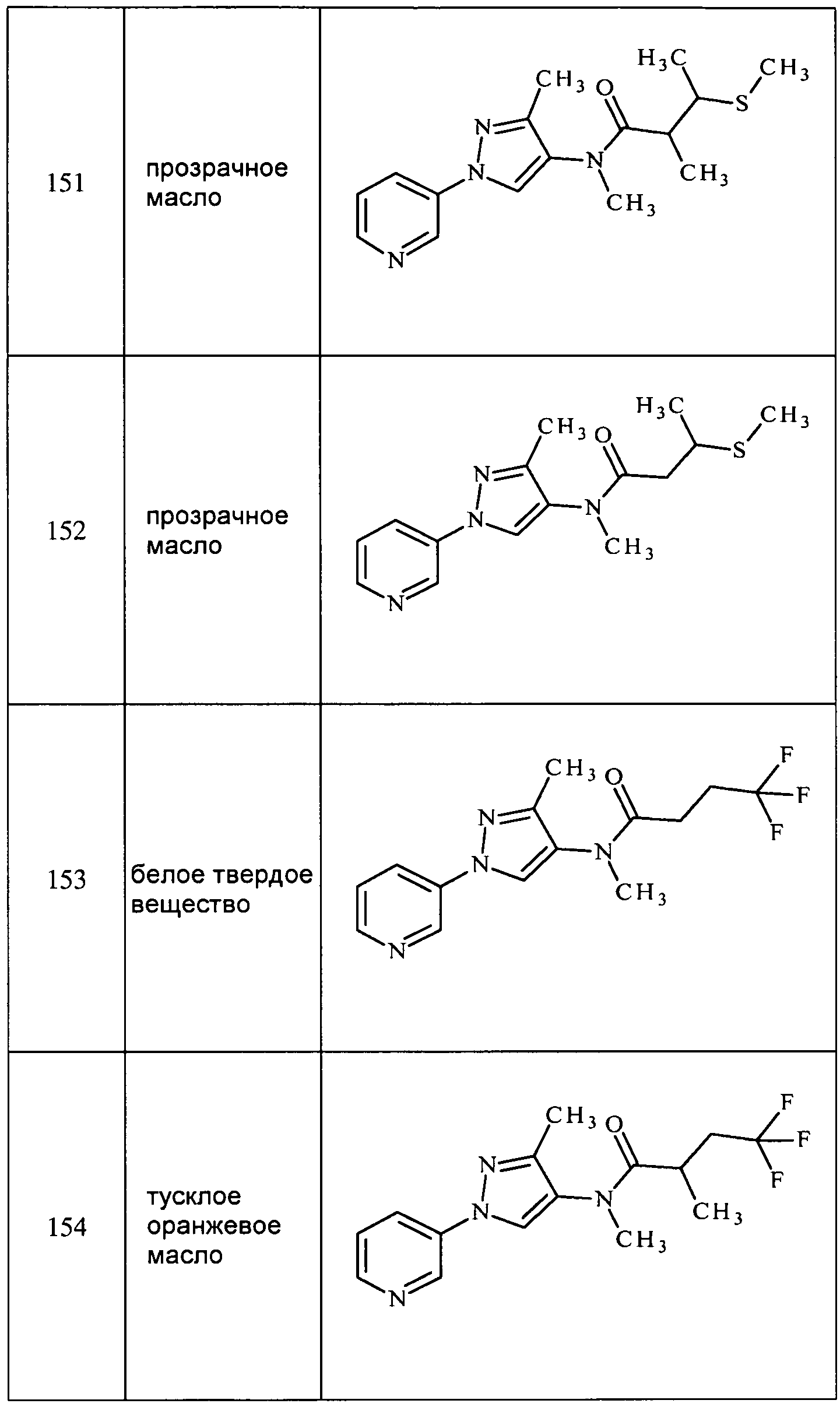
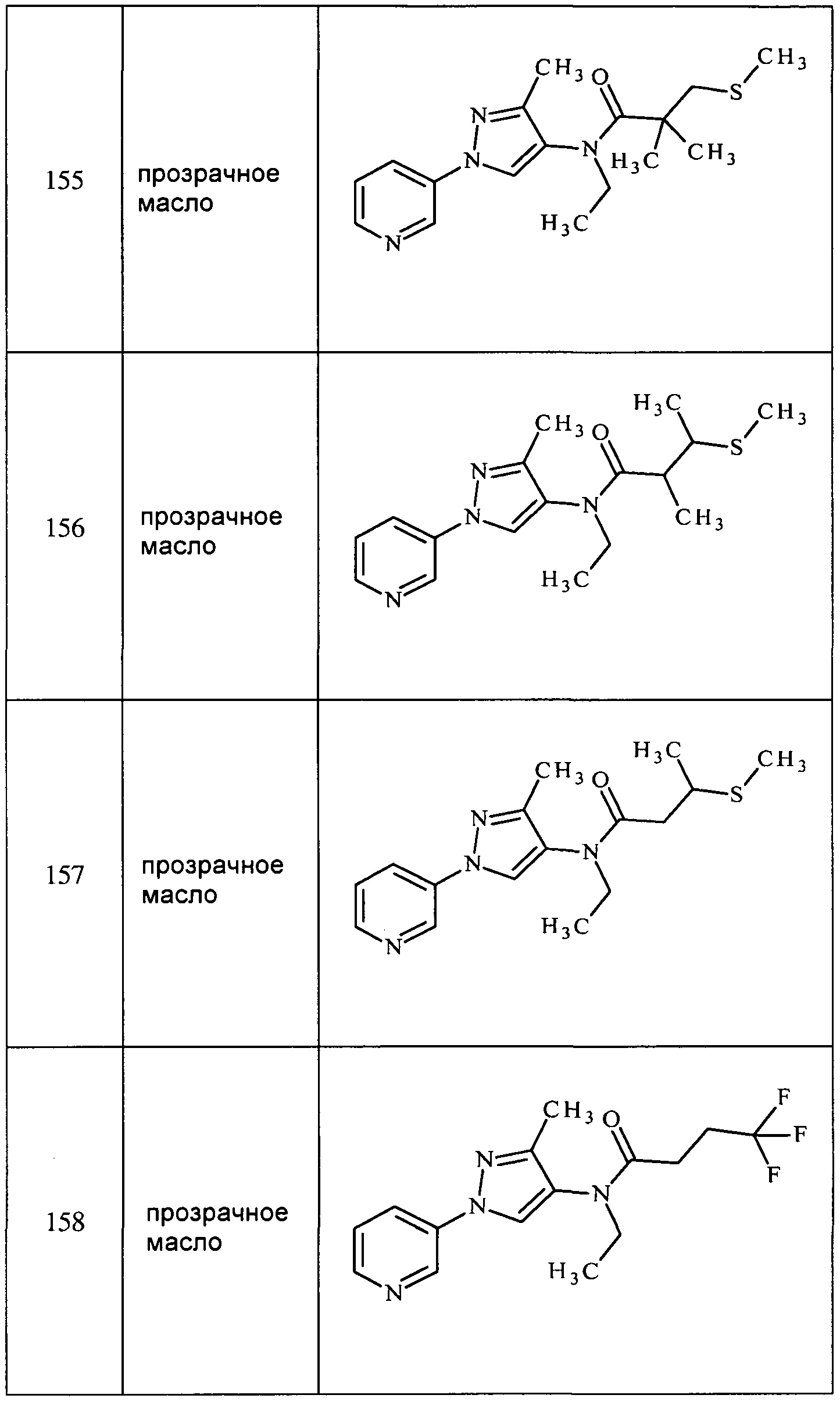
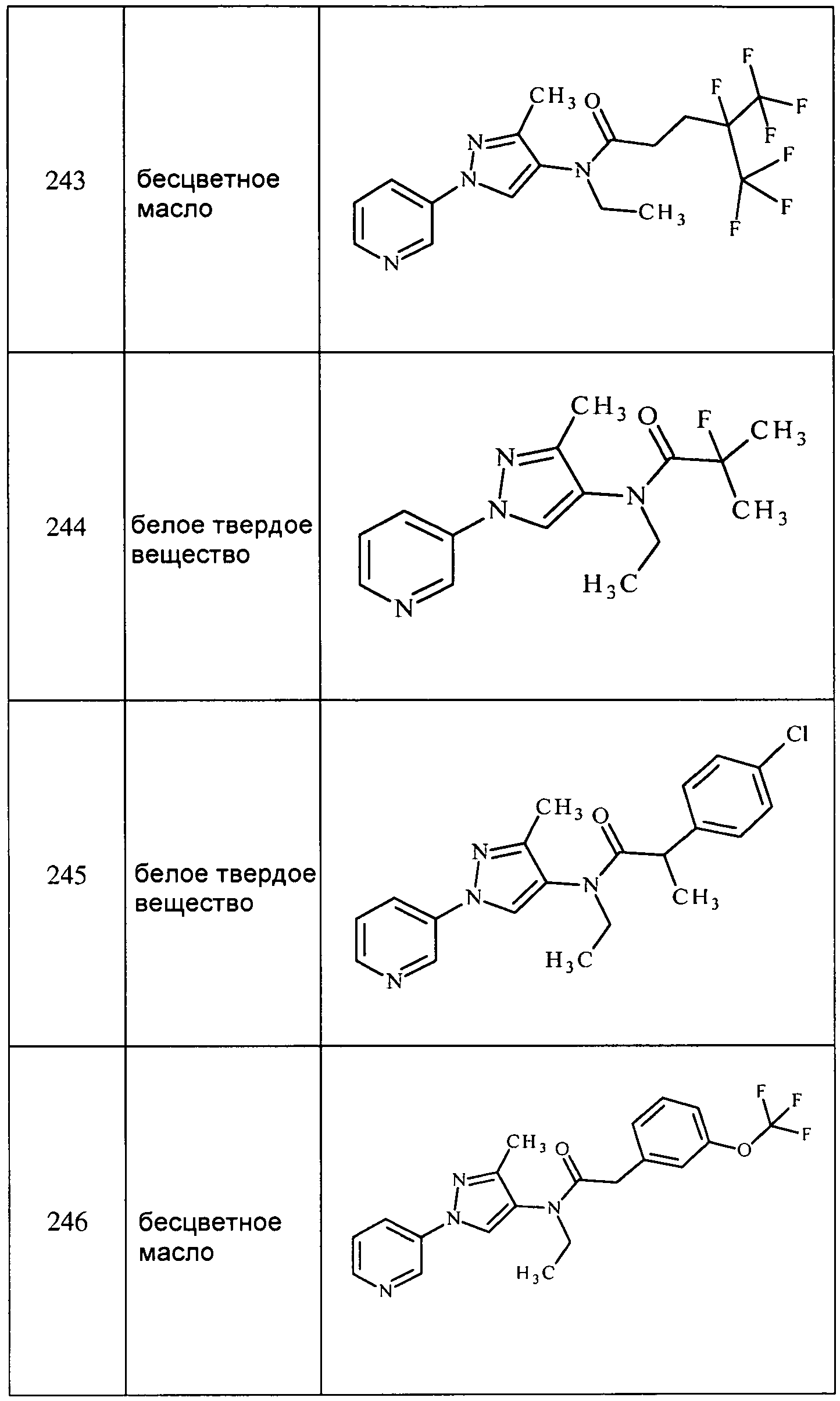
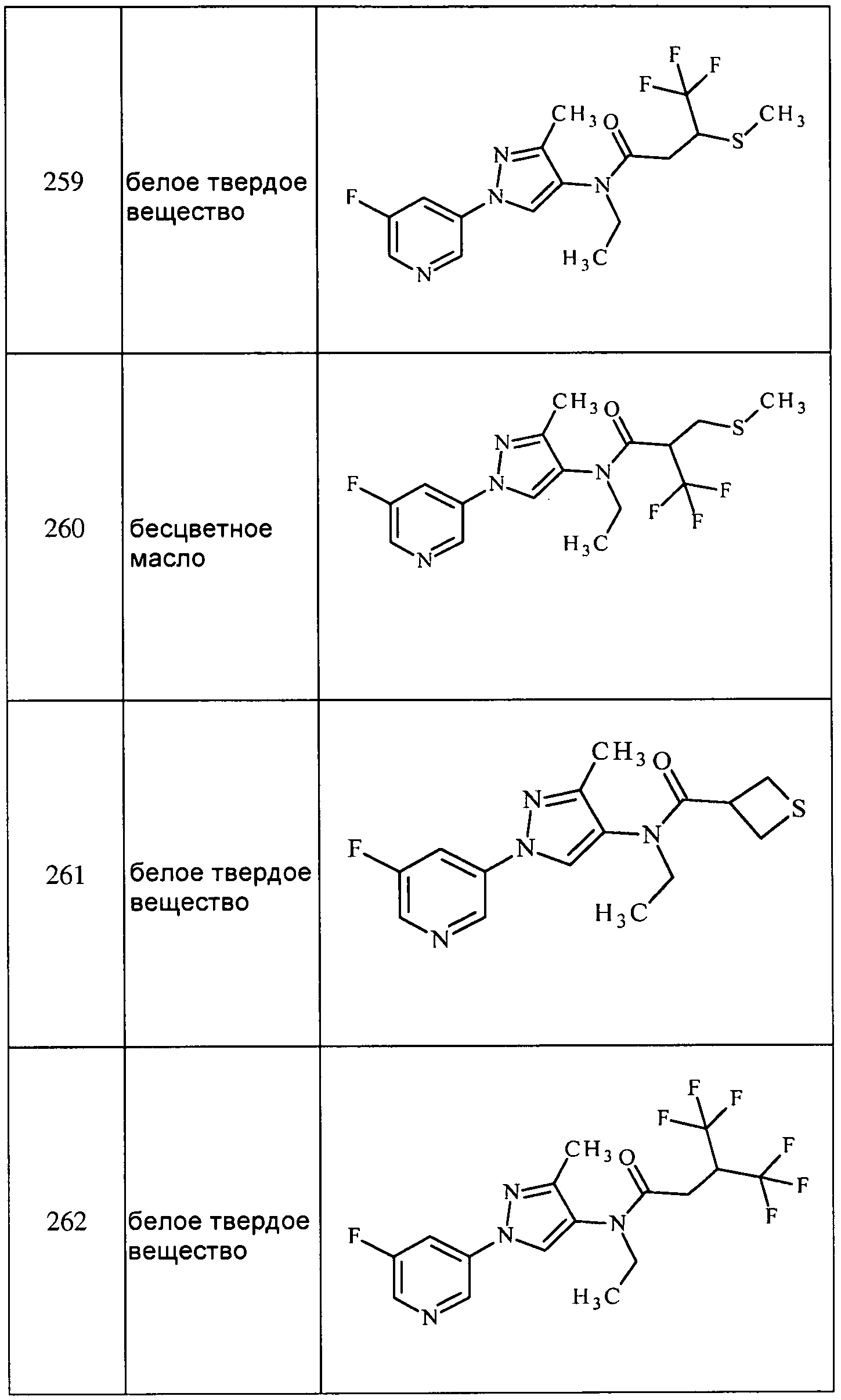
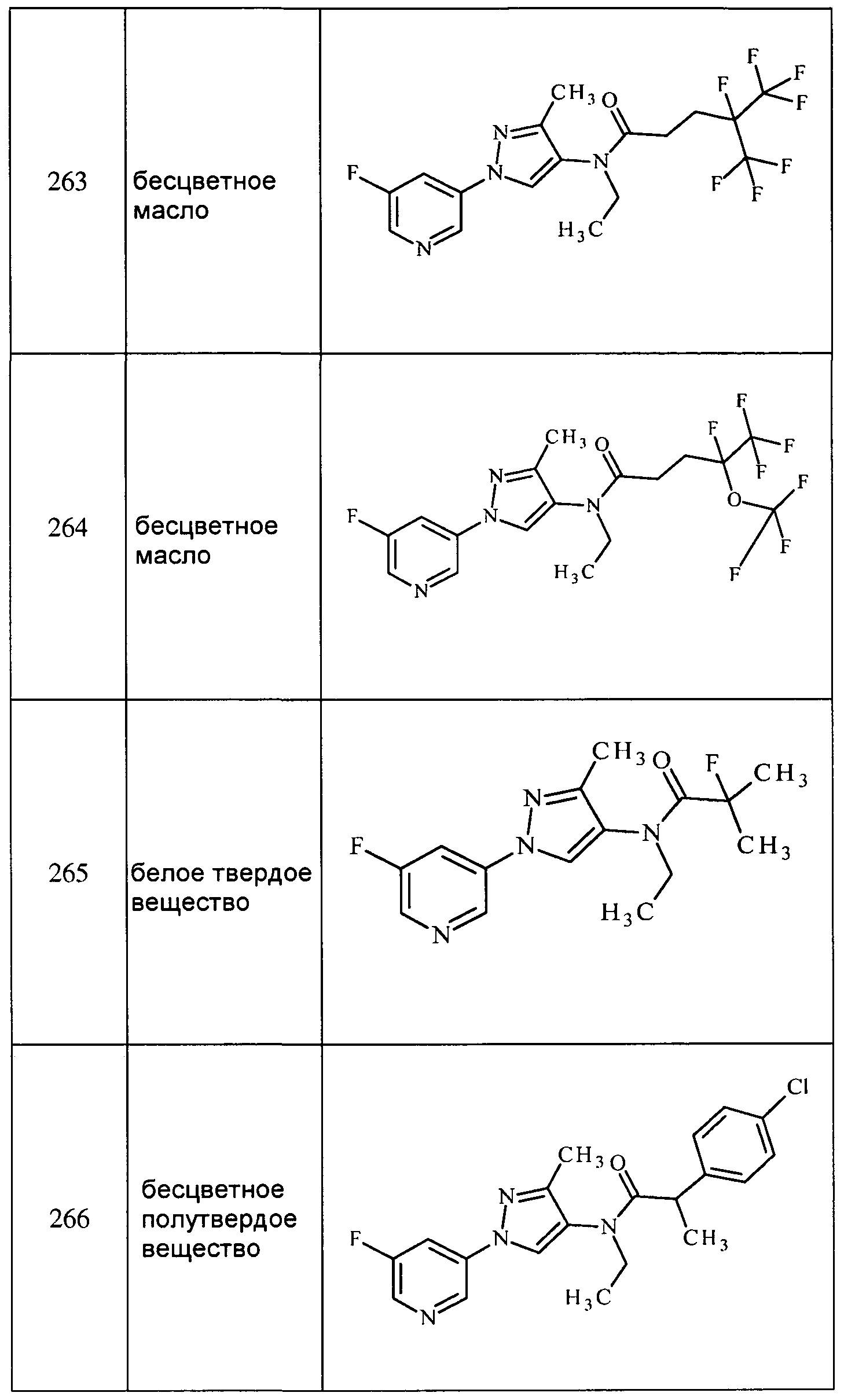
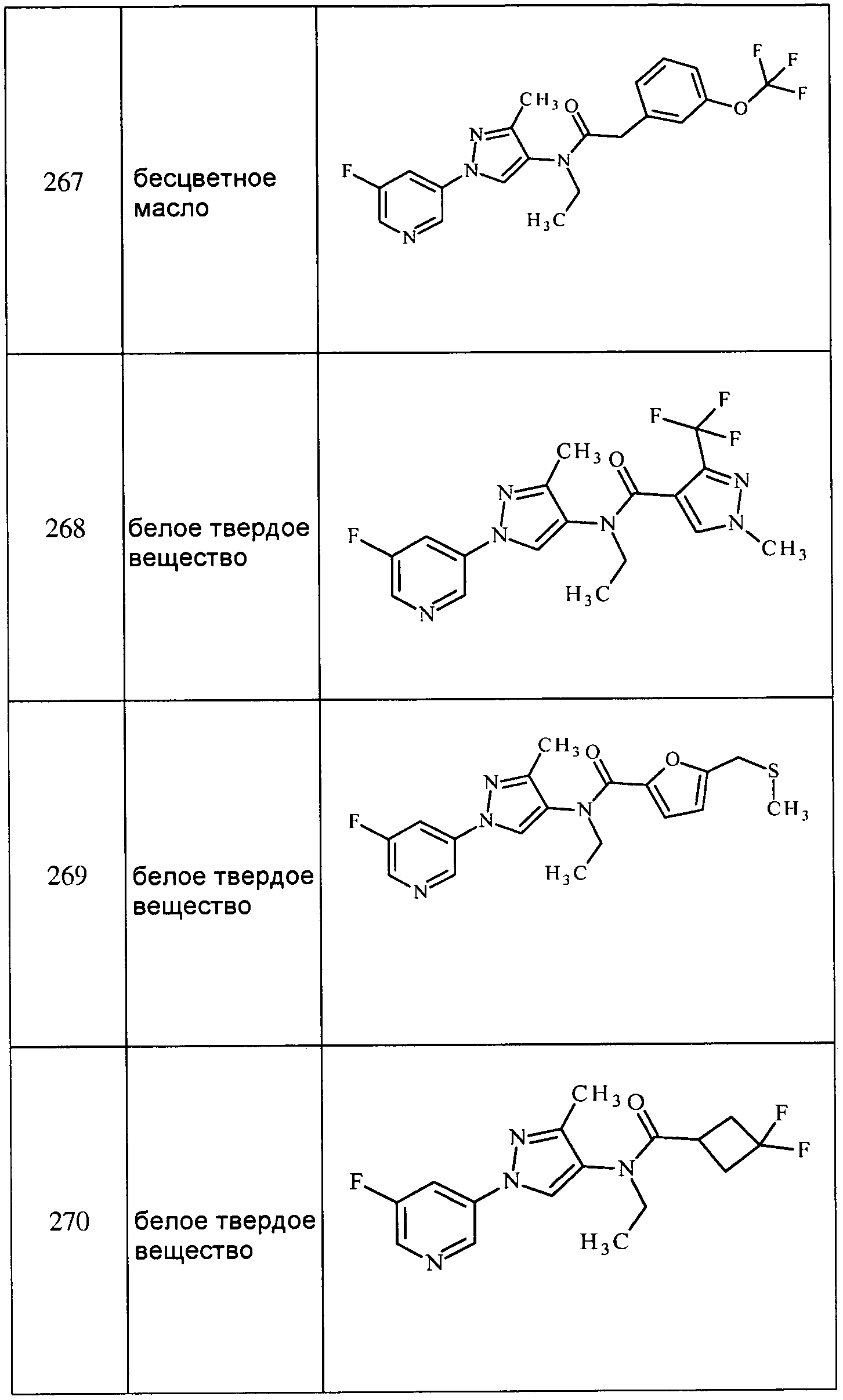
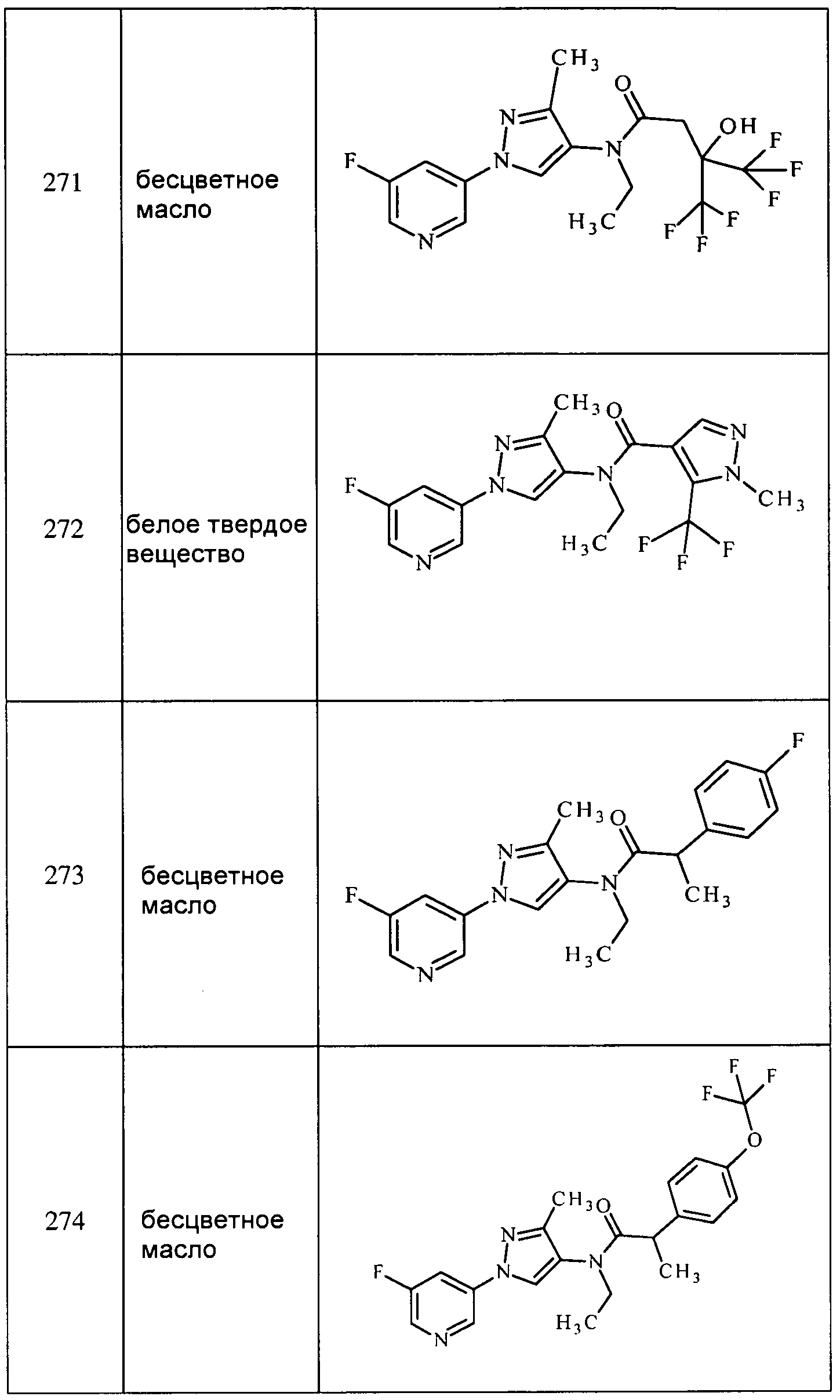
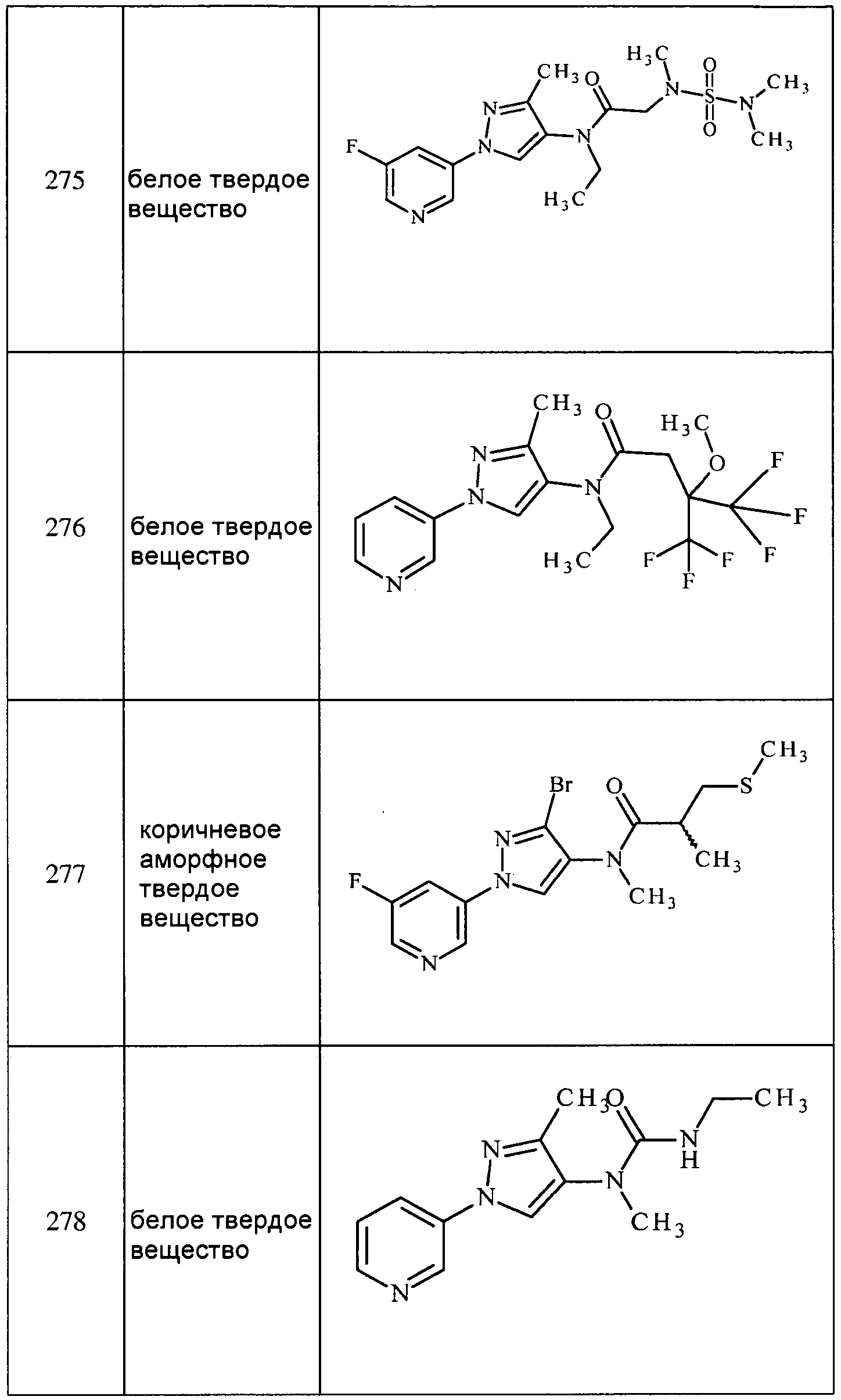
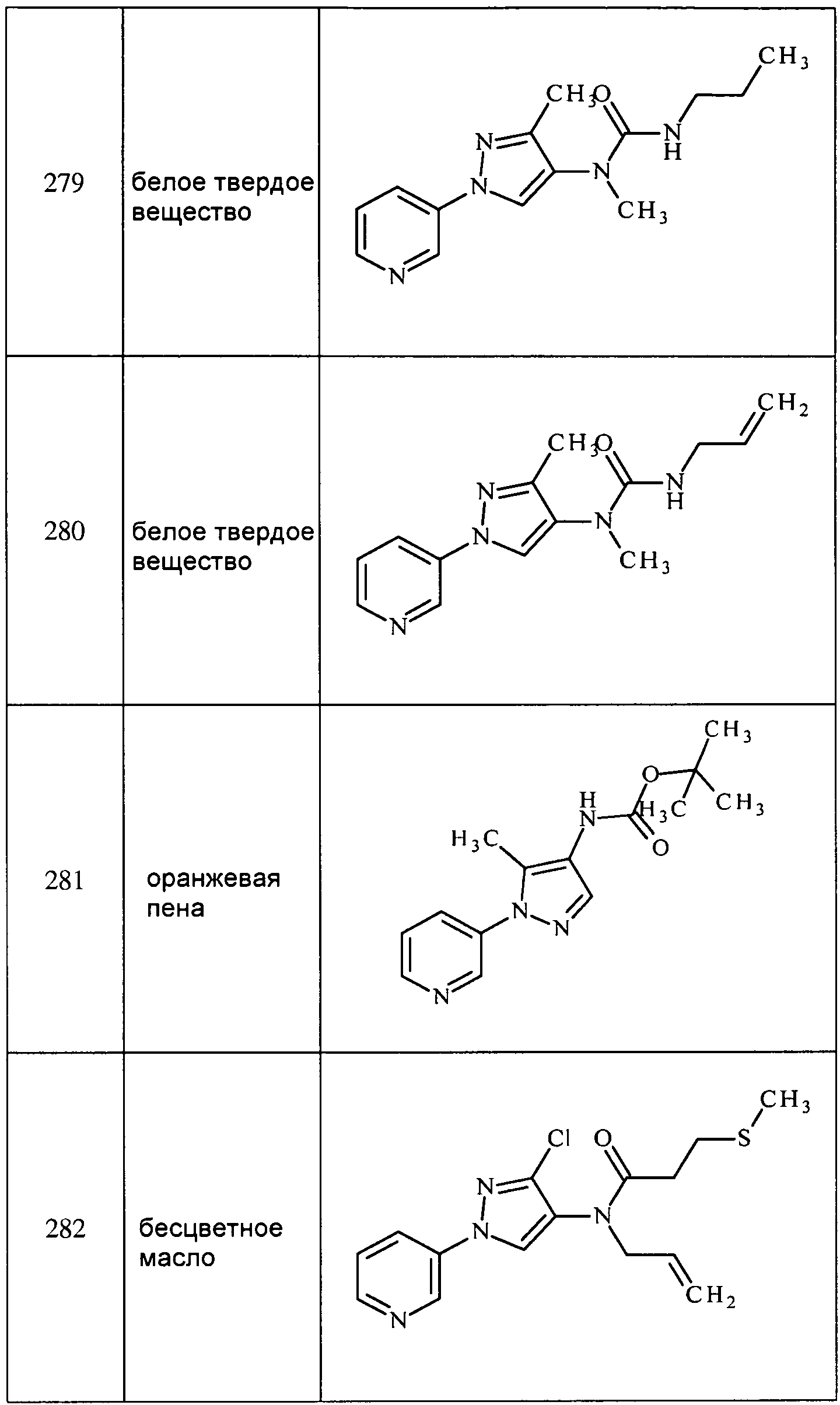
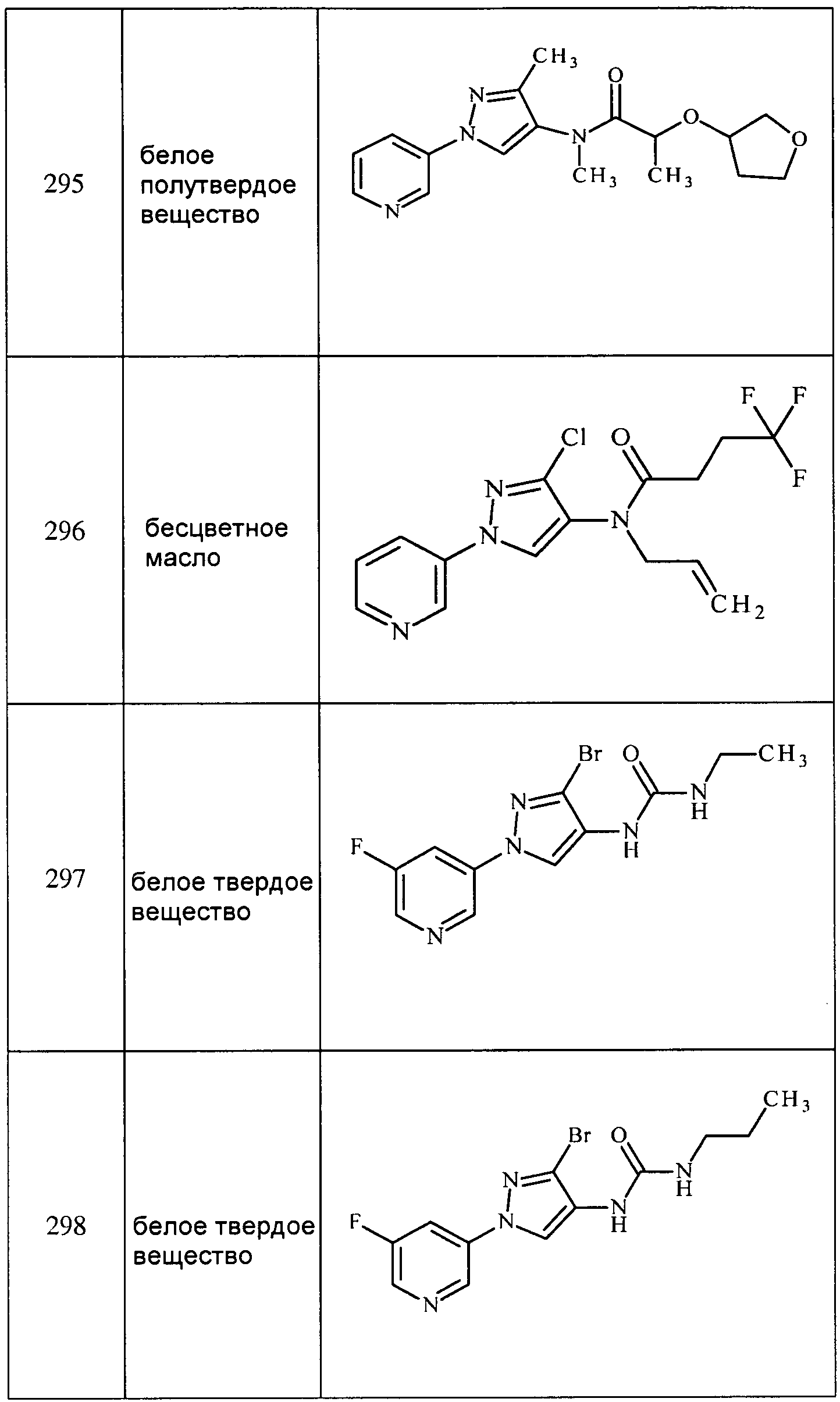
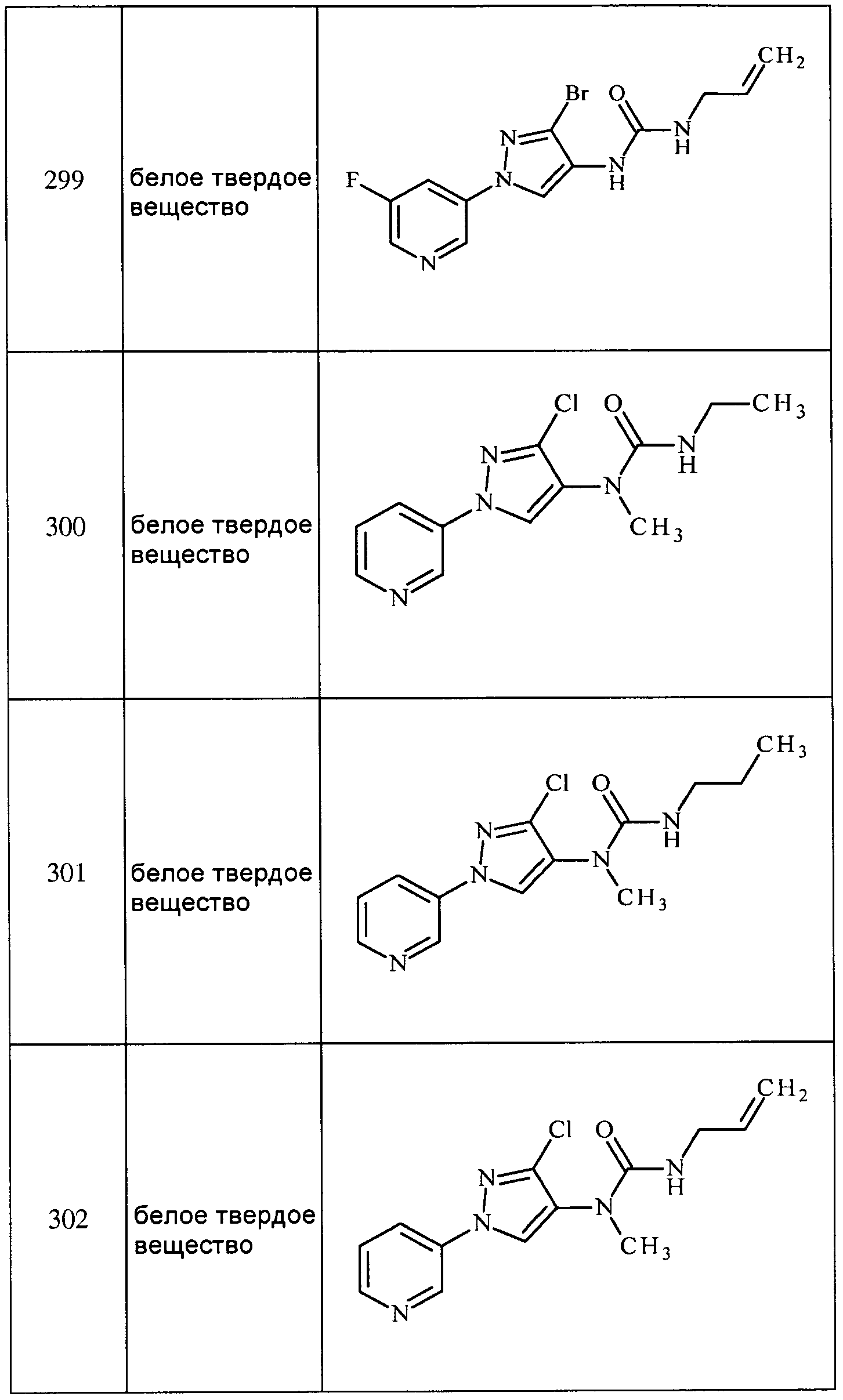
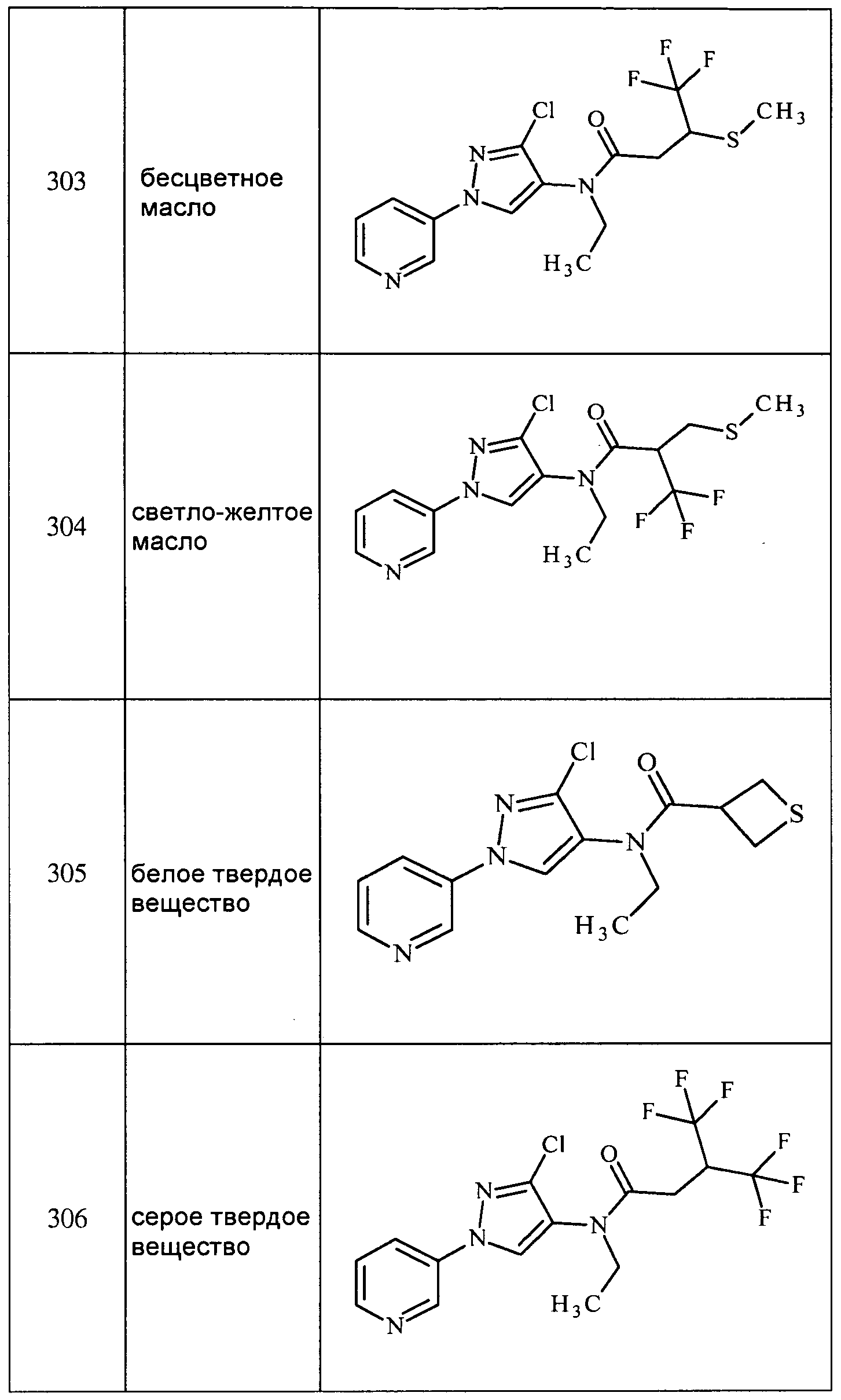
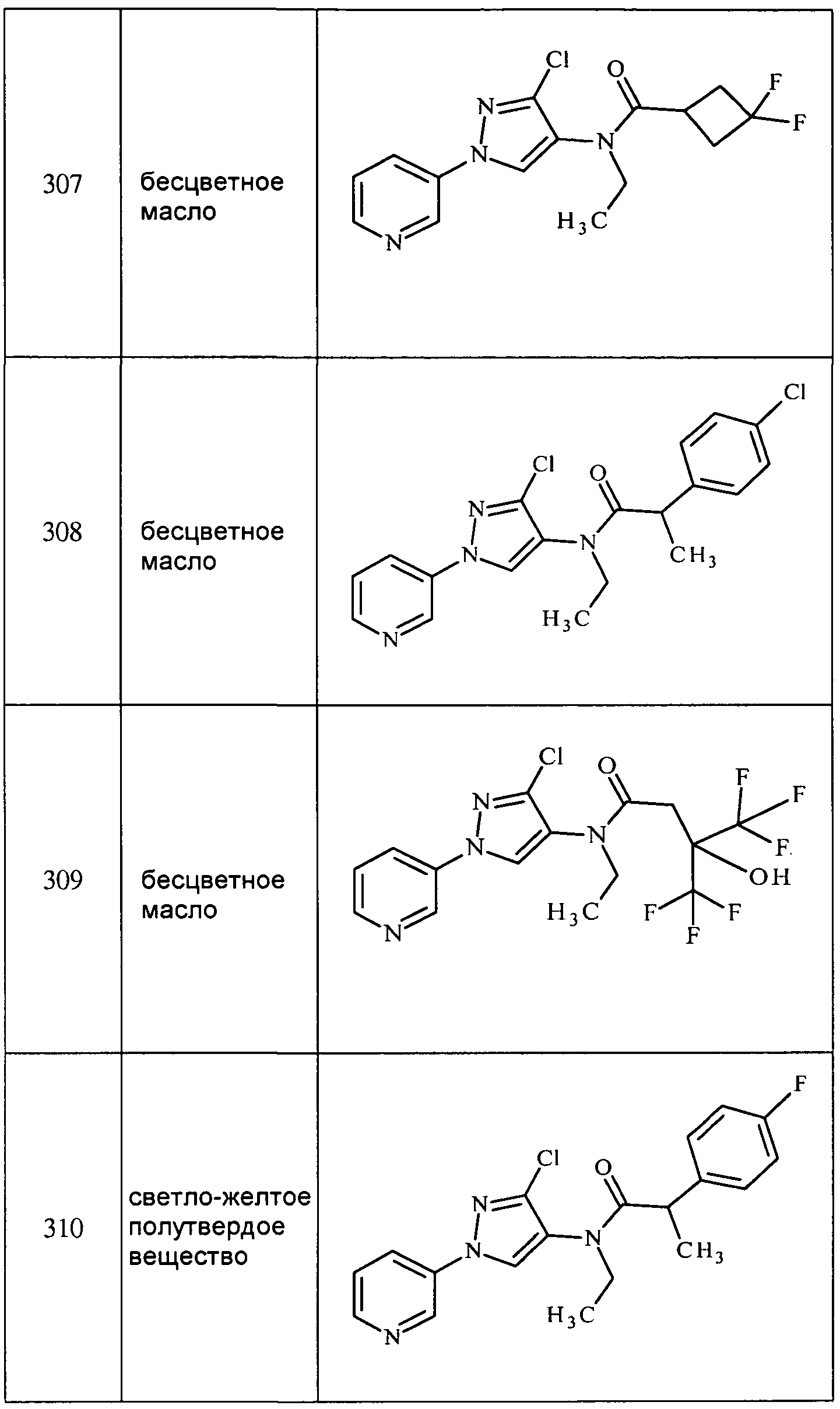
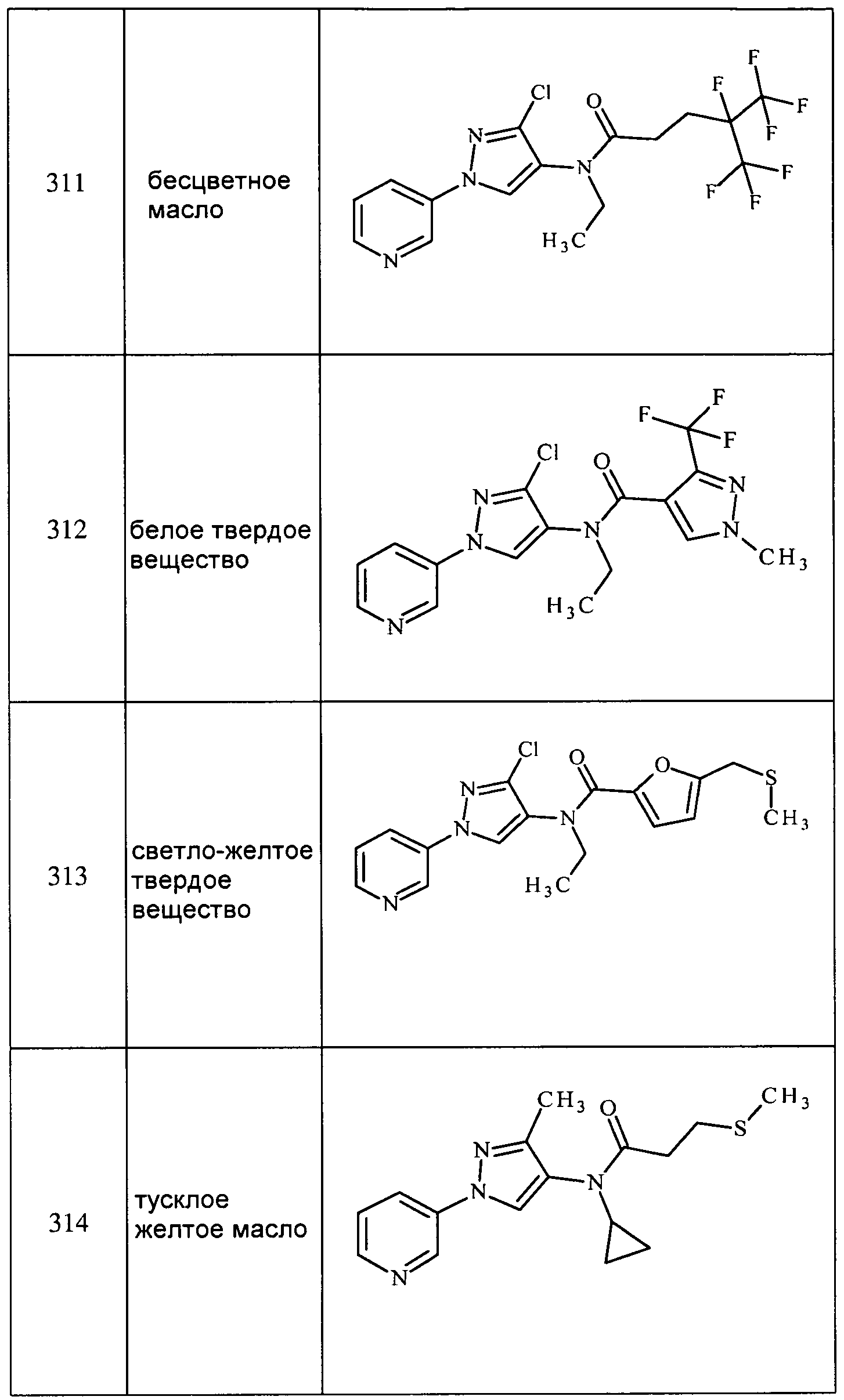
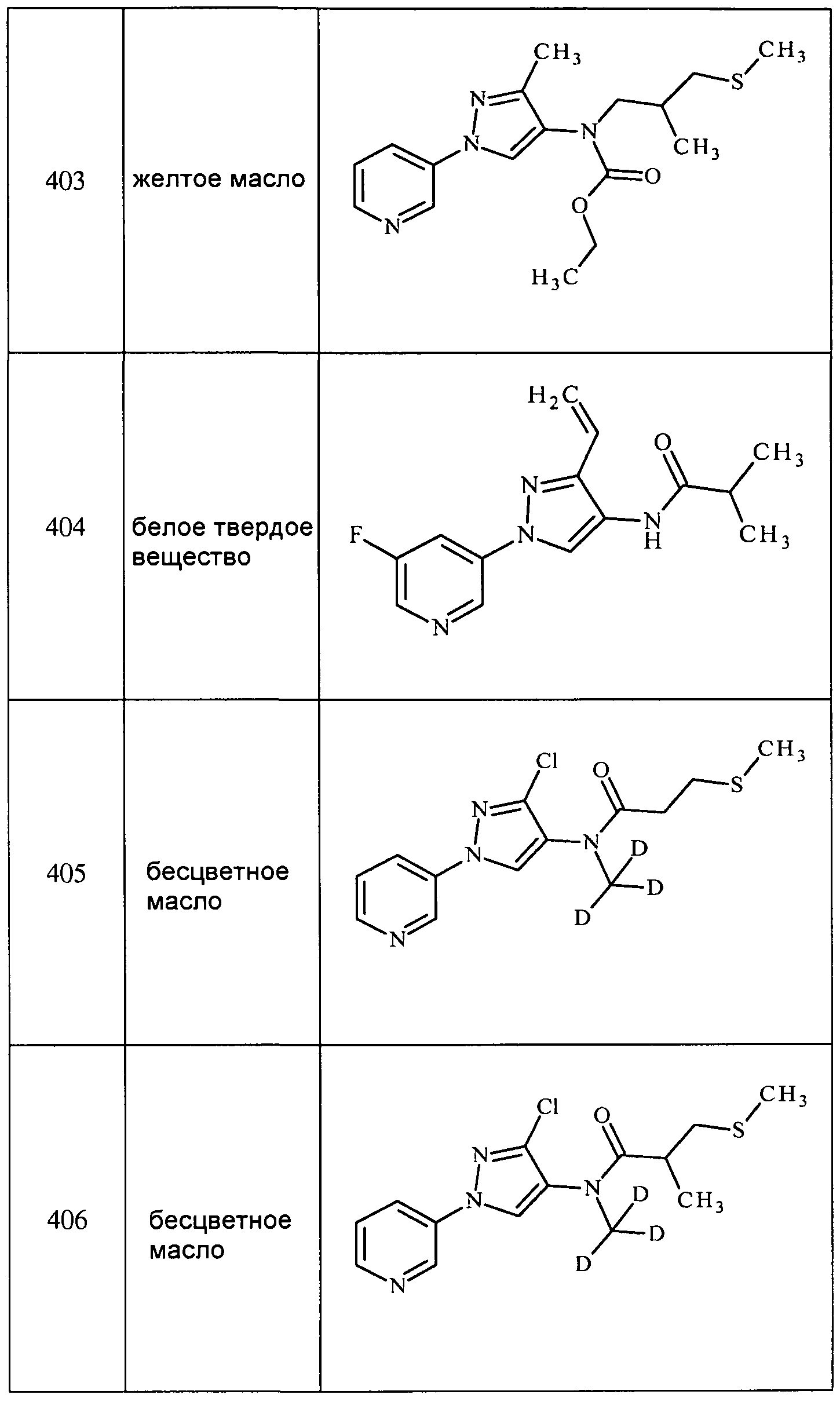
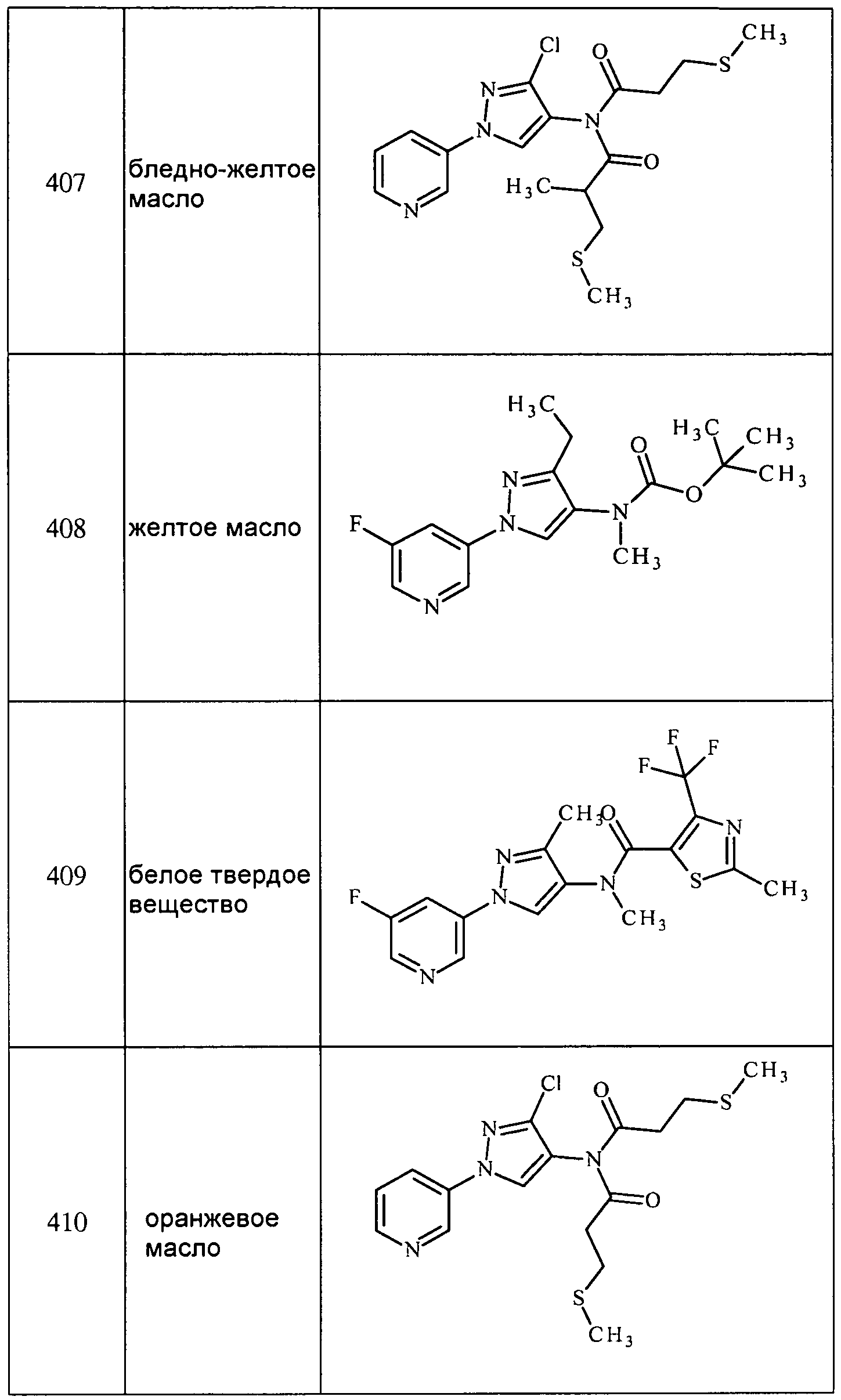
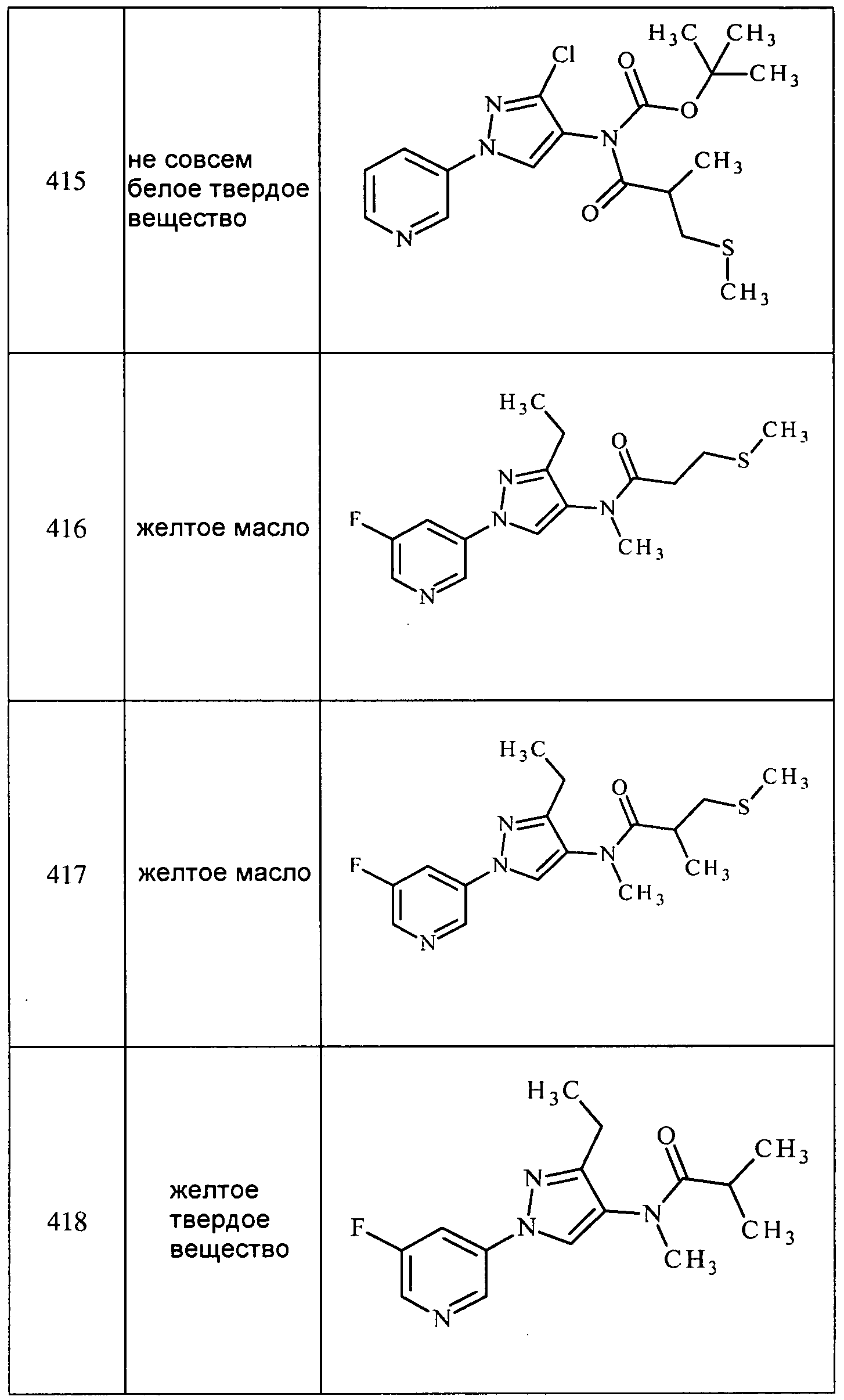
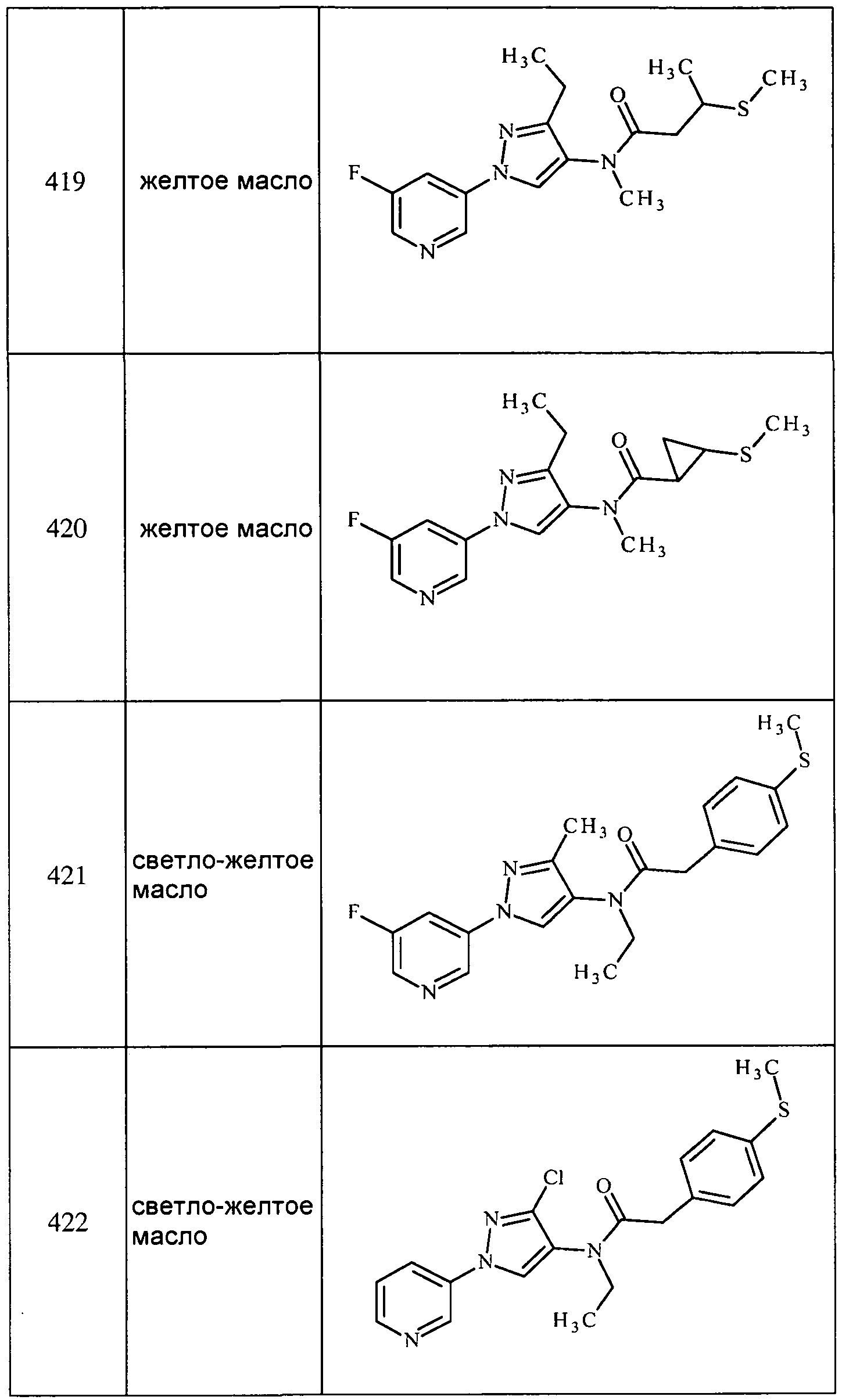
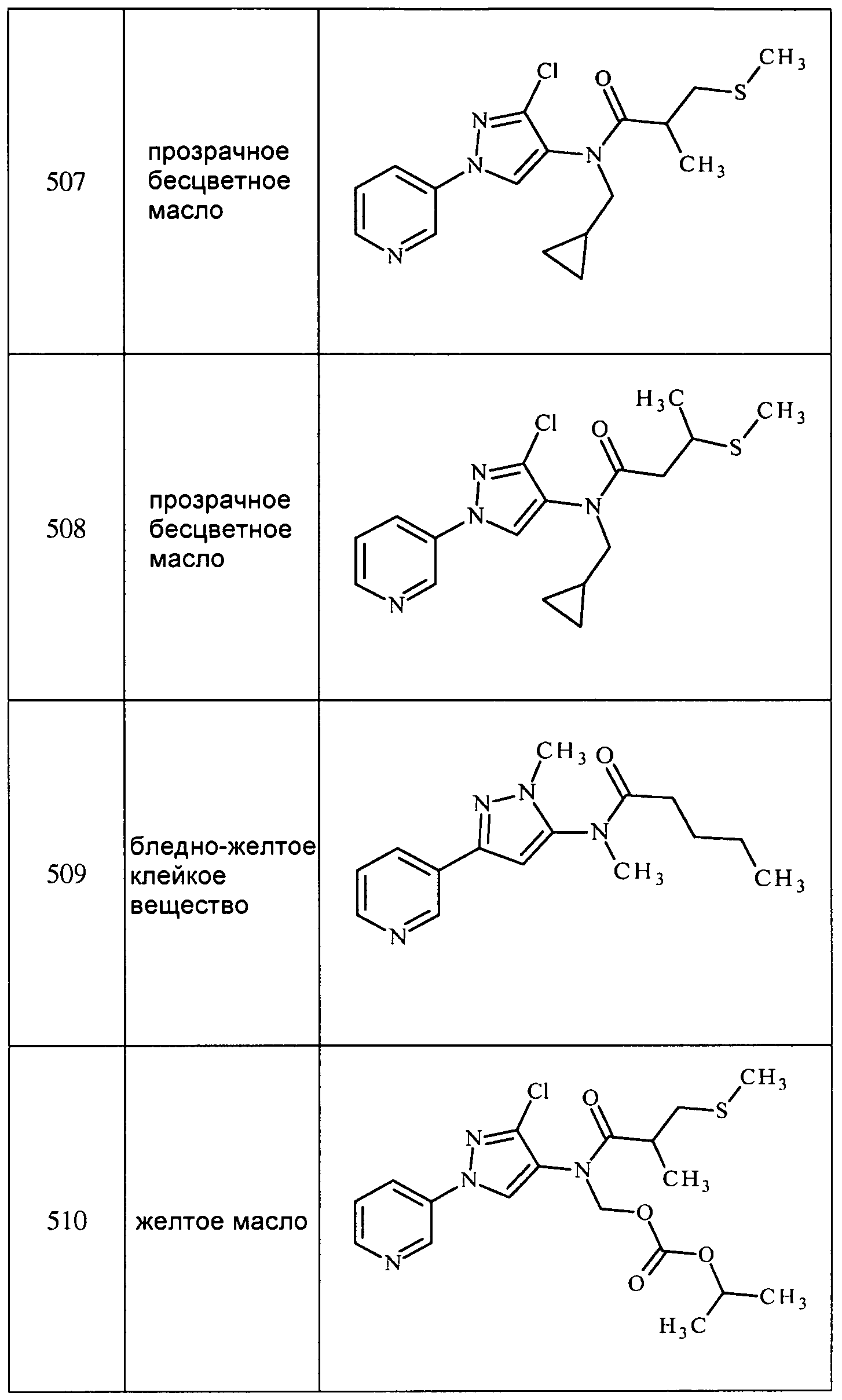
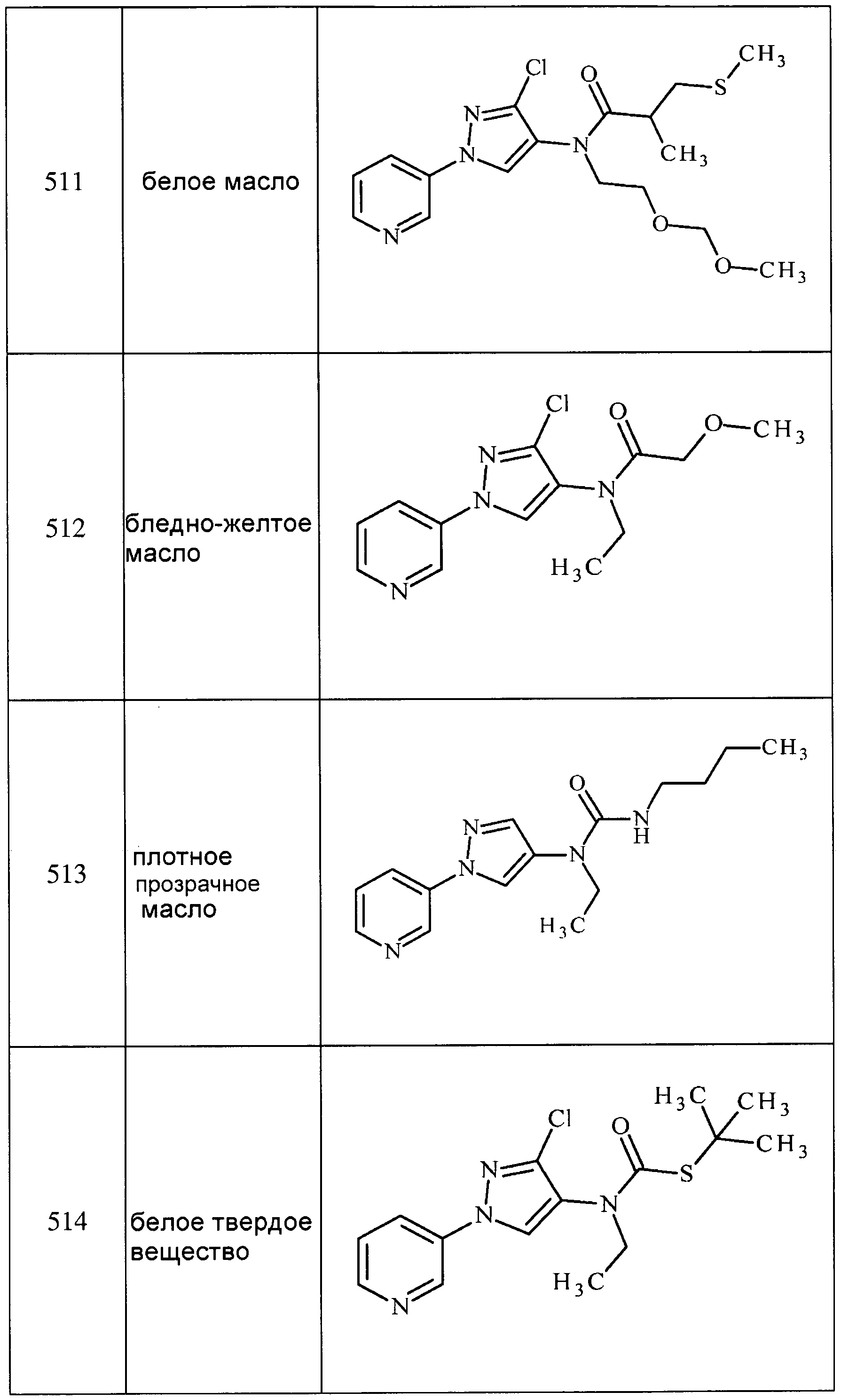
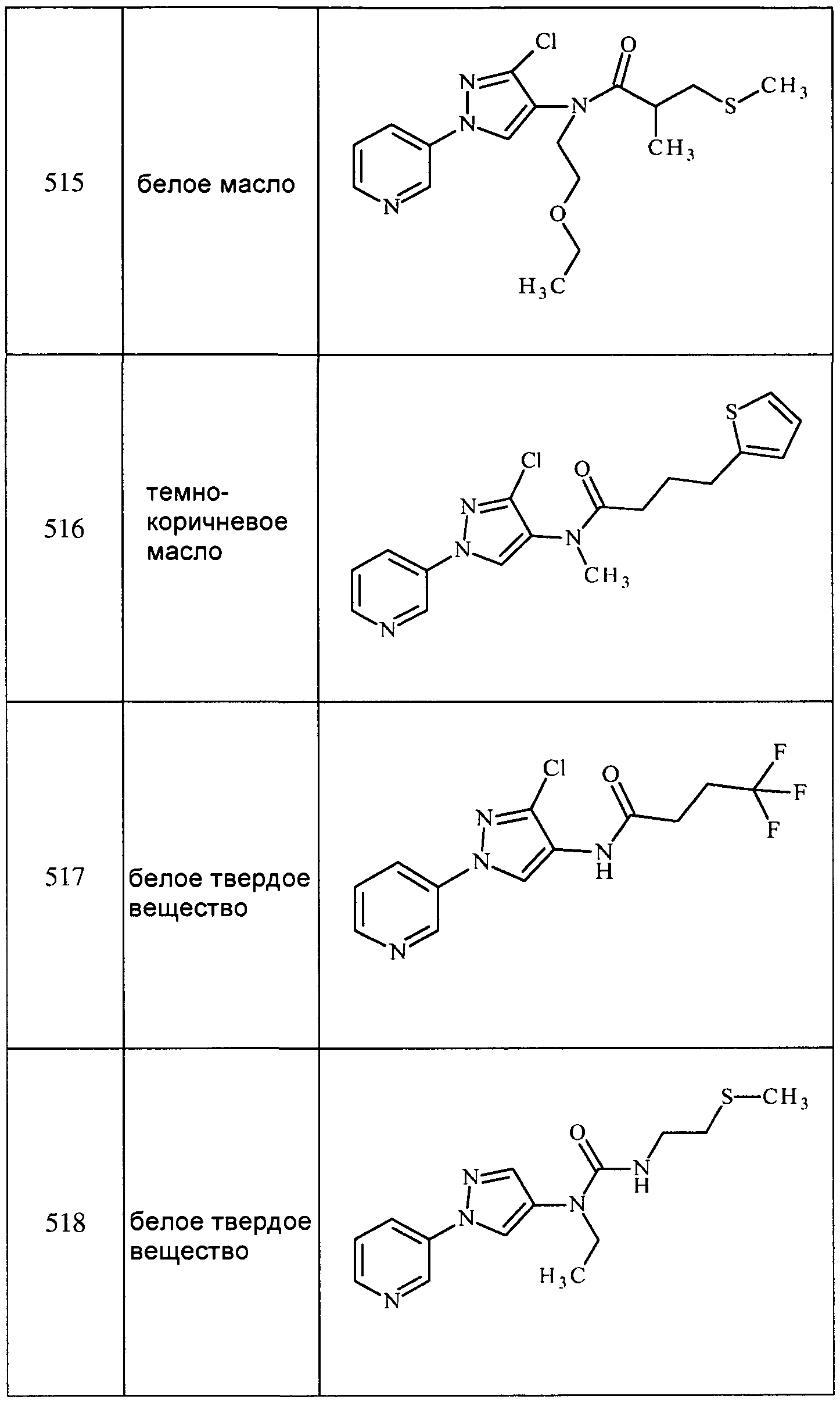
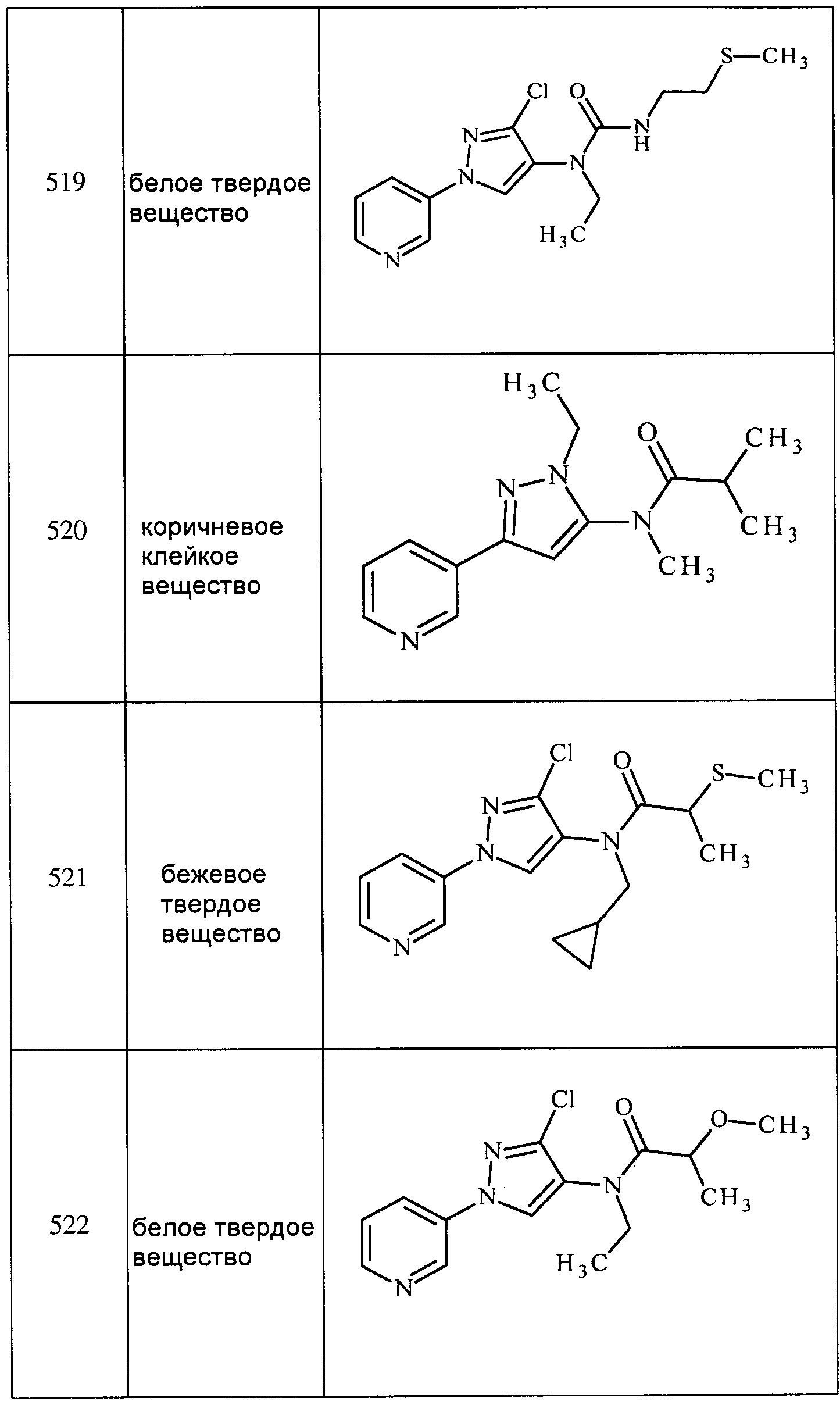
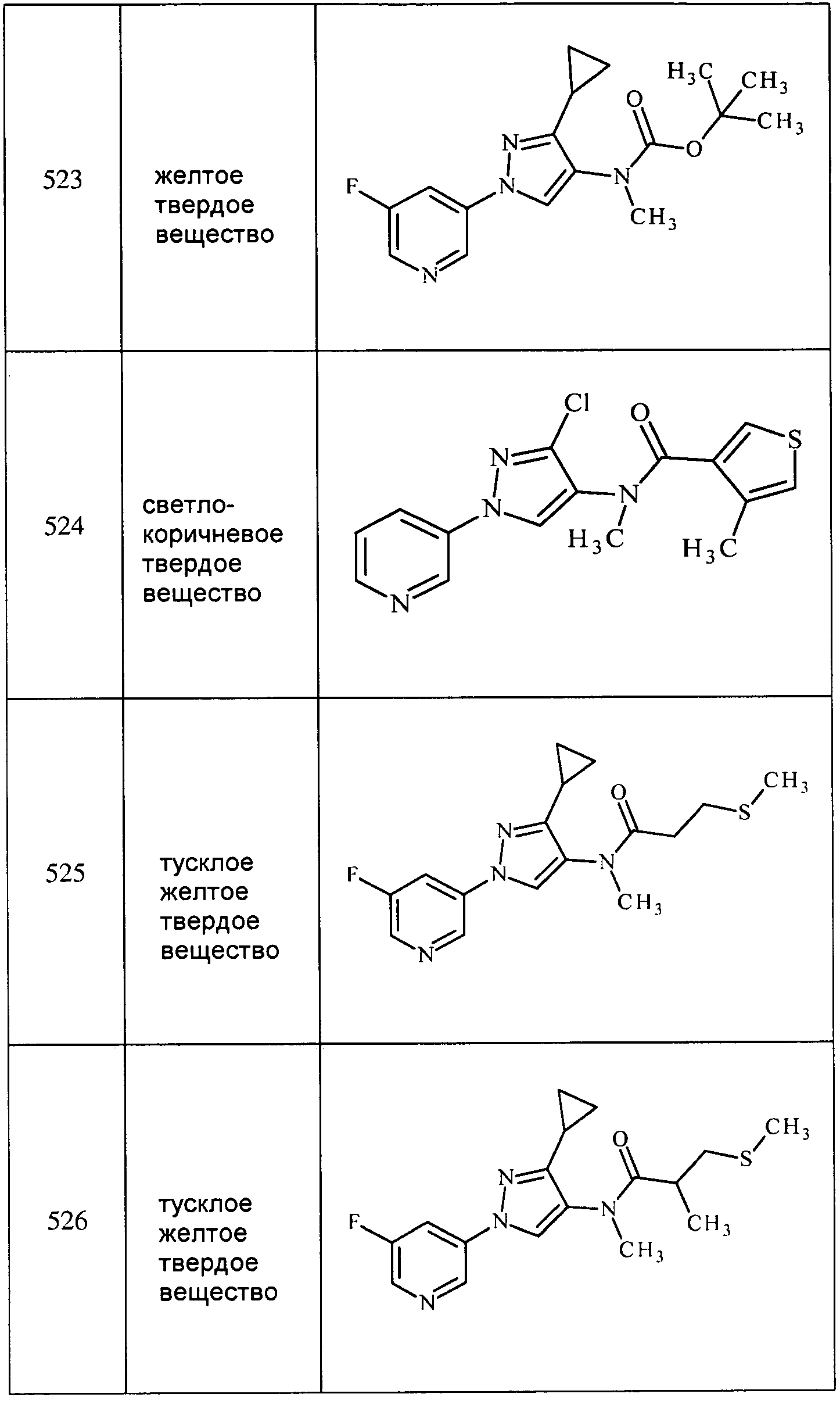
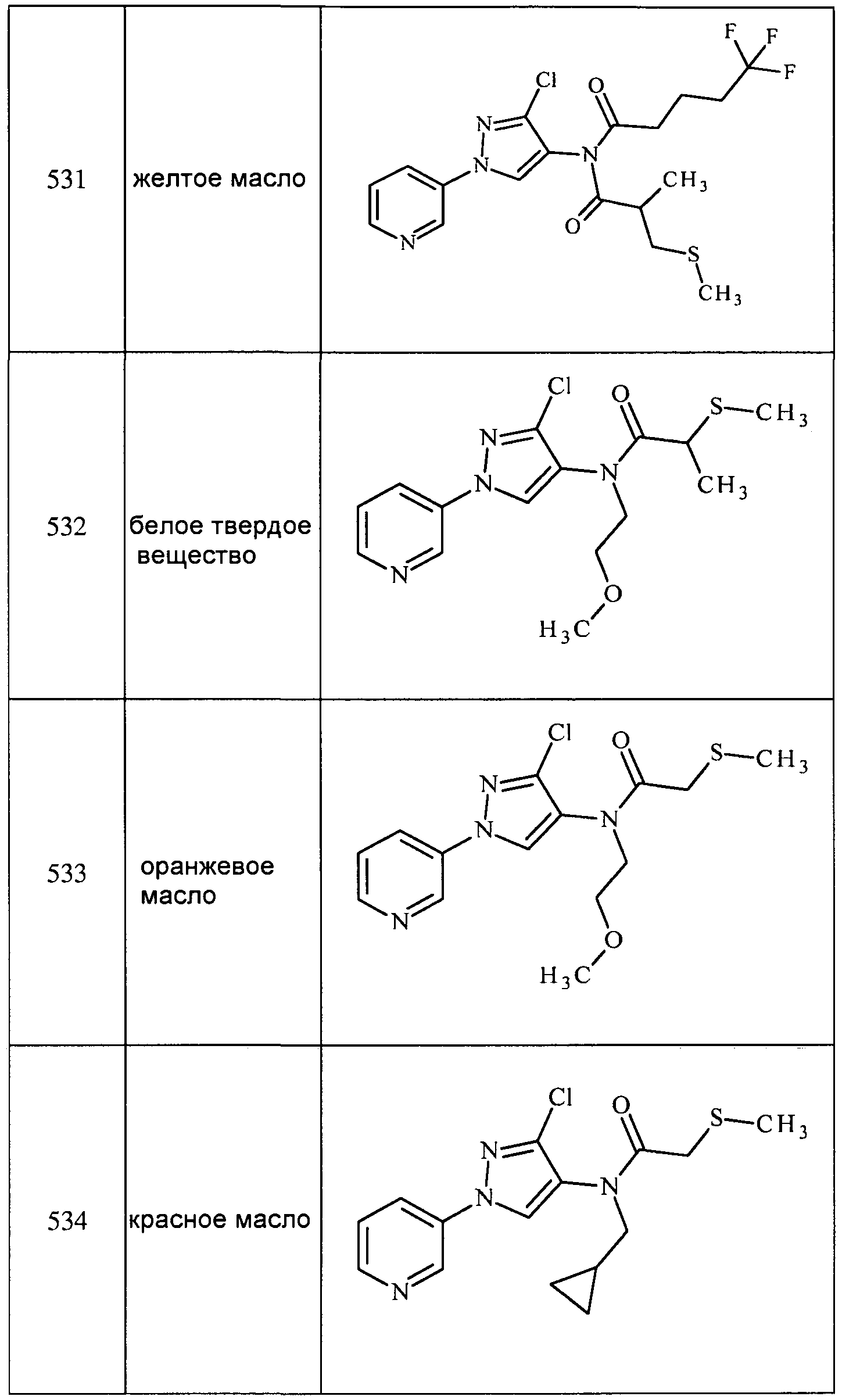
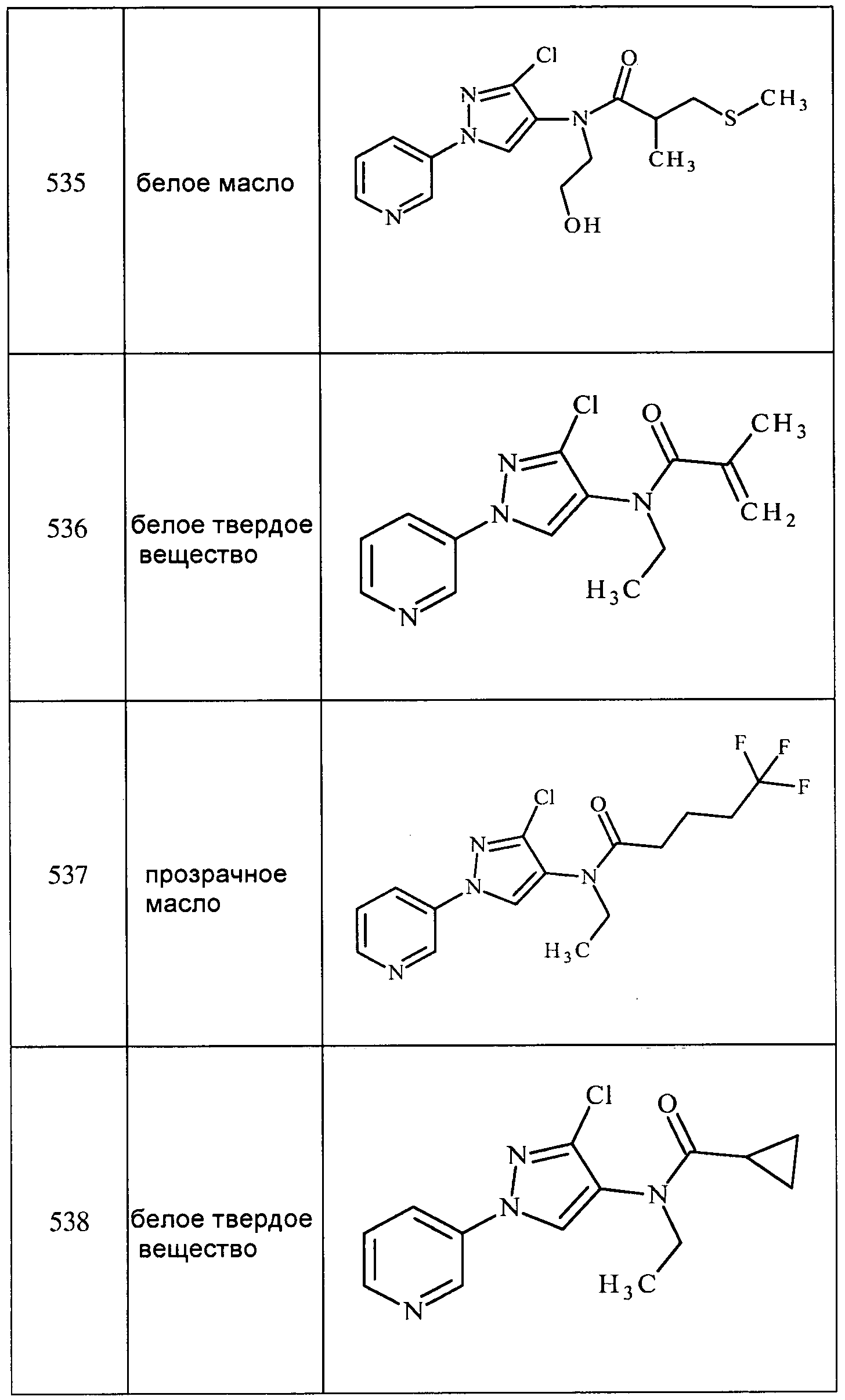
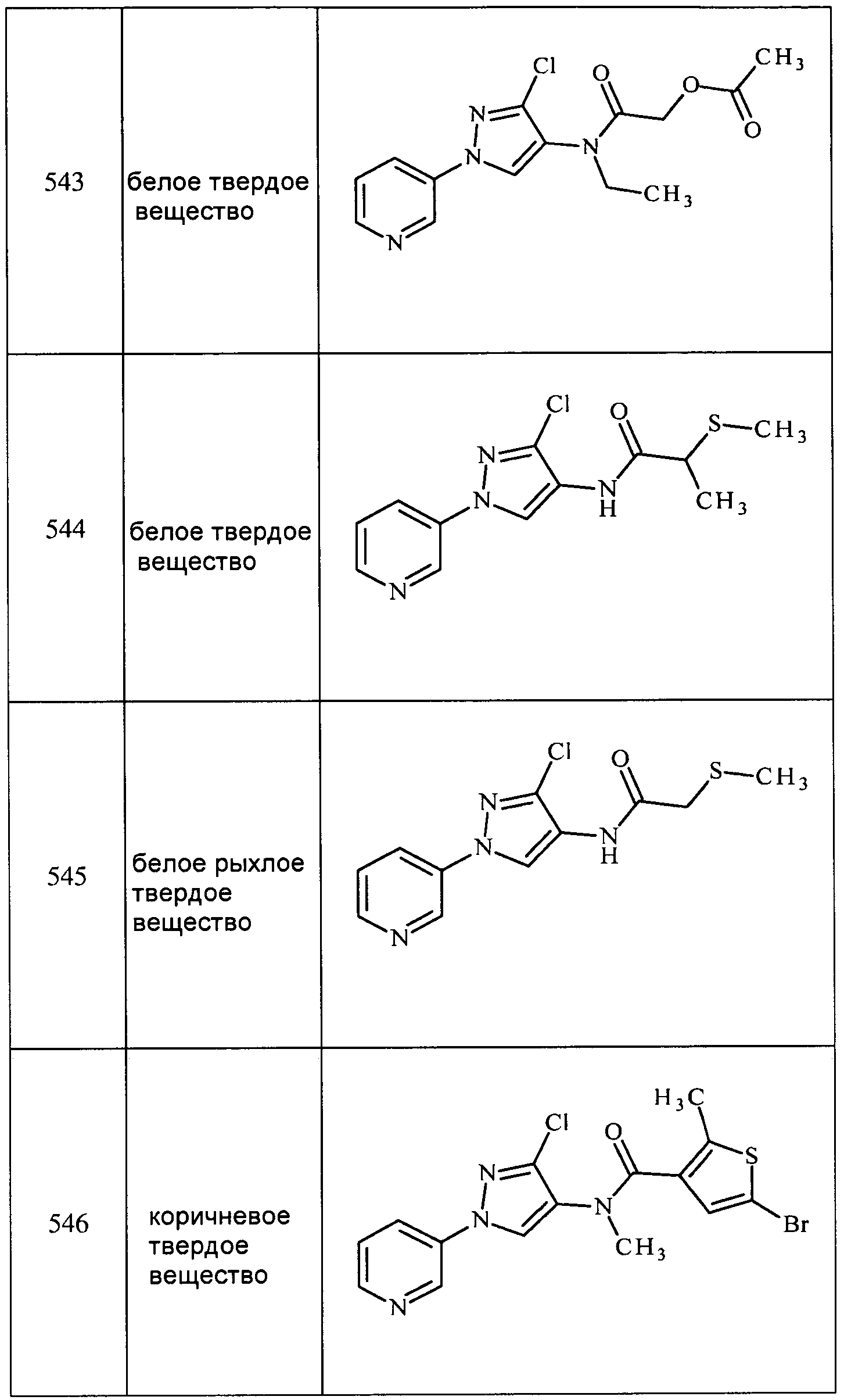
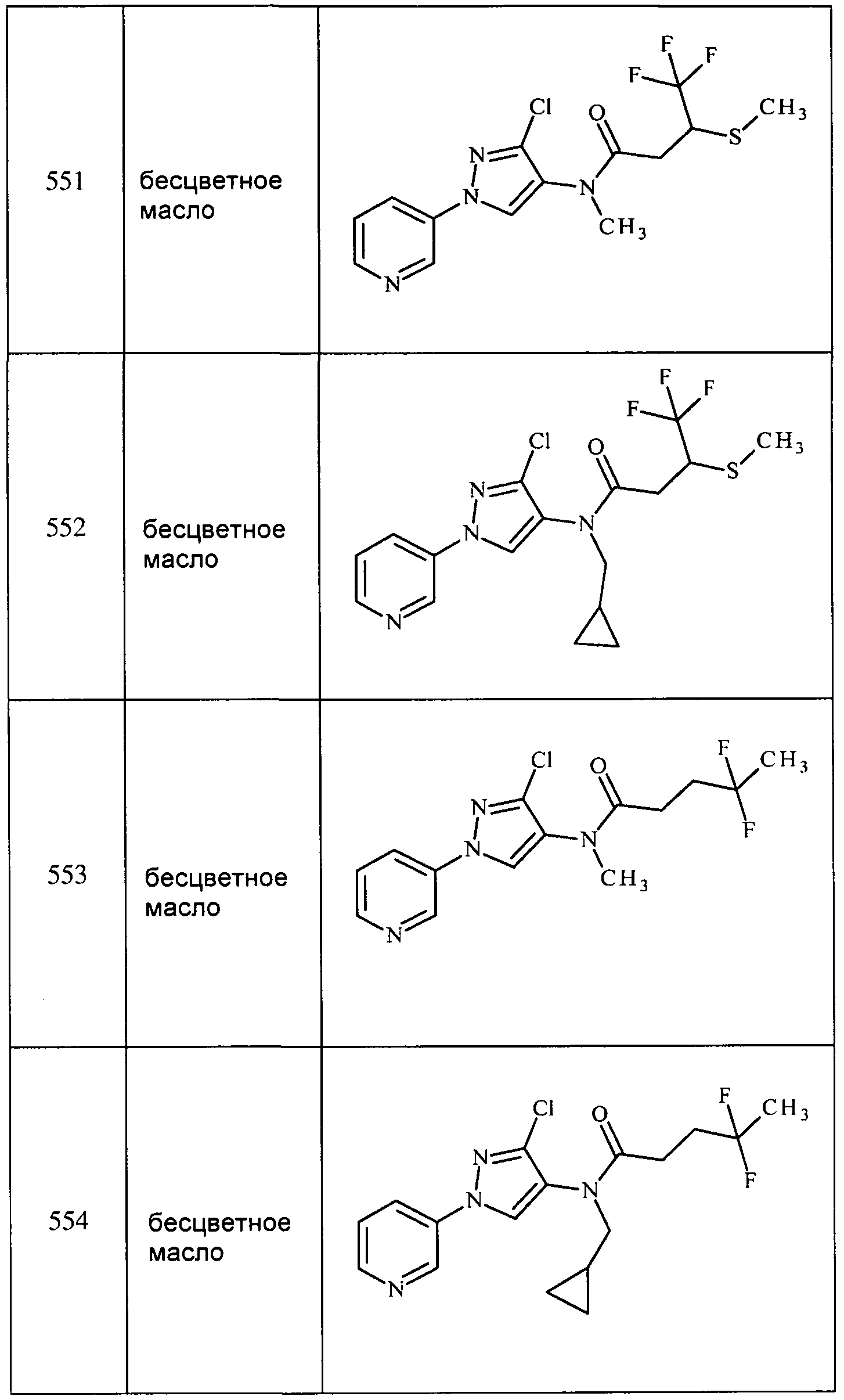
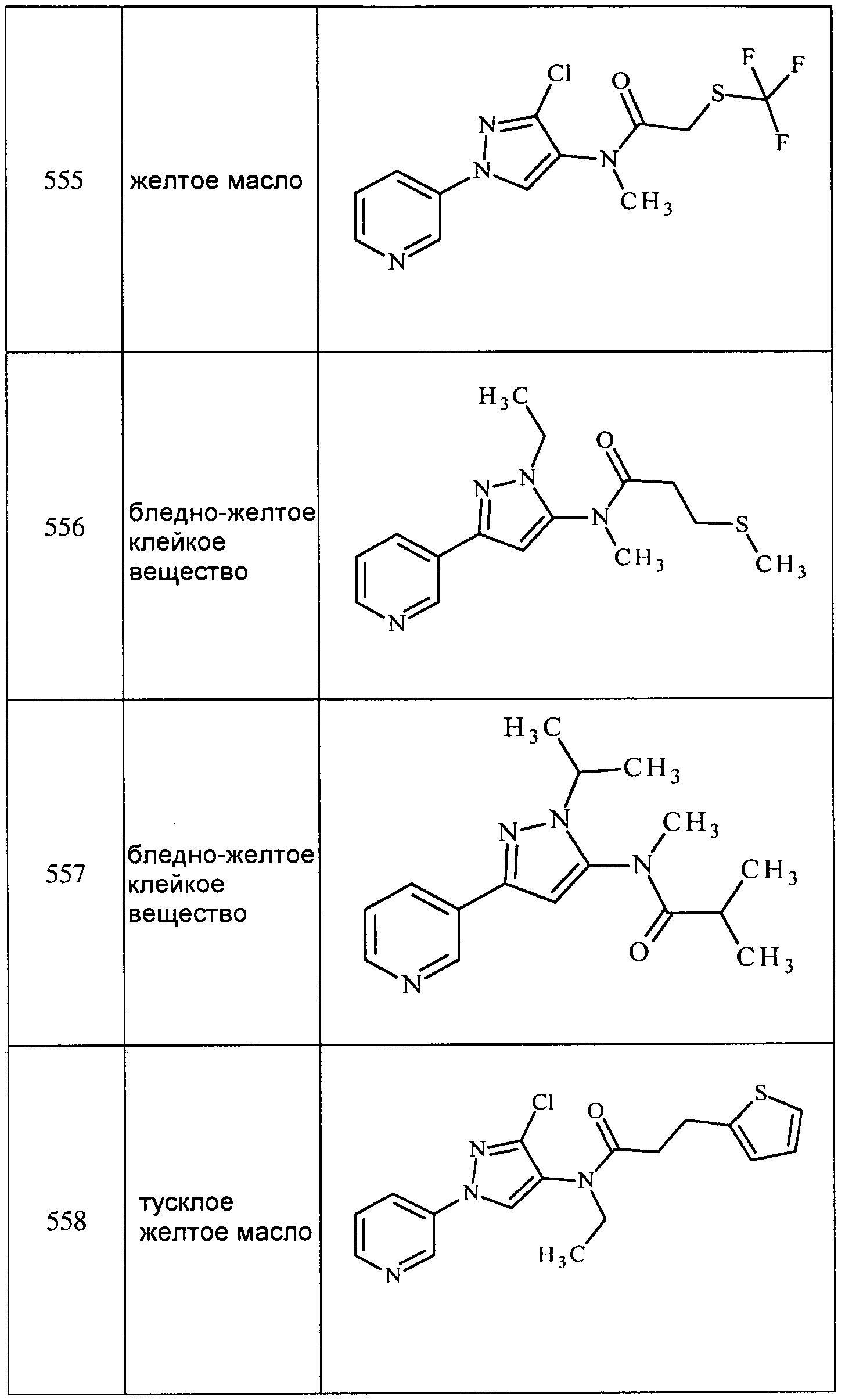
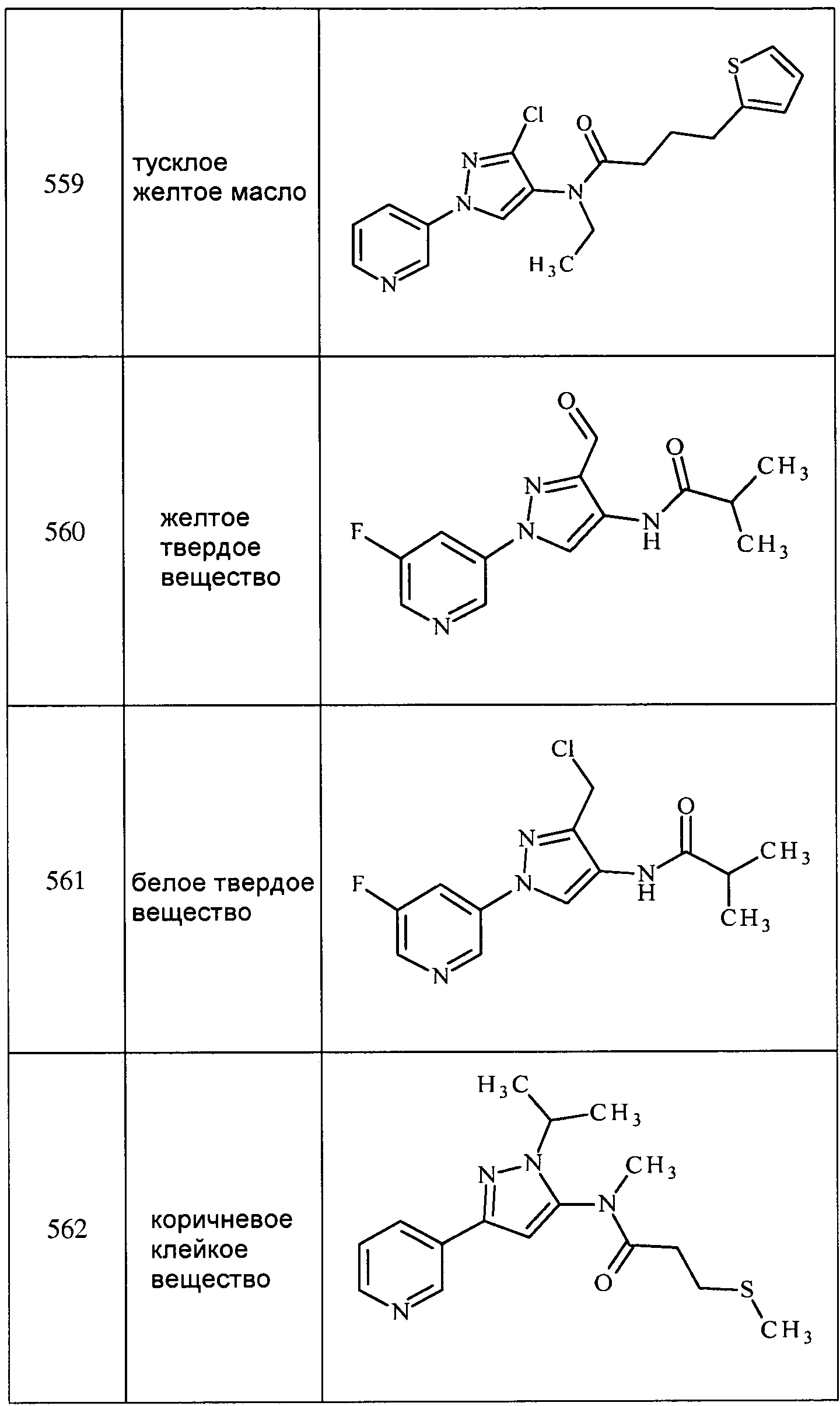
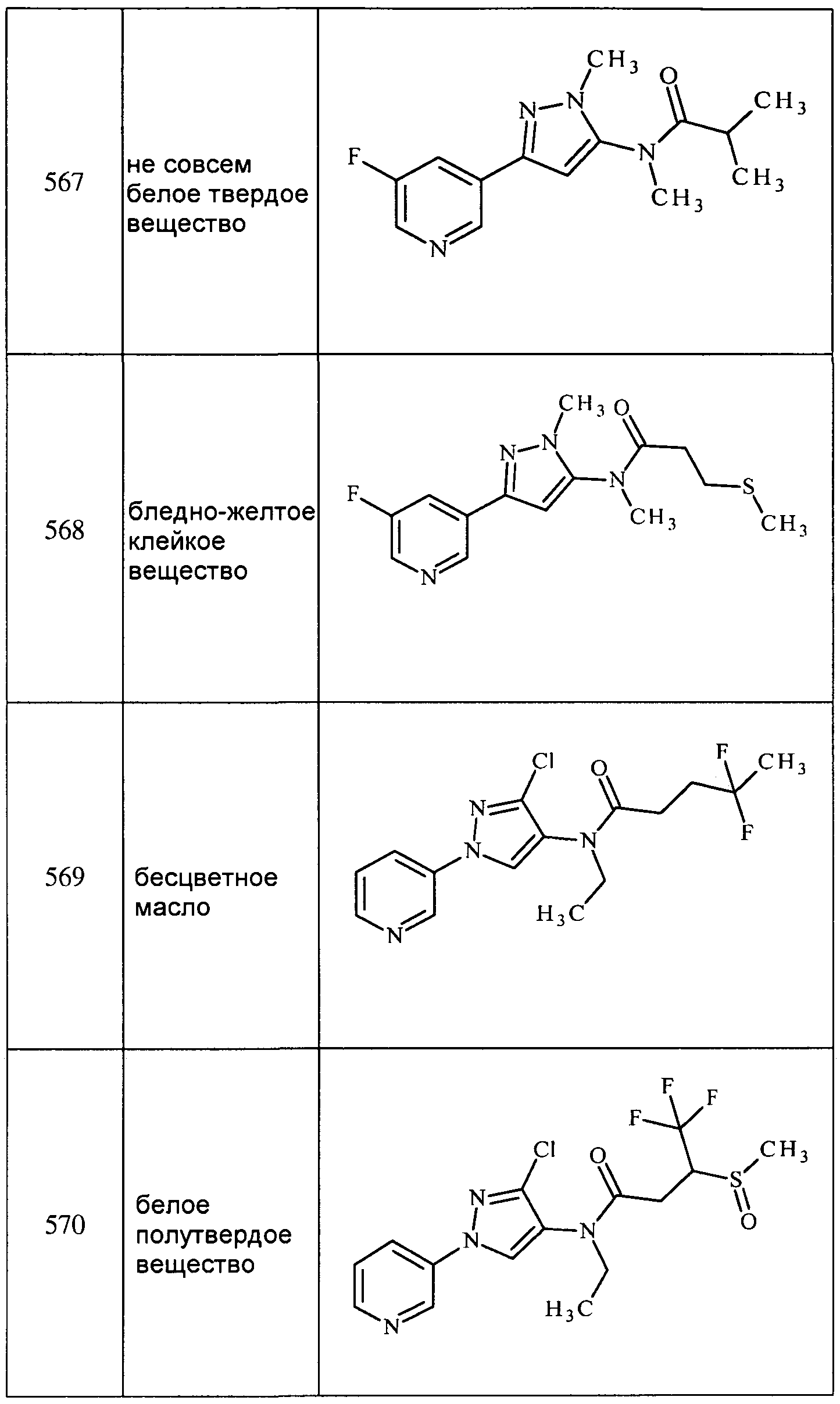
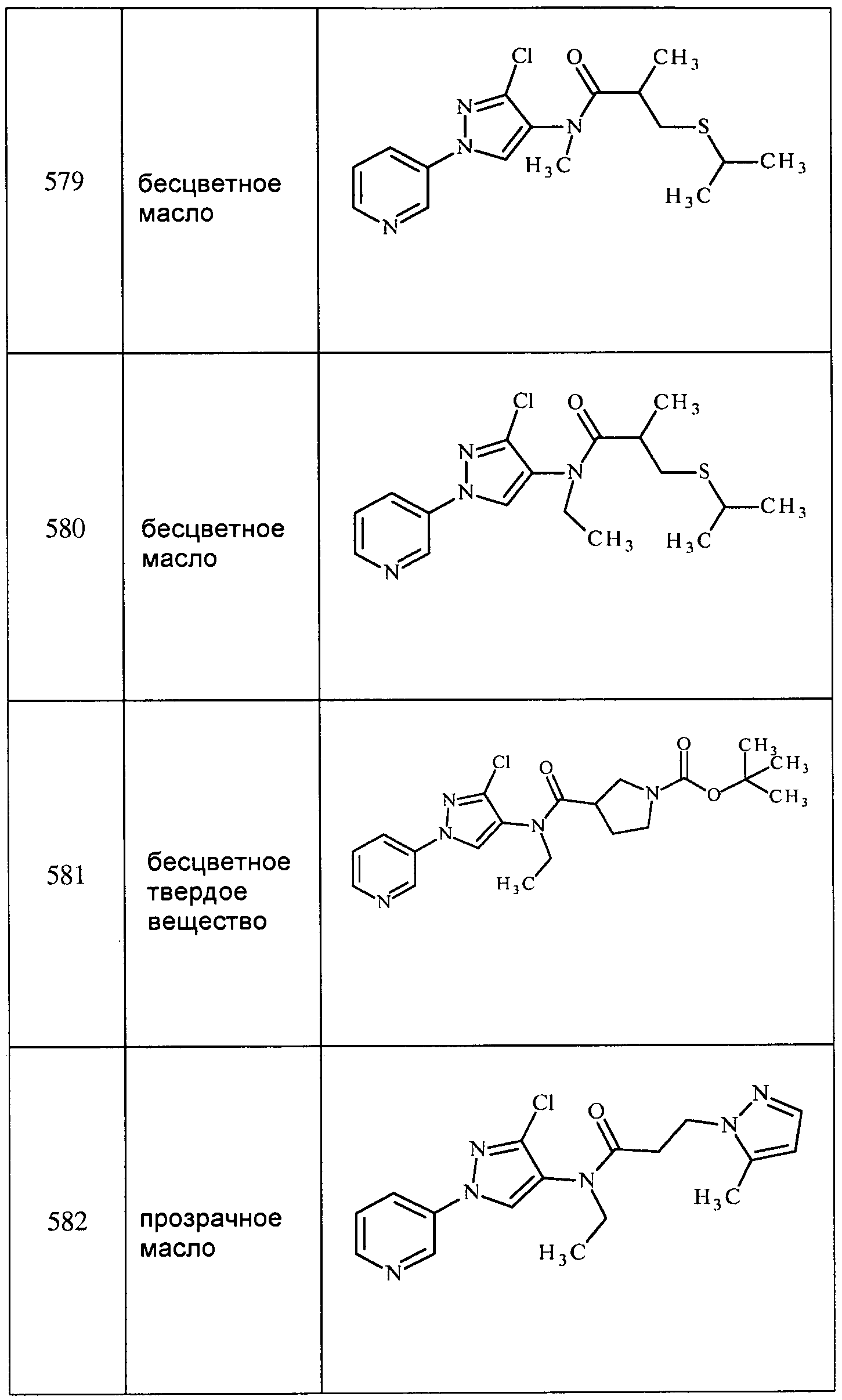
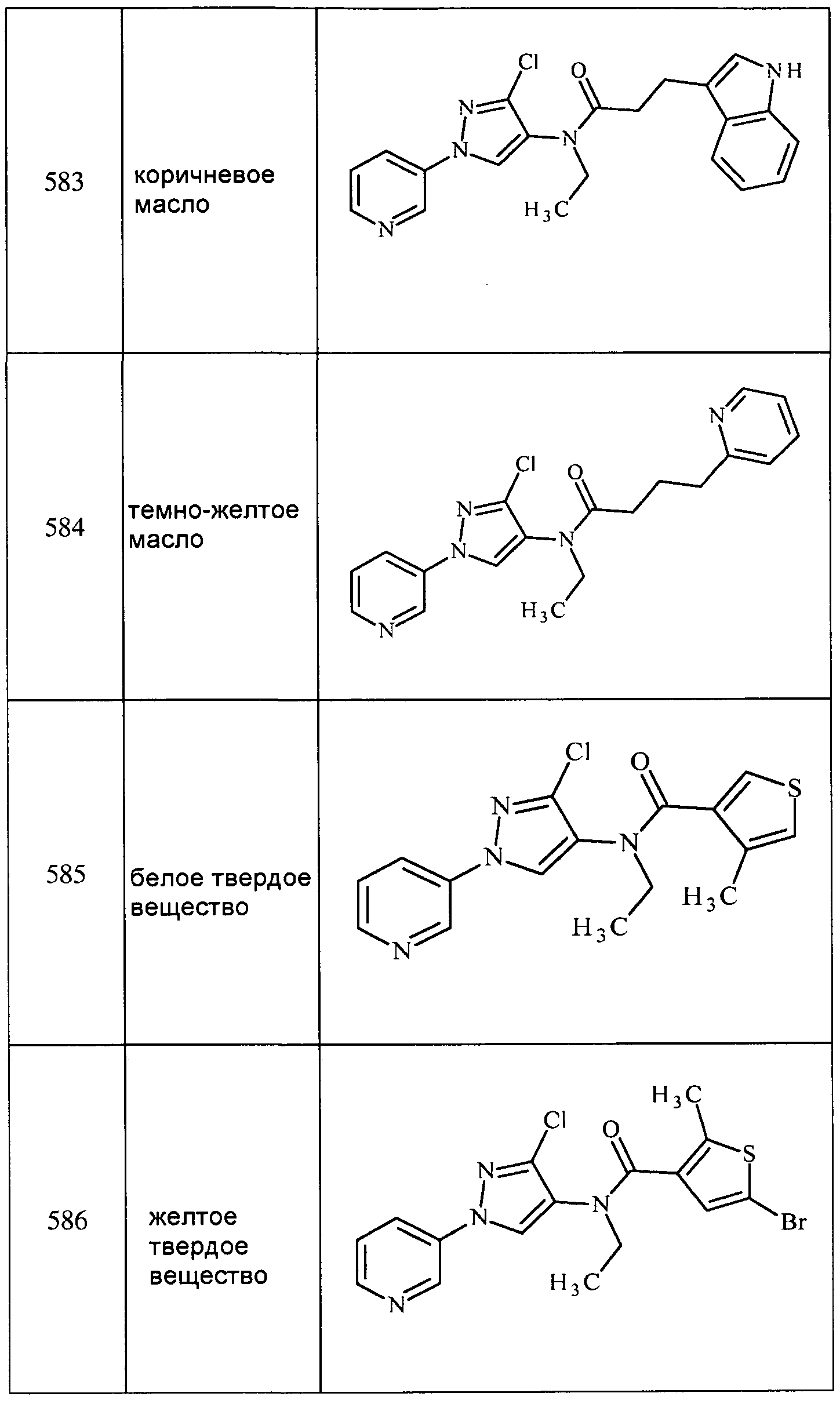
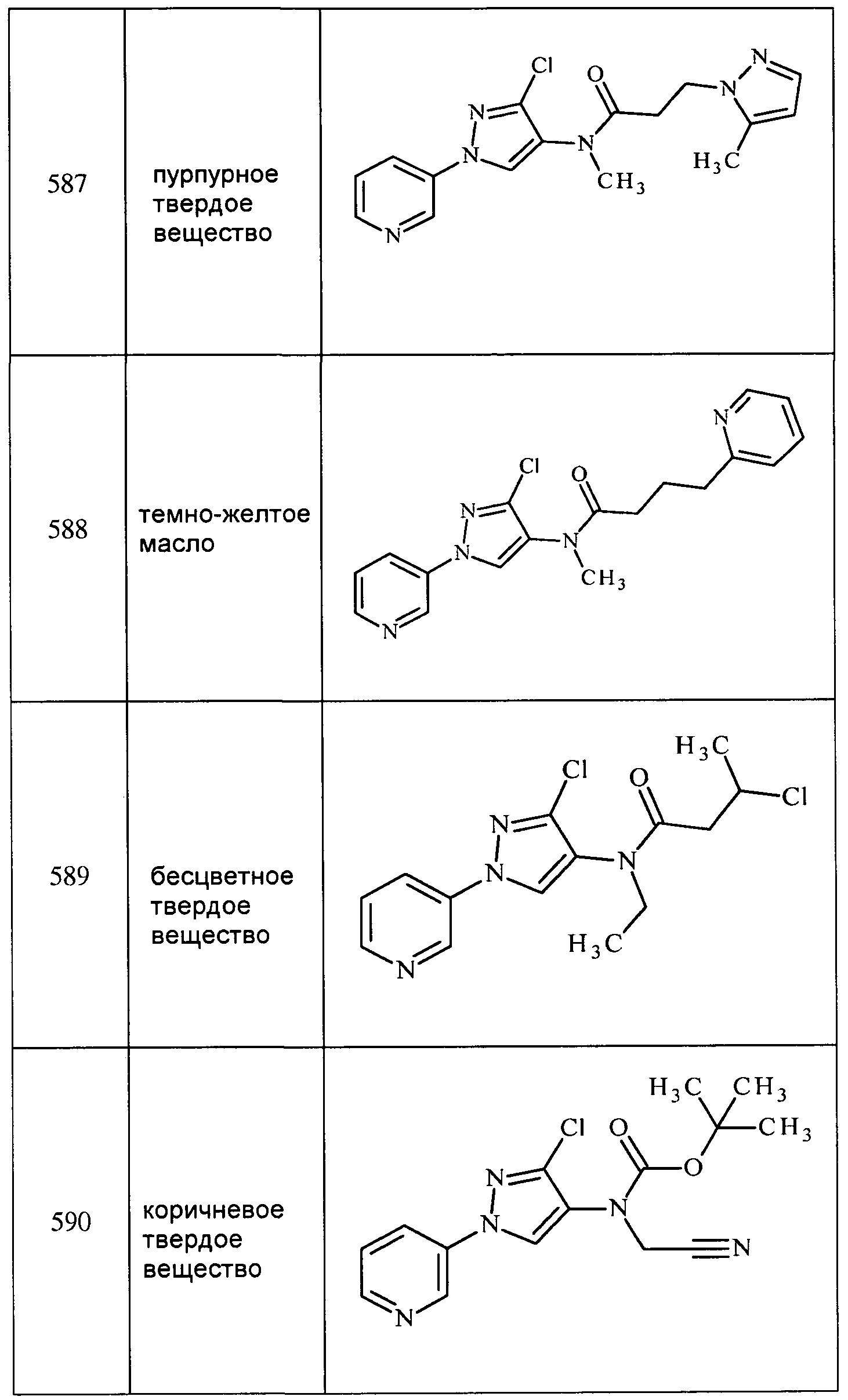
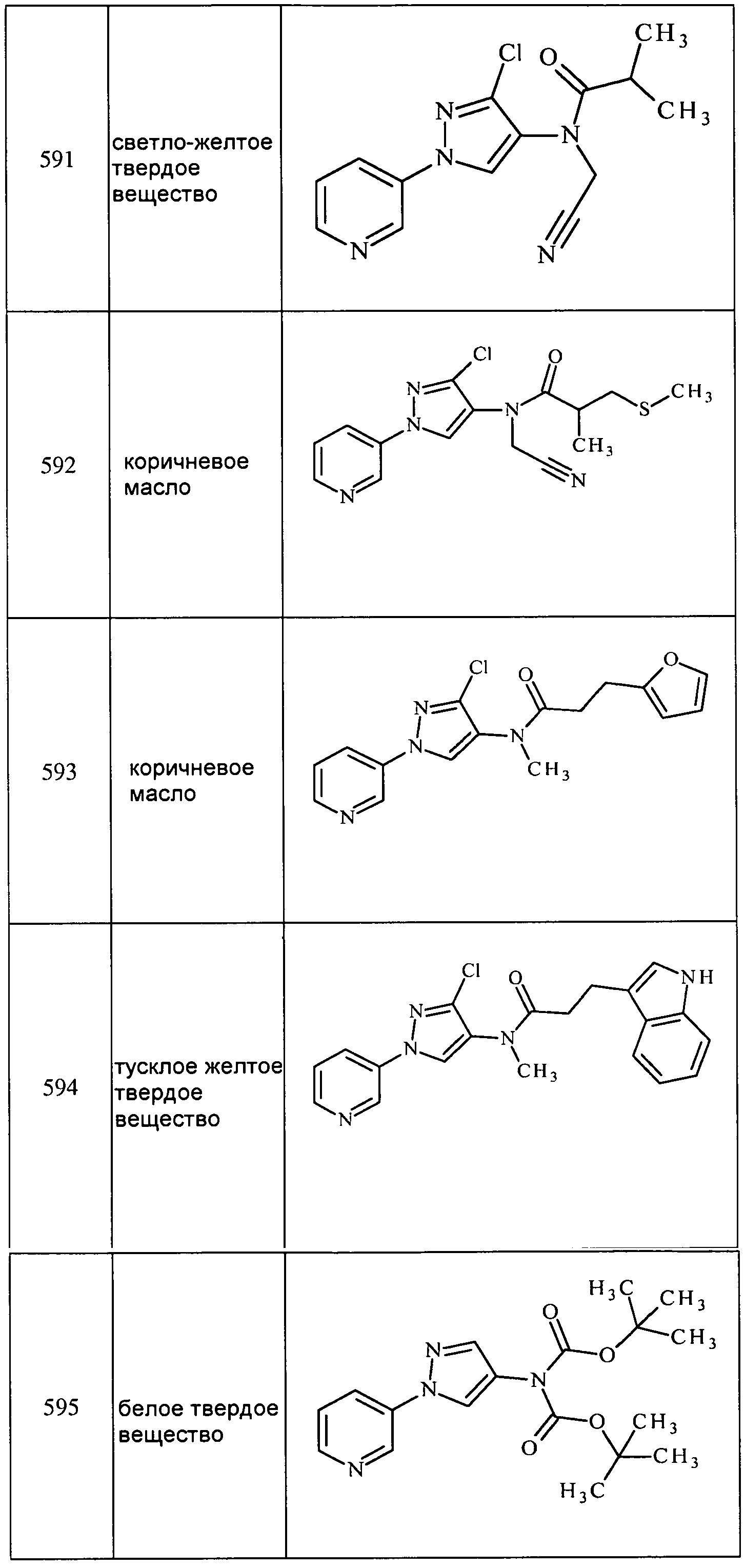
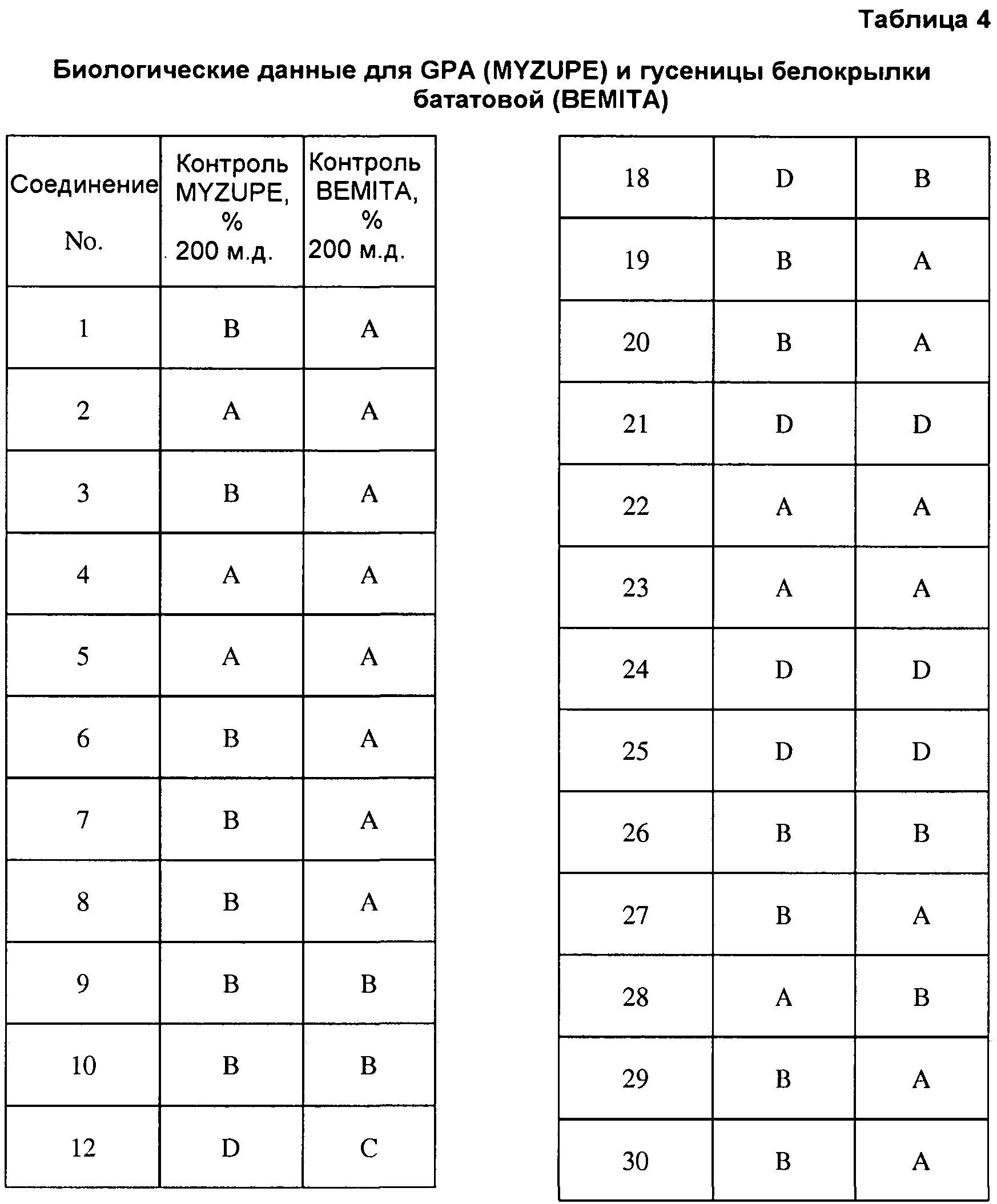
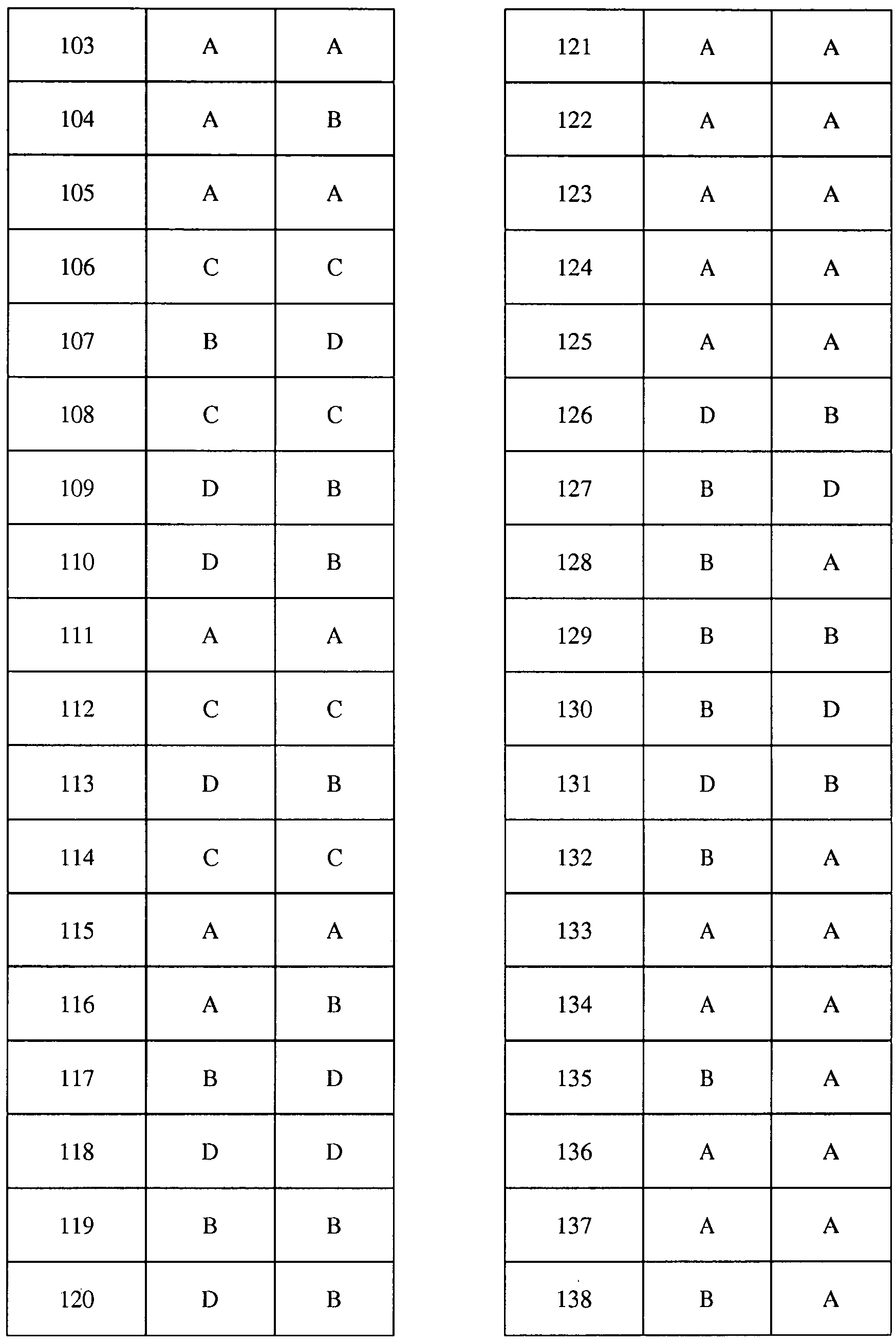
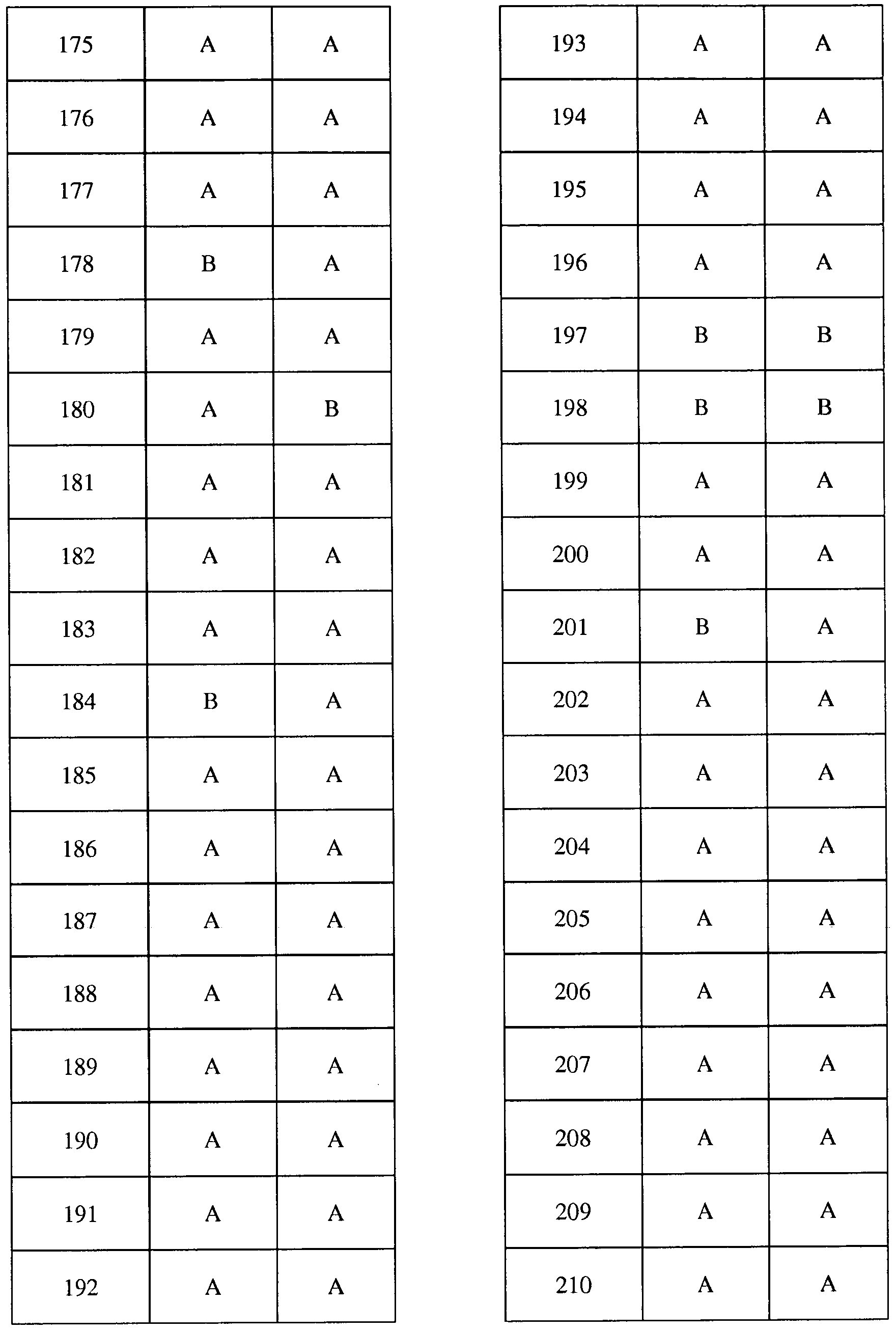
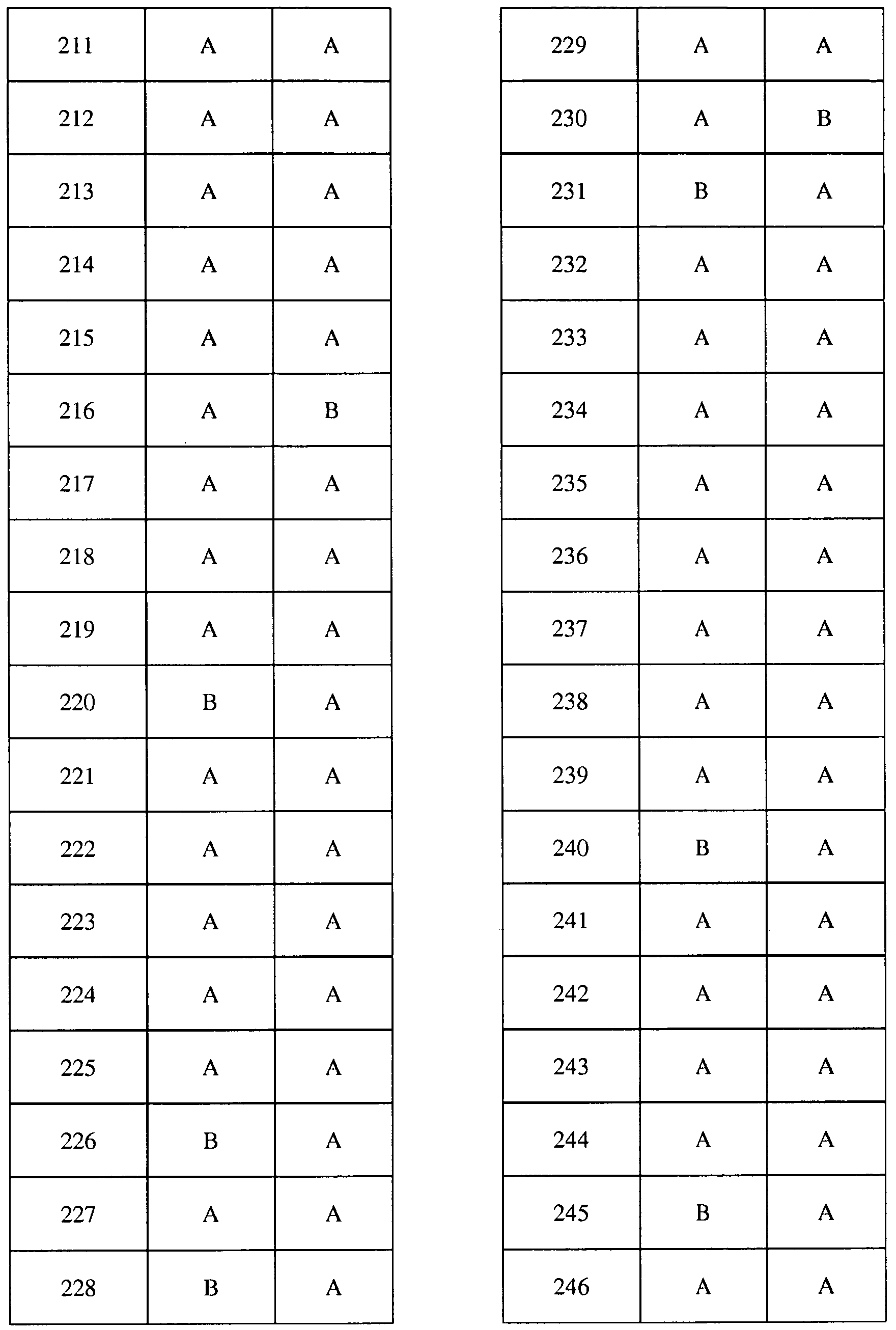
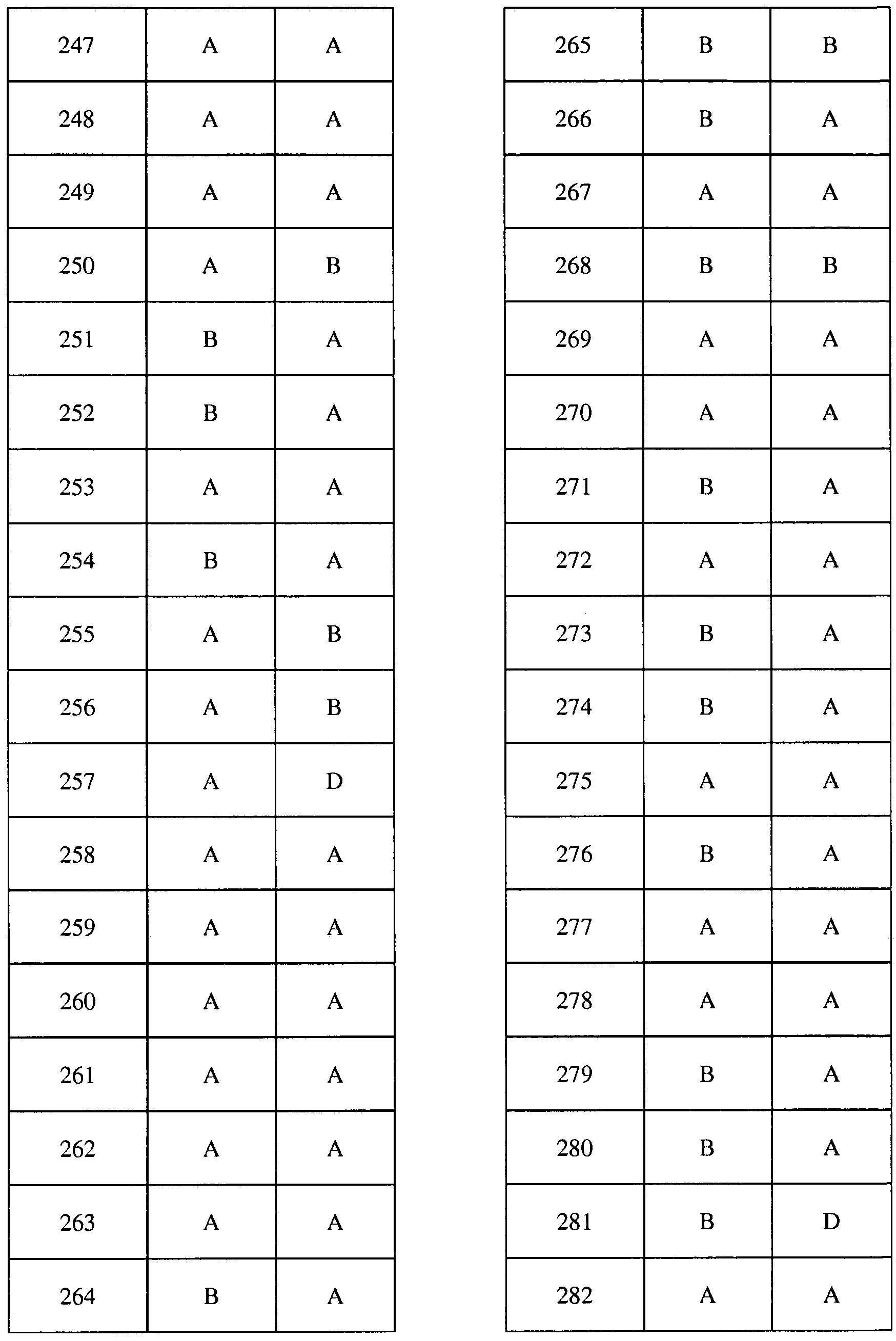
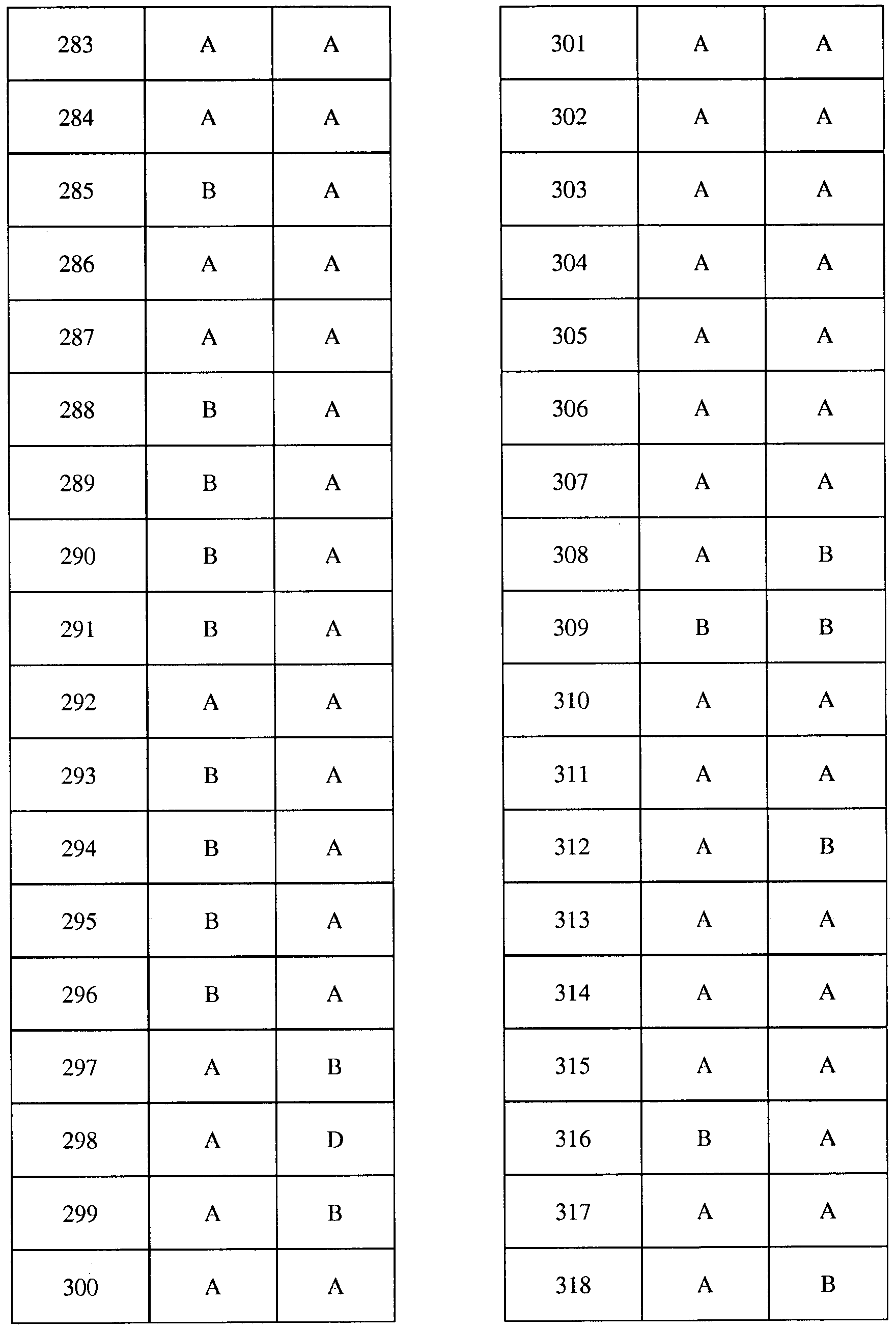
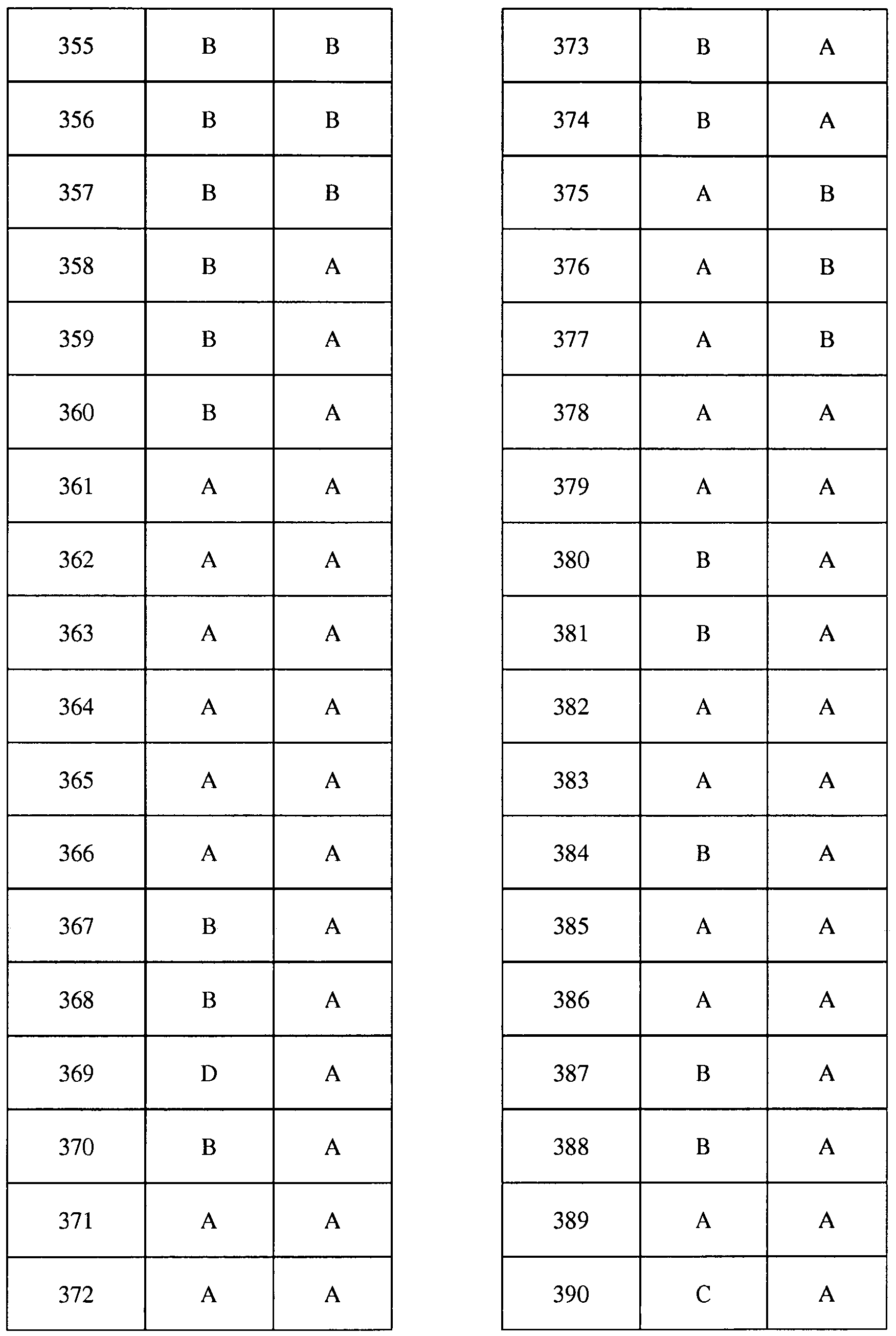
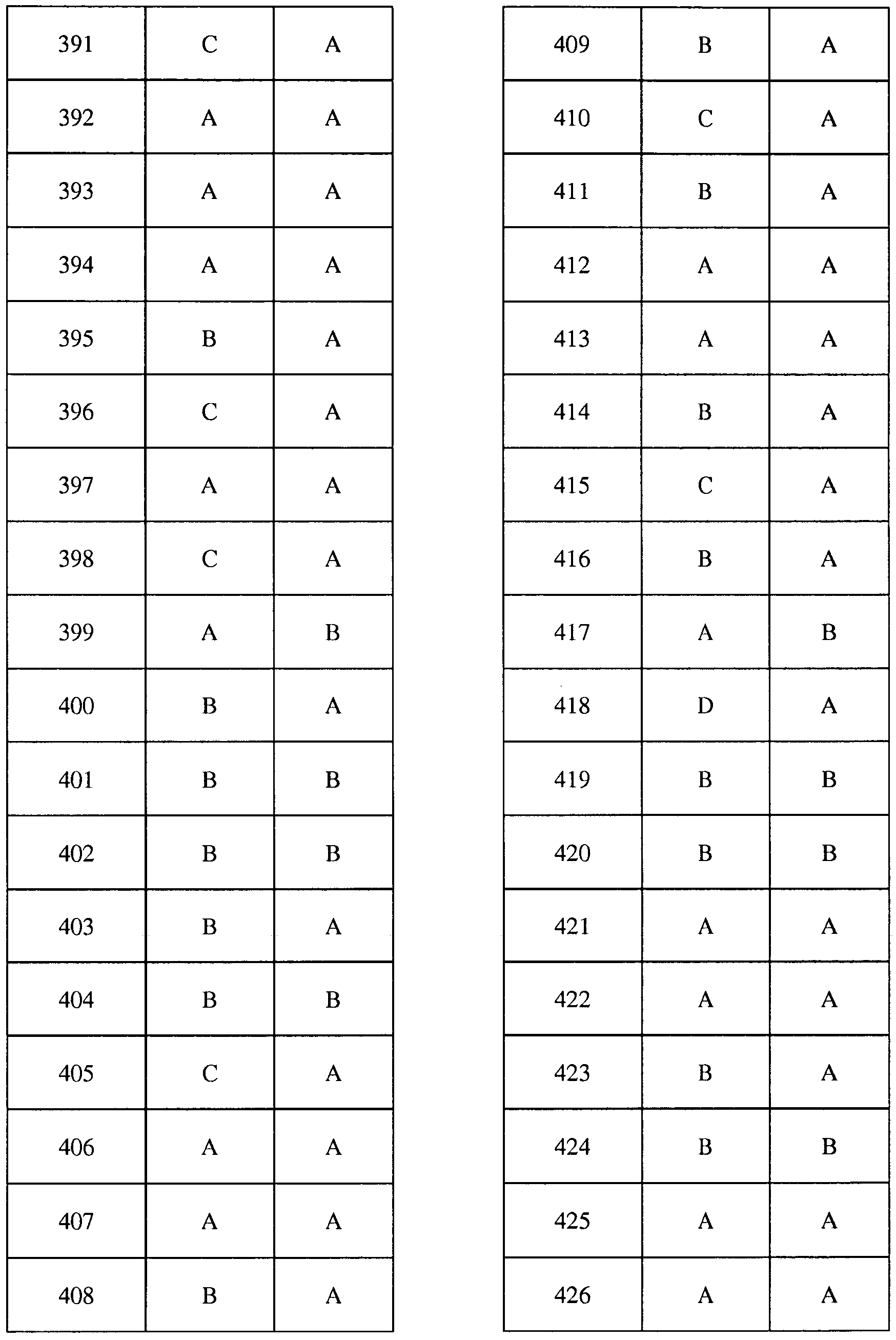
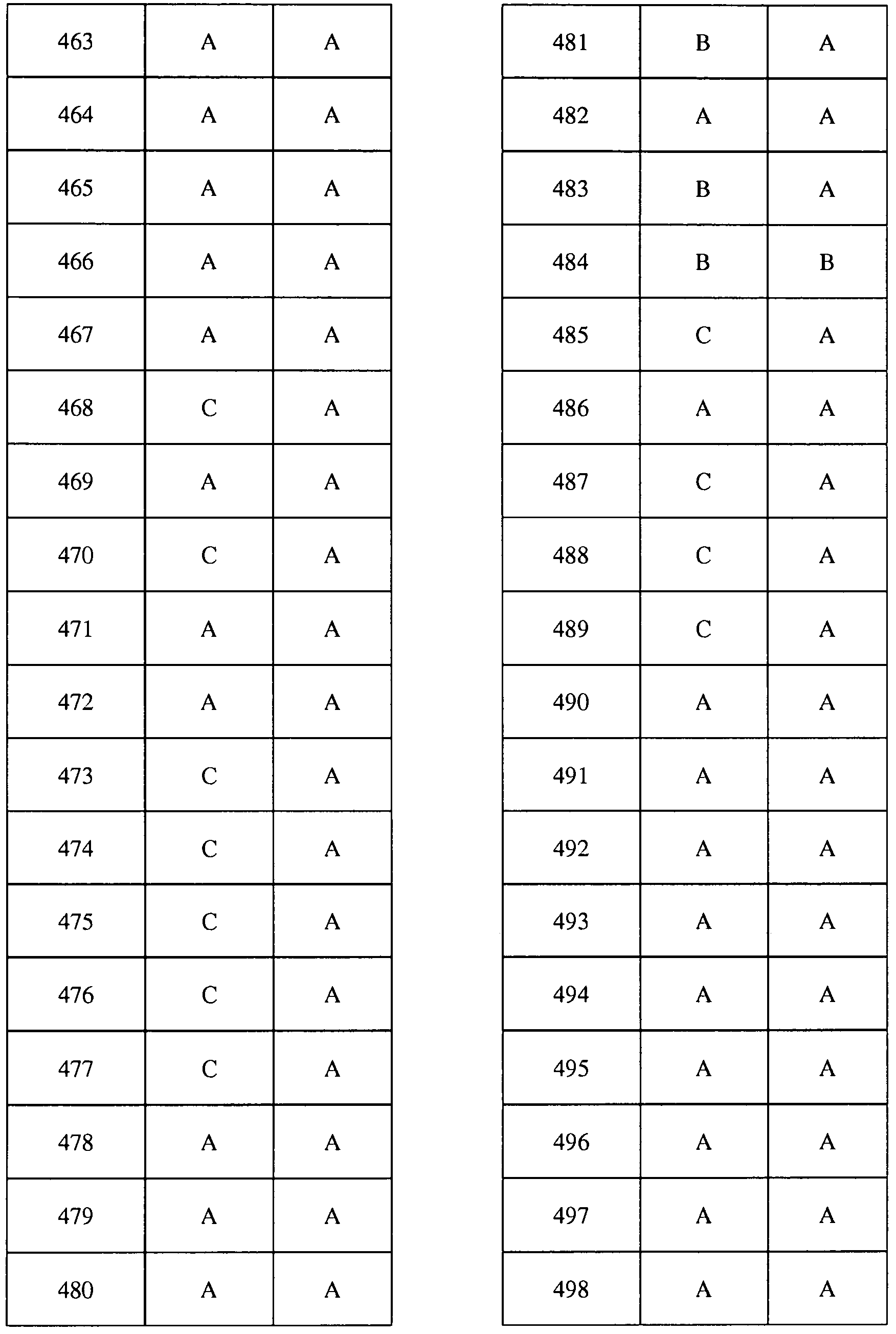
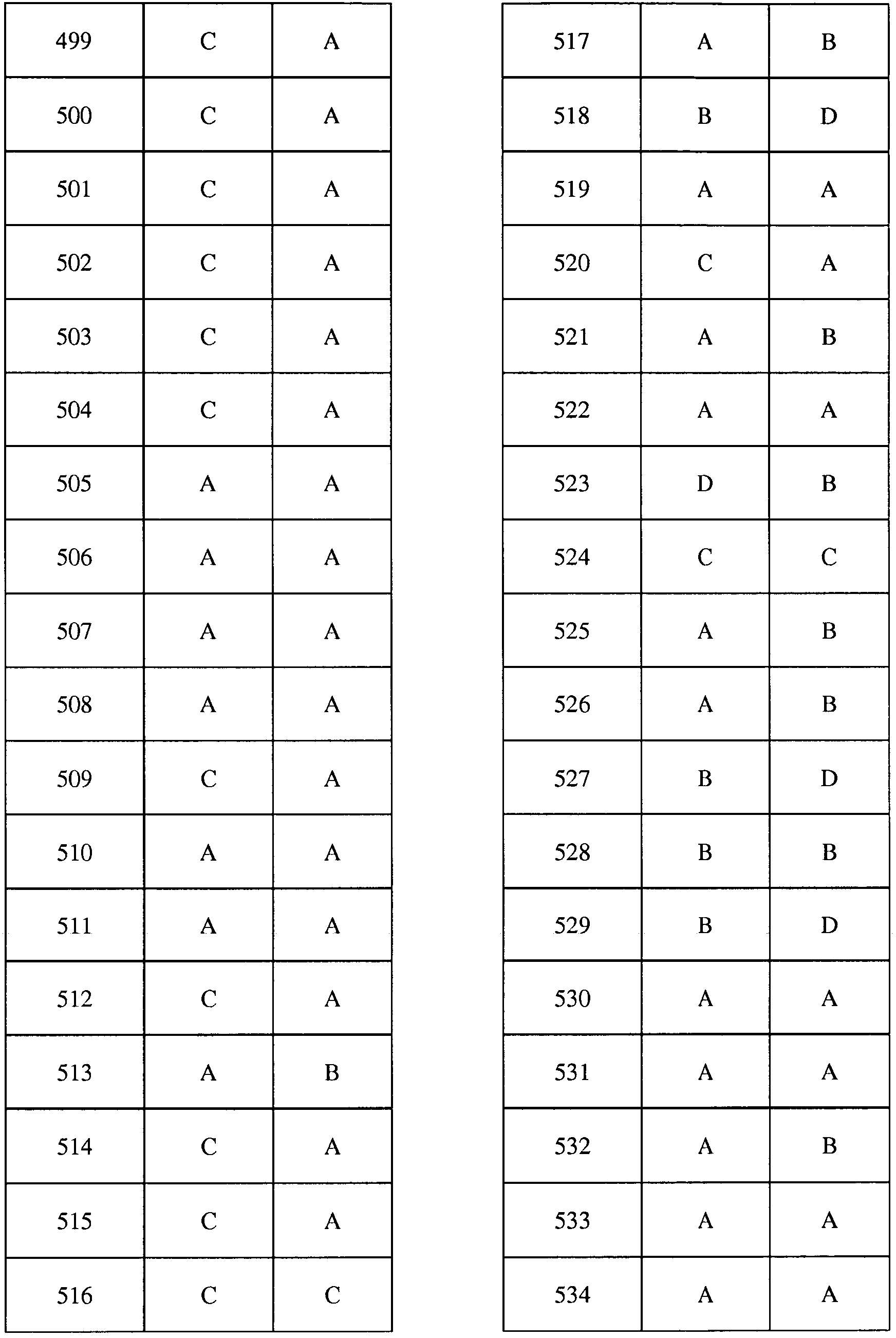
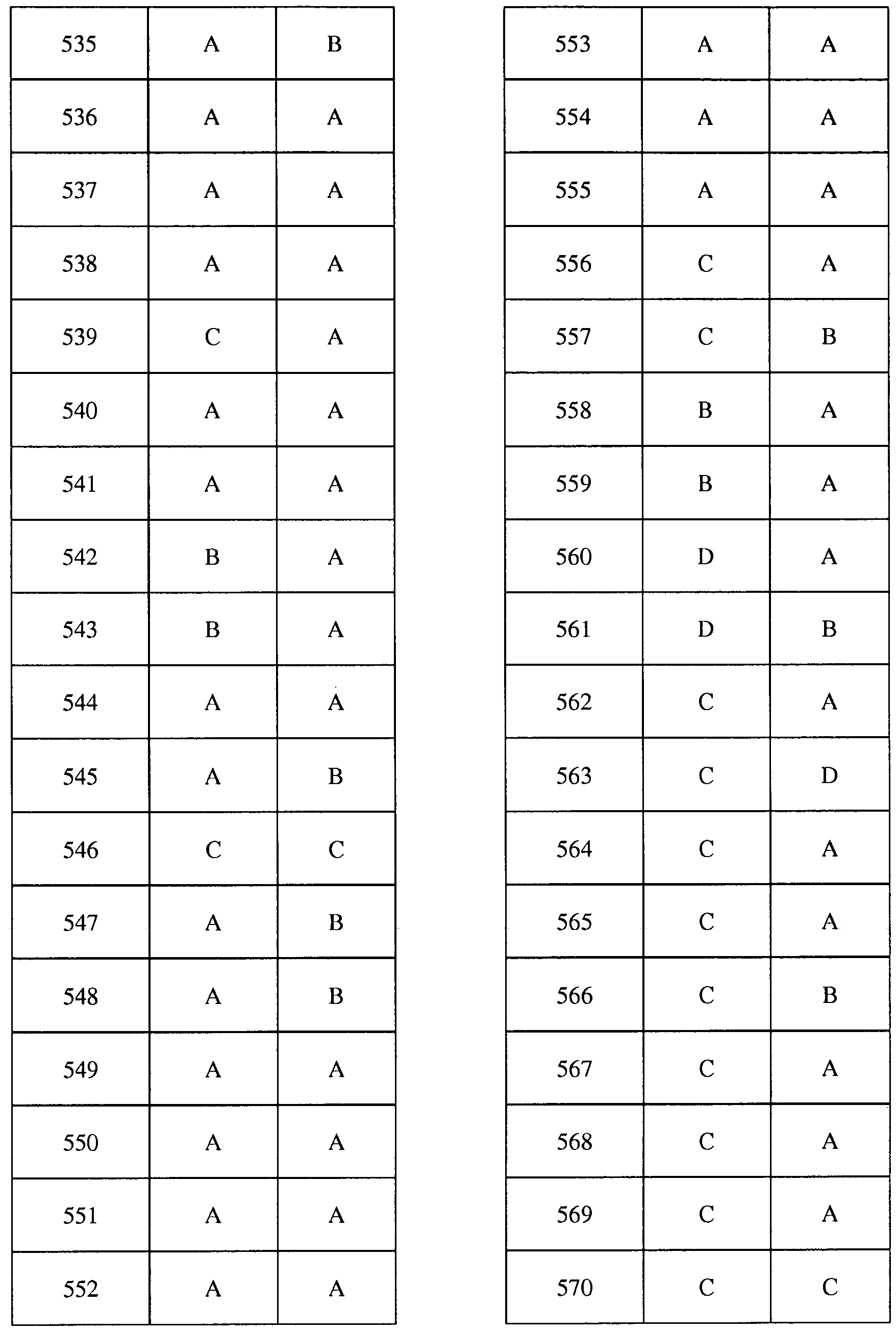
Соединения 2-6, 9-10, 12, 18-21, 24-33, 477, 487, 509, 520, 556-557, 562-568 получали из соответствующих аминов в соответствии с методиками, изложенными в примере 3.
Пример 4: Получение 1-метил-1-(2-метил-5-пиридин-3-ил-2H-пиразол-3-ил)-3-(2-метилсульфанилэтил)мочевины (соединение 7)
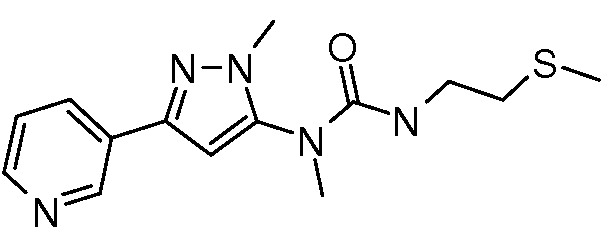
К раствору метил(2-метил-5-пиридин-3-ил-2H-пиразол-3-ил)амина (150 мг, 0,8 ммоль) в ледяном DCE (2 мл) в атмосфере N2 добавляли раствор фосгена в толуоле (20%, 0,43 мл, 0,88 ммоль). Спустя 30 мин водяную баню удаляли, и перемешивали смесь при комнатной температуре в течение 1 ч и при нагревании с обратным холодильником в течение 2 ч. Смесь охлаждали до комнатной температуры, а затем дополнительно добавляли фосген (0,86 мл, 1,76 ммоль). Смесь перемешивали при нагревании с обратным холодильником в течение 90 мин, а затем охлаждали на бане со льдом. К смеси добавляли раствор 2-метилтиоэтиламина (80 мг, 0,88 ммоль) в DCE (2 мл). Спустя 10 мин баню со льдом удаляли, реакционную смесь перемешивали с обратным холодильником в течение 14 ч, охлаждали и разбавляли DCE (30 мл). Разбавленную реакционную смесь промывали насыщенным NaHCO3 (20 мл), сушили над MgSO4, адсорбировали на силикагеле и очищали методом хроматографии на силикагеле, элюируя градиентом метанола в дихлорметане, с получением 1-метил-1-(2-метил-5-пиридин-3-ил-2H-пиразол-3-ил)-3-(2-метилсульфанилэтил)мочевины в виде желтого клейкого вещества (14 мг, 6%):1H ЯМР (400 МГц, CDCl3) δ 8,99 (д, J=1,5 Гц, 1H), 8,57 (дд, J=4,8, 1,5 Гц, 1H), 8,08 (ддд, J=8,1, 2,1, 2,1 Гц, 1H), 7,34 (дд, J=7,9, 4,8 Гц, 1H), 6,52 (с, 1H), 4,88 (ушир.т, J=5,5 Гц, 1H), 3,80 (с, 3H), 3,41 (кв, J=6,3 Гц, 2H), 3,24 (с, 3H), 2,61 (т, J=6,3, 2H), 2,06 (с, 3H); ESEVIS (m/z) 292,2 [M+2].
Соединение 8 получали в соответствии с методиками, изложенными в примере 4, с использованием 2-(метилтио)этанола вместо 2-метилтиоэтиламина.
Пример 5: Получение 1-метил-5-(пиридин-3-ил)-1H-пиразол-3-амина и 1-метил-3-(пиридин-3-ил)-1H-пиразол-5-амина

К этанолу (8,53 мл) добавляли 3-оксо-3-(пиридин-3-ил)пропаннитрил (0,82 г, 5,61 ммоль) и метилгидразид (0,25 г, 5,61 ммоль) и перемешивали при нагревании с обратным холодильником в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и концентрировали досуха. Неочищенное вещество очищали методом хроматографии на силикагеле, элюируя 0-20% MeOH в дихлорметане с получением двух продуктов - 1-метил-5-(пиридин-3-ил)-1H-пиразол-3-амина (0,060 г, 6,14%):1H ЯМР (300 МГц, CDCl3) δ 8,72 (с, 1H), 8,53 (д, 1H), 7,76-7,63 (м, 1H), 7,43-7,33 (м, 1H), 5,75 (с, 1H), 3,76-3,57 (м, 5H) и 1-метил-3-(пиридин-3-ил)-1H-пиразол-5-амина (0,150 г, 15,35%):1H ЯМР (300 МГц, CDCl3) δ 8,88 (с, 1H), 8,48 (д, 1H), 7,99 (д, 1H), 7,38-7,07 (м, 1H), 585 (с, 1H), 3,80-3,59 (м, 5H).
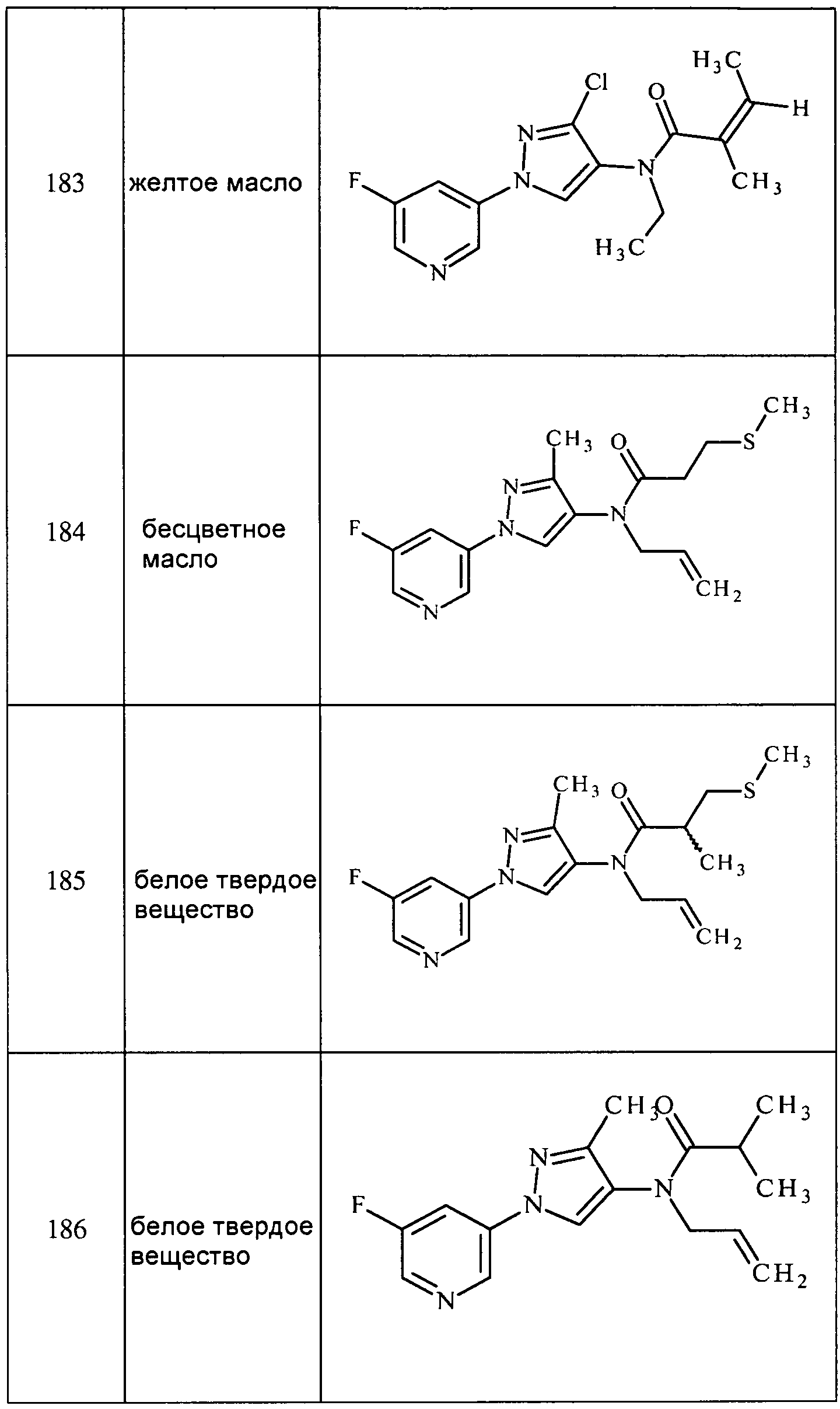
Пример 6, стадия 1: Получение 3-пиразол-1-илпиридина
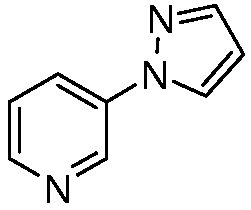
К раствору 3-бромпиридина (5 г, 0,031 моль) в 50 мл ацетонитрила в атмосфере N2 добавляли пиразол (2,6 г, 0,038 моль), Cs2CO3 (16,5 г, 0,050 моль), Cu2O (0,226 г, 0,0016 моль) и салицилальдоксим (0,867 г, 0,006 моль). Реакционную массу нагревали с обратным холодильником в течение 24 ч при 80°C. Реакционную массу концентрировали, и неочищенное вещество очищали методом колоночной хроматографии с использованием этилацетата и гексана (1/1) с получением пиразолилпиридина в виде темно-коричневой жидкости (2 г, 43%):1H ЯМР (400 МГц, CDCl3) δ 8,99 (д, J=2,8 Гц, 1H), 8,48 (дд, J=4,8, 1,2 Гц, 1H), 8,11-8,08 (м, 1H), 7,99 (д, J=1,2 Гц, 1H), 7,78 (д, J=1,2 Гц, 1H), 7,38-7,35 (м, 1H), 6,53 (т, J=1,2 Гц, 1H); MS (m/z) 146 [M+1].
3-(3-Хлор-1H-пиразол-1-ил)пиридин получали, как описано для стадии 1 примера 6: т.пл. 98-106°C;1H ЯМР (400 МГц, CDCl3) δ 8,93 (д, J=2,6 Гц, 1H), 8,57 (дд, J=4,8, 1,4 Гц, 1H), 8,03 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,90 (д, J=2,5 Гц, 1H), 7,42 (ддд, J=8,3, 4,8, 0,7 Гц, 1H), 6,46 (д, J=2,5 Гц, 1H);13C (DMSO-d6) 148, 142, 140, 136, 131, 126, 125, 108.
2-Метил-3-(3-метил-1H-пиразол-1-ил)пиридин получали, как описано для стадии 1 примера 6:1H ЯМР (400 МГц, CDCl3) δ 8,53 (д, J=4,7 Гц, 1H), 7,67 (д, J=7,9 Гц, 1H), 7,54 (т, J=8,0 Гц, 1H), 7,27-7,19 (м, 1H), 6,27 (д, J=1,4 Гц, 1H), 2,53 (с, 3H), 2,38 (с, 3H).
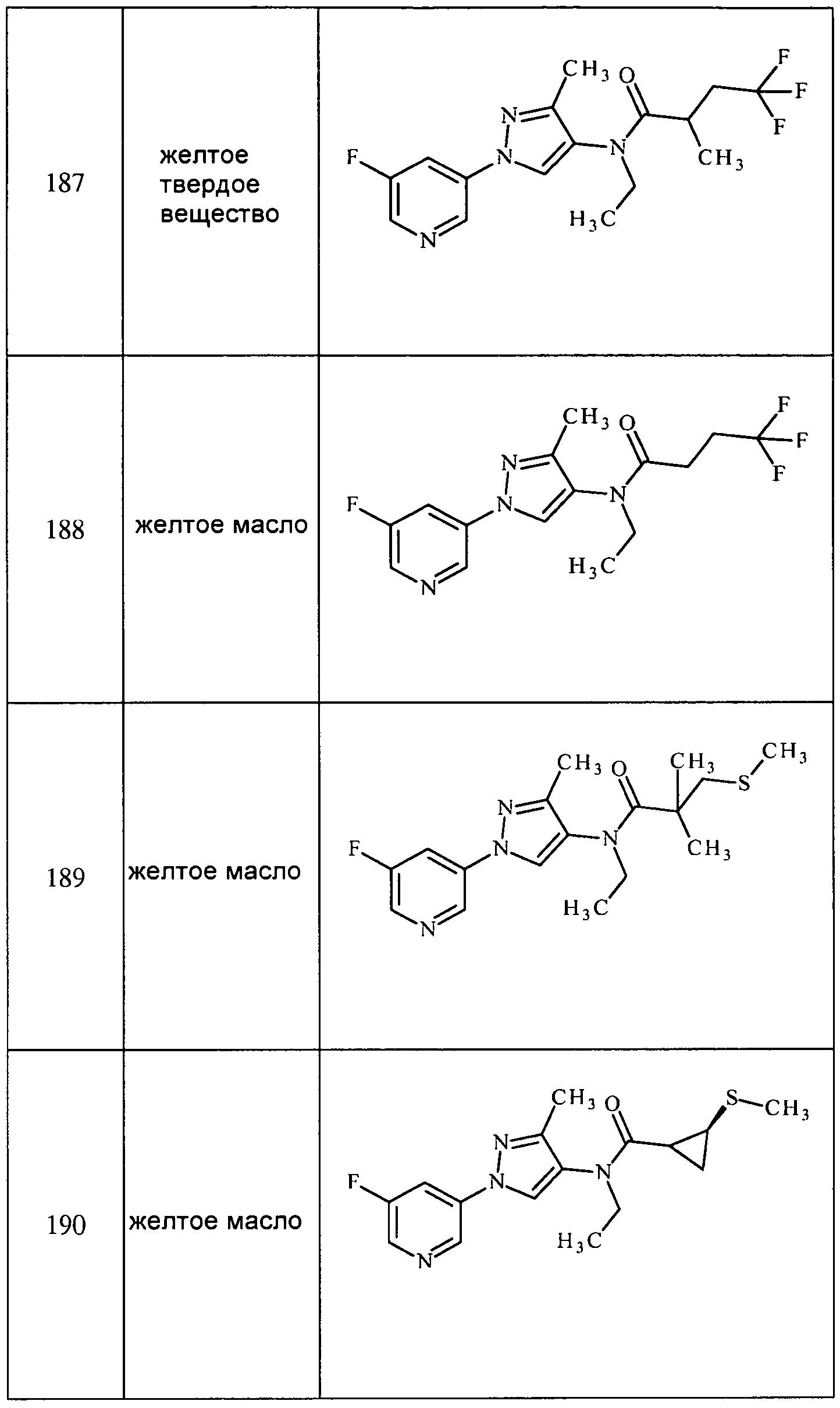
3-(3-(Трифторметил)-1H-пиразол-1-ил)пиридин получали из соответствующих исходных веществ, как описано для стадии 1 примера 6: т.пл. 59,0-61,0°C;1H ЯМР (400 МГц, CDCl3) δ 9,00 (с, 1H), 8,70-8,59 (м, 1H), 8,11 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 8,05-7,98 (м, 1H), 7,46 (дд, J=8,3, 4,8 Гц, 1H), 6,79 (д, J=2,4 Гц, 1H); EIMS m/z 213.
3-Фтор-5-(3-метил-1H-пиразол-1-ил)пиридин получали из соответствующих исходных веществ, как описано для стадии 1 примера 6: т.пл. 70,0-72,0°C;1H ЯМР (400 МГц, CDCl3) δ 8,76-8,73 (м, 1H), 8,37-8,33 (м, 1H), 7,88-7,85 (м, 1H), 7,84-7,79 (м, 1H), 6,34-6,29 (м, 1H), 2,37 (с, 3H); EIMS m/z 117.
3-(3-Хлор-1H-пиразол-1-ил)-5-фторпиридин получали из соответствующих исходных веществ, как описано для стадии 1 примера 6: т.пл. 77,0-82,0°C;1H ЯМР (400 МГц, CDCl3) δ 8,75 (д, J=1,8 Гц, 1H), 8,43 (д, J=2,3 Гц, 1H), 7,92 (д, J=2,6 Гц, 1H), 7,84 (дт, J=9,3, 2,4 Гц, 1H), 6,48 (д, J=2,6 Гц, 1H); EIMS m/z 198.
3-(3-Метил-1H-пиразол-1-ил)пиридин получали, как описано для стадии 1 примера 6:1H ЯМР (400 МГц, CDCl3) δ 8,94 (ушир.с, 1H), 8,51 (д, J=3,9 Гц, 1H), 8,02 (ддд, J=8,3, 2,6, 1,5 Гц, 1H), 7,90-7,79 (м, 1H), 7,39 (дд, J=8,2, 5,1 Гц, 1H), 6,30 (д, J=2,4 Гц, 1H), 2,39 (с, 3H).
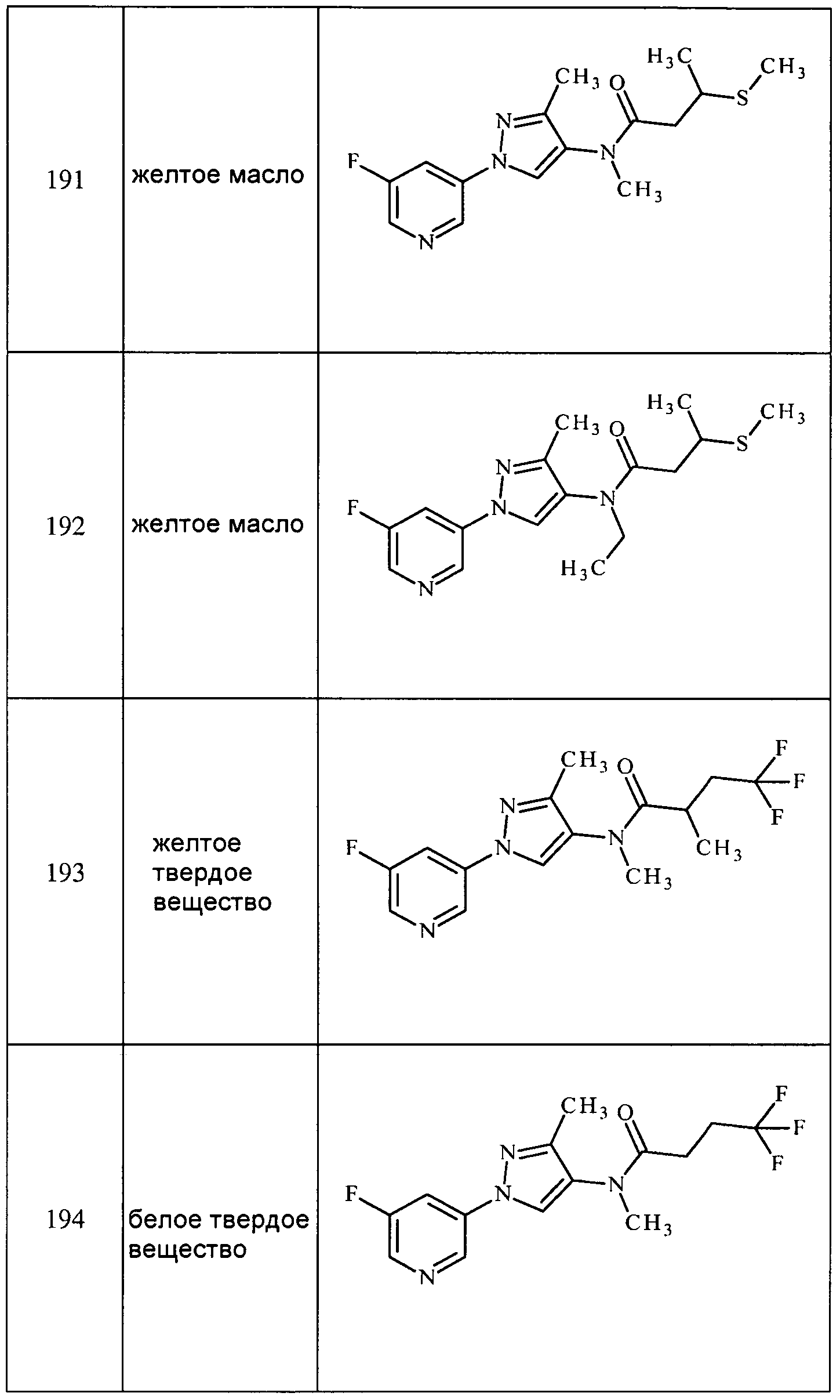
3-(5-Метил-1H-пиразол-1-ил)пиридин получали, как описано для стадии 1 примера 6:1H ЯМР (400 МГц, CDCl3) δ 8,77 (д, J=2,5 Гц, 1H), 8,65 (дд, J=4,8, 1,5 Гц, 1H), 7,84 (ддд, J=8,2, 2,5, 1,5 Гц, 1H), 7,63 (д, J=1,6 Гц, 1H), 7,44 (ддд, J=8,2, 4,8, 0,7 Гц, 1H), 6,225 (дд, J=1,6, 0,7 Гц, 1H), 2,40 (с, 3H).
Пример 6, стадия 2: Получение 3-(4-нитропиразол-1-ил)пиридина

3-Пиразол-1-илпиридин (2 г, 0,032 моль) растворяли в концентрированной H2SO4 (32 мл 0,598 ммоль.) и охлаждали до -5°C с использованием бани со льдом. К реакционной массе по каплям в течение 30 мин добавляли смесь (1/1) концентрированной HNO3 (30 мл, 0,673 ммоль) и концентрированной H2SO4 (30 мл, 15 об.). Охлаждение прекращали, и перемешивали реакционную смесь при комнатной температуре в течение ночи. После завершения реакции, смесь выливали на колотый лед и нейтрализовали добавлением насыщенного NaHCO3, фильтровали, промывали водой и сушили с получением нитропиразола в виде бледно-желтого твердого вещества (1,8 г, 68%):1H ЯМР (400 МГц, DMSO-d6) δ 9,03 (д, J=2,8 Гц, 1H); 8,70 (дд, J=4,8, 1,6 Гц, 1H), 8,69 (с, 1H), 8,33 (с, 1H), 8,11-8,08 (м, 1H), 7,51 (дд, J=8,4, 4,8 Гц, 1H); MS (m/z) 191 [M+1].
3-(3-Хлор-4-нитро-1H-пиразол-1-ил)пиридин получали, как описано для стадии 2 примера 6: т.пл. 139-142°C,1H ЯМР (400 МГц, CDCl3) δ 9,01 (д, J=2,0 Гц, 1H), 8,73 (д, J=4,9 Гц, 2H), 8,08 (ддд, J=8,3, 2,5, 1,3 Гц, 1H), 7,52 (дд, J=8,3, 4,8 Гц, 1H), EMS m/z 224.
3-(5-Метил-4-нитро-1H-пиразол-1-ил)пиридин получали, как описано для стадии 2 примера 6:1H ЯМР (400 МГц, CDCl3) δ 8,81-8,71 (м, 2H), 8,32 (с, 1H), 7,83 (ддд, J=8,2, 2,5, 1,6 Гц, 1H), 7,54 (дд, J=8,2, 4,8 Гц, 1H), 2,72(с, 3H).
2-Метил-3-(3-метил-4-нитро-1H-пиразол-1-ил)пиридин получали, как описано для стадии 2 примера 6:1H ЯМР (400 МГц, d6-DMSO) δ 14,01 (с, 1H), 9,37 (д, J=4,0 Гц, 1H), 8,69 (т, J=17,3 Гц, 1H), 8,21 (дд, J=7,7, 4,8 Гц, 1H), 2,29 (с, 3H), 2,20 (с, 3H);13C 154, 150, 146, 135, 134,9, 134,8, 134,3, 122, 21, 14; EIMS m/z 218.
3-(3-Метил-4-нитро-1H-пиразол-1-ил)пиридин получали, как описано для стадии 2 примера 6: т.пл. 122-124°C;1H ЯМР (400 МГц, CDCl3) δ 9,01 (д, J=2,5 Гц, 1H), 8,77-8,56 (м, 2H), 8,07 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,56-7,37 (м, 1H), 2,66 (с, 3H); EIMS m/z 208.
3-Фтор-5-(3-метил-4-нитро-1H-пиразол-1-ил)пиридин получали из соответствующего исходного вещества, как описано для стадии 2 примера 6: т.пл. 90,0-92,0°C;1H ЯМР (400 МГц, CDCl3) δ 8,82 (д, J=2,0 Гц, 1H), 8,69 (с, 1H), 8,54 (д, J=2,5 Гц, 1H), 7,89 (дт, J=8,9, 2,4 Гц, 1H), 2,66 (с, 3H); EIMS m/z 222.
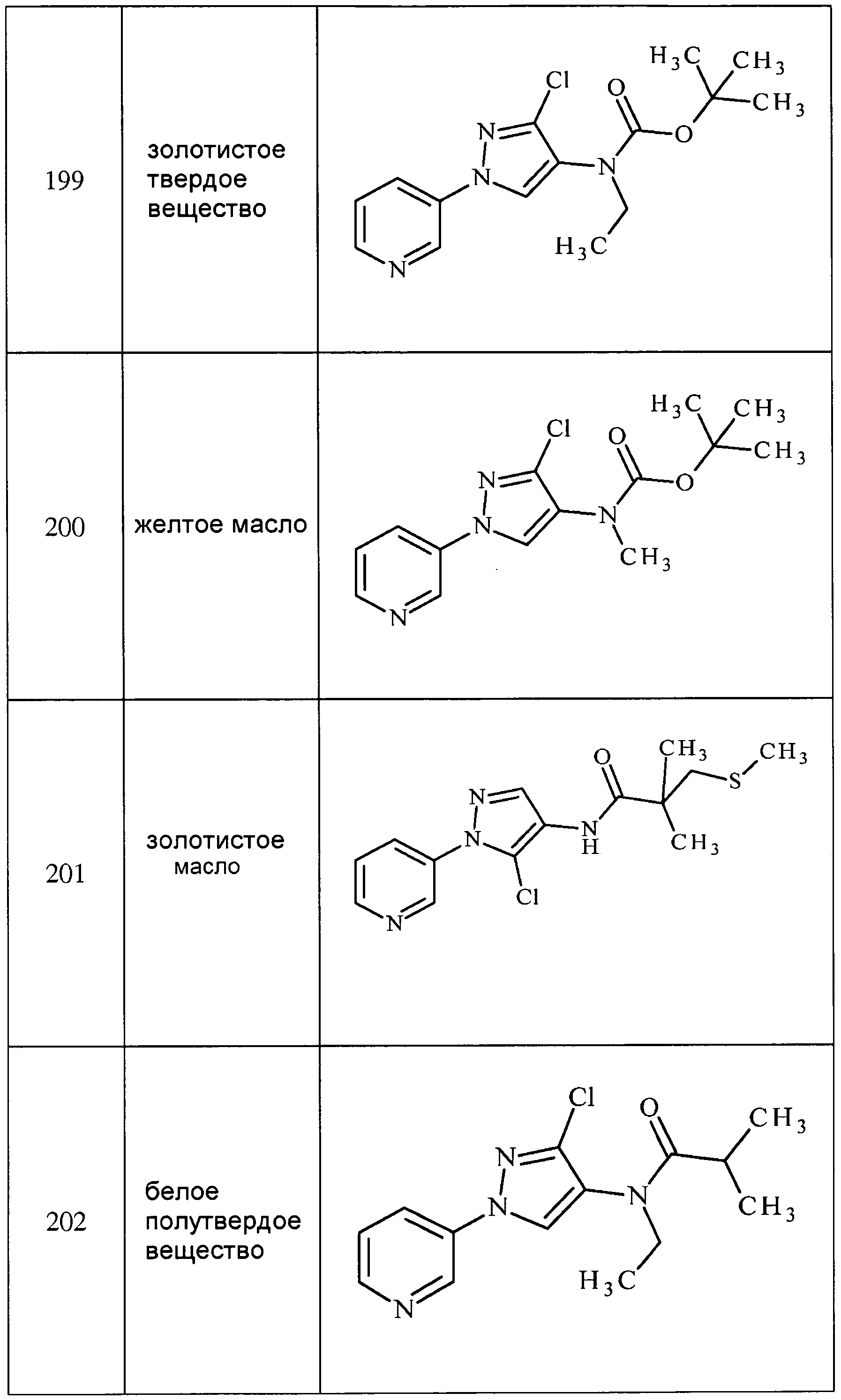
3-(4-Нитро-3-(трифторметил)-1H-пиразол-1-ил)пиридин получали из соответствующего исходного вещества, как описано для стадии 2 примера 6: т.пл. 121,0-123,0°C;1H ЯМР (400 МГц, CDCl3) δ 9,04 (д, J=2,5 Гц, 1H), 8,79 (с, 1H), 8,77 (д, J=0,9 Гц, 1H), 8,13 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,55 (дт, J=10,8, 5,4 Гц, 1H); EIMS m/z 258.
3-(3-Хлор-4-нитро-1H-пиразол-1-ил)-5-фторпиридин получали из соответствующего исходного вещества, как описано для стадии 2 примера 6: т.пл. 109,5-111,0°C;1H ЯМР (400 МГц, CDCl3) δ 8,83 (д, J=2,1 Гц, 1H), 8,75 (с, 1H), 8,60 (д, J=2,4 Гц, 1H), 7,89 (дт, J=8,6, 2,4 Гц, 1H); EIMS m/z 242.
3-(3-Бром-4-нитро-1H-пиразол-1-ил)пиридин получали из соответствующего исходного вещества, как описано для стадии 2 примера 6: т.пл. 139,0-141,0°C;1H ЯМР (400 МГц, CDCl3) δ 9,01 (д, J=2,5 Гц, 1H), 8,73 (дд, J=4,7, 1,1 Гц, 1H), 8,71 (с, 1H), 8,15-8,00 (м, 1H), 7,52 (дд, J=8,3, 4,8 Гц, 1H); ESIMS m/z 271 ([M+2]+).
Пример 6, стадия 3: Получение 1-пиридин-3-ил-1H-пиразол-4-иламина

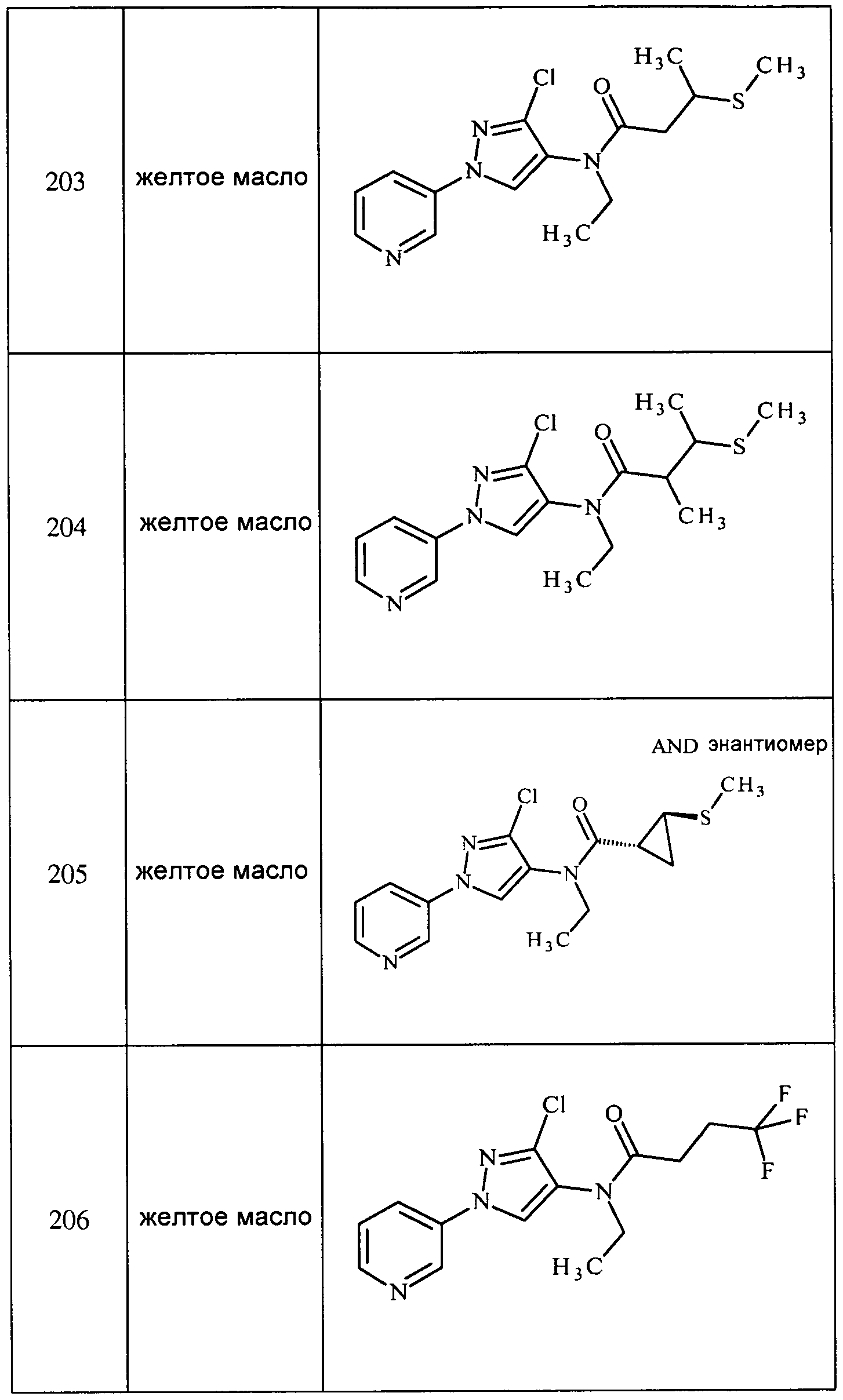
К раствору 3-(4-нитропиразол-1-ил)пиридина (1,8 г, 0,009 моль) в безводном THF (18 мл) в атмосфере азота добавляли 5% Pd/C (180 мг). Затем, смесь перемешивали в атмосфере водорода до завершения реакции. Реакционную смесь фильтровали через слой целита, и концентрировали досуха с получением содержащего примеси темно-коричневого твердого вещества (1,76 г):1H ЯМР (400 МГц, DMSO-d6) δ 8,89 (дд, J=2,8, 0,4 Гц, 1H); 8,48 (дд, J=4,8, 1,2 Гц, 1H), 7,99-7,96 (м, 1H), 7,54 (д, J=1,2 Гц, 1H), 7,45 (д, J=0,4 Гц, 1H), 7,38-7,35 (м, 1H), 4,81 (ушир.с 1H); ESIMS (m/z) 161 [M+1].
5-Метил-1-(пиридин-3-ил)-1H-пиразол-4-амин получали, как описано для стадии 3 примера 6:1H ЯМР (400 МГц, CDCl3) δ 8,74 (д, J=2,3 Гц, 1H), 8,63-8,50 (м, 1H), 7,81 (ддд, J=8,2, 2,5, 1,5 Гц, 1H), 7,46-7,33 (м, 2H), 2,64 (ушир.с, 1H),, 2,29 (с, 3H);13C (DMSO-d6) 147, 144, 137, 133, 130, 129, 124, 123, 10; EIMS m/z 174.
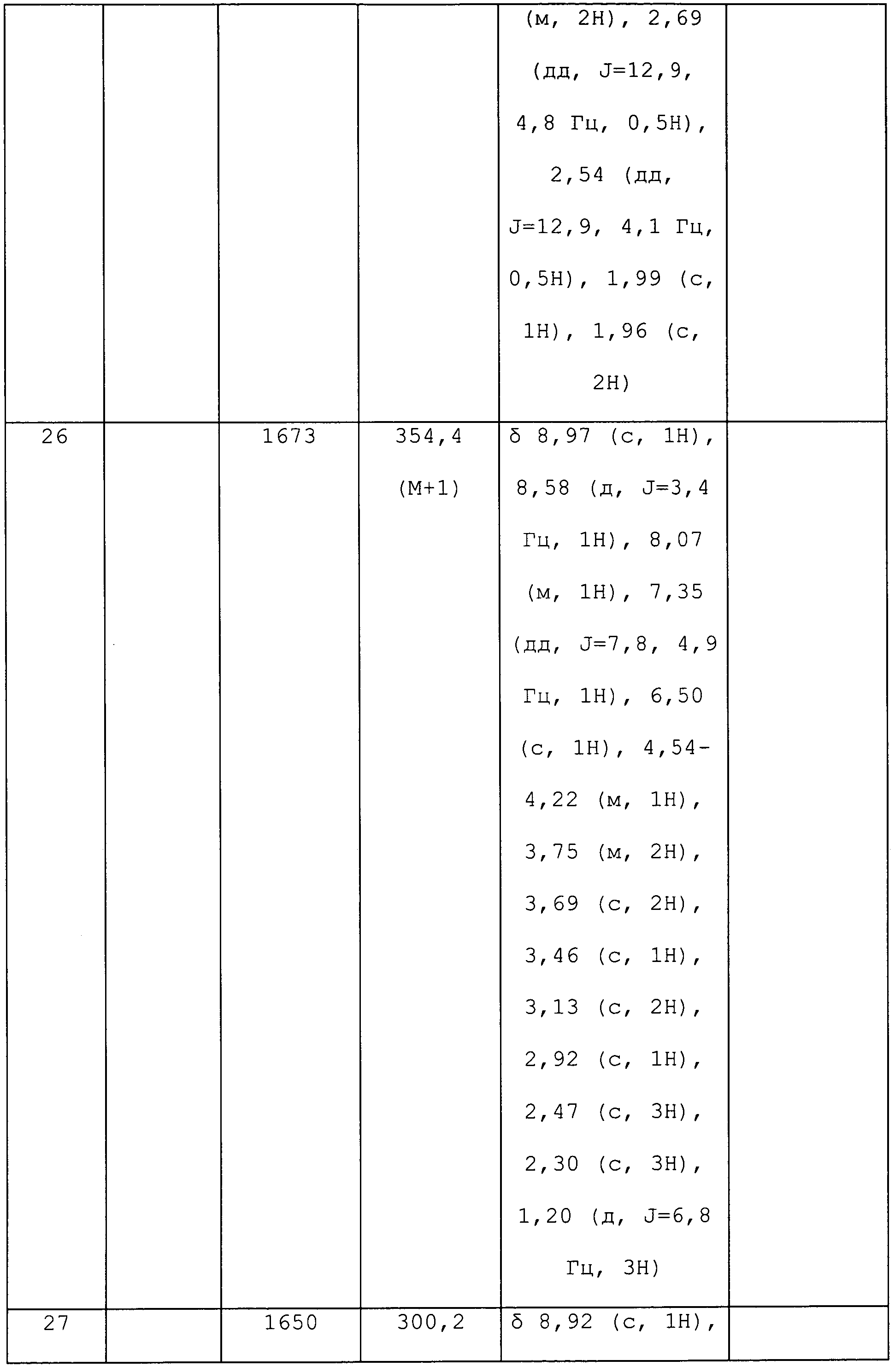
3-Метил-1-(пиримидин-5-ил)-1H-пиразол-4-амин получали, как описано для стадии 3 примера 6: т.пл. 211-215°C;1H ЯМР (400 МГц, CDCl3) δ 9,10-8,87 (м, 3H), 7,51 (с, 1H), 3,24 (ушир.с, 2H), 2,29 (с, 3H); ESIMS m/z 176 ([M+H]).
3-Хлор-1-(пиримидин-5-ил)-1H-пиразол-4-амин получали, как описано для стадии 3 примера 6: т.пл. 146-148°C;1H ЯМР (400 МГц, CDCl3) δ 9,07 (с, 1H), 9,02 (с, 2H), 7,52 (с, 1H), 3,45 (с, 2H); ESIMS m/z 196 ([M+H]).
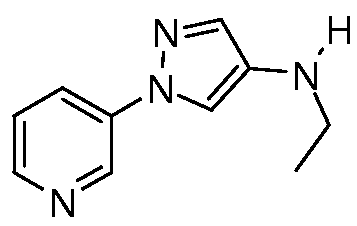
Пример 7: Получение метил(1-пиридин-3-ил-1H-пиразол-4-ил)амина

Способ A:
В круглодонную колбу емкостью 25 мл, содержащую 1-пиридин-3-ил-1H-пиразол-4-иламин (1,76 г, 0,011 моль) в этаноле (26,4 мл), добавляли бензотриазол (1,31 г, 0,011 моль). Реакционную смесь охлаждали до 0°C-10°C, медленно добавляли формальдегид (0,36 мл, 0,0121 моль) и поддерживали при этой температуре в течение 30 мин. Реакционную смесь фильтровали и концентрировали досуха. Неочищенное вещество (2,56 г, 0,009 моль) растворяли в безводном тетрагидрофуране (25,6 мл), охлаждали до 0°C, и в течение 15 мин добавляли боргидрид натрия (0,326 г, 0,00882 моль). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 2 часов. Реакционную смесь вливали в воду и экстрагировали дихлорметаном, органический слой сушили над безводным Na2SO4 и концентрировали досуха. Неочищенное вещество очищали методом хроматографии на силикагеле, элюируя 20% метанолом в хлороформе, с получением целевого продукта в виде коричневого твердого вещества (0,610 г, 32%):1Н ЯМР (400 МГц, d6-DMSO) δ 8,92 (д, J=2,4 Гц, 1H), 8,47 (дд, J=4,8, 1,6 Гц, 1H), 8,01-7,98 (м, 1H), 7,45 (с, 1H), 7,30 (с, 1H), 7,37 (дд, J=8,0, 4,4 Гц, 1H), 2,84 (с, 3H); ESIMS m/z 175 ([M+1]).
Способ B:
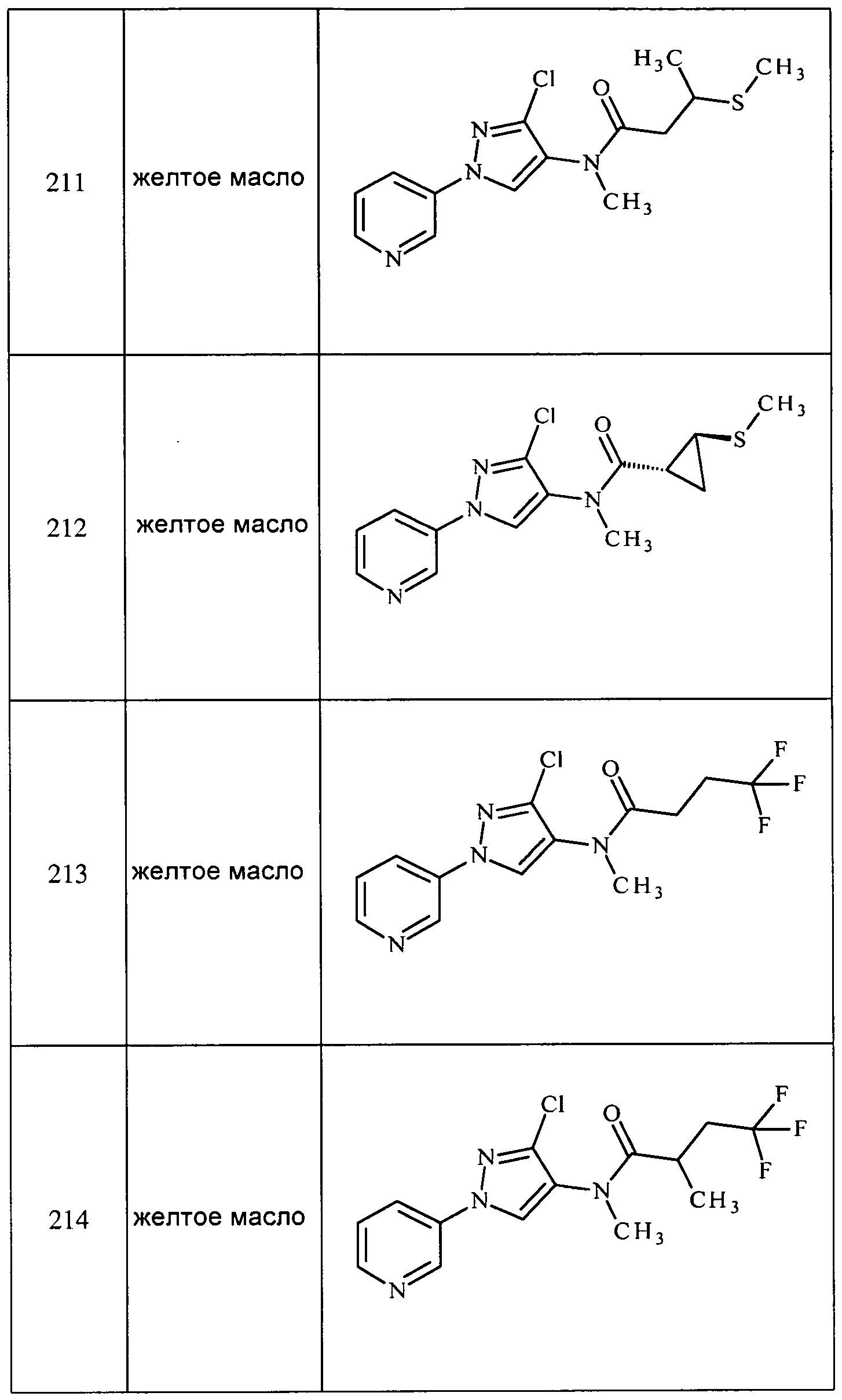
1-Пиридин-3-ил-1H-пиразол-4-иламин (1,0 г, 6,2 ммоль) растворяли в триэтил-орто-формиате (5 мл, 30 ммоль), и добавляли трифторуксусную кислоту (3-4 капли). Реакционную смесь нагревали с обратным холодильником при 120°C в течение 3 часов, а затем концентрировали. Неочищенное вещество растворяли в этаноле (5 мл), охлаждали до 0°C и обрабатывали боргидридом натрия (0,6 г, 15,7 ммоль). После нагревания до комнатной температуры, смесь нагревали с обратным холодильником в течение 3 часов. Смесь концентрировали, и распределяли остаток между водой и диэтиловым эфиром. Эфирный слой разделяли и концентрировали досуха. Неочищенное вещество очищали методом хроматографии на силикагеле, элюируя 5% метанолом в хлороформе, с получением целевого продукта в виде бледно-желтого твердого вещества (0,3 г, 27%): т.пл. 65-67°C;1H ЯМР (300 МГц, CDCl3) δ 8,91 (ушир.с, 1H), 8,46 (д, J=4,5 Гц, 1H), 7,99 (д, J=8,3 Гц, 1H), 7,43 (с, 1H), 7,41 (с, 1H), 7,36 (дд, J=8,3, 4,7 Гц, 1H), 2,86 (д, J=12,4 Гц, 3H); ESIMS m/z 175 ([M+1]).
Пример 8: Получение этил(1-пиридин-3-ил-1H-пиразол-4-ил)амина
Способ A:
К 1-пиридин-3-ил-1H-пиразол-4-иламину (0,5 г, 3,12 ммоль) в дихлорметане (5 мл) добавляли ацетилхлорид (0,28 г, 3,75 ммоль), а затем DMAP (0,57 г, 4,68 ммоль), и перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали и очищали методом колоночной хроматографии на силикагеле. Извлеченное вещество растворяли в тетрагидрофуране (5 мл), добавляли алюмогидрид лития (0,23 г, 6,25 ммоль), и перемешивали при комнатной температуре в течение 12 часов. Реакционную смесь гасили добавлением насыщенного Na2SO4 и фильтровали через целит. Фильтрат собирали и концентрировали досуха. Неочищенное вещество очищали методом колоночной хроматографии на силикагеле, элюируя 0-5% метанолом в хлороформе, и снова проводили хроматографию на силикагеле, элюируя 0-100% этилацетатом в гексанах, с получением целевого продукта (0,080 г, 14%):1H ЯМР (400 МГц, CDCl3) δ 8,90 (д, J=2,7 Гц, 1H), 8,46 (дд, J=4,7, 1,3 Гц, 1H), 7,98 (ддд, J=8,3, 2,6, 1,5 Гц, 1H), 7,41 (дт, J=13,3, 6,6 Гц, 2H), 7,36 (ддд, J=8,3, 4,7, 0,7 Гц, 1H), 3,10 (кв, J=7,1 Гц, 2H), 1,27 (т, 3H).
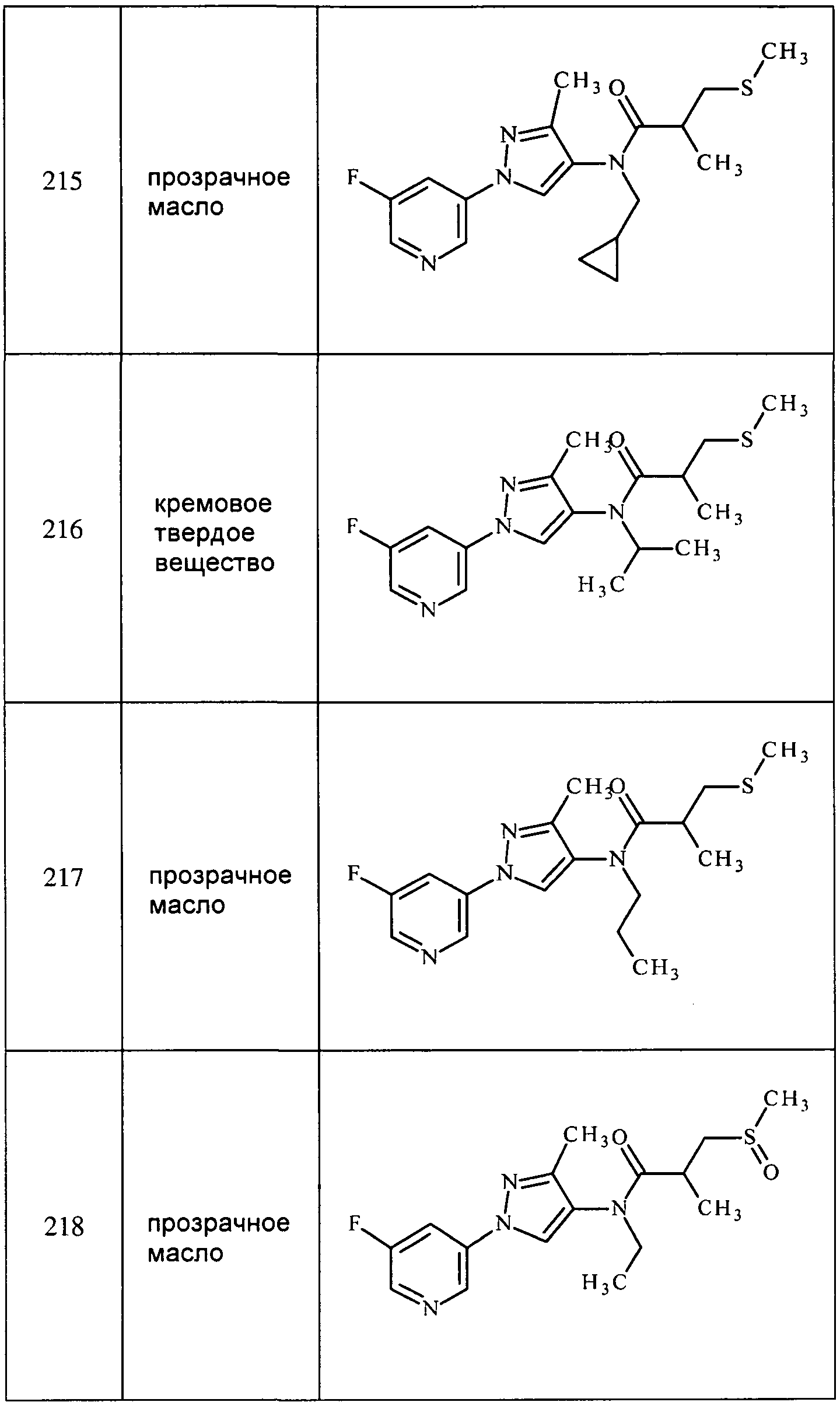
Способ B:
К раствору трет-бутилэтил(1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамата (3,4 г, 11,79 ммоль) в дихлорметане (4,54 мл) добавляли трифторуксусную кислоту (9 мл), и перемешивали реакционную смесь в течение 1 часа при комнатной температуре. Добавляли толуол, и концентрировали реакционную смесь почти досуха. Реакционную смесь вливали в делительную воронку, осторожно гасили добавлением насыщенного водного NaHCO3 и экстрагировали дихлорэтаном. Органический слой сушили (MgSO4), фильтровали и концентрировали досуха. Неочищенный продукт очищали методом хроматографии на силикагеле (элюируя 0-10% MeOH в дихлорметане) с получением целевого продукта в виде бледно-желтого масла (2,10 г, 95%):1H ЯМР (400 МГц, CDCl3) δ 8,90 (дд, J=1,8, 0,8 Гц, 1H), 8,51-8,39 (м, 1H), 7,97 (ддт, J=8,3, 2,7, 1,3 Гц, 1H), 7,41 (д, J=0,8 Гц, 2H), 7,38-7,30 (м, 1H), 3,21-2,93 (м, 2H), 1,34-1,19 (м, 3H).
3-Хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амин получали, как описано для способа B примера 8:1H ЯМР (400 МГц, CDCl3) δ 8,87 (д, J=2,5 Гц, 1H), 8,47 (дд, J=4,7, 1,2 Гц, 1H), 7,96 (ддд, J=8,4, 2,6, 1,4 Гц, 1H), 7,38-7,32 (м, 2H), 3,11 (кв, J=7,1 Гц, 2H), 2,97 (ушир.с, 1H), 1,31 (т, J=7,1 Гц, 3H).
3-Хлор-N-метил-1-(пиридин-3-ил)-1H-пиразол-4-амин получали, как описано для способа B примера 8: т.пл. 108-118 C;1H ЯМР (400 МГц, CDCl3) δ 8,88 (д, J=2,4 Гц, 1H), 8,48 (дд, J=4,7, 1,4 Гц, 1H), 7,96 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,41-7,29 (м, 2H), 2,87 (с, 3H); EIMS m/z 208.
N,3-диметил-1-(пиридин-3-ил)-1H-пиразол-4-амин получали, как описано для способа B примера 8:1H ЯМР (400 МГц, CDCl3) δ 9,03-8,73 (м, 1H), 8,41 (дд, J=4,7, 1,4 Гц, 1H), 7,95 (ддд, J=8,4, 2,7, 1,4 Гц, 1H), 7,42-7,27 (м, 2H), 2,85 (с, 4H), 2,25 (с, 3H); EIMS m/z 189.
3-Хлор-N-(циклопропилметил)-1-(пиридин-3-ил)-1H-пиразол-4-амин получали, как описано для способа B примера 8:1H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,5 Гц, 1H), 8,47 (дд, J=4,7, 1,4 Гц, 1H), 8,03-7,89 (м, 1H), 7,40-7,29 (м, 2H), 3,21 (с, 1H), 2,91 (д, J=4,4 Гц, 2H), 1,18-1,02 (м, 1H), 0,65-0,45 (м, 2H), 0,41-0,12 (м, 2H).
3-Хлор-N-пропил-1-(пиридин-3-ил)-1H-пиразол-4-амин получали, как описано для способа B примера 8:1H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,6 Гц, 1H), 8,47 (дд, J=4,7, 1,4 Гц, 1H), 8,01-7,89 (м, 1H), 7,42-7,27 (м, 2H), 3,23-2,84 (м, 3H), 1,77-1,59 (м, 2H), 1,03 (т, J=7,4 Гц, 3Н).
1-(5-Фторпиридин-3-ил)-N,3-диметил-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано для способа B примера 8: т.пл. 142,0-143,5°C;1H ЯМР (400 МГц, CDCl3) δ 8,67 (с, 1H), 8,26 (д, J=2,3 Гц, 1H), 7,73 (дт, J=10,0, 2,4 Гц, 1H), 7,27 (с, 1H), 2,92-2,81 (м, 4H), 2,24 (с, 3H); ESIMS m/z 207 ([M+H]+).
N-этил-1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано для способа B примера 8: т.пл. 85,0-86,0°C;1H ЯМР (400 МГц, CDCl3) δ 8,66 (с, 1H), 8,25 (д, J=2,5 Гц, 1H), 7,72 (дт, J=10,0, 2,3 Гц, 1H), 7,27 (с, 1H), 3,07 (кв, J=7,1 Гц, 2H), 2,71 (с, 1H), 2,25 (с, 3H), 1,30 (т, J=7,1 Гц, 3H); ESIMS m/z 221 ([M+H]+).
3-Метил-N-пропил-1-(пиридин-3-ил)-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано для способа B примера 8: т.пл. 65,0-67,0°C;1H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,4 Гц, 1H), 8,40 (дд, J=4,7, 1,4 Гц, 1H), 7,94 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,35-7,28 (м, 2H), 3,00 (т, J=7,1 Гц, 2H), 2,26 (с, 3H), 1,76-1,58 (м, 2H), 1,03 (т, J=7,4 Гц, 3H); ESIMS m/z 211 ([M+H]+).
N-(циклопропилметил)-3-метил-1-(пиридин-3-ил)-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано для способа B примера 8: т.пл. 73,0-75,0°C;1H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,4 Гц, 1H), 8,40 (дд, J=4,7, 1,3 Гц, 1H), 7,94 (ддд, J=8,3, 2,6, 1,5 Гц, 1H), 7,35-7,28 (м, 2H), 2,87 (д, J=6,9 Гц, 2H), 2,75 (с, 1H), 2,28 (с, 3H), 1,22-1,05 (м, 1H), 0,63-0,56 (м, 2H), 0,26 (кв, J=4,7 Гц, 2H); ESIMS m/z 229 ([M+H]+).
N-изопропил-3-метил-1-(пиридин-3-ил)-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано для способа B примера 8: ИК (тонкая пленка) 3303 см-1;1H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,3 Гц, 1H), 8,41 (дд, J=4,7, 1,4 Гц, 1H), 7,94 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,36-7,28 (м, 2H), 3,30 (гепт, J=6,3 Гц, 1H), 2,25 (с, 3H), 1,24 (д, J=6,3 Гц, 6H); EIMS m/z 216.
5-Этокси-1-(5-фторпиридин-3-ил)-N,3-диметил-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано для способа B примера 8: ИК (тонкая пленка) 3340 см-1;1H ЯМР (400 МГц, CDCl3) δ 8,91 (с, 1H), 8,31 (д, J=2,5 Гц, 1H), 7,88-7,80 (м, 1H), 4,24 (кв, J=7,1 Гц, 2H), 2,79 (с, 3H), 2,24 (с, 3H), 1,36 (т, J=7,1 Гц, 3H); EIMS m/z 250.
5-Бром-N-метил-1-(пиридин-3-ил)-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано для способа B примера 8: т.пл. 77,0-79,0°C;1H ЯМР (400 МГц, CDCl3) δ 8,90 (д, J=2,0 Гц, 1H), 8,63 (д, J=3,9 Гц, 1H), 7,93 (ддд, J=8,2, 2,4, 1,5 Гц, 1H), 7,51 (с, 1H), 7,43 (дд, J=8,2, 4,8 Гц, 1H), 4,49 (с, 1H), 2,91 (с, 3H); ESIMS m/z 255 [M+2]+.
5-Фтор-N,3-диметил-1-(пиридин-3-ил)-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано для способа B примера 8:1H ЯМР (400 МГц, CDCl3) δ 8,91 (т, J=2,1 Гц, 1H), 8,50 (дд, J=4,8, 1,5 Гц, 1H), 7,93 (ддт, J=8,3, 2,8, 1,5 Гц, 1H), 7,37 (ддд, J=8,3, 4,8, 0,7 Гц, 1H), 2,86 (д, J=1,6 Гц, 3H), 2,43 (с, 2H), 2,24 (с, 3H); EIMS m/z 206.
5-Бром-N,3-диметил-1-(пиридин-3-ил)-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано для способа B примера 8:1H ЯМР (400 МГц, CDCl3) δ 8,86 (дд, J=2,5, 0,5 Гц, 1H), 8,59 (дд, J=4,8, 1,5 Гц, 1H), 7,88 (ддд, J=8,2, 2,6, 1,5 Гц, 1H), 7,40 (ддд, J=8,2, 4,8, 0,7 Гц, 1H), 2,85 (с, 3H), 2,69 (с, 1H), 2,35 (с, 3H); ESIMS m/z 268 [M+H]+.
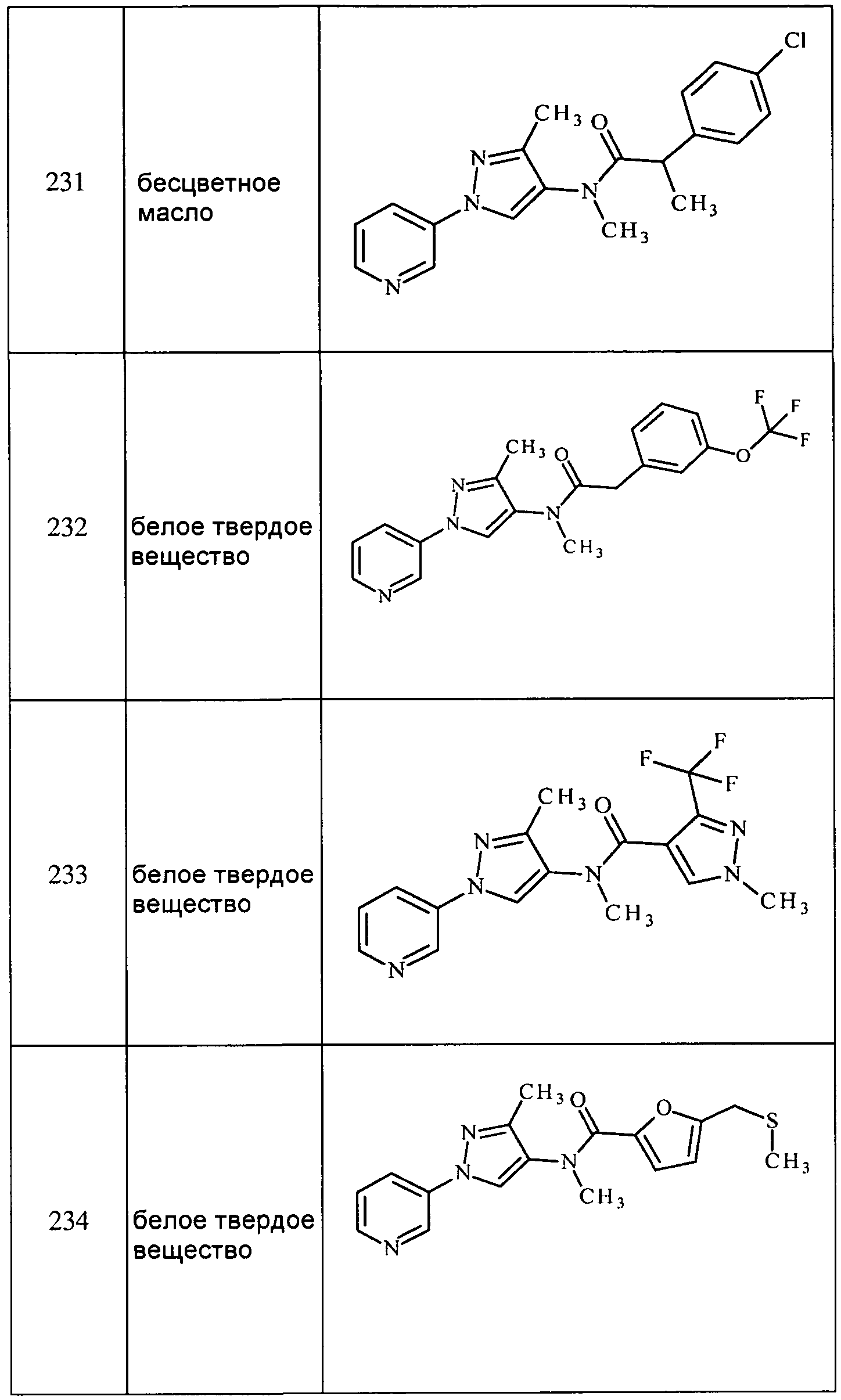
5-Хлор-N,3-диметил-1-(пиридин-3-ил)-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано для способа B примера 8:1H ЯМР (400 МГц, CDCl3) δ 8,87 (д, J=2,3 Гц, 1H), 8,59 (дд, J=4,8, 1,3 Гц, 1H), 7,90 (ддд,J=8,2, 2,6, 1,5 Гц, 1H), 7,40 (ддд, J=8,2, 4,8, 0,6 Гц, 1H), 2,87 (с, 3H), 2,45-2,19 (м, 4H); EIMS m/z 223.
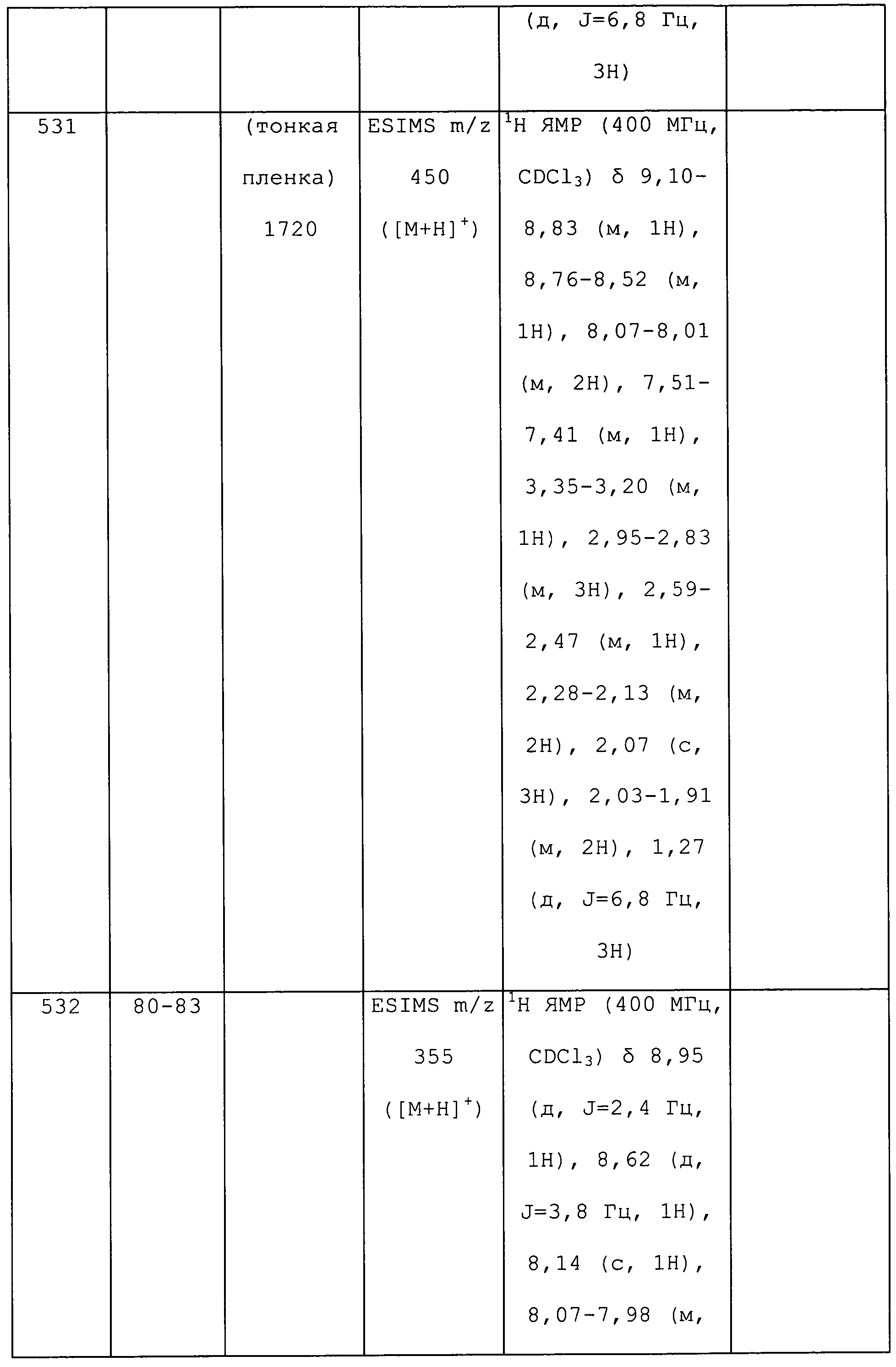
3-Хлор-1-(5-фторпиридин-3-ил)-N-метил-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано для способа B примера 8: т.пл. 117,5-119,0°C;1H ЯМР (400 МГц, CDCl3) δ 8,68 (д, J=1,1 Гц, 1H), 8,33 (д, J=2,5 Гц, 1H), 7,75 (дт, J=9,6, 2,4 Гц, 1H), 7,31 (с, 1H), 3,14 (с, 1H), 2,87 (с, 3H); ESIMS m/z 227 ([M]+).
3-Хлор-N-этил-1-(5-фторпиридин-3-ил)-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано для способа B примера 8:1H ЯМР (400 МГц, CDCl3) δ 8,70-8,63 (м, 1H), 8,32 (д, J=2,4 Гц, 1H), 7,74 (дт, J=9,7, 2,4 Гц, 1H), 7,31 (с, 1H), 3,11 (кв, J=7,2 Гц, 2H), 1,31 (т, J=7,1 Гц, 3H).
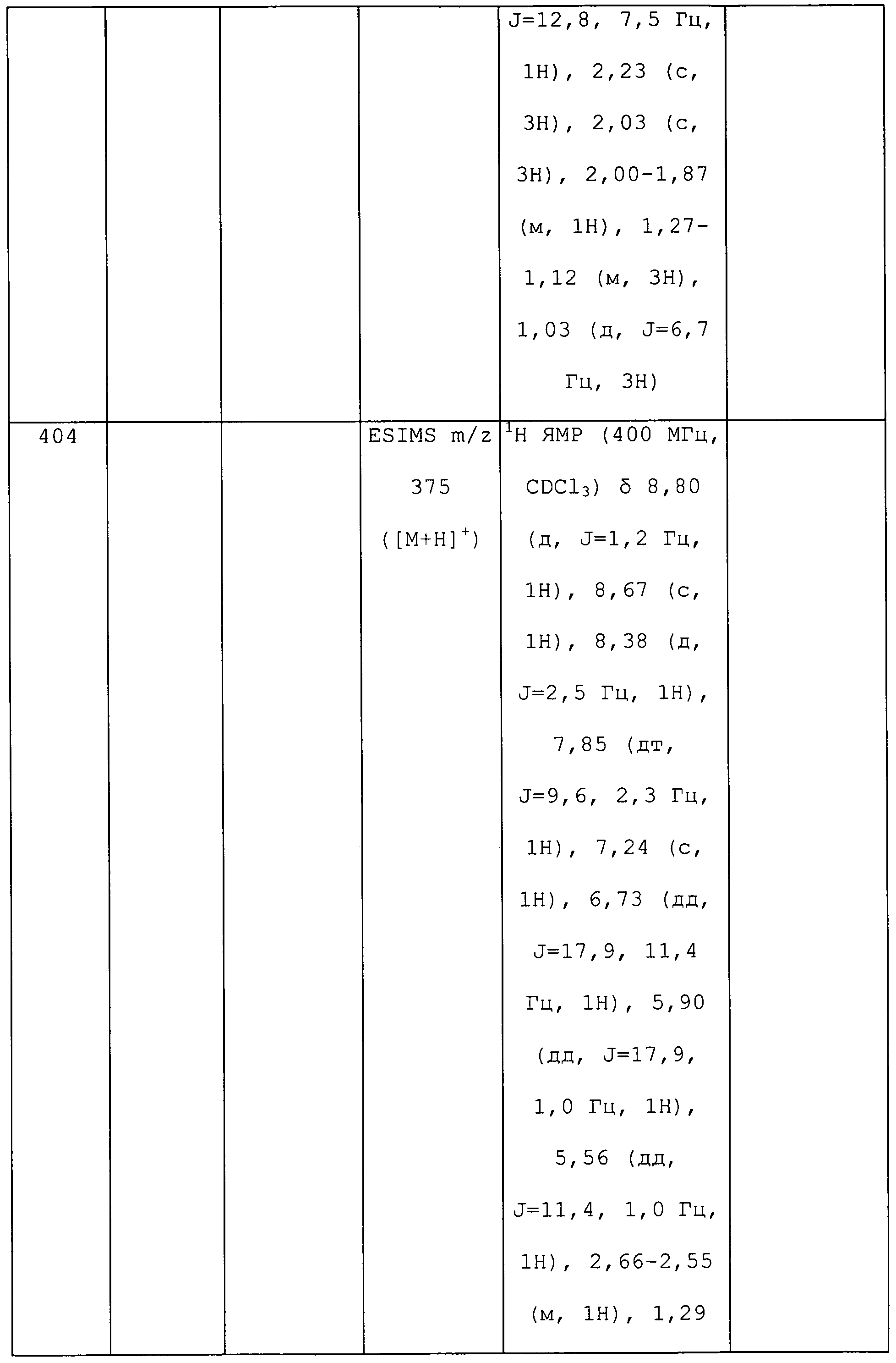
1-(5-Фторпиридин-3-ил)-N-метил-3-винил-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано для способа B примера 8: 105,0-107,0°C;1H ЯМР (400 МГц, CDCl3) δ 8,72 (с, 1H), 8,31 (д, J=2,5 Гц, 1H), 7,81 (дт, J=9,8, 2,4 Гц, 1H), 7,33 (с, 1H), 6,75 (дд, J=18,0, 11,6 Гц, 1H), 5,83 (дд,J=18,0, 1,1 Гц, 1H), 5,46 (дд, J=11,6, 1,1 Гц, 1H), 2,86 (с, 3H); ESIMS m/z 219 ([M+H]+).
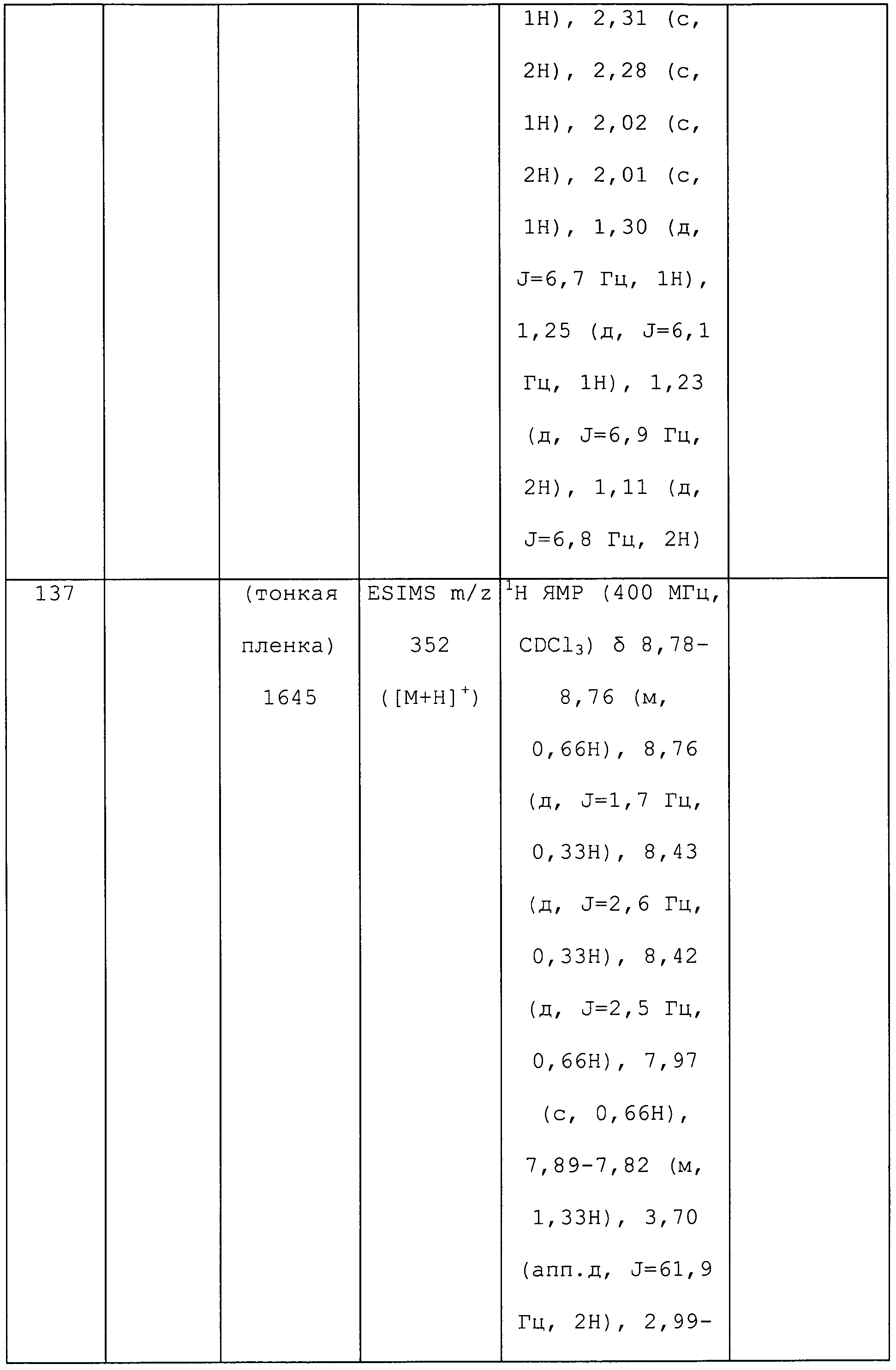
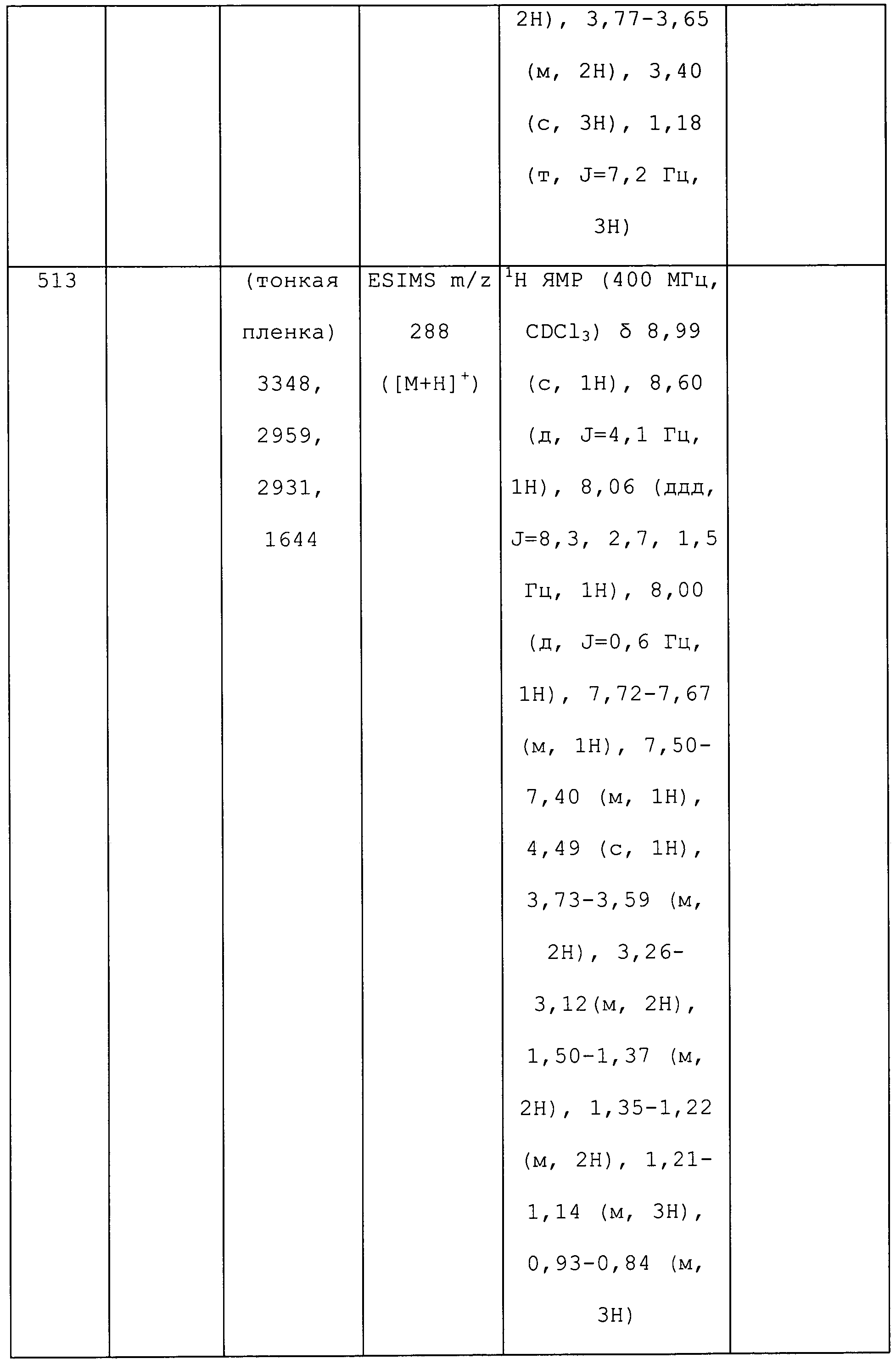
3-Циклопропил-1-(5-фторпиридин-3-ил)-N-метил-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано для способа B примера 8: т.пл. 118,0-119,5°C;1H ЯМР (400 МГц, CDCl3) δ 8,66-8,58 (м, 1H), 8,23 (д, J=2,5 Гц, 1H), 7,75-7,68 (м, 1H), 7,25 (с, 1H), 3,09 (с, 1H), 2,86 (с, 3H), 1,78-1,63 (м, 1H), 0,99-0,90 (м, 4H); ESIMS m/z 233 ([M+H]+).
3-Хлор-1-(пиридин-3-ил)-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано для способа B примера 8: т.пл. 137,9-139,9;1H ЯМР (400 МГц, CDCl3) δ 8,84 (д, J=2,4 Гц, 1H), 8,50 (дд, J=4,7, 1,4 Гц, 1H), 7,95 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,52 (с, 1H), 7,37 (ддд, J=8,4, 4,7, 0,7 Гц, 1H), 3,18 (с, 2H); ESIMS m/z 196 ([M+H]+).
2-((3-Хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)амино)ацетонитрил получали из трет-бутил(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(цианометил)карбамата, как описано для способа B примера 8: т.пл. 141-143°C;1H ЯМР (300 МГц, CDCl3) δ 8,91 (д, J=2,7 Гц, 1H), 8,54 (дд, J=5,1, 1,8 Гц, 1H), 7,97 (м, 1H), 7,62 (с, 1H), 7,38 (дд,J=12,0, 7,5 Гц, 1H), 4,97 (д, J=6,9 Гц, 2H), 3,52 (м, 1H); EIMS m/z 235 ([M+1]+).
N,3-диметил-1-(пиримидин-5-ил)-1H-пиразол-4-амин получали, как описано для способа B примера 8: т.пл. 139-143°C;1H ЯМР (400 МГц, CDCl3) δ 9,02 (с, 2H), 9,00 (с, 1H), 7,30 (с, 1H), 2,87 (д, J=11,5 Гц, 3H), 2,27 (с, 3H); ESIMS m/z 190 ([M+H]).
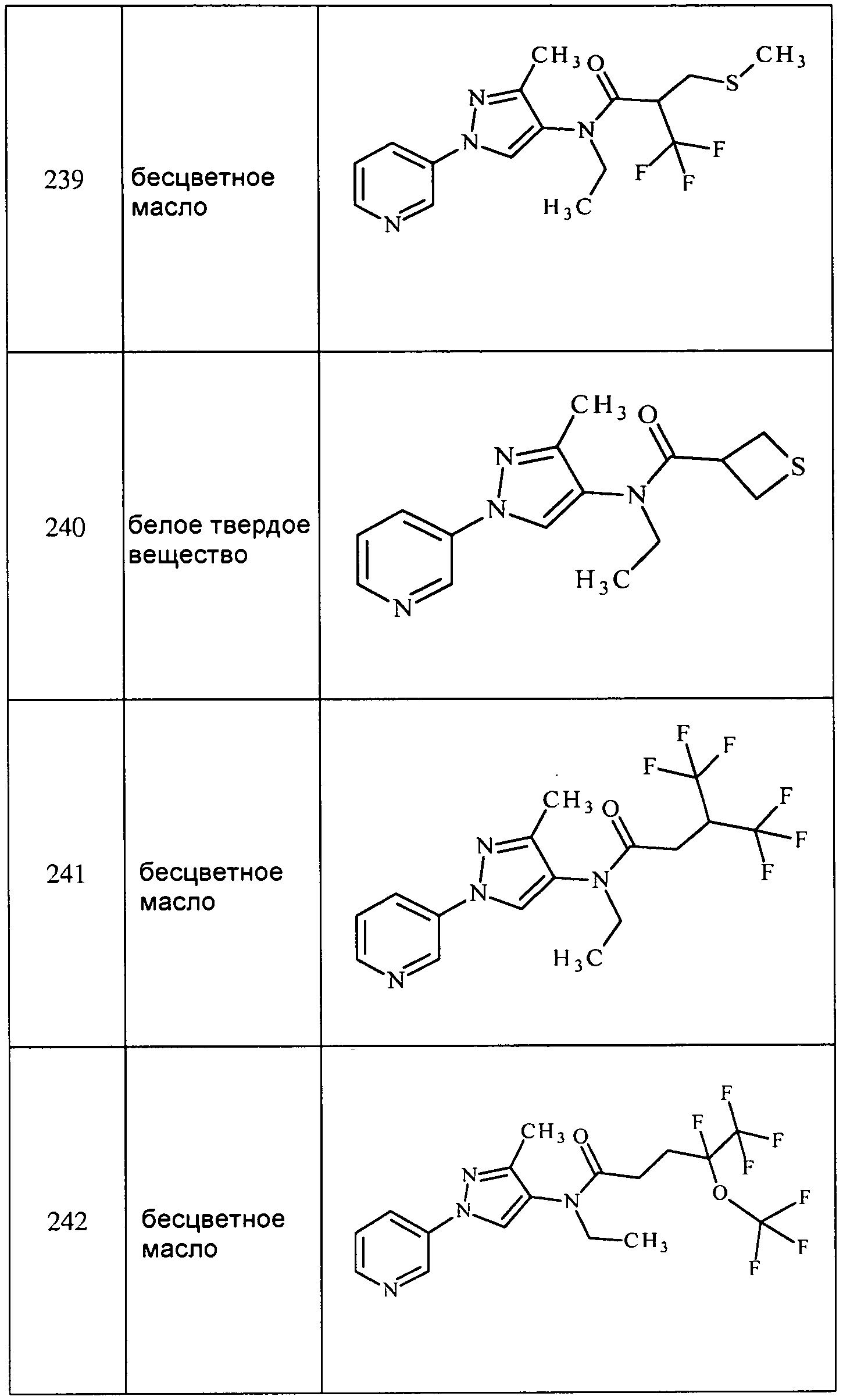
3-Хлор-N-метил-1-(пиримидин-5-ил)1-1H-пиразол-4-амин получали, как описано для способа B примера 8: т.пл. 111-114°C;1H ЯМР (400 МГц, CDCl3) δ 9,09-9,04 (м, 1H), 9,02 (с, 2H), 7,30 (с, 1H), 3,14 (ушир.с, 1H), 2,88 (с, 3H); ESIMS m/z 196 ([M+H]).
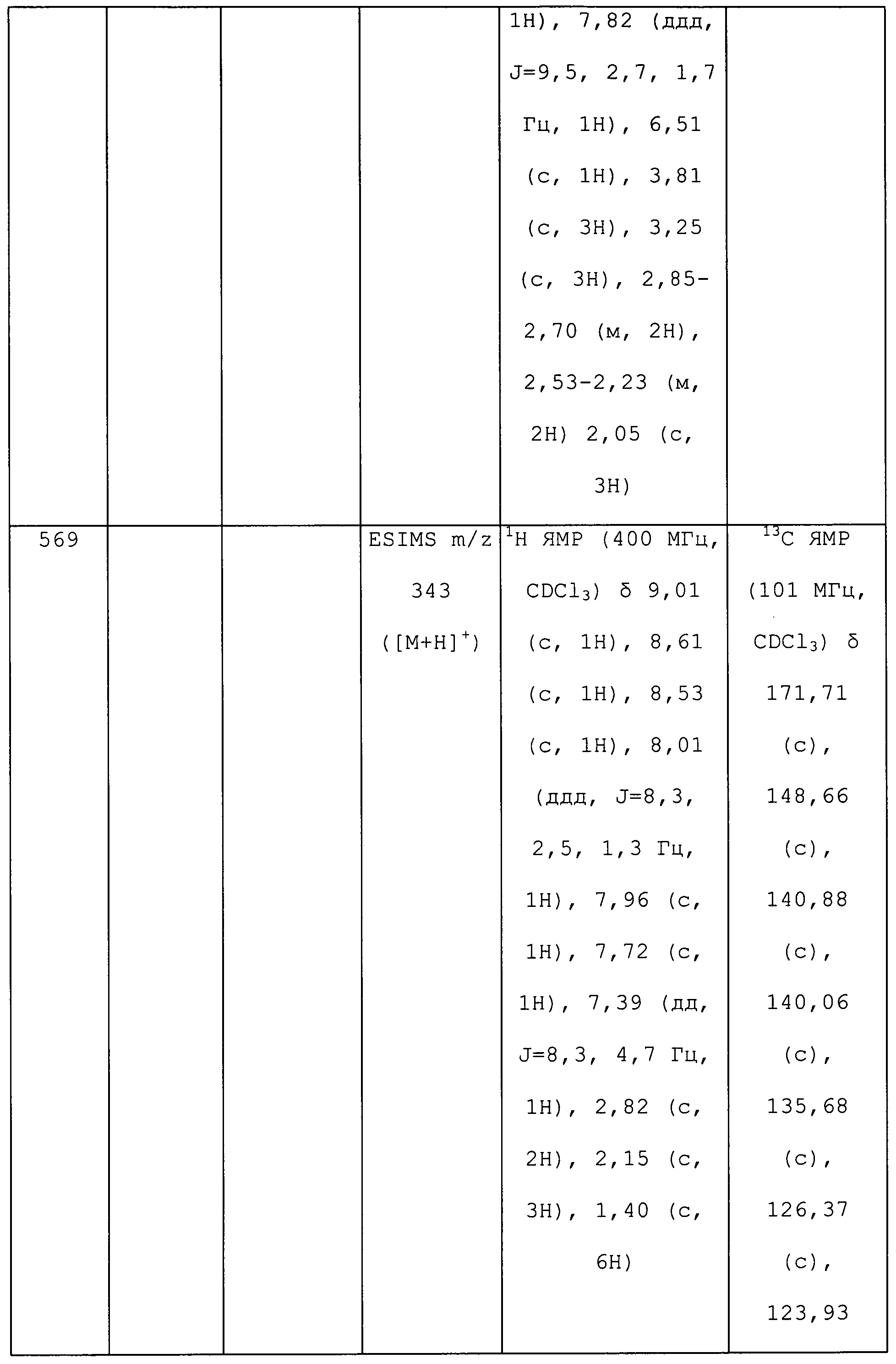
1-(5-Фтор-3-пиридил)-3-метил-N-(тридейтерометил)пиразол-4-амин получали из соединения 380 с использованием методики, описанной для способа B примера 8: т.пл. 146-148°C;1H ЯМР (400 МГц, CDCl3) δ 8,67 (с, 1H), 8,25 (д, J=2,5 Гц, 1H), 7,73 (дт, J=10,0, 2,3 Гц, 1H), 7,27 (с, 1H), 2,87 (с, 1H), 2,24 (с, 3H); ESIMS m/z 210 ([M+H]+); ИК (тонкая пленка) 1599 см-1.
3-Хлор-1-(3-пиридил)-N-(тридейтерометил)пиразол-4-амин получали из соединения 381 с использованием методики, описанной для способа B примера 8: т.пл. 104-106°C;1H ЯМР (400 МГц, CDCl3) δ 8,87 (д, J=1,9 Гц, 1H), 8,47 (д, J=4,7 Гц, 1H), 8,00-7,90 (м, 1H), 7,40-7,30 (м, 2H), 3,10 (с, 1H); ESIMS m/z 212 ([M+H]+); ИК (тонкая пленка) 1579 см-1.
3-Хлор-N-(циклопропилметил)-1-(пиридин-3-ил)-1H-пиразол-4-амин получали из соединения 361 с использованием методики, описанной для способа B примера 8: т.пл. 82-83°C;1H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,5 Гц, 1H), 8,47 (дд, J=4,7, 1,3 Гц, 1H), 7,95 (ддд, J=8,4, 2,7, 1,5 Гц, 1H), 7,38-7,32 (м, 2H), 3,22 (с, 1H), 2,90 (д, J=6,9 Гц, 2H), 1,23-1,06 (м, 1H), 0,65-0,53 (м, 2H), 0,31-0,19 (м, 2H); ESIMS m/z 249 ([M+H]+).
3-Хлор-N-пропил-1-(пиридин-3-ил)-1H-пиразол-4-амин получали из соединения 360 с использованием методики, описанной для способа B примера 8: т.пл. 92-94°C;1H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,6 Гц, 1H), 8,47 (дд, J=4,7, 1,4 Гц, 1H), 7,95 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,35 (ддд, J=8,4, 4,7, 0,6 Гц, 1H), 7,33 (с, 1H), 3,22-2,94 (м, 3H), 1,75-1,52 (м, 2H), 1,02 (т, J=7,4 Гц, 3H); ESIMS m/z 237 ([M+H]+).
Пример 9: Получение изопропил(1-пиридин-3-ил-1H-пиразол-4-ил)амина

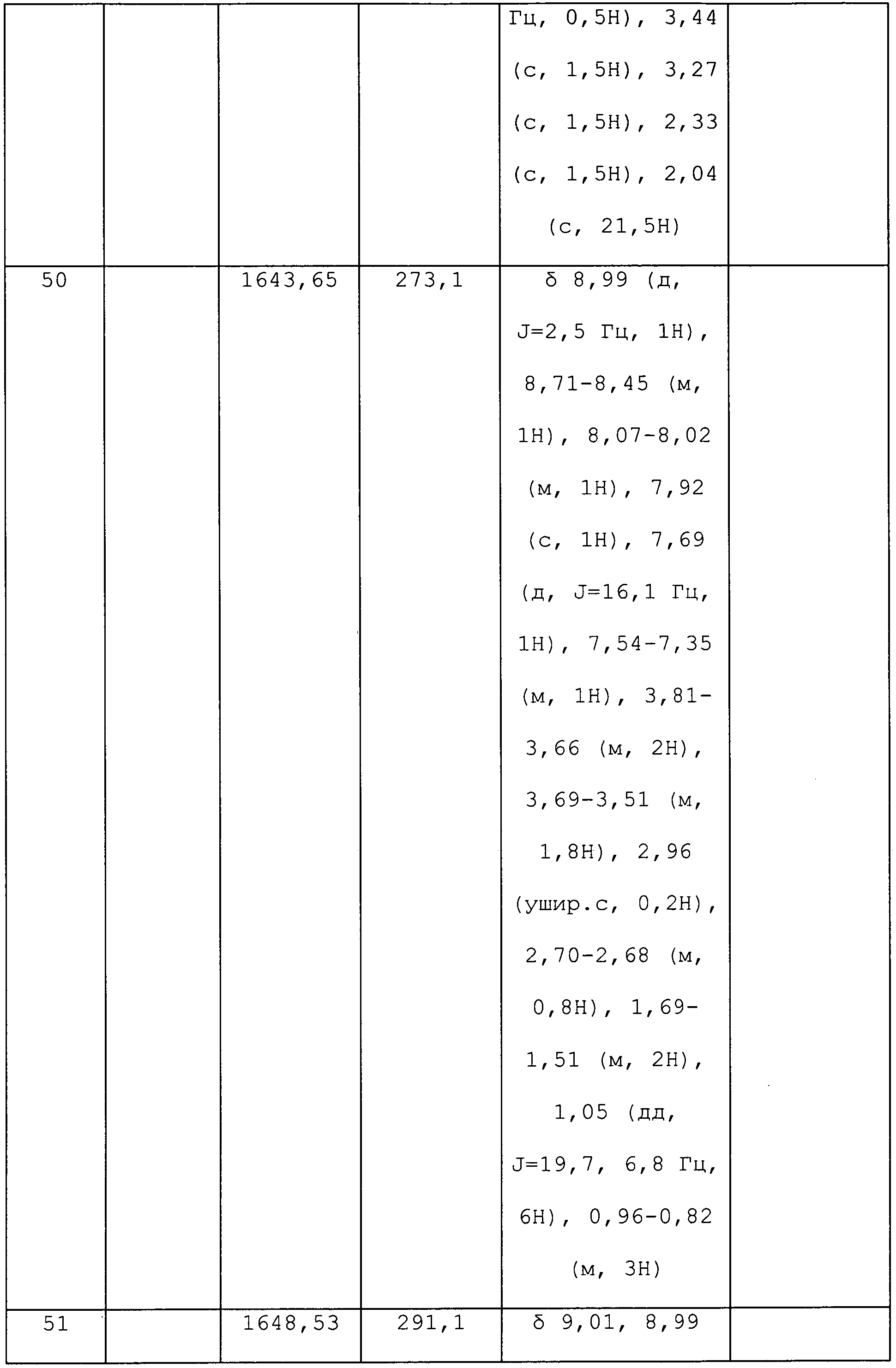
1-Пиридин-3-ил-1H-пиразол-4-иламин (0,6 г, 3,7 ммоль) растворяли в изопропилацетате (8,5 мл). К смеси добавляли ацетон (0,261 г, 4,5 ммоль), трифторуксусную кислоту (0,855 г, 7,5 ммоль) и триацетоксиборгидрид натрия (0,945 г, 4,5 ммоль). Реакционную смесь перемешивали в атмосфере азота при комнатной температуре в течение 4,5 часов, а затем гасили добавлением 10% раствора гидроксида натрия до достижения pH ~ 9. Слои разделяли, и экстрагировали водную фазу этилацетатом. Органические экстракты объединяли, сушили над сульфатом натрия и концентрировали досуха. Неочищенное вещество очищали методом хроматографии на силикагеле (элюируя градиентом 0-5% метанола в дихлорметане) с получением указанного в заголовке соединения в виде не совсем белого твердого вещества (0,35 г, 46%): т.пл. 105-107°C;1H ЯМР (300 МГц, CDCl3) δ 8,82 (д, J=2,2 Гц, 1H), 8,63 (дд, J=4,8, 1,5 Гц, 1H), 8,13 (д, J=1,8 Гц, 1H), 8,03 (д, J=2,7 Гц, 1H), 7,94-7,77 (м, 1H), 7,38 (дт, J=15,2, 7,6 Гц, 1H), 6,99 (т, 1H), 3,72 (м, 1H), 1,30 (т, J=10,0 Гц,6H), ESIMS 214 m/z (м+1).
Пример 10: Получение пропил(1-пиридин-3-ил-1H-пиразол-4-ил-амина

К 1-пиридин-3-ил-1H-пиразол-4-иламину (0,5 г, 3,12 ммоль) в дихлорметане (5 мл) добавляли пропиональдегид (0,18 г, 3,12 ммоль) и триацетоксиборгидрид натрия (0,99 г, 4,68 ммоль), и перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь переносили в дихлорметан и промывали водой и солевым раствором. Органический слой сушили (MgSO4), фильтровали и концентрировали досуха. Неочищенное вещество очищали методом хроматографии на силикагеле, элюируя 0-5% MeOH в дихлорметане, а затем 0-100% этилацетатом в гексанах, с получением указанного в заголовке соединения в виде темного масла (0,05 г, 7%):1H ЯМР (300 МГц, CDCl3) δ 8,92 (д, J=2,6 Гц, 1H), 8,48 (дд, J=4,7, 1,4 Гц, 1H), 8,00 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,47-7,40 (м, 2H), 7,37 (дд, J=8,3, 4,7 Гц, 1H), 3,04 (т, J=7,1 Гц, 3H), 1,92-1,46 (м, 2H), 1,03 (т, J=7,4 Гц, 3H).
Пример 11: Получение N-метил-N-(1-пиридин-3-ил-1H-пиразол-4-ил)изобутирамида (соединение 42)

Раствор изобутирилхлорида (0,138 г, 1,3 ммоль) в дихлорэтане (1 мл) по каплям добавляли пипеткой к ледяной суспензии метил(1-пиридин-3-ил-1H-пиразол-4-ил)амина (0,15 г, 0,86 ммоль) в дихлорэтане (5 мл), перемешивали в течение 10 минут, а затем по каплям обрабатывали раствором 4-N,N-диметиламинопиридином (0,11 г, 0,9 ммоль) в дихлорэтане (1,5 мл). Спустя 30 минут охлаждающую баню удаляли, перемешивали в атмосфере азота при комнатной температуре в течение 14 часов, разбавляли дихлорэтаном (40 мл), промывали водой (30 мл), солевым раствором (10 мл), сушили над MgSO4 и очищали методом обращенно-фазовой колоночной хроматографии с получением желтоватого клейкого вещества (0,114 г, 54%);1H ЯМР (300 МГц, CDCl3) δ 9,01-8,93 (м, 1H), 8,67 (с, 0,4H), 8,61 (д, J=4,2 Гц, 0,6H), 8,54 (д, 0,4H), 8,08-8,02 (м, 1H), 7,96 (с, 0,6H), 7,80 (с, 0,4H), 7,70 (с, 0,6H), 7,47-7,37 (м, 1H), 3,49 (с, 1,2H), 3,26 (с, 2,8H), 3,06-2,98 (м, 0,4H), 2,86-2,70 (м, 0,6H), 1,25 (д, J=6,1 Гц, 2,4H), 1,09 (д, J=6,6 Гц, 3,6H), ESEVIS m/z 245 ([M+1]).
Соединения 32-41, 43-52, 54-56, 59-61, 66, 73-75, 77-79, 82-85, 93-100, 113, 117-129, 131-134, 139-140, 142-144, 148, 160, 163, 173-175, 184-186, 197-198, 202, 208, 215-217, 252-253, 277, 282-285, 287-290, 314-316, 347, 350-351, 353-355, 365-367, 370, 388, 395, 399-403, 407, 409, 415-418, 444-449, 452-454, 462-463, 465, 467-469, 496-498, 506-507, 512, 525-527, 569, 577, 581, 591 и 592 получали из соответствующих аминов в соответствии с методиками, изложенными в примере 11.
Пример 12: Получение 4,4,4-трифтор-2-метил-N-(1-(пиридин-3-ил)-1H-пиразол-4-ил)бутанамида (соединение 65)

К раствору 1-(пиридин-3-ил)-1H-пиразол-4-амина (0,150 г, 0,93 ммоль) в дихлорэтане (1,8 мл) добавляли 4,4,4-трифтор-2-метилбутановую кислоту (0,14 г, 0,93 ммоль) и 4-N,N-диметиламинопиридин (0,23 г, 1,87 ммоль), а затем гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (0,36 г, 1,87 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали, и очищали неочищенный продукт методом хроматографии на силикагеле, элюируя 0-5% MeOH в дихлорметане, с получением белого твердого вещества (0,15 г, 55%); т.пл. 140-145°C;1H ЯМР (400 МГц, CDCl3) δ 9,00 (д, J=2,4 Гц, 1H), 8,62-8,47 (м, 2H), 8,01 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,68 (с, 1H), 7,53 (ушир.с, 1H), 7,40 (ддд, J=8,3, 4,8, 0,6 Гц, 1H), 2,92-2,61 (м, 2H), 2,32-2,05 (м, 1H), 1,38 (д, J=6,6 Гц, 3H); ESIMS m/z 300 ([M+2]).
Соединения 53, 58, 62-63, 72, 76, 80-81, 107-108, 136-138, 147, 151-159, 164-168, 176-179, 187-196, 201, 203-207, 209-214, 220, 224-249, 251, 259-275, 286, 292-296, 303-313, 323-326, 341-344, 356-359, 371, 378-379, 382, 384, 419-426, 439-443, 455, 458-461, 464, 466, 476, 486, 490-493, 505, 508, 517, 528-529, 536-537, 539-541, 544-545, 549-554, 572-577, 578, 579 и 580 получали из соответствующих аминов в соответствии с методиками, изложенными в примере 12.
Пример 13: Получение трет-бутил-1-(пиридин-3-ил)-1H-пиразол-4-илкарбамата (соединение 57)
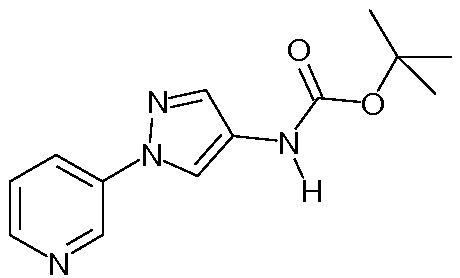
Способ A:
К раствору 1-(пиридин-3-ил)-1H-пиразол-4-амина (3 г, 18,73 ммоль) в дихлорметане (33,4 мл) добавляли триэтиламин (3,13 мл, 7,68 ммоль) и BOC-ангидрид (4,5 г, 20,60 ммоль). Полученный раствор перемешивали при комнатной температуре в течение ночи. Реакционную смесь распределяли между этилацетатом и водой. Органическую фазу сушили (MgSO4), фильтровали и концентрировали досуха. Неочищенный продукт очищали методом хроматографии на силикагеле, элюируя 0-100% этилацетатом в гексанах, с получением белого твердого вещества (2,0 г, 41%); т.пл. 108-112°C;1H ЯМР (400 МГц, CDCl3) δ 9,02 (д, J=2,2 Гц, 1H), 8,51 (т, J=8,7 Гц, 1H), 8,37 (с, 1H), 8,30 (с, 1H), 7,98 (ддд, J=8,3, 2,4, 1,3 Гц, 1H), 7,68 (с, 1H), 7,36 (дд, J=8,2, 4,8 Гц, 1H), 1,52 (с, 9H); ESIMS m/z 261 ([M+1]).
Соединения 64 и 130 получали в соответствии с методиками, изложенными для способа A примера 13.
Способ B:
К раствору 1-(пиридин-3-ил)-1H-пиразол-4-амина (0,1 г, 0,624 ммоль) и ди-трет-бутилдикарбоната (0,161 мл, 0,693 ммоль) в тетрагидрофуране (1,890 мл) и воде (0,568 мл) по каплям добавляли насыщенный водный бикарбонат натрия (0,572 мл, 0,687 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли водой и экстрагировали этилацетатом. Объединенные органические фазы концентрировали с получением трет-бутил-1-(пиридин-3-ил)-1H-пиразол-4-илкарбамата (135 мг, 0,519 ммоль, 83%), аналитические данные для которого соответствовали таковым, приведенным для способа A примера 13.
Соединения 150, 172, 223 и 317 получали в соответствии с методиками, изложенными для способа B примера 13. Соединения 172 и 317 также получали в соответствии с методиками, изложенными в примере 17. Указанные соединения, а также некоторые другие соединения, получали альтернативными способами, дополнительно иллюстрирующими некоторые варианты осуществления.
Пример 14: Получение трет-бутилметил(1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамата (соединение 67)

К раствору трет-бутил-1-(пиридин-3-ил)-1H-пиразол-4-илкарбамата (1,6 г, 6,15 ммоль) в DMF (30,7 мл) при 0°C одной порцией добавляли гидрид натрия (0,34 г, 8,61 ммоль, 60% дисперсия в минеральном масле), и перемешивали суспензию в течение 30 минут. Баню со льдом удаляли и перемешивали еще в течение 30 минут. Одной порцией добавляли йодметан (0,46 мл, 7,38 ммоль), и перемешивали в течение ночи при комнатной температуре. Добавляли воду и этилацетат, и разделяли полученную двухфазную смесь. Водный слой однократно экстрагировали этилацетатом. Объединенные органические экстракты промывали солевым раствором, сушили (MgSO4), фильтровали и концентрировали досуха. Неочищенный продукт очищали методом хроматографии на силикагеле, элюируя 0-35% этилацетатом в гексанах, с получением светло-желтого полутвердого вещества (0,85 г, 50%): ИК (KBr) 1703 см-1;1H ЯМР(400 МГц, CDCl3) δ 8,98 (с, 1H), 8,52 (д, J=3,8 Гц, 1H), 8,32 (с, 0,5H), 8,13-7,97 (м, 1H), 7,84 (с, 0,5H), 7,74 (с, 1H), 7,39 (дд, J=8,0, 4,8 Гц, 1H), 3,30 (с, 3H), 1,56 (с, 9H); ESIMS m/z 275 ([M+H]).
Соединения 68, 86-92, 105-106, 114-116, 141, 149, 161-162, 199-200, 254, 258, 291, 332, 352, 360-361, 380-381, 414, 430-431, 450, 457, 474-475, 485, 488, 510-511, 515, 523 и 590 получали из соответствующих амидов в соответствии с методиками, изложенными в примере 14.
трет-Бутилметил(3-метил-1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамат получали, как описано в примере 14:1H ЯМР (400 МГц, CDCl3) δ 8,91 (д, J=2,5 Гц, 1H), 8,51 (дд, J=4,7, 1,3 Гц, 1H), 8,00 (ддд, J=8,3, 2,4, 1,4 Гц, 1H), 7,83 (с, 1H), 7,38 (дд, J=8,3, 4,7 Гц, 1H), 3,20 (с, 3H), 2,22 (с, 3H), 1,60-1,30 (м, 9H).
Пример 15: Получение N-этил-N-(1-метил-3-(пиридин-3-ил)-1H-пиразол-5-ил)изобутирамида (соединение 23)

К раствору N-(1-метил-3-(пиридин-3-ил)-1H-пиразол-5-ил)изобутирамида (0,08 г, 0,33 ммоль) в DMF (0,66 мл) при 0°C одной порцией добавляли гидрид натрия (0,016 г, 0,39 ммоль, 60% дисперсия в минеральном масле), и перемешивали суспензию в течение 30 минут. Удаляли баню со льдом, и перемешивали еще в течение 30 минут. Одной порцией добавляли йодэтан (0,06 г, 0,39 ммоль), и перемешивали в течение ночи при комнатной температуре. Добавляли воду и этилацетат, и разделяли полученную двухфазную смесь. Водный слой однократно экстрагировали этилацетатом. Объединенные органические экстракты промывали солевым раствором, сушили (MgSO4), фильтровали и концентрировали досуха. Неочищенный продукт очищали методом хроматографии на силикагеле с получением указанного в заголовке соединения в виде прозрачного масла (27,5 мг, 30%):1H ЯМР (300 МГц, CDCl3) δ 9,00 (ушир.с, 1H), 8,57 (с, 1H), 8,09 (дд, J=7,9 Гц, 1H), 7,34 (дд, 1H), 6,48 (с, 1H), 4,00 (м, 1H), 3,76 (с, 3H), 3,36 (м, 1H), 2,33 (м, 1H), 1,17 (т, J=7,1 Гц, 3H), 1,08 (т, J=6,7 Гц, 6H); ESEVIS m/z 273 (м+H).
Соединение 22 получали в соответствии с методиками, изложенными в примере 15.
Пример 16: Получение гидробромида 5-бром-1H-пиразол-4-амина

Смесь 4-нитро-1H-пиразола (10 г, 88 ммоль) и 5% палладия на Al2O3 (1 г) в смеси этанола (150 мл) и 50% водного HBr (50 мл) перемешивали встряхиванием в аппарате Парра в атмосфере водорода (10 psi) в течение 36 ч. Смесь фильтровали, и промывали катализатор этанолом. Фильтрат концентрировали в условиях вакуума с получением белого твердого вещества. Это твердое вещество суспендировали в 10 мл этанола. После взбалтывания колбы в течение 5 мин, добавляли эфир для завершения кристаллизации. Твердое вещество фильтровали, промывали эфиром и сушили в условиях высокого вакуума с получением гидробромида 5-бром-1H-пиразол-4-амина (18,1 г, выход 84%) в виде белого твердого вещества: т.пл. 248°C (с разложением);1H ЯМР (400 МГц, DMSO-d6) δ 11,47 (с, 1H), 10,00 (с, 1H), 7,79 (с, 1H).
Пример 17: Получение трет-бутил(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамата (соединение 172)
Пример 17, стадия 1: Получение гидрохлорида 3-хлор-1H-пиразол-4-амина
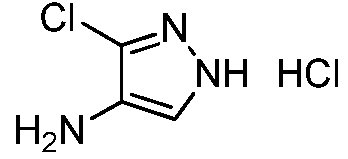
В трехгорлую круглодонную колбу емкостью 2 л, оснащенную верхнеприводной мешалкой, датчиком температуры, капельной воронкой и впуском азота добавляли этанол (600 мл) и 4-нитро-1H-пиразол (50,6 г, 447 ммоль). К этому раствору одной порцией добавляли конц. HCl (368 мл) (внимание: быстрое повышение температуры от 15°C до 39°C), и продували полученную смесь азотом в течение 5 минут. К смеси добавляли палладий на окиси алюминия (5% масс./масс.) (2,6 г, Alfa, черное твердое вещество), и перемешивали при комнатной температуре, добавляя по каплям триэтилсилан (208 г, 1789 ммоль) в течение 4 ч. Реакционную смесь, которая начинала медленно нагреваться от 35°C до 55°C в течение 2,0 ч, перемешивали всего в течение 16 ч и проводили вакуумное фильтрование через слой Celite® с получением двухфазной смеси. Смесь переносили в делительную воронку, нижний водный слой собирали и упаривали досуха на роторном испарителе (60°C, 50 мм рт. ст.) с добавлением ацетонитрила (3×350 мл). Полученное желтое твердое вещество суспендировали в ацетонитриле (150 мл) и оставляли отстаиваться в течение 2 ч при комнатной температуре, а затем на 1 ч при 0°C (в холодильнике). Твердые вещества фильтровали и промывали ацетонитрилом (100 мл) с получением указанного в заголовке соединения, гидрохлорида 3-хлор-1H-пиразол-4-амина (84 г, выход 97%, чистота 80%), в виде белого твердого вещества:т.пл. 190-193°C;1H ЯМР (400 МГц, DMSO-d6) δ 10,46-10,24 (ушир.с, 2H), 8,03 (с, 0,54H), 7,75 (с, 0,46H), 5,95 (ушир.с, 1H));13C-ЯМР (101 МГц, DMSO) δ 128,24, 125,97, 116,71.
Пример 17, стадия 2: Получение трет-бутил(3-хлор-1H-пиразол-4-ил)карбамата

В круглодонную колбу емкостью 2 л добавляли гидрохлорид 3-хлор-1H-пиразол-4-амина (100 г, 649 ммоль) и THF (500 мл). К этой смеси добавляли ди-трет-бутилдикарбонат (156 г, 714 ммоль), а затем бикарбонат натрия (120 г, 1429 ммоль) и воду (50,0 мл). Смесь перемешивали в течение 16 ч, разбавляли водой (500 мл) и этилацетатом (500 мл) и переносили в делительную воронку. Получали три слоя: нижний - белый желатиноподобный осадок, средний - светло-желтая водная фаза, верхний - красновато-коричневая органическая фаза. Фазы разделяли, собирая вместе желатиноподобный осадок и водную фазу. Водную фазу экстрагировали этилацетатом (2×200 мл), этилацетатные экстракты объединяли, промывали солевым раствором (200 мл), сушили над безводным сульфатом натрия, фильтровали и упаривали на роторном испарителе с получением красновато-коричневого вязкого масла (160 г). Вязкое масло суспендировали в гексане (1000 мл) и перемешивали при 55°C в течение 2 ч. Получали светло-коричневую суспензию. Смесь охлаждали до 0°C, твердое вещество собирали путем вакуумного фильтрования и промывали гексаном (2×10 мл). Образец сушили на воздухе до постоянной массы с получением (3-хлор-1H-пиразол-4-ил)карбамата (102,97 г, выход 72%, чистота 80%) в виде светло-коричневого твердого вещества: т.пл. 137-138°C;1H ЯМР (400 МГц, CDCl3) δ 10,69 (с, 1H), 7,91 (с, 1H), 1,52 (с, 9H).
Пример 17, стадия 3: Получение трет-бутил(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамата (соединение 172)
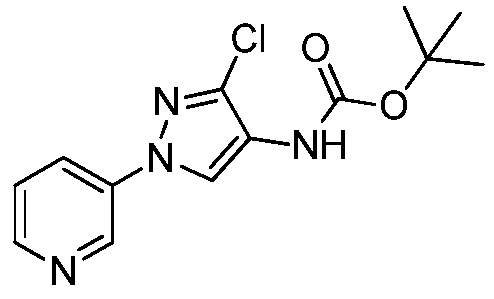
В сухую круглодонную колбу емкостью 2 л, оснащенную механической мешалкой, впуском азота, термометром и обратным холодильником, загружали 3-йодпиридин (113,0 г, 551 ммоль), (3-хлор-1H-пиразол-4-ил)карбамат (100 г, 459 ммоль), фосфат калия (измельченный пестиком в ступке) (195 г, 919 ммоль) и хлорид меди (3,09, 22,97 ммоль). Добавляли ацетонитрил (1 л), а затем N1,N2-диметилэтан-1,2-диамин, и нагревали смесь до 81°C в течение 4 часов. Смесь охлаждали до комнатной температуры и фильтровали через слой Celite®. Фильтрат переносили в колбу Эрленмейера емкостью 4 л, оснащенную механической мешалкой, и разбавляли водой до общего объема, приблизительно равного 4 л. Смесь перемешивали в течение 30 минут при комнатной температуре, и собирали полученное твердое вещество путем вакуумного фильтрования. Твердое вещество промывали водой и сушили в печи в течение нескольких суток в условиях вакуума при 40°C до постоянной массы с получением трет-бутил(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамата (117,8 г, выход 87%, чистота 80%) в виде рыжеватого твердого вещества: т.пл. 140-143°C;1H ЯМР (400 МГц, CDCl3) δ 8,96 (с, 1H), 8,53 (дд, J=4,7, 1,2 Гц, 1H), 8,36 (с, 1H), 7,98 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,38 (дд, J=8,3, 4,8 Гц, 1H), 6,37 (с, 1H), 1,54 (с, 9H); ESIMS (m/z) 338 ([M-t-Bu]+), 220 ([M-O-t-Bu]-).
Соединение 172 также получали в соответствии с методиками, изложенными в примере 13. Соединение 317 получали в соответствии с методиками, изложенными в примере 17, из трет-бутил(3-бром-1H-пиразол-4-ил)карбамата, и также в соответствии с методиками, изложенными в примере 13.
Пример 18: Получение 3-(3-метил-1H-пиразол-1-ил)пиридина и 3-(5-метил-1H-пиразол-1-ил)пиридина

К раствору 3-метил-1H-пиразола (10,99 г, 134 ммоль) в N,N-диметилформамиде (100 мл) при 0°C добавляли гидрид натрия (3,71 г, 154 ммоль, 60% дисперсия). Реакционную смесь перемешивали при 0°C в течение 2 часов. Добавляли 3-фторпиридин (10,0 г, 103 ммоль), и перемешивали реакционную смесь при 100°C в течение ночи. Реакционную смесь охлаждали до комнатной температуры, и медленно добавляли воду. Смесь экстрагировали дихлорметаном и объединенные органические фазы промывали солевым раствором, концентрировали и проводили хроматографию (элюируя 0-100% этилацетатом в гексанах) с получением 3-(3-метил-1H-пиразол-1-ил)пиридина (8,4 г, 52,77 ммоль, 51,2%) и 3-(5-метил-1H-пиразол-1-ил)пиридин (1,0 г, 6%). Аналитические данные обоих продуктов соответствовали таковым, приведенным для стадии 1 примера 6.
3-(3-Бром-1H-пиразол-1-ил)пиридин получали из 3-фторпиридина и 3-бромпиразола, полученного в соответствии с WO 2008130021, как описано в примере 18: т.пл. 89,5-92,5°C;1H ЯМР (400 МГц, CDCl3) δ 8,94 (д, J=2,4 Гц, 1H), 8,62-8,49 (м, 1H), 8,03 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,87 (д, J=2,5 Гц, 1H), 7,42 (дд, J=8,2, 4,7 Гц, 1H), 6,54 (д, J=2,5 Гц, 1H); ESIMS m/z 224 ([M]+).
Пример 19: Получение 3-хлор-1-(5-фторпиридин-3-ил)-1H-пиразол-4-амина
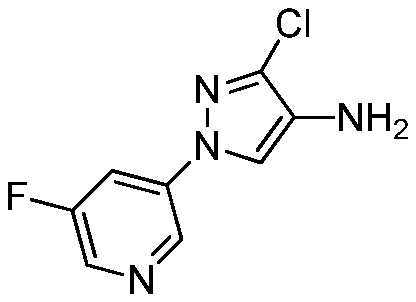
К перемешиваемому раствору гидрохлорида 5-хлор-1H-пиразол-4-амина (2 г, 12,99 ммоль) и карбоната цезия (8,89 г, 27,3 ммоль) в DMF (13 мл) добавляли 3,5-дифторпиридин (1,794 г, 15,58 ммоль), и нагревали смесь при 70°C в течение 12 ч. Смесь охлаждали до комнатной температуры и фильтровали. Твердые вещества промывали большим количеством этилацетата. Фильтраты промывали солевым раствором, сушили над безводным MgSO4 и концентрировали в условиях вакуума с получением коричневого твердого вещества. Это твердое вещество растворяли в этилацетате, полученный раствор насыщали гексанами с выпадением в осадок 3-хлор-1-(5-фторпиридин-3-ил)-1H-пиразол-4-амина (2,31 г, 10,32 ммоль, выход 79%) в виде коричневого твердого вещества:1H ЯМР (400 МГц, DMSO-d6) δ 8,89-8,82 (м, 1H), 8,45 (д, J=2,5 Гц, 1H), 8,07 (д, J=10,4 Гц, 1H), 7,94 (с, 1H), 4,51 (с, 2H); EIMS (m/z) 213 ([M+1]+).
3-Бром-1-(5-фторпиридин-3-ил)-1H-пиразол-4-амин получали из соответствующего пиразола, как описано в примере 19: т.пл. 164-165°C;1H ЯМР (400 МГц, CDCl3) δ 8,65 (д, J=1,7 Гц, 1H), 8,36 (д, J=2,5 Гц, 1H), 7,76 (дд, J=5,9, 3,6 Гц, 1H), 7,48 (с, 1H), 3,22 (с, 2H),13C ЯМР (101 МГц, CDCl3) δ 160,87, 158,30, 135,36, 135,13, 134,39, 134,35, 131,16, 123,31, 114,02, 112,77, 112,54; EIMS (m/z) 258 ([M+1]+).
Пример 20: Получение 1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-амина
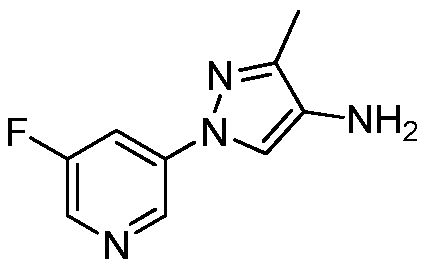
К раствору 3-фтор-5-(3-метил-4-нитро-1H-пиразол-1-ил)пиридина (3,133 г, 14,10 ммоль) в этаноле (28,2 мл) добавляли этилацетат до перехода всего исходного вещества в раствор. Раствор дегазировали, добавляли 10% палладированный уголь (0,750 г, 0,705 ммоль), и перемешивали реакционную смесь в аппарате Парра при 40 psi в течение 3 часов. Раствор фильтровали через целит с этилацетатом и концентрировали с получением 1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-амина (2,000 г, 10,41 ммоль, 73,8%) в виде коричневого твердого вещества: т.пл. 136,0-138,0°C;1H ЯМР (400 МГц, CDCl3) δ 8,67-8,59 (м, 1H), 8,27 (д, J=2,5 Гц, 1H), 7,73 (дт, J=9,9, 2,3 Гц, 1H), 7,45 (с, 1H), 3,01 (с, 2H), 2,28 (с, 3H); EIMS m/z 192.
1-(Пиридин-3-ил)-3-(трифторметил)-1H-пиразол-4-амин получали из соответствующего нитропиразола, как описано в примере 20: т.пл. 112,5-115,0°C;1H ЯМР (400 МГц, CDCl3) δ 8,89 (д, J=2,4 Гц, 1H), 8,57 (дд, J=4,7, 1,4 Гц, 1H), 8,03 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,56 (д, J=0,7 Гц, 1H), 7,41 (ддд, J=8,3, 4,8, 0,7 Гц, 1H), 3,47-3,31 (м, 2H); EIMS m/z 228.
Пример 21: Получение 3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-амина

К 3-(3-хлор-4-нитро-1H-пиразол-1-ил)пиридину (0,95 г, 4,23 ммоль) в уксусной кислоте (8,46 мл), этаноле (8,46 мл) и воде (4,23 мл) добавляли железный порошок (1,18 г, 21,15 ммоль), и перемешивали реакционную смесь при комнатной температуре в течение 30 минут. К этой смеси осторожно добавляли 2 M KOH, и экстрагировали этилацетатом. Этилацетатные слои объединяли, сушили (MgSO4), фильтровали и концентрировали досуха. Неочищенное вещество очищали методом хроматографии на силикагеле (элюируя 0-10% метанолом в дихлорметане) с получением целевого продукта в виде белого твердого вещества (0,66 г, 80%):1H ЯМР (400 МГц, CDCl3) δ 8,84 (д, J=2,6 Гц, 1H), 8,49 (дд, J=4,7, 1,4 Гц, 1H), 7,95 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,53 (с, 1H), 7,37 (ддд, J=8,4, 4,7, 0,6 Гц, 1H), 3,17 (ушир.с, 2H).
3-Метил-1-(2-метилпиридин-3-ил)-1H-пиразол-4-амин получали, как описано в примере 21:1H ЯМР (400 МГц, CDCl3) δ 8,48 (дд, J=4,8, 1,6 Гц, 1H), 7,62 (дд, J=8,0, 1,6 Гц, 1H), 7,23-7,18 (м, 2H), 2,91 (ушир.с, 2H), 2,55 (с, 3H), 2,28 (с, 3H); EIMS m/z 188.
3-Фенил-1-(пиридин-3-ил)-1H-пиразол-4-амин получали из соответствующего нитропиразола, как описано в примере 21: ИК (тонкая пленка) 3324 см-1;1H ЯМР (400 МГц, CDCl3) δ 8,94 (д, J=2,2 Гц, 1H), 8,47 (дд, J=4,7, 1,4 Гц, 1H), 8,07 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,87-7,80 (м, 2H), 7,60 (с, 1H), 7,50-7,44 (м, 2H), 7,40-7,34 (м, 2H), 3,86 (с, 2H); EIMS m/z 236.
3-Хлор-1-(5-фторпиридин-3-ил)-1H-пиразол-4-амин получали из соответствующего нитропиразола, как описано в примере 21: т.пл. 149,0-151,0°C;1H ЯМР (400 МГц, CDCl3) δ 8,65 (д, J=1,6 Гц, 1H), 8,35 (д, J=2,4 Гц, 1H), 7,75 (дт, J=9,5, 2,4 Гц, 1H), 7,51 (с, 1H), 3,21 (с, 2H); ESIMS m/z 213 ([M]+).
3-Бром-1-(пиридин-3-ил)-1H-пиразол-4-амин получали из соответствующего нитропиразола, как описано в примере 21: т.пл. 143,0-146,0°C;1H ЯМР (400 МГц, CDCl3) δ 8,85 (д, J=2,4 Гц, 1H), 8,50 (дд,J=4,7, 1,4 Гц, 1H), 7,96 (ддд,J=8,3, 2,7, 1,5 Гц, 1H), 7,49 (с, 1H), 7,37 (ддд, J=8,4, 4,7, 0,7 Гц, 1H), 3,21 (с, 2H); ESIMS m/z 241 ([M+2]+).
Пример 22: Получение трет-бутил(5-метил-1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамата (соединение 281)
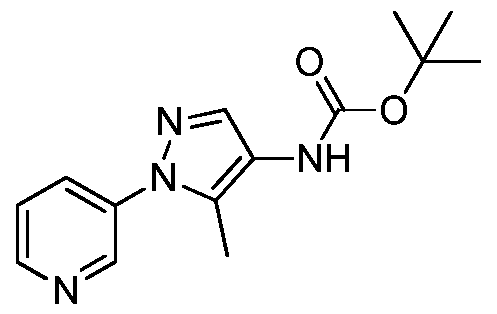
К раствору (E)-трет-бутил-1-(диметиламино)-3-оксобут-1-ен-2-илкарбамата (0,59 г, 2,58 ммоль) в этаноле (2,5 мл) добавляли дигидрохлорид 3-гидразинилпиридина, 2HCl (0,470 г, 2,58 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 16 часов. Реакционную смесь концентрировали и очищали методом хроматографии на силикагеле (элюируя 0-100% этилацетатом в гексанах) с получением указанного в заголовке соединения в виде оранжевой пены (0,235 г, 30%): ИК (тонкая пленка) 3268, 2978 и 1698 см-1;1H ЯМР (400 МГц, CDCl3) δ 8,75 (дд, J=2,5, 0,5 Гц, 1H), 8,62 (дд, J=4,8, 1,5 Гц, 1H), 7,82 (ддд, J=8,2, 2,6, 1,5 Гц, 1H), 7,78 (с, 1H), 7,43 (ддд, J=8,1, 4,8, 0,6 Гц, 1H), 6,04 (с, 1H), 2,29 (с, 3H), 1,52 (с, 9H); ESIMS m/z 275 ([M+H]+), 273 ([M-H]-).
Пример 23: Получение трет-бутил-1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-илкарбамата (соединение 111) и трет-бутил-5-этокси-1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-илкарбамата (соединение 112)

К раствору 3-фтор-5-(3-метил-4-нитро-1H-пиразол-1-ил)пиридина (3,133 г, 14,10 ммоль) в этаноле (28,2 мл) добавляли этилацетат до перехода всего исходного вещества в раствор. Раствор дегазировали, добавляли 10% палладированный уголь (0,750 г, 0,705 ммоль), и перемешивали реакционную смесь в аппарате Парра при 40 psi в течение 3 часов. Раствор фильтровали через целит с этилацетатом, и удаляли растворитель в условиях пониженного давления. Остаток растворяли в тетрагидрофуране (32,0 мл) и воде (9,61 мл). Добавляли ди-трет-бутилдикарбонат (2,52 г, 11,55 ммоль), а затем насыщенный водный бикарбонат натрия (9,54 мл, 11,45 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, разбавляли водой и экстрагировали этилацетатом. Объединенные органические фазы концентрировали, и проводили хроматографию (элюируя 0-100% этилацетатом в гексанах) с получением трет-бутил-1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-илкарбамата (1,673 г, 5,72 ммоль, 41,0%) в виде желтого твердого вещества и трет-бутил-5-этокси-1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-илкарбамата (0,250 г, 0,74 ммоль, 5,2%) в виде коричневого масла:
трет-Бутил-1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-илкарбамат (соединение 111): т.пл. 131,5-133,0°C;1H ЯМР (400 МГц, CDCl3) δ 8,75 (с, 1H), 8,32 (д, J=2,5 Гц, 1H), 8,28 (с, 1H), 7,77 (дт, J=9,7, 2,4 Гц, 1H), 6,15 (с, 1H), 2,29 (с, 3H), 1,54 (с, 9H); ESIMS m/z 293.
трет-Бутил-5-этокси-1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-илкарбамат (соединение 112): ИК (тонкая пленка) 1698 см-1;1H ЯМР (400 МГц, CDCl3) δ 8,88 (с, 1H), 8,34 (д, J=2,5 Гц, 1H), 7,83 (д, J=9,9 Гц, 1H), 5,99 (с, 1H), 4,37 (кв, J=7,0 Гц, 2H), 2,17 (с, 3H), 1,50 (с, 9H), 1,37 (т, J=7,1 Гц, 3H); ESIMS m/z 337 ([M+H]+).
Пример 24: Получение бис-трет-бутил(1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамата (соединение 595)

К раствору трет-бутил(1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамата (2,00 г, 7,68 ммоль) в безводном THF (21,95 мл) при 0°C одной порцией добавляли 60% гидрид натрия (0,33 г, 8,45 ммоль) и перемешивали при этой температуре в течение 30 минут. Затем, к этой смеси одной порцией добавляли Boc-ангидрид (1,84 г, 8,45 ммоль), и перемешивали в течение 5 минут при 0°C. Водную баню удаляли, реакционную смесь нагревали до комнатной температуры и перемешивали еще в течение 30 минут. Реакционную смесь гасили добавлением воды и экстрагировали этилацетатом. Этилацетатные слои объединяли, сушили (MgSO4), фильтровали и концентрировали досуха. Неочищенное вещество очищали методом хроматографии на силикагеле (элюируя 0-100% этилацетатом в гексанах) с получением целевого продукта в виде белого твердого вещества (2,0 г, 72%):1H ЯМР (400 МГц, CDCl3) δ 9,12-8,86 (м, 1H), 8,55 (дд, J=4,7, 1,4 Гц, 1H), 8,04 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 8,01 (д, J=0,5 Гц, 1H), 7,84-7,65 (м, 1H), 7,41 (ддд, J=8,3, 4,8, 0,7 Гц, 1H), 1,51 (с, 18H).
Пример 25: Получение 3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-амина (соединение 516)
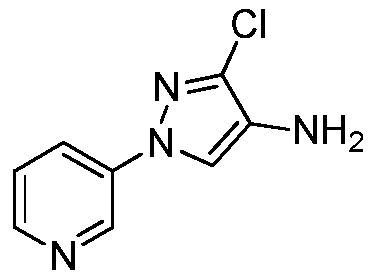
К трет-бутил(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамату (2 г, 6,79 ммоль) в дихлорметане (6,79 мл) добавляли трифторуксусную кислоту (6,79 мл), и оставляли смесь перемешиваться при комнатной температуре в течение 2 часов. Добавляли толуол (12 мл), и концентрировали реакционную смесь почти досуха. Смесь вливали в делительную воронку, содержащую насыщенный водный бикарбонат натрия, и экстрагировали дихлорметаном. Объединенные органические слои концентрировали с получением 3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-амина (0,954 г, 4,90 ммоль, 72,2%) в виде белого твердого вещества: т.пл. 137,9-139,9°C;1H ЯМР (400 МГц, CDCl3) δ 8,84 (д, J=2,4 Гц, 1H), 8,50 (дд, J=4,7, 1,4 Гц, 1H), 7,95 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,52 (с, 1H), 7,37 (ддд, J=8,4, 4,7, 0,7 Гц, 1H), 3,18 (с, 2H); ESIMS m/z 196 ([M+H]+).
Пример 26: Получение гидрохлорида N-аллил-1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-амина
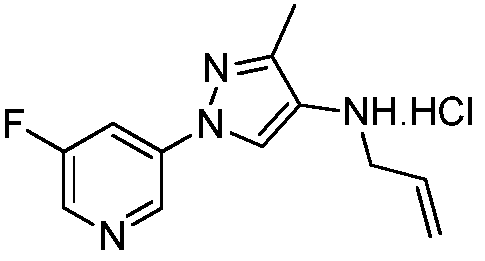
К раствору трет-бутил-аллил(1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-ил)карбамата (908 мг, 2,73 ммоль) в диоксане (5 мл) добавляли HCl (1 M в эфире) (13,65 мл, 13,65 ммоль), и перемешивали смесь при комнатной температуре в течение 48 ч. Полученное белое твердое вещество фильтровали, промывали эфиром и сушили в условиях вакуума с получением гидрохлорида N-аллил-1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-амина (688 мг, выход 94%) в виде белого твердого вещества: т.пл. 189-190°C;1H ЯМР (400 МГц, CDCl3) δ 8,79-8,68 (м, 1H), 8,32-8,26 (м, 1H), 8,23 (с, 1H), 7,98-7,86 (м, 1H), 5,86-5,68 (м, 1H), 5,28-5,17 (м, 1H), 5,17-5,03 (м, 1H), 3,59 (д, J=6,2 Гц, 2H), 2,11 (с, 3H); EIMS (m/z) 233 ([M+1]+).
Гидрохлорид N-аллил-3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-амина получали, как описано в примере 26, из трет-бутил-аллил(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамата: т.пл. 172-174°C;1H ЯМР (400 МГц, CDCl3) δ 9,20 (д, J=2,5 Гц, 1H), 8,65 (дд, J=5,3, 1,1 Гц, 1H), 8,61 (ддд, J=8,6, 2,5, 1,1 Гц, 1H), 8,24 (с, 1H), 7,93 (дд, J=8,6, 5,3 Гц, 1H), 3,66 (дт, J=5,5, 1,3 Гц, 2H); EIMS (m/z) 235 ([M+1]+).
Гидрохлорид N-аллил-3-метил-1-(пиридин-3-ил)-1H-пиразол-4-амина получали, как описано в примере 26, из трет-бутил-аллил(3-метил-1-(пиридин-3-ил)-1H-пиразол-4-ил): т.пл. 195-197°C;1H ЯМР (400 МГц, DMSO-d6) δ 9,12 (д, J=2,4 Гц, 1H), 8,58 (дд, J=5,0, 1,2 Гц, 1H), 8,48 (с, 1H), 8,43 (д, J=9,7 Гц, 1H), 7,77 (дд, J=8,4, 5,0 Гц, 1H), 6,04-5,92 (м, 1H), 5,44 (дд, J=17,2, 1,4 Гц, 1H), 5,32 (д, J=9,4 Гц, 1H), 3,81 (д, J=6,2 Гц, 2H); EIMS (m/z) 249([M+1]+).
Гидрохлорид 3-бром-1-(5-фторпиридин-3-ил)-N-метил-1H-пиразол-4-амина получали, как описано в примере 26, из трет-бутил-3-бром-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил(метил)карбамата: т.пл. 167-168°C;1H ЯМР (400 МГц, CDCl3) δ 8,93 (с, 1H), 8,50 (д, J=2,5 Гц, 1H), 8,23 (с, 1H), 8,14 (дт, J=10,4, 2,3 Гц, 1H), 2,73 (с, 3H).
Гидрохлорид 3-бром-N-метил-1-(пиридин-3-ил)-1H-пиразол-4-амина получали, как описано в примере 26, из трет-бутил(3-бром-1-(пиридин-3-ил)-1H-пиразол-4-ил)(метил)карбамата (160 мг, 0,45 ммоль) в диоксане (1 мл) с добавлением 4 M HCl: т.пл. 226-228°C;1H ЯМР (400 МГц, DMSO-d6) δ 9,26-9,06 (д, J=2,6 Гц, 1H), 8,69-8,54 (м, 1H), 8,54-8,39 (д, J=8,0 Гц, 1H), 8,33-8,14 (с, 1H), 7,90-7,72 (м, 1H), 2,82-2,67 (с, 3H); EIMS (m/z) 253 ([M+1]+), 255([M+2Н]+).
Гидрохлорид 3-бром-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина получали, как описано в примере 26, из гидрохлорида 3-бром-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина: т.пл. 216-217°C;1H ЯМР (400 МГц, DMSO-d6) δ 10,66-10,05 (с, 3H), 9,28-9,20 (д, J=2,5 Гц, 1H), 8,74-8,67 (м, 1H), 8,67-8,56 (м, 3H), 7,96-7,84 (м, 1H), 3,21-3,14 (м, 2H), 1,29-1,22 (м, 3H); EIMS (m/z) 267 ([M+1]+).
Гидрохлорид 3-хлор-N-(2-метоксиэтил)-1-(пиридин-3-ил)-1H-пиразол-4-амина получали, как описано в примере 26, из гидрохлорида трет-бутил(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(2-метоксиэтил)карбамата: т.пл. 157-158°C;1H ЯМР (400 МГц, DMSO) δ 9,22-9,14 (д, J=2,5 Гц, 1H), 8,70-8,65 (с, 1H), 8,65-8,59 (м, 1H), 8,38-8,33 (м, 1H), 8,00-7,89 (м, 1H), 3,59-3,50 (т, J=5,8 Гц, 2H), 3,32-3,27 (с, 3H), 3,22-3,14 (м, 2H); EIMS (m/z) 253([M+1]+).
Пример 27: Получение гидрохлорида 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина

В трехгорлую круглодонную круглодонную колбу емкостью 500 мл, оснащенную магнитной мешалкой, добавляли раствор трет-бутил(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)карбамата (21 г, 65,1 ммоль) в 1,4-диоксане (35 мл). Полученный бледно-желтый раствор помещали на баню со льдом и охлаждали до 1°C. Одной порцией добавляли 4 M раствор HCl в диоксане (65 мл, 260 ммоль). После перемешивания в течение 20 минут, баню со льдом удаляли, и перемешивали суспензию еще в течение 16 часов при температуре окружающей среды. Реакционную смесь разбавляли 200 мл этилового эфира, твердое вещество фильтровали и промывали эфиром и помещали в вакуумную печь при 40°C на 18 часов. Указанное в заголовке соединение выделяли в виде бледно-желтого твердого вещества (18,2 г, 95%):1H ЯМР (400 МГц, MeOD) δ 9,52 (д, J=2,5 Гц, 1H), 9,17 (с, 1H), 9,14 (ддд, J=8,7, 2,5, 1,1 Гц, 1H), 8,93 (ддд, J=5,7, 1,1, 0,6 Гц, 1H), 8,31 (ддд, J=8,7, 5,7, 0,5 Гц, 1H), 3,58 (кв, J=7,3 Гц, 2H), 1,48 (т, J=7,3 Гц, 3H); ESIMS m/z 223 ([M+H]+).
Дигидрохлорид 3-хлор-N-метил-1-(пиридин-3-ил)-1H-пиразол-4-амина получали, как описано в примере 27:1H ЯМР (400 МГц, MeOD) δ 9,28 (д, J=2,5 Гц, 1H), 8,86 (ддд, J=8,7, 2,5, 1,2 Гц, 1H), 8,79-8,75 (м, 1H), 8,62 (с, 1H), 8,19 (ддд, J=8,7, 5,6, 0,5 Гц, 1H), 3,06 (с, 3H);13C ЯМР (101 МГц, MeOD) δ 141,42, 139,58, 137,76, 134,58, 134,11, 129,33, 127,55, 122,14, 35,62); ESIMS m/z 209 ([M+H]+).
Пример 28: Получение 3-(4-нитро-3-фенил-1H-пиразол-1-ил)пиридина
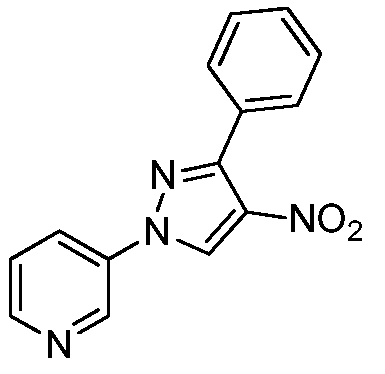
К суспензии фенилбороновой кислоты (0,546 г, 4,47 ммоль) в толуоле (6,63 мл) добавляли 3-(3-хлор-4-нитро-1H-пиразол-1-ил)пиридин (0,335 г, 1,492 ммоль), а затем этанол (3,31 мл) и 2 M водный карбонат калия (1,492 мл, 2,98 ммоль). Раствор дегазировали с использованием вакуума, а затем продували азотом (трижды). К реакционной смеси добавляли тетракис(трифенилфосфин)палладий (0,086 г, 0,075 ммоль), и нагревали колбу в течение 16 часов при 110°C в атмосфере азота. Водный слой удаляли, и концентрировали органический слой. Неочищенный продукт очищали методом хроматографии на силикагеле (элюируя 0-100% этилацетатом в гексанах) с получением 3-(4-нитро-3-фенил-1H-пиразол-1-ил)пиридина (499 мг, 1,874 ммоль, 80%) в виде желтого твердого вещества: т.пл. 144,0-146,0°C;1H ЯМР (400 МГц, CDCl3) δ 9,09 (д, J=2,3 Гц, 1H), 8,82 (с, 1H), 8,71 (дд, J=4,8, 1,4 Гц, 1H), 8,16 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,82-7,74 (м, 2H), 7,55-7,48 (м, 4H); EMS m/z 266.
Пример 29: Получение 5-бром-1-(пиридин-3-ил)-1H-пиразол-4-ил(метил)карбамата (соединение 110)

К трет-бутилметил(1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамату (0,200 г, 0,729 ммоль) в дихлорэтане (3,65 мл) добавляли 1-бромпирролидин-2,5-дион (0,260 г, 1,458 ммоль), и перемешивали реакционную смесь в течение ночи при 50°C. Реакционную смесь концентрировали, разбавляли дихлорметаном и промывали водой и насыщенным водным тиосульфатом натрия. Органическую фазу концентрировали с получением трет-бутил-5-бром-1-(пиридин-3-ил)-1H-пиразол-4-ил(метил)карбамата (256 мг, 0,725 ммоль, 99%) в виде коричневого масла: ИК (тонкая пленка) 1697 см-1;1H ЯМР (400 МГц, CDCl3) δ 8,89 (с, 1H), 8,68 (д, J=4,1 Гц, 1H), 7,93 (ддд, J=8,2, 2,5, 1,5 Гц, 1H), 7,69 (с, 1H), 7,46 (дд, J=8,1, 4,8 Гц, 1H), 3,22 (с, 3H), 1,44 (с, 9H); ESIMS m/z 352 ([M-H]-).
Пример 30: Получение бис-трет-бутил(5-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамата (соединение 109)
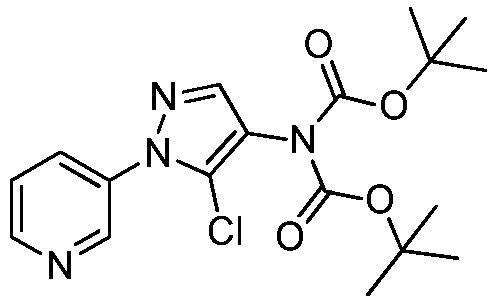
К бис-трет-бутил(1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамату (1,30 г, 3,61 ммоль) в ацетонитриле (21,22 мл) добавляли N-хлорсукцинимид (0,96 г, 7,21 ммоль) и перемешивали реакционную смесь при 45°C в течение 48 часов. Реакционную смесь охлаждали до комнатной температуры, выливали в воду и экстрагировали дихлорметаном. Дихлорметановые слои объединяли, пропускали через фазовый сепаратор для удаления воды и концентрировали досуха. Неочищенное вещество очищали методом хроматографии на силикагеле (элюируя 0-60% этилацетатом в гексанах) с получением целевого продукта в виде желтого твердого вещества (0,90 г, 63%): т.пл. 109-115°C;1H ЯМР (400 МГц, CDCl3) δ 8,90 (д, J=2,3 Гц, 1H), 8,68 (дд, J=4,8, 1,5 Гц, 1H), 7,94 (ддд, J=8,2, 2,5, 1,5 Гц, 1H), 7,70 (с, 1H), 7,47 (дтд, J=11,0, 5,6, 5,5, 4,8 Гц, 1H), 1,49 (с, 18H); ESIMS m/z 395 ([M+H]+).
трет-Бутил(5-хлор-3-метил-1-(пиридин-3-ил)-1H-пиразол-4-ил)(метил)карбамат получали из соответствующего пиразола в дихлорэтане в качестве растворителя, как описано в примере 30: ESIMS m/z 324 ([M+H]+).
Соединения 110 (см. также методику, описанную в примере 29) и 146 получали из соответствующих пиразолов с использованием N-бромсукцинимида в соответствии с методиками, изложенными в примере 30.
трет-Бутил-5-бром-3-метил-1-(пиридин-3-ил)-1H-пиразол-4-ил(метил)карбамат получали из соответствующего пиразола в дихлорэтане, как описано в примере 30:1H ЯМР (400 МГц, CDCl3) δ 8,88 (д, J=2,3 Гц, 1H), 8,69-8,60 (м, 1H), 7,96-7,86 (м, 1H), 7,48-7,39 (м, 1H), 3,18 (с, 3H), 2,26 (с, 3H), 1,60-1,36 (м, 9H); ESIMS m/z 368 ([M+H]+).
Пример 31: Получение бис-трет-бутил(5-фтор-1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамата (соединение 135)
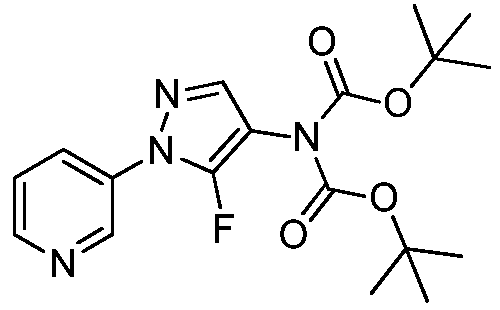
К раствору бис-трет-бутил(1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамата (0,075 г, 0,208 ммоль) в DMF (0,416 мл) и ацетонитриле (0,416 мл) добавляли Selecfluor® (0,184 г, 0,520 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение одной недели. Реакционную смесь концентрировали, добавляли насыщенный водный хлорид натрия, и смесь экстрагировали этилацетатом. Объединенные органические фазы концентрировали и подвергали хроматографии (элюируя 0-100% этилацетатом в гексанах) с получением бис-трет-бутил(5-фтор-1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамата (16 мг, 0,042 ммоль, 20,32%) в виде не совсем белого твердого вещества:1H ЯМР (400 МГц, CDCl3) δ 8,97 (т, J=2,0 Гц, 1H), 8,61 (дд, J=4,8, 1,4 Гц, 1H), 7,99 (ддт, J=8,3, 2,6, 1,3 Гц, 1H), 7,57 (д, J=2,5 Гц, 1H), 7,44 (ддд, J=8,3, 4,8, 0,6 Гц, 1H), 1,50 (с, 18H); ESIMS m/z 379 ([M+H]+).
трет-Бутил(5-фтор-3-метил-1-(пиридин-3-ил)-1H-пиразол-4-ил)(метил)карбамат получали, как описано в примере 31:1H ЯМР (400 МГц, CDCl3) δ 8,94 (с, 1H), 8,57 (д, J=4,2 Гц, 1H), 7,96 (д, J=7,7 Гц, 1H), 7,41 (дд, J=7,9, 4,7 Гц, 1H), 3,17 (с, 3H), 2,23 (с, 3H), 1,58-1,40 (м, 9H); ESEVIS m/z 307 ([M+H]+).
Пример 32: Получение N-циклопропил-3-метил-1-(пиридин-3-ил)-1H-пиразол-4-амина
Пример 32, стадия 1: Получение 3-(4-йод-3-метил-1H-пиразол-1-ил)пиридина

К смеси 3-(3-метил-1H-пиразол-1-ил)пиридина (6,7 г, 42,1 ммоль), йодной кислоты (2,96 г, 16,84 ммоль) и дийода (8,55 г, 33,7 ммоль) в уксусной кислоте (60,1 мл) добавляли концентрированную серную кислоту (3,74 мл, 21,04 ммоль). Реакционную смесь нагревали до 70°C в течение 30 минут. Реакционную смесь выливали на лед с тиосульфатом натрия и экстрагировали диэтиловым эфиром. Объединенные органические фазы промывали насыщенным водным бикарбонатом натрия. Затем, органические фазы сушили с сульфатом магния, фильтровали и концентрировали в условиях вакуума. Твердый остаток растворяли в дихлорметане, наносили на колонку с 80 г силикагеля и элюировали 0-80% ацетона в гексанах с получением 3-(4-йод-3-метил-1H-пиразол-1-ил)пиридина (11,3 г, 35,7 ммоль, 85%) в виде белого твердого вещества: т.пл. 131°C;1H ЯМР (400 МГц, CDCl3) δ 8,95-8,85 (м, 1H), 8,52 (дд, J=4,8, 1,4 Гц, 1H), 8,00-7,94 (м, 1H), 7,91 (с, 1H), 7,38 (ддд, J=8,3, 4,8, 0,7 Гц, 1H), 2,34 (с, 3H); EIMS m/z 285.
Пример 32, стадия 2: Получение N-циклопропил-3-метил-1-(пиридин-3-ил)-1H-пиразол-4-амина

К раствору 3-(4-йод-3-метил-1H-пиразол-1-ил)пиридина (2,0 г, 7,02 ммоль) в диметилсульфоксиде (7,02 мл) добавляли 1-(5,6,7,8-тетрагидрохинолин-8-ил)этанон (0,246 г, 1,403 ммоль), циклопропанамин (0,486 мл, 7,02 ммоль), карбонат цезия (6,86 г, 21,05 ммоль) и бромид меди(I) (0,101 г, 0,702 ммоль). Реакционную смесь перемешивали при 35°C в течение 2 суток. Реакционную смесь разбавляли водой и экстрагировали дихлорметаном. Объединенные органические фазы промывали солевым раствором, концентрировали и подвергали хроматографии (элюируя 0-100% этилацетатом в гексанах) с получением N-циклопропил-3-метил-1-(пиридин-3-ил)-1H-пиразол-4-амина (269 мг, 1,255 ммоль, 17,90%) в виде желтого твердого вещества: т.пл. 104,0-107,0°C;1H ЯМР (400 МГц, CDCl3) δ 8,89 (дд, J=2,7, 0,5 Гц, 1H), 8,41 (дд, J=4,7, 1,4 Гц, 1H), 7,96 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,51 (с, 1H), 7,33 (ддд, J=8,3, 4,7, 0,7 Гц, 1H), 3,42 (с, 1H), 2,53-2,42 (м, 1H), 2,22 (с, 3H), 0,72-0,65 (м, 2H), 0,60-0,53 (м, 2H); ESEVIS m/z 215 ([M+H]+).
3-Метил-N-(3-(метилтио)пропил)-1-(пиридин-3-ил)-1H-пиразол-4-амин получали, как описано в примере 32: ИК (тонкая пленка) 3298 см-1;1H ЯМР (400 МГц, CDCl3) δ 8,87 (д, J=2,3 Гц, 1H), 8,40 (дд, J=4,7, 1,4 Гц, 1H), 7,93 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,35 (с, 1H), 7,34-7,29 (м, 1H), 3,16 (т,J=6,8 Гц, 2H), 2,89 (с, 1H), 2,64 (т, J=7,0 Гц, 2H), 2,25 (с, 3H), 2,13 (с, 3H), 1,95 (p, J=6,9 Гц, 2H); ESIMS m/z 263 ([M+H]+).
3-Метил-N-(2-метил-3-(метилтио)пропил)-1-(пиридин-3-ил)-1H-пиразол-4-амин получали, как описано в примере 32: ИК (тонкая пленка) 3325 см-1;1H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,5 Гц, 1H), 8,40 (дд, J=4,7, 1,2 Гц, 1H), 7,93 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,35 (с, 1H), 7,32 (ддд, J=8,3, 4,7, 0,5 Гц, 1H), 3,12 (дд, J=11,5, 6,1 Гц, 1H), 2,94 (дд, J=11,9, 6,6 Гц, 1H), 2,62 (дд, J=12,9, 6,9 Гц, 1H), 2,52 (дд, J=12,9, 6,2 Гц, 1H), 2,26 (с, 3H), 2,14 (с, 3H), 2,12-2,02 (м, 1H), 1,11 (д, J=6,8 Гц, 3H); EIMS m/z 276.
Пример 33: Получение трет-бутил(3-циклопропил-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)карбамата (соединение 434) и трет-бутил(1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)карбамата (соединение 489)

К суспензии 2-циклопропил-4,4,5,5-тетраметил-1,3,2-диоксаборолана (1,087 г, 6,47 ммоль) в толуоле (13,69 мл) добавляли трет-бутил(3-бром-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)карбамат (1,1 г, 3,08 ммоль), а затем этанол (6,84 мл) и 2 M водный карбонат калия (3,08 мл, 6,16 ммоль). Раствор дегазировали с использованием вакуума, а затем продували азотом (трижды). К реакционной смеси добавляли тетракис(трифенилфосфин)палладий (0,178 г, 0,154 ммоль), и нагревали колбу в течение 36 часов при 100°C в атмосфере азота. Добавляли воду (5 мл), и экстрагировали смесь этилацетатом. Объединенные органические фазы концентрировали и подвергали хроматографии (элюируя 0-100% этилацетатом в гексанах) с получением трет-бутил(3-циклопропил-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)карбамата (705 мг, 2,215 ммоль, выход 71,9%) в виде желтого твердого вещества и трет-бутил(1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)карбамата (242 мг, 0,870 ммоль, выход 28,2%) в виде желтого твердого вещества.
трет-Бутил(3-циклопропил-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)карбамат: т.пл. 156,5-158,0;1H ЯМР (400 МГц, CDCl3) δ 8,73 (с, 1H), 8,30 (д, J=2,5 Гц, 1H), 8,27 (с, 1H), 7,76 (дт, J=9,8, 2,4 Гц, 1H), 6,43 (с, 1H), 1,55 (с, 9H), 1,01-0,91 (м, 4H); ESIMS m/z 319 ([M+H]+).
(1-(5-Фторпиридин-3-ил)-1H-пиразол-4-ил)карбамат: т.пл. 121,0-123,0°C;1H ЯМР(300 МГц, CDCl3) δ 8,78 (с, 1H), 8,37 (с, 1H), 8,28 (с, 1H), 7,81 (д, J=9,6 Гц, 1H), 7,59 (с, 1H), 6,44 (с, 1H), 1,53 (с, 9H), ESIMS m/z 278 ([M]+).
Соединения 340 и 404 получали, как описано в примере 33.
Пример 34: Получение трет-бутил(3-этил-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)(метил)карбамата (соединение 408)
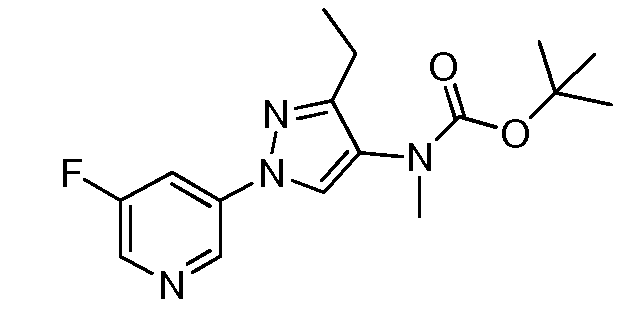
В продутый N2 раствор трет-бутил(1-(5-фторпиридин-3-ил)-3-винил-1H-пиразол-4-ил)(метил)карбамата (0,730 г, 2,293 ммоль) в метаноле (15,29 мл) добавляли 10% палладированный уголь (0,036 г, 0,339 ммоль). Реакционную смесь продували водородом, и проводили реакцию под давлением 80 фунт./кв.дюйм водорода при комнатной температуре в течение 60 часов. В реакции получали менее чем 20% преобразование. Реакционную смесь фильтровали через целит, концентрировали, повторно растворяли в этилацетате (4 мл) и переносили в автоклав. Реакционную смесь нагревали при 50°C при давлении 600 фунт./кв.дюйм водорода в течение 20 часов. Получали 50% завершение реакции. Добавляли метанол (1 мл) и 10% палладированный уголь (36 мг), и нагревали реакционную смесь при 80°C при давлении 650 фунт./кв.дюйм водорода в течение 20 часов. Реакционную смесь фильтровали через целит и концентрировали с получением трет-бутил(3-этил-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)(метил)карбамата (616 мг, 1,923 ммоль, выход 84%) в виде желтого масла: ИК (тонкая пленка) 1692 см-1;1H ЯМР (300 МГц, CDCl3) δ 8,71 (т, J=1,4 Гц, 1H), 8,35 (д, J=2,6 Гц, 1H), 7,83 (дт, J=9,5, 2,3 Гц, 2H), 3,18 (с, 3H), 2,65 (кв, J=7,5 Гц, 2H), 1,44 (с, 9H), 1,25 (т, J=7,1 Гц, 3H); EIMS m/z 320.
Пример 35: Получение N-(1-(5-фторпиридин-3-ил)-3-формил-1H-пиразол-4-ил)изобутирамида (соединение 560)
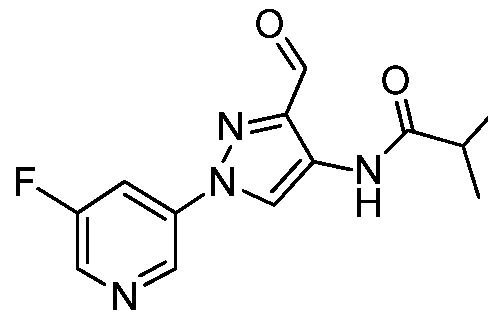
К раствору N-(1-(5-фторпиридин-3-ил)-3-винил-1H-пиразол-4-ил)изобутирамида (0,706 г, 2,57 ммоль) в тетрагидрофуране (12,87 мл) и воде (12,87 мл) добавляли тетроксид осмия (0,164 мл, 0,026 ммоль). Спустя 10 минут при комнатной температуре, порциями в течение 3 минут добавляли перйодат натрия (1,101 г, 5,15 ммоль), и перемешивали полученный раствор при комнатной температуре. Спустя 18 часов, раствор вливали в 10 мл воды и экстрагировали дихлорметаном (3×10 мл). Объединенные органические слои сушили, концентрировали и подвергали хроматографии (элюируя 0-100% этилацетатом в гексанах) с получением N-(1-(5-фторпиридин-3-ил)-3-формил-1H-пиразол-4-ил)изобутирамида (626 мг, 2,266 ммоль, 88% выход) в виде желтого твердого вещества: т.пл. 140,0-142,0°C;1H ЯМР (300 МГц, CDCl3) δ 10,12 (с, 1H), 9,14 (с, 1H), 8,90 (д, J=2,0 Гц, 1H), 8,82 (с, 1H), 8,51 (д, J=2,5 Гц, 1H), 7,92 (дт, J=9,2, 2,4 Гц, 1H), 2,65 (дт, J=13,8, 6,9 Гц, 1H), 1,31 (д, J=6,9 Гц, 6H); ESEVIS m/z 277 ([M+H]+).
Соединение 369 получали в соответствии с методиками, изложенными в примере 35.
Пример 36: Получение N-(1-(5-фторпиридин-3-ил)-3-(гидроксиметил)-1H-пиразол-4-ил)изобутирамида (соединение 435) и N-(1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)изобутирамида (соединение 436)
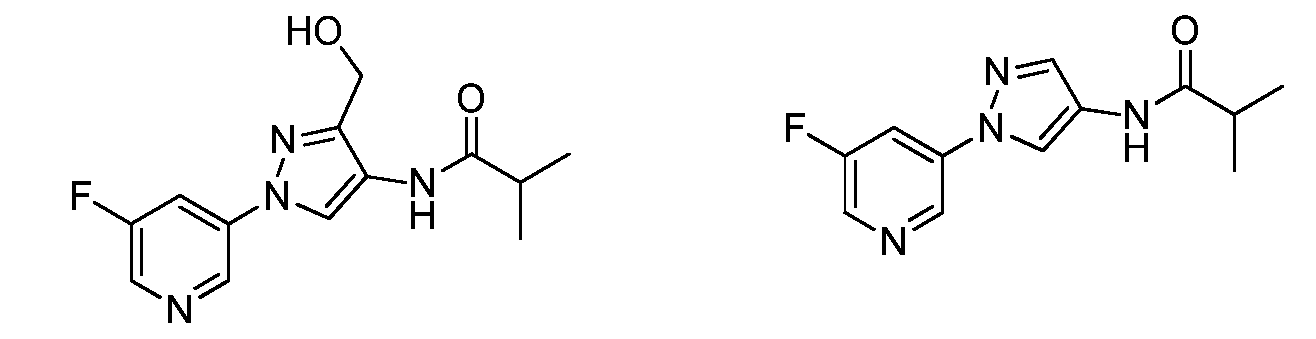
К раствору N-(1-(5-фторпиридин-3-ил)-3-формил-1H-пиразол-4-ил)изобутирамида (0,315 г, 1,140 ммоль) в метаноле (5,70 мл) при 0°C добавляли боргидрид натрия (0,086 г, 2,280 ммоль). Реакционную смесь перемешивали при 0°C в течение 2 часов и при комнатной температуре в течение 20 часов. Добавляли 0,5 M HCl, реакционную смесь нейтрализовали насыщенным водным бикарбонатом натрия, и экстрагировали смесь дихлорметаном. Органические фазы концентрировали и подвергали хроматографии (элюируя 0-100% этилацетатом в гексанах) с получением N-(1-(5-фторпиридин-3-ил)-3-(гидроксиметил)-1H-пиразол-4-ил)изобутирамида (180 мг, 0,647 ммоль, 56,7%) в виде белого твердого вещества и N-(1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)изобутирамида (9 мг, 0,036 ммоль, 3,18%) в виде белого твердого вещества.
N-(1-(5-фторпиридин-3-ил)-3-(гидроксиметил)-1H-пиразол-4-ил)изобутирамид: т.пл. 144,0-146,0°C;1H ЯМР (400 МГц, CDCl3) δ 8,74 (д, J=1,1 Гц, 1H), 8,64 (с, 1H), 8,37-8,29 (м, 2H), 7,74 (дт, J=9,5, 2,3 Гц, 1H), 4,95 (д, J=3,0 Гц, 2H), 3,21-3,06 (м, 1H), 2,63-2,48 (м, 1H), 1,26 (д, J=6,9 Гц, 6H); ESIMS m/z 279 ([M+H]+).
N-(1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)изобутирамид: ИК (тонкая пленка) 1659 см-1;1H ЯМР (400 МГц, CDCl3) δ 8,79 (д, J=1,2 Гц, 1H), 8,60 (с, 1H), 8,38 (д, J=2,5 Гц, 1H), 7,81 (дт, J=9,5, 2,3 Гц, 1H), 7,68 (с, 1H), 7,54 (с, 1H), 2,63-2,51 (м, 1H), 1,28 (д, J=6,9 Гц, 6H); ESIMS m/z 249 ([M+H]+).
Пример 37: Получение N-(3-(хлорметил)-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)изобутирамида (соединение 561)

К раствору N-(1-(5-фторпиридин-3-ил)-3-(гидроксиметил)-1H-пиразол-4-ил)изобутирамида (0,100 г, 0,359 ммоль) в дихлорметане (3,59 мл) добавляли тионилхлорид (0,157 мл, 2,151 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Добавляли насыщенный водный бикарбонат натрия, и экстрагировали смесь дихлорметаном. Объединенные органические фазы промывали солевым раствором и концентрировали с получением N-(3-(хлорметил)-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)изобутирамида (100 мг, 0,337 ммоль, выход 94%) в виде белого твердого вещества: т.пл. 172,0-177,0°C;1H ЯМР (400 МГц, CDCl3) δ 8,79 (с, 1H), 8,67 (с, 1H), 8,40 (с, 1H), 7,80 (дт, J=9,4, 2,3 Гц, 1H), 7,42 (с, 1H), 4,77 (с, 2H), 2,63 (гепт, J=6,9 Гц, 1H), 1,30 (д, J=6,9 Гц, 6H); ESIMS m/z 298 ([M+H]+).
Пример 38: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-метоксиацетамида (соединение 512) (см. также пример 11)

К раствору дигидрохлорида 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина (0,130 г, 0,502 ммоль) в DCM (2,508 мл) добавляли N-этил-N-изопропилпропан-2-амин (0,257 мл, 1,505 ммоль), а затем 2-метоксиацетилхлорид (0,109 г, 1,003 ммоль), и перемешивали реакционную смесь при температуре окружающей среды в течение 16 часов. Реакционную смесь гасили добавлением насыщенного бикарбоната натрия. Органический слой экстрагировали DCM. Органический слой сушили над сульфатом натрия, фильтровали, концентрировали и очищали методом хроматографии на силикагеле (элюируя 0-100% этилацетатом в гексанах) с получением указанного в заголовке соединения в виде бледно-желтого масла (0,12 г, 77%): ИК (тонкая пленка) 3514, 3091, 2978, 1676 см-1;1H ЯМР (400 МГц, CDCl3) δ 8,96 (д, J=2,4 Гц, 1H), 8,63 (д, J=3,8 Гц, 1H), 8,09-8,03 (м, 1H), 7,99 (с, 1H), 7,47 (дд, J=8,3, 4,8 Гц, 1H), 3,88 (с, 2H), 3,77-3,65 (м, 2H), 3,40 (с, 3H), 1,18 (т, J=7,2 Гц, 3H); ESIMS m/z 295 ([M+H]+).
Соединения 71, 478, 481, 483-484 и 543 получали в соответствии с методиками, изложенными в примере 38.
Пример 39: Получение N-(3-хлор-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-метил-3-(метилтио)бутанамида (соединение 182) и (Z)-N-(3-хлор-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-метилбут-2-енамида (соединение 183)
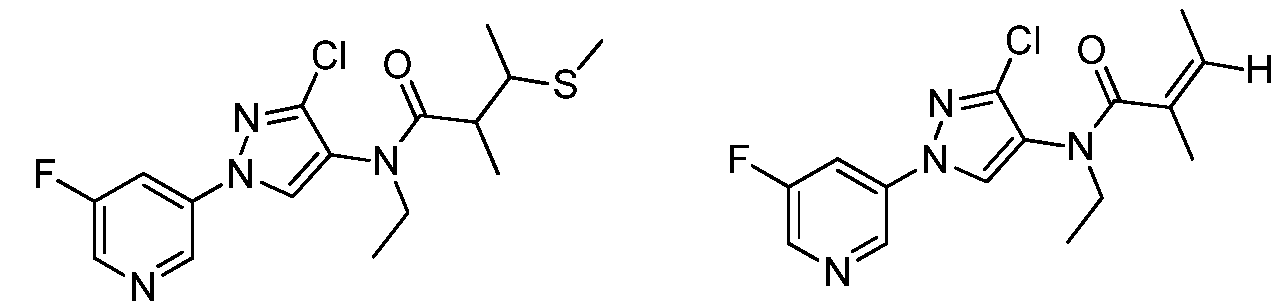
К раствору 2-метил-3-(метилтио)бутановой кислоты (0,154 г, 1,039 ммоль) в дихлорметане (1 мл) при комнатной температуре добавляли 1 каплю диметилформамида. По каплям добавляли оксалилдихлорид (0,178 мл, 2,078 ммоль), и перемешивали реакционную смесь при комнатной температуре в течение ночи. Растворитель удаляли в условиях пониженного давления. Остаток повторно растворяли в дихлорметане (1 мл), и удаляли растворитель в условиях пониженного давления. Остаток повторно растворяли в дихлорметане (0,5 мл), добавляли раствор к раствору 3-хлор-N-этил-1-(5-фторпиридин-3-ил)-1H-пиразол-4-амина (0,100 г, 0,416 ммоль) и 4-диметиламинопиридина (0,254 г, 2,078 ммоль) в дихлорметане (1,5 мл), и перемешивали при комнатной температуре в течение ночи. Растворитель удаляли в условиях пониженного давления, и очищали остаток методом хроматографии (элюируя 0-100% этилацетатом в гексанах) с получением N-(3-хлор-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-метил-3-(метилтио)бутанамида (34 мг, 0,092 ммоль, 22,06%) в виде тусклого желтого масла и (Z)-N-(3-хлор-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-метилбут-2-енамида (38 мг, 0,118 ммоль, 28,3% выход) в виде желтого масла.
N-(3-хлор-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-метил-3-(метилтио)бутанамид: ИК (тонкая пленка) 1633 см-1;1H ЯМР (400 МГц, CDCl3) δ 8,79 (д, J=2,0 Гц, 0,66H), 8,77 (д, J=2,0 Гц, 0,33H), 8,50 (д, J=2,6 Гц, 0,33H), 8,49 (д, J=2,5 Гц, 0,66H), 8,08 (с, 0,66H), 7,95 (с, 0,33H), 7,92-7,81 (м, 1H), 4,03-3,46 (м, 2H), 3,03-2,78 (м, 1H), 2,59-2,33 (м, 1H), 2,04 (с, 2H), 2,02 (с, 1H), 1,32 (д, J=6,7 Гц, 1H), 1,27 (д, J=6,2 Гц, 1H), 1,23 (д, J=6,9 Гц, 2H), 1,18-1,12 (м, 5H); ESIMS m/z 371 ([M]+).
(Z)-N-(3-хлор-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-метилбут-2-енамид:1H ЯМР (400 МГц, CDCl3) δ 8,73 (д, J=2,0 Гц, 1H), 8,46 (д, J=2,4 Гц, 1H), 7,87 (д, J=4,9 Гц, 1H), 7,84 (дт, J=9,2, 2,4 Гц, 1H), 5,93-5,76 (м, 1H), 3,73 (кв, J=7,1 Гц, 2H), 1,72 (с, 3H), 1,58 (дд, J=6,9, 0,9 Гц, 3H), 1,17 (т, J=7,1 Гц, 3H); ESIMS m/z 323 ([M]+).
Соединения 70, 180-181, 389-392, 397-398, 405-406, 427-429, 432, 456, 482, 521-522, 532-534, 555 и 589 получали из соответствующих интермедиатов и исходных веществ в соответствии с методиками, изложенными в примере 39.
Пример 40: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-метил-2-(метилтио)ацетамида (соединение 337)

К ледяному раствору 2-(метилтио)уксусной кислоты (0,092 г, 0,863 ммоль) в DCM (2 мл) добавляли N-этил-N-изопропилпропан-2-амин (0,111 г, 0,863 ммоль), а затем изобутилхлороформиат (0,099 мл, 0,767 ммоль). Продолжали перемешивание в течение 10 минут. Затем, к раствору 3-хлор-N-метил-1-(пиридин-3-ил)-1H-пиразол-4-амина (0,08 г, 0,383 ммоль) в DCM (0,66 мл) добавляли смешанный ангидрид, и перемешивали реакционную смесь при температуре окружающей среды в течение 2 часов. Реакционную смесь концентрировали и очищали методом хроматографии с использованием обращенно-фазовой C-18 колонки (элюируя 0-100% CH3CN в H2O) с получением указанного в заголовке соединения в виде бледно-желтого масла (0,075 г, 66%):1H ЯМР (400 МГц, CDCl3) δ 8,95 (д, J=2,5 Гц, 1H), 8,62 (дд, J=4,8, 1,4 Гц, 1H), 8,13 (с, 1H), 8,04 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,50-7,43 (м, 1H), 3,26 (с, 3H), 3,12 (с, 2H), 2,24 (с, 3H);13C ЯМР (101 МГц, CDCl3) δ 170,00, 148,61, 140,15, 140,03, 135,68, 126,56, 126,42, 125,33, 124,15, 37,16, 34,94, 16,22; ESIMS m/z 297 ([M+H]+).
Соединения 335, 336 и 542 получали в соответствии с методиками, изложенными в примере 40.
Пример 41: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-метил-3-оксобутанамида (соединение 499)
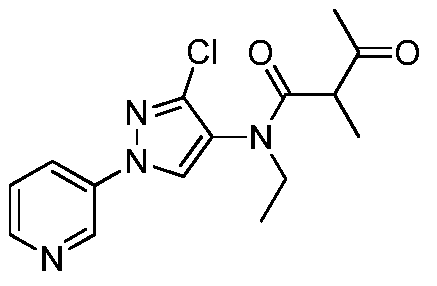
К раствору гидрохлорида 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина (259 мг, 1 ммоль) и этил-2-метил-3-оксобутаноата (144 мг, 1,000 ммоль) в диоксане (1 мл) добавляли 2,3,4,6,7,8-гексагидро-1H-пиримидо[1,2-a]пиримидин (181 мг, 1,30 ммоль), и смесь нагревали в микроволновой печи (CEM Discover) при 150°C в течение 1,5 ч с использованием внешнего ИК-датчика температуры для мониторинга температуры со дна сосуда. Методом LCMS (ELSD) обнаруживали 40% преобразование до целевого продукта. Смесь разбавляли этилацетатом (50 мл) и насыщенным водным NH4Cl (15 мл), и разделяли органическую фазу. Водную фазу экстрагировали этилацетатом (20 мл), объединенную органическую фазу промывали солевым раствором, сушили над MgSO4 и концентрировали в условиях вакуума с получением маслянистого остатка. Этот остаток очищали на силикагеле, элюируя смесью этилацетата и гексанов, с получением N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-метил-3-оксобутанамида (37 мг, выход 11%, чистота 96%) в виде бесцветного масла:1H ЯМР (400 МГц, CDCl3) δ 9,02-8,92 (дд, J=2,6, 0,8 Гц, 1H), 8,68-8,60 (дд, J=4,8, 1,5 Гц, 1H), 8,09-7,98 (м, 1H), 7,96-7,87 (с, 1H), 3,87-3,58 (д, J=3,0 Гц, 2H), 3,49-3,38 (м, 1H), 2,16-2,08 (с, 3H), 1,39-1,32 (д, J=7,0 Гц, 3H), 1,22-1,13 (м, 3H); EIMS (m/z) 321 ([M+1]+), 319 ([M-1]-).
Пример 42: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этилциклопропанкарбоксамида (соединение 538)

К раствору гидрохлорида 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина (0,10 г, 0,0,38 ммоль) в дихлорэтане (0,75 мл) добавляли циклопропанкарбоновую кислоту (0,03 г, 0,38 ммоль) и 4-N,N-диметиламинопиридин (0,14 г, 1,15 ммоль), а затем гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (0,14 г, 0,77 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали досуха, и очищали неочищенный продукт методом обращенно-фазовой колоночной хроматографии на силикагеле, элюируя 0-50% ацетонитрилом в воде, с получением белого твердого вещества (0,03 г, 25%); т.пл. 111-119°C;1H ЯМР (400 МГц, CDCl3) δ 8,96 (д, J=2,5 Гц, 1H), 8,63-8,59 (м, 1H), 8,06 (ддд, J=8,3, 2,6, 1,4 Гц, 1H), 8,01 (с, 1H), 7,46 (дд, J=8,3, 4,7 Гц, 1H), 3,73 (кв, J=7,2 Гц, 2H), 1,46 (ддд, J=12,6, 8,1, 4,7 Гц, 1H), 1,16 (т, J=7,2 Гц, 3H), 1,04 (т, J=3,7 Гц, 2H), 0,71 (дд, J=7,7, 3,0 Гц, 2H); ESEVIS m/z 291 ([M+H]).
Соединения 69, 516, 524, 546, 558-559, 582-588, 593 и 594 получали из соответствующих кислот в соответствии с методиками, изложенными в примере 42.
Пример 43: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2-метил-3-(метилтио)-N-(3-(метилтио)пропаноил)пропанамида (соединение 407)

В сосуде емкостью 10 мл к раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-(метилтио)пропанамида (0,216 г, 0,728 ммоль) в DCE (2,91 мл) добавляли 2-метил-3-(метилтио)пропаноилхлорид (0,244 г, 1,601 ммоль). Сосуд закрывали крышкой и помещали в микроволновой реактор Biotage Initiator на 3 часа при 100°C с использованием внешнего ИК-датчика температуры для мониторинга температуры с боковой стенки сосуда. Неочищенную смесь концентрировали и очищали с использованием обращенно-фазовой хроматографии на C-18 колонке (элюируя 0-100% ацетонитрилом в воде) с получением указанного в заголовке соединения в виде бледно-желтого масла (67 мг, 22%): ИК (тонкая пленка) 2916 и 1714 см-1;1H ЯМР (300 МГц, CDCl3) δ 8,96-8,92 (д, J=2,7 Гц, 1H), 8,64-8,59 (дд, J=4,9, 1,4 Гц, 1H), 8,07-7,99 (м, 2H), 7,50-7,40 (дд, J=8,4, 4,8 Гц, 1H), 3,39-3,28 (м, 1H), 3,10-2,99 (тд, J=7,2, 3,9 Гц, 2H), 2,96-2,86 (дд, J=13,2, 8,7 Гц, 1H), 2,86-2,79 (т, J=7,3 Гц, 2H), 2,58-2,48 (дд, J=13,1, 5,8 Гц, 1H), 2,14-2,12 (с, 3H), 2,09-2,06 (с, 3H), 1,30-1,26 (д, J=6,9 Гц, 3H); ESIMS m/z 413 ([M+H]+).
Соединения 383, 410, 433, 437, 451, 470, 530 и 531 получали в соответствии с методиками, изложенными в примере 43.
Пример 44: Получение N-[3-хлор-1-(3-пиридил)пиразол-4-ил]-2,2-дидейтеро-N-этил-3-метилсульфанилпропанамида (соединение 393)
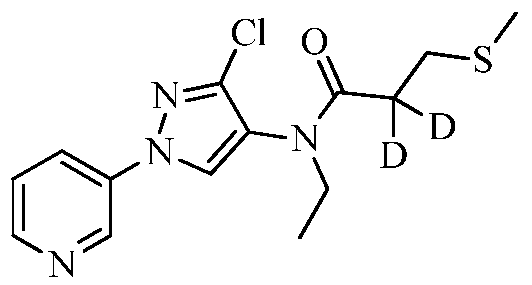
В сосуд емкостью 7 мл добавляли 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амин (111 мг, 0,5 ммоль), 2,2-дидейтеро-3-метилсульфанилпропановую кислоту (58,0 мг, 0,475 ммоль), а затем DCM (объем: 2 мл). Раствор перемешивали при 0°C. Затем, добавляли раствор DCC (0,500 мл, 0,500 ммоль, 1,0 M в DCM). Раствор оставляли медленно нагреваться до 25°C и перемешивали при 25°C в течение ночи. В процессе реакции образовывался белый осадок. Неочищенную реакционную смесь фильтровали через слой ваты и очищали методом хроматографии на силикагеле (элюируя 0-100% EtOAc в гексане) с получением N-[3-хлор-1-(3-пиридил)пиразол-4-ил]-2,2-дидейтеро-N-этил-3-метилсульфанил-пропанамида (97 мг, 0,297 ммоль, 59,4% выход) в виде бесцветного масла:1H ЯМР (400 МГц, CDCl3) δ 8,96 (д, J=2,4 Гц, 1H), 8,63 (дд, J=4,6, 0,9 Гц, 1H), 8,06 (ддд, J=8,4, 2,7, 1,4 Гц, 1H), 7,98 (с, 1H), 7,52-7,40 (м, 1H), 3,72 (кв, J=7,2 Гц, 2H), 2,78 (с, 2H), 2,06 (с, 3H), 1,17 (т, J=7,2 Гц, 3H); ESIMS m/z 327 ([M+H]+); ИК (тонкая пленка) 1652 см-1.
Соединения 394, 396 и 471-473 получали из соответствующих интермедиатов и исходных веществ в соответствии с методиками, изложенными в примере 44.
Пример 45: Получение 1-этил-3-(3-метил-1-(пиридин-3-ил)-1H-пиразол-4-ил)мочевины (соединение 145)

К раствору 3-метил-1-(пиридин-3-ил)-1H-пиразол-4-амина (0,1 г, 0,574 ммоль) в DCM (5,74 мл) добавляли этилизоцианат (0,041 г, 0,574 ммоль), и перемешивали реакционную смесь при температуре окружающей среды в течение 40 минут. Реакционную смесь превращалась из прозрачного раствора в суспензию белого твердого вещества. Реакционную смесь концентрировали и очищали методом хроматографии на силикагеле (элюируя 0-20% MeOH в DCM) с получением указанного в заголовке соединения в виде белого твердого вещества (0,135 г, 95%): т.пл. 197-200ºC;1H ЯМР (400 МГц, CDCl3) δ 8,94 (д, J=2,3 Гц, 1H), 8,48-8,37 (м, 1H), 8,32 (с, 1H), 7,94 (д, J=8,3 Гц, 1H), 7,52 (ушир.с, 1H), 7,41-7,25 (м, 1H), 5,79 (ушир.с, 1H), 3,33-3,23 (м, 2H), 2,29 (д, J=2,9 Гц, 3H), 1,16 (дд, J=8,7, 5,7 Гц, 3H); ESIMS m/z 246 ([M+H]+), 244 ([M-H]-).
Соединения 169-171, 221-222, 255-257, 278-280, 297-302, 318-322, 334, 345, 348, 375-377, 385-387 и 411-413 получали в соответствии с методиками, изложенными в примере 45.
Пример 46: Получение 3-бутил-1-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-1-этилмочевины (соединение 500)
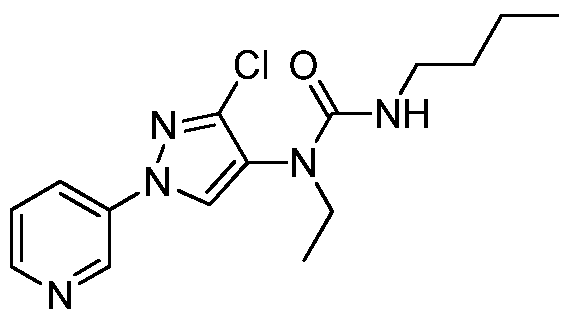
К раствору дигидрохлорида 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина (0,130 г, 0,502 ммоль) в DCE (1,25 мл) добавляли N-этил-N-изопропилпропан-2-амин (0,21 мл, 1,255 ммоль), а затем 1-изоцианатобутан (0,109 г, 1,104 ммоль), и перемешивали реакционную смесь при температуре окружающей среды в течение 16 часов. Реакционную смесь концентрировали и очищали методом хроматографии на силикагеле (элюируя 0-20% MeOH в DCM) с получением указанного в заголовке соединения в виде бежевого твердого вещества (0,131 г, 77%): ИК (тонкая пленка) 3326, 2959, 2931, 1648 см-1;1H ЯМР (400 МГц, CDCl3) δ 8,95 (с, 1H), 8,62 (д, J=4,0 Гц, 1H), 8,08-8,01 (м, 1H), 7,97 (с, 1H), 7,46 (дд, J=8,3, 4,7 Гц, 1H), 4,42-4,32 (м, 1H), 3,74-3,61 (м, 2H), 3,27-3,15 (м, 2H), 1,49-1,37 (м, 2H), 1,37-1,22 (м, 2H), 1,19-1,12 (м, 3H), 0,94-0,84 (м, 3H); ESIMS m/z 322 ([M+H]+).
Соединения 479-480, 501-504, 513, 518 и 519 получали в соответствии с примером 46.
Пример 47: Получение 1-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)имидазолидин-2-она (соединение 374)

К раствору 1-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-(2-хлорэтил)мочевины (0,1 г, 0,333 ммоль) в THF (6,66 мл) добавляли гидрид натрия (8,00 мг, 0,333 ммоль), и перемешивали реакционную смесь при температуре окружающей среды в течение 30 минут. Реакционную смесь гасили добавлением насыщенного раствора хлорида аммония, и экстрагировали продукт этилацетатом (2×). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали. Продукт представлял собой бежевое твердое вещество, которое было чистым и не требовало дополнительной очистки (63 мг, 72%): т.пл. 167-170ºC;1H ЯМР (400 МГц, CDCl3) δ 8,96 (д, J=2,2 Гц, 1H), 8,56 (дд, J=4,7, 1,4 Гц, 1H), 8,33 (с, 1H), 7,99 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,40 (ддд, J=8,3, 4,8, 0,7 Гц, 1H), 5,00 (с, 1H), 4,14-4,07 (м, 2H), 3,68-3,58 (м, 2H); ESEVIS m/z 264 ([M+H]+).
Соединение 349 получали в соответствии с методиками, изложенными в примере 47.
Пример 48: Получение S-трет-бутил(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)карбамотиоата (соединение 514)
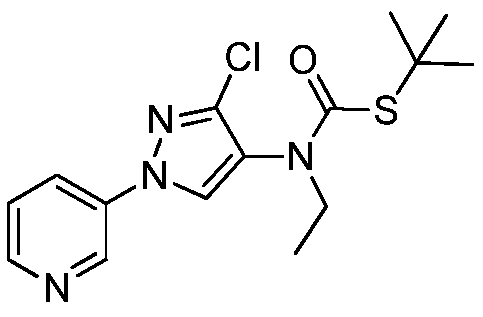
К раствору дигидрохлорида 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина (0,13 г, 0,502 ммоль) в DCM (2,508 мл) добавляли N-этил-N-изопропилпропан-2-амин (0,257 мл, 1,505 ммоль), а затем S-трет-бутилкарбонохлоридотиоат (0,153 г, 1,003 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 16 часов. Реакционную смесь гасили добавлением водного бикарбоната натрия. Органический слой экстрагировали DCM. Органический слой сушили над сульфатом натрия, фильтровали, концентрировали и очищали методом колоночной хроматографии на силикагеле (элюируя 0-100% этилацетатом в гексанах) с получением указанного в заголовке соединения в виде белого твердого вещества (132 мг, 78%): т.пл. 91-93ºC;1H ЯМР (400 МГц, CDCl3) δ 8,96 (д, J=2,5 Гц, 1H), 8,60 (дд, J=4,7, 1,4 Гц, 1H), 8,08-8,03 (м, 1H), 7,97 (с, 1H), 7,47-7,41 (м, 1H), 3,69 (кв, J=7,2 Гц, 2H), 1,47 (с, 9H), 1,21-1,13 (м, 3H); ESIMS m/z 339 ([M+H]+).
Соединения 333, 338, 339, 346, 368 и 373 получали в соответствии с методиками, изложенными в примере 48.
Пример 49: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-метил-3-(метилтио)пропантиоамида (соединение 364)

В сосуд для обработки микроволнами добавляли N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-метил-3-(метилтио)пропанамид (0,07 г, 0,22 ммоль) в дихлорэтане (1,87 мл) и реагент Лавессона (0,05 г, 0,12 ммоль). Сосуд закрывали крышкой и нагревали в микроволновом реакторе Biotage Initiator в течение 15 минут при 130°C с использованием внешнего ИК-датчика температуры для мониторинга температуры с боковой стенки сосуда. Реакционную смесь концентрировали досуха, и очищали неочищенное вещество методом хроматографии на силикагеле (элюируя 0-80% ацетонитрилом в воде) с получением целевого продукта в виде желтого масла (0,33 г, 44%): ИК (тонкая пленка) 1436 см-1;1H ЯМР (400 МГц, CDCl3) δ 8,97 (д, J=2,5 Гц, 1H), 8,77-8,52 (м, 1H), 8,11-7,89 (м, 2H), 7,60-7,38 (м, 1H), 4,62 (ушир.с, 1H), 4,02 (ушир.с, 1H), 3,21-2,46 (м, 3H), 2,01 (с, 3H), 1,35-1,15 (м, 6H); ESEVIS m/z 355 ([M+H]+).
Соединения 372, 438 и 548 получали в соответствии с методиками, изложенными в примере 49.
Пример 50: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-4,4,4-трифтор-3-(метилсульфинил)бутанамида (соединение 570)
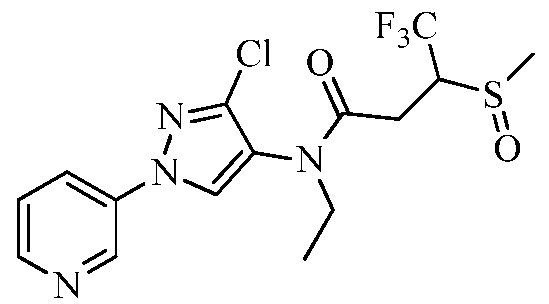
В сосуд емкостью 20 мл добавляли N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-4,4,4-трифтор-3-(метилтио)бутанамид (82 мг, 0,209 ммоль) и гексафторизопропанол (1,5 мл). Одной порцией добавляли пероксид водорода (0,054 мл, 0,626 ммоль, 35% раствор в воде), и перемешивали раствор при комнатной температуре. Спустя 3 часа, реакционную смесь гасили добавлением насыщенного раствора сульфита натрия и экстрагировали EtOAc (3×20 мл). Объединенные органические слои сушили над сульфатом натрия, концентрировали и очищали методом хроматографии (элюируя 0-10% MeOH в DCM) с получением N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-4,4,4-трифтор-3-(метилсульфинил)бутанамида (76 мг, 0,186 ммоль, выход 89%) в виде белого полутвердого вещества:1H ЯМР (400 МГц, CDCl3) δ 8,98 (д, J=2,3 Гц, 1H), 8,63 (тд, J=4,8, 2,4 Гц, 1H), 8,14-8,01 (м, 2H), 7,46 (ддд, J=8,3, 4,8, 0,7 Гц, 1H), 4,26 (дд, J=17,2, 8,4 Гц, 1H), 3,89-3,61 (м, 2H), 3,01 (дд, J=17,6, 8,2 Гц, 1H), 2,77 (с, 2H), 2,48 (дд, J=17,7, 3,3 Гц, 1H), 1,19 (т, J=7,2 Гц, 3H) (показан только один изомер); ESIMS m/z 409 ([M+H]+); ИК (тонкая пленка) 1652 см-1.
Соединение 571 получали из соответствующих интермедиатов и исходных веществ в соответствии с методиками, изложенными в примере 50.
Пример 51: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-(метилсульфинил)пропанамида (соединение 362)

К N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-(метилтио)пропанамиду (0,08 г, 0,24 ммоль) в ледяной уксусной кислоте (0,82 мл) добавляли тетрагидрат пербората натрия (0,05 г, 0,25 ммоль), и нагревали смесь при 60°C в течение 1 часа. Реакционную смесь осторожно выливали в делительную воронку с насыщенным водным NaHCO3, что приводило к выделению газа. После завершения выделения газа добавляли этилацетат, и разделяли слои. Водный слой дважды экстрагировали этилацетатом, все органические слои объединяли, сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления. Неочищенное вещество очищали методом хроматографии на силикагеле (элюируя 0-10% метанолом в дихлорметане) с получением целевого продукта в виде прозрачного масла (0,03 г, 40%): ИК (тонкая пленка) 1655 см-1;1H ЯМР (400 МГц, CDCl3) δ 8,95 (т, J=9,2 Гц, 1H), 8,63 (дд, J=4,7, 1,4 Гц, 1H), 8,20-7,86 (м, 2H), 7,59-7,33 (м, 1H), 3,73 (ддт, J=20,5, 13,4, 6,8 Гц, 2H), 3,23-3,06 (м, 1H), 2,94-2,81 (м, 1H), 2,74-2,62 (м, 2H), 2,59 (с, 3H), 1,25-1,07 (м, 3H); ESEVIS m/z 341 ([M+H]+).
Соединения 101-102, 218, 328, 330 и 494 получали из соответствующих сульфидов в соответствии с методиками, изложенными в примере 51.
Пример 52: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-(метилсульфонил)пропанамида (соединение 363)
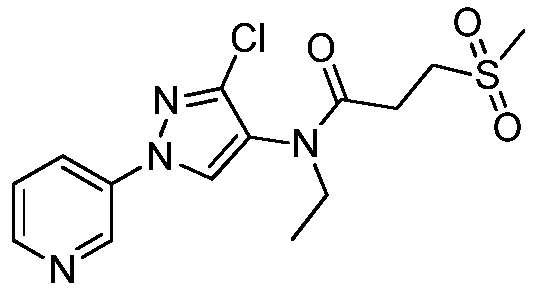
К N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-(метилтио)пропанамиду (0,08 г, 0,25 ммоль) в ледяной уксусной кислоте (0,85 мл) добавляли тетрагидрат пербората натрия (0,11 г, 0,52 ммоль), и нагревали смесь при 60°C в течение 1 часа. Реакционную смесь осторожно выливали в делительную воронку с насыщенным водным NaHCO3, что приводило к выделению газа. После завершения выделения газа добавляли этилацетат, и разделяли слои. Водный слой дважды экстрагировали этилацетатом, все органические слои объединяли, сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления. Неочищенный продукт очищали методом хроматографии на силикагеле (элюируя 0-10% метанолом в дихлорметане) с получением целевого продукта в виде прозрачного масла (0,04, 47%): (тонкая пленка) 1661 см-1;1H ЯМР (400 МГц, CDCl3) δ 8,95 (т, J=11,5 Гц, 1H), 8,64 (дд, J=4,8, 1,4 Гц, 1H), 8,17-7,96 (м, 2H), 7,59-7,39 (м, 1H), 3,73 (д, J=7,0 Гц, 2H), 3,44 (дд, J=22,5, 15,7 Гц, 2H), 2,96 (с, 3H), 2,71 (т, J=6,9 Гц, 2H), 1,18 (дд, J=8,8, 5,5 Гц, 3H); ESIMS m/z 357 ([M+H]+).
Соединения 103, 104, 219, 329, 331 и 495 получали из соответствующих сульфидов в соответствии с методиками, изложенными в примере 52.
Пример 53: Получение N-(3-метил-1-(3-фторпиридин-5-ил)-1H-пиразол-4-ил)N-этил-2-метил(3-оксидо-λ4-сульфанилиденцианамид)(метил)пропанамида (соединение 250)

К раствору N-этил-N-(1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-ил)-2-метил-3-(метилтио)пропанамида (0,30 г, 0,89 ммоль) в дихлорметане (3,57 мл) при 0°C добавляли цианамид (0,07 г, 1,78 ммоль) и йодбензолдиацетат (0,31 г, 0,98 ммоль), а затем перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали досуха, и очищали неочищенное вещество методом хроматографии на силикагеле (элюируя 10% метанолом в этилацетате) с получением целевого сульфиламина в виде светло-желтого твердого вещества (0,28 г, 85%). К раствору 70% mCPBA (0,25 г, 1,13 ммоль) в этаноле (4,19 мл) при 0°C добавляли раствор карбоната калия (0,31 г, 2,26 ммоль) в воде (4,19 мл), перемешивали в течение 20 минут, после чего одной порцией добавляли раствор сульфиламина (0,28 г, 0,75 ммоль) в этаноле (4,19 мл). Реакционную смесь перемешивали в течение 1 часа при 0°C. Избыток mCPBA гасили добавлением 10% тиосульфита натрия, и концентрировали реакционную смесь досуха. Остаток очищали методом хроматографии на силикагеле (элюируя 0-10% метанолом в дихлорметане) с получением целевого продукта в виде прозрачного масла (0,16 г, 56%): ИК (тонкая пленка) 1649 см-1;1H ЯМР (400 МГц, CDCl3) δ 8,80 (дд, J=43,8, 10,1 Гц, 1H), 8,51-8,36 (м, 1H), 8,11 (д, J=38,7 Гц, 1H), 7,96-7,77 (м, 1H), 4,32-3,92 (м, 2H), 3,49-3,11 (м, 6H), 2,32 (с, 3H), 1,27-1,05 (м, 6H); ESIMS m/z 393 ([M+H]+).
Пример 54: Получение N-этил-4,4,4-трифтор-3-метокси-N-(3-метил-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-(трифторметил)бутанамида (соединение 276)
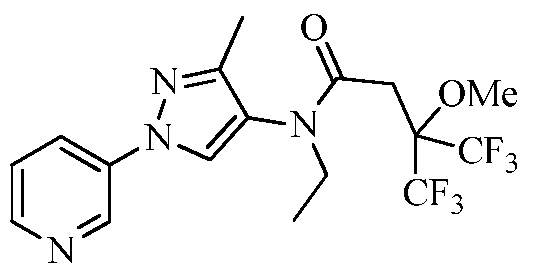
К раствору N-этил-4,4,4-трифтор-3-гидрокси-N-(3-метил-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-(трифторметил)бутанамида (184 мг, 0,448 ммоль) в DMF (3 мл) при перемешивании при 0°C добавляли гидрид натрия (26,9 мг, 0,673 ммоль). Раствор перемешивали при 0°C в течение 0,5 часа. Затем, добавляли йодметан (0,034 мл, 0,538 ммоль), удаляли баню со льдом, и перемешивали смесь при 25°C в течение ночи. Из реакционной смеси выделяли продукт реакции путем медленного добавления воды, дополнительно разбавляли 20 мл воды, а затем экстрагировали 4×20 мл EtOAc. Объединенные органические слои промывали водой, сушили над Na2SO4 и концентрировали. Методом хроматографии на силикагеле (элюируя 0-100% EtOAc в гексане) получали N-этил-4,4,4-трифтор-3-метокси-N-(3-метил-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-(трифторметил)бутанамид (52 мг, 0,123 ммоль, 27,3% выход) в виде белого твердого вещества: т.пл.=83-86°C;1H ЯМР (400 МГц, CDCl3) δ 8,94 (д, J=2,5 Гц, 1H), 8,59 (дд, J=4,7, 1,3 Гц, 1H), 8,01 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,85 (с, 1H), 7,44 (ддд, J=8,3, 4,8, 0,6 Гц, 1H), 4,00 (ушир.с, 1H), 3,73 (с, 3H), 3,39 (ушир.с, 1H), 2,86 (с, 2H), 2,26 (с, 3H), 1,16 (т, J=7,1 Гц, 3H); ESIMS m/z 425 ([M+H]+); ИК (тонкая пленка) 1664 см-1.
Соединение 327 получали из соответствующих интермедиатов и исходных веществ в соответствии с методиками, изложенными в примере 54.
Пример 55, стадия 1: Получение N-(2-((трет-бутилдиметилсилил)окси)этил)-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2-метил-3-(метилтио)пропанамида

Раствор N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2-метил-3-(метилтио)пропанамида (0,150 г, 0,483 ммоль) в N,N-диметилформамиде (2,413 мл) охлаждали до 0°C. Добавляли гидрид натрия (0,039 г, 0,965 ммоль, 60% дисперсия) и перемешивали реакционную смесь при 0°C в течение 30 минут. Добавляли (2-бромэтокси)(трет-бутил)диметилсилан (0,231 г, 0,965 ммоль), удаляли баню со льдом, и перемешивали реакционную смесь при комнатной температуре в течение 2 часов. Реакционную смесь нагревали при 65°C в течение 1,5 часов, а затем охлаждали до комнатной температуры. Добавляли солевой раствор, и экстрагировали смесь дихлорметаном. Объединенные органические фазы концентрировали и подвергали хроматографии (элюируя 0-100% этилацетатом в гексанах) с получением N-(2-((трет-бутилдиметилсилил)окси)этил)-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2-метил-3-(метилтио)пропанамида (0,120 г, 0,243 ммоль, 50,4%) в виде оранжевого масла:1H ЯМР (400 МГц, CDCl3) δ 8,88 (д, J=2,5 Гц, 1H), 8,55 (дд, J=4,7, 1,4 Гц, 1H), 8,05 (с, 1H), 7,98 (ддд, J=8,3, 2,6, 1,4 Гц, 1H), 7,41 (ддд, J=8,4, 4,8, 0,5 Гц, 1H), 4,35-3,06 (м, 4H), 2,86-2,73 (м, 1H), 2,73-2,59 (м, 1H), 2,41 (дд, J=12,8, 5,7 Гц, 1H), 1,94 (с, 3H), 1,11 (д, J=6,7 Гц, 3H), 0,80 (с, 9H), 0,00 (с, 3H), -0,01 (с, 3H); ESIMS m/z 470 ([M+H]+).
Пример 55, стадия 2: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-(2-гидроксиэтил)-2-метил-3-(метилтио)пропанамида (соединение 535)
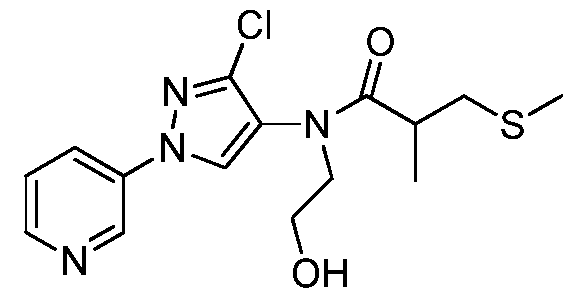
К раствору N-(2-((трет-бутилдиметилсилил)окси)этил)-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2-метил-3-(метилтио)пропанамида (0,180 г, 0,384 ммоль) в тетрагидрофуране (1,54 мл) добавляли фторид тетрабутиламмония (0,201 г, 0,767 ммоль), и перемешивали реакционную смесь при комнатной температуре в течение 2 часов. Добавляли солевой раствор, и экстрагировали смесь этилацетатом. Объединенные органические фазы концентрировали и подвергали хроматографии (элюируя 0-100% водой в ацетонитриле) с получением N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-(2-гидроксиэтил)-2-метил-3-(метилтио)пропанамида в виде белого масла (0,081 г, 0,217 ммоль, 56,5%): ИК (тонкая пленка) 3423, 1654 см-1;1H ЯМР (400 МГц, CDCl3) δ 9,00 (д, J=2,5 Гц, 1H), 8,62 (дд, J=4,7, 1,2 Гц, 1H), 8,25 (с, 1H), 8,07 (ддд, J=8,3, 2,4, 1,3 Гц, 1H), 7,47 (дд, J=8,3, 4,7 Гц, 1H), 4,47-3,70 (м, 3H), 3,65-3,09 (м, 2H), 2,91-2,68 (м, 2H), 2,48 (дд, J=12,4, 5,0 Гц, 1H), 2,01 (с, 3H), 1,18 (д, J=6,5 Гц, 3H); ESIMS m/z 356 ([M+H]+).
Пример 56: Получение 2-(N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2-метил-3-(метилтио)пропанамидо)этилацетата (соединение 547)
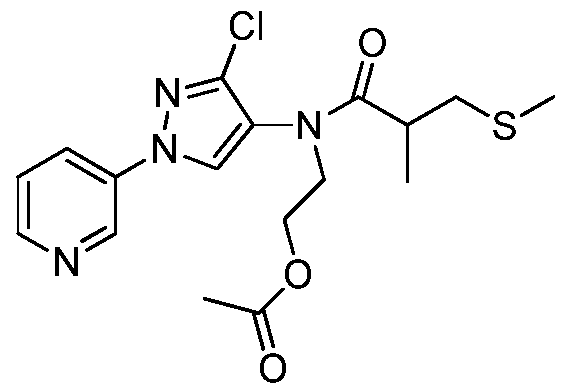
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-(2-гидроксиэтил)-2-метил-3-(метилтио)пропанамида (0,045 г, 0,127 ммоль) в дихлорметане (1,27 мл) добавляли N,N-диметилпиридин-4-амин (0,023 г, 0,190 ммоль) и триэтиламин (0,019 г, 0,190 ммоль), а затем ацетилхлорид (0,015 г, 0,190 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Добавляли воду, и экстрагировали смесь дихлорметаном. Объединенные органические фазы концентрировали и подвергали хроматографии (элюируя 0-100% этилацетатом в гексанах) с получением 2-(N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2-метил-3-(метилтио)пропанамидо)этилацетата в виде желтого масла (0,015 г, 0,034 ммоль, 26,8%): ИК (тонкая пленка) 1739, 1669 см-1;1H ЯМР (400 МГц, CDCl3) δ 8,97 (д, J=2,3 Гц, 1H), 8,64 (дд, J=4,7, 1,4 Гц, 1H), 8,15 (с, 1H), 8,04 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,47 (ддд, J=8,3, 4,8, 0,7 Гц, 1H), 4,50-3,40 (м, 4H), 2,84 (дд, J=12,7, 8,9 Гц, 1H), 2,78-2,63 (м, 1H), 2,46 (дд, J=12,7, 5,4 Гц, 1H), 2,03 (с, 3H), 2,01 (с, 3H), 1,16 (д, J=6,6 Гц, 3H); ESIMS m/z 398 ([M+H]+).
Пример 57: Получение 2,2-дидейтеро-3-метилсульфанилпропановой кислоты

В круглодонную колбу емкостью 100 мл добавляли 3-(метилтио)пропановую кислоту (3 г, 24,96 ммоль), затем D2O (23 мл) и KOD (8,53 мл, 100 ммоль) (40 масс. % раствор в D2O), и нагревали раствор до температуры возгонки в течение ночи. Методом ЯМР обнаруживали ~95% D в α-положении. Реакционную смесь охлаждали и гасили добавлением концентрированной HCl до pH <2. При подкислении в водном слое появлялся белый осадок. Реакционную смесь экстрагировали EtOAc (3×50 мл), объединенные органические слои сушили над Na2SO4, и почти досуха концентрировали в условиях вакуума. Добавляли 100 мл гексана, и снова концентрировали раствор с получением 2,2-дидейтеро-3-метилсульфанилпропановой кислоты в виде бесцветного масла (2,539 г, 20,78 ммоль, 83%): ИК (тонкая пленка) 3430, 1704 см-1;1H ЯМР (400 МГц, CDCl3) δ 2,76 (с, 2H), 2,14 (с, 3H);13C NMR (101 МГц, CDCl3) δ 178,28, 38,14-28,55(м), 28,55, 15,51; EIMS m/z 122.
2-Дейтеро-2-метил-3-метилсульфанилпропановую кислоту получали, как описано в примере 57, с получением бесцветного масла (3,62 г, 26,8 ммоль, 60,9%): ИК (тонкая пленка) 2975, 1701 см-1;1H ЯМР (400 МГц, CDCl3) δ 11,39-10,41 (ушир.с, 1H), 2,88-2,79 (д, J=13,3 Гц, 1H), 2,61 -2,53 (д, J=13,3 Гц, 1H), 2,16-2,09 (с, 3H), 1,32-1,25 (с, 3H);13C ЯМР (101 МГц, CDCl3) δ 181,74, 39,74-39,02 (м), 37,16, 16,50, 16,03; EIMS m/z 135.
Пример 58: Получение 2-метил-3-(тридейтерометилсульфанил)пропановой кислоты

В круглодонную колбу емкостью 50 мл добавляли 3-меркапто-2-метилпропановую кислоту (5 г, 41,6 ммоль), а затем MeOH (15 мл), и перемешивали раствор при 25°C. Медленно добавляли гидроксид калия (5,14 г, 92 ммоль), поскольку реакция является экзотермической. Медленно добавляли йодметан-d3 (6,63 г, 45,8 ммоль), а затем нагревали реакционную смесь при 65°C в течение ночи. Из реакционной смеси выбивали продукт путем добавления 2н HCl до тех пор, пока смесь не становилась кислой. Затем, смесь экстрагировали EtOAc (4×50 мл), объединенные органические слои сушили над Na2SO4, концентрировали и очищали методом флэш-хроматографии, элюируя 0-80% EtOAc в гексане, с получением 2-метил-3-(тридейтерометилсульфанил)пропановой кислоты (4,534 г, 33,0 ммоль, 79%) в виде бесцветного масла: ИК (тонкая пленка) 3446, 1704 см-1;1H ЯМР (400 МГц, CDCl3) δ 2,84 (дд, J=13,0, 7,1 Гц, 1H), 2,80-2,66 (м, 1H), 2,57 (дд, J=13,0, 6,6 Гц, 1H), 1,30 (д, J=7,0 Гц, 3H); EIMS m/z 137.
Пример 59: Получение 2-гидрокси-3-(метилтио)пропановой кислоты

К раствору 3-хлор-2-гидроксипропановой кислоты (2 г, 16,06 ммоль) в MeOH (120 мл) при 25°C добавляли метантиолат натрия (4,50 г, 64,2 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 8 часов, а затем охлаждали до 25°C. Осадок удаляли путем фильтрования, и упаривали фильтрат. Остаток подкисляли до pH 2 добавлением 2н HCl, экстрагировали EtOAc (3×30 мл), объединенные органические слои сушили с Na2SO4 и концентрировали с получением 2-гидрокси-3-(метилтио)пропановой кислоты в виде белого твердого вещества, (1,898 г, 13,94 ммоль, выход 87%): т.пл. 55-59°C; ИК (тонкая пленка) 2927, 1698 см-1;1H ЯМР (400 МГц, CDCl3) δ 6,33 (с, 3H), 4,48 (дд, J=6,3, 4,2 Гц, 1H), 3,02 (дд, J=14,2, 4,2 Гц, 1H), 2,90 (дд, J=14,2, 6,3 Гц, 1H), 2,20 (с, 3H); EIMS m/z 136.
Пример 60: Получение 2-метокси-3-(метилтио)пропановой кислоты
К перемешиваемому раствору гидрида натрия (0,176 г, 4,41 ммоль) в DMF (5 мл) при 25°C добавляли раствор 2-гидрокси-3-(метилтио)пропановой кислоты (0,25 г, 1,836 ммоль) в 1 мл DMF, и перемешивали в течение 10 мин. При добавлении NaH наблюдали энергичное образование пузырей. Затем, добавляли йодметан (0,126 мл, 2,020 ммоль), и перемешивали раствор при 25°C в течение ночи. Реакционную смесь гасили добавлением 2н HCl, экстрагировали EtOAc (3×10 мл), объединенные органические слои промывали водой (2×20 мл), концентрировали и очищали методом колоночной хроматографии, элюируя 0-100% EtOAc в гексане, с получением 2-метокси-3-(метилтио)пропановой кислоты (126 мг, 0,839 ммоль, выход 45,7%) в виде бесцветного масла:1H ЯМР (400 МГц, CDCl3) δ 9,10 (с, 1H), 4,03 (дд, J=6,9, 4,4 Гц, 1H), 3,51 (с, 3H), 2,98-2,93 (м, 1H), 2,86 (дд, J=14,1, 6,9 Гц, 1H), 2,21 (с, 3H); EIMS m/z 150.
Пример 61: Получение 2-(ацетилтиометил)-3,3,3-трифторпропановой кислоты

В круглодонную колбу емкостью 50 мл добавляли 2-(трифторметил)акриловую кислоту (6 г, 42,8 ммоль), а затем тиоуксусную кислоту (4,59 мл, 64,3 ммоль). Реакция была слегка экзотермической. Затем, смесь перемешивали при 25°C в течение ночи. Методом ЯМР обнаруживали некоторое количество исходного вещества (~30%). Добавляли еще один эквивалент тиоуксусной кислоты, смесь нагревали при 95°C в течение 1 часа, а затем оставляли охлаждаться до комнатной температуры. Смесь очищали методом вакуумной перегонки при 2,1-2,5 мм рт. ст.; при этом фракция, перегоняемая при 80-85°C, главным образом представляла собой тиоуксусную кислоту, фракция, перегоняемая при 100-110°C, представляла собой чистый продукт с неполярными примесями (согласно методу TLC). Смесь снова очищали методом флэш-хроматографии (элюируя 0-20% MeOH в DCM) с получением 2-(ацетилтиометил)-3,3,3-трифторпропановой кислоты (7,78 г, 36,0 ммоль, выход 84%) в виде бесцветного масла, которое отверждалось в условиях высокого вакуума с получением белого твердого вещества: т.пл. 28-30°C;1H ЯМР (400 МГц, CDCl3) δ 7,52 (ушир.с, 1H), 3,44 (дт, J=7,5, 3,5 Гц, 2H), 3,20 (дд, J=14,9, 11,1 Гц, 1H), 2,38 (с, 3H);13C ЯМР (101 МГц, CDCl3) δ 194,79, 171,14, 123,44 (кв, J=281,6 Гц), 50,47 (кв, J=27,9 Гц), 30,44, 24,69 (кв, J=2,6 Гц);19F ЯМР (376 МГц, CDCl3) δ -67,82.
Пример 62: Получение 3,3,3-трифтор-2-(метилтиометил)пропановой кислоты
К раствору 2-(ацетилтиометил)-3,3,3-трифторпропановой кислоты (649 мг, 3 ммоль) в MeOH (5 мл), перемешиваемому при 25°C, четырьмя порциями в течение 5 минут добавляли гранулы гидроксида калия (421 мг, 7,50 ммоль). Реакция была экзотермической. Затем, однократно добавляли MeI, реакционную смесь нагревали при 65°C в течение 18 часов. Затем, реакционную смесь охлаждали и гасили добавлением 2н HCl до получения кислой смеси, и экстрагировали водный слой хлороформом (4×20 мл). Объединенный органический слой сушили, концентрировали в условиях вакуума и очищали методом флэш-хроматографии (элюируя 0-20% MeOH в DCM) с получением 3,3,3-трифтор-2-(метилтиометил)пропановой кислоты (410 мг, 2,179 ммоль, выход 72,6%) в виде светло-желтого масла:1H ЯМР (400 МГц, CDCl3) δ 10,95 (с, 1H), 3,49-3,37 (м, 1H), 3,02 (дд, J=13,8, 10,8 Гц, 1H), 2,90 (дд, J=13,8, 4,0 Гц, 1H), 2,18 (с, 3H);13C ЯМР (101 МГц, CDCl3) δ 172,04 (кв, J=2,8 Гц), 123,55 (кв, J=281,2 Гц), 50,89 (кв, J=27,5 Гц), 29,62 (кв, J=2,3 Гц), 15,85;19F ЯМР (376 МГц, CDCl3) δ -67,98.
Пример 63: Получение 3-(метилтио)пентановой кислоты

К раствору (E)-пент-2-еновой кислоты (2,002 г, 20 ммоль) в 30% растворе KOH (полученном из гидроксида калия (3,87 г, 69 ммоль) и воды (10 мл)) при энергичном перемешивании добавляли S,S-диметилкарбонодитиоат (1,467 г, 12,00 ммоль). Реакционную смесь медленно нагревали до 90°C в течение 20-30 мин. Нагревание продолжали в течение 3 часов, после чего реакционную смесь охлаждали до 25°C и медленно гасили добавлением HCl. Затем смесь экстрагировали DCM (3×30 мл), объединенный органический слой сушили и концентрировали с получением 3-(метилтио)пентановой кислоты (2,7 г, 18,22 ммоль, выход 91%) в виде светло-оранжевого масла: ИК (тонкая пленка) 2975, 1701 см-1;1H ЯМР (400 МГц, CDCl3) δ 2,92 (квд, J=7,3, 5,6 Гц, 1H), 2,63 (д, J=7,2 Гц, 2H), 2,08 (с, 3H), 1,75-1,51 (м, 2H), 1,03 (т, J=7,4 Гц, 3H);13C ЯМР (101 МГц, CDCl3) δ 178,14, 43,95, 39,78, 27,04, 12,95, 11,29; EIMS m/z 148.
4-Метил-3-(метилтио)пентановую кислоту получали, как описано в примере 63, и выделяли в виде бесцветного масла: ИК (тонкая пленка) 2960, 1704 см-1;1H ЯМР (400 МГц, CDCl3) δ 2,88 (ддд, J=9,1, 5,4, 4,7 Гц, 1H), 2,68 (дд, J=16,0, 5,5 Гц, 1H), 2,55 (дд, J=16,0, 9,1 Гц, 1H), 2,13 (с, 3H), 2,01-1,90 (м, 1H), 1,03 (д, J=6,8 Гц, 3H), 0,99 (д, J=6,8 Гц, 3H); EIMS m/z 162.
Пример 64: Получение этил-1-(гидроксиметил)циклопропанкарбоксилата

К перемешиваемому раствору диэтилциклопропан-1,1'-дикарбоксилата (6 г, 32,20 ммоль) в тетрагидрофуране (129 мл) при 23°C добавляли 1 M раствор три-трет-бутоксиалюмогидрида лития в тетрагидрофуране (70,90 мл, 70,90 ммоль). Полученный раствор нагревали до 65°C и перемешивали в течение 24 ч. Охлажденную реакционную смесь разбавляли 10% раствором бисульфата натрия (275 мл) и экстрагировали этилацетатом. Объединенные органические слои сушили (MgSO4), фильтровали и концентрировали досуха с получением целевого продукта в виде бледно-желтого масла (4,60, 91%):1H ЯМР (300 МГц, CDCl3) δ 4,16 (кв, J=7 Гц, 2H), 3,62 (с, 2H), 2,60 (ушир.с, 1H), 1,22-1,30 (м, 5H), 0,87 (дд, J=7, 4 Гц, 2H).
Пример 65: Получение этил-1-((метилсульфонилокси)метил)циклопропанкарбоксилата

К перемешиваемому раствору 1-(гидроксиметил)циклопропанкарбоксилата (4,80 г, 33,30 ммоль) в дихлорметане (83 мл) при 23°C последовательно добавляли триэтиламин (5,57 мл, 40,00 ммоль) и метансульфонилхлорид (2,85 мл, 36,60 ммоль). Полученный ярко-желтый раствор перемешивали при 23°C в течение 20 ч. Реакционную смесь разбавляли водой и экстрагировали дихлорметаном. Объединенные органические слои сушили (MgSO4), фильтровали и концентрировали досуха с получением целевого продукта в виде коричневого масла (6,92 г, 94%):1H ЯМР (300 МГц, CDCl3) δ 4,33 (с, 2H), 4,16 (кв, J=7 Гц, 2H), 3,08 (с, 3H), 1,43 (дд, J=7, 4 Гц, 2H), 1,26 (т,J=7 Гц, 3H), 1,04 (дд, J=7, 4 Гц, 2H).
Пример 66: Получение этил-1-(метилтиометил)циклопропанкарбоксилата

К перемешиваемому раствору этил-1-((метилсульфонилокси)метил)циклопропанкарбоксилата (6,92 г, 31,10 ммоль) в N,N-диметилформамиде (62,30 мл) при 23°C добавляли метантиолат натрия (4,36 г, 62,30 ммоль). Полученную коричневую суспензию перемешивали при 23°C в течение 18 ч. Реакционную смесь разбавляли водой и экстрагировали диэтиловым эфиром. Объединенные органические слои сушили (MgSO4), фильтровали и концентрировали на роторном испарителе с получением указанного в заголовке соединения в виде коричневого масла (5,43 г, 100%):1H ЯМР (300 МГц, CDCl3) δ 4,14 (кв, J=7 Гц, 2H), 2,83 (с, 2H), 2,16 (с, 3H), 1,31 (дд, J=7, 4 Гц, 2H), 1,25 (т, J=7 Гц, 3H), 0,89 (дд, J=7,4 Гц, 2H).
Пример 67: Получение 1-(метилтиометил)циклопропанкарбоновой кислоты

К перемешиваемому раствору этил-1-(метилтиометил)циклопропанкарбоксилата (5,43 г, 31,20 ммоль) в абсолютном этаноле (62,30 мл) при 23°C добавляли 50% раствор гидроксида натрия (12,63 мл, 243 ммоль). Полученный раствор перемешивали при 23°C в течение 20 ч. Реакционную смесь разбавляли 0,5 M раствором гидроксида натрия и промывали дихлорметаном. Водный слой подкисляли до pH≈1 добавлением концентрированной хлористоводородной кислоты и экстрагировали дихлорметаном. Объединенные органические слои сушили (Na2SO4), фильтровали и концентрировали досуха с получением целевого продукта в виде светло-коричневого масла (2,10 г, 46%):1H ЯМР (300 МГц, CDCl3) δ 2,82 (с, 2H), 2,17 (с, 3H), 1,41 (дд, J=7, 4 Гц, 2H), 0,99 (дд, J=7,4 Гц, 2H).
Пример 68: Получение 2,2-диметил-3-(метилтио)пропановой кислоты
2,2-Диметил-3-(метилтио)пропановая кислота может быть получена, как представлено в литературе (см. Musker, W. K.; et al. J. Org. Chem. 1996, 51, 1026-1029). К перемешиваемому раствору 3-хлор-2,2-диметилпропановой кислоты (1,0 г, 7,2 ммоль, 1,0 эквив.) в N,N-диметилформамиде (3,7 мл) при 0°C добавляли метантиолат натрия (1,0 г, 14 ммоль, 2,0 эквив.). Полученную коричневую суспензию оставляли нагреваться до 23°C и перемешивали в течение 24 ч. Реакционную смесь разбавляли насыщенным раствором бикарбоната натрия (300 мл) и промывали диэтиловым эфиром (3×75 мл). Водный слой подкисляли до pH≈1 добавлением концентрированной хлористоводородной кислоты и экстрагировали диэтиловым эфиром (3×75 мл). Объединенные органические слои сушили (сульфат натрия), подвергали гравитационному фильтрованию и концентрировали с получением бесцветного масла (1,2 г, выход неочищенного вещества 99%).1H ЯМР (300 МГц, CDCl3) δ 2,76 (с, 2H), 2,16 (с, 3H), 1,30 (с, 6H).
Пример 69: Получение 4,4,4-трифтор-3-(метилтио)бутановой кислоты

В круглодонную колбу емкостью 100 мл добавляли (E)-4,4,4-трифторбут-2-еновую кислоту (8 г, 57,1 ммоль) и метанол (24 мл), раствор перемешивали на водяной бане, а затем тремя порциями добавляли метантиолат натрия (10,01 г, 143 ммоль). Наблюдали энергичное образование пузырей, перемешивали смесь при 25°C в течение ночи, и методом ЯМР более не обнаруживали исходное вещество. К реакционной смеси добавляли 2н HCl до получения кислой смеси. Смесь экстрагировали хлороформом (5×50 мл), объединенный органический слой сушили над Na2SO4, концентрировали в условиях вакуума и затем очищали в условиях высокого вакуума до отсутствия потери веса с получением 4,4,4-трифтор-3-(метилтио)бутановой кислоты (10,68 г, 56,8 ммоль, выход 99%) в виде бесцветного масла:1H ЯМР (400 МГц, CDCl3) δ 10,88 (с, 1H), 3,53 (дквд, J=10,5, 8,3, 4,0 Гц, 1H), 2,96 (дд, J=16,9, 4,0 Гц, 1H), 2,65 (дд, J=16,9, 10,4 Гц, 1H), 2,29 (с, 3H);13C ЯМР (101 МГц, CDCl3) δ 175,78 (с), 126,61 (кв, JC-F=278,8 Гц), 44,99 (кв, JC-F=30,3 Гц), 34,12 (д, JC-F=1,7 Гц), 15,95 (с); EIMS m/z 162.
Пример 70: Получение 3-метил-3-метилсульфанилмасляной кислоты
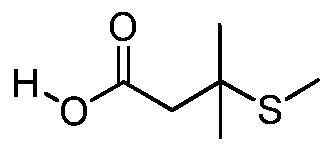
3-Метил-3-метилсульфанилмасляную кислоту получали с использованием методик, раскрытых в J. Chem Soc Perkin 1, 1992, 10, 1215-21).
Пример 71: Получение 3-метилсульфанилмасляной кислоты
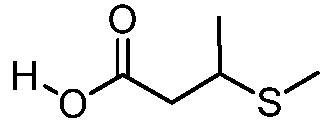
3-Метилсульфанилмасляную кислоту получали с использованием методик, раскрытых в Synthetic Comm., 1985, 15(7), 623-32.
Пример 72: Получение тетрагидротиофен-3-карбоновой кислоты

Тетрагидротиофен-3-карбоновую кислоту получали с использованием методик, раскрытых в Heterocycles, 2007, 74, 397-409.
Пример 73: Получение 2-метил-3-метилсульфанилмасляной кислоты
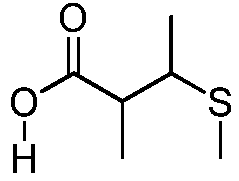
2-Метил-3-метилсульфанилмасляную кислоту получали, как описано в J. Chem Soc Perkin 1, 1992, 10, 1215-21.
Пример 74: Получение (1S,2S)-2-(метилтио)циклопропанкарбоновой кислоты

(1S,2S)-2-(метилтио)циклопропанкарбоновую кислоту получали с использованием методик, раскрытых в Synthetic Comm., 2003, 33(5); 801-807.
Пример 75: Получение 2-(2-(метилтио)этокси)пропановой кислоты
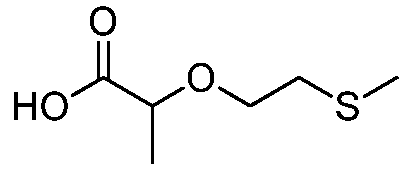
2-(2-(Метилтио)этокси)пропановую кислоту получали, как описано в WO 2007/064316 A1.
Пример 76: Получение 2-((тетрагидрофуран-3-ил)окси)пропановой кислоты
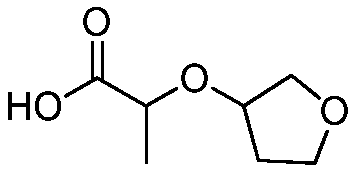
2-((Тетрагидрофуран-3-ил)окси)пропановую кислоту получали, как описано в WO 2007/064316 A1.
Пример 77: Биотестирование на тле персиковой зеленой («GPA») (Myzus persicae) (MYZUPE)
GPA является наиболее серьезным тлевым вредителем персиковых деревьев, вызывающим снижение роста, увядание листьев и отмирание различных тканей. Она также опасна, поскольку действует как вектор для переноса вирусов растений, таких как Y-вирус картофеля и вирус скручивания листьев картофеля, членам семейства пасленовых/картофельных Solanaceae, а также различных вирусов мозаики многим другим продовольственным культурам. Наряду с другими растениями, GPA нападает на такие растения, как брокколи, репейник, капуста, морковь, цветная капуста, дайкон, баклажан, овощная фасоль, латук, макадамия, папайя, перцы, бататы, томаты, кресс водяной и цукини. GPA также нападает на многие декоративные культуры, такие как гвоздика, хризантема, цветковая белокочанная капуста, пуансеттия и розы. У GPA выработалась устойчивость ко многим пестицидам.
Некоторые молекулы, раскрытые в настоящем документе, тестировали против GPA с использованием методик, описанных в следующем примере. В представлении результатов использовали «Таблицу 3: Оценочная таблица GPA (MYZUPE) и гусеницы белокрылки бататовой (BEMITA)» (см. раздел «Таблицы»).
В качестве экспериментального субстрата использовали выращиваемые в 3-дюймовых горшках проростки капусты с 2-3 небольшими (3-5 см) настоящими листьями. Проростки заражали 20-50 GPA (бескрылой взрослой и личиночной стадиями) за один день до применения химических соединений. Для каждой обработки использовали четыре горшка с отдельными проростками. Тестируемые соединения (2 мг) растворяли в 2 мл ацетона/метанола (1/1), получая исходные растворы, содержащие 1000 м.д. тестируемого соединения. Исходные растворы разбавляли в 5 раз 0,025% Tween 20 в H2O с получением раствора, содержащего 200 м.д. тестируемого соединения. Использовали ручной опрыскиватель аспирационного типа для распыления раствора на обеих сторонах листьев капусты до стекания. Контрольные растения (контроль с растворителем) опрыскивали только растворителем, содержащим 20 об.% ацетона/метанола (1/1). До выставления оценки обработанные растения содержали в помещении для временного содержания в течение трех суток приблизительно при 25°C и относительной влажности (RH) окружающей среды. Оценку проводили с помощью подсчета числа живых тлей на растение под микроскопом. Контроль (%) измеряли с использованием следующей поправочной формулы Эббота (W.S. Abbott, “A Method of Computing the Effectiveness of an Insecticide” J. Econ. Entomol. 18 (1925), pp. 265-267) следующим образом:
Исправленный контроль (%)=100*(X-Y)/X,
где
X = число живых тлей на контрольных обработанных растворителем растениях, и
Y = число живых тлей на обработанных растениях.
Результаты представлены в таблице под названием «Таблица 4. Биологические данные для GPA (MYZUPE) и гусеницы белокрылки бататовой (BEMITA)» (см. раздел «Таблицы»).
Пример 78: Инсектицидный тест для гусеницы белокрылки бататовой (Bemisia tabaci) (BEMITA) в анализе с опрыскиванием листьев
В качестве экспериментального субстрата использовали выращиваемые в 3-дюймовых горшках растения хлопчатника с 1 небольшим (3-5 см) настоящим листком. Растения помещали в помещение с взрослыми белокрылками. Взрослым особям позволяли откладывать яйца в течение 2-3 суток. После 2-3-суточного периода яйцекладки растения забирали из помещения с взрослыми белокрылками. Взрослых особей сдували с листьев с использованием ручного опрыскивателя Devilbiss (23 фунта на квадратный дюйм). Зараженные яйцами растения (100-300 яиц на растение) помещали в помещение для временного содержания на 5-6 дней при 82°F и 50% RH для выведения из яиц и развития стадии гусеницы. Для каждой обработки использовали четыре растения хлопчатника. Соединения (2 мг) растворяли в 1 мл ацетона, получая маточные растворы, содержащие 2000 м.д. соединения. Маточные растворы разбавляли в 10 раз 0,025% Tween 20 в H2O с получением тестового раствора, содержащего 200 м.д. соединения. Использовали ручной опрыскиватель Devilbiss для распыления раствора на обеих сторонах листка хлопчатника до стекания. Контрольные растения (контроль с растворителем) опрыскивали только растворителем. До выставления оценки обработанные растения содержали в помещении для временного содержания в течение 8-9 суток приблизительно при 82°F и 50% RH. Оценку проводили с помощью подсчета числа живых личинок на растение под микроскопом. Инсектицидную активность измеряли с использованием поправочной формулы Эббота и представляли в «Таблице 4. Биологические данные для GPA (MYZUPE) и гусеницы белокрылки бататовой (BEMITA)» (см. колонку «BEMITA»):
Исправленный контроль (%)=100*(X-Y)/X,
где
X = число живых личинок на контрольных обработанных растворителем растениях,
Y = число живых личинок на обработанных растениях.
пестицидНО приемлемые кислотно-аддитивные соли, производные солей, сольваты, сложнОэфирНЫЕ производные, полиморфы, изотопы и радионуклиды
Молекулы формулы 1 могут быть представлены в виде пестицидно приемлемых кислотно-аддитивных солей. В качестве неограничивающего примера функциональная аминогруппа может образовывать соли с хлористоводородной, бромистоводородной, серной, фосфорной, уксусной, бензойной, лимонной, малоновой, салициловой, яблочной, фумаровой, щавелевой, янтарной, винной, молочной, глюконовой, аскорбиновой, малеиновой, аспарагиновой, бензолсульфоновой, метансульфоновой, этансульфоновой, гидроксиметансульфоновой и гидроксиэтансульфоновой кислотами. Дополнительно, в качестве неограничивающего примера, кислотная функциональная группа может образовывать соли, включая соли щелочных или щелочноземельных металлов, и соли аммония и аминов. Примеры предпочтительных катионов включают натрий, калий и магний.
Молекулы формулы 1 могут быть преобразованы в производные солей. В качестве неограничивающего примера, производные солей могут быть получены путем приведения свободного основания в контакт с достаточным количеством нужной кислоты с получением соли. Свободное основание может быть регенерировано путем обработки соли подходящим разбавленным водным раствором основания, таким как разбавленный водный гидроксид натрия (NaOH), карбонат калия, аммиак и бикарбонат натрия. В качестве примера, во многих случаях, пестицид, такой как 2,4-D, делают более растворимым в воде путем его преобразования до его соли диметиламина.
Молекулы формулы 1 могут быть преобразованы в стабильные комплексы с растворителем, так что комплекс остается интактным после удаления растворителя, не входящего в состав комплекса. Такие комплексы часто называют «сольватами». Однако особенно желательно образование стабильных гидратов с водой в качестве растворителя.
Молекулы формулы 1 могут быть преобразованы в сложноэфирные производные. Такие сложноэфирные производные могут затем использоваться тем же образом, что и раскрытые в настоящем документе соединения.
Молекулы формулы 1 могут быть преобразованы в различные кристаллические полиморфы. Полиморфизм важен для разработки агрохимикатов, поскольку различные кристаллические полиморфы или структуры одной и той же молекулы могут обладать совершенно различными физическими свойствами и биологическими эффектами.
Могут быть получены молекулы формулы 1 с содержанием различных изотопов. Особую важность представляют собой молекулы, содержащие2H (также известный как дейтерий) вместо1H.
Могут быть получены молекулы формулы 1 с содержанием различных радионуклидов. Особую важность представляют собой молекулы, содержащие14C.
СТЕРЕОИЗОМЕРЫ
Молекулы формулы 1 могут существовать в виде одного или нескольких стереоизомеров. Таким образом, некоторые молекулы могут быть получены в виде рацемических смесей. Специалистам в данной области техники следует понимать, что один стереоизомер может быть более активным, чем другие стереоизомеры. Отдельные стереоизомеры могут быть получены посредством традиционных селективных методик синтеза, традиционных методик синтеза с использованием разделенных исходных веществ или посредством общепринятых методик разделения. Некоторые раскрытые в настоящем документе молекулы могут существовать в виде двух или нескольких изомеров. Различные изомеры включают геометрические изомеры, диастереоизомеры и энантиомеры. Таким образом, раскрытые в настоящем документе молекулы включают геометрические изомеры, рацемические смеси, отдельные стереоизомеры и оптически активные смеси. Специалистам в данной области техники следует понимать, что один изомер может быть более активным, чем другие. Структуры, раскрытые в настоящем описании, представлены для ясности лишь в одной геометрической форме, но предназначены для представления всех геометрических форм молекулы.
КОМБИНАЦИИ
Молекулы формулы 1 также могут быть использованы в комбинации (например, в композиционной смеси или при одновременном или последовательном применении) с одним или несколькими соединениями, обладающими акарицидными, альгицидными, авицидными, бактерицидными, фунгицидными, гербицидными, инсектицидными, моллюскоцидными, нематоцидными, родентицидными или вироцидными свойствами. Кроме того, молекулы формулы 1 также могут быть использованы в комбинации (например, в композиционной смеси или при одновременном или последовательном применении) с соединениями, которые являются антифидингами, средствами отпугивания птиц, химическими стерилизаторами, гербицидными антидотами, аттрактантами для насекомых, средствами отпугивания насекомых, средствами отпугивания млекопитающих, средствами нарушения спаривания, активаторами растений, регуляторами роста растений или синергистами. Примерами таких соединений в вышеупомянутых группах, которые могут быть использованы с молекулами формулы 1, являются бромид (3-этоксипропил)ртути, 1,2-дихлорпропан, 1,3-дихлорпропен, 1-метилциклопропен, 1-нафтол, 2-(октилтио)этанол, 2,3,5-три-йодбензойная кислота, 2,3,6-TBA, 2,3,6-TBA-диметиламмоний, 2,3,6-TBA-литий, 2,3,6-TBA-калий, 2,3,6-TBA-натрий, 2,4,5-T, 2,4,5-T-2-бутоксипропил, 2,4,5-T-2-этилгексил, 2,4,5-T-3-бутоксипропил, 2,4,5-TB, 2,4,5-T-бутометил, 2,4,5-T-бутотил, 2,4,5-T-бутил, 2,4,5-T-изобутил, 2,4,5-T-изооктил, 2,4,5-T-изопропил, 2,4,5-T-метил, 2,4,5-T-пентил, 2,4,5-T-натрий, 2,4,5-T-триэтиламмоний, 2,4,5-T-троламин, 2,4-D, 2,4-D-2-бутоксипропил, 2,4-D-2-этилгексил, 2,4-D-3-бутоксипропил, 2,4-D-аммоний, 2,4-DB, 2,4-DB-бутил, 2,4-DB-диметиламмоний, 2,4-DB-изооктил, 2,4-DB-калий, 2,4-DB-натрий, 2,4-D-бутотил, 2,4-D-бутил, 2,4-D-диэтиламмоний, 2,4-D-диметиламмоний, 2,4-D-диоламин, 2,4-D-додециламмоний, 2,4-DEB, 2,4-DEP, 2,4-D-этил, 2,4-D-гептиламмоний, 2,4-D-изобутил, 2,4-D-изооктил, 2,4-D-изопропил, 2,4-D-изопропиламмоний, 2,4-D-литий, 2,4-D-мептил, 2,4-D-метил, 2,4-D-октил, 2,4-D-пентил, 2,4-D-калий, 2,4-D-пропил, 2,4-D-натрий, 2,4-D-тефурил, 2,4-D-тетрадециламмоний, 2,4-D-триэтиламмоний, 2,4-D-трис(2-гидроксипропил)аммоний, 2,4-D-троламин, 2iP, 2-метоксиэтилртути хлорид, 2-фенилфенол, 3,4-DA, 3,4-DB, 3,4-DP, 4-аминопиридин, 4-CPA, 4-CPA-калий, 4-CPA-натрий, 4-CPB, 4-CPP, 4-гидроксифенетиловый спирт, сульфат 8-гидроксихинолина, 8-фенилртутьоксихинолин, абамектин, абсцизовая кислота, ACC, ацефат, ацехиноцил, ацетамиприд, ацетион, ацетохлор, ацетофос, ацетопрол, ацибензолар, ацибензолар-S-метил, ацифлуорфен, ацифлуорфен-метил, ацифлуорфен-натрий, аклонифен, акреп, акринатрин, акролеин, акрилонитрил, аципетакс, аципетакс-медь, аципетакс-цинк, алахлор, аланикарб, албендазол, альдикарб, алдиморф, алдоксикарб, алдрин, аллетрин, аллицин, аллидохлор, аллозамидин, аллоксидим, аллоксидим-натрий, аллиловый спирт, алликсикарб, алорак, альфа-циперметрин, альфа-эндосульфан, аметоктрадин, аметридион, аметрин, амибузин, амикарбазон, амикартиазол, амидитион, амидофлумет, амидосульфурон, аминокарб, аминоциклопирахлор, аминоциклопирахлор-метил, аминоциклопирахлор-калий, аминопиралид, аминопиралид-калий, аминопиралид-трис(2-гидроксипропил)аммоний, амипрофос-метил, амипрофос, амисулбром, амитон, амитон оксалат, амитраз, амитрол, сульфамат аммония, α-нафталинацетат аммония, амобам, ампропилфос, анабазин, анцимидол, анилазин, анилофос, анизурон, антрахинон, анту, афолат, арамит, оксид мышьяка, азомат, аспирин, асулам, асулам-калий, асулам-натрий, атидатион, атратон, атразин, ауреофунгин, авиглицин, гидрохлорид авиглицина, азаконазол, азадирахтин, азафенидин, азаметифос, азимсульфурон, азинфос-этил, азинфос-метил, азипротрин, азитирам, азобензол, азоциклотин, азотоат, азоксистробин, бахмедеш, барбан, гексафторсиликат бария, полисульфид бария, бартрин, BCPC, бефлубутамид, беналаксил, беналаксил-M, беназолин, беназолин-диметиламмоний, беназолин-этил, беназолин-калий, бенкарбазон, бенклотиаз, бендиокарб, бенфлуралин, бенфуракарб, бенфурезат, беноданил, беномил, беноксакор, беноксафос, бенквинокс, бенсульфурон, бенсульфурон-метил, бенсулид, бенсултап, бенталурон, бентазон, бентазон-натрий, бентиаваликарб, бентиаваликарб-изопропил, бентиазол, бентранил, бензадокс, бензадокс-аммоний, бензалкония хлорид, бензамакрил, бензамакрил-изобутил, бензаморф, бензфендизон, бензипрам, бензобициклон, бензофенап, бензофлуор, бензогидроксамовая кислота, бензоксимат, бензоилпроп, бензоилпроп-этил, бензтиазурон, бензилбензоат, бензиладенин, берберин, хлорид берберина, бета-цифлутрин, бета-циперметрин, бетоксазин, бициклопирон, бифеназат, бифенокс, бифентрин, bifujunzhi, биланафос, биланафос-натрий, бинапакрил, bingqingxiao, биоаллетрин, биоэтанометрин, биоперметрин, биоресметрин, бифенил, бисазир, бисмертиазол, биспирибак, биспирибак-натрий, бистрифлурон, битертанол, битионол, биксафен, бластицидин-S, боракс, бордосская смесь, борная кислота, боскалид, брассинолид, брассинолид-этил, бревикомин, бродифакум, брофенвалерат, брофлутринат, бромацил, бромацил-литий, бромацил-натрий, бромадиолон, брометалин, брометрин, бромфенвинфос, бромоацетамид, бромобонил, бромобутид, бромоциклен, бромо-DDT, бромофеноксим, бромофос, бромофос-этил, бромопропилат, бромоталонил, бромоксинил, бромоксинил бутират, бромоксинил гептаноат, бромоксинил октаноат, бромоксинил-калий, бромпиразон, бромуконазол, бронопол, букарполат, буфенкарб, буминафос, бупиримат, бупрофезин, бургундская смесь, бусульфан, бутакарб, бутахлор, бутафенацил, бутамифос, бутатиофос, бутенахлор, бутетрин, бутидазол, бутиобат, бутиурон, бутокарбоксим, бутонат, бутопироноксил, бутоксикарбоксим, бутралин, бутроксидим, бутурон, бутиламин, бутилат, какодиловая кислота, кадусафос, кафенстрол, арсенат кальция, хлорат кальция, цианамид кальция, полисульфид кальция, калвинфос, камбендихлор, камфехлор, камфора, каптафол, каптан, карбаморф, карбанолат, карбарил, карбасулам, карбендазим, карбендазим бензолсульфонат, карбендазим сульфит, карбетамид, карбофуран, углерода дисульфид, углерода тетрахлорид, карбофенотион, карбосульфан, карбоксазол, карбоксид, карбоксин, карфентразон, карфентразон-этил, карпропамид, картап, картапа гидрохлорид, карвакрол, карвон, CDEA, целлоцидин, CEPC, цералур, чешантовая смесь, хинометионат, хитозан, хлобентиазон, хлометоксифен, хлоралоза, хлорамбен, хлорамбен-аммоний, хлорамбен-диоламин, хлорамбен-метил, хлорамбен-метиламмоний, хлорамбен-натрий, хлорамин фосфор, хлорамфеникол, хлораниформетан, хлоранил, хлоранокрил, хлорантранилипрол, хлоразифоп, хлоразифоп-пропаргил, хлоразин, хлорбензид, хлорбензурон, хлорбициклен, хлорбромурон, хлорбуфам, хлордан, хлордекон, хлордимеформ, хлордимеформа гидрохлорид, хлоремпентрин, хлорэтоксифос, хлоретурон, хлорфенак, хлорфенак-аммоний, хлорфенак-натрий, хлорфенапир, хлорфеназол, хлорфенетол, хлорфенпроп, хлорфенсон, хлорфенсульфид, хлорфенвинфос, хлорфлуазурон, хлорфлуразол, хлорфлурен, хлорфлурен-метил, хлорфлуренол, хлорфлуренол-метил, хлоридазон, хлоримурон, хлоримурон-этил, хлормефос, хлормекват, хлормекват хлорид, хлорнидин, хлорнитрофен, хлорбензилат, хлородинитронафталины, хлороформ, хлоромебуформ, хлорометиурон, хлоронеб, хлорофацинон, хлорофацинон-натрий, хлоропикрин, хлоропон, хлоропропилат, хлороталонил, хлоротолурон, хлороксурон, хлороксинил, хлорфониум, хлорфониум хлорид, хлорфоксим, хлорпарзофос, хлорпрокарб, хлорпрофам, хлорпирифос, хлорпирифос-метил, хлорквинокс, хлорсульфурон, хлортал, хлортал-диметил, хлортал-монометил, хлортиамид, хлортиофос, хлозолинат, холина хлорид, хромафенозид, цинерин I, цинерин II, цинерины, цинидон-этил, цинметилин, циносульфурон, циобутид, цисанилид, цисметрин, клетодим, климбазол, клиодинат, клодинафоп, клодинафоп-пропаргил, клоетокарб, клофенцет, клофенцет-калий, клофентезин, клофибриновая кислота, клофоп, клофоп-изобутил, кломазон, кломепроп, клопроп, клопроксидим, клопиралид, клопиралид-метил, клопиралид-оламин, клопиралид-калий, клопиралид-трис(2-гидроксипропил)аммоний, клоквинтоцет, клоквинтоцет-мексил, клорансулам, клорансулам-метил, клосентел, клотианидин, клотримазол, клоксифонак, клоксифонак-натрий, CMA, кодлелур, колофонат, ацетат меди, ацетоарсенит меди, арсенат меди, медь углекислая основная, гидроксид меди, нафтенат меди, олеат меди, оксихлорид меди, силикат меди, сульфат меди, хромат меди и цинка, кумахлор, кумафурил, кумафос, куматетралил, кумитоат, кумоксистробин, CPMC, CPMF, CPPC, кредазин, крезол, кримидин, кротамитон, кротоксифос, круфомат, криолит, куелур, куфранеб, кумилурон, купробам, оксид меди, куркуменол, цианамид, цианатрин, цианазин, цианофенфос, цианофос, циантоат, циантранилипрол, циазофамид, цибутрин, циклафурамид, цикланилид, циклетрин, циклоат, циклогексимид, циклопрат, циклопротрин, циклосульфамурон, циклоксидим, циклурон, циенопирафен, цифлуфенамид, цифлуметофен, цифлутрин, цигалофоп, цигалофоп-бутил, цигалотрин, цигексатин, цимиазол, цимиазола гидрохлорид, цимоксанил, циометринил, ципендазол, циперметрин, циперкват, циперкват хлорид, цифенотрин, ципразин, ципразол, ципроконазол, ципродинил, ципрофурам, ципромид, ципросульфамид, циромазин, цитиоат, даимурон, далапон, далапон-кальций, далапон-магний, далапон-натрий, даминозид, dayoutong, дазомет, дазомет-натрий, DBCP, d-камфора, DCIP, DCPTA, DDT, дебакарб, декафентин, декарбофуран, дегидроуксусная кислота, делахлор, дельтаметрин, демефион, демефион-O, демефион-S, деметон, деметон-метил, деметон-O, деметон-O-метил, деметон-S, деметон-S-метил, деметон-S-метилсульфон, десмедифам, десметрин, d-fanshiluquebingjuzhi, диафентиурон, диалифос, диаллат, диамидафос, диатомовая земля, диазинон, дибутилфталат, дибутилсукцинат, дикамба, дикамба-дигликольамин, дикамба-диметиламмоний, дикамба-диоламин, дикамба-изопропиламмоний, дикамба-метил, дикамба-оламин, дикамба-калий, дикамба-натрий, дикамба-троламин, дикаптон, дихлобенил, дихлофентион, дихлофлуанид, дихлон, дихлоральмочевина, дихлорбензурон, дихлорфлуренол, дихлорфлуренол-метил, дихлормат, дихлормид, дихлорофен, дихлорпроп, дихлорпроп-2-этилгексил, дихлорпроп-бутотил, дихлорпроп-диметиламмоний, дихлорпроп-этиламмоний, дихлорпроп-изооктил, дихлорпроп-метил, дихлорпроп-P, дихлорпроп-P-2-этилгексил, дихлорпроп-P-диметиламмоний, дихлорпроп-калий, дихлорпроп-натрий, дихлорвос, дихлозолин, диклобутразол, диклоцимет, диклофоп, диклофоп-метил, дикломезин, дикломезин-натрий, диклоран, диклосулам, дикофол, дикумарол, дикрезил, дикротофос, дицикланил, дициклонон, диелдрин, диенохлор, диетамкват, диетамкват дихлорид, диетатил, диетатил-этил, диэтофенкарб, диетолат, диэтилпирокарбонат, диэтилтлуамид, дифенакум, дифеноконазол, дифенопентен, дифенопентен-этил, дифеноксурон, дифензокват, дифензокват метилсульфат, дифетиалон, дифловидазин, дифлубензурон, дифлуфеникан, дифлуфензопир, дифлуфензопир-натрий, дифлуметорим, дикегулак, дикегулак-натрий, дилор, диматиф, димефлутрин, димефокс, димефурон, димепиперат, диметахлон, диметан, диметакарб, диметахлор, диметаметрин, диметенамид, диметенамид-P, диметипин, диметиримол, диметоат, диметоморф, диметрин, диметилкарбат, диметилфталат, диметилвинфос, диметилан, димексано, димидазон, димоксистробин, динекс, динекс-диклексин, dingjunezuo, диниконазол, диниконазол-M, динитрамин, динобутон, динокап, динокап-4, динокап-6, диноктон, динофенат, динопентон, динопроп, диносам, диносеб, диносеб ацетат, диносеб-аммоний, диносеб-диоламин, диносеб-натрий, диносеб-троламин, диносульфон, динотефуран, динотерб, динотерб ацетат, динотербон, диофенолан, диоксабензофос, диоксакарб, диоксатион, дифацинон, дифацинон-натрий, дифенамид, дифенил сульфон, дифениламин, дипропалин, дипропетрин, дипиритион, дикват, дикват дибромид, диспарлур, дисул, дисулфирам, дисулфотон, дисул-натрий, диталимфос, дитианон, дитикрофос, дитиоэтер, дитиопир, диурон, d-лимонен, DMPA, DNOC, DNOC-аммоний, DNOC-калий, DNOC-натрий, додеморф, додеморф ацетат, додеморф бензоат, додицин, додицин гидрохлорид, додицин-натрий, додин, дофенапин, доминикалур, дорамектин, дразоксолон, DSMA, дуфулин, EBEP, EBP, экдустерон, эдифенфос, эглиназин, эглиназин-этил, эмамектин, эмамектин бензоат, EMPC, эмпентрин, эндосульфан, эндотал, эндотал-диаммоний, эндотал-дикалий, эндотал-динатрий, эндотион, эндрин, энестробурин, EPN, эпохолеон, эпофенонан, эпоксиконазол, эприномектин, эпроназ, EPTC, эрбон, эргокальциферол, erlujixiancaoan, эсдепаллетрин, эсфенвалерат, эспрокарб, этацелазил, этаконазол, этафос, этем, этабоксам, этахлор, эталфлуралин, этаметсульфурон, этаметсульфурон-метил, этапрохлор, этефон, этидимурон, этиофенкарб, этиолат, этион, этиозин, этипрол, этиримол, этоат-метил, этофумезат, этогексадиол, этопрофос, этоксифен, этоксифен-этил, этоксиквин, этоксисульфурон, этихлозат, этилформиат, этил-α-нафталинацетат, этил-DDD, этилен, этилен дибромид, этилен дихлорид, этилен оксид, этилицин, этилртути 2,3-дигидроксипропил меркаптид, этилмеркурацетат, этилмеркурбромид, этилмеркурхлорид, этилмеркурфосфат, этинофен, этнипромид, этобензанид, этофенпрокс, этоксазол, этридиазол, этримфос, эвгенол, EXD, фамоксадон, фамфур, фенамидон, фенаминосульф, фенамифос, фенапанил, фенаримол, фенасулам, феназафлор, феназаквин, фенбуконазол, фенбутатин оксид, фенхлоразол, фенхлоразол-этил, фенхлорфос, фенклорим, фенетакарб, фенфлутрин, фенфурам, фенгексамид, фенитропан, фенитротион, fenjuntong, фенобукарб, фенопроп, фенопроп-3-бутоксипропил, фенопроп-бутометил, фенопроп-бутотил, фенопроп-бутил, фенопроп-изооктил, фенопроп-метил, фенопроп-калий, фенотиокарб, феноксакрим, феноксанил, феноксапроп, феноксапроп-этил, феноксапроп-P, феноксапроп-P-этил, феноксасульфон, феноксикарб, фенпиклонил, фенпиритрин, фенпропатрин, фенпропидин, фенпропиморф, фенпиразамин, фенпироксимат, фенридазон, фенридазон-калий, фенридазон-пропил, фензон, фенсульфотион, фентеракол, фентиапроп, фентиапроп-этил, фентион, фентион-этил, фентин, фентин ацетат, фентин хлорид, фентин гидроксид, фентразамид, фентрифанил, фенурон, фенурон TCA, фенвалерат, фербам, феримзон, сульфат железа, фипронил, флампроп, флампроп-изопропил, флампроп-M, флампроп-метил, флампроп-M-изопропил, флампроп-M-метил, флазасульфурон, флокумафен, флометоквин, флоникамид, флорасулам, флуакрипирим, флуазифоп, флуазифоп-бутил, флуазифоп-метил, флуазифоп-P, флуазифоп-P-бутил, флуазинам, флуазолат, флуазурон, флубендиамид, флубензимин, флукарбазон, флукарбазон-натрий, флуцетосульфурон, флухлоралин, флукофурон, флуциклоксурон, флуцитринат, флудиоксонил, флуенетил, флуенсульфон, флуфенацет, флуфенерим, флуфеникан, флуфеноксурон, флуфенпрокс, флуфенпир, флуфенпир-этил, флуфипрол, флуметрин, флуметовер, флуметралин, флуметсулам, флумезин, флумиклорак, флумиклорак-пентил, флумиоксазин, флумипропин, флуморф, флуометурон, флуопиколид, флуопирам, флуорбензид, флуоридамид, фторацетамид, флуородифен, флуорогликофен, флуорогликофен-этил, фторомид, флуоромидин, флуоронитрофен, флуотиурон, флуотримазол, флуоксастробин, флупоксам, флупропацил, флупропадин, флупропанат, флупропанат-натрий, флупирадифурон, флупирсульфурон, флупирсульфурон-метил, флупирсульфурон-метил-натрий, флуквинконазол, флуразол, флуренол, флуренол-бутил, флуренол-метил, флуридон, флурохлоридон, флуроксипир, флуроксипир-бутометил, флуроксипир-мептил, флурпримидол, флурсуламид, флуртамон, флусилазол, флусульфамид, флутиацет, флутиацет-метил, флутианил, флутоланил, флутриафол, флувалинат, флуксапироксад, флуксофеним, фолпет, фомесафен, фомесафен-натрий, фонофос, форамсульфурон, форхлорфенурон, формальдегид, форметанат, форметаната гидрохлорид, формотион, формпаранат, формпараната гидрохлорид, фосамин, фосамин-аммоний, фосетил, фосетил-алюминий, фосметилан, фоспират, фостиазат, фостиетан, фронталин, фуберидазол, fucaojing, fucaomi, funaihecaoling, фуфентиомочевина, фуралан, фуралаксил, фураметрин, фураметпир, фуратиокарб, фуркарбанил, фурконазол, фурконазол-цис, фуретрин, фурфурал, фурилазол, фурмециклокс, фурофанат, фурилоксифен, гамма-цигалотрин, гамма-HCH, генит, гиббереллиновая кислота, гиббереллины, глифтор, глуфосинат, глуфосинат-аммоний, глуфосинат-P, глуфосинат-P-аммоний, глуфосинат-P-натрий, глиодин, глиоксим, глифосат, глифосат-диаммоний, глифосат-диметиламмоний, глифосат-изопропиламмоний, глифосат-моноаммоний, глифосат-калий, глифосат-сесквинатрий, глифосат-тримезиум, глифосин, госсиплур, грандлур, гризеофульвин, квазатин, квазатин ацетаты, галакринат, галфенпрокс, галофенозид, галосафен, галосульфурон, галосульфурон-метил, галоксидин, галоксифоп, галоксифоп-этотил, галоксифоп-метил, галоксифоп-P, галоксифоп-P-этотил, галоксифоп-P-метил, галоксифоп-натрий, HCH, хемел, хемпа, HEOD, гептахлор, гептенофос, гептопаргил, гетерофос, гексахлорацетон, гексахлорбензол, гексахлорбутадиен, гексахлорфен, гексаконазол, гексафлумурон, гексафлурат, гексалур, гексамид, гексазинон, гексилтиофос, гекситиазокс, HHDN, голосулф, huancaiwo, huangcaoling, huanjunzuo, гидраметилнон, гидраргафен, гашеная известь, цианистый водород, гидропрен, гимексазол, хиквинкарб, IAA, IBA, икаридин, имазалил, имазалил нитрат, имазалил сульфат, имазаметабенз, имазаметабенз-метил, имазамокс, имазамокс-аммоний, имазапик, имазапик-аммоний, имазапир, имазапир-изопропиламмоний, имазаквин, имазаквин-аммоний, имазаквин-метил, имазаквин-натрий, имазетапир, имазаквин-аммоний, имазосульфурон, имибенконазол, имициафос, имидаклоприд, имидаклотиз, иминоктадин, иминоктадин триацетат, иминоктадин триалбезилат, имипротрин, инабенфид, инданофан, индазифлам, индоксакарб, инезин, йодобонил, йодокарб, йодометан, йодосульфурон, йодосульфурон-метил, йодосульфурон-метил-натрий, иофенсульфурон, иофенсульфурон-натрий, иоксанил, иоксанил октаноат, иоксанил-литий, иоксанил-натрий, ипазин, ипконазол, ипфенкарбазон, ипробенфос, ипродион, ипроваликарб, ипримидам, ипсдиенол, ипсенол, IPSP, изамидофос, исазофос, изобензан, изокарбамид, изокарбофос, изоцил, изодрин, изофенфос, изофенфос-метил, изолан, изометиозин, изонорунон, изополинат, изопрокарб, изопропалин, изопротиолан, изопротурон, изопиразам, изопиримол, изотиоат, изотианил, изоурон, изовалидион, изоксабен, изоксахлортол, изоксадифен, изоксадифен-этил, изоксафлутол, изоксапирифоп, изоксатион, ивермектин, изопамфос, японилур, жапотрины, жасмолин I, жасмолин II, жасмоновая кислота, jiahuangchongzong, jiajizengxiaolin, jiaxianjunzhi, jiecaowan, jiecaoxi, йодофенфос, ювенильный гормон I, ювенильный гормон II, ювенильный гормон III, кадетрин, карбутилат, каретазан, каретазан-калий, касугамицин, касугамицина гидрохлорид, kejunling, келеван, кетоспирадокс, кетоспирадокс-калий, кинетин, кинопрен, коезоксим-метил, kuicaoxi, лактофен, лямбда-цигалотрин, латилур, арсенат свинца, ленацил, лепимектин, лепрофос, линдан, линеатин, линурон, лиримфос, литлур, луплур, луфенурон, lvdingjunzhi, lvxiancaolin, литидатион, MAA, малатион, гидразид малеиновой кислоты, малонобен, мальтодекстрин, MAMA, манкоппер, манкозеб, мандипропамид, манеб, матрин, мазидокс, MCPA, MCPA-2-этилгексил, MCPA-бутотил, MCPA-бутил, MCPA-диметиламмоний, MCPA-диоламин, MCPA-этил, MCPA-изобутил, MCPA-изооктил, MCPA-изопропил, MCPA-метил, MCPA-оламин, MCPA-калий, MCPA-натрий, MCPA-тиоэтил, MCPA-троламин, MCPB, MCPB-этил, MCPB-метил, MCPB-метил-натрий, мебенил, мекарбам, мекарбинзид, мекарфон, мекопроп, мекопроп-2-этилгексил, мекопроп-диметиламмоний, мекопроп-диоламин, мекопроп-этадил, мекопроп-изооктил, мекопроп-метил, мекопроп-P, мекопроп-P-2-этилгексил, мекопроп-P-диметиламмоний, мекопроп-P-изобутил, мекопроп-калий, мекопроп-P-калий, мекопроп-натрий, мекопроп-троламин, медимеформ, мединотерб, мединотерб ацетат, медлур, мефенацет, мефенпир, мефенпир-диэтил, мефлуидид, мефлуидид-диоламин, мефлуидид-калий, тетрадекадиеновая кислота, меназон, мепанипирим, меперфлутрин, мефенат, мефосфолан, мепикват, мепикват хлорид, мепикват пентаборат, мепронил, мептилдинокам, хлорид ртути, оксид ртути, хлористая ртуть, мерфос, мезопразин, мезосульфурон, мезосульфурон-метил, мезотрион, месульфен, месульфенфос, метафлумизон, металаксил, металаксил-M, метальдегид, метам, метам-аммоний, метамифоп, метамитрон, метам-калий, метам-натрий, метазахлор, метазосульфурон, метазоксолон, метконазол, метепа, метфлуразон, метабензтиазурон, метакрифос, металпропалин, метамидофос, метасульфокарб, метазол, метфуроксам, метидатион, метиобенкарб, метиокарб, метиопирисульфурон, метиотепа, метиозолин, метиурон, метокротофос, метометон, метомил, метопрен, метопротрин, метоквин-бутил, метотрин, метоксихлор, метоксифенозид, метоксифенон, метил афолат, метилбромид, метилэвгенол, метилйодид, метил изотиоцианат, метилфцетофос, метилхлороформ, метилдимрон, метилен хлористый, метилртути бензоат, метилртути дициандиамид, метилртути пентахлорфеноксид, метилнеодеканамид, метирам, метобензурон, метобромурон, метофлутрин, метолахлор, метолкарб, метоминостробин, метосулам, метоксадиазон, метоксурон, метрафенон, метрибузин, метсульфовакс, метсульфурон, метсульфурон-метил, мевинфос, мексакарбат, mieshuan, милбемектин, милбемицин оксим, милнеб, мипафокс, мирекс, MNAF, могучун, молинат, молосултап, моналид, монисоурон, монохлоруксусная кислота, монокротофос, монолинурон, моносульфурон, моносульфурон-сложный эфир, монурон, монурон TCA, морфамкват, морфамкват дихлорид, мороксидин, мороксидина гидрохлорид, морфотион, морзид, моксидектин, MSMA, мускалур, миклобутанил, миклозолин, N-(этилртуть)-п-толуолсульфонанилид, набам, нафталофос, налед, нафталин, нафталинацетамид, ангидрид нафтойной кислоты, нафтоксиуксусные кислоты, напроанилид, напропамид, напталам, напталам-натрий, натамицин, небурон, никлозамид, никлозамид-оламин, никосульфурон, никотин, нифлуридид, нипираклофен, нитенпирам, нитиазин, нитралин, нитрапирин, нитрилакарб, нитрофен, нитрофлуорфен, нитрострин, нитротал-изопропил, норбормид, норфлуразон, норникотин, норурон, новалурон, новифлумурон, нуаримол, OCH, октахлордипропиловый эфир, октилинон, офурас, ометоат, орбенкарб, орфралур, орто-дихлорбензол, ортосульфамурон, орикталур, орисастробин, оризалин, остол, острамон, оксабетринил, оксадиаргил, оксадиазон, оксадиксил, оксамат, оксамил, оксапиразон, оксапиразон-димоламин, оксапиразон-натрий, оксасульфурон, оксазикломефон, оксиновая медь, оксолиновая кислота, окспоконазол, окспоконазол фумарат, оксикарбоксин, оксидеметон-метил, оксидепрофос, оксидисульфотон, оксифлуорфен, оксиматрин, окситетрациклин, гидрохлорид окситетрациклина, паклобутразол, paichongding, пара-дихлорбензол, парафлурон, паракват, паракват дихлорид, паракват диметилсульфат, паратион, паратион-метил, паринол, пебулат, пефуразоат, пеларгоновая кислота, пенконазол, пенцикурон, пендиметалин, пенфлуфен, пенфлурон, пенокссулам, пентахлорфенол, пентанохлор, пентиопирад, пентметрин, пентоксазон, перфлуидон, перметрин, петоксамид, фенамакрил, феназин оксид, фенизофам, фенкаптон, фенмедифам, фенмедифам-этил, фенобензурон, фенотрин, фенпроксид, фентоат, фенилмеркуромочевина, фенилмеркурацетат, фенилмеркурхлорид, фенилмеркурпроизводное пирокатехола, фенилмеркурнитрат, фенилмеркурсалицилат, форат, фосацетим, фосалон, фосдифен, фосфолан, фосфолан-метил, фосглицин, фосмет, фоснихлор, фосфамидон, фосфин, фосфокарб, фосфор, фостин, фоксим, фоксим-метил, фталид, пиклорам, пиклорам-2-этилгексил, пиклорам-изооктил, пиклорам-метил, пиклорам-оламин, пиклорам-калий, пиклорам-триэтиламмоний, пиклорам-трис(2-гидроксипропил)аммоний, пиколинафен, пикоксистробин, пиндон, пиндон-натрий, пиноксаден, пипералин, пиперонил бутоксид, пиперонил циклонен, пиперофос, пипроктанил, пипроктанил бромид, пипротал, пириметафос, пиримикарб, пиримиоксифос, пиримифос-этил, пиримифос-метил, плифенат, поликарбамат, полиоксины, полиоксорим, полиоксорим-цинк, политиалан, арсенат калия, азид калия, цианат калия, гиббереллат калия, нафтенат калия, полисульфид калия, тиоцианат калия, α-нафталинацетат калия, пп'-DDT, праллетрин, прекоцен I, прекоцен II, прекоцен III, претилахлор, примидофос, примисульфурон, примисульфурон-метил, пробеназол, прохлораз, прохлораз-марганец, проклонол, проциазин, процимидон, продиамин, профенофос, профлуазол, профлуралин, профлутрин, профоксидим, проглиназин, проглиназин-этил, прогексадион, прогексадион-кальция, прогидрожасмон, промацил, промекарб, прометон, прометрин, промурит, пропахлор, пропамидин, пропамидин дигидрохлорид, пропамокарб, пропамокарба гидрохлорид, пропанил, пропафос, пропаквизафоп, пропаргит, пропартрин, пропазин, пропетамфос, профам, пропиконазол, пропинеб, пропизохлор, пропоксур, пропоксикарбазон, прпоксикарбазон-натрий, пропилизом, пропирисульфурон, пропизамид, проксиназид, просулер, просульфалин, просульфокарб, просульфурон, протидатион, протиокарб, протиокарб гидрохлорид, протиоконазол, протиофос, протоат, протрифенбут, проксан, проксан-натрий, принахлор, пиданон, пиметрозин, пиракарболид, пираклофос, пираклонил, пираклостробин, пирафлуфен, пирафлуфен-этил, пирафлупрол, пирамат, пираметостробин, пираоксистробин, пирасульфотол, пиразолинат, пиразофос, пиразосульфурон, пиразосульфурон-этил, пиразотион, пиразоксифен, пиресметрин, пиретрин I, пиретрин II, пиретрины, пирибамбенз-изопропил, пирибамбенз-пропил, пирибенкарб, пирибензоксим, пирибутикарб, пириклор, пиридабен, пиридафол, пиридалил, пиридафентион, пиридат, пиридинитрил, пирифенокс, пирифлуквиназон, пирифталид, пириметанил, пиримидифен, пириминобак, пириминобак-метил, пиримисульфан, пиримитат, пиринурон, пириофенон, пирипрол, пирипропанол, пирипроксифен, пиритиобак, пириминобак-натрий, пиролан, пироквилон, пироксасульфон, пирокссулам, пироксихлор, пироксифур, квассия, квинацетол, квинацетол сульфат, квиналфос, квиналфос-метил, квиназамид, квинклорак, квинконазол, квинмерак, квинокламин, квинонамид, квинотион, квиноксифен, квинтиофос, квинтозен, квизалофоп, квизалофоп-этил, квизалофоп-P, квизалофоп-P-этил, квизалофоп-P-тефурил, quwenzhi, quyingding, рабензазол, рафоксанид, ребемид, ресметрин, родетанил, родожапонин-III, рибавирин, римсульфурон, ротенон, риания, салфуфенацил, saijunmao, saisentong, салициланилид, сангвинарин, сантонин, шрадан, сциллирозид, себутилазин, секбуметон, седаксан, селамектин, семиамитраз, семиамитраз хлорид, сезамекс, сезамолин, сетоксидим, shuangjiaancaolin, сидурон, сиглур, силафлуофен, силатран, силикагель, силтиофам, симазин, симеконазол, симетон, симетрин, синтофен, SMA, C-метолахлор, арсенит натрия, азид натрия, хлорат натрия, фторид натрия, фторацетат натрия, гексафторсиликат натрия, нафтенат натрия, ортофенилфеноксид натрия, пентахлорфеноксид натрия, полисульфид натрия, тиоцианат натрия, α-нафталинацетат натрия, софамид, спинеторам, спиносад, спиродиклофен, спиромезифен, спиротетрамат, спироксамин, стрептомицин, стрептомицин сесквисульфат, стрихнин, сулкатол, сулкофурон, сулкофурон-натрий, сулкотрион, сульфаллат, сульфентразон, сульфирам, сульфлурамид, сульфометурон, сульфометурон-метил, сульфосульфурон, сульфотеп, сульфоксафлор, сульфоксид, сульфоксим, сера, серная кислота, сульфурил фторид, сулгликапин, сулпрофос, султропен, свеп, тау-флювалинат, таврон, тазимкарб, TCA, TCA-аммоний, TCA-кальция, TCA-этадил, TCA-магний, TCA-натрий, TDE, тебуконазол, тебуфенозид, тебуфенпирад, тебуфлоквин, тебупиримфос, тебутам, тебутиурон, теклофталам, фекназен, текорам, тефлубензурон, тефлутрин, тефурилтрион, темботрион, темефос, тепа, TEPP, тепралоксидим, тераллетрин, тербацил, тербукарб, тербухлор, тербуфос, тербуметон, тербутилазин, тербутрин, тетсикласис, тетрахлоретан, тетрахлорвинфос, тетраконазол, тетрадифон, тетрафлурон, тетраметрин, тетраметилфлутрин, тетрамин, тетранактин, тетрасул, таллия сульфат, тенилхлор, тета-циперметрин, тиабендазол, тиаклоприд, тиадифлуор, тиаметоксам, тиапронил, тиазафлурон, тиазопир, тикрофос, тициофен, тиадиазимин, тиадиазурон, тиенкарбазон, тиенкарбазон-метил, тифенсульфурон, тифенсульфурон-метил, тифлузамид, тиобенкарб, тиокарбоксим, тиохлорфенпим, тиоциклам, тиоциклама гидрохлорид, тиоциклам оксалат, тиодиазол-меди, тиодикарб, тиофанокс, тиофлуоксимат, тиохемпа, тиомерсал, тиометон, тионазин, тиофанат, тиофанат-метил, тиоквинокс, тиосемикарбазид, тиосултап, тиосултап-димаммоний, тиосултап-динатрий, тиосултап-мононатрий, тиотепа, тирам, thuringiensin, тиадинил, tiaojiean, тиокарбазил, тиоклорим, тиоксимид, тирпат, толклофос-метил, толфенпирад, толилфлуанид, толилмеркурацетат, топрамезон, тралкосидим, тралоцитрин, тралометрин, тралопирил, трансфлутрин, трансперметрин, третамин, триаконтанол, триадимефон, триадименол, триафамон, триаллат, триамифос, триапентенол, триаратен, триаримол, триасульфурон, триазамат, триазбутил, триазифлам, триазофос, триазоксид, трибенурон, трибенурон-метил, трибуфос, трибутилолова оксид, трикамба, трихламид, трихлорфон, трихлорметафос-3, трихлоронат, триклопир, триклопир-бутотил, триклопир-этил, триклопир-триэтиламмоний, трициклазол, тридеморф, тридифан, триэтазин, трифенморф, трифенофос, трифлоксистробин, трифлоксисульфурон, трифлоксисульфурон-натрий, трифлумизол, трифлумурон, трифлуралин, трифлусульфурон, трифлусульфурон-метил, трифоп, трифоп-метил, трифопсим, трифорин, тригидрокситриазин, тримедлур, триметакарб, триметурон, тринексапак, тринексапак-этил, трипрен, трипропиндан, трипролид, тритак, тритиконазол, тритосульфурон, трунк-кол, униконазол, униконазол-P, урбацид, уредепа, валерат, валидамицин, валифеналат, валон, вамидотион, вангард, ванилипрол, вернолат, винклозолин, варфарин, варфарин-калий, варфарин-натрий, xiaochongliulin, xinjunan, xiwojunan, XMC, ксилахлор, ксиленолы, ксилилкарб, yishijing, зариламид, зеатин, zengxiaoan, зета-циперметрин, цинка нафтенат, цинка фосфид, цинка тиазол, зинеб, зирам, золапрофос, зоксамид, zuomihuanglong, α-хлоргидрин, α-экдизон, α-мултистриатин и α-нафтилуксусная кислота. Для более подробной информации см. “Compendium of Pesticide Common Names”, размещенный на http://www.alanwood.net/pesticides/index.html. Также см. “The Pesticide Manual” 14th Edition, edited by C D S Tomlin, copyright 2006 by British Crop Production Council, или более ранние, или более поздние его издания.
БИОПЕСТИЦИДЫ
Молекулы формулы 1 также могут быть использованы в комбинации (такой как в композиционной смеси или при одновременном или последовательном применении) с одним или несколькими биопестицидами. Термин «биопестицид» используется для средств контроля микробиологических вредителей, которые применяются способом, подобным способу применения химических пестицидов. Обычно они являются бактериальными, но также имеются примеры грибковых средств контроля, включающие Trichoderma spp. и Ampelomyces quisqualis (средство контроля мучнистой росы винограда). Bacillus subtilis используется для контроля растительных патогенов. Сорняки и грызуны также контролируются микробными средствами. Одним хорошо известным примером инсектицида является Bacillus thuringiensis, вызывающая бактериальное заболевание у Lepidoptera, Coleoptera и Diptera. Поскольку она оказывает незначительный эффект на другие организмы, то считается более экологически безопасной, чем синтетические пестициды. Биологические инсектициды предусматривают продукты на основе:
1. энтомопатогенных грибов (например, Metarhizium anisopliae),
2. энтомопатогенных нематод (например, Steinernema feltiae) и
3. энтомопатогенных вирусов (например, вирус гранулеза Cydia pomonella).
Другие примеры энтомопатогенных организмов включают без ограничения бакуловирусы, бактерии и другие прокариотические организмы, грибы, простейшие и Microsproridia. Инсектициды биологического происхождения включают без ограничения ротенон, вератридин, а также микробные токсины; выносливые или устойчивые к насекомым сорта растений и организмы, модифицированные технологией рекомбинантной ДНК либо для продуцирования инсектицидов, либо для обеспечения свойства устойчивости к насекомым у генномодифицированного организма. Согласно одному варианту осуществления, молекулы формулы 1 могут быть использованы с одним или несколькими биопестицидами для обработки семян и улучшения почвы. В The Manual of Biocontrol Agents приводится обзор доступных биологических инсектицидных продуктов (и других средств контроля на основе биологического материала) (Copping L.G. (ed.) (2004), The Manual of Biocontrol Agents (ранее The Biopesticide Manual) 3rd Edition. British Crop Production Council (BCPC), Farnham, Surrey UK).
ДРУГИЕ АКТИВНЫЕ СОЕДИНЕНИЯ
Молекулы формулы (I) могут также использоваться в сочетании (например, в составной смеси или при одновременном или последовательном применении) с одним или несколькими из:
1. 3-(4-хлор-2,6-диметилфенил)-4-гидрокси-8-окса-1-азаспиро[4,5]дец-3-ен-2-она;
2. 3-(4'-хлор-2,4-диметил[1,1'-бифенил]-3-ил)-4-гидрокси-8-окса-1-азаспиро[4,5]дец-3-ен-2-она;
3. 4-[[(6-хлор-3-пиридинил)метил]метиламино]-2(5H)-фуранона;
4. 4-[[(6-хлор-3-пиридинил)метил]циклопропиламино]-2(5H)-фуранона;
5. 3-хлор-N2-[(1S)-1-метил-2-(метилсульфонил)этил]-N1-[2-метил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]-1,2-бензолдикарбоксамида;
6. 2-циано-N-этил-4-фтор-3-метоксибензолсульфонамида;
7. 2-циано-N-этил-3-метоксибензолсульфонамида;
8. 2-циано-3-дифторметокси-N-этил-4-фторбензолсульфонамида;
9. 2-циано-3-фторметокси-N-этилбензолсульфонамида;
10. 2-циано-6-фтор-3-метокси-N,N-диметилбензолсульфонамида;
11. 2-циано-N-этил-6-фтор-3-метокси-N-метилбензолсульфонамида;
12. 2-циано-3-дифторметокси-N,N-диметилбензолсульфонамида;
13. 3-(дифторметил)-N-[2-(3,3-диметилбутил)фенил]-1-метил-1H-пиразол-4-карбоксамида;
14. N-этил-2,2-диметилпропионамид-2-(2,6-дихлор-α,α,α-трифтор-пара-толил)гидразона;
15. N-этил-2,2-дихлор-1-метилциклопропанкарбоксамид-2-(2,6-дихлор-α,α,α-трифтор-пара-толил)гидразонникотина;
16. O-{(E-)-[2-(4-хлорфенил)-2-циано-1-(2-трифторметилфенил)-винил]}-S-метилтиокарбоната;
17. (E)-N1-[(2-хлор-1,3-тиазол-5-илметил)]-N2-циано-N1-метилацетамидина;
18. 1-(6-хлорпиридин-3-илметил)-7-метил-8-нитро-1,2,3,5,6,7-гексагидроимидазо[1,2-a]пиридин-5-ола;
19. 4-[4-хлорфенил-(2-бутилидингидразоно)метил)]-фенилмезилата; и
20. N-этил-2,2-дихлор-1-метилциклопропанкарбоксамид-2-(2,6-дихлор-α,α,α-трифтор-пара-толил)гидразона.
СИНЕРГИЧНЫЕ СМЕСИ
Молекулы формулы 1 могут использоваться вместе с некоторыми активными соединениями для образования синергичных смесей, в которых механизм действия таких соединений является таким же, сходным или различным по сравнению с механизмом действия молекул формулы 1. Примеры механизмов действия включают без ограничения: ингибитор ацетилхолинэстеразы; модулятор натриевых каналов; ингибитор биосинтеза хинина; антагонист канала-переносчика ионов хлора, регулируемого глутаматом и GABA; агонист канала-переносчика ионов хлора, регулируемого глутаматом и GABA; агонист рецептора ацетилхолина; антагонист рецептора ацетилхолина; ингибитор MET I; ингибитор Mg-стимулируемой АТФазы; никотиновый ацетилхолиновый рецептор; мембранный разобщитель средней зоны кишечника; разобщитель окислительного фосфорилирования и рецептор рианодина (RyRs). Как правило, в синергичной смеси весовые соотношения молекул формулы 1 и другого соединения составляют приблизительно от 10/1 приблизительно до 1/10, согласно другому варианту осуществления приблизительно от 5/1 приблизительно до 1/5, и согласно другому варианту осуществления приблизительно 3/1, и согласно другому варианту осуществления приблизительно 1/1.
СОСТАВЫ
Пестициды редко подходят для использования в чистой форме. Обычно необходимо добавление других веществ, так чтобы пестицид мог быть использован в необходимой концентрации и в подходящей форме, обеспечивая простоту нанесения, обращения, транспортировки, хранения и максимальную пестицидную активность. Таким образом, пестициды включают в состав, например, приманки, концентрированные эмульсии, порошковидные препараты, эмульгируемые концентраты, фумиганты, гели, гранулы, микроинкапсулированные препараты, протравки для семян, концентраты суспензий, суспоэмульсии, таблетки, растворимые в воде жидкости, диспергируемые в воде гранулы или сухие сыпучие препараты, смачивающиеся порошки и ультрамалообъемные растворы. Для дополнительной информации о типах составов см. “Catalogue of Pesticide Formulation Types and International Coding System” Technical Monograph n°2, 5th Edition by CropLife International (2002).
Пестициды чаще всего применяют в виде водных суспензий или эмульсий, приготовленных из концентрированных составов таких пестицидов. Такие растворимые в воде, суспендируемые в воде или эмульгируемые составы представляют собой либо твердые вещества, обычно известные как смачивающиеся порошки или диспергируемые в воде гранулы, либо жидкости, обычно известные как эмульгируемые концентраты или водные суспензии. Смачивающиеся порошки, которые могут быть спрессованы с получением диспергируемых в воде гранул, содержат однородную смесь пестицида, носителя и поверхностно-активных веществ. Концентрация пестицида обычно составляет приблизительно от 10% приблизительно до 90% по массе. Носитель обычно выбирают из аттапульгитовых глин, монтмориллонитовых глин, диатомовых земель или очищенных силикатов. Эффективные поверхностно-активные вещества, составляющие приблизительно от 0,5% приблизительно до 10% от массы смачивающегося порошка, находят среди сульфонированных лигнинов, конденсированных нафталинсульфонатов, нафталинсульфонатов, алкилбензолсульфонатов, алкилсульфатов и неионогенных поверхностно-активных веществ, таких как этиленоксидные аддукты алкилфенолов.
Эмульгируемые концентраты пестицидов содержат подходящую концентрацию пестицида, такую как приблизительно от 50 приблизительно до 500 г на литр жидкости, растворенного в носителе, который представляет собой либо смешиваемый с водой растворитель, либо смесь не смешиваемого с водой органического растворителя и эмульгаторов. Применимые органические растворители включают ароматические вещества, особенно ксилолы и нефтяные фракции, особенно высококипящие нафталиновые и олефиновые нефтяные фракции, такие как обогащенный ароматикой тяжелый лигроин. Также могут быть использованы другие органические растворители, такие как терпеновые растворители, включая производные канифоли, алифатические кетоны, такие как циклогексанон, и сложные спирты, такие как 2-этоксиэтанол. Подходящие эмульгаторы для эмульгируемых концентратов выбирают из общепринятых анионогннных и неионогенных поверхностно-активных веществ.
Водные суспензии содержат суспензии нерастворимых в воде пестицидов, диспергированных в водном носителе в концентрации приблизительно от 5% приблизительно до 50% по массе. Суспензии приготавливают путем тонкого измельчения пестицида и энергичного вмешивания его в носитель, состоящий из воды и поверхностно-активных веществ. Для увеличения плотности и вязкости водного носителя также могут быть добавлены такие ингредиенты, как неорганические соли и синтетические или природные камеди. Часто наиболее эффективным является измельчение и перемешивание пестицида одновременно с приготовлением водной смеси и ее гомогенизация в устройстве, таком как песчаная мельница, шаровая мельница или гомогенизатор поршневого типа.
Пестициды также могут использоваться в виде гранулированных композиций, которые являются особенно применимыми для нанесения на почву. Гранулированные композиции обычно содержат приблизительно от 0,5% приблизительно до 10% по массе пестицида, диспергированного в носителе, который содержит глину или похожее вещество. Такие композиции обычно приготавливают путем растворения пестицида в подходящем растворителе и нанесения его на гранулированный носитель, который был предварительно отформован в частицы подходящего размера в диапазоне приблизительно от 0,5 приблизительно до 3 мм. Такие композиции также могут быть составлены путем приготовления густой массы или пасты из носителя и соединения, и измельчения и высушивания с получением гранулированных частиц желаемого размера.
Содержащие пестицид порошковидные препараты приготавливают путем тщательного перемешивания пестицида в порошковой форме с подходящим порошкообразным сельскохозяйственным носителем, таким как каолиновая глина, грунт вулканической породы и т.п. Порошковидные препараты могут надлежащим образом содержать приблизительно от 1% приблизительно до 10% пестицида. Они могут быть использованы в виде протравки для семян или в виде внекорневой подкормки с использованием опыливателя.
В равной степени практичным является применение пестицида в форме раствора в подходящем органическом растворителе, обычно в нефтяном масле, таком как аэрозольные масла, которые широко используются в сельскохозяйственной химии.
Пестициды также могут быть использованы в форме аэрозольной композиции. В таких композициях пестицид растворяют или диспергируют в носителе, который представляет собой создающую давление смесь пропеллентов. Аэрозольную композицию упаковывают в контейнер, из которого смесь распыляется через распыляющий клапан.
Пестицидные приманки получают при смешении пестицида с пищей или аттрактантом или с обоими. Когда вредители съедают приманку, они также поглощают пестицид. Приманки могут иметь форму гранул, гелей, сыпучих порошков, жидкостей или твердых препаратов. Они могут быть использованы в местах скопления вредителей.
Фумиганты представляют собой пестициды, которые обладают сравнительно высоким давлением паров, и, следовательно, могут существовать в виде газа в концентрациях, достаточных для гибели вредителей в почве или замкнутых пространствах. Токсичность фумиганта пропорциональна его концентрации и длительности воздействия. Они характеризуются хорошей диффузионной способностью и действуют посредством проникновения в дыхательную систему вредителя или всасывания через кутикулу вредителя. Фумиганты применяют для контроля вредителей запасов продовольствия под газонепроницаемыми листами, в герметизированных комнатах или сооружениях или в специальных камерах.
Пестициды могут быть микроинкапсулированы путем суспендирования частиц или капель пестицида в пластиковых полимерах различных типов. Путем изменения химического состава полимера или условий переработки могут быть получены микрокапсулы с различными размерами, значениями растворимости, толщиной стенок и степенями проницаемости. Эти факторы определяют скорость, с которой высвобождается активный ингредиент, что в свою очередь влияет на остаточное действие, скорость действия и запах продукта.
Концентраты масляных растворов приготавливают путем растворения пестицида в растворителе, который будет удерживать пестицид в растворе. Масляные растворы пестицида обычно обеспечивают более быстрый нокдаун-эффект и гибель вредителей, чем другие составы, в связи с тем, что растворители сами по себе обладают пестицидным действием, а растворение воскового покрытия наружного покрова увеличивает скорость всасывания пестицида. Другие преимущества масляных растворов включают улучшенную стабильность при хранении, улучшенное проникновение в трещины и улучшенную адгезию к сальным поверхностям.
Другой вариант осуществления представляет собой эмульсию типа «масло в воде», причем эмульсия содержит масляные капли, каждая из которых снабжена ламеллярным жидкокристаллическим покрытием, и которые диспергированы в водной фазе, причем каждая масляная капля содержит, по меньшей мере, одно соединение, которое является эффективным в сельском хозяйстве, и отдельно покрыта моноламеллярным или олиголамеллярным слоем, содержащим: (1) по меньшей мере, одно неионогенное липофильное поверхностно-активное средство, (2) по меньшей мере, одно неионогенное гидрофильное поверхностно-активное средство и (3) по меньшей мере, одно неионогенное поверхностно-активное средство, причем капли имеют средний диаметр частиц менее 800 нм. Дополнительная информация об этом варианте осуществления раскрыта в публикации патента США 20070027034, опубликованной 1 февраля 2007 года, с патентной заявкой № 11/495228. Для удобства использования этот вариант осуществления будет обозначаться как «OIWE».
Для дополнительной информации см. “Insect Pest Management” 2nd Edition by D. Dent, copyright CAB International (2000). Кроме того, для более детальной информации см. “Handbook of Pest Control - The Behavior, Life History, and Control of Household Pests” by Arnold Mallis, 9th Edition, copyright 2004 by GIE Media Inc.
ДРУГИЕ КОМПОНЕНТЫ СОСТАВА
Как правило, если молекулы, раскрытые в формуле 1, используют в каком-либо составе, то такой состав также может содержать другие компоненты. Эти компоненты включают без ограничения (это неисчерпывающий и невзаимоисключающий список) смачивающие средства, растекатели, клейкие вещества, пенетранты, буферы, секвестранты, средства, снижающие вымывание, агенты совместимости, противовспениватели, очищающие средства и эмульгаторы. Несколько компонентов описаны далее.
Смачивающее средство представляет собой вещество, которое при добавлении к жидкости улучшает растекание или проникающую способность жидкости путем уменьшения поверхностного натяжения между жидкостью и поверхностью, по которой она растекается. Смачивающие средства выполняют в агрохимических составах две основные функции: увеличивают скорость смачивания порошков в воде для приготовления концентратов для растворимых жидкостей или концентратов суспензий в процессе технологической обработки и производства; и снижают время смачивания смачивающихся порошков и улучшают проницаемость воды в диспергируемые в ней гранулы в процессе смешивания продукта с водой в резервуаре опрыскивателя. Примерами смачивающих средств, используемых в составах со смачивающимися порошками, концентратами суспензий и диспергируемыми в воде гранулами, являются: лаурилсульфат натрия; диоксилсульфосукцинат натрия; алкилфенолэтоксилаты; и этоксилаты алифатических спиртов.
Диспергирующее средство представляет собой вещество, которое адсорбируется на поверхности частиц, помогает сохранить частицы в состоянии дисперсии и предохраняет их от повторной агрегации. Диспергирующие средства добавляют в агрохимические составы для облегчения диспергирования и суспендирования в процессе производства, и для обеспечения повторного диспергирования частиц в воде в резервуаре опрыскивателя. Они широко используются в смачивающихся порошках, концентратах суспензий и диспергируемых в воде гранулах. Поверхностно-активные вещества, которые используются в качестве диспергирующих средств, обладают способностью прочно адсорбироваться на поверхности частицы и обеспечивают электростатический или стерический барьер для повторной агрегации частиц. Наиболее широко используемыми поверхностно-активными веществами являются анионогенные, неионогенные или смеси указанных двух типов. Для составов в виде смачивающегося порошка самыми распространенными диспергирующими средствами являются лигносульфонаты натрия. Для концентратов суспензий очень хорошей адсорбции и стабилизации достигают с использованием полиэлектролитов, таких как конденсаты нафталинсульфоната натрия и формальдегида. Также используют тристирилфенолэтоксилат фосфатные эфиры. В качестве диспергирующих средств для концентратов суспензий неионогенные поверхностно-активные вещества, такие как конденсаты алкиларилэтиленоксида и EO-PO блок-сополимеры, иногда сочетают с анионогенными. В последние годы были разработаны новые типы полимерных поверхностно-активных веществ с очень высоким молекулярным весом в качестве диспергирующих средств. Эти вещества имеют очень длинные гидрофобные «остовы» и большое число этиленоксидных цепей, образующих «зубцы» на «гребенке» поверхностно-активного вещества. Эти высокомолекулярные полимеры могут придавать концентратам суспензий очень хорошую долговременную стабильность, так как гидрофобные остовы имеют много точек закрепления на поверхности частиц. Примерами диспергирующих средств, используемых в агрохимических составах, являются: конденсаты нафталинсульфоната натрия и формальдегида; тритирилфенолэтоксилат фосфатные эфиры; этоксилаты алифатических спиртов; алкилэтоксилаты; EO-PO блок-сополимеры; и привитые сополимеры.
Эмульгатор представляет собой вещество, которое стабилизирует суспензию капель одной жидкой фазы в другой жидкой фазе. Без эмульгатора две жидкости будут разделяться на две несмешивающиеся жидкие фазы. Наиболее широко используемые эмульгируемые смеси содержат алкилфенол или алифатический спирт с двенадцатью или более субъединицами этиленоксида и растворимую в масле кальциевую соль додецилбензолсульфоновой кислоты. Диапазон значений гидрофильно-липофильного баланса (HLB) от 8 до 18 будет стандартно обеспечивать хорошие стабильные эмульсии. Стабильность эмульсий иногда можно улучшить путем добавления небольшого количества EO-PO блок-сополимерного поверхностно-активного вещества.
Солюбилизатор представляет собой поверхностно-активное вещество, которое будет образовывать мицеллы в воде при концентрациях выше критической концентрации мицеллообразования. Мицеллы затем способны растворять или солюбилизировать нерастворимые в воде вещества внутри гидрофобной части мицеллы. Типы поверхностно-активных веществ, обычно используемых для солюбилизации, представляют собой неионогенные поверхностно-активные вещества, моноолеаты сорбитана, этоксилаты моноолеатов сорбитана и сложные метилолеатные эфиры.
Поверхностно-активные вещества иногда используют, либо отдельно, либо с другими добавками, такими как минеральные или растительные масла, в качестве адъювантов смесей для опрыскивателя, для улучшения биологического эффекта пестицида на мишень. Типы поверхностно-активных веществ, используемых для биоусиления, как правило, зависят от природы и механизма действия пестицида. Однако, часто это неионогенные поверхностно-активные вещества, такие как алкилэтоксилаты; этоксилаты линейных алифатических спиртов; этоксилаты алифатических аминов.
Носитель или разбавитель в сельскохозяйственном составе представляет собой вещество, добавляемое к пестициду для придания продукту необходимой концентрации. Носители чаще всего представляют собой вещества с высокой абсорбирующей способностью, тогда как разбавители представляют собой вещества с низкой абсорбирующей способностью. Носители и разбавители используют при составлении порошковидных препаратов, смачивающихся порошков, гранул и диспергируемых в воде гранул.
Органические растворители в основном используют при составлении эмульгируемых концентратов, эмульсий типа «масло в воде», суспоэмульсий и ультрамикрообъемных составов, и в меньшей степени в гранулированных составах. Иногда используют смеси растворителей. Первая основная группа растворителей представляет собой алифатические парафиновые масла, такие как керосин или очищенные парафины. Вторая основная группа (и наиболее часто используемая) включает ароматические растворители, такие как ксилол и фракции C9 и C10 ароматических растворителей с более высокой молекулярной массой. Хлорированные углеводороды применимы в качестве сорастворителей для предотвращения кристаллизации пестицидов, когда состав эмульгируют в воде. В качестве сорастворителей иногда используют спирты для увеличения растворяющей способности. Другие растворители могут включать растительные масла, масла из семян и сложные эфиры растительных масел и масел из семян.
Загустители или желирующие средства используют в основном при составлении концентратов суспензий, эмульсий и суспоэмульсий для изменения реологии или свойств текучести жидкости и для предотвращения разделения и осаждения диспергированных частиц или капель. Загустители, желирующие средства и противоосаждающие средства обычно подразделяют на две категории, а именно на нерастворимые в воде твердые частицы и растворимые в воде полимеры. Существует возможность получения концентратов суспензий с использованием глин и кремнеземов. Примеры указанных типов веществ включают без ограничения монтмориллонит, бентонит, алюмосиликат магния и аттапульгит. В течение многих лет в качестве загустителей/желирующих средств использовали растворимые в воде полисахариды. Наиболее широко используемыми типами полисахаридов являются натуральные экстракты семян и морских водорослей или синтетические производные целлюлозы. Примеры указанных типов веществ включают без ограничения гуаровую камедь; камедь бобов рожкового дерева; каррагенан; альгинаты; метилцеллюлозу; карбоксиметилцеллюлозу натрия (SCMC); гидроксиэтилцеллюлозу (HEC). Другие типы противоосаждающих средств основаны на модифицированных крахмалах, полиакрилатах, поливиниловом спирте и полиэтиленоксиде. Другим хорошим противоосаждающим средством является ксантановая камедь.
Микроорганизмы могут служить причиной порчи полученных составов. Поэтому, для устранения или снижения их эффекта используют консерванты. Примеры таких средств включают без ограничения: пропионовую кислоту и ее натриевую соль; сорбиновую кислоту и ее натриевую и калиевую соли; бензойную кислоту и ее натриевую соль; натриевую соль пара-гидроксибензойной кислоты; метил-пара-гидроксибензоат; и 1,2-бензизотиазолин-3-он (BIT).
Присутствие поверхностно-активных веществ часто вызывает образование пены в составах на водной основе в процессе перемешивания при получении и при использовании с помощью распылителя. С целью снижения тенденции к пенообразованию часто добавляют противовспениватели, как на стадии получения, так и перед заполнением флаконов. Как правило, существует два типа противовспенивателей, а именно силиконы и несиликоны. Силиконы обычно представляют собой водные эмульсии диметилполисилоксана, тогда как несиликоновые противовспениватели представляют собой водорастворимые масла, такие как октанол и нонанол, или диоксид кремния. В обоих случаях функцией противовспенивателя является вытеснение поверхностно-активного вещества с границы раздела воздух-вода.
«Зеленые» средства (например, адъюванты, поверхностно-активные вещества, растворители) могут снижать общий масштаб воздействия защитных сельскохозяйственных составов на окружающую среду. Зеленые средства являются биоразлагаемыми и, как правило, производятся из натуральных и/или неистощимых источников, например, из растительных и животных источников. Конкретными примерами являются: растительные масла, масла из семян и их сложные эфиры, а также алкоксилированные алкилполигликозиды.
Для дальнейшей информации см. “Chemistry and Technology of Agrochemical Formulations” edited by D.A. Knowles, copyright 1998 by Kluwer Academic Publishers. Также см. “Insecticides in Agriculture and Environment - Retrospects and Prospects” by A.S. Perry, I. Yamamoto, I. Ishaaya, and R. Perry, copyright 1998 by Springer-Verlag.
ВРЕДИТЕЛИ
В целом, молекулы формулы 1 могут быть использованы для контроля вредителей, например, жуков, уховерток, тараканов, мух, тлей, щитовок, белокрылок, цикадок, муравьев, ос, термитов, мотыльков, бабочек, вшей, кузнечиковых, саранчевых, сверчков, блох, трипсов, щетинохвосток, клещей, иксодовых клещей, нематод и многоножек.
Согласно другому варианту осуществления, молекулы формулы 1 могут быть использованы для контроля вредителей из типа Nematoda и/или Arthropoda.
Согласно другому варианту осуществления, молекулы формулы 1 могут быть использованы для контроля вредителей из подтипа Chelicerata, Myriapoda и/или Hexapoda.
Согласно другому варианту осуществления, молекулы формулы 1 могут быть использованы для контроля вредителей из классов Arachnida, Symphyla и/или Insecta.
Согласно другому варианту осуществления, молекулы формулы 1 могут быть использованы для контроля вредителей из отряда Anoplura. Неисчерпывающий перечень конкретных родов включает без ограничения Haematopinus spp., Hoplopleura spp., Linognathus spp., Pediculus spp. и Polyplax spp. Неисчерпывающий перечень конкретных видов включает без ограничения Haematopinus asini, Haematopinus suis, Linognathus setosus, Linognathus ovillus, Pediculus humanus capitis, Pediculus humanus humanus и Pthirus pubis.
Согласно другому варианту осуществления, молекулы формулы 1 могут быть использованы для контроля вредителей из отряда Coleoptera. Неисчерпывающий перечень конкретных родов включает без ограничения Acanthoscelides spp., Agriotes spp., Anthonomus spp., Apion spp., Apogonia spp., Aulacophora spp., Bruchus spp., Cerosterna spp., Cerotoma spp., Ceutorhynchus spp., Chaetocnema spp., Colaspis spp., Ctenicera spp., Curculio spp., Cyclocephala spp., Diabrotica spp., Hypera spp., Ips spp., Lyctus spp., Megascelis spp., Meligethes spp., Otiorhynchus spp., Pantomorus spp., Phyllophaga spp., Phyllotreta spp., Rhizotrogus spp., Rhynchites spp., Rhynchophorus spp., Scolytus spp., Sphenophorus spp., Sitophilus spp. и Tribolium spp. Неисчерпывающий перечень конкретных видов включает без ограничения Acanthoscelides obtectus, Agrilus planipennis, Anoplophora glabripennis, Anthonomus grandis, Ataenius spretulus, Atomaria linearis, Bothynoderes punctiventris, Bruchus pisorum, Callosobruchus maculatus, Carpophilus hemipterus, Cassida vittata, Cerotoma trifurcata, Ceutorhynchus assimilis, Ceutorhynchus napi, Conoderus scalaris, Conoderus stigmosus, Conotrachelus nenuphar, Cotinis nitida, Crioceris asparagi, Cryptolestes ferrugineus, Cryptolestes pusillus, Cryptolestes turcicus, Cylindrocopturus adspersus, Deporaus marginatus, Dermestes lardarius, Dermestes maculatus, Epilachna varivestis, Faustinus cubae, Hylobius pales, Hypera postica, Hypothenemus hampei, Lasioderma serricorne, Leptinotarsa decemlineata, Liogenys fuscus, Liogenys suturalis, Lissorhoptrus oryzophilus, Maecolaspis joliveti, Melanotus communis, Meligethes aeneus, Melolontha melolontha, Oberea brevis, Oberea linearis, Oryctes rhinoceros, Oryzaephilus mercator, Oryzaephilus surinamensis, Oulema melanopus, Oulema oryzae, Phyllophaga cuyabana, Popillia japonica, Prostephanus truncatus, Rhyzopertha dominica, Sitona lineatus, Sitophilus granarius, Sitophilus oryzae, Sitophilus zeamais, Stegobium paniceum, Tribolium castaneum, Tribolium confusum, Trogoderma variabile и Zabrus tenebrioides.
Согласно другому варианту осуществления, молекулы формулы 1 могут быть использованы для контроля вредителей отряда Dermaptera.
Согласно другому варианту осуществления, молекулы формулы 1 могут быть использованы для контроля вредителей отряда Blattaria. Неисчерпывающий перечень конкретных видов включает без ограничения Blattella germanica, Blatta orientalis, Parcoblatta pennsylvanica, Periplaneta americana, Periplaneta australasiae, Periplaneta brunnea, Periplaneta fuliginosa, Pycnoscelus surinamensis и Supella longipalpa.
Согласно другому варианту осуществления, молекулы формулы 1 могут быть использованы для контроля вредителей отряда Diptera. Неисчерпывающий перечень конкретных родов включает без ограничения Aedes spp., Agromyza spp., Anastrepha spp., Anopheles spp., Bactrocera spp., Ceratitis spp., Chrysops spp., Cochliomyia spp., Contarinia spp., Culex spp., Dasineura spp., Delia spp., Drosophila spp., Fannia spp., Hylemyia spp., Liriomyza spp., Musca spp., Phorbia spp., Tabanus spp. и Tipula spp. Неисчерпывающий перечень конкретных видов включает без ограничения Agromyza frontella, Anastrepha suspensa, Anastrepha ludens, Anastrepha obliqa, Bactrocera cucurbitae, Bactrocera dorsalis, Bactrocera invadens, Bactrocera zonata, Ceratitis capitata, Dasineura brassicae, Delia platura, Fannia canicularis, Fannia scalaris, Gasterophilus intestinalis, Gracillia perseae, Haematobia irritans, Hypoderma lineatum, Liriomyza brassicae, Melophagus ovinus, Musca autumnalis, Musca domestica, Oestrus ovis, Oscinella frit, Pegomya betae, Psila rosae, Rhagoletis cerasi, Rhagoletis pomonella, Rhagoletis mendax, Sitodiplosis mosellana и Stomoxys calcitrans.
Согласно другому варианту осуществления, молекулы формулы 1 могут быть использованы для контроля вредителей отряда Hemiptera. Неисчерпывающий перечень конкретных родов включает без ограничения Adelges spp., Aulacaspis spp., Aphrophora spp., Aphis spp., Bemisia spp., Ceroplastes spp., Chionaspis spp., Chrysomphalus spp., Coccus spp., Empoasca spp., Lepidosaphes spp., Lagynotomus spp., Lygus spp., Macrosiphum spp., Nephotettix spp., Nezara spp., Philaenus spp., Phytocoris spp., Piezodorus spp., Planococcus spp., Pseudococcus spp., Rhopalosiphum spp., Saissetia spp., Therioaphis spp., Toumeyella spp., Toxoptera spp., Trialeurodes spp., Triatoma spp. и Unaspis spp. Неисчерпывающий перечень конкретных видов включает без ограничения Acrosternum hilare, Acyrthosiphon pisum, Aleyrodes proletella, Aleurodicus dispersus, Aleurothrixus floccosus, Amrasca biguttula biguttula, Aonidiella aurantii, Aphis gossypii, Aphis glycines, Aphis pomi, Aulacorthum solani, Bemisia argentifolii, Bemisia tabaci, Blissus leucopterus, Brachycorynella asparagi, Brevennia rehi, Brevicoryne brassicae, Calocoris norvegicus, Ceroplastes rubens, Cimex hemipterus, Cimex lectularius, Dagbertus fasciatus, Dichelops furcatus, Diuraphis noxia, Diaphorina citri, Dysaphis plantaginea, Dysdercus suturellus, Edessa meditabunda, Eriosoma lanigerum, Eurygaster maura, Euschistus heros, Euschistus servus, Helopeltis antonii, Helopeltis theivora, Icerya purchasi, Idioscopus nitidulus, Laodelphax striatellus, Leptocorisa oratorius, Leptocorisa varicornis, Lygus hesperus, Maconellicoccus hirsutus, Macrosiphum euphorbiae, Macrosiphum granarium, Macrosiphum rosae, Macrosteles quadrilineatus, Mahanarva frimbiolata, Metopolophium dirhodum, Mictis longicornis, Myzus persicae, Nephotettix cinctipes, Neurocolpus longiros трис, Nezara viridula, Nilaparvata lugens, Parlatoria pergandii, Parlatoria ziziphi, Peregrinus maidis, Phylloxera vitifoliae, Physokermes piceae, Phytocoris californicus, Phytocoris relativus, Piezodorus guildinii, Poecilocapsus lineatus, Psallus vaccinicola, Pseudacysta perseae, Pseudococcus brevipes, Quadraspidiotus perniciosus, Rhopalosiphum maidis, Rhopalosiphum padi, Saissetia oleae, Scaptocoris castanea, Schizaphis graminum, Sitobion avenae, Sogatella furcifera, Trialeurodes vaporariorum, Trialeurodes abutiloneus, Unaspis yanonensis и Zulia entrerriana.
Согласно другому варианту осуществления, молекулы формулы 1 могут быть использованы для контроля вредителей отряда Hymenoptera. Неисчерпывающий перечень конкретных родов включает без ограничения Acromyrmex spp., Atta spp., Camponotus spp., Diprion spp., Formica spp., Monomorium spp., Neodiprion spp., Pogonomyrmex spp., Polistes spp., Solenopsis spp., Vespula spp. и Xylocopa spp. Неисчерпывающий перечень конкретных видов включает без ограничения Athalia rosae, Atta texana, Iridomyrmex humilis, Monomorium minimum, Monomorium pharaonis, Solenopsis invicta, Solenopsis geminata, Solenopsis molesta, Solenopsis richtery, Solenopsis xyloni и Tapinoma sessile.
Согласно другому варианту осуществления, молекулы формулы 1 могут быть использованы для контроля вредителей отряда Isoptera. Неисчерпывающий перечень конкретных родов включает без ограничения Coptotermes spp., Cornitermes spp., Cryptotermes spp., Heterotermes spp., Kalotermes spp., Incisitermes spp., Macrotermes spp., Marginitermes spp., Microcerotermes spp., Procornitermes spp., Reticulitermes spp., Schedorhinotermes spp. и Zootermopsis spp. Неисчерпывающий перечень конкретных видов включает без ограничения Coptotermes curvignathus, Coptotermes frenchi, Coptotermes formosanus, Heterotermes aureus, Microtermes obesi, Reticulitermes banyulensis, Reticulitermes grassei, Reticulitermes flavipes, Reticulitermes hageni, Reticulitermes hesperus, Reticulitermes santonensis, Reticulitermes speratus, Reticulitermes tibialis и Reticulitermes virginicus.
Согласно другому варианту осуществления, молекулы формулы 1 могут быть использованы для контроля вредителей отряда Lepidoptera. Неисчерпывающий перечень конкретных родов включает без ограничения Adoxophyes spp., Agrotis spp., Argyrotaenia spp., Cacoecia spp., Caloptilia spp., Chilo spp., Chrysodeixis spp., Colias spp., Crambus spp., Diaphania spp., Diatraea spp., Earias spp., Ephestia spp., Epimecis spp., Feltia spp., Gortyna spp., Helicoverpa spp., Heliothis spp., Indarbela spp., Lithocolletis spp., Loxagrotis spp., Malacosoma spp., Peridroma spp., Phyllonorycter spp., Pseudaletia spp., Sesamia spp., Spodoptera spp., Synanthedon spp. и Yponomeuta spp. Неисчерпывающий перечень конкретных видов включает без ограничения Achaea janata, Adoxophyes orana, Agrotis ipsilon, Alabama argillacea, Amorbia cuneana, Amyelois transitella, Anacamptodes defectaria, Anarsia lineatella, Anomis sabulifera, Anticarsia gemmatalis, Archips argyrospila, Archips rosana, Argyrotaenia citrana, Autographa gamma, Bonagota cranaodes, Borbo cinnara, Bucculatrix thurberiella, Capua reticulana, Carposina niponensis, Chlumetia transversa, Choristoneura rosaceana, Cnaphalocrocis medinalis, Conopomorpha cramerella, Cossus cossus, Cydia caryana, Cydia funebrana, Cydia molesta, Cydia nigricana, Cydia pomonella, Darna diducta, Diatraea saccharalis, Diatraea grandiosella, Earias insulana, Earias vittella, Ecdytolopha aurantianum, Elasmopalpus lignosellus, Ephestia cautella, Ephestia elutella, Ephestia kuehniella, Epinotia aporema, Epiphyas postvittana, Erionota thrax, Eupoecilia ambiguella, Euxoa auxiliaris, Grapholita molesta, Hedylepta indicata, Helicoverpa armigera, Helicoverpa zea, Heliothis virescens, Hellula undalis, Keiferia lycopersicella, Leucinodes orbonalis, Leucoptera coffeella, Leucoptera malifoliella, Lobesia botrana, Loxagrotis albicosta, Lymantria dispar, Lyonetia clerkella, Mahasena corbetti, Mamestra brassicae, Maruca testulalis, Metisa plana, Mythimna unipuncta, Neoleucinodes elegantalis, Nymphula depunctalis, Operophtera brumata, Ostrinia nubilalis, Oxydia vesulia, Pandemis cerasana, Pandemis heparana, Papilio demodocus, Pectinophora gossypiella, Peridroma saucia, Perileucoptera coffeella, Phthorimaea operculella, Phyllocnistis citrella, Pieris rapae, Plathypena scabra, Plodia interpunctella, Plutella xylostella, Polychrosis viteana, Prays endocarpa, Prays oleae, Pseudaletia unipuncta, Pseudoplusia includens, Rachiplusia nu, Scirpophaga incertulas, Sesamia inferens, Sesamia nonagrioides, Setora nitens, Sitotroga cerealella, Sparganothis pilleriana, Spodoptera exigua, Spodoptera frugiperda, Spodoptera eridania, Thecla basilides, Tineola bisselliella, Trichoplusia ni, Tuta absoluta, Zeuzera coffeae и Zeuzera pyrina.
Согласно другому варианту осуществления, молекулы формулы 1 могут быть использованы для контроля вредителей отряда Mallophaga. Неисчерпывающий перечень конкретных родов включает без ограничения Anaticola spp., Bovicola spp., Chelopistes spp., Goniodes spp., Menacanthus spp. и Trichodectes spp. Неисчерпывающий перечень конкретных видов включает без ограничения Bovicola bovis, Bovicola caprae, Bovicola ovis, Chelopistes meleagridis, Goniodes dissimilis, Goniodes gigas, Menacanthus stramineus, Menopon gallinae и Trichodectes canis.
Согласно другому варианту осуществления, молекулы формулы 1 могут быть использованы для контроля вредителей отряда Orthoptera. Неисчерпывающий перечень конкретных родов включает без ограничения Melanoplus spp. и Pterophylla spp. Неисчерпывающий перечень конкретных видов включает без ограничения Anabrus simplex, Gryllotalpa africana, Gryllotalpa australis, Gryllotalpa brachyptera, Gryllotalpa hexadactyla, Locusta migratoria, Microcentrum retinerve, Schistocerca gregaria и Scudderia furcata.
Согласно другому варианту осуществления, молекулы формулы 1 могут быть использованы для контроля вредителей отряда Siphonaptera. Неисчерпывающий перечень конкретных видов включает без ограничения Ceratophyllus gallinae, Ceratophyllus niger, Ctenocephalides canis, Ctenocephalides felis и Pulex irritans.
Согласно другому варианту осуществления, молекулы формулы 1 могут быть использованы для контроля вредителей отряда Thysanoptera. Неисчерпывающий перечень конкретных родов включает без ограничения Caliothrips spp., Frankliniella spp., Scirtothrips spp. и Thrips spp. Неисчерпывающий перечень конкретных видов включает без ограничения Frankliniella fusca, Frankliniella occidentalis, Frankliniella schultzei, Frankliniella williamsi, Heliothrips haemorrhoidalis, Rhipiphorothrips cruentatus, Scirtothrips citri, Scirtothrips dorsalis и Taeniothrips rhopalantennalis, Thrips hawaiiensis, Thrips nigropilosus, Thrips orientalis, Thrips tabaci.
Согласно другому варианту осуществления, молекулы формулы 1 могут быть использованы для контроля вредителей отряда Thysanura. Неисчерпывающий перечень конкретных родов включает без ограничения Lepisma spp. и Thermobia spp.
Согласно другому варианту осуществления, молекулы формулы 1 могут быть использованы для контроля вредителей отряда Acarina. Неисчерпывающий перечень конкретных родов включает без ограничения Acarus spp., Aculops spp., Boophilus spp., Demodex spp., Dermacentor spp., Epitrimerus spp., Eriophyes spp., Ixodes spp., Oligonychus spp., Panonychus spp., Rhizoglyphus spp. и Tetranychus spp. Неисчерпывающий перечень конкретных видов включает без ограничения Acarapis woodi, Acarus siro, Aceria mangiferae, Aculops lycopersici, Aculus pelekassi, Aculus schlechtendali, Amblyomma americanum, Brevipalpus obovatus, Brevipalpus phoenicis, Dermacentor variabilis, Dermatophagoides pteronyssinus, Eotetranychus carpini, Notoedres cati, Oligonychus coffeae, Oligonychus ilicis, Panonychus citri, Panonychus ulmi, Phyllocoptruta oleivora, Polyphagotarsonemus latus, Rhipicephalus sanguineus, Sarcoptes scabiei, Tegolophus perseaflorae, Tetranychus urticae и Varroa destructor.
Согласно другому варианту осуществления, молекулы формулы 1 могут быть использованы для контроля вредителя отряда Symphyla. Неисчерпывающий перечень конкретных видов включает без ограничения Scutigerella immaculata.
Согласно другому варианту осуществления, молекулы формулы 1 могут быть использованы для контроля вредителей типа Nematoda. Неисчерпывающий перечень конкретных родов включает без ограничения Aphelenchoides spp., Belonolaimus spp., Criconemella spp., Ditylenchus spp., Heterodera spp., Hirschmanniella spp., Hoplolaimus spp., Meloidogyne spp., Pratylenchus spp. и Radopholus spp. Неисчерпывающий перечень конкретных видов включает без ограничения Dirofilaria immitis, Heterodera zeae, Meloidogyne incognita, Meloidogyne javanica, Onchocerca volvulus, Radopholus similis и Rotylenchulus reniformis.
Для дополнительной информации см. “Handbook of Pest Control - The Behavior, Life History, and Control of Household Pests” by Arnold Mallis, 9th Edition, copyright 2004 by GIE Media Inc.
ВНЕСЕНИЯ
Для обеспечения контроля молекулы формулы 1, как правило, применяют в количествах приблизительно от 0,01 г на гектар приблизительно до 5000 г на гектар. Обычно предпочтительными являются количества приблизительно от 0,1 г на гектар приблизительно до 500 г на гектар, а более предпочтительными являются количества приблизительно от 1 г на гектар приблизительно до 50 г на гектар.
Площадью, на которую наносится молекула формулы 1, может служить любая площадь, заселенная (или предположительно заселенная или пересекаемая) вредителем, например: на которой выращиваются сельскохозяйственные культуры, деревья, фруктовые культуры, зерновые культуры, виды кормовых растений, сорта винограда, газонные и декоративные растения; на которой живут одомашненные животные; внутренние или внешние поверхности зданий (таких как помещения для хранения зерна), материалы конструкций, применяемые в строительстве (такие как пропитанная древесина), и почва вокруг зданий. Конкретные возделываемые посевные площади, на которых применяется молекула формулы 1, предусматривают площади, на которых будут высажены яблони, кукуруза, подсолнечник, хлопчатник, соя, канола, пшеница, рис, сорго, ячмень, овес, картофель, апельсины, люцерна, латук, земляника, томаты, перец, крестоцветные, груши, табак, миндаль, сахарная свекла, фасоль и другие ценные культурные растения или их семена. Также выгодно при выращивании различных растений с молекулой формулы 1 применять сульфат аммония.
Контроль вредителей в общих чертах означает, что на площади снижаются популяции насекомых, активность вредителей или оба показателя. Это может происходить в таких случаях: популяции насекомых отпугиваются от площади; вредители являются неспособными к размножению на площади или вокруг нее; или вредители уничтожаются, полностью или частично, на площади или вокруг нее. Разумеется, может наблюдаться комбинация этих результатов. Как правило, популяции вредителей, активность или оба показателя желательно снижать более чем на пятьдесят процентов, предпочтительно более чем на 90 процентов. Как правило, площадь не является площадью внутри организма человека или на его поверхности; следовательно, участком обычно является отличная от человеческого организма площадь.
Молекулы формулы 1 могут быть использованы в смесях, наноситься одновременно или последовательно, отдельно или с другими соединениями для усиления мощности растения (например, для роста лучшей корневой системы, для лучшего противостояния стрессовым условиям выращивания). Такими другими соединениями являются, например, соединения, которые модулируют этиленовые рецепторы растений, особенно 1-метилциклопропен (так же известный, как 1-MCP). Кроме того, такие молекулы могут быть использованы в периоды, когда активность вредителей низкая, например, до того, как выращиваемые растения начинают давать ценное сельскохозяйственное сырье. Такие периоды включают ранний сезон посадки, когда нагрузка вредителей обычно низкая.
Молекулы формулы 1 для контроля вредителей могут быть нанесены на листву и плодоносящие участки растений. Либо молекулы будут вступать в непосредственный контакт с вредителем, либо вредитель будет поглощать пестицид, поедая листву, плодовую массу или выделяющийся сок, который содержит пестицид. Молекулы формулы 1 также могут быть внесены в почву, и при внесении таким способом можно контролировать поедающих корень и стебель вредителей. Корни могут всасывать молекулу и передавать ее в листовые участки растения, при этом будут контролироваться наземные грызущие и питающиеся соком вредители.
Что касается приманок, то они, как правило, размещаются на почве, где, например, термиты могут вступать в контакт с приманкой и/или могут быть привлечены ею. Приманки также могут быть нанесены на поверхность здания (горизонтальную, вертикальную или наклонную поверхность), где, например, муравьи, термиты, тараканы и мухи могут вступать в контакт с приманкой и/или могут быть привлечены ею. Приманки могут содержать молекулу формулы 1.
Молекулы формулы 1 могут быть заключены внутрь или помещены на поверхность капсулы. Размер капсул может варьировать от нанометрового размера (приблизительно 100-900 нм в диаметре) до микрометрового размера (приблизительно 10-900 мкм в диаметре).
Из-за уникальной способности яиц некоторых вредителей быть устойчивыми к некоторым пестицидам, для контроля заново появившихся личинок могут понадобиться повторные внесения молекул формулы 1.
Системное перемещение пестицидов в растениях могут быть использованы для контроля вредителей на одной части растения путем нанесения (например, с помощью опрыскивания площади) молекул формулы 1 на другую часть растения. Например, контроль питающихся листьями насекомых может быть достигнут путем капельного орошения или внесения в борозды, путем обработки почвы, например, допосевным или послепосевным пропитыванием почвы, или путем обработки семян растения перед посевом.
Обработка семян может быть применена для всех типов семян, в том числе семян, из которых прорастут растения, генномодифицированные для экспрессии специальных признаков. Типичные примеры включают семена, экспрессирующие белки, токсичные для беспозвоночных вредителей, например, токсин Bacillus thuringiensis или другие инсектицидные токсины, семена, проявляющие устойчивость к гербицидам, например, устойчивые к гербициду раундап семена, или семена с «упакованными» чужеродными генами, экспрессирующие инсектицидные токсины, устойчивость к гербицидам, усиление усвоения питательных веществ, засухоустойчивость или какие-либо другие полезные признаки. Кроме того, такие обработки семян молекулами формулы 1 дополнительно могут улучшать способность растения к лучшему противостоянию стрессовым условиям выращивания. Это обеспечивает жизнеспособное, более сильное растение, которое в период сбора урожая может дать более высокие урожаи. Как правило, считается, что количества приблизительно от 1 г молекул формулы 1 приблизительно до 500 г на 100000 семян обеспечивают хороший эффект, считается, что количества приблизительно от 10 г приблизительно до 100 г на 100000 семян обеспечивают бóльший эффект, и считается, что количества приблизительно от 25 г приблизительно до 75 г на 100000 семян обеспечат еще бóльший эффект.
Должно быть совершенно очевидно, что молекулы формулы 1 могут быть использованы на растениях, в растениях или вокруг растений, генномодифицированных для экспрессии специальных признаков, например, токсинов Bacillus thuringiensis или других инсектицидных токсинов, или растений, экспрессирующих устойчивость к гербицидам, или растений с «упакованными» чужеродными генами, экспрессирующих инсектицидные токсины, устойчивость к гербицидам, усиление усвоения питательных веществ, засухоустойчивость или какие-либо другие полезные признаки.
Молекулы формулы 1 могут быть использованы для контроля эндопаразитов и эктопаразитов в области ветеринарной медицины или в области содержания отличных от человека животных. Молекулы формулы 1 применяют, например, путем перорального введения, например, в форме таблеток, капсул, напитков, гранул, накожных аппликаций, например, в форме погружения, распыления, наливания, точечного нанесения и опудривания, а также путем парентерального введения, например, в форме инъекции.
Молекулы формулы 1 также могут успешно использоваться при содержании сельскохозяйственных животных, например, крупного рогатого скота, овец, свиней, кур и гусей. Они также могут успешно использоваться для домашних животных, таких как, лошади, собаки и кошки. Особенно подлежат контролю блохи и иксодовые клещи, которые докучают таким животным. Приемлемые составы вводят животным перорально с питьевой водой или кормом. Дозировки и составы, которые являются приемлемыми, зависят от видов.
Молекулы формулы 1 также могут быть использованы для контроля у вышеперечисленных животных паразитических червей, особенно в кишечнике.
Молекулы формулы 1 также могут применяться в терапевтических методах оказания медицинской помощи человеку. Такие методы предусматривают без ограничения пероральное введение, например, в форме таблеток, капсул, напитков, гранул, а также накожных аппликаций.
По всему миру вредители мигрируют в новую (для такого вредителя) окружающую среду и становятся после этого новыми инвазивными видами в этой новой окружающей среде. Молекулы формулы 1 также могут быть использованы на таких новых инвазивных видах для их контроля в этой новой окружающей среде.
Молекулы формулы 1 также могут быть использованы на площади, на которой выращиваются растения, такие как культурные растения, (например, до посева, в период посева, до сбора урожая), и на которой наблюдаются низкие уровни (даже без фактического присутствия) вредителей, которые могут наносить таким растениям коммерческий ущерб. Применение этих молекул на такой площади приносит пользу растениям, выращиваемым на площади. Такая польза может включать без ограничения улучшение жизнеспособности растения, увеличение урожая с растения (например, повышенная биомасса и/или повышенное содержание ценных ингредиентов), улучшение мощности растения (например, улучшенный рост растения и/или более зеленая листва), улучшение качества растения (например, улучшенное содержание или композиция определенных ингредиентов) и улучшение выносливости растения к абиотическому и/или биотическому стрессу.
До того как пестицид может быть использован или продан в коммерческом масштабе, такой пестицид подлежит длительным процессам оценки различными государственными органами (местными, региональными, государственными, национальными и международными). Многочисленные требования к данным определяются контролирующими органами и должны учитываться при получении и предоставлении данных регистрантом продукта или третьей стороной, действующей от имени регистранта продукта, часто с использованием компьютера с подключением к Всемирной паутине. Затем, эти государственные органы рассматривают такие данные и, если имеется заключение о безопасности, предоставляют подтверждение регистрации продукта потенциальному потребителю или продавцу. После этого такой потребитель или продавец может использовать этот пестицид в той местности, где регистрация продукта разрешается и предоставляется.
Молекула формулы 1 может быть протестирована для определения ее эффективности против вредителей. Кроме того, для определения, обладает ли указанная молекула механизмом действия, отличным от такового у других пестицидов, могут быть проведены исследования механизма действия. Затем эти полученные данные могут быть предоставлены третьим сторонам, например, с помощью Интернета.
Заголовки в настоящем документе предоставляются исключительно для удобства, и не должны использоваться для интерпретации какой-либо части настоящего документа.
Реферат
Изобретение относится к сельскому хозяйству. Пестицидная композиция содержит молекулу со следующей формулой:,гдеА представляет собой либо, либо.Изобретение позволяет эффективно бороться с вредителями, эндопаразитами, эктопаразитами и усилить жизнестойкость растений. 4 н. и 59 з.п. ф-лы, 4 табл., 78 пр.
Формула

где
(a) А представляет собой либо


(b) R1 представляет собой Н, F, Cl, Br, I, CN, NO2, замещенный или незамещенный C1-C6алкил, замещенный или незамещенный C2-C6алкенил, замещенный или незамещенный C1-C6алкокси, замещенный или незамещенный C2-C6алкенилокси, замещенный или незамещенный C3-C10циклоалкил, замещенный или незамещенный C3-C10циклоалкенил, замещенный или незамещенный C6-C20арил, замещенный или незамещенный C1-C20гетероциклил, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)С(=X1)R9, SR9, S(O)nOR9, S(O)nN(R9)2 или R9S(O)nR9, причем каждый указанный R1, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-C6алкила, C2-C6алкенила, C1-C6галогеналкила, С2-С6галогеналкенила, С1-С6галогеналкилокси, С2-С6галогеналкенилокси, C3-C10циклоалкила, C3-C10циклоалкенила, C3-C10галогенциклоалкила, C3-C10галогенциклоалкенила, OR9, S(O)nOR9, С6-С20арила или C1-С20гетероциклила (каждый из которых, возможный к замещению, может быть необязательно замещен R9);
(c) R2 представляет собой Н, F, Cl, Br, I, CN, NO2, замещенный или незамещенный С1-С6алкил, замещенный или незамещенный С2-С6алкенил, замещенный или незамещенный С1-С6алкокси, замещенный или незамещенный С2-С6алкенилокси, замещенный или незамещенный С3-С10циклоалкил, замещенный или незамещенный C3-C10циклоалкенил, замещенный или незамещенный С6-С20арил, замещенный или незамещенный С1-С20гетероциклил, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)С(=X1)R9, SR9, S(O)nOR9 или R9S(O)nR9,
причем каждый указанный R2, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, С1-С6алкила, С2-С6алкенила, С1-С6галогеналкила, С2-С6галогеналкенила, С1-С6галогеналкилокси, С2-С6галогеналкенилокси, C3-C10циклоалкила, C3-C10циклоалкенила, C3-C10галогенциклоалкила, C3-C10галогенциклоалкенила, OR9, S(O)nOR9, С6-С20арила или С1-С20гетероциклила (каждый из которых, возможный к замещению, может быть необязательно замещен R9);
(d) R3 представляет собой Н, F, Cl, Br, I, CN, NO2, замещенный или незамещенный С1-С6алкил, замещенный или незамещенный С2-С6алкенил, замещенный или незамещенный C1-С6алкокси, замещенный или незамещенный С2-С6алкенилокси, замещенный или незамещенный C3-C10циклоалкил, замещенный или незамещенный C3-C10циклоалкенил, замещенный или незамещенный С6-С20арил, замещенный или незамещенный С1-С20гетероциклил, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)С(=X1)R9, SR9, S(O)nOR9 или R9S(O)nR9,
причем каждый указанный R3, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-С6алкила, С2-С6алкенила, С1-С6галогеналкила, С2-С6галогеналкенила, С1-С6галогеналкилокси, С2-С6галогеналкенилокси, C3-C10циклоалкила, C3-C10циклоалкенила, C3-C10галогенциклоалкила, C3-C10галогенциклоалкенила, OR9, S(O)nOR9, С6-С20арила или С1-С20гетероциклила (каждый из которых, возможный к замещению, может быть необязательно замещен R9);
(е) если А представляет собой
(1) А1, то А1 представляет собой либо
(a) A11

где R4 представляет собой Н, NO2, замещенный или незамещенный С1-С6алкил, замещенный или незамещенный С2-С6алкенил, замещенный или незамещенный С1-С6алкокси, замещенный или незамещенный C3-C10циклоалкил, замещенный или незамещенный С3-C10циклоалкенил, замещенный или незамещенный С6-С20арил, замещенный или незамещенный С1-С20гетероциклил, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)С(=X1)R9, S(O)nOR9 или R9S(O)nR9,
причем каждый указанный R4, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-С6алкила, С2-С6алкенила, С1-С6галогеналкила, С2-С6галогеналкенила, С1-С6галогеналкилокси, С2-С6галогеналкенилокси, C3-C10циклоалкила, C3-C10циклоалкенила, С3-С10галогенциклоалкила, С3-С10галогенциклоалкенила, OR9, S(O)nOR9, С6-С20арила или C1-С20гетероциклила (каждый из которых, возможный к замещению, может быть необязательно замещен R9), либо
(b) А12

где R4 представляет собой С1-С6алкил,
(2) А2, то R4 представляет собой Н, F, Cl, Br, I, CN, NO2, замещенный или незамещенный С1-С6алкил, замещенный или незамещенный С2-С6алкенил, замещенный или незамещенный C1-С6алкокси, замещенный или незамещенный С2-С6алкенилокси, замещенный или незамещенный C3-C10циклоалкил, замещенный или незамещенный C3-C10циклоалкенил, замещенный или незамещенный С6-С20арил, замещенный или незамещенный С1-С20гетероциклил, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)С(=X1)R9, SR9, S(O)nOR9 или R9S(O)nR9,
причем каждый указанный R4, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-С6алкила, С2-С6алкенила, С1-С6галогеналкила, С2-С6галогеналкенила, C1-С6галогеналкилокси, С2-С6галогеналкенилокси, С3-С10циклоалкила, C3-C10циклоалкенила, C3-C10галогенциклоалкила, C3-C10галогенциклоалкенила, OR9, S(O)nOR9, С6-С20арила или С1-С20гетероциклила (каждый из которых, возможный к замещению, может быть необязательно замещен R9);
(f) R5 представляет собой Н, F, Cl, Br, I, CN, NO2, замещенный или незамещенный С1-С6алкил, замещенный или незамещенный С2-С6алкенил, замещенный или незамещенный C1-С6алкокси, замещенный или незамещенный С2-С6алкенилокси, замещенный или незамещенный C3-C10циклоалкил, замещенный или незамещенный C3-C10циклоалкенил, замещенный или незамещенный С6-С20арил, OR9, C(=X1)R9, C(=X1)0R9, С(=Х1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, SR9, S(O)nOR9 или R9S(O)nR9,
причем каждый указанный R5, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, С1-С6алкила, С2-С6алкенила, С1-С6галогеналкила, С2-С6галогеналкенила, C1-С6галогеналкилокси, С2-С6галогеналкенилокси, C3-C10циклоалкила, C3-C10циклоалкенила, C3-C10галогенциклоалкила, C3-C10галогенциклоалкенила, OR9, S(O)nOR9 или С6-С20арила (каждый из которых, возможный к замещению, может быть необязательно замещен R9);
(g)
(1) если А представляет собой А1, то R6 представляет собой замещенный или незамещенный С1-С6алкил, замещенный или незамещенный С2-С6алкенил, замещенный или незамещенный C1-С6алкокси, замещенный или незамещенный С2-С6алкенилокси, замещенный или незамещенный C3-C10циклоалкил, замещенный или незамещенный C3-C10циклоалкенил, замещенный или незамещенный С6-С20арил, замещенный или незамещенный С1-С20гетероциклил, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)С(=X1)R9, SR9, S(O)nOR9, R9S(O)nR9, С1-С6алкилС6-С20арил (где алкил и арил независимо могут быть замещенными или незамещенными), C(=X2)R9, C(=X1)X2R9, R9X2C(=X1)R9, R9X2R9, С(=O)(С1-С6алкил)S(О)n(C1-С6алкил), С(=O)(С1-С6алкил)С(=O)О(С1-С6алкил), (С1-С6алкил)ОС(=O)(С6-С20арил), (С1-С6алкил)ОС(=O)(С1-С6алкил), C1-С6алкил-(C3-C10циклогалогеналкил) или (С1-С6алкенил)С(=O)О(С1-С6алкил) или R9X2C(=Х1)X2R9,
причем каждый указанный R6, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, С1-С6алкила, С2-С6алкенила, С1-С6галогеналкила, С2-С6галогеналкенила, C1-С6галогеналкилокси, С2-С6галогеналкенилокси, C3-C10циклоалкила, C3-C10циклоалкенила, С3-С10галогенциклоалкила, С3-С10галогенциклоалкенила, OR9, S(O)nOR9, С6-С20арила или С1-С20гетероциклила, R9apилa (каждый из которых, возможный к замещению, может быть необязательно замещен R9),
необязательно R6 и R8 могут быть соединены в циклическую структуру, причем такая циклическая структура, соединяющая R6 и R8, может необязательно содержать один или несколько гетероатомов, выбранных из О, S, или N, и
(2) если А представляет собой А2, то R6 представляет собой Н, замещенный или незамещенный С1-С6алкил, замещенный или незамещенный С2-С6алкенил, замещенный или незамещенный C1-С6алкокси, замещенный или незамещенный С2-С6алкенилокси, замещенный или незамещенный C3-C10циклоалкил, замещенный или незамещенный C3-C10циклоалкенил, замещенный или незамещенный С6-С20арил, замещенный или незамещенный С1-С20гетероциклил, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)С(=X1)R9, SR9, S(O)nOR9, R9S(O)nR9, С1-С6алкил С6-С20арил (причем алкил и арил независимо могут быть замещенными или незамещенными), C(=X2)R9, C(=X1)X2R9, R9X2C(=X1)R9, R9X2R9, С(=O)(С1-С6алкил)S(О)n(C1-С6алкил), С(=O)(С1-С6алкил)С(=O)О(С1-С6алкил), (C1-С6алкил)ОС(=O)(С6-С20арил), (С1-С6алкил)ОС(=O)(С1-С6алкил), C1-С6алкил-(C3-C10циклогалогеналкил) или (С1-С6алкенил)С(=O)О(С1-С6алкил) или R9X2C(=Х1)X2R9,
причем каждый указанный R6, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, С1-С6алкила, С2-С6алкенила, С1-С6галогеналкила, С2-С6галогеналкенила, С1-С6галогеналкилокси, С2-С6галогеналкенилокси, C3-C10циклоалкила, C3-C10циклоалкенила, С3-С10галогенциклоалкила, С3-С10галогенциклоалкенила, OR9, S(O)nOR9, С6-С20арила или C1-С20гетероциклила, R9apилa, (каждый из которых, возможный к замещению, может быть необязательно замещен R9),
необязательно R6 и R8 могут быть соединены в циклическую структуру, причем такая циклическая структура, соединяющая R6 и R8, может необязательно содержать один или несколько гетероатомов, выбранных из О, S, или N;
(h) R7 представляет собой О, S, NR9 или NOR9;
(i) R8 представляет собой замещенный или незамещенный С1-С6алкил, замещенный или незамещенный С2-С6алкенил, замещенный или незамещенный С1-С6алкокси, замещенный или незамещенный С2-С6алкенилокси, замещенный или незамещенный C3-C10циклоалкил, замещенный или незамещенный C3-C10циклоалкенил, замещенный или незамещенный С6-С20арил, замещенный или незамещенный С1-С20гетероциклил OR9, OR9S(O)nR9, C(=X1)R9, C(=X1)OR9, R9C(=X1)OR9, R9X2C(=X1)R9X2R9, С(=X1)N(R9)2, N(R9)2, N(R9)(R9S(O)nR9), N(R9)С(=X1)R9, SR9, S(O)nOR9, R9S(O)nR9 или R9S(O)n(NZ)R9,
причем каждый указанный R8, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, С1-С6алкила, С2-С6алкенила, С1-С6галогеналкила, С2-С6галогеналкенила, C1-С6галогеналкилокси, С2-С6галогеналкенилокси, C3-C10циклоалкила, C3-C10циклоалкенила, С3-С10галогенциклоалкила, С3-С10галогенциклоалкенила, N(R9)S(О)nR9, оксо, OR9, S(O)nOR9, R9S(O)nR9, S(O)nR9, С6-С20арила или С1-С20гетероциклила (каждый из которых, возможный к замещению, может быть необязательно замещен R9);
(j) R9 (каждый независимо) представляет собой Н, CN, замещенный или незамещенный С1-С6алкил, замещенный или незамещенный С2-С6алкенил, замещенный или незамещенный С1-С6алкокси, замещенный или незамещенный С2-С6алкенилокси, замещенный или незамещенный C3-C10циклоалкил, замещенный или незамещенный C3-C10циклоалкенил, замещенный или незамещенный С6-С20арил, замещенный или незамещенный С1-С20гетероциклил, S(O)nC1-С6алкил, N(C1-С6алкил)2, причем каждый указанный R9, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, С1-С6алкила, С2-С6алкенила, С1-С6галогеналкила, С2-С6галогеналкенила, C1-С6галогеналкилокси, С2-С6галогеналкенилокси, C3-C10циклоалкила, C3-C10циклоалкенила, С3-С10галогенциклоалкила, С3-С10галогенциклоалкенила, ОС1-С6алкила, OC1-С6галогеналкила, S(О)nС1-С6алкила, S(О)nOC1-С6алкила, С6-С20арила или С1-С20гетероциклила;
(k) n равно 0, 1 или 2;
(l) X представляет собой N или CRn1, где Rn1 представляет собой Н, F, Cl, Br, I, CN, NO2, замещенный или незамещенный С1-С6алкил, замещенный или незамещенный С2-С6алкенил, замещенный или незамещенный С1-С6алкокси, замещенный или незамещенный С2-С6алкенилокси, замещенный или незамещенный C3-C10циклоалкил, замещенный или незамещенный С3-С10циклоалкенил, замещенный или незамещенный С6-С20арил, замещенный или незамещенный С1-С20гетероциклил, OR9, C(=X1)R9, C(=X1)OR9, С(=Х1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, SR9, S(O)nR9, S(O)nOR9 или R9S(O)nR9,
причем каждый указанный Rn1, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, С1-С6алкила, С2-С6алкенила, C1-С6галогеналкила, С2-С6галогеналкенила, С1-С6галогеналкилокси, С2-С6галогеналкенилокси, С3-С10циклоалкила, C3-C10циклоалкенила, С3-С10галогенциклоалкила, С3-С10галогенциклоалкенила, OR9, S(O)nOR9, С6-С20арила или С1-С20гетероциклила (каждый из которых, возможный к замещению, может быть необязательно замещен R9);
(m) X1 (каждый независимо) представляет собой О или S;
(n) X2 (каждый независимо) представляет собой О, S, =NR9 или =NOR9; и
(o) Z представляет собой CN, NO2, С1-С6алкил(R9), C(=X1)N(R9)2; и
(p) при следующих условиях:
(1) что R6 и R8 не могут оба представлять собой С(=O)СН3,
(2) что если А1 представляет собой A11, то R6 и R8 вместе не образуют конденсированные кольцевые системы,
(3) что R6 и R8 не соединены в циклическую структуру только с -СН2-,
(4) что если А представляет собой А2, то R5 не представляет собой С(=O)ОН,
(5) что если А представляет собой А2, и R6 представляет собой Н, то R8 не представляет собой -(С1-С6алкил)-О-(замещенный арил), и
(6) что если А представляет собой А2, то R6 не представляет собой -(С1алкил)(замещенный арил),
и носитель или разбавитель.

(a) одно или несколько соединений, обладающих акарицидным, альгицидным, авицидным, бактерицидным, фунгицидным, гербицидным, инсектицидным, моллюскоцидным, нематоцидным, родентицидным или вироцидным свойствами; или
(b) одно или несколько соединений, которые являются антифидингами, средствами отпугивания птиц, химическими стерилизаторами, гербицидными антидотами, аттрактантами для насекомых, средствами отпугивания насекомых, средствами отпугивания млекопитающих, средствами нарушения спаривания, активаторами растений, регуляторами роста растений или синергистами; или
(c) и (a) и (b).
(a) 3-(4-хлор-2,6-диметилфенил)-4-гидрокси-8-окса-1-азаспиро[4,5]дец-3-ен-2-он;
(b) 3-(4′-хлор-2,4-диметил[1,1′-бифенил]-3-ил)-4-гидрокси-8-окса-1-азаспиро[4,5]дец-3-ен-2-он;
(c) 4-[[(6-хлор-3-пиридинил)метил]метиламино]-2(5Н)-фуранон;
(d) 4-[[(6-хлор-3-пиридинил)метил]циклопропиламино]-2(5Н)-фуранон;
(e) 3-хлор-N2-[(1S)-1-метил-2-(метилсульфонил)этил]-N1-[2-метил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]-1,2-бензолдикарбоксамид;
(f) 2-циано-N-этил-4-фтор-3-метоксибензолсульфонамид;
(g) 2-циано-N-этил-3-метоксибензолсульфонамид;
(h) 2-циано-3- дифторметокси-N-этил-4-фторбензолсульфонамид;
(i) 2-циано-3-фторметокси-N-этилбензолсульфонамид;
(j) 2-циано-6-фтор-3-метокси-N,N-диметилбензолсульфонамид;
(k) 2-циано-N-этил-6-фтор-3-метокси-N-метилбензолсульфонамид;
(l) 2-циано-3-дифторметокси-N,N-диметилбензолсульфонамид;
(m) 3-(дифторметил)-N-[2-(3,3-диметилбутил)фенил]-1-метил-1Н-пиразол-4-карбоксамид;
(n) N-этил-2,2-диметилпропионамид-2-(2,6-дихлор-α,α,α-трифтор-пара-толил)гидразон;
(о) N-этил-2,2-дихлор-1-метилциклопропанкарбоксамид-2-(2,6-дихлор-α,α,α-трифтор-пара-толил)гидразонникотин;
(р) О-{(Е-)-[2-(4-хлорфенил)-2-циано-1-(2-трифторметилфенил)винил]}-S-метилтиокарбонат;
(q) (Е)-N1-[(2-хлор-1,3-тиазол-5-илметил)]-N2-циано-N1-метилацетамидин;
(r) 1-(6-хлорпиридин-3-илметил)-7-метил-8-нитро-1,2,3,5,6,7-гексагидроимидазо[1,2-а]пиридин-5-ол;
(s) 4-[4-хлорфенил-(2-бутилидингидразоно)метил)]фенилмезилат; и
(t) N-этил-2,2-дихлор-1-метилциклопропанкарбоксамид-2-(2,6-дихлор-α,α,α-трифтор-пара-толил)гидразон.
56 Способ по п. 49, где упомянутое количество составляет от 0,01 г/га до 5000 г/га.

Комментарии