Пакетированное событие 8264.44.06.1 с устойчивостью к гербицидам, связанные трансгенные линии сои и их детектирование - RU2608650C2
Код документа: RU2608650C2
Чертежи







































Описание
УРОВЕНЬ ТЕХНИКИ, ПРЕДШЕСТВУЮЩИЙ ИЗОБРЕТЕНИЮ
Глифосат (N-фосфонометилглицин), гербицид широкого спектра, ингибирует 5-энолпирувилшикимат-3-фосфатсинтазу (EPSPS), фермент шикиматного пути биосинтеза, который синтезирует незаменимые ароматические аминокислоты в растительных клетках. Ингибирование EPSPS эффективно нарушает синтез белка и тем самым, убивает пораженные растительные клетки. Поскольку глифосат является неселективным, он убивает как сорняки, так и сельскохозяйственные культуры. Таким образом, его можно применять для сельскохозяйственных культур только в том случае, если сельскохозяйственным культурам можно придать устойчивость к глифосату, которая позволит желаемым растениям выжить при воздействии глифосата.
Технологию рекомбинантных ДНК применяли для изоляции мутантных EPSP синтаз, устойчивых к глифосату. Такие устойчивые к глифосату мутантные EPSP-синтазы можно трансформировать в растения и передавать устойчивость к глифосату трансформированным растениям. В качестве примера, ген устойчивости к глифосату выделяли из штамма Agrobacterium CP4, как описано в патенте США № 5633435. Эта ссылка и все цитируемые в настоящем документе ссылки включены в документ в качестве ссылки.
Другие гены устойчивости к глифосату были созданы посредством введения мутаций. Они включают ген AroA, изолированный Comai и описанный в патентах США №№ 5094945, 4769061 и 4535060. Одну мутацию вводили, как описано в патенте США № 5310667, посредством замены остатка аланина на остаток глицина между аминокислотными позициями 80 и 120. Две мутации вводили, как описано в патентах США №№ 6225114 и 5866775, в которых, в дополнение к указанной выше мутации, вводили вторую мутацию (замена остатка треонина на остаток аланина между позициями 170 и 210) в ген EPSPS дикого типа.
В других работах получали устойчивую к глифосату кукурузу, посредством введения модифицированного гена EPSPS кукурузы, несущего мутации остатка 102 (замена треонина на изолейцин) и остатка 106 (замена пролина на серин) аминокислотной последовательности, с номером доступа GeneBank X63374. См. патенты США №№ 6566587 и 6040497.
Примеры событий, обеспечивающих устойчивость к глифосату у сои, включают линию сои GTS 40-3-2 (Padgette et al. 1995), событие соя MON89788 (патент США № 7608761), патент США № 7608761, который относится к событию соя MON89788, каждое из которых было получено посредством вставки гена cp4 epsps в сою.
Повсеместное внедрение устойчивой к глифосату системы выращивания сельскохозяйственных культур и возрастающее применение глифосата способствовало распространению устойчивых к глифосату и трудных для контроля сорняков в последние годы. В регионах, где фермеры сталкиваются с устойчивыми к глифосату сорняками или со сдвигом в сторону более трудных для контроля видов сорняков, фермеры могут компенсировать недостатки глифосата баковыми смесями или чередованием с другими гербицидами, которые помогают бороться с пропущенными сорняками.
Широко используемым и эффективным компонентом баковой смеси для борьбы с широколиственными сорняками во многих случаях является 2,4-дихлорфеноксиуксусная кислота (2,4-D). 2,4-D, которую используют в качестве гербицида в течение более 60 лет, представляет собой послевсходовый гербицид с широким спектром для борьбы с многими однолетними, двухлетними, и многолетними широколиственными сорняками, включая несколько ключевых сорняков кукурузы, сои и хлопка. Ключевые сорняки, которые контролирует 2,4-D (расход 560-1120 г кэ/га) при выращивании пропашных культур, включают Ambrosia artemisiifolia, Ambrosia trifida, Xanthium strumarium, Chenopodium album, Helianthus annuus, Ipomoea sp., Abutilon theophrasti, Conyza Canadensis и Senna obtusifolia. 2,4-D обеспечивает частичный контроль нескольких ключевых сорняков, включая Polygonium pensylvanicum, Polygonium persicaria, Cirsium arvense, Taraxacum officinale и Amaranthus sp., включая Amaranthus rudis и Amaranthus palmeri.
Ограничение для дальнейшего применения 2,4-D заключается в том, что ее селективность в отношении двудольных сельскохозяйственных растений, таких как соя или хлопок, очень низкая, и, таким образом 2,4-D, как правило, не применяют для (и, как правило, не применяют возле) чувствительных двудольных сельскохозяйственных растений. Кроме того, применение 2,4-D для травянистых сельскохозяйственных растений отчасти ограничено природой повреждений, которые могут возникать у растений. 2,4-D в комбинации с глифосатом применяют для обеспечения более сильной обработки выжиганием перед беспахотным посевом сои и хлопка; однако из-за чувствительности этих двудольных видов растений к 2,4-D, такую обработку выжиганием нужно проводить, по меньшей мере, за 14-30 суток до посева (Agriliance, 2005).
Организм, который интенсивно изучали, благодаря его способности разрушать 2,4-D, представляет собой Ralstonia eutropha, которая содержит ген, кодирующий tfdA (Streber et al., 1987), фермент, который катализирует первый этап метаболического пути минерализации. (См. патент США № 6153401 и GENBANK Acc. No. M16730). Показано, что tfdA разрушает 2,4-D (Smejkal et al, 2001). Продукты, образующиеся в результате разрушения, обладают очень низкой или нулевой гербицидной активностью по сравнению с 2,4-D. tfdA использовали в трансгенных растениях для передачи устойчивости к 2,4-D двудольным растениям (например, хлопку и табаку), в норме чувствительным к 2,4-D (Streber et al. (1989), Lyon et al. (1989), Lyon (1993), и патент США № 5608147).
Многие гены типа tfdA, которые кодируют белки, способные разрушать 2,4-D, были идентифицированы из их окружения, и помещены в базу данных Genbank. Многие гомологи сходны с tfdA (>85% идентичных аминокислот). Однако существует ряд полинуклеотидных последовательностей со значительно меньшей идентичностью с tfdA (25-50%), которые при этом содержат характерные остатки, ассоциированные с α-кетоглутарат-зависимым Fe (II) диоксигеназами.
Пример разрушающего 2,4-D гена с низкой идентичностью последовательности (<35%) по отношению к tfdA представляет собой ген aad-12 из Delftia acidovorans (патент США App 2011/0203017). Ген aad-12 кодирует S-энантиомер-специфичную α-кетоглутарат-зависимую диоксигеназу, которую применяют в отношении растений для обеспечения устойчивости к определенным феноксиауксиновым гербицидам, включая в качестве неограничивающих примеров: гербициды на основе феноксиуксусной кислоты, такие как 2,4-D и MCPA; и гербициды на основе феноксибутановой кислоты, такие как 2,4-DB и MCPB, и гербициды на основе пиридилоксиалкановой кислоты (например, гербициды на основе пиридилоксиуксусной кислоты, такие как триклопир и флюроксипир), и включая кислоты, соли или сложные эфиры активного ингредиента(ов). (См., например, WO 2007/053482).
Глуфосинат-аммоний ("глуфосинат") представляет собой несистемный неселективный гербицид фосфинотрицинового класса гербицидов. Применяемый преимущественно для послевсходового контроля широкого спектра широколиственных и травянистых сорняков, L-фосфинотрицин, активный ингредиент глуфосината, контролирует сорняки посредством необратимого ингибирования глутамин-синтазы, фермента, который необходим для нейтрализации аммиака в растениях. Гербициды на основе глуфосината доступны в продаже, например, под торговыми марками Ignite®, BASTA и Liberty®.
Фермент фосфинотрицин-N-ацетил-трансфераза (PAT), изолированный из почвенной бактерии Streptomyces viridochromogenes, катализирует превращение L-фосфинотрицина в его неактивную форму посредством ацетилирования. Оптимизированную для растений форму гена, экспрессирующего PAT, применяли в отношении сои для обеспечения устойчивости к гербицидам на основе глуфосината. Один такой пример устойчивой к глуфосинату сои представляет собой событие A5547-127. Недавно применение гербицидов на основе глуфосината в комбинации с признаком устойчивости к глуфосинату было предложено в качестве неселективного способа эффективной борьбы с устойчивыми к ALS и глифосату сорняками.
Экспрессия гетерологичных или чужеродных генов в растениях зависит от того, в какой участок хромосомы вставлен чужеродный ген. Это может быть связано со структурой хроматина (например, гетерохроматин) или близостью элементов регуляции транскрипции (например, энхансеров) к сайту интеграции (Weising et al, Ann. Rev. Genet 22:421-477, 1988). Один и тот же ген в трансгенном растении одного типа (или в другом организме) может демонстрировать высокую изменчивость уровня экспрессии среди различных событий. Также могут наблюдаться различия в пространственных или временных паттернах экспрессии. Например, различия в относительной экспрессии трансгена в различных тканях растения могут не соответствовать ожидаемым паттернам для транскрипционных регуляторных элементов, присутствующих в интродуцированной генной конструкции.
Таким образом, обычно создают и скринируют большое количество событий с целью идентификации события, в котором необходимый интродуцированный ген экспрессируется на достаточном уровне, нужном для конкретной цели. В коммерческих целях часто создают от сотен до тысяч различных событий и скринируют эти события с целью обнаружения одного события, имеющего желаемый уровень и паттерн экспрессии трансгена. Событие, имеющее желаемые уровни и/или паттерны экспрессии трансгена, пригодно для интрогрессии трансгена в другое генетическое окружение, посредством ауткроссинга с применением общепринятых способов скрещивания. Потомки таких гибридов сохраняют характеристики экспрессии трансгена исходного трансформанта. Такой способ используют для обеспечения необходимой генной экспрессии у ряда сортов, которые адаптированы к местным условиям роста.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение предоставляет, в частности, эффективные способы контроля устойчивости сорняков, которые помогают сохранить практическую ценность применения гербицидоустойчивых технологий. Данное изобретение также предоставляет фермерам значительную гибкость и удобство способов контроля сорняков.
Более конкретно, настоящее изобретение относится, в частности, к событию сои (Glycine max), обозначенному pDAB8264.44.06.1 ("Событие pDAB8264.44.06.1"), типичные семена которого хранятся в Американской коллекции типовых культур (ATCC) под номером доступа PTA-11336, и его потомкам. Данное изобретение включает растения сои, содержащие событие pDAB8264.44.06.1 (и включает растения сои, содержащие трансгенную вставку в сегменте генома, содержащем SEQ ID NO:l и SEQ ID NO:2).
Трансгенная вставка, присутствующая в данном событии и хранящихся в коллекции семенах, содержит три гена устойчивости к гербицидам: aad-12, 2mepsps и pat ген. Ген aad-12, полученный из Delftia acidovorans, кодирует белок арилоксиалканоат-диоксигеназу (AAD-12), который обеспечивает устойчивость к, например, гербицидам на основе 2,4-дихлорфеноксиуксусной кислоты и пиридилоксиацетата. Ген 2mepsps, который представляет собой модифицированную последовательность EPSPS, изолированную из кукурузы, кодирует белок, который обеспечивает устойчивость к гербицидам на основе глифосата. Ген pat, изолированный из почвенной бактерии Streptomyces viridochromogenes, обеспечивает устойчивость к гербицидам на основе глуфосината.
Другие аспекты изобретения включают растения-потомки, сою, семена и/или регенерируемые части растений, семян и потомков, содержащие событие сои pDAB8264.44.06.1, а также пищевые или кормовые продукты, полученные из них. Изобретение также включает растительные части события pDAB8264.44.06.1, которые в качестве неограничивающих примеров включают пыльцу, семязачатки, цветы, побеги, корни, листья, ядра вегетативных клеток, пыльцевые клетки и другие растительные клетки, содержащие событие pDAB8264.44.06.1. Кроме того, изобретение относится к растениям сои, характеризующимся устойчивостью к многочисленным гербицидам, включая гербициды на основе феноксиуксусной кислоты, феноксибутановой кислоты, пиридилоксиалкановой кислоты, глифосата и/или глуфосината. Такие растения сои можно пакетировать с генами, которые обеспечивают устойчивость к различным другим неселективным и селективным гербицидам, включая в качестве неограничивающих примеров дикамбу, имидазолинон и гербициды на основе HPPD. Изобретение также включает новую генетическую композицию событие pDAB8264.44.06.1 и аспекты агротехнической приспособленности растений сои, содержащих событие pDAB8264.44.06.1.
Настоящее изобретение относится, в частности, к селекции растений и устойчивых к гербицидам растений. Данное изобретение включает новое событие трансформации в растениях сои, содержащее полинуклеотид, как описано в настоящем документе, вставленный в определенный сайт генома клетки сои.
В некоторых вариантах осуществления указанное событие/полинуклеотид может быть "пакетировано" с другими признаками, включая, например, агрономические признаки и/или белки, ингибирующие развитие насекомых. Однако данное изобретение включает растения, содержащие одно событие, как описано в настоящем документе.
В некоторых вариантах осуществления данное событие устойчивости к гербицидам можно комбинировать посредством пакетирования при скрещивании с событием устойчивости к насекомым. В некоторых из этих вариантов осуществления событие устойчивости к насекомым содержит ген crylF и ген crylAc. Некоторые такие события и пакетированные события специально приведены в качестве примеров в настоящем документе, включая событие сои 9582.812.9.1 ("Событие 812") и событие сои 9582.814.19.1 ("Событие 814"). Растения, растительные клетки и семена, например, содержащие любую комбинацию данных событий, включены в данное изобретение. В некоторых вариантах осуществления данное изобретение включает только Событие сои 9582.812.9.1 ("Событие 812"), как более подробно описано ниже.
Дополнительные признаки можно пакетировать в геном растения или в тот же локус, что и событие pDAB8264.44.06.1, например, с применением селекции растений, повторной трансформации трансгенного растения, содержащего Событие DAS-8264.44.06.1, или добавления новых признаков, посредством направленной интеграции с применением гомологичной рекомбинации.
Другие варианты осуществления включают вырезание участка или всей трансгенной вставки и/или фланкирующих последовательностей События DAS-8264.44.06.1. После вырезания в сайт События DAS-8264.44.06.1 можно вставлять другие и/или дополнительные вставки. Таким образом, приведенную вставку данного события сои можно заменять или пакетировать с ней другую вставку(и).
В одном из вариантов осуществления настоящее изобретение относится к сайту-мишени хромосомы сои, находящемуся на хромосоме 6. В некоторых вариантах осуществления сайт-мишень содержит гетерологичную нуклеиновую кислоту. В некоторых вариантах осуществления сайт-мишень хромосомы сои находится между или внутри геномных фланкирующих последовательностей, приведенных в SEQ ID NO:l и SEQ ID NO:2.
В одном из вариантов осуществления настоящее изобретение относится к способу получения трансгенного растения сои, содержащего гетерологичную нуклеиновую кислоту на хромосоме 6. В другом варианте осуществления гетерологичная нуклеиновая кислота вставлена в хромосому 6 возле или между различных приведенных в пример полинуклеотидных сегментов, как описано в настоящем документе.
Дополнительно, данное изобретение предоставляет способы детектирования наличия данного события в образце (образце сои, например). Способы могут быть основаны на ДНК-последовательности рекомбинантной конструкции, вставленной в геном сои, и на геномной последовательности, фланкирующей участок вставки. Также предоставлены наборы и условия, применяемые при осуществлении этих способов.
Таким образом, данное изобретение относится, в частности, к клонированию и анализу ДНК-последовательностей всей приведенной в пример вставки и граничащих с ней участков (в трансгенных линиях сои). Эти последовательности являются уникальными. На основе этих последовательностей вставок и пограничных (и соединяющих) последовательностей получали специфичные к событию праймеры. Анализ с применением ПЦР показал, что события можно идентифицировать посредством анализа ПЦР-ампликонов, полученных с применением этих специфичных к событию праймеров. Таким образом, эти и другие связанные способы можно использовать для уникальной идентификации линий сои, содержащей событие по данному изобретению.
Данное изобретение также относится, в частности, к анализу ПЦР в реальном времени или анализу ПЦР "по конечной точке" с TaqMan для детектирования события 8264.44.06.1. Некоторые варианты осуществления относятся к тестам, позволяющим проводить высокопроизводительный анализ зиготности. Данное изобретение, кроме того, относится, в частности, к применению референсного гена GMFL01-25-J19 (GenBank: AK286292.1) для применения в определении зиготности. Эти и другие связанные способы можно использовать для уникальной идентификации зиготности события pDAB8264.44.06.1 и сортов сои, содержащих это событие.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
Фиг.1 представляет собой плазмидную карту pDAB8264.
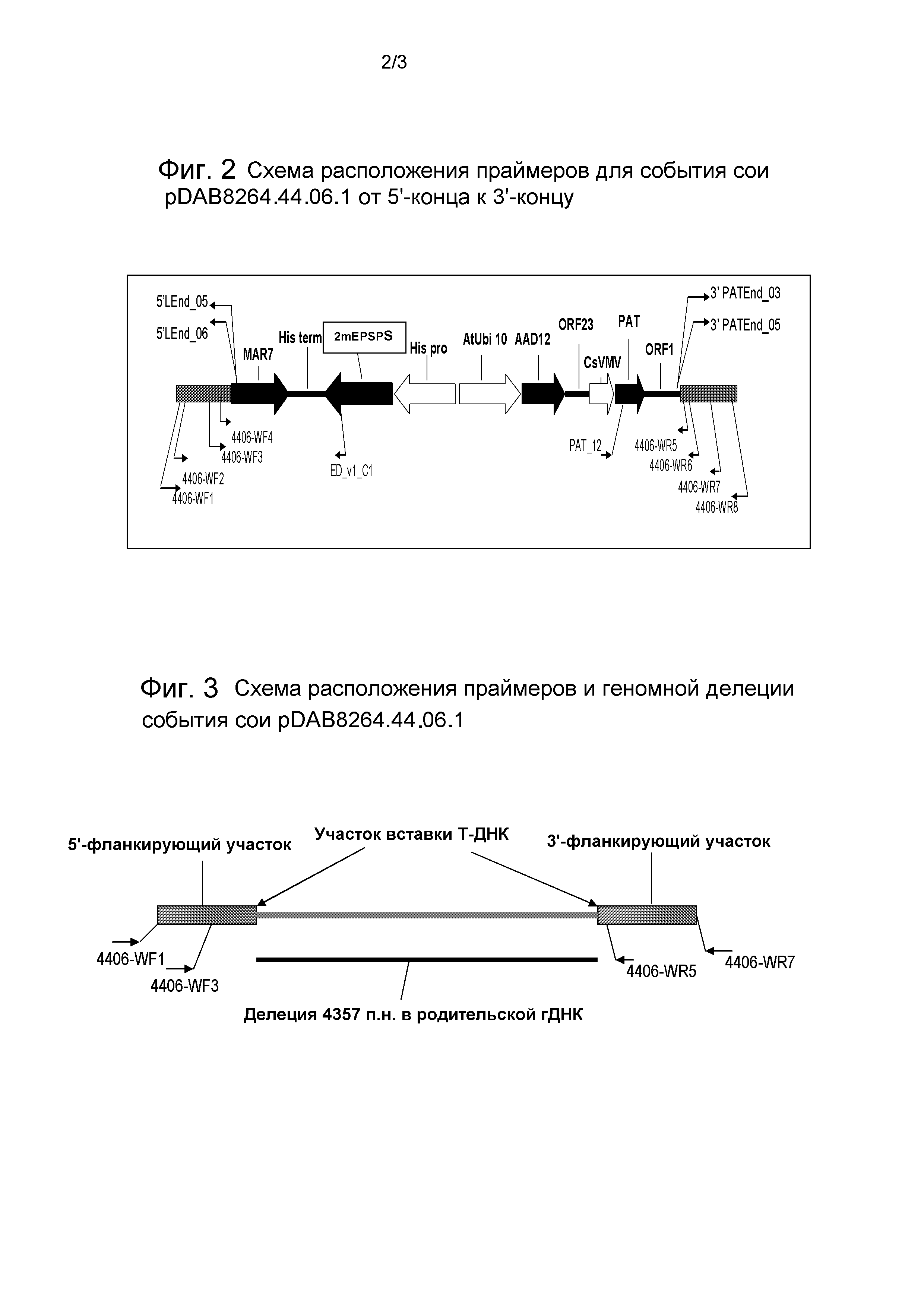
Фиг.2 представляет собой схематическую диаграмму, иллюстрирующую расположение праймеров для События сои pDAB8264.44.06.1.
Фиг.3 представляет собой схематическую диаграмму, иллюстрирующую расположение праймеров и делеций геномной ДНК в Событии сои pDAB8264.44.06.1.
Фиг.4 представляет собой схематическую диаграмму, иллюстрирующую расположение праймеров для детекции События сои pDAB8264.44.06.1 с применением TaqMan.
КРАТКОЕ ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO:l представляет собой 5'-фланкирующую пограничную последовательность рассматриваемого События сои pDAB8264.44.06.1.
SEQ ID NO:2 представляет собой 3'-фланкирующую пограничную последовательность рассматриваемого События сои pDAB8264.44.06.1.
SEQ ID NO:3 представляет собой праймер 4406_WF1.
SEQ ID NO:4 представляет собой праймер 4406_WF2.
SEQ ID NO:5 представляет собой праймер 4406_WF3.
SEQ ID NO:6 представляет собой праймер 4406_WF4.
SEQ ID NO:7 представляет собой праймер 4406_WR5.
SEQ ID NO:8 представляет собой праймер 4406_WR6.
SEQ ID NO:9 представляет собой праймер 4406_WR7.
SEQ ID NO:10 представляет собой праймер 4406_WR8.
SEQ ID NO:11 представляет собой праймер ED_vl_Cl.
SEQ ID NO:12 представляет собой праймер PAT_12.
SEQ ID NO:13 представляет собой последовательность плазмиды pDAB8264.
SEQ ID NO:14 представляет собой частичную 5'-фланкирующую последовательность генома сои и частичную последовательность 5'-вставки.
SEQ ID NO:15 представляет собой частичную 3'-фланкирующую последовательность генома сои и частичную последовательность 3'-вставки.
SEQ ID NO:16 представляет собой последовательность длиной в 98 пар оснований, охватывающую участок соединения 5'-вставки.
SEQ ID NO:17 представляет собой последовательность длиной в 131 пару оснований, охватывающую участок соединения 3'-вставки.
SEQ ID NO:18 представляет собой праймер 4406_5'F.
SEQ ID NO:19 представляет собой праймер 4406_5'R.
SEQ ID NO:20 представляет собой зонд 4406_5'P.
SEQ ID NO:21 представляет собой праймер 4406_3'F.
SEQ ID NO:22 представляет собой праймер 4406_3'R.
SEQ ID NO:23 представляет собой зонд 4406_3'P.
SEQ ID NO:24 представляет собой праймер GMS116F.
SEQ ID NO:25 представляет собой праймер GMS116R.
SEQ ID NO:26 представляет собой зонд GMS116Pзонд.
SEQ ID NO:27 представляет собой последовательность События сои pDAB8264.44.06.1, содержащую 5'-фланкирующую геномную последовательность, вставку и 3'-фланкирующую геномную последовательность.
SEQ ID NO:28 представляет собой ожидаемую последовательность События сои 9582.812.9.1, содержащую 5'-фланкирующую геномную последовательность, вставку T-ДНК pDAB9582 и 3'-фланкирующую геномную последовательность.
SEQ ID NO:29 представляет собой ожидаемую последовательность События сои 9582.814.19.1, содержащую 5'-фланкирующую геномную последовательность, вставку T-ДНК pDAB9582 и 3'-фланкирующую геномную последовательность.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение, описываемое в настоящем документе, включает новые события трансформации растений сои (сои), содержащие кассету для экспрессии многочисленных генов устойчивости к гербицидам, вставленные в специфичные локусы генома клетки сои.
Приведенная в пример трансгенная вставка, содержащая событие pDAB8264.44.06.1, включает генетические элементы для экспрессии трех различных генов устойчивости к гербицидам: (1) синтетический ген aad-12; (2) последовательность EPSPS из кукурузы, кодирующая белок, содержащий мутации по сравнению с полипептидом EPSPS дикого типа: на месте аминокислотных остатков 102 (замена треонина на изолейцин) и 106 (замена пролина на серин) и придающий устойчивость или резистентность к гербицидам на основе глифосата; и (3) ген pat, который обеспечивает устойчивость или резистентность к гербицидам на основе глуфосинатов. Ген aad-12 получен из Delftia acidovorans и кодирует белок-фермент арилоксиалканоат-диоксигеназу (AAD-12), способный деактивировать гербициды, содержащие составную группу α-кетоглутарата, включая гербициды на основе феноксиалканоата (например, гербициды на основе феноксиуксусной кислоты, такие как 2,4-D и MCPA; гербициды на основе феноксипропионовой кислоты, такие как дихлорпроп, мекопроп и их энантиомеры; и гербициды на основе феноксибутановой кислоты, такие как 2,4-DB и MCPB) и гербициды на основе пиридилоксиалкановой кислоты (например, гербициды на основе пиридилоксиуксусной кислоты, такие как триклопир и флуроксипир), включая кислоты, соли или сложные эфиры активного ингредиента(ов).
Более конкретно, данное изобретение относится, в частности, к трансгенному Событию сои pDAB8264.44.06.1, линиям растений, содержащим эти события, и клонированию и анализу ДНК-последовательностей этой вставки и/или ее пограничных участков. Линии растений по данному изобретению можно детектировать с применением последовательностей, раскрытых и предложенных в настоящем документе.
Настоящее изобретение относится, в частности, к селекции растений и устойчивых к гербицидам растений. В некоторых вариантах осуществления указанную полинуклеотидную последовательность можно "пакетировать" с другими признаками (такими как устойчивость к другому гербициду(ам) и/или геном(ами), которые кодируют белки устойчивости к насекомым или ингибиторные РНК-последовательности). Однако данное изобретение также включает растения, содержащие одно событие, как описано в настоящем документе.
В некоторых вариантах осуществления данное событие устойчивости к гербицидам можно комбинировать в пакетированном событии с событием устойчивости к насекомым. В некоторых вариантах осуществления устойчивость к насекомым выбрана из группы, состоящей из События 812 и События 814 (как более подробно описано выше), каждое из которых содержит ген crylF и ген crylAc. Растения, растительные клетки и семена, например, содержащие любую комбинацию рассматриваемых событий, включены в данное изобретение. Данное изобретение также включает новое, взятое отдельно Событие 812, в определенных вариантах осуществления включающее, например, растения, растительные клетки и семена.
Предварительная заявка США с серийным номером 61/471845, зарегистрированная 5 апреля 2011 года, относится, в частности, к линиям сои, содержащим Событие сои 9582.812.9.1 (Событие 812). Семена, содержащие это событие, хранятся с публичным доступом без ограничений (однако защищены патентными правами) в Американской коллекции типовых культур (ATCC), 10801 University Boulevard, Manassas, VA, 20110. Этот депозит, обозначенный депозитным номером ATCC No. PTA-11602, был получен 20 января 2011 года. Этот депозит был получен, и хранится согласно правилам Будапештского договора в отношении депозитов семян для использования в процедурах выдачи патентов.
Предварительные заявки США с серийными номерами 61/511664 (зарегистрированная 26 июля 2011 года) и 61/521798 (зарегистрированная 10 августа 2011 года) относятся, в частности, к линиям сои, содержащим событие сои 9582.814.19.1 (Событие 814). Семена, содержащие это событие, хранятся в Американской коллекции типовых культур (ATCC), 10801 University Boulevard, Manassas, VA, 20110. Депозит с патентным депозитным номером ATCC PTA-12006, был получен ATCC 21 июля 2011 года. Этот депозит был получен, и хранится согласно правилам Будапештского договора в отношении депозитов семян для использования в процедурах выдачи патентов.
Данное изобретение также включает растения, семена и растительные клетки, например, содержащие SEQ ID NO:27 (Событие pDAB8264.44.06.1; Событие 4406), SEQ ID NO:28 (Событие 812) и/или SEQ ID NO:29 (Событие 814) и варианты этих последовательностей, имеющие, например, по меньшей мере, 95,%, 96%, 97%, 98% или 99% идентичность с этими последовательностями. Часто некоторые вариации (такие как делеция некоторых сегментов) появляются после интеграции последовательности-вставки в растительный геном. Это более подробно обсуждается, например, в примере 7.
Данное изобретение также предоставляет анализы для детектирования наличия рассматриваемого события в образце. Аспекты данного изобретения включают способы создания и/или получения любых диагностических молекул нуклеиновой кислоты, приведенных в качестве примера или предложенных в настоящем документе, в частности, основанных полностью или целиком на рассматриваемых фланкирующих последовательностях.
В некоторых вариантах осуществления полинуклеотидный сегмент, приведенный в качестве примера или описываемый в настоящем документе (такой как SEQ ID NO:l, SEQ ID NO:2 и/или вставка между ними, как показано, например, на фиг. 2), можно удалять и затем повторно вставлять дополнительную полинуклеотидную последовательность(и).
В некоторых вариантах осуществления настоящее изобретение относится к устойчивым к гербицидам линиям сои и их идентификации. Данное изобретение относится, в частности, к детектированию наличия рассматриваемого события, с целью определения наличия рассматриваемого события в потомстве от полового скрещивания. Кроме того, включен способ детектирования события, который можно применять, например, для выполнения требований предпродажного одобрения и маркировки продуктов, полученных из рекомбинантных сельскохозяйственных культур. Детектирование наличия рассматриваемого события можно проводить посредством любого хорошо известного способа детектирования нуклеиновой кислоты, такого как полимеразная цепная реакция (ПЦР) или гибридизация ДНК с нуклеиновокислотными зондами. Специфичные к событию анализы ПЦР обсуждаются в настоящем документе. (См. например, Windels et al. (Med. Fac. Landbouww, Univ. Gent 64/5b:459462, 1999) в качестве другого примера.) Некоторые эти примеры относятся к применению набора праймеров, охватывающих участок соединения вставки и фланкирующих ДНК. Более конкретно, один праймер содержит последовательность вставки, а второй праймер содержит последовательность, фланкирующую ДНК.
В настоящем документе приведено в пример Событие сои pDAB8264.44.06.1 и его селекция и диагностика стабильности и экспрессии в растениях сои от поколения к поколению. Обе фланкирующие последовательности события pDAB8264.44.06.1 были секвенированы и в настоящем документе описаны как SEQ ID NO:l и SEQ ID NO:2. Были разработаны специфичные к событию анализы. Событие также было нанесено на карту генома сои (хромосома сои 6). Событие pDAB8264.44.06.1 можно интрогрессировать в элитные культурные сорта, в которых оно обеспечивает устойчивость к фенокси-гербицидам, гербицидам на основе глифосата и гербицидам на основе глуфосинатов в инбредных и гибридных линиях сои.
Рассматриваемый ген EPSPS кодирует мутантную 5-энолпирувил-3-фосфошикимовой кислоты синтазу (EPSPS). Ген EPSPS дикого типа был исходно изолирован из Zea mays, и последовательность была помещена в GenBank под номером доступа X63374. Также см. патент США № 6566587 (в частности, SEQ ID No.3 в нем).
Для обеспечения высокого уровня экспрессии гетерологичных генов в растениях предпочтительно повторно сконструировать указанные гены с тем, чтобы они более эффективно экспрессировались в растительных клетках. Модификация нуклеотидной последовательности EPSPS растения дикого типа может обеспечивать устойчивость при экспрессии в растительной клетке. Как описано в патенте '587, при сравнении полипептида EPSPS с полипептидом дикого типа модификация по замене изолейцина на треонин на месте остатка 102 и замене серина на пролин в позиции 106 белка приводит к получению полипептида EPSPS с двумя мутациями (2mEPSPS), который применяют в рассматриваемой вставке. При экспрессии в растительной клетке он обеспечивает устойчивость к глифосату. Рассматриваемый ген EPSPS, также обозначаемый как "ген 2mepsps" или DMMG, можно альтернативно оптимизировать с повышением экспрессии, как в двудольных, так и в однодольных растениях, в частности, в сое. Частоту использования кодона можно выбирать в зависимости от предпочтительной полудольной частоты использования кодона, т.е. повторно конструировать с тем, чтобы белок кодировался кодонами, предпочтительно используемыми как однодольными, так и двудольными растениями. Вредные последовательности и избыточные участки рестрикции можно удалять с повышением эффективности транскрипции/трансляции кодирующей последовательности 2mepsps и облегчения проведения этапов манипуляции ДНК. Оптимизированная полудольная версия рассматриваемого гена однодольного растения подробно рассмотрена в U.S.S.N. 13/303502 (зарегистрированной 23 ноября 2011 года, испрашивающей приоритет до 3 декабря 2010 года), озаглавленной "OPTIMIZED EXPRESSION OF GLYPHOSATE RESISTANCE ENCODING NUCLEIC ACID MOLECULES IN PLANT CELLS."
Как ранее указано в настоящем документе, вставка и интеграция трансгена в растительный геном включает несколько случайных событий (отсюда название "событие" для данной экспрессирующейся вставки). А именно, во многих способах трансформации, таких как трансформация с применением Agrobacterium, "генная пушка" и WHISKERS, нельзя предсказать, в какое место генома будет вставлен трансген. Таким образом, идентификация фланкирующей геномной ДНК по обе стороны вставки может быть важна для идентификации растения, содержащего данное событие вставки. Например, можно конструировать праймеры для ПЦР, которые позволяют получать ПЦР-ампликон для участка соединения вставки и генома хозяина. Этот ПЦР-ампликон можно использовать для идентификации уникального или особенного события вставки.
Во время процесса введения вставки в геном растительных клеток часто возникают некоторые делеции или другие изменения фланкирующих вставочных и/или геномных последовательностей. Таким образом, подходящий сегмент последовательности плазмиды, предоставленной в настоящем документе, может содержать некоторые незначительные вариации. То же верно и для фланкирующих последовательностей, предоставленных в настоящем документе. Таким образом, растение, содержащее полинуклеотид, имеющий некоторую степень идентичности с рассматриваемыми фланкирующими и/или вставочными последовательностями, находится в рамках объема данного изобретения. Идентичность полинуклеотидной последовательности с последовательностью по настоящему изобретению может составлять, по меньшей мере, 65% идентичности последовательности, более предпочтительно, по меньшей мере, 70% идентичности последовательности, более предпочтительно, по меньшей мере, 75% идентичности последовательности, более предпочтительно, по меньшей мере, 80% идентичности и более предпочтительно, по меньшей мере, 85% 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% идентичности последовательности с последовательностью, приведенной в качестве примера или описываемой в настоящем документе. Гибридизацию и условия гибридизации, описанные в настоящем документе, также можно использовать для определения таких растений и полинуклеотидных последовательностей по данному изобретению. Последовательность, которая содержит фланкирующие последовательности, а также полную вставочную последовательность, можно подтверждать со ссылкой на хранящиеся в банке семена.
Поскольку "события" исходно представляют собой случайные события, в качестве части данного изобретения, по меньшей мере, 2500 семян линии сои, содержащей событие pDAB8264.44.06.1, помещали в банк для хранения с публичным доступом без ограничений (однако защищали патентными правами) в Американской коллекции типовых культур (ATCC), 10801 University Boulevard, Manassas, VA, 20110. Депозит обозначали депозитным номером ATCC PTA-11336. 100 пакетов (25 семян на пакет) семян Glycine max ("семена сои Glycine max L.: pDAB8264.44.06.1") были помещены в банк от имени Dow AgroSciences LLC и MS Technologies, LLC - 14 сентября 2010 года. Депозит тестировали 04 октября 2010 года, и в тот момент семена были жизнеспособными. Этот депозит был получен, и хранится, согласно правилам Будапештского договора в отношении депозитов семян для использования в процедурах выдачи патентов. Депозит будет храниться без ограничений в хранилище ATCC, которое представляет собой публичное хранилище, в течение 30 лет, или в течение пяти лет после последнего запроса, или в течение срока действия патента, в зависимости от того, какой срок дольше, и будет заменен в том случае, если станет нежизнеспособным в течение этого периода.
В качестве части данного изобретения, по меньшей мере, 2500 семян линии сои, содержащей Событие pDAB9582.812.9.1 и событие pDAB8264.44.06.1 (рассматриваемое событие устойчивости к гербицидам и событие 812 устойчивости к насекомым) помещали в банк для хранения с публичным доступом без ограничений (однако, защищали патентными правами) в Американской коллекции типовых культур (ATCC), 10801 University Boulevard, Manassas, VA, 20110. Депозит обозначали в ATCC как "Номер: pDAB9582.812.9.1:: Событие pDAB8264.44.06.1. 100 пакетов (25 семян на пакет) семян Glycine max ("семена сои семян Glycine max L. pDAB8264.44.06.1") были помещены в банк 18 ноября 2011 года. Этот депозит был получен, и хранится согласно правилам Будапештского договора в отношении депозитов семян для использования в процедурах выдачи патентов. Депозит будет храниться без ограничений в хранилище ATCC, которое представляет собой публичное хранилище, в течение 30 лет, или в течение пяти лет после последнего запроса, или в течение срока действия патента, в зависимости от того, какой срок дольше, и будет заменен в том случае, если станет не жизнеспособным в течение этого периода.
Хранящиеся в банке семена являются частью данного изобретения. Ясно, что из этих семян можно выращивать растения сои, и такие растения являются частью данного изобретения. Данное изобретение также относится к ДНК-последовательностям, содержащимся в этих растениях сои, которые пригодны для детектирования этих растений и их потомков. Способы детектирования и наборы по данному изобретению могут быть направлены на идентификацию любого одного, двух или даже всех трех этих событий, в зависимости от конечной цели теста.
Определения и примеры приведены в настоящем документе для облегчения описания настоящего изобретения и для помощи специалистам в данной области в осуществлении изобретения. Если не указано иначе, термины нужно понимать согласно общепринятому применению среди специалистов в соответствующей области. Использована номенклатура оснований ДНК, приведенная в 37 CFR § 1.822.
В рамках изобретения термин "потомки" обозначает потомство любого поколения родительского растения, которое содержит Событие сои pDAB8264.44.06.1.
Трансгенное "событие" получают посредством трансформации растительных клеток гетерологичной ДНК, т.е. конструкцией нуклеиновой кислоты, содержащей рассматриваемый трансген, восстановлением популяции растений, полученных в результате вставки трансгена в геном растения и отбора определенного растения, несущего вставку в определенный участок генома. Термин "событие" относится к исходному трансформанту и потомкам трансформанта, которые содержат гетерологичную ДНК. Термин "событие" также относится к потомкам, полученным посредством скрещивания трансформанта и другой разновидности, которая содержит геномную/трансгенную ДНК. Даже после повторного возвратного скрещивания с рекуррентным родителем, вставленная трансгенная ДНК и фланкирующая геномная ДНК (геномная/трансгенная ДНК) из трансформированного родительского растения, остается у потомков от скрещивания в том же участке хромосомы. Термин "событие" также относится к ДНК из исходного трансформанта и его потомкам, содержащим вставленную ДНК и фланкирующую геномную последовательность, непосредственно прилежащую к вставленной ДНК, которая, как ожидают, передается потомкам, получающим вставленную ДНК, включая рассматриваемый трансген, в результате скрещивания родительской линии, которая содержит вставленную ДНК (например, исходный трансформант и потомство от самоопыления), и родительской линии, которая не содержит вставленной ДНК.
"Соединяющая последовательность" охватывает точку, в которой ДНК, вставленная в геном, соединяется с ДНК из исходного генома сои, фланкирующей место вставки, где идентификация или детектирование той или иной соединяющей последовательности в генетическом материале растения является достаточным для диагностики события. Включены последовательности ДНК, которые охватывают вставки в описанных в настоящем документе событиях сои и фланкирующую ДНК той же длины. Конкретные примеры таких диагностических последовательностей приведены в настоящем документе; однако другие последовательности, которые перекрывают соединения вставок, или соединения вставок и геномной последовательности, также являются диагностическими, и могут быть использованы по данному изобретению.
Данное изобретение относится, в частности, к идентификации события с применением таких фланкирующих, соединяющих и вставочных последовательностей. Связанные праймеры для ПЦР и ампликоны включены в изобретение.
Согласно данному изобретению, способы анализа с применением ампликонов ПЦР, которые охватывают вставки ДНК и их границы, можно использовать для детектирования или идентификации запущенных в серийное производство трансгенных разновидностей сои или линий, полученных от рассматриваемых запатентованных трансгенных линий сои.
Бинарная плазмида pDAB8264 (SEQ ID NO:13) содержит генетические элементы, приведенные на фиг.1. Следующие генетические элементы (пограничные последовательности T-ДНК не включены) содержатся в регионе T-ДНК pDAB8264. В табл. 1 количество остатков в генетических элементах приведено в отношении SEQ ID NO:13, описываемой в настоящем документе.
SEQ ID NO:14 и 15, соответственно, представляют собой 5'- и 3'-фланкирующие последовательности вместе с 5'- и 3'-участками вставочной последовательности, как более детально описано ниже, и, таким образом, включают 5'- и 3'-соединяющие или переходные последовательности между вставкой и геномной ДНК. В SEQ ID NO:14 остатки 1-570 представляют собой 5'-фланкирующую геномную последовательность, а остатки 571-859 представляют собой остатки 5'-конца вставки. В SEQ ID NO:15 остатки 1-220 представляют собой остатки 3'-конца вставки, а остатки 221-1719 представляют собой 3'-фланкирующую геномную последовательность. Соединяющая или переходная последовательность 5'-конца вставки, таким образом, находится на месте остатков 570-571 SEQ ID NO:14. Соединяющая или переходная последовательность 3'-конца вставки, таким образом, находится на месте остатков 220-221 SEQ ID NO:15. Полинуклеотиды по данному изобретению включают полинуклеотиды, содержащие, например, 5, 10, 20, 50, 100, 150 или 200 оснований, или, возможно, больше, и любые промежуточные количества, по любую сторону от соединяющей последовательности. Таким образом, праймер, охватывающий соединяющую последовательность, может содержать, например, 5-10 оснований, которые гибридизуются с фланкирующей последовательностью, и 5-10 оснований, которые гибридизуются со вставочной последовательностью. Зонды и ампликоны могут быть сконструированы сходным образом, хотя они обычно длиннее праймеров.
Рассматриваемые последовательности (включая фланкирующие последовательности) являются уникальными. На основе этих вставочных и фланкирующих последовательностей получали специфичные к событиям праймеры. Анализ ПЦР показал, что эти линии сои можно идентифицировать в различных генотипах сои посредством анализа ампликонов ПЦР, полученных с применением этих специфичных к событиям наборов праймеров. Таким образом, эти и другие связанные способы можно использовать для уникальной идентификации указанных линий сои. Последовательности, идентифицированные в настоящем документе, являются уникальными.
Способы детектирования по данному изобретению являются особенно эффективными в сочетании с селекцией растений, что позволяет определить, какие растения-потомки содержат рассматриваемое событие после скрещивания родительского растения, содержащего рассматриваемое событие, с другой линией растений с целью передачи одного или нескольких необходимых дополнительных признаков потомству. Эти способы анализа с применением ПЦР полезны для программ разведения сои так же, как контроль качества, особенно в отношении запущенных в серийное производство трансгенных семян сои. Наборы для детектирования с применением ПЦР для этих трансгенных линий сои также выпускаются и применяются. Также эти способы могут быть полезны для регистрации продукции и управления качеством продукции.
Кроме того, фланкирующие соевые/геномные последовательности можно использовать для специфичной идентификации локализации в геноме каждой вставки. Эту информацию можно использовать для получения наборов молекулярных маркеров, специфичных для каждого события. Их можно использовать для улучшенных стратегий разведения и для получения данных о сцеплении.
Кроме того, информацию о фланкирующих последовательностях можно использовать для изучения и описания процессов интеграции трансгена, описания сайта интеграции в геноме, сортировки событий, стабилизации трасгенов и их фланкирующих последовательностей и генной экспрессии (особенно в отношении сайленсинга генов, паттернов метилирования трансгена, эффекта положения и потенциальных связанных с экспрессией элементов, таких как MARS [участки прикрепления к матриксу], и т.п.).
В свете данного изобретения ясно, что данное изобретение включает семена, доступные под депозитным номером ATCC PTA- 11336. Данное изобретение также включает устойчивые к гербицидам растения сои, выращенные из семян, хранящихся под номером доступа ATCC PTA-11336. Данное изобретение также включает части указанного растения, такие как листья, образцы тканей, семена, полученные от указанного растения, пыльцу и т.п. (которые содержат трансгенную вставку, фланкированную SEQ ID NO:l и SEQ ID NO:2).
Кроме того, данное изобретение включает потомство и/или растения-потомки растений, выращенных из хранящихся в банке семян, предпочтительно устойчивые к гербицидам растения сои, где указанные растения имеют геном, содержащий поддающуюся детектированию соединяющую последовательность геномной ДНК дикого типа/вставочной ДНК, как описано в настоящем документе. В рамках изобретения термин "соя" означает Glycine max, и включает все ее разновидности, которые можно скрестить с растением сои.
Изобретение далее включает способы получения гибридов с применением растения по данному изобретению в качестве, по меньшей мере, одного родителя. Например, данное изобретение включает растение-гибрид F1, один или оба родителей которого являются любым растением, приведенным в пример в настоящем документе. Также в данное изобретение включены семена, полученные от таких гибридов F1по данному изобретению. Данное изобретение включает способ получения семян гибридов F1 посредством скрещивания, приведенного в пример растения с другим растением (например, инбредным родителем) и сбора полученных гибридных семян. Данное изобретение включает приведенное в пример растение, которое является либо женским, либо мужским родительским растением. Признаки полученных растений можно улучшать посредством внимательного изучения родительских растений.
Устойчивое к гербицидам растение сои по данному изобретению можно размножать, посредством скрещивания первого родительского растения сои, представляющего собой растение сои, выращенное из семени любой линии, приведенной в настоящем документе, и второго родительского растения сои с получением множества растений первого поколения; затем отбора растения первого поколения, устойчивого к гербицидам (или содержащего, по меньшей мере, одно из событий по данному изобретению); самоопыления растения первого поколения с получением множества растений второго поколения; и отбора из растений второго поколения растения, устойчивого к гербицидам (или содержащего, по меньшей мере, одно из событий по данному изобретению). Эти этапы могут далее включать возвратное скрещивание растения первого поколения или растения второго поколения со вторым родительским растением сои или третьим родительским растением сои. Урожай сои, содержащий семена сои по данному изобретению полученных из них потомков затем можно высаживать.
Также следует понимать, что два разных трансгенных растения также можно скрещивать с получением потомков, которые содержат два независимо расщепляющихся добавленных экзогенных гена. В результате самоопыления подходящих потомков можно получать растения, гомозиготные по обоим добавленным экзогенным генам. Возвратное скрещивание с родительским растением и ауткроссинг с нетрансгенным растением также предусмотрено, как и вегетативное размножение. В данной области известны и другие способы скрещивания, широко используемые для различных признаков и культур. Систему разведения посредством возвратного скрещивания применяют для переноса генов, кодирующих хорошо наследуемые признаки с простым наследованием, в желаемый гомозиготный сорт или инбредную линию, представляющую собой рекуррентного родителя. Источник признака, подлежащего переносу, называют родителем-донором. Полученное растение, как ожидают, имеет признаки рекуррентного родителя (например, сорта) и желаемый признак, перенесенный от родителя-донора. После первого скрещивания выбирают экземпляры, имеющие фенотип родителя-донора, и повторно скрещивают их (возвратное скрещивание) с рекуррентным родителем. Полученное родительское растение, как ожидают, имеет признаки рекуррентного родителя (например, сорта) и желаемый признак, перенесенный от родителя-донора.
Молекулы ДНК по настоящему изобретению можно использовать в качестве молекулярных маркеров в способе скрещивания с использованием маркера (MAB). Молекулы ДНК по настоящему изобретению можно использовать в способах (таких как, способы с применением маркеров AFLP, маркеров RFLP, маркеров RAPD, SNP и SSR), которые позволяют идентифицировать генетически связанные агрономически полезные признаки, известные в данной области. Признак устойчивости к гербицидам можно отслеживать в потомках от скрещивания с растением сои по данному изобретению (или их потоками и любым другим сортом или разновидностью сои) с применением способов MAB. Молекулы ДНК являются маркерами этого признака, и способы MAB, хорошо известные в данной области, можно использовать для отслеживания признака(ов) устойчивости к гербицидам в растениях сои, где, по меньшей мере, одна линия сои по данному изобретению или ее потомки была родителем или предком. Способы по настоящему изобретению можно использовать для идентификации любой разновидности сои, содержащей рассматриваемое событие.
Способы по данному изобретению включают способ получения устойчивого к гербицидам растения сои, где указанный способ включает интрогрессию события pDAB8264.44.06.1 в сорт сои. Более конкретно, способы по настоящему изобретению могут включать скрещивание двух растений по данному изобретению или одного растения по данному изобретению и любого другого растения. Предпочтительные способы дополнительно включают отбор потомков от указанного скрещивания посредством анализа указанных потомков на наличие события, детектируемого по данному изобретению. Например, данное изобретение можно использовать для отслеживания рассматриваемого события в циклах размножения растений, содержащих другие желаемые признаки, такие как агрономические признаки, такие как приведенные в настоящем документе в различных примерах. Растения, содержащие рассматриваемое событие и желаемый признак, можно детектировать, идентифицировать, отбирать и, например, сразу же использовать в дальнейших циклах скрещивания. Рассматриваемое событие/признак также можно комбинировать посредством скрещивания с признаком(ами) резистентности к насекомым и/или с дополнительными признаками устойчивости к гербицидам и отслеживать согласно данному изобретению. Один из вариантов осуществления последнего представляет собой растение, содержащее рассматриваемое событие, комбинированное с геном, кодирующим резистентность к гербициду дикамба.
Таким образом, данное изобретение можно комбинировать с, например, дополнительными признаками, обеспечивающими устойчивость к глифосату (например, устойчивость к растительной или бактериальной глифосат-оксидазе (GOX)), глифосат-ацетил-трансферазе (GAT), дополнительными признаками устойчивости к глуфосинату (например, устойчивость к биалафосу (bar)), признаки, обеспечивающие устойчивость к ингибирующему ацетолактатсинтазу (ALS) гербициду (например, имидазолиноны [такие как имазетапир], сульфонилмочевины, триазолопиримидин сульфонанилид, пирмидинилтиобензоаты и другие химические вещества [Csrl, SurA и другие]), признаками устойчивости к бромоксинилу (например, Bxn), признаками устойчивости к гербициду дикамба (см., например, U.S. 2003/0135879), признаками устойчивости к ингибиторам HPPD (4-гидроксифенил-пируват-диоксигеназа), признаками устойчивости к ингибиторам фитоин десатуразы (PDS), признаками устойчивости к гербицидам, ингибирующим фотосистему II (например, psbA), признаками устойчивости к гербицидам, ингибирующим фотосистему I, признаками устойчивости к гербицидам, ингибирующим протопорфироген оксидазу IX (PPO) (например, PPO-1) и признаками устойчивости к гербицидам на основе фенилмочевины (например, CYP76B1). Один или несколько таких признаков можно комбинировать с данным изобретением с получением возможности эффективного контроля, отсрочки и/или предотвращения смены сорняков и/или устойчивости сорняков к гербицидам различных классов.
Специалисты в данной области понимают, что ген aad-12, применяемый в данном изобретении, также предоставляет резистентность к соединениям, которые превращаются в гербициды на основе феноксиацетата и ауксина (например, 2,4-DB, MCPB и т.д.). Составная группа масляной кислоты, которая содержится в гербициде 2,4-DB, превращается посредством β-окисления в фитотоксичную 2,4-дихлорфеноксиуксусную кислоту. Аналогично, MCPB превращается посредством β-окисления в фитотоксичную MCPA. Гербициды на основе бутановой кислоты, сами по себе, не имеют гербицидных свойств, однако в восприимчивых растениях они превращаются в кислотную форму посредством β-окисления с образованием уксусно-кислотной формы гербицида, которая является фитотоксичной.
Растения, неспособные на быстрое β-окисление, не повреждаются под воздействием гербицидов на основе бутановой кислоты. Однако растения, которые способны к быстрому β-окислению и которые могут превращать гербицид на основе бутановой кислоты в его уксусную форму, защищают AAD-12.
Способы применения гербицидов хорошо известны в данной области. Такие области применения могут включать баковые смеси более чем одного гербицида. Предпочтительные гербициды для применения согласно данному изобретению представляют собой комбинации гербицидов на основе глифосата, глуфосината и феноксиауксина (такие как 2,4-D; 2,4-DB; MCPA; MCPB). Другие предпочтительные комбинации включают глифосат в сочетании с 2,4-D или глуфосинат в сочетании 2,4-D. Эти три типа гербицидов можно использовать в эффективных комбинациях, которые понятны специалистам в данной области, применяющим данное изобретение. Один или несколько рассматриваемых гербицидов можно использовать на поле/участке перед засевом семенами по данному изобретению. Такой способ можно применять, например, в течение 14 суток, посадки семян по данному изобретению. Один или несколько рассматриваемых гербицидов также можно применять после посадки и до всходов. Один или несколько рассматриваемых гербицидов также можно применять для обработки почвы (для контроля сорняков) или обработки наземных частей сорняков и/или наземных частей трансгенных растений по данному изобретению. Три рассматриваемых гербицида можно чередовать или использовать в комбинации, например, для контроля или предотвращения появления сорняков, которые могут быть устойчивыми к одному гербициду, но не к другому. Различные периоды нанесения для трех рассматриваемых типов гербицидов можно использовать различными способами, как известно в данной области.
Дополнительно, данное событие можно пакетировать с одним или несколькими дополнительными признаками устойчивости к гербицидам, одним или несколькими дополнительными внутренними признаками (например, резистентность к насекомым (например, Событие 812 или Событие 814), резистентность к грибам или устойчивость к стрессу и другими) или внешними признаками (например, повышенная урожайность, улучшенные характеристики содержания масел, повышенное качество волокон и другими), как трансгенными, так и нетрансгенными. Таким образом, данное изобретение можно использовать для предоставления полного агрономического набора повышенного качества урожая и возможности гибко и экономично контролировать любое количество сельскохозяйственных вредителей.
Способы встраивания полинуклеотидной последовательности в определенный участок хромосомы растительной клетки посредством гомологичной рекомбинации описаны в данной области. Например, сайт-специфичное встраивание, описанное в публикации патентной заявки США №. 2009/0111188 Al, включает применение рекомбиназы или интегразы для встраивания донорной полинуклеотидной последовательности в хромосому-мишень. Кроме того, международная патентная заявка No. WO 2008/021207 описывает гомологичную рекомбинацию с применением цинковых пальцев для встраивания одной или нескольких донорных полинуклеотидных последовательностей в определенные участки генома. Применение рекомбиназы, такой как FLP/FRT, как описано в патенте США № 6720475, или CRE/LOX, как описано в патенте США № 5658772, можно проводить для встраивания полинуклеотидной последовательности в определенный сайт хромосомы. Наконец, применение мегануклеаз для встраивания донорных полинуклеотидов в определенный сайт на хромосоме было описано в Puchta et al., PNAS USA 93 (1996) pp. 5055-5060).
Известны и применяются различные другие способы сайт-специфичного встраивания в растительные клетки (Kumar et al., Trends in Plant Sci. 6(4) (2001) pp. 155-159). Кроме того, системы сайт-специфичной рекомбинации, которые были идентифицированы в нескольких прокариотических и низших эукариотических организмах, можно применять в отношении растений. Примеры таких систем в качестве неограничивающих примеров включают систему рекомбиназы R/RS из плазмиды pSRl дрожжей Zygosaccharomyces rouxii (Araki et al. (1985) J. Mol. Biol. 182: 191-203), и систему фага Mu Gin/gix (Maeser и Kahlmann (1991) Mol. Gen. Genet. 230: 170-176).
В некоторых вариантах осуществления настоящего изобретения может быть желательным вставить или пакетировать новый трансген(ы) вблизи существующего трансгенного события. Трансгенным событием можно считать предпочтительный геномный локус, выбранный на основе уникальных характеристик, таких как один сайт встраивания, нормальное менделеевское расщепление и стабильная экспрессия, и выгодной комбинации эффективности, включая устойчивость к гербицидам, и сельскохозяйственные характеристики в различных условиях окружающей среды. Новые интегрируемые трансгены должны поддерживать характеристики экспрессии трансгена существующего трансформанта. Кроме того, можно не проводить разработку анализов для детектирования и подтверждения нового интегрируемого события, поскольку геномные фланкирующие последовательности и расположение на хромосоме нового интегрируемого события уже идентифицированы. Наконец, интеграция нового трансгена в специфичный участок хромосомы, связанный с существующим трансгеном, упрощает интрогрессию трансгенов в другое генетическое окружение при ауткроссинге с применением общепринятых способов скрещивания.
В некоторых вариантах осуществления настоящего изобретения может быть желательным вырезать полинуклеотидные последовательности из трансгенного события. Например, вырезание трансгена, описанное в патентной заявке США No. 13/011666, включает применение нуклеазы "цинковые пальцы" для удаления полинуклеотидной последовательности, состоящей из экспрессионной кассеты, из встроенного в хромосому трансгенного события. Удаленная полинуклеотидная последовательность может быть селектируемым маркером. После вырезания и удаления полинуклеотидной последовательности в модифицированное трансгенное событие можно повторно вставлять полинуклеотидную последовательность. Вырезание полинуклеотидной последовательности и последующее повторное направленное воздействие на модифицированное трансгенное событие предоставляет преимущества, такие как повторное использование селектируемого маркера или возможность избежать непредусмотренных изменений в транскриптоме растения, которые возникают, вследствие экспрессии определенных генов.
Данное изобретение раскрывает специфичный сайт на хромосоме 6 генома сои, который очень хорошо подходит для вставки гетерологичных нуклеиновых кислот. Также раскрыты 5'-фланкирующая последовательность и 3'-фланкирующая последовательность, которые можно применять для идентификации и/или направленного воздействия на участок вставки/сайта-мишени на хромосоме 6. Таким образом, данное изобретение предоставляет способы встраивания рассматриваемых гетерологичных нуклеиновых кислот в данный предварительно установленный сайт-мишень или в участок вблизи этого сайта-мишени. Данное изобретение также охватывает семена сои и/или растения сои, содержащие гетерологичную нуклеотидную последовательность, встроенную в раскрытый сайт-мишень или в участок вблизи этого сайта. Один из способов осуществления такого направленного встраивания заключается в вырезании и/или замещении другой вставки на месте экспрессирующей кассеты pat, приведенной в пример в настоящем документе. В этом отношении направленную гомологичную рекомбинацию можно использовать, в качестве неограничивающего примера, согласно данному изобретению.
В рамках изобретения "пакетирование" гена, события или признака представляет собой комбинирование желаемых признаков в одной трансгенной линии. Растениеводы-селекционеры пакетируют трансгенные признаки посредством скрещивания родителей, каждый из которых имеет желаемый признак, и затем идентификации потомков, которые имеют оба этих желаемых признака. Другой способ пакетирования генов заключается в переносе двух или более генов в клеточное ядро растения одновременно с трансформацией. Другой способ пакетирования генов заключается в повторной трансформации трансгенного растения с другим представляющим интерес геном. Например, пакетирование генов можно использовать для комбинирования двух или более различных признаков, включая, например, два или более различных признаков резистентности к насекомым и признаков резистентности к заболеванию(ям), два или более признаков резистентности к гербициду(ам) и/или признаков устойчивости к насекомым и признаков устойчивости к гербициду(ам). Применение селектируемого маркера в дополнение к представляющему интерес гену также можно рассматривать как пакетирование генов.
"Гомологичная рекомбинация" относится к взаимодействию любой пары нуклеотидных последовательностей, содержащих соответствующие сайты с одинаковой нуклеотидной последовательностью, посредством которых две нуклеотидные последовательности могут взаимодействовать (рекомбинировать) с получением новой, рекомбинантной последовательности ДНК. Участки с одинаковой нуклеотидной последовательностью в настоящем документе обозначены как "гомологичные последовательности". Как правило, частота гомологичной рекомбинации увеличивается по мере удлинения гомологичной последовательности. Таким образом, хотя гомологичная рекомбинация может происходить между двумя не совсем идентичными нуклеотидными последовательностями, частота рекомбинации (или эффективность) уменьшается по мере увеличения различий между двумя последовательностями. Рекомбинацию можно проводить с применением одной гомологичной последовательности в каждой донорной молекуле и молекуле-мишени, получая продукт рекомбинации в результате одиночного кроссовера. Альтернативно, в нуклеотидную последовательность-мишень и донорную нуклеотидную последовательность можно помещать по две гомологичные последовательности. Рекомбинация двух гомологичных последовательностей донора с двумя гомологичными последовательностями мишени приводит к получению продукта рекомбинации в результате двойного кроссовера. Если гомологичные последовательности донорной молекулы фланкируют последовательность, подлежащую воздействию (например, представляющую интерес последовательность), рекомбинация с молекулой-мишенью посредством двойного кроссовера приводит к получению продукта рекомбинации, в котором представляющая интерес последовательность замещает ДНК-последовательность, исходно находившуюся между гомологичными последовательностями молекулы-мишени. Событие обмена ДНК-последовательностями мишени и донора, посредством рекомбинации с двойным кроссовером, называют "замещением последовательности".
Рассматриваемое событие обеспечивает трансгенную экспрессию трех различных белков устойчивости к гербицидам, которая приводит к устойчивости к комбинациям гербицидам, позволяющей контролировать почти все широколиственные и травянистые сорняки. Такую экспрессирующую кассету/трансгенную вставку, обеспечивающую признак множественной устойчивости к гербицидам, можно пакетировать, например, с другими признаками устойчивости к гербицидам (например, резистентности к глифосату, резистентности к глуфосинату, резистентности к имидазолинону, резистентности к дикамбе, резистентности к HPPD, резистентности к бромоксинилу и т.п.) и признаками резистентности к насекомым (такие как CrylF, CrylAb, CrylAc, Cry34/45, CrylBe, CrylCa, CrylDa, CrylEa, CrylFa, вегетативные инсектицидные белки ("VIPS") - включая VIP3A, и т.п.). Дополнительно, белки устойчивости к гербицидам в экспрессирующей кассете /трансгенной вставке по данному изобретению могут выступать в качестве одного или нескольких селектируемых маркеров для отбора первичных трансформантов растений, в которые способами генной инженерии был вставлен второй ген или группа генов.
Эти комбинации признаков дают начало для появления новых способов контроля сорняков (и подобных им видов), благодаря новоприобретенной резистентности или унаследованной устойчивости к гербицидам (например, глифосату). Таким образом, новые способы контроля сорняков с применением события pDAB8264.44.06.1 находятся в рамках объема изобретения.
Применение рассматриваемых трансгенных признаков, пакетированных или индивидуально трансформированных в сорта, предоставляет способ контроля других устойчивых к гербицидам выбранных сортов, которые не содержат генов, обеспечивающих устойчивость к фенокси-гербицидам, пиридилокси-гербицидам и гербицидам на основе глифосата и/или глуфосинатов.
Предпочтительное растение или семя по данному изобретению содержит в геноме вставочные последовательности, как определено в настоящем документе, а также, по меньшей мере, 20-500 или более смежных фланкирующих нуклеотидов по обе стороны вставки, как описано в настоящем документе. Если не указано иначе, ссылка на фланкирующие последовательности относится к приведенным в SEQ ID NO:l и SEQ ID NO:2. В свою очередь, рассматриваемые события содержат гетерологичную ДНК, встроенную между рассматриваемыми фланкирующими геномными последовательностями, непосредственно примыкающими к встроенной ДНК. Эти фланкирующие последовательности, как ожидается, целиком или частично могут передаваться потомкам, которые получают встроенную ДНК в результате скрещивания родительской линии, содержащей событие.
Данное изобретение включает тканевые культуры регенерирующих клеток растения по данному изобретению. Также включено растение, полученное из такой тканевой культуры, в частности, если указанное растение способно проявлять все морфологические и физиологические свойства приведенного в пример сорта. Предпочтительные растения по данному изобретению имеют все физиологические и морфологические признаки растения, выращенного из хранящихся в банке семян. Данное изобретение дополнительно включает потомков таких семян и семена, несущие представляющие интерес признаки.
Манипуляции (такие как мутация, дальнейшая трансфекция и дальнейшее скрещивание) растений или семян или их частей могут приводить к получению того, что можно обозначить как "по существу производные" сорта. Международный союз по охране новых сортов растений (UPOV) предоставляет следующее руководство для определения того, является ли сорт по существу производным от охраняемого сорта:
[A] сорт нужно определять как, по существу производный от другого сорта ("исходного сорта"), если
(i) он преимущественно получен от исходного сорта или от сорта, который сам преимущественно получен от исходного сорта, при сохранении проявления основных признаков генотипа или комбинации генотипов исходного сорта;
(ii) он ясно отличим от исходного сорта; и
(iii) за исключением различий, возникающих в результате отклонений, он соответствует исходному сорту по проявлению основных признаков генотипа или комбинации генотипов исходного сорта.
UPOV, шестая встреча с международными организациями, Женева, 30 октября 1992 года; документ подготовлен офисом Союза.
В рамках изобретения "линия" представляет собой группу растений, которая демонстрирует, не демонстрирует или почти не демонстрирует генетические вариации между особями в отношении, по меньшей мере, одного признака. Такие линии можно получать посредством нескольких поколений самоопыления и селекции или вегетативного размножения одного родителя с применением культуры тканей или клеток.
В рамках изобретения термины "разновидность" и "сорт" являются синонимичными и относятся к линии, которую используют для коммерческого производства.
"Стабильность" или "стабильный" означает, что в отношении конкретного компонента компонент сохраняется от поколения к поколению и, предпочтительно, по меньшей мере, в трех поколениях на по существу, одинаковом уровне, например, предпочтительно ±15%, более предпочтительно ±10%, наиболее предпочтительно ±5%. На стабильность может влиять температура, местоположение, стресс и время посадки. Сравнение последовательных поколений в полевых условиях должно быть основано на получении компонента одинаковым способом.
"Коммерческую пригодность" определяют как наличие у растения высокой мощности и высокой фертильности, благодаря чему фермеры могут получать урожай с применением общепринятого сельскохозяйственного оборудования, а масло из описанных компонентов можно получать с применением общепринятого оборудования для измельчения и выделения. Коммерчески выгодный урожай при измерении массы семян, содержания масла и общего количества масла, полученного на единицу площади, находится в пределах 15% среднего урожая во всех отношениях сопоставимого коммерческого сорта канолы без признаков высокой ценности, растущего в том же регионе.
"Элитный с агрономической точки зрения" означает, что линия имеет желаемые агрономические характеристики, такие как урожай, зрелость, резистентность к заболеваниям и т.п., в дополнение к устойчивости к гербицидам, обусловленному рассматриваемым событием(ями). Агрономические признаки растения, содержащего событие по данному изобретению, отдельно или в комбинации, как указано в примерах ниже, включены в объем данного изобретения. Любые из этих агрономических признаков и измеренных параметров можно использовать для идентификации таких растений, как в качестве одного значения, так и в качестве крайнего значения или двух крайних значений диапазона признаков, применяемых для идентификации таких растений.
Как ясно специалистам в данной области в свете настоящего изобретения, предпочтительные варианты осуществления наборов для детектирования, могут, например, включать зонды и/или праймеры, направленные на и/или содержащие "соединяющие последовательности" или "переходные последовательности" (где геномная фланкирующая последовательность сои соединяется со вставочной последовательностью). Например, они включают полинуклеотидные зонды, праймеры и/или ампликоны, созданные для идентификации одной или обеих соединяющих последовательностей (где вставка соединяется с фланкирующей последовательностью), как указано в табл. 1. Один общепринятый набор включает один праймер, который гибридизуется с фланкирующей областью, и другой праймер, который гибридизуется со вставкой. Длина таких праймеров часто составляет приблизительно, по меньшей мере, 15 остатков. Согласно такой схеме, праймеры можно использовать для получения /амплификации детектируемого ампликона, который служит признаком наличия события по данному изобретению. Эти праймеры можно использовать для получения ампликона, который охватывает (и включает) соединяющую последовательность, как указано выше.
Праймер(ы) "садящиеся" на фланкирующую последовательность, как правило, гибридизуются в пределах не более чем 200 оснований за пределами соединения. Таким образом, типичные фланкирующие праймеры сконструированы с тем, чтобы содержать, по меньшей мере, 15 остатков на любой из цепей, находящихся в пределах 200 оснований фланкирующих последовательностей с начала вставки. То есть, праймеры, содержащие последовательность подходящего размера из (или гибридизующихся с) примерно от 100 до 200-500 оснований одной или обеих соединяющих последовательностей, приведенных выше, включены в объем данного изобретения. Праймеры для вставки можно таким же образом конструировать для гибридизации с любым участком вставки, однако остатки вставки (включая комплементарную цепь) в пределах примерно от 100 до 200-500 оснований в последовательности(ях) вставки, приведенной выше, можно использовать, например, без ограничений для дизайна таких праймеров.
Специалистам в данной области также известно, что праймеры и зонды можно конструировать для гибридизации в различных стандартных условиях гибридизации и/или ПЦР с участками последовательностей, приведенных в пример в настоящем документе (или комплементарными ими последовательностями), где праймер или зонд не полностью комплементарны приведенной в пример последовательности. То есть, некоторая степень несоответствия является допустимой. Например, для праймера длиной в приблизительно 20 нуклеотидов, как правило, приблизительно один или два нуклеотида, не обязательно должны связываться с противоположной цепью, если неподходящее основание находится внутри последовательности праймера или на конце, противоположном ампликону. Различные подходящие условия гибридизации приведены ниже. Синтетические аналоги нуклеотидов, такие как инозин, также можно использовать в пробах. Также можно использовать зонды, состоящие из пептидо-нуклеиновой кислоты (ПНК), а также ДНК и РНК. Важно, что такие зонды и праймеры являются диагностическими (способны уникально идентифицировать, и различать) для наличия события по данному изобретению.
Следует отметить, что при ПЦР-амплификации могут возникать ошибки, приводящие, например, к незначительным ошибкам в последовательности. А именно, если не указано иначе, последовательности, приведенные в настоящем документе, определяли посредством получения длинного ампликона геномной ДНК сои, а затем клонирования и секвенирования этого ампликона. Нередко при этом обнаруживают небольшие различия и незначительные несоответствия в последовательностях, полученных и определенных таким способом, что объясняется необходимость проведения множества циклов амплификации для получения достаточного количества ампликона для секвенирования геномной ДНК. Специалисты в данной области должны понимать, что любые поправки, необходимые в связи с такими обычными ошибками секвенирования, включены в объем данного изобретения.
Также следует отметить, что нередко некоторая геномная последовательность оказывается удаленной, например, когда последовательность вставлена во время создания конструирования события. Таким образом, некоторые различия могут также возникать между рассматриваемыми фланкирующими последовательностями и геномными последовательностями, приведенными, например, в GENBANK.
Компоненты "вставки" приведены на фигурах, и более подробно рассмотрены в примерах ниже. Полинуклеотидные последовательности ДНК этих компонентов или их фрагменты можно использовать в качестве ДНК-праймеров или зондов в способах по настоящему изобретению.
В некоторых вариантах осуществления изобретения предоставлены композиции и способы для детектирования наличия участка полученной от растения сои трансгенной вставки в геноме растений и семян и т.п. В настоящем документе приведены последовательности ДНК, которые содержат соединяющую последовательность рассматриваемой трансгенной вставки/генома, участки, содержащие соединяющую последовательность, приведенную в настоящем документе, и последовательности, комплементарные любым из таких приведенных в пример последовательностей и любым их участкам. Соединяющая последовательность участка вставки охватывает место соединения гетерологичной ДНК, встроенной в геном, и ДНК клетки сои, фланкирующей участок вставки. Такие последовательности могут быть диагностическими для конкретного события.
На основе этих вставочных и пограничных последовательностей можно получать специфичные к событию праймеры. Анализы, проведенные с применением ПЦР, показали, что линии сои по данному изобретению можно идентифицировать в различных генотипах сои посредством анализа ПЦР-ампликона, полученного с применением этих специфичных к событию наборов праймеров. Эти и другие связанные способы можно использовать для уникальной идентификации таких линий сои. Таким образом, ПЦР-ампликон, полученный с применением таких пар праймеров, является уникальным и может использоваться для идентификации этих линий сои.
В некоторых вариантах осуществления последовательности ДНК, содержащие смежный фрагмент нового участка трансгенной вставки в геном, представляют собой аспект по настоящему изобретению. Включены последовательности ДНК, которые содержат полинуклеотиды трансгенной вставочной последовательности достаточной длины и полинуклеотиды геномной последовательности сои достаточной длины из одного или нескольких указанных выше растений сои и/или последовательности, пригодные для применения в качестве последовательностей праймеров для получения ампликона, служащего диагностическим признаком одного или нескольких из этих растений сои.
Связанные варианты осуществления относятся к последовательностям ДНК, которые содержат, по меньшей мере, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 или более смежных нуклеотидов трансгенного участка последовательности ДНК, приведенной в настоящем документе, или комплементарной ей последовательности, и то же количество нуклеотидов фланкирующей последовательности ДНК сои (такой как SEQ ID NO: l и SEQ ID NO:2 и их участки) из этих последовательностей, или комплементарные им последовательности. Такие последовательности пригодны для применения в качестве ДНК-праймеров для способов амплификации ДНК. Ампликон, полученный с применением этих праймеров, является диагностическим для любого из событий сои, приведенных в настоящем документе. Таким образом, изобретение также включает ампликон, полученный с применением таких ДНК-праймеров и гомологичных им праймеров.
Настоящее изобретение также включает способы детектирования наличия в образце ДНК, которая относится к событию сои, приведенному в настоящем документе. Такие способы могут включать: (a) взаимодействие образца, содержащего ДНК, с набором праймеров, которые при применении в реакции амплификации нуклеиновой кислоты с ДНК из, по меньшей мере, одного из этих событий сои позволяют получать ампликон, который является диагностическим для указанного события(й); (b) проведение реакции амплификации нуклеиновой кислоты с получением такого ампликона; и (c) детектирование ампликона.
Другие способы детектирования по данному изобретению включают способ детектирования наличия в образце ДНК, относящейся к указанному событию, где указанный способ включает: (a) взаимодействие образца, содержащего ДНК, с зондом, который гибридизуется в условиях высокой жесткости с ДНК из, по меньшей мере, одного из указанных событий сои и не гибридизуется в условиях высокой жесткости с контрольным растением сои (ДНК, не содержащее рассматриваемое событие); (b) воздействие на образец и зонд условиями гибридизации высокой жесткости; и (c) детектирование гибридизации зонда с ДНК.
В дополнительных вариантах осуществления данное изобретение включает способы получения растения сои, содержащего событие pDAB8264.44.06.1, где указанный способ включает следующие этапы: (a) скрещивание первой родительской линии сои (содержащей экспрессирующие кассеты по настоящему изобретению, которые обеспечивают указанную резистентность к гербициду для растений указанной линии) со второй родительской линией сои (которая лишена этого признака устойчивости к гербицидам) с получением множества растений-потомков; и (b) отбор растений-потомков с применением молекулярных маркеров. Такие способы могут необязательно включать дополнительный этап возвратного скрещивания растения-потомка со второй родительской линией сои с получением чистого сорта растения сои, обладающего указанным признаком устойчивости к гербицидам.
По другому аспекту изобретения предоставлены способы определения зиготности потомков скрещивания с указанным событием. Указанные способы могут включать взаимодействие образца, содержащего ДНК сои, с набором праймеров по данному изобретению. Указанные праймеры при применении в реакции амплификации нуклеиновой кислоты в отношении геномной ДНК из, по меньшей мере, одного из указанных событий сои позволяют получать первый ампликон, который является диагностическим для, по меньшей мере, одного из указанных событий сои. Такие способы дополнительно содержат проведение реакции амплификации нуклеиновой кислоты с получением первого ампликона; детектирование первого ампликона; и взаимодействие образца, содержащего ДНК сои, с указанным набором праймеров (указанный набор праймеров при применении в реакции амплификации нуклеиновой кислоты в отношении геномной ДНК из растений сои позволяет получать второй ампликон, содержащий нативную геномную ДНК сои, гомологичную геномному участку сои; и проведение реакции амплификации нуклеиновой кислоты с получением второго ампликона. Способы дополнительно содержат детектирование второго ампликона и сравнение первого второго ампликонов в образце, где наличие обоих ампликонов указывает на то, что образец является гетерозиготным по трансгенной вставке.
Наборы детектирования ДНК можно получать с применением композиции, описываемой в настоящем документе, и способы хорошо известны в области детектирования ДНК. Наборы пригодны для идентификации ДНК рассматриваемого события сои в образце и могут применяться в способах разведения растений сои, содержащих такую ДНК. Наборы содержат последовательности ДНК, гомологичные или комплементарные ампликону, например, описанному в настоящем документе, или последовательности ДНК, гомологичные или комплементарные ДНК, содержащейся в трансгенных генетических элементах рассматриваемых событий. Эти последовательности ДНК можно использовать в реакциях амплификации ДНК или в качестве зондов для применения в способах гибридизация ДНК. Наборы могут также включать реагенты и материалы, необходимые для проведения детектирования.
"Зонд" представляет собой изолированную молекулу нуклеиновой кислоты, к которой прикреплена общепринятая детектируемая метка или репортерная молекула (такая как радиоактивный изотоп, лиганд, хемилюминесцентное средство или фермент). Такой зонд комплементарен цепи нуклеиновой кислоты-мишени, в случае по настоящему изобретению цепи геномной ДНК из одного из указанных событий сои: из растения сои из образца, который содержит ДНК события. Зонды по настоящему изобретению содержат не только дезоксирибонуклеиновые или рибонуклеиновые кислоты, но и полиамиды и другие вещества, которые специфически связываются с последовательностью ДНК-мишени, и могут использоваться для детектирования наличия такой последовательности ДНК-мишени. "Изолированный" полинуклеотид означает, что полинуклеотид находится в неестественном состоянии - функционально связанном с гетерологичным промотором, например. "Очищенный" белок, таким же образом, означает белок, который находится в неестественном состоянии.
"Праймеры" представляют собой изолированные/синтезированные нуклеиновые кислоты, которые отжигаются с комплементарной цепью ДНК-мишени, посредством гибридизации нуклеиновой кислоты с образованием гибрида праймера и цепи ДНК-мишени и затем удлиняются вдоль цепи ДНК-мишени полимеразой, например, ДНК-полимеразой. Пары праймеров по настоящему изобретению относятся к их применению для амплификации последовательности нуклеиновой кислоты-мишени, например, посредством полимеразной цепной реакции (ПЦР) или других общепринятых способов амплификации нуклеиновой кислоты.
Длина зондов и праймеров, как правило, составляет 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 277, 278, 279, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289, 290, 291, 292, 293, 294, 295, 296, 297, 298, 299, 300, 301, 302, 303, 304, 305, 306, 307, 308, 309, 310, 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 324, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336, 337, 338, 339, 340, 341, 342, 343, 344, 345, 346, 347, 348, 349, 350, 351, 352, 353, 354, 355, 356, 357, 358, 359, 360, 361, 362, 363, 364, 365, 366, 367, 368, 369, 370, 371, 372, 373, 374, 375, 376, 377, 378, 379, 380, 381, 382, 383, 384, 385, 386, 387, 388, 389, 390, 391, 392, 393, 394, 395, 396, 397, 398, 399, 400, 401, 402, 403, 404, 405, 406, 407, 408, 409, 410, 411, 412, 413, 414, 415, 416, 417, 418, 419, 420, 421, 422, 423, 424, 425, 426, 427, 428, 429, 430, 431, 432, 433, 434, 435, 436, 437, 438, 439, 440, 441, 442, 443, 444, 445, 446, 447, 448, 449, 450, 451, 452, 453, 454, 455, 456, 457, 458, 459, 460, 461, 462, 463, 464, 465, 466, 467, 468, 469, 470, 471, 472, 473, 474, 475, 476, 477, 478, 479, 480, 481, 482, 483, 484, 485, 486, 487, 488, 489, 490, 491, 492, 493, 494, 495, 496, 497, 498, 499, 500 или более нуклеотидов. Такие зонды и праймеры специфично гибридизуются с последовательностью-мишенью в условиях высокой жесткости. Предпочтительно последовательность зондов и праймеров по настоящему изобретению полностью совпадает с последовательностью-мишенью, хотя зонды, отличающиеся от последовательности-мишени и сохраняющие способность гибридизоваться с последовательностями-мишенями, можно конструировать общепринятыми способами.
Способы получения и применения зондов и праймеров описаны, например, в Molecular Cloning: A Laboratory Manual, 2nd ed., vol. 1-3, ed. Sambrook et al., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1989. ПЦР-пары праймеров можно получать от известной последовательности, например, с применением предназначенных для этого компьютерных программ.
Праймеры и зонды, основанные на последовательностях фланкирующих ДНК и вставок, описываемых в настоящем документе, можно использовать для подтверждения (и, при необходимости, для коррекции) раскрытых последовательностей с применением общепринятых способов, например, посредством повторного клонирования и секвенирования таких последовательностей.
Нуклеиновокислотные зонды и праймеры по настоящему изобретению гибридизуются в условиях высокой жесткости с последовательностью ДНК-мишени. Любой общепринятый способ гибридизации или амплификации нуклеиновой кислоты можно использовать для идентификации наличия ДНК трансгенного события в образце. Молекулы нуклеиновой кислоты или их фрагменты способны к специфичной гибридизации с другими молекулами нуклеиновой кислоты в определенных условиях. В рамках изобретения две молекулы нуклеиновой кислоты способны специфично гибридизоваться друг с другом, если две этих молекулы способны образовать антипараллельную двухцепочечную структуру нуклеиновой кислоты. Молекула нуклеиновой кислоты является "комплементарной" другой молекуле нуклеиновой кислоты, если они демонстрируют полную комплементарность. В рамках изобретения молекулы демонстрируют "полную комплементарность", если каждый нуклеотид одной молекулы комплементарен нуклеотиду другой молекулы. Две молекулы являются "минимально комплементарными", если они могут гибридизоваться друг с другом с достаточной стабильностью, позволяющей им оставаться соединенными друг с другом, по меньшей мере, в общепринятых условиях "пониженной жесткости". Таким же образом, молекулы являются "комплементарными", если они могут гибридизоваться друг с другом с достаточной стабильностью, позволяющей им оставаться соединенными друг с другом, в общепринятых условиях "высокой жесткости". Общепринятые условия гибридизации описаны в Sambrook et al., 1989. Отклонения от полной комплементарности являются, таким образом, допустимыми, при условии, что такие отклонения не полностью исключают способность молекул к образованию двухцепочечной структуры. Чтобы молекула нуклеиновой кислоты могла служить в качестве праймера или зонда, она должна быть в достаточной степени комплементарна последовательности, чтобы быть способной образовывать стабильную двухцепочечную структуру при применении определенного растворителя и концентрации солей.
В рамках изобретения по существу гомологичная последовательность представляет собой последовательность нуклеиновой кислоты, которая специфично гибридизуется с комплементарной последовательностью нуклеиновой кислоты, с которой ее сравнивают, в условиях высокой жесткости. Термин "жесткие условия" функционально определяют по отношению к гибридизации нуклеиновокислотного зонда с нуклеиновой кислотой-мишенью (т.е., с определенной, представляющей интерес последовательностью нуклеиновой кислоты) в процессе специфичной гибридизации, как описано в Sambrook et al., 1989, в 9.52-9.55. Также см. Sambrook et al, 1989 в 9.47-9.52 и 9.56-9.58. Таким образом, нуклеотидные последовательности по изобретению можно использовать благодаря их способности к селективному образованию двухцепочечных молекул с комплементарными фрагментами ДНК.
В зависимости от предполагаемого способа применения можно использовать различные условия гибридизации для достижения различной степени селективности зондов по отношению к последовательности-мишени. Для способов применения, требующих высокой селективности, как правило, применяют относительно жесткие условия образования гибридов, например, по отношению к ПЦР по конечной точке с применением TaqMan и ПЦР в реальном времени выбирают от 1,5 мМ до приблизительно 4,0 мМ MgCl2 при температуре от приблизительно 60ºC до приблизительно 75ºC, и варьируют время удержания, как описано в настоящем документе, для повышения жесткости. Для других способов гибридизации, как правило, применяют условия с относительно низким содержанием соли и/или высокой температурой, такие как приблизительно от 0,02 M до приблизительно 0,15 M NaCl при температуре от приблизительно 50ºC до приблизительно 70ºC. Жесткие условия могут включать, например, промывание фильтра для гибридизации, по меньшей мере, в течение двух раз буфером, обеспечивающим жесткими условия (0,2X SSC, 0,1% SDS, 65ºC). Подходящие условия гибридизации, которые способствуют гибридизация ДНК, например, 6.OX хлорида натрия/цитрата натрия (SSC) при приблизительно 45ºC с последующим промыванием 2.OX SSC при 50ºC известны специалистам в данной области. Например, концентрацию солей на этапе промывания можно выбирать от концентрации, обеспечивающей низкую жесткость, составляющей приблизительно 2,0X SSC при 50ºC, до концентрации, обеспечивающей высокую жесткость, составляющей приблизительно 0,2X SSC при 50ºC. Кроме того, температуру на этапе промывания можно повышать от условий низкой жесткости при комнатной температуре, приблизительно 22ºC, до условий высокой жесткости при приблизительно 65ºC. Варьировать можно как температуру, так и концентрацию соли, или температура или концентрация солей может быть неизменной при изменении другого параметра. Такие селективные условия не допускают или почти не допускают несоответствия между зондом и матрицей или цепью-мишенью. Детектирование последовательностей ДНК посредством гибридизации хорошо известно специалистам в данной области, и идеи патентов США №№ 4965188 и 5176995 приведены в качестве примера способов гибридизации.
В особенно предпочтительном варианте осуществления нуклеиновая кислота по настоящему изобретению специфично гибридизуется с одним или несколькими праймерами (или ампликонами или другими последовательностями), приведенными в качестве примера или предложенными в настоящем документе, включая комплементарные им последовательности и их фрагменты, в условиях высокой жесткости. В одном из аспектов настоящего изобретения маркерная молекула нуклеиновой кислоты по настоящему изобретению имеет последовательность нуклеиновой кислоты, указанную в настоящем документе для одной из приведенных в пример последовательностей, или комплементарных ей последовательностей и/или ее фрагментов.
В другом аспекте настоящего изобретения маркерная молекула нуклеиновой кислоты по настоящему изобретению между 80% и 100% или 90% и 100% идентична таким последовательностям нуклеиновой кислоты. В дополнительном аспекте настоящего изобретения маркерная молекула нуклеиновой кислоты по настоящему изобретению между 95% и 100% идентична такой последовательности. Такие последовательности можно использовать в качестве маркеров в способах селекции растений способах для идентификации потомков скрещиваний. Гибридизацию зонда с молекулой ДНК-мишени можно детектировать множеством способов, известных специалистам в данной области, где эти способы в качестве неограничивающих примеров включают флуоресцентные метки, радиоактивные метки, основанные на антителах метки и хемилюминесцентные метки.
По отношению амплификации последовательности нуклеиновой кислоты-мишени (например, посредством ПЦР) с применением определенной пары праймеров для амплификации "жесткие условия" представляют собой условия, которые позволяют паре праймеров гибридизоваться только с последовательностью нуклеиновой кислоты-мишени, с которой гибридизуется праймер, имеющий соответствующую последовательность дикого типа (или комплементарную ей последовательность), и предпочтительно получать уникальный продукт амплификации, ампликон.
Термин "специфичный по отношению к (последовательности-мишени)" означает, что зонд или праймер гибридизуется в условиях высокой жесткости только с последовательностью-мишенью в образце, содержащем последовательность-мишень.
В рамках изобретения "амплифицированная ДНК" или "ампликон" относится к продукту амплификации последовательности нуклеиновой кислоты, которая входит в состав матричной нуклеиновой кислоты. Например, чтобы установить, содержит ли растение сои, полученное в результате скрещивания, трансгенную вставку геномной ДНК из растения сои по настоящему изобретению, ДНК, выделенную из образца ткани растения сои, можно использовать в способе амплификации нуклеиновой кислоты с применением пары праймеров, включающей один праймер, полученный на основе фланкирующей последовательности в геноме растения, прилежащей к участку вставки встроенной гетерологичной ДНК, и второй праймер, полученный на основе встроенной гетерологичной ДНК, с получением ампликона, который является диагностическим для наличия ДНК события. Длина и последовательность ампликона также является диагностической для события. Длина ампликона может варьировать от общей длины пары праймеров плюс один нуклеотид, и/или общей длины пары праймеров плюс приблизительно 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 277, 278, 279, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289, 290, 291, 292, 293, 294, 295, 296, 297, 298, 299, 300, 301, 302, 303, 304, 305, 306, 307, 308, 309, 310, 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 324, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336, 337, 338, 339, 340, 341, 342, 343, 344, 345, 346, 347, 348, 349, 350, 351, 352, 353, 354, 355, 356, 357, 358, 359, 360, 361, 362, 363, 364, 365, 366, 367, 368, 369, 370, 371, 372, 373, 374, 375, 376, 377, 378, 379, 380, 381, 382, 383, 384, 385, 386, 387, 388, 389, 390, 391, 392, 393, 394, 395, 396, 397, 398, 399, 400, 401, 402, 403, 404, 405, 406, 407, 408, 409, 410, 411, 412, 413, 414, 415, 416, 417, 418, 419, 420, 421, 422, 423, 424, 425, 426, 427, 428, 429, 430, 431, 432, 433, 434, 435, 436, 437, 438, 439, 440, 441, 442, 443, 444, 445, 446, 447, 448, 449, 450, 451, 452, 453, 454, 455, 456, 457, 458, 459, 460, 461, 462, 463, 464, 465, 466, 467, 468, 469, 470, 471, 472, 473, 474, 475, 476, 477, 478, 479, 480, 481, 482, 483, 484, 485, 486, 487, 488, 489, 490, 491, 492, 493, 494, 495, 496, 497, 498, 499, или 500, 750, 1000, 1250, 1500, 1750, 2000 или более нуклеотидов (плюс или минус любые дополнительные нуклеотиды, приведенные выше). Альтернативно, пару праймеров можно получать на основе фланкирующей последовательности по обе стороны встроенной ДНК с тем, чтобы получать ампликон, который включает всю вставочную нуклеотидную последовательность. Член пары праймеров, полученной на основе геномной последовательности растения, может располагаться на некотором расстоянии от встроенной последовательности ДНК. Это расстояние может варьировать от одного нуклеотида до приблизительно двадцати тысяч нуклеотидов. Применением термина "ампликон" не включает димеры праймеров, которые могут образовываться при проведении реакции термальной амплификации ДНК.
Амплификацию нуклеиновой кислоты можно проводить посредством любого из множества способов амплификации нуклеиновой кислоты, известных в данной области, включая полимеразную цепную реакцию (ПЦР). В данной области известно множество способов амплификации, описанных, в том числе, в патенте США № 4683195 и патенте США № 4683202. Известны способы ПЦР-амплификации, которые позволяют амплифицировать до 22 т.п.н. геномной ДНК. Эти способы, а также другие известные в данной области способы амплификации ДНК, можно использовать в практическом осуществлении настоящего изобретения. Последовательность гетерологичной трансгенной вставки ДНК или фланкирующей геномной последовательности рассматриваемого события сои можно подтверждать (и при необходимости корректировать), посредством амплификации таких последовательностей события с применением праймеров, полученных на основе последовательностей, приведенных в настоящем документе, с последующим стандартным секвенированием ПЦР-ампликона или клонированной ДНК.
Ампликон, полученный этими способами, можно детектировать посредством множества способов. Электрофорез в агарозном геле и окрашивание бромистым этидием представляет собой общепринятый хорошо известный способ детектирования ампликона. Другой такой способ представляет собой анализ Genetic Bit, в котором конструируют олигонуклеотид ДНК, который перекрывается с последовательностью прилежащей фланкирующей геномной ДНК и последовательностью ДНК вставки. Олигонуклеотид иммобилизуют в лунках планшета. После проведения ПЦР представляющего интерес участка (с применением одного праймера в последовательности вставки и одного праймера в прилежащей фланкирующей геномной последовательности) одноцепочечный продукт ПЦР можно гибридизовать с иммобилизованным олигонуклеотидом и использовать в качестве матрицы в реакции удлинения цепи на одно основание с применением ДНК-полимеразы и меченных ddNTP, специфичных для ожидаемого следующего основания. Результаты можно получать на основе флуоресценции или ELISA. Сигнал указывает на наличие вставочной/фланкирующей последовательности в результате успешной амплификации, гибридизации и реакции удлинения на одно основание.
Другой способ представляет собой пиросеквенирование, как описано Winge (Innov. Pharma. Tech. 00: 18-24, 2000). В этом способе конструируют олигонуклеотид, который перекрывается с местом соединения прилежащей геномной ДНК и встроенной ДНК. Олигонуклеотид гибридизуют с одноцепочечным продуктом ПЦР представляющего интерес участка (один праймер во вставочной последовательности, а второй во фланкирующей геномной последовательности) и инкубируют в присутствии ДНК-полимеразы, АТФ, сульфурилазы, люциферазы, апиразы, аденозин-5'-фосфосульфата и люциферина. Отдельно добавляют DNTP и измеряют результаты встраивания по световому сигналу. Световой сигнал указывает на наличие трансгенной встроенной/фланкирующей последовательности в результате успешной амплификации, гибридизации и реакции удлинения на одно или множество оснований.
Флуоресцентная поляризация представляет собой другой способ, который можно использовать для детектирования ампликона по настоящему изобретению. Согласно этому способу, конструируют олигонуклеотид, который перекрывается с местом соединения геномной фланкирующей ДНК и встроенной ДНК. Олигонуклеотид гибридизуют с одноцепочечным продуктом ПЦР представляющего интерес участка (один праймер во вставочной последовательности, а второй во фланкирующей геномной последовательности) и инкубируют в присутствии ДНК-полимеразы и флуоресцентно-меченных ddNTP. Реакция удлинения на одно основание приводит к включению ddNTP. Включение можно измерять на основе изменения поляризации с применением флуориметра. Изменение поляризации указывает на наличие трансгенной встроенной/фланкирующей последовательности в результате успешной амплификации, гибридизации и реакции удлинения на одно основание.
TAQMAN (PE Applied Biosystems, Foster City, Calif.) представляет собой способ детектирования количественной оценки наличия последовательности ДНК. В кратком изложении, конструируют олигонуклеотидный зонд FRET, который перекрывается с местом соединения геномной фланкирующей ДНК и встроенной ДНК. Зонд FRET и праймеры ПЦР (один праймер во вставочной последовательности, а второй во фланкирующей геномной последовательности) подвергают циклической обработке в присутствии термостабильной полимеразы и dNTP. Во время специфичной амплификации Taq ДНК-полимераза высвобождает флуоресцентную составную группу от подвергающейся гашению составной группы зонда FRET. Флуоресцентный сигнал указывает на наличие трансгенной встроенной/фланкирующей последовательности в результате успешной амплификации и гибридизации.
Молекулярные маяки описаны для применения в детектировании последовательностей. В кратком изложении, конструируют олигонуклеотидный зонд FRET, который перекрывается с местом соединения фланкирующей геномной ДНК и встроенной ДНК. Уникальная структура зонда FRET заключается в том, что он содержит вторичную структуру, которая удерживает флуоресцентную составную группу и гаситель флуоресценции в непосредственной близости. Зонд FRET и праймер ПЦР (один праймер во вставочной последовательности, а второй во фланкирующей геномной последовательности) подвергают циклической обработке в присутствии термостабильной полимеразы и dNTP. После успешной ПЦР-амплификации гибридизация зонда FRET с последовательностью-мишенью приводит к удалению вторичной структуры зонда и пространственному разделению флуоресцентной составной группы и группы-гасителя. В результате возникает флуоресцентный сигнал. Флуоресцентный сигнал указывает на наличие трансгенной встроенной/фланкирующей последовательности в результате успешной амплификации и гибридизации.
После установления участка генома сои, хорошо подходящего для вставки, данное изобретение также включает семена сои и/или растения сои, содержащие, по меньшей мере, одну кодирующую последовательность non-aadl2/pat/2mepsps внутри или рядом с этим участком генома. Один из способов заключается во встраивании другой вставки на место вставки, приведенной в пример в настоящем документе. В этом отношении целевую гомологичную рекомбинацию, например, можно использовать согласно данному изобретению. Такие способы являются объектом, например, WO 03/080809 A2 и соответствующей опубликованной заявки США (U.S. 2003/0232410). Таким образом, данное изобретение включает растения и растительные клетки, содержащие гетерологичную вставку (вместо или совместно с множеством копий приведенной в пример вставки), фланкированную целой или распознаваемым участком фланкирующих последовательностей, приведенных в настоящем документе в SEQ ID NO:l и SEQ ID NO:2. Дополнительная копия (или дополнительные копии) приведенной в пример вставки или любых ее компонентов также можно применять для встраивания таким способом/такими способами.
Все патенты, патентные заявки, предварительные заявки и публикации, упоминаемые или цитируемые в настоящем документе, полностью включены в качестве ссылки в объеме, соответствующем явной идее настоящей заявки.
Следующие примеры включены с целью иллюстрации способов осуществления изобретения и демонстрации определенных предпочтительных вариантов осуществления изобретения. Эти примеры не следует рассматривать как ограничивающие. Специалисты в данной области должны понимать, что способы, раскрытые в приведенных ниже примерах, представляют конкретные подходы, использованные для иллюстрации предпочтительных способов осуществления. Однако специалисты в данной области должны, в свете настоящего изобретения, понимать, что в эти конкретные варианты осуществления можно вносить множество изменений с получением таких же или сходных результатов без отступления от существа и объема изобретения. Если не указано иначе, все процентные значения приведены по массе, а все пропорции смесей растворителей приведены по объему.
Если не указано иначе, используют следующие сокращения.
п.н. - пара нуклеотидов
ºC - градусы Цельсия
ДНК - дезоксирибонуклеиновая кислота
DIG - дигоксигенин
ЭДТА - этилендиаминтетрауксусная кислота
т.п.н. - тысяча пар нуклеотидов
мкг - микрограмм
мкл - микролитр
M - молярная масса
OLP - перекрывающийся зонд
ПЦР - полимеразная цепная реакция
PTU - единица транскрипции растения
SDS - додецилсульфат натрия
СОП - стандартная операционная процедура
SSC - буферный раствор, содержащий смесь хлорида натрия и цитрата натрия, pH 7,0
TBE - буферный раствор, содержащий смесь основания Tris, борной кислоты и ЭДТА, pH 8,3
В - вольт
ПРИМЕРЫ
Пример 1: Трансформация и отбор соевого события 8264.44.06.1 с 2mEPSPS и AAD-12
Трансгенную сою (Glycine max), содержащую событие сои 8264.44.06.1, получали посредством опосредованной Agrobacterium трансформации эксплантата семядольного узла сои. Для инициации трансформации использовали нейтрализованный штамм Agrobacterium EHA101 (Hood et al., 2006), несущий бинарный вектор pDAB8264 (фиг.1), содержащий селектируемый маркер, pat и представляющие интерес гены, aad-12 и 2mepsps vl, в участке T-ДНК.
Опосредованную Agrobacterium трансформацию проводили посредством модифицированного способа по Zeng et al. (2004). В кратком изложении, семена сои (cv Maverick) проращивали на базальной среде, выделяли семядольные узлы, и инфицировали их Agrobacterium. Среды для начала роста и удлинения побегов и укоренения обогащали цефотаксимом, тиментином и ванкомицином для удаления Agrobacterium. Глуфосинат применяли для ингибирования роста нетрансформированных побегов. Выбранные побеги переносили на среду для укоренения для развития корней, а затем переносили на почвенную смесь для акклиматизации ростков.
Терминальные листья выбранных ростков обрабатывали глуфосинатом для поиска предполагаемых трансформантов. Отобранные ростки переносили в теплицу, оставляли для акклиматизации, а затем обрабатывали листья глуфосинатом для повторного подтверждения устойчивости и принадлежности к предполагаемым трансформантам. С отобранных ростков брали образцы, и проводили молекулярный анализ для подтверждения наличия гена селективного маркера и/или представляющего интерес гена. Растения оставляли в теплице для самоопыления с получением семян T1.
Рассматриваемое событие сои 8264.44.06.1 получали из независимой трансформированной культуры. Растения T1 возвратно скрещивали и в течение последующих поколений интрогрессировали в элитные сорта. Событие выбирали на основе его уникальных признаков, таких как одиночный участок вставки, нормальное менделеевское расщепление и стабильная экспрессия, и эффективного сочетания признаков, включая устойчивость к гербицидам и сельскохозяйственные свойства. Следующие примеры содержат данные, которые использовали для описания соевого события 8264.44.06.1.
Пример 2: Описание белков AAD-12, 2mEPSPS и PAT в соевом событии 8264.44.06.1
Описывали биохимические свойства рекомбинантых белков AAD-12, 2mEPSPS и PAT, полученных из трансгенного соевого события pDAB8264.44.06.1. Количественный твердофазный иммуноферментный анализ (ELISA) использовали для описания биохимических свойств белков и подтверждения экспрессии белков AAD-12, PAT и 2mEPSPS.
Пример 2.1: Экспрессия белка AAD-12 в растительных тканях
Определяли уровни белка AAD-12 в соевом событии 8264.44.06.1. Растворимый экстрагируемый белок AAD-12 из ткани листа сои измеряли с применением количественного твердофазного иммуноферментного анализа (ELISA).
Образцы тканей сои получали из изучаемых растений, и подготавливали к анализу экспрессии. Белок AAD-12 экстрагировали из тканей растения сои посредством раствора фосфатно-солевого буфера, содержащего детергент Tween-20 (PBST) с 0,5% бычьего сывороточного альбумина (BSA). Растительную ткань центрифугировали; водный супернатант собирали, по мере необходимости разводили подходящим буфером и анализировали с применением набора AAD-12 ELISA в многослойном формате. Набор использовали согласно предложенному производителем протоколу.
Детектирование проводили для изучения стабильности экспрессии и наследуемости вертикальной (между поколениями) и горизонтальной (между линиями одного поколения) события сои 8264.44.06.1. В поколении T4 события сои 8264.44.06.1 экспрессия была стабильной (не расщепляющейся) и постоянной для всех линий. Экспериментальное изучение уровня экспрессии проводили для события сои; средний уровень экспрессии среди всех линий составлял приблизительно 200-400 нг/см2.
Пример 2.2: Экспрессия белка 2mEPSPS в растительных тканях
Определяли уровни белка 2mEPSPS в соевом событии 8264.44.06.1. Растворимый экстрагируемый белок 2mEPSPS из ткани листа сои измеряли с применением количественного твердофазного иммуноферментного анализа (ELISA).
Образцы тканей сои получали из изучаемых растений, и подготавливали к анализу экспрессии. Белок 2mEPSPS экстрагировали из тканей растения сои посредством раствора фосфатно-солевого буфера, содержащего детергент Tween-20 (PBST) с 0,5% бычьего сывороточного альбумина (BSA). Растительную ткань центрифугировали; водный супернатант собирали, по мере необходимости разводили подходящим буфером и анализировали с применением набора 2mEPSPS ELISA в многослойном формате. Набор использовали согласно предложенному производителем протоколу.
Детектирование проводили для изучения стабильности экспрессии и наследуемости вертикальной (между поколениями) и горизонтальной (между линиями одного поколения) события сои 8264.44.06.1. В поколении T4 события сои 8264.44.06.1 экспрессия была стабильной (не расщепляющейся) и постоянной для всех линий. Экспериментальное изучение уровня экспрессии проводили для события сои 8264.44.06.1. Средний уровень экспрессии среди всех линий составлял приблизительно 5000-17500 нг/см2. Такие уровни экспрессии были выше, чем положительный контроль, который экспрессировал белок 2mEPSPS.
Пример 2.3: Экспрессия белка PAT в растительных тканях
Определяли уровни белка PAT в соевом событии 8264.44.06.1. Растворимый экстрагируемый белок PAT из ткани листа сои измеряли с применением количественного твердофазного иммуноферментного анализа (ELISA).
Образцы тканей сои получали из изучаемых растений и подготавливали к анализу экспрессии. Белок PAT экстрагировали из тканей растения сои, посредством раствора фосфатно-солевого буфера, содержащего детергент Tween-20 (PBST) с 0,5% бычьего сывороточного альбумина (BSA). Растительную ткань центрифугировали; водный супернатант собирали, по мере необходимости разводили подходящим буфером и анализировали с применением набора PAT ELISA в многослойном формате. Набор использовали согласно предложенному производителем протоколу.
Детектирование проводили для изучения стабильности экспрессии и наследуемости вертикальной (между поколениями) и горизонтальной (между линиями одного поколения) события сои 8264.44.06.1. В поколении T4 события сои 8264.44.06.1 экспрессия была стабильной (не расщепляющейся) и постоянной для всех линий. Экспериментально изучение уровня экспрессии проводили для события сои 8264.44.06.1. Средний уровень экспрессии среди всех линий составлял приблизительно 15-25 нг/см2.
Пример 3: Клонирование и описание последовательностей ДНК вставки фланкирующих пограничных участков события сои pDAB8264.44.06.1
Для описания и оценки геномного участка вставки определяли последовательность фланкирующей геномной области Т-ДНК события сои pDAB8264.44.06.1. В целом подтверждали 2578 п.н. геномной последовательности события сои pDAB8264.44.06.1, включающей 570 п.н. 5'-фланкирующей пограничной последовательности (SEQ ID NO:l) и 1499 п.н. 3'-фланкирующей пограничной последовательности (SEQ ID NO:2). ПЦР-амплификация, проведенная для пограничных последовательностей события сои pDAB8264.44.06.1, подтверждала, что пограничные участки были получены от сои, и что участки соединения представляют собой уникальные для события pDAB8264.44.06.1 последовательности. Участки соединения можно использовать для специфичной идентификации соевого события pDAB8264.44.06.1. Кроме того, участок Т-ДНК вставки оценивали посредством амплификации геномного фрагмента, соответствующего участку идентифицированной фланкирующей пограничной последовательности из генома сои дикого типа. Сравнение события сои pDAB8264.44.06.1 с геномной последовательностью дикого типа показало делецию приблизительно 4357 п.н. из исходного локуса. В целом, описание вставочной и пограничных последовательностей события сои pDAB8264.44.06.1 показало, что в геноме сои присутствует интактная копия Т-ДНК.
Пример 3.1: Подтверждение геномной последовательности сои
5'- и 3'-фланкирующие пограничные последовательности выравнивали с полной последовательностью хромосомы 6 генома Glycine max, полученной посредством секвенирования способом shotgun для подтверждения того, что трансген из соевого события pDAB8264.44.06.1 встроился в хромосому 6 генома сои. Для подтверждения участка вставки трансгена соевого события pDAB8264.44.06.1 из генома сои проводили ПЦР с различными парами праймеров (фиг.2 и табл. 3). Геномную ДНК из соевого события pDAB8264.44.06.1 и другие трансгенные или нетрансгенные линии сои использовали в качестве матрицы. Таким образом, для подтверждения правильности 5'-пограничных последовательностей использовали специфичный к 2mepsps праймер, например, ED_vl_Cl (SEQ ID NO:l1) и два праймера, сконструированных на основе клонированной 5'-пограничной последовательности и/или выравненной последовательности на хромосоме 6 генома сои, 4406-WF1 (SEQ ID NO:3) и 4406-WF3 (SEQ ID NO:5), для амплификации участка ДНК, который охватывает ген 2mepsps до 5'-пограничной последовательности. Таким же образом, для подтверждения клонированной 3'-пограничной последовательности использовали специфичный к pat праймер, например, PAT-12 (SEQ ID NO:12), и три праймера, сконструированные на основе клонированной 3'-пограничной последовательности, 4406-WR5 (SEQ ID NO:7), 4406-WR7 (SEQ ID NO:9) и 4406-WR8 (SEQ ID NO:10), для амплификации участков ДНК, которые охватывают ген pat до 3'-пограничной последовательности. Фрагменты ДНК с теоретически рассчитанной длиной амплифицировали только на основе геномной ДНК соевого события pDAB8264.44.06.1 с применением каждой пары праймеров, где один праймер находится на фланкирующей последовательности события сои pDAB8264.44.06.1, а другой праймер специфичен к трансгену, но не из образцов ДНК от других трансгенных линий сои или нетрансгенных контрольных линий. Результаты указывают на то, что клонированные 5'- и 3'-пограничные последовательности представляют собой фланкирующие пограничные последовательности вставки ЕТ-ДНК события сои pDAB8264.44.06.1.
Для дальнейшего подтверждения вставки ДНК в геном сои проводили ПЦР-амплификацию двух последовательностей сои. Два праймера, сконструированных конструировали на основе 5'-пограничной последовательности, 4406-WF1 (SEQ ID NO:3) и 4406-WF3 (SEQ ID NO:5), и два праймера, сконструированных на основе 3-пограничной последовательности, 4406-WR5 (SEQ ID NO:7) и 4406-WR7 (SEQ ID NO:9), использовали для амплификации участков ДНК, которые содержат полный трансген, 5'-пограничную последовательность и 3'-пограничную последовательность. Как и ожидалось, ПЦР-амплификация с парой праймеров 4406-WF1 (SEQ ID NO:3) и 4406-WR5 (SEQ ID NO:7) позволяла амплифицировать фрагмент ДНК из геномной ДНК события сои pDAB8264.44.06.1 длиной приблизительно в 12 т.п.н. и фрагмент ДНК из нетрансгенных контрольных линий сои и других трансгенных линий сои длиной в 6 т.п.н. Таким же образом, реакции ПЦР, которые проводили с парой праймеров 4406-WF3 (SEQ ID NO:5) и 4406-WR7 (SEQ ID NO:9), позволяли получать фрагмент ДНК из образца события сои pDAB8264.44.06.1 длиной приблизительно в 12 т.п.н. и фрагмент ДНК из всех остальных контрольных линий сои длиной в 6 т.п.н., соответственно. Эти результаты показывают на то, что трансген события сои pDAB8264.44.06.1 был встроен в участок на хромосоме 6 генома сои. Выравнивание идентифицированных 5'-и 3'-пограничных последовательностей события сои pDAB8264.44.06.1 с полной последовательностью хромосомы 6 генома Glycine max, секвенированной способом shotgun, указывало на наличие делеции приблизительно 4,4 т.п.н. из исходного локуса (фиг.3).
Пример 4: Описание события сои pDAB8264.44.06.1 посредством Саузерн-блоттинга
Саузерн-блоттинг использовали для установления паттерна встраивания события сои pDAB8264.44.06.1. Эти эксперименты позволили получить данные, которые продемонстрировали встраивание и целостность вставок aad-12, pat и 2mepsps vl в геном сои. Событие сои pDAB8264.44.06.1 описывали как событие полной длины с простым встраиванием, содержащее одну копию aad-12, pat и 2mepsps vl PTU из плазмиды pDAB8264.
Данные, полученные посредством Саузерн-блоттинга, указывают на то, что фрагмент Т-ДНК встроился в геном события сои pDAB8264.44.06.1. Подробный Саузерн-блоттинг проводили с применением зонда, специфичного к вставке aad-12, pat и 2mepsps vl, содержащейся в участке встраивания Т-ДНК pDAB8264, и рестрикционных ферментов, участки расщепления которых находятся в пределах плазмиды и которые приводят к образованию гибридизующихся фрагментов в пределах плазмиды или фрагментов, которые охватывают участок соединения плазмиды и геномной ДНК сои (пограничные фрагменты). Молекулярные массы, полученные посредством Саузерн-блоттинга для комбинации рестрикционного фермента и зонда, были уникальными для события, и использовались для определения его характерного описания. Эти анализы также показали, что фрагмент плазмиды был встроен в геномную ДНК сои без перестройки aad-12, pat и 2mepsps vl PTU.
Пример 4.1: Сбор образца листа сои и выделение геномной ДНК (гДНК)
Геномную ДНК экстрагировали из ткани листьев, собранных от рассматриваемых растений сои, содержащих событие сои pDAB8264.44.06.1. Кроме того, гДНК выделяли из обычного растения сои, Maverick, генетическое окружение клеток которого является типичным для указанной линии, и в которых отсутствуют гены aad-12 и 2mepsps vl. Рассматриваемую геномную ДНК экстрагировали из лиофилизированной ткани листьев посредством стандартного способа с применением цетилтриметиламмония бромида CTAB. После выделения, определяли количество ДНК спектрофлюорометрическим способом с применением реагента Pico Green (Invitrogen, Carlsbad, CA). Затем ДНК изучали на агарозном геле для подтверждения результатов анализа Pico Green и определения качества ДНК.
Пример 4.2: Расщепление и разделение ДНК
Для молекулярного описания события сои pDAB8264.44.06.1 посредством Саузерн-блоттинга расщепляли десять микрограммов (10 мкг) геномной ДНК. Геномную ДНК из события сои pDAB8264.44.06.1 и нетрансгенной линии сои Maverick расщепляли посредством добавления приблизительно пяти единиц выбранного рестрикционного фермента на мкг ДНК и соответствующего буфера к каждому образцу ДНК. Каждый образец инкубировали при приблизительно 37ºC в течение ночи. Рестрикционные ферменты BstZl 71, HinDIII, Ncol, Nsil, и Pad использовали по отдельности для расщеплений (New England Biolabs, Ipswich, MA). Кроме того, положительный контрольный образец для гибридизации получали посредством комбинирования плазмиды ДНК, pDAB8264, с геномной ДНК из нетрансгенного сорта сои, Maverick. Смесь ДНК плазмиды/геномной ДНК расщепляли посредством тех же способов и рестрикционных ферментов, что и в случае тестируемых образцов. Продукты расщепления инкубировали в течение ночи, добавляли NaCl до конечной концентрации 0,1M, и расщепленные образцы ДНК осаждали изопропанолом. Осажденную ДНК ресуспендировали в 20 мкл 1X загрузочного буфера (0,01% бромфеноловый синий, 10,0 мМ ЭДТА, 5,0% глицерин, 1,0 мМ Tris, pH 7,5). Образцы ДНК образцы и маркеры молекулярного размера затем пропускали с помощью электрофореза через 0,85%> агарозные гели с 0,4X TAE буфером (Fisher Scientific, Pittsburgh, PA) при 35 В в течение приблизительно 18-22 часов для достижения разделения фрагментов (separation). Гели окрашивали бромистым этидием (Invitrogen, Carlsbad, CA), а ДНК изучали под ультрафиолетовым (УФ) светом.
Пример 4.3: Саузерн-блоттинг и обработка мембран
Саузерн-блоттинг проводили в основном как описано Memelink, J.; Swords, K.; Harry J.; Hoge, C; (1994) Southern, Northern, and Western Blot Analysis. Plant Mol. Biol. Manual Fl: 1-23. В кратком изложении, после электрофоретического разделения и визуального анализа фрагментов ДНК гели депуринировали с применением 0,25M HCl в течение приблизительно 20 минут, а затем обрабатывали денатурирующим раствором (0,4 M NaOH, 1,5 M NaCl) в течение приблизительно 30 минут с последующей нейтрализацией раствора (1,5 M NaCl, 0,5 M Tris pH 7,5) в течение, по меньшей мере, 30 минут.
Саузерн-блоттинг проводили в течение ночи на нейлоновых мембранах с применением капиллярной системы с 10x SSC. После переноса ДНК связывали с мембраной посредством УФ-сшивания с последующим быстрым промыванием мембраны раствором 2x SSC. Посредством этого способа получали мембраны Саузерн-блоттинга, готовые для гибридизации.
Пример 4.4: Мечение и гибридизация ДНК-зонда
Фрагменты ДНК, связанные с нейлоновой мембраной, детектировали с применением меченого зонда. Зонды получали посредством основанного на ПЦР включения меченного дигоксигенином (DIG) нуклеотида, [DIG-11]-dUTP, во фрагмент ДНК, амплифицированный на основе плазмиды pDAB8264 с применением праймеров, специфичных к элементам гена. Получение ДНК-зондов посредством ПЦР-синтеза проводили с применением набора PCR DIG Probe Synthesis (Roche Diagnostics, Indianapolis, IN) согласно рекомендованным производителем инструкциям.
Меченые зонды анализировали посредством электрофореза в агарозном геле для определения их количества и качества. Желаемое количество меченых зондов затем использовали для гибридизации с ДНК-мишенью на нейлоновых мембранах для детектирования определенных фрагментов преимущественно с применением способов, описанных для раствора DIG Easy Hyb (Roche Diagnostics, Indianapolis, IN). В кратком изложении, нейлоновые мембраны, содержащие фиксированную ДНК, промывали 2x SSC и предварительно гибридизовали с 20-25 мл предварительно нагретого раствора DIG Easy Hyb в колбах для гибридизации при приблизительно 45-55ºC в течение приблизительно 2 часов в печи для гибридизации. Раствор для предварительной гибридизации затем сливали, и заменяли приблизительно 15 мл предварительно нагретого раствора DIG Easy Hyb, содержащего желаемое количество специфичных зондов, денатурированных, посредством кипячения на водяной бане в течение приблизительно пяти минут. Затем проводили этап гибридизации при приблизительно 45-55ºC в течение ночи в камере для гибридизации.
В конце гибридизации зондов растворы DIG Easy Hyb, содержащие зонды, сливали в чистые пробирки и хранили при приблизительно -20ºC. Эти зонды, согласно рекомендованным производителем инструкциям, можно было использовать дважды. Мембранные блоты быстро ополаскивали и дважды промывали в чистых пластиковых контейнерах промывочным буфером с низкой жесткостью (2х SSC, 0,1% SDS) в течение приблизительно пяти минут при комнатной температуре, после чего дважды промывали промывочным буфером с высокой жесткостью (0,1х SSC, 0,1% SDS) в течение 15 минут при приблизительно 65ºC. Мембранные блоты быстро промывали 1х буфером на основе малеиновой кислоты из набора DIG Wash и Block Buffer Set (Roche Diagnostics, Indianapolis, IN) в течение приблизительно 5 минут. Затем проводили блокирование в 1х блокирующем буфере в течение 2 часов, и инкубировали с антителом против DIG-AP (щелочная фосфатаза) (Roche Diagnostics, Indianapolis, IN) в 1х блокирующем буфере в течение как минимум 30 минут. После 2-3 промываний 1х промывочным буфером специфичные ДНК-зонды оставались связанными с мембранами, и меченные DIG стандарты ДНК визуально анализировали с применением CDP-Star Chemiluminescent Nuckeic Acid Detection System (Roche Diagnostics, Indianapolis, IN), согласно рекомендациям производителя. Блоты регистрировали на хемилюминесцентную пленку в течение одного или нескольких моментов времени для детектирования гибридизующихся фрагментов и визуализации маркеров молекулярного размера. Пленки проявляли в проявителе All-Pro 100 Plus (Konica Minolta, Osaka, Japan) и сканировали изображения. Для каждого зонда регистрировали число, и размер замеченных полос записывали (табл. 5). Меченный DIG маркер молекулярной массы II (DIG MWM II) и меченный DIG маркер молекулярной массы VII (DIG MWM VII), видимые после детектирования DIG, как описано выше, использовали для определения размеров гибридизованных фрагментов в Саузерн-блотах.
Пример 4.5: Результаты Саузер-блоттинга
Ожидаемые и экспериментальные размеры фрагментов для определенных расщеплений и зондов, полученные на основе известных участков распознавания рестрикционных ферментов aad-12 и 2mepsps PTU, приведены в таблице 6. Ожидаемые размеры фрагментов основаны на плазмидной карте pDAB8264, и ожидаемые размеры фрагментов примерно определены на основе этих анализов, и основаны на указанных размерах меченного DIG маркера молекулярной массы II и Mark VII.
Два типа фрагментов идентифицировали на основе этих расщеплений и гибридизаций: внутренние фрагменты, в которых известные сайты распознавания ферментов фланкируют участок зонда и полностью содержатся в участке вставки aad-12 и 2mepsps PTU PTU, и пограничные фрагменты, в которых первый известный сайт распознавания ферментов находится на одном конце участка зонда, а второй сайт, как ожидается, находится в геноме сои. Размеры пограничных фрагментов варьируют для разных событий, поскольку в большинстве случаев сайты встраивания фрагмента ДНК уникальны для каждого события. Пограничные фрагменты предоставляют способы определения расположения участка распознавания рестрикционного фермента по отношению к встроенной ДНК и оценки числа ДНК-вставок.
Саузерн-блоттинг проводили с применением многочисленных поколений сои, содержащих событие pDAB8264.44.06.1, с получением данных, которые указывают на то, что в геном сои события сои pDAB8264.44.06.1 были встроены малокопийные интактные aad-12 и 2mepsps PTU из плазмиды pDAB8264.
Рестрикционные ферменты NcoI и HinD III связываются, и расщепляют уникальные участки рестрикции в плазмиде pDAB8264. В связи с этим, эти ферменты выбирали так, чтобы описать вставку гена aad-12 в событии сои pDAB8264.44.06.1. Пограничные фрагменты длиной более чем 4078 п.н. или более чем 3690 п.н. были теоретически рассчитаны на гибридизацию с зондом после расщепления HinD III и NcoI, соответственно (табл. 6). Наблюдали одиночные полосы гибридизации aad-12 длиной приблизительно в 7400 п.н. и приблизительно 3800 п.н. при использовании HinD III и NcoI, соответственно. Гибридизация зондов с полосами этого размера указывает на наличие одного участка встраивания для гена aad-12 в геноме события сои pDAB8264.44.06.1. Рестрикционные ферменты BstZ17I, NsiI и PacI выбирали для получения фрагмента, который содержит единицу транскрипции растения aad-12 (PTU; промотор/ген/терминатор) (табл. 6). Предполагаемые приблизительно 5000, приблизительно 5000 и приблизительно 6800 п.н. фрагменты наблюдали в случае зонда после расщеплений BstZ17I, NsiI и PacI, соответственно. Результаты, полученные для расщепления образцов pDAB8264.44.06.1 с последующей гибридизацией зондов показали, что интактная PTU aad-12 из плазмиды pDAB8264 была встроена в геном события сои pDAB8264.44.06.1. Кроме того, молекулярные массы полос гибридизации, полученных для рестрикционных фрагментов HinD III, NcoI, NsiI и BstZl7I, указывают на то, что PTU aad-12 также содержит связанную PTU pat.
Рестрикционные ферменты BstZl7I, NcoI и NsiI связываются, и расщепляют участки рестрикции в плазмиде pDAB8264. В связи с этим эти ферменты выбирали для описания вставки гена 2mepsps в событии сои pDAB8264.44.06.1. Пограничные фрагменты длиной более чем 4858 п.н., более чем 3756 или более чем 5199 п.н., как ожидалось, гибридизовались с зондами после расщеплений BstZ17I, NcoI и NsiI, соответственно (табл. 6). Одиночные полосы гибридизации 2mepsps длиной приблизительно в 16000 п.н., приблизительно 6100 п.н. и приблизительно 5300 п.н. наблюдали при использовании BstZl7I, NcoI и NsiI, соответственно. Гибридизация зонда с полосами такого размера указывает на наличие одного участка встраивания гена 2mepsps в геном события сои pDAB8264.44.06.1. Рестрикционный фермент PacI выбирали для получения фрагмента, который содержит единицу транскрипции растения (PTU; промотор/ген/терминатор) 2mepsps (табл. 6). Теоретически ожидаемый фрагмент длиной в приблизительно 6800 п.н. наблюдали при применении зонда после расщеплений PacI. Результаты, полученные в результате ферментативного расщепления образца pDAB8264.44.06.1 и последующей гибридизации с зондами, показали, что интактная PTU 2mepsps из плазмиды pDAB8264 была встроена геном события сои pDAB8264.44.06.1.
Пример 4.6: Отсутствие основной последовательности
Саузенр-блоттинг также проводили для подтверждения отсутствия гена резистентности к спектиномицину (specR), элемента Ori Rep и белка инициации репликации trfA (элемент trf A) в событии сои pDAB8264.44.06.1. Когда подходящие положительные (pDAB8264 плюс Maverick) и отрицательные (Maverick) контроли включают в Саузерн-блоттинг, не ожидают специфической гибридизации с геном резистентности к спектиномицину, элементом Ori Rep или элементом trf A. После расщепления Hind III и гибридизации со специфичным к specR зондом наблюдали одну ожидаемую полосу длиной в приблизительно 9300 п.н. в образце положительного контроля (pDAB8264 плюс Maverick), отсутствующую в образцах отрицательного контроля и событии сои pDAB8264.44.06.1. Аналогично, одну ожидаемую полосу с длиной в приблизительно 9200 п.н. детектировали в образце положительного контроля (pDAB8264 плюс Maverick), но не в образцах отрицательного контроля и событии сои pDAB8264.44.06.1 после расщепления Pac I и гибридизации со смесью специфичного к Ori Rep зонда и специфичного к trfA зонда. Эти данные указывают на отсутствие гена устойчивости к спектиномицину, элемента Ori Rep и белка инициации репликации trfA в событии сои pDAB8264.44.06.1.
Пример 5: Оценка агрономических свойств, урожайности и устойчивости к гербицидам
Агрономические свойства и устойчивость к гербицидам события сои pDAB 8264.44.06.1 изучали посредством анализа урожая в многочисленных географических областях во время одного вегетационного периода. Между событием pDAB8264.44.06.1 и контрольными растениями Maverick не наблюдали никаких агрономически значимых неожиданных различий. Результаты исследования указывают на то, что событие pDAB8264.44.06.1 в агрономическом отношении эквивалентно контрольным растениям Maverick. Кроме того, событие сои pDAB8264.44.06.1 проявляет надежную устойчивость к гербицидам при обработке его баковой смесью, состоящей из глифосата и 2,4-D.
Следующие агрономические признаки измеряли, и записывали для всех тестируемых групп в каждой области.
1.) Прорастание: Подсчитывали посредством деления густоты стояния на число растений, посаженных на секции в один метр, и умножения на 100.
2.) Мощность проростков на V1: Мощность представляет собой суммарную оценку здоровья участка. Результаты оценивали по шкале 0-100%, где 0% означает участок с мертвыми растениями, а 100% означает участки, которые являются здоровыми.
3.) Суммарная оценка повреждений культуры, хлороза и некроза через 1 сутки, 7 суток и 14 суток после химической обработки V3. Наблюдения делали для любых признаков, типичных для повреждений 2,4-D. Эпинастия проявляется как скручивание или провисание листьев и стеблей. Все поврежденные культуры оценивали по шкале от 0 до 100%, где 0% соответствует отсутствию повреждений, а 100% соответствует полной гибели растения.
4.) Время цветения: Это измерение подразумевает запись момента времени, в который 50% растений на участке начинают цвести. Записывали число суток, прошедших со времени посадки до момента, в который 50% растений на участке начинают цвести.
5.) Густота стояния для R2 или Rl: Это визуальная оценка средней мощности растений на каждом участке, которую определяют посредством подсчета числа растений на типичной секции в один метр с одним рядом на участок, и записи на стадиях роста R2 или R1.
6.) Суммарная оценка повреждений культуры, хлороза и некроза через 1 сутки, 7 суток и 14 суток после химической обработки R2. Наблюдения делали для любых признаков, типичных для повреждений 2,4-D. Эпинастия проявляется как скручивание или провисание листьев и стеблей. Все поврежденные культуры оценивали по шкале от 0 до 100%, где 0% означает отсутствие повреждений, а 100% означает полную гибель растения.
7.) Частота заболеваний на стадии роста R6: Это визуальная оценка частоты заболеваний, которую используют для оценки тяжести заболевания на участке. Оценивали по шкале 0-100%, на которой 0% означает отсутствие заболеваний, а 100% означает, что все растения на участке имеют заболевание.
8.) Повреждение насекомыми на стадии роста R6: Это визуальная оценка повреждений насекомыми, которую используют для оценки тяжести повреждений насекомыми на участке. Записывали процент растительной ткани на участке, поврежденной насекомыми, с применением шкалы 0-100%, на которой 0% означает отсутствие повреждений насекомыми, а 100% означает, что все растения на участке имеют повреждения насекомыми.
9.) Высота растений при старении: Записывали среднюю высоту растений на каждом участке. Растения измеряли от поверхности почвы до верхушки после опадания листьев. Результаты измерений записывали в сантиметрах. Если участок был полеглым, для проведения измерений поднимали типичную группу растений.
10.) Количество суток до зрелости. Записывали момент времени, в который 95% бобов на участке достигали физиологической зрелости, а растения становились пожухлыми. Рассчитывали число суток, которое прошло с момента посадки.
11.) Полегание: Записывали результаты визуальной оценки степени полегания в период сбора урожая. Оценивали по шкале от 0 до 100%, где 0% означает отсутствие полегания, а 100% означает, что все растения на участке лежат на земле.
12.) Растрескивание: Записывали результаты визуальной оценки растрескивания бобов в период сбора урожая. Записывали в виде процента бобов, растрескавшихся на одном участке. Использовали шкалу 0-100%, где 0% означает отсутствие растрескивания, а 100% означает, что растрескались все стручки.
13.) Урожайность: Записывали массу семян, собранных с каждого участка. Собрали урожай со всего участка с 2 рядами, и записывали массу и влажность семян. Значения буш/акр получали посредством приведения к влажности 13%.
14.) Масса 100 семян: Для каждого участка отсчитывали 100 семян, и записывали их массу в граммах.
Устойчивость к гербицидам события сои pDAB 8264.44.06.1 оценивали после применения баковой смеси 2,4-D и глифосата с 2185 г кэ/га, смешанной с 2% по массе сульфата аммония (AMS). Гербициды распыляли посредством последовательной обработки V3/R2. Эту обработку гербицидами проводили посредством опрыскивания растений сои на стадии роста V3 с последующей обработкой на стадии развития R2. Стадия развития V3 характеризуется полным развитием однолопастного и первых трех трилопастных листьев. Стадия развития R2 характеризуется единственным раскрытым цветком на одном или двух верхних узлах главного стебля с полностью развитым листом.
Эти исследования проводили с применением рандомизированного полноблочного плана с четырьмя повторениями каждой обработки. Каждый участок был в 2 ряда шириной, и ряды разделялись 30 дюймами. Общая длина участков составляла 12,5 футов с проходом между участками от 2,5 до 3,0 футов. Контрольные растения Maverick, как ожидалось, должны были погибать после обработки гербицидами, поэтому их выращивали на отдельном участке, вдалеке от рядов с трансгенными растениями сои.
Суммировали результаты обработки события сои pDAB8264.44.06.1 баковой смесью 2,4-D и глифосата по сравнению с необработанным событием pDAB8264.44.06.1. В табл. 7 представлены средние значения, полученные в результате сравнения события pDAB8264.44.06.1, обработанного баковой смесью 2,4-D и глифосата, с необработанным событием сои pDAB8264.44.06.1. Применение гербицида не повреждало событие сои pDAB8264.44.06.1, эти растения реагировали эквивалентно по сравнению с необработанным событием pDAB 8264.44.06.1 в отношении описанных агрономических признаков, приведенных в табл. 7.
За исключением некоторых ранних преходящих повреждений через 1 и 7 daa (суток после применения) на стадии развития V3 и через 1, 7 и 14 daa на стадии развития R2, событие сои pDAB8264.44.06.1 демонстрировало надежную устойчивость к баковой смеси 2,4-D и глифосата. Напротив, ни одно из растений Maverick не выжило после обработки гербицидам.
Оценивали агрономическую эквивалентность события сои pDAB8264.44.06.1 и контрольной линии, Maverick. Эти исследования проводили с применением блочного плана с двумя повторениями. Каждый участок был в 2 ряда шириной, и ряды разделялись 30 дюймами. Общая длина участков составляла 12,5 футов с проходом между участками от 2,5 до 3,0 футов.
В табл. 8 представлены средние значения, полученные в результате сравнения агрономической эквивалентности события сои pDAB8264.44.06.1 и контрольной линии, Maverick. Агрономические данные указывают на то, что событие сои pDAB8264.44.06.1 проявляет признаки, эквивалентные признакам растений Maverick, и не указывают на наличие агрономически значимых неожиданных различий.
Пример 6: Специфичный к событию анализ TaqMan
Проводили два специфичных к событию анализа TAQMAN для детектирования события сои pDAB8264.44.06.1 и определения зиготности растений в размножающихся популяциях. Событие сои pDAB8264.44.06.1 содержит T-ДНК бинарного вектора pDAB8264 (фиг.1). Для специфичного детектирования события сои pDAB8264.44.06.1 конструировали специфичные зонды и праймеры Taqman на основе ДНК-последовательности, расположенной на месте соединения вставки и генома растения на 5'-конце (SEQ ID NO:14) или 3'-конце (SEQ ID NO:15) (фиг.4). Один специфичный к событию анализ события сои pDAB8264.44.06.1 проводили для специфичного детектирования фрагмента ДНК длиной в 98 п.н. (SEQ ID NO:16), который охватывает участок соединения на 5'-конце, с применением двух праймеров и специфичного к MGB зонда, синтезированного Applied Biosystems (ABI) и содержащего репортерную молекулу FAM на 5'-конце. Другой специфичный к событию анализ события сои pDAB8264.44.06.1 проводили для специфичного детектирования фрагмента ДНК длиной в 131 п.н. (SEQ ID NO:17), который охватывает участок соединения на 3'-конце, с применением двух специфичных праймеров и специфичного к мишени зонда MGB, синтезированного ABI и содержащего репортерную молекулу FAM на 5'-конце. Специфичность способа детектирования с применением Taqman для события сои pDAB8264.44.06.1 тестировали в двойном формате для 11 различных событий, которые содержат PTU 2mEPSPS и aad-12, и контрольного нетрансгенного сорта сои (Maverick) с специфичным эндогенным референсным геном сои, GMFL01-25-J19 (Glycine max кДНК, GenBank: AK286292.1).
Пример 6.1: Выделение гДНК
В этом исследовании тестировали образцы гДНК 11 различных событий сои и нетрансгенных сортов сои. Геномную ДНК экстрагировали с применением модифицированного набора Qiagen MagAttract plant DNA (Qiagen, Valencia, CA). Для выделения гДНК использовали свежие листовые диски сои, по 8 штук на образец. гДНК количественно оценивали посредством способа Pico Green, согласно инструкциям производителя (Molecular Probes, Eugene, OR). Образцы разбавляли свободной от ДНКазы водой с получением концентрации 10 нг/мкл для целей данного исследования.
Пример 6.2: Анализ Taqman и его результаты
Специфичные праймеры и зонды Taqman конструировали для специфичного анализа Taqman события сои pDAB8264.44.06.1. Эти реагенты можно использовать в условиях, приведенных ниже, для детектирования события сои pDAB8264.44.06.1. В табл. 9 приведены последовательности праймеров и зондов, которые были разработаны специально для детектирования события сои pDAB8264.44.06.1.
Условия амплификации посредством мультиплексной ПЦР следующие: 1х буфер для ПЦР Roche, 0,4 мкМ специфичного к событию прямого праймера, 0,4 мкМ специфичного к событию обратного праймера, 0,4 мкМ праймера GMS116 F, 0,4 мкМ праймера GMS116 R, 0,2 мкМ специфичного к событию зонда, 0,2 мкМ зонда GMS116, 0,1% PVP, 20 нг гДНК в общей реакционной смеси 10 мкл. Смесь амплифицировали с применением следующих условий: i) 95ºC в течение 10 минут, ii) 95ºC в течение 10 секунд, iii) 60ºC в течение 30 секунд, iv) 72ºC в течение 1 секунды) повторение этапов ii-iv в течение 35 циклов, v) удержание при 40ºC. ПЦР в реальном времени проводили на Roche LightCycler 480. Анализ данных был основан на определении точки пересечения (значения Cp), установленной посредством программного обеспечения LightCycler 480, которая представляет собой число циклов ПЦР, при котором скорость изменения флуоресценции достигает максимума.
Способ детектирования события сои pDAB8264.44.06.1 с применением Taqman использовали в двойном формате для 11 различных событий сои, содержащих PTU 2mEPSPS и aad-12, и нетрансгенных сортов сои со специфичным эндогенным референсным геном, GMFL01-25-J19 (GenBank: AK286292.1). Способ позволяет специфично детектировать событие сои pDAB 8264.44.06.1 и не предоставлял или амплифицировал никаких ложноположительных результатов для контролей (т.е. 11 различных событий, содержащих PTU 2mEPSPS и aad-12, и нетрансгенных сортов сои). Специфичные к событию праймеры и зонды можно использовать для детектирования события сои pDAB8264.44.06.1, и эти условия и реагенты можно применять для анализа зиготности.
Пример 7: Полная последовательность события сои pDAB8264.44.06.1
SEQ ID NO:27 представляет собой полную последовательность события сои pDAB8264.44.06.1. Эта последовательность содержит 5'-фланкирующую геномную последовательность, встроенную Т-ДНК из pDAB8264 и 3'-фланкирующую геномную последовательность. В SEQ ID NO:27 остатки 1-1494 представляют собой 5'-фланкирующую геномную последовательность, остатки 1495-1497 представляют собой вставку из трех оснований, остатки 1498-11774 представляют собой вставку Т-ДНК pDAB8264, а остатки 11775-13659 представляют собой 3'-фланкирующую последовательность. Соединяющая последовательность или переходная последовательность на 5'-конце вставки, таким образом, приходится на остатки 1494-1495 в SEQ ID NO:27. Соединяющая последовательность или переходная последовательность на 3'-конце вставки, таким образом, приходится на остатки 11774-11775 в SEQ ID NO:27. SEQ ID NO:27 представляет собой полинуклеотидную последовательность события сои pDAB8264.44.06.1 и была составлена на основе выравнивания многочисленных контигов ПЦР, которые были получены посредством реакций ПЦР-амплификации и секвенирования с применением терминаторного набора для секвенирования ABI Big Dye® Terminator (Applied Biosystems, Foster City, CA).
Пример 8: Пакетирование события сои pDAB8264.44.06.1 и события сои pDAB9582.812.9.1 с устойчивостью к насекомым
Пример 8.1: Скрещивание события сои pDAB8264.44.06.1 и события сои pDAB9582.812.9.1 с устойчивостью к насекомым
Событие сои pDAB8264.44.06.1 скрещивали с событием сои pDAB9582.812.9.1. Пыльники события сои pDAB8264.44.06.1 вручную втирали в рыльца события сои pDAB9582.812.9.1, тем самым опыляя событие сои pDAB9582.812.9.1. Полученное потомство Fl, которое содержало встроенные события из события сои pDAB9582.812.9.1 и события сои pDAB8264.44.06.1, проверяли на устойчивость к гербицидам 2,4-D и глифосату для идентификации растений-потомков, содержащих оба встроенного события. Затем растения-потомки Fl самоопыляли с получением потомков F2, для которых подтверждали независимое расщепление для обоих событий. Растения F2 обрабатывали смесью, содержащей 2,4-D (1120 г кэ/га) и глифосат (1120 г кэ/га). Полученные растения F2 анализировали с применением анализа зиготности на основе Taqman для идентификации растений, гомозиготных по обоим событиям. В результате самоопыления этих гомозиготных растений F2 получали растения-потомки F3, гомозиготные по обоим событиям сои pDAB9582.812.9.1 и pDAB8264.44.06.1. Полученное событие помечали как событие сои pDAB9582.812.9.1::pDAB8264.44.06.1.
Пример 8.2: Определение зиготности события сои pDAB9582.812.9.1::pDAB8264.44.06.1
Для определения зиготности растений, полученных от скрещивания события сои pDAB8264.44.06.1 и события сои pDAB9582.812.9.1 проводили отдельные специфичные к событиям анализы TAQMAN® для детектирования наличия события pDAB9582.812.9.1 или события pDAB8264.44.06.1. Расщепленные растения F2, полученные в результате самоопыления гибрида события сои pDAB9582.812.9.1 и события сои pDAB8264.44.06.1, тестировали с применением этих специфичных к событиям анализов TAQMAN® для идентификации растений, содержащих событие сои pDAB9582.812.9.1 и событие сои pDAB8264.44.06.1 и гомозиготных по обоим этим событиям.
Выделение гДНК
В этом исследовании тестировали образцы гДНК образцы из расщепленных растений F2 пакетированного события сои pDAB9582.812.9.1::pDAB8264.44.06.1. Свежие листовые диски, по 4 штуки на растение, собирали от 3187 расщепленных растений F2 пакетированного события сои pDAB9582.812.9.1::pDAB8264.44.06.1. Геномную ДНК экстрагировали из этих образцов с применением модифицированного набора Qiagen MagAttract Plant DNA (Qiagen, Valencia, CA).
Анализ TAQMAN® и его результаты
Праймеры и зонды TAQMAN®, как описано ранее, конструировали для применения в специфичных к событию анализах для событий сои pDAB9582.812.9.1 (предварительная заявка США № 61/471845) и pDAB8264.44.06.1 (описанного выше). Эти реагенты использовали в условиях, приведенных ниже, для определения зиготности каждого встроенного события, содержащегося в пакетированном событии сои pDAB9582.812.9.1::pDAB8264.44.06.1.
Условия для амплификации посредством мультиплексной ПЦР следующие: 1х буфер для ПЦР Roche, 0,4 мкМ специфичного к событию pDAB8264.44.06.1 прямого праймера, 0,4 мкМ специфичного к событию pDAB8264.44.06.1 обратного праймера, 0,4 мкМ специфичного к событию pDAB9582.812.9.1 прямого праймера, 0,4 мкМ специфичного к событию pDAB9582.812.9.1 обратного праймера, 0,4 мкМ праймера GMSl16 F, 0,4 мкМ праймера GMSl16 R, 0,2 мкМ специфичного к событию pDAB9582.812.9.1 зонда, 0,2 мкМ специфичного к событию pDAB8264.44.06.1 зонда, 0,2 мкМ зонда GMSl16, 0,1% PVP, 20 нг гДНК в общей реакционной смеси объемом 10 мкл. Смесь амплифицировали с применением следующих условий: i) 95ºC в течение 10 минут, ii) 95ºC в течение 10 секунд, iii) 60ºC в течение 30 секунд, iv) 72ºC в течение 1 секунды v) повторение этапов ii-iv в течение 35 циклов, v) удержание при 40ºC. ПЦР в реальном времени проводили на Roche LightCycler® 480. Анализ данных был основан на определении точки пересечения (значения Cp), установленной посредством программного обеспечения LightCycler 480, которая представляет собой число циклов ПЦР, при котором скорость изменения флуоресценции достигает максимума.
Общее количество в 3187 расщепленных растений F2, полученных от гибрида события сои pDAB9582.812.9.1 и события сои pDAB8264.44.06.1, тестировали посредством специфичных анализов TAQMAN® для определения зиготности растений по обоим событиям сои pDAB9582.812.9.1 и pDAB8264.44.06.1. Результаты этих анализов указывали на то, что событие сои pDAB9582.812.9.1 и событие сои pDAB8264.44.06.1 присутствовали и детектировались в 2360 растениях. Зиготность (которую также называют плоидностью) каждого встроенного события приведена в табл. 9b. Из 2360 идентифицированных растений 237 определяли как содержащие две копии события сои pDAB9582.812.9.1 и события сои pDAB8264.44.06.1.
Пример 8.3: Описание экспрессии белка в пакетированном событии сои pDAB9582.812.9.1::pDAB8264.44.06.1
Описывали биохимические свойства рекомбинантных белков CrylF, CrylAc, AAD12, 2mEPSPS и PAT, экспрессирующихся в пакетированном событии сои pDAB9582.812.9.1::pDAB8264.44.06.1. Использовали иммуноферментный анализ (ELISA) для количественной оценки экспрессии PAT. В то же время, белки Cryl Ac/CrylF и AAD12/2mEPSPS количественно оценивали посредством мультиплексных иммунологических анализов с применением электрохемилюминесцентной технологии из Meso-Scale Discovery (MSD, Gaithersburg, Maryland). Все эти анализы использовали для описания биохимических свойств и подтверждения надежности экспрессии этих белков в пакетированном событии сои pDAB9582.812.9.1::pDAB8264.44.06.1.
Экспрессия белка PAT в растительных тканях
Уровни белка PAT определяли в F3 пакетированного события сои pDAB9582.812.9.1::pDAB8264.44.06.1, гомозиготных по обоим событиям pDAB9582.812.9.1 и pDAB 8264.44.06.1. Уровни белка PAT, экспрессирующегося в событии сои pDAB9582.812.9.l::pDAB8264.44.06.1, сравнивали с уровнем для родительских событий, события сои pDAB9582.812.9.1 и события сои pDAB8264.44.06.1.
Растворимый экстрагируемый белок PAT получали из ткани листа сои и анализировали с применением количественного способа ELISA (APS 014, Envirologix, Portland, ME). Образцы ткани листа сои получали от выращенных в теплице тестируемых растений на стадиях развития от однолистного до V1 и подготавливали к анализу экспрессии. Белок PAT экстрагировали из тканей листа сои с применением фосфатно-солевого буфера, содержащего детергент Tween-20 (PBST) и 1% поливинилпирролидона 40 (PVP-40). Образцы затем обрабатывали с применением GenoGrinder® при 1500 об./мин. в течение 5 минут. Растительный экстракт центрифугировали; собирали водный супернатант, разводили подходящим буфером по мере необходимости и анализировали с применением набора PAT ELISA для слоистого метода. Набор использовали согласно предложенному производителем протоколу (Envirologix, Portland, ME).
Детектирование проводили для анализа экспрессии и наследуемости события сои pDAB9582.812.9.l::pDAB8264.44.06.1. Поколение F3 пакетированного события, событие сои pDAB9582.812.9.l::pDAB8264.44.06.1 экспрессировало PAT в более высокой концентрации, чем оба родительских события, pDAB9582.812.9.1 и pDAB8264.44.06.1. Повышенная концентрация PAT в пакетированном событии сои pDAB9582.812.9.1::pDAB8264.44.06.1 была ожидаемой. Повышенные концентрации PAT представляют собой результат того, что событие сои pDAB9582.812.9.1::pDAB8264.44.06.1 содержит вдвое больше копий кодирующей последовательности pat, по сравнению с обоими родительскими событиями (табл. 10).
Экспрессия белков Cry1F и Cry1Ac в растительных тканях
Уровни белков Cry1F и Cry1Ac определяли в F3 пакетированного события сои pDAB9582.812.9.1::pDAB8264.44.06.1, гомозиготных по обоим событиям pDAB9582.812.9.1 и pDAB 8264.44.06.1. Уровни белков Cry1F и Cry1Ac, экспрессирующегося в событии сои pDAB9582.812.9.1::pDAB8264.44.06.1, сравнивали с уровнем для родительских событий, события сои pDAB9582.812.9.1 и события сои pDAB8264.44.06.1.
Растворимые экстрагируемые белки Cry1F и Cry1Ac получали из ткани листа сои и анализировали с применением количественного способа ELISA (APS 014, Envirologix, Portland, ME). Образцы ткани листа сои получали от выращенных в теплице тестируемых растений на стадиях развития от однолистного до V1 и подготавливали к анализу экспрессии. Белки Cry1F и Cry1Ac экстрагировали из тканей листа сои с применением фосфатно-солевого буфера, содержащего детергент Tween-20 (PBST) и 1% поливинилпирролидона 40 (PVP-40). Образцы затем обрабатывали с применением GenoGrinder® при 1500 об./мин. в течение 5 минут. Растительный экстракт центрифугировали; собирали водный супернатант, разводили подходящим буфером по мере необходимости и анализировали с применением мультиплексного анализа MSD Cry1F/CrylAc из Meso-Scale Discovery. Набор использовали согласно предложенному производителем протоколу.
Детектирование проводили для анализа экспрессии и наследуемости события сои pDAB9582.812.9.1::pDAB8264.44.06.1. F3 пакетированного события сои pDAB9582.812.9.l::pDAB8264.44.06.1 экспрессировали белки CrylF и CrylAc в концентрациях, которые были выше, чем концентрации для родительского события сои pDAB9582.812.9.1 (табл. 11). Эти результаты указывают на то, что растения события сои pDAB9582.812.9.1::pDAB8264.44.06.1 содержат функциональные экспрессирующие копии кодирующих последовательностей cry1F и cry1Ac, унаследованные от родительской линии, события сои pDAB9582.812.9.1.
Экспрессия белков AAD12 и 2mEPSPS в растительных тканях
Уровни белков AAD12 и 2mEPSPS определяли в F3 пакетированного события сои pDAB9582.812.9.1::pDAB8264.44.06.1, гомозиготных по обоим событиям pDAB9582.812.9.1 и pDAB8264.44.06.1. Уровни белков AAD12 и 2mEPSPS, экспрессирующихся в событии сои pDAB9582.812.9.1::pDAB8264.44.06.1, сравнивали с уровнем в родительском событии сои pDAB8264.44.06.1.
Растворимые экстрагируемые белки AAD12 и 2mEPSPS получали из ткани листа сои и анализировали с применением мультиплексного электрохемилюминесцентного анализа MSD. Образцы ткани листа сои брали из выращенных в теплице растений на стадиях развития от однолистной до V1 и подготавливали к анализу экспрессии. Белки AAD12 и 2mEPSPS экстрагировали из ткани листа сои с применением фосфатно-солевой буфера, содержащего детергент Tween-20 (PBST) и 1% поливинилпирролидон 40 (PVP-40). Образцы затем обрабатывали с применением GenoGrinder® при 1500 об./мин. в течение 5 минут. Растительный экстракт центрифугировали; собирали водный супернатант, разводили подходящим буфером по мере необходимости и анализировали с применением мультиплексного анализа MSD AAD12 и 2mEPSPS из Meso-Scale Discovery. Набор использовали согласно предложенному производителю протоколу.
Детектирование проводили для изучения экспрессии и наследуемости события сои pDAB9582.812.9.1::pDAB8264.44.06.1. F3 пакетированного события сои pDAB9582.812.9.1::pDAB8264.44.06.1 экспрессировали белки AAD12 и 2mEPSPS в концентрациях, которые были выше, чем концентрации для родительского события сои pDAB8264.44.06.1 (табл. 12). Эти результаты указывали на то, что растения события сои pDAB9582.812.9.1::pDAB8264.44.06.1 содержат функциональные экспрессирующие копии кодирующих последовательностей aad-12 и 2mEPSPS, унаследованные от родительской линии, события сои pDAB8264.44.06.1.
Пример 8.4: Устойчивость к гербицидам пакетированного события сои pDAB9582.812.9.1::pDAB8264.44.06.1
Устойчивость к гербицидам пакетированного события сои pDAB9582.812.9.1::pDAB8264.44.06.1 анализировали в течение двух вегитационных периодов. Семена события сои pDAB9582.812.9.1::pDAB8264.44.06.1 высаживали и выращивали до зрелости. Зрелые растения обрабатывали смесью 2,4-D и глифосата. Общую устойчивость к этим гербицидам измеряли посредством подсчета выживших растений. В то же время, в исследование включали контрольные растения, которые не содержали генов aad-12 и 2mEPSPS и, как ожидалось, должны были быть чувствительными к обработке гербицидами 2,4-D и глифосатом.
Во время первого опыта устойчивость к гербицидам оценивали с применением 120 полевых участков расщепленных F2 пакетированного события сои pDAB9582.812.9.1::pDAB 8264.44.06.1. Каждый участок был в 1 ряд шириной, и ряды разделялись 30 дюймами. Участки полосами по 12 футов (общая длина посадки 7,5 фута) с проходами между участками в 4,5 фута. Общее количество в 4364 растения из расщепленных F2 пакетированного события сои pDAB9582.812.9.1::pDAB8264.44.06.1 обрабатывали смесью 2,4-D и глифосата (1120 г кэ/га). Обработку смесью гербицидов глифосата/2,4-D проводили между стадиями развития V3 и V4. Стадия развития V3 характеризуется полным развитием однолопастного листа и первых трех трехлопастных листьев, а стадия развития V4 характеризуется полным развитием однолопастного и первых четырех трехлопастных листьев. После обработки гербицидами участки анализировали, и идентифицировали 3234 растения как устойчивые к обработке гербицидами. Растения события сои pDAB9582.812.9.1::pDAB8264.44.06.1, которые были чувствительными к обработке гербицидами, не содержали копий aad-12 и 2mEPSPS в результате менделеевского расщепления события pDAB8264.44.06.1.
Во время второго опыта устойчивость к гербицидам оценивали для выращенных в теплице гомозиготных растений F3 события сои pDAB9582.812.9.1::pDAB8264.44.06.1. Растения сои выращивали на участках в 4 дюйма с одним растением на участок. Общее количество в 15 гомозиготных растений F3 обрабатывали смесью 2,4-D и глифосата (840 г кэ/га). Все 15 растений выжили после обработки гербицидами, что указывает на то, что растения события сои pDAB9582.812.9.1::pDAB8264.44.06.1 являются устойчивыми к обработке гербицидами, глифосатом и 2,4-D.
Таким образом, гены aad-12 и 2mEPSPS, которые содержались в родительской линии события сои pDAB8264.44.06.1, обеспечивали устойчивость к гербицидам 2,4-D и глифосату. Эти признаки передавались, и наследовались в событии сои pDAB9582.812.9.1::pDAB8264.44.06.1, обеспечивая устойчивость к гербицидам для события сои pDAB9582.812.9.1::pDAB8264.44.06.1. В то же время, контрольные растения, которые не содержали генов aad-12 и 2mEPSPS, были чувствительными к обработке гербицидами 2,4-D и глифосатом.
Пример 8.5: Описание инсектицидных свойств события сои pDAB9582.812.9.1::pDAB8264.44.06.1
Оценку выращенных в теплице растений проводили для описания устойчивости к инсектицидам пакетированного события сои pDAB9582.812.9.1::pDAB8264.44.06.1, которая проявлялась, благодаря экспрессии трансгенов crylAc и crylF. Событие сои pDAB9582.812.9.1::pDAB8264.44.06.1 тестировали с применением выращенных в лаборатории вредителей сои, включая Anticarsia gemmatalis (бобовая гусеница) и Pseudoplusia includens (соевая пяденица).
Пакетированное событие сои pDAB9582.812.9.1::pDAB8264.44.06.1 сравнивали с родительскими событиями сои (событие сои pDAB9582.812.9.1 и событие сои pDAB8264.44.06.1) в дополнение к нетрансформированному сорту сои Maverick. Это сравнение проводили для того, чтобы установить, присутствует ли уровень защиты, предоставляемый белками Cry1F и Cry1Ac, в пакетированном событии, которое вводит дополнительные трансгены в геном растения сои. Кроме того, пакетированное событие сои pDAB9582.812.9.1::pDAB8264.44.06.1 и событие сои pDAB8264.44.06.1 обрабатывали смесью гербицидов, содержащей 2,4-D и глифосат (840 г кэ/га) перед тестом на устойчивость к насекомым, чтобы определить, повлияла ли обработка гербицидами на защиту растений от насекомых, предоставляемую белками CrylF и CrylAc.
Вегетационные опыты проводили на растениях возраста приблизительно три недели. Использовали по десять растений для оценки события сои pDAB9582.812.9.1::pDAB8264.44.06.1, события сои pDAB9582.812.9.1 и отрицательных контролей; обработанного гербицидом события сои pDAB8264.44.06.1 и Maverick. Для каждого использованного вида насекомых (Anticarsia gemmatalis и Chrysodeixis (ранее Pseudoplusia) includens) вырезали по три кусочка листа от каждого растения с общим количеством в 30 листовых дисков/растений/видов насекомых. Кусочки листа с диаметром 1,4 см (или 1,54 см2) помещали на тестовую поверхность, состоящую из 2% водного агара, зараженную одной личинкой и закрытой перфорированной пластиковой крышкой. Смертность и потребление листьев оценивали через 4 суток после заражения. Личинок, которые не отвечали на осторожное прикосновение, считали мертвыми. Повреждения листьев оценивали посредством визуального подсчета процента кусочков листа, съеденных насекомыми. Статистический анализ данных проводили с применением JMP® Pro 9.0.1 (2010 SAS Institute Inc., Cary, NC).
Результаты (табл. 13), полученные в результате этих повторных экспериментов, указывают на то, что уровень защиты от насекомых и смертность, предоставляемые белками CrylF и CrylAc пакетированного события сои pDAB9582.812.9.1::pDAB8264.44.06.1, соответствует родительскому событию сои pDAB9582.812.9.1. Как и ожидалось, событие сои pDAB9582.812.9.1::pDAB8264.44.06.1 подвергалось существенно меньшему повреждению насекомыми (0,10-0,15%), чем контрольные растения события сои pDAB8264.44.06.1 (58-76%) и Maverick (79-91%) для всех использованных насекомых. Дополнительно, высокую смертность насекомых (100%) наблюдали для всех событий сои, содержащих кодирующие последовательности cry1F и cry1Ac, в то время как отрицательные контроли, Maverick и событие сои pDAB8264.44.06.1, демонстрировали смертность насекомых на уровне <10%. Таким образом, событие сои pDAB9582.812.9.1::pDAB8264.44.06.1 предоставляло защиту от активности насекомых на уровне, сопоставимом с уровнем для события сои pDAB9582.812.9.1.
Пример 9: Пакетирование посредством скрещивания события сои pDAB8264.44.06.1 и события сои с устойчивостью к насекомым pDAB9582.814.19.1
Пример 9.1: Скрещивание события сои pDAB8264.44.06.1 и события сои с устойчивостью к насекомым pDAB9582.814.19.1
Событие сои pDAB8264.44.06.1 скрещивали с событием сои pDAB9582.814.19.1. Пыльники события сои pDAB8264.44.06.1 вручную втирали в рыльца события сои pDAB9582.814.19.1, тем самым оплодотворяя событие сои pDAB9582.814.19.1. Полученное потомство Fl, содержащее встроенные события от обоих событий сои pDAB9582.814.19.1 и pDAB8264.44.06.1, анализировали на устойчивость к гербицидам 2,4-D и глифосату для идентификации растений, содержащих оба события. Затем растения поколения Fl самоопыляли с получением потомков F2, которые независимо расщеплялись по обоим событиям. Растения F2 обрабатывали смесью гербицидов, содержащей 2,4-D (840 г кэ/га) и глифосат (840 г кэ/га). Полученные растения F2 анализировали с применением анализа зиготности на основе Taqman для идентификации растений, гомозиготных по обоим событиям. В результате самоопыления этих гомозиготных растений F2 получали потомков F3, гомозиготных по обоим событиям сои pDAB9582.814.19.1 и pDAB8264.44.06.1. Полученное событие помечали как событие сои pDAB9582.814.19.1::pDAB8264.44.06.1.
Пример 9.2: Определение зиготности события сои pDAB9582.814.19.1::pDAB8264.44.06.1
Для определения зиготности растений, полученных от скрещивания события сои pDAB8264.44.06.1 и события сои pDAB9582.814.19.1, проводили отдельные специфичные к событию анализы на основе TAQMAN® для детектирования наличия встроенных событий pDAB9582.814.19.1 или pDAB8264.44.06.1. Расщепленные растения F2, полученные в результате самоопыления гибрида события сои pDAB9582.814.19.1 и события сои pDAB8264.44.06.1, тестировали с применением этих специфичных к событию анализов TAQMAN® для идентификации растений, содержащих оба события сои pDAB9582.814.19.1 и pDAB8264.44.06.1 и гомозиготных по обоим событиям.
Выделение гДНК
В этом исследовании тестировали образцы гДНК расщепленных растений F2 пакетированного события сои pDAB9582.814.19.1::pDAB8264.44.06.1. Свежие листовые диски сои, по 4 штуки на растение, собирали от 37 расщепленных растений F2 пакетированного события сои pDAB9582.814.19.1::pDAB8264.44.06.1. Геномную ДНК экстрагировали из этих образцов с применением модифицированного набора Qiagen MagAttract Plant ДНК (Qiagen, Valencia, CA).
Анализ TAQMAN® и его результаты
Праймеры и зонды TAQMAN®, как описано ранее, конструировали для применения в специфичных к событию анализов событий сои pDAB9582.814.19.1 (предварительная заявка США № 61/471845) и pDAB8264.44.06.1 (описано выше). Эти реагенты использовали в условиях, приведенных ниже, для определения зиготности каждого встроенного события, содержащегося в пакетированном событии сои pDAB9582.814.19.1::pDAB8264.44.06.1.
Условия амплификации посредством мультиплексной ПЦР были следующими: 1х буфера для ПЦР Roche, 0,4 мкМ специфичного к событию pDAB8264.44.06.1 прямого праймера, 0,4 мкМ специфичного к событию pDAB8264.44.06.1 обратного праймера, 0,4 мкМ специфичного к событию pDAB9582.814.19.1 прямого праймера, 0,4 мкМ специфичного к событию pDAB9582.814.19.1 обратного праймера, 0,4 мкМ праймера GMS116F, 0,4 мкМ праймера GMS116R, 0,2 мкМ специфичного к событию pDAB9582.814.19.1 зонда, 0,2 мкМ специфичного к событию pDAB8264.44.06.1 зонда, 0,2 мкМ зонда GMS116, 0,1% PVP, 20 нг гДНК в общей реакционной смеси объемом 10 мкл. Смесь амплифицировали с применением следующих условий: i) 95ºC в течение 10 минут, ii) 95ºC в течение 10 секунд, iii) 60ºC в течение 30 секунд, iv) 72ºC в течение 1 секунды) повторение этапов ii-iv в течение 35 циклов, v) удержание при 40ºC. ПЦР в реальном времени проводили на Roche LightCycler 480. Анализ данных был основан на определении точки пересечения (значения Cp), установленной, посредством программного обеспечения LightCycler 480, которая представляет собой число циклов ПЦР, при котором скорость изменения флуоресценции достигает максимума.
В общей сложности 37 расщепленных растений F2, полученных от гибрида события сои pDAB9582.814.19.1 и события сои pDAB8264.44.06.1 тестировали посредством специфичных к событию анализов TAQMAN® для определения зиготности растений по обоим событиям сои pDAB9582.814.19.1 и pDAB8264.44.06.1. Результаты этих анализов указывают на то, что событие сои pDAB9582.814.19.1 и событие сои pDAB8264.44.06.1 присутствуют, и детектируются в 23 растениях. Зиготность (которую также называют плоидностью) каждого события указана в таб. 14. Из 23 идентифицированных растений, 1 растение было идентифицировано как содержащее две копии события сои pDAB9582.814.19.1 и события сои pDAB8264.44.06.1.
Пример 9.3: Описание экспрессии белка в пакетированном событии сои pDAB9582.814.19.1::pDAB8264.44.06.1
Описывали биохимические свойства рекомбинантных белков CrylF, CrylAc, AAD12, 2mEPSPS и PAT, экспрессирующихся в пакетированном событии сои pDAB9582.814.19.1::pDAB8264.44.06.1. Иммуноферментный анализ (ELISA) использовали для количественной оценки экспрессии PAT. В свою очередь, белки CrylAc/CrylF и AAD12/2mEPSPS количественно оценивали посредством мультиплексных иммунологических анализов с применением электрохемилюминесцентной технологии из Meso-Scale Discovery (MSD, Gaithersburg, Maryland). Все эти анализы использовали для описания биохимических свойств и подтверждения надежной экспрессии этих белков в пакетированном событии сои pDAB9582.814.19.1::pDAB8264.44.06.1.
Экспрессия белка PAT в растительных тканях
Определяли уровни белка PAT в F3 пакетированного события сои pDAB9582.814.19.1::pDAB8264.44.06.1, гомозиготных по обоим событиям pDAB9582.814.19.1 и pDAB8264.44.06.1. Уровни белка PAT, экспрессирующегося в событии сои pDAB9582.814.19.1::pDAB8264.44.06.1, сравнивали с уровнями для родительских событий, события сои pDAB9582.814.19.1 и события сои pDAB8264.44.06.1.
Растворимый экстрагируемый белок PAT получали из ткани листа сои и анализировали с применением количественного способа ELISA (APS 014, Envirologix, Portland, ME). Образцы ткани листа сои получали от выращенных в теплице тестируемых растений на стадиях развития от однолистного до V1 и подготавливали к анализу экспрессии. Белок PAT экстрагировали из тканей листа сои с применением фосфатно-солевого буфера, содержащего детергент Tween-20 (PBST) и 1% поливинилпирролидона 40 (PVP-40). Образцы затем обрабатывали с применением GenoGrinder® при 1500 об./мин. в течение 5 минут. Растительный экстракт центрифугировали; собирали водный супернатант, разводили подходящим буфером по мере необходимости и анализировали с применением набора PAT ELISA для слоистого метода. Набор использовали согласно предложенному производителем протоколу (Envirologix, Portland, ME).
Детектирование проводили для анализа экспрессии и наследуемости события сои pDAB9582.814.19.1::pDAB8264.44.06.1. Поколение F3 пакетированного события сои pDAB9582.814.19.l::pDAB8264.44.06.1 экспрессировали PAT в более высоких концентрациях, чем оба родительских события, pDAB9582.814.19.1 и pDAB8264.44.06.1. Повышенная концентрация PAT в пакетированном событии сои pDAB9582.814.19.1::pDAB8264.44.06.1 была теоретически ожидаемой. Повышенные концентрации PAT являются результатом события сои pDAB9582.814.19.1::pDAB8264.44.06.1, содержащего вдвое больше копий кодирующей последовательности pat, по сравнению с обоими родительскими событиями (табл. 15).
Экспрессия белков Cry1F и Cry1Ac в растительных тканях
Уровни белков CrylF и CrylAc определяли в F3 пакетированного события сои pDAB9582.814.19.1::pDAB8264.44.06.1, гомозиготных по обоим событиям pDAB9582.814.19.1 и pDAB8264.44.06.1. Уровни белков CrylF и CrylAc, экспрессирующихся в событии сои pDAB9582.814.19.1::pDAB8264.44.06.1, сравнивали с уровнями для родительского события сои pDAB9582.814.19.1.
Растворимые экстрагируемые белки CrylF и CrylAc получали из ткани листа сои и анализировали посредством мультиплексного электрохемилюминесцентного анализа MSD. Образцы ткани листа сои получали от выращенных в теплице тестируемых растений на стадиях развития от однолистного до V1 и подготавливали к анализу экспрессии. Белки Cry1F и Cry1Ac экстрагировали из тканей листа сои с применением фосфатно-солевого буфера, содержащего детергент Tween-20 (PBST) и 1% поливинилпирролидона 40 (PVP-40). Образцы затем обрабатывали с применением GenoGrinder® при 1500 об./мин. в течение 5 минут. Растительный экстракт центрифугировали; собирали водный супернатант, разводили подходящим буфером по мере необходимости и анализировали с применением мультиплексного анализа MSD Cry1F/CrylAc из Meso-Scale Discovery. Набор использовали согласно предложенному производителем протоколу.
Детектирование проводили для анализа экспрессии и наследуемости события сои pDAB9582.814.19.1::pDAB8264.44.06.1. Поколение F3 пакетированного события сои pDAB9582.814.19.1::pDAB8264.44.06.1 экспрессировало белок CrylAc в более высоких концентрациях, чем родительское событие сои pDAB9582.814.19.1. Поколение F3 пакетированного события сои pDAB9582.814.19.1::pDAB8264.44.06.1 экспрессировало белок CrylF в более низких концентрациях, чем родительское событие сои pDAB9582.814.19.1. (табл. 16). Несмотря на различия в уровнях экспрессии, эти результаты указывают на то, что растения события сои pDAB9582.814.19.1::pDAB8264.44.06.1 содержат функциональные экспрессирующие копии кодирующих последовательностей cry1F и cry1Ac, унаследованные от родительской линии, события сои pDAB9582.814.19.1.
Экспрессия белков AAD12 и 2mEPSPS в растительных тканях
Определяли уровни белков AAD12 и 2mEPSPS в F3 пакетированного события сои pDAB9582.814.19.1::pDAB8264.44.06.1, гомозиготных по обоим событиям pDAB9582.814.19.1 и pDAB8264.44.06.1. Уровни белков AAD12 и 2mEPSPS, экспрессирующихся в событии сои pDAB9582.814.19.1::pDAB8264.44.06.1, сравнивали с уровнями для родительского события, события сои pDAB8264.44.06.1.
Растворимые экстрагируемые белки AAD12 и 2mEPSPS получали из ткани листа сои и анализировали посредством мультиплексного электрохемилюминесцентного анализа MSD. Образцы ткани листа сои получали от выращенных в теплице тестируемых растений на стадиях развития от однолистного до V1 и подготавливали к анализу экспрессии. Белки AAD12 и 2mEPSPS экстрагировали из тканей листа сои с применением фосфатно-солевого буфера, содержащего детергент Tween-20 (PBST) и 1% поливинилпирролидона 40 (PVP-40). Образцы затем обрабатывали с применением GenoGrinder® при 1500 об./мин. в течение 5 минут. Растительный экстракт центрифугировали; собирали водный супернатант, разводили подходящим буфером по мере необходимости и анализировали с применением мультиплексного анализа MSD AAD12 и 2mEPSPS из Meso-Scale Discovery. Набор использовали согласно предложенному производителем протоколу.
Детектирование проводили для анализа экспрессии и наследуемости события сои pDAB9582.814.19.1::pDAB8264.44.06.1. Поколение F3 пакетированного события сои pDAB9582.814.19.1::pDAB8264.44.06.1 экспрессировало белки AAD12 и 2mEPSPS в более высоких концентрациях, чем родительское событие сои pDAB8264.44.06.1 (табл. 17). Несмотря на различия в уровнях экспрессии, эти результаты указывают на то, что растения события сои pDAB9582.814.19.1::pDAB8264.44.06.1 содержат функциональные экспрессирующие копии кодирующих последовательностей AAD12 и 2mEPSPS, унаследованные от родительской линии, события сои pDAB8264.44.06.1.
Пример 9.4: Устойчивость к гербицидам пакетированного события сои pDAB9582.814.19.1::pDAB8264.44.06.1
Оценивали устойчивость к гербицидам пакетированного события сои pDAB9582.814.19.1::pDAB8264.44.06.1. Семена события сои pDAB9582.814.19.1::pDAB8264.44.06.1 высаживали в вегетационных опытах, и зрелые растения обрабатывали смесью гербицидов, представляющей собой комбинацию 2,4-D и глифосата. Полученную устойчивость к этим гербицидам измеряли посредством подсчета числа выживших растений. В то же время, в исследование были включены контрольные растения, которые не содержали генов aad-12 и 2mEPSPS, и были, как ожидалось, чувствительными к обработке гербицидами 2,4-D и глифосатом.
Устойчивость к гербицидам оценивали для выращенных в теплице растений F2 события сои pDAB9582.814.19.1::pDAB8264.44.06.1. Растения сои выращивали на участках в 4 дюйма с одним растением на участок. Всего 37 гомозиготных растений F3 обрабатывали смесью гербицидов 2,4-D и глифосата (840 г кэ/га) на стадии однолопастного листа. Все 25 растений выжили после обработки гербицидами, что указывает на то, что эти растения события сои pDAB9582.814.19.1::pDAB8264.44.06.1 были устойчивыми к обработке гербицидами, глифосатом и 2,4-D.
Таким образом, гены aad-12 и 2mEPSPS, которые присутствовали в родительской линии события сои pDAB8264.44.06.1, обеспечивали устойчивость к гербицидам 2,4-D и глифосату. Эти признаки передавались, и наследовались в событии сои pDAB9582.814.19.1::pDAB8264.44.06.1, тем самым предоставляя устойчивость к гербицидам событию сои pDAB9582.814.19.1::pDAB8264.44.06.1. Растения события сои pDAB9582.812.9.1::pDAB8264.44.06.1, которые были чувствительными к обработке гербицидами, не содержали копий aad-12 и 2mEPSPS в результате менделеевского расщепления события pDAB8264.44.06.1. Кроме того, контрольные растения, которые не содержали генов aad-12 и 2mEPSPS, были чувствительными к обработке гербицидами 2,4-D и глифосатом.
Пример 9.5: Описание инсектицидных свойств события сои pDAB9582.814.19.1::pDAB8264.44.06.1
Вегетационные опыты проводили для описания инсектицидной устойчивости события сои pDAB9582.814.19.1::pDAB8264.44.06.1, которое обеспечивалось экспрессией трансгенов CrylAc и CrylF. Событие сои pDAB9582.814.19.1::pDAB8264.44.06.1 тестировали с применением выращенных в лаборатории вредителей сои, включая Anticarsia gemmatalis (бобовая гусеница) и Pseudoplusia includens (соевая пяденица). Пакетированное событие сои pDAB9582.814.19.1::pDAB8264.44.06.1 сравнивали с родительскими событиями сои (событие сои pDAB9582.814.19.1 и событие сои pDAB8264.44.06.1) в дополнение к нетрансформированному сорту сои Maverick. Это сравнение проводили, чтобы определить, присутствует ли уровень защиты растения от повреждения насекомыми, которую обеспечивают белки CrylF и CrylAc, в пакетированном событии, которое вводит дополнительные трансгены в геном события сои. Кроме того, пакетированное событие сои pDAB9582.814.19.1::pDAB8264.44.06.1 и событие сои pDAB8264.44.06.1 обрабатывали смесью гербицидов, содержащей 2,4-D и глифосат (840 г кэ/га), перед проведением биопробы с применением насекомых, чтобы определить, влияет ли обработка гербицидами на защиту растений от насекомых, которую обеспечивают белки CrylF и CrylAc.
Вегетационные опыты проводили на растениях возрастом приблизительно три недели. Использовали по десять растений для анализа пакетированного события сои pDAB9582.814.19.1::pDAB8264.44.06.1, события сои pDAB9582.814.19.1 и отрицательных контролей; обработанных гербицидами события сои pDAB8264.44.06.1 и Maverick. Для каждого тестированного вида насекомых (Anticarsia gemmatalis и Pseudoplusia includens) вырезали 3 кусочка листа для каждого растения с общим количеством 30 листовых дисков/растений/видов насекомых. Кусочки листа с диаметром 1,4 см (или 1,54 см2) помещали на тестовую поверхность, состоящую из 2% водного агара, зараженную одной личинкой и закрытой перфорированной пластиковой крышкой. Смертность и потребление листьев оценивали через 4 суток после заражения. Личинок, которые не отвечали на осторожное прикосновение, считали мертвыми. Повреждения листьев оценивали посредством визуального подсчета процента кусочков листа, съеденных насекомыми. Статистический анализ данных проводили с применением JMP® Pro 9.0.1 (2010 SAS Institute Inc., Cary, NC).
Результаты (табл. 18), полученные в результате этих повторных экспериментов, указывают на то, что уровень защиты от насекомых и смертность, предоставляемые белками CrylF и CrylAc пакетированного события сои pDAB9582.814.19.1::pDAB8264.44.06.1, соответствует родительскому событию сои pDAB9582.814.19.1. Как и ожидалось, событие сои pDAB9582.814.19.1::pDAB8264.44.06.1 подвергалось существенно меньшему повреждению насекомыми (0,10-0,12%), чем контрольные растения события сои pDAB8264.44.06.1 (58-76%) и Maverick (79-91%) для всех использованных насекомых. Дополнительно, высокую смертность насекомых (100%) наблюдали для всех событий сои, содержащих кодирующие последовательности cry1F и cry1Ac, в то время как отрицательные контроли, Maverick и событие сои pDAB8264.44.06.1, демонстрировали смертность насекомых на уровне <10%. Таким образом, событие сои pDAB9582.814.19.1::pDAB8264.44.06.1 предоставляло защиту от активности насекомых на уровне, сопоставимом с уровнем для события сои pDAB9582.814.19.1.
Реферат
Изобретение относится к области биохимии, в частности к трансгенной растительной клетке сои, семени и растению сои, которые предназначены для получения растения, имеющего устойчивость к гербициду, выбранному из группы, состоящей из 2,4-D, глифосата, глюфосината и их комбинаций. Также раскрыт способ борьбы с сорняками, где указанный способ включает нанесение, по меньшей мере, одного из гербицида из группы, включающей гербициды на основе арилоксиалканоата, глифосата, или глюфосината, на сорняки и вышеуказанное растение. Изобретение также относится к способу получения растения сои, устойчивого к гербицидам на основе 2,4-D, глифосата, глюфосината. Изобретение позволяет эффективно получать растение, обладающее устойчивостью к гербициду, выбранному из группы, состоящей из 2,4-D, глифосата, глюфосината и их комбинаций. 13 н. и 16 з.п. ф-лы, 4 ил., 18 табл., 9 пр.
Формула
Документы, цитированные в отчёте о поиске
Растения пшеницы с повышенной устойчивостью к имидазолиноновым гербицидам

Комментарии