Способы обработки летучей золы - RU2633579C9
Код документа: RU2633579C9
Чертежи



Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка испрашивает приоритет по заявке США 61/617,422, поданной 29 марта 2012; и US 61/706,028, поданной 26 сентября 2012. Эти документы полностью включены в настоящий текст посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
[0002] Настоящее описание относится к улучшениям в области способов обработки материалов промышленных отходов. Настоящее изобретение относится к улучшениям в области способов обработки промышленных отходов. Например, оно относится к способам обработки летучей золы. Например, эти способы могут обеспечивать экстрагирование из летучей золы различных материалов, таких как оксид алюминия и оксиды различных металлов, двуокись кремния и редкоземельные элементы и т.д.
ПРЕДПОСЫЛКИ СОЗДАНИЯ
[0003] Летучая зола представляет собой один из остатков, образующихся при сжигании. Она содержит мелкие частицы, которые поднимаются вместе с отходящими газами. Зола, которая не поднимается, называется зольным остатком (шлаком). Материал летучей золы может уплотняться в процессе суспендирования в отходящих газах и тогда его собирают с использованием электростатических пылеуловителей или мешочных фильтров. Поскольку в процессе суспендирования уплотняются, частицы летучей золы могут иметь в целом сферическую форму и размер от 0.5 мкм до 100 мкм. Летучая золя может содержать диоксид кремния (SiO2) (который может присутствовать в двух формах: аморфной, которая является округлой и гладкой, и кристаллической, имеющей острые грани и углы и опасной), оксид алюминия (Al2O3) и оксид железа (Fe2O3). Летучие золы могут также содержать оксид кальция (СаО). Летучие золы могут быть высокогетерогенными. Они могут содержать смесь стекловидных частиц с различными идентифицируемыми.
[0004] Например, летучей золой может называться зола, образующаяся в процессе сжигания угля. Компоненты летучей золы значительно варьируют в зависимости от источника и состава сжигаемого угля.
[0005] Раньше летучая зола обычно выбрасывалась в атмосферу, но в настоящее время оборудование для контроля загрязнения окружающей среды, ставшее в последние десятилетия обязательным, требует обязательного улавливания золы перед выбросом. Летучая зола обычно улавливается электростатическими пылеуловителями или другим оборудованием для фильтрации частиц до того как дымные газы достигают труб углесжигающих электростанций и в этом случае вместе с топочной золой из пода топки называются угольной золой. Например, в США летучую золу обычно складируют на угольных электростанциях или помещают на полигоны для отходов. Повторно используется приблизительно 43 процента,[3] она часто используется в качестве добавки к портландцементу в производстве бетона. Однако некоторые исследователи выражают в связи с этим озабоченность, касающуюся проблем здравоохранения.
[0006] Раньше летучая зола, образующаяся в результате сжигания угля, просто увлекалась дымовыми газами и рассеивалась в атмосфере. Это создавало экологические и здравоохранительные проблемы, которые подтолкнули создание законов по снижению выбросов летучей золы до уровня ниже 1 процента от образующейся золы. Более 65% летучей золы, производимой угольными электростанциями в мире, отправляется на свалки и в золоотстойники. Переработка летучей золы стала в последние годы растущей проблемой из-за роста затрат на свалки и современного интереса к устойчивому развитию. Сообщалось, что в 2005 г. углесжигающие заводы в США произвели 71.1 миллионов тонн летучей золы, из которых 29.1 миллионов тонн было повторно использовано по различным назначениям. Если бы почти 42 миллиона тонн неиспользованной летучей золы было переработано, это снизило бы потребность в приблизительно 27,500 акрофутах (33,900,000 м3) территории для полигонов.
[0007] Соответственно, существует потребность в по меньшей мере альтернативном способе переработки и/или полезного применения летучей золы.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0008] В соответствии с одним аспектом предложен способ получения оксида алюминия и возможно других продуктов, причем способ включает:
выщелачивание алюминийсодержащего материала с использованием HCl с получением продукта выщелачивания, содержащего ионы алюминия и твердое вещество, и отделение указанного твердого вещества от продукта выщелачивания;
осуществление реакции продукта выщелачивания с HCl, в результате чего получают жидкость и осадок, содержащий ионы алюминия в форме AlCl3, и отделение осадка от жидкости;
нагревание осадка в условиях, обеспечивающих превращение AlCl3 в Al2O3 и извлечение образующегося при этом HCl; и
повторное использование полученного в способе газообразного HCl путем приведения его в контакт с водой, в результате чего получают композицию с концентрацией выше азеотропной концентрации HCl (20.2 массовых %) и осуществление реакции композиции с дополнительным количеством алюминийсодержащего материала, в результате чего происходит его выщелачивание.
[0009] В соответствии с другим аспектом предложен способ получения оксида алюминия и возможно других продуктов, причем указанный способ включает:
выщелачивание алюминийсодержащего материала с использованием HCl с получением продукта выщелачивания, содержащего ионы алюминия и твердое вещество, и отделение указанного твердого вещества от продукта выщелачивания;
осуществление реакции продукта выщелачивания с HCl, в результате чего получают жидкость и осадок, содержащий ионы алюминия в форме AlCl3, и отделение осадка от жидкости;
нагревание осадка в условиях, обеспечивающих превращение AlCl3 в Al2O3 и извлечение образующегося при этом HCl; и
повторное использование полученного в способе газообразного HCl путем приведения его в контакт с водой, в результате чего получают композицию с концентрацией от приблизительно 18 до приблизительно 45 массовых % или от приблизительно 25 до приблизительно 45 массовых %, и осуществление реакции композиции с дополнительным количеством алюминийсодержащего материала, в результате чего происходит его выщелачивание.
[0010] В соответствии с другим аспектом предложен способ получения оксида алюминия и возможно других продуктов, причем указанный способ включает:
выщелачивание алюминийсодержащего материала с использованием HCl с получением продукта выщелачивания, содержащего ионы алюминия и твердое вещество, и отделение указанного твердого вещества от продукта выщелачивания;
осуществление реакции продукта выщелачивания с HCl, в результате чего получают жидкость и осадок, содержащий ионы алюминия в форме AlCl3, и отделение осадка от жидкости;
нагревание осадка в условиях, обеспечивающих превращение AlCl3 в Al2O3 и извлечение образующегося при этом HCl; и
повторное использование полученного в способе газообразного HCl путем приведения его в контакт с водой, в результате чего получают композицию с концентрацией от приблизительно 18 до приблизительно 45 массовых % или от приблизительно 25 до приблизительно 45 массовых %, и применение этой композиции для выщелачивания алюминийсодержащего материала.
[0011] В соответствии с другим аспектом предложен способ получения оксида алюминия и возможно других продуктов, причем указанный способ включает:
выщелачивание алюминийсодержащего материала с использованием HCl с получением продукта выщелачивания, содержащего ионы алюминия и твердое вещество, и отделение указанного твердого вещества от продукта выщелачивания;
осуществление реакции продукта выщелачивания с HCl, в результате чего получают жидкость и осадок, содержащий ионы алюминия в форме AlCl3, и отделение осадка от жидкости;
нагревание осадка в условиях, обеспечивающих превращение AlCl3 в Al2O3 и извлечение образующегося при этом HCl; и
повторное использование полученного в способе газообразного HCl путем приведения его в контакт с продуктом выщелачивания, что приводит к преципитации ионов алюминия в форме AlCl3⋅6H2O.
[0012] В соответствии с другим аспектом предложен способ получения оксида алюминия и возможно других продуктов, причем указанный способ включает:
выщелачивание алюминийсодержащего материала с использованием HCl с получением продукта выщелачивания, содержащего ионы алюминия и твердое вещество, и отделение указанного твердого вещества от продукта выщелачивания;
осуществление реакции продукта выщелачивания с HCl, в результате чего получают жидкость и осадок, содержащий ионы алюминия в форме AlCl3, и отделение осадка от жидкости; и
нагревание осадка в условиях, обеспечивающих превращение AlCl3 в Al2O3.
[0013] В соответствии с другим аспектом предложен способ получения оксида алюминия и возможно других продуктов, причем указанный способ включает:
выщелачивание алюминийсодержащего материала с использованием HCl с получением продукта выщелачивания, содержащего ионы алюминия и твердое вещество, и отделение указанного твердого вещества от продукта выщелачивания;
осуществление реакции продукта выщелачивания с HCl, в результате чего получают жидкость и осадок, содержащий ионы алюминия в форме AlCl3, и отделение осадка от жидкости; и
нагревание осадка в условиях, обеспечивающих превращение AlCl3 в Al2O3, и необязательно извлечение образующегося при этом газообразного HCl.
[0014] В соответствии с одним аспектом предложен способ получения алюминия и возможно других продуктов, причем указанный способ включает:
выщелачивание алюминийсодержащего материала с использованием HCl с получением продукта выщелачивания, содержащего ионы алюминия и твердое вещество, и отделение указанного твердого вещества от продукта выщелачивания;
осуществление реакции продукта выщелачивания с HCl, в результате чего получают жидкость и осадок, содержащий ионы алюминия в форме AlCl3, и отделение осадка от жидкости;
нагревание осадка в условиях, обеспечивающих превращение AlCl3 в Al2O3; и
превращение Al2O3 в алюминий.
[0015] В соответствии с другим аспектом предложен способ получения алюминия и возможно других продуктов, причем указанный способ включает:
выщелачивание алюминийсодержащего материала с использованием HCl с получением продукта выщелачивания, содержащего ионы алюминия и твердое вещество, и отделение указанного твердого вещества от продукта выщелачивания;
осуществление реакции продукта выщелачивания с HCl, в результате чего получают жидкость и осадок, содержащий ионы алюминия в форме AlCl3, и отделение осадка от жидкости;
нагревание осадка в условиях, обеспечивающих превращение AlCl3 в Al2O3, и необязательно извлечение образующегося при этом газообразного HCl; и
превращение Al2O3 в алюминий.
[0016] В соответствии с другим аспектом предложен способ получения различных продуктов, причем указанный способ включает:
выщелачивание алюминийсодержащего материала, содержащего первый металл, с использованием HCl, в результате чего получают продукт выщелачивания, содержащий ионы первого металла, и твердое вещество, и отделение указанного твердого вещества от продукта выщелачивания;
осуществление реакции продукта выщелачивания с HCl, в результате чего получают жидкость и осадок, содержащий хлорид первого металла, и отделение осадка от жидкости; и
нагревание осадка в условиях, обеспечивающих превращение хлорида первого металл в оксид первого металла.
[0017] В соответствии с другим аспектом предложен способ получения различных продуктов, причем указанный способ включает:
выщелачивание алюминийсодержащего материала, содержащего первый металл, кислотой, в результате чего получают продукт выщелачивания, содержащий ионы первого металла, и твердое вещество, и отделение указанного твердого вещества от продукта выщелачивания;
по существу селективное удаление ионов первого металла из продукта выщелачивания, в результате чего получают композицию; и
по существу селективное удаление ионов первого металла из композиции.
[0018] В соответствии с другим аспектом предложен способ обработки алюминийсодержащего материала, включающий:
выщелачивание летучей золы кислотой, в результате чего получают продукт выщелачивания и твердый остаток, и отделение продукта выщелачивания от твердого остатка;
по меньшей мере частичное удаление ионов железа из продукта выщелачивания путем по существу селективного осаждения ионов железа при pH выше 10 путем осуществления реакции продукта выщелачивания с основанием и по меньшей мере частичного удаления осажденных ионов железа из продукта выщелачивания, в результате чего получают богатую Al композицию, содержащую ионы Al3+;
необязательно очистку ионов Al3+; и
превращение ионов Al3+в оксид алюминия.
[0019] В соответствии с другим аспектом предложен способ обработки алюминийсодержащего материала, включающий:
выщелачивание алюминийсодержащего материала кислотой, в результате чего получают продукт выщелачивания и твердый остаток, и отделение продукта выщелачивания от твердого остатка;
по меньшей мере частичное удаление ионов железа из продукта выщелачивания путем по существу селективного осаждения ионов железа при pH от приблизительно 3 до приблизительно 6 путем осуществления реакции продукта выщелачивания с основанием и по меньшей мере частичного удаления осажденных ионов железа из продукта выщелачивания, в результате чего получают богатую Al композицию, содержащую ионы Al3+;
необязательно очистку ионов Al3+; и
превращение ионов Al3+ в оксид алюминия.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0020] На представленных ниже чертежах, которые приведены исключительно в качестве примера, показаны различные варианты реализации описанного решения:
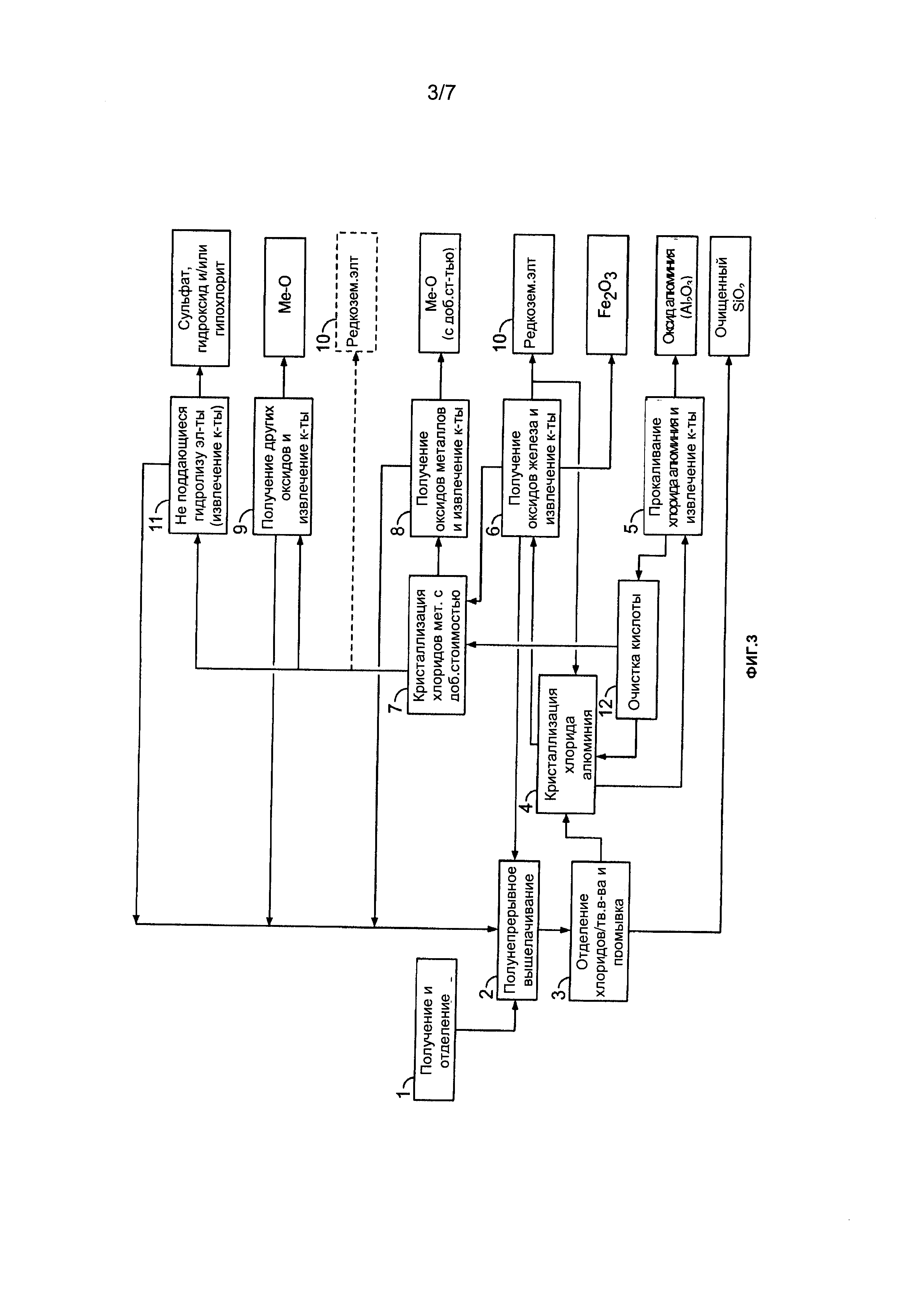
[0021] На Фиг. 1 показана блок-схема примера процесса получения оксида алюминия и различных других продуктов в соответствии с настоящим описанием;
[0022] Фиг. 2 представляет собой кривую экстракции для Al и Fe, на которой процентная доля экстракции представлена как функция времени выщелачивания в способе согласно одному из примеров, описанных в настоящей заявке;
[0023] На Фиг. 3 показана блок-схема другого примера способа получения оксида алюминия и различных других продуктов в соответствии с настоящим описанием;
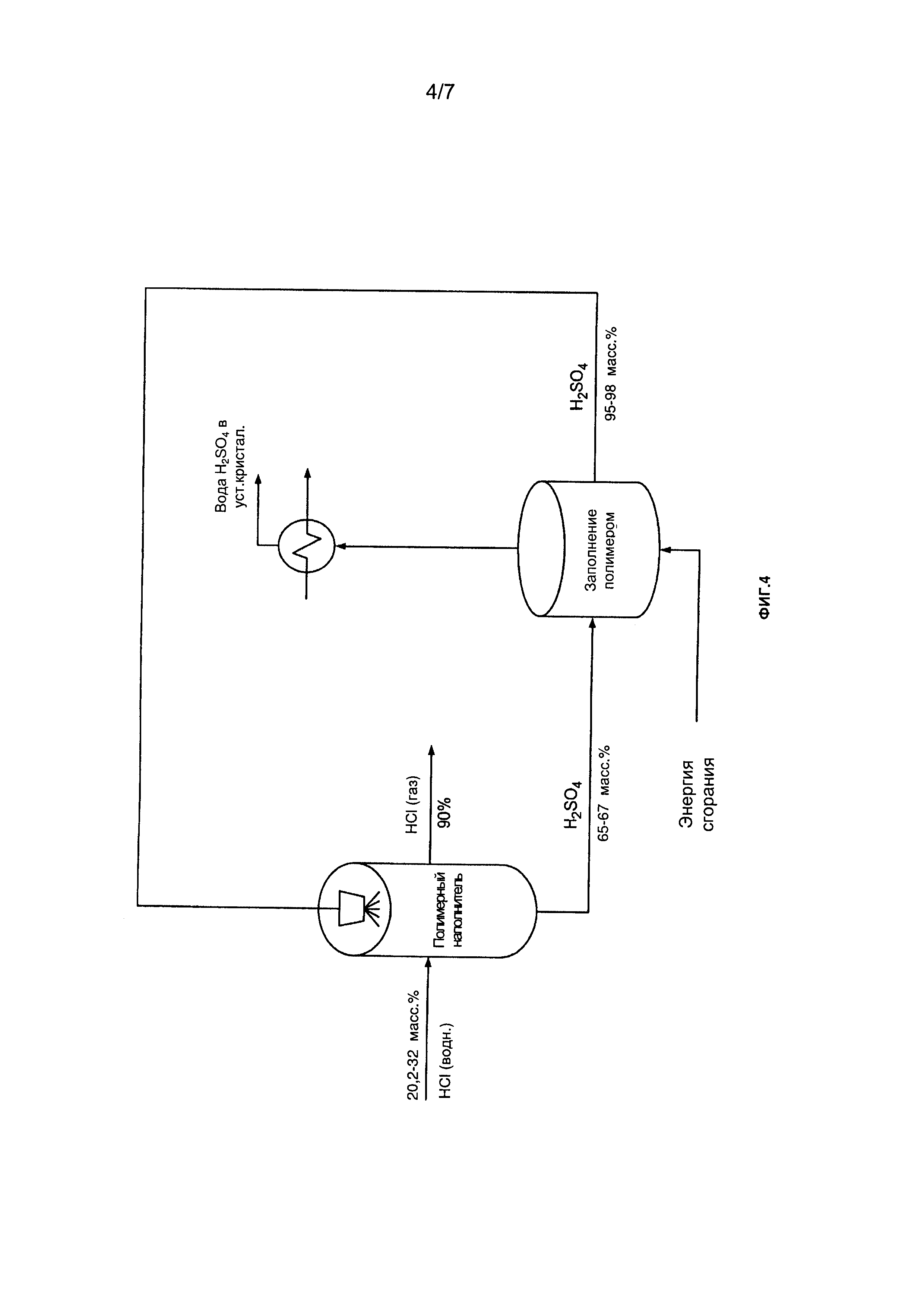
[0024] Фиг. 4 представляет собой схему примера способа очистки/концентрирования HCl в соответствии с настоящим описанием;
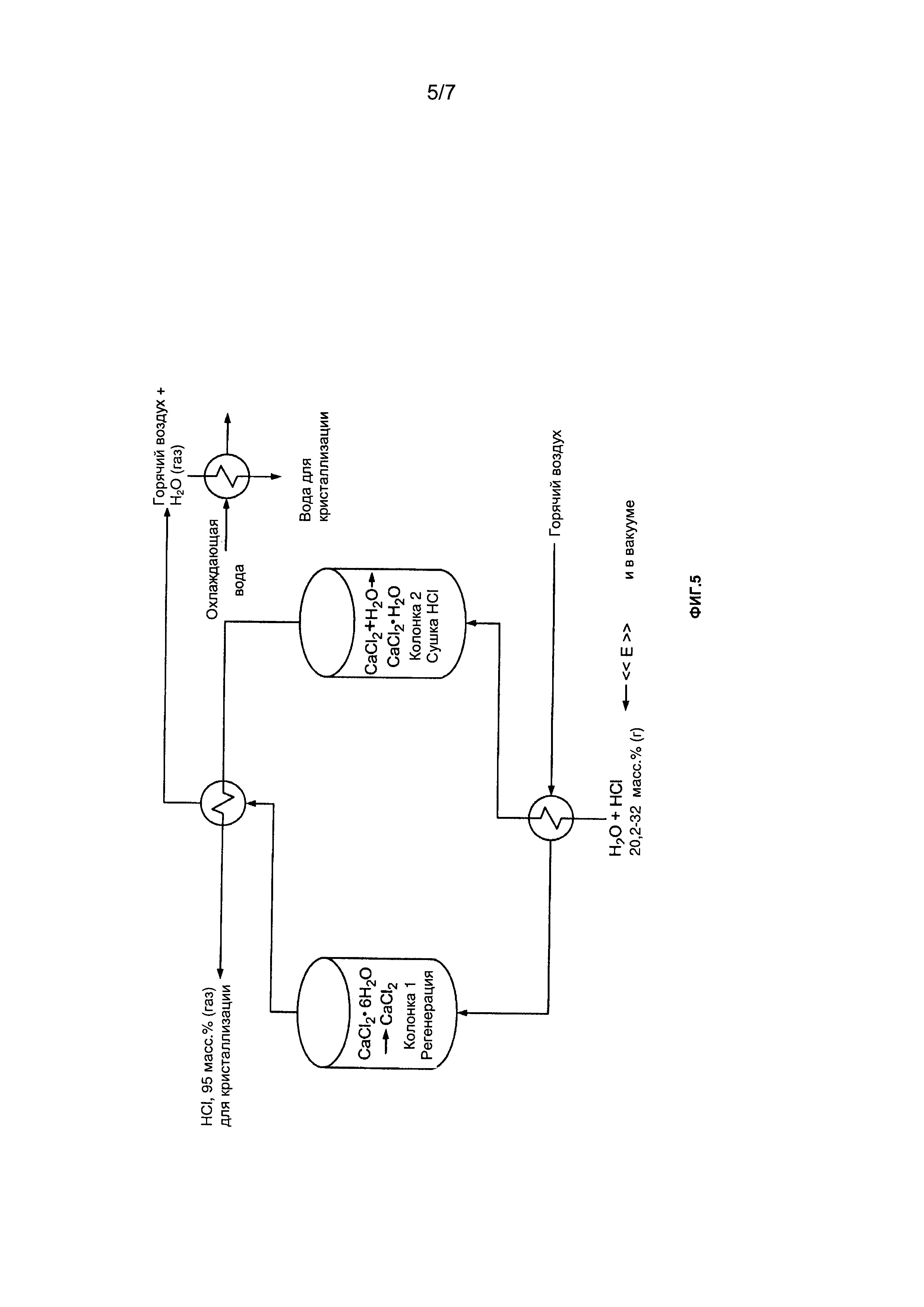
[0025] Фиг. 5 представляет собой схему примера способа очистки/концентрирования HCl в соответствии с настоящим описанием;
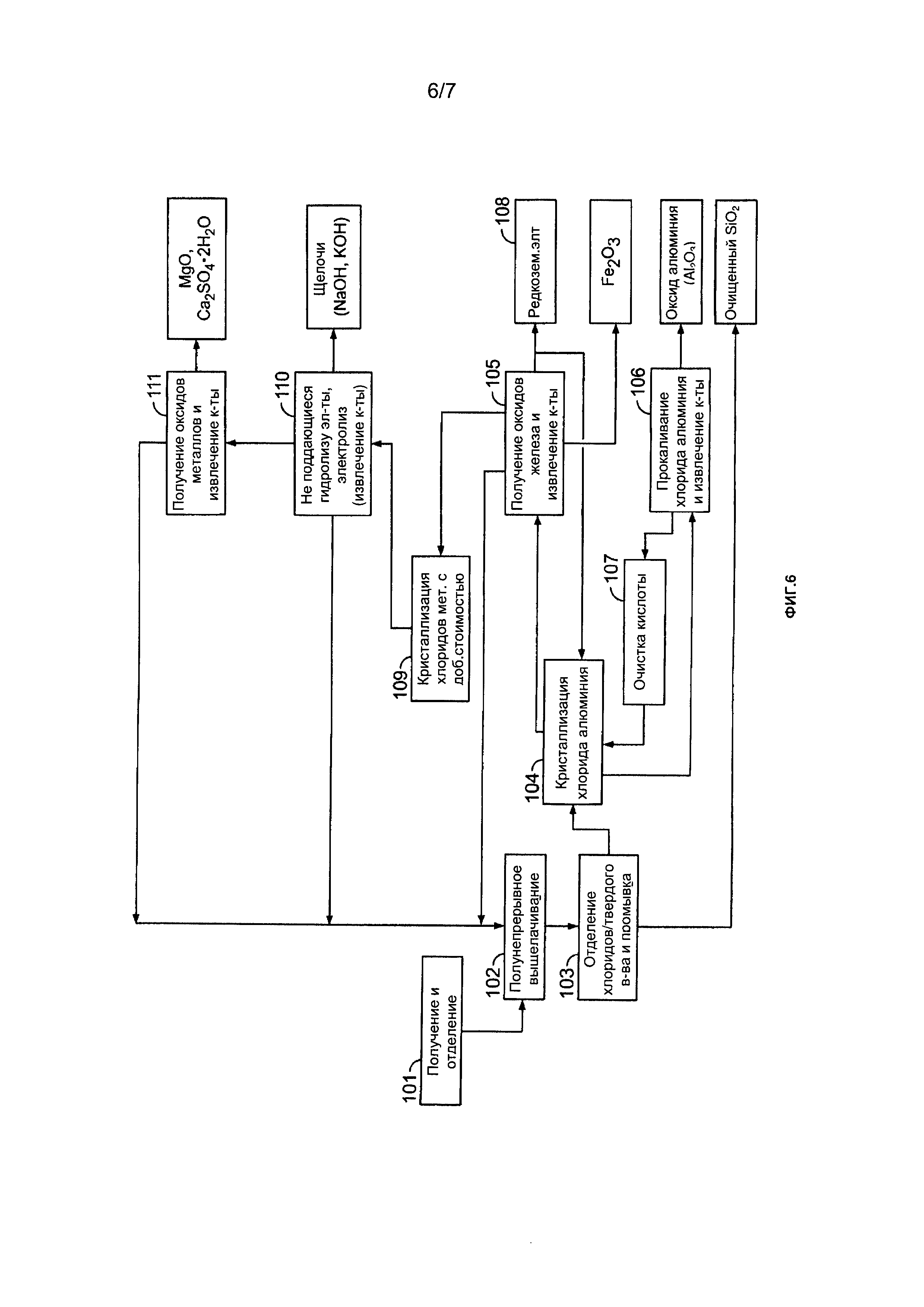
[0026] На Фиг. 6 показана другая блок-схема примера способа получения оксида алюминия и различных других продуктов в соответствии с настоящим описанием; и
[0027] На Фиг. 7 показана другая блок-схема примера способа получения оксида и различных других продуктов в соответствии с настоящим описанием.
ПОДРОБНОЕ ОПИСАНИЕ РАЗЛИЧНЫХ ВАРИАНТОВ РЕАЛИЗАЦИИ
[0028] Приведенные ниже неограничивающие примеры дополнительно иллюстрируют методику, раскрытую в настоящем описании.
[0029] Алюминийсодержащий материал может быть, например, выбран из алюминийсодержащих руд (могут использоваться такие как алюмосиликатные минералы, глины, аргиллит, нефелин, мадстоун, берилл, криолит, гранат, шпинель, боксит, каолин или их смеси). Алюминийсодержащий материал также может представлять собой повторно используемый алюминийсодержащий материал, такой как шлак, красный шлам или летучая зола.
[0030] Выражение "красный шлам" в настоящем тексте относится, например, к побочному продукту производства, образующемуся в ходе получения оксида алюминия. Например, такой побочный продукт может включать двуокись кремния, алюминий, железо, кальций и, возможно, титан. Он также может содержать ряд минорных компонентов, таких как Na, K, Cr, V, Ni, Ва, Cu, Mn, Pb, и/или Zn и т.д. Например, красный шлам может содержать от приблизительно 15 до приблизительно 80% по массе Fe2O3, от приблизительно 1 до приблизительно 35% по массе Al2O3, от приблизительно 1 до приблизительно 65% по массе SiO2, от приблизительно 1 до приблизительно 20% по массе Na2O, от приблизительно 1 до приблизительно 20% по массе СаО, и от 0 до приблизительно 35% по массе TiO2. В соответствии с другим примером красный шлам может содержать от приблизительно 30 до приблизительно 65% по массе Fe2O3, от приблизительно 10 до приблизительно 20% по массе Al2O3, от приблизительно 3 до приблизительно 50% по массе SiO2, от приблизительно 2 до приблизительно 10% по массе Na2O, от приблизительно 2 до приблизительно 8% по массе СаО и от 0 до приблизительно 25% по массе TiO2.
[0031] Выражение "летучие золы" или "летучая зола" в настоящем тексте относится, например, к побочному продукту производства, образующемуся при сжигании. Например, такой побочный продукт может содержать различные элементы, такие как двуокись кремния, кислород, алюминий, железо, кальций. Например, летучая зола может содержать диоксид кремния (SiO2) и оксид алюминия (Al2O3). Например, летучая зола может дополнительно содержать оксид кальция (СаО) и/или оксид железа (Fe2O3). Например, летучая зола может содержать тонкие частицы, которые поднимаются с дымовыми газами. Например, летучая зола может образовываться в ходе сжигания угля. Например, летучая зола может также содержать по меньшей мере один элемент, выбранный из мышьяка, бериллия, бора, кадмия, хрома, хрома IV, кобальта, свинца, магния, ртути, молибдена, селена, стронция, таллия и/или ванадия. Например, летучая зола может также содержать редкоземельные элементы и редкие металлы. Например, летучая зола может рассматриваться как алюминийсодержащий материал. Например, летучая зола может содержать от приблизительно 40 до приблизительно 50% по массе SiO2, приблизительно 20 до приблизительно 30% по массе Al2O3, приблизительно 15 приблизительно 25% по массе Fe2O3, приблизительно 1 до приблизительно 6% по массе Ca2O, приблизительно 0 до приблизительно 2% по массе MgO, приблизительно 0 до приблизительно 2% Na2O и приблизительно 1 до приблизительно 4% K2O.
[0032] Выражение "редкоземельный элемент" (также обозначаемый "РЗЭ") в настоящем тексте относится, например, к редкому элементу, выбранному из скандия, иттрия, лантан, церия, празеодим, неодим, прометия, самария, европия, гадолиния, тербия, диспрозия, гольмия, эрбия, тулия, иттербия и лютеция. Выражение "редкие металлы" в настоящем тексте относится, например, к редким металлам, выбранным из индия, циркония лития и галлия. Эти редкоземельные элементы и редкие металлы могут присутствовать в различных формах, таких как элементарная форма (или металлическая форма), в форме хлоридов, оксидов, гидроксидов и т.д. Выражение "редкоземельные" в настоящем тексте употребляется как синоним "редкоземельных элементов и редких металлов", которые описаны выше.
[0033] Выражение "по меньшей мере один хлорид железа" в настоящем тексте относится к FeCl2, FeCl3 или их смеси.
[0034] Термин «гематит» в настоящем тексте относится, например, к соединению, содержащему α-Fe2O3, γ-Fe2O3, β-FeO.OH или их смеси.
[0035] Выражение "ионы железа" в настоящем тексте относится, например, к ионам, включающим по меньшей мере один тип ионов железа, выбранный из всех возможных форм ионов Fe. Например, по меньшей мере один тип ионов железа может представлять собой Fe2+, Fe3+ или их смесь.
[0036] Выражение "ионы алюминия" в настоящем тексте относится, например, к ионам, включающим по меньшей мере один тип ионов алюминия, выбранный из всех возможных форм ионов Al. Например, по меньшей мере один тип ионов алюминия может представлять собой Al+3.
[0037] Выражение "по меньшей мере один ион алюминия" в настоящем тексте относится, например, к по меньшей мере одному типу ионов алюминия, выбранному из всех возможных форм ионов Al. Например, по меньшей мере ион алюминия может представлять собой Al+3.
[0038] Выражение "по меньшей мере один ион железа", в настоящем тексте относится, Например, к по меньшей мере одному типу ионов железа, выбранному из всех возможных форм ионов Fe. Например, по меньшей мере один ион железа может представлять собой Fe2+, Fe3+ или их смесь.
[0039] Выражение "по меньшей мере один осажденный ион железа" в настоящем тексте относится, например, к по меньшей мере одному типу ионов железа, выбранному из всех возможных форм ионов Fe, осажденному в твердой форме. Например, по меньшей мере один ион железа, присутствующий в таком осадке, может представлять собой Fe2+, Fe3+ или их смесь.
[0040] Термины, обозначающие степень, такие как "приблизительно" и "приблизительно" в настоящем тексте обозначают разумное значение отклонения от термина, к которому они относятся, при котором не происходит значительного изменения конечного результата. Предполагается, что эти термины степени включают отклонение, равное по меньшей мере ±5% или по меньшей мере ±10% от значения, к которому они относятся, если такое отклонение не противоречит истинности значения слова, к которому оно относится.
[0041] Например, материал может быть подвергнут выщелачиванию с использованием HCl в концентрации от приблизительно 10 до приблизительно 50 массовых %, приблизительно 15 до приблизительно 45 массовых %, от приблизительно 18 до приблизительно 45 массовых %, от приблизительно 18 до приблизительно 32 массовых %, от приблизительно 20 до приблизительно 45 массовых %, от приблизительно 25 до приблизительно 45 массовых %, от приблизительно 26 до приблизительно 42 массовых %, от приблизительно 28 до приблизительно 40 массовых %, от приблизительно 30 до приблизительно 38 массовых %, или от 25 до 36 массовых %. Например, может использоваться HCl в концентрации приблизительно 18 масс. % или приблизительно 32 масс. %.
[0042] Выщелачивание также может быть осуществлено путем добавления сухой высококонцентрированной кислоты (например, 85%, 90% или 95%) в газовой фазе в водном растворе. В альтернативном варианте выщелачивание может также быть осуществлено с использованием слабого раствора кислоты (например, <3 масс %).
[0043] Например, выщелачивание может быть осуществлено с использованием HCl с концентрацией от приблизительно 18 до приблизительно 32 масс. % в первом реакторе, и затем с использованием HCl с концентрацией от приблизительно 90 до приблизительно 95% (газообразная) во втором реакторе.
[0044] Например, выщелачивание может быть осуществлено с использованием HCl с концентрацией от приблизительно 18 до приблизительно 32 масс. % в первом реакторе, затем с использованием HCl с концентрацией от приблизительно 90 до приблизительно 95% (газообразного) во втором реакторе; и с использованием HCl с концентрацией от приблизительно 90 до приблизительно 95% (газообразной) в третьем реакторе.
[0045] Например, выщелачивание может быть осуществлено в атмосфере инертного газа (например, аргона или азота).
[0046] Например, выщелачивание может быть осуществлено в атмосфере NH3.
[0047] Например, выщелачивание материала может осуществляться при температуре от приблизительно 125 до приблизительно 225°C, от приблизительно 150 до приблизительно 200°C, от приблизительно 160 до приблизительно 190°C, от приблизительно 185 до приблизительно 190°C, от приблизительно 160 до приблизительно 180°C, от приблизительно 160 до приблизительно 175°C, или от приблизительно 165 до приблизительно 170°C.
[0048] Например, выщелачивание материала может осуществляться при давлении от приблизительно 4 до приблизительно 10 бар по манометру, от приблизительно 4 до приблизительно 8 бар по манометру, или от приблизительно 5 до приблизительно 6 бар по манометру.
[0049] Выщелачивание может быть осуществлено под давлением (например, выше атмосферного давления) в автоклаве. Например, оно может быть осуществлено под давлением от приблизительно 5 КПа до приблизительно 850 КПа, от приблизительно 50 КПа до приблизительно 800 КПа, от приблизительно 100 КПа до приблизительно 750 КПа, от приблизительно 150 КПа до приблизительно 700 КПа, от приблизительно 200 КПа до приблизительно 600 КПа или от приблизительно 250 КПа до приблизительно 500 КПа. Выщелачивание может быть осуществлено при температуре, равной по меньшей мере 80°C, по меньшей мере 90°C или от приблизительно 100°C до приблизительно 110°C. В некоторых случаях, оно может осуществляться при более высоких температурах.
[0050] Выщелачивание также может осуществляться под давлением. Например, давление может составлять от приблизительно 100 до приблизительно 300 или от приблизительно 150 до приблизительно 200 фунтов на квадратный дюйм по манометру. Выщелачивание можно осуществлять в течение от приблизительно 30 минут до приблизительно 5 часов. Оно может быть осуществлено при температуре от приблизительно 60°C до приблизительно 200°C.
[0051] Например, способы могут дополнительно включать повторное использование полученного в способе газообразного HCl путем приведения его в контакт с водой, в результате чего получают композицию с концентрацией от приблизительно 18 до приблизительно 45 массовых % или от 25 до приблизительно 45 массовых %.
[0052] Например, способы могут дополнительно включать повторное использование полученного в способе газообразного HCl путем приведения его в контакт с водой, в результате чего получают композицию с концентрацией от приблизительно 18 до приблизительно 45 массовых %, от приблизительно 26 до приблизительно 42 массовых %, от приблизительно 28 до приблизительно 40 массовых %, от приблизительно 30 до приблизительно 38 массовых %, от 18 до 36 массовых %, от 19 до 36 массовых %, от 25 до 36 массовых % или от приблизительно 25 до приблизительно 45 массовых % и возможно использование этой композиции для выщелачивания материала.
[0053] Например, жидкость может содержать хлорид железа. Хлорид железа может включать по меньшей мере один из FeCl2, FeCl3, и из смесь.
[0054] Например, концентрация хлорида железа в жидкости может составлять по меньшей мере 30% по массе; и жидкость может быть затем гидролизована при температуре от приблизительно 155 до приблизительно 350°C.
[0055] Например, жидкость можно концентрировать с получением концентрированной жидкости, концентрация хлорида железа в которой составляет по меньшей мере 30% по массе; после чего хлорид железа может быть гидролизован при температуре от приблизительно 155 до приблизительно 350°C при поддержании концентрации хлорида железа (III) на уровне по меньшей мере 65% по массе, с получением композиции, содержащей жидкость и осажденный гематит, и извлечение указанного гематита.
[0056] Например, концентрация негидролизуемых элементов с гематитом может быть повышена обратно до концентрации от приблизительно 0.125 до приблизительно 52% масс. в циркуляционном контуре ввиду селективной экстракции.
[0057] Например, жидкость можно концентрировать с получением концентрированной жидкости с концентрацией по меньшей мере одного хлорида железа, равной по меньшей мере 30% по массе; и затем гидролизовать при температуре от приблизительно 155 до приблизительно 350°C.
[0058] Например, жидкость можно концентрировать с получением концентрированной жидкости с концентрацией по меньшей мере одного хлорида железа, равной по меньшей мере 30% по массе; после чего этот по меньшей мере один хлорид железа гидролизуют при температуре от приблизительно 155 до приблизительно 350°C при поддержании концентрации хлорида железа(III) на уровне по меньшей мере 65% по массе, с получением композиции, содержащей жидкость и осажденный гематит, и извлечением указанного гематита.
[0059] Например, жидкость можно концентрировать с получением концентрированной жидкости с концентрацией по меньшей мере одного хлорида железа, равной по меньшей мере 30% по массе; после чего по меньшей мере один хлорид железа гидролизуют при температуре от приблизительно 155 до приблизительно 350°C при поддержании концентрации хлорида железа(III) на уровне по меньшей мере 65% по массе, с получением композиции, содержащей жидкость и осажденный гематит, и извлечением указанного гематита; извлечение гематита; и извлечение редкоземельных элементов и/или редких металлов из жидкости.
[0060] Например, по меньшей мере один хлорид железа может быть гидролизован при температуре от приблизительно 150 до приблизительно 175, от 155 до приблизительно 170 или от 165 до приблизительно 170°C.
[0061] Например, жидкость можно концентрировать с получением концентрированной жидкости, концентрация хлорида железа в которой составляет по меньшей мере 30% по массе; после чего хлорид железа может быть гидролизован при температуре от приблизительно 155 до приблизительно 350°C при поддержании концентрации хлорида железа(III) на уровне по меньшей мере 65% по массе, с получением композиции, содержащей жидкость и осажденный гематит; извлечение гематита; и извлечение редкоземельных элементов и/или редкие металлы из жидкости.
[0062] Например, способы могут дополнительно включать, после извлечения редкоземельных элементов и/или редких металлов, осуществление реакции жидкости с HCl, что обеспечивает осаждение MgCl2, и его извлечение.
[0063] Например, способы могут дополнительно включать прокаливание MgCl2 в MgO и возможно повторное использование образующегося при этом HCl.
[0064] Например, способы могут дополнительно включать, после извлечения редкоземельных элементов и/или редких металлов, осуществление реакции жидкости с HCl, и по существу селективное осаждение Na2SO4. Например, Na2SO4может быть осажден путем осуществление реакции жидкости с H2SO4.
[0065] Например, способы могут дополнительно включать, после извлечения редкоземельных элементов и/или редких металлов, осуществление реакции жидкости с HCl, и по существу селективное осаждение K2SO4. Например, преципитация K2SO4 может быть осуществлена путем добавления H2SO4.
[0066] Например, жидкость можно концентрировать с получением концентрированной жидкости, концентрация хлорида железа в которой составляет по меньшей мере 30% по массе; и затем этот хлорид железа может быть гидролизован при температуре от приблизительно 155 до приблизительно 350°C при поддержании концентрации хлорида железа(III) на уровне по меньшей мере 65% по массе, с получением композиции, содержащей жидкость и осажденный гематит, и извлечением указанного гематита; извлечение гематита; и осуществление реакции жидкости с HCl. Например, такие способы могут дополнительно включать осуществление реакции жидкости с H2SO4, в результате чего происходит по существу селективное осаждение Na2SO4. Способы могут также включать далее осуществление реакции жидкости с H2SO4, что обеспечивает по существу селективное осаждение K2SO4.
[0067] Например, способы могут включать осуществление реакции отдельных сухих солей (например, солей Na или K), полученных в способах, с H2SO4 и извлечение HCl с одновременным получением пригодных к продаже K2SO4 и Na2SO4 и извлечением хлороводородной кислоты в количестве 15 до приблизительно 90% масс.
[0068] Например, хлорид натрия, получаемый в способах, может вступать в химические реакции с серной кислотой, в которых чего получают сульфат натрия и регенерированную соляную кислоту. Хлорид калия может вступать в химическую реакцию с серной кислотой, в результате чего получают сульфат калия и регенерированную соляную кислоту. В альтернативном варианте, насыщенный раствор хлорида натрия и калия может быть загружаемым материалом для маленьких хлорощелочных электролизеров. В последнем случае образуются обычные основания (NaOH и KOH) и гипохлориты (NaOCl и KOCl).
[0069] Например, способы могут дополнительно включать, после извлечения редкоземельных элементов и/или редких металлов, извлечение NaCl из жидкости, осуществление реакции NaCl с H2SO4, и по существу селективное осаждение Na2SO4.
[0070] Например, способы могут дополнительно включать, после извлечения редкоземельных элементов и/или редких металлов, извлечение KCl из жидкости, осуществление реакции KCl с H2SO4, и по существу селективное осаждение K2SO4.
[0071] Например, способы могут дополнительно включать, после извлечения редкоземельных элементов и/или редких металлов, извлечение NaCl из жидкости, проведение электролиза, в результате чего образуются NaOH и NaOCl.
[0072] Например, способы могут дополнительно включать, после извлечения редкоземельных элементов и/или редких металлов, извлечение KCl из жидкости, осуществление реакции KCl, проведение электролиза, в результате чего образуются KOH и KOCl.
[0073] Например, жидкость можно концентрировать с получением концентрированной жидкости с концентрацией по меньшей мере одного хлорида железа по меньшей мере 30% по массе; и затем по меньшей мере один хлорид железа гидролизуют при температуре от приблизительно 155 до приблизительно 350°C при поддержании концентрации хлорида железа(III) на уровне по меньшей мере 65% по массе, с получением композиции, содержащей жидкость и осажденный гематит, и извлечением указанного гематита; извлечение гематита; и экстракцию NaCl и/или KCl из жидкости.
[0074] Например, способы могут дополнительно включать осуществление реакции NaCl с H2SO4, в результате чего происходит по существу селективное осаждение Na2SO4.
[0075] Например, способы могут дополнительно включать осуществление реакции KCl с H2SO4, в результате чего происходит по существу селективное осаждение K2SO4.
[0076] Например, способы могут дополнительно включать осуществление электролиза NaCl с получением NaOH и NaOCl.
[0077] Например, способы могут дополнительно включать осуществление электролиза KCl с получением KOH и KOCl.
[0078] Например, способы могут включать отделение твердого вещества от продукта выщелачивания и промывку твердого вещества, в результате чего получают диоксид кремния, степень чистоты которого составляет по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99%, по меньшей мере 99.5% или по меньшей мере 99.9%.
[0079] Например, AlCl3 может быть представлен в форме AlCl3⋅6H2O.
[0080] Например, способы могут включать осуществление реакции продукта выщелачивания с газообразным HCl, в результате чего получают жидкость и осадок, содержащий ионы алюминия в форме AlCl3⋅6H2O.
[0081] Например, способы могут включать осуществление реакции продукта выщелачивания с сухим газообразным HCl, в результате чего получают жидкость и осадок, содержащий ионы алюминия в форме AlCl3⋅6H2O.
[0082] Например, способы могут включать осуществление реакции продукта выщелачивания с кислотой, по меньшей мере 30% масс. которой было извлечено, регенерировано и/или очищено как описано в настоящем тексте, в результате чего получают жидкость и осадок, содержащий ионы алюминия в форме AlCl3⋅6H2O.
[0083] Например, способы могут включать осуществление реакции продукта выщелачивания с газообразным HCl, в результате чего получают жидкость и осадок, содержащий ионы алюминия, причем указанный осадок образуется в результате кристаллизации AlCl3⋅6H2O.
[0084] Например, способы могут включать осуществление реакции продукта выщелачивания с сухим газообразным HCl, в результате чего получают жидкость и осадок, содержащий ионы алюминия, причем указанный осадок образуется в результате кристаллизации AlCl3⋅6H2O.
[0085] Например, ионы алюминия могут осаждаться в форме AlCl3 (например, AlCl3⋅6H2O) в кристаллизаторе, например, в результате добавления HCl с концентрацией от приблизительно 26 до приблизительно 32 масс. % или от приблизительно 24 до приблизительно 26% масс.
[0086] Например, концентрация HCl в газообразной HCl может составлять по меньшей мере 85% масс. или по меньшей мере 90% масс.
[0087] Например, концентрация HCl в газообразной HCl может составлять от приблизительно 90% масс. или приблизительно 90% до приблизительно 95% масс.
[0088] Например, в процессе кристаллизации AlCl3⋅6H2O концентрация HCl в жидкости может поддерживаться на уровне от приблизительно 25 до приблизительно 35% по массе, от приблизительно 30 до приблизительно 32% по массе или от приблизительно 23 до приблизительно 26% по массе.
[0089] Например, кристаллизация может осуществляться при температуре от приблизительно 45 до приблизительно 65°C или от приблизительно 50 до приблизительно 60°C.
[0090] Например, из образующейся в качестве побочного продукта газообразной HCl может быть получена HCl.
[0091] Например, в описанных здесь способах конкретную партию или количество алюминийсодержащего минерала подвергают выщелачиванию, затем превращают в AlCl3⋅6H2O, а затем HCl, полученную в ходе прокаливания AlCl3⋅6H2O в Al2O3используют например, для выщелачивания другой конкретной партии или количества алюминийсодержащего минерала.
[0092] Например, способы могут включать нагревание осадка при температуре по меньшей мере 850, 900, 925, 930, 1000, 1100, 1200 или 1250°C для превращения AlCl3⋅6H2O в Al2O3.
[0093] Например, превращение AlCl3⋅6H2O в Al2O3 может включать прокаливание AlCl3.
[0094] Например, кальцинация обеспечивает превращение AlCl3⋅6H2O в бета-Al2O3.
[0095] Например, кальцинация обеспечивает превращение AlCl3⋅6H2O в альфа-Al2O3.
[0096] Например, превращение AlCl3⋅6H2O в Al2O3 может включать осуществление прокаливания в двухступенчатом реакторе с циркулирующим псевдоожиженным слоем или с использованием одностадийной процедуры в псевдоожиженном слое или с использованием любого устройства кипящего слоя, устройства для прокаливания или плазменной системы.
[0097] Например, превращение AlCl3 в Al2O3 может включать осуществление прокаливания в двухступенчатом реакторе с циркулирующем псевдоожиженным слоем, который включает систему предварительного нагрева.
[0098] Например, превращение AlCl3⋅6H2O в Al2O3 может включать осуществление прокаливания при низкой температуре, например, по меньшей мере от приблизительно 350°C, по меньшей мере 375°C приблизительно 300 до приблизительно 600°C, от приблизительно 325 до приблизительно 550°C, от приблизительно 350 до приблизительно 500°C, от приблизительно 375 до приблизительно 450°C, от приблизительно 375 до приблизительно 425°C, или от приблизительно 385 до приблизительно 400°C и/или впрыскиваемого пара.
[0099] Например, превращение AlCl3⋅6H2O в Al2O3 может включать осуществление прокаливания при низкой температуре, например, по меньшей мере 350°C и/или впрыскиваемого пара.
[00100] Например, превращение AlCl3⋅6H2O в Al2O3 может включать осуществление прокаливания при низкой температуре, например, менее 600°C и/или впрыскиваемого пара.
[00101] Например, превращение AlCl3⋅6H2O в Al2O3 может включать осуществление прокаливания с использованием угля в качестве источника горения и с использованием устройства для дегазации.
[00102] Например, водяной пар (или парогаз) может впрыскиваться при давлении от приблизительно 200 до приблизительно 700 фунтов на квадратный дюйм по манометру, от приблизительно 300 до приблизительно 700 фунтов на квадратный дюйм по манометру, приблизительно 400 до приблизительно 700 фунтов на квадратный дюйм по манометру, приблизительно 550 до приблизительно 650 фунтов на квадратный дюйм по манометру, приблизительно 575 до приблизительно 625 фунтов на квадратный дюйм по манометру, или от приблизительно 590 до приблизительно 610 фунтов на квадратный дюйм по манометру.
[00103] Например, может осуществляться впрыскивание водяного пара (или парогаза), и плазменная горелка может использоваться для создания псевдоожиженного слоя.
[00104] Например, водяной пар (или парогаз) может быть перегретым.
[00105] Например, водяной пар (или парогаз) может иметь температуру от приблизительно 300 до приблизительно 400°C.
[00106] Например, кислота из отходящих газов, образующихся в ходе прокаливания, может затем обрабатываться посредством процесса очистки газовой фазы.
[00107] Например, превращение AlCl3⋅6H2O в Al2O3 может включать осуществление прокаливания посредством монооксида углерода (СО).
[00108] Например, превращение AlCl3⋅6H2O в Al2O3 может включать осуществление прокаливания посредством топливного газа с нефтеочистных заводов (RFG).
[00109] Например, кальцинация может быть осуществлена путем впрыскивания водяного пара или парогаза и/или с использованием источника горения, выбранного из ископаемого топлива, монооксида углерода, топливного газа с нефтеочистных заводов, угля, или хлорсодержащих газов и/или растворителей.
[00110] Например, способы могут включать превращение AlCl3⋅6H2O в Al2O3 путем осуществления прокаливания AlCl3⋅6H2O, которое осуществляется путем сжигания газовой смеси, которая представляет собой поступающий газ металлургических комбинатов или отходящий газ установки восстановления.
[00111] Например, способы могут включать превращение AlCl3⋅6H2O в Al2O3 путем осуществления прокаливания AlCl3⋅6H2O, которое осуществляется путем сжигания газовой смеси, которая представляет собой поступающий газ металлургических комбинатов или отходящий газ установки восстановления.
[00112] Например, способы могут включать превращение AlCl3⋅6H2O в Al2O3 путем осуществления прокаливания AlCl3⋅6H2O, которая обеспечивается путем сжигания газовой смеси, содержащей:
СН4: от 0 до приблизительно 1% объемных;
С2Н6: от 0 до приблизительно 2% объемных;
С3Н8: 0 до приблизительно 2% объемных;
С4Н10: от 0 до приблизительно 1% объемных;
N2: от 0 до приблизительно 0.5% объемных;
Н2: от приблизительно 0.25 до приблизительно 15.1% объемных;
СО: от приблизительно 70 до приблизительно 82.5% объемных; и
СО2: от приблизительно 1.0 до приблизительно 3.5% объемных.
[00113] Например, О2 может по существу отсутствовать в смеси.
[00114] Например, кальцинация может быть осуществлена путем впрыскивания водяного пара или парогаза и/или с использованием источника горения, выбранного из природного газа или пропана.
[00115] Например, кальцинация может быть осуществлена с применением тепла, получаемого за счет электрического нагрева, газового нагрева, микроволнового нагрева и плазменного нагрева.
[00116] Полученный оксид алюминия можно промыть деминерализованной водой для того, чтобы по меньшей мере частично удалить NaCl и/или KCl.
[00117] Например, реактор с псевдоожиженным слоем включает металлический катализатор, выбранный из хлоридов металлов.
[00118] Например, реактор с псевдоожиженным слоем может включать металлический катализатор, который представляет собой FeCl3, FeCl2 или их смесь.
[00119] Например, реактор с псевдоожиженным слоем включает металлический катализатор, который представляет собой FeCl3.
[00120] Например, система предварительного нагрева может включать плазменную горелку.
[00121] Например, для нагревания псевдоожиженной среды может использоваться пар. Нагрев также может быть электрическим.
[00122] Например, для предварительного нагрева реактора, в котором осуществляется прокаливание, может использоваться плазменная горелка.
[00123] Например, плазменная горелка может и пользоваться для предварительного нагрева воздуха, подаваемого в реактор, где осуществляется прокаливание.
[00124] Например, плазменная горелка может использоваться для предварительного нагрева псевдоожиженного слоя.
[00125] Например, плазменная горелка может обеспечивать образование пара, впрыскиваемого в реактор, где осуществляется прокаливание.
[00126] Например, плазменная горелка может обеспечивать образование пара, представляет собой псевдоожиженную среду в реакторе с псевдоожиженным слоем.
[00127] Например, среда прокаливания может быть по существу нейтральной по отношению к О2 (окислению). Например, среда прокаливания может способствовать восстановлению (например, концентрация СО от приблизительно 100 ppm).
[00128] Например, среда прокаливания эффективно предотвращает образование Cl2.
[00129] Например, способы могут включать превращение AlCl3⋅6H2O в Al2O3 путем осуществления прокаливания AlCl3⋅6H2O, которая обеспечивается путем сжигания газовой смеси, содержащей:
СН4: от 0 до приблизительно 1% объемных;
С2Н6: от 0 до приблизительно 2% объемных;
С3Н8: от 0 до приблизительно 2% объемных;
С4Н10: от 0 до приблизительно 1% объемных;
N2: от 0 до приблизительно 0.5% объемных;
Н2: от приблизительно 0.25 до приблизительно 15.1% объемных;
СО: от приблизительно 70 до приблизительно 82.5% объемных; и
CO2: от приблизительно 1.0 до приблизительно 3.5% объемных.
[00130] Такая смесь может обеспечивать снижение объема газообразных отходов на величину от 15.3 до 16.3%; таким образом, оказывается, что при эксплуатации циркулирующего псевдоожиженного слоя емкость возрастает на от 15.3 до 16.3%. Соответственно, для такого же потока производственные расходы составляют 0.65*16.3%=10.6%.
[00131] Например, отношение воздуха к природному газу (Nm3/h на Nm3/h) в псевдоожиженном слое может составлять от приблизительно 9.5 до приблизительно 10.
[00132] Например, отношение воздуха к газу СО (нм3/ч к нм3/ч) в псевдоожиженном слое может составлять от приблизительно 2 до приблизительно 3.
[00133] Например, способы могут включать, перед выщелачиванием алюминийсодержащего материала, предварительное удаление фтора, который может содержаться в алюминийсодержащем материале.
[00134] Например, способы могут включать выщелачивание алюминийсодержащего материала с использованием HCl, в результате чего получают продукт выщелачивания, содержащий ионы алюминия и твердое вещество, отделение твердого вещества от продукта выщелачивания; и затем обработку твердого вещества для отделения SiO2, содержащегося в нем, от TiO2, содержащегося в нем.
[00135] Например, способы могут включать выщелачивание алюминийсодержащего материала с использованием HCl, в результате чего получают продукт выщелачивания, содержащий ионы алюминия и твердое вещество, отделение твердого вещества от продукта выщелачивания; и затем обработку твердого вещества с использованием HCl для отделения содержащегося в нем Si от содержащегося в нем Ti.
[00136] Например, способы могут включать выщелачивание алюминийсодержащего материала с использованием HCl, в результате чего получают продукт выщелачивания, содержащий ионы алюминия и твердое вещество, отделение твердого вещества от продукта выщелачивания; и затем обработку твердого вещества с использованием HCl в концентрации ниже 20% масс, при температуре ниже 85°C, в присутствии MgCl2, для отделения содержащегося в нем Si от содержащегося в нем Ti.
[00137] Например, способы могут включать выщелачивание указанной летучей золы с использованием HCl (HCl), в результате чего получают продукт выщелачивания, содержащий ионы алюминия и твердое вещество, отделение твердого вещества от продукта выщелачивания; и затем обработку твердого вещества для отделения содержащегося в нем Si от содержащегося в нем Ti.
[00138] Например, способы могут включать затем обработку летучей золы с использованием HCl, в результате чего получают продукт выщелачивания, содержащий ионы алюминия и твердое вещество, отделение твердого вещества от продукта выщелачивания; и затем обработку твердого вещества с использованием HCl для отделения содержащегося в нем SiO2 от содержащегося в нем TiO2.
[00139] Например, способы могут включать затем обработку летучей золы с использованием HCl, в результате чего получают продукт выщелачивания, содержащий ионы алюминия и твердое вещество, отделение твердого вещества от продукта выщелачивания; и затем обработку твердого вещества с использованием HCl в концентрации ниже 20% по массе, при температуре ниже 85°C, в присутствии MgCl, для отделения содержащегося в нем SiO2 от содержащегося в нем TiO2.
[00140] Например, превращение AlCl3⋅6H2O в Al2O3 может включать осуществление прокаливания в одну стадию.
[00141] Например, способы могут включать превращение AlCl3⋅6H2O в Al2O3 путем осуществления прокаливания AlCl3⋅6H2O, где кальцинация включает впрыскивание пара.
[00142] Например, кальцинация может быть осуществлена при различных температурах паром. Применяемая температура перегретого пара может составлять от приблизительно 350°C до приблизительно 550°C или приблизительно 350°C до приблизительно 940°C или приблизительно 350°C до приблизительно 1200°C.
[00143] Например, может быть осуществлен этап многостадийного испарения гидролизера, что позволяет резко снизить потребление энергии.
[00144] Например, способы могут обеспечивать выход извлечения Al2O3, равный по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, от приблизительно 90 до приблизительно 95%, от приблизительно 92 до приблизительно 95% или от приблизительно 93 до приблизительно 95%.
[00145] Например, способы могут обеспечивать выход извлечения Fe2O3, равный по меньшей мере 98%, по меньшей мере 99%, от приблизительно 98 до приблизительно 99.5% или от приблизительно 98.5 до приблизительно 99.5%.
[00146] Например, способы могут обеспечивать выход извлечения MgO, равный по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или от приблизительно 96 до приблизительно 98%.
[00147] Например, способы могут обеспечивать выход извлечения HCl, равный по меньшей мере 98%, по меньшей мере 99%, приблизительно 98 до приблизительно 99.9% или от приблизительно 98 до приблизительно 99.99%.
[00148] Например, способы могут обеспечивать получение хлоридов редкоземельных элементов (РЗЭ-Cl) и хлоридов редких металлов (PM-Cl) при выходах извлечения от приблизительно 75% до приблизительно 96.5% ха счет применения внутренних процессов с внутренним циклом концентрирования.
[00149] Например, способы могут обеспечивать выход извлечения хлороводородной кислоты от приблизительно 99.75% с негидролизуемыми элементами.
[00150] Например, алюминийсодержащий материал может представлять собой аргиллит.
[00151] Например, алюминийсодержащий материал может представлять собой боксит.
[00152] Например, алюминийсодержащий материал может представлять собой красный шлам.
[00153] Например, алюминийсодержащий материал может представлять собой летучую золу.
[00154] Например, алюминийсодержащий материал может быть выбран из жаропрочных промышленных материалов.
[00155] Например, алюминийсодержащий материал может быть выбран из алюмосиликатных материалов.
[00156] Например, способы могут позволять избежать образования красного шлама.
[00157] Например, оксид алюминия и другие продукты по существу не содержат красного шлама.
[00158] Например, HCl может быть использован повторно. Например, такая повторно используемая HCl может быть концентрирована и/или очищена.
[00159] Например, концентрирование и/или очистку газообразной HCl можно осуществить с использованием H2SO4. Например, можно обработать газообразную HCl серной кислотой - H2SO4, что обеспечивает снижение количества воды, присутствующей в газообразном HCl. Например, можно пропустить газообразную HCl через заполненную колонку, где она контактирует с обратным потоком H2SO4. Например, эта операция позволяет увеличить концентрацию HCl на по меньшей мере 50% масс., по меньшей мере 60% масс., по меньшей мере 70% масс., по меньшей мере 75% масс., по меньшей мере 80% масс., приблизительно 50% масс. до приблизительно 80% масс., приблизительно 55% масс. до приблизительно 75% масс., или приблизительно 60% масс. Например, колонка может быть заполнена полимером, таким как полипропилен (РР) или политриметилентерефталат (РТТ).
[00160] Например, концентрирование и/или очистка газообразной HCl могут осуществляться с использованием CaCl2 или LiCl. Например, газообразная HCl может быть пропущена через колонку, заполненную CaCl2 или LiCl.
[00161] Например, концентрация газообразной HCl может быть повышена со значения ниже азеотропной точки перед обработкой до значения выше азеотропной точки после обработки.
[00162] Например, различные продукты, получаемые способами согласно настоянию, такие как оксид алюминия, гематит, оксиды титана, оксиды магния, редкоземельные элементы и редкие металлы можно дополнительно очистить с при помощи плазменной горелки. Например, редкоземельные элементы и редкие металлы после удаления можно по отдельности впрыскивать в плазменную горелку, что обеспечивает их дополнительную очистку.
[00163] Например, кислота может быть выбрана из HCl, HNO3, H2SO4 и из смесей.
[00164] Например, первый металл может представлять собой алюминий или железо. Например, второй металл может представлять собой алюминий или железо.
[00165] Например, если первый металл представляет собой алюминий, ионы алюминия могут быть удалены из продукта выщелачивания путем осуществление реакции продукта выщелачивания с кислотой (такой как HCl), в результате чего получают жидкость и осадок, содержащий ионы алюминия (например, в форме AlCl3), и отделение указанного осадка от указанной жидкости. Ионы железа можно затем извлечь из жидкости из жидкости путем преципитации, гидролиза, очистки и т.д.
[00166] Например, если первый металл представляет собой железо, ионы железа могут быть удалены из продукта выщелачивания путем обработки основанием (таким как NaOH или KOH), в результате чего получают жидкость и осадок, содержащий указанные ионы железа, и отделение указанного осадка от указанной жидкости. После этого ионы алюминия могут быть извлечены из жидкости путем преципитации, гидролиза, очистки и т.д.
[00167] Например, способы могут включать осаждение указанных ионов Al3+ в форме Al(OH)3. Например, при этом осаждение указанного Al3+ в форме Al(OH)3 осуществляют при pH от приблизительно 7 до приблизительно 10, от приблизительно 9 до приблизительно 10, от приблизительно 9.2 до приблизительно 9.8, приблизительно 9.3 до приблизительно 9.7, от приблизительно 9.5, приблизительно 7.5 до приблизительно 8.5, от приблизительно 7.8 до приблизительно 8.2 или приблизительно 8.
[00168] Например, преципитация ионов железа может осуществляться при pH выше 11, pH выше 12, pH в диапазоне между 10 и 11, pH от приблизительно 11.5 до приблизительно 12.5 или от приблизительно 11.8 до приблизительно 12.0.
[00169] Например, преципитация ионов железа может осуществляться при pH от приблизительно 3.0 до приблизительно 5.5, приблизительно 3 до приблизительно 5, приблизительно 3 до приблизительно 4, приблизительно 3.0 до приблизительно 3.5, приблизительно 3.5 до приблизительно 4.0, приблизительно 4 до приблизительно 5, приблизительно 4.5 до приблизительно 5.0, приблизительно 5 до приблизительно 6 путем добавления указанного основания.
[00170] Например, если первый извлекаемый металл представляет собой железо, способ можно осуществить способом, аналогичным описанному в WO 2008/141423 или в WO 2012/065253 и с использованием, например, алюминийсодержащего материала, описанного в настоящем тексте, в качестве исходного материала. Этот документ полностью включен в настоящий текст посредством ссылки.
[00171] Например, ионы Al3+ могут быть очищены.
[00172] Например, способы могут дополнительно включать превращение оксид алюминия (Al2O3) в алюминий. Превращение оксида алюминия в алюминий может быть осуществлено, например, с использованием процесса Холла-Эру. Различные патенты и заявки на патенты, такие как US 20100065435; US 20020056650; US 5,876,584; US 6,565,733 включают ссылки на указанный хорошо известный процесс. Превращение также может быть осуществлено другими способами, такими как способы, описанные в US 7,867,373; US 4,265,716; US 6,565,733 (превращение оксида алюминия в сульфид алюминия с последующим превращением сульфида алюминия в алюминий). Например, алюминий может быть получен с использованием восстанавливающей среды и углерода при температуре ниже 200°C. Алюминий также может быть получен путем восстановления с использованием кальция и безводного хлорида алюминия (процесс Велера).
[00173] Например, превращение AlCl3 в Al2O3 может быть выполнено в атмосфере инертного газа.
[00174] Например, превращение AlCl3 в Al2O3 может быть выполнено в атмосфере азота.
[00175] В качестве примеров, способы, описанные в настоящем тексте, могут представлять собой непрерывные процессы или полунепрерывные процессы.
[00176] В соответствии с одним примером, показанным на стр. 1, способы могут включать следующие этапы (ссылочные номера на Фиг. 1 соответствуют описанным ниже этапам):
1 - Алюминийсодержащий материал измельчают до среднего размера частиц от приблизительно 50 до приблизительно 80 мкм.
2 - Измельченный и отсортированный материал обрабатывают хлороводородной кислотой, что обеспечивает растворение, при заранее определенных температуре и давлении, алюминия и других элементов, таких как железо, магний и другие металлы, включая редкоземельные элементы и/или редкие металлы. Двуокись кремния и титан (если они присутствуют в исходном материале) остаются в полностью нерастворенном состоянии.
3 - Маточную жидкость, полученную на стадии выщелачивания, затем разделяют, проводят стадию очистки для выделения очищенного оксида кремния из раствора хлорида металлов. Затем очищенную двуокись кремния могут необязательно обрабатывать на одной или двух дополнительных стадиях выщелачивания (например, при температуре от приблизительно 150 до приблизительно 160°C), в результате чего чистота двуокиси кремния возрастает до более чем 99.9%. TiO2, содержащийся в двуокись кремния, можно отделить от двуокиси кремния при помощи выщелачивающей жидкости, полученной с использованием HCl и MgCl2 в качестве выщелачивающей композиции.
4 - Затем концентрацию отработанной кислоты (продукта выщелачивания), полученной на этапе 1, увеличивают сухим и высококонцентрированным газообразным хлористым водородом путем барботирования его в кристаллизатор. Эти приводит к кристаллизации гексагидрата хлорида алюминия (осадок) с минимумом других примесей. В зависимости от концентрации хлорида железа на этом этапе, могут понадобиться дополнительные этап или этапы кристаллизации. Затем осадок отделают от жидкости.
5 - Затем гексагидрат хлорида алюминия прокаливают (например, с использованием ротационной печи, ожженного слоя и т.д.) при высокой температуре для получения формы оксида алюминия. Затем извлекают высококонцентрированный газообразный хлористый водород, и его избыток в жидкой форме доводят до максимально высокой концентрации для применения (повторного применения) на этапе выщелачивания кислотой. Кислоты также можно напрямую в газовой фазе направлять на стадию очистки (этап 12) для повышения концентрации HCl с приблизительно 30 масс. % до приблизительно 95 масс. %. Это может быть осуществлено, например, в ходе стадии сушки.
6 - Затем хлорид железа (жидкость, полученную на этапе 4) предварительно концентрируют и гидролизуют при низкой температуре для экстракции Fe2O3 (в форме гематита) и извлечения кислоты при гидролизе. Все тепло, выделяемое на стадии прокаливания (этап 5), экзотермической реакции в процессе выщелачивания (этап 1) и других этапах способа, направляют в блок предварительного концентрирования.
10 - После удаления гематита раствор, богатый редкоземельными элементами и/или редкими металлами, можно обрабатывать. Как видно на Фиг. 3, можно проводить циркуляцию по замкнутому контуру (после удаления гематита), и раствор, обогащенный редкоземельными элементами и/или редкими металлами, можно использовать на этапе кристаллизации 4. Экстракцию редкоземельных элементов и/или редких металлов можно осуществлять, как описано в заявках РСТ/СА 2012/000253 и/или РСТ/СА 2012000419. Содержание этих двух документов включено в настоящую заявку во всей полноте посредством ссылок.
Затем другие не поддающиеся гидролизу хлориды металлов (Me-Cl), такие как MgCl2 и другие, обрабатывают на следующих этапах:
7 - концентрацию раствора, обогащенного хлоридом магния и другими продуктами, не поддающимися гидролизу, повышают при низкой температуре с использованием сухого и высококонцентрированного газообразного хлороводорода путем его барботирования в кристаллизатор. Это приводит к осаждению хлорида магния в виде гексагидрата, например, после удаления хлоридов натрия и калия.
8 - Затем гексагидрат хлорида магния прокаливают (с использованием либо вращающейся печи, либо псевдоожиженного слоя и т.д.), таким образом, выделяют хлороводородную кислоту с очень высокой концентрацией, и ее повторно используют на этапе выщелачивания.
9 - Другие Me-Cl подвергают стандартной обработке на стадии пирогидролиза, которая позволяет получать смешанные оксиды (Ме-О), также выделяют хлороводородную кислоту с азеотропной концентрацией (20,2 масс. %).
[00177] NaCl может вступать в химическую реакцию с H2SO4 с образованием Na2SO4 и HCl в концентрации, равной азеотропной концентрации, или выше. Кроме того, KCl может вступать в химическую реакцию с H2SO4 с образованием K2SO4 и HCl в концентрации, которая выше азеотропной концентрации. Солевой раствор хлоридов натрия и калия затем можно подавать в адаптированные небольшие электролитические ячейки для получения хлора и щелочей. В указанном последнем случае получают традиционные основания (NaOH и KOH) и отбеливающие вещества (NaOCl и KOCl), а также HCl.
[00178] Например, жидкость можно концентрировать с получением концентрированной жидкости, концентрация хлорида железа в которой составляет по меньшей мере 30% по массе; а затем хлорид железа можно гидролизовать при температуре от приблизительно 155 до приблизительно 350°C при поддержании концентрации хлорида железа(III) на уровне по меньшей мере 65% по массе, с получение композиции, содержащей жидкость и осажденный гематит, и извлечением указанного гематита.
[00179] Например, жидкость можно концентрировать с получением концентрированной жидкости, концентрация хлорида железа в которой составляет по меньшей мере 30% по массе; а затем хлорид железа может быть гидролизован при температуре от приблизительно 155 до приблизительно 350°C при поддержании концентрации хлорида железа(III) на уровне по меньшей мере 65% по массе, с получением композиции, содержащей жидкость и осажденный гематит, и извлечением указанного гематита; извлечение гематита; и извлечение редкоземельных элементов и/или редких металлов из жидкости. Например, способы могут дополнительно включать, после извлечения редкоземельных элементов и/или редких металлов, осуществление реакции жидкости с HCl, что обеспечивает осаждение MgCl2, и его извлечение.
[00180] [00219] Тем не менее, специалист в данной области техники поймет, что непрерывные способы можно осуществлять при высоком процентном содержании оксида кремния (>55%) и примесей, а также при относительно низком процентном содержании алюминия (например, не более чем приблизительно 15%), при этом они все равно остаются экономически и технически эффективными. Могут быть получены удовлетворительные значения выхода Al2O3 (>93-95%) и более чем 75%, 85 или 90% выход редкоземельных элементов и/или редких металлов. В большинстве случаев предварительная термическая обработка не требуется. Способы, описанные в настоящем тексте, могут включать специальные методики выщелачивания и извлечения кислоты в очень высокой концентрации, и, таким образом, обеспечивают несколько преимуществ по сравнению со способами, в которых используют щелочи.
[00181] На этапе 1 обрабатываемый материал, независимо от того, подвергали его термической обработке или нет, дробят, измельчают, сушат и отбирают частицы со средним размером от приблизительно 50 до приблизительно 80 мкм.
[00182] На этапе 2 измельченный материал вводят в реактор, в котором проводят фазу выщелачивания материала.
[00183] Хлороводородная кислота, используемая для выщелачивания на этапе 2, может представлять собой кислоту, используемую повторно или регенерируемую на стадиях 5, 6, 8, 9, 10 и 11 (см. фиг. 3), ее концентрация может варьировать в пределах от 15 до 45 масс. %. Более высокие концентрации могут быть достигнуты с использованием мембранного разделения, криогенных методик и/или высокого давления. Выщелачивание кислотой может осуществляться под давлением и при температуре, близкой к точке ее кипения, что обеспечивает минимальное время обработки и увеличение степени прохождения реакции (90%-100%). Выщелачивание (этап 2) можно осуществлять в полунепрерывном режиме, при котором отработанную кислоту и оставшуюся свободную хлороводородную кислоту заменяют на высококонцентрированную кислоту на определенном этапе взаимодействия или обеспечивают пониженное отношение кислота/минерал, за счет чего сокращается время проведения реакции и улучшается кинетика реакции. Например, константа скорости к может составлять 0,5-0,75 г/моль.л.
[00184] Как отмечалось выше, щелочные металлы, железо, магний, натрий, кальций, калий, редкоземельные элементы и другие элементы также будут находиться в виде хлоридов на различных этапах. Двуокись кремния и необязательно титан могут оставаться в нерастворенном виде, и их подвергают обработке (этап 3) на этапе разделения жидкость/твердое вещество и очистки, реечных классификаторов, фильтрация с использованием ленточных фильтров, использование высокого давления, центрифугирование с использованием ротофильтров и т.д. SiO2 очищают (один дополнительный этап выщелачивания) с использованием нановоды с минимальной чистотой 99%. Маточный раствор, не содержащий двуокись кремния, который называют отработанной кислотой (содержащей различные хлориды металлов и воду), подают на стадию кристаллизации (этап 4).
[00185] Затем на этапе 4 отработанную кислоту (или продукт выщелачивания), содержащую значительное количество хлорида алюминия, насыщают с использованием сухого и высококонцентрированного газообразного хлороводорода, полученного или используемого повторно после этапе 5, или водной HCl >30 масс. %, что приводит к осаждению гексагидрата хлорида алюминия (AlCl3.6H2O). Задержанный осадок затем промывают и фильтруют или центрифугируют, после чего подают на стадию прокаливания (этап 5). Остаток отработанной кислоты, полученной на этапе 4, затем обрабатывают в системе выделения кислоты (этапы 6-8), в которой получают чистые вторичные продукты.
[00186] На этапе 5 оксид алюминия (окись алюминия) поучают напрямую в условиях высоких температур. Полученный высококонцентрированный газообразный хлористый водород можно подавать на этапы 4 и 7 для проведения кристаллизации, где его можно обрабатывать, пропуская через гидрофобные мембраны. Избыток хлористого водорода абсорбируется и используется в качестве регенерированной кислоты для выщелачивания на этапе 2 в форме высококонцентрированной кислоты, концентрацию выше азеотропной концентрации (>20,2%). Например, такая концентрация может составлять от приблизительно 18 до приблизительно 45 массовых %, от приблизительно 25 до приблизительно 45 массовых % или между 25 и 36 массовыми %. Кислоту также можно перенаправлять на стадию очистки кислоты непосредственно в газовой фазе (>30 масс. %).
[00187] После этапа 4 различные хлоридные производные (в основном железо с магнием и редкоземельные элементы и редкие металлы) используют в этапе экстракции железа. Такой этап может быть осуществлен, например, с использованием методики, раскрытой в WO 2009/153321, которая полностью включена в настоящий текст посредством ссылки. Кроме того может быть внесен гематит для роста кристалла. Например, внесение затравки гематита может включать рециркуляцию затравки.
[00188] На этапе 6 проводят гидролиз при низкой температуре (155-350°C), получают чистый Fe2O3 (гематит) и регенерируют хлороводородную кислоту с концентрацией по меньшей мере 15%. Согласно описанию способа, приведенному в WO 2009/153321, осуществляется обработка раствора хлорид железа/II/ и хлорида железа/III/, возможно в смеси друг с другом, и свободной хлороводородной кислоты через ряд этапов предварительного концентрирования, этап окисления, на котором хлорид железа/II/ окисляется в треххлористую форму и, наконец, этап гидролиза в функционально блоке, называемом гидролизером, в котором концентрация хлорида железа/III/ поддерживается на уровне 65 массовых % с получением обогащенного газом потока, концентрация которого обеспечивает концентрацию хлорида водорода 15-20.2%, и чистого гематита, который будет обработан на этапе физического отделения. Скрытая теплота конденсации возвращается в процесс предварительной конденсации и используется в качестве подводимой теплоты с избытком теплоты со стадии прокаливания (этап 5).
[00189] Маточный раствор из гидролизера (этап 6) можно частично повторно использовать на первом этапе кристаллизации, где наблюдается повышение концентрации не поддающихся гидролизу элементов. После удаления железа жидкость обогащена другими не поддающимися гидролизу элементами и содержит, главным образом, хлорид магния или разнообразные смеси других элементов (различные хлориды) и редкоземельных элементов и редких металлов, которые, например, тоже находятся в виде хлоридов.
[00190] Редкоземельные элементы и редкие металлы в виде хлоридов концентрируют до достижения высокого процентного содержания в функциональном блоке гидролизера (этап 6) и экстрагируют из маточного раствора (этап 10), где для экстракции различных отдельных РЗЭ-O (оксидов редкоземельных элементов) можно применять различные известные методики. Помимо прочего, способы согласно настоящему изобретению позволяют концентрировать в гидролизере следующие элементы до высоких концентраций: скандий (Sc), галлий (Ga), иттрий (Y), диспрозий (Dy), церий (Се), празеодим (Pr), неодим (Nd), европий (Eu), лантан (La), самарий (Sm), гадолиний (Gd), эрбий (Er), цирконий (Zr) и их смеси. Методики, используемые для экстракции редкоземельных элементов и/или редких металлов, можно найти, например, в Zhou et al., RARE METALS, Vol. 27, No. 3, 2008, p 223-227, и в заявке на патент США №2004/0042945, содержание которых полностью включено в настоящее описание посредством ссылок. Специалист в данной области техники также поймет, что можно также применять различные другие способы, обычно используемые для экстракции редкоземельных элементов и/или редких металлов, получаемых в процессе Байера. Например, можно использовать различные способы экстракции растворителем. Для определенных элементов можно использовать способ с применением фосфата октилфениловой кислоты (ОРАР) и толуола. В качестве вымывающего агента можно использовать HCl. Этот способ может быть эффективным для выделения Ce2O3, Sc2O3, Er2O3 и т.д. Например, для выделения хлорида железа(III) можно применять различные последовательности операций с использованием щавелевой кислоты и металлического железа.
[00191] Отработанный раствор кислоты с этапов 6 и 10, обогащенный ценными металлами, главным образом, магнием, обрабатывают на этапе 7. Раствор насыщают сухим и высококонцентрированным газообразным хлороводородом, полученным на этапе 5, что приводит к осаждению гексагидрата хлорида магния. Например, это можно осуществить с использованием водной HCl с концентрацией более 30 масс. %. Полученный осадок подают на стадию прокаливания 8, где получают чистый MgO (>98 масс. %) и регенерируют высококонцентрированную хлороводородную кислоту (например, с концентрацией по меньшей мере 38%), которую подают на стадию выщелачивания (этап 2). Альтернативный способ осуществления этапе 7 включает применение сухой газообразной хлороводородной кислоты, полученной на этапе 8.
[00192] На этапе 9 непрореагировавшие хлориды металлов переходят в этап пирогидролиза (700-900°C) с получением смешанных оксидов, где возможно извлечение хлороводородной кислоты с концентрацией 15-20.2% масс. %.
[00193] Согласно другому примеру, такому как показано на фиг. 3, способы могут быть схожими с примерами, приведенными на фиг. 1, но могут включать некоторые варианты, обсуждаемые ниже.
[00194] Фактически, как показано на фиг. 3, способы могут включать (после проведения этапа 6 или непосредственно перед стадией 10) внутреннюю рециркуляцию потоков на стадию кристаллизации 4. В этом случае маточный раствор из гидролизера (этап 6) можно полностью или частично повторно направлять для кристаллизации на этапе 4, где происходит увеличение концентрации не поддающихся гидролизу элементов, включая редкоземельные элементы и/или редкие металлы.
[00195] Такой этап может быть полезен для значительного увеличения концентрации редкоземельных элементов и/или редких металлов, что облегчает их экстракцию на этапе 10.
[00196] Что касается этапа 7, раствор, обогащенный хлоридом магния и другими не поддающимися гидролизу продуктами, как обсуждалось ранее, концентрируют при низкой температуре с использованием сухого и высококонцентрированного газообразного хлороводорода путем его барботирования в кристаллизатор. Это может приводить к осаждению хлорида магния в виде гексагидрата (например, после удаления хлоридов натрия и калия). Эту операцию также можно проводить с использованием водной HCl.
[00197] Как показано на фиг. 3, может быть добавлен дополнительный этап 11. Хлорид натрия может вступать в химическую реакцию с серной кислотой с получением сульфата натрия и регенерации хлороводородной кислоты в концентрации, равной концентрации в азеотропе или более. Как показано на фиг. 3, может быть добавлен дополнительный этап 11. Хлорид натрия может вступать в химическую реакцию с серной кислотой с получением сульфата натрия и регенерации хлороводородной кислоты в концентрации, равной концентрации в азеотропе или более. Хлорид калия может вступать в реакцию с серной кислотой с получением сульфата калия и регенерации хлороводородной кислоты в концентрации, равной азеотропной концентрации, или выше. Солевой раствор хлоридов натрия и калия затем может использовать для подачи в адаптированные небольшие электролитические ячейки для получения хлора и щелочей. В указанном последнем случае получают обычные основания (NaOH и KOH) и отбеливающие вещества (NaOCl и KOCl), которые в известной мере можно повторно использовать в других операциях способов согласно настоящему изобретению (в устройствах очистки газов и т.д.).
[00198] Далее приведены неограничивающие примеры.
Пример 1
Получение оксида алюминия и различных других продуктов
[00199] В качестве исходного материала брали образец глины из района Grande Vallée в Квебеке, Канада.
[00200] Эти результаты представляют среднее по 80 испытаниям, проведенных на образцах массой приблизительно 900 кг каждый.
[00201] Сырая свежедобытая глина после измельчения и классификации имела следующий состав:
Al2O3: 15%-26%;
SiO2: 45%-50%;
Fe2O3: 8%-9%;
MgO: 1%-2%;
Редкоземельные элементы и/или редкие металлы: 0.04%-0.07%;
ППП: 5%-10%.
[00202] Затем этот материал выщелачивают, используя двухстадийную процедуру, при 140-170°C с 18-32 массовыми % HCl. Раствор HCl использовали в стехиометрическом избытке 10-20% относительно стехиометрического количества, необходимого для удаления составляющих глины, выщелачиваемых кислотой. На первой стадии выщелачивания полунепрерывного процесса (этап 2) глину в течение 2.5 часов выдерживали в контакте с необходимым количеством или определенной долей от общего количества хлороводородной кислоты. После удаления использованной кислоты глину снова обрабатывали раствором хлороводородной кислоты, содержащим минимум 18 массовых % хлороводородной кислоты, в течение приблизительно 1.5 часа при тех же температуре и давлении.
[00203] Типичная кривая экстракции, полученная для железа и алюминия в результате одностадийного выщелачивания показана на фиг. 2.
[00204] Продукт выщелачивания фильтровали, а твердое вещество промывали водой и исследовали с использованием обычных методик анализа (см. стадию 3 на фиг. 1). Чистота полученного оксида кремния составляла 95,4%, он не содержал никаких хлоридов и HCl.
[00205] В другом примере чистота оксида кремния после дополнительного этапе выщелачивания составляла 99,67%.
[00206] После выщелачивания и удаления оксида кремния получали следующие концентрации различных хлоридов металлов:
AlCl3: 15-20%;
FeCl2: 4-6%;
FeCl3: 0.5-2.0%;
MgCl2: 0.5-2.0%;
РЗЭ-Cl: 0.1-2%
Свободна HCl: 5-50 г/л
[00207] Отработанную кислоту затем кристаллизовали с использованием сухой газообразной хлороводородной кислоты с чистотой от приблизительно 90 до приблизительно 98% в две стадии, при этом содержание железа в получаемом гексагидрате хлорида алюминия составляло менее 25 ppm. Концентрация HCl в растворе (водная фаза) составляла от приблизительно 22 до приблизительно 32% или от 25 до приблизительно 32%, что позволяло извлечь 95,3% Al2O3. Извлеченный кристаллизованный материал (гидратированную форму Al2O3 с минимальной чистотой 99,8%) затем прокаливали при 930°C или 1250°C с получением таким образом α-формы оксида алюминия. Нагревание при 930°C обеспечивает получение бета-формы оксида алюминия, тогда как нагревание при 1250°C обеспечивает получение альфа-формы.
[00208] В другом примере использовали низкую температуру (разложение и прокаливание приблизительно при 350°C), содержание α-формы оксида алюминия составляло меньше 2%.
[00209] Концентрация HCl в газовой фазе на выходе стадии прокаливания составляла более 30%, и ее использовали (повторно) для кристаллизации AlCl3 и MgCl2. Избыток хлороводородной кислоты абсорбировали в концентрации, необходимой и желаемой для осуществления этапе выщелачивания.
[00210] Хлорид железа (приблизительно 90-95% в виде железа(III)) затем использовали в гидротермическом способе для его экстракции в виде чистого гематита (Fe2O3). Это можно осуществлять при помощи технологии низкотемпературного гидролиза, описанной в международной заявке WO 2009/153321, где полностью использовали теплоту, выделенную на этапах прокаливания, пирогидролиза и выщелачивания.
[00211] Редкоземельные элементы и редкие металлы экстрагируют из маточного раствора в гидролизере, откуда удалены оксид кремния, алюминий, железо и основная часть воды, и после предварительного концентрирования в гидролизере для кристаллизации. Путем измерения было установлено, что редкоземельные элементы можно концентрировать приблизительно в 4,0-10,0 раза непосредственно в гидролизере, пропуская смесь через гидролизер один раз, т.е. без использования концентрирующей петли. В гидролизере наблюдали следующие значения уровня концентрирования (за один цикл):
Се>6
La>9
Nd>7
Y>9
[00212] Оставшийся хлорид магния продували сухой и высококонцентрированной хлороводородной кислотой, а затем прокаливали с получением MgO, выделяя высококонцентрированную кислоту (например, до 38,4%).
[00213] Затем смешанные оксиды (Ме-О), содержащие другие не поддающиеся гидролизу компоненты, подвергали пирогидролизу при 700-800°C и извлеченную кислоту (15-20,2 масс. %) повторно направляли, например, в систему выщелачивания.
Достигнутые итоговые значения выхода:
Al2O3: извлечение 93.0-95.03%;
Fe2O3: извлечение 92.65-99.5%;
Редкоземельные элементы: минимальное извлечение 95% (смесь);
MgO: извлечение 92.64-98.00%;
Выброшенный материал: максимум 0-5%;
Общее извлечение HCl: минимум 99.75%;
Концентрация HCl, подаваемой для выщелачивания 15-32% (водная); 95% (газ)
Получение красного шлама: нет.
Пример 2
Получение оксида алюминия и различных других продуктов
[00214] Аналогичное сырье (боксит вместо глины) обрабатывали согласно примеру 1 до этапа выщелачивания включительно, и обнаружили, что оно легко поддается выщелачиванию в условиях, приведенных в примере 1. Выщелачивание обеспечивало 100% экстракцию железа и более чем 90-95% экстракцию алюминия. Эту технологию признали экономически обоснованной, вредные побочные продукты (красный шлам) не образовывались. Исследуемые образцы имели различные концентрации Al2O3 (до 51%), Fe2O3 (до 27%) и MgO (до 1,5%). Наблюдали 97,0% экстракцию галлия. Экстракция скандия составляла 95%.
Пример 3
Обогащение и очистка газообразной HCl: с использованием H2SO4
[00215] Для проведения очистки HCl можно использовать H2SO4. Очистку можно проводить с использованием заполненной колонны и встречного потока H2SO4 (см. фиг. 4). Это позволяет превращать выделенную HCl в HCl с концентрацией выше его азеотропной концентрации (20,1 масс. %), и повысить его концентрацию как минимум на от приблизительно 60 до приблизительно 70%.
[00216] Вода абсорбируется H2SO4, а затем применяют регенерацию H2SO4, в процессе которой концентрацию H2SO4 снова доводят до от приблизительно 95 до приблизительно 98 масс. %. Воду, высвобождаемую на этой этапе, свободную от серы, используют повторно и применяют для кристаллизации, растворения и т.д. Материал, заполняющий колонну, может содержать полипропилен или политриметилентерефталат (ПТТ).
[00217] Энергию сгорания можно использовать для предварительного нагревания воздуха и обогащения кислородом отходящих газов. Обогащение кислородом на +2% соответствует увеличению температуры пламени как максимум на 400°C.
Пример 4
Обогащение и очистка HCl: превращение хлорида кальция в гексагидрат хлорида кальция (процесс абсорбции/десорбции)
[00218] Как показано на фиг. 5, для сушки HCl можно использовать CaCl2. Действительно, для поглощения воды, содержащейся в HCl, можно использовать CaCl2. В этом случае CaCl2 превращается в гексахлоридную форму (CaCl2⋅H2O), и насыщенная система в итоге переходит в режим регенерации, при котором горячий воздух, выделяемый из отходящих газов прокаливания, полученных при обжиге распылением оксида алюминия и оксида магния, вводят для регенерации псевдоожиженного слоя. В альтернативном варианте вместо CaCl2 можно применять другой абсорбирующий агент, такой как LiCl. Указанный тип ионообменного процесса можно увидеть на фиг. 4, цикл можно обращать для переключения с одной колонны на другую.
[00219] Специалисту в данной области будет понятно, что способы, описанные в примерах 3 и 4, можно применять различным образом. Например, указанные способы можно объединять с различными способами, приведенными в настоящем описании. Например, указанные способы очистки можно включать в способы, показанные на фиг. 1, 3 или 6. Например, указанные способы можно использовать после проведения по меньшей мере одной из стадий, выбранных из стадий 5, 6, 8, 9, 10 и 11 (см. фиг. 1 и 3). Также их можно использовать после проведения этапа 4 и/или этапа 7. Также их можно использовать после проведения по меньшей мере одной из стадий, выбранных из стадий 104-111 (см. фиг. 6).
Пример 5
Получение оксида алюминия и различных других продуктов
[00220] Этот пример реализовали с использованием способа, представленного на Фигурах 6 и 7. Следует отметить, что способы, приведенные на фиг. 6 и 7 отличаются только тем, что на фиг. 7 показаны дополнительные этапы, т.е. этапы 112 и 113.
Подготовка сырья
[00221] Сырье, например, глину, обрабатывали в дробилке вторичного дробления в блоке получения глины 101. Проводили измельчение и классификацию частиц сухого вещества в вертикальных валковых мельницах (например, Fuller-Loesche LM 30.41). Блок получения глины 101 включал три валковые мельницы: для работы использовали две мельницы с пропускной способностью приблизительно 160-180 тонн в час и одну использовали в качестве запасной. Сырье при необходимости можно измельчать таким образом, чтобы 85% частиц имели размер менее 63 микрон. Если руда содержит элементарный фтор, то перед проведением этапа 102 можно осуществлять специальную обработку. В присутствии хлороводородной кислоты фтор может превращаться во фтороводородную кислоту. Эта кислота вызывает сильную коррозию и очень опасна для здоровья человека. Таким образом, перед проведением выщелачивания 102 можно, но не обязательно, проводить обработку для отделения фтора 112. Этап 112 может включать обработку обработанного материала, полученного на этапе 101, кислотой в качестве операции предварительного выщелачивания для удаления фтороводородной кислоты. Таким образом, в зависимости от состава сырья можно проводить стадию отделения фтора 112 (или стадию предварительного выщелачивания 112).


Выщелачивание кислотой
[00222] Затем проводили выщелачивание кислотой в полунепрерывном режиме 102 в эмалированном реакторе объемом 80 м3. Полунепрерывный режим включает замену 1/3 прореагировавшей кислоты в процессе взаимодействия на регенерированную кислоту с более высокой концентрацией, что значительно улучшает кинетику реакции. Конфигурация реактора включает, например, три последовательно установленных реактора. В других примерах проводили первое выщелачивание при 1 атм, а затем с использованием водной или газообразной HCl проводили второе и третье выщелачивание в полунепрерывном или непрерывном режиме.
[00223] Выщелачивание осуществляли при высоких температуре и давлении (от приблизительно 160 до приблизительно 195°C под давлением от приблизительно 5 до приблизительно 8 бар изб.) в течение заданного периода времени. Время реакции зависело от желаемой степени прохождения реакции (98% для Al2O3), режима выщелачивания, концентрации кислоты и применяемых температуры/давления.
[00224] Затем отработанную кислоту, извлеченную после кислотного выщелачивания 102, отфильтровывали 103 от непрореагировавшего оксида кремния и диоксида титана и промывали, пропуская через автоматический фильтр-пресс, в котором извлекали всю свободную HCl и хлориды. Это приводило к попаданию в раствор отработанной кислоты как максимум приблизительно 30 ppm SiO2. Затем получали очищенную двуокись кремния в концентрации ≈96%+ SiO2. На этой этапе возможны несколько вариантов. Например, 96% двуокись кремния можно подвергать конечной нейтрализации в каустической ванне, очистке, а затем брикетированию перед хранением. Согласно другому примеру двуокись кремния очищали на дополнительном этапе выщелачивания и последующем этапе отделения твердого вещества для обеспечения удаления TiO2 (см. стадию 113 на фиг. 7). В этом конкретном случае получают двуокись кремния высокой степени чистоты 99,5%+. На этапе 113 титан и кремний можно отделять друг от друга при помощи различных способов. Например, твердое вещество, полученное на этапе 103, можно выщелачивать в присутствии MgCl2 при температуре ниже 90 или 80°C с использованием кислоты в низкой концентрации. Например, концентрация кислоты может быть ниже 25 или 20%. Кислота может представлять собой HCl или H2SO4. В этом случае титан остается растворимым после такого выщелачивания, тогда как титан остается в твердой форме. Таким образом, указанные твердое вещество и жидкость, полученные на этапе 113, разделяют и в конечном счете получают TiO2 и SiO2. Подвод воды и расход оксида кремния при очистке находятся в отношении 1:1 (двуокись кремния/вода) (150 т/ч SiO2 /150 т/ч H2O), но способ включает циркуляцию промывочной воды по замкнутой петле, что ограничивает количество технической воды для конечной очистки оксида кремния и извлечения всех хлоридов и свободной HCl, получаемых на этапе выщелачивания. Ниже в таблице 2 приведены результаты, полученные на этапе 102.

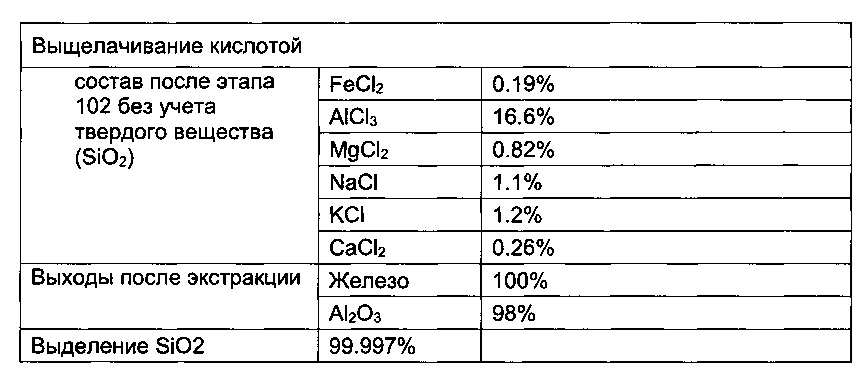
Кристаллизация AlCl3
[00225] Затем отработанную кислоту с содержанием хлорида алюминия от приблизительно 20 до приблизительно 30% обрабатывали на этапе кристаллизации 104. Сухую и высококонцентрированную HCl (>90 масс. %) в газовой фазе барботировали в двухступенчатом реакторе кристаллизации, что обеспечивало кристаллизацию гексагидрата хлорида алюминия.
[00226] Скорость потока кислоты через эти реакторы составляла от приблизительно 600 до приблизительно 675 м3/ч, температуру в реакторе поддерживали в диапазоне от приблизительно 50 до приблизительно 60°C при прохождении сильно экзотермической реакции. Теплоту отводили и направляли в блок очистки кислоты 107 блока, что, таким образом, обеспечивало подходящий теплообмен и минимизировало потребление теплоты в блоке. При увеличении концентрации свободной HCl в реакторе кристаллизации растворимость хлорида алюминия снижается намного быстрее по сравнению с другими элементами. Концентрация AlCl3при осаждении/кристаллизации составляла приблизительно 30%.
[00227] Таким образом, концентрация HCl в ходе кристаллизации составляла от приблизительно 30 до приблизительно 32 масс. %.
[00228] Затем водный раствор, полученный на этапе кристаллизации 104, подавали в блок гидротермического извлечения кислоты 105, а кристаллы обрабатывали на этапе разложения/прокаливания в блоке прокаливания 106.
[00229] Можно проводить одностадийный этап кристаллизации или многостадийный этап кристаллизации. Например, можно проводить двухстадийный этап кристаллизации.
[00230] Ниже в таблицах 3А и 3В приведены результаты, полученные на этапе 104.
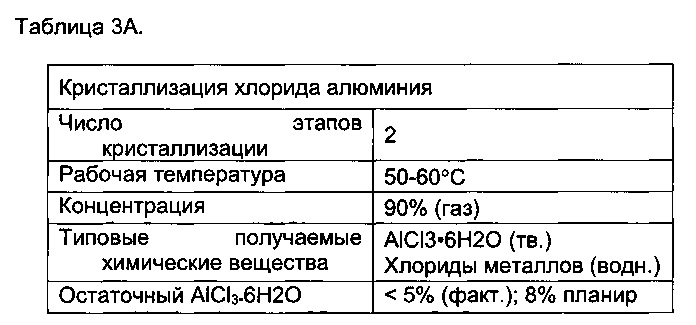

Прокаливание и гидротермическое выделение кислоты
[00231] Прокаливание 106 включает применение двухступенчатых систем с циркулирующим псевдоожиженным слоем (ЦПС) и предварительным нагреванием. Система предварительного нагревания может включать плазменную горелку для нагревания пара, поступающего в процесс. Основную часть хлороводородной кислоты извлекали на первом этапе, который проводили при температуре приблизительно 350°C, тогда как на втором этапе проводят непосредственно прокаливание. Затем кислоту, полученную на двух указанных этапах (от приблизительно 66 до приблизительно 68% кислоты, извлекаемой при осуществлении способов), извлекали и направляли в блок кислотного выщелачивания 102 или очистки кислоты 107. Во втором реакторе, который эксплуатировали при температуре приблизительно 930°C, кислоту извлекали путем конденсации и абсорбции в двух колоннах с использованием, в основном, промывочной воды из сектора кислотного выщелачивания 102. Скрытую теплоту из этого этапа извлекали одновременно с большими количествами воды, что ограничивает общий подвод воды.
[00232] В системе получения оксидов железа и извлечения кислоты 105, которая содержит водный раствор, полученный после кристаллизации 104, сначала проводят стадию предварительного концентрирования, а затем обработку в гидролизере. В указанной системе получали гематит после обработки при низкой температуре (приблизительно 165°C). Затем использовали рециркуляционную петлю, выходящую из гидролизера и поступающую в установку предварительного концентрирования, что обеспечивало концентрирование РЗЭ, Mg, K и других элементов. Указанная рециркуляционная петля обеспечивает концентрирование хлоридов редкоземельных элементов и/или хлоридов редких металлов и хлоридов различных металлов в отсутствие, до определенной степени, соосаждения указанных продуктов с гематитом.
[00233] В зависимости от кислотного баланса в установке извлеченную кислоту направляли непосредственно на стадию 102 или 107. В таблице 4 показаны результаты, полученные на этапе 105.
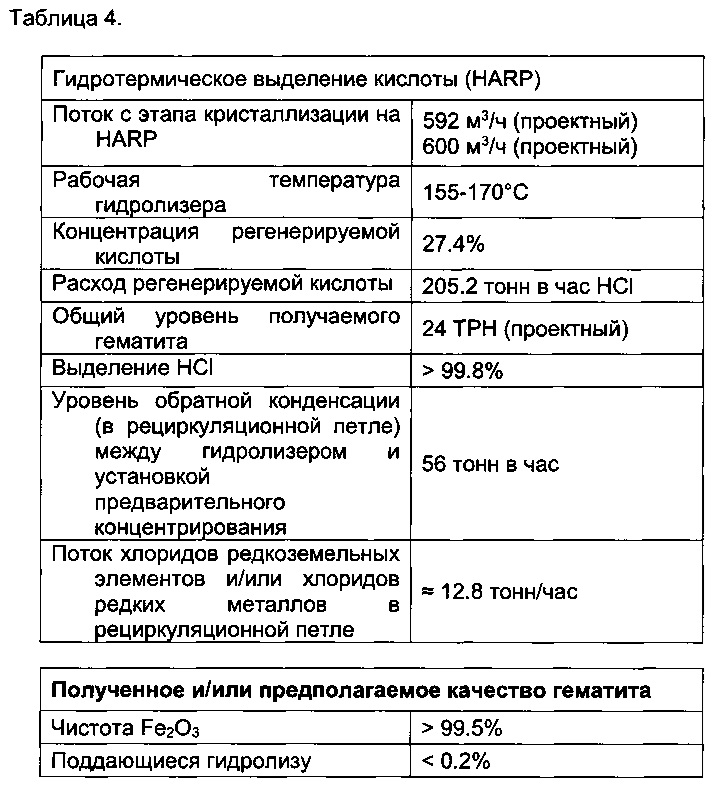

[00234] В таблице 5 показаны результаты, полученные на этапе 106.
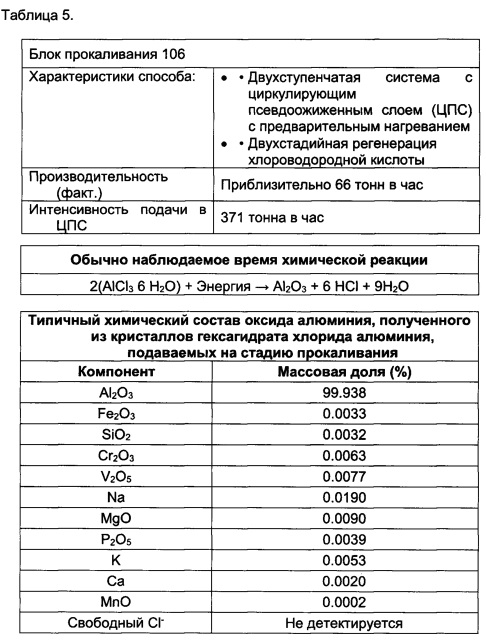
Экстракция редкоземельных элементов и редких металлов
[00235] Поток, выделяемый из рециркуляционной петли 105, затем обрабатывали для экстракции редкоземельных элементов и редких металлов на этапе 108, на котором проводили восстановление оставшегося железа до железа II (Fe2+), после чего следовала серия стадий экстракции растворителем. В качестве реагентов применяли щавелевую кислоту, NaOH, органический раствор DEHPA (ди(2-этилгексил)фосфорную кислоту) и ТВР (три-н-бутилфосфата), керосин и HCl использовали для превращения хлоридов редкоземельных элементов и хлоридов редких металлов в гидроксиды. Перед проведением специального прокаливания редкоземельных элементов и редких металлов в виде гидроксидов и превращения их в отдельные оксиды высокой степени чистоты для извлечения указанных веществ из раствора с использованием HCl пропускали встречный поток органического растворителя. При помощи техники ионообмена также можно добиваться тех же результатов, что и использованием мембраны из политриметилентерефталата (ПТТ).
[00236] Порошок железа с этапа 105, или металлический скрап, такой как FeO, можно использовать с расходом, зависящим от концентрации Fe3+ в маточном растворе. Для разделения РЗЭ путем экстракции растворителем (SX) и повторного выщелачивания оксалатов редкоземельных элементов и/или редких металлов в качестве обедненного раствора может требоваться HCl (100 масс. %) со скоростью 1 тонна в час.
[00237] Воду очень высокой степени чистоты, деминерализованную или нановоду добавляли в раствор для экстракции и для промывки осадков при скорости 100 тонн в час.
[00238] Добавляли щавелевую кислоту в виде дигидрата со скоростью 0,2 тонны в час, что способствовало осаждению оксалатов редкоземельных элементов и редких металлов. В качестве нейтрализующего агента можно применять NaOH или Mg(OH) при скорости 0,5 тонны в час.
[00239] Органический раствор DEHPA SX при скорости 500 г/ч применяли в качестве активного реагента для извлечения редкоземельных элементов, в то же время органический раствор ТВР SX с расходом 5 кг/ч использовали в качестве активного реагента для извлечения галлия и извлечения иттрия. Наконец, использовали керосиновый разбавитель при скорости приблизительно 2 кг/ч на протяжении всего этапа SX. Для превращения содержимого в РЗЭ2О3 (в виде оксидов) и сохранения чистоты продукта прокаливание проводили во вращающейся электропечи путем непрямого нагревания.
[00240] Результаты различных исследований, касающихся этапа 108, показаны в таблице 6.
Для извлечения следующих элементов путем экстракции растворителем использовали одну линию, разделенную на подсекции (5):





Таблица 6.

Общий выход: 84.53%
[00241] В альтернативном варианте этап 108 можно проводить как описано в РСТ/СА 2012/000253 и/или РСТ/СА 2012000419.
[00242] Раствор, полученный на этапах 108 и 109, содержал, в основном, MgCl2, NaCl, KCl, CaCl2, FeCl2/FeCl3 и AlCl3 (следы), и его подвергали обработке на этапе 111. После MgO можно экстрагировать Na, K, Са на этапе 110 путем кристаллизации в определенном порядке: сначала Na, затем K и, наконец, Са. Этот способ можно применять, например, в перерабатывающих заводах на Мертвом море для получения MgO и удаления щелочных металлов из сырья.
Регенерация HCl
[00243] После кристаллизации щелочные металлы (Na, K) направляли и обрабатывали в блоке щелочной регенерации хлороводородной кислоты 110 для выделения высококонцентрированной хлороводородной кислоты (HCl). При помощи способа, выбранного для конверсии, можно получать продукты с добавленной стоимостью.
[00244] Для превращения NaCl и KCl с целью извлечения HCl доступны различные варианты. Одним из примеров может быть приведение их в контакт с высококонцентрированной серной кислотой (H2SO4), что приводит к получению сульфата натрия (Na2SO4) и сульфата калия (K2SO4), соответственно, и HCl в концентрации более 90 масс. %. Другим примером является применение солевого раствора хлоридов натрия и калия в качестве сырья для адаптированных небольших электролитических ячеек. В указанном последнем случае получают обычные основания (NaOH и KOH) и отбеливающие вещества (NaOCl и KOCl). Электролиз солевого раствора NaCl и KCl проводят в различных ячейках, в которых электрический ток регулируют в соответствии с требованиями проведения конкретной химической реакции. В обоих случаях применяют двухстадийный способ, в котором солевой раствор подвергают воздействию тока высокого напряжения с получением основания (NaOH или KOH), хлора (Cl2) и водорода (Н2). Затем Н2 и Cl2 направляют в единое пламя, где образуется высококонцентрированная кислота в газовой фазе (100 масс. %), которую можно использовать непосредственно на этапе кристаллизации 104 или на этапах кристаллизации, для которых требуется применение сухой высококонцентрированной кислоты.
Оксид магния
[00245] Восстановленный поток, по существу не содержащий большую часть элементов (например, AlCl3, FeCl3, РЗЭ-Cl, NaCl, KCl) и обогащенный MgCl2, подавали затем в блок получения оксидов магния 111. В блоке MgO проводили пирогидролиз MgCl2, а любые другие оставшиеся примеси превращали в оксиды с одновременной регенерацией кислоты. Первый этап представляет собой этап предварительного выпаривания/кристаллизации, на котором кальций удаляли и превращали в гипс (CaSO4⋅2H2O) путем простого химического взаимодействия с серной кислотой, для чего требуется отделение MgO. Это повышает производительность прокаливания MgO, а также незначительно потребление энергии, и при этом происходит существенное извлечение HCl. Следующий этап представлял собой специфический пирогидролиз концентрированного раствора MgO путем прокаливания распылением. Получали два (2) основных продукта: MgO, которые подвергали дополнительной обработке, и HCl (приблизительно 18 масс. %), которую или использовали повторно на предшествующем этапе выщелачивания 102 или в блоке очистки хлороводородной кислоты 107. Продукт, содержащий MgO, полученный в печи для прокаливания распылением, может требовать дополнительной промывки, очистки и, наконец, прокаливания в зависимости от требуемого качества. Очистка и обжиг могут включать стадию промывки-гидратации и стандартную стадию прокаливания.
[00246] MgO, полученный в печи для прокаливания распылением, обладает высокой химической активностью, и его помещали непосредственно в резервуар с водой, где он вступал во взаимодействие с водой с образованием гидроксида магния, который плохо растворим в воде. Следовые количества оставшихся хлоридов, таких как MgCl2, NaCl, растворялись в воде. Суспензию Mg(OH)2 после отстаивания в загустителе направляли на вакуумные барабанные фильтры, на которых удаляли оставшуюся воду. Затем очищенный Mg(OH)2 направляли в реактор прокаливания, где его подвергали воздействию высоких температур в вертикальной многозонной печи. Вода, захваченная в процессе гидратации, высвобождалась, что обеспечивало превращение Mg(OH)2 в MgO и воду. На этой этапе оксид магния обладал высокой степенью чистоты (>99%).
Очистка HCl
[00247] Этап очистки хлороводородной кислоты 107 обеспечивает очистку HCl, регенерируемой на различных этапах (например, 105, 106, 111) и повышение ее чистоты для проведения кристаллизации, поскольку в качестве барботируемого агента можно применять сухую высококонцентрированную кислоту (>90 масс. %). Этап 107 позволял контролировать концентрацию кислоты, поступающей обратно на стадию 102 (от приблизительно 22 до приблизительно 32 масс. %) и обеспечивал общий баланс кислоты и воды. Общий баланс воды в установке определялся, в основном, повторным использованием воды для промывки в качестве абсорбирующей среды, в качестве гасящего агента или среды-растворителя на этапах кристаллизации.
[00248] Например, очистка может быть осуществлена посредством мембранной дистилляции. В процессе мембранной дистилляции, применяемом в настоящем изобретении, две водные жидкости, имеющие различную температуру, разделяются гидрофобной мембраной. Движущей силой процесса была разница в парциальном давлении паров, вызванная градиентом температуры между указанными растворами. Пары перемещаются с теплой стороны на холодную. Без намерения ограничения этой теорией, считается, что механизм разделения был основан на равновесии пар/жидкость в жидкой смеси HCl/вода. Указанная методика нашла практическое применение для систем HCl/вода, H2SO4/вода, а также для крупных коммерческих партий водного раствора хлорида натрия с целью получения питьевой воды из морской воды и получения нановоды. Таким образом, мембранная дистилляция представляет собой способ разделения, основанный на испарении через пористую гидрофобную мембрану. Способ осуществляли приблизительно при 60°C, он был эффективным для извлечения теплоты, полученной на этапах 104 и 102, с использованием замкнутой петли рециркуляции воды для поддержания постоянной температуры веществ, подаваемых к мембранам. Например, для получения HCl с концентрацией выше азеотропной (т.е. >36%), с производительностью 750 м3/ч в качестве мембраны можно использовать восемь мембран с эквивалентной площадью 300000 м2, затем конечную 90% концентрацию можно получать путем перегонки под давлением (на ректификационной колонне).
[00249] Очистка HCl путем обработки регенерированной таким образом кислоты на гидрофобной мембране и извлечения воды из HCl приводила к увеличению концентрации HCl до приблизительно 36% (выше азеотропной концентрации), и, соответственно позволяла проводить одну стадию ректификации на колонне для отгонки под давлением с получением кислоты с >90% концентрацией в газовой фазе для использования на этапе кристаллизации (в качестве барботируемого агента); и, соответственно, контролировать концентрацию кислоты на этапах кристаллизации на уровне до 30-35% (водн.).
[00250] Как указано, этап 107 проводили приблизительно при 60°C и подвод тепла обеспечивали при помощи теплоты, выделяемой на этапах 102-110. Ректификационную колонну эксплуатировали при температуре нагревателя у основания колонны, составляющей приблизительно 140°C.Чистая потребность в энергии была нейтральной (фактически даже отрицательной, -3,5 ГДж/т Al2O3), поскольку обе системы находились в равновесии и были сбалансированы.
[00251] Например, очистку кислоты можно проводить с использованием методики адсорбции на подложке активированного оксида алюминия. В непрерывном режиме требуется использование по меньшей мере двух адсорбционных колонн для обеспечения адсорбции в одной из них и регенерации в другой. Регенерацию можно проводить путем подачи встречного потока горячего или разреженного газа. Эта технология обеспечивает очистку с получением 100 масс. % газа.
[00252] Например, очистку кислоты можно проводить с использованием хлорида кальция в качестве поглотителя воды. Слабый раствор хлороводородной кислоты приводят в контакт с концентрированным раствором хлорида кальция, пропуская через колонну. Затем воду удаляют из раствора хлороводородной кислоты, в результате образуется 99,9% газообразная HCl. Для конденсации следов воды в HCl используют охлаждающую воду и криогенный охладитель. Слабый раствор CaCl2концентрируют в испарителе, что обеспечивает регенерацию хлорида кальция. В зависимости от примесей, поступающих вместе с раствором HCl, подаваемым в колонну, некоторые металлы могут загрязнять концентрированный раствор хлорида кальция. Осаждение Са(ОН)2 и фильтрование позволяет удалять указанные примеси. Колонну можно эксплуатировать, например, при 0,5 бар изб. Эта технология обеспечивает регенерацию 98% HCl.
[00253] В таблице 7 показаны результаты, полученные для способа, показанного на фиг. 6.
Таблица 7.

[00254] В Таблицах с 8 по 26 показаны результаты, полученные для продуктов, изготовленных в соответствии со способом, показанном на Фиг. 6, в сравнении со стандартом данной области промышленности.




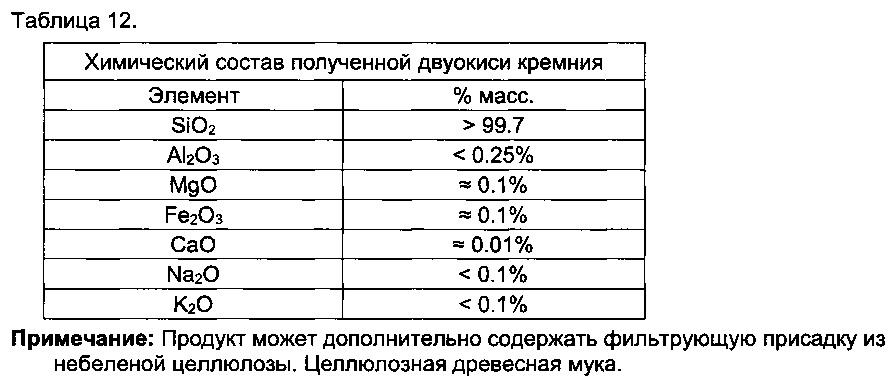



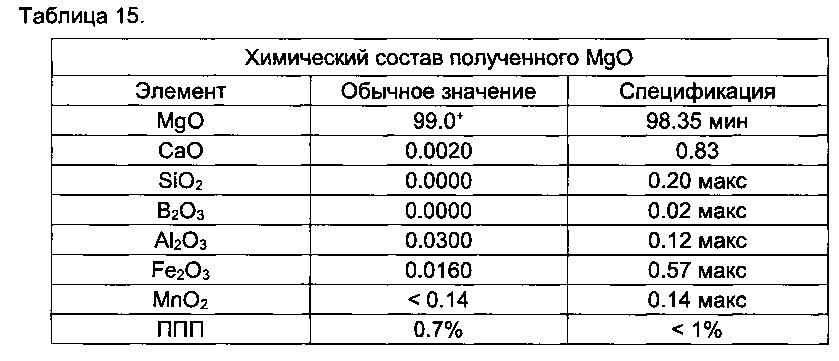






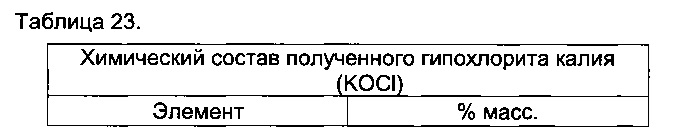


[00255] Для демонстрации гибкости способов согласно настоящему изобретению было проведено несколько испытаний, чтобы показать, что эти способы можно применять с исходным материалом из разных источников.
Пример 6
[00256] Для использования кислотных композиций, содержащих различные компоненты, использовали другой исходный материал. Фактически, исследовали материал, который представляет собой концентрат редкоземельных элементов и редких металлов (в частности, богат цирконием). В Таблице 27 показаны результаты выщелачивания, проведенного с таким исходным материалом с применением способа, аналогичного показанным на Фигурах 1, 3, 6 и 7 и подробно описанного в Примерах 1, 2 и 5. На основании данных, приведенных в Таблице 27, можно заключить, что различные компоненты, присутствующие при выщелачивании (различные металлы, такие как алюминий, железо, магний, а также редкоземельные элементы и редкие металлы), могут быть извлечены из полученного продукта выщелачивания, и что они могут быть выделены в результате способов, описанных здесь, таких как, например, способы, представленные в Примерах 1, 2 и 5.
Пример 7
[00257] Другие испытания провели аналогично тому, что описано в Примере 6.
В этом примере в качестве исходного материала использовали карбонатит (см. Таблицу 28 ниже).

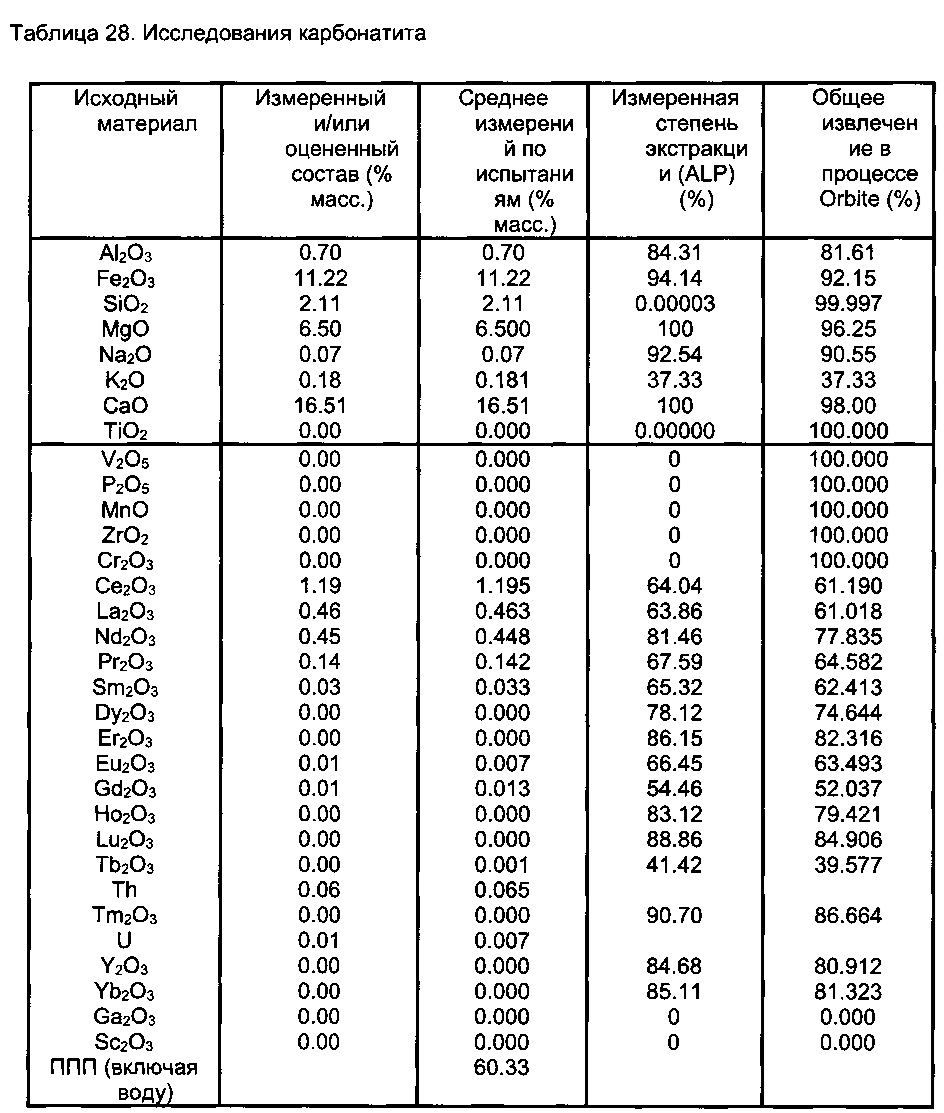
[00258] Соответственно, результаты, представленные в Таблице 29, позволяются сделать вывод, что различные экстрагированные металлы, редкоземельные элементы и редкие металлы присутствуют в полученном продукте выщелачивания и могут быть извлечены в результате осуществления способа, описанного здесь, такого как, например, способы, представленные в Примерах 1, 2 и 5.
Пример 8
[00259] Были проведены испытания для применения летучей золы в качестве исходного материала. Результаты показаны ниже в Таблицах 29, 30 и 31.


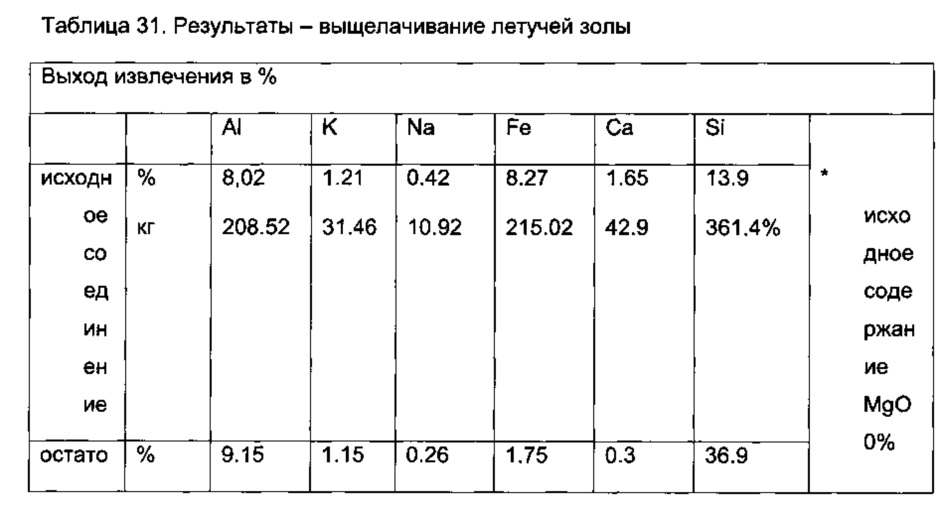

[00260] Таким образом, видно, что выщелачивания летучей золы с использованием HCl было успешным, обеспечивая хорошие значения выхода в отношении извлечения различных компонентов, присутствующих в летучей золе. Все эти различные продукты или компоненты, присутствующие в полученном продукте выщелачивания могут быть выделены и обработаны как указано ранее в описанных здесь способах. Затем полученный продукт выщелачивания можно обработать как описано в описанных здесь способах. Выщелачивание согласно примеру 8 может рассматриваться, например, как выщелачивание 2 на Фиг. 1 или Фиг. 3; выщелачивание 102 на Фиг. 6 или Фиг. 7 и т.д. Например, продукт выщелачивания, полученный в Примере 8, может быть затем обработан как показано на Фигурах 1, 3, 6 и 7.
Пример 9
[00261] Были проведены другие испытания для применения альтернативного источника летучей золы. Использовали аналогичный способ. Измеренные исходные параметры были следующими:


[00262] Образцы выщелачивали партиями при 75 фунтов на квадратный дюйм по манометру (150°C) на протяжении 6 часов при избытке HCl, соответствующем стехиометрическому значению +5% (20% масс).
На стадии выщелачивания были определены следующие значения выхода экстракции:

[00263] После обработки на основных этапах способа (см., например, Фигуру 6) были измерены следующие значения выхода.
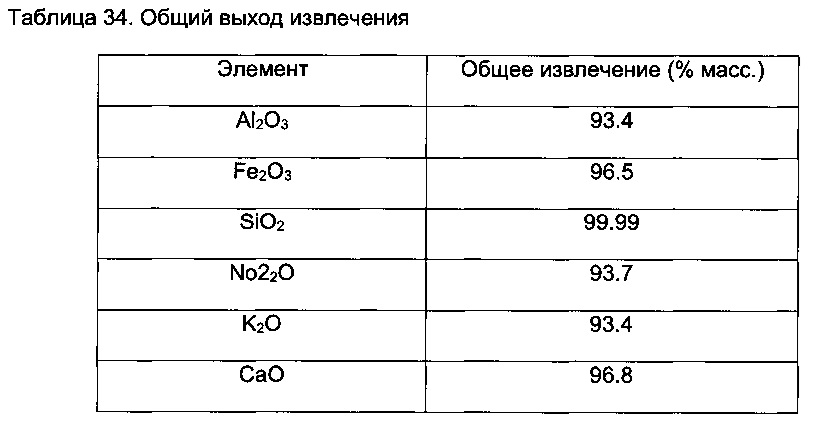
Основные характеристики получаемого оксида алюминия были следующими: Химический состав: 99.4%;
- РЧР dp50: 63 мкм;
- α Al2O3: 2%; и
- объемная плотность: 0.63.
Пример 10
[00264] Другие испытания проводили с другим альтернативным источником материала, при этом во всех случаях использовался тот же способ, что и в предыдущих примерах. Измеренный исходный состав был следующим:
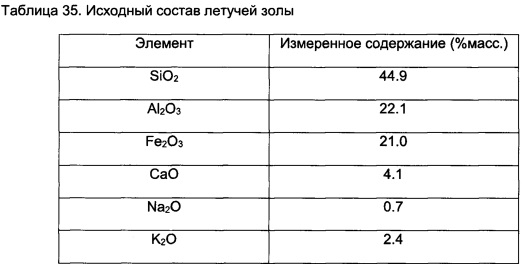
[00265] Образцы выщелачивали партиями при 160°C (80 фунтов на квадратный дюйм по манометру) на протяжении 6 часов при избытке HCl, соответствующем стехиометрическому значению (20% масс.).
На этапе выщелачивания были измерены следующие значения выхода.

[00266] После обработки на главных этапах непрерывного процесса (см. Фигуру 6) были измерены следующие значения выхода:
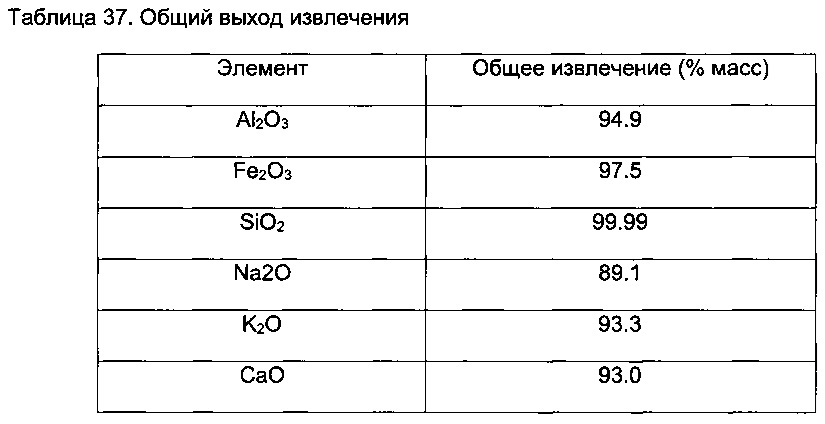
[00267] Заявители разработали полностью интегрированные и непрерывные способы с по существу полным извлечением хлороводородной кислоты для экстракции оксида алюминия и других ценных продуктов из различных материалов, которые содержат алюминий (глины, боксита, алюмосиликатных материалов, шлака, красного шлама, летучей золы и т.д.), содержащих алюминий. Фактически эти способы обеспечивают возможность получения по существу чистого оксида алюминия и других ценных продуктов в очищенном виде, таких как очищенная двуокись кремния, чистый гематит, другие материалы в чистом виде (пр: оксид магния), и продуктов, содержащих редкоземельные элементы. Кроме того, эти способы не требуют предварительной термической обработки перед процедурой кислотного выщелачивания. Кислотное выщелачивание может осуществляться с использованием полунепрерывных методик в условиях высокого давления и температуры и при очень высокой концентрации регенерируемой хлороводородной кислоты. Способы могут также осуществляться при атмосферном давлении. Кроме того, в способах по существу не образуется остатков, которые нельзя продать, что исключает опасные для окружающей среды остатки как в случае щелочных процессов.
[00268] Преимуществом стадии прокаливания при высокой температуре, помимо того, что она обеспечивает возможность контроля необходимой α-формы оксида алюминия, является то, что она может обеспечивать более высокую концентрацию хлороводородной кислоты в водной форме (>38%), чем концентрация HCl в азеотропной точке, и, соответственно, более высокую входную концентрацию HCl для стадии выщелачивания. Сеть хлороводородной кислоты стадии прокаливания может быть связаны с двумя (2) системами кристаллизации и регулировка давления может обеспечивать поглощение избытка HCl при наивысшей возможной водной концентрации. Преимущество гексагидрата с низким содержанием влаги (<2%) на входе обеспечивает непрерывную основу для извлечения кислоты в концентрации более высокой, чем азеотропная концентрация. Этот баланс HCl и ее двойное применение в трех (3) общих частях способа и при концентрации выше азеотропной точки представляет существенный прогресс в данной области.
[00269] Другое преимущество проявляется при использовании исходных реагентов (трихлорида железа) в устройстве для извлечения оксида железа и хлороводородной кислоты, когда вся избыточная тепловая нагрузка от компонента кальцинации, пирогидролиза или компонента выщелачивания используется для предварительного концентрирования маточной жидкости по хлориду металла, что обеспечивает гидролиз при очень низкой температуре трихлорида железа в форму очень чистого гематита и регенерацию кислоты при концентрации, соответствующей ее азеотропной точке.
[00270] Дополнительный крупным преимуществом способов, описанных здесь, на этапе гидролиза трихлорида железа может быть возможность концентрировать редкоземельные элементы в форме хлоридов при очень высокой концентрации в реакторе-гидролизере за счет внутренней петли между гидролизером и кристаллизацией. Преимущество заключается в том, что способы, описанные в настоящем тексте, позволяют извлекать пользу из различных этапов, на которых используются ступенчатые отношения концентраций. Соответственно, на этой стадии, в дополнения к внутренней петле концентрирования, присутствие двуокиси кремния, алюминия, железа и присутствие в равновесном состоянии раствора, близкого к насыщению (большое количество выпариваемой воды без присутствия свободной хлороводородной кислоты) позволяет брать редкоземельные элементы и негидролизуемые элементы в частях на миллион в подаваемом на вход материале и концентрировать их в высоком процентном отношении непосредственно в гидролизере после удаления конкретных оксидов. Затем может быть проведена очистка конкретных оксидов (RE-O) с использованием различных методик, в процентных уровнях. Здесь может быть получено двойное преимущество: получение очень высоких уровней концентрации редкоземельных элементов с использованием интегральных стадий способа и, что наиболее важно, это подход позволяет устранить риска загрязнения основным потоком (очень разбавленным) отработанной кислоты после этапа выщелачивания основного потока хлорида алюминия, который снижает выход Al2O3. Другое важное улучшение по сравнению с уровнем техники может заключаться в том, что в дополнение к полному интегрированию селективное удаление компонентов обеспечивает концентрирование редкоземельных элементов до относительно высокой концентрации (процентных долей).
[00271] Другим преимуществом этих способов может, опять же, быть селективная кристаллизация MgCl2 в результате пропускания HCl, получаемая либо на этапе прокаливания оксида алюминия, либо в результате прямой прокаливания оксида магния, причем в обоих случаях образуется высококонцентрированная кислота, в казовой фазе, или в водной форме. Что касается специфической кристаллизации хлорида алюминия, прямая взаимосвязь с реактором, в котором осуществляется прокаливание, очень высокая концентрация газообразной HCl (от приблизительно 85 до приблизительно 95%, приблизительно от 90 до 95% или приблизительно 90% по массе) обеспечивает возможность точной регулировки непрерывной работы кристаллизатора в зависимости от целевого качества оксида магния. Если этот этап способа (получение MgO или другого ценного оксида металла) необходим с учетом подаваемых на вход реагентов, то экстракцию редкоземельных элементов осуществляют после этого дополнительного этапа; преимуществом является эффект дополнительного концентрирования.
[00272] Пирогидролиз может обеспечивать возможность конечного превращения любых остатков хлорида и получения очищенных оксидов, которые можно использовать (в случае когда исходным материалом является глина) в качестве удобрения и обработку больших количеств промывной воды, образующихся в процессах с восстановлением хлороводородной кислоты в замкнутом цикле в азеотропной точке, на этапе выщелачивания. Преимуществом этого последнего этапа может быть связано с тем фактом, что он полностью замыкает процесс с точки зрения извлечения кислота, и гарантией того, что не образуются никакие опасные для окружающей среды остатки при обработке любого типа исходного материала, как описано ранее.
[00273] Основной вклад в уровень техники может заключаться в том, что предложенные полностью интегрированные способы согласно настоящему описанию обеспечивают, среди прочего, обработку экономичную боксита, при которой не образуется красного шлама или опасны отходов. В дополнение к возможности применения к другим природным исходным материалам (любому подходящему алюминийсодержащему материалу или содержащим глинозем рудам), факт применения полного извлечения хлороводородной кислоты и общей концентрации, которая может быть выше концентрации в азеотропной точке (например, от приблизительно 21% до приблизительно 38%), селективная экстракция ценных вторичных продуктах и соответствие (при сохранении высокой конкурентоспособности по затратам на переработку) экологическим требованиям, составляют основные преимущества для данной области.
[00274] Способы согласно настоящему раскрытию могут обеспечивать полностью непрерывные и экономичные решения, которые позволяют успешно экстрагировать оксид алюминия из различных типов материалов, получая при этом высокоочищенные вторичные продукты с высокой дополнительной ценностью, включая высококонцентрированные редкоземельные элементы и редкие металлы. Технология, описанная в настоящем тексте, может обеспечивать инновационное значение общего извлечения кислоты, а также ультравысокую концентрацию извлекаемой кислоты. В совокупности с тем фактом, что в комбинации с полунепрерывным способом выщелачивания, который способствует очень высоким выходам экстракции и обеспечивает специфический способ кристаллизации хлорида алюминия и концентрирование других ценных элементов. Эти способы также могут обеспечивать получение алюминия с производимым таким образом оксидом алюминия.
[00275] Например, за счет типа оборудования, доступного для использования (например, вертикальной валковой мельницы) и конкретного режима работы этого оборудования измельчение, сушку и классификацию исходного материала можно осуществлять при различных значениях твердости материала (например, топочного шлака), различных значениях влажности (до 30%) и размере частиц на входе. Установленный размер частиц может обеспечивать на стадии выщелачивания преимущество, заключающееся в обеспечении эффективного контакта между материалами и кислотой, а затем более быстрой кинетики реакции. Применяемый размер частиц может обеспечивать значительное уменьшение проблемы трения и обеспечивать возможность применения упрощенного литья/футеровки при контакте с хлороводородной кислотой.
[00276] Другим преимуществом способов согласно настоящему описанию может быть комбинация высокой температуры и высокой входной концентрации хлороводородной кислоты. В комбинации с полунепрерывным режимом работы, в котором возможно систематическое использование направляющей силы свободной HCl, значения выхода экстракции железа и алюминия достигают соответственно 100% и 98% за менее чем приблизительно 40% контрольного времени базового периодического процесса. Другим преимуществом более высокой концентрации HCl, чем концентрация в азеотропной точке, может быть потенциально повышение производительности. Опять же, более высокая концентрация HCl, чем концентрация в азеотропной точке, и полунепрерывный подход могут представлять значительный прогресс в данной области.
[00277] Другим преимуществом является то, что методика, используемая для отделения маточного раствора от двуокиси кремния после противоточной промывки стадии выщелачивания, может включать полосные фильтры, дающие ультрачистую двуокись кремния с ожидаемой степенью чистоты выше 96%.
[00278] Кристаллизация AlCl3 в AlCl3⋅6H2O с использованием сухой, очищенной и в высокой степени газообразной HCl в качестве средства для орошения может обеспечить получение чистого гексагидрата хлорида алюминия, содержащего только небольшое число частей на миллион железа и других примесей. Для обеспечения надлежащего роста кристалла может потребоваться минимальное число стадий.
[00279] Прямая взаимосвязь с кальцинацией AlCl3⋅6H2O в Al2O3, которая может давать очень высокую концентрацию газа, обеспечивает возможность непрерывной точной корректировки концентрации HCl в кристаллизаторе и, таким образом, надлежащий контроль роста кристаллов и процесса кристаллизации.
[00280] Таким образом, было продемонстрировано, что настоящее раскрытие обеспечивает полностью интегрированные способы получения чистого оксида алюминия с использованием обработки хлороводородной кислотой, с одновременным получением продуктов (минералов) высокой степени чистоты и высокого качества и экстракцией редкоземельных элементов и редких металлов.
[00281] Хотя в описании сделаны конкретные ссылки на отдельные варианты реализации, понятно, что их многочисленные модификации будут ясны специалисту в данной области. Соответственно, приведенное выше описание и сопутствующие графические материалы не следует понимать как конкретные примеры или в ограничивающем смысле.
Реферат
Изобретение относится к способам обработки материалов промышленных отходов, а именно к способам обработки летучей золы. Способ включает выщелачивание летучей золы с использованием HCl с получением продукта выщелачивания, содержащего ионы алюминия, ионы железа и твердое вещество, и отделение указанного твердого вещества от продукта выщелачивания. Затем осуществляют реакцию продукта выщелачивания с HCl с получением жидкости, содержащей ионы железа, и осадка, содержащего ионы алюминия в форме AlCl. Отделяют осадок от жидкости. Нагревают осадок в условиях, обеспечивающих превращение AlClв AlO, и необязательно извлекают образующийся при этом газообразный HCl. Обеспечивается экономичный способ получения чистого оксида алюминия с одновременным получением других продуктов высокой степени чистоты и высокого качества. 3 н. и 250 з.п. ф-лы, 7 ил., 38 табл., 10 пр.
Формула
Документы, цитированные в отчёте о поиске
Способ выщелачивания в присутствии хлористоводородной кислоты для регенерации ценного металла из руды

Комментарии