Производные фенилалканамида, способы их получения и сельскохозяйственный или садовый фунгицид - RU2156235C2
Код документа: RU2156235C2
Чертежи












Описание
Настоящее изобретение относится к новым производным фенилалканамидов и сельскохозяйственным или садовым фунгицидам, содержащим их в качестве активных ингредиентов.
До сих пор N-фенилацетаминонитрилы, такие как N-(1-циано-1-циклопропилэтил)-2-(2,4-дихлорфенил)ацетамид и подобные соединения были известны как промежуточные продукты 3-арилпирролидин-2, 4-дионов (заявка на патент Японии, первая публикация, N Hei 6-220004 и заявка на патент Японии, первая публикация, N Hie 6-263731); однако полезность этих соединений в качестве сельскохозяйственных или садовых фунгицидов не известна совсем.
В последнее время фунгицидная активность обычных фунгицидов может ухудшаться вследствие появления устойчивых грибов после многократного использования этих фунгицидов. По этой причине, а также вследствие проблем окружающей среды, желательно предложить новый фунгицид, который может эффективно подавлять вредные грибы даже при низкой концентрации.
Чтобы разработать агент, имеющий превосходящую фунгицидную активность по сравнению с обычными фунгицидами, авторы настоящего изобретения синтезировали различные новые производные фенилалканамидов и провели обширное исследование в отношении их действия на биологическую активность грибов. В результате этого авторы настоящего изобретения нашли, что новые соединения по настоящему изобретению обладают превосходной фунгицидной активностью по отношению к пирикуляриозу риса и подобным заболеваниям, в то же время не мешают росту желательных растений.
Раскрытие сущности изобретения
Настоящее изобретение представляет производные фенилалканамидов, представленные формулой (1):
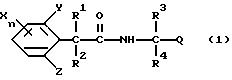
где R1 представляет атом водорода или C1-C4 алкильную группу,
R2 представляет атом водорода, C1 -C6 алкильную группу, C2-C6 циклоалкильную группу или C1-C4 галогеналкильную группу,
каждый из R3 и R4 независимо представляет C1-C6 алкильную группу, C2-C6 алкенильную группу, C3-C6 циклоалкильную группу, C2-C6 алкоксиалкильную группу или C1-C4 галогеналкильную группу или
R3 и R4 вместе с атомом углерода, к которому они присоединены, образуют циклоалкильную группу от 5-членного до 7-членного кольца (которая может быть замещена C1-C6 алкильной группой),
Q представляет цианогруппу или группу формулы: -COR5 (где R5 представляет гидроксигруппу, C1-C6 алкильную группу, C1-C6 алкоксигруппу, C2-C6 алкенилоксигруппу, C2-C6 алкинилоксигруппу, C3-C6 циклоалкилоксигруппу, феноксигруппу, бензилоксигруппу, аминогруппу, C1-C6 алкиламиногруппу или C1 -C6 диалкиламиногруппу),
X представляет атом галогена, C1-C6 алкильную группу, C2-C6 алкенильную группу, C2-C6 алкинильную группу, C3-C6 циклоалкильную группу, C1-C4 галогеналкильную группу, гидроксигруппу, C1-C6 алкоксигруппу, C2 -C6 алкенилоксигруппу, C2-C6 алкинилоксигруппу, C3-C6 циклоалкилоксигруппу, C1-C4 галогеналкоксигруппу, арилоксигруппу (которая может быть замещена C1-C6 алкильной группой, C1-C4 галогеналкильной группой, C1-C6 алкоксигруппой, цианогруппой, нитрогруппой или атомом галогена), гетероарилоксигруппу (которая может быть замещена C1-C6 алкильной группой, C1-C4 галогеналкильной группой, C1-C6 алкоксигруппой, цианогруппой, нитрогруппой или атомом галогена), C1-C6 алкилтиогруппу, C1-C6 алкилсульфинильную группу, C1-C6 алкилсульфонильную группу, C1-C4 галогеналкилтиогруппу, арилтиогруппу (которая может быть замещена C1-C6 алкильной группой, C1-C4 галогеналкильной группой, C1-C6 алкоксигруппой, цианогруппой, нитрогруппой или атомом галогена), гетероарилтиогруппа (которая может быть замещена C1-C6 алкильной группой, C1-C4 галогеналкильной группой, C1-C6 алкоксигруппой, цианогруппой, нитрогруппой или атомом галогена), арилсульфинильную группу (которая может быть замещена C1-C6 алкильной группой, C1-C4 галогеналкильной группой, C1-C6 алкоксигруппой, цианогруппой, нитрогруппой или атомом галогена), арилсульфонильную группу (которая может быть замещена C1-C6 алкильной группой, C1-C4 галогеналкильной группой, C1-C6 алкоксигруппой, цианогруппой, нитрогруппой или атомом галогена), аминогруппу, C1-C6 алкиламиногруппу, C1-C6 диалкиламиногруппу, нитрогруппу, цианогруппу или арильную группу (которая может быть замещена C1-C6 алкильной группой, C1-C4 галогеналкильной группой, C1-C6 алкоксигруппой, цианогруппой, нитрогруппой или атомом галогена), гетероарильную группу (которая может быть замещена, C1-C6 алкильной группой, C1-C4 галогеналкильной группой, C1-C6 алкоксигруппой, цианогруппой, нитрогруппой или атомом галогена, аралкильную группу (которая может быть замещена C1-C6 алкильной группой, C1 -C4 галогеналкильной группой, C1-C6 алкоксигруппой, цианогруппой, нитрогруппой или атомом галогена), C1-C6 алкилкарбонильную группу, арилкарбонильную группу (которая может быть замещена C1-C6 алкильной группой, C1-C4 галогеналкильной группой, C1-C6 алкоксигруппой, цианогруппой, нитрогруппой или атомом галогена), гетероарилкарбонильную группу (которая может быть замещена C1-C6 алкильной группой, C1-C4 галогеналкильной группой, C1-C6 алкоксигруппой, цианогруппой, нитрогруппой или атомом галогена), формильную группу или C1-C6 алкоксикарбонильную группу,
каждый из Y и Z независимо представляет атом водорода, C1-C6 алкильную группу, C1-C4 галогеналкильную группу, C1-C6 алкоксигруппу, цианогруппу, нитрогруппу или атом галогена и
n равно целому числу 0-3,
исключая случай, когда R3 и R4 представляют одновременно трифторметильную группу, и
при условии, что, когда как R1, так и R2, представляют атом водорода одновременно, то как Y, так и Z, представляют атом водорода, и n равно целому числу 1-3,
а также сельскохозяйственный или садовый фунгицид, включающий производное фенилалканамида в качестве активного ингредиента.
Термины, используемые в настоящем изобретении, определяются ниже. В настоящем изобретении, например, в случае выражения "C1-C6", группа, показанная после "C1-C6", имеет от 1 до 6 атомов углерода.
Термин "C1-C6 алкильная группа" используют здесь для обозначения алкильной группы с неразветвленной или разветвленной цепью, включая, но не ограничиваясь ими, метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, изобутильную группу, втор-бутильную группу, трет-бутильную группу, н-пентильную группу, изопентильную группу, неопентильную группу, н-гексильную группу, изогексильную группу, 3,3-диметилбутильную группу и т.п.
В качестве "C3-C6 циклоалкильной группы" здесь можно упомянуть, например, циклопропильную группу, циклопентильную группу, циклогексильную группу и т.п.
Термин "C1-C4 галогеналкильную группу" используют здесь для обозначения галогензамещенной алкильной группы с неразветвленной или разветвленной цепью, включая, но не ограничиваясь ими, фторметильную группу, хлорметильную группу, дифторметильную группу, дихлорметильную группу, трифторметильную группу, пентафторметильную группу и т.п.
Термин "C2-C6 алкенильную группу" используют здесь для обозначения алкенильной группы с неразветвленной или разветвленной цепью, включая, но не ограничиваясь ими, винильную группу, 1-пропенильную группу, аллильную группу, изопропенильную группу, 1-бутенильную группу, 2-бутенильную группу и т.п.
Термин "C2-C6 алкинильную группу" используют здесь для обозначения алкинильной группы с неразветвленной или разветвленной цепью, включая, но не ограничиваясь ими, этинильную группу, 1-пропинильную группу, 2-пропинильную группу, 1-бутинильную группу, 2-бутинильную группу, 3-бутинильную группу, 4-метил-1-пентинильную группу, 3-метил-1-пентинильную группу и т.п.
В качестве "арильной группы" можно упомянуть здесь, например, фенильную группу, 1-нафтильную группу, 2-нафтильную группу и т.п.
В качестве "гетероарильной группы" здесь можно упомянуть, например, 2-пиридильную группу, 3-пиридильную группу, 4-пиридильную группу, 2-фурильную группу, 3-фурильную группу, 2-тиенильную группу, 3-тиенильную группу, 1-пиррольную группу, 2-пиррольную группу, 3-пиррольную группу и т.п.
Термин "аралкильная группа" используют здесь для обозначения арил (имеет такое же значение, как определено выше) замещенной C1-C3 алкильной группы с неразветвленной или разветвленной цепью, включая, но не ограничиваясь ими, бензильную группу, фенетильную группу, 1-нафтилметильную группу, 2-нафтилметильную группу и т.п.
Термин "атом галогена" используют здесь для обозначения атома фтора, атома хлора, атома брома или атома иода.
Термин "C1-C6 алкоксигруппа" используют здесь для обозначения алкоксигруппы с неразветвленной или разветвленной цепью, включая, но не ограничиваясь ими, метоксигруппу, этоксигруппу, н-пропоксигруппу, изопропоксигруппу, н/бутоксигруппу, изобутоксигруппу, втор-бутоксигруппу, трет-бутоксигруппу, н-пентилоксигруппу, изопентилоксигруппу, н-гексилоксигруппу и т.п.
Термин "C2-C6 алкенилоксигруппа" используют здесь для обозначения алкенилоксигруппы с неразветвленной или разветвленной цепью, включая, но не ограничиваясь ими, аллилоксигруппу, изопропенилоксигруппу, 2-бутенилоксигруппу и т.п.
Термин "C2-C6 алкинилоксигруппа" используют здесь для обозначения алкинилоксигруппы с неразветвленной или разветвленной цепью, включая, но не ограничиваясь ими, 2-пропинилоксигруппу, 2-бутинилоксигруппу, 3-бутинилоксигруппу и т.п.
В качестве "C3-C6 циклоалкилоксигруппы" здесь можно упомянуть, например, циклопропилоксигруппу, циклопентилоксигруппу, циклогексилоксигруппу и т.п.
Термин "C1-C4 галогеналкоксигруппа" используют здесь для обозначения галогензамещенной алкоксигруппы с неразветвленной или разветвленной цепью, включая, но не ограничиваясь ими, фторметоксигруппу, дифторметоксигруппу, трифторметоксигруппу, пентафторэтоксигруппу и т.п.
В качестве "арилоксигруппы" здесь можно упомянуть, например, феноксигруппу, 1-нафтилоксигруппу, 2-нафтилоксигруппу и т.п.
В качестве "гетероарилоксигруппы" можно упомянуть, например, 2-пиридилоксигруппу, 3-пиридилоксигруппу, 4-пиридилоксигруппу, 2-фурилоксигруппу, 3-фурилоксигруппу, 2-тиенилоксигруппу, 3-тиенилоксигруппу и т.п.
Термин "аралкилоксигруппа" используют здесь для обозначения арилзамещенной C1-C3 алкоксигруппы с неразветвленной или разветвленной цепью, включая, но не ограничиваясь ими, бензилоксигруппу, фенетилоксигруппу и т.п.
Термин "C1-C6 алкилтиогруппа" используют здесь для обозначения алкилтиогруппы с неразветвленной или разветвленной цепью, включая, но не ограничиваясь ими, метилтиогруппу, этилтиогруппу, н-пропилтиогруппу, изопропилтиогруппу, н-бутилтиогруппу, изобутилтиогруппу, втор-бутилтиогруппу, трет-бутилтиогруппу, н-гексилтиогруппу и т.п.
Термин "C1-C6 алкилсульфинильная группа" используют здесь для обозначения алкилсульфинильной группы с неразветвленной или разветвленной цепью, включая, но не ограничиваясь ими, метилсульфинильную группу, этилсульфинильную группу, н-пропилсульфинильную группу, изопропилсульфинильную группу, н-бутилсульфинильную группу, изобутилсульфинильную группу, втор-бутилсульфинильную группу, трет-бутилсульфинильную группу, н-гексилсульфинильную группу и т.п.
Термин "C1-C6 алкилсульфонильная группа" используют здесь для обозначения алкилсульфонильной группы с неразветвленной или разветвленной цепью, включая, но не ограничиваясь ими, метилсульфонильную группу, этилсульфонильную группу, н-пропилсульфонильную группу, изопропилсульфонильную группу, н-бутилсульфонильную группу, изобутилсульфонильную группу, втор-бутилсульфонильную группу, трет-бутилсульфонильную группу, н-гексилсульфонильную группу и т.п.
Термин "C1-C4 галогеналкилтиогруппа" используют здесь для обозначения галогензамещенной алкилтиогруппы с неразветвленной или разветвленной цепью, включая, но не ограничиваясь ими, фторметилтиогруппу, дифторметилтиогруппу, трифторметилтиогруппу, пентафтортиогруппу и т.п.
В качестве "арилтиогруппы" здесь можно упомянуть, например, фенилтиогруппу, 1-нафтилтиогруппу, 2-нафтилтиогруппу или тому подобное.
В качестве "гетероарилтиогруппы" можно упомянуть, например, 2-пиридилтиогруппу, 3-пиридилтиогруппу, 4-пиридилтиогруппу, 2-фурилтиогруппу, 3-фурилтиогруппу, 2-тиенилтиогруппу, 3-тиенилтиогруппу и т.п.
В качестве "арилсульфинильной группы" здесь можно упомянуть, например, фенилсульфинильную группу, 1-нафтилсульфинильную группу, 2-нафтилсульфинильную группу и т.п.
В качестве "арилсульфонильной группы" здесь можно упомянуть фенилсульфонильную группу, 1-нафтилсульфонильную группу, 2-нафтилсульфонильную группу и т.п.
Термин "C1-C6 алкиламиногруппа" используют здесь для обозначения алкиламиногруппы с неразветвленной или разветвленной цепью, включая, например, метиламиногруппу, этиламиногруппу, н-пропиламиногруппу, изопропиламиногруппу, н-бутиламиногруппу, изобутиламиногруппу, втор-бутиламиногруппу, трет-бутиламиногруппу, н-гексиламиногруппу и т.п.
В качестве "C1-C6 диалкиламиногруппы" можно упомянуть, например, диметиламиногруппу, диэтиламиногруппу, дипропиламиногруппу, дибутиламиногруппу и т.п.
Термин "C1-C6 алкилкарбонильная группа" используют здесь для обозначения алкилкарбонильной группы с неразветвленной или разветвленной цепью, включая, например, ацетильную группу, пропионильную группу, бутилильную группу, изобутилильную группу и т.п.
В качестве "арилкарбонильной группы" здесь можно упомянуть, например, бензоильную группу, 1-нафтилкарбонильную группу, 2-нафтилкарбонильную группу и т.п.
В качестве "гетероарилкарбонильной группы" здесь можно упомянуть, например, 2-пиридилкарбонильнуго группу, 3-пиридилкарбонильную группу, 4-пиридилкарбонильную группу, 2-фурилкарбонильную группу, 3-фурилкарбонильную группу, 2-тиенилкарбонильную группу, 3-тиенилкарбонильную группу и т.п.
Термин "C1-C6 алкоксикарбонильная группа" используют здесь для обозначения алкоксикарбонильной группы с неразветвленной или разветвленной цепью, включая, например, метоксикарбонильную группу, этоксикарбонильную группу, н-пропоксикарбонильную группу, изопропоксикарбонильную группу, н-бутоксикарбонильную группу, изобутоксикарбонильную группу, втор-бутоксикарбонильную группу, трет-бутоксикарбонильную группу, н-пентилоксикарбонильную группу, н-гексилоксикарбонильную группу и т.п.
Соединения, представленные формулой (1) по настоящему изобретению, могут существовать в виде оптических изомеров благодаря присутствию одного или нескольких хиральных центров в молекуле. Настоящее изобретение относится ко всем таким диастереомерам энантиомерам и их смесям.
Предпочтительными соединениями, представленными формулой
(1) по настоящему изобретению, являются соединения, у которых:
R1 представляет атом водорода или метильную группу,
R2 представляет атом водорода, метильную
группу или этильную группу,
R3 представляет метильную группу, этильную группу или н-пропильную группу,
R4 представляет метильную группу, этильную группу,
н-пропильную группу, изопропильную группу, н-бутильную группу, изобутильную группу, втор-бутильную группу, трет-бутильную группу, циклопропильную группу, циклопентильную группу или дихлорметильную
группу,
Q представляет цианогруппу, метоксикарбонильную группу, этоксикарбонильную группу, н-пропоксикарбонильную группу, изопропоксикарбонильную группу, н-бутоксикарбонильную группу,
втор-бутоксикарбонильную группу или карбамоильную группу,
X представляет атом фтора, атом хлора, атом брома, атом иода, метильную группу, этильную группу, изопропильную группу, изобутильную
группу, втор-бутильную группу, трет-бутильную группу, циклопентильную группу, циклогексильную группу, трифторметильную группу, метоксигруппу, этоксигруппу, н-пропоксигруппу, изопропоксигруппу,
дифторметоксигруппу, трифторметоксигруппу, феноксигруппу, метилтиогруппу, этилтиогруппу, изопропилтиогруппу, диметиламиногруппу, диэтиламиногруппу, нитрогруппу, цианогруппу, фенильную группу,
ацетильную группу или бензоильную группу,
каждый из Y и Z независимо представляет атом водорода или атом фтора и
n равен целому числу 1-3.
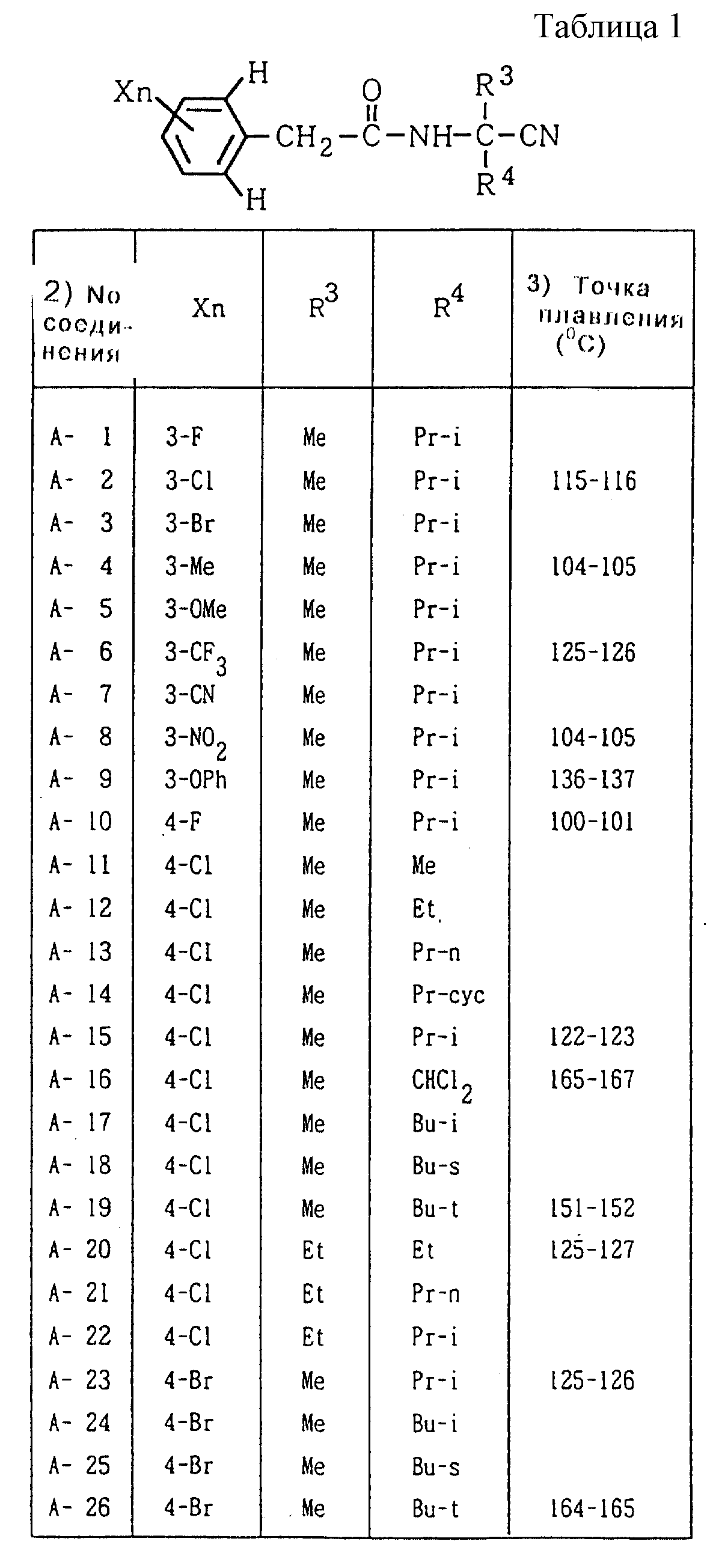
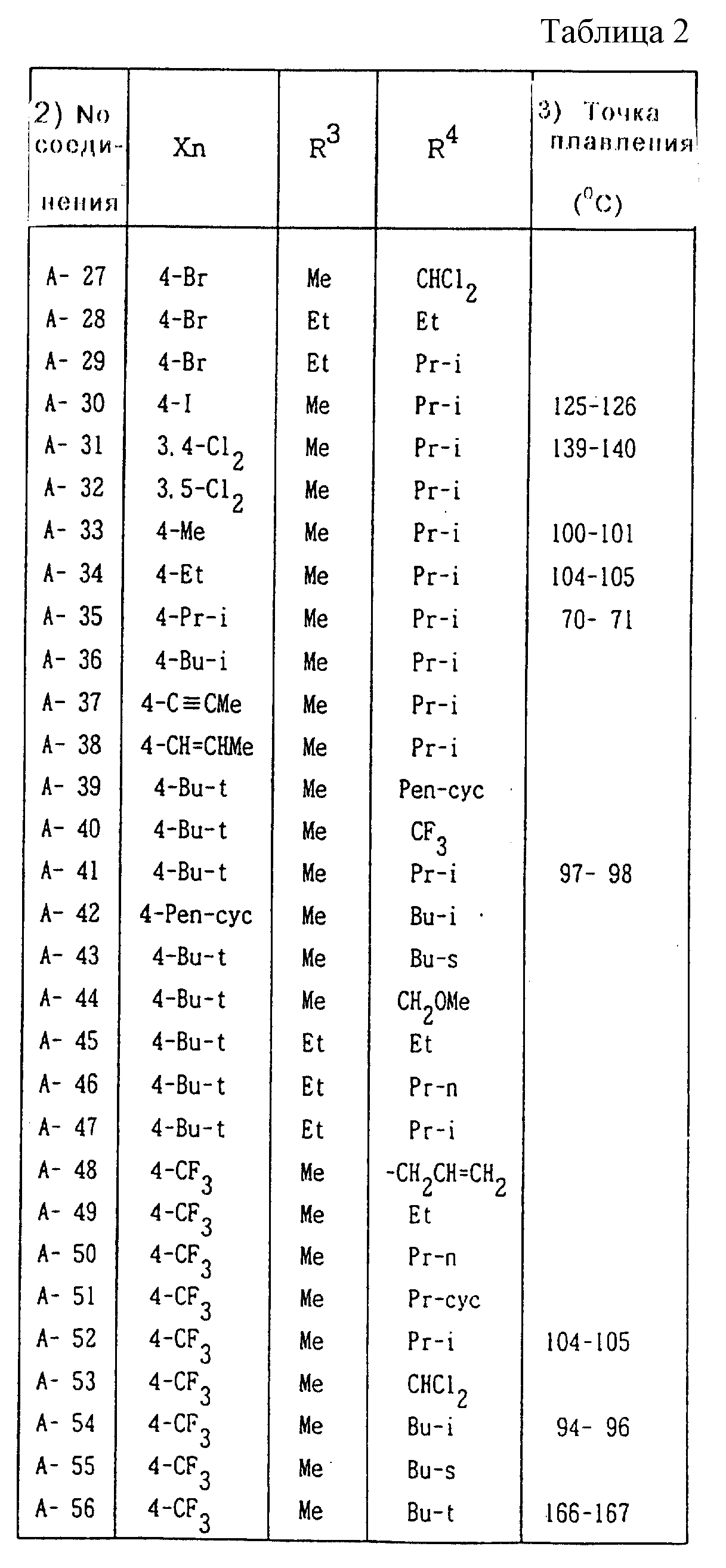
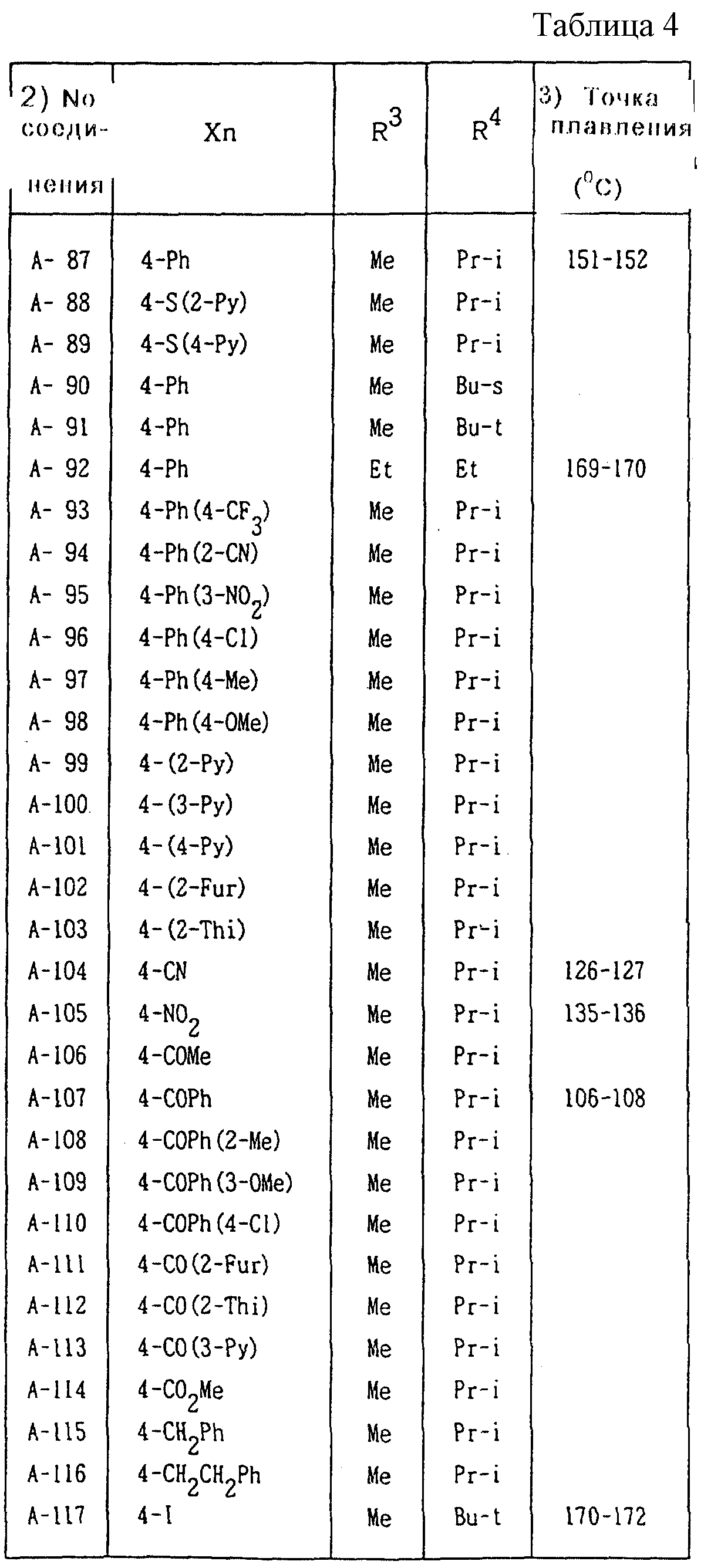
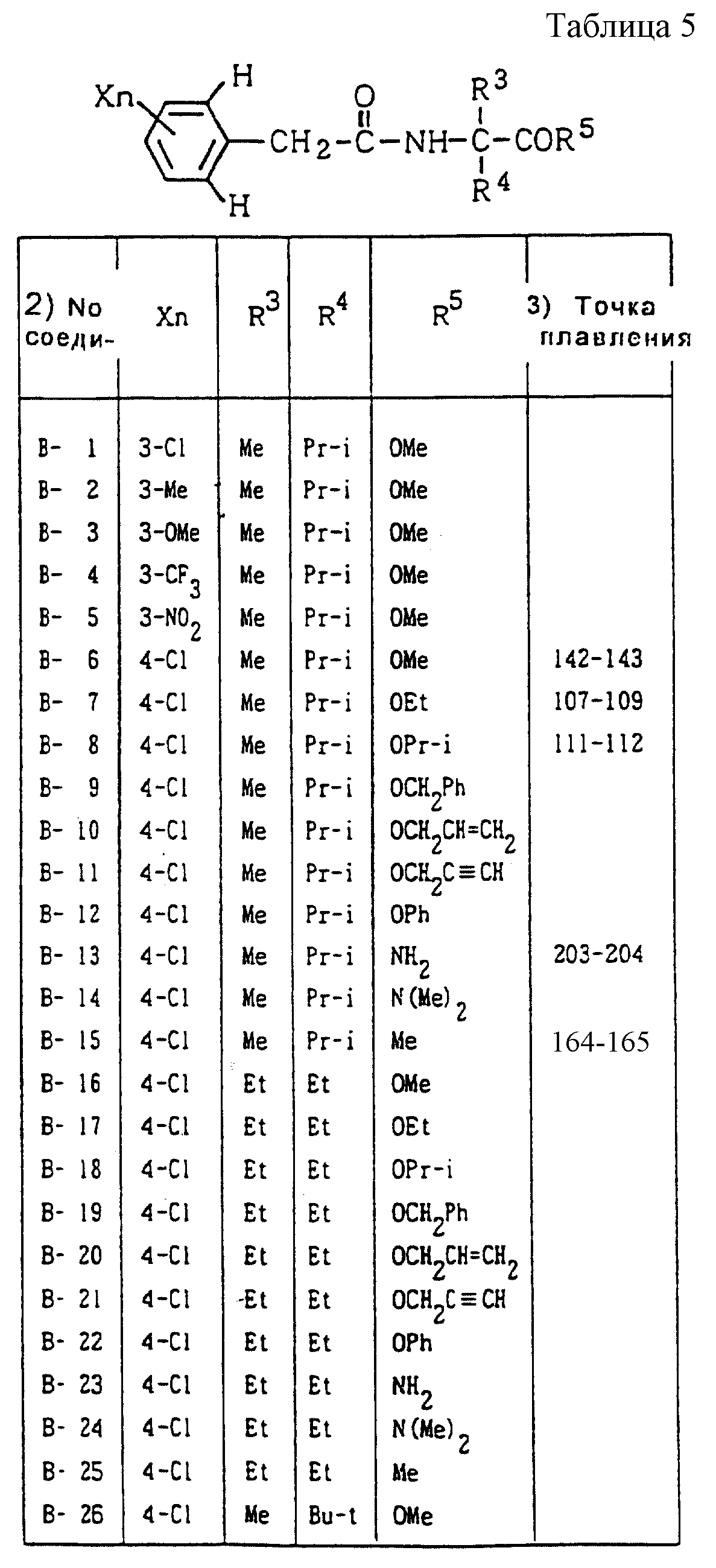
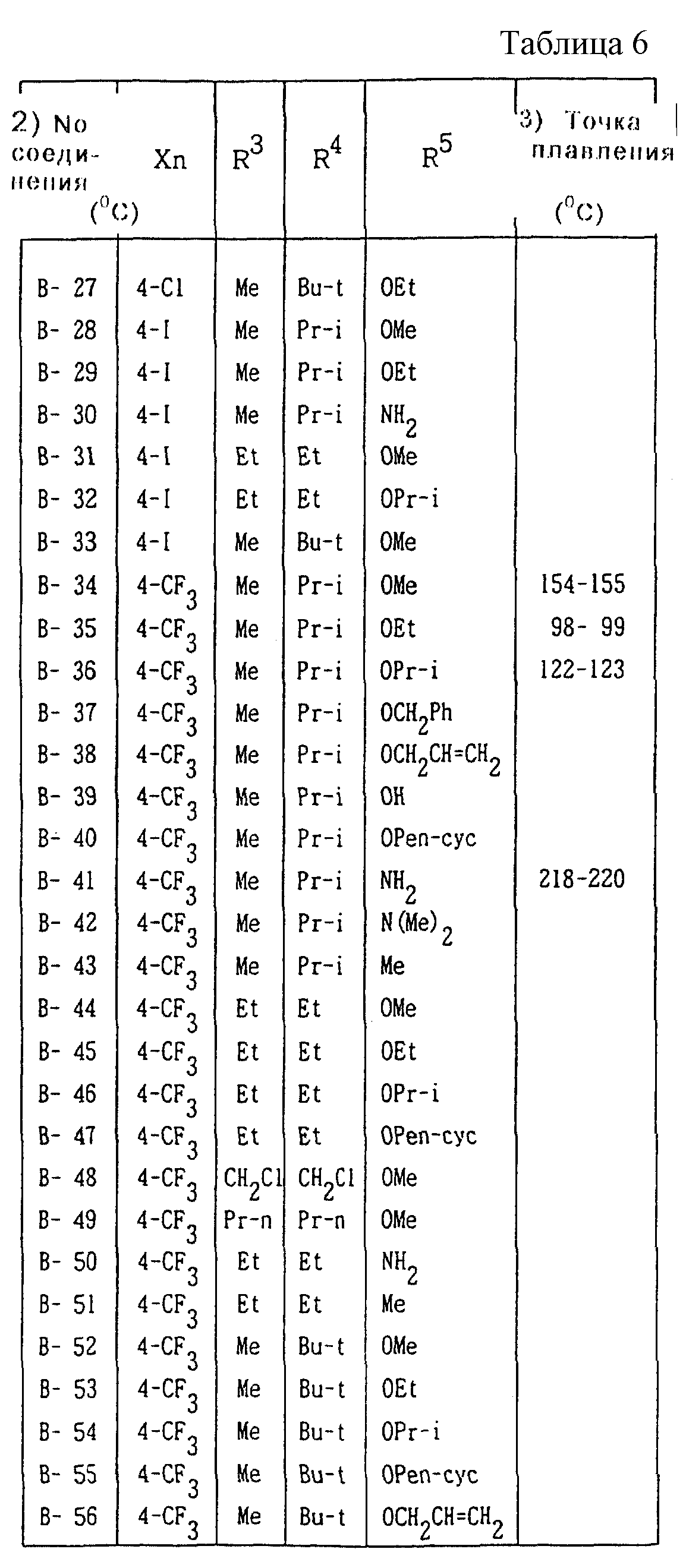
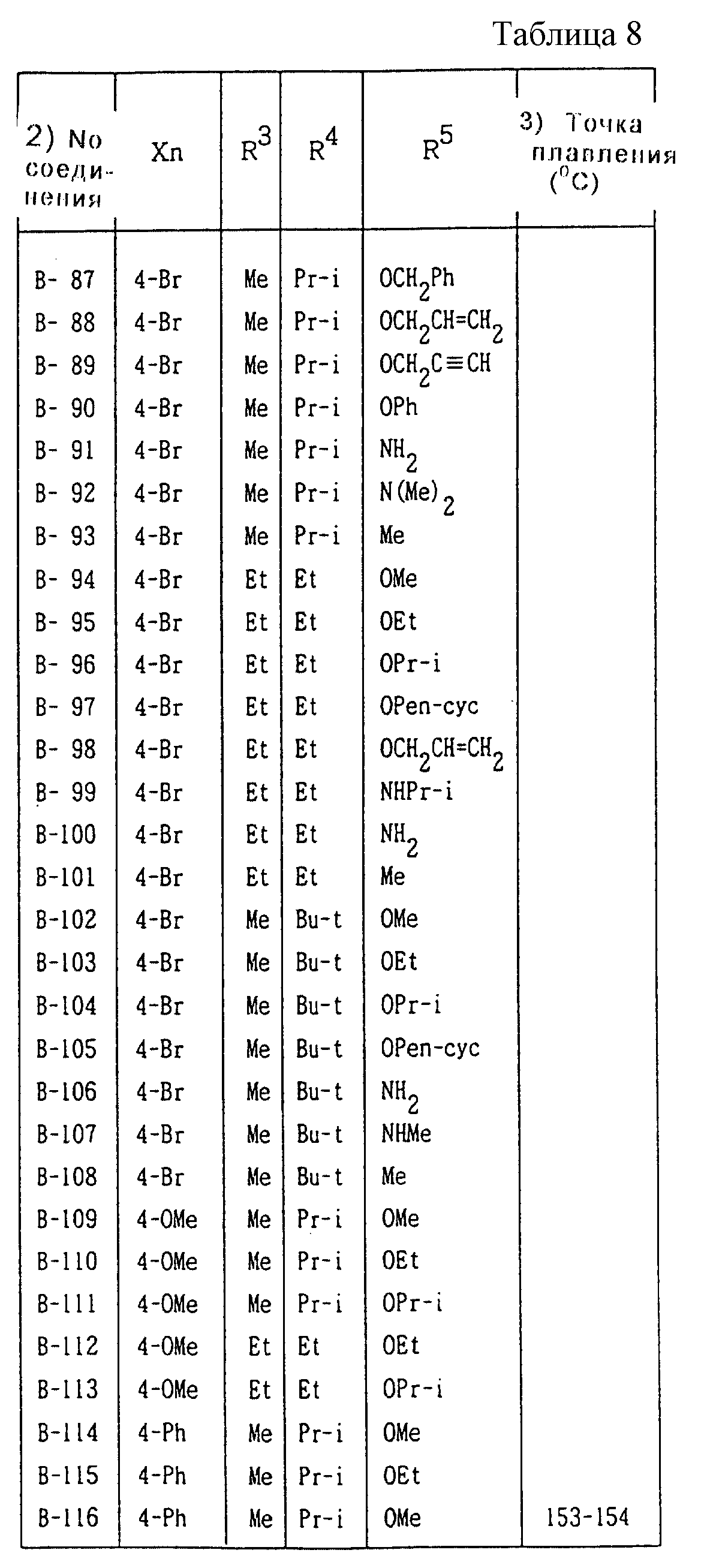
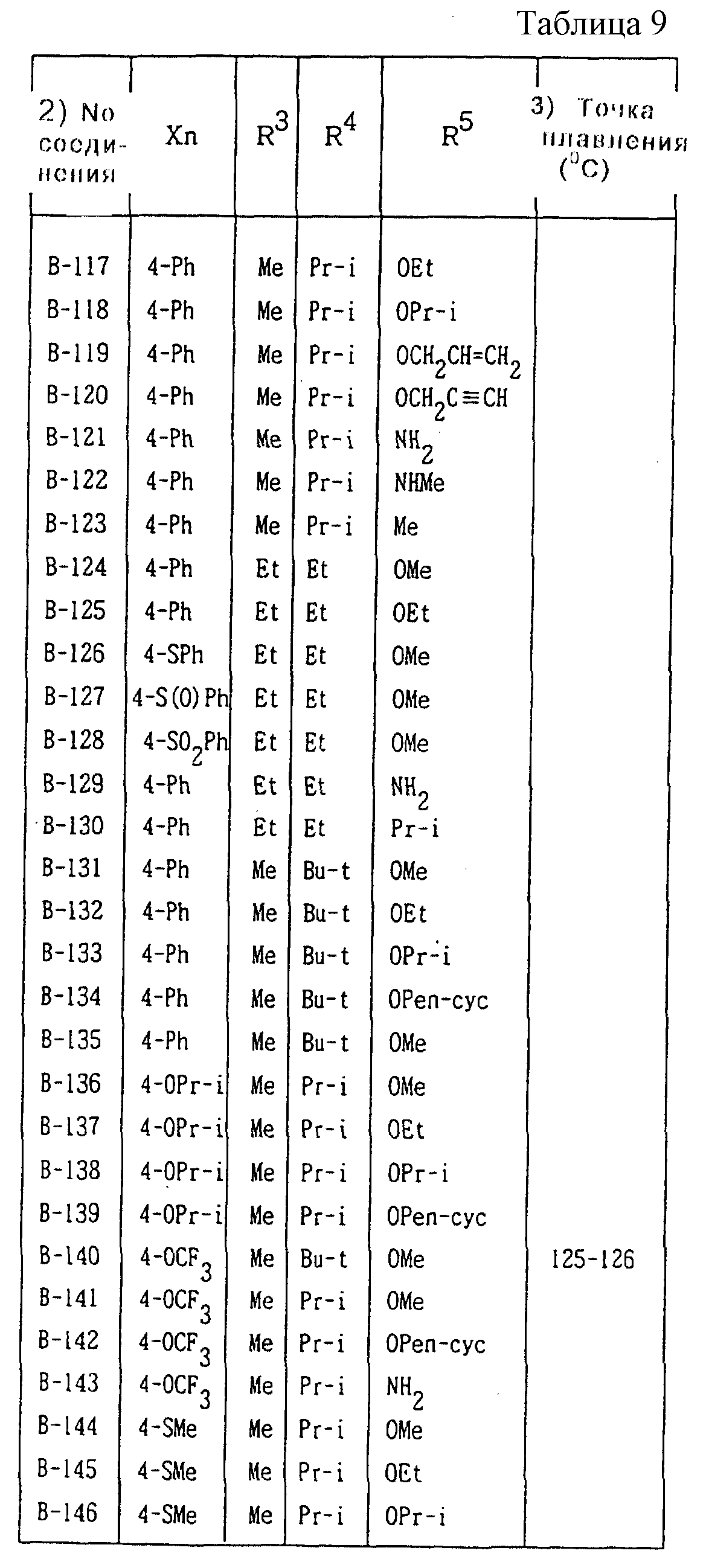
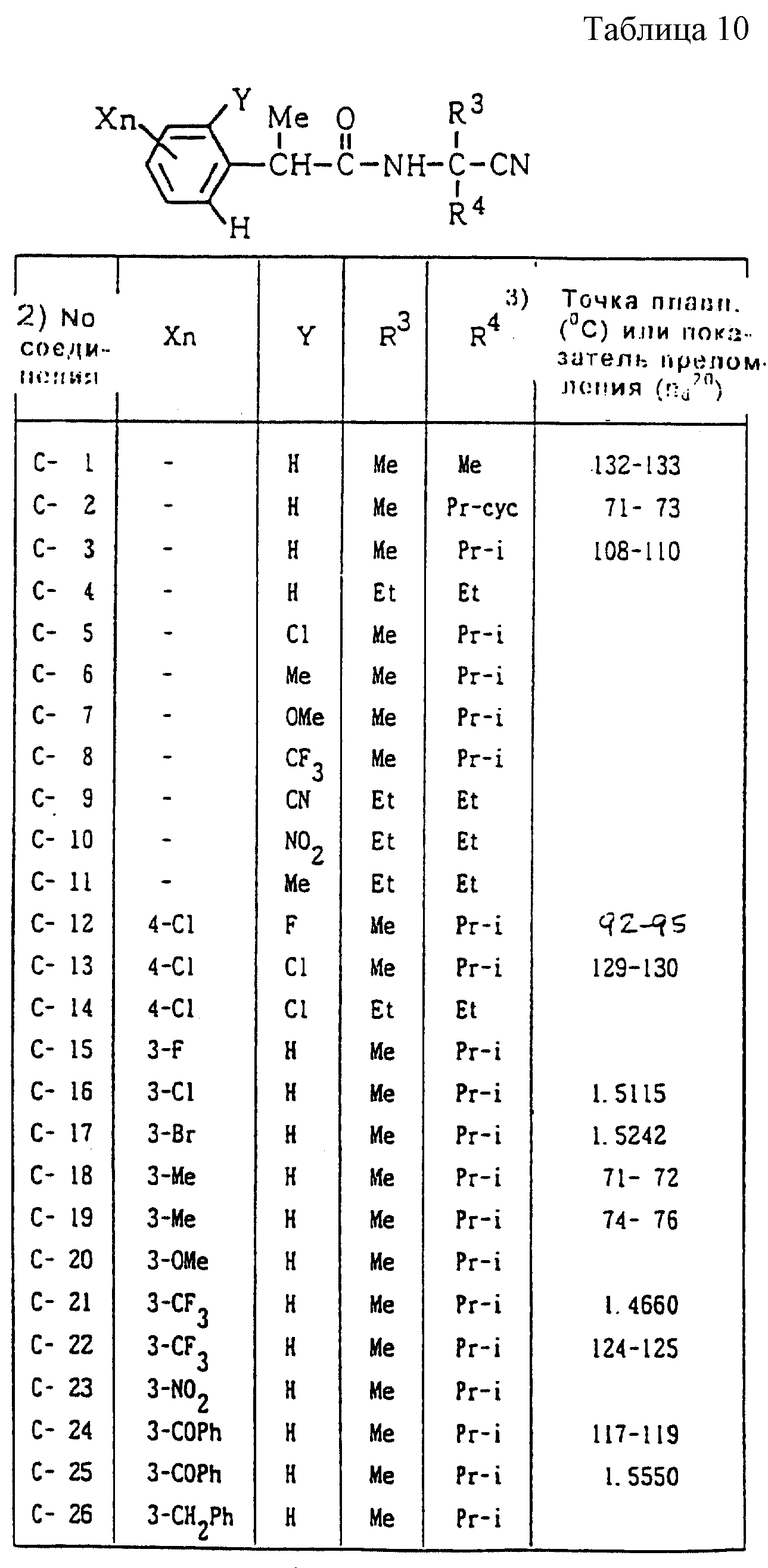
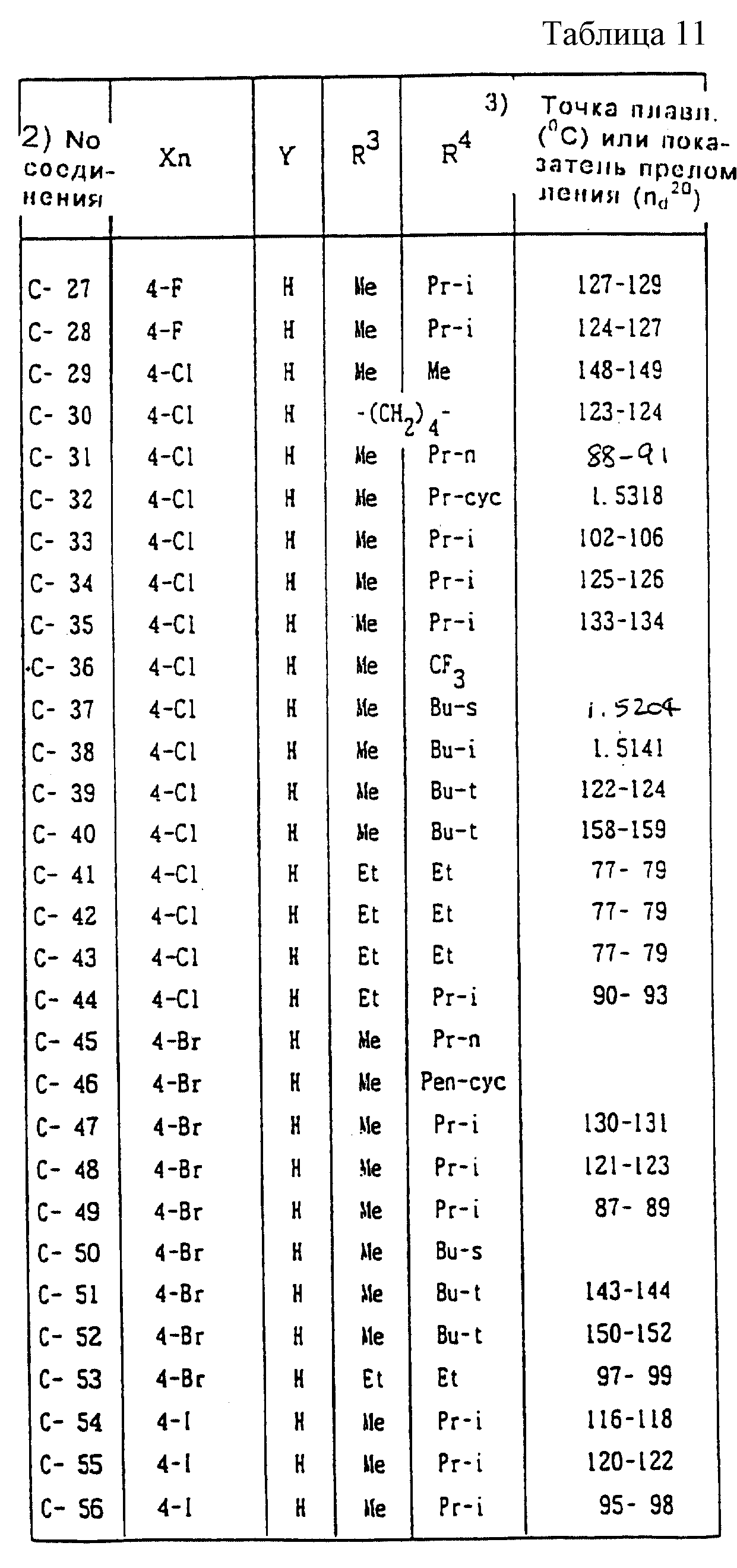
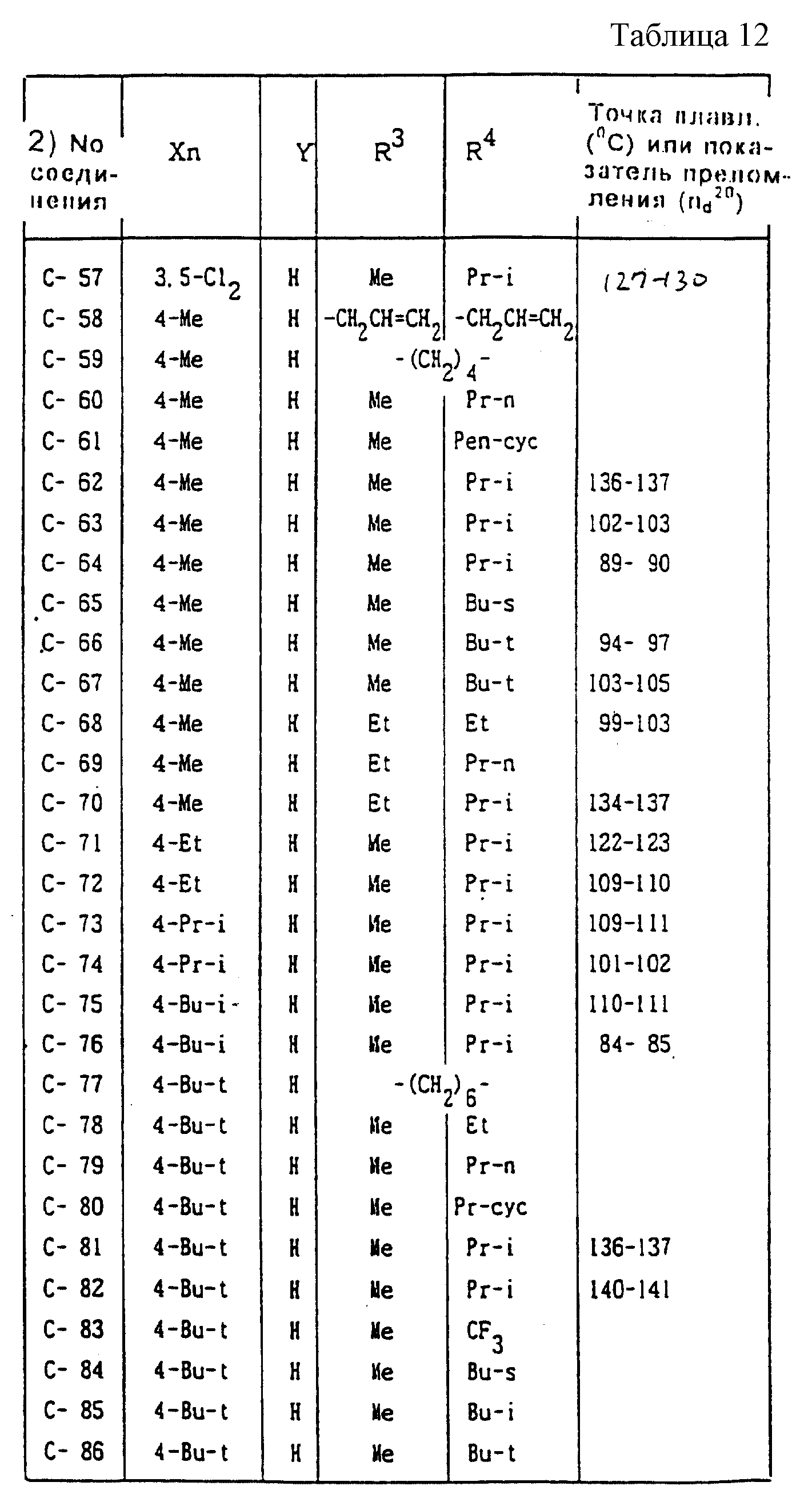
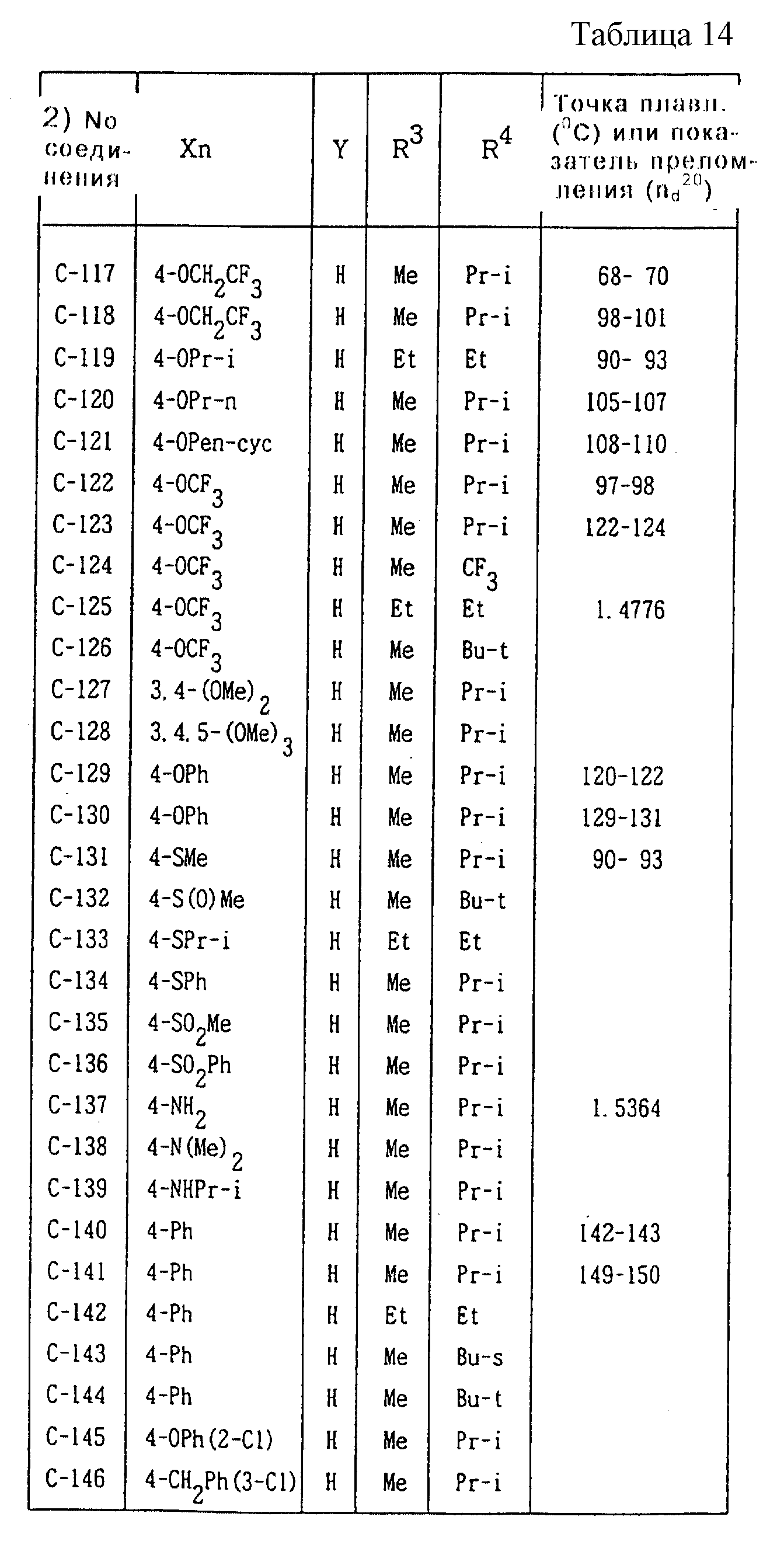
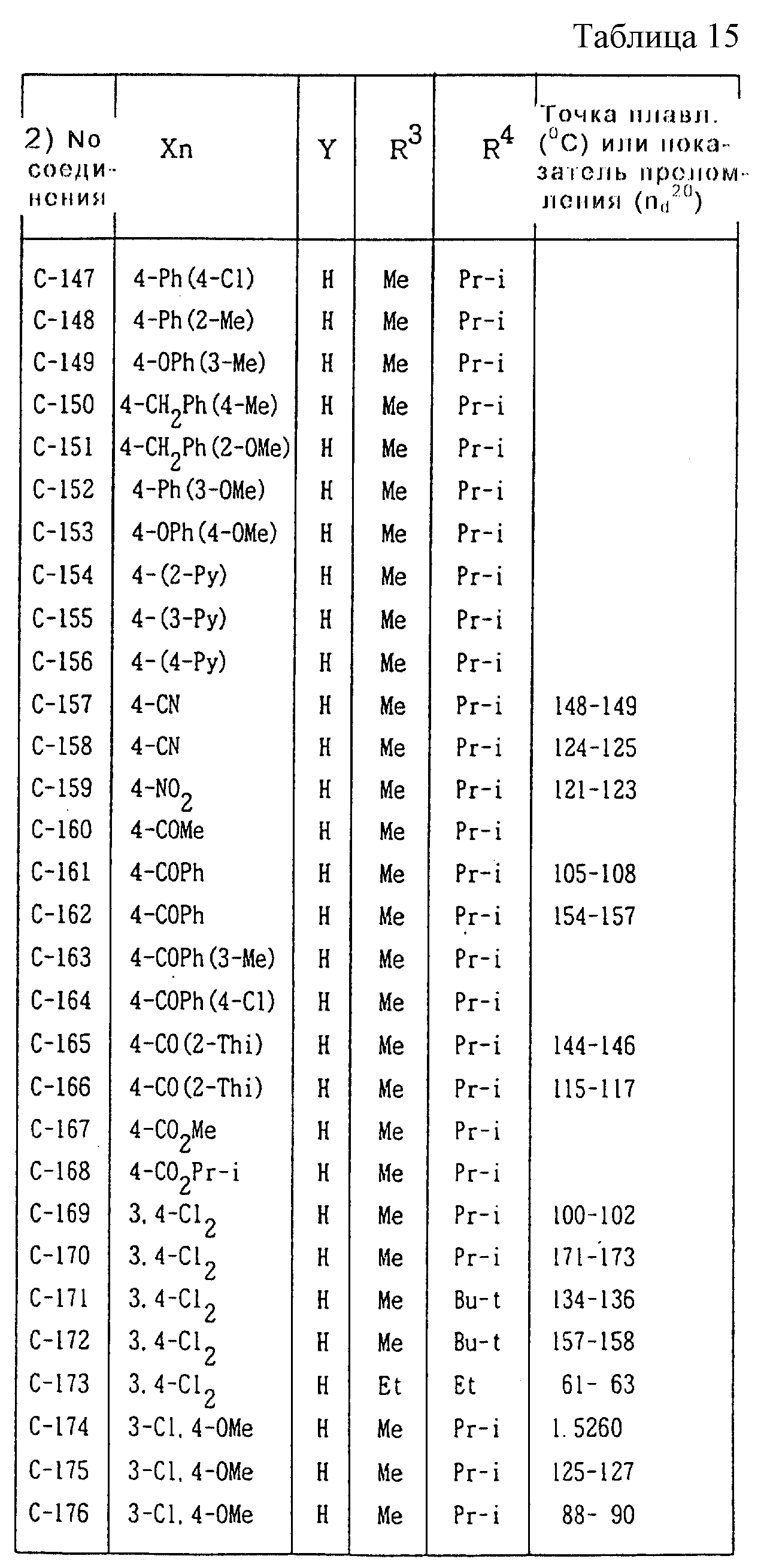
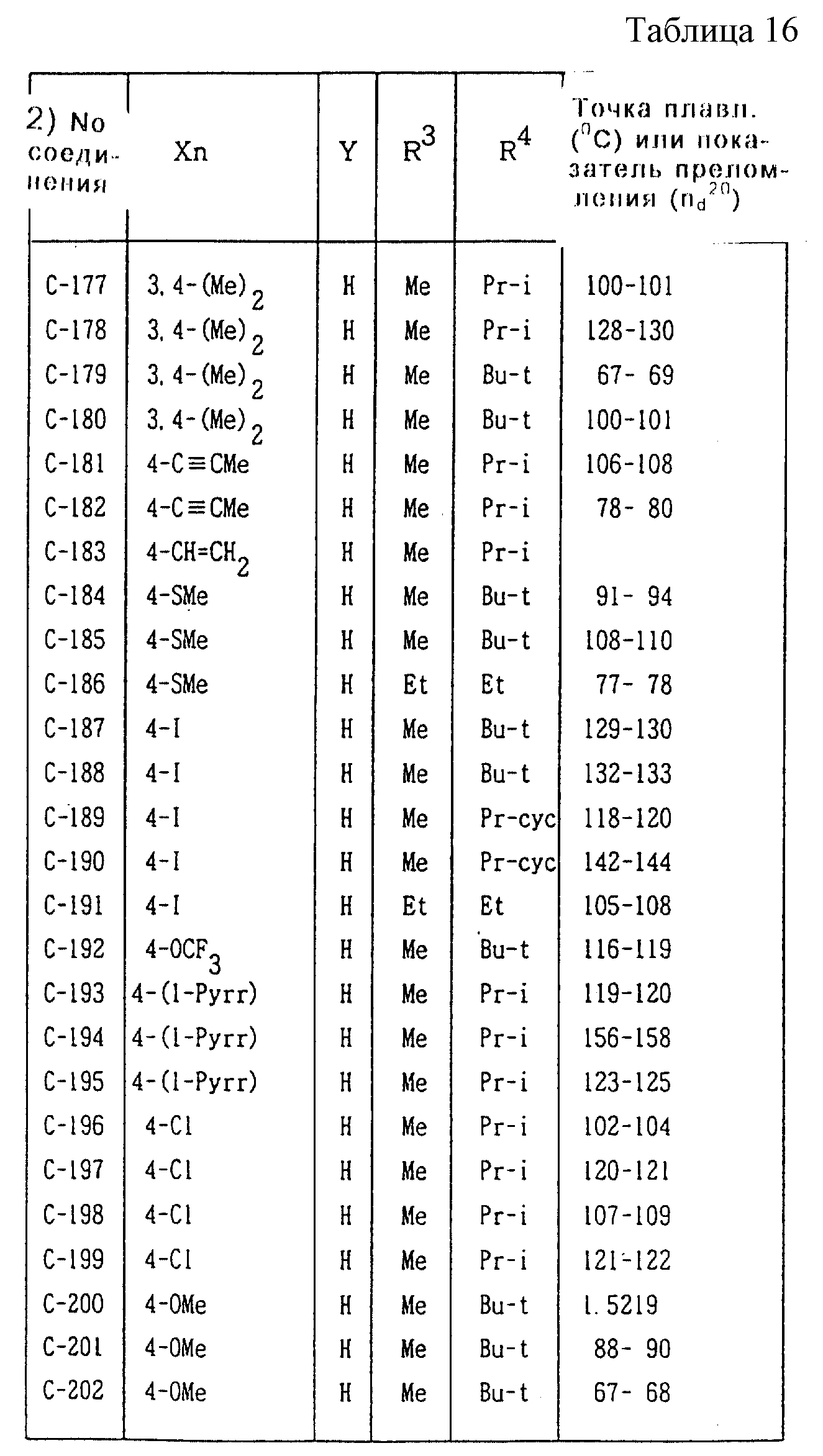
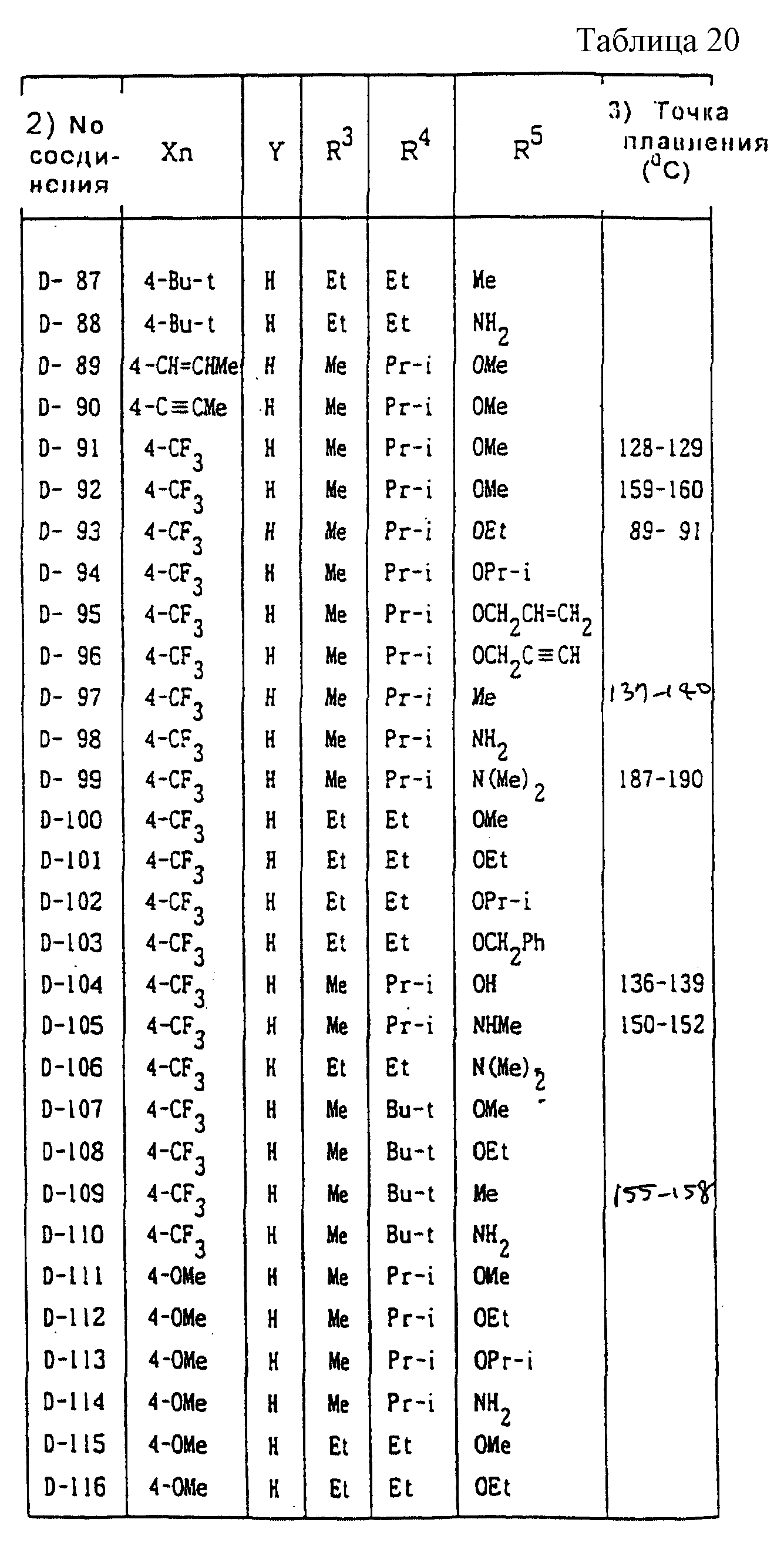
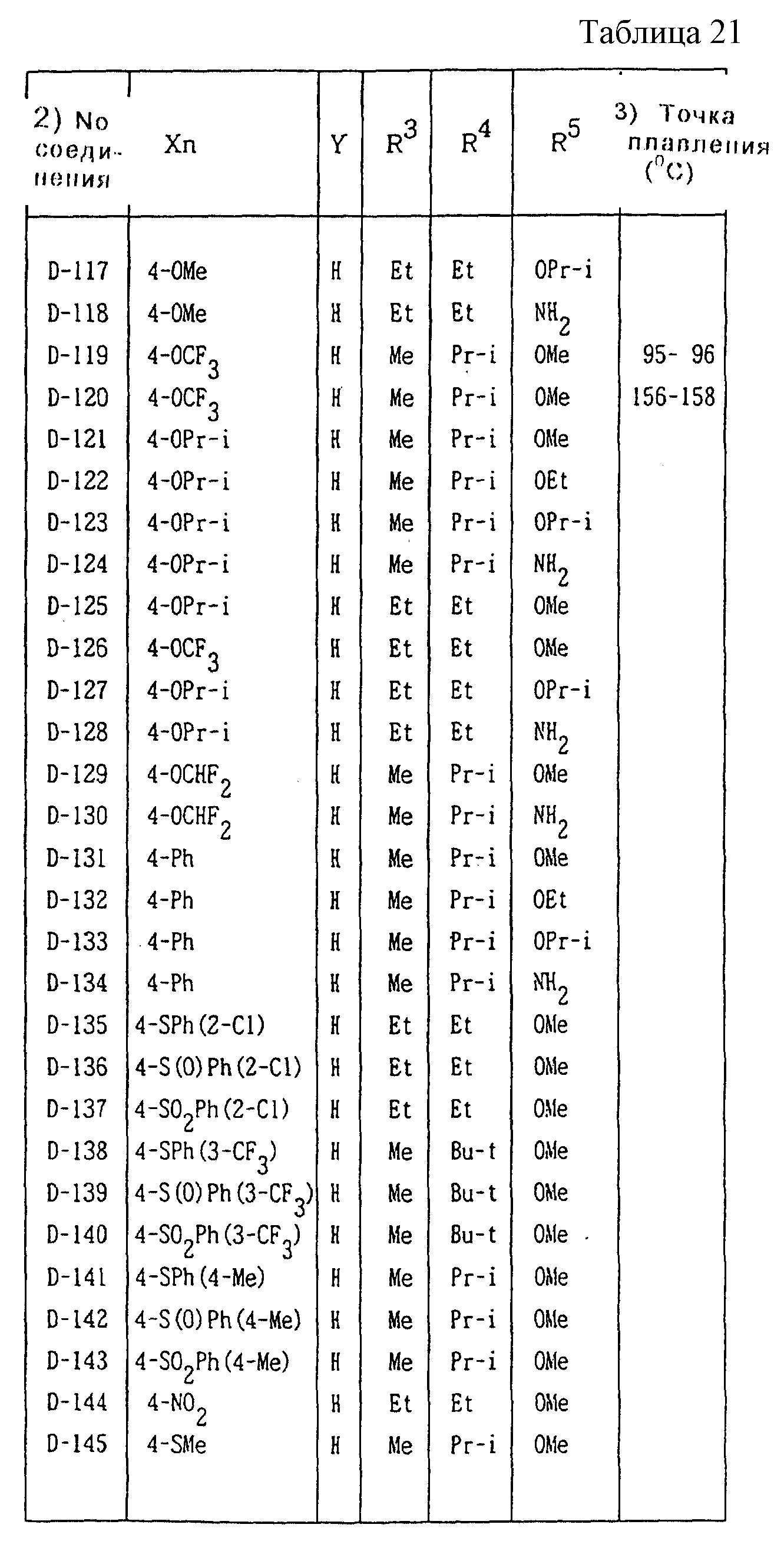
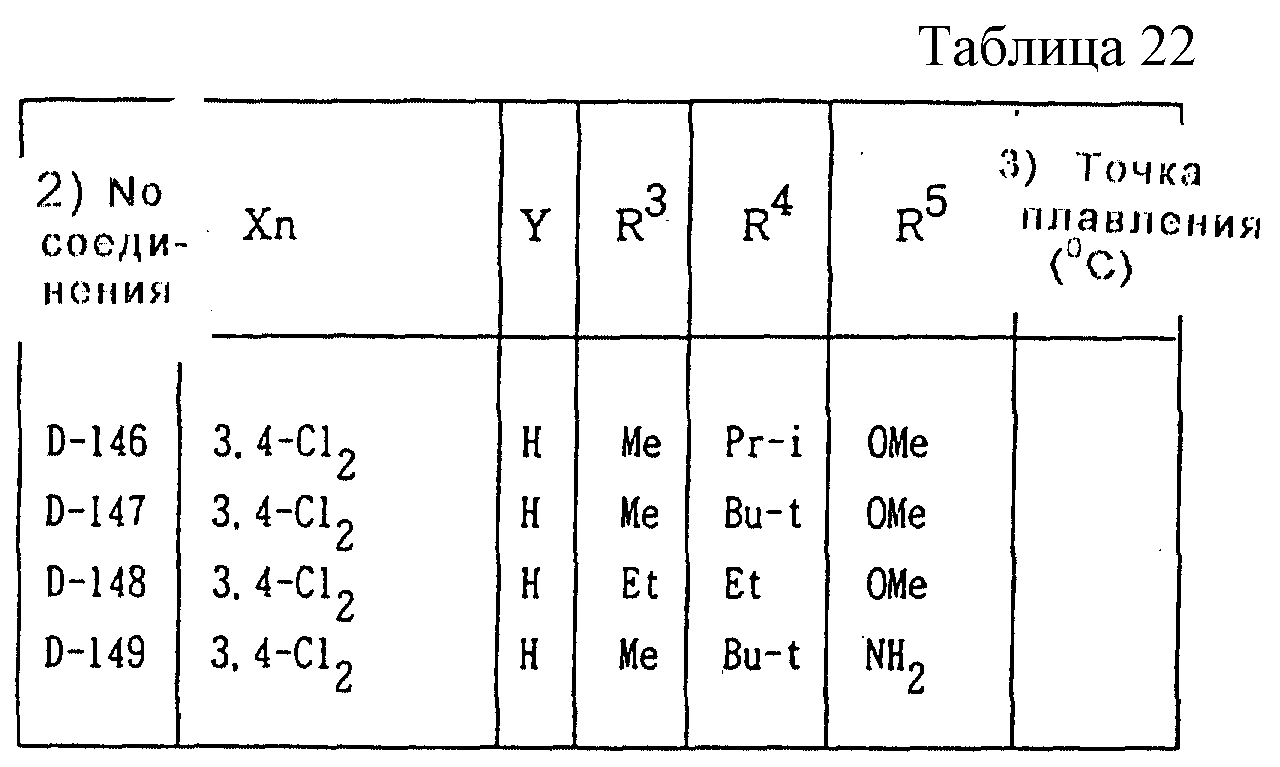
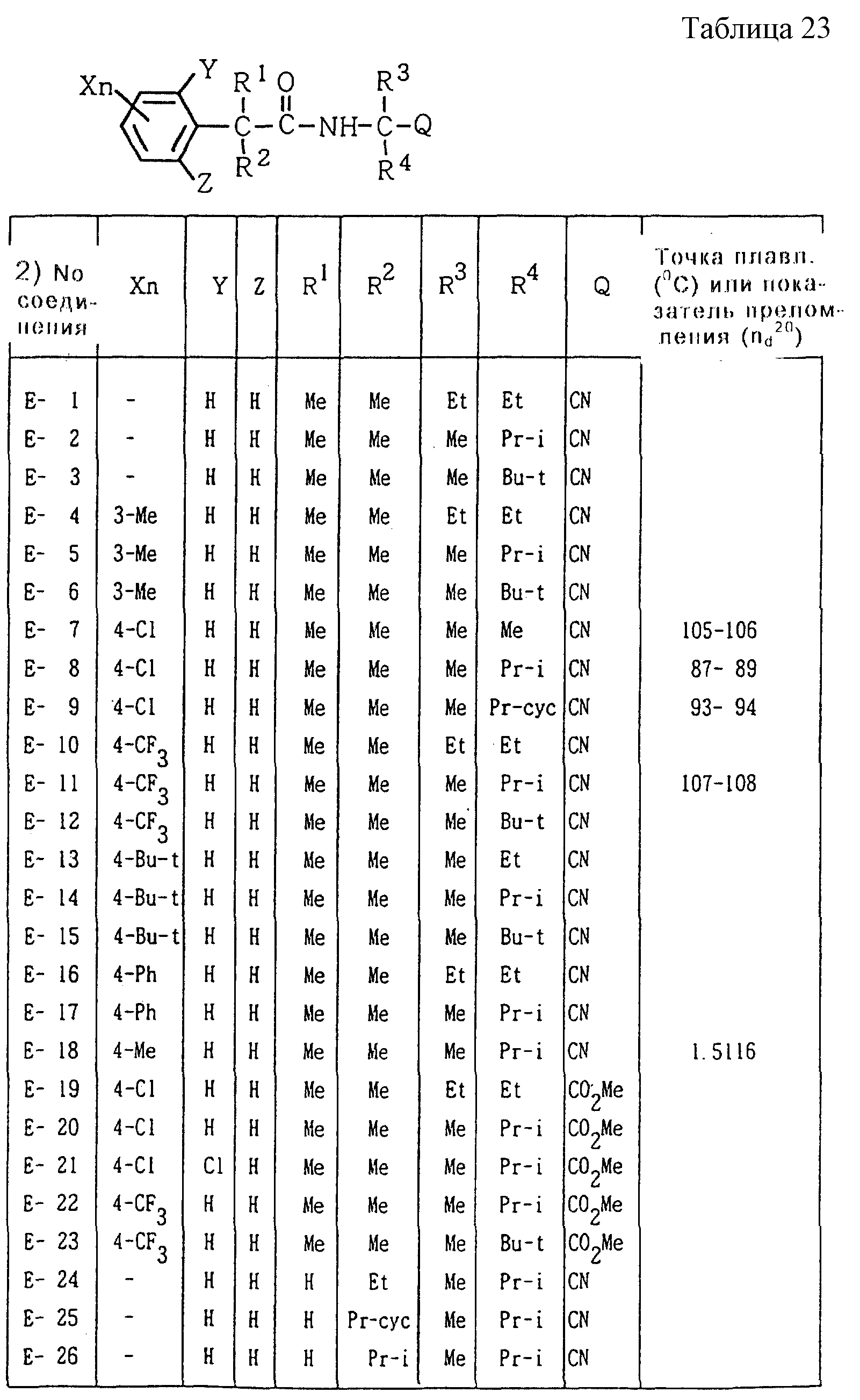
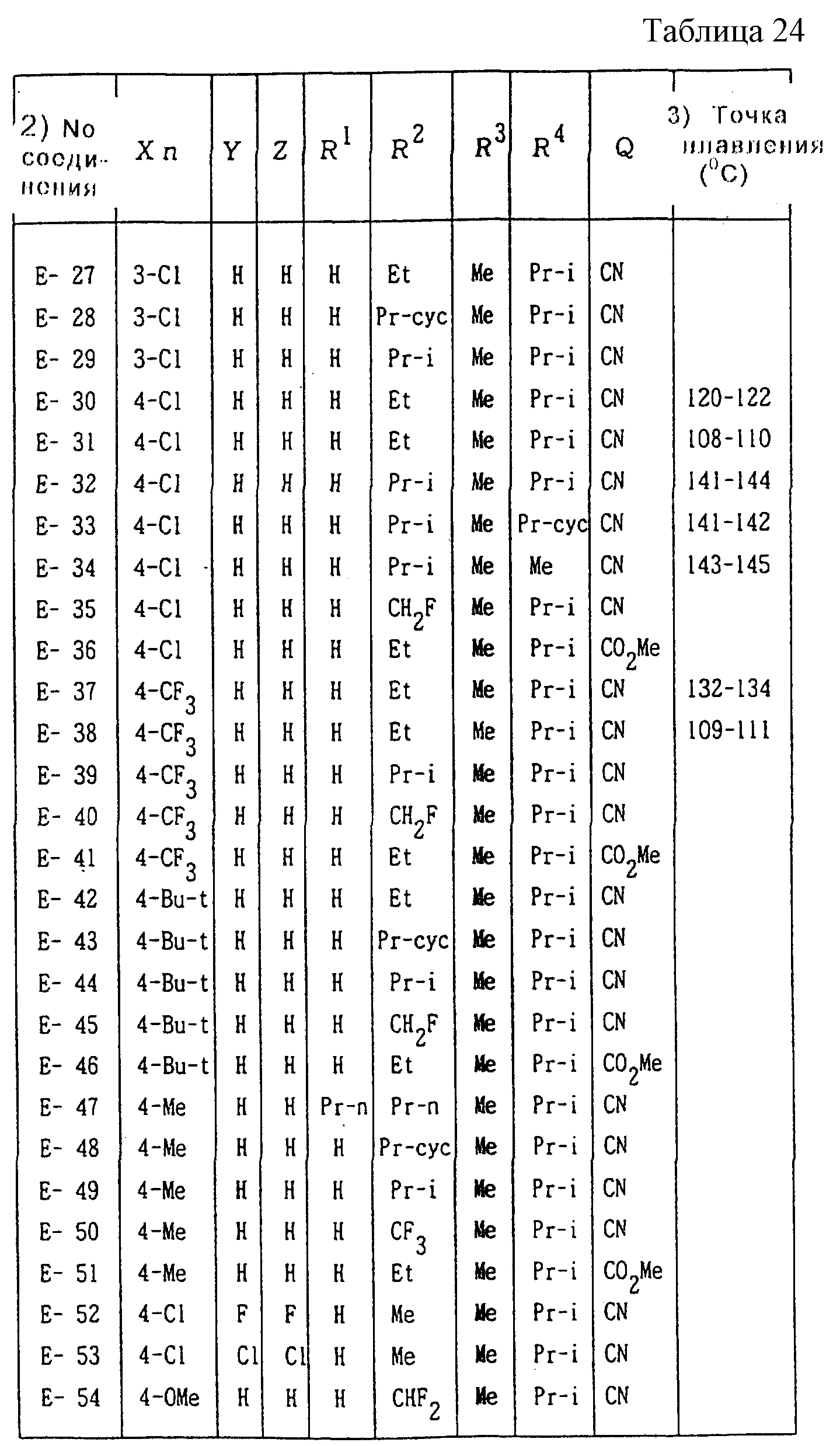
Далее представленные примеры соединений, представленных формулой (1) по настоящему изобретению, перечисляются в таблицах 1-24. Однако должно быть понятно, что настоящее изобретение не ограничивается этими соединениями. Номера соединений, данные в таблицах, будут указываться далее в описании.
В таблицах "Me" означает метильную группу,
"Et" обозначает этильную группу,
"Pr-n"
обозначает пропильную группу,
"Pr-i" обозначает изопропильную группу,
"Bu-n" обозначает н-бутильную группу,
"Bu-i" обозначает изобутильную группу,
"Bu-s" обозначает
втор-бутильную группу,
"Bu-t" обозначает трет-бутильную группу,
"Pr-cyc" обозначает циклопропильную группу,
"Pen-cyc" обозначает циклопентильную группу,
"Ph"
обозначает фенильную группу,
"4-OPh(2-Cl)" обозначает 4-(2-хлорфенил)оксигруппу,
"4-O(2-Py)" обозначает 4-(2-пиридил)оксигруппу,
"4-O(5-CF3,2-Py)" обозначает
4-(5-трифторметил-2-пиридил)- оксигруппу,
"4-O(3-Py)" обозначает 4-(3-пиридил)оксигруппу,
"4-O(4-Py)" обозначает 4-(4-пиридил)оксигруппу,
"4-SPh(2-Cl)" обозначает
4-(2-хлорфенил)тиогруппу,
"4-S(O)Ph(2-Cl)" обозначает 4-(2-хлорфенил)сульфинильную группу,
"4-SO2Ph(2-Cl)" обозначает 4-(2-хлорфенил)сульфонильную группу,
"4-S(2-Py)" обозначает 4-(2-пиридил)тиогруппу,
"4-Ph(4-CF3)" обозначает 4-(4-трифторметилфенильную) группу,
"4-(2-Py)" обозначает 4-(2-пиридильную) группу,
"4-(2-Fur)" обозначает 4-(2-фурильную) группу,
"4-(2-Thi)" обозначает 4-(2-тиенильную) группу,
"4-COPh(2-Ме)" обозначает 4-(2-метилбензоильную) группу,
"4-CO(3-Py)"
обозначает 4-(3-пиридил)карбонильную группу,
"4-CO(2-Fur)" обозначает 4-(2-фурил)карбонильную группу,
"4-CO(2-Thi)" обозначает 4-(2-тиенил)карбонильную группу,
"4-CH2Ph(3-Cl)" обозначает 4-(3-хлорбензильную) группу и
"4-(1-Pyrr)" обозначает 4-(1-пирролильную) группу.
Соединения NN C-42, C-43, C-196, C-197, C-198 и C-199 являются
оптически активными соединениями, имеющими углы вращения [α] = +32,7o (c = 0,5,
CHCl3), [α]
Соединения NN C-16, C-17, C-18, C-21, C-24, C-27, C-34, C-39, C-47, C-51, C-54, C-62, C-66, C-71, C-73, C-75, C-81, C-88, C-92, C-94, C-99, C-102, C-106, C-108, C-112, C-114, C-117, C-122, C-129, C-131, C-140, C-157, C-161, C-165, C-169, C-171, C-174, C-177, C-179, C-181, C- 184, C-187, C-189, C-193, C-196, C-198, C-200, D-40, D-63, D-91, D-119, E-30 и E-37 являются A-конфигурационными диастереомерами. Соединения NN C-19, C-22, C-25, C-28, C-35, C-40, C-48, C-52, C-55, C-63, C-67, C-72, C-74, C-76, C-82, C-89, C-93, C-95, C-100, C-103, C-107, C-109, C-113, C-115, C-118, C-123, C-130, C-141, C-158, C-162, C-166, C-170, C-172, C-175, C-178, C-180, C-182, C-185, C-188, C-190, C-194, C-197, C-199, C-201, D-41, D-64, D-92, D-120, E-31 и E-38 являются B-конфигурационными диастереомерами. Кроме того, другие соединения, имеющие два или более асимметричных атомов углерода, являются смесями диастереомеров.
"A-конфигурационный диастереомер" обозначает низкополярный диастереомер, выделенный колоночной хроматографией на силикагеле, высокоэффективной жидкостной хроматографией или подобным способом, тогда как "B-конфигурационный диастереомер" обозначает высокополярный диастереомер, выделенный таким же способом, как указано выше.
Соединения, представленные формулой (1), можно синтезировать в соответствии, например, со способами получения, показанными ниже.
Способ получения 1
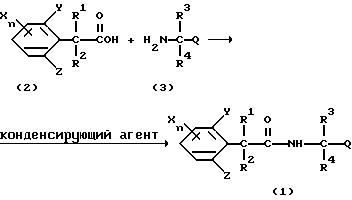
где R1, R2, R3, R4, X, Y, Z, Q и n имеют такие значения, как определено выше).
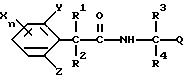
Соединения формулы (1) по настоящему изобретению можно получить реакцией производных фенилалкановых кислот, представленных формулой (2), и аминов, представленных формулой (3), с использованием конденсирующего агента в присутствии катализатора и/или основания, если необходимо.
Данную реакцию можно проводить в растворителе: этим растворителем может быть любой растворитель, который не препятствует реакции, например, углеводороды, такие как пентан, гексан, гептан, циклогексан, петролейный эфир, лигроин, бензол, толуол, ксилол и тому подобное, галогенированные углеводороды такие как метиленхлорид, дихлорэтан, хлороформ, тетрахлорид углерода, хлорбензол, дихлорбензол и тому подобные, простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, диметиловый эфир этиленгликоля, тетрагидрофуран, диоксан и тому подобные, кетоны, такие как ацетон, метилэтилкетон, метилизопропилкетон, метилизобутилкетон и тому подобные, сложные эфиры, такие как метилацетат, этилацетат и тому подобные, нитрилы, такие как ацетонитрил, пропионитрил и тому подобные, апротонные полярные растворители, такие как диметилсульфоксид, N,N-диметилформамид, сульфолан и тому подобные, и смеси растворителей, объединяющие растворители, выбранные из вышеупомянутых.
В качестве конденсирующего агента можно упомянуть гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида, N, N'-дициклогексилкарбодиимид, карбонилдиимидазол, хлорид 2-хлор-1,3-диметиламидазолия и т.п.
В качестве катализатора можно упомянуть, например, 4-диметиламинопиридин, 1-гидроксибензотриазол, диметилформамид и т.п.
Основанием может быть любой тип основания, обычно используемого в этом типе реакции. Можно упомянуть, например, гидроксиды щелочных металлов, такие как гидроксид натрия, гидроксид калия и тому подобное, гидроксиды щелочноземельных металлов, такие как гидроксид кальция и тому подобные, карбонаты щелочных металлов, такие как карбонат натрия, карбонат калия и тому подобные, органические основания, такие как триэтиламин, триметиламин, N,N-диметиланилин, пиридин, N-метилпиперидин, 1,5-диазабицикло/4.3.0/нон-5-ен (DBN), 1,8-диазабицикло/5.4.0/ундец-7-ен (DBU) и тому подобные, и амины, такие как триэтиламин, пиридин, N-метилпиперидин и тому подобные.
Данную реакцию проводят при температуре от -50 до 150oC, предпочтительно от 0 до 60oC. Время реакции предпочтительно находится в диапазоне от 1 до 30 часов.
Далее приводится объяснение способа синтеза каждого из исходных соединений.
Соединения, представленные формулой (2), можно синтезировать, например, гидролизом фенилмалонатов при помощи щелочи, нагреванием гидролизованного продукта и последующим декарбонилированием нагретого продукта. Этот способ получения описывается в Journal of Organic Chemistry, vol. 13, p. 763 (1948); Organic Syntheses, vol. 3, p. 557, 1955; заявке на патент Японии, первая публикация, N Sho 40-7491 и Synthesis, vol. 6, p. 456, 1982.
Кроме того, соединения, представленные формулой (3), можно синтезировать, например, с использованием кетона, цианида натрия и хлорида аммония в соответствии со способом Strecker, который описывается в Organic Synthesis, vol. 3, p. 88, 1955; Journal of Medicinal Chemistry, vol. 9, p. 911, 1966 Tetrahedron Letters, vol. 17, p. 1455, 1977.
Способ получения 2
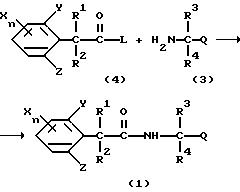
(где R1, R2, R3, R4, X, Y, Z, Q и n имеют такие значения, как определено выше, и L представляет атом галогена).
Соединения, представленные формулой (1) по настоящему изобретению, можно получить реакцией галогенангидридов фенилалкановых кислот, представленных формулой (4), и аминов, представленных формулой (3).
Данную реакцию можно проводить в растворителе: этим растворителем может быть любой растворитель, который не препятствует реакции, например углеводороды, такие как пентан, гексан, гептан, циклогексан, петролейный эфир, лигроин, бензол, толуол, ксилол и тому подобные, галогенированные углеводороды, такие как метиленхлорид, дихлорэтан, хлороформ, тетрахлорид углерода, хлорбензол, дихлорбензол и тому подобные, простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, диметиловый эфир этиленгликоля, тетрагидрофуран, диоксан и тому подобные, кетоны, такие как ацетон, метилэтилкетон, метилизопропилкетон, метилизобутилкетон и тому подобные, сложные эфиры, такие как метилацетат, этилацетат и тому подобные, нитрилы, такие как ацетонитрил, пропионитрил и тому подобные, апротонные полярные растворители, такие как диметилсульфоксид, N, N-диметилформамид, сульфолан и тому подобные, и смеси растворителей, объединяющие растворители, выбранные из вышеупомянутых.
Основанием может быть любой тип основания, обычно используемого в этом типе реакции. Можно упомянуть, например, гидроксиды щелочных металлов, такие как гидроксид натрия, гидроксид калия и тому подобные, гидроксиды щелочноземельных металлов, такие как гидроксид кальция и тому подобные, карбонаты щелочных металлов, такие как карбонат натрия, карбонат калия и тому подобные, органические основания, такие как триэтиламин, триметиламин, N,N-диметиланилин, пиридин, N-метилпиперидин, 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), 1,8-диазабицикло[5.4.0] ундец-7-ен (DBU) и тому подобные, и амины, такие как триэтиламин, пиридин, N-метилпиперидин и тому подобные.
Данную реакцию проводят при температуре от -50 до 150oC, предпочтительно от 0 до 60oC. Время реакции предпочтительно находится в диапазоне от 1 до 30 часов.
Далее дается объяснение способа получения исходных соединений, используемых в указанном способе.
Галогенангидриды фенилалкановых кислот, представленные формулой (4), можно получить реакцией фенилалкановых кислот, представленных формулой (2), полученных, например, вышеупомянутым способом, и галогенирующих агентов, таких как тионилхлорид, пентахлорид фосфора, трибромид фосфора или тому подобные.
Способ получения 3
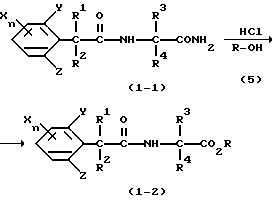
(где R1, R2, R3, R4, X, Y, Z и n имеют такие значения, как определено выше, и R представляет C1-C6 алкильную группу).
Соединения, представленные формулой (1-2) по настоящему изобретению, можно получить реакцией соединений, представленных формулой (1-1) настоящего изобретения, и спиртов, представленных формулой (5), которые насыщены хлоридом водорода.
Данную реакцию можно проводить в растворителе: этим растворителем может быть любой растворитель, который не препятствует реакции, например спирты, такие как метанол, этанол, пропанол, изопропанол, бутанол и тому подобные, углеводороды, такие как пентан, гексан, гептан, циклогексан, петролейный эфир, лигроин, бензол, толуол, ксилол и тому подобные, галогенированные углеводороды, такие как метиленхлорид, дихлорэтан, хлороформ, тетрахлорид углерода, хлорбензол, дихлорбензол и тому подобные, простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, диметиловый эфир этиленгликоля, тетрагидрофуран, диоксан и тому подобные и смеси растворителей, объединяющие растворители, выбранные из вышеупомянутых.
Данную реакцию проводят при температуре от -50 до 150oC, предпочтительно от 0 до 120oC. Время реакции предпочтительно находится в диапазоне от 1 до 20 часов.
Лучшие способы осуществления
настоящего изобретения
Ниже приводятся примеры получения соединений по настоящему изобретению.
Пример получения 1
Синтез N-(1-циано-1,
2-диметилпропил)-2-(4-бифенилил)ацетамида (соединение N A-87)
1,1 г (5,7 ммоль) гидрохлорида 1-этил-3-(3-диметиламинопропил) карбодиимида добавляют к раствору, содержащему 1,0 г (4,5 ммоль)
4-бифенилуксусной кислоты, растворенной в 50 мл метиленхлорида, при комнатной температуре и смесь перемешивают в течение 10 мин. Затем по каплям добавляют 0,5 г (4,7 ммоль) 2-амино-2,
3-диметилбутиронитрила и всю смесь перемешивают в течение 3 часов при комнатной температуре. После завершения реакции к получаемой смеси добавляют воду и слой метиленхлорида промывают водой и затем
сушат над безводным сульфатом магния. Метиленхлорид удаляют из органического слоя при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, таким образом получая 1,1 г (выход:
76%) целевого соединения, имеющего точку плавления 151-152oC.
Пример получения 2
Синтез N-(1-циано-1,2-диметилпропил)-2-(4-бромфенил)пропионамида (соединения NN
C-47 и C-48)
0,9 г (8,0 ммоль) 2-амино-2,3-диметилбутиронитрила и 0,8 г (7,9 ммоль) триэтиламина растворяют в 20 мл тетрагидрофурана. К этой смеси, которую перемешивают при 10oC, в
течение 5 минут по каплям добавляют 1,5 г (6,0 ммоль) 2-(4-бромфенил)пропионилхлорида. После окончания прикапывания реакционную смесь перемешивают в течение 5 часов при комнатной температуре.
Реакционную смесь концентрируют и затем к ней добавляют воду. Органический слой экстрагируют этилацетатом и затем сушат над безводным сульфатом магния. Этилацетат из органического слоя удаляют при
пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, таким образом получая 0,45 г (выход 24%) A-конфигурационного диастереомера (низкополярный продукт), имеющего точку
плавления 130-131oC и 0,75 г (выход 40%) B-конфигурационного диастереомера (высокополярный продукт), имеющего точку плавления 121-123oC.
Пример получения 3
Синтез N-(1-карбамоил-1-этилпропил)-2-(4-хлорфенил)пропионамида (соединение N D-32)
2,3 г (18 ммоль) 2-амино-2-этилбутиламида 2,0 г (20 ммоль) триэтиламина суспендируют в 50 мл
тетрагидрофурана. Тетрагидрофурановый раствор (10 мл), содержащий 3,0 г (15 ммоль) растворенного в нем 2-(4-хлорэтил)пропионилхлорида, добавляют по каплям в течение 10 минут в суспензию, которую
перемешивают при комнатной температуре. После окончания прикапывания реакционную смесь перемешивают в течение 3 часов при комнатной температуре. Реакционную смесь концентрируют и затем к ней добавляют
воду. Органический слой экстрагируют хлороформом и затем сушат над безводным сульфатом магния. Хлороформ удаляют из органического слоя при пониженном давлении. Полученные кристаллы промывают
диизопропиловым эфиром, таким образом получая 4,2 г (выход 95%) целевого продукта, имеющего точку плавления 116-118oC.
Пример получения 4
Синтез
метил-2-[1-(4-хлорфенил)этилкарбониламино] -2-этилбутирата (соединение N D-28)
0,6 г (2,0 ммоль) N-(1-карбамоил-1-этилпропил)-2-(4- хлорфенил)пропионамида растворяют в 10 мл насыщенного
хлоридом водорода метанола. Раствор кипятят с обратным холодильником в течение 3 часов. Реакционную смесь концентрируют и затем к ней добавляют воду. Органический слой экстрагируют этилацетатом и
затем сушат над безводным сульфатом магния. Этилацетат из органического слоя удаляют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, таким образом получая 0,5 г
(выход 81%) целевого продукта, имеющего точку плавления 98-99oC.
Пример получения 5
Синтез N-(1-циано-1-циклопропилэтил)-2-(4-хлорфенил)-2-метилпропионамида
(соединение N E-9)
0,25 г (2,3 ммоль) 2-амино-2-циклопропилпропионитрила и 0,3 г (3,0 ммоль) триэтиламина растворяют в 20 мл тетрагидрофурана. По каплям к смеси, которую перемешивают при
10oC, в течение 5 минут добавляют 0,5 г (2,3 ммоль) 2-(4-хлорфенил)-2-метилпропионилхлорида. После окончания прикапывают реакционную смесь перемешивают в течение 3 часа при комнатной
температуре. Реакционную смесь концентрируют и затем к ней добавляют воду. Органический слой экстрагируют этилацетатом и затем сушат над безводным сульфатом магния. Этилацетат из органического слоя
удаляют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, таким образом получая 0,5 г (выход 75%) целевого продукта, имеющего точку плавления 93-94oC.
Пример получения 6
Синтез изопропил-2-(4-трифторметилбензилкарбониламино)-2,3- диметилбутирата (соединение N B-36)
1,1 г (5,7 ммоль) гидрохлорида
1-этил-3-(3-диметиламинопропил) карбодиимида добавляют к раствору, содержащему 1,0 г (4,9 ммоль) 4-трифторметилфенилуксусной кислоты, растворенной в 50 мл метиленхлорида, при комнатной температуре, и
смесь затем перемешивают в течение 10 минут. К ней добавляют 0,9 г (5,2 ммоль) изопропил-2-амино-2,3-диметилбутирата и всю смесь перемешивают в течение 3 часов при комнатной температуре. После
завершения реакции к реакционной смеси добавляют воду. Слой метиленхлорида промывают водой и затем сушат над безводным сульфатом магния. Метиленхлорид удаляют при пониженном давлении. Остаток очищают
колоночной хроматографией на силикагеле, таким образом получая 1,4 г (выход 80%) целевого продукта, имеющего точку плавления 122-123oC.
Сельскохозяйственные и садовые фунгициды по настоящему изобретению включают в качестве активных ингредиентов производные фенилалканамидов, представленные формулой (1). В случае, когда соединения по настоящему изобретению используют в качестве сельскохозяйственных и садовых фунгицидов, эти соединения, действующие в качестве активных ингредиентов, можно приготовить в виде подходящей готовой препаративной формы, зависящей от цели использования. Активный ингредиент обычно разбавляют инертным жидким или твердым носителем и, если необходимо, к нему добавляют поверхностно-активное вещество и т.п. Смесь затем превращают известным способом в готовую препаративную форму, например, тонкоизмельченный порошок, смачивающийся порошок, эмульгирующийся концентрат, гранулы и т.п.
В качестве подходящих носителей, используемых в готовой препаративной форме, можно упомянуть твердые носители, такие как тальк, бентонит, глину, каолин, диатомовую землю, белую сажу, вермикулит, гашеную известь, кремниевый песок, сульфат аммония, мочевину или тому подобные, и жидкие носители, такие как изопропиловый спирт, ксилол, циклогексанон, метилнафталин и тому подобные. В качестве поверхностно-активных веществ и диспергаторов можно упомянуть динафтилметандисульфонат, сульфаты спиртов, алкиларилсульфонаты, лигнинсульфонаты, полиоксиэтиленгликолевые простые эфиры, полиоксиэтиленалкилариловые простые эфиры, моноалкилаты полиоксиэтиленсорбита и тому подобные. В качестве вспомогательных агентов можно упомянуть карбоксиметилцеллюлозу и тому подобные. Превращенный в готовую препаративную форму сельскохозяйственный или садовый фунгицид по настоящему изобретению можно развести до подходящей разбавленной концентрации или можно применять непосредственно.
Сельскохозяйственный или садовый фунгицид по настоящему изобретению можно использовать для разбрызгивания на стебли или листы, внесения в землю и применения погружением. Пропорцию активного ингредиента выбирают по потребности. Когда фунгицид превращают в форму мелкоизмельченного порошка или гранул, содержание активного ингредиента предпочтительно составляет от 0,1 до 20% по массе. Для эмульгирующегося концентрата или смачивающегося порошка активный ингредиент предпочтителен в количестве от 5 до 80% по массе.
Доза применения сельскохозяйственного или садового фунгицида по настоящему изобретению может изменяться в зависимости от типа соединений, типа вредителя или болезни, которую нужно подавить, природы вредителя или болезни, степени повреждения, условий окружающей среды, формы используемого препарата и тому подобное. Когда сельскохозяйственный или садовый фунгицид по настоящему изобретению применяют непосредственно в форме порошка или гранул, рекомендуется, чтобы доза применения активного ингредиента была подходящим образом выбрана в пределах диапазона от 0,1 до 5 кг на 10 ар, предпочтительно в диапазоне от 1 г до 1 кг на 10 ар. Кроме того, когда фунгицид настоящего изобретения находится в форме жидкости, такой как эмульгируемый концентрат или смачиваемый порошок, рекомендуется, чтобы доза применения активного ингредиента была подходящим образом выбрана в пределах диапазона от 0,1 ч./млн. до 10000 ч./млн., предпочтительно в диапазоне от 10 ч./млн. до 3000 ч./млн.
Сельскохозяйственный или садовый фунгицид по настоящему изобретению в упомянутой выше готовой препаративной форме может подавлять болезни растений, вызванные патогенными грибами Oomycetes, Ascomycetes, Deuteromycetes, Oomycetes и Basidiomycetes.
Ниже перечисляются примеры грибов, но они не ограничиваются этими грибами: Pyricularia, такие как грибы пирикуляриоза риса (Pyricularia oryzae), Sphaerotheca, такие как грибы настоящей мучнистой росы огурцов (Sphaerotheca fuliginea), Venturia, такие как грибы парши яблок (Ventura inaequalis), Gibberella, такие как грибы болезни "баканаэ" (Gibberella fujikuroi), Botrytis, такие как грибы серой гнили огурцов (Botrytis cinerea), Alternaria, такие как грибы черной пятнистости горчицы сарептской (Alternaria Brassicicola), Rhizoctonia, такие как грибы ризоктониоза риса (Rhizoctonia solani), Puccinia, такие как грибы ржавчины (Puccinia recondita), Pseudoperonospora, такие как грибы ложной мучнистой росы огурцов Pseudoperonospora cubensis).
Кроме того, соединения по настоящему изобретению можно использовать как таковые или в сочетании с другими фунгицидами, инсектицидами, гербицидами, модификаторами роста растений, удобрениями или тому подобным. Далее представительные готовые препаративные формы иллюстрируются со ссылкой на следующие примеры готовых препаративных форм, где все "%" представляют "проценты по массе".
Пример состава 1:
Тонкоизмельченный порошок
2% соединения N A-4, 5% диатомовой земли и 93% глины смешивают до образования однородной смеси и размалывают в тонкоизмельченный порошок.
Пример
состава 2: Смачивающийся порошок
50% соединения N B-6, 45% диатомовой земли, 2% динавтилметандисульфоната натрия и 3% лигнинсульфоната натрия смешивают до образования однородной смеси и
размалывают в смачивающийся порошок.
Пример состава 3: Эмульгирующийся концентрат
30% соединения N C-29, 20% циклогексанона, 11% полиоксиэтиленалкиларилового эфира, 4%
алкилбензолсульфоната кальция и 35% метилнафталина равномерно растворяют, таким образом получая эмульгирующийся концентрат.
Пример состава 4: Гранулы
5% соединения N B-34, 2%
натриевой соли сульфата лаурилового спирта, 5% лигнинсульфоната натрия, 2% карбоксиметилцеллюлозы и 86% глины смешивают и размалывают. К 100 частям по массе размолотой смеси добавляют 20 частей по
массе воды. Получаемую смесь разминают и превращают в гранулы размера от 14 до 32 меш. при помощи экструзионного гранулятора и затем сушат, получая целевые гранулы.
Далее дается объяснение эффектов, которые проявляют сельскохозяйственные или садовые фунгициды по настоящему изобретению, путем ссылки на примеры испытаний. В примерах испытаний в качестве сравнительного соединения используют соединение, описанное в заявке на патент Японии, первая публикация N Hei 6-220004.
Пример испытания 1
Испытание на профилактический эффект при
пирикуляриозе риса (Pyricularia oryzae)
Семена риса (сорт: Aichi Asahi) высевают при норме приблизительно по 15 зерен в каждый из фарфоровых горшков, имеющих диаметр 7 см. Семенам дают
прорасти и расти в течение 3-4 недель в теплице. Смачивающийся порошок, полученный в соответствии с примером 2 готовой препаративной формой, разбавляют водой до концентрации 500 м.д. активного
ингредиента и затем полученный водный препарат разбрызгивают, при норме 10 мл на горшок, на проростки риса на стадии 4-го листа. После сушки на воздухе проростки инокулируют суспензией конидиоспоры
грибов пирикуляриоза риса (Pyricularia oryzae) и сразу помещают во влажную камеру для выдерживания при 25oC в течение 24 часов и затем в теплицу. На пятый день после инокуляции подчитывают
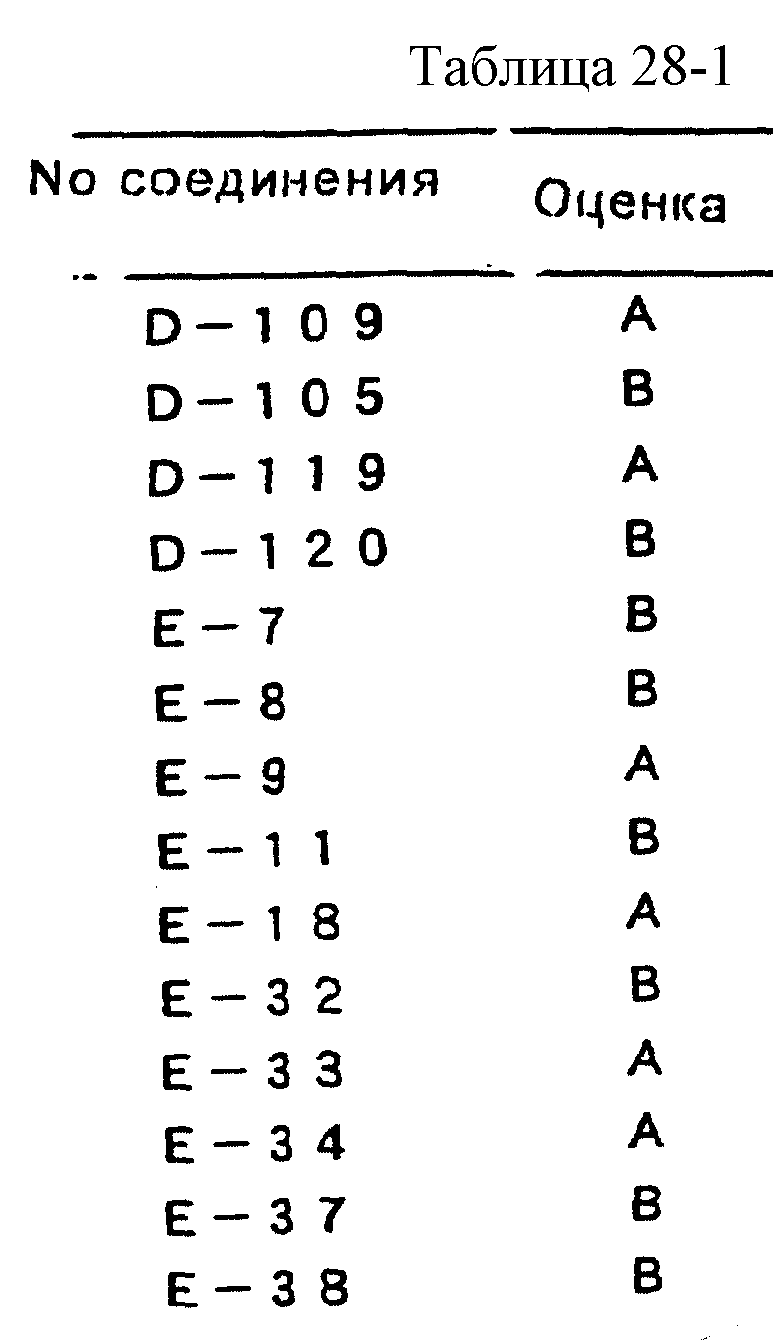
число повреждений на четвертом листе. Подавляющую активность вычисляют по уравнению 1. Результаты оценки, полученные в соответствии со стандартом оценки, показанном в таблице 25, приводятся в таблицах
26-28.
Уравнение 1

Пример 2 испытания
Испытание эффекта при пирикуляриозе риса (Pyricularia oryzae) при применении погружением.
Проростки риса (сорт: Aichi Asahi) на стадии 2-го листа высаживают 4 пятнами при норме 3 проростка на участок в белые фарфоровые емкости, имеющие диаметр 9 см. Проросткам дают развиваться и расти в теплице. Когда проростки вырастают до стадии 3-го листа, гранулы, полученные в соответствии с примером состава 4, вносят в поливную воду и горшок так, чтобы концентрация активного ингредиента была 300 г на 10 ар. Когда четвертый лист полностью разовьется, проростки инокулируют суспензией спор пирикуляриоза риса (Pyricularia oryzae) и сразу помещают во влажную камеру для выдерживания при 25oC в течение 24 часов и затем в теплицу так, чтобы индуцировать поражение болезнью. На пятый день после инокуляции подсчитывают число повреждений на четвертом листе. Подавляющую активность вычисляют по уравнению 1. Результаты оценки, полученные в соответствии со стандартом оценки, показанном в таблице 25, приводятся в таблице 29.
Пример испытания 3
Испытание на профилактическое влияние на яблоневую паршу (Yenturia inaequalis)
Семена яблок (сорт: Jonathan) высевают
при норме 4 зерна в пластиковые горшки, имеющие диаметр 5,5 см. Смачивающийся порошок, полученный в соответствии с примером состава 2, разбавляют водой до концентрации 50 ч./млн. активного ингредиента
и затем полученный водный препарат разбрызгивают, при норме 20 мл на горшок, на проростки яблок, у которых полностью развился настоящий четвертый лист. После сушки на воздухе проростки инокулируют
суспензией спор грибов парши яблок (Venturia inaequalis) и сразу помещают во влажную камеру для выдерживания при 20oC в течение 48 часов и затем в теплицу. На четырнадцатый день после
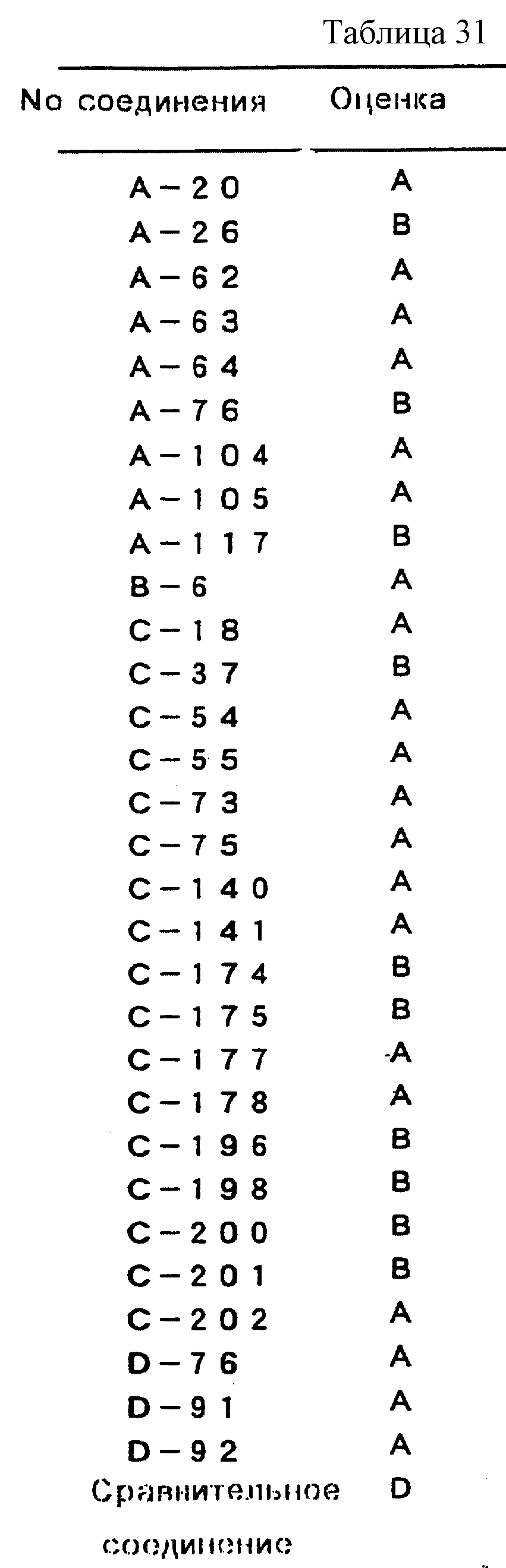
инокуляции осматривают инфицированную площадь на листьях. Индекс заболеваемости вычисляют в соответствии со стандартом оценки, показанным в таблице 30, с использованием индекса заболеваемости и числа
инфицированных листьев, степень повреждения вычисляют в соответствии с уравнением 2 и подавляющую активность вычисляют в соответствии с уравнением 3. Полученную подавляющую активность оценивают в
соответствии со стандартом оценки, показанным в таблице 25, результаты приводятся в таблице 31.
Уравнение (2):

Уравнение (3):

Пример получения 7
Синтез 2-(4-хлорфенил)-N-(1-изопропил-1-метил-2-оксопропил)ацетамида (соединение N B-15).
4-хлорфенилуксусную кислоту (1,0 г, 5,9 ммоль) растворяют в метиленхлориде (50 мл). К ней при комнатной температуре добавляют гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (1,5 г, 7,8 ммоль) и смесь перемешивают в течение 10 минут. К смеси добавляют 3-амино-3,4-диметил-2-пентанон (0, 8 г, 6,2 ммоль) и смесь перемешивают в течение 3 часов при комнатной температуре. После завершения реакции к реакционной смеси добавляют воду. Слой метиленхлорида промывают водой и сушат над безводным сульфатом магния. После этого метиленхлорид удаляют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, что, таким образом, дает в итоге 1,0 г (выход: 60%) целевого продукта, имеющего температуру плавления в диапазоне от 164 до 165oC.
Пример получения 8
Синтез N-(1-циано-1,2,2-триметилпропил)-2-(4-бромфенил)пропионамида
(соединение N C-51 и C-52).
2-амино-2,3,3-триметилбутиронитрил (1,3 г, 10,0 ммоль) и триэтиламин (1,2 г, 11,8 ммоль) растворяют в тетрагидрофуране (20 мл). Когда смесь перемешивают при 10oC, к ней по каплям в течение 5 минут добавляют хлорид 2-(4-бромфенил)пропионовой кислоты (1,5 г, 6,0 ммоль). После окончания прикапывания реакционную смесь перемешивают в течение 8 часов при комнатной температуре. Реакционную смесь концентрируют, к ней добавляют воду. Органический слой экстрагируют этилацетатом. После того как этилацетатный слой осушен над безводным сульфатом магния, этилацетат удаляют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, что, таким образом, дает в итоге 0,3 г (выход: 15%) диастереомера конфигурации A, имеющего температуру плавления в диапазоне от 143 до 144oC и 0,85 г (выход: 42%) диастереомера конфигурации B, имеющего температуру плавления в диапазоне от 150 до 152oC.
Пример получения 9
Синтез N-(1-циано-1,2-диметилпропил)-2-(4-трифторметоксифенил) пропионамида (соединения N C-122 и C-123).
2-амино-2,3-диметилбутиронитрил (0,6 г, 5,3 ммоль) и триэтиламин (0,5 г, 5,3 ммоль) растворяют в тетрагидрофуране (20 мл). Когда смесь перемешивают при 10oC, к ней по каплям в течение 5 минут добавляют хлорид 2-(4-трифторметоксифенил)пропионовой кислоты (1,1 г, 4,4 ммоль). После завершения прикапывания реакционную смесь перемешивают в течение 4 часов при комнатной температуре. Реакционную смесь концентрируют и к ней добавляют воду. Органический слой экстрагируют этилацетатом. После того как этилацетатный слой был осушен над безводным сульфатом магния, этилацетат удаляют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, что, таким образом, дало в итоге 0,35 г (выход: 25%) диастереомера конфигурации A (конфигурация с низкой полярностью), имеющего температуру плавления в диапазоне от 97 до 98oC, и 0,4 г (выход: 29%) диастереомера конфигурации B (конфигурация с высокой полярностью), имеющего температуру плавления в диапазоне от 122 до 124oC.
Пример получения 10
Синтез 2-(4-хлорфенил)-N-(1-изопропил-1-метил-2-оксопропил)пропионамида (соединение N D-25).
Гидрохлорид 3-амино-3, 4-лиметил-2-пентанона (1,3 г, 7,8 ммоль) и карбонат калия (2,6 г, 18,7 ммоль) растворяют в ацетонитриле (20 мл). При перемешивании смеси при 10oC к ней по каплям в течение 5 минут добавляют хлорид 2-(4-хлорфенил) пропионовой кислоты (1,7 г, 8,5 ммоль). После завершения прикапывания реакционную смесь перемешивают в течение 2 часов при комнатной температуре. Реакционную смесь концентрируют и после этого к ней добавляют воду. Органический слой экстрагируют этилацетатом. После того как этилацетатный слой был осушен над безводным сульфатом магния, этилацетат удаляют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, что, таким образом, дает в итоге 1,3 г (выход: 56%) целевого продукта, имеющего температуру плавления в диапазоне от 140 до 143oC.
Пример получения 11
Синтез N- (1-изопропил-1-метил-2-оксопропил)-2-(4-метилфенил)пропионамида (соединение N D-50).
Гидрохлорид 3-амино-3, 4-диметил-2-пентанона (1,0 г, 6,0 ммоль) и карбонат калия (2,1 г, 15,2 ммоль) растворяют в ацетонитриле (20 мл). Когда смесь перемешивают при 10oC, к ней по каплям в течение 5 минут добавляют хлорид 2-(4-метилфенил)пропионовой кислоты (1,2 г, 6,6 ммоль). После завершения прикапывания реакционную смесь перемешивают в течение 2 часов при комнатной температуре. Реакционную смесь концентрируют и после этого к ней добавляют воду. Органический слой экстрагируют этилацетатом. После того как этилацетатный слой был осушен над безводным сульфатом магния, этилацетат удаляют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, что, таким образом, дает в итоге 1,1 г (выход; 66%) целевого продукта, имеющего температуру плавления в диапазоне от 94 до 96oC.
Пример получения 12
Синтез N-(1-циано-1,2-диметилпропил)-2-(4-трифторметилфенил)пропионамида (соединение N C-94 и C-95).
2-амино-2, 3-диметилбутиронитрил (0,34 г, 3,0 ммоль) и триэтиламин (0,3 г, 3,0 ммоль) растворяют в тетрагидрофуране (30 мл). Когда смесь перемешивают при 10oC, к ней по каплям в течение 10 минут добавляют хлорид 2-(4-трифторметилфенил)пропионовой кислоты (0,7 г, 3,0 ммоль). После завершения прикапывания реакционную смесь перемешивают в течение 3 часов при комнатной температуре. Реакционную смесь концентрируют и после этого к ней добавляют воду. Органический слой экстрагируют этилацетатом. После того как этилацетатный слой был осушен над безводным сульфатом магния, этилацетат удаляют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, что, таким образом, дает в итоге 0,15 г (выход: 16%) диастереомера конфигурации A (конфигурация с низкой полярностью), имеющего температуру плавления в диапазоне от 121 до 124oC, и 0,3 г (выход: 32%) диастереомера конфигурации B (конфигурация с высокой полярностью), имеющего температуру плавления в диапазоне от 126 до 127oC.
Пример получения 13
Синтез 2-(4-хлорфенил)-N-(1-цианоциклопентил)пропионамида (соединение N C-30).
1-амино-1-циклопентанкарбонитрила (0,5 г, 5,0 ммоль) и триэтиламин (0,7 г, 7,0 ммоль) растворяют в тетрагидрофуране (30 мл). При перемешивании смеси при 10oC к ней по каплям в течение 10 минут добавляют хлорид 2-(4-хлорфенил)пропионовой кислоты (1,0 г, 5,0 ммоль). После завершения прикапывания реакционную смесь перемешивают в течение 7 часов при комнатной температуре. Реакционную смесь концентрируют и после этого к ней добавляют воду. Органический слой экстрагируют этилацетатом. После того как этилацетатный слой осушают над безводным сульфатом магния, этилацетат удаляют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, что, таким образом, дает в итоге 0,2 г (выход: 14%) целевого продукта, имеющего температуру плавления в диапазоне от 123 до 124oC.
Пример получения 14
Синтез 2-(3,4-дихлорфенил)-N-(1-циано-1,2-диметилпропил) пропионамида (соединение N C-169 и C-170).
2-амино-2, 3-диметилбутиронитрил (0,5 г, 4,6 ммоль) и триэтиламин (0,46 г, 4,6 ммоль) растворяют в тетрагидрофуране (30 мл). При перемешивании смеси при 10oC к ней по каплям в течение 5 минут добавляют хлорид 2-(3,4-дихлорфенил)пропионовой кислоты (1,1 г, 4,6 ммоль). После завершения прикапывания реакционную смесь перемешивают в течение 3 часов при комнатной температуре. Реакционную смесь концентрируют, после чего к ней добавляют воду. Органический слой экстрагируют этилацетатом. После того как этилацетатный слой был осушен над безводным сульфатом магния, этилацетат удаляют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, что, таким образом, дает в итоге 0,19 г (выход: 27%) диастереомера конфигурации A (конфигурация с низкой полярностью), имеющего температуру плавления в диапазоне от 100 до 102oC, и 0,21 г (выход: 29%) диастереомера конфигурации B (конфигурация с высокой полярностью), имеющего температуру плавления в диапазоне от 171 до 173oC.
Пример получения 15
Синтез N-(1-изопропил-1-метил-2-оксопропил)-2-(4- трифторметилфенил)пропионамида (соединение N D-97).
Гидрохлорид 3-амино-3,4-диметил-2-пентанона (1,3 г, 7,8 ммоль) и карбонат калия (2,6 г, 18,7 ммоль) растворяют в ацетонитриле (20 мл). Когда смесь перемешивают при 10oC, к ней по каплям в течение 5 минут добавляют хлорид 2-(4-трифторметилфенил)пропионовой кислоты (1,9 г, 8,1 ммоль). После завершения прикапывания реакционную смесь перемешивают в течение 2 часов при комнатной температуре. Реакционную смесь концентрируют и после этого к ней добавляют воду. Органический слой экстрагируют этилацетатом. После того как этилацетатный слой был осушен над безводным сульфатом магния, этилацетат удаляют при пониженном давлении. Остаток был очищен колоночной хроматографией на силикагеле, что, таким образом, дает в итоге 1,7 г (выход; 65%) целевого продукта, имеющего температуру плавления в диапазоне от 137 до 140oC.
Пример получения 16
Синтез 2-(4-хлорфенил)-N-(1-циано-1,2-диметилпропил)пропионамида (соединение N C-33).
2-амино-2,3-диметилбутиронитрил (2,6 г, 23,2 ммоль) и карбонат калия (3,3 г, 23,9 ммоль) растворяют в ацетонитриле (30 мл). Когда смесь перемешивают при 10oC, к ней по каплям в течение 10 минут добавляют хлорид 2-(4-хлорфенил)пропионовой кислоты (4,5 г, 22,2 ммоль). После завершения прикапывания реакционную смесь перемешивают в течение 6 часов при комнатной температуре. Реакционную смесь концентрируют и после этого к ней добавляют воду. Органический слой экстрагируют этилацетатом. После того как этилацетатный слой был осушен над безводным сульфатом магния, этилацетат удаляют при пониженном давлении. Остаток очищают жидкостной хроматографией высокого давления на колонке с силикагелем, что, таким образом, дает в итоге 4,6 г (выход: 75%) целевого продукта, имеющего температуру плавления в диапазоне от 102 до 106oC.
Пример получения 17
Синтез N-(1-циано-1,2-диметилпропил)-2-(3-феноксифенил)ацетамида (соединение N A-9).
3-феноксифенилуксусную кислоту (0,9 г, 5,0 ммоль) растворяют в хлороформе (50 мл). К ней при комнатной температуре добавляют гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (1,2 г, 6,3 ммоль)
и всю смесь перемешивают в течение 20 минут. К смеси добавляют 2-амино-2,3-диметилбутиронитрил (0,56 г, 5,0 ммоль) и реакционную смесь перемешивают в течение 8 часов при комнатной температуре. После
завершения реакции к реакционной смеси добавляют воду. Слой хлороформа промывают водой и сушат над безводным сульфатом магния. Хлороформ удаляют при пониженном давлении. Остаток очищают колоночной
хроматографией на силикагеле, что, таким образом, дает в итоге 1,2 г (выход: 72%) целевого продукта, имеющего температуру плавления в диапазоне от 136 до 137oC.
Пример
получения 18
Синтез N-(1-циано-1-дихлорметилэтил)-2-(4-хлорфенил)ацетамида (соединение N A-16).
4-хлорфенилуксусную кислоту (0,85 г, 5,0 ммоль) растворяют в хлороформе (50 мл). К ней при комнатной температуре добавляют гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (1,2 г, 6,3 ммоль), и всю смесь перемешивают в течение 20 минут. К смеси добавляют 2-амино-2-дихлорметилпропионитрила (0,77 г, 5,0 ммоль) и реакционную смесь перемешивают в течение 10 часов при комнатной температуре. После завершения реакции к реакционной смеси добавляют воду. Слой хлороформа промывают водой и осушают над безводным сульфатом магния. Хлороформ удаляют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, что, таким образом, дает в итоге 1,2 г (выход: 78%) целевого продукта, имеющего температуру плавления в диапазоне от 165 до 167oC.
Реферат
Описываются новые производные фенилалканамида, представленные формулой 1, где R1 означает атом водорода или С1-С6 алкильную группу, R2 означает атом водорода, С1-С6 алкильную группу, R3 и R4 каждый независимо представляет С1-С6 алкильную группу, С2-С6 циклоалкильную группу, С2-С6 алкоксильную группу или С1-С4 галогеналкильную группу или R3 и R4 вместе с атомом углерода, к которому они присоединены, образуют циклоалкильную группу 5-7-членного цикла, которая может быть замещена С1-С6 алкильной группой, Q представляет цианогруппу или группу формулы -COR5, где R5 означает гидроксигруппу, С1-С6 алкильную группу, С1-С6 алкоксигруппу, аминогруппу, С1-С6 алкиламиногруппу или С1-С6 диалкиламиногруппу, Х означает атом галогена, С1-С6 алкильную группу, С2-С6 алкинильную группу, С1-С4 галогеналкильную группу, гидроксигруппу, С1 -С6 алкоксигруппу, С3-С6 циклоалкоксигруппу, С1-С4 галогеналкоксигруппу, арилоксигруппу, гетероарилоксигруппу, выбранную из пиридилокси и тиенилокси, С1-С6 алкилтиогруппу, С1-С6 алкилсульфинильную группу, С1-С6 алкилсульфонильную группу, аминогруппу, С1-С6 алкиламиногруппу, С1-С6 диалкиламиногруппу, нитрогруппу, циано, арильную группу, гетероарильную группу, выбранную из пиридила или пирролила, алкилкарбонильную группу, арилкарбонильную группу, тиенилкарбонильную группу, каждый из Е и Z независимо представляет атом водорода или атом галогена, n равно целому числу 0-3, исключая случай, когда R3 и R4 представляют трифторметильную группу одновременно, и при условии, что, когда R1 и R2 оба представляют водород, оба Y и Z представляют атом водорода и n представляет целое число 1-3. Соединения формулы 1 проявляют превосходящую фунгицидную активность по сравнению с обычными фунгицидами по отношению к перикуляриозу риса и подобным заболеваниям и в то же время не мешают росту желательных растений. Описывается способ их получения и с/х или садовые фунгициды на основе указанных соединений. 4 с. и 4 з.п. ф-лы, 32 табл.
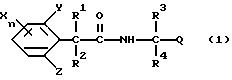
Формула
где R1 означает атом водорода или C1-C6 алкильную группу;
R2 означает атом водорода, C1-C6 алкильную группу;
R3 и R4 каждый независимо представляет C1-C6 алкильную группу, C2-C6 алкенильную группу, C3-C6 циклоалкильную группу, C2-C6 алкоксильную группу или C1-C4 галогеналкильную группу или R3 и R4 вместе с атомом углерода, к которому они присоединены, образуют циклоалкильную группу 5-7 членного цикла, которая может быть замещена C1-C6 алкильной группой;
Q представляет цианогруппу или группу формулы -COR5, где R5 означает гидроксигруппу, C1-C6 алкильную группу, C1-C6 алкоксигруппу, аминогруппу, C1-C6 алкиламиногруппу или C1-C6 диалкиламиногруппу;
Х означает атом галогена, C1-C6 алкильную группу, C2-C6 алкенильную группу, C2-C6 алкинильную группу, C1-C4 галогеналкильную группу, гидроксигруппу, C1-C6 алкоксигруппу, C3-C6 циклоалкоксигруппу, C1-C4 галогеналкоксигруппу, арилоксигруппу, гетероарилоксигруппу, выбранную из пиридилокси и тиенилокси, C1-C6 алкилтиогруппу, C1-C6 алкилсульфинильную группу, C1-C6 алкилсульфонильную группу, аминогруппу, C1-C6 алкиламиногруппу, C1-C6 диалкиламиногруппу, нитрогруппу, циано, арильную группу, гетероарильную группу, выбранную из пиридила или пирролила, алкилкарбонильную группу, арилкарбонильную группу, тиенилкарбонильную группу;
каждый из Y и Z независимо представляет атом водорода или атом галогена;
n равно целому числу 0-3, исключая случай, когда R3 и R4 представляют трифторметильную группу одновременно, и при условии, что когда R1 и R2 оба представляют водород, оба Y и Z представляют атом водорода и n представляет целое число 1-3.
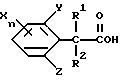
где R1, R2, Х, Y, Z, и n имеют такие значения, как определено в п.1,
с производным амина, представленным формулой 3
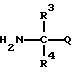
где R3, R4 и Q имеют такие же значения, как определено в п.1.
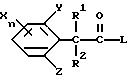
где R1, R2, Х, Y, Z, и n имеют такие значения, как определено в п.1;
L представляет атом галогена,
с производным амина, представленным формулой 3
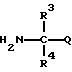
где R3, R4 и Q имеют такие значения, как определено в п.1.

Комментарии