Противогельминтные депсипептидные соединения - RU2707298C2
Код документа: RU2707298C2
Описание
Область техники, к которой относится изобретение
Настоящее изобретение касается новых противогельминтных депсипептидных соединений с улучшенной активностью против эндопаразитов и эктопаразитов. Настоящее изобретение касается также композиций, содержащих указанные соединения, способов и применения указанных соединений для избавления, борьбы и предотвращения заражения паразитами и/или паразитных инфекций у животных. Соединения по настоящему изобретению можно вводить животным, в частности млекопитающим, рыбам и птицам, для предотвращения или лечения паразитных инфекций.
Предшествующий уровень техники
Животные, такие как млекопитающие и птицы, часто подвержены заражению паразитами. Эти паразиты могут представлять собой эктопаразиты, такие как блохи и клещи. Животные и люди страдают также от эндопаразитических инфекций, включая, например, гельминтоз, который чаще всего вызывается группой паразитических червей, называемых нематодами или круглыми червями. Эти паразиты являются причиной больших экономических потерь в свиноводстве, овцеводстве, коневодстве и разведении крупного рогатого скота, а также поражают животных-компаньонов (например, кошек и собак), и в птицеводстве. Другие паразиты включают обитающих в желудочно-кишечном тракте животных и людей, включая Ancylostoma, Necator, Ascaris, Strongyloides, Trichinella, Capillaria, Toxocara, Toxascaris, Trichuris, Enterobius, и паразитов, которые встречаются в крови или других тканях и органах, таких как филярийные черви и внекишечные стадии Strongyloides, Toxocara и Trichinella.
Одним типом эндопаразитов, который серьезно вредит млекопитающим, является Dirofilaria immitis, известный также как сердечный гельминт. Другие филярийные эндопаразиты включают Dirofilaria repens и Dirofilaria honkongensis, которые заражают также людей. Наиболее частыми хозяевами являются кошки и собаки, но могут подвергаться заражению также другие млекопитающие, такие как хорьки и еноты. Сердечный гельминт проходит несколько жизненных стадий перед тем как стать взрослым, заражающим легочную артерию гостя-млекопитающего. Червям требуется комар в качестве промежуточного хозяина для завершения своего жизненного цикла. Период между изначальным заражением, когда собаку кусает комар, и превращением червей во взрослых особей, живущих в сердце и легочных артериях, составляет от шести до семи месяцев у собак и известен как «препатентный период». L3 личинки мигрируют во время сосания комаром крови в кончик ротового аппарата комара (лабиум), покидают комара и остаются на коже собаки, где они затем мигрируют в хозяина через ранку от укуса. Большинство L3 личинок переходят в личинок четвертой стадии (L4) в подкожных тканях собаки в течение 1-3 дней после заражения. Затем они мигрируют в мышцы груди и брюшной полости, и через 45-60 дней после заражения переходят в пятую стадию (L5, незрелая взрослая особь). Примерно через 75-20 дней после заражения, эти незрелые сердечные гельминты затем попадают в кровоток и проходят через сердце, задерживаясь в легочной артерии. Примерно через семь месяцев после заражения, взрослые особи Dirofilaria immitis достигают зрелости и приступают к половому размножению в легочных артериях и правом желудочке. Взрослые самцы имеют длину около 15см, а самки около 25см, и их нормальная продолжительность жизни во взрослом состоянии составляет около 5 лет.
Заражение сердечными гельминтами представляет собой тяжелое и угрожающее жизни заболевание. Инфицирование сердечными гельминтами собак можно предотвратить, и профилактическое лечение является приоритетом в областях, эндемичных по заболеванию сердечными гельминтами. Лечение инфекции зрелых сердечных гельминтов препаратами, убивающими взрослых гельминтов (например, меларсомина дигидрохлорид) является дорогостоящим и может вызвать серьезные побочные эффекты, поэтому широко применяется предотвращение заражения посредством ежемесячного введения лекарств, прерывающих развитие личинок. Целью доступных методов терапии сердечных гельминтов у собак является предотвращение развития паразита во взрослых червей путем прерывания жизненного цикла Dirofilaria immitis после заражения.
Макроциклические лактоны (МЛ, например, ивермектин, эприномектин, милбемицин оксим, моксидектин и селамектин) представляют собой наиболее широко используемые средства химиопрофилактики и вводятся ежемесячно или каждые шесть месяцев. Эти лекарственные средства эффективны против инвазионных личинок третьей стадии (L3) Dirofilaria immitis, распространяемых комарами, а также против взрослеющих личинок четвертой стадии (L4). При ежемесячном введении, МЛ убивают L3 и L4 личинок, попавших в организм в течение предыдущих 30 дней, и таким образом предотвращают заболевание, вызываемое взрослыми червями. МЛ можно также применять ежемесячно у инфицированных собак для подавления размножения взрослых червей и удаления микрофилярий, тем самым уменьшая передачу и постепенно избавляя от взрослых червей (Vet. Parasitol. 2005 Oct 24 133(2-3) 197-206).
В последние годы сообщается об увеличивающемся числе случаев отсутствия эффективности (LOE), при которых у собак развивается инфекция зрелых сердечных гельминтов, несмотря на ежемесячное введение профилактических доз лекарственных средств, представляющих собой макроциклические лактоны. Например, Atkins с соавторами (Vet. Parasitol. 206 (2014) 106-113) недавно сообщали об увеличивающемся числе случаев собак, у которых наблюдалась положительная реакция на антиген сердечных гельминтов при получении профилактической терапии против сердечных гельминтов, что говорит о том, что некоторые популяции Dirofilaria immitis выработали селективную устойчивость к профилактическим средствам против сердечных гельминтов (American Heartworm Society, 2010. Heartworm Preventive Resistance. Is it Possible, vol. 37. Bulletin of the American Heartworm Society, pp. 5.). Таким образом, существует насущная потребность в разработке новых противогельминтных средств с улучшенной активностью против Dirofilaria immitis и других эндопаразитов.
Существуют различные паразитицидные средства для лечения инфекций эндопаразитов у животных. Помимо макроциклических лактонов, известны циклические депсипептиды с антипаразитической активностью. Было обнаружено, что PF1022A, 24-членный циклооктадепсипептид, выделенный из гриба Mycelia sterilia группой Sasaki с соавторами (см. J. Antibiotics 45: 692-697 (1992)), демонстрирует широкий спектр противогельминтной активности против различных эндопаразитов in vivo при низкой токсичности. Эти соединения описаны, например, в патентах США 5,514,773; 5,747,448; 5,646,244; 5,874,530; среди прочих, которые включены в настоящий текст посредством ссылки. Эмодепсид представляет собой полусинтетический аналог PF1022A, содержащий морфолиновую группу в параположении арильного цикла в фениллактатных группах. Эмодепсид представляет собой сильное противогельминтное средство, применяемое в комбинации с празиквантелом в продукте Profender® для лечения паразитических червей у кошек и собак. Однако, антипаразитическая активность PF1022А и эмодепсида недостаточна для лечения от некоторых паразитов, в особенности для борьбы с Dirofilaria immitis у млекопитающих для предотвращения развития заболевания сердечными гельминтами. Таким образом, имеется потребность в более эффективных антипаразитических средствах для лечения и защиты животных, например млекопитающих, рыб и птиц, от паразитов, в частности от внутренних паразитов, включая нематод и филярийных червей, таких как сердечные гельминты.
Следует отметить, что цитирование или упоминание какого-либо документа в настоящей заявке не является признанием того, что такой документ является частью предшествующего уровня техники для настоящего изобретения. Все предшествующие заявки и все документы, процитированные в них или во время их рассмотрения («процитированные в заявках документы»), и все документы, процитированные или упомянутые в процитированных в заявках документах, и все документы, процитированные или упомянутые в настоящем тексте («процитированные в настоящем тексте документы»), и все документы, процитированные или упомянутые в процитированных в настоящем тексте документах, вместе со всеми инструкциями производителей, описаниями, спецификациями продуктов и технологическими картами продуктов для всех упомянутых в настоящем тексте продуктов, или в любом документе, включенном в настоящий текст посредством ссылки, включены в настоящий текст посредством ссылки и могут использоваться в практической реализации настоящего изобретения.
Краткое описание изобретения
В настоящем изобретении описаны новые и инновационные циклические депсипептидные соединения с улучшенной противогельминтной активностью, а также обладающие повышенной активностью в отношении эктопаразитов. Кроме того, в настоящем изобретении описаны композиции, содержащие новые депсипептидные соединения, и способы их применения в лечении и профилактике паразитных инфекций и заражения животных паразитами, с применением указанных соединений.
В одном варианте осуществления, в настоящем изобретении описаны циклические депсипептидные соединения, имеющие изображенную ниже формулу (I):

или их ветеринарно приемлемая соль, где значения переменных R1, R2, R3, R4, Cy1, Cy2, Ra, Rb, R’, R’’, R’’’ и R’’’’ соответствуют приведенным ниже. В настоящем изобретении описаны также ветеринарные композиции, содержащие указанные инновационные соединения или их соли, в комбинации с фармацевтически приемлемым носителем или разбавителем.
Соединения по настоящему изобретению охватывают рацемические смеси, отдельные стереоизомеры и таутомерные формы указанного соединения. Другим аспектом настоящего изобретения является солевая форма соединения по настоящему изобретению.
Указанные инновационные соединения и композиции, содержащие указанные соединения, обладают высокой эффективностью в лечении и профилактике внутренних паразитов у млекопитающих, рыб и птиц, и, в частности, у кошек, собак, лошадей, цыплят, свиней и крупного рогатого скота, с конечной целью избавить указанных хозяев от всех эндопаразитов, обычно встречающихся у млекопитающих, рыб и птиц.
В одном варианте осуществления, соединения и композиции по настоящему изобретению обладают высокой эффективностью против эндопаразитов, таких как филярии (например, сердечный гельминт), анкилостомы, власоглавы и круглые черви пищеварительного тракта животных и людей. В некоторых вариантах осуществления, соединения и композиции по настоящему изобретению эффективны против Dirofilaria immitis (сердечный гельминт), который менее чувствителен к лечению макроциклическими лактонами. В другом варианте осуществления, новые и инновационные депсипептиды по настоящему изобретению эффективны для лечения и предотвращения инфицирования животных круглыми червями, которые менее чувствительны к лечению коммерчески доступными или известными макроциклическими лактонами.
В некоторых вариантах осуществления, в настоящем изобретении описаны композиции, содержащие комбинацию нового депсипептида по настоящему изобретению в комбинации с по меньшей мере одним вторым действующим веществом, которое расширяет спектр защиты животных от эндопаразитов и, возможно, также эктопаразитов.
Настоящее изобретение касается также способов лечения и предотвращения паразитной инфекции или заражения у животного, включающих введение млекопитающему по меньшей мере одного из соединений, имеющих формулу (I) по настоящему изобретению. Также в настоящее изобретение входит применение указанных соединений для лечения и/или предотвращения паразитных инфекций и заражений животных, и применение указанных соединений для изготовления лекарственного средства для лечения и/или предотвращения паразитных инфекций у животного.
Задачей настоящего изобретения является не включать в настоящее изобретение любые ранее известные продукты, способы изготовления таких продуктов или способы применения таких продуктов, так что Заявитель сохраняет права на настоящее изобретение и заявляет отсутствие притязаний на любой ранее известный продукт, процесс или способ.
Следует отметить, что в настоящем описании, и в частности в формуле изобретения и/или абзацах, такие термины как «содержит», «содержащий» и т.п. имеют значение, указанное для них в патентном законодательстве США; например, они могут означать «включает», «включающий» и т.п.; и что такие термины как «состоящий главным образом из» и «состоит главным образом из» имеют значение, указанное для них в патентном законодательстве США, например они допускают наличие элементов, не указанных явным образом, но исключают элементы, известные в предшествующем уровне техники или которые влияют на основные или новые отличительные черты настоящего изобретения. Эти и другие варианты осуществления раскрыты или являются очевидными из приведенного далее подробного описания, и охватываются им.
Подробное описание изобретения
В настоящем изобретении описаны новые и инновационные циклические депсипептидные соединения, имеющие формулу (I), обладающие паразитицидным действием против эндопаразитов и также против эктопаразитов в некоторых вариантах осуществления, или их ветеринарно приемлемые соли, и композиции, содержащие соединения или их соли, для лечения или предотвращения паразитных инфекций и/или заражений у животного. Также описаны способы для лечения или предотвращения заражений и/или инфекций паразитами у животных, включающие введение млекопитающему эффективного количества депсипептидного соединения по настоящему изобретению или его соли.
Новые и инновационные циклические депсипептиды, имеющие описанную в настоящем тексте формулу (I), и их ветеринарно приемлемые соли особенно эффективны для борьбы с эндопаразитами. Эндопаразиты включают (но не ограничиваются только ими) нематоды (такие как круглые черви, анкилостомы и власоглавы) и филярийные черви, такие как Dirofilaria immitis (сердечный гельминт). В некоторых вариантах осуществления, было обнаружено, что новые циклические депсипептиды по настоящему изобретению имеют значительно более высокую эффективность против эндопаразитов, по сравнению с известными циклическими депсипептидами, включая PF1022A и эмодепсид. Кроме того, было обнаружено, что новые циклические депсипептиды по настоящему изобретению значительно более устойчивы к метаболической модификации в теле животных, так что они могут поддерживать высокую концентрацию в теле животного-хозяина и высокий уровень активности против внутренних паразитов в течение более длительного периода времени.
В одном варианте осуществления, было обнаружено, что циклические депсипептиды по настоящему изобретению высоко эффективны против филярийных червей, таких как Dirofilaria immitis (микрофилярийные и личиночные стадии), включая изоляты паразитов, резистентные к макроциклическим лактонам. В других вариантах осуществления, соединения по настоящему изобретению эффективны против эндопаразитов, для борьбы с которыми недостаточно эффективны известные циклические депсипептиды, такие как PF1022A и эмодепсид.
В другом варианте осуществления, было обнаружено, что циклические депсипептиды по настоящему изобретению обладают активностью против эктопаразитов, таких как блохи и клещи. Так, в некоторых вариантах осуществления циклические депсипептиды могут иметь эндектоцидную активность как против внутренних, так и против внешних паразитов.
Настоящее изобретение включает по меньшей мере следующие отличительные черты:
(a) В одном варианте осуществления, в настоящем изобретении описаны новые циклические депсипептидные соединения, имеющие формулу (I), или их фармацевтически или ветеринарно приемлемые соли, которые активны против эндопаразитов, и в некоторых случаях также против эктопаразитов;
(b) ветеринарные композиции, содержащие паразитицидно эффективное количество циклических депсипептидных соединений, имеющих формулу (I), или их фармацевтически или ветеринарно приемлемой соли, в комбинации с фармацевтически или ветеринарно приемлемым носителем или разбавителем;
(c) ветеринарные композиции, содержащие паразитицидно эффективное количество циклических депсипептидных соединений по настоящему изобретению, или их фармацевтически или ветеринарно приемлемых солей, в комбинации с еще одним другим действующим веществом и фармацевтически или ветеринарно приемлемым носителем или разбавителем;
(d) описаны способы лечения заражений/инфекций паразитами в организме животного или на его покровах, включающие введение паразитицидно эффективного количества циклического депсипептидного соединения, имеющего формулу (I), или его фармацевтически или ветеринарно приемлемых солей, необязательно с одним или больше дополнительными действующими веществами, нуждающемуся в этом млекопитающему;
(e) способы предотвращения заражений/инфекций паразитами у животного, которые включают введение паразитицидно эффективного количества циклического депсипептидного соединения, имеющего формулу (I), или его фармацевтически или ветеринарно приемлемых солей, необязательно с одним или больше дополнительными действующими веществами, нуждающемуся в этом млекопитающему;
(f) применение циклических депсипептидных соединений, имеющих формулу (I), или их фармацевтически или ветеринарно приемлемых солей, для лечения или предотвращения паразитных инфекций и, возможно, заражения паразитами у животного;
(g) применение циклических депсипептидных соединений, имеющих формулу (I), или их фармацевтически или ветеринарно приемлемых солей, в производстве ветеринарного лекарственного средства для лечения или предотвращения паразитных инфекций у животного; и
(h) способы получения соединений, имеющих формулу (I).
Определения
Применяемые в настоящем тексте термины имеют общепринятое в данной области значение, если не указано иное. Органические фрагменты, указанные в определениях переменных, присутствующих в циклически депсипептидах, имеющих формулу (I), являются - как термин «галоген» - собирательными терминами для списков отдельных членов групп - в случае «галогена» это фтор, хлор, бром и иод. Приставка Cn-Cm в каждом случае указывает возможное число атомов углерода в группе.
Термин “алкил” относится к насыщенным линейным, разветвленным, первичным, вторичным или третичным углеводородам, включая углеводороды, содержащие от 1 до 12 атомов. В некоторых вариантах осуществления, алкильные группы включают C1-C10, C1-C8, C1-C6, C1-C4 или C1-C3 алкильные группы. Примеры C1-C10 алкилов включают (но не ограничиваются только ими) метил, этил, пропил, 1-метилэтил, бутил, 1-метилпропил, 2-метилпропил, 1,1-диметилэтил, пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, 2,2-диметилпропил, 1-этилпропил, гексил, 1,1-диметилпропил, 1,2-диметилпропил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 1,1-диметилбутил, 1,2-диметилбутил, 1,3-диметилбутил, 2,2-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, 1-этилбутил, 2-этилбутил, 1,1,2-триметилпропил, 1,2,2-триметилпропил, 1-этил-1-метилпропил, 1-этил-2-метилпропил, гептил, октил, 2-этилгексил, нонил и децил, и их изомеры. C1-C4-алкил означает, например, метил, этил, пропил, 1-метилэтил, бутил, 1-метилпропил, 2-метилпропил или 1,1-диметилэтил.
Циклические алкильные группы, именуемые также “циклоалкил”, включают группы с 3-10 атомами углерода, содержащие один или несколько конденсированных циклов. Неограничивающие примеры циклоалкильных групп включают адамантил, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил и т.п.
Карбоциклические группы представляют собой циклические группы, состоящие исключительно из атомов углерода. Карбоциклические группы включают и ароматические циклы, такие как фенил, и неароматические циклы, такие как циклогексил, и включают циклы, содержащие от 3 до 14 атомов углерода, содержащие одно или несколько конденсированных колец.
Описанные в настоящем документе алкильные, циклоалкильные и карбоциклические группы могут быть незамещенными или замещены одним или более фрагментами, выбранными из группы, состоящей из алкила, галогена, галогеналкила, гидроксила, карбоксила, ацила, ацилокси-группу, амино-группу, алкил- или диалкиламино-группу, амидо, ариламино-группу, алкокси-группу, арилокси-группу, нитро, циано, азидо, тиола, имино, сульфокислоты, сульфата, сульфонила, сульфанила, сульфинила, сульфамоила, сложного эфира, фосфонила, фосфинила, фосфорила, фосфина, тиосложного эфира, тиопростого эфира, галогенангидрида, ангидрида, оксима, гидразина, карбамата, фосфоновой кислоты, фосфата, фосфоната или любой другой возможной функциональной группы, которая не подавляет биологическую активность соединений по настоящему изобретению, в незащищенном или при необходимости защищенном виде, как известно квалифицированным специалистам в данной области техники, например, как описано в книге Greene, et al., Protective Groups in Organic Synthesis, John Wiley и Sons, Third Edition, 1999, включенной в настоящий документ посредством ссылки.
Термин «алкенил» относится к линейным и разветвленным углеродным цепям, содержащим по меньшей мере одну углерод-углеродную двойную связь. В некоторых вариантах осуществления, алкенильные группы могут включать C2-C12 алкенильные группы. В других вариантах осуществления, «алкенил» включает C2-C10, C2-C8, C2-C6 или C2-C4 алкенильные группы. В одном варианте алкенила, число двойных связей составляет 1-3, в другом варианте алкенила число двойных связей равно одному. Другие количества двойных связей углерод-углерод и атомов углерода также входят в определение данного термина, в зависимости от расположения алкенильного фрагмента в молекуле. “C2-C10-алкенильные” группы могут содержать больше одной двойной связи в цепи. Примеры включают (но не ограничиваются только ими) этенил, 1-пропенил, 2-пропенил, 1-метил-этенил, 1-бутенил, 2-бутенил, 3-бутенил, 1-метил-1-пропенил, 2-метил-1-пропенил, 1-метил-2-пропенил, 2-метил-2-пропенил; 1-пентенил, 2-пентенил, 3-пентенил, 4-пентенил, 1-метил-1-бутенил, 2-метил-1-бутенил, 3-метил-1-бутенил, 1-метил-2-бутенил, 2-метил-2-бутенил, 3-метил-2-бутенил, 1-метил-3-бутенил, 2-метил-3-бутенил, 3-метил-3-бутенил, 1,1-диметил-2-пропенил, 1,2-диметил-1-пропенил, 1,2-диметил-2-пропенил, 1-этил-1-пропенил, 1-этил-2-пропенил, 1-гексенил, 2-гексенил, 3-гексенил, 4-гексенил, 5-гексенил, 1-метил-1-пентенил, 2-метил-1-пентенил, 3-метил-1-пентенил, 4-метил-1-пентенил, 1-метил-2-пентенил, 2-метил-2-пентенил, 3-метил-2-пентенил, 4-метил-2-пентенил, 1-метил-3-пентенил, 2-метил-3-пентенил, 3-метил-3-пентенил, 4-метил-3-пентенил, 1-метил-4-пентенил, 2-метил-4-пентенил, 3-метил-4-пентенил, 4-метил-4-пентенил, 1,1-диметил-2-бутенил, 1,1-диметил-3-бутенил, 1,2-диметил-1-бутенил, 1,2-диметил-2-бутенил, 1,2-диметил-3-бутенил, 1,3-диметил-1-бутенил, 1,3-диметил-2-бутенил, 1,3-диметил-3-бутенил, 2,2-диметил-3-бутенил, 2,3-диметил-1-бутенил, 2,3-диметил-2-бутенил, 2,3-диметил-3-бутенил, 3,3-диметил-1-бутенил, 3,3-диметил-2-бутенил, 1-этил-1-бутенил, 1-этил-2-бутенил, 1-этил-3-бутенил, 2-этил-1-бутенил, 2-этил-2-бутенил, 2-этил-3-бутенил, 1,1,2-триметил-2-пропенил, 1-этил-1-метил-2-пропенил, 1-этил-2-метил-1-пропенил и 1-этил-2-метил-2-пропенил.
Термин “циклоалкенил” означает одновалентные циклические алкенильные группы, содержащие от 4 до 10 атомов углерода, предпочтительно от 5 до 8 атомов углерода, имеющие одно или несколько конденсированных циклов, которые могут быть или не быть циклоалкенильными, при условии, что точкой присоединения к остальной части молекулы является атом циклоалкенильного кольца. Примеры циклоалкенильных групп включают, например, циклопентен-4-ил, циклооктен-5-ил и т.п.. Алкенильные и циклоалкенильные группы могут быть незамещенными или могут быть замещены одним или больше заместителями, описанными выше для алкила.
Термин «алкинил» относится к линейным и разветвленным углеродным цепям, содержащим по меньшей мере одну углерод-углеродную тройную связь. В одном варианте алкинила, число тройных связей составляет 1-3; в другом варианте алкинила число тройных связей равно одному. В некоторых вариантах осуществления, алкинильные группы включают C2-C12 алкинильные группы. В других вариантах осуществления, алкинильные группы могут включать C2-C10, C2-C8, C2-C6 или C2-C4 алкинильные группы. Другие количества тройных связей углерод-углерод и атомов углерода также входят в определение данного термина, в зависимости от расположения алкинильного фрагмента в молекуле. “C2-C10-алкинил” при использовании в настоящем тексте относится к линейным или разветвленным ненасыщенным углеводородным группам, содержащим от 2 до 10 атомов углерода и содержащим по меньшей мере одну тройную связь, таким как этинил, проп-1-ин-1-ил, проп-2-ин-1-ил, н-бут-1-ин-1-ил, н-бут-1-ин-3-ил, н-бут-1-ин-4-ил, н-бут-2-ин-1-ил, н-пент-1-ин-1-ил, н-пент-1-ин-3-ил, н-пент-1-ин-4-ил, н-пент-1-ин-5-ил, н-пент-2-ин-1-ил, н-пент-2-ин-4-ил, н-пент-2-ин-5-ил, 3-метилбут-1-ин-3-ил, 3-метилбут-1-ин-4-ил, н-гекс-1-ин-1-ил, н-гекс-1-ин-3-ил, н-гекс-1-ин-4-ил, н-гекс-1-ин-5-ил, н-гекс-1-ин-6-ил, н-гекс-2-ин-1-ил, н-гекс-2-ин-4-ил, н-гекс-2-ин-5-ил, н-гекс-2-ин-6-ил, н-гекс-3-ин-1-ил, н-гекс-3-ин-2-ил, 3-метилпент-1-ин-1-ил, 3-метилпент-1-ин-3-ил, 3-метилпент-1-ин-4-ил, 3-метилпент-1-ин-5-ил, 4-метилпент-1-ин-1-ил, 4-метилпент-2-ин-4-ил или 4-метилпент-2-ин-5-ил и т.п.
Термин “галогеналкил” относится к алкильной группе, определение которой дано в настоящем тексте, которая замещена одним или больше атомами галогена. Например, C1-C4-галогеналкил включает (но не ограничивается только ими) хлорметил, бромметил, дихлорметил, трихлорметил, фторметил, дифторметил, трифторметил, хлорфторметил, дихлорфторметил, хлордифторметил, 1-хлорэтил, 1-бромэтил, 1-фторэтил, 2-фторэтил, 2,2-дифторэтил, 2,2,2-трифторэтил, 2-хлор-2-фторэтил, 2-хлор-2,2-дифторэтил, 2,2-дихлор-2-фторэтил, 2,2,2-трихлорэтил, пентафторэтил и т.п.
Термин "фторалкил" при использовании в настоящем тексте означает алкил, в котором один или больше атомов углерода заменены на атомы фтора, например дифторметил, трифторметил, 1-фторэтил, 2-фторэтил, 2,2-дифторэтил, 2,2,2-трифторэтил, 1,1,2,2-тетрафторэтил или пентафторэтил.
Термин “галогеналкенил” относится к алкенильной группе, определение которой дано в настоящем тексте, которая замещена одним или больше атомами галогена.
Термин “галогеналкинил” относится к алкинильной группе, определение которой дано в настоящем тексте, которая замещена одним или больше атомами галогена.
Термин “алкокси” относится к группе алкил-O-, где алкил имеет указанное выше значение. Аналогично, термины “алкенилокси”, “алкинилокси”, “галогеналкокси”, “галогеналкенилокси”, “галогеналкинилокси”, “циклоалкокси”, “циклоалкенилокси”, “галогенциклоалкокси” и “галогенциклоалкенилокси” относятся к группам алкенил-O-, алкинил-O-, галогеналкил-O-, галогеналкенил-O-, галогеналкинил-O-, циклоалкил-O-, циклоалкенил-O-, галогенциклоалкил-O- и галогенциклоалкенил-O-, соответственно, где алкенил, алкинил, галогеналкил, галогеналкенил, галогеналкинил, циклоалкил, циклоалкенил, галогенциклоалкил и галогенциклоалкенил имеют указанные выше значения. Примеры C1-C6-алкокси включают (но не ограничиваются только ими) метокси, этокси, OCH2-C2H5, OCH(CH3)2, н-бутокси, OCH(CH3)-C2H5, OCH2-CH(CH3)2, OC(CH3)3, н-пентокси, 1-метилбутокси, 2-метилбутокси, 3-метилбутокси, 1,1-диметилпропокси, 1,2-диметилпропокси, 2,2-диметил-пропокси, 1-этилпропокси, н-гексокси, 1-метилпентокси, 2-метилпентокси, 3-метилпентокси, 4-метилпентокси, 1,1-диметилбутокси, 1,2-диметилбутокси, 1,3-диметилбутокси, 2,2-диметилбутокси, 2,3-диметилбутокси, 3,3-диметилбутокси, 1-этилбутокси, 2-этилбутокси, 1,1,2-триметилпропокси, 1,2,2-триметилпропокси, 1-этил-1-метилпропокси, 1-этил-2-метилпропокси и т.п..
Термин “арил” относится к одновалентной карбоциклической группе, содержащей от 6 до 14 атомов углерода, имеющей один цикл или несколько конденсированных циклов. Арильные группы включают (но не ограничиваются только ими) фенил, бифенил и нафтил. В некоторых вариантах осуществления, арил включает тетрагидронафтил, фенилциклопропил и инданил. Арильные группы могут быть незамещенными или быть замещены одним или более заместителями, выбранными из следующих: атом галогена, циано-группа, нитро-группа, гидрокси-группа, меркапто-группа, амино-группа, алкил, алкенил, алкинил, циклоалкил, циклоалкенил, галогеналкил, галогеналкенил, галогеналкинил, галогенциклоалкил, галогенциклоалкенил, алкокси-группа, алкенилокси-группа, алкинилокси-группа, галогеналкокси-группа, галогеналкенилокси-группа, галогеналкинилокси-группа, циклоалкокси-группа, циклоалкенилокси-группа, галогенциклоалкокси-группа, галогенциклоалкенилокси-группа, алкилтио-группа, галогеналкилтио-группа, циклоалкилтио-группа, галогенциклоалкилтио-группа, алкилсульфинил, алкенилсульфинил, алкинил-сульфинил, галогеналкилсульфинил, галогеналкенилсульфинил, галогеналкинилсульфинил, алкилсульфонил, алкенилсульфонил, алкинилсульфонил, галогеналкил-сульфонил, галогеналкенилсульфонил, галогеналкинилсульфонил, -SF5, алкиламино-группа, алкениламино-группа, алкиниламино-группа, ди(алкил)амино-группа, ди(алкенил)-амино-группа, ди(алкинил)амино-группа или триалкилсилил.
Термин “аралкил” относится к арильной группе, которая связана с остальной частью соединения через дирадикальный алкиленовый мостик, (-CH2-)n, где n равно 1-12 и где “арил” имеет указанное выше значение.
Термин «Гетероарил» относится к одновалентной ароматической группе, содержащей 1 - 15 атомов углерода, предпочтительно от 1 до 10 атомов углерода, содержащей один или более гетероатомов кислорода, азота и серы в цикле, предпочтительно 1 - 4 гетероатома или 1 - 3 гетероатома. Гетероатомы азота и серы опционально могут быть окислены. Такие гетероарильные группы могут иметь один цикл (например, пиридил или фурил) или несколько конденсированных циклов, при условии, что точка присоединения находится на атоме гетероарильного цикла. Предпочтительные гетероарилы включают пиридил, пиридазинил, пиримидинил, пиразинил, триазинил, пирролил, индолил, хинолинил, изохинолинил, хиназолинил, хиноксалиннил, фуранил, тиофенил, фурил, пирролил, имидазолил, оксазолил, изоксазолил, изотиазолил, пиразолил, бензофуранил, бензотиофенил, имидазопиридил, имидазопиримидил или пирролопиримидил. Гетероарильные циклы могут быть незамещенными или замещены одним или более фрагментами, определенными выше для термина «арил».
Термины «Гетероциклил», «гетероциклический» или «гетероцикло» относится к полностью насыщенным или ненасыщенным циклическим группам, например, 3-7-членным моноциклическим, 7-11-членным бициклическим или 10-15-членным трициклическим системам, которые могут содержать по меньшей мере один гетероатом в цикле, содержащем по меньшей мере один атом углерода. Каждый цикл гетероциклической группы, содержащий гетероатом, может содержать 1, 2, 3 или 4 гетероатома, выбранных из атомов азота, атомов кислорода и/или атомов серы, где гетероатомы азота и серы опционально могут быть окислены, и гетероатомы азота опционально могут быть кватернизованы. Гетероциклическая группа может быть присоединена по любому гетероатому или атому углерода в цикле или в циклической системе, и может быть незамещенной или замещенной одним или больше заместителями, как описано выше для арильных групп.
Примеры моноциклических гетероциклических групп включают (но не ограничиваются только ими) азиридинил, азетидинил, оксетанил, пирролидинил, пирролил, пиразолил, оксетанил, пиразолинил, имидазолил, имидазолинил, имидазолидинил, оксазолил, оксазолидинил, изоксазолинил, изоксазолил, тиазолил, тиадиазолил, тиазолидинил, изотиазолил, изотиазолидинил, фурил, тетрагидрофурил, тиенил, оксадиазолил, пиперидинил, пиперазинил, 2-оксопиперазинил, 2-оксопиперидинил, 2-оксопирролидинил, 2-оксоазепинил, азепинил, 4-пиперидонил, пиридинил, пиразинил, пиримидинил, пиридазинил, тетрагидропиранил, морфолинил, тиаморфолинил, тиаморфолинил сульфоксид, тиаморфолинил сульфон, 1,3-диоксолан и тетрагидро-1,1-диоксотиенил, триазолил, триазинил и т.п.
Примеры бициклических гетероциклических групп включают (но не ограничиваются только ими) индолил, бензотиазолил, бензоксазолил, бензодиоксолил, бензотиенил, хинуклидинил, хинолинил, тетрагидроизохинолинил, изохинолинил, бензимидазолил, бензопиранил, индолизинил, бензофурил, хромонил, кумаринил, бензопиранил, циннолинил, хиноксалинил, индазолил, пирролопиридил, фуропиридинил (такой как фуро[2,3-c]пиридинил, фуро[3,2-b]пиридинил] или фуро[2,3-b]пиридинил), дигидроизоиндолил, дигидрохиназолинил (такой как 3,4-дигидро-4-оксо-хиназолинил), тетрагидрохинолинил и т.п.
Термин “алкилтио” относится к группе алкил-S-, где алкил имеет указанное выше значение. В некоторых вариантах осуществления, алкильный компонент алкилтио-группы включает C1-C10, C1-C8, C1-C6 C1-C4 или C1-C3 алкильные группы. Например, C1-C4-алкилтио-группа включает (но не ограничивается только ими) метилтио-группу, этилтио-группу, пропилтио-группу, 1-метилэтилтио-группу, бутилтио-группу, 1-метилпропилтио-группу, 2-метилпропилтио-группу или 1,1-диметилэтилтио-группу.
Аналогично, термины “галогеналкилтио”, “циклоалкилтио”, “галогенциклоалкилтио” относятся к группам -S-галогеналкил, -S-циклоалкил и -S-галогенциклоалкил, соответственно, где термины “галогеналкил”, “циклоалкил” и “галогенциклоалкил” имеют указанные выше значения.
Термин “алкилсульфинил" означает группу алкил-S(=O)-, где “алкил” имеет указанное выше значение. В некоторых вариантах осуществления, алкильный компонент алкилсульфинильных групп включает C1-C12, C1-C10, C1-C8, C1-C6, C1-C4 или C1-C3 алкильные группы. Примеры включают (но не ограничиваются только ими) -SO-CH3, -SO-C2H5, н-пропилсульфинил, 1-метилэтилсульфинил, н-бутилсульфинил, 1-метилпропилсульфинил, 2-метилпропилсульфинил, 1,1-диметилэтилсульфинил, н-пентилсульфинил, 1-метилбутилсульфинил, 2-метилбутилсульфинил, 3-метилбутилсульфинил, 1,1-диметилпропилсульфинил, 1,2-диметилпропилсульфинил, 2,2-диметилпропилсульфинил, 1-этилпропилсульфинил, н-гексилсульфинил, 1-метилпентилсульфинил, 2-метилпентилсульфинил, 3-метилпентилсульфинил, 4-метилпентилсульфинил, 1,1-диметилбутилсульфинил, 1,2-диметилбутилсульфинил, 1,3-диметилбутилсульфинил, 2,2-диметилбутилсульфинил, 2,3-диметилбутилсульфинил, 3,3-диметилбутилсульфинил, 1-этилбутилсульфинил, 2-этилбутилсульфинил, 1,1,2-триметилпропилсульфинил, 1,2,2-триметилпропилсульфинил, 1-этил-1-метилпропилсульфинил или 1-этил-2-метилпропилсульфинил.
Аналогично, термины “алкенилсульфинил”, “алкинилсульфинил”, “галогеналкилсульфинил”, “галогеналкенилсульфинил” и “галогеналкинилсульфинил” относятся к группам алкенил-S(=O)-, алкинил-S(=O)- и галогеналкил-S(=O)-, галогеналкенил-S(=O)- и галогеналкинил-S(=O)-, где термины “алкенил”, “алкинил”, “галогеналкил”, “галогеналкенил” и “галогеналкинил” имеют указанные выше значения.
Термин "алкилсульфонил" означает группу алкил-S(=O)2-, где термин “алкил” имеет указанное выше значение. В некоторых вариантах осуществления, алкильный компонент в алкилсульфонильных группах включает C1-C12, C1-C10, C1-C8, C1-C6 или C1-C4 алкильные группы. Примеры включают (но не ограничиваются только ими) -SO2-CH3, -SO2-C2H5, н-пропилсульфонил, -SO2-CH(CH3)2, н-бутилсульфонил, 1-метилпропилсульфонил, 2-метилпропилсульфонил, -SO2-C(CH3)3, н-пентилсульфонил, 1-метилбутилсульфонил, 2-метилбутилсульфонил, 3-метилбутилсульфонил, 1,1-диметилпропилсульфонил, 1,2-диметилпропилсульфонил, 2,2-диметилпропилсульфонил, 1-этилпропилсульфонил, н-гексилсульфонил, 1-метилпентилсульфонил, 2-метилпентилсульфонил, 3-метилпентилсульфонил, 4-метилпентилсульфонил, 1,1-диметилбутилсульфонил, 1,2-диметилбутилсульфонил, 1,3-диметилбутилсульфонил, 2,2-диметилбутилсульфонил, 2,3-диметилбутилсульфонил, 3,3-диметилбутилсульфонил, 1-этилбутилсульфонил, 2-этилбутилсульфонил, 1,1,2-триметилпропилсульфонил, 1,2,2-триметилпропилсульфонил, 1-этил-1-метилпропилсульфонил или 1-этил-2-метилпропилсульфонил и т.п.
Термины “алкенилсульфонил”, “алкинилсульфонил”, “галогеналкилсульфонил”, “галогеналкенилсульфонил” и “галогеналкинилсульфонил” относятся к группам алкенил-S(=O)2-, алкинил-S(=O)2- и галогеналкил-S(=O)2-, галогеналкенил-S(=O)2- и галогеналкинил-S(=O)2-, где термины “алкенил”, “алкинил”, “галогеналкил”, “галогеналкенил” и “галогеналкинил” имеют указанные выше значения.
Термины “алкиламино-группа”, “диалкиламино-группа”, “алкениламино-группа”, “алкиниламино-группа”, “ди(алкенил)амино-группа” и “ди(алкинил)амино-группа” относятся к группам -NH(алкил), -N(алкил)2, -NH(алкенил), -NH(алкинил), -N(алкенил)2 и -N(алкинил)2, где термины “алкил”, “алкенил” и “алкинил” имеют указанные выше значения. В некоторых вариантах осуществления, алкильный компонент в алкиламино-группах или диалкиламино-группах включают C1-C12, C1-C10, C1-C8, C1-C6 или C1-C4 алкильные группы.
Соединения по настоящему изобретению:
Соединения по настоящему изобретению представляют собой 24-членные циклические депсипептидные соединения, которые обладают высокой активностью против эндопаразитов, таких как нематоды и филярийные черви (микрофилярийные и личиночные стадии), а также в некоторых случаях против эктопаразитов, таких как блохи и клещи. В одном варианте осуществления, в настоящем изобретении описаны циклические депсипептидные соединения, имеющие формулу (I), или их фармацевтически или ветеринарно приемлемые соли:
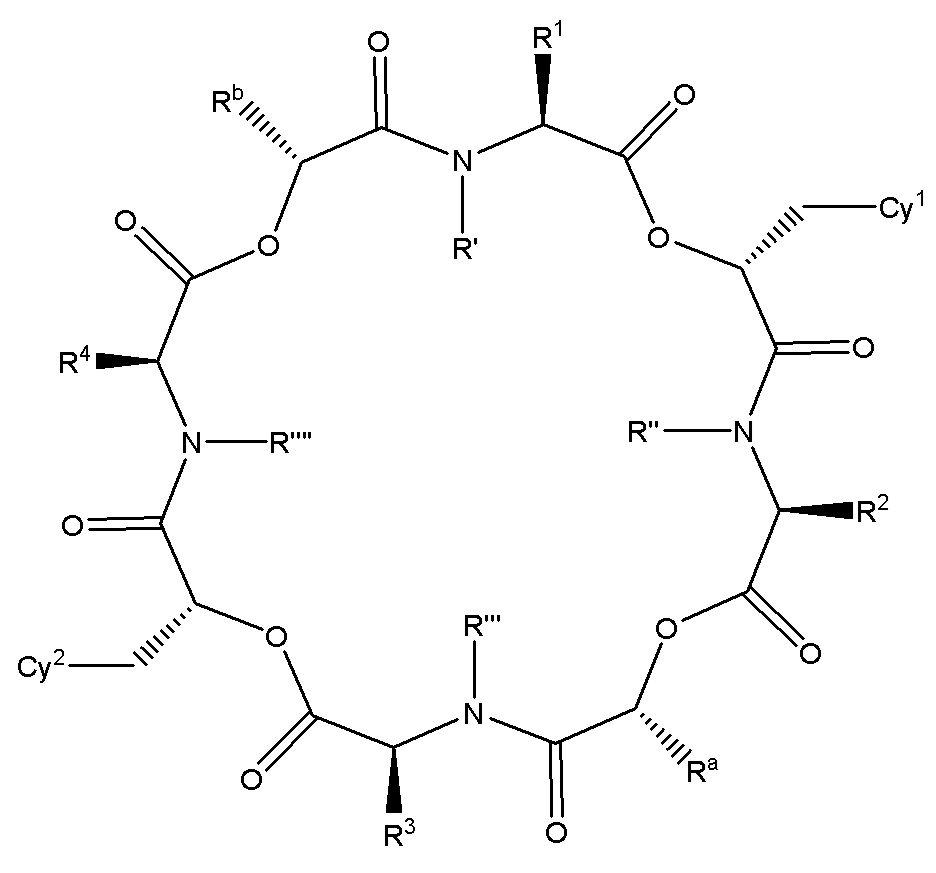
где:
Cy1 и Cy2 независимо представляют собой арил, карбоцикл, гетероарил или гетероцикл, необязательно замещенный одним или больше заместителями, выбранными из группы, состоящей из галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, тиоамидо-группы, амино-группы, алкиламино-группы, диалкиламино-группы, алкила, галогеналкила, алкенила, галогеналкенила, алкинила, галогеналкинила, SF5, R5S(O)-, R5S(O)2-, R5C(O)-, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, циклоалкила, гетероалкила, гетероциклила, арила, гетероарила, -O-гетероарила, -S-гетероарила, -O-гетероциклила или -S-гетероциклила, где каждый циклоалкил, гетероалкил, арил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, тиоамидо-группы, амино-группы, алкиламино-группы, диалкиламино-группы, алкила, галогеналкила, алкенила, галогеналкенила, алкинила, галогеналкинила, SF5, R5S(O)-, R5S(O)2-, R5C(O)-, R5R6NC(O)-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN и -NO2;
R5 и R6 независимо представляют собой атом водорода, алкил, галогеналкил, тиоалкил, алкилтиоалкил, гидроксиалкил, алкоксиалкил, алкенил, галогеналкенил, алкинил, галогеналкинил или группу -CH2C(O)NHCH2CF3; или R5 и R6 вместе с атомом(-ами), с которыми они связаны, образуют C3-C6 циклическую группу;
R’, R’’, R’’’ и R’’’’ каждый независимо представляют собой атом водорода или C1-C3алкил;
Ra и Rb независимо представляют собой атом водорода, C1-C3алкил или C1-C3галогеналкил; и
(a) R1 представляет собой C1-C8 алкил, замещенный одним или больше заместителями, выбранными из группы, состоящей из арила, гетероарила, гетероциклила, галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, алкилсульфинила, галогеналкилсульфинила, алкилсульфонила, галогеналкилсульфонила, алкоксиалкокси-группы, оксо-группы, циано-группы, амино-группы, алкиламино-группы и диалкиламино-группы; и
R2, R3 и R4 каждый независимо представляют собой C1-C8 алкил; или
(b) R2 представляет собой C1-C8 алкил, замещенный одним или больше заместителями, выбранными из группы, состоящей из арила, гетероарила, гетероциклила, галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, алкилсульфинила, галогеналкилсульфинила, алкилсульфонила, галогеналкилсульфонила, алкоксиалкокси-группы, оксо-группы, циано-группы, амино-группы, алкиламино-группы и диалкиламино-группы; и
R1, R3 и R4 каждый независимо представляют собой C1-C8 алкил; или
(c) R3 представляет собой C1-C8 алкил, замещенный одним или больше заместителями, выбранными из группы, состоящей из арила, гетероарила, гетероциклила, галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, алкилсульфинила, галогеналкилсульфинила, алкилсульфонила, галогеналкилсульфонила, алкоксиалкокси-группы, оксо-группы, циано-группы, амино-группы, алкиламино-группы и диалкиламино-группы; и
R1, R2 и R4 каждый независимо представляют собой C1-C8 алкил; или
(d) R4 представляет собой C1-C8 алкил, замещенный одним или больше заместителями, выбранными из группы, состоящей из арила, гетероарила, гетероциклила, галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, алкилсульфинила, галогеналкилсульфинила, алкилсульфонила, галогеналкилсульфонила, алкоксиалкокси-группы, оксо-группы, циано-группы, амино-группы, алкиламино-группы и диалкиламино-группы; и
R1, R2 и R3 каждый независимо представляют собой C1-C8 алкил; или
(e) R1 и R2 каждый независимо представляют собой C1-C8 алкил, замещенный одним или больше заместителями, выбранными из группы, состоящей из арила, гетероарила, гетероциклила, галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, алкилсульфинила, галогеналкилсульфинила, алкилсульфонила, галогеналкилсульфонила, алкоксиалкокси-группы, оксо-группы, циано-группы, амино-группы, алкиламино-группы и диалкиламино-группы; и
R3 и R4 каждый независимо представляют собой C1-C8 алкил; или
(f) R1 и R3 каждый независимо представляют собой C1-C8 алкил, замещенный одним или больше заместителями, выбранными из группы, состоящей из арила, гетероарила, гетероциклила, галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, алкилсульфинила, галогеналкилсульфинила, алкилсульфонила, галогеналкилсульфонила, алкоксиалкокси-группы, оксо-группы, циано-группы, амино-группы, алкиламино-группы и диалкиламино-группы; и
R2 и R4 каждый независимо представляют собой C1-C8 алкил; или
(g) R1 и R4 каждый независимо представляют собой C1-C8 алкил, замещенный одним или больше заместителями, выбранными из группы, состоящей из арила, гетероарила, гетероциклила, галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, алкилсульфинила, галогеналкилсульфинила, алкилсульфонила, галогеналкилсульфонила, алкоксиалкокси-группы, оксо-группы, циано-группы, амино-группы, алкиламино-группы и диалкиламино-группы; и
R2 и R3 каждый независимо представляют собой C1-C8 алкил; или
(h) R2 и R4 каждый независимо представляют собой C1-C8 алкил, замещенный одним или больше заместителями, выбранными из группы, состоящей из арила, гетероарила, гетероциклила, галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, алкилсульфинила, галогеналкилсульфинила, алкилсульфонила, галогеналкилсульфонила, алкоксиалкокси-группы, оксо-группы, циано-группы, амино-группы, алкиламино-группы и диалкиламино-группы; и
R1 и R3 каждый независимо представляют собой C1-C8 алкил; или
(i) R2 и R3 каждый независимо представляют собой C1-C8 алкил, замещенный одним или больше заместителями, выбранными из группы, состоящей из арила, гетероарила, гетероциклила, галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, алкилсульфинила, галогеналкилсульфинила, алкилсульфонила, галогеналкилсульфонила, алкоксиалкокси-группы, оксо-группы, циано-группы, амино-группы, алкиламино-группы и диалкиламино-группы; и
R1 и R4 каждый независимо представляют собой C1-C8 алкил; или
(j) R3 и R4 каждый независимо представляют собой C1-C8 алкил, замещенный одним или больше заместителями, выбранными из группы, состоящей из арила, гетероарила, гетероциклила, галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, алкилсульфинила, галогеналкилсульфинила, алкилсульфонила, галогеналкилсульфонила, алкоксиалкокси-группы, оксо-группы, циано-группы, амино-группы, алкиламино-группы и диалкиламино-группы; и
R1 и R2 каждый независимо представляют собой C1-C8 алкил; или
(k) R1, R2 и R3 каждый независимо представляют собой C1-C8 алкил, замещенный одним или больше заместителями, выбранными из группы, состоящей из арила, гетероарила, гетероциклила, галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, алкилсульфинила, галогеналкилсульфинила, алкилсульфонила, галогеналкилсульфонила, алкоксиалкокси-группы, оксо-группы, циано-группы, амино-группы, алкиламино-группы и диалкиламино-группы; и
R4 представляет собой C1-C8 алкил; или
(l) R2, R3 и R4 каждый независимо представляют собой C1-C8 алкил, замещенный одним или больше заместителями, выбранными из группы, состоящей из арила, гетероарила, гетероциклила, галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, алкилсульфинила, галогеналкилсульфинила, алкилсульфонила, галогеналкилсульфонила, алкоксиалкокси-группы, оксо-группы, циано-группы, амино-группы, алкиламино-группы и диалкиламино-группы; и
R1 представляет собой C1-C8 алкил; или
(m) R1, R3 и R4 каждый независимо представляют собой C1-C8 алкил, замещенный одним или больше заместителями, выбранными из группы, состоящей из арила, гетероарила, гетероциклила, галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, алкилсульфинила, галогеналкилсульфинила, алкилсульфонила, галогеналкилсульфонила, алкоксиалкокси-группы, оксо-группы, циано-группы, амино-группы, алкиламино-группы и диалкиламино-группы; и
R2 представляет собой C1-C8 алкил; или
(n) R1, R2 и R4 каждый независимо представляют собой C1-C8 алкил, замещенный одним или больше заместителями, выбранными из группы, состоящей из арила, гетероарила, гетероциклила, галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, алкилсульфинила, галогеналкилсульфинила, алкилсульфонила, галогеналкилсульфонила, алкоксиалкокси-группы, оксо-группы, циано-группы, амино-группы и алкиламино-группы, диалкиламино-группы; и
R3 представляет собой C1-C8 алкил; или
(o) R1, R2, R3 и R4 каждый независимо представляют собой C1-C8 алкил, замещенный одним или больше заместителями, выбранными из группы, состоящей из арила, гетероарила, гетероциклила, галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, алкилсульфинила, галогеналкилсульфинила, алкилсульфонила, галогеналкилсульфонила, алкоксиалкокси-группы, оксо-группы, циано-группы, амино-группы, алкиламино-группы и диалкиламино-группы.
Cy1 и Cy2 группы
В одном варианте осуществления, Cy1 и Cy2 независимо представляют собой фенил, необязательно замещенный одним или больше заместителями, выбранными из группы, состоящей из галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, тиоамидо-группы, амино-группы, алкиламино-группы, диалкиламино-группы, алкила, галогеналкила, алкенила, галогеналкенила, алкинила, галогеналкинила, SF5, R5S(O)-, R5S(O)2-, R5C(O)-, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, циклоалкила, гетероалкила, гетероциклила, арила, гетероарила, -O-гетероарила, -S-гетероарила, -O-гетероциклила или -S-гетероциклила, где каждый циклоалкил, гетероалкил, арил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, тиоамидо-группы, амино-группы, алкиламино-группы, диалкиламино-группы, алкила, галогеналкила, алкенила, галогеналкенила, алкинила, галогеналкинила, SF5, R5S(O)-, R5S(O)2-, R5C(O)-, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN и -NO2, где R5 и R6 имеют значения, указанные выше для формулы (I).
В другом варианте осуществления, Cy1 и Cy2 независимо представляют собой фенил, гетероарил или гетероциклил, необязательно независимо замещенные одним или больше заместителями, выбранными из группы, состоящей из галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, тиоамидо-группы, амино-группы, алкиламино-группы, диалкиламино-группы, алкила, галогеналкила, алкенила, галогеналкенила, алкинила, галогеналкинила, SF5, R5S(O)-, R5S(O)2-, R5C(O)-, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, циклоалкила, гетероалкила, гетероциклила, арила, гетероарила, -O-гетероарила, -S-гетероарила, -O-гетероциклила или -S-гетероциклила, где каждый циклоалкил, гетероалкил, арил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, тиоамидо-группы, амино-группы, алкиламино-группы, диалкиламино-группы, алкила, галогеналкила, алкенила, галогеналкенила, алкинила, галогеналкинила, SF5, R5S(O)-, R5S(O)2-, R5C(O)-, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN и -NO2, где R5 и R6 имеют значения, указанные выше для формулы (I).
В другом варианте осуществления, Cy1 и Cy2 независимо представляют собой 6-12 -членные бициклические арильные или гетероарильные группы, необязательно замещенные одним или больше заместителями, выбранными из группы, состоящей из галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, тиоамидо-группы, амино-группы, алкиламино-группы, диалкиламино-группы, алкила, галогеналкила, алкенила, галогеналкенила, алкинила, галогеналкинила, SF5, R5S(O)-, R5S(O)2-, R5C(O)-, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, циклоалкила, гетероалкила, гетероциклила, арила, гетероарила, -O-гетероарила, -S-гетероарила, -O-гетероциклила или -S-гетероциклила, где каждый циклоалкил, гетероалкил, арил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, тиоамидо-группы, амино-группы, алкиламино-группы, диалкиламино-группы, алкила, галогеналкила, алкенила, галогеналкенила, алкинила, галогеналкинила, SF5, R5S(O)-, R5S(O)2-, R5C(O)-, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN и -NO2, где R5 и R6 имеют значения, указанные выше для формулы (I).
В другом варианте осуществления, Cy1 и Cy2 независимо представляют собой бициклические гетероциклические группы, необязательно замещенные одним или больше заместителями, выбранными из группы, состоящей из галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, тиоамидо-группы, амино-группы, алкиламино-группы, диалкиламино-группы, алкила, галогеналкила, алкенила, галогеналкенила, алкинила, галогеналкинила, SF5, R5S(O)-, R5S(O)2-, R5C(O)-, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, циклоалкила, гетероалкила, гетероциклила, арила, гетероарила, -O-гетероарила, -S-гетероарила, -O-гетероциклила или -S-гетероциклила, где каждый циклоалкил, гетероалкил, арил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, тиоамидо-группы, амино-группы, алкиламино-группы, диалкиламино-группы, алкила, галогеналкила, алкенила, галогеналкенила, алкинила, галогеналкинила, SF5, R5S(O)-, R5S(O)2-, R5C(O)-, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN и -NO2, где R5 и R6 имеют значения, указанные выше для формулы (I).
В другом варианте осуществления, Cy1 и Cy2 независимо представляют собой фенил, бифенил, нафтил, тетрагидронафтил, фенилциклопропил, бифенилен, флуорен, антрацен, аценафтен, фенантрен или инданил, необязательно замещенный одним или больше заместителями, выбранными из группы, состоящей из галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, тиоамидо-группы, амино-группы, алкиламино-группы, диалкиламино-группы, алкила, галогеналкила, алкенила, галогеналкенила, алкинила, галогеналкинила, SF5, R5S(O)-, R5S(O)2-, R5C(O)-, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, циклоалкила, гетероалкила, гетероциклила, арила, гетероарила, -O-гетероарила, -S-гетероарила, -O-гетероциклила или -S-гетероциклила, где каждый циклоалкил, гетероалкил, арил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, тиоамидо-группы, амино-группы, алкиламино-группы, диалкиламино-группы, алкила, галогеналкила, алкенила, галогеналкенила, алкинила, галогеналкинила, SF5, R5S(O)-, R5S(O)2-, R5C(O)-, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN и -NO2, где R5 и R6 имеют значения, указанные выше для формулы (I).
В другом варианте осуществления, Cy1 и Cy2 независимо представляют собой пиридил, пиридазинил, пиримидинил, пиразинил, триазинил, пирролил, индолил, хинолинил, изохинолинил, хиназолинил, хиноксалинил, фуранил, тиофенил, пирролил, имидазолил, оксазолил, изоксазолил, изотиазолил, пиразолил, бензофуранил, дигидробензофуранил, бензотиофенил, имидазопиридил, имидазопиримидил или пирролопиримидил, необязательно замещенный одним или больше заместителями, выбранными из группы, состоящей из галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, тиоамидо-группы, амино-группы, алкиламино-группы, диалкиламино-группы, алкила, галогеналкила, алкенила, галогеналкенила, алкинила, галогеналкинила, SF5, R5S(O)-, R5S(O)2-, R5C(O)-, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, циклоалкила, гетероалкила, гетероциклила, арила, гетероарила, -O-гетероарила, -S-гетероарила, -O-гетероциклила или -S-гетероциклила, где каждый циклоалкил, гетероалкил, арил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, тиоамидо-группы, амино-группы, алкиламино-группы, диалкиламино-группы, алкила, галогеналкила, алкенила, галогеналкенила, алкинила, галогеналкинила, SF5, R5S(O)-, R5S(O)2-, R5C(O)-, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN и -NO2, где R5 и R6 имеют значения, указанные выше для формулы (I).
В другом варианте осуществления, Cy1 и Cy2 независимо представляют собой пирролидинил, пирролил, пиразолил, оксетанил, пиразолинил, имидазолил, имидазолинил, имидазолидинил, оксазолил, оксазолидинил, изоксазолинил, изоксазолил, тиазолил, тиадиазолил, тиазолидинил, изотиазолил, изотиазолидинил, фурил, тетрагидрофуранил, тиенил, оксадиазолил, пиперидинил, пиперазинил, 2-оксопиперазинил, 2-оксопиперидинил, 2-оксопирролидинил, 2-оксоазепинил, азепинил, 4-пиперидонил, пиридинил, пиразинил, пиримидинил, пиридазинил, тетрагидропиранил, морфолинил, тиаморфолинил, тиаморфолинил сульфоксид, тиаморфолинил сульфон, 1,3-диоксолан и тетрагидро-1,1-диоксотиенил, триазолил или триазинил, необязательно независимо замещенные одним или больше заместителями, выбранными из группы, состоящей из галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, тиоамидо-группы, амино-группы, алкиламино-группы, диалкиламино-группы, алкила, галогеналкила, алкенила, галогеналкенила, алкинила, галогеналкинила, SF5, R5S(O)-, R5S(O)2-, R5C(O)-, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, циклоалкила, гетероалкила, гетероциклила, арила, гетероарила, -O-гетероарила, -S-гетероарила, -O-гетероциклила или -S-гетероциклила, где каждый циклоалкил, гетероалкил, арил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, тиоамидо-группы, амино-группы, алкиламино-группы, диалкиламино-группы, алкила, галогеналкила, алкенила, галогеналкенила, алкинила, галогеналкинила, SF5, R5S(O)-, R5S(O)2-, R5C(O)-, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN и -NO2, где R5 и R6 имеют значения, указанные выше для формулы (I).
В другом варианте осуществления, Cy1 и Cy2 независимо представляют собой индолил, изоиндолил, бензотиазолил, бензоксазолил, бенз[d]изоксазолил, бензотриазолил, бензодиоксолил, бензотиенил, хинуклидинил, хиназолинил, хиноксалинил, хинолинил, изохинолинил, бензимидазолил, бензопиранил, индолизинил, бензофуранил, дигидробензофуранил, хромонил, кумаринил, циннолинил, индазолил, пирролопиридил, фталазинил, 1,2,3-бензотриазинил, 1,2,4-бензотриазинил, фуропиридинил (такой как фуро[2,3-c]пиридинил, фуро[3,2-b]пиридинил] или фуро[2,3-b]пиридинил), дигидроизоиндолил, дигидрохиназолинил (такой как 3,4-дигидро-4-оксо-хиназолинил), тетрагидрохинолинил или тетрагидроизохинолинил, необязательно замещенный одним или больше заместителями, выбранными из группы, состоящей из галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, тиоамидо-группы, амино-группы, алкиламино-группы, диалкиламино-группы, алкила, галогеналкила, алкенила, галогеналкенила, алкинила, галогеналкинила, SF5, R5S(O)-, R5S(O)2-, R5C(O)-, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, циклоалкила, гетероалкила, гетероциклила, арила, гетероарила, -O-гетероарила, -S-гетероарила, -O-гетероциклила или -S-гетероциклила, где каждый циклоалкил, гетероалкил, арил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, тиоамидо-группы, амино-группы, алкиламино-группы, диалкиламино-группы, алкила, галогеналкила, алкенила, галогеналкенила, алкинила, галогеналкинила, SF5, R5S(O)-, R5S(O)2-, R5C(O)-, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN и -NO2, где R5 и R6 имеют значения, указанные выше для формулы (I).
В одном варианте осуществления, Cy1 и Cy2 независимо представляют собой фенил, замещенный гетероциклилом. В другом варианте осуществления, Cy1 и Cy2 независимо представляют собой 6-членную гетероарильную группу, замещенную гетероциклилом. В другом варианте осуществления, Cy1 и Cy2 независимо представляют собой гетероциклил, замещенный гетероциклильной группой. В другом варианте осуществления, Cy1 и Cy2 независимо представляют собой фенил, пиридинил, пиридазинил, пиримидинил, пиразинил или тетразинил, замещенный гетероциклилом.
В одном варианте осуществления, Cy1 и Cy2 независимо представляют собой фенил, пиридинил, пиридазинил, пиримидинил, пиразинил или тетразинил, замещенный морфолино-группой, тетрагидропирановой группой, тетрагидрофурановой группой, пирролидиновой или пиперидиновой группой.
В одном варианте осуществления, Cy1 и Cy2 независимо представляют собой фенил, 5-членный или 6-членный гетероарильный цикл, необязательно замещенный галогеном, гидрокси-группой, алкокси-группой, галогеналкокси-группой, алкилтио-группой, галогеналкилтио-группой, тиоамидо-группой, -SF5, амино-группой, алкиламино-группой или диалкиламино-группой.
В другом варианте осуществления, Cy1 и Cy2 независимо представляют собой фенил, 5-членный или 6-членный гетероарильный цикл, необязательно замещенный алкилом, галогеналкилом, алкенилом, галогеналкенилом, алкинилом, галогеналкинилом.
В другом варианте осуществления, Cy1 и Cy2 независимо представляют собой фенил, 5-членный или 6-членный гетероарильный цикл, необязательно замещенный C1-C3алкилом, C1-C3галогеналкилом, C2-C4алкенилом, C2-C4галогеналкенилом, C2-C4алкинилом, C2-C4галогеналкинилом, C1-C3алкокси-группой, C1-C3галогеналкокси-группой, C1-C3алкилтио-группой, C1-C3галогеналкилтио-группой, C1-C3алкиламино-группой или C1-C3диалкиламино-группой.
В другом варианте осуществления, Cy1 и Cy2 независимо представляют собой фенил, 5-членный или 6-членный гетероарильный цикл, необязательно замещенный метилом, этилом, пропилом, изопропилом, бутилом, изобутилом, трет-бутилом, CF3, -CH2CF3, -CHFCF3или-CF2CF3.
В другом варианте осуществления, Cy1 и Cy2 независимо представляют собой фенил, 5-членный или 6-членный гетероарильный цикл, необязательно замещенный фтором, хлором, бромом или иодом.
В другом варианте осуществления, Cy1 и Cy2 независимо представляют собой фенил, 5-членный или 6-членный гетероарильный цикл, необязательно замещенный гидрокси-группой, метокси-группой, трифторметокси-группой, -OCH2CF3, -OCHFCF3, -OCF2CF3, -SCH3, -SCF3, -SCH2CF3, -SCHFCF3, -SCF2CF3, -S(O)CH3, -S(O)CF3, -S(O)CH2CF3, -S(O)CHFCF3, -S(O)CF2CF3, -S(O)2CH3, -S(O)2CF3, -S(O)2CH2CF3, -S(O)2CHFCF3, -S(O)2CF2CF3илиSF5.
В другом варианте осуществления, Cy1 и Cy2 независимо представляют собой фенил, тиенил, оксазолил, изотиазолил, 1,3-4-тиадиазолил, пиразолил, фурил, имидазолил, пирролил, пиридинил, пиридазинил, пиримидинил, пиразинил или тетразинил, необязательно замещенный галогеном, гидрокси-группой, алкокси-группой, галогеналкокси-группой, алкилтио-группой, галогеналкилтио-группой, тиоамидо-группой, амино-группой, алкиламино-группой или диалкиламино-группой.
В другом варианте осуществления, Cy1 и Cy2 независимо представляют собой фенил, тиенил, оксазолил, изотиазолил, 1,3-4-тиадиазолил, пиразолил, фурил, имидазолил, пирролил, пиридинил, пиридазинил, пиримидинил, пиразинил или тетразинил, необязательно замещенный алкилом, галогеналкилом, алкенилом, галогеналкенилом, алкинилом и галогеналкинилом.
В другом варианте осуществления, Cy1 и Cy2 независимо представляют собой фенил, тиенил, оксазолил, изотиазолил, 1,3-4-тиадиазолил, пиразолил, фурил, имидазолил, пирролил, пиридинил, пиридазинил, пиримидинил, пиразинил или тетразинил, необязательно замещенный C1-C3алкилом, C1-C3галогеналкилом, C2-C4алкенилом, C2-C4галогеналкенилом, C2-C4алкинилом, C2-C4галогеналкинилом, C1-C3алкокси-группой, C1-C3галогеналкокси-группой, C1-C3алкилтио-группой, C1-C3галогеналкилтио-группой, C1-C3алкиламино-группой или C1-C3диалкиламино-группой.
В другом варианте осуществления, Cy1 и Cy2 независимо представляют собой фенил, 5-членный или 6-членный гетероарильный цикл, необязательно замещенный метилом, этилом, пропилом, изопропилом, бутилом, изобутилом, трет-бутилом, CF3, -CH2CF3, -CHFCF3или-CF2CF3.
В другом варианте осуществления, Cy1 и Cy2 независимо представляют собой фенил, тиенил, оксазолил, изотиазолил, 1,3-4-тиадиазолил, пиразолил, фурил, имидазолил, пирролил, пиридинил, пиридазинил, пиримидинил, пиразинил или тетразинил, необязательно замещенный фтором, хлором, бромом или иодом.
В другом варианте осуществления, Cy1 и Cy2 независимо представляют собой фенил, тиенил, оксазолил, изотиазолил, 1,3-4-тиадиазолил, пиразолил, фурил, имидазолил, пирролил, пиридинил, пиридазинил, пиримидинил, пиразинил или тетразинил, необязательно замещенный гидрокси-группой, метокси-группой, трифторметокси-группой, -OCH2CF3, -OCHFCF3, -OCF2CF3, -SCH3, -SCF3, -SCH2CF3, -SCHFCF3или-SCF2CF3, -S(O)CH3, -S(O)CF3, -S(O)CH2CF3, -S(O)CHFCF3, -S(O)CF2CF3, -S(O)2CH3, -S(O)2CF3, -S(O)2CH2CF3, -S(O)2CHFCF3, -S(O)2CF2CF3 или SF5.
В другом варианте осуществления, Cy1 и Cy2 независимо представляют собой одну из изображенных ниже групп R1 - R8:
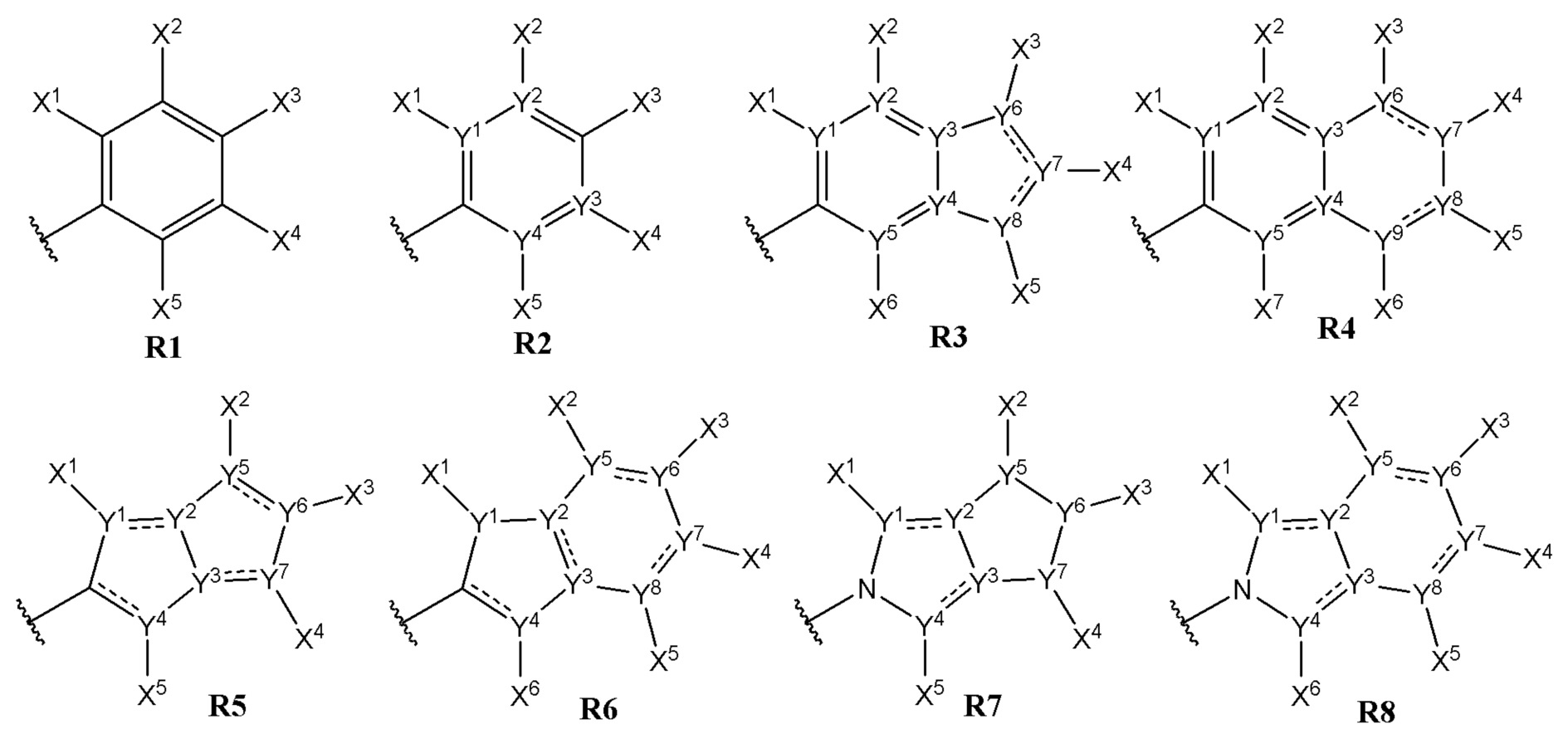
где Y1, Y2, Y3, Y4, Y5, Y6, Y7, Y8 и Y9 каждый независимо представляют собой C, CH или N; и X1, X2, X3, X4, X5, X6 и X7 независимо представляют собой атом водорода, галоген, гидрокси-группу, алкокси-группу, галогеналкокси-группу, алкилтио-группу, галогеналкилтио-группу, тиоамидо-группу, амино-группу, алкиламино-группу, диалкиламино-группу, алкил, галогеналкил, алкенил, галогеналкенил, алкинил, галогеналкинил, SF5, R5S(O)-, R5S(O)2-, R5C(O)-, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, циклоалкил, гетероалкил, гетероциклил, арил, -O-гетероарил, -S-гетероарил, -O-гетероциклил или -S-гетероциклил, гетероарил, где каждый циклоалкил, гетероалкил, арил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, тиоамидо-группы, амино-группы, алкиламино-группы, диалкиламино-группы, алкила, галогеналкила, алкенила, галогеналкенила, алкинила, галогеналкинила, SF5, R5S(O)-, R5S(O)2-, R5C(O)-, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN и -NO2 , где R5 и R6 имеют значения, указанные выше для формулы (I).
В одном варианте осуществления, Cy1 и Cy2 независимо представляют собой R1 - R8, где Y1, Y2, Y3, Y4, Y5, Y6, Y7, Y8 и Y9 каждый независимо представляют собой C, CH или N; и X1, X2, X3, X4, X5, X6 и X7 независимо представляют собой атом водорода, галоген, гидрокси-группу, алкокси-группу, галогеналкокси-группу, алкилтио-группу, галогеналкилтио-группу, R5R6NC(O)-, R5R6NC(O)NR5-, тиоамидо-группу, амино-группу, алкиламино-группу или диалкиламино-группу.
В другом варианте осуществления, Cy1 и Cy2 независимо представляют собой R1 - R8, где Y1, Y2, Y3, Y4, Y5, Y6, Y7, Y8 и Y9 каждый независимо представляют собой C, CH или N; и X1, X2, X3, X4, X5, X6 и X7 независимо представляют собой атом водорода, алкил, галогеналкил, алкенил, галогеналкенил, алкинил, галогеналкинил.
В другом варианте осуществления, Cy1 и Cy2 независимо представляют собой R1 - R8, где Y1, Y2, Y3, Y4, Y5, Y6, Y7, Y8 и Y9 каждый независимо представляют собой C, CH или N; и X1, X2, X3, X4, X5, X6 и X7 независимо представляют собой атом водорода, метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, CF3, -CH2CF3, -CHFCF3 или CF2CF3.
В другом варианте осуществления, Cy1 и Cy2 независимо представляют собой R1 - R8, где Y1, Y2, Y3, Y4, Y5, Y6, Y7, Y8 и Y9 каждый независимо представляют собой C, CH или N; и X1, X2, X3, X4, X5, X6 и X7 независимо представляют собой атом водорода, фтор, хлор, бром или иод.
В другом варианте осуществления, Cy1 и Cy2 независимо представляют собой R1 - R8, где Y1, Y2, Y3, Y4, Y5, Y6, Y7, Y8 и Y9 каждый независимо представляют собой C, CH или N; и X1, X2, X3, X4, X5, X6 и X7 независимо представляют собой атом водорода, гидрокси-группу, метокси-группу, трифторметокси-группу, -OCH2CF3, -OCHFCF3, -OCF2CF3, метилтио-группу, трифторметилтио-группу, -SCH2CF3, -SCHFCF3, -SCF2CF3 или SF5.
В другом варианте осуществления, Cy1 и Cy2 независимо представляют собой изображенные ниже R9 - R11:

где X1, X2 и X3 независимо представляют собой атом водорода, галоген, гидрокси-группу, алкокси-группу, галогеналкокси-группу, алкилтио-группу, галогеналкилтио-группу, тиоамидо-группу, амино-группу, алкиламино-группу, диалкиламино-группу, алкил, галогеналкил, алкенил, галогеналкенил, алкинил, галогеналкинил, SF5, R5S(O)-, R5S(O)2-, R5C(O)-, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, циклоалкил, гетероалкил, гетероциклил, арил, -O-гетероарил, -S-гетероарил, -O-гетероциклил или -S-гетероциклил, гетероарил, где каждый циклоалкил, гетероалкил, арил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, тиоамидо-группы, амино-группы, алкиламино-группы, диалкиламино-группы, алкила, галогеналкила, алкенила, галогеналкенила, алкинила, галогеналкинила, SF5, R5S(O)-, R5S(O)2-, R5C(O)-, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN и -NO2, где R5 и R6 имеют значения, указанные выше для формулы (I).
В одном варианте осуществления, Cy1 и Cy2 независимо представляют собой R9 - R11, где X1, X2 и X3 независимо представляют собой атом водорода, галоген, алкил или галогеналкил. В другом варианте осуществления, Cy1 и Cy2 независимо представляют собой R9 - R11, где X1, X2 и X3 независимо представляют собой атом водорода, фтор, хлор, бром или иод. В другом варианте осуществления, Cy1 и Cy2 независимо представляют собой R9 - R11, где X1, X2 и X3 независимо представляют собой атом водорода, метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, CF3, -CH2CF3, -CHFCF3 или CF2CF3. В другом варианте осуществления, Cy1 и Cy2 независимо представляют собой R9 - R11, где X1, X2 и X3 независимо представляют собой атом водорода, гидрокси-группу, метокси-группу, трифторметокси-группу, -OCH2CF3, -OCHFCF3, -OCF2CF3, метилтио-группу, трифторметилтио-группу, -SCH2CF3, -SCHFCF3, -SCF2CF3 или SF5.
В другом варианте осуществления, Cy1 и/или Cy2 независимо представляют собой фенил, п-морфолинофенил, п-фторфенил, п-OCF3-фенил, п-CF3-фенил, 3,4,5-трифтор-фенил, п-тетрагидропиранил-4-ил-фенил, 2-(морфолин-4-ил)пиридин-5-ил, 5-(морфолин-4-ил)пиридин-2-ил, п-тиосульфонилморфолин-4-ил-фенил, п-NH2-фенил, п-(1-Me-1H-тетразол-5-тиолил)фенил, п-NH2- фенил, 2,3-дигидробензофуран-5-ил, 4-(морфолин-4-ил)циклилгексанил, п-иодфенил, п-бромфенил, п-нитрофенил и п-трет-бутилфенил.
В другом варианте осуществления, Cy1 и Cy2 представляют собой группы, перечисленные ниже в таблице 1:
Таблица 1
Ra и Rb
Ra и Rb могут независимо представлять собой атом водорода, C1-C3алкил или C1-C3галогеналкил. В одном варианте осуществления, Ra и Rb независимо представляют собой атом водорода или метил. В другом варианте осуществления, Ra и Rb независимо представляют собой атом водорода, метил, этил или пропил. В другом варианте осуществления, Ra и Rb независимо представляют собой атом водорода, метил или CF3. В другом варианте осуществления, Ra и Rb оба представляют собой метил. В другом варианте осуществления, Ra и Rb оба представляют собой атом водорода.
R', R'', R''' и R''''
В одном варианте осуществления, каждый из R', R'', R''' и R'''' независимо представляют собой атом водорода или C1-C3алкил. В другом варианте осуществления, каждый из R', R'', R''' и R'''' независимо представляют собой атом водорода или метил. В другом варианте осуществления, каждый из R', R'', R''' и R'''' независимо представляют собой атом водорода, метил или этил.
R1, R2, R3 и R4
Следует понимать, что настоящее изобретение включает соединения, в которых различные группы Cy1 и Cy2, описанные в приведенных выше вариантах осуществления, комбинируются с любой комбинацией R1, R2, R3 и R4, описанных выше для формулы (I) и в описанных ниже вариантах осуществления.
В одном варианте осуществления настоящего изобретения, один из R1 - R4 представляет собой C1-C8 алкильную группу, замещенную одним или более заместителями, описанными для этих переменных выше для формулы (I), в то время как остальные из R1 - R4 представляют собой незамещенный C1-C8 алкил.
В другом варианте осуществления, два из R1 - R4 представляют собой C1-C8алкил, независимо замещенный одним или более из заместителей, описанных для этих переменных выше для формулы (I), в то время как остальные два из R1 - R4 представляют собой незамещенный C1-C8 алкил.
В другом варианте осуществления, три из R1 - R4 представляют собой C1-C8алкил, независимо замещенный одним или более из заместителей, описанных для этих переменных выше для формулы (I), в то время как оставшийся из R1 - R4 представляет собой незамещенный C1-C8 алкил.
В другом варианте осуществления, все четыре из R1 - R4 представляют собой C1-C8алкил, независимо замещенный одним или более из заместителей, описанных для этих переменных выше для формулы (I).
В другом варианте осуществления настоящего изобретения, один из R1 - R4 представляет собой C1-C6 алкильную группу, замещенную одним или более заместителями, описанными для этих переменных выше для формулы (I), в то время как остальные из R1 - R4 представляют собой незамещенный C1-C6 алкил.
В другом варианте осуществления, два из R1 - R4 представляют собой C1-C6алкил, независимо замещенный одним или более из заместителей, описанных для этих переменных выше для формулы (I), в то время как остальные два из R1 - R4 представляют собой незамещенный C1-C6 алкил.
В другом варианте осуществления, три из R1 - R4 представляют собой C1-C6алкил, независимо замещенный одним или более из заместителей, описанных для этих переменных выше для формулы (I), в то время как оставшийся из R1 - R4 представляет собой незамещенный C1-C6 алкил.
В другом варианте осуществления, все четыре из R1 - R4 независимо представляют собой C1-C6алкил, замещенный одним или более из заместителей, описанных для этих переменных выше для формулы (I).
В другом варианте осуществления настоящего изобретения, один из R1 - R4 представляет собой C1-C6 алкильную группу, замещенную одним или более заместителями, описанными для этих переменных выше для формулы (I), в то время как остальные из R1 - R4 представляют собой незамещенный 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, два из R1 - R4 представляют собой C1-C6алкил, независимо замещенный одним или более из заместителей, описанных для этих переменных выше для формулы (I), в то время как остальные два из R1 - R4 представляют собой незамещенный 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, три из R1 - R4 представляют собой C1-C6алкил, независимо замещенный одним или более из заместителей, описанных для этих переменных выше для формулы (I), в то время как оставшийся из R1 - R4 представляет собой незамещенный 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления настоящего изобретения, один из R1 - R4 представляет собой C1-C8 алкильную группу, замещенную одним или более галогенами, в то время как остальные из R1 - R4 представляют собой незамещенный C1-C8 алкил.
В другом варианте осуществления, два из R1 - R4 представляют собой C1-C8алкил, независимо замещенный одним или более галогенами, в то время как остальные два из R1 - R4 представляют собой незамещенный C1-C8 алкил.
В другом варианте осуществления, три из R1 - R4 представляют собой C1-C8алкил, независимо замещенный одним или более галогенами, в то время как оставшийся из R1 - R4 представляет собой незамещенный C1-C8 алкил.
В другом варианте осуществления, все четыре из R1 - R4 представляют собой C1-C8алкил, независимо замещенный одним или более галогенами.
В другом варианте осуществления настоящего изобретения, один из R1 - R4 представляет собой C1-C6 алкильную группу, замещенную одним или более галогенами, в то время как остальные из R1 - R4 представляют собой незамещенный C1-C6 алкил.
В другом варианте осуществления, два из R1 - R4 представляют собой C1-C6алкил, независимо замещенный одним или более галогенами, в то время как остальные два из R1 - R4 представляют собой незамещенный C1-C6 алкил.
В другом варианте осуществления, три из R1 - R4 представляют собой C1-C6алкил, независимо замещенный одним или более галогенами, в то время как оставшийся из R1 - R4 представляет собой незамещенный C1-C6 алкил.
В другом варианте осуществления, все четыре из R1 - R4 представляют собой C1-C6алкил, независимо замещенный одним или более галогенами.
В другом варианте осуществления настоящего изобретения, один из R1 - R4 представляет собой C1-C6 алкильную группу, замещенную одним или более галогенами, в то время как остальные из R1 - R4 представляют собой незамещенный 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, два из R1 - R4 представляют собой C1-C6алкил, независимо замещенный одним или более галогенами, в то время как остальные два из R1 - R4 представляют собой незамещенный 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, три из R1 - R4 представляют собой C1-C6алкил, независимо замещенный одним или более галогенами, в то время как оставшийся из R1 - R4 представляет собой незамещенный 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления настоящего изобретения, один из R1 - R4 представляет собой C1-C8 алкильную группу, замещенную одним или более атомами фтора, в то время как остальные из R1 - R4 представляют собой незамещенный C1-C8 алкил.
В другом варианте осуществления, два из R1 - R4 представляют собой C1-C8алкил, независимо замещенный одним или более атомами фтора, в то время как остальные два из R1 - R4 представляют собой незамещенный C1-C8 алкил.
В другом варианте осуществления, три из R1 - R4 представляют собой C1-C8алкил, независимо замещенный одним или более атомами фтора, в то время как оставшийся из R1 - R4 представляет собой незамещенный C1-C8 алкил.
В другом варианте осуществления, все четыре из R1 - R4 представляют собой C1-C8алкил, независимо замещенный одним или более атомами фтора.
В другом варианте осуществления настоящего изобретения, один из R1 - R4 представляет собой C1-C6 алкильную группу, замещенную одним или более атомами фтора, в то время как остальные из R1 - R4 представляют собой незамещенный C1-C6 алкил.
В другом варианте осуществления, два из R1 - R4 представляют собой C1-C6алкил, независимо замещенный одним или более атомами фтора, в то время как остальные два из R1 - R4 представляют собой незамещенный C1-C6 алкил.
В другом варианте осуществления, три из R1 - R4 представляют собой C1-C6алкил, независимо замещенный одним или более атомами фтора, в то время как оставшийся из R1 - R4 представляет собой незамещенный C1-C6 алкил.
В другом варианте осуществления, все четыре из R1 - R4 представляют собой C1-C6алкил, независимо замещенный одним или более атомами фтора.
В другом варианте осуществления настоящего изобретения, один из R1 - R4 представляет собой C1-C6 алкильную группу, замещенную одним или более атомами фтора, в то время как остальные из R1 - R4 представляют собой незамещенный 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, два из R1 - R4 представляют собой C1-C6алкил, независимо замещенный одним или более атомами фтора, в то время как остальные два из R1 - R4 представляют собой незамещенный 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, три из R1 - R4 представляют собой C1-C6алкил, независимо замещенный одним или более атомами фтора, в то время как оставшийся из R1 - R4 представляет собой незамещенный 2-метилпропил или 2,2-диметилпропил.
В одном варианте осуществления настоящего изобретения, один из R1 - R4 представляет собой CH2F, CHF2 или CF3; и остальные из R1 - R4 представляют собой незамещенный 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, два из R1 - R4 представляют собой CH2F, CHF2 или CF3; и остальные два из R1 - R4 представляют собой незамещенный 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, три из R1 - R4 представляют собой CH2F, CHF2 или CF3; и оставшийся из R1 - R4 представляет собой незамещенный 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, все четыре из R1 - R4 представляют собой CH2F, CHF2 или CF3.
В одном варианте осуществления настоящего изобретения, один из R1 - R4 представляет собой -CH2CX(CH3)2, где X представляет собой галоген; и остальные из R1 - R4 представляют собой незамещенный 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, два из R1 - R4 представляют собой -CH2CX(CH3)2, где X представляет собой галоген; и остальные два из R1 - R4 представляют собой незамещенный 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, три из R1 - R4 представляют собой -CH2CX(CH3)2, где X представляет собой галоген; и оставшийся из R1 - R4 представляет собой незамещенный 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, все четыре из R1 - R4 представляют собой -CH2CX(CH3)2, где X представляет собой галоген.
В одном варианте осуществления настоящего изобретения, один из R1 - R4 представляет собой -CH2CF(CH3)2; и остальные из R1 - R4 представляют собой незамещенный 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, два из R1 - R4 представляют собой -CH2CF(CH3)2; и остальные два из R1 - R4 представляют собой незамещенный 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, три из R1 - R4 представляют собой -CH2CF(CH3)2; и оставшийся из R1 - R4 представляет собой незамещенный 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, все четыре из R1 - R4 представляют собой -CH2CF(CH3)2.
В другом варианте осуществления настоящего изобретения, один из R1 - R4 представляет собой -CH2CX(CH3)2, где X представляет собой CH2F, CHF2 или CF3; и остальные из R1 - R4 представляют собой незамещенный 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, два из R1 - R4 представляют собой -CH2CX(CH3)2, где X представляет собой CH2F, CHF2 или CF3; и остальные два из R1 - R4 представляют собой незамещенный 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, три из R1 - R4 представляют собой -CH2CX(CH3)2, где X представляет собой CH2F, CHF2 или CF3; и оставшийся из R1 - R4 представляет собой незамещенный 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, все четыре из R1 - R4 представляют собой -CH2CX(CH3)2, где X представляет собой CH2F, CHF2 или CF3.
В одном варианте осуществления настоящего изобретения, один из R1 - R4 представляет собой C1-C8 алкильную группу, замещенную одной или больше арильными или гетероарильными группами, в то время как остальные из R1 - R4 представляют собой незамещенный C1-C8 алкил.
В другом варианте осуществления, два из R1 - R4 представляют собой C1-C8алкил, независимо замещенный одной или больше арильными или гетероарильными группами, в то время как остальные два из R1 - R4 представляют собой незамещенный C1-C8 алкил.
В другом варианте осуществления, три из R1 - R4 представляют собой C1-C8алкил, независимо замещенный одной или больше арильными или гетероарильными группами, в то время как оставшийся из R1 - R4 представляет собой незамещенный C1-C8 алкил.
В другом варианте осуществления, все четыре из R1 - R4 представляют собой C1-C8алкил, независимо замещенный одной или больше арильными или гетероарильными группами.
В другом варианте осуществления настоящего изобретения, один из R1 - R4 представляет собой C1-C6 алкильную группу, замещенную одной или больше арильными или гетероарильными группами, в то время как остальные из R1 - R4 представляют собой незамещенный C1-C6 алкил.
В другом варианте осуществления, два из R1 - R4 представляют собой C1-C6алкил, независимо замещенный одной или больше арильными или гетероарильными группами, в то время как остальные два из R1 - R4 представляют собой незамещенный C1-C6 алкил.
В другом варианте осуществления, три из R1 - R4 представляют собой C1-C6алкил, независимо замещенный одной или больше арильными или гетероарильными группами, в то время как оставшийся из R1 - R4 представляет собой незамещенный C1-C6 алкил.
В другом варианте осуществления, все четыре из R1 - R4 представляют собой C1-C6алкил, независимо замещенный одной или больше арильными или гетероарильными группами.
В другом варианте осуществления настоящего изобретения, один из R1 - R4 представляет собой C1-C6 алкильную группу, замещенную одной или больше арильными или гетероарильными группами, в то время как остальные из R1 - R4 представляют собой незамещенный 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, два из R1 - R4 представляют собой C1-C6алкил, независимо замещенный одной или больше арильными или гетероарильными группами, в то время как остальные два из R1 - R4 представляют собой незамещенный 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, три из R1 - R4 представляют собой C1-C6алкил, независимо замещенный одной или больше арильными или гетероарильными группами, в то время как оставшийся из R1 - R4 представляет собой незамещенный 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления настоящего изобретения, один из R1 - R4 представляет собой C1-C6 алкильную группу, замещенную необязательно замещенным фенилом, в то время как остальные из R1 - R4 представляют собой незамещенный 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, два из R1 - R4 независимо представляют собой C1-C6алкил, замещенный необязательно замещенным фенилом, в то время как остальные два из R1 - R4 представляют собой незамещенный 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, три из R1 - R4 независимо представляют собой C1-C6алкил, замещенный необязательно замещенным фенилом, в то время как оставшийся из R1 - R4 представляет собой незамещенный 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, все четыре из R1 - R4 независимо представляют собой C1-C6алкил, замещенный необязательно замещенным фенилом.
В другом варианте осуществления настоящего изобретения, один из R1 - R4 представляет собой C1-C6 алкильную группу, замещенную необязательно замещенной гетероарильной группой, выбранной из группы, состоящей из тиенила, оксазолила, изотиазолила, 1,3-4-тиадиазолила, пиразолила, фурила, имидазолила, пирролила, пиридинила, пиридазинила, пиримидинила, пиразинила, триазинила и тетразинила, в то время как остальные из R1 - R4 представляют собой незамещенный 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, два из R1 - R4 независимо представляют собой C1-C6алкил, замещенный необязательно замещенной гетероарильной группой, выбранной из группы, состоящей из тиенила, оксазолила, изотиазолила, 1,3-4-тиадиазолила, пиразолила, фурила, имидазолила, пирролила, пиридинила, пиридазинила, пиримидинила, пиразинила, триазинила и тетразинила, в то время как остальные два из R1 - R4 представляют собой незамещенный 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, три из R1 - R4 независимо представляют собой C1-C6алкил, замещенный необязательно замещенной гетероарильной группой, выбранной из группы, состоящей из тиенила, оксазолила, изотиазолила, 1,3-4-тиадиазолила, пиразолила, фурила, имидазолила, пирролила, пиридинила, пиридазинила, пиримидинила, пиразинила, триазинила и тетразинила, в то время как оставшийся из R1 - R4 представляет собой незамещенный 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, все четыре из R1 - R4 независимо представляют собой C1-C6алкил, замещенный необязательно замещенной гетероарильной группой, выбранной из группы, состоящей из тиенила, оксазолила, изотиазолила, 1,3-4-тиадиазолила, пиразолила, фурила, имидазолила, пирролила, пиридинила, пиридазинила, пиримидинила, пиразинила, триазинила и тетразинила.
В другом варианте осуществления настоящего изобретения, один, два, три или все четыре из R1 - R4 представляют собой группу G-1:

G-1;
где R1A, R1B, R1C, R1D и R1E независимо представляют собой атом водорода, галоген, алкил или галогеналкил; и остальные из R1 - R4, где это применимо, представляют собой незамещенный C1-C8алкил.
В одном варианте осуществления настоящего изобретения, один из R1 - R4 представляет собой G-1; и остальные из R1 - R4 представляют собой незамещенный 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, два из R1 - R4 представляют собой G-1; и остальные два из R1 - R4 представляют собой незамещенный 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, три из R1 - R4 представляют собой G-1; и оставшийся из R1 - R4 представляет собой незамещенный 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, все четыре из R1 - R4 представляют собой G-1.
В одном варианте осуществления, один, два, три или все четыре из R1 - R4 представляют собой G-1, где R1A, R1B, R1C, R1D и R1E независимо представляют собой атом водорода, фтора, C1-C3 алкил или C1-C3 галогеналкил, и остальные из R1 - R4 представляют собой незамещенный C1-C6алкил. В другом варианте осуществления, один, два, три или все четыре из R1 - R4 представляют собой G-1, где R1A, R1B, R1C, R1D и R1E независимо представляют собой атом водорода, фтора, C1-C3 алкил или C1-C3 галогеналкил, и остальные из R1 - R4 представляют собой незамещенный 2-метилпропил или 2,2-диметилпропил.
В одном варианте осуществления, один, два, три или все четыре из R1 - R4 представляют собой G-1, где R1D и R1E независимо представляют собой H или галоген. В другом варианте осуществления, один, два, три или все четыре из R1 - R4 представляют собой G-1, где R1D и R1E независимо представляют собой C1-C3 алкил или C1-C3 галогеналкил. В другом варианте осуществления, один, два, три или все четыре из R1 - R4 представляют собой G-1, где R1A представляет собой H или галоген. В другом варианте осуществления, один, два, три или все четыре из R1 - R4 представляют собой G-1, где R1A представляет собой C1-C3 алкил или C1-C3 галогеналкил. В другом варианте осуществления, один, два, три или все четыре из R1 - R4 представляют собой G-1, где R1A представляет собой галоген, и R1B и R1C независимо представляют собой C1-C3 алкил или C1-C3 галогеналкил. В другом варианте осуществления, один, два, три или все четыре из R1 - R4 представляют собой G-1, где R1D и R1E представляют собой H, R1A представляет собой галоген, и R1B и R1C независимо представляют собой C1-C3 алкил или C1-C3 галогеналкил.
В одном варианте осуществления, один, два, три или все четыре из R1 - R4 представляют собой G-1, где R1D и R1E независимо представляют собой H или F. В другом варианте осуществления, один, два, три или все четыре из R1 - R4 представляют собой G-1, где R1D и R1E независимо представляют собой метил или трифторметил. В другом варианте осуществления, один, два, три или все четыре из R1 - R4 представляют собой G-1, где R1A представляет собой H или F. В другом варианте осуществления, один, два, три или все четыре из R1 - R4 представляют собой G-1, где R1A представляет собой метил или трифторметил. В другом варианте осуществления, один, два, три или все четыре из R1 - R4 представляют собой G-1, где R1A представляет собой F, и R1B и R1C представляют собой метил или трифторметил. В другом варианте осуществления, один, два, три или все четыре из R1 - R4 представляют собой G-1, где R1D и R1E представляют собой H, R1A представляет собой F, R1B и R1C представляют собой метил или трифторметил.
В другом варианте осуществления, один, два, три или все четыре из R1 - R4 представляют собой G-1, где R1A представляет собой C1-C3 алкил или C1-C3 галогеналкил; и оставшийся из R1 - R4представляет собой 2-метилпропил или 2,2-диметилпропил. В другом варианте осуществления, один, два, три или все четыре из R1 - R4 представляют собой G-1, где R1A представляет собой галоген, и R1B и R1C независимо представляют собой C1-C3 алкил или C1-C3 галогеналкил; и оставшийся из R1 - R4представляет собой 2-метилпропил или 2,2-диметилпропил. В другом варианте осуществления, один, два, три или все четыре из R1 - R4 представляют собой G-1, где R1D и R1E представляют собой H, R1A представляет собой галоген, и R1B и R1C независимо представляют собой C1-C3 алкил или C1-C3 галогеналкил; и оставшийся из R1 - R4представляет собой 2-метилпропил или 2,2-диметилпропил.
В одном варианте осуществления, один, два, три или все четыре из R1 - R4 представляют собой G-1, где один из R1D и R1E представляет собой F; и остальные из R1 - R4представляют собой 2-метилпропил или 2,2-диметилпропил. В другом варианте осуществления, один, два, три или все четыре из R1 - R4 представляют собой G-1, где один из R1D и R1E представляет собой метил или трифторметил; и остальные из R1 - R4представляют собой 2-метилпропил или 2,2-диметилпропил. В другом варианте осуществления, один, два, три или все четыре из R1 - R4 представляют собой G-1, где R1A представляет собой F; и остальные из R1 - R4представляют собой 2-метилпропил или 2,2-диметилпропил. В другом варианте осуществления, один, два, три или все четыре из R1 - R4 представляют собой G-1, где R1A представляет собой метил или трифторметил; и остальные из R1 - R4представляют собой 2-метилпропил или 2,2-диметилпропил. В другом варианте осуществления, один, два, три или все четыре из R1 - R4 представляют собой G-1, где R1A представляет собой F, и R1B и R1C представляют собой метил или трифторметил; и остальные из R1 - R4представляют собой 2-метилпропил или 2,2-диметилпропил. В другом варианте осуществления, один, два, три или все четыре из R1 - R4 представляют собой G-1, где R1D и R1E представляют собой H, R1A представляет собой F, R1B и R1C представляют собой метил или трифторметил; и остальные из R1 - R4представляют собой 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, один из R1 - R4 представляет собой G-1, где R1A представляет собой F, и R1B и R1C представляют собой метил или трифторметил; и остальные из R1 - R4представляют собой 2-метилпропил или 2,2-диметилпропил. В другом варианте осуществления, два из R1 - R4 представляют собой G-1, где R1A представляет собой F, и R1B и R1C представляют собой метил или трифторметил; и остальные из R1 - R4представляют собой 2-метилпропил или 2,2-диметилпропил. В другом варианте осуществления, три из R1 - R4 представляют собой G-1, где R1A представляет собой F, и R1B и R1C представляют собой метил или трифторметил; и остальные из R1 - R4представляют собой 2-метилпропил или 2,2-диметилпропил. В другом варианте осуществления, все четыре из R1 - R4 представляют собой G-1, где R1A представляет собой F, и R1B и R1C представляют собой метил или трифторметил. В одном варианте осуществления, R1 представляет собой G-1, где R1A представляет собой F, и R1B и R1C представляют собой метил или трифторметил; и R2, R3 и R4представляют собой 2-метилпропил или 2,2-диметилпропил. В другом варианте осуществления, R2 представляет собой G-1, где R1A представляет собой F, и R1B и R1C представляют собой метил или трифторметил; и R2, R3 и R4представляют собой 2-метилпропил или 2,2-диметилпропил. В другом варианте осуществления, R3 представляет собой G-1, где R1A представляет собой F, и R1B и R1C представляют собой метил или трифторметил; и R1, R2 и R4представляют собой 2-метилпропил или 2,2-диметилпропил. В другом варианте осуществления, R4 представляет собой G-1, где R1A представляет собой F, и R1B и R1C представляют собой метил или трифторметил; и R1, R2 и R3представляют собой 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, R1 и R3 представляют собой G-1, где R1A представляет собой F, и R1B и R1C представляют собой метил или трифторметил; и R2 и R4представляют собой 2-метилпропил или 2,2-диметилпропил. В другом варианте осуществления, R2 и R4 представляют собой G-1, где R1A представляет собой F, и R1B и R1C представляют собой метил или трифторметил; и R1 и R3представляют собой 2-метилпропил или 2,2-диметилпропил. В другом варианте осуществления, R1 и R2 представляют собой G-1, где R1A представляет собой F, и R1B и R1C представляют собой метил или трифторметил; и R3 и R4представляют собой 2-метилпропил или 2,2-диметилпропил. В другом варианте осуществления, R2 и R3 представляют собой G-1, где R1A представляет собой F, и R1B и R1C представляют собой метил или трифторметил; и R1 и R4представляют собой 2-метилпропил или 2,2-диметилпропил. В другом варианте осуществления, R1 и R4 представляют собой G-1, где R1A представляет собой F, и R1B и R1C представляют собой метил или трифторметил; и R2 и R3представляют собой 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, R1, R2 и R3 представляют собой G-1, где R1A представляет собой F, и R1B и R1C представляют собой метил или трифторметил; и R4представляет собой 2-метилпропил или 2,2-диметилпропил. В другом варианте осуществления, R1, R2 и R4 представляют собой G-1, где R1A представляет собой F, и R1B и R1C представляют собой метил или трифторметил; и R3представляет собой 2-метилпропил или 2,2-диметилпропил. В другом варианте осуществления, R1, R3 и R4 представляют собой G-1, где R1A представляет собой F, и R1B и R1C представляют собой метил или трифторметил; и R2представляет собой 2-метилпропил или 2,2-диметилпропил. В другом варианте осуществления, R2, R3 и R4 представляют собой G-1, где R1A представляет собой F, и R1B и R1C представляют собой метил или трифторметил; и R1представляет собой 2-метилпропил или 2,2-диметилпропил.
В одном варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой фенил или нафтил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, тиоамидо-группы, амино-группы, алкиламино-группы, диалкиламино-группы, алкила, галогеналкила, алкенила, галогеналкенила, алкинила, галогеналкинила, SF5, R5S(O)-, R5S(O)2-, R5C(O)-, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, циклоалкила, гетероалкила, гетероциклила, арила, гетероарила, -O-гетероарила, -S-гетероарила, -O-гетероциклила или -S-гетероциклила, где каждый циклоалкил, гетероалкил, арил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, тиоамидо-группы, амино-группы, алкиламино-группы, диалкиламино-группы, алкила, галогеналкила, алкенила, галогеналкенила, алкинила, галогеналкинила, SF5, R5S(O)-, R5S(O)2-, R5C(O)-, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN и -NO2;
Ra и Rb могут независимо представлять собой атом водорода, C1-C3алкил или C1-C3галогеналкил;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или C1-C3алкил;
R1 и R3 независимо представляют собой C1-C6 алкил, замещенный одним или больше заместителями, выбранными из группы, состоящей из арила, гетероарила, гетероциклила, галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, алкилсульфинила, галогеналкилсульфинила, алкилсульфонила, галогеналкилсульфонила, алкоксиалкокси-группы, оксо-группы, циано-группы, амино-группы, алкиламино-группы и диалкиламино-группы;
R2 и R4 независимо представляют собой незамещенный C1-C6 алкил; и
R5 и R6 независимо представляют собой атом водорода, алкил, галогеналкил, тиоалкил, алкилтиоалкил, гидроксиалкил, алкоксиалкил, алкенил, галогеналкенил, алкинил, галогеналкинил или группу -CH2C(O)NHCH2CF3; или R5 и R6 вместе с атомом(-ами), с которыми они связаны, образуют C3-C6 циклическую группу.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой фенил или нафтил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, амино-группы, алкиламино-группы, диалкиламино-группы, алкила, галогеналкила, SF5, R5S(O)-, R5S(O)2-, R5C(O)-, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, циклоалкила, гетероциклила, гетероарила, -O-гетероарила, -S-гетероарила, -O-гетероциклила или -S-гетероциклила, где каждый циклоалкил, гетероалкил, арил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, амино-группы, алкиламино-группы, диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, C1-C3алкил или C1-C3галогеналкил;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или C1-C3алкил; и
R1 и R3 независимо представляют собой C1-C6 алкил, замещенный одним или больше атомами галогена, необязательно замещенным фенилом или необязательно замещенным гетероарилом, выбранным из группы, состоящей из тиенила, оксазолила, изотиазолила, 1,3-4-тиадиазолила, пиразолила, фурила, имидазолила, пирролила, пиридинила, пиридазинила, пиримидинила, пиразинила, триазинила и тетразинила;
R2 и R4 независимо представляют собой незамещенный C1-C6 алкил; и
R5 и R6 независимо представляют собой атом водорода, алкил, галогеналкил или группу -CH2C(O)NHCH2CF3.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой фенил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3диалкиламино-группы, C1-C3алкила, C1-C3галогеналкила, SF5, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, фенила, C3-C6циклоалкила, C4-C7гетероциклила, C5-C6гетероарила, -O-C5-C6гетероарила, -S-C5-C6гетероарила, -O-C4-C7гетероциклила или -S-C4-C7гетероциклила, где каждый циклоалкил, гетероциклил, фенил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, амино-группы, алкиламино-группы, диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, C1-C3алкил или C1-C3галогеналкил;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил; и
R1 и R3 независимо представляют собой C1-C6алкил, замещенный одним или больше атомами галогена, необязательно замещенным фенилом или необязательно замещенным гетероарилом, выбранным из группы, состоящей из тиенила, оксазолила, изотиазолила, 1,3-4-тиадиазолила, пиразолила, фурила, имидазолила, пирролила, пиридинила, пиридазинила, пиримидинила, пиразинила, триазинила и тетразинила;
R2 и R4 независимо представляют собой 2-метилпропил или 2,2-диметилпропил; и
R5 и R6 независимо представляют собой атом водорода, C1-C3алкил или C1-C3галогеналкил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой фенил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, C1-C3алкила, C1-C3галогеналкила, R5R6NC(O)-, фенила, C3-C6циклоалкила, C4-C6гетероциклила, C5-C6гетероарила, -O-C5-C6гетероарила, -S-C5-C6гетероарила, -O-C4-C6гетероциклила или -S-C4-C6гетероциклила, где каждый циклоалкил, гетероциклил, фенил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, CN, NO2, SF5, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, амино-группы, алкиламино-группы, диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, метил или CF3;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил; и
R1 и R3 независимо представляют собой -CH2CX(CH3)2,где X представляет собойгалоген;
R2 и R4 независимо представляют собой 2-метилпропил или 2,2-диметилпропил; и
R5 и R6 независимо представляют собой атом водорода, C1-C3алкил или C1-C3галогеналкил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой фенил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, CN, NO2, SF5, C1-C3алкила, C1-C3галогеналкила, C3-C6циклоалкила, морфолино-группы, тетрагидропирана, тетрагидрофурана, пиперидино-группы или пирролидино-группы, где каждый C3-C6циклоалкил, морфолино-группа, тетрагидропиран, тетрагидрофуран, пиперидино-группа или пирролидино-группа необязательно дополнительно замещены одним или больше заместителями, выбранными из группы, состоящей из галогена, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, алкиламино-группы, диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, метил или CF3;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил; и
R1 и R3 независимо представляют собой -CH2CX(CH3)2,где X представляет собойгалоген; и
R2 и R4 независимо представляют собой 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой фенил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, NO2, SF5, метила, CF3, OCF3, циклопропила, циклобутила, циклопентила, циклогексила, морфолинила, тетрагидропиранила, тетрагидрофурила, пиперидинила, -S-тетразолила или пирролидинила, где каждый циклопропил, циклобутил, циклопентил, циклогексил, морфолино-группа, тетрагидропиран, тетрагидрофуран, пиперидино-группа или пирролидино-группа необязательно дополнительно замещены одним или больше заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, метил или CF3;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил; и
R1 и R3 независимо представляют собой -CH2CX(CH3)2, где X представляет собойгалоген; и
R2 и R4 независимо представляют собой 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой фенил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, NO2, SF5, метила, CF3, OCF3, циклогексила, морфолинила, тетрагидропиранила, тетрагидрофурила, пиперидинила или пирролидинила, где каждый циклогексил, морфолинил, тетрагидропиранил, тетрагидрофурил, пиперидинил или пирролидинил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, метил или CF3;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил; и
R1 и R3 независимо представляют собой -CH2CF(CH3)2; и
R2 и R4 независимо представляют собой 2-метилпропил или 2,2-диметилпропил.
В одном варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой фенил или нафтил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, тиоамидо-группы, амино-группы, алкиламино-группы, диалкиламино-группы, алкила, галогеналкила, алкенила, галогеналкенила, алкинила, галогеналкинила, SF5, R5S(O)-, R5S(O)2-, R5C(O)-, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, циклоалкила, гетероалкила, гетероциклила, арила, гетероарила, -O-гетероарила, -S-гетероарила, -O-гетероциклила или -S-гетероциклила, где каждый циклоалкил, гетероалкил, арил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, тиоамидо-группы, амино-группы, алкиламино-группы, диалкиламино-группы, алкила, галогеналкила, алкенила, галогеналкенила, алкинила, галогеналкинила, SF5, R5S(O)-, R5S(O)2-, R5C(O)-, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN и -NO2;
Ra и Rb могут независимо представлять собой атом водорода, C1-C3алкил или C1-C3галогеналкил;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или C1-C3алкил;
R2 и R4 независимо представляют собой C1-C6 алкил, замещенный одним или больше заместителями, выбранными из группы, состоящей из арила, гетероарила, гетероциклила, галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, алкилсульфинила, галогеналкилсульфинила, алкилсульфонила, галогеналкилсульфонила, алкоксиалкокси-группы, оксо-группы, циано-группы, амино-группы, алкиламино-группы и диалкиламино-группы;
R1 и R3 независимо представляют собой незамещенный C1-C6 алкил; и
R5 и R6 независимо представляют собой атом водорода, алкил, галогеналкил, тиоалкил, алкилтиоалкил, гидроксиалкил, алкоксиалкил, алкенил, галогеналкенил, алкинил, галогеналкинил или группу -CH2C(O)NHCH2CF3; или R5 и R6 вместе с атомом(-ами), с которыми они связаны, образуют C3-C6 циклическую группу.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой фенил или нафтил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, амино-группы, алкиламино-группы, диалкиламино-группы, алкила, галогеналкила, SF5, R5S(O)-, R5S(O)2-, R5C(O)-, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, циклоалкила, гетероциклила, гетероарила, -O-гетероарила, -S-гетероарила, -O-гетероциклила или -S-гетероциклила, где каждый циклоалкил, гетероалкил, арил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, амино-группы, алкиламино-группы, диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, C1-C3алкил или C1-C3галогеналкил;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или C1-C3алкил;
R2 и R4 независимо представляют собой C1-C6 алкил, замещенный одним или больше атомами галогена, необязательно замещенным фенилом или необязательно замещенным гетероарилом, выбранным из группы, состоящей из тиенила, оксазолила, изотиазолила, 1,3-4-тиадиазолила, пиразолила, фурила, имидазолила, пирролила, пиридинила, пиридазинила, пиримидинила, пиразинила, триазинила и тетразинила;
R1 и R3 независимо представляют собой незамещенный C1-C6 алкил; и
R5 и R6 независимо представляют собой атом водорода, алкил, галогеналкил или группу -CH2C(O)NHCH2CF3.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой фенил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3диалкиламино-группы, C1-C3алкила, C1-C3галогеналкила, SF5, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, фенила, C3-C6циклоалкила, C4-C7гетероциклила, C5-C6гетероарила, -O-C5-C6гетероарила, -S-C5-C6гетероарила, -O-C4-C7гетероциклила или -S-C4-C7гетероциклила, где каждый циклоалкил, гетероциклил, фенил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, амино-группы, алкиламино-группы, диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, C1-C3алкил или C1-C3галогеналкил;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил; и
R2 и R4 независимо представляют собой C1-C6алкил, замещенный одним или больше атомами галогена, необязательно замещенным фенилом или необязательно замещенным гетероарилом, выбранным из группы, состоящей из тиенила, оксазолила, изотиазолила, 1,3-4-тиадиазолила, пиразолила, фурила, имидазолила, пирролила, пиридинила, пиридазинила, пиримидинила, пиразинила, триазинила и тетразинила;
R1 и R3 независимо представляют собой 2-метилпропил или 2,2-диметилпропил; и
R5 и R6 независимо представляют собой атом водорода, C1-C3алкил или C1-C3галогеналкил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой фенил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, C1-C3алкила, C1-C3галогеналкила, R5R6NC(O)-, фенила, C3-C6циклоалкила, C4-C6гетероциклила, C5-C6гетероарила, -O-C5-C6гетероарила, -S-C5-C6гетероарила, -O-C4-C6гетероциклила или -S-C4-C6гетероциклила, где каждый циклоалкил, гетероциклил, фенил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, CN, NO2, SF5, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, амино-группы, алкиламино-группы, диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, метил или CF3;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил; и
R2 и R4 независимо представляют собой -CH2CX(CH3)2, где X представляет собойгалоген;
R1 и R3 независимо представляют собой 2-метилпропил или 2,2-диметилпропил; и
R5 и R6 независимо представляют собой атом водорода, C1-C3алкил или C1-C3галогеналкил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой фенил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, CN, NO2, SF5, C1-C3алкила, C1-C3галогеналкила, C3-C6циклоалкила, морфолино-группы, тетрагидропирана, тетрагидрофурана, пиперидино-группы или пирролидино-группы, где каждый C3-C6циклоалкил, морфолино-группа, тетрагидропиран, тетрагидрофуран, пиперидино-группа или пирролидино-группа необязательно дополнительно замещены одним или больше заместителями, выбранными из группы, состоящей из галогена, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, алкиламино-группы, диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, метил или CF3;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил; и
R2 и R4 независимо представляют собой -CH2CX(CH3)2, где X представляет собойгалоген;
R1 и R3 независимо представляют собой 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой фенил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, NO2, SF5, метила, CF3, OCF3, циклопропила, циклобутила, циклопентила, циклогексила, морфолинила, тетрагидропиранила, тетрагидрофурила, пиперидинила, -S-тетразолила или пирролидинила, где каждый циклопропил, циклобутил, циклопентил, циклогексил, морфолино-группа, тетрагидропиран, тетрагидрофуран, пиперидино-группа или пирролидино-группа необязательно дополнительно замещены одним или больше заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, метил или CF3;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил;
R2 и R4 независимо представляют собой -CH2CX(CH3)2, где X представляет собойгалоген; и
R1 и R3 независимо представляют собой 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой фенил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, NO2, SF5, метила, CF3, OCF3, циклогексила, морфолинила, тетрагидропиранила, тетрагидрофурила, пиперидинила или пирролидинила, где каждый циклогексил, морфолинил, тетрагидропиранил, тетрагидрофурил, пиперидинил или пирролидинил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, метил или CF3;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил; и
R2 и R4 независимо представляют собой -CH2CF(CH3)2; и
R1 и R3 независимо представляют собой 2-метилпропил или 2,2-диметилпропил.
В одном варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой гетероарил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, тиоамидо-группы, амино-группы, алкиламино-группы, диалкиламино-группы, алкила, галогеналкила, алкенила, галогеналкенила, алкинила, галогеналкинила, SF5, R5S(O)-, R5S(O)2-, R5C(O)-, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, циклоалкила, гетероалкила, гетероциклила, арила, гетероарила, -O-гетероарила, -S-гетероарила, -O-гетероциклила или -S-гетероциклила, где каждый циклоалкил, гетероалкил, арил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, тиоамидо-группы, амино-группы, алкиламино-группы, диалкиламино-группы, алкила, галогеналкила, алкенила, галогеналкенила, алкинила, галогеналкинила, SF5, R5S(O)-, R5S(O)2-, R5C(O)-, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN и -NO2;
Ra и Rb могут независимо представлять собой атом водорода, C1-C3алкил или C1-C3галогеналкил;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или C1-C3алкил; и
R1 и R3 независимо представляют собой C1-C6 алкил, замещенный одним или больше заместителями, выбранными из группы, состоящей из арила, гетероарила, гетероциклила, галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, алкилсульфинила, галогеналкилсульфинила, алкилсульфонила, галогеналкилсульфонила, алкоксиалкокси-группы, оксо-группы, циано-группы, амино-группы, алкиламино-группы и диалкиламино-группы;
R2 и R4 независимо представляют собой незамещенный C1-C6 алкил; и
R5 и R6 независимо представляют собой атом водорода, алкил, галогеналкил, тиоалкил, алкилтиоалкил, гидроксиалкил, алкоксиалкил, алкенил, галогеналкенил, алкинил, галогеналкинил или группу -CH2C(O)NHCH2CF3; или R5 и R6 вместе с атомом(-ами), с которыми они связаны, образуют C3-C6 циклическую группу.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой гетероарил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, амино-группы, алкиламино-группы, диалкиламино-группы, алкила, галогеналкила, SF5, R5S(O)-, R5S(O)2-, R5C(O)-, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, циклоалкила, гетероциклила, гетероарила, -O-гетероарила, -S-гетероарила, -O-гетероциклила или -S-гетероциклила, где каждый циклоалкил, гетероалкил, арил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, амино-группы, алкиламино-группы, диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, C1-C3алкил или C1-C3галогеналкил;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или C1-C3алкил;
R1 и R3 независимо представляют собой C1-C6 алкил, замещенный одним или больше арилами, гетероарилами, гетероциклилами или галогенами;
R2 и R4 независимо представляют собой незамещенный C1-C6 алкил; и
R5 и R6 независимо представляют собой атом водорода, алкил, галогеналкил или группу -CH2C(O)NHCH2CF3.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой тиенил, оксазолил, изотиазолил, 1,3-4-тиадиазолил, пиразолил, фурил, имидазолил, пирролил, пиридинил, пиридазинил, пиримидинил, пиразинил, триазинил или тетразинил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3диалкиламино-группы, C1-C3алкила, C1-C3галогеналкила, SF5, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, фенила, C3-C6циклоалкила, C4-C7гетероциклила, C5-C6гетероарила, -O-C5-C6гетероарила, -S-C5-C6гетероарила, -O-C4-C7гетероциклила или -S-C4-C7гетероциклила, где каждый циклоалкил, гетероциклил, фенил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, амино-группы, алкиламино-группы, диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, C1-C3алкил или C1-C3галогеналкил;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил;
R1 и R3 независимо представляют собой C1-C6алкил, замещенный одним или более галогенами, необязательно замещенным фенилом или необязательно замещенным гетероарилом, выбранным из группы, состоящей из тиенила, оксазолила, изотиазолила, 1,3-4-тиадиазолила, пиразолила, фурила, имидазолила, пирролила, пиридинила, пиридазинила, пиримидинила, пиразинила, триазинила и тетразинила;
R2 и R4 независимо представляют собой 2-метилпропил или 2,2-диметилпропил; и
R5 и R6 независимо представляют собой атом водорода, C1-C3алкил или C1-C3галогеналкил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой пиридинил, пиримидинил, пиридазинил, пиразинил, триазинил или тетразинил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, C1-C3алкила, C1-C3галогеналкила, R5R6NC(O)-, фенила, C3-C6циклоалкила, C4-C6гетероциклила, C5-C6гетероарила, -O-C5-C6гетероарила, -S-C5-C6гетероарила, -O-C4-C6гетероциклила или -S-C4-C6гетероциклила, где каждый циклоалкил, гетероциклил, фенил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, CN, NO2, SF5, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, амино-группы, алкиламино-группы, диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, метил или CF3;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил;
R1 и R3 независимо представляют собой -CH2CX(CH3)2, где X представляет собойгалоген;
R2 и R4 независимо представляют собой 2-метилпропил или 2,2-диметилпропил; и
R5 и R6 независимо представляют собой атом водорода, C1-C3алкил или C1-C3галогеналкил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой пиридинил, пиримидинил, пиридазинил, или пиразинил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, CN, NO2, SF5, C1-C3алкила, C1-C3галогеналкила, C3-C6циклоалкила, морфолино-группы, тетрагидропирана, тетрагидрофурана, пиперидино-группы или пирролидино-группы, где каждый C3-C6циклоалкил, морфолино-группа, тетрагидропиран, тетрагидрофуран, пиперидино-группа или пирролидино-группа необязательно дополнительно замещены одним или больше заместителями, выбранными из группы, состоящей из галогена, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, алкиламино-группы, диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила
Ra и Rb могут независимо представлять собой атом водорода, метил или CF3;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил; и
R1 и R3 независимо представляют собой -CH2CX(CH3)2, где X представляет собойгалоген; и
R2 и R4 независимо представляют собой 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой пиридил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, NO2, SF5, метила, CF3, OCF3, циклопропила, циклобутила, циклопентила, циклогексила, морфолинила, тетрагидропиранила, тетрагидрофурила, пиперидинила, -S-тетразолила или пирролидинила, где каждый циклопропил, циклобутил, циклопентил, циклогексил, морфолино-группа, тетрагидропиран, тетрагидрофуран, пиперидино-группа или пирролидино-группа необязательно дополнительно замещены одним или больше заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, метил или CF3;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил;
R1 и R3 независимо представляют собой -CH2CX(CH3)2, где X представляет собойгалоген; и
R2 и R4 независимо представляют собой 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой пиридил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, NO2, SF5, метила, CF3, OCF3, циклогексила, морфолинила, тетрагидропиранила, тетрагидрофурила, пиперидинила или пирролидинила, где каждый циклогексил, морфолинил, тетрагидропиранил, тетрагидрофурил, пиперидинил или пирролидинил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, метил или CF3;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил; и
R1 и R3 независимо представляют собой -CH2CF(CH3)2; и
R2 и R4 независимо представляют собой 2-метилпропил или 2,2-диметилпропил.
В одном варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой гетероарил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, тиоамидо-группы, амино-группы, алкиламино-группы, диалкиламино-группы, алкила, галогеналкила, алкенила, галогеналкенила, алкинила, галогеналкинила, SF5, R5S(O)-, R5S(O)2-, R5C(O)-, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, циклоалкила, гетероалкила, гетероциклила, арила, гетероарила, -O-гетероарила, -S-гетероарила, -O-гетероциклила или -S-гетероциклила, где каждый циклоалкил, гетероалкил, арил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, тиоамидо-группы, амино-группы, алкиламино-группы, диалкиламино-группы, алкила, галогеналкила, алкенила, галогеналкенила, алкинила, галогеналкинила, SF5, R5S(O)-, R5S(O)2-, R5C(O)-, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN и -NO2;
Ra и Rb могут независимо представлять собой атом водорода, C1-C3алкил или C1-C3галогеналкил;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или C1-C3алкил;
R2 и R4 независимо представляют собой C1-C6 алкил, замещенный одним или больше заместителями, выбранными из группы, состоящей из арила, гетероарила, гетероциклила, галогена, гидрокси-группы, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, алкилсульфинила, галогеналкилсульфинила, алкилсульфонила, галогеналкилсульфонила, алкоксиалкокси-группы, оксо-группы, циано-группы, амино-группы, алкиламино-группы и диалкиламино-группы;
R1 и R3 независимо представляют собой незамещенный C1-C6 алкил; и
R5 и R6 независимо представляют собой атом водорода, алкил, галогеналкил, тиоалкил, алкилтиоалкил, гидроксиалкил, алкоксиалкил, алкенил, галогеналкенил, алкинил, галогеналкинил или группу -CH2C(O)NHCH2CF3; или R5 и R6 вместе с атомом(-ами), с которыми они связаны, образуют C3-C6 циклическую группу.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой гетероарил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, амино-группы, алкиламино-группы, диалкиламино-группы, алкила, галогеналкила, SF5, R5S(O)-, R5S(O)2-, R5C(O)-, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, циклоалкила, гетероциклила, гетероарила, -O-гетероарила, -S-гетероарила, -O-гетероциклила или -S-гетероциклила, где каждый циклоалкил, гетероалкил, арил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, амино-группы, алкиламино-группы, диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, C1-C3алкил или C1-C3галогеналкил;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или C1-C3алкил;
R2 и R4 независимо представляют собой C1-C6 алкил, замещенный одним или больше арилами, гетероарилами, гетероциклилами или галогенами;
R1 и R3 независимо представляют собой незамещенный C1-C6 алкил; и
R5 и R6 независимо представляют собой атом водорода, алкил, галогеналкил или группу -CH2C(O)NHCH2CF3.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой тиенил, оксазолил, изотиазолил, 1,3-4-тиадиазолил, пиразолил, фурил, имидазолил, пирролил, пиридинил, пиридазинил, пиримидинил, пиразинил, триазинил или тетразинил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3диалкиламино-группы, C1-C3алкила, C1-C3галогеналкила, SF5, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, фенила, C3-C6циклоалкила, C4-C7гетероциклила, C5-C6гетероарила, -O-C5-C6гетероарила, -S-C5-C6гетероарила, -O-C4-C7гетероциклила или -S-C4-C7гетероциклила, где каждый циклоалкил, гетероциклил, фенил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, амино-группы, алкиламино-группы, диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, C1-C3алкил или C1-C3галогеналкил;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил; и
R2 и R4 независимо представляют собой C1-C6алкил, замещенный одним или более галогенами, необязательно замещенным фенилом или необязательно замещенным гетероарилом, выбранным из группы, состоящей из тиенила, оксазолила, изотиазолила, 1,3-4-тиадиазолила, пиразолила, фурила, имидазолила, пирролила, пиридинила, пиридазинила, пиримидинила, пиразинила, триазинила и тетразинила;
R1 и R3 независимо представляют собой 2-метилпропил или 2,2-диметилпропил; и
R5 и R6 независимо представляют собой атом водорода, C1-C3алкил или C1-C3галогеналкил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой пиридинил, пиримидинил, пиридазинил, пиразинил, триазинил или тетразинил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, C1-C3алкила, C1-C3галогеналкила, R5R6NC(O)-, фенила, C3-C6циклоалкила, C4-C6гетероциклила, C5-C6гетероарила, -O-C5-C6гетероарила, -S-C5-C6гетероарила, -O-C4-C6гетероциклила или -S-C4-C6гетероциклила, где каждый циклоалкил, гетероциклил, фенил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, CN, NO2, SF5, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, амино-группы, алкиламино-группы, диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, метил или CF3;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил;
R2 и R4 независимо представляют собой -CH2CX(CH3)2, где X представляет собойгалоген;
R1 и R3 независимо представляют собой 2-метилпропил или 2,2-диметилпропил; и
R5 и R6 независимо представляют собой атом водорода, C1-C3алкил или C1-C3галогеналкил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой пиридинил, пиримидинил, пиридазинил, или пиразинил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, CN, NO2, SF5, C1-C3алкила, C1-C3галогеналкила, C3-C6циклоалкила, морфолино-группы, тетрагидропирана, тетрагидрофурана, пиперидино-группы или пирролидино-группы, где каждый C3-C6циклоалкил, морфолино-группа, тетрагидропиран, тетрагидрофуран, пиперидино-группа или пирролидино-группа необязательно дополнительно замещены одним или больше заместителями, выбранными из группы, состоящей из галогена, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, алкиламино-группы, диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, метил или CF3;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил;
R2 и R4 независимо представляют собой -CH2CX(CH3)2, где X представляет собойгалоген; и
R1 и R3 независимо представляют собой 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой пиридил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, NO2, SF5, метила, CF3, OCF3, циклопропила, циклобутила, циклопентила, циклогексила, морфолинила, тетрагидропиранила, тетрагидрофурила, пиперидинила, -S-тетразолила или пирролидинила, где каждый циклопропил, циклобутил, циклопентил, циклогексил, морфолино-группа, тетрагидропиран, тетрагидрофуран, пиперидино-группа или пирролидино-группа необязательно дополнительно замещены одним или больше заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, метил или CF3;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил; и
R2 и R4 независимо представляют собой -CH2CX(CH3)2, где X представляет собойгалоген; и
R1 и R3 независимо представляют собой 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой пиридил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, NO2, SF5, метила, CF3, OCF3, циклогексила, морфолинила, тетрагидропиранила, тетрагидрофурила, пиперидинила или пирролидинила, где каждый циклогексил, морфолинил, тетрагидропиранил, тетрагидрофурил, пиперидинил или пирролидинил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, метил или CF3;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил;
R2 и R4 независимо представляют собой -CH2CF(CH3)2; и
R1 и R3 независимо представляют собой 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой гетероарил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3диалкиламино-группы, C1-C3алкила, C1-C3галогеналкила, SF5, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, фенила, C3-C6циклоалкила, C4-C7гетероциклила, C5-C6гетероарила, -O-C5-C6гетероарила, -S-C5-C6гетероарила, -O-C4-C7гетероциклила или -S-C4-C7гетероциклила, где каждый циклоалкил, гетероциклил, фенил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, амино-группы, алкиламино-группы, диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, C1-C3алкил или C1-C3галогеналкил;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил;
R1 и R2 независимо представляют собой C1-C6алкил, замещенный одним или более галогенами, арилами, гетероарилами или гетероциклилами;
R3 и R4 независимо представляют собой 2-метилпропил или 2,2-диметилпропил; и
R5 и R6 независимо представляют собой атом водорода, C1-C3алкил или C1-C3галогеналкил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой гетероарил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3диалкиламино-группы, C1-C3алкила, C1-C3галогеналкила, SF5, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, фенила, C3-C6циклоалкила,C4-C7гетероциклила,C5-C6гетероарила, -O-C5-C6гетероарила, -S-C5-C6гетероарила, -O-C4-C7гетероциклила или -S-C4-C7гетероциклила, где каждый циклоалкил, гетероциклил, фенил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, амино-группы, алкиламино-группы, диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, C1-C3алкил или C1-C3галогеналкил;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил; и
R3 и R4 независимо представляют собой C1-C6алкил, замещенный одним или более галогенами, арилами, гетероарилами или гетероциклилами;
R1 и R2 независимо представляют собой 2-метилпропил или 2,2-диметилпропил; и
R5 и R6 независимо представляют собой атом водорода, C1-C3алкил или C1-C3галогеналкил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой гетероарил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3диалкиламино-группы, C1-C3алкила, C1-C3галогеналкила, SF5, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, фенила, C3-C6циклоалкила,C4-C7гетероциклила,C5-C6гетероарила, -O-C5-C6гетероарила, -S-C5-C6гетероарила, -O-C4-C7гетероциклила или -S-C4-C7гетероциклила, где каждый циклоалкил, гетероциклил, фенил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, амино-группы, алкиламино-группы, диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, C1-C3алкил или C1-C3галогеналкил;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил;
R2 и R3 независимо представляют собой C1-C6алкил, замещенный одним или более галогенами, арилами, гетероарилами или гетероциклилами;
R1 и R4 независимо представляют собой 2-метилпропил или 2,2-диметилпропил; и
R5 и R6 независимо представляют собой атом водорода, C1-C3алкил или C1-C3галогеналкил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой гетероарил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3диалкиламино-группы, C1-C3алкила, C1-C3галогеналкила, SF5, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, фенила, C3-C6циклоалкила,C4-C7гетероциклила,C5-C6гетероарила, -O-C5-C6гетероарила, -S-C5-C6гетероарила, -O-C4-C7гетероциклила или -S-C4-C7гетероциклила, где каждый циклоалкил, гетероциклил, фенил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, амино-группы, алкиламино-группы, диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, C1-C3алкил или C1-C3галогеналкил;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил;
R1 и R4 независимо представляют собой C1-C6алкил, замещенный одним или более галогенами, арилами, гетероарилами или гетероциклилами;
R2 и R3 независимо представляют собой 2-метилпропил или 2,2-диметилпропил; и
R5 и R6 независимо представляют собой атом водорода, C1-C3алкил или C1-C3галогеналкил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой гетероарил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, NO2, SF5, метила, CF3, OCF3, циклогексила, морфолинила, тетрагидропиранила, тетрагидрофурила, пиперидинила или пирролидинила, где каждый циклогексил, морфолинил, тетрагидропиранил, тетрагидрофурил, пиперидинил или пирролидинил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, метил или CF3;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил;
R1 и R2 представляют собой -CH2CF(CH3)2; и
R3 и R4 независимо представляют собой 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой гетероарил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, NO2, SF5, метила, CF3, OCF3, циклогексила, морфолинила, тетрагидропиранила, тетрагидрофурила, пиперидинила или пирролидинила, где каждый циклогексил, морфолинил, тетрагидропиранил, тетрагидрофурил, пиперидинил или пирролидинил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, метил или CF3;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил;
R3 и R4 представляют собой -CH2CF(CH3)2; и
R1 и R2 независимо представляют собой 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой гетероарил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, NO2, SF5, метила, CF3, OCF3, циклогексила, морфолинила, тетрагидропиранила, тетрагидрофурила, пиперидинила или пирролидинила, где каждый циклогексил, морфолинил, тетрагидропиранил, тетрагидрофурил, пиперидинил или пирролидинил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, метил или CF3;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил; и
R2 и R3 представляют собой -CH2CF(CH3)2; и
R1 и R4 независимо представляют собой 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой гетероарил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, NO2, SF5, метила, CF3, OCF3, циклогексила, морфолинила, тетрагидропиранила, тетрагидрофурила, пиперидинила или пирролидинила, где каждый циклогексил, морфолинил, тетрагидропиранил, тетрагидрофурил, пиперидинил или пирролидинил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, метил или CF3;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил; и
R1 и R4 представляют собой -CH2CF(CH3)2; и
R2 и R3 независимо представляют собой 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой гетероарил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3диалкиламино-группы, C1-C3алкила, C1-C3галогеналкила, SF5, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, фенила, C3-C6циклоалкила,C4-C7гетероциклила,C5-C6гетероарила, -O-C5-C6гетероарила, -S-C5-C6гетероарила, -O-C4-C7гетероциклила или -S-C4-C7гетероциклила, где каждый циклоалкил, гетероциклил, фенил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, амино-группы, алкиламино-группы, диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, C1-C3алкил или C1-C3галогеналкил;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил; и
R1, R2 и R3 независимо представляют собой C1-C6алкил, замещенный одним или более галогенами, арилами, гетероарилами или гетероциклилами;
R4 представляет собой 2-метилпропил или 2,2-диметилпропил; и
R5 и R6 независимо представляют собой атом водорода, C1-C3алкил или C1-C3галогеналкил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой гетероарил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3диалкиламино-группы, C1-C3алкила, C1-C3галогеналкила, SF5, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, фенила, C3-C6циклоалкила,C4-C7гетероциклила,C5-C6гетероарила, -O-C5-C6гетероарила, -S-C5-C6гетероарила, -O-C4-C7гетероциклила или -S-C4-C7гетероциклила, где каждый циклоалкил, гетероциклил, фенил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, амино-группы, алкиламино-группы, диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, C1-C3алкил или C1-C3галогеналкил;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил;
R1, R2 и R4 независимо представляют собой C1-C6алкил, замещенный одним или более галогенами, арилами, гетероарилами или гетероциклилами;
R3 представляет собой 2-метилпропил или 2,2-диметилпропил; и
R5 и R6 независимо представляют собой атом водорода, C1-C3алкил или C1-C3галогеналкил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой гетероарил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3диалкиламино-группы, C1-C3алкила, C1-C3галогеналкила, SF5, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, фенила, C3-C6циклоалкила,C4-C7гетероциклила,C5-C6гетероарила, -O-C5-C6гетероарила, -S-C5-C6гетероарила, -O-C4-C7гетероциклила или -S-C4-C7гетероциклила, где каждый циклоалкил, гетероциклил, фенил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, амино-группы, алкиламино-группы, диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, C1-C3алкил или C1-C3галогеналкил;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил;
R1, R3 и R4 независимо представляют собой C1-C6алкил, замещенный одним или более галогенами, арилами, гетероарилами или гетероциклилами;
R2 представляет собой 2-метилпропил или 2,2-диметилпропил; и
R5 и R6 независимо представляют собой атом водорода, C1-C3алкил или C1-C3галогеналкил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой гетероарил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3диалкиламино-группы, C1-C3алкила, C1-C3галогеналкила, SF5, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, фенила, C3-C6циклоалкила,C4-C7гетероциклила,C5-C6гетероарила, -O-C5-C6гетероарила, -S-C5-C6гетероарила, -O-C4-C7гетероциклила или -S-C4-C7гетероциклила, где каждый циклоалкил, гетероциклил, фенил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, амино-группы, алкиламино-группы, диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, C1-C3алкил или C1-C3галогеналкил;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил;
R2, R3 и R4 независимо представляют собой C1-C6алкил, замещенный одним или более галогенами, арилами, гетероарилами или гетероциклилами;
R1 представляет собой 2-метилпропил или 2,2-диметилпропил; и
R5 и R6 независимо представляют собой атом водорода, C1-C3алкил или C1-C3галогеналкил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой гетероарил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, NO2, SF5, метила, CF3, OCF3, циклогексила, морфолинила, тетрагидропиранила, тетрагидрофурила, пиперидинила или пирролидинила, где каждый циклогексил, морфолинил, тетрагидропиранил, тетрагидрофурил, пиперидинил или пирролидинил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, метил или CF3;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил;
R1, R2 и R3 представляют собой -CH2CF(CH3)2; и
R4 представляет собой 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой гетероарил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, NO2, SF5, метила, CF3, OCF3, циклогексила, морфолинила, тетрагидропиранила, тетрагидрофурила, пиперидинила или пирролидинила, где каждый циклогексил, морфолинил, тетрагидропиранил, тетрагидрофурил, пиперидинил или пирролидинил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, метил или CF3;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил;
R1, R2 и R4 представляют собой -CH2CF(CH3)2; и
R3 представляет собой 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой гетероарил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, NO2, SF5, метила, CF3, OCF3, циклогексила, морфолинила, тетрагидропиранила, тетрагидрофурила, пиперидинила или пирролидинила, где каждый циклогексил, морфолинил, тетрагидропиранил, тетрагидрофурил, пиперидинил или пирролидинил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, метил или CF3;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил;
R1, R3 и R4 представляют собой -CH2CF(CH3)2; и
R2 представляет собой 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой гетероарил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, NO2, SF5, метила, CF3, OCF3, циклогексила, морфолинила, тетрагидропиранила, тетрагидрофурила, пиперидинила или пирролидинила, где каждый циклогексил, морфолинил, тетрагидропиранил, тетрагидрофурил, пиперидинил или пирролидинил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, метил или CF3;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил;
R2, R3 и R4 представляют собой -CH2CF(CH3)2; и
R1 представляет собой 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой гетероарил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3диалкиламино-группы, C1-C3алкила, C1-C3галогеналкила, SF5, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, фенила, C3-C6циклоалкила,C4-C7гетероциклила,C5-C6гетероарила, -O-C5-C6гетероарила, -S-C5-C6гетероарила, -O-C4-C7гетероциклила или -S-C4-C7гетероциклила, где каждый циклоалкил, гетероциклил, фенил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, амино-группы, алкиламино-группы, диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, C1-C3алкил или C1-C3галогеналкил;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил; и
R1, R2, R3 и R4 независимо представляют собой C1-C6алкил, замещенный одним или более галогенами, арилами, гетероарилами или гетероциклилами; и
R5 и R6 независимо представляют собой атом водорода, C1-C3алкил или C1-C3галогеналкил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой гетероарил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, NO2, SF5, метила, CF3, OCF3, циклогексила, морфолинила, тетрагидропиранила, тетрагидрофурила, пиперидинила или пирролидинила, где каждый циклогексил, морфолинил, тетрагидропиранил, тетрагидрофурил, пиперидинил или пирролидинил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, метил или CF3;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил; и
R1, R2, R3 и R4 каждый представляют собой -CH2CF(CH3)2.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой фенил или пиридил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3диалкиламино-группы, C1-C3алкила, C1-C3галогеналкила, SF5, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, фенила, C3-C6циклоалкила,C4-C7гетероциклила,C5-C6гетероарила, -O-C5-C6гетероарила, -S-C5-C6гетероарила, -O-C4-C7гетероциклила или -S-C4-C7гетероциклила, где каждый циклоалкил, гетероциклил, фенил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, амино-группы, алкиламино-группы, диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, C1-C3алкил или C1-C3галогеналкил;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил;
R1 и R2 независимо представляют собой C1-C6алкил, замещенный одним или больше атомами галогена, необязательно замещенным фенилом или необязательно замещенным гетероарилом, выбранным из группы, состоящей из тиенила, оксазолила, изотиазолила, 1,3-4-тиадиазолила, пиразолила, фурила, имидазолила, пирролила, пиридинила, пиридазинила, пиримидинила, пиразинила, триазинила и тетразинила;
R3 и R4 независимо представляют собой 2-метилпропил или 2,2-диметилпропил; и
R5 и R6 независимо представляют собой атом водорода, C1-C3алкил или C1-C3галогеналкил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой фенил или пиридил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3диалкиламино-группы, C1-C3алкила, C1-C3галогеналкила, SF5, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, фенила, C3-C6циклоалкила,C4-C7гетероциклила,C5-C6гетероарила, -O-C5-C6гетероарила, -S-C5-C6гетероарила, -O-C4-C7гетероциклила или -S-C4-C7гетероциклила, где каждый циклоалкил, гетероциклил, фенил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, амино-группы, алкиламино-группы, диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, C1-C3алкил или C1-C3галогеналкил;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил;
R3 и R4 независимо представляют собой C1-C6алкил, замещенный одним или больше атомами галогена, необязательно замещенным фенилом или необязательно замещенным гетероарилом, выбранным из группы, состоящей из тиенила, оксазолила, изотиазолила, 1,3-4-тиадиазолила, пиразолила, фурила, имидазолила, пирролила, пиридинила, пиридазинила, пиримидинила, пиразинила, триазинила и тетразинила;
R1 и R2 независимо представляют собой 2-метилпропил или 2,2-диметилпропил; и
R5 и R6 независимо представляют собой атом водорода, C1-C3алкил или C1-C3галогеналкил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой фенил или пиридил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3диалкиламино-группы, C1-C3алкила, C1-C3галогеналкила, SF5, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, фенила, C3-C6циклоалкила,C4-C7гетероциклила,C5-C6гетероарила, -O-C5-C6гетероарила, -S-C5-C6гетероарила, -O-C4-C7гетероциклила или -S-C4-C7гетероциклила, где каждый циклоалкил, гетероциклил, фенил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, амино-группы, алкиламино-группы, диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, C1-C3алкил или C1-C3галогеналкил;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил;
R2 и R3 независимо представляют собой C1-C6алкил, замещенный одним или больше атомами галогена, необязательно замещенным фенилом или необязательно замещенным гетероарилом, выбранным из группы, состоящей из тиенила, оксазолила, изотиазолила, 1,3-4-тиадиазолила, пиразолила, фурила, имидазолила, пирролила, пиридинила, пиридазинила, пиримидинила, пиразинила, триазинила и тетразинила;
R1 и R4 независимо представляют собой 2-метилпропил или 2,2-диметилпропил; и
R5 и R6 независимо представляют собой атом водорода, C1-C3алкил или C1-C3галогеналкил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой фенил или пиридил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3диалкиламино-группы, C1-C3алкила, C1-C3галогеналкила, SF5, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, фенила, C3-C6циклоалкила,C4-C7гетероциклила,C5-C6гетероарила, -O-C5-C6гетероарила, -S-C5-C6гетероарила, -O-C4-C7гетероциклила или -S-C4-C7гетероциклила, где каждый циклоалкил, гетероциклил, фенил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, амино-группы, алкиламино-группы, диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, C1-C3алкил или C1-C3галогеналкил;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил;
R1 и R4 независимо представляют собой C1-C6алкил, замещенный одним или больше атомами галогена, необязательно замещенным фенилом или необязательно замещенным гетероарилом, выбранным из группы, состоящей из тиенила, оксазолила, изотиазолила, 1,3-4-тиадиазолила, пиразолила, фурила, имидазолила, пирролила, пиридинила, пиридазинила, пиримидинила, пиразинила, триазинила и тетразинила;
R2 и R3 независимо представляют собой 2-метилпропил или 2,2-диметилпропил; и
R5 и R6 независимо представляют собой атом водорода, C1-C3алкил или C1-C3галогеналкил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой фенил или пиридил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, NO2, SF5, метила, CF3, OCF3, циклогексила, морфолинила, тетрагидропиранила, тетрагидрофурила, пиперидинила или пирролидинила, где каждый циклогексил, морфолинил, тетрагидропиранил, тетрагидрофурил, пиперидинил или пирролидинил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3 диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, метил или CF3;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил;
R1 и R2 представляют собой -CH2CF(CH3)2; и
R3 и R4 независимо представляют собой 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой фенил или пиридил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, NO2, SF5, метила, CF3, OCF3, циклогексила, морфолинила, тетрагидропиранила, тетрагидрофурила, пиперидинила или пирролидинила, где каждый циклогексил, морфолинил, тетрагидропиранил, тетрагидрофурил, пиперидинил или пирролидинил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3 диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, метил или CF3;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил;
R3 и R4 представляют собой -CH2CF(CH3)2; и
R1 и R2 независимо представляют собой 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой фенил или пиридил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, NO2, SF5, метил, CF3, OCF3, циклогексила, морфолинила, тетрагидропиранила, тетрагидрофурила, пиперидинила или пирролидинила, где каждый циклогексил, морфолинил, тетрагидропиранил, тетрагидрофурил, пиперидинил или пирролидинил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3 диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, метил или CF3;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил;
R2 и R3 представляют собой -CH2CF(CH3)2; и
R1 и R4 независимо представляют собой 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой фенил или пиридил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, NO2, SF5, метила, CF3, OCF3, циклогексила, морфолинила, тетрагидропиранила, тетрагидрофурила, пиперидинила или пирролидинила, где каждый циклогексил, морфолинил, тетрагидропиранил, тетрагидрофурил, пиперидинил или пирролидинил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3 диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, метил или CF3;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил;
R1 и R4 представляют собой -CH2CF(CH3)2; и
R2 и R3 независимо представляют собой 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой фенил или пиридил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3диалкиламино-группы, C1-C3алкила, C1-C3галогеналкила, SF5, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, фенила, C3-C6циклоалкила,C4-C7гетероциклила,C5-C6гетероарила, -O-C5-C6гетероарила, -S-C5-C6гетероарила, -O-C4-C7гетероциклила или -S-C4-C7гетероциклила, где каждый циклоалкил, гетероциклил, фенил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, амино-группы, алкиламино-группы, диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, C1-C3алкил или C1-C3галогеналкил;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил;
R1, R2 и R3 независимо представляют собой C1-C6алкил, замещенный одним или больше атомами галогена, необязательно замещенным фенилом или необязательно замещенным гетероарилом, выбранным из группы, состоящей из тиенила, оксазолила, изотиазолила, 1,3-4-тиадиазолила, пиразолила, фурила, имидазолила, пирролила, пиридинила, пиридазинила, пиримидинила, пиразинила, триазинила и тетразинила;
R4 представляет собой 2-метилпропил или 2,2-диметилпропил; и
R5 и R6 независимо представляют собой атом водорода, C1-C3алкил или C1-C3галогеналкил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой фенил или пиридил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3диалкиламино-группы, C1-C3алкила, C1-C3галогеналкила, SF5, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, фенила, C3-C6циклоалкила,C4-C7гетероциклила,C5-C6гетероарила, -O-C5-C6гетероарила, -S-C5-C6гетероарила, -O-C4-C7гетероциклила или -S-C4-C7гетероциклила, где каждый циклоалкил, гетероциклил, фенил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, амино-группы, алкиламино-группы, диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, C1-C3алкил или C1-C3галогеналкил;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил;
R1, R2 и R4 независимо представляют собой C1-C6алкил, замещенный галогеном, необязательно замещенным фенилом или необязательно замещенным гетероарилом, выбранным из группы, состоящей из тиенила, оксазолила, изотиазолила, 1,3-4-тиадиазолила, пиразолила, фурила, имидазолила, пирролила, пиридинила, пиридазинила, пиримидинила, пиразинила, триазинила и тетразинила;
R3 представляет собой 2-метилпропил или 2,2-диметилпропил; и
R5 и R6 независимо представляют собой атом водорода, C1-C3алкил или C1-C3галогеналкил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой фенил или пиридил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3диалкиламино-группы, C1-C3алкила, C1-C3галогеналкила, SF5, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, фенила, C3-C6циклоалкила,C4-C7гетероциклила,C5-C6гетероарила, -O-C5-C6гетероарила, -S-C5-C6гетероарила, -O-C4-C7гетероциклила или -S-C4-C7гетероциклила, где каждый циклоалкил, гетероциклил, фенил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, амино-группы, алкиламино-группы, диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, C1-C3алкил или C1-C3галогеналкил;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил;
R1, R3 и R4 независимо представляют собой C1-C6алкил, замещенный галогеном, необязательно замещенным фенилом или необязательно замещенным гетероарилом, выбранным из группы, состоящей из тиенила, оксазолила, изотиазолила, 1,3-4-тиадиазолила, пиразолила, фурила, имидазолила, пирролила, пиридинила, пиридазинила, пиримидинила, пиразинила, триазинила и тетразинила;
R2 представляет собой 2-метилпропил или 2,2-диметилпропил; и
R5 и R6 независимо представляют собой атом водорода, C1-C3алкил или C1-C3галогеналкил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой фенил или пиридил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3диалкиламино-группы, C1-C3алкила, C1-C3галогеналкила, SF5, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, фенила, C3-C6циклоалкила,C4-C7гетероциклила,C5-C6гетероарила, -O-C5-C6гетероарила, -S-C5-C6гетероарила, -O-C4-C7гетероциклила или -S-C4-C7гетероциклила, где каждый циклоалкил, гетероциклил, фенил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, амино-группы, алкиламино-группы, диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, C1-C3алкил или C1-C3галогеналкил;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил;
R2, R3 и R4 независимо представляют собой C1-C6алкил, замещенный галогеном, необязательно замещенным фенилом или необязательно замещенным гетероарилом, выбранным из группы, состоящей из тиенила, оксазолила, изотиазолила, 1,3-4-тиадиазолила, пиразолила, фурила, имидазолила, пирролила, пиридинила, пиридазинила, пиримидинила, пиразинила, триазинила и тетразинила;
R1 представляет собой 2-метилпропил или 2,2-диметилпропил; и
R5 и R6 независимо представляют собой атом водорода, C1-C3алкил или C1-C3галогеналкил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой фенил или пиридил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, NO2, SF5, метила, CF3, OCF3, циклогексила, морфолинила, тетрагидропиранила, тетрагидрофурила, пиперидинила или пирролидинила, где каждый циклогексил, морфолинил, тетрагидропиранил, тетрагидрофурил, пиперидинил или пирролидинил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3 диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, метил или CF3;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил;
R1, R2 и R3 представляют собой -CH2CF(CH3)2; и
R4 представляет собой 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой фенил или пиридил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, NO2, SF5, метила, CF3, OCF3, циклогексила, морфолинила, тетрагидропиранила, тетрагидрофуранила, пиперидинила или пирролидинила, где каждый циклогексил, морфолинил, тетрагидропиранил, тетрагидрофуранил, пиперидинил или пирролидинил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3 диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, метил или CF3;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил;
R1, R2 и R4 представляют собой -CH2CF(CH3)2; и
R3 представляет собой 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой фенил или пиридил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, NO2, SF5, метила, CF3, OCF3, циклогексила, морфолинила, тетрагидропиранила, тетрагидрофуранила, пиперидинила или пирролидинила, где каждый циклогексил, морфолинил, тетрагидропиранил, тетрагидрофуранил, пиперидинил или пирролидинил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3 диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, метил или CF3;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил;
R1, R3 и R4 представляют собой -CH2CF(CH3)2; и
R2 представляет собой 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой фенил или пиридил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, NO2, SF5, метила, CF3, OCF3, циклогексила, морфолинила, тетрагидропиранила, тетрагидрофуранила, пиперидинила или пирролидинила, где каждый циклогексил, морфолинил, тетрагидропиранил, тетрагидрофуранил, пиперидинил или пирролидинил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3 диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, метил или CF3;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил;
R2, R3 и R4 представляют собой -CH2CF(CH3)2; и
R1 представляет собой 2-метилпропил или 2,2-диметилпропил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой фенил или пиридил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3диалкиламино-группы, C1-C3алкила, C1-C3галогеналкила, SF5, R5R6NC(O)-, R5R6NC(O)NR5-, R5OC(O)-, R5C(O)O-, R5C(O)NR6-, -CN, -NO2, фенила, C3-C6циклоалкила,C4-C7гетероциклила,C5-C6гетероарила, -O-C5-C6гетероарила, -S-C5-C6гетероарила, -O-C4-C7гетероциклила или -S-C4-C7гетероциклила, где каждый циклоалкил, гетероциклил, фенил или гетероарил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, алкокси-группы, галогеналкокси-группы, алкилтио-группы, галогеналкилтио-группы, амино-группы, алкиламино-группы, диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, C1-C3алкил или C1-C3галогеналкил;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил;
R1, R2, R3 и R4 независимо представляют собой C1-C6алкил, замещенный галогеном, необязательно замещенным фенилом или необязательно замещенным гетероарилом, выбранным из группы, состоящей из тиенила, оксазолила, изотиазолила, 1,3-4-тиадиазолила, пиразолила, фурила, имидазолила, пирролила, пиридинила, пиридазинила, пиримидинила, пиразинила, триазинила и тетразинила; и
R5 и R6 независимо представляют собой атом водорода, C1-C3алкил или C1-C3галогеналкил.
В другом варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), где:
Cy1 и Cy2 независимо представляют собой фенил или пиридил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, NO2, SF5, метила, CF3, OCF3, циклогексила, морфолинила, тетрагидропиранила, тетрагидрофуранила, пиперидинила или пирролидинила, где каждый циклогексил, морфолинил, тетрагидропиранил, тетрагидрофуранил, пиперидинил или пирролидинил необязательно дополнительно замещен одним или больше заместителями, выбранными из группы, состоящей из галогена, C1-C3алкокси-группы, C1-C3галогеналкокси-группы, C1-C3алкилтио-группы, C1-C3галогеналкилтио-группы, амино-группы, C1-C3алкиламино-группы, C1-C3 диалкиламино-группы, C1-C3алкила или C1-C3галогеналкила;
Ra и Rb могут независимо представлять собой атом водорода, метил или CF3;
R', R'', R''' и R'''' каждый независимо представляют собой атом водорода или метил; и
R1, R2, R3 и R4 каждый представляют собой -CH2CF(CH3)2.
В одном варианте осуществления, в настоящем изобретении описано соединение, имеющее формулу (I), показанную ниже в таблицах 2-39, где R’, R’’, R’’’ и R’’’’ каждый независимо представляют собой атом водорода или C1-C3алкил; и Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 такие, как показано ниже в таблицах 2-39. Во всех таблицах Me означает метил.
Таблица 2. Соединения, имеющие формулу (I), где Cy1 и Cy2 представляют собой незамещенный фенил, и Ra, Rb, R1 - R4 имеют указанные значения
Таблица 3. Соединения, имеющие формулу (I), где Cy1 и Cy2 представляют собой п-фторфенил, и Ra, Rb, R1 - R4 имеют указанные значения
Таблица 4. Соединения, имеющие формулу (I), где Cy1 и Cy2 представляют собой п-трифторметилфенил, и Ra, Rb, R1 - R4 имеют значения, указанные в таблице 2
Таблица 5. Соединения, имеющие формулу (I), где Cy1 и Cy2 представляют собой п-трифторметоксифенил, и Ra, Rb, R1 - R4 имеют указанные значения
Таблица 6. Соединения, имеющие формулу (I), где Cy1 и Cy2 представляют собой

Таблица 7. Соединения, имеющие формулу (I), где Cy1 и Cy2 представляют собой

Таблица 8. Соединения, имеющие формулу (I), где Cy1 и Cy2 представляют собой

Таблица 9. Соединения, имеющие формулу (I), где Cy1 и Cy2 представляют собой

Таблица 10. Соединения, имеющие формулу (I), где Cy1 и Cy2 представляют собой

Таблица 11. Соединения, имеющие формулу (I), где Cy1 и Cy2 представляют собой

Таблица 12. Соединения, имеющие формулу (I), где Cy1 и Cy2 представляют собой

Таблица 13. Соединения, имеющие формулу (I), где Cy1 и Cy2 представляют собой

Таблица 14. Соединения, имеющие формулу (I), где Cy1 и Cy2 представляют собой

Таблица 15. Соединения, имеющие формулу (I), где Cy1 и Cy2 представляют собой

Таблица 16. Соединения, имеющие формулу (I), где Cy1 и Cy2 представляют собой

Таблица 17. Соединения, имеющие формулу (I), где Cy1 и Cy2 представляют собой

Таблица 18. Соединения, имеющие формулу (I), где Cy1 и Cy2 представляют собой

Таблица 19. Соединения, имеющие формулу (I), где Cy1 и Cy2 представляют собой

Таблица 20. Соединения, имеющие формулу (I), где Cy1 и Cy2 представляют собой 3,4,5-трифторфенил; и Ra, Rb, R1 - R4 имеют указанные значения
Таблица 21. Соединения, имеющие формулу (I), где Cy1 и Cy2 представляют собой п-аминофенил; и Ra, Rb, R1 - R4 имеют указанные значения
Таблица 22. Соединения, имеющие формулу (I), где Cy1 и Cy2 представляют собой п-иодфенил; и Ra, Rb, R1 - R4 имеют указанные значения
Таблица 23. Соединения, имеющие формулу (I), где Cy1 и Cy2 представляют собой п-бромфенил; и Ra, Rb, R1 - R4 имеют указанные значения
Таблица 24. Соединения, имеющие формулу (I), где Cy1 и Cy2 представляют собой п-цианофенил; и Ra, Rb, R1 - R4 имеют указанные значения
Таблица 25. Соединения, имеющие формулу (I), где Cy1 и Cy2 представляют собой

Таблица 26. Соединения, имеющие формулу (I), где Cy1 и Cy2 представляют собой

Таблица 27. Соединения, имеющие формулу (I), где Cy1 и Cy2 представляют собой

Таблица 28. Соединения, имеющие формулу (I), где Cy1 и Cy2 представляют собой п-нитрофенил; и Ra, Rb, R1 - R4 имеют указанные значения
Таблица 29. Соединения, имеющие формулу (I), где Cy1 и Cy2 представляют собой

Таблица 30. Соединения, имеющие формулу (I), где Cy1 и Cy2 представляют собой

Таблица 31. Соединения, имеющие формулу (I), где Cy1 и Cy2 представляют собой
Таблица 32. Соединения, имеющие формулу (I), где Cy1 и Cy2 представляют собой

Таблица 33. Соединения, имеющие формулу (I), где Cy1 и Cy2 представляют собой
Таблица 34. Соединения, имеющие формулу (I), где Cy1 и Cy2 представляют собой

Таблица 35. Соединения, имеющие формулу (I), где Cy1 и Cy2 представляют собой

Таблица 36. Соединения, имеющие формулу (I), где Cy1 и Cy2 представляют собой

Таблица 37. Соединения, имеющие формулу (I), где Cy1 и Cy2 представляют собой

Таблица 38. Соединения, имеющие формулу (I), где Cy1 и Cy2 представляют собой
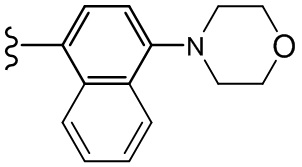
Частные осуществления соединений по изобретению дополнительно описаны в таблицах 39-112, где значения переменных Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 такие, как описано в таблицах 2-38, соответственно, за исключением того, что R’, R’’, R’’’ и R’’’’ имеют указанные ниже значения.
Таблица 39: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 2, и R’, R’’, R’’’ и R’’’’ каждый представляют собой метил.
Таблица 40: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 3, и R’, R’’, R’’’ и R’’’ каждый представляют собой метил.
Таблица 41: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 4, и R’, R’’, R’’’ и R’’’’ каждый представляют собой метил.
Таблица 42: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 5, и R’, R’’, R’’’ и R’’’’ каждый представляют собой метил.
Таблица 43: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 6, и R’, R’’, R’’’ и R’’’’ каждый представляют собой метил.
Таблица 44: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 7, и R’, R’’, R’’’ и R’’’’ каждый представляют собой метил.
Таблица 45: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 8, и R’, R’’, R’’’ и R’’’’ каждый представляют собой метил.
Таблица 46: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 9, и R’, R’’, R’’’ и R’’’’ каждый представляют собой метил.
Таблица 47: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 10, и R’, R’’, R’’’ и R’’’’ каждый представляют собой метил.
Таблица 48: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 11, и R’, R’’, R’’’ и R’’’’ каждый представляют собой метил.
Таблица 49: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 12, и R’, R’’, R’’’ и R’’’’ каждый представляют собой метил.
Таблица 50: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 13, и R’, R’’, R’’’ и R’’’’ каждый представляют собой метил.
Таблица 51: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 14, и R’, R’’, R’’’ и R’’’’ каждый представляют собой метил.
Таблица 52: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 15, и R’, R’’, R’’’ и R’’’’ каждый представляют собой метил.
Таблица 53: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 16, и R’, R’’, R’’’ и R’’’’ каждый представляют собой метил.
Таблица 54: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 17, и R’, R’’, R’’’ и R’’’’ каждый представляют собой метил.
Таблица 55: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 18, и R’, R’’, R’’’ и R’’’’ каждый представляют собой метил.
Таблица 56: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 19, и R’, R’’, R’’’ и R’’’’ каждый представляют собой метил.
Таблица 57: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 20, и R’, R’’, R’’’ и R’’’’ каждый представляют собой метил.
Таблица 58: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 21, и R’, R’’, R’’’ и R’’’’ каждый представляют собой метил.
Таблица 59: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 22, и R’, R’’, R’’’ и R’’’’ каждый представляют собой метил.
Таблица 60: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 23, и R’, R’’, R’’’ и R’’’’ каждый представляют собой метил.
Таблица 61: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 24, и R’, R’’, R’’’ и R’’’’ каждый представляют собой метил.
Таблица 62: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 25, и R’, R’’, R’’’ и R’’’’ каждый представляют собой метил.
Таблица 63: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 26, и R’, R’’, R’’’ и R’’’’ каждый представляют собой метил.
Таблица 64: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 27, и R’, R’’, R’’’ и R’’’’ каждый представляют собой метил.
Таблица 65: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 28, и R’, R’’, R’’’ и R’’’’ каждый представляют собой метил.
Таблица 66: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 29, и R’, R’’, R’’’ и R’’’’ каждый представляют собой метил.
Таблица 67: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 30, и R’, R’’, R’’’ и R’’’’ каждый представляют собой метил.
Таблица 68: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 31, и R’, R’’, R’’’ и R’’’’ каждый представляют собой метил.
Таблица 69: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 32, и R’, R’’, R’’’ и R’’’’ каждый представляют собой метил.
Таблица 70: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 33, и R’, R’’, R’’’ и R’’’’ каждый представляют собой метил.
Таблица 71: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 34, и R’, R’’, R’’’ и R’’’’ каждый представляют собой метил.
Таблица 72: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 35, и R’, R’’, R’’’ и R’’’’ каждый представляют собой метил.
Таблица 73: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 36, и R’, R’’, R’’’ и R’’’’ каждый представляют собой метил.
Таблица 74: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 37, и R’, R’’, R’’’ и R’’’’ каждый представляют собой метил.
Таблица 75: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 38, и R’, R’’, R’’’ и R’’’’ каждый представляют собой метил.
Таблица 76: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 2, и R’, R’’, R’’’ и R’’’’ каждый представляют собой атом водорода.
Таблица 77: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 3, и R’, R’’, R’’’ и R’’’’ каждый представляют собой атом водорода.
Таблица 78: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 4, и R’, R’’, R’’’ и R’’’’ каждый представляют собой атом водорода.
Таблица 79: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 5, и R’, R’’, R’’’ и R’’’’ каждый представляют собой атом водорода.
Таблица 80: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 6, и R’, R’’, R’’’ и R’’’’ каждый представляют собой атом водорода.
Таблица 81: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 7, и R’, R’’, R’’’ и R’’’’ каждый представляют собой атом водорода.
Таблица 82: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 8, и R’, R’’, R’’’ и R’’’’ каждый представляют собой атом водорода.
Таблица 83: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 9, и R’, R’’, R’’’ и R’’’’ каждый представляют собой атом водорода.
Таблица 84: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 10, и R’, R’’, R’’’ и R’’’’ каждый представляют собой атом водорода.
Таблица 85: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 11, и R’, R’’, R’’’ и R’’’’ каждый представляют собой атом водорода.
Таблица 86: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 12, и R’, R’’, R’’’ и R’’’’ каждый представляют собой атом водорода.
Таблица 87: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 13, и R’, R’’, R’’’ и R’’’’ каждый представляют собой атом водорода.
Таблица 88: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 14, и R’, R’’, R’’’ и R’’’’ каждый представляют собой атом водорода.
Таблица 89: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 15, и R’, R’’, R’’’ и R’’’’ каждый представляют собой атом водорода.
Таблица 90: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 16, и R’, R’’, R’’’ и R’’’’ каждый представляют собой атом водорода.
Таблица 91: Соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в Таблице 17, и R’, R’’, R’’’ и R’’’’ каждый представляют собой атом водорода.
Таблица 92: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 18, и R’, R’’, R’’’ и R’’’’ каждый представляют собой атом водорода.
Таблица 93: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 19, и R’, R’’, R’’’ и R’’’’ каждый представляют собой атом водорода.
Таблица 94: Соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в Таблице 20, и R’, R’’, R’’’ и R’’’’ каждый представляют собой атом водорода.
Таблица 95: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 21, и R’, R’’, R’’’ и R’’’’ каждый представляют собой атом водорода.
Таблица 96: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 22, и R’, R’’, R’’’ и R’’’’ каждый представляют собой атом водорода.
Таблица 97: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 23, и R’, R’’, R’’’ и R’’’’ каждый представляют собой атом водорода.
Таблица 98: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 24, и R’, R’’, R’’’ и R’’’’ каждый представляют собой атом водорода.
Таблица 99: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 25, и R’, R’’, R’’’ и R’’’’ каждый представляют собой атом водорода.
Таблица 100: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 26, и R’, R’’, R’’’ и R’’’’ каждый представляют собой атом водорода.
Таблица 101: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 27, и R’, R’’, R’’’ и R’’’’ каждый представляют собой атом водорода.
Таблица 102: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 28, и R’, R’’, R’’’ и R’’’’ каждый представляют собой атом водорода.
Таблица 103: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 29, и R’, R’’, R’’’ и R’’’’ каждый представляют собой атом водорода.
Таблица 104: Соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в Таблице 30, и R’, R’’, R’’’ и R’’’’ каждый представляют собой атом водорода.
Таблица 105: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 31, и R’, R’’, R’’’ и R’’’’ каждый представляют собой атом водорода.
Таблица 106: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 32, и R’, R’’, R’’’ и R’’’’ каждый представляют собой атом водорода.
Таблица 107: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 33, и R’, R’’, R’’’ и R’’’’ каждый представляют собой атом водорода.
Таблица 108: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 34, и R’, R’’, R’’’ и R’’’’ каждый представляют собой атом водорода.
Таблица 109: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 35, и R’, R’’, R’’’ и R’’’’ каждый представляют собой атом водорода.
Таблица 110: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 36, и R’, R’’, R’’’ и R’’’’ каждый представляют собой атом водорода.
Таблица 111: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 37, и R’, R’’, R’’’ и R’’’’ каждый представляют собой атом водорода.
Таблица 112: соединения, имеющие формулу (I), где Cy1, Cy2, Ra, Rb, R1, R2, R3 и R4 имеют значения, указанные в таблице 38, и R’, R’’, R’’’ и R’’’’ каждый представляют собой атом водорода.
Неожиданно было обнаружено, что замещение определенными группами алкильных групп R1, R2, R3 и R4, которые представляют собой 2-метилпропильные группы в материнском циклическом депсипептиде PF1022, а также в эмодепсиде, улучшает in vitro метаболическую устойчивость соединений и может также повышать активность данных соединений против эндопаразитов и эктопаразитов. Кроме того, неожиданно было обнаружено, что замещение в соединениях, имеющих формулу (I), определенными группами Cy1 и/или Cy2 также значительно улучшает in vitro метаболическую устойчивость соединений по настоящему изобретению, по сравнению с PF1022 и эмодепсидом. Таким образом, было обнаружено, что соединения по настоящему изобретению, в которых группы Cy1 и/или Cy2 и по меньшей мере один из R1, R2, R3 и R4 замещены определенными заместителями, обладают значительно улучшенной метаболической устойчивостью и равной или значительно более высокой эффективностью против эндопаразитов, включая Dirofilaria immitis микрофилярии и/или L3 и L4 личинки и/или личинки Haemonchus contortus. В частных вариантах осуществления, соединения, имеющие формулу (I), с определенными заместителями также демонстрируют улучшенную активность против эктопаразитов.
Также неожиданно было обнаружено, что пространственный порядок замещения R1 - R4 также оказывает значительное влияние на активность соединений. Например, было обнаружено, что когда модифицируются встречающиеся в природе 2-метилпропильные группы в PF1022A и эмодепсиде, находящиеся в положениях, идентифицированных как R1 и R3 в соединении, имеющем формулу (I), то активность таких соединений значительно увеличивается по сравнению с соединениями, где заместителями в положениях R2 и R4 являются 2-метилпропильные группы.
Также неожиданным является влияние некоторых заместителей в одном или больше из R1, R2, R3 и R4. Так, было обнаружено, что замещение одного или более из R1, R2, R3 и R4фтором значительно повышает in vitro активность соединений, имеющих формулу (I), в отношении подвижности личинок Haemonchus contortus и Dirofilaria immitis микрофилярий, по сравнению с незамещенными соединениями (например, PF1022 или аналоги, где Cy1 и/или Cy2 представляют собой замещенный фенил, но R1 - R4 представляют собой 2-метилпропил) или соединениями, в которых встречающиеся в природе 2-метилпропильные группы PF1022A и эмодепсида, присутствующие в положениях R1 и R3 в соединении, имеющем формулу (I), заменены на метильную группу. Кроме того, было обнаружено, что замещение R1 и R3 групп фтором значительно повышает in vitro активность против личинок H. contortus и D. immitis микрофилярий, по сравнению с соединениями, замещенными фтором в положении R2, или с другими комбинациями. Очевидно, что тип замещения в группах R1, R2, R3 и R4, а также то, какой именно из R1, R2, R3 и R4 замещен, оказывают значительное влияние на активность соединений.
Scherkenbeck с соавторами (Bioorg. Med. Chem. Lett. 8 (1998), 1035-1040) описал, что замена N-метил лейцинового заместителя на серию родственных N-метилированных аминокислот, таких как изолейцин, валин, норвалин, аланин и фенилаланин, приводила к почти полной потере противогельминтной эффективности при пероральном введении овцам. Кроме того, в данной публикации сообщалось, что модификация половины N-метил лейциновых остатков метильными или н-пропильными боковыми цепочками также неожиданно приводила к значительно пониженной активности. Был сделан вывод, что (L)-N-метил лейциновые остатки в циклическом депсипептиде PF1022A являлись критически важной частью фармакофора и необходимыми для in vivo активности.
Таким образом, является неожиданным тот факт, что модификация групп R1 - R4 в соединении, имеющем формулу (I), которые соответствуют N-метил лейциновым остаткам в PF1022A или эмодепсиде, приводит к повышению in vitro метаболической устойчивости и/или повышенной активности по сравнению с соединениями, содержащими немодифицированные N-метил лейциновые остатки. Также очень неожиданным является тот факт, что соединения, имеющие формулу (I), в которых алкильные группы, представленные R1 и R3, замещены определенными группами, демонстрируют значительно более высокую эффективность против эндопаразитов, по сравнению с соединениями, которые замещены теми же группами в положениях R2 и R4, или в других комбинациях. Кроме того, включение определенных заместителей в группы R1 - R4 и Cy1 и Cy2 приводит к повышению in vitro метаболической устойчивости, в сравнении с незамещенными соединениями. Из этого следует, что определенная комбинация заместителей в Cy1 и Cy2 и R1 - R4 в соединениях, имеющих формулу (I), приводит к значительному повышению активности против эндопаразитов и улучшенной метаболической устойчивости в животных.
Кроме того, было обнаружено, что замещение встречающихся в природе 2-метилпропильных групп в PF1022A и эмодепсиде, находящихся в положениях R1 и R3 в соединении, имеющем формулу (I), некоторыми заместителями, включая фтор и метил, улучшает in vitro проницаемость данных соединений. Например, было обнаружено, что соединения, имеющие формулу (I), где Cy1 и Cy2 оба представляют собой незамещенные фенильные или п-фторфенильные группы, и R2 и R4, соответственно, представляют собой фторзамещенный 2-метилпропил, имеют значительно улучшенную проницаемость, по сравнению с соединениями, где R2 и R4 представляют собой незамещенный 2-метилпропил. Кроме того, было обнаружено, что соединения, в которых Cy1 и Cy2 представляют собой п-морфолино-фенил, и R2 и R4 представляют собой метилзамещенный 2-метилпропил, имеют значительно улучшенную проницаемость, по сравнению с эмодепсидом (R2 и R4 = 2-метилпропил).
Ожидается, что характеристики, описанные выше для соединений, имеющих формулу (I), приводят в итоге к соединениям с более высокой антипаразитической эффективностью против эндопаразитов и эктопаразитов в организме животных или на их покровах.
Стереоизомеры и полиморфные формы
Специалистам в данной области понятно, что соединения по настоящему изобретению могут существовать и быть выделенными в виде оптически активных и рацемических форм Соединения, имеющие один или более хиральных центров, включая таковой на атоме серы, могут присутствовать в виде единственных энантиомеров или диастереомеров или в виде смесей энантиомеров и/или диастереомеров. Например, хорошо известно, что сульфоксидные соединения могут быть оптически активными и могут существовать в виде отдельных энантиомеров или рацемических смесей. Кроме того, соединения по настоящему изобретению могут включать один или больше хиральных центров, которые приводят к существованию теоретического числа оптически активных изомеров. Там, где соединения по настоящему изобретению включают n хиральных центров, соединения могут иметь до 2n оптических изомеров. Настоящее изобретение охватывает частные энантиомеры или диастереомеры каждого соединения, а также смеси различных энантиомеров и/или диастереомеров соединений по настоящему изобретению, которые обладают полезными свойствами, описанными в настоящем документе. Оптически активные формы могут быть получены, например, путем разделения рацемических форм методами селективной кристаллизации, синтеза из оптически активных предшественников, хирального синтеза, хроматографического разделения с использованием хиральной неподвижной фазы или с помощью ферментативного разделения.
Соединения по настоящему изобретению также могут присутствовать в различных твердых формах, таких как различные кристаллические формы, или в форме аморфного твердого вещества. Настоящее изобретение охватывает различные кристаллические формы, а также аморфные формы соединений по настоящему изобретению.
Кроме того, соединения по настоящему изобретению могут существовать в виде гидратов или сольватов, в которых определенные стехиометрические количества воды или растворителя ассоциированы с молекулой в кристаллической форме. Гидраты и сольваты соединений, имеющих формулу (I), также являются объектом изобретения.
Соли
Помимо нейтральных соединений формулы (I), соли данных соединений также обладают активностью против эндопаразитов. Термин "ветеринарно приемлемая соль" используется в настоящем документе для описания любых солей соединений, которые приемлемы для введения в ветеринарии, и которые при введении обеспечивают доставку активного соединения.
В случаях, когда соединения являются в достаточной степени основными или кислыми для образования устойчивых нетоксичных солей с кислотами или основаниями, соединения могут находиться в форме ветеринарно приемлемой соли или соли, приемлемой для сельского хозяйства. Приемлемые для ветеринарии соли включают соли, полученные из приемлемых для ветеринарии или для сельского хозяйства неорганических или органических оснований и кислот. Подходящие соли включают соли щелочных металлов, таких как литий, натрий или калий, щелочноземельных металлов, таких как кальций, магний и барий. Также могут применяться соли переходных металлов, включая (но не ограничиваясь только ими) магний, медь, цинк и железо. Кроме того, соли, содержащие катионы аммония (NH4+), а также замещенные катионы аммония, в которых один или более атомов водорода замещены на алкильные или арильные группы, также входят в объем настоящего изобретения.
Особенно хорошо подходят соли, полученные из неорганических кислот, включая (но не ограничиваясь только ими) гидрогалогенидные кислоты (HCl, HBr, HF, HI), серную кислоту, азотную кислоту, фосфорную кислоту, и т.п.. Подходящие неорганические соли также включают (но не ограничиваются только ими) бикарбонатные и карбонатные соли. В некоторых вариантах осуществления, примеры приемлемых для ветеринарии и для сельского хозяйства солей представляют собой соли с органическими кислотами, образуемые с органическими кислотами, включая (но не ограничиваясь только ими) малеат, дималеат, фумарат, тозилат, метансульфонат, ацетат, цитрат, малонат, тартрат, сукцинат, бензоат, аскорбат, α-кетоглютарат и α-глицерофосфат. Разумеется, можно применять другие приемлемые органические кислоты.
Соли описанных соединений со щелочными металлами (например, натрий, калий или литий) или с щелочноземельными металлами (например, кальций) также можно получать введением в реакцию достаточно кислого остатка соединений с гидроксидом щелочного или щелочноземельного металла.
Приемлемые для ветеринарии соли можно получать по обычным методикам, хорошо известным в данной области техники, например, введением в реакцию достаточно основного соединения, такого как амин, с подходящей достаточно кислой функциональной группой, содержащейся в соединении, или введением подходящей кислоты в реакцию с достаточно основной функциональной группой соединения по настоящему изобретению.
Способы получения соединений, имеющих формулу (I):
Соединения, имеющие формулу (I) можно получить способами, являющимися адаптацией способов, описанных в патентах США 5 514 773; 5 747 448; 5 874 530; 5 856 436; 6 033 879; 5 763 221; 6 329 338, 5 116 815; 6 468 966; 6 369 028; 5 777 075; и 5 646 244, которые все полностью включены в настоящий текст посредством ссылки. Кроме того, в химической литературе описаны различные способы синтеза циклических депсипептидов (см. Luttenberg et al., Tetrahedron 68 (2012), 2068-2073; Byung H. Lee, Tetrahedron Letters, 1997, 38 (5), 757-760; Scherkenbeck et al., Eur. J. Org. Chem., 2012, 1546-1553; Biosci. Biotech. Biochem., 1994, 58(6), 1193-1194; и Scherkenbeck et al., Tetrahedron, 1995, 51(31), 8459-8470). Квалифицированному специалисту в данной области будет понятно, что определенные функциональные группы в соединениях и интермедиатах могут быть незащищенными или защищенными подходящими защитными группами, как описано в книге Greene and Wuts, Protective Groups in Organic Synthesis, John Wiley and Sons, Inc., 4th edition 2006. Кроме того, квалифицированному специалисту в данной области будет понятно, что соединения и интермедиаты можно выделять в стандартных условиях водной обработки реакционных смесей и, опционально, очищать. Например, соединения или интермедиаты можно очистить хроматографическими методами или перекристаллизовать, получая целевой продукт приемлемой чистоты.
В одном варианте осуществления, соединения, имеющие формулу (I), где R1, R2, R3, R4, Cy1 и Cy2 имеют указанные выше значения, и R’, R’’, R’’’ и R’’’’ представляют собой метил, получают общим способом, изображенным ниже на Схеме 1:
Схема 1


P1 и P2 представляют собой, соответственно, защитные группы для аминной и карбоксильной групп, общеизвестные в данной области (см., например, Greene and Wuts, Protective Groups in Organic Synthesis, John Wiley and Sons, Inc., 4th edition 2006), и R1, R2, R3, R4, Cy1 и Cy2 имеют указанные выше значения.
Кроме того, сочетание аминов с карбоновыми кислотами с образованием амидов хорошо известно в данной области, и можно применять стандартные реагенты в данном сочетании фрагмента с незащищенным амином и второго фрагмента, содержащего свободную карбоксильную группу (см., например, Peptide Synthesis by Miklos Bodanszky and Miguel Ondetti, Interscience Publishers, 1966; Амино Acid and Peptide Synthesis, 2nd Ed. By John Jones, Oxford University Press, 2002). Соединения можно получить синтезом в растворе или с применением твердофазного синтеза на полимерной подложке. Например, формирование амидных связей можно осуществлять с применением активирующих реагентов, таких как карбодиимидные реагенты (например, дициклогексилдиимид, диизопропилдиимид и (N-(3-диметиламинопропил)-N’-этилкарбодиимид HCl), в комбинации с такими добавками, как N-гидроксибензотриазол (HOBt) и т.п.. Кроме того, формирование амидных связей в данном синтезе можно осуществлять с применением фосфониевых реагентов, таких как BOP (Бензотриазол-1-илокси-трис(диметиламино)-фосфония гексафторфосфат), PyBOP (Бензотриазол-1-илокси-трипирролидинo-фосфония гексафторфосфат), PyBrOP (Бром-трипирролидинo-фосфония гекса-фторфосфат) и т.п.. Другими подходящими реагентами для образования амидных связей в соединениях по настоящему изобретению являются так называемые аминий/уроний-имониевые реагенты, такие как TBTU/HBTU (2-(1H-Бензотриазол-1-ил)-N,N,N’,N’- тетраметиламиния тетрафторборат/гексафторфосфат), HATU (2-(7-аза-1H-бензотриазол-1-ил)-N,N,N’,N’-тетраметиламиния гексафторфосфат) и т.п.. Эти реагенты и способы применения этих реагентов для получения амидных связей хорошо известны в данной области.
Ветеринарные композиции:
Соединения, имеющие формулу (I), и композиции, содержащие указанные соединения, можно применять для предотвращения и лечения паразитных заражений/инфекций у животных. Композиции по настоящему изобретению содержат эффективное количество по меньшей мере одного циклического депсипептидного соединения, имеющего формулу (I), или его ветеринарно приемлемой соли, в комбинации с ветеринарно приемлемым носителем или разбавителем и, необязательно, другими неактивными вспомогательными соединениями. Композиции могут иметь вид различных твердых или жидких готовых форм, которые подходят для различных способов применения или введения животным. Например, ветеринарные композиции, содержащие инновационные соединения, могут иметь вид препаратов, подходящих для перорального введения, введения в виде инъекций, включая подкожное и парентеральное введение, и наружное применение (например, точечное нанесение или препарат для обливания), кожное или подкожное введение. Готовые формы предназначены для введения животному, включая (но не ограничиваясь только ими) млекопитающих, птиц и рыб. Примеры млекопитающих включают (но не ограничиваются только ими) человека, крупный рогатый скот, овец, коз, лам, альпаков, свиней, лошадей, ослов, собак, кошек и других сельскохозяйственных или домашних млекопитающих. Примеры птиц включают индеек, цыплят, страусов и других сельскохозяйственных или домашних птиц. В особенности полезно применение соединений, имеющих формулу (I), для защиты животных-компаньонов, таких как собаки и кошки, от эндопаразитов.
Как описано выше, композиции по настоящему изобретению могут иметь подходящую для перорального применения форму (см., например, патент США № 4 564 631, включенный в настоящий документ посредством ссылки), пищевых добавок, пастилок, ромбовидных пастилок, жевательных таблеток, таблеток, твердых или мягких капсул, болюсов, эмульсий, водных или масляных суспензий, водных или масляных растворов, препаратов для вливания в ротовую полость, диспергируемых порошков или гранул, готовых смесей, сиропов или эликсиров, кишечнорастворимых препаратов или паст. Предназначенные для перорального применения композиции можно получать согласно любому известному в данной области техники способу получения фармацевтических композиций, и данные композиции могут содержать один или более подсластителей, горечей, ароматизаторов, красителей и консервантов, для получения превосходных в фармацевтическом смысле и внешне привлекательных препаратов.
Таблетки могут содержать активный ингредиент в смеси с нетоксичным фармацевтически приемлемым наполнителем, подходящим для производства таблеток. Такими наполнителями могут быть, например, инертные разбавители, такие как карбонат кальция, карбонат натрия, лактоза, фосфат кальция и фосфат натрия; гранулирующие и дезинтегрирующие агенты, например, кукурузный крахмал или альгиновая кислота; связующие средства, например, крахмал, желатин или смола акации, и смазывающие вещества, например, стеарат магния, стеариновая кислота или тальк, таблетки могут быть без покрытия или с нанесенным известными методами покрытием для задержки распада и всасывания в желудочно-кишечном тракте, что обеспечивает продолжительное действие в течение большего промежутка времени. Например, могут применяться такие материалы для увеличения продолжительности действия, как глицерил моностеарат или глицерил дистеарат. На таблетки также можно наносить покрытие по методике, описанной в патентах США № 4 256 108; 4 166 452; и 4 265 874 (включенных в настоящий текст посредством ссылки), для получения осмотических терапевтических таблеток с контролируемым высвобождением.
Препараты для перорального применения включают твердые желатиновые капсулы, в которых активный ингредиент смешан с инертным твердым разбавителем, например, карбонатом кальция, фосфатом кальция или каолином. Капсулы также могут представлять собой мягкие желатиновые капсулы, в которых активный ингредиент смешан с водой или со смешивающимся с водой растворителем, таким как пропиленгликоль, полиэтиленгликоли (PEG) и этанол, или с масляной средой, например, с арахисовым маслом, жидким парафином или оливковым маслом.
В одном варианте осуществления, соединения, имеющие формулу (I), можно вводить в виде мягких таблетированных композиций или мягких жевательных композиций, таких как описанные в US 2013/0203692 A1, US 2010/0087492, US 2006/0222684, US 2004/0151759, US 7955632, все включены в настоящий текст посредством ссылки. Ветеринарные композиции могут иметь вид мягких жевательных препаратов (“мягкая жвачка”), которые привлекательны и приемлемы для млекопитающих. Помимо действующего вещества (веществ), мягкие жвачки по настоящему изобретению могут включать один или больше из следующих компонентов: растворитель или смесь растворителей, один или больше наполнителей, один или больше связующих, одно или больше поверхностно-активных веществ, один или больше увлажнителей, одно или больше смазывающих веществ, один или больше разрыхлителей, один или больше красителей, один или больше противомикробных агентов, один или больше антиоксидантов, один или больше модификаторов рН, и один или больше ароматизаторов.
Растворители, которые могут быть использованы в композициях по настоящему изобретению, включают, без ограничения перечисленным, различные категории жидкого полиэтиленгликоля (PEG), включая PEG 200, PEG 300, PEG 400 и PEG 540; пропилен карбонат; пропиленгликоль; триглицериды, включая, без ограничения перечисленным, каприловый/каприновый триглицерид, каприловый/каприновый/линолевый триглицерид (например, MIGLYOL® 810 и 812, каприловый/каприновый/янтарный триглицерид, пропиленгликоль дикаприлат/дикапрат, и т.п.; воду, раствор сорбита, глицерин каприлат/капрат и полигликозилированные глицериды (GELUCIRE®) или их комбинации.
Различные наполнители, известные в данной области, могут быть использованы в мягких жевательных композициях изобретения. Наполнители включают, без ограничения перечисленным, кукурузный крахмал, предварительно клейстеризованный кукурузный крахмал, тонкоизмельченный соевый белок, мука из зёрен кукурузы с початками, кукурузная глютеновая мука и т.п. В некоторых воплощениях в композициях может быть использована комбинация двух или большего количества наполнителей.
Связующие, которые могут быть использованы в композициях изобретения, включают, без ограничения перечисленным, поливинилпирролидон (например, повидон), перекрестно-связанный поливинилпиррролидон (кросповидон), полиэтиленгликоли различных категорий, включая PEG 3350, PEG 4000, PEG 6000, PEG 8000 и даже PEG 20,000, кополимеры винилпирролидона и винилацетата (например, коповидона), такие как продукты, продаваемые BASF под торговой маркой Kollidon® VA 64 и т.п., крахмал, такой как картофельный крахмал, крахмал из тапиоки, и кукурузный крахмал; меласса, кукурузный сироп, мед, кленовый сироп и сахара различных типов; или комбинация двух или нескольких связующих.
Увлажнители, которые могут быть использованы в композициях, включают, без ограничения перечисленным, глицерол (также упоминается в данном документе как глицерин), пропиленгликоль, цетиловый спирт или глицерин моностеарат, и т.п. Полиэтиленгликоли различных категорий также могут быть использованы в качестве увлажнителей.
В композициях могут присутствовать поверхностно-активные вещества для улучшения растворимости и всасывания после переваривания. Поверхностно-активные вещества в типичном случае присутствуют в концентрации примерно от 1 до 10% (вес/вес), более типично от примерно 1 до примерно 5% (вес/вес). Примеры поверхностно-активных веществ, которые могут быть использованы в композициях, включают, но не ограничиваются ими, глицерил моноолеат, полиоксиэтиленовые сложные эфиры сорбита и жирных кислот, сложные эфиры сорбита, в том числе моноолеат сорбита (Span®20), поливиниловый спирт, полисорбаты в том числе полисорбат 20 и полисорбат 80, d-α-токоферил полиэтиленгликоль 1000 сукцинат (TPGS), лаурилсульфат натрия, сополимеры окиси этилена и окиси пропилена (например, полоксомеры, такие как LUTROL®F87 и т.п.), полиэтиленгликоль производные касторового масла, включая полиоксил 35 касторовое масло (Cremophor®EL), полиоксил 40 гидрогенизированное касторовое масло (Cremophor®RH 40), полиоксил 60 касторовое масло (Cremophor®RH60); пропиленгликольмонолаурат (LAUROGLYCOL®); сложные эфиры глицерина включая каприлат/капрат глицерина (CAPMUL®MCM), полигликолизированные глицериды (GELUCIRE®), PEG 300 каприловые/каприновые триглицериды (Softigen®767), PEG 400 каприловые/каприновые триглицериды (Labrasol®), PEG 300 олеиновые глицериды (Labrafil®M-1944CS), PEG 300 линолевые глицериды (Labrafil®M-2125CS); полиэтиленгликоль стеараты и полиэтиленгликоль гидроксистеараты, в том числе полиоксил 8 стеарат (PEG 400 моностеарат), полиоксилстеарат 40 (PEG 1750, моностеарат) и т.п.
Инновационные составы могут содержать другие инертные ингредиенты, такие как антиоксиданты, консерванты или стабилизаторы pH. Эти соединения также хорошо известны в области приготовления составов. Антиоксиданты могут быть добавлены к композициям изобретения для ингибирования деградации активных агентов. Подходящие антиооксиданты включают, без ограничения перечисленным, альфа токоферол, аскорбиновую кислоту, аскорбил пальмитат, фумаровую кислоту, яблочную кислоту, аскорбат натрия, метабисульфат натрия, н-пропил галлат, BHA (бутилированный гидроксианизол), BHT (бутилированный гидрокситолуол), монотиоглицерин и т.п.
Композиции по настоящему изобретению могут также включать один или несколько смазывающих веществ/вспомогательных веществ. В некоторых случаях смазывающее вещество может также выполнять роль растворителя, и, соответственно, некоторые компоненты оригинальных композиций могут выполнять двойные функции. Смазывающие вещества/вспомогательные вещества включают, без ограничения перечисленным, полиэтиленгликоли различных диапазонов молекулярных масс, включая PEG 3350 (Dow Chemical) и PEG 4000, кукурузное масло, минеральное масло, гидрогенизированные растительные масла (STEROTEX или LUBRITAB), арахисовое масло и/или касторовое масло.
Многие вкусоароматические агенты могут быть использованы в композициях изобретения для улучшения вкусовых качеств пероральных ветеринарных композициях. Предпочтительными вкусоароматическими агентами являются те, которые не получают из животных источников. В различных воплощениях могут быть использованы вкусовые ароматические компоненты, полученные из фруктов, мяса (включая, без ограничения перечисленным, свинину, говядину, курятину, рыбу, домашнюю птицу и т.п.), овощей, сыра, бекона, сыра-бекона и/или искусственных вкусовых ароматизирующих веществ. Вкусовой ароматический компонент, как правило, выбирают на основании рассмотрения организма, который будет проглатывать мягкую жвачку. Например, лошадь может предпочитать яблочный вкусовой ароматизирующий компонент, а собака может предпочитать мясной вкусовой ароматизирующий компонент. Хотя вкусовые компоненты, полученные из неживотных источников являются предпочтительными, в некоторых воплощениях могут быть использованы натуральные вкусоароматические добавки, содержащие экстракты говядины или печени и т.п., такие как добавка со вкусом тушеного мяса, искусственная порошкообразная добавка со вкусом говядины, добавка со вкусом жареной говядины, и добавка со вкусом говяжьей солонины в числе прочих.
В другом варианте осуществления настоящего изобретения, активную композицию можно вводить в виде жидких композиций, и можно применять либо наружно, либо перорально. Жидкие препараты - это жидкость-содержащие композиции по настоящему изобретению, их вводят в рот или горло животным, или выливают на кожу или покровы животного.
Композиции по настоящему изобретению могут также иметь форму эмульсий масло-в-воде или вода-в-масле. Масляная фаза может представлять собой растительное масло, например оливковое масло или арахисовое масло, или минеральное масло, например жидкий парафин, или их смесь. Подходящие эмульгаторы включают природные фосфатиды, например соевое масло, лецитин, и сложные эфиры или частичные сложные эфиры, полученные из жирных кислот и ангидридов гекситолов, например сорбитан моноолеат, и продукты конденсации указанных частичных сложных эфиров с этиленоксидом, например полиоксиэтилен сорбитан моноолеат. Эмульсии могут также содержать подсластители, горечи, ароматизаторы и/или консерванты.
В одном варианте осуществления, композиция по настоящему изобретению может быть в форме микроэмульсии. Микроэмульсии хорошо подходят в качестве жидкого носителя. Микроэмульсии представляют собой четырехкомпонентные системы, содержащие водную фазу, масляную фазу, поверхностно-активное вещество и косурфактант. Они представляют собой прозрачные и изотропные жидкости.
Микроэмульсии состоят из стабильных дисперсий микрокапель водной фазы в масляной фазе, или наоборот - микрокапель масляной фазы в водной фазе. Размер таких микрокапель может быть менее 200 нм (от 1000 до 100000 нм для эмульсий). Пленка на границе раздела фаз может состоять из чередования молекул поверхностно-активного вещества и косурфактанта, которые благодаря уменьшению коэффициента поверхностного натяжения делают возможным спонтанное образование микроэмульсии.
В одном варианте осуществления масляной фазы, масляная фаза может быть образована из минеральных или растительных масел, из ненасыщенных полигликозилированных глицеридов или из триглицеридов, или, альтернативно, из смесей перечисленных соединений. В одном варианте масляной фазы, масляная фаза образована триглицеридами; в другом варианте осуществления масляной фазы, триглицериды представляют собой триглицериды со средней длиной цепочки, например, C8-C10 каприловый/каприновый триглицерид. В другом варианте осуществления, процентное содержание (об/об) масляной фазы выбрано из группы, состоящей из следующих интервалов: от около 2 до около 15%; от около 7 до около 10%; и от около 8 до около 9% (об/об) микроэмульсии.
Водная фаза включает, например, воду или гликолевые производные, такие как пропиленгликоль, простые эфиры гликолей, полиэтиленгликоль или глицерин. В одном варианте гликолевого производного, гликоль может представлять собой пропиленгликоль, моноэтиловый эфир диэтиленгликоля, моноэтиловый эфир дипропиленгликоля и их смеси. В целом, водная фаза составляет от около 1 до около 4% (об/об) микроэмульсии.
Поверхностно-активные вещества для микроэмульсии включают моноэтиловый эфир диэтиленгликоля, монометиловый эфир дипропиленгликоля, полигликолезированные C8-C10 глицериды или полиглицерил-6-диолеат. Помимо перечисленных поверхностно-активных веществ, вспомогательные поверхностно-активные вещества включают короткоцепочечные спирты, такие как этанол и пропанол.
Некоторые вещества являются общими для обсужденных выше трех компонентов, т.е. водной фазы, поверхностно-активного вещества и вспомогательного поверхностно-активного вещества. Однако, квалифицированный специалист в данной области может использовать различные вещества для каждого компонента в составе одного препарата. В одном варианте соотношения ПАВ/со-ПАВ, соотношение со-ПАВ к ПАВ составляет от около 1/7 до около 1/2. В другом варианте количества со-ПАВ, указанное соотношение составляет от около 25 до около 75% (об/об) поверхностно-активного вещества и от около 10 до около 55% (об/об) со-ПАВ в микроэмульсии.
Масляные суспензии можно приготовить суспендированием активного ингредиента в растительном масле, например, в арахисовом масле, оливковом масле, кунжутном масле или кокосовом масле, или в минеральном масле, таком как жидкий парафин. Масляные суспензии могут содержать загуститель, например, пчелиный воск, твердый парафин или цетиловый спирт. Можно добавлять подсластители, такие как сахароза, сахарин или аспартам, горечи и ароматизаторы, чтобы приготовить приятный на вкус препарат для перорального введения. Описанные композиции можно законсервировать добавлением антиоксиданта, такого как аскорбиновая кислота, или других известных консервантов.
Водные суспензии могут содержать действующее вещество в смеси с наполнителями, подходящими для приготовления водных суспензий. Такие наполнители включают суспендирующие средства, например, натрия карбоксиметилцеллюлоза, метилцеллюлоза, гидрокси-пропилметилцеллюлоза, альгинат натрия, поливинилпирролидон, трагакантовая камедь и смола акации; диспергирующими или увлажняющими средствами могут быть природные фосфатиды, например, лецитин, или продукты конденсации алкиленоксида с жирными кислотами, например, полиоксиэтилен стеарат, или продукты конденсации этиленоксида с длинноцепочечными алифатическими спиртами, например, гептадекаэтиленоксицетанол, или продукты конденсации этиленоксида с неполными эфирами, полученными из жирных кислот и гекситола, такие как полиоксиэтилен сорбитол моноолеат, или продукты конденсации этиленоксида с неполными эфирами, полученными из жирных кислот и ангидридов гекситола, например, полиэтилен сорбитан моноолеат. Водные суспензии могут содержать один или более консервантов, например, этил- или н-пропил, п-гидроксибензоат, один или более красителей, один или более ароматизаторов, и один или более подсластителей и/или горечей, таких как описано выше.
Диспергируемые порошки и гранулы, подходящие для приготовления водной суспензии путем добавления воды, содержат активный ингредиент в смеси с диспергирующим или увлажняющим средством, суспендирующим средством и одним или более консервантами. Примерами подходящих диспергирующих или увлажняющих средств, а также суспендирующих средств, являются уже перечисленные выше. Могут также присутствовать дополнительные наполнители, например, подсластители, горечи, ароматизаторы и красители.
В состав сиропов и эликсиров могут входить подсластители, например, глицерин, пропиленгликоль, сорбит или сахароза. Такие препараты могут также содержать средство, уменьшающее раздражение, консервант, подсластитель(-ли) и/или краситель(-ли).
В другом варианте осуществления настоящего изобретения, композиция может иметь вид пасты. Примеры вариантов пастообразной готовой формы включают (но не ограничены только ими) описанные в патентах США № 6 787 342 и 7 001 889, которые оба включены в настоящий текст посредством ссылки. Помимо соединений по настоящему изобретению, паста может также содержать высокодисперсный диоксид кремния; модификатор вязкости; носитель; опционально, адсорбент; и, опционально, краситель, стабилизирующее средство, поверхностно-активное вещество или консервант.
В одном варианте препарата, препарат может представлять собой пасту, содержащую соединения по настоящему изобретению, высокодисперсный диоксид кремния, модификатор вязкости, адсорбент, краситель; и гидрофильный носитель, который представляет собой триацетин, моноглицерид, диглицерид или триглицерид.
Паста может также включать модификатор вязкости. Подходящие модификаторы вязкости включают (но не ограничиваются только ими) полиэтиленгликоли (PEG), включающие (но не ограничивающиеся только ими) PEG 200, PEG 300, PEG 400, PEG 600, моноэтаноламин, триэтаноламин, глицерин, пропиленгликоль, полиоксиэтилен (20) сорбитан моно-олеат (полисорбат 80 или Tween 80), и полиоксамеры (например, Pluronic L 81); адсорбент, такой как карбонат магния, карбонат кальция, крахмал, и целлюлозу и ее производные; и краситель, включающий (но не ограничивающийся только ими) диоксид титана, оксид железа, FD&C Blue #1 Aluminum Lake.
В некоторых вариантах осуществления, композиции могут иметь форму стерильных инъецируемых водных или масляных суспензий. Такую суспензию можно получать согласно известным в данной области методикам с применением подходящих диспергирующих или смачивающих агентов и суспендирующих агентов, которые были упомянуты выше. Стерильный инъецируемый препарат может также представлять собой стерильный инъецируемый раствор или суспензию в нетоксичном парентерально-приемлемом разбавителе или растворителе, например раствор в 1,3-бутандиоле. Среди приемлемых носителей и растворителей, подходящих для применения, находятся вода, раствор Рингера и изотонический раствор хлорида натрия. Можно также применять сорастворители, такие как этанол, пропиленгликоль, глицерин формаль или полиэтиленгликоли. Можно применять консерванты, такие как фенол или бензиловый спирт.
Кроме того, можно применять стерильные жирные масла в качестве растворителя или суспендирующей среды. Для этой цели можно применять любую марку жирного масла, включая синтетические моно- и диглицериды. Кроме того, в приготовлении инъецируемых композиций находят применение жирные кислоты, такие как олеиновая кислота.
Препараты для наружного, кожного и подкожного применения могут включать, в качестве неограничивающих примеров, эмульсии, кремы, мази, гели, пасты, порошки, шампуни, препараты для обливания, готовые к применению препараты, растворы и суспензии для точечного нанесения, растворы для погружения и спреи. Наружное нанесение инновационного соединения или композиции, содержащей по меньшей мере одно инновационное соединение среди других действующих веществ, в форме препарата для точечного нанесения, опрыскивания или обливания, позволяет добиться абсорбции инновационных композиций через кожу и достижения системной концентрации, распределения через сальные железы или по поверхности кожи, обеспечивая достижения желательной концентрации по всей площади покровов. Когда соединение распределяется через сальные железы, они могут играть роль резервуара, благодаря чему можно достичь продолжительного (до нескольких месяцев) эффекта. Препараты для точечного нанесения обычно наносят на локализованный участок, составляющий область, отличную от всего животного в целом. В одном варианте осуществления, локализованный участок может представлять собой область между лопатками. В другом варианте осуществления, это может быть полоса, например полоса от головы до хвоста животного.
Препараты для обливания описаны в патенте США 6 010 710, который также включен в настоящий текст посредством ссылки. Препараты для обливания преимущественно могут быть масляными и обычно содержат разбавитель или носитель, а также растворитель (например, органический растворитель) для действующего вещества, если он нерастворим в разбавителе.
Органические растворители, которые можно применять по настоящему изобретению, включают (но не ограничиваются только ими) ацетилбутил цитрат, сложные эфиры жирных кислот, такие как диметиловый эфир, диизобутил адипат, ацетон, ацетонитрил, бензиловый спирт, этиловый спирт, бутилдигликоль, диметилацетамид, диметилформамид, диметилсульфоксид, дипропиленгликоля н-бутиловый эфир, этанол, изопропанол, метанол, этиленгликоля моноэтиловый эфир, этиленгликоля монометиловый эфир, монометилацетамид, дипропиленгликоля монометиловый эфир, жидкие полиоксиэтиленгликоли, пропиленгликоль, 2-пирролидон (например, N-метилпирролидон), диэтиленгликоля моноэтиловый эфир, этиленгликоль, триацетин, C1-C10 эфиры карбоновых кислот, такие как бутил- или октилацетат, и диэтилфталат, или смесь по меньшей мере двух из перечисленных растворителей.
Растворитель применяют пропорционально концентрации действующего вещества и его растворимости в данном растворителе. Следует применять наименьший возможный объем. Носитель составляет оставшееся до 100% количество.
Носители или разбавители для данных препаратов могут включать диметилсульфоксид (ДМСО), гликолевые производные, такие как, например, пропиленгликоль, простые эфиры гликолей, полиэтиленгликоли или глицерин. В качестве носителя или разбавителя можно также указать растительные масла, такие как (но не ограничиваясь только ими) соевое масло, арахисовое масло, касторовое масло, кукурузное масло, хлопковое масло, оливковое масло, масло виноградных косточек, подсолнечное масло, минеральные масла, такие как (но не ограничиваясь только ими) петролатум, парафин, силикон и т.д.; алифатические или циклические углеводороды или, альтернативно, например среднецепочечные (такие как C8 - C12) триглицериды.
В другом варианте осуществления настоящего изобретения, можно добавлять умягчитель и/или растекатель и/или пленкообразующее средство. В одном варианте осуществления, умягчитель и/или растекатель и/или пленкообразующий агент может представлять собой:
(a) поливинилпирролидон, поливиниловые спирты, сополимеры винилацетата и винилпирролидона, полиэтиленгликоли, бензиловый спирт, маннит, глицерин, сорбит, полиоксиэтиленированные сложные эфиры сорбитана, лецитин, натрия карбоксиметилцеллюлоза, силиконовые масла, полидиорганосилоксановые масла (такие как полидиметилсилоксановые (PDMS) масла), например, содержащие силанольные функциональные группы, или масло 45V2,
(b) анионогенные ПАВ, такие как стеараты щелочных металлов, стеараты натрия, калия или аммония; стеарат кальция, стеарат триэтаноламина; абиетат натрия; алкилсульфаты (например, лаурилсульфат натрия и цетилсульфат натрия); додецилбензолсульфонат натрия, диоктилсульфосукцинат натрия; жирные кислоты (например, производные кокосового масла),
(c) катионогенные ПАВ, такие как водорастворимые четвертичные соли аммония формулы N+R'R"R"'R""Y-, в которой радикалы R представляют собой при желании гидроксилированные углеводородные радикалы, а Y- представляет собой анион сильной кислоты, такой как галогенидные, сульфатные и сульфонатные анионы; среди подходящих катионогенных ПАВ также находится цетилтриметиламмония бромид,
(d) соли аминов формулы N+ R'R"R'", в которой радикалы R представляют собой при желании гидроксилированные углеводородные радикалы; среди подходящих катионогенных ПАВ также находится октадециламина гидрохлорид,
(e) неионогенные ПАВ, такие как сложные эфиры сорбитана, которые при желании являются полиоксиэтиленированными (например, полисорбат 80), полиоксиэтиленированные алкиловые эфиры; полиоксипропиленированные жирные спирты, такие как полиоксипропилен-стироловый эфир; полиэтиленгликоль стеарат, полиоксиэтиленированные производные касторового масла, сложные эфиры полиглицерина, полиоксиэтиленированные жирные спирты, полиоксиэтиленированные жирные кислоты, сополимеры этиленоксида и пропиленоксида,
(f) амфотерные ПАВ, такие как замещенные лауриловые соединения бетаина, и
(g) смесь по меньшей мере двух из перечисленных средств.
В одном варианте осуществления, количество умягчителя составляет примерно от 0,1 до 50% или от 0,25 до 5%, по объему. В другом варианте осуществления, количество умягчителя составляет от примерно 0,1% до примерно 30%, от примерно 1% до примерно 30%, от примерно 1% до примерно 20%, или от примерно 5% до примерно 20%, по объему.
В другом варианте осуществления настоящего изобретения, композиции могут быть готовым к применению раствором, как описано, например, в U.S. Patent No. 6,395,765, который включен в настоящий текст посредством ссылки. Помимо соединений по настоящему изобретению, готовый к применению раствор может содержать ингибитор кристаллизации, органический растворитель или органический сорастворитель. В некоторых вариантах осуществления, вместе с органическим растворителем в состав может входить вода.
В различных вариантах осуществления настоящего изобретения, композиции могут включать ингибитор кристаллизации в количестве от примерно 1 до примерно 50% (вес/об) или от примерно 5 до примерно 40% (вес/об) из расчета на общий вес препарата. В других вариантах осуществления, количество ингибитора кристаллизации в инновационных препаратах может составлять от примерно 1% до примерно 30%, от примерно 5% до примерно 20%, от примерно 1% до примерно 15%, или от примерно 1% до примерно 10% (вес/вес). Тип ингибитора кристаллизации, применяемого в инновационных препаратах, не ограничивается, при условии что он подавляет кристаллизацию действующих или инертных веществ из препарата. Например, в некоторых вариантах осуществления настоящего изобретения, растворитель или сорастворитель в препарате также может выполнять роль ингибитора кристаллизации, если он в достаточной степени подавляет формирование кристаллов после введения препарата.
Ингибиторы кристаллизации, которые могут применяться в настоящем изобретении, включают (но не ограничены только ими):
(a) поливинилпирролидон, поливиниловые спирты, сополимеры винилацетата и винилпирролидона, полиэтиленгликоли, бензиловый спирт, диметилформамид, диметилацетамид, диметилсульфоксид, 2-пирролидон, N-метилпирролидон, маннит, глицерин, сорбит или полиоксиэтиленированные сложные эфиры сорбитана; лецитин или натрия карбоксиметилцеллюлоза; или акриловые производные, такие как акрилаты или метакрилаты или их полимеры или сополимеры, полиэтиленгликоли (PEG) или полимеры, содержащие полиэтиленгликоли, такие как гликофуролы и т.п., и другие;
(b) анионогенные ПАВ, такие как стеараты щелочных металлов (например, стеараты натрия, калия или аммония); стеарат кальция или стеарат триэтаноламина; абиетат натрия; алкилсульфаты, которые включают (но не ограничваются только ими) лаурилсульфат натрия и цетилсульфат натрия; додецилбензолсульфонат натрия или диоктилсульфосукцинат натрия; или жирные кислоты (например, кокосовое масло),
(c) катионогенные ПАВ, такие как водорастворимые четвертичные соли аммония формулы N+R'R"R"'R""Y-, в которой радикалы R представляют собой одинаковые или разные при желании гидроксилированные углеводородные радикалы, а Y- представляет собой анион сильной кислоты, такой как галогенидные сульфатные и сульфонатные анионы; цетилтриметиламмония бромид является одним из подходящих для применения катионогенных ПАВ,
(d) соли аминов формулы N+R'R"R'", в которой радикалы R представляют собой одинаковые или разные при желании гидроксилированные углеводородные радикалы; октадециламина гидрохлорид является одним из подходящих для применения катионогенных ПАВ;
(e) неионогенные ПАВ, такие как при желании полиоксиэтиленированные сложные эфиры сорбитана, например полисорбат 80, или полиоксиэтиленированные алкиловые эфиры; полиэтиленгликоль стеарат, полиоксиэтиленированные производные касторового масла, сложные эфиры полиглицерина, полиоксиэтиленированные жирные спирты, полиоксиэтиленированные жирные кислоты или сополимеры этиленоксида и пропиленоксида;
(f) амфотерные ПАВ, такие как замещенные лауриловые соединения бетаина, или
(g) смесь по меньшей мере двух из перечисленных выше в пунктах (a)-(f) соединений, или
(h) органический растворитель или смесь растворителей, которые подавляют образование кристаллов или аморфного твердого вещества после введения препарата.
В одном варианте ингибитора кристаллизации, может применяться пара ингибиторов. Такие пары включают, например, комбинацию пленкообразующего средства полимерного типа и поверхностно-активного вещества. Указанные средства могут быть выбраны из соединений, перечисленных выше в качестве ингибиторов кристаллизации.
В некоторых вариантах осуществления, органический растворитель(-ли) могут иметь диэлектрическую константу от примерно 10 до примерно 35 или от примерно 20 до примерно 30. В других вариантах осуществления, органический растворитель может иметь диэлектрическую константу от примерно 10 до примерно 40 или от примерно 20 до примерно 30. Содержание органического растворителя или смеси растворителей в композиции не ограничивается, и он присутствует в количестве, достаточном для растворения целевых компонентов в желаемой концентрации. Как обсуждено выше, органический растворитель может также играть роль ингибитора кристаллизации в препарате.
В некоторых вариантах осуществления, один или больше органических растворителей могут иметь температуру кипения ниже примерно 100ºC, или ниже примерно 80ºC. В других вариантах осуществления, органический растворитель(-ли) могут иметь температуру кипения ниже примерно 300°C, ниже примерно 250°C, ниже примерно 230°C, ниже примерно 210°C или ниже примерно 200°C.
В некоторых вариантах осуществления, когда присутствует смесь растворителей, т.е. растворитель и сорастворитель, растворители могут присутствовать в композиции в вес/вес соотношении от примерно 1/50 до примерно 1/1. В типичном случае растворители присутствуют в соотношении от примерно 1/30 до примерно 1/1, от примерно 1/20 до примерно 1/1, или от примерно 1/15 до примерно 1/1 по весу. Предпочтительно, два растворителя присутствуют в вес/вес соотношении от примерно 1/15 до примерно 1/2. В некоторых вариантах осуществления, по меньшей мере один из присутствующих растворителей может улучшать растворимость действующего вещества или выступать в роли ускорителя высыхания. В частных вариантах осуществления, по меньшей мере один из растворителей смешивается с водой.
Препарат может также содержать антиоксидант, предназначенный для ингибирования окисления на воздухе, и этот антиоксидант может присутствовать в количестве от примерно 0,005 до примерно 1% (вес/об), от примерно 0,01 до примерно 0,1%, или от примерно 0,01 до примерно 0,05%.
В одном варианте пленкообразующего средства, данные средства являются средствами полимерного типа, которые включают (но не ограничиваются только ими) различные марки поливинилпирролидона, поливиниловые спирты и сополимеры винилацетата и винилпирролидона.
В одном варианте поверхностно-активных веществ, данные вещества включают (но не ограничиваются только ими) вещества, изготовленные из неионогенных ПАВ; в другом варианте поверхностно-активных веществ, данные вещества представляют собой полиоксиэтиленированный сложный эфир сорбитана. В другом варианте поверхностно-активных веществ, данные вещества включают различные марки полисорбата, например Полисорбат 80.
В другом варианте осуществления настоящего изобретения, пленкообразующее средство и поверхностно-активное вещество могут присутствовать в близких или одинаковых количествах, в указанных выше рамках границ общего количества ингибитора кристаллизации.
Ингибитор кристаллизации подавляет образование кристаллов на покровах и улучшает сохранение косметического вида на коже или мехе; при этом без создания ощущения липкости или липкого вида, несмотря на высокую концентрацию действующего вещества. В настоящем изобретении можно также применять в качестве ингибиторов кристаллизации вещества, отличные от указанных в настоящем тексте. В одном варианте осуществления, эффективность ингибитора кристаллизации можно продемонстрировать в ходе теста, согласно которому 0,3 мл раствора, содержащего 10% (вес/об) действующего вещества в указанном выше подходящем растворителе, и 10% (вес/об) соединения, играющего роль ингибитора кристаллизации, помещают на стеклянную пластинку при 20°C на 24 часа, после чего на поверхности стекла менее 10 кристаллов, предпочтительно 0 кристаллов, видны невооруженным глазом.
В одном варианте антиоксидантов, данными агентами являются известные в данной области и включают (но не ограничиваются только ими) бутилированный гидроксианизол, бутилированный гидрокситолуол, аскорбиновая кислота, метабисульфит натрия, пропил галлат, тиосульфат натрия или смесь по меньшей мере двух соединений, обладающих антиоксидантными свойствами.
Вспомогательные вещества для составления готовых форм хорошо известны практикующим специалистам в данной области и могут быть приобретены у коммерческих поставщиков или получены по известным методикам. Описанные концентрированные композиции в целом готовят простым смешиванием описанных выше компонентов; преимущественно, отправной точкой служит смешивание действующего вещества с основным растворителем, с последующим добавлением других ингредиентов или вспомогательных веществ.
Объем применяемого препарата зависит от типа животного размера животного, а также от силы препарата и активности действующих веществ. В одном варианте осуществления, для млекопитающего можно применять количество от примерно 0,1 до примерно 20 мл препарата. В другом варианте осуществления, объем может составлять от примерно 0,1 до примерно 10 мл, от примерно 0,1 до примерно 5 мл, от примерно 0,5 мл до примерно 10 мл, или от примерно 0,3 до примерно 3 мл.
В другом варианте осуществления настоящего изобретения, нанесение препарата для точечного нанесения по настоящему изобретению может также оказывать продолжительное действие широкого спектра, когда раствор наносится на животное или птицу. Препараты для точечного нанесения обеспечивают местное нанесение концентрированного раствора, суспензии, микроэмульсии или эмульсии для периодического нанесения на определенный участок животного, обычно между двумя плечами (раствор для точечного нанесения).
В случае препаратов для точечного нанесения, носитель может представлять собой жидкий носитель, как описано в патенте США 6 426 333 (включен в настоящий текст посредством ссылки), который в одном варианте препарата для точечного нанесения может содержать растворитель или смесь растворителей, включая (но не ограничиваясь только ими) ацетон, алифатический спирт, такой как метанол, этанол, пропанол, бутанол, изопропанол, пентанол, гексанол, гептанол, октанол, нонанол, циклопентанол, циклогексанол, этиленгликоль, пропиленгликоль и т.п.; ароматический спирт, такой как фенол, крезол, нафтол, бензиловый спирт и т.п.; ацетонитрил, бутил дигликоль, органический амид, такой как диметилацетамид, диметилформамид, монометилацетамид, 2-пирролидон, N-метилпирролидон, винилпирролидон и т.п.; пропилен или этилен карбонат, диметилсульфоксид (ДМСО), полимер гликоля или его простой эфир, такой как полиэтиленгликоль (PEG) различных марок, полипропиленгликоли различных марок, дипропиленгликоля н-бутиловый эфир, этиленгликоля моноэтиловый эфир, этиленгликоля монометиловый эфир, дипропиленгликоля монометиловый эфир, диэтиленгликоля моноэтиловый эфир, этиленгликоль, диэтилфталат, сложные эфиры жирных кислот, такие как диэтил- или диизобутиладипат, или смесь по меньшей мере двух из перечисленных растворителей.
Жидкий носитель необязательно можно содержать ингибитор кристаллизации, включая (но не ограничиваясь только ими) описанные выше в пунктах (a)-(h), или соединение, которое может одновременно играть роль растворителя и ингибитора кристаллизации (как описано выше), или смесь указанных ингибиторов кристаллизации.
Препараты для точечного нанесения можно приготовить растворением активных ингредиентов в фармацевтически или ветеринарно приемлемом носителе. Альтернативно, препарат для точечного нанесения можно приготовить инкапсулированием активного ингредиента, чтобы остаток терапевтического средства оставался на покровах животного. Состав таких препаратов может варьироваться в отношении содержания терапевтического средства в комбинации, в зависимости от вида животного, подвергающегося лечению, степени и типа инфекции, и веса животного.
Дозированные формы в типичном случае содержат от примерно 0,1 мг до примерно 5г действующего вещества. В других вариантах осуществления, дозированная форма может содержать от примерно 0,5 мг до примерно 5 г действующего вещества. В одном варианте дозированной формы, дозировка может составлять от примерно 1 мг до примерно 500 мг действующего вещества, в типичном случае примерно 25 мг, примерно 50 мг, примерно 100 мг, примерно 200 мг, примерно 300 мг, примерно 400 мг, примерно 500 мг, примерно 600 мг, примерно 800 мг или примерно 1000 мг.
В одном варианте осуществления настоящего изобретения, действующее вещество может присутствовать в препарате в концентрации от примерно 0,05 до примерно 10% вес/объем. В другом варианте осуществления настоящего изобретения, действующее вещество может присутствовать в препарате в концентрации от примерно 0,1 до примерно 2% вес/объем. В другом варианте осуществления настоящего изобретения, действующее вещество может присутствовать в препарате в концентрации от примерно 0,25 до примерно 1,5% вес/объем. В другом варианте осуществления настоящего изобретения, действующее вещество может присутствовать в препарате в концентрации примерно 1% вес/объем.
II. Способы лечения:
Как описано выше, соединения, имеющие формулу (I), эффективны против эндопаразитов и могут применяться для лечения или предотвращения паразитных инфекций в организме животных или на их покровах. В одном варианте осуществления, в настоящем изобретении описан способ лечения или предотвращения эндопаразитной инфекции в организме животных или на их покровах (например, млекопитающего или птицы) включающий введение млекопитающему эндопаразитицидно эффективного количества соединения, имеющего формулу (I), или их ветеринарно приемлемых солей, или композиции по настоящему изобретению.
Соединения, имеющие формулу (I), могут также быть эффективны против эктопаразитов и могут применяться для лечения или предотвращения заражения животных эктопаразитами. В другом варианте осуществления, в настоящем изобретении описан способ лечения или предотвращения заражения животных эктопаразитами (например, млекопитающего или птицы), включающий введение млекопитающему эктопаразитицидно эффективного количества соединения, имеющего формулу (I), или их ветеринарно приемлемых солей, или композиции по настоящему изобретению.
В другом варианте осуществления, в настоящем изобретении описан способ лечения или предотвращения эндопаразитной инфекции в организме животных или на их покровах или предотвращения заражения животных эктопаразитами, включающий введение млекопитающему композиции, содержащей эффективное количество соединения, имеющего формулу (I), в комбинации с эффективным количеством по меньшей мере одного второго действующего вещества, или его ветеринарно приемлемой соли.
В другом варианте осуществления настоящего изобретения, описан способ для лечения или предотвращения заражения паразитами в очаге, который включает введение или нанесение на очаг паразитицидно эффективного количества соединения, имеющего формулу (I), или его ветеринарно приемлемой соли. В применении к охране здоровья животных, под "очагом" понимается место обитания, размножения, площадь, материал или окружение, в котором паразит растет или может расти, исключая организм животного или его покровы.
В другом варианте осуществления, в настоящем изобретении описаны способы и применения соединений, имеющих формулу (I), для борьбы с вредителями растений или круп, или для защиты дерево-содержащих конструкций.
Млекопитающие, которые могут подвергаться обработке, включают (но не ограничиваются только ими) людей, кошек, собак, крупный рогатый скот, кур, коров, бизонов, оленей, коз, лошадей, лам, верблюдов, свиней, овец и яков. В одном варианте осуществления настоящего изобретения, обрабатываемыми животными являются люди, кошки или собаки.
В одном варианте осуществления настоящего изобретения, соединения, имеющие формулу (I), обладают повышенной эффективностью против эндопаразитов, и в частности против эндопаразитов, резистентных к действующим веществам из класса макроциклических лактонов. В одном варианте осуществления, соединения и композиции по настоящему изобретению эффективны для борьбы с Haemonchus contortus, Ostertagia circumcincta и Trichostrongylus colubriformis у млекопитающих или птиц.
В другом варианте осуществления, в настоящем изобретении описан способ лечения паразитной инфекции или заражения паразитами у животного, включающий введение эффективного количества противогельминтного соединения по настоящему изобретению в комбинации с эффективным количеством активаторов ГАМК-рецепторов беспозвоночных, включая авермектин или милбемицин, млекопитающему, нуждающемуся в этом. Авермектины, которые можно применять в комбинации с соединениями по настоящему изобретению, включают (но не ограничиваются только ими) абамектин, димадектин, дорамектин, эмамектин, эприномектин, ивермектин, латидектин, лепимектин и селамектин. Милбемицины, которые можно применять в комбинации с соединениями по настоящему изобретению, включают (но не ограничиваются только ими) милбемиктин, милбемицин D, моксидектин и немадектин. Также включены 5-оксо и 5-оксимные производные указанных авермектинов и милбемицинов.
В одном варианте осуществления, соединения и композиции по настоящему изобретению можно применять для лечения или предотвращения эндопаразитной инфекции следующих паразитов: Anaplocephala (Anoplocephala), Ancylostoma, Necator, Ascaris, Brugia, Bunostomum, Capillaria, Chabertia, Cooperia, Cyathostomum, Cylicocyclus, Cylicodontophorus, Cylicostephanus, Craterostomum, Dictyocaulus, Dipetalonema, Dipylidium, Dirofilaria, Dracunculus, Echinococcus, Enterobius, Fasciola, Filaroides, Habronema, Haemonchus, Metastrongylus, Moniezia, Necator, Nematodirus, Nippostrongylus, Oesophagostomum, Onchocerca, Ostertagia, Oxyuris, Parascaris, Schistosoma, Strongylus, Taenia, Toxocara, Strongyloides, Toxascaris, Trichinella, Trichuris, Trichostrongylus, Triodontophorus, Uncinaria, Wuchereria, и их комбинаций.
В особенно предпочтительном варианте осуществления настоящего изобретения, соединения и композиции по настоящему изобретению применяют для лечения или предотвращения инфекции Dirofilaria immitis. Было обнаружено, что соединения, имеющие формулу (I), высоко эффективны против микрофилярий и L4 личинок D. immitis. Так, соединения, имеющие формулу (I) можно применять для защиты животных от развития заболевания сердечными гельминтами посредством истребления незрелых стадий D. immitis до того, как они разовьются в зрелых червей. В одном варианте осуществления, соединения, имеющие формулу (I), и композиции, содержащие данные соединения, можно применять для предотвращения развития заболевания сердечными гельминтами посредством истребления незрелых стадий D. immitis, устойчивых к макроциклическим лактонам. В другом варианте осуществления, соединения и композиции по настоящему изобретению применяют для лечения или предотвращения инфекции Dirofilaria repens или Dirofilaria hongkongensis.
В другом варианте осуществления настоящего изобретения, паразит представляет собой Haemonchus contortus, Ostertagia circumcincta, Trichostrongylus axei, Trichostrongylus colubriformis, Cooperia curticei, Nematodirus battus и их комбинации.
В другом варианте лечения против эндопаразитов и эктопаразитов, при комбинировании с эктопаразитицидными веществами, эктопаразит представляет собой одно или больше насекомое или паукообразное, включая представителей родов Ctenocephalides, Rhipicephalus, Dermacentor, Ixodes, Boophilus, Amblyomma, Haemaphysalis, Hyalomma, Sarcoptes, Psoroptes, Otodectes, Chorioptes, Hypoderma, Damalinia, Linognathus, Haematopinus, Solenoptes, Trichodectes и Felicola.
В другом воплощении лечения эктопаразитов, эктопаразит происходит из родов Ctenocephalides, Rhipicephalus, Dermacentor, Ixodes и/или Boophilus. Обрабатываемые эктопаразиты включают, без ограничения перечисленным, блох, паразитиформных клещей, акариформных клещей, москитов, мух, вшей, мясных мух и их комбинаций. Конкретные примеры включают, без ограничения перечисленным, блох котов и собак (Ctenocephalides felis, Ctenocephalides sp. и т.п.), паразитиформных клещей (Rhipicephalus sp., Ixodes sp., Dermacentor sp., Amblyomma sp., и т.п.), и акариформных клещей (Demodex sp., Sarcoptes sp., Otodectes sp. и т.п.), вшей (Trichodectes spp., Cheyletiella spp., Linognathus spp., и т.п.), комаров (Aedes spp., Culex spp., Anopheles spp., и т.п.) и мух (Haematobia spp., Musca spp., Stomoxys spp., Dermatobia spp., Cochliomyia spp., и т.п.). В другом воплощении лечения эктопаразитов, эктопаразит представляет собой блоху и/или клеща.
Дополнительные примеры эктопаразитов включают, без ограничения перечисленным, род клещей Boophilus, особенно видов microplus (клещ кольчатый), decoloratus и annulatus; миазы, такие как Dermatobia hominis (известна как Berne in Brazil) и Cochliomyia hominivorax (падальница зелёная); миазы овец, такие как Lucilia sericata, Lucilia cuprina (известна как падальная муха в Австралии, Новой Зеландии и Южной Африке), собственно мухи, а именно те, чьи взрослые формы являются паразитами, такие как Haematobia irritans (жигалка коровья малая); вши, такие как Linognathus vituli и т.п.; и акариформные клещи, такие как Sarcoptes scabiei и Psoroptes ovis. Вышеуказанный перечень не является исчерпывающим, и другие эктопаразиты хорошо известны в данной области как опасные для животных и людей. Они включают, например, мигрирующие личинки двукрылых.
В другом варианте осуществления настоящего изобретения, соединения и композиции по настоящему изобретению пригодны для борьбы с вредителями, выбранными из группы, состоящей из Blatella germanica, Heliothis virescens, Leptinotarsa decemlineata, Tetramorium caespitum и их комбинации.
Фитопаразитические нематоды включают, например, виды родов Anguina, Aphelenchoides, Belonoaimus, Bursaphelenchus, Ditylenchus dipsaci, Globodera, Heliocotylenchus, Heterodera, Longidorus, Meloidogyne, Pratylenchus, Radopholus similis, Rotylenchus, Trichodorus, Tylenchorhynchus, Tylenchulus, Tylenchulus semipenetrans, Xiphinema.
Кроме того, с добавлением или без добавления других пестицидных средств в композицию, настоящее изобретение может также применяться для избавления от других вредителей, которые включают (но не ограничиваются только ими) следующих вредителей:
(1) из отряда Isopoda, например Oniscus asellus, Armadillidium vulgare и Porcellio scaber;
(2) из отряда Diplopoda, например Blaniulus guttulatus;
(3) из отряда Chilopoda, например Geophilus carpophagus и Scutigera spp.;
(4) из отряда Symphyla, например Scutigerella immaculata;
(5) из отряда Thysanura, например Lepisma saccharina;
(6) из отряда Collembola, например Onychiurus armatus;
(7) из отряда Blattaria, например Blatta orientalis, Periplaneta americana, Leucophaea maderae и Blattella germanica;
(8) из отряда Hymenoptera, например, виды родов Diprion, Hoplocampa, Lasius, Monomorium pharaonis и Vespa;
(9) из отряда Siphonaptera, например Xenopsylla cheopis и виды родов Ceratophyllus;
(10) из отряда Anoplura (Phthiraptera), например, виды родов Damalinia, Haematopinus, Linognathus, Pediculus, Trichodectes;
(11) из класса Arachnida, например, Acarus siro, Aceria sheldoni, виды родов Aculops, Aculus, Amblyomma, Argas, Boophilus, Brevipalpus, Bryobia praetiosa, Chorioptes, Dermanyssus gallinae, Eotetranychus, Epitrimerus pyri, Eutetranychus, Eriophyes, Hemitarsonemus, Hyalomma, Ixodes, Latrodectus mactans, Metatetranychus, Oligonychus, Ornithodoros, Panonychus, Phyllocoptruta oleivora, Polyphagotarsonemus latus, Psoroptes, Rhipicephalus, Rhizoglyphus, Sarcoptes, Scorpio maurus, Stenotarsonemus, Tarsonemus, Tetranychus, Vasates lycopersici;
(12) из класса Bivalva, например, виды рода Dreissena;
(13) из отряда Coleoptera, например, Acanthoscelides obtectus, виды родов Adoretus, Agelastica alni, Agriotes, Amphimallon solstitialis, Anobium punctatum, Anoplophora, Anthonomus, Anthrenus, Apogonia, Atomaria, Attagenus, Bruchidius obtectus, Bruchus, Ceuthorhynchus, Cleonus mendicus, Conoderus, Cosmopolites, Costelytra zealandica, Curculio, Cryptorhynchus lapathi, Dermestes, Diabrotica, Epilachna, Faustinus cubae, Gibbium psylloides, Heteronychus arator, Hylamorpha elegans, Hylotrupes bajulus, Hypera postica, Hypothenemus, Lachnosterna consanguinea, Leptinotarsa decemlineata, Lissorhoptrus oryzophilus, Lixus, Lyctus, Meligethes aeneus, Melolontha melolontha, Migdolus, Monochamus, Naupactus xanthographus, Niptus hololeucus, Oryctes rhinoceros, Oryzaephilus surinamensis, Otiorrhynchus sulcatus, Oxycetonia jucunda, Phaedon cochleariae, Phyllophaga spp., Popillia japonica, Premnotrypes, Psylliodes chrysocephala, Ptinus, Rhizobius ventralis, Rhizopertha dominica, Sitophilus, Sphenophorus, Sternechus, Symphyletes, Tenebrio molitor, Tribolium, Trogoderma, Tychius, Xylotrechus, Zabrus;
(14) из отряда Diptera, например, виды родов Aedes, Anopheles, Bibio hortulanus, Calliphora erythrocephala, Ceratitis capitata, Chrysomyia, Cochliomyia, Cordylobia anthropophaga, Culex, Cuterebra, Dacus oleae, Dermatobia hominis, Drosophila, Fannia, Gastrophilus, Hylemyia, Hyppobosca, Hypoderma, Liriomyza, Lucilia, Musca, Nezara, Oestrus, Oscinella frit, Pegomyia hyoscyami, Phorbia, Stomoxys, Tabanus, Tannia, Tipula paludosa, Wohlfahrtia;
(15) из класса Gastropoda, например, виды родов Arion, Biomphalaria, Bulinus, Deroceras, Galba, Lymnaea, Oncomelania, Succinea;
(16) из класса гельминтов, например, Ancylostoma duodenale, Ancylostoma ceylanicum, Acylostoma braziliensis, виды родов Ancylostoma, Ascaris lubricoides, Ascaris, Brugia malayi, Brugia timori, Bunostomum, Chabertia, Clonorchis, Cooperia, Dicrocoelium Dictyocaulus filaria, Diphyllobothrium latum, Dracunculus medinensis, Echinococcus granulosus, Echinococcus multilocularis, Enterobius vermicularis, Faciola, Haemonchus, Heterakis, Hymenolepis nana, Hyostrongulus, Loa Loa, Nematodirus, Oesophagostomum, Opisthorchis, Onchocerca volvulus, Ostertagia, Paragonimus, Schistosomen, Strongyloides fuelleborni, Strongyloides stercoralis, Stronyloides, Taenia saginata, Taenia solium, Trichinella spiralis, Trichinella nativa, Trichinella britovi, Trichinella nelsoni, Trichinella pseudopsiralis, Trichostrongulus, Trichuris trichuria, Wuchereria bancrofti;
(17) из отряда Heteroptera, например, Anasa tristis, виды родов Antestiopsis, Blissus, Calocoris, Campylomma livida, Cavelerius, Cimex, Creontiades dilutus, Dasynus piperis, Dichelops furcatus, Diconocoris hewetti, Dysdercus, Euschistus, Eurygaster, Heliopeltis, Horcias nobilellus, Leptocorisa, Leptoglossus phyllopus, Lygus, Macropes excavatus, Miridae, Nezara, Oebalus, Pentomidae, Piesma quadrata, Piezodorus, Psallus seriatus, Pseudacysta persea, Rhodnius, Sahlbergella singularis, Scotinophora, Stephanitis nashi, Tibraca, Triatoma;
(18) из отряда Homoptera, например, виды родов Acyrthosipon, Aeneolamia, Agonoscena, Aleurodes, Aleurolobus barodensis, Aleurothrixus, Amrasca, Anuraphis cardui, Aonidiella, Aphanostigma piri, Aphis, Arboridia apicalis, Aspidiella, Aspidiotus, Atanus, Aulacorthum solani, Bemisia, Brachycaudus helichrysii, Brachycolus, Brevicoryne brassicae, Calligypona marginata, Carneocephala fulgida, Ceratovacuna lanigera, Cercopidae, Ceroplastes, Chaetosiphon fragaefolii, Chionaspis tegalensis, Chlorita onukii, Chromaphis juglandicola, Chrysomphalus ficus, Cicadulina mbila, Coccomytilus halli, Coccus, Cryptomyzus ribis, Dalbulus, Dialeurodes, Diaphorina, Diaspis, Doralis, Drosicha, Dysaphis, Dysmicoccus, Empoasca, Eriosoma, Erythroneura, Euscelis bilobatus, Geococcus coffeae, Homalodisca coagulata, Hyalopterus arundinis, Icerya, Idiocerus, Idioscopus, Laodelphax striatellus, Lecanium, Lepidosaphes, Lipaphis erysimi, Macrosiphum, Mahanarva fimbriolata, Melanaphis sacchari, Metcalfiella, Metopolophium dirhodum, Monellia costalis, Monelliopsis pecanis, Myzus, Nasonovia ribisnigri, Nephotettix, Nilaparvata lugens, Oncometopia, Orthezia praelonga, Parabemisia myricae, Paratrioza, Parlatoria, Pemphigus, Peregrinus maidis, Phenacoccus, Phloeomyzus passerinii, Phorodon humuli, Phylloxera, Pinnaspis aspidistrae, Planococcus, Protopulvinaria pyriformis, Pseudaulacaspis pentagona, Pseudococcus, Psylla, Pteromalus, Pyrilla, Quadraspidiotus, Quesada gigas, Rastrococcus, Rhopalosiphum, Saissetia, Scaphoides titanus, Schizaphis graminum, Selenaspidus articulatus, Sogata, Sogatella furcifera, Sogatodes, Stictocephala festina, Tenalaphara malayensis, Tinocallis caryaefoliae, Tomaspis, Toxoptera, Trialeurodes vaporariorum, Trioza, Typhlocyba, Unaspis, Viteus vitifolii;
(19) из отряда Isoptera, например, виды родов Reticulitermes, Odontotermes;
(20) из отряда Lepidoptera, например, Acronicta major, Aedia leucomelas, виды родов Agrotis, Alabama argillacea, Anticarsia, Barathra brassicae, Bucculatrix thurberiella, Bupalus piniarius, Cacoecia podana, Capua reticulana, Carpocapsa pomonella, Cheimatobia brumata, Chilo, Choristoneura fumiferana, Clysia ambiguella, Cnaphalocerus, Earias insulana, Ephestia kuehniella, Euproctis chrysorrhoea, Euxoa, Feltia, Galleria mellonella, Helicoverpa, Heliothis, Hofmannophila pseudospretella, Homona magnanima, Hyponomeuta padella, Laphygma, Lithocolletis blancardella, Lithophane antennata, Loxagrotis albicosta, Lymantria, Malacosoma neustria, Mamestra brassicae, Mocis repanda, Mythimna separata, Oria, Oulema oryzae, Panolis flammea, Pectinophora gossypiella, Phyllocnistis citrella, Pieris, Plutella xylostella, Prodenia spp., Pseudaletia, Pseudoplusia includens, Pyrausta nubilalis, Spodoptera, Thermesia gemmatalis, Tinea pellionella, Tineola bisselliella, Tortrix viridana, Trichoplusia;
(21) из отряда Orthoptera, например, Acheta domesticus, Blatta orientalis, Blattella germanica, Gryllotalpa spp., Leucophaea maderae, виды родов Locusta, Melanoplus, Periplaneta americana, Schistocerca gregaria.;
(22) из отряда Thysanoptera, например, Baliothrips biformis, Enneothrips flavens, виды родов Frankliniella, Heliothrips, Hercinothrips femoralis, Kakothrips, Rhipiphorothrips cruentatus, Scirtothrips, Taeniothrips cardamoni, Thrips;
(23) из класса Protozoa, например, виды рода Eimeria.
В каждом аспекте настоящего изобретения, соединения и композиции по настоящему изобретению можно применять против одного вредителя или их комбинации.
III. Смеси с другими действующими веществами
В другом варианте осуществления, композиции, содержащие циклические депсипептиды, имеющие формулу (I), могут также включать другие ветеринарные терапевтические средства. Ветеринарные фармацевтические агенты, которые можно включать в композиции по настоящему изобретению, хорошо известны в данной области техники (смотри, например, Plumb’ Veterinary Drug Handbook, 5th Edition, ed. Donald C. Plumb, Blackwell Publishing, (2005) или The Merck Veterinary Manual, 9th Edition, (January 2005)) и включают (но не ограничиваются только ими) акарбоза, ацепромазина малеат, ацетаминофен, ацетазоламид, ацетазоламид натрий, уксусная кислота, ацетогидроксамовая кислота, ацетилцистеин, ацитрецин, ацикловир, албендазол, албутерол сульфат, алфентанил, аллопуринол, алпразолам, альтреногест, амантадин, амикацин сульфат, аминокапроновая кислота, аминопентамида гидросульфат, аминофиллин/теофиллин, амиодарон, амитриптилин, амлодипина безилат, хлорид аммония, молибденат аммония, амоксициллин, клавуланат калия, амфотрецин В дезоксихолат, амфотрецин В на липидной основе, ампициллин, ампролиум, антациды (для перорального применения), антивенин, апоморфион, апрамицина сульфат, аскорбиновая кислота, аспрагиназа, аспирин, атенолол, атипамезол, атракурия безилат, атропина сульфат, аурнофин, ауротиоглюкоза, азаперон, азатиоприн, азитромицин, баклофен, барбитураты, беназеприл, бетаметазон, бетанехол хлорид, бисакодил, субсалицилат висмута, блеомицин сульфат, болденона ундециленат, бромиды, бромокриптина мезилат, буденозид, бупренорфин, бусирон, бусульфан, буторфанола тартрат, каберголин, кальцитонин лососевых рыб, кальцитрол, соли кальция, каптоприл, карбенициллин инданил натрий, карбимазол, карбоплатин, карнитин, карпрофен, карведилол, цефадроксил, цефазолин натрий, цефиксим, клорсулон. цефоперазон натрий, цефотаксим натрий, цефотетан динатрий, цефокситин натрий, цефподоксим проксетил, цефтазидим, цефтиофур натрий, цефтиофур, цефтиаксон натрий, цефалексин, цефалоспорины, цефапирин, активированный уголь, хлорамбуцил, хлорамфеникол, хлордиазэпоксид, хлордиазэпоксид +/- клидиниум бромид, хлортиазид, хлорфенирамина малеат, хлорпромазин, хлорпропамид, хлортетрациклин, хорионический гонадотропин (ХГЧ), хром, циметидин, ципрофлоксацин, цисаприд, цисплатин, цитратные соли, кларитромицин, клемастина фумарат, кленбутерол, клиндамицин, клофазимин, кломипрамин, клаоназепам, клонидин, клопростенол натрий, клоразепат дикалий, клорсулон, клоксациллин, кодеина фосфат, колхицин, кортикотропин (АКТГ), косинтропин, циклофосфамид, циклоспорин, циклогептадин, цитарабин, дакарбазин, дактиномицин/актиномицин D, далтепарин натрий, даназол, дантролен натрий, дапсон, декохинат, дефероксамина мезилат, деракоксиб, деслорелина ацетат, десмопрессина ацетат, дезоксикортиокстерона пивалат, детомидин, дексаметазон, декспантенол, дексраазоксан, декстран, диазепам, диазоксид (перорально), дихлорфенамид, диклофенак натрий, диклоксациллин, диэтилкарбамазина цитрат, диэтилстилбестрол (DES), дифлоксацин, дигоксин, дигидротахистерол (DHT), дилтиазем, дименгидринат, димеркапрол/BAL, диметилсульфоксид, динопрост трометамин, дифенилгидрамин, дисопирамида фосфат, добутамин, докузат/DSS, доласетрона мезилат, домперидон, допамин, дорамектин, доксапрам, доксепин, доксорубицин, доксициклин, едетат кальция динатрия, кальция ЭДТА, эдрофония хлорид, эналаприл/эналаприлат, эноксапарин натрий, энрофлоксацин, эфедрина сульфат, эпинефрин, эпоетин/эритропоетин, эприномектин, эпсипрантел, эритромицин, эсмолол, эстрадиол ципионат, этакриновая кислота/этакринат натрия, этанол (спирт), этидронат натрия, этодолак, этомидат, средства для эвтаназии с пентобарбиталом, фамотидин, жирные кислоты (незаменимые/омега), фелбамат, фентанил, сульфат железа, филграстим, финастерид, фипронил, флорфеникол, флуконазол, флуцитозин, флудрокортизона ацетат, флумазенил, флуметазон, флуниксин меглумин, фторурацил (5-FU), флуоксетин, флутиказона пропионат, флувоксамина малеат, фомепизол (4-MP), фуразолидон, фуросемид, габапентин, гемцитабин, гентамицина сульфат, глимепирид, глипизид, глюкагон, глюкокортикоидные средства, глюкозамин/хондроитин сульфат, глутамин, глибурид, глицерин (перорально), гликопирролат, гонадорелин, гриссеофульвин, гвайфенезин, галотан, гемоглобин глутамер-200 (оксиглобин®), гепарин, гидроксиэтилкрахмал, гиалуронат натрия, гидразалин, гидрохлортиазид, гидрокодона битартрат, гидрокортизон, гидроморфон, гидроксимочевина, гидроксизин, ифосфамид, имидаклоприд, имидокарб дипропионат, импенем-циластатин натрий, имипрамин, инамринон лактат, инсулин, интерферон альфа-2а (человеческий рекомбинантный), иодид (натрия/калия), ипекак (сироп), иподат натрия, декстран железа, изофлуран, изопротеренол, изотретиноин, изокссуприн, итраконазол, каолин/пектин, кетамин, кетоконазол, кетопрофен, кеторолак трометамин, лактулоза, левпролид, левамизол, левитирацетам, левотироксин натрий, лидокаин, линкомицин, лиотиронин натрий, лизиноприл, ломустин (CCNU), луфенурон, лизин, магний, маннит, марбофлоксацин, мехлорэтамин, меклизин, меклофенамовая кислота, медетомидин, среднецепочечные триглицериды, медроксипрогестерона ацетат, мегестрола ацетат, меларсомин, мелатонин, мелоксикан, мелфалан, меперидин, меркаптопурин, меропенем, метформин, метадон, метазоламид, метенамина манделат/гиппурат, метимазол, метионин, метокарбамол, метогекситал натрий, метотрексат, метоксифлуран, метиленовый синий, метилфенидат, метилпреднизолон, метоклопрамид, метопролол, метронидаксол, мексилетин, миболерлон, мидазолам, милбемицин оксим, минеральное масло, миноциклин, мисопростол, митотан, митоксантрон, морфина сульфат, моксидектин, налоксон, мандролон деканоат, напроксен, наркотические (опиатные) агонистические анальгетики, неомицина сульфат, неостигмин, ниацинамид, нитазоксанид, нитенпирам, нитрофурантоин, нитроглицерин, нитропруссид натрия, низатидин, новобиоцин натрий, нистатин, октреотида ацетат, олсалазин натрий, омепрозол, ондансетрон, опиатные противодиарейные средства, орбифлоксацин, оксациллин натрий, оксазепам, оксибутинин хлорид, оксиморфон, окситетрациклин, окситоцин, памидронат динатрия, панкреплипаза, панкурония бромид, паромомицина сульфат, парозетин, пеницилламин, общеизвестные пенициллины, пенициллин G, пенициллин V калий, пентазоцин, пентобарбитал натрий, пентосан полисульфат натрия, пентоксифиллин, перголида мезилат, фенобарбитал, феноксибензамин, фенилбутазон, фенилэфрин, фенилпропаноламин, фенитоин натрий, феромоны, парентеральный фосфат, фитонадион/витамин К-1, пимобендан, пиперазин, пирлимицин, пироксикам, полисульфатированный гликозамингликан, поназурил, хлорид калия, пралидоксим хлорид, празосин, преднизолон/преднизон, примидон, прокаинамид, прокарбазин, прохлорперазин, пропантелина бромид, инъекция пропионовой бактерии акне, пропофол, пропранолол, протамина сульфат, псевдоэфедрин, объемное слабительное из подорожника, пиридостигмина бромид, пириламина малеат, пириметамин, хинакрин, хинидин, ранитидин, рифампин, s-аденозил-метионин (SAMe), физраствор/гиперосмотическое слабительное, селамектин, селегилин/l-депренил, сертралин, севеламер, севофлуран, силимарин/расторопша, бикарбонат натрия, полистиролсульфонат натрия, стибоглюконат натрия, сульфат натрия, тиосульфат натрия, соматотропин, соталол, спектиномицин, спиронолактон, станозолол, стрептокиназа, стрептозоцин, сукцимер, сукцинилхолин хлорид, сукралфат, суфентанила цитрат, сульфахлорпиридазин натрий, сульфадиазин/триметроприм, сульфаметоксазол/триметоприм, сульфадиментоксин, сульфадиментоксин/орметроприм, сульфасалазин, таурин, тепоксалин, тербинафлин, тербуталина сульфат, тестостерон, тетрациклин, тиабедазол, тиацетарсамид натрий, тиамин, тиогуанин, тиопентал натрий, тиотепа, тиротропин, тиамулин, тикарцилин динатрий, тилетамин/золазепам, тилмоксин, тиопронин, тобрамицина сульфат, токаинид, толазолон, телфенамовая кислота, топирамат, трамадол, тримцинолона ацетонид, триентин, трилостан, тримепраксина тартрат с преднизолоном, трипеленнамин, тилосин, урдосиол, вальпроевая кислота, ванадий, ванкомицин, вазопрессин, векурония бромид, верапамил, винбластина сульфат, винкристина фульфат, витамин Е/селен, варфарин натрий, ксилазин, йохимбин, зафирлукаст, зидовудин (АЗТ), ацетат цинка/сульфат цинка, зонисамид и их смеси.
В одном варианте осуществления настоящего изобретения, арилпиразольные соединения, такие как фенилпиразолы, можно включать в ветеринарные композиции по настоящему изобретению. Арилпиразолы известны в данной области техники и подходят для комбинирования с циклическими депсипептидами, имеющими формулу (I), в композициях по настоящему изобретению. Примеры таких арилпиразольных соединений включают (но не ограничиваются только ими) описанные в патентах США 6 001 384; 6 010 710; 6 083 519; 6 096 329; 6 174 540; 6 685 954, 6 998 131 и 7 759 381 (все они включены в настоящий текст посредством ссылок). Особенно предпочтительным арилпиразольным действующим веществом является фипронил.
В другом варианте осуществления настоящего изобретения, один или больше макроциклических лактонов, которые работают как акарицид, противогельминтное средство и/или инсектицид, можно включать в композиции по настоящему изобретению в комбинации с соединениями, имеющими формулу (I). Во избежание сомнений, термин “макроциклический лактон” при использовании в настоящем тексте включает как природные, так и синтетические или полусинтетические авермектин и милбемицин.
Макроциклические лактоны, которые можно применять в композициях по настоящему изобретению, включают (но не ограничиваются только ими) природные авермектины (например, включая компоненты, обозначенные как A1a, A1b, A2a, A2b, B1a, B1b, B2a и B2b) и милбемицины, полусинтетические авермектины и милбемицины, моносахаридные авермектины и агликоновые авермектины. Примеры макроциклических лактоновых соединений, которые можно применять в композициях по настоящему изобретению, включают (но не ограничиваются только ими) абамектин, димадектин, дорамектин, эмамектин, эприномектин, ивермектин, латидектин, лепимектин, селамектин, ML-1,694,554, и милбемицины, включая (но не ограничиваясь только ими) милбемектин, милбемицин D, милбемицин A3, милбемицин A4, милбемицин оксим, моксидектин и немадектин. Также включены 5-оксо и 5-оксимные производные указанных авермектинов и милбемицинов.
Макроциклические лактоны известны в данной области техники и могут быть легко получены из коммерческих источников или известными методами синтеза. Широко доступна техническая и коммерческая литература по данному вопросу. Для авермектинов, ивермектина и абамектина можно указать, например, работу “Ivermectin and Abamectin”, 1989, by M.H. Fischer and H. Mrozik, William C. Campbell, опубликованную издательством Springer Verlag., или Albers-Schönberg et al. (1981), “Avermectins Structure Determination”, J. Am. Chem. Soc., 103, 4216-4221. В случае дорамектина можно порекомендовать работу “Veterinary Parasitology”, vol. 49, No. 1, July 1993, 5-15. В случае милбемицинов можно указать, среди прочих, работы Davies H.G. et al., 1986, “Avermectins and Milbemycins”, Nat. Prod. Rep., 3, 87-121, Mrozik H. et al., 1983, Synhesis of Milbemycins from Avermectins, Tetrahedron Lett., 24, 5333-5336, патент США 4 134 973 и EP 0 677 054, которые оба включены в настоящий текст посредством ссылки.
Структуры авермектинов и милбемицинов являются близко родственными, например, они все содержат сложный 16-членный макроциклический лактоновый цикл. Природные авермектины описаны в патенте США 4 310 519, а 22,23-дигидро авермектиновые соединения описаны в патенте США 4 199 569. Следует также упомянуть, среди прочих, патенты США 4 468 390, 5 824 653, EP 0 007 812 A1, патент Великобритании 1 390 336, EP 0 002 916, и патент Новой Зеландии 237 086. Природные милбемицины описаны в патенте США 3 950 360, а также в многочисленных публикациях, процитированных в “The Merck Index” 12th ed., S. Budavari, Ed., Merck & Co., Inc. Whitehouse Station, New Jersey (1996). Латидектин описан в “International Nonproprietary Names for Pharmaceutical Substances (INN)”, WHO Drug Information, vol. 17, no. 4, pp. 263- 286, (2003). Полусинтетические производные этих классов соединений хорошо известны в данной области и описаны, например, в патентах США 5 077 308, 4 859 657, 4 963 582, 4 855 317, 4 871 719, 4 874 749, 4 427 663, 4 310 519, 4 199 569, 5 055 596, 4 973 711, 4 978 677, 4 920 148, и в EP 0 667 054, все включены в настоящий текст посредством ссылки.
В одном варианте осуществления, ветеринарные композиции по настоящему изобретению содержат эффективное количество по меньшей мере одного из следующих веществ: абамектин, димадектин, дорамектин, эмамектин, эприномектин, ивермектин, латидектин, лепимектин, селамектин, милбемектин, милбемицин D, милбемицин A3, милбемицин A4, милбемицин оксим, моксидектин и немадектин, или их комбинации. В другом варианте осуществления, в настоящем изобретении описана ветеринарная композиция, содержащая эффективное количество по меньшей мере одного из следующих веществ: абамектин, эмамектин, эприномектин, ивермектин, дорамектин и селамектин, или их комбинации. В другом варианте осуществления, ветеринарные композиции по настоящему изобретению содержат эффективное количество по меньшей мере одного из следующих веществ: ивермектин, милбемектин, милбемицин оксим или моксидектин, или их комбинации. В другом варианте осуществления настоящего изобретения, описана композиция, содержащая соединение, имеющее формулу (I), в комбинации с классом акарицидов или инсектицидов, известных как регуляторы роста насекомых (IGR). Соединения, принадлежащие к данной группе, хорошо известны практикующим специалистам и представляют собой широкий спектр различных химических классов. Эти соединения работают посредством нарушения развития или роста насекомых-вредителей. Регуляторы роста насекомых описаны, например, в патентах США 3 748 356, 3 818 047, 4 225 598, 4 798 837, 4 751 225, EP 0 179 022 или U.K. 2 140 010, а также в патентах США 6 096 329 и 6 685 954 (все включены в настоящий текст посредством ссылки).
В одном варианте осуществления, композиции по настоящему изобретению могут включать IGR соединение, которое является мимиком ювенильного гормона или модулирует концентрацию ювенильных гормонов у насекомого. Примеры мимиков ювенильного гормона включают азадирахтин, диофенолан, феноксикарб, гидропрен, кинопрен, метопрен, пирипроксифен, тетрагидроазадирахтин и 4-хлор-2(2-хлор-2-метил-пропил)-5-(6-иод-3-пиридилметокси)пиридазин-3(2H)-он. В другом варианте осуществления, композиции по настоящему изобретению содержат соединение, имеющее формулу (I), в комбинации с метопреном или пирипроксифеном, и фармацевтически приемлемый носитель.
В другом варианте осуществления, композиции по настоящему изобретению включают IGR соединение, которое представляет собой ингибитор синтеза хитина. Ингибиторы синтеза хитина включают хлорфлуазурон, циромазин, дифлубензурон, флуазурон, флуциклоксурон, флуфеноксурон, гексафлуморон, луфенурон, тебуфенозид, тефлубензурон, трифлуморон, 1-(2,6-дифторбензоил)-3-(2-фтор-4-(трифторметил)-фенилмочевину, 1-(2,6-дифтор-бензоил)-3-(2-фтор-4-(1,1,2,2-тетрафторэтокси)-фенилмочевину и 1-(2,6-дифторбензоил)-3-(2-фтор-4-трифторметил)фенилмочевину.
В некоторых вариантах осуществления, композиции по настоящему изобретению могут включать один или больше противонематодных средств, включая (но не ограничиваясь только ими) действующие вещества из классов бензимидазолов, имидазотиазолов, тетрагидропиримидинов и органических фосфатов. В некоторых вариантах осуществления, в композиции могут входить бензимидазолы, включая (но не ограничиваясь только ими) тиабендазол, камбендазол, парбендазол, оксибендазол, мебендазол, флубендазол, фенбендазол, оксфендазол, албендазол, циклобендазол, фебантел, тиофанат и его o,o-диметильные аналоги.
В других вариантах осуществления, композиции могут включать имидазотиазольные соединения, включая (но не ограничиваясь только ими) тетрамизол, левамизол и бутамизол.
В других вариантах осуществления, композиции по настоящему изобретению могут включать тетрагидропиримидиновые активные соединения, включая (но не ограничиваясь только ими) пирантел, оксантел и морантел.
Подходящие органофосфатные активные соединения включают (но не ограничиваются только ими) кумафос, трихлорфон, галоксон, нафталофос и дихлорфос, гептенофос, мевинфос, монокротофос, тетраэтилпирофосфат и тетрахлорвинфос.
В других вариантах осуществления, композиции могут включать противонематодные соединения фенотиазин, пиперазин в виде нейтральных соединений и в виде различных солей, диэтилкарбамазин, фенолы, такие как дисофенол, соединения мышьяка, такие как арсенамид, этаноламины, такие как бефений, тений клозилат и метиридин; цианиновые красители, включая пирвиний хлорид, пирвиний памоат и дитиазанин иодид, изотиоцианаты, включая битосканат, сурамин натрий, фталофин, и различные природные вещества, включая (но не ограничиваясь только ими), гигромицин B, α-сантонин и каиновую кислоту.
В других вариантах осуществления, композиции по настоящему изобретению могут включать противотрематодозные средства. Подходящие противотрематодозные средства включают (но не ограничиваются только ими) мирацилы, такие как мирацил D и мирасан, празиквантел, клоназепам и его 3-метильное производное, олтипраз, лукантон, гикантон, оксамнихин, амосканат, ниридазол, нитроксинил, различные бисфенольные соединения, известные в данной области техники, включая гексахлорофен, битионол, битионол сульфоксид и менихлофолан; различные салициланилидные соединения, включая трибромсалан, оксиклозанид, клиоксанид, рафоксанид, бротианид, бромоксанид и клосантел; триклабендазол, диамфенетид, клорсулон, гетолин и эметин.
В композиции по настоящему изобретению также могут с пользой применяться противоцестодозные средства, включая (но не ограничиваясь только ими) ареколин в виде различных солей, бунамидин, никлозамид, нитросканат, паромомицин, паромомицин II и празиквантел.
В других вариантах осуществления, композиции по настоящему изобретению могут включать другие активные средства, эффективные против членистоногих паразитов. Подходящие активные средства включают (но не ограничиваются только ими) бромциклен, хлордан, ДДТ, эндосульфан, линдан, метоксихлор, токсафен, бромофос, бромофос-этил, карбофенотион, хлорфенвинфос, хлорпирифос, кротоксифос, цитиоат, диазинон, дихлорентион, диэмтоат, диоксатион, этион, фамфур, фенитротион, фентион, фосфпират, иодофенфос, малатион, налед, фосалон, фосмет, фоксим, пропетамфос, роннел, стирофос, аллетрин, цигалотрин, циперметрин, дельтаметрин, фенвалерат, флуцитринат, перметрин, фенотрин, пиретрины, респетрин, бензилбензоат, дисульфид углерода, кротамитон, дифлубензурон, дифениламин, дисульфирам, изоборнилтиоцианатоацетат, метропрен, моносульфирам, пиренонилбутоксид, ротенон, трифенилолова ацетат, трифенилолова гидроксид, ДЭТА, диметилфталат и соединения 1,5a,6,9,9a,9b-гексагидро-4a(4H)-дибензофуранкарбоксальдегид (MGK-11), 2-(2-этилгексил)-3a,4,7,7a-тетрагидро-4,7-метано-1H-изоиндол-1,3(2H)дион (MGK-264), дипропил-2,5-пиридиндикарбоксилат (MGK-326) и 2-(октилтио)этанол (MGK-874).
В другом варианте осуществления, антипаразитарным средством, которое можно включать в ветеринарную композицию, содержащую соединение, имеющее формулу (I), может быть биологически активный пептид или белок, включая (но не ограничиваясь только ими) депсипептиды, отличные от соединений, имеющих формулу (I). Они включают PF1022A или его аналоги, и эмодепсид. Эти соединения работают в нейромышечном соединении посредством стимулирования пресинаптических рецепторов, принадлежащих к семейству секретиновых рецепторов, что приводит к параличу и смерти паразитов. В одном варианте депсипептида, депсепептид представляет собой эмодепсид (смотри Willson et al., Parasitology, Jan. 2003, 126(Pt 1):79-86).
В другом варианте осуществления, композиции по настоящему изобретению могут содержать действующее вещество из неоникотиноидного класса паразитицидов. Неоникотиноиды связываются и ингибируют специфические для насекомых никотиновые ацетилхолиновые рецепторы. В одном варианте осуществления, неоникотиноидным инсектицидом, который можно комбинировать с соединением, имеющим формулу (I), в композиции по настоящему изобретению является имидаклоприд. Средства из данного класса описаны, например, в патенте США 4 742 060 или в EP 0 892 060 (оба включены в настоящий текст посредством ссылки). В другом варианте осуществления, композиции по настоящему изобретению могут содержать нитенпирам, другое действующее вещество из неоникотиноидного класса пестицидов. Применение нитенпирама для борьбы с блохами описано в патенте США 5 750 548, который включен в настоящий текст в полном объеме посредством ссылки.
В некоторых других вариантах осуществления настоящего изобретения, циклические депсипептиды, имеющие формулу (I), можно комбинировать с композициями по настоящему изобретению, содержащими семикарбазон, такой как метафлумизон.
В другом варианте осуществления, композиции по настоящему изобретению могут содержать смесь одного или больше других изоксазолиновых соединений, известных в данной области, в дополнение или вместо описанных выше изоксазолиновых действующих веществ. Изоксазолиновые действующие вещества обладают высокой эффективностью против ряда эктопаразитов, и комбинация с циклическими депсипептидами, имеющими формулу (I), расширяет спектр эффективности против данных паразитов. Особенно подходящие изоксазолиновые действующие вещества, которые можно комбинировать с соединениями, имеющими формулу (I), включают афоксоланер (включая практически чистый активный энантиомер), сароланер, флураланер (включая практически чистый активный энантиомер) и лотиланер. Эти действующие вещества описаны в US7,964,204, US 2010/0254960 A1, US2011/0159107, US2012/0309620, US2012/0030841, US2010/0069247, WO 2007/125984, WO 2012/086462, US 8318757, US 8466115, US 8618126, US 8822466, US8383659, US8853186, US 9221835, US 2011/0144349, US 8,053,452; US 2010/0137612, US 8410153, US 2011/152081, WO 2012/089623, WO 2012/089622, US 8,119,671; US 7,947,715; WO 2102/120135, WO 2012/107533, WO 2011/157748, US 2011/0245274, US 2011/0245239, US 2012/0232026, US 2012/0077765, US 2012/0035122, US 2011/0251247, WO 2011/154433, WO 2011/154434, US 2012/0238517, US 2011/0166193, WO 2011/104088, WO 2011/104087, WO 2011/104089, US 2012/015946, US 2009/0143410, WO 2007/123855 A2, US 2011/0118212, US7951828 & US7662972, US 2010/0137372 A1, US 2010/0179194 A2, US 2011/0086886 A2, US 2011/0059988 A1, US 2010/0179195 A1, US 2015/0126523, WO 2010/003923, WO 2010/003877, WO 2010/072602, WO 2014/134236, US 7897630 и U.S. 7951828, которые все включены в настоящий текст в полном объеме посредством ссылки.
В другом варианте осуществления настоящего изобретения, в композиции по настоящему изобретению можно добавлять нодулиспоровую кислоту и ее производные. Данные соединения применяются для лечения или профилактики инфекций у человека и животных и описаны, например, в U.S. Patent No. 5,399,582, 5,962,499, 6,221,894 и 6,399,786, которые все включены в текст настоящего изобретения посредством ссылки во всем своем объеме. Композиции могут включать одно или больше известных в данной области производных нодулиспоровой кислоты, включая все стереоизомеры, такие как описанные в процитированных выше литературных источниках.
В другом варианте осуществления, в композиции по настоящему изобретению можно добавлять противогельминтные соединения из класса аминоацетонитрилов (AAD), такие как монепантел (ZOLVIX) и т.п. Данные соединения описаны, например, в патенте США 7 084 280, выданном Ducray с соавторами (включен в настоящий текст посредством ссылки); Sager et al., Veterinary Parasitology, 2009, 159, 49-54; Kaminsky et al., Nature vol. 452, 13 March 2008, 176-181.
Композиции по настоящему изобретению могут также включать арилоазол-2-ил цианоэтиламиновые соединения, такие как описанные в патенте США 8 088 801, выданном Soll с соавторами, который включен в настоящий текст посредством ссылки, и тиоамидные производные данных соединений, как описано в патенте США 7 964 621, выданном Le Hir de Fallois, который также включен в настоящий текст посредством ссылки. Арилоазол-2-ил цианоэтиламиновые действующие вещества, которые системно работают против эндопаразитов, можно применять в комбинации с соединениями, имеющими формулу (I), в ветеринарных композициях по настоящему изобретению.
Композиции по настоящему изобретению могут также включать парагерквамиды и производные этих соединений, включая дерквантел (см. Ostlind et al., Research in Veterinary Science, 1990, 48, 260-61; и Ostlind et al., Medical and Veterinary Entomology, 1997, 11, 407-408). Семейство парагерквамидных соединений является известным классом соединений, которые содержат спиродиоксепиноиндольное ядро, обладающее активностью в отношении определенных паразитов (см. Tet. Lett. 1981, 22, 135; J. Antibiotics 1990, 43, 1380, и J. Antibiotics 1991, 44, 492). Кроме того, структурно родственное семейство маркфортинов, таких как маркфортины A-C, также известно и может комбинироваться с препаратами по настоящему изобретению (см. J. Chem. Soc. - Chem. Comm. 1980, 601 и Tet. Lett. 1981, 22, 1977). Дополнительную информацию по производным парагерквамидов можно найти, например, в WO 91/09961, WO 92/22555, WO 97/03988, WO 01/076370, WO 09/004432 и US 2010/0197624, патенте США 5 703 078 и патенте США 5 750 695, которые все включены в настоящий текст в полном объеме посредством ссылки.
В другом варианте осуществления настоящего изобретения, композиции могут включать спинозиновое действующее вещество, вырабатываемое почвенным актиномицетом Saccharopolyspora spinosa (см., например Salgado V.L. and Sparks T.C., “The Spinosyns: Chemistry, Biochemistry, Mode of Action, and Resistance,” в Comprehensive Molecular Insect Science, vol. 6, pp. 137-173, 2005) или полусинтетическое спинозиновое действующее вещество. Спинозины обычно называют факторами или компонентами A, B, C, D, E, F, G, H, J, K, L, M, N, О, P, Q, R, S, T, U, V, W или Y, и любой из этих компонентов или их комбинация могут применяться в композициях по настоящему изобретению. Спинозиновое соединение может представлять собой 5,6,5-трициклическую кольцевую систему, сконденсированную с 12-членным макроциклическим лактоном, нейтральным сахаром (рамноза) и аминосахаром (форосамин). Эти и другие природные спинозиновые соединения, включая 21-бутенил спинозин, вырабатываемый Saccharopolyspora pagona, которые можно применять в композициях по настоящему изобретению, можно получить ферментацией согласно известным в данной области методикам. Другие спинозиновые соединения, которые можно применять в композициях по настоящему изобретению, описаны в патентах США 5 496 931; 5 670 364; 5 591 606; 5 571 901; 5 202 242; 5 767 253; 5 840 861; 5 670 486; 5 631 155 и 6 001 981, которые все включены в настоящий текст в полном объеме посредством ссылки. Спинозиновые соединения могут включать (но не ограничиваются только ими) спинозин A, спинозин D, спиносад, спинеторам или их комбинации. Спиносад представляет собой комбинацию спинозина A и спинозина D, и спинеторам представляет собой комбинацию 3’-этокси-5,6-дигидро спинозина J и 3’-этокси спинозина L.
В целом, дополнительные действующие вещества (отличные от соединения, имеющего описанную выше формулу (I)) включают в дозированные лекарственные формы по настоящему изобретению в количестве от примерно 0,1 мкг до примерно 1000 мг. В типичном случае, действующее вещество можно включать в количестве от примерно 10 мкг до примерно 500 мг, от примерно 10 мкг до примерно 400 мг, от примерно 1 мг до примерно 300 мг, от примерно 10 мг до примерно 200 мг, или от примерно 10 мг до примерно 100 мг. В более типичном случае дополнительное действующее вещество присутствует в композициях по настоящему изобретению в количестве от примерно 5 мг до примерно 50 мг.
Концентрация дополнительного действующего вещества в композициях по настоящему изобретению в типичном случае составляет от примерно 0,01% до примерно 30% (вес/вес), в зависимости от активности действующего вещества. В некоторых вариантах осуществления для очень активных действующих веществ, включая (но не ограничиваясь только ими) макроциклические лактоны, концентрация действующего вещества в типичном случае составляет от примерно 0,01% до примерно 10% (вес/вес), от примерно 0,01 до примерно 1% (вес/вес), от примерно 0,01% до примерно 0,5% (вес/вес), от примерно 0,1% до примерно 0,5% (вес/вес), или от примерно 0,01% до примерно 0,1% (вес/вес). В других вариантах осуществления, концентрация действующего вещества в типичном случае составляет от примерно 0,1% до примерно 2% (вес/вес), или от примерно 0,1% до примерно 1% (вес/вес).
В других вариантах осуществления, дополнительное действующее вещество в типичном случае присутствует в более высоких концентрациях, для достижения целевой эффективности. В некоторых вариантах осуществления, действующее вещество присутствует в концентрации от примерно 1% до примерно 30% (вес/вес), от примерно 1% до примерно 20% (вес/вес), или от примерно 1% до примерно 15% (вес/вес). В других вариантах осуществления, действующее вещество присутствует в композиции в концентрации от примерно 5% до примерно 20% (вес/вес), или от примерно 5% до примерно 15% (вес/вес).
В различных вариантах осуществления настоящего изобретения, дополнительное действующее вещество может входить в состав композиция в таком количестве, чтобы обеспечить введение дозы от примерно 0,001 мг/кг до примерно 50 мг/кг, или от примерно 0,5 мг/кг до примерно 50 мг/кг веса тела животного. В других вариантах осуществления, действующее вещество в типичном случае присутствует в количестве, достаточном для создания дозы от примерно 0,05 мг/кг до примерно 30 мг/кг, от примерно 0,1 мг/кг до примерно 20 мг/кг. В других вариантах осуществления, действующее вещество присутствует в количестве, достаточном для создания дозы от примерно 0,1 мг/кг до примерно 10 мг/кг, от примерно 0,1 мг/кг до примерно 1 мг/кг, или от примерно 0,5 мг/кг до примерно 50 мг/кг веса тела животного.
В некоторых вариантах осуществления настоящего изобретения, когда дополнительное действующее вещество представляет собой очень активное соединение, такое как макроциклический лактон или другие активные соединения, действующее вещество присутствует в концентрации, достаточной для создания дозы от примерно 0,001 мг/кг до примерно 5 мг/кг, от примерно 0,001 мг/кг до примерно 0,1 мг/кг, или от примерно 0,001 мг/кг до примерно 0,01 мг/кг. В других вариантах осуществления, действующее вещество присутствует в концентрации, достаточной для создания дозы от примерно 0,01 мг/кг до примерно 2 мг/кг или от примерно 0,1 мг/кг до примерно 1 мг/кг веса тела животного. В других вариантах осуществления, дополнительное действующее вещество присутствует в количестве, достаточном для создания дозы от примерно 1 мкг/кг до примерно 200 мкг/кг, или от примерно 0,1 мг/кг до примерно 1 мг/кг веса животного.
В дополнение к указанным выше другим действующим веществам, можно применять комбинации двух или больше действующих веществ с соединениями по настоящему изобретению в композиции для лечения от целевого спектра вредителей и паразитов. Решение о том, какое конкретное соединение можно применять в инновационных препаратах для лечения конкретного заражения насекомыми, находится в рамках компетенции специалиста, реализующего настоящее изобретение на практике.
Настоящее изобретение далее описано подробнее с привлечением частных неограничивающих примеров.
Примеры
Список сокращений
ACN ацетонитрил
AIBN азобисизобутиронитрил
BSA альбумин бычьей сыворотки
BOC трет-бутоксикарбонил
BOP-Cl бис(2-оксо-3-оксазолидинил)фосфин хлорид
DCC раствор N,N′-дициклогексилкарбодиимида
ДХМ дихлорметан
DEAD диэтил азодикарбоксилат
DIEA диизопропилэтиламин
ДМФА N,N-диметилформамид
DMAP 4-(Диметиламино)пиридин
ДМСО диметилсульфоксид
EDAC N-(3-диметиламинопропил)-N′-этилкарбодиимида гидрохлорид
ES электроспрей
EtOAc или ЭА этилацетат
HATU 1-[бис(диметиламино)метилен]-1H-1,2,3-триазоло[4,5-b]пиридиний 3-оксид гексафторфосфат
HOBt или HOBT 1-гидроксибензотриазол
KHMDS калия гексаметилдисилазид, точнее калия бис(триметилсилил)амид
MeOH метанол
PE петролейный эфир
TBAF трет-бутиламмония фторид
ТГФ тетрагидрофуран
ТСХ тонкослойная хроматография
Примеры получения
Приведенные ниже примеры получения являются неограничивающими примерами способов, применявшихся для получения примеров по настоящему изобретению. 4-Фтор-N-метиллейцин, защищенный трет-бутилоксикарбонильной группой (BOC), изображенный ниже, используется в получении исходного соединения, показанного на Схемах 1 и 2.

Это соединение получают по стандартным методикам из коммерчески доступного 4-фторлейцина (Chemical Abstracts Registry Number 857026-04-1). Следует понимать, что другие группы R1 - R4 могут также быть получены из различных аналогов лейцина аналогичным образом. Например, 3-фторлейцин (Chemical Abstracts Registry No. 171077-98-8, например, см. Kaneko et al., Chem. Pharm Bull., 1995, 43(5), 760-765) и 5-фторлейцин (Chemical Abstracts Registry No. 159415-71-1, см. Moody et al., Tett. Lett., 1994, 35(30), 5485-8) также известны и могут использоваться для получения соединений, в которых R1 - R4 представляют собой различным образом замещенные остатки фторлейцина. Кроме того, следует понимать, что могут также применяться альтернативные аминокислоты с различными боковыми цепочками для получения альтернативных соединений по настоящему изобретению.
Как показано выше на Схеме 1, получение соединений по настоящему изобретению осуществляют циклизацией прекурсора 1-7 после снятия защиты с терминальной амино-группы и карбоксильной группы. Квалифицированным специалистам в данной области будет понятно, что при использовании общего способа, изображенного на Схеме 1, можно получить широкий ряд разнообразных соединений по настоящему изобретению, выбирая подходящие мономерные исходные вещества с желаемыми группами R1, R2, R3, R4, Cy1 и Cy2, и получая димеры с общими формулами 1-1, 1-2, 1-3 и 1-4 путем снятия защитных групп с подходящих карбоксильных групп и амино-групп и формирования амида.
На изображенных ниже примерах получения 1-28 приведены способы получения различных мономерных соединений M1 - M49, замещенных широким рядом групп R1, R2, R3, R4, Cy1 и Cy2, что позволяет получать диверсифицированный набор димерных соединений, применяющихся для получения соединений по настоящему изобретению.
Пример синтеза 1. Получение мономера M1.
Мономер M1 получали способом, показанным на схеме 2 ниже.
Схема 2

Подробное описание эксперимента

1-Бензил 4-метил (2S)-2-[[(трет-бутокси)карбонил]амино]бутандиоат. В 20-литровую 3-горлую круглодонную колбу в инертной атмосфере азота помещали раствор (2S)-2-[[(трет-бутокси)карбонил]амино]-4-метокси-4-оксобутановой кислоты (150 г, 606,69 ммоль, 1,00 экв.) в N,N-диметилформамиде (5 л), Cs2CO3 (396 г, 1,22 моль, 2,00 экв.), BnBr (124 г, 725,02 ммоль, 1,20 экв.). Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Полученный раствор разбавляли 10 л этилацетата. Полученную смесь промывали 3x5 л H2O. Полученную смесь промывали 3x5 л насыщенного раствора хлорида натрия. Смесь сушили над безводным сульфатом натрия. Твердый осадок отфильтровывали. Полученную смесь упаривали в вакууме. В результате получали 170 г (83%) 1-бензил 4-метил (2S)-2-[[(трет-бутокси)карбонил]амино]бутандиоата в виде белого твердого вещества. MS (ES, m/z): 338 (M+H).

1-Бензил 4-метил (2S)-2-[[(трет-бутокси)карбонил](метил)амино]бутандиоат: В 10-литровую 3-горлую круглодонную колбу в инертной атмосфере азота помещали раствор 1-бензил 4-метил (2S)-2-[[(трет-бутокси)карбонил]амино]бутандиоата (170 г, 503,90 ммоль, 1,00 экв.) в N,N-диметилформамиде (5 мл), Ag2O (348 г, 3,00 экв.), CH3I (1433 г, 10,10 моль, 20,00 экв.). Полученный раствор перемешивали в течение 1 часа при 60oC на масляной бане. Полученный раствор разбавляли 10 л этилацетата. Полученную смесь промывали 3x8 л H2O. Смесь промывали 3x8 л насыщенного раствора хлорида натрия. Органическую фазу сушили над безводным сульфатом натрия. Твердый осадок отфильтровывали. Полученную смесь упаривали в вакууме. В результате получали 159 г (90%) 1-бензил 4-метил (2S)-2-[[(трет-бутокси)карбонил](метил)амино]бутандиоата в виде желтого масла. MS (ES, m/z): 352 (M+H).

(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метокси-4-оксобутановая кислота: В 10-литровую 3-горлую круглодонную колбу помещали раствор 1-бензил 4-метил (2S)-2-[[(трет-бутокси)карбонил](метил)амино]бутандиоата (159 г) в метаноле (3 л), палладий на угле (15,9 г, 0,10 экв.), H2(газ) (достаточное количество). Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Твердый осадок отфильтровывали. Полученную смесь упаривали в вакууме. В результате получали 115 г (97%) (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метокси-4-оксобутановой кислоты в виде желтого масла. MS (ES, m/z): 262 (M+H).

(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-гидрокси-4-метилпентановая кислота: В 3-литровую 3-горлую круглодонную колбу в инертной атмосфере азота помещали раствор (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метокси-4-оксобутановой кислоты (114 г) в тетрагидрофуране (4 л), CH3MgBr (874 мл, 6,00 экв.). Полученный раствор перемешивали в течение 3 часов при -30oC в охлаждающей бане. Затем реакцию гасили добавлением 1000 мл раствора NH4Cl/H2O. Значение pH раствора доводили до 3~4 добавлением раствора хлороводород/H2O. Полученный раствор разбавляли 6 л H2O. Полученный раствор экстрагировали 3x4 л этилацетата и органические слои объединяли. Полученную смесь промывали 2x5 л насыщенного раствора хлорида натрия. Органическую фазу сушили над безводным сульфатом натрия. Твердый осадок отфильтровывали. Полученную смесь упаривали в вакууме. В результате получали 90 г (сырой продукт) (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-гидрокси-4-метилпентановой кислоты в виде желтого масла. MS (ES, m/z): 262 (M+H).

Метил (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-гидрокси-4-метилпентаноат. В 3-литровую 3-горлую круглодонную колбу в инертной атмосфере азота помещали раствор (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-гидрокси-4-метилпентановой кислоты (90 г) в дихлорметане (4 л), (диазометил)триметилсилан (340 мл, 2,00 экв, 2M). Полученный раствор перемешивали в течение 2 часов при комнатной температуре в бане лед/соль. Полученную смесь промывали 2x3 л H2O. Смесь промывали 2x3 л насыщенного раствора хлорида натрия. Органическую фазу сушили над безводным сульфатом натрия. Твердый осадок отфильтровывали. Полученную смесь упаривали в вакууме. В результате получали 92 г (сырой продукт) метил (2S)-2-[[(трет-бутокси) карбонил](метил)амино]-4-гидрокси-4-метилпентаноата в виде желтого масла. MS (ES, m/z): 276 (M+H).

Метил (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноат. В 3-литровую 3-горлую круглодонную колбу в инертной атмосфере азота помещали раствор метил (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-гидрокси-4-метилпентаноата (90 г) в дихлорметане (3,0 л), DAST (106 г, 2,00 экв.). Полученный раствор перемешивали в течение 2 часов при -30oC в охлаждающей бане. Затем реакцию гасили добавлением 1 литра раствора NaHCO3при 0oC. Полученную смесь промывали 2x1 л H2O. Смесь промывали 2x1 л насыщенного раствора хлорида натрия. Органическую фазу сушили над безводным сульфатом натрия. Твердый осадок отфильтровывали. Полученную смесь упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:100~1:20). В результате получали 15 г (16%) метил (2S)-2-[[(трет-бутокси)карбонил] (метил)амино]-4-фтор-4-метилпентаноата в виде желтого масла. MS (ES, m/z): 278 (M+H).

(S)-2-(трет-бутоксикарбонил(метил)амино)-4-фтор-4-метилпентановая кислота (M1): В 500-миллилитровую 3-горлую круглодонную колбу помещали раствор (S)-метил 2-(трет-бутоксикарбонил(метил)амино)-4-фтор-4-метилпентаноата (15 г) в MeOH (80 мл), LiOH (11,4 г, 5,00 экв.) в H2O (150 мл). Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Раствор экстрагировали 3x100 мл этилацетата. Значение pH водных слоев доводили до 3~4 добавлением раствора хлороводород/H2O. Полученный раствор экстрагировали 3x100 мл этилацетата, и органические слои объединяли. Полученную смесь промывали 2x5 л насыщенного раствора хлорида натрия. Органическую фазу сушили над безводным сульфатом натрия. Твердый осадок отфильтровывали. Полученную смесь упаривали в вакууме. В результате получали 12,6 г (89%) (S)-2-(трет-бутоксикарбонил(метил)амино)-4-фтор-4-метилпентановой кислоты в виде желтого масла. MS (ES, m/z): 264 (M+H).
Пример синтеза 2. Получение мономера M2.
Мономер M2 получали способом, показанным на схеме 3 ниже.
Схема 3

Подробное описание эксперимента

(R)-2-Гидрокси-3-[4-(трифторметил)фенил]пропановая кислота. В 500-миллилитровую 3-горлую круглодонную колбу помещали (R)-2-амино-3-[4-(трифторметил)фенил]пропановую кислоту (20 г, 85,77 ммоль, 1,00 экв.), серную кислоту (0,5 M) (340 мл). Затем добавляли раствор NaNO2 (35,5 г, 514,49 ммоль, 6,00 экв.) в воде (80 мл) по каплям при перемешивании при 0oC. Полученный раствор перемешивали в течение 1 часа при 0oC. Полученный раствор оставляли реагировать при перемешивании на ночь при комнатной температуре. Твердый осадок отделяли фильтрованием. В результате получали 17,5 г (87%) (R)-2-гидрокси-3-[4-(трифторметил)фенил]пропановой кислоты в виде белого твердого вещества. MS (ES, m/z): 233 (M-H);1H ЯМР (ДМСО, 300 МГц) δ: 7,63 (д, J=3,9 Гц, 2 H), 7,46 (д, J=4,0 Гц, 2 H), 4,21-4,17 (м, 1 H), 3,09-3,03 (м, 1 H), 2,91-2,84 (м, 1 H).

Бензил (2R)-2-гидрокси-3-[4-(трифторметил)фенил]пропаноат (M2): В 500-миллилитровую 3-горлую круглодонную колбу помещали (2R)-2-гидрокси-3-[4-(трифторметил)фенил]пропановую кислоту (17,5 г, 74,73 ммоль, 1,00 экв.), (бромметил)бензол (15,3 г, 89,46 ммоль, 1,20 экв.), карбонат калия (31 г, 224,30 ммоль, 3,00 экв.), N,N-диметилформамид (100 мл). Полученный раствор перемешивали в течение 30 минут при 0oC и оставляли нагреваться до комнатной температуры при перемешивании в течение ночи. Затем реакцию гасили добавлением 250 мл воды. Полученный раствор экстрагировали 3x150 мл этилацетата, и органические слои объединяли. Полученную смесь промывали 3x250 мл насыщенного раствора хлорида натрия. Органическую фазу сушили над безводным сульфатом натрия и упаривали в вакууме. Остаток от упаривания очищали на колонке с силикагелем со смесью этилацетат/петролейный эфир (1:6), получая 10,6 г (44%) бензил (2R)-2-гидрокси-3-[4-(трифторметил)фенил]пропаноата в виде белого твердого вещества.1H ЯМР (ДМСО, 300 МГц) δ: 7,60 (д, J=4,0 Гц, 2 H), 7,42 (д, J=4,0 Гц, 2 H), 7,39-7,27 (м, 5 H), 5,72 (д, J=3 Гц, 1 H), 5,10 (с, 2 H), 4,40-4,33 (м, 1 H), 3,10-3,04 (м, 1 H), 2,99-2,91 (м, 1 H).
Пример синтеза 3. Получение мономера M3.
Мономер M3 получали способом, показанным на схеме 4 ниже.
Схема 4

Подробное описание эксперимента
(2R)-3-(4-фторфенил)-2-гидроксипропановая кислота. В 500-миллилитровую 4-горлую круглодонную колбу помещали (2R)-2-амино-3-(4-фторфенил)пропановую кислоту (10 г, 54,59 ммоль, 1,00 экв.), серную кислоту (218,6 мл, 2,00 экв.). Затем добавляли раствор NaNO2 (23 г, 333,33 ммоль, 6,00 экв.) в воде (15 мл) по каплям при перемешивании при 0oC. Полученный раствор перемешивали в течение 3 часов при 5°C. Полученный раствор экстрагировали 3x30 мл этилацетата, и органические слои объединяли. Полученную смесь промывали 5x40 мл раствора хлорида натрия. Смесь сушили над безводным сульфатом натрия и упаривали в вакууме. В результате получали 12 г (сырой продукт) (2R)-3-(4-фторфенил)-2-гидроксипропановой кислоты в виде белого твердого вещества. MS (ES, m/z): 183 (M-H).
Бензил (2R)-3-(4-фторфенил)-2-гидроксипропаноат (M3): В 50-миллилитровую 3-горлую круглодонную колбу помещали (2R)-3-(4-фторфенил)-2-гидроксипропановую кислоту (7 г, 38,01 ммоль, 1,00 экв.), N,N-диметилформамид (30 мл), карбонат калия (16 г, 115,77 ммоль, 3,00 экв.). Затем добавляли BnBr (7,8 г, 45,61 ммоль, 1,20 экв.) по каплям при перемешивании при 0oC. Полученный раствор перемешивали в течение 30 минут при 0oC. Полученный раствор оставляли для прохождения реакции при перемешивании еще на 14 часов при комнатной температуре. Твердый осадок отфильтровывали. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:30). Собранные фракции объединяли и упаривали в вакууме. В результате получали 6 г (58%) бензил (2R)-3-(4-фторфенил)-2-гидроксипропаноата в виде белого твердого вещества.1H ЯМР (ДМСО, 300 МГц) δ: 7,41-7,22 (м, 7 H), 7,09-7,03 (м, 2 H), 5,10 (с, 2 H), 4,31-4,27 (м, 1 H), 2,99-2,93 (м, 1 H), 2,88-2,81 (м, 1 H).
Пример синтеза 4. Получение мономера M4.
Мономер M4 получали способом, показанным на схеме 5 ниже.
Схема 5

Подробное описание эксперимента

(2R)-3-(4-бромфенил)-2-гидроксипропановая кислота. В 2000-миллилитровую 4-горлую круглодонную колбу помещали (2R)-2-амино-3-(4-бромфенил)пропановую кислоту (150 г, 614,54 ммоль, 1,00 экв.), серную кислоту (0,5M/L) (2500 мл). Затем добавляли раствор NaNO2 (256 г, 3,71 моль, 6,00 экв.) в воде (900 мл) по каплям при перемешивании. Полученный раствор перемешивали в течение 48 часов при комнатной температуре. Твердый осадок отделяли фильтрованием. Полученное твердое вещество сушили в термошкафу при пониженном давлении. В результате получали 240 г (80%) (2R)3-(4-бромфенил)-2-гидроксипропановлй кислоты в виде белого твердого вещества. MS (ES, m/z): 243 (M-H);1H ЯМР (ДМСО, 300 МГц) δ: 12,59 (ушир.с, 1 H), 7,51-7,44 (м, 2 H), 7,27-7,14 (м, 2 H), 5,34 (ушир.с, 1 H), 4,16-4,12 (м, 1 H), 2,97-2,91 (м, 1 H), 2,80-2,70 (м, 1 H).
Бензил (2R)-3-(4-бромфенил)-2-гидроксипропаноат. В 2000-миллилитровую 4-горлую круглодонную колбу помещали (2R)-3-(4-бромфенил)-2-гидроксипропановую кислоту (60 г, 244,83 ммоль, 1,00 экв.), карбонат калия (67,6 г, 489,11 ммоль, 2,00 экв.), N,N-диметилформамид (1000 мл). Затем добавляли BnBr (50,3 г, 294,10 ммоль, 1,20 экв.) по каплям при перемешивании. Полученный раствор перемешивали в течение ночи при комнатной температуре. Полученный раствор разбавляли 2000 мл H2O. Полученный раствор экстрагировали 3x500 мл этилацетата, и органические слои объединяли. Органические слои промывали 3x500 мл воды и 1x500 мл насыщенного раствора хлорида натрия. Органические слои сушили над безводным сульфатом натрия и упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:5). В результате получали 62 г (76%) бензил (2R)-3-(4-бромфенил)-2-гидроксипропаноата в виде белого твердого вещества.1H ЯМР (ДМСО, 300 МГц) δ: 7,49 (д, J=3,9 Гц, 2 H), 741-7,34 (м, 5 H), 7,15 (д, J=4,4 Гц, 2 H), 5,28-5,15 (м, 2 H), 4,55-4,51 (м, 1 H), 3,23-3,16 (м, 1 H), 3,07-3,01 (м, 1 H).

Бензил (2R)-3-(4-бромфенил)-2-[(трет-бутилдиметилсилил)окси]пропаноат. В 2-литровую 4-горлую круглодонную колбу помещали бензил (2R)-3-(4-бромфенил)-2-гидроксипропаноат (60 г, 179,00 ммоль, 1,00 экв.), N,N-диметилформамид (1000 мл), 1H-имидазол (24,5 г, 359,89 ммоль, 2,00 экв.). Затем добавляли TBDMSCl (32,4 г, 1,20 экв.) по каплям при перемешивании. Полученный раствор перемешивали в течение 16 часов при комнатной температуре. Полученный раствор разбавляли 2 л H2O. Раствор экстрагировали 3x500 мл этилацетата и органические слои объединяли. Органические слои промывали 3x500 мл насыщенного раствора хлорида натрия. Органические слои сушили над безводным сульфатом натрия и упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:50). В результате получали 78 г (97%) бензил (2R)-3-(4-бромфенил)-2-[(трет-бутилдиметилсилил)окси]пропаноата в виде желтого масла. MS (ES, m/z): 449 (M+H);1H ЯМР (ДМСО, 300 МГц) δ: 7,44 (д, J=4,2 Гц, 2 H), 7,40-7,31 (м, 5 H), 7,16 (д, J=4,0 Гц, 2 H), 5,13 (с, 2 H), 4,50-4,46 (м, 1 H), 3,03-2,98 (м, 1 H), 2,86-2,79 (м, 1 H), 0,73 (с, 9 H), -0,15 (с, 3 H), -0,25 (с, 3 H).

Бензил (2R)-2-[(трет-бутилдиметилсилил)окси]-3-[4-(морфолин-4-ил)фенил]пропаноат. В 2-литровую 4-горлую круглодонную колбу в инертной атмосфере азота помещали бензил (2R)-3-(4-бромфенил)-2-[(трет-бутилдиметилсилил)окси]пропаноат (78 г, 173,54 ммоль, 1,00 экв.), X-phos (8,27 г, 0,10 экв.), Pd(OAc)2 (1,95 г, 8,69 ммоль, 0,05 экв.), толуол (1500 мл), морфолин (45,3 г, 519,97 ммоль, 3,00 экв.), Cs2CO3 (170 г, 3,00 экв.). Полученный раствор перемешивали в течение 16 часов при 90oC. Твердый осадок отфильтровывали. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/ петролейный эфир (1:5). В результате получали 64 г (81%) бензил (2R)-2-[(трет-бутилдиметилсилил)окси]-3-[4-(морфолин-4-ил)фенил]пропаноата в виде желтого масла. MS (ES, m/z): 456 (M+H);1H ЯМР (CDCl3, 300 МГц) δ: 7,34-7,31 (м, 5 H), 7,12 (д, J=4,2 Гц, 2 H), 6,90-6,80 (м, 2 H), 5,20-5,10 (м, 2 H), 4,36-4,32 (м, 1 H), 3,90-3,80 (м, 4 H), 3,13-3,05 (м, 4 H), 3,04-2,95 (м, 1 H), 2,89-2,82 (м, 1 H), 0,79 (с, 9 H), -0,15 (с, 3 H), -0,20 (с, 3 H).
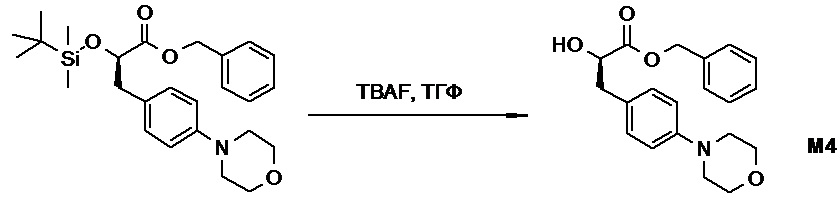
Бензил (2R)-2-гидрокси-3-[4-(морфолин-4-ил)фенил]пропаноат (M4). В 2000-миллилитровую 4-горлую круглодонную колбу помещали бензил (2R)-2-[(трет-бутилдиметилсилил)окси]-3-[4-(морфолин-4-ил)фенил]пропаноат (60 г, 131,68 ммоль, 1,00 экв.), тетрагидрофуран (1200 мл). Затем добавляли TBAF (51,7 г, 197,74 ммоль, 1,20 экв.) порциями при 0oC. Полученный раствор перемешивали в течение 20 минут при комнатной температуре. Полученный раствор разбавляли 2000 мл H2O. Полученный раствор экстрагировали 3x500 мл этилацетата, и органические слои объединяли. Органические слои промывали 3x500 мл воды и 1x500 мл насыщенного раствора хлорида натрия. Органические слои сушили над безводным сульфатом натрия и упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:3). В результате получали 42 г (93%) бензил (2R)-2-гидрокси-3-[4-(морфолин-4-ил)фенил]пропаноата в виде желтого твердого вещества. MS (ES, m/z): 342 (M+H);1H ЯМР (ДМСО, 300 МГц) δ: 7,40-7,27 (м, 5H), 7,06 (д, J=8,4 Гц, 2H), 6,82 (д, J=8,7 Гц, 2H), 5,57 (д, J=6,3 Гц, 1H), 5,08 (с, 2H), 4,27-4,21 (м, 1H), 3,75-3,71 (м, 4H), 3,06-3,03 (м, 4H), 2,91-2,74 (м, 2H).
Пример синтеза 5. Получение мономера M5.
Мономер M5 получали описанным ниже способом.

(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4,4-диметилпентановая кислота (M5). В 3000-миллилитровую круглодонную колбу помещали тетрагидрофуран (2 л), (2S)-2-[[(трет-бутокси)карбонил]амино]-4,4-диметилпентановую кислоту (30 г, 122,29 ммоль, 1,00 экв.), гидрид натрия (48 г, 2,00 моль, 16,35 экв.), CH3I (348 г, 2,45 моль, 20,05 экв.). Полученный раствор перемешивали в течение ночи при 35oC. Затем реакцию гасили добавлением 2000 мл смеси вода/лед. Значение pH раствора доводили до 4 добавлением раствора хлороводорода (2 моль/л). Полученный раствор экстрагировали 3x2 л этилацетата, и органические слои объединяли, сушили над безводным сульфатом натрия и упаривали в вакууме. В результате получали 23 г (73%) (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4,4-диметилпентановой кислоты в виде желтого твердого вещества. MS (ES, m/z): 260 (M+H);1H ЯМР (300 МГц, CDCl3): δ 4,92-4,88 (м, 0,5H), 4,68-4,64 (м, 0,5H), 2,83-2,80 (м, 3H), 1,91-1,64 (м, 2H), 1,51 (с, 9H), 0,96 (с, 9H).
Пример синтеза 6. Получение мономера M8.
Мономер M8 получали способом, показанным на схеме 6 ниже.
Схема 6
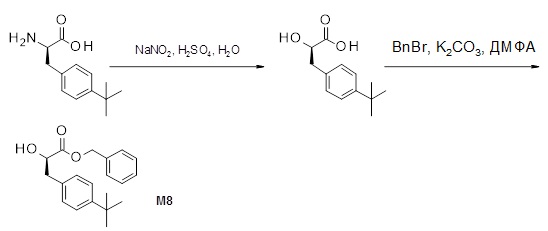
Подробное описание эксперимента

(2R)-3-(4-трет-бутилфенил)-2-гидроксипропановая кислота. В 2000-миллилитровую 3-горлую круглодонную колбу помещали раствор (2R)-2-амино-3-(4-трет-бутилфенил) пропановой кислоты (30 г, 135,57 ммоль, 1,00 экв.) в серной кислоте (0,5M) (480 мл), раствор NaNO2 (94 г, 1,36 моль, 10,00 экв.) в воде (180 мл). Полученный раствор перемешивали в течение ночи при комнатной температуре в бане лед/соль. Твердый осадок отделяли фильтрованием. В результате получали 20,0 г (66%) (2R)-3-(4-трет-бутилфенил)-2-гидроксипропановой кислоты в виде белого твердого вещества. MS (ES, m/z): 221 (M-H).

(2R)-3-(4-трет-бутилфенил)-2-гидроксипропаноат (M8). В 2000-миллилитровую 3-горлую круглодонную колбу помещали раствор (2R)3-(4-трет-бутилфенил)-2-гидроксипропановой кислоты (40 г, 179,95 ммоль, 1,00 экв.) в N,N-диметилформамиде (1000 мл), карбонат калия (50 г, 361,77 ммоль, 2,00 экв.), BnBr (61 г, 356,66 ммоль, 2,00 экв.). Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Полученный раствор разбавляли 2000 мл этилацетата. Смесь промывали 3x2000 мл воды. Полученную смесь промывали 2x2000 мл насыщенного раствора хлорида натрия. Смесь сушили над безводным сульфатом натрия. Твердый осадок отфильтровывали. Полученную смесь упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:50~1:10). В результате получали 42 г (75%) бензил (2R)-3-(4-трет-бутилфенил)-2-гидроксипропаноата в виде желтого масла.1H ЯМР (300 МГц, CDCl3): δ 7,40-7,27 (м, 7H), 7,10 (д, J=8,1 Гц, 2H), 5,20 (с, 2H), 4,49 (т, J=5,4 Гц, 1H), 3,14-2,93 (м, 2H), 1,31 (с, 9H).
Пример синтеза 7. Получение мономера M9.
Мономер M9 получали способом, показанным на схеме 7 ниже.
Схема 7

Подробное описание эксперимента

(2R)-2-гидрокси-3-[4-(трифторметокси)фенил]пропановая кислота. В 1000-миллилитровую 3-горлую круглодонную колбу помещали (2R)2-амино-3-[4-(трифторметокси)фенил]пропановой кислоты гидрохлорид (10 г, 35,01 ммоль, 1,00 экв.). Затем добавляли раствор NaNO2 (29 г, 420,29 ммоль, 12,00 экв.) в воде (150 мл) по каплям при перемешивании при 0oC. Затем добавляли серную кислоту (0,5M/л) (300 мл). Полученный раствор перемешивали в течение ночи при комнатной температуре. Полученный раствор экстрагировали 3x200 мл этилацетата, и органические слои объединяли. Полученную смесь промывали 3x200 мл насыщенного раствора хлорида натрия. Смесь сушили над безводным сульфатом натрия и упаривали в вакууме. В результате получали 11 г (сырой продукт) (2R)-2-гидрокси-3-[4-(трифторметокси)фенил]пропановой кислоты в виде желтого масла. MS (ES, m/z): 249 (M-H).

Бензил (2R)-2-гидрокси-3-[4-(трифторметокси)фенил]пропаноат (M9). В 1000-миллилитровую 3-горлую круглодонную колбу помещали (2R)2-гидрокси-3-[4-(трифторметокси)фенил]пропановую кислоту (11 г, 43,97 ммоль, 1,00 экв.), N,N-диметилформамид (300 мл), карбонат калия (12 г, 86,82 ммоль, 2,00 экв.). Затем добавляли (бромметил)бензол (9 г, 52,62 ммоль, 1,20 экв.) по каплям при перемешивании при 0oC. Полученный раствор перемешивали в течение ночи при комнатной температуре. Затем реакцию гасили добавлением 100 мл воды. Полученный раствор экстрагировали 3x150 мл этилацетата, и органические слои объединяли. Полученную смесь промывали 3x200 мл насыщенного раствора хлорида натрия. Смесь сушили над безводным сульфатом натрия и упаривали в вакууме. В результате получали 7,6 г (51%) бензил (2R)-2-гидрокси-3-[4-(трифторметокси)фенил]пропаноата в виде желтого масла.1H ЯМР (ДМСО, 300 МГц) δ: 7,45-7,30 (м, 7 H), 7,25-7,17 (м, 2 H), 5,70 (д, J=2,7 Гц, 1 H), 5,10 (с, 2 H), 4,34-4,32 (м, 1 H), 3,04-2,98 (м, 1 H), 2,92-2,85 (м, 1 H).
Пример синтеза 8. Получение мономера M10.
Мономер M10 получали способом, показанным на схеме 8 ниже.
Схема 8

Подробное описание эксперимента

4-(5-бромпиридин-2-ил)морфолин. В 1-литровую круглодонную колбу помещали раствор 5-бром-2-хлорпиридина (50 г, 259,82 ммоль, 1,00 экв.) в N,N-диметилформамиде (300 мл), морфолин (91 г, 1,04 моль, 4,00 экв.), карбонат калия (108 г, 781,42 ммоль, 3,00 экв.). Полученный раствор перемешивали в течение ночи при 120oC. Полученный раствор экстрагировали 5x150 мл этилацетата, и органические слои объединяли. Полученную смесь промывали 3x100 мл насыщенного раствора хлорида натрия. Смесь сушили над безводным сульфатом натрия и упаривали в вакууме. Полученную смесь промывали смесью петролейный эфир:этилацетат = 1:5. В результате получали 80 г (63%) 4-(5-бромпиридин-2-ил)морфолинв в виде белого твердого вещества. MS (ES, m/z): 243 (M+H);1H ЯМР (CDCl3, 300 МГц) δ: 8,22 (с, 1 H), 7,57 (д, J=4,5Гц, 1 H), 6,54 (д, J=2,4Гц, 1 H), 3,82 (т, J=5,1 Гц, 4 H), 3,48 (т, J = 5,1 Гц, 4 H).

Метил (2E)-3-[6-(морфолин-4-ил)пиридин-3-ил]проп-2-еноат. В 250-миллилитровую круглодонную колбу в инертной атмосфере азота помещали раствор 4-(5-бромпиридин-2-ил)морфолина (5 г, 20,57 ммоль, 1,00 экв.) в N,N-диметилформамиде (120 мл), метил проп-2-еноат (3,54 г, 41,12 ммоль, 2,00 экв.), Pd(OAc)2 (92 мг, 0,41 ммоль, 0,02 экв.), бикарбонат натрия (3,46 г, 41,19 ммоль, 2,00 экв.), Bu4NCl (11,4 г, 41,02 ммоль, 2,00 экв.). Полученный раствор перемешивали в течение 3 дней при 100oC. Полученный раствор экстрагировали 5x150 мл этилацетата, и органические слои объединяли. Полученную смесь промывали 3x100 мл насыщенного раствора хлорида натрия. Смесь сушили над безводным сульфатом натрия и упаривали в вакууме. Твердый осадок отфильтровывали. В результате получали 11,5 г (56%) метил (2E)-3-[6-(морфолин-4-ил)пиридин-3-ил]проп-2-еноата в виде светло-коричневого твердого вещества. MS (ES, m/z): 249 (M+H);1H ЯМР (CDCl3, 300 МГц) δ: 8,30 (с, 1 H), 7,72-7,58 (м, 2 H), 6,64 (д, J=4,5Гц, 1 H), 6,27 (д, J=8,0 Гц, 1 H), 3,84-3,80 (м, 7 H), 3,62 (т, J=4,8 Гц, 4 H).
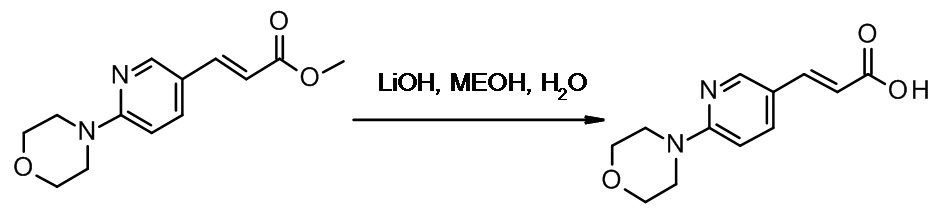
(2E)-3-[6-(морфолин-4-ил)пиридин-3-ил]проп-2-еновая кислота. В 500-миллилитровую круглодонную колбу помещали раствор метил (2E)-3-[6-(морфолин-4-ил)пиридин-3-ил]проп-2-еноата (11 г, 44,31 ммоль, 1,00 экв.) в смеси метанол/H2O (60:60 мл), LiOH (10,6 г, 442,59 ммоль, 10,00 экв.). Полученный раствор перемешивали в течение 1 часа при 80oC. Полученный раствор разбавляли 150 мл воды. Значение pH раствора доводили до 6~7 добавлением насыщенного раствора NaHCO3. Полученный раствор экстрагировали 5x150 мл этилацетата, и органические слои объединяли. Органическую фазу промывали 3x150 мл насыщенного раствора хлорида натрия. Органическую фазу сушили над безводным сульфатом натрия и упаривали в вакууме. В результате получали 10,4 г (сырой продукт) (2E)-3-[6-(морфолин-4-ил)пиридин-3-ил]проп-2-еновой кислоты в виде светло-коричневого твердого вещества. MS (ES, m/z): 245 (M+H).

Бензил (2E)-3-[6-(морфолин-4-ил)пиридин-3-ил]проп-2-еноат. В 250-миллилитровую круглодонную колбу помещали раствор (2E)-3-[6-(морфолин-4-ил)пиридин-3-ил]проп-2-еновой кислоты (4 г, 17,08 ммоль, 1,00 экв.) в N,N-диметилформамиде (70 мл), карбонат калия (7,1 г, 51,37 ммоль, 3,00 экв.), (бромметил)бензол (4,4 г, 25,73 ммоль, 1,50 экв.). Полученный раствор перемешивали в течение ночи при комнатной температуре. Раствор экстрагировали 5x150 мл этилацетата, и органические слои объединяли. Полученную смесь промывали 3x150 мл насыщенного раствора хлорида натрия. Смесь сушили над безводным сульфатом натрия и упаривали в вакууме. Полученную смесь промывали 1x70 мл петролейного эфира. Твердый осадок отделяли фильтрованием. В результате получали 10 г (72%) бензил (2E)-3-[6-(морфолин-4-ил)пиридин-3-ил]проп-2-еноата в виде желтого твердого вещества. MS (ES, m/z): 325 (M+H);1H ЯМР (CDCl3, 300 МГц) δ: 8,30 (с, 1 H), 7,70-7,62 (м, 2 H), 7,45-7,32 (м, 5 H), 6,63 (д, J=4,5Гц, 1 H), 6,32 (д, J=8,0 Гц, 1 H), 5,25 (с, 2 H), 3,82 (т, J=4,5 Гц, 4 H), 3,63-3,60 (м, 4 H).

(2R, 3S)-2,3-дигидрокси-3-[6-(морфолин-4-ил)пиридин-3-ил]пропаноат. В 100-миллилитровую 3-горлую круглодонную колбу помещали смесь трет-бутанол:H2O (20:20 мл), AD-mix-α (8,6 г). Затем добавляли бензил (2E)-3-[6-(морфолин-4-ил)пиридин-3-ил]проп-2-еноата (2 г, 6,17 ммоль, 1,00 экв.) и MeSO2NH2 (586 г, 6,17 моль, 1,00 экв.) при перемешивании при 0oC. Полученный раствор перемешивали в течение 3 дней при комнатной температуре. Затем реакцию гасили добавлением Na2SO3. Полученный раствор экстрагировали 3x150 мл этилацетата, и органические слои объединяли, сушили над безводным сульфатом натрия и упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:1). В результате получали 5,4 г (49%) бензил (2R, 3S)-2,3-дигидрокси-3-[6-(морфолин-4-ил)пиридин-3-ил]пропаноата в виде светло-желтого твердого вещества. MS (ES, m/z): 359 (M+H).

бензил (2R)-2-гидрокси-3-[6-(морфолин-4-ил)пиридин-3-ил]пропаноат (M10). В 100-миллилитровую круглодонную колбу помещали раствор бензил (2R, 3S)-2,3-дигидрокси-3-[6-(морфолин-4-ил)пиридин-3-ил]пропаноата (1,5 г, 4,19 ммоль, 1,00 экв.) в дихлорметане (15 мл), трифторуксусную кислоту (5 мл), Et3SiH (10 мл). Полученный раствор перемешивали в течение 3 дней при 50oC. Полученную смесь упаривали в вакууме. Затем реакцию гасили добавлением смеси вода/лед. Значение pH раствора доводили до 9 добавлением водного раствора бикарбоната натрия. Полученный раствор экстрагировали 3x40 мл дихлорметана, органические слои объединяли и сушили над безводным сульфатом натрия и упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:2). В результате получали 2,3 г (27%) бензил (2R)-2-гидрокси-3-[6-(морфолин-4-ил)пиридин-3-ил]пропаноата в виде желтого масла. MS (ES, m/z): 343 (M+H);1H ЯМР (CDCl3, 300 МГц) δ: 8,02 (с, 1 H), 7,43-7,32 (м, 6 H), 6,54 (д, J=4,4 Гц, 1 H), 5,21 (с, 2 H), 4,52-4,46 (м, 1 H), 3,84 (т, J=7,8Гц, 4 H), 3,48 (т, J=4,8Гц, 4 H) 3,05-3,01 (м, 1H), 2,91-2,85 (м, 1H).
Пример синтеза 9. Получение мономера M11.
Мономер M11 получали способом, показанным на схеме 9 ниже.
Схема 9

Подробное описание эксперимента

(2R)-3-(4-цианофенил)-2-гидроксипропановая кислота. В 500-миллилитровую 3-горлую круглодонную колбу помещали (2R)2-амино-3-(4-цианофенил)пропановую кислоту (10 г, 52,58 ммоль, 1,00 экв.), 0,5M серную кислоту (100 мл). Затем добавляли раствор NaNO2 (21,8 г, 315,94 ммоль, 5,98 экв.) в воде (20 мл) по каплям при перемешивании при 0oC. Полученный раствор перемешивали в течение 18 часов при комнатной температуре. Раствор экстрагировали 2x500 мл этилацетата, и органические слои объединяли. Органическую смесь промывали 2x500 мл насыщенного раствора хлорида натрия и сушили над безводным сульфатом натрия. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. В результате получали 9 г (сырой продукт) (2R)-3-(4-цианофенил)-2-гидроксипропановой кислоты в виде светло-желтой жидкости. MS (ES, m/z): 190 (M-H).

бензил (2R)-3-(4-цианофенил)-2-гидроксипропаноат (M11). В 250-миллилитровую круглодонную колбу помещали (2R)3-(4-цианофенил)-2-гидроксипропановую кислоту (9 г, 47,08 ммоль, 1,00 экв.), N,N-диметилформамид (150 мл). Затем порциями добавляли карбонат калия (20,6 г, 149,05 ммоль, 3,17 экв.) при 0oC. Затем добавляли BnBr (16,9 г, 98,81 ммоль, 2,10 экв.) по каплям при перемешивании при 0oC. Полученный раствор перемешивали в течение 16 часов при комнатной температуре. Полученный раствор разбавляли добавлением 50 мл воды и экстрагировали 2x200 мл этилацетата. Органические слои объединяли. Объединенную смесь промывали 3x150 мл водного раствора NaCl и сушили над безводным сульфатом натрия. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1/10-1/5). В результате получали 2,5 г (19%) бензил (2R)-3-(4-цианофенил)-2-гидроксипропаноата в виде светло-желтой жидкости.1H ЯМР (CDCl3, 300 МГц) δ: 7,50 (д, J=4,0 Гц, 2 H), 7,43-7,32 (м, 5 H), 7,23 (д, J=4,0 Гц, 2 H), 5,31-5,13 (м, 2 H), 4,53-4,49 (м, 1 H), 3,21-3,15 (м, 1 H), 3,06-2,99 (м, 1 H).
Пример синтеза 10. Получение мономера M16.
Мономер M16 получали способом, показанным на схеме 10 ниже.
Схема 10

Подробное описание эксперимента

Бензил (2R)-2-[(трет-бутилдиметилсилил)окси]-3-[4-(4,4-дифторпиперидин-1-ил)фенил] пропаноат. В 250-миллилитровую круглодонную колбу в инертной атмосфере азота помещали бензил (2R)-3-(4-бромфенил)-2-[(трет-бутилдиметилсилил)окси] пропаноат (14,53 г, 32,33 ммоль, 1,00 экв.), 4,4-дифторпиперидин (6,2 г, 51,19 ммоль, 1,20 экв.), Cs2CO3 (19 г, 3,00 экв.), X-PhOS (309 мг, 0,02 экв.), толуол (50 мл), Pd(OAc)2 (145 мг, 0,65 ммоль, 0,02 экв.). Полученный раствор перемешивали в течение 16 часов при 90oC. Полученную смесь упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:6). В результате получали 12,28 г (78%) бензил (2R)-2-[(трет-бутилдиметилсилил)окси]-3-[4-(4,4-дифторпиперидин-1-ил)фенил] пропаноата в виде бесцветного масла.

Бензил (2R)-3-[4-(4,4-дифторпиперидин-1-ил)фенил]-2-гидроксипропаноат (M16). В 100-миллилитровую 3-горлую круглодонную колбу помещали бензил (2R)-2-[(трет-бутилдиметилсилил)окси]-3-[4-(4,4-дифторпиперидин-1-ил)фенил]пропаноат (12,28 г, 25,08 ммоль, 1,00 экв.), тетрагидрофуран (30 мл), TBAF (8,4 г, 32,13 ммоль, 1,20 экв.). Полученный раствор перемешивали в течение 20 минут при комнатной температуре. Полученную смесь упаривали в вакууме. Полученный раствор разбавляли 100 мл этилацетата. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:10). В результате получали 6,8 г (72%) бензил (2R)-3-[4-(4,4-дифторпиперидин-1-ил)фенил]-2-гидроксипропаноата в виде белого твердого вещества. MS (ES, m/z): 376 (M+H).
Пример синтеза 11. Получение мономера M17.
Мономер M17 получали способом, показанным на схеме 11 ниже.
Схема 11

Подробное описание эксперимента

бензил (2S)-2-[[(трет-бутокси)карбонил]амино]-4,4,4-трифторбутаноат. В 100-миллилитровую круглодонную колбу помещали N,N-диметилформамид (15 мл), 2-[[(трет-бутокси)карбонил]амино]-4,4,4-трифторбутановой кислоты (1,5 г, 5,83 ммоль, 1,00 экв.), Cs2CO3 (5,7 г, 17,49 ммоль, 3,00 экв.), BnBr (1,1 г, 6,43 ммоль, 1,10 экв.). Полученный раствор перемешивали в течение 4 часов при комнатной температуре. Полученный раствор разбавляли 20 мл воды, экстрагировали 3x30 мл этилацетата, и органические слои объединяли. Органические слои промывали 1x40 мл насыщенного раствора хлорида натрия. Органические слои сушили над безводным сульфатом натрия и упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/ петролейный эфир (1:20). В результате получали 1,3 г (64%) бензил (2S)-2-[[(трет-бутокси)карбонил]амино]-4,4,4-трифторбутаноата в виде белого твердого вещества.1H ЯМР (300 МГц, CDCl3): δ 7,40-7,34 (м, 5H), 5,25 (с, 2H), 4,60-4,59 (м, 1H), 2,78-2,71 (м, 2H), 1,45 (с, 9H).
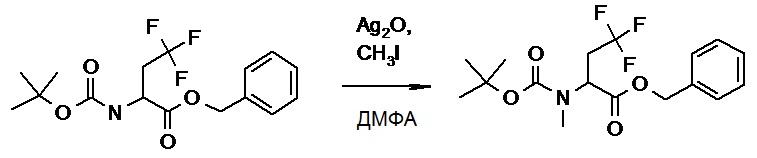
бензил -2-[[(трет-бутокси)карбонил](метил)амино]-4,4,4-трифторбутаноат. В 250-миллилитровую круглодонную колбу помещали N,N-диметилформамид (25 мл), бензил-2-[[(трет-бутокси)карбонил]амино]-4,4,4-трифторбутаноат (3,1 г, 8,93 ммоль, 1,00 экв.), Ag2O (5,4 г), CH3I (17 г, 119,77 ммоль, 13,42 экв.). Полученный раствор перемешивали в течение 2 часов при 60oC. Твердый осадок отфильтровывали. Фильтрат разбавляли 80 мл воды, экстрагировали 3x50 мл этилацетата, и органические слои объединяли. Органические слои промывали 1x20 мл насыщенного раствора хлорида натрия. Органические слои сушили над безводным сульфатом натрия и упаривали в вакууме. В результате получали 2,8 г (87%) бензил-2-[[(трет-бутокси)карбонил](метил)амино]-4,4,4-трифторбутаноата в виде желтого масла.1H ЯМР (300 МГц, CDCl3): δ 7,38-7,35 (м, 5H), 5,26-5,20 (м, 2H), 4,47-4,44 (м, 1H), 2,96-2,89 (м, 3H), 2,79-2,63 (м, 2H), 1,47-1,41 (м, 9H).

2-[[(трет-бутокси)карбонил](метил)амино]-4,4,4-трифторбутановая кислота (M17). В 100-миллилитровую круглодонную колбу помещали этилацетат (20 мл), бензил-2-[[(трет-бутокси)карбонил](метил)амино]-4,4,4-трифторбутаноат (3,1 г, 8,58 ммоль, 1,00 экв.), палладий на угле (300 мг), и подавали водород. Полученный раствор перемешивали в течение 1 часа при комнатной температуре. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. В результате получали 2,1 г (90%) 2-[[(трет-бутокси)карбонил](метил)амино]-4,4,4-трифторбутановой кислоты в виде желтого масла.
Пример синтеза 12. Получение мономера M19.
Мономер M19 получали способом, показанным на схеме 12 ниже.
Схема 12

Подробное описание эксперимента

трет-бутил (2S)-2-[(дифенилметилиден)амино]-4-метилпент-4-еноат. В 500-миллилитровую 3-горлую круглодонную колбу помещали трет-бутил 2-[(дифенилметилиден)амино]ацетат (15 г, 50,78 ммоль, 1,00 экв.), 1-бромпропан-2-он (8,2 г, 59,86 ммоль, 1,20 экв.), толуол (150 мл), хлорметан (65 мл). Затем добавляли CAS:200132-54-3 (1,57 г, 2,59 ммоль, 0,05 экв.) порциями при -20oC. Затем добавляли раствор гидроксида калия (28,6 г, 510,71 ммоль, 10,00 экв.) в воде (30 мл) по каплям при перемешивании при -20oC. Полученный раствор перемешивали в течение 48 часов при -20oC. Твердый осадок отфильтровывали. Фильтрат промывали водой (50 мл x 3) и насыщенным раствором хлорида натрия (50 мл x 1). Органическую фазу сушили над безводным сульфатом натрия и упаривали в вакууме. Сырой продукт очищали методом хроматографии в следующих условиях (IntelFlash-1): Колонка, C18 силикагель; подвижная фаза, CH3CN/H2O (0,5% NH3H2O); Детектор, УФ 254 нм. В результате получали 12,0 г (68%) трет-бутил (2S)-2-[(дифенилметилиден)амино]-4-метилпент-4-еноата в виде белого твердого вещества. MS (ES, m/z): 350 (M+H);1H ЯМР (CDCl3, 300 МГц) δ: 7,64-7,61 (м, 2 H), 7,45-7,28 (м, 6 H), 7,19-7,16 (м, 2 H), 4,74-4,72 (м, 2H), 4,10-4,06 (м, 1 H), 2,62-2,57 (м, 2 H), 1,52 (с, 3 H), 1,45 (с, 9 H).

трет-бутил (2S)-2-амино-4-метилпент-4-еноат. В 250-миллилитровую круглодонную колбу помещали раствор трет-бутил (2S)-2-[(дифенилметилиден)амино]-4-метилпент-4-еноата (10 г, 28,62 ммоль, 1,00 экв.) в 2н. растворе HCl (100 мл). Полученный раствор перемешивали в течение 1 часа при комнатной температуре. Полученный раствор экстрагировали 3x30 мл н-гексана, и водные слои объединяли. Значение pH водной фазы доводили до 9 добавлением насыщенного раствора NaHCO3. Полученный раствор экстрагировали 4x30 мл этилацетата, и органические слои объединяли. Органическую фазу промывали 3x30 мл насыщенного раствора хлорида натрия. Органическую фазу сушили над безводным сульфатом натрия и упаривали в вакууме. В результате получали 4,2 г (79%) трет-бутил (2S)-2-амино-4-метилпент-4-еноата в виде светло-желтого масла. MS (ES, m/z): 186 (M+H).

(2S)-2-амино-4-метилпент-4-еновая кислота. В 250-миллилитровую круглодонную колбу помещали раствор трет-бутил (2S)-2-амино-4-метилпент-4-еноата (4,2 г, 22,67 ммоль, 1,00 экв.) в дихлорметане (20 мл), трифторуксусную кислоту (10 мл). Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Полученную смесь упаривали в вакууме. В результате получали 3 г (сырой продукт) (2S)-2-амино-4-метилпент-4-еновой кислоты в виде коричневого масла. MS (ES, m/z): 128 (M-H).
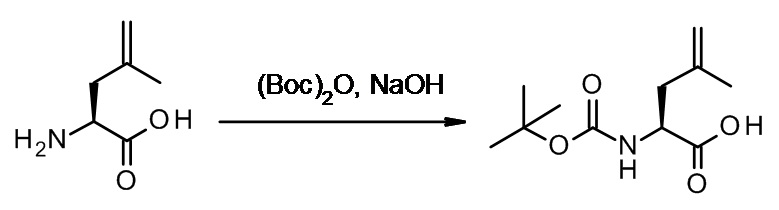
(2S)-2-[[(трет-бутокси)карбонил]амино]-4-метилпент-4-еновая кислота. В 250-миллилитровую круглодонную колбу помещали раствор (2S)-2-амино-4-метилпент-4-еновой кислоты (3 г, 23,23 ммоль, 1,00 экв.) в диоксане (100 мл), (Boc)2O (7,5 г, 34,36 ммоль, 1,50 экв.), раствор гидроксида натрия (3 г, 75,00 ммоль, 3,00 экв.) в воде (5 мл). Полученный раствор перемешивали в течение 1 часа при комнатной температуре. Полученный раствор экстрагировали 2x20 мл н-гексана, и водную фазу объединяли. Значение pH водной фазы доводили до 6-5 добавлением HCl (2н.). Полученный раствор экстрагировали 3x30 мл этилацетата, и органические слои объединяли. Органическую фазу промывали 3x30 мл насыщенного раствора хлорида натрия. Органическую фазу сушили над безводным сульфатом натрия и упаривали в вакууме. В результате получали 3,5 г (66%) (2S)-2-[[(трет-бутокси)карбонил]амино]-4-метилпент-4-еновой кислоты в виде светло-желтого масла. MS (ES, m/z): 228 (M-H).

бензил (2S)-2-[[(трет-бутокси)карбонил]амино]-4-метилпент-4-еноат. В 250-миллилитровую круглодонную колбу помещали раствор (2S)-2-[[(трет-бутокси)карбонил]амино]-4-метилпент-4-еновой кислоты (3,5 г, 15,27 ммоль, 1,00 экв.) в N,N-диметилформамиде (80 мл), BnBr (3,2 г, 18,71 ммоль, 1,20 экв.), карбонат калия (6,3 г, 45,58 ммоль, 3,00 экв.). Полученный раствор перемешивали в течение ночи при комнатной температуре. Затем реакцию гасили добавлением воды (100 мл). Полученный раствор экстрагировали 3x40 мл этилацетата, и органические слои объединяли. Органическую фазу промывали 3x30 мл насыщенного раствора хлорида натрия. Органическую фазу сушили над безводным сульфатом натрия и упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:10). В результате получали 4 г (82%) бензил (2S)-2-[[(трет-бутокси)карбонил]амино]-4-метилпент-4-еноата в виде светло-желтого масла. MS (ES, m/z): 320 (M+H);1H ЯМР (CDCl3, 300 МГц) δ: 7,39-7,33 (м, 5 H), 5,23-5,12 (м, 2 H), 4,96-4,94 (м, 1 H), 4,80 (д, J=14,0 Гц, 2 H), 4,47-4,46 (м, 1H), 2,58-2,51 (м, 1 H), 2,42-2,35 (м, 1 H), 1,73 (с, 3 H), 1,27 (с, 9 H).

бензил (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпент-4-еноат. В 250-миллилитровую круглодонную колбу помещали раствор бензил (2S)-2-[[(трет-бутокси)карбонил]амино]-4-метилпент-4-еноата (5,2 г, 16,28 ммоль, 1,00 экв.) в N,N-диметилформамиде (100 мл), Ag2O (11,2 г, 3,00 экв.), AcOH (1 г, 16,65 ммоль, 1,00 экв.)., CH3I (23 г, 162,04 ммоль, 10,00 экв.). Полученный раствор перемешивали в течение ночи при комнатной температуре. Твердый осадок отфильтровывали. Фильтрат разбавляли водой (200 мл) и экстрагировали 3x70 мл этилацетата, и органические слои объединяли. Органическую фазу промывали 2x50 мл насыщенного раствора хлорида натрия. Органическую фазу сушили над безводным сульфатом натрия и упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:10). В результате получали 4 г (74%) бензил (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпент-4-еноата в виде светло-желтого масла. MS (ES, m/z): 334 (M+H); 1H ЯМР (CDCl3, 300 МГц) δ: 7,36 (с, 5 H), 5,23 (с, 2 H), 5,13-5,06 (м, 0,5 H), 4,83-4,73 (м, 2,5 H), 2,83-2,77 (м, 3H), 2,66-2,46 (м, 2 H), 1,78 (с, 3 H), 1,47-1,33 (м, 9 H).

бензил (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-оксопентаноат. В 100-миллилитровую круглодонную колбу помещали раствор бензил (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпент-4-еноата (4 г, 12,00 ммоль, 1,00 экв.) в смеси CH3CN:H2O:EA ( мл), RuCl3 (124 мг, 0,05 экв.), NaIO4 (10,3 г, 4,00 экв.). Полученный раствор перемешивали в течение 1 часа при комнатной температуре. Полученный раствор экстрагировали 3x60 мл этилацетата, и органические слои объединяли. Органическую фазу промывали 3x30 мл насыщенного раствора хлорида натрия. Органическую фазу сушили над безводным сульфатом натрия и упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:10). В результате получали 3 г (75%) бензил (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-оксопентаноата в виде светло-коричневого масла. MS (ES, m/z): 336 (M+H);1H ЯМР (CDCl3, 300 МГц) δ: 7,35 (с, 5 H), 5,20-5,10 (м, 2 H), 4,70-4,66 (м, 1 H), 2,94-2,74 (м, 5H), 2,24-2,22 (м, 3 H), 1,49-1,31 (м, 9 H).

бензил (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4,4-дифторпентаноат. В 30-миллилитровую виалу помещали раствор бензил (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-оксопентаноата (500 мг, 1,49 ммоль, 1,00 экв.), дихлорметан (3 мл), метанол (0,01 мл). Затем добавляли DAST (1,5 мл) по каплям при перемешивании при 0oC. Полученный раствор перемешивали в течение ночи при комнатной температуре. Затем реакцию гасили добавлением смеси вода/лед. Значение pH раствора доводили до 9 добавлением насыщенного раствора NaHCO3. Полученный раствор экстрагировали 3x50 мл дихлорметана, и органические слои объединяли. Органическую фазу промывали 3x30 мл насыщенного раствора хлорида натрия. Органическую фазу сушили над безводным сульфатом натрия и упаривали в вакууме. В результате получали 1,8 г (42%) бензил (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4,4-дифторпентаноата в виде желтого масла. MS (ES, m/z): 338 (M+H);1H ЯМР (ДМСО, 300 МГц) δ: 7,37-7,33 (м, 5 H), 5,20-5,09 (м, 2 H), 4,82-4,59 (м, 1 H), 2,77-2,76 (м, 3H), 2,57-2,47 (м, 2 H), 1,72-1,57 (м, 3 H), 1,41-1,30 (м, 9 H).

(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4,4-дифторпентановая кислота (M19). В 100-миллилитровую круглодонную колбу помещали раствор бензил (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4,4-дифторпентаноата (900 мг, 2,52 ммоль, 1,00 экв.) в метаноле (20 мл), палладий на угле (50 мг). Заполняли колбу водородом. Полученный раствор перемешивали в течение 30 минут при комнатной температуре. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. В результате получали 700 мг (сырой продукт) (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4,4-дифторпентановой кислоты в виде белого твердого вещества. MS (ES, m/z): 268 (M+H).
Пример синтеза 13. Получение мономера M20.
Мономер M20 получали способом, показанным на схеме 13 ниже.
Схема 13

Подробное описание эксперимента

трет-бутил (2S)-2-[[(бензилокси)карбонил]амино]-3-гидроксипропаноат. В 2-литровую круглодонную колбу помещали (2S)-2-[[(бензилокси)карбонил]амино]-3-гидроксипропановую кислоту (50 г, 209,01 ммоль, 1,00 экв.), ацетонитрил (400 мл), калия метанпероксоат (180 г, 1,29 моль, 6,50 экв.), бензилтриэтилазания хлорид (47 г, 206,35 ммоль, 1,00 экв.). Полученный раствор перемешивали в течение 5 часов при комнатной температуре. Затем добавляли 2-бром-2-метилпропан (250 мл, 10,20 экв.). Полученный раствор перемешивали в течение ночи при 50oC на масляной бане. Реакционную смесь охлаждали. Полученную смесь упаривали в вакууме. Остаток растворяли в 1,5 л этилацетата. Полученную смесь промывали 1x500 мл H2O. Органический слой промывали 2x400 мл насыщенного раствора хлорида натрия. Органический слой сушили над безводным сульфатом натрия и упаривали в вакууме. В результате получали 39 г (63%) трет-бутил (2S)-2-[[(бензилокси)карбонил]амино]-3-гидроксипропаноата в виде белого твердого вещества. MS (ES, m/z): 296 (M+H).

трет-бутил (2R)-2-[[(бензилокси)карбонил]амино]-3-иодпропаноат. В 250-миллилитровую круглодонную колбу помещали N,N-диметилформамид (150 мл), трет-бутил (2S)-2-[[(бензилокси)карбонил]амино]-3-гидроксипропаноат (20 г, 67,72 ммоль, 1,00 экв.). Затем добавляли метилтрифеноксифосфония иодид (43 г, 95,09 ммоль, 1,30 экв.) порциями при перемешивании при 0oC. Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Реакционную смесь охлаждали до 0oC на ледяной бане. Затем реакцию гасили добавлением 30 г бикарбоната натрия. Полученный раствор разбавляли 260 мл H2O. Полученный раствор экстрагировали 3x300 мл этилацетата, и органические слои объединяли. Органические слои промывали 2x200 мл водного раствора гидроксида натрия (0,05 моль/л). Органические слои промывали 1x200 мл насыщенного раствора хлорида натрия. Органические слои сушили над безводным сульфатом натрия и упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/ петролейный эфир (1:100-1:30). В результате получали 20 г (73%) трет-бутил (2R)2-[[(бензилокси)карбонил]амино]-3-иодпропаноата в виде бесцветного масла. MS (ES, m/z): 406 (M+H).

трет-бутил (2S)-2-[[(бензилокси)карбонил]амино]-5,5,5-трифтор-4-гидрокси-4-(трифторметил)пентаноат. В 250-миллилитровую круглодонную колбу в инертной атмосфере азота помещали N,N-диметилформамид (50 мл), цинк (16 г, 244,61 ммоль, 5,00 экв.), иод (1,25 г, 4,92 ммоль, 0,10 экв.), смесь перемешивали, она становилась бесцветной, и в реакцию добавляли трет-бутил (2R)2-[[(бензилокси)карбонил]амино]-3-иодпропаноат (20 г, 49,35 ммоль, 1,00 экв.) и I2 (1,25 г, 4,92 ммоль, 0,10 экв.). Затем добавляли раствор гексафторпропан-2-он (100 мл, 3,00 экв.) в N,N-диметилформамиде (50 мл) при -30oC. Полученный раствор перемешивали в течение 4 часов при комнатной температуре. Полученный раствор разбавляли добавлением 500 мл смеси льда и воды. Полученный раствор экстрагировали 3x200 мл этилацетата, и органические слои объединяли. Органические слои промывали 3x100 мл насыщенного раствора хлорида натрия. Органические слои сушили над безводным сульфатом натрия и упаривали в вакууме. Сырой продукт очищали методом препаративной флэш-ВЭЖХ в следующих условиях (IntelFlash-1): Колонка, C18 силикагель; подвижная фаза, CH3CN/H2O = 30% с возрастанием до CH3CN/H2O = 65% в течение 20 мин; Детектор, УФ 220 нм. В результате получали 17 г (77%) трет-бутил (2S)-2-[[(бензилокси)карбонил] амино]-5,5,5-трифтор-4-гидрокси-4-(трифторметил) пентаноата в виде белого твердого вещества. MS (ES, m/z): 446 (M+H);1H ЯМР (300 МГц, CDCl3): δ 7,52-7,3 (м, 5H), 6,15-5,80 (ушир, 1H), 5,16 (с, 2H), 4,52-4,40 (м, 1H), 2,80-2,70 (м, 1H), 2,40-2,25 (м, 1H), 1,50 (с, 9H).

трет-бутил (2S)-2-[[(бензилокси)карбонил]амино]-5,5,5-трифтор-4-(трифторметил)пентаноат. В 250-миллилитровую круглодонную колбу в инертной атмосфере азота помещали толуол (50 мл), трет-бутил (2S)-2-[[(бензилокси)карбонил] амино]-5,5,5-трифтор-4-гидрокси-4-(трифторметил)пентаноат (12,34 г, 27,71 ммоль, 1,00 экв.), фенил 2-хлор-2-оксоацетат (7,4 г, 40,09 ммоль, 1,45 экв.). Затем добавляли пиридин (3 г, 37,93 ммоль, 1,40 экв.) по каплям при перемешивании при 0oC и перемешивали 1 час. Твердый осадок отфильтровывали. Полученную смесь упаривали в вакууме. Затем добавляли AIBN (1,8 г, 10,96 ммоль, 0,40 экв.) и полученный сырой продукт к трибутилолова гидриду (14,4 г, 49,65 ммоль, 1,80 экв.) и толуолу при 100oC на масляной бане. Полученный раствор перемешивали в течение 1 часа при 100oC на масляной бане. Реакционную смесь охлаждали. Полученный раствор разбавляли 100 мл эфира. Затем реакцию гасили добавлением 30 г KF/Al2O3, и смесь перемешивали при комнатной температуре 1 час. Твердый осадок отфильтровывали. Полученную смесь упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:100-1:30). Сырой продукт очищали методом препаративной флэш-ВЭЖХ в следующих условиях (IntelFlash-1): Колонка, C18 силикагель; подвижная фаза, CH3CN/H2O = 40% с повышением до CH3CN/H2O = 78% в течение 20 мин; Детектор, УФ 254 нм. В результате получали 1,2 г (10%) трет-бутил (2S)-2-[[(бензилокси)карбонил]амино]-5,5,5-трифтор-4-(трифторметил) пентаноата в виде белого твердого вещества. MS (ES, m/z): 430 (M+H);1H ЯМР: (300 МГц, CDCl3, м.д.): 7,46-7,31 (м, 5H), 5,46-5,30 (ушир, 1H), 5,15 (с, 2H), 4,50-4,30 (м, 1H), 3,40-3,20 (м, 1H), 2,45-2,00 (м, 2H), 1,49 (с, 9H).

трет-бутил (2S)-2-амино-5,5,5-трифтор-4-(трифторметил)пентаноат. В 100-миллилитровую круглодонную колбу помещали палладий на угле (400 мг), метанол (40 мл), трет-бутил (2S)-2-[[(бензилокси)карбонил]амино]-5,5,5-трифтор-4-(трифторметил)пентаноат (2,1 г, 4,89 ммоль, 1,00 экв.), подавали водород. Полученный раствор перемешивали в течение ночи при комнатной температуре. Твердый осадок отфильтровывали. Полученную смесь упаривали в вакууме. В результате получали 1,4 г (97%) трет-бутил (2S)-2-амино-5,5,5-трифтор-4-(трифторметил)пентаноата в виде бесцветного масла. MS (ES, m/z): 296 (M+H).

трет-бутил (2S)-2-[бензил(метил)амино]-5,5,5-трифтор-4-(трифторметил)пентаноат. В 250-миллилитровую круглодонную колбу помещали тетрагидрофуран (40 мл), трет-бутил (2S)-2-амино-5,5,5-трифтор-4-(трифторметил)пентаноат (1,35 г, 4,57 ммоль, 1,00 экв.). Затем добавляли бензальдегид (1,17 г, 11,03 ммоль, 2,50 экв.) по каплям при 0oC. Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Затем добавляли NaBH3CN (820 мг, 13,23 ммоль, 3,00 экв.) порциями при 0oC. Полученный раствор перемешивали в течение 2 часов при комнатной температуре. В смесь добавляли формальдегид (330 мг, 10,99 ммоль, 2,50 экв.) порциями при 0oC. Затем добавляли NaBH3CN (820 мг, 13,23 ммоль, 3,00 экв.) порциями при 0oC. Полученный раствор перемешивали в течение ночи при комнатной температуре. Твердый осадок отфильтровывали. Полученную смесь упаривали в вакууме. Остаток очищали методом препаративной ТСХ (эфир/н-гексан = 1:1). В результате получали 800 мг (44%) трет-бутил (2S)-2-[бензил(метил)амино]-5,5,5-трифтор-4-(трифторметил)пентаноата в виде бесцветного масла. MS (ES, m/z): 400 (M+H).

трет-бутил (2S)-5,5,5-трифтор-2-(метиламино)-4-(трифторметил)пентаноат. В 50-миллилитровую круглодонную колбу помещали трет-бутил (2S)-2-[бензил(метил)амино]-5,5,5-трифтор-4-(трифторметил)пентаноат (240 мг, 0,60 ммоль, 1,00 экв.), этилацетат (10 мл), палладий на угле (50 мг). Подавали H2 (газ). Полученный раствор перемешивали в течение 3 часов при комнатной температуре. В результате получали 130 мг (70%) трет-бутил (2S)-5,5,5-трифтор-2-(метиламино)-4-(трифторметил)пентаноата в виде бесцветного масла. MS (ES, m/z): 310 (M+H).

трет-бутил (2S)-2-[[(9H-флуорен-9-илметокси)карбонил](метил)амино]-5,5,5-трифтор-4-(трифторметил)пентаноат. В 8-миллилитровую круглодонную колбу помещали диоксан (2 мл), воду (1 каплю), трет-бутил (2S)-5,5,5-трифтор-2-(метиламино)-4-(трифторметил) пентаноат (130 мг, 0,42 ммоль, 1,00 экв.), NaHCO3 (43 мг, 0,51 ммоль, 1,20 экв.), 9H-флуорен-9-илметил хлорформиат (120 мг, 0,46 ммоль, 1,10 экв.). Полученный раствор перемешивали в течение 3 часов при комнатной температуре. Полученную смесь упаривали в вакууме. Остаток очищали методом препаративной ТСХ (EtOAc:петролейный эфир = 1:5). В результате получали 150 мг (67%) трет-бутил (2S)-2-[[(9H-флуорен-9-илметокси)карбонил] (метил)амино]-5,5,5-трифтор-4-(трифторметил) пентаноата в виде бесцветного масла. MS (ES, m/z): 554 (M+Na).

(2S)-2-[[(9H-флуорен-9-илметокси)карбонил](метил)амино]-5,5,5-трифтор-4-(трифторметил)пентановая кислота (M20). В 50-миллилитровую круглодонную колбу помещали дихлорметан (10 мл), трет-бутил (2S)-2-[[(9H-флуорен-9-илметокси)карбонил] (метил)амино]-5,5,5-трифтор-4-(трифторметил)пентаноат (150 мг, 0,28 ммоль, 1,00 экв.). Затем добавляли трифторуксусную кислоту (3 мл) по каплям при перемешивании. Полученный раствор перемешивали в течение 4 часов при комнатной температуре. Полученную смесь упаривали в вакууме. В результате получали 210 мг (2S)-2-[[(9H-флуорен-9-илметокси)карбонил](метил)амино]-5,5,5-трифтор-4-(трифторметил)пентановой кислоты в виде бесцветного масла. MS (ES, m/z): 476 (M+H);1H ЯМР: (300 МГц, CDCl3, м.д.): 7,82-7,78 (м, 2H), 7,63-7,50 (м, 2H), 7,47-7,30 (м, 4H), 4,82-4,30 (м, 5H), 2,90-2,78 (м, 3H), 2,60-2,20 (м, 2H).
Пример синтеза 14. Получение мономера M21.
Мономер M21 получали способом, показанным на схеме 14 ниже.
Схема 14

Подробное описание эксперимента
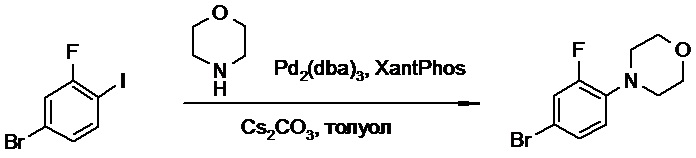
4-(4-Бром-2-фторфенил)морфолин. В 1-литровую круглодонную колбу в инертной атмосфере азота помещали раствор 4-бром-2-фтор-1-иодбензола (15 г, 49,85 ммоль, 1,00 экв.) в толуоле (300 мл). Добавляли Pd2(dba)3 (1,3 г, 1,42 ммоль, 0,03 экв.), Cs2CO3 (41 г, 125,45 ммоль, 2,50 экв.), XantPhos (2,9 г, 5,01 ммоль, 0,10 экв.), морфолин (4,3 г, 49,36 ммоль, 1,00 экв.). Полученный раствор перемешивали в течение ночи при 100oC. Затем реакцию гасили добавлением 150 мл воды. Полученный раствор экстрагировали 3x100 мл этилацетата, органические слои объединяли и сушили над безводным сульфатом натрия и упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:15). В результате получали 10,5 г (81%) 4-(4-бром-2-фторфенил)морфолина в виде желтого твердого вещества. MS (ES, m/z): 260 (M+H).

Бензил (2E)-3-[3-фтор-4-(морфолин-4-ил)фенил]проп-2-еноат. В 100-миллилитровую круглодонную колбу в инертной атмосфере азота помещали 4-(4-бром-2-фторфенил)морфолин (1,25 г, 4,81 ммоль, 1,00 экв.), Pd(OAc)2 (50 мг, 0,22 ммоль, 0,05 экв.), раствор бикарбоната натрия (810 мг, 9,64 ммоль, 2,00 экв.) в N,N-диметилформамиде (30 мл), Bu4NCl (2,7 г, 9,72 ммоль, 2,00 экв.), бензил проп-2-еноат (1,6 г, 9,87 ммоль, 2,00 экв.). Полученный раствор перемешивали в течение 36 часов при 100oC. Затем реакцию гасили добавлением воды. Полученный раствор экстрагировали 4x100 мл этилацетата, и органические слои объединяли. Органическую фазу промывали 3x60 мл насыщенного раствора хлорида натрия. Органическую фазу сушили над безводным сульфатом натрия и упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:5). В результате получали 10,5 г (80%) бензил (2E)-3-[3-фтор-4-(морфолин-4-ил)фенил]проп-2-еноата в виде желтого твердого вещества. MS (ES, m/z): 342 (M+H).

Бензил (2R, 3S)-3-[3-фтор-4-(морфолин-4-ил)фенил]-2,3-дигидроксипропаноат. В 250-миллилитровую 3-горлую круглодонную колбу помещали раствор AD-mix-α (12,3 г) в смеси трет-бутанол/H2O (60:60 мл). Затем добавляли бензил (2E)-3-[3-фтор-4-(морфолин-4-ил)фенил]проп-2-еноат (3 г, 8,79 ммоль, 1,00 экв.) порциями при 0oC. Затем добавляли MeSO2NH2 (1,23 г, 1,00 экв.) порциями при 0oC. Полученный раствор перемешивали в течение 3 дней при комнатной температуре. Затем реакцию гасили добавлением Na2SO3. Полученный раствор экстрагировали 3x100 мл этилацетата, и органические слои объединяли. Органическую фазу промывали 3x60 мл насыщенного раствора хлорида натрия. Органическую фазу сушили над безводным сульфатом натрия и упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:1). В результате получали 9,5 г (72%) бензил (2R, 3S)-3-[3-фтор-4-(морфолин-4-ил)фенил]-2,3-дигидроксипропаноата в виде желтого масла. MS (ES, m/z): 376 (M+H).

Бензил (2R)-3-[3-фтор-4-(морфолин-4-ил)фенил]-2-гидроксипропаноат (M21). В 40-миллилитровую виалу помещали раствор бензил (2R,3S)-3-[3-фтор-4-(морфолин-4-ил)фенил]-2,3-дигидроксипропаноата (900 мг, 2,40 ммоль, 1,00 экв.) в дихлорметане (2 мл), Et3SiH (4 мл), трифторуксусную кислоту (2 мл). Полученный раствор перемешивали в течение 3 дней при комнатной температуре. Затем реакцию гасили добавлением смеси вода/лед. Полученный раствор экстрагировали 3x80 мл этилацетата, и органические слои объединяли. Органическую фазу промывали 3x60 мл насыщенного раствора хлорида натрия. Органическую фазу сушили над безводным сульфатом натрия и упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:3). В результате получали 4,1 г (48%) бензил (2R)-3-[3-фтор-4-(морфолин-4-ил)фенил]-2-гидроксипропаноата в виде красноватого масла. MS (ES, m/z): 360 (M+H).
Пример синтеза 15. Получение мономера M24.
Мономер M24 получали способом, показанным на схеме 15 ниже.
Схема 15

Подробное описание эксперимента

Бензил (2R)-2-[(трет-бутилдиметилсилил)окси]-3-[4-(4-фторфенил)фенил]пропаноат. В 100-миллилитровую круглодонную колбу в инертной атмосфере азота помещали (4-фторфенил)бороновую кислоту (1 г, 7,15 ммоль, 1,50 экв.), диоксан (20 мл), воду (2 мл), бензил (2R)3-(4-бромфенил)-2-[(трет-бутилдиметилсилил)окси]пропаноат (2 г, 4,45 ммоль, 1,00 экв.), карбонат натрия (1,2 г, 11,32 ммоль, 2,50 экв.), Pd(PPh3)4 (250 мг, 0,22 ммоль, 0,05 экв.). Полученный раствор перемешивали в течение 3 часов при 70oC. Полученную смесь упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента петролейный эфир. В результате получали 2,1 г (сырой продукт) бензил (2R)2-[(трет-бутилдиметилсилил)окси]-3-[4-(4-фторфенил)фенил]пропаноата в виде бесцветного масла.1H ЯМР (ДМСО, 300 МГц) δ: 7,70-7,54 (м, 4 H), 7,45 (д, J=4,2 Гц, 1 H), 7,39-7,25 (м, 8 H), 7,16 (д, J=4,2 Гц, 1 H), 5,14 (с, 2 H), 4,53-4,47 (м, 1 H), 3,06-2,86 (м, 2 H), 0,73 (с, 9 H), -0,13 (с, 3 H), -0,23 (с, 3 H).

Бензил (2R)-3-[4-(4-фторфенил)фенил]-2-гидроксипропаноат (M24). (2R)2-[(трет-бутилдиметилсилил)окси]-3-[4-(4-фторфенил)фенил]пропаноат (2,1 г, 4,52 ммоль, 1,00 экв.), тетрагидрофуран (50 мл). Затем добавляли TBAF (1,5 г, 5,74 ммоль, 1,30 экв.) порциями при 0oC. Полученный раствор перемешивали в течение 40 минут при комнатной температуре. Затем реакцию гасили добавлением смеси вода/лед. Полученный раствор экстрагировали 3x60 мл этилацетата, и органические слои объединяли. Органическую фазу промывали 3x50 мл насыщенного раствора хлорида натрия. Органическую фазу сушили над безводным сульфатом натрия и упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:10). В результате получали 1,2 г (76%) бензил (2R)3-[4-(4-фторфенил)фенил]-2-гидроксипропаноата в виде белого твердого вещества.1H ЯМР (CDCl3, 300 МГц) δ: 7,56-7,51 (м, 2 H), 7,46-7,32 (м, 7 H), 7,25-7,22 (м, 2 H), 7,17-7,11 (м, 2 H), 5,27-5,15 (м, 2 H), 4,53-4,47 (м, 1 H), 3,12-2,92 (м, 2 H).
Пример синтеза 16. Получение мономера M25.
Мономер M25 получали способом, показанным на схеме 16 ниже.
Схема 16

Подробное описание эксперимента

Бензил (2R)-2-[(трет-бутилдиметилсилил)окси]-3-[4-(4,4-диметилциклогекс-1-ен-1-ил)фенил]пропаноат. В 250-миллилитровую круглодонную колбу в инертной атмосфере азота помещали бензил (2R)3-(4-бромфенил)-2-[(трет-бутилдиметилсилил)окси]пропаноат (1,58 г, 3,52 ммоль, 1,00 экв.), 2-(4,4-диметилциклогекс-1-ен-1-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (1 г, 4,23 ммоль, 1,20 экв.), K3PO4 (1,86 г, 8,76 ммоль, 2,50 экв.), Pd(dppf)2Cl2 (130 мг, 0,18 ммоль, 0,05 экв.), диоксан (25 мл), воду (2,5 мл). Полученный раствор перемешивали в течение 2 часов при 75oC. Твердый осадок отфильтровывали. Полученную смесь упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:50). В результате получали 1,5 г (89%) бензил (2R)-2-[(трет-бутилдиметилсилил)окси]-3-[4-(4,4-диметилциклогекс-1-ен-1-ил)фенил]пропаноата в виде желтого масла.1H ЯМР (ДМСО, 300 МГц) δ: 7,40-7,28 (м, 7 H), 7,17 (д, J=4,0 Гц, 2 H), 6,07 (т, J=3,9 Гц, 1 H), 5,23- 5,13 (м, 2 H), 4,44-4,40 (м, 1 H), 3,13-3,08 (м, 1 H), 2,98-2,91 (м, 1 H), 2,47-2,42 (м, 2 H), 2,04-2,03 (м, 2 H), 1,57 (т, J=6,1 Гц, 2 H), 1,01 (с, 6 H), 0,85 (с, 9 H), -0,07 (с, 3 H), -0,15 (с, 3 H).
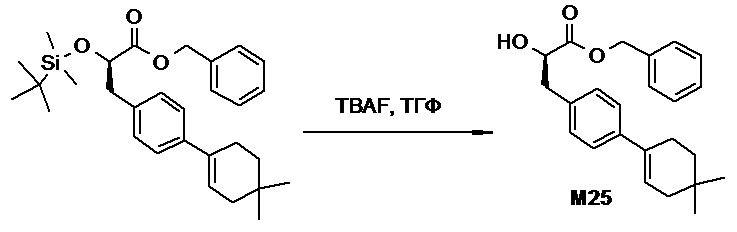
Бензил (2R)-3-[4-(4,4-диметилциклогекс-1-ен-1-ил)фенил]-2-гидроксипропаноат (M25). В 100-миллилитровую 3-горлую круглодонную колбу помещали бензил (2R)2-[(трет-бутилдиметилсилил)окси]-3-[4-(4,4-диметилциклогекс-1-ен-1-ил)фенил]пропаноат (1,5 г, 3,13 ммоль, 1,00 экв.), тетрагидрофуран (25 мл). Затем добавляли раствор TBAF (980 мг, 3,75 ммоль, 1,20 экв.) в тетрагидрофуране (5 мл) по каплям при перемешивании при 0oC. Полученный раствор перемешивали в течение 1 часа при комнатной температуре. Затем реакцию гасили добавлением 12 мл смеси вода/лед. Полученный раствор экстрагировали 3x25 мл этилацетата, и органические слои объединяли. Полученную смесь промывали 3x30 мл насыщенного раствора хлорида натрия. Смесь сушили над безводным сульфатом натрия и упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:20). В результате получали 1 г (88%) бензил (2R)3-[4-(4,4-диметилциклогекс-1-ен-1-ил)фенил]-2-гидроксипропаноата в виде желтого масла. MS (ES, m/z): 365 (M+H);1H ЯМР (ДМСО, 300 МГц) δ: 7,41-7,28 (м, 7 H), 7,11 (д, J=4,0 Гц, 2 H), 6,08-6,06 (м, 1 H), 5,20 (с, 2 H), 4,53-4,49 (м, 1 H), 3,20-3,09 (м, 1 H), 3,02-2,98 (м, 1 H), 2,45-2,40 (м, 2 H), 2,02-2,00 (м, 2 H), 1,60-1,52 (м, 2 H), 0,99 (с, 6 H).
Пример синтеза 17. Получение мономера M28.
Мономер M28 получали способом, показанным на схеме 17 ниже.
Схема 17

Подробное описание эксперимента
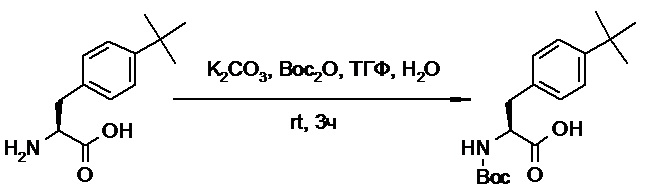
(2S)-2-[[(трет-бутокси)карбонил]амино]-3-(4-трет-бутилфенил)пропановая кислота. В 250-миллилитровую круглодонную колбу помещали тетрагидрофуран (140 мл), (2S)-2-амино-3-(4-трет-бутилфенил)пропановую кислоту (7 г, 31,63 ммоль, 1,00 экв.). Затем добавляли раствор карбонат калия (10,9 г, 78,87 ммоль, 2,50 экв.) в H2O (25 мл) по каплям при перемешивании при 0oC. Затем добавляли раствор Boc2O (10,2 г, 46,74 ммоль, 1,50 экв.) в тетрагидрофуране (5 мл) по каплям при перемешивании при 0oC. Полученный раствор перемешивали в течение 3 часов при комнатной температуре. Значение pH раствора доводили до 6 добавлением раствора хлороводорода (3 моль/л). Полученный раствор экстрагировали 3x100 мл этилацетата, и органические слои объединяли. Органические слои промывали 3x50 мл насыщенного раствора хлорида натрия. Слои сушили над безводным сульфатом натрия и упаривали в вакууме. В результате получали 14 г (2S)-2-[[(трет-бутокси) карбонил]амино]-3-(4-трет-бутилфенил)пропановой кислоты в виде белого твердого вещества. MS (ES, m/z): 322 (M+H).

Метил (2S)-2-[[(трет-бутокси)карбонил]амино]-3-(4-трет-бутилфенил)пропаноат. В 100-миллилитровую круглодонную колбу помещали N,N-диметилформамид (80 мл), (2S)-2-[[(трет-бутокси)карбонил]амино]-3-(4-трет-бутилфенил)пропановую кислоту (10,1 г, 31,42 ммоль, 1,00 экв.), Ag2O (14,6 г, 2,00 экв.), CH3I (5,4 г, 38,04 ммоль, 1,10 экв.). Полученный раствор перемешивали в течение 2 часов при 60oC на масляной бане. Реакционную смесь охлаждали. Полученный раствор разбавляли добавлением 200 мл смеси льда и воды. Полученный раствор экстрагировали 3x100 мл этилацетата, и органические слои объединяли. Органические слои промывали 3x50 мл насыщенного раствора хлорида натрия. Органические слои сушили над безводным сульфатом натрия и упаривали в вакууме. В результате получали 11,7 г (сырой продукт) метил (2S)-2-[[(трет-бутокси)карбонил]амино]-3-(4-трет-бутилфенил)пропаноата в виде светло-желтого масла. MS (ES, m/z): 336 (M+H).

Метил (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-3-(4-трет-бутилфенил) пропаноат. В 250-миллилитровую 3-горлую круглодонную колбу помещали N,N-диметилформамид (150 мл), метил (2S)-2-[[(трет-бутокси)карбонил]амино]-3-(4-трет-бутилфенил)пропаноат (11,7 г, 34,88 ммоль, 1,00 экв.), Ag2O (16 г, 3,00 экв.), CH3I (14,7 г, 103,56 ммоль, 2,00 экв.). Полученный раствор перемешивали в течение 2 часов при 60oC. Реакционную смесь охлаждали. Полученный раствор разбавляли добавлением 400 мл смеси льда и воды. Полученный раствор экстрагировали 3x300 мл этилацетата, и органические слои объединяли. Органические слои промывали 3x100 мл насыщенного раствора хлорида натрия. Органические слои сушили над безводным сульфатом натрия и упаривали в вакууме. В результате получали 13,7 г (сырой продукт) метил (2S)-2-[[(трет-бутокси)карбонил](метил) амино]-3-(4-трет-бутилфенил)пропаноата в виде светло-желтого масла.

(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-3-(4-трет-бутилфенил)пропановая кислота (M28). В 500-миллилитровую круглодонную колбу помещали метанол (200 мл), метил (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-3-(4-трет-бутилфенил)пропаноат (13,7 г, 39,20 ммоль, 1,00 экв.). Затем добавляли раствор LiOH (9,4 г, 392,48 ммоль, 10,00 экв.) в H2O (40 мл) по каплям при перемешивании при 0oC. Полученный раствор перемешивали в течение 1 часа при комнатной температуре. Полученную смесь упаривали в вакууме. Значение pH раствора доводили до 7 добавлением раствора хлороводорода (12 моль/л). Полученный раствор экстрагировали 3x100 мл дихлорметана, органические слои объединяли и сушили над безводным сульфатом натрия и упаривали в вакууме. В результате получали 10 г (76%) (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-3-(4-трет-бутилфенил) пропановой кислоты в виде бесцветного масла. MS (ES, m/z): 336(Ms+H);1H ЯМР (300 МГц, CDCl3): δ 7,33-7,27 (м, 2H), 7,17-7,11 (м, 2H), 4,90-4,63 (м, 1H), 3,35-3,23 (м, 1H), 3,15-2,89 (м, 1H), 2,75 (д, J = 22,8Гц, 3H), 1,47-1,23 (м, 18H).
Пример синтеза 18. Получение мономера M29.
Мономер M29 получали способом, показанным на схеме 18 ниже.
Схема 18

Подробное описание эксперимента

Бензил (2S)-2-[[(трет-бутокси)карбонил]амино]-3-(4-фенилфенил)пропаноат. В 100-миллилитровую круглодонную колбу помещали N,N-диметилформамид (20 мл), (2S)-2-[[(трет-бутокси)карбонил]амино]-3-(4-фенилфенил)пропановую кислоту (3 г, 8,79 ммоль, 1,00 экв.), Cs2CO3 (9 г, 27,62 ммоль, 3,14 экв.), BnBr (1,6 г, 9,36 ммоль, 1,06 экв.). Полученный раствор перемешивали в течение 3 часов при комнатной температуре. Твердый осадок отфильтровывали. Полученный раствор экстрагировали 3x30 мл этилацетата, и органические слои объединяли и упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:4). В результате получали 4,5 г бензил (2S)-2-[[(трет-бутокси)карбонил]амино]-3-(4-фенилфенил)пропаноата в виде белого твердого вещества. MS (ES, m/z): 432(M+H);1H ЯМР (300 МГц, CDCl3): δ 7,59-7,11 (м, 14H), 5,23-5,19 (м, 2H), 5,05-5,04 (м, 0,5H), 4,72-4,6 5 (м, 0,5H), 3,15-3,14 (м, 2H), 1,44 (с, 9H).

Бензил (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-3-(4-фенилфенил)пропаноат. Бензил (2S)-2-[[(трет-бутокси)карбонил]амино]-3-(4-фенилфенил)пропаноат (4,5 г, 10,43 ммоль, 1,00 экв.), Ag2O (4,8 г), CH3I (7,4 г, 52,13 ммоль, 5,00 экв.). Полученный раствор перемешивали в течение 3 часов при 60oC. Твердый осадок отфильтровывали. Полученный раствор экстрагировали 3x30 мл этилацетата, органические слои объединяли и сушили над безводным сульфатом натрия и упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:5). В результате получали 2,4 г (52%) бензил (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-3-(4-фенилфенил)пропаноата в виде бесцветного масла. MS (ES, m/z): 446 (M+H);1H ЯМР (300 МГц, CD3OD): δ 7,59-7,28 (м, 14H), 5,22 (с, 2H), 4,80-4,71 (м, 1H), 3,37-3,11 (м, 2H), 2,71 (с, 3H), 1,48-1,45 (м, 9H).

(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-3-(4-фенилфенил)пропановая кислота (M29). В 100-миллилитровую круглодонную колбу помещали этилацетат (10 мл), бензил (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-3-(4-фенилфенил)пропаноат (2,4 г, 5,39 ммоль, 1,00 экв.), палладий на угле (0,4 г), водород (достаточное количество). Полученный раствор перемешивали в течение 1 часа при комнатной температуре. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. В результате получали 1,4 г (73%) (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-3-(4-фенилфенил)пропановой кислоты в виде бесцветного масла.
Пример синтеза 19. Получение мономера M30.
Мономер M30 получали способом, показанным на схеме 19 ниже.
Схема 19

Подробное описание эксперимента

(2R)-3-(4-бромфенил)-2-гидроксипропановая кислота. В 5-литровую 4-горлую круглодонную колбу помещали смесь серная кислота/H2O (0,5моль/л) (3,2 л), (2R)2-амино-3-(4-бромфенил)пропановую кислоту (100 г, 409,69 ммоль, 1,00 экв.). Затем добавляли раствор NaNO2 (350 г, 5,07 моль, 12,38 экв.) в H2O (500 мл) по каплям при перемешивании при 0oC. Полученный раствор перемешивали в течение ночи при комнатной температуре. Твердый осадок отделяли фильтрованием. Полученное твердое вещество сушили в термошкафу при пониженном давлении. В результате получали 146 г (73%) (2R)3-(4-бромфенил)-2-гидроксипропановой кислоты в виде белого твердого вещества. MS (ES, m/z): 243 (M-H).

(2R)-3-[4-(3,6-дигидро-2H-пиран-4-ил)фенил]-2-гидроксипропановая кислота: В 1-литровую круглодонную колбу в инертной атмосфере азота помещали диоксан (500 мл), H2O (50 мл), (2R)-3-(4-бромфенил)-2-гидроксипропановую кислоту (30 г, 122,41 ммоль, 1,00 экв.), 2-(3,6-дигидро-2H-пиран-4-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (40 г, 190,41 ммоль, 1,60 экв.), K3PO4 (65 г, 306,21 ммоль, 2,50 экв.), Pd(dppf)Cl2 (4,5 г, 6,15 ммоль, 0,05 экв.). Полученный раствор перемешивали в течение 2 часов при 75oC на масляной бане. Реакционную смесь охлаждали. Полученную смесь упаривали в вакууме. Остаток растворяли в 100 мл эфира. Твердый осадок отфильтровывали. Твердую фазу растворяли в 10 мл H2O и 500 мл ТГФ. Значение pH раствора доводили до 4-5 добавлением раствора хлороводорода (12 моль/л). Твердый осадок отфильтровывали. Фильтрат сушили над безводным сульфатом натрия и упаривали в вакууме. В результате получали 28 г (92%) (2R)-3-[4-(3,6-дигидро-2H-пиран-4-ил)фенил]-2-гидроксипропановой кислоты в виде светло-коричневого твердого вещества. MS (ES, m/z): 249(M+H).

Бензил (2R)-3-[4-(3,6-дигидро-2H-пиран-4-ил)фенил]-2-гидроксипропаноат (M30). В 500-миллилитровую круглодонную колбу помещали толуол (300 мл), (2R)3-[4-(3,6-дигидро-2H-пиран-4-ил)фенил]-2-гидроксипропановую кислоту (9 г, 36,25 ммоль, 1,00 экв.), фенилметанол (10,3 г, 95,25 ммоль, 2,50 экв.), TsOH (2 г, 11,61 ммоль, 0,30 экв.), 4А молекулярные сита (5,4 г). Полученный раствор перемешивали в течение 40 минут при 110oC на масляной бане. Реакционную смесь охлаждали. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:10-1:3). В результате получали 24 г (98%) бензил (2R)-3-[4-(3,6-дигидро-2H-пиран-4-ил)фенил]-2-гидроксипропаноата в виде белого твердого вещества. MS (ES, m/z): 339 (M+H);1H ЯМР (300 МГц, CDCl3): δ 7,62-7,30 (м, 7H), 7,13 (д, J=8,4 Гц, 2H), 6,12-6,10 (м, 1H), 5,24 (с, 2H), 4,52-4,48 (м, 1H), 4,35-4,32 (м, 2H), 3,96-3,92 (м, 2H), 3,16-2,95 (м, 2H), 2,67-2,49 (м, 2H).
Пример синтеза 20. Получение мономера M33.
Мономер M33 получали способом, показанным на схеме 20 ниже.
Схема 20



Подробное описание эксперимента

трет-бутил (2S)-3-(4-бром-3-фторфенил)-2-[(дифенилметилиден)амино]пропаноат. В 1000-миллилитровую 3-горлую круглодонную колбу помещали трет-бутил 2-[(дифенилметилиден)амино]ацетат (30 г, 101,57 ммоль, 1,00 экв.), толуол (315 мл), раствор 1-бром-4-(бромметил)-2-фторбензола (54 г, 201,55 ммоль, 1,98 экв.) в хлороформе (135 мл), O-аллил-N-(9-антраценилметил)цинхонидиния бромид (1,1 г, 2,09 ммоль, 0,02 экв.), гидроксид калия (56 г, 998,04 ммоль, 9,83 экв.). Полученный раствор перемешивали в течение 3 дней при -20oC. Полученный раствор разбавляли 1000 мл этилацетата. Смесь промывали 3x1000 мл H2O. Органический слой сушили над сульфатом натрия. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. Остаток наносили на С18 обращенно-фазную колонку с H2O/ACN (1/9). В результате получали 28 г (57%) трет-бутил (2S)-3-(4-бром-3-фторфенил)-2-[(дифенилметилиден)амино]пропаноата в виде светло-желтого масла. MS (ES, m/z): 482 (M+H).

трет-бутил (2S)-2-амино-3-(4-бром-3-фторфенил)пропаноат. В 2-литровую 3-горлую круглодонную колбу помещали трет-бутил (2S)-3-(4-бром-3-фторфенил)-2-[(дифенилметилиден)амино]пропаноат (28 г, 58,04 ммоль, 1,00 экв.), тетрагидрофуран (580 мл), лимонную кислоту (580 мл). Полученный раствор перемешивали в течение 4 часов при комнатной температуре. Смесь упаривали в вакууме. Полученный раствор разбавляли 1000 мл воды. Раствор экстрагировали 3x200 мл эфира и водные слои объединяли. Значение рН водного слоя доводили до 8 добавлением бикарбоната натрия и экстрагировали 3x300 мл этилацетата. Органические слои объединяли, сушили над сульфатом натрия и упаривали в вакууме. В результате получали 14,8 г (80%) трет-бутил (2S)-2-амино-3-(4-бром-3-фторфенил)пропаноата в виде светло-желтого масла. MS (ES, m/z): 318 (M+H).

(2S)-2-амино-3-(4-бром-3-фторфенил)пропановая кислота. В 500-миллилитровую круглодонную колбу помещали трет-бутил (2S)-2-амино-3-(4-бром-3-фторфенил)пропаноат (5,9 г, 18,54 ммоль, 1,00 экв.), дихлорметан (200 мл), трифторуксусную кислоту (21 г, 185,77 ммоль, 10,02 экв.). Полученный раствор перемешивали в течение 3 дней при комнатной температуре. Полученную смесь упаривали в вакууме. Остаток наносили на С18 обращенно-фазную колонку с H2O/ACN (1/3). В результате получали 5,4 г (сырой продукт) (2S)-2-амино-3-(4-бром-3-фторфенил)пропановой кислоты в виде белого твердого вещества. MS (ES, m/z): 262 (M+H).

(2S)-3-(4-бром-3-фторфенил)-2-гидроксипропановая кислота. В 500-миллилитровую 3-горлую круглодонную колбу помещали (2S)-2-амино-3-(4-бром-3-фторфенил)пропановую кислоту (5,4 г, 20,60 ммоль, 1,00 экв.), трифторуксусную кислоту (28,3 г, 250,35 ммоль, 12,15 экв.), воду (180 мл) и медленно добавляли раствор NaNO2 (17,1 г, 247,83 ммоль, 12,03 экв.) в воде (180 мл). Полученный раствор перемешивали в течение 16 часов при комнатной температуре. Твердый осадок отделяли фильтрованием. В результате получали 3,1 г (57%) (2S)-3-(4-бром-3-фторфенил)-2-гидроксипропановой кислоты в виде светло-желтого твердого вещества.

(2S)-3-[4-(3,6-дигидро-2H-пиран-4-ил)-3-фторфенил]-2-гидроксипропановая кислота. В 500-миллилитровую 3-горлую круглодонную колбу в инертной атмосфере азота помещали (2S)-3-(4-бром-3-фторфенил)-2-гидроксипропановую кислоту (3 г, 11,40 ммоль, 1,00 экв.), 2-(3,6-дигидро-2H-пиран-4-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (4,8 г, 22,85 ммоль, 2,00 экв.), K3PO4 (7,28 г, 34,30 ммоль, 3,01 экв.), диоксан (180 мл), воду (18 мл), Pd(dppf)Cl2 (1,67 г, 2,28 ммоль, 0,20 экв.). Полученный раствор перемешивали в течение 5 часов при 80oC. Полученную смесь упаривали в вакууме. Полученную смесь разбавляли 900 мл эфира. Твердый осадок отделяли фильтрованием. Твердую фазу растворяли в 200 мл тетрагидрофурана. Значение pH раствора доводили до 3-4 добавлением раствора хлороводорода. Выпавший осадок отфильтровывали. Фильтрат упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1/10). В результате получали 2,63 г (87%) (2S)-3-[4-(3,6-дигидро-2H-пиран-4-ил)-3-фторфенил]-2-гидроксипропановой кислоты в виде коричневого твердого вещества. MS (ES, m/z): 265 (M-H).
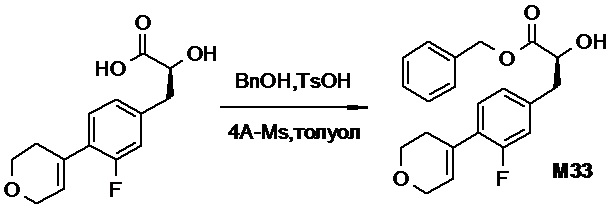
Бензил(2S)-3-[4-(3,6-дигидро-2H-пиран-4-ил)-3-фторфенил]-2-гидроксипропаноат (M33). В 100-миллилитровую круглодонную колбу помещали (2S)-3-[4-(3,6-дигидро-2H-пиран-4-ил)-3-фторфенил]-2-гидроксипропановую кислоту (1 г, 3,76 ммоль, 1,00 экв.), BnOH (1,1 г), TsOH (160 мг, 0,93 ммоль, 0,25 экв.), 4А молекулярные сита (1 г), толуол (20 мл). Полученный раствор перемешивали в течение 4 часов при 110oC. Полученную смесь упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1/4). В результате получали 350 мг (26%) бензил (2S)-3-[4-(3,6-дигидро-2H-пиран-4-ил)-3-фторфенил]-2-гидроксипропаноата в виде коричневого масла.1H ЯМР (300 МГц, CD3OD): δ 7,37-7,29 (м, 5H), 7,20-7,15 (м, 1H), 6,97-6,92 (м, 2H), 6,02 (ушир, 1H), 5,19 (с, 2H), 4,44-4,40 (м, 1H), 4,30-4,27 (м, 2H), 3,92-3,885 (м, 2H), 3,33-2,90 (м, 2H), 2,47-2,46 (м, 2H).
Пример синтеза 21. Получение мономера M34.
Мономер M34 получали способом, показанным на схеме 21 ниже.
Схема 21

Подробное описание эксперимента

(2S)-3-[4-(циклогекс-1-ен-1-ил)-3-фторфенил]-2-гидроксипропановая кислота. В 50-миллилитровую круглодонную колбу в инертной атмосфере азота помещали смесь диоксан/H2O (20/2 мл), (2S)-3-(4-бром-3-фторфенил)-2-гидроксипропановую кислоту (830 мг, 3,16 ммоль, 1,00 экв.), 2-(циклогекс-1-ен-1-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (790 мг, 3,80 ммоль, 1,20 экв.), Pd(dppf)Cl2 (115 мг, 0,16 ммоль, 0,05 экв.), K3PO4 (2 г, 9,42 ммоль, 3,00 экв.). Полученный раствор перемешивали в течение 1 часа при 80oC на масляной бане. Реакционную смесь охлаждали. Полученную смесь упаривали в вакууме. Остаток растворяли в 20 мл эфира. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. Остаток растворяли в 20 мл ТГФ. Значение pH раствора доводили до 4 добавлением раствора хлороводорода (12 моль/л). Твердый осадок отфильтровывали. Фильтрат сушили над безводным сульфатом натрия и упаривали в вакууме. В результате получали 1 г (2S)-3-[4-(циклогекс-1-ен-1-ил)-3-фторфенил]-2-гидроксипропановой кислоты в виде коричневого твердого вещества. MS (ES, m/z): 263 (M-H).

Бензил (2S)-3-[4-(циклогекс-1-ен-1-ил)-3-фторфенил]-2-гидроксипропаноат (M34). В 100-миллилитровую круглодонную колбу помещали толуол (40 мл), (2S)-3-[4-(циклогекс-1-ен-1-ил)-3-фторфенил]-2-гидроксипропановую кислоту (1 г, 3,78 ммоль, 1,00 экв.), BnOH (0,8 г, 2,00 экв.), TsOH (130 мг, 0,75 ммоль, 0,20 экв.), 4А молекулярные сита (0,3 г). Полученный раствор перемешивали в течение 2 часов при 110oC на масляной бане. Реакционную смесь охлаждали. Полученную смесь упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:20-1:10). В результате получали 730 г (сырой продукт) бензил (2S)-3-[4-(циклогекс-1-ен-1-ил)-3-фторфенил]-2-гидроксипропаноата в виде бесцветного масла. MS (ES, m/z): 355 (M+H);1H ЯМР (300 МГц, CDCl3): δ 7,41-7,33 (м, 5H), 7,14-7,08 (м, 1H), 6,88-6,83 (м, 2H), 5,92 (м, 1H), 5,25 (с, 2H), 4,45-4,47 (м, 1H), 3,13-2,91 (м, 2H), 2,35 (ушир, 2H), 2,22 (ушир, 2H), 1,87-1,58 (м, 4H).
Пример синтеза 22. Получение мономера M35.
Мономер M35 получали способом, показанным на схеме 22 ниже.
Схема 22
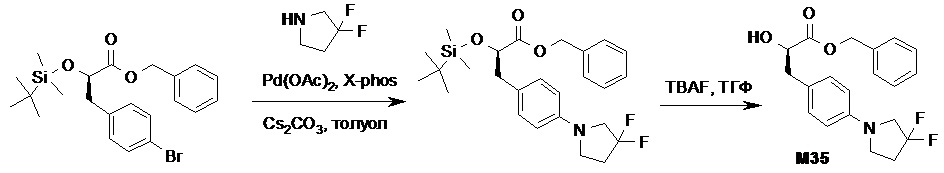
Подробное описание эксперимента

Бензил (2R)-2-[(трет-бутилдиметилсилил)окси]-3-[4-(3,3-дифторпирролидин-1-ил)фенил]пропаноат. В 250-миллилитровую круглодонную колбу в инертной атмосфере азота помещали бензил (2R)-3-(4-бромфенил)-2-[(трет-бутилдиметилсилил)окси]пропаноат (5 г, 11,12 ммоль, 1,00 экв.), толуол (100 мл), 3,3-дифторпирролидин гидрохлорид (4,7 г, 32,74 ммоль, 3,00 экв.), X-Phos (2,1 г, 0,40 экв.), Pd(OAc)2 (500 мг, 2,23 ммоль, 0,20 экв.), Cs2CO3 (14,3 г, 43,89 ммоль, 4,00 экв.). Полученный раствор перемешивали в течение ночи при 90oC. Твердый осадок отфильтровывали. Полученную смесь упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/ петролейный эфир (1:30). В результате получали 4,2 г (79%) бензил (2R)-2-[(трет-бутилдиметилсилил)окси]-3-[4-(3,3-дифторпирролидин-1-ил)фенил]пропаноата в виде желтого масла. MS (ES, m/z): 476 (M+H);1H ЯМР (CDCl3, 300 МГц) δ: 7,37-7,30 (м, 5 H), 7,10 (д, J=4,4 Гц, 2 H), 6,50 (д, J=4,2 Гц, 2 H), 5,20-5,10 (м, 2 H), 4,38-4,33 (м, 1 H), 3,66 (т, J=13,2 Гц, 2 H), 3,51 (т, J=6,9 Гц, 2 H), 3,04-2,98 (м, 1 H), 2,90-2,83 (м, 1 H), 2,58-2,46 (м, 2 H), 0,79 (с, 9 H), -0,10 (с, 3 H), -0,15 (с, 3 H).

Бензил (2R)-3-[4-(3,3-дифторпирролидин-1-ил)фенил]-2-гидроксипропаноат (M35). В 250-миллилитровую 3-горлую круглодонную колбу помещали бензил (2R)-2-[(трет-бутилдиметилсилил)окси]-3-[4-(3,3-дифторпирролидин-1-ил)фенил]пропаноат (4,2 г, 8,83 ммоль, 1,00 экв.), тетрагидрофуран (80 мл). Затем добавляли TBAF (4,6 г, 17,59 ммоль, 2,00 экв.) по каплям при перемешивании при 0oC. Полученный раствор перемешивали в течение 30 минут при комнатной температуре. Затем реакцию гасили добавлением 100 мл смеси вода/лед. Полученный раствор экстрагировали 3x100 мл этилацетата, и органические слои объединяли. Органическую фазу промывали 3x50 мл насыщенного раствора хлорида натрия. Органическую фазу сушили над безводным сульфатом натрия и упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:15). В результате получали 2,5 г (78%) бензил (2R)-3-[4-(3,3-дифторпирролидин-1-ил)фенил]-2-гидроксипропаноата в виде желтого масла. MS (ES, m/z): 362 (M+H);1H ЯМР (ДМСО, 300 МГц) δ: 7,38-7,24 (м, 5 H), 7,04 (д, J=4,0 Гц, 2 H), 6,51 (д, J=4,4 Гц, 2 H), 5,54-5,52 (м, 1 H), 5,08 (с, 2H), 4,25-4,19 (м, 1 H), 3,64 (т, J=13,5 Гц, 2 H), 3,42 (т, J=6,9 Гц, 2 H), 2,90-2,74 (м, 2 H), 2,58-2,44 (м, 2 H).
Пример синтеза 23. Получение мономера M45.
Мономер M45 получали способом, показанным на схеме 23 ниже.
Схема 23


Подробное описание эксперимента

Метил (2R)-2-[[(трет-бутокси)карбонил]амино]-3-[5-(трифторметил)пиридин-2-ил] пропаноат. В 500-миллилитровую 3-горлую круглодонную колбу в инертной атмосфере азота помещали Zn (1,35 г), N,N-диметилформамид (100 мл). Затем добавляли I2 (188,1 мг) в несколько приемов при 50oC в течение 10 минут. Затем добавляли метил (2S)-2-[[(трет-бутокси)карбонил]амино]-3-иодпропаноат (6 г, 18,23 ммоль, 1,00 экв.) в несколько приемов при 0oC в течение 30 минут. В смесь добавляли 2-бром-5-(трифторметил)пиридин (3,3 г, 14,60 ммоль, 0,80 экв.) в несколько приемов при 0oC. В смесь добавляли Pd(PPh3)2Cl2 (1,04 г, 1,48 ммоль, 0,08 экв.) в несколько приемов при 0oC. Полученный раствор перемешивали в течение 5 часов при 50oC. Реакционную смесь охлаждали. Твердый осадок отфильтровывали. Полученный раствор разбавляли добавлением 50 мл H2O. Полученный раствор экстрагировали 3x100 мл этилацетата, и органические слои объединяли. Органическую фазу промывали 6x100 мл насыщенного раствора хлорида натрия. Органическую фазу сушили над безводным сульфатом натрия и упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:4). Собранные фракции объединяли и упаривали в вакууме. В результате получали 5 г (79%) метил (2R)-2-[[(трет-бутокси)карбонил]амино]-3-[5-(трифторметил)пиридин-2-ил]пропаноата в виде желтого масла. MS (ES, m/z): 349 (M+H);1H ЯМР (CDCl3, 300 МГц) δ: 8,80 (с, 1 H), 7,89-7,86 (м, 1 H), 7,32 (д, J=4,5 Гц, 1 H), 5,80-5,60 (м, 1 H), 4,77-4,75 (м, 1 H), 3,73 (с, 3 H), 3,42-3,41 (м, 2 H), 1,43 (с, 9 H).

(2R)-2-[[(трет-бутокси)карбонил]амино]-3-[5-(трифторметил)пиридин-2-ил] пропановая кислота. В 250-миллилитровую круглодонную колбу помещали метил (2R)-2-[[(трет-бутокси)карбонил]амино]-3-[5-(трифторметил)пиридин-2-ил]пропаноат (5 г, 14,35 ммоль, 1,00 экв.), метанол (60 мл), добавляли раствор гидроксида натрия (1,7 г, 42,50 ммоль, 2,96 экв.) в воде (15 мл). Полученный раствор перемешивали в течение 12 часов при 25oC. Полученную смесь упаривали в вакууме. Полученный раствор разбавляли 10 мл H2O. Значение pH раствора доводили до 6 с помощью серной кислоты (1 моль/л). Полученный раствор экстрагировали 3x50 мл этилацетата, и органические слои объединяли. Органическую фазу промывали 3x100 мл насыщенного раствора хлорида натрия. Органическую фазу сушили над безводным сульфатом натрия и упаривали в вакууме. В результате получали 4,2 г (88%) (2R)-2-[[(трет-бутокси)карбонил]амино]-3-[5-(трифторметил)пиридин-2-ил]пропановой кислоты в виде желтого масла. MS (ES, m/z): 335 (M+H).

(2R)-2-амино-3-[5-(трифторметил)пиридин-2-ил]пропановая кислота. В 100-миллилитровую круглодонную колбу помещали (2R)-2-[[(трет-бутокси)карбонил]амино]-3-[5-(трифторметил)пиридин-2-ил]пропановую кислоту (3 г, 8,97 ммоль, 1,00 экв.), дихлорметан (30 мл), трифторуксусную кислоту (6 мл). Полученный раствор перемешивали в течение 2 часов при 25oC. Полученную смесь упаривали в вакууме. В результате получали 4 г (сырой продукт) соли (2R)-2-амино-3-[5-(трифторметил)пиридин-2-ил]пропановой кислоты с трифторуксусной кислотой в виде коричневого масла. MS: (ES, m/z): 235 (M+H);1H ЯМР (ДМСО, 300 МГц) δ: 8,89 (с, 1 H), 8,22-8,21 (ушир.с, 3 H), 8,19-8,18 (м, 1 H), 7,65-7,54 (м, 1 H), 4,46 (ушир.с, 1 H), 3,50-3,35 (м, 2 H).

(2R)-2-гидрокси-3-[5-(трифторметил)пиридин-2-ил]пропановая кислота. В 250-миллилитровую круглодонную колбу помещали воду (76 мл). Затем добавляли серную кислоту (7,5 г, 76,47 ммоль, 6,34 экв.) по каплям при перемешивании при 0oC. Затем добавляли соль (2R)-2-амино-3-[5-(трифторметил)пиридин-2-ил]пропановой кислоты с трифторуксусной кислотой (4,2 г, 12,06 ммоль, 1,00 экв.), NaNO2 (1,75 г, 25,36 ммоль, 2,10 экв.). Полученный раствор перемешивали в течение 12 часов при 25oC. Полученный раствор экстрагировали 5x100 мл этилацетата, и органические слои объединяли. Органическую фазу промывали 3x100 мл насыщенного раствора хлорида натрия. Органическую фазу сушили над безводным сульфатом натрия и упаривали в вакууме. В результате получали 2,5 г (88%) (2R)-2-гидрокси-3-[5-(трифторметил)пиридин-2-ил]пропановой кислоты в виде желтого масла. MS (ES, m/z): 236 (M+H).

Бензил-(2R)-2-гидрокси-3-[5-(трифторметил)пиридин-2-ил]пропаноат (M45). В 250-миллилитровую круглодонную колбу помещали (2R)-2-гидрокси-3-[5-(трифторметил)пиридин-2-ил]пропановую кислоту (2 г, 8,50 ммоль, 1,00 экв.), N,N-диметилформамид (100 мл), Cs2CO3 (13,87 г, 42,57 ммоль, 5,01 экв.). Затем добавляли (бромметил)бензол (2,89 г, 16,90 ммоль, 1,99 экв.) по каплям при 0oC в течение 10 минут. Полученный раствор перемешивали в течение 12 часов при 25oC. Твердый осадок отфильтровывали. Полученный раствор разбавляли 100 мл H2O. Полученный раствор экстрагировали 3x100 мл этилацетата, и органические слои объединяли. Полученную смесь промывали 6x100 мл насыщенного раствора хлорида натрия. Смесь сушили над безводным сульфатом натрия и упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:4). Собранные фракции объединяли и упаривали в вакууме. В результате получали 1,9 г (69%) бензил (2R)-2-гидрокси-3-[5-(трифторметил)пиридин-2-ил]пропаноата в виде светло-желтого масла. MS (ES, m/z): 326 (M+H);1H ЯМР (ДМСО, 300 МГц) δ: 8,85 (д, J=5,3 Гц, 1 H), 8,10-8,07 (м, 1 H), 7,54-7,50 (м, 1 H), 7,38-7,29 (м, 5 H), 5,74-5,65 (м, 1 H), 5,12 (с, 2 H), 4,61-4,54 (м, 1 H), 3,25-3,11 (м, 2 H).
Пример синтеза 24. Получение мономера M46.
Мономер M46 получали способом, показанным на схеме 24 ниже.
Схема 24

Подробное описание эксперимента

Метил 4-(5-бромпиридин-2-ил)оксан-4-карбоксилат. В 1000-миллилитровую 3-горлую круглодонную колбу помещали тетрагидрофуран (300 мл), 5-бром-2-фторпиридин (13 г, 73,87 ммоль, 1,00 экв.), метил оксан-4-карбоксилат (17 г, 117,92 ммоль, 1,60 экв.). Затем добавляли KHMDS (300 мл) по каплям при перемешивании при -30oC. Полученный раствор перемешивали в течение 3 часов при комнатной температуре. Затем реакцию гасили добавлением 100 мл NH4Cl. Полученный раствор экстрагировали 3x120 мл этилацетата, органические слои объединяли и сушили над безводным сульфатом натрия и упаривали в вакууме. В результате получали 22 г (99%) метил 4-(5-бромпиридин-2-ил)оксан-4-карбоксилата в виде твердого вещества. MS (ES, m/z): 301 (M+H).
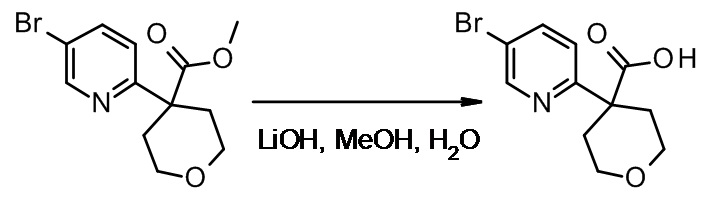
4-(5-бромпиридин-2-ил)оксан-4-карбоновая кислота. В 50-миллилитровую круглодонную колбу помещали метанол (5 мл), воду (1 мл), метил 4-(5-бромпиридин-2-ил)оксан-4-карбоксилат (500 мг, 1,67 ммоль, 1,00 экв.), LiOH (80 мг, 3,34 ммоль, 2,01 экв.). Полученный раствор перемешивали в течение 3 часов при комнатной температуре. Полученную смесь упаривали в вакууме. В результате получали 420 мг (88%) 4-(5-бромпиридин-2-ил)оксан-4-карбоновой кислоты в виде желтого твердого вещества. MS (ES, m/z): 287 (M+H).

5-Бром-2-(оксан-4-ил)пиридин. В 1000-миллилитровую круглодонную колбу помещали ДМСО (200 мл), 4-(5-бромпиридин-2-ил)оксан-4-карбоновую кислоту (20 г, 69,90 ммоль, 1,00 экв.), воду (60 мл), хлорид натрия (16 г). Полученный раствор перемешивали в течение 3 часов при 150oC. Полученный раствор разбавляли добавлением 500 мл смеси вода/лед. Полученный раствор экстрагировали 3x300 мл этилацетата, органические слои объединяли и сушили над безводным сульфатом натрия и упаривали в вакууме. В результате получали 10 г (59%) 5-бром-2-(оксан-4-ил)пиридина в виде желтого твердого вещества. MS (ES, m/z): 243 (M+H).

Метил-(2S)-2-[[(трет-бутокси)карбонил]амино]-3-[6-(оксан-4-ил)пиридин-3-ил] пропаноат. В 250-миллилитровую 3-горлую круглодонную колбу помещали N,N-диметилформамид (40 мл), Zn (26 г), I2 (4 г), метил (2S)-2-[[(трет-бутокси)карбонил]амино]-3-иодпропаноат (10 г, 30,38 ммоль, 1,00 экв.), Pd(PPh3)2Cl2 (1,6 г, 2,28 ммоль, 0,08 экв.), 5-бром-2-(оксан-4-ил)пиридин (17 г, 70,22 ммоль, 2,31 экв.). Полученный раствор перемешивали в течение ночи при 50oC. Твердый осадок отфильтровывали. Полученный раствор экстрагировали 3x50 мл этилацетата, и органические слои объединяли и сушили над безводным сульфатом натрия и упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (3:1). В результате получали 4 г (36%) метил (2S)-2-[[(трет-бутокси)карбонил]амино]-3-[6-(оксан-4-ил)пиридин-3-ил]пропаноата в виде желтого масла. MS (ES, m/z): 365 (M+H).

(2S)-2-[[(трет-бутокси)карбонил]амино]-3-[6-(оксан-4-ил)пиридин-3-ил]пропановая кислота. В 50-миллилитровую круглодонную колбу помещали воду (2 мл), метанол (10 мл), LiOH (420 мг, 17,54 ммоль, 3,20 экв.), метил (2S)-2-[[(трет-бутокси)карбонил]амино]-3-[6-(оксан-4-ил)пиридин-3-ил]пропаноат (2 г, 5,49 ммоль, 1,00 экв.). Полученный раствор перемешивали в течение 3 часов при комнатной температуре. Полученную смесь упаривали в вакууме. В результате получали 1,5 г (78%) (2S)-2-[[(трет-бутокси)карбонил]амино]-3-[6-(оксан-4-ил)пиридин-3-ил]пропановой кислоты в виде желтого твердого вещества. MS (ES, m/z): 351 (M+H).

(2S)-2-амино-3-[6-(оксан-4-ил)пиридин-3-ил]пропановая кислота. В 50-миллилитровую круглодонную колбу помещали дихлорметан (10 мл), (2S)-2-[[(трет-бутокси)карбонил]амино]-3-[6-(оксан-4-ил)пиридин-3-ил]пропановую кислоту (900 мг, 2,57 ммоль, 1,00 экв.), трифторуксусную кислоту (3 мл). Полученный раствор перемешивали в течение 3 часов при комнатной температуре. Полученную смесь упаривали в вакууме. В результате получали 700 мг (сырой продукт) (2S)-2-амино-3-[6-(оксан-4-ил)пиридин-3-ил]пропановой кислоты. MS (ES, m/z): 251 (M+H).

(2S)-2-гидрокси-3-[6-(оксан-4-ил)пиридин-3-ил]пропановая кислота. В 100-миллилитровую круглодонную колбу помещали воду (20 мг), трифторуксусную кислоту (1,6г, 14,15 ммоль, 5,90 экв.), (2S)-2-амино-3-[6-(оксан-4-ил)пиридин-3-ил]пропановую кислоту (600 мг, 2,40 ммоль, 1,00 экв.). Затем добавляли раствор NaNO2 (1 г, 14,49 ммоль, 6,05 экв.) в воде (10 мл) по каплям при перемешивании при 0oC. Полученный раствор перемешивали в течение ночи при комнатной температуре. Полученную смесь упаривали в вакууме. Остаток разводили в смеси ДХМ:MeOH (15:1, 50 мл). Полученное твердое вещество отфильтровывали. Фильтрат упаривали в вакууме. В результате получали 300 мг (50%) (2S)-2-гидрокси-3-[6-(оксан-4-ил)пиридин-3-ил]пропановой кислоты в виде желтого масла. MS (ES, m/z): 252 (M+H).

Бензил-(2S)-2-гидрокси-3-[6-(оксан-4-ил)пиридин-3-ил]пропаноат (M46). В 100-миллилитровую круглодонную колбу помещали N,N-диметилформамид (15 мл), (2S)-2-гидрокси-3-[6-(оксан-4-ил)пиридин-3-ил]пропановую кислоту (2 г, 7,96 ммоль, 1,00 экв.), Cs2CO3 (5 г, 15,35 ммоль, 1,93 экв.), BnBr (2,6 г, 15,20 ммоль, 1,91 экв.). Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Твердый осадок отфильтровывали. Полученный раствор экстрагировали 3x30 мл этилацетата, органические слои объединяли и сушили над безводным сульфатом натрия и упаривали в вакууме. В результате получали 2,7 г (99%) бензил (2S)-2-гидрокси-3-[6-(оксан-4-ил)пиридин-3-ил]пропаноата в виде желтого масла. MS (ES, m/z): 342 (M+H);1H ЯМР (300 МГц, CDCl3): δ 8,37 (д, J=2,1 Гц, 1H), 7,48-7,45 (м, 1H), 7,41-7,33 (м, 5H), 7,06 (д, J=8,1 Гц, 1H), 5,21 (с, 2H), 4,50-4,46 (м, 1H), 4,12-4,07 (м, 2H), 3,59-3,51 (м, 2H), 3,14-2,89 (м, 3H), 1,89-1,82 (м, 4H).
Пример синтеза 25. Получение мономера M47.
Мономер M47 получали способом, показанным на схеме 25 ниже.
Схема 25

Подробное описание эксперимента

(2R)-3-[4-(4,4-дифторциклогекс-1-ен-1-ил)фенил]-2-гидроксипропановая кислота. В 250-миллилитровую круглодонную колбу в инертной атмосфере азота помещали смесь диоксан/H2O (88 мл), (2R)-3-(4-бромфенил)-2-гидроксипропановую кислоту (4 г, 16,32 ммоль, 1,00 экв.), 2-(4,4-дифторциклогекс-1-ен-1-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (4,0 г, 16,39 ммоль, 1,00 экв.), Pd(dppf)Cl2 (640 мг, 0,87 ммоль, 0,05 экв.), K3PO4 (11 г, 51,82 ммоль, 3,00 экв.). Полученный раствор перемешивали в течение 4 часов при 80oC на масляной бане. Реакционную смесь охлаждали. Полученную смесь упаривали в вакууме. Остаток растворяли в 50 мл эфира. Твердый осадок отделяли фильтрованием. Твердую фазу растворяли в 50 мл ТГФ. Значение pH раствора доводили до 5 добавлением раствора хлороводорода (12 моль/л). Полученный раствор разбавляли 200 мл этилацетата. Твердый осадок отделяли фильтрованием. Фильтрат сушили над безводным сульфатом натрия и упаривали в вакууме. В результате получали 4,5 г (98%) (2R)-3-[4-(4,4-дифторциклогекс-1-ен-1-ил)фенил]-2-гидроксипропановой кислоты в виде светло-желтого масла. MS (ES, m/z): 281 (M-H).

Бензил-(2R)-3-[4-(4,4-дифторциклогекс-1-ен-1-ил)фенил]-2-гидроксипропаноат (M47). В 500-миллилитровую круглодонную колбу помещали толуол (200 мл), (2R)-3-[4-(4,4-дифторциклогекс-1-ен-1-ил)фенил]-2-гидроксипропановую кислоту (4,5 г, 15,94 ммоль, 1,00 экв.), BnOH (2,24 г, 1,30 экв.), TsOH (540 мг, 3,14 ммоль, 0,20 экв.), 4А молекулярные сита (2 г). Полученный раствор перемешивали в течение 4 часов при 110oC на масляной бане. Реакционную смесь охлаждали. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:20-1:10). В результате получали 5 г (84%) бензил (2R)-3-[4-(4,4-дифторциклогекс-1-ен-1-ил)фенил]-2-гидроксипропаноата в виде светло-желтого твердого вещества.1H ЯМР (300 МГц, CDCl3): δ 7,62-7,30 (м, 7H), 7,11 (д, J=8,4 Гц, 2H), 5,89 (ушир, 1H), 5,21 (с, 2H), 4,52-4,48 (м, 1H), 3,16-2,95 (м, 2H), 2,71-2,67 (м, 4H), 2,25-2,12 (м, 2H).
Пример синтеза 26. Получение мономера M48.
Мономер M48 получали способом, показанным на схеме 26 ниже.
Схема 26

Подробное описание эксперимента

4-(4-Бромнафталин-1-ил)морфолин. В 250-миллилитровую круглодонную колбу помещали 4-бромнафталин-1-амин (5 г, 22,51 ммоль, 1,00 экв.), 1-бром-2-(2-бромэтокси)этан(8 г, 34,50 ммоль, 1,53 экв.), N,N-диметилформамид (100 мл), карбонат калия (14 г, 101,30 ммоль, 4,50 экв.). Полученный раствор перемешивали в течение ночи при 110oC. Твердый осадок отфильтровывали. Полученный раствор гасили добавлением 200 мл воды, экстрагировали 2x50 мл этилацетата, и органические слои объединяли. Органическую фазу промывали 2x20 мл воды. Органическую фазу сушили над безводным сульфатом натрия и упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:5). В результате получали 3,5 г (53%) 4-(4-бромнафталин-1-ил)морфолина в виде коричневого масла. MS (ES, m/z): 292 (M+H);1H ЯМР (CDCl3, 300 МГц) δ: 8,29-8,25 (м, 2 H), 7,73 (д, J=4,0 Гц, 1 H), 7,64-7,59 (м, 2 H), 6,98 (д, J=4,0 Гц, 1 H), 4,00 (т, J=4,5 Гц, 4 H), 3,11 (т, J=4,5 Гц, 4 H).

Бензил (2E)-3-[4-(морфолин-4-ил)нафталин-1-ил]проп-2-еноат. В 250-миллилитровую круглодонную колбу в инертной атмосфере азота помещали 4-(4-бромнафталин-1-ил) морфолин (3 г, 10,27 ммоль, 1,00 экв.), бензил проп-2-еноат (2,0 г, 12,33 ммоль, 1,20 экв.), N,N-диметилформамид (100 мл), Bu4NCl (5,7 г, 20,51 ммоль, 2,00 экв.), бикарбонат натрия (4,3 г, 51,18 ммоль, 4,98 экв.), Pd(OAc)2 (230 мг, 1,02 ммоль, 0,10 экв.). Полученный раствор перемешивали в течение ночи при 110oC. Твердый осадок отфильтровывали. Полученный раствор гасили добавлением 200 мл воды, экстрагировали 2x50 мл этилацетата, и органические слои объединяли. Органическую фазу промывали 2x30 мл воды и 1x30 мл насыщенного раствора хлорида натрия. Органическую фазу сушили над безводным сульфатом натрия и упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:10). В результате получали 2,3 г (60%) бензил (2E)-3-[4-(морфолин-4-ил)нафталин-1-ил]проп-2-еноата в виде желтого масла. MS (ES, m/z): 374 (M+H).

Бензил (2R, 3S)-2,3-дигидрокси-3-[4-(морфолин-4-ил)нафталин-1-ил]пропаноат. В 250-миллилитровую круглодонную колбу помещали бензил (2E)-3-[4-(морфолин-4-ил)нафталин-1-ил]проп-2-еноат (2,1 г, 5,62 ммоль, 1,00 экв.), трет-бутанол (40 мл), воду (40 мл), метан-сульфонамид (600 мг, 6,31 ммоль, 1,12 экв.), AD-mix-α (8 г). Полученный раствор перемешивали в течение ночи при комнатной температуре. Затем реакцию гасили добавлением 11,5 г Na2SO3. Твердый осадок отфильтровывали. Полученный раствор разбавляли 200 мл воды, экстрагировали 2x50 мл этилацетата, и органические слои объединяли. Органическую фазу промывали 2x30 мл воды и 1x30 мл насыщенного раствора хлорида натрия. Органическую фазу сушили над безводным сульфатом натрия и упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:4). В результате получали 1,6 г (70%) бензил (2R, 3S)-2,3-дигидрокси-3-[4-(морфолин-4-ил)нафталин-1-ил]пропаноата в виде коричневого масла. MS (ES, m/z): 408 (M+H);1H ЯМР (CDCl3, 300 МГц) δ: 8,34-8,31 (м, 1 H), 8,06-8,03 (м, 1 H), 7,66 (д, J=3,9 Гц, 1 H), 7,58-7,52 (м, 2 H), 7,41-7,31 (м, 5 H), 7,13 (д, J=4,0 Гц, 1 H), 5,84 (ушир.с, 1 H), 5,34-5,21 (м, 2 H), 4,73 (ушир.с, 1 H), 4,63-4,60 (м, 1 H), 4,00 (т, J=4,5 Гц, 4 H), 3,80-3,66 (м, 1 H), 3,16-3,11 (м, 4 H).

Бензил (2R)-2-гидрокси-3-[4-(морфолин-4-ил)нафталин-1-ил]пропаноат. В 250-миллилитровую круглодонную колбу помещали бензил (2R, 3S)-2,3-дигидрокси-3-[4-(морфолин-4-ил)нафталин-1-ил]пропаноат (1,6 г, 3,93 ммоль, 1,00 экв.), дихлорметан (100 мл), Et3SiH (1,35 г, 11,61 ммоль, 2,96 экв.), трифторуксусную кислоту (1,3 г, 11,50 ммоль, 2,93 экв.). Полученный раствор перемешивали в течение ночи при комнатной температуре. Затем реакцию гасили добавлением 40 мл воды. Полученный раствор экстрагировали 2x50 мл дихлорметана, и органические слои объединяли. Органическую фазу промывали 3x30 мл насыщенного раствора хлорида натрия. Органическую фазу сушили над безводным сульфатом натрия и упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:5). В результате получали 600 мг (39%) бензил (2R)-2-гидрокси-3-[4-(морфолин-4-ил)нафталин-1-ил] пропаноата в виде желтого масла. MS (ES, m/z): 392 (M+H);1H ЯМР (CDCl3, 300 МГц) δ: 8,38-8,36 (м, 1 H), 8,11-8,08 (м, 1 H), 7,58-7,52 (м, 2 H), 7,40-7,28 (м, 6 H), 7,08 (д, J=3,8 Гц, 1 H), 5,24-5,14 (м, 2 H), 4,66-4,62 (м, 1 H), 4,07 (т, J=4,5 Гц, 4 H), 3,69-3,63 (м, 1 H), 3,37-3,29 (м, 1 H), 3,19-3,10 (м, 4 H).
Пример синтеза 27. Получение мономера M49.
Мономер M49 получали способом, показанным на схеме 27 ниже.
Схема 27
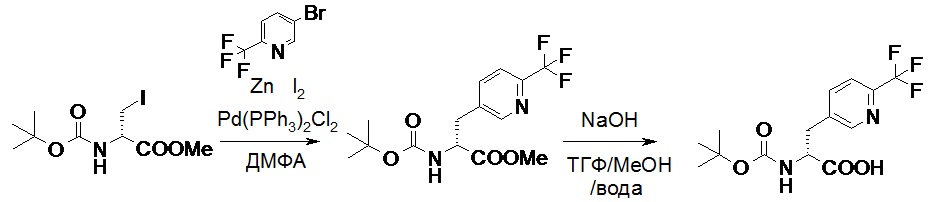

Подробное описание эксперимента

метил (2R)-2-(трет-бутоксикарбониламино)-3-[6-(трифторметил)-3-пиридил] пропаноат. В перемешиваемую смесь порошка цинка (0,7 г, 11 ммоль) и иода (0,1 г, 0,4 ммоль) в 5 мл ДМФА в атмосфере азота и при охлаждении до 00C добавляли по каплям раствор (S)-N-трет-бутоксикарбонил-бета-иодаланин метилового эфира (2,5 г, 7,6 ммоль) в 10 мл ДМФА, и полученную смесь перемешивали 30 минут. Затем в смесь добавляли 5-бром-2-трифторметилпиридин (1,7 г, 7,6 ммоль) и бис-трифенилфосфин-палладия(II) хлорид (0,26 г, 0,4 ммоль), и нагревали 5 часов при 500C. Затем смесь охлаждали до комнатной температуры, фильтровали через слой целита, фильтрат разбавляли добавлением 200 мл воды и экстрагировали 200 мл этилацетата. Органический слой промывали 100 мл 20%-ного раствора LiCl, промывали насыщенным раствором хлорида натрия, сушили над сульфатом натрия, фильтровали, упаривали, и остаток очищали на колонке с силикагелем, элюируя смесью этилацетат/гептан, получая целевое соединение в виде желтого масла. Выход: 1,4 г, 54%. MS (CI, m/z): 349 (M+H); 1H ЯМР (CDCl3):
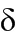
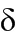

(2R)-2-(трет-бутоксикарбониламино)-3-[6-(трифторметил)-3-пиридил]пропановая кислота. В перемешиваемый раствор метил (2R)-2-(трет-бутоксикарбониламино)-3-[6-(трифторметил)-3-пиридил]пропаноата (1,4 г, 4,0 ммоль) в 15 мл смеси 2:1 метанол:ТГФ добавляли раствор гидроксида натрия (0,32 г, 8,1 ммоль) в 7 мл воды, и полученную смесь перемешивали 1 час. Смесь разбавляли 60 мл воды, подкисляли до pH 2 1M раствором HCl и экстрагировали 75 мл этилацетата. Органический слой промывали насыщенным раствором хлорида натрия, сушили над сульфатом натрия, фильтровали и упаривали, получая целевое соединение в виде прозрачного масла. Выход: 1,4 г (количественный). MS (CI, m/z): 335 (M+H).
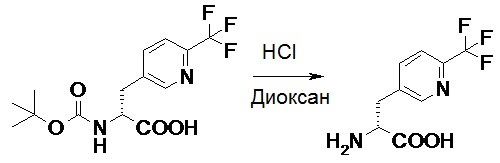
(2R)-2-амино-3-[6-(трифторметил)-3-пиридил]пропановой кислоты гидрохлорид. В 10 мл 4M раствора HCl в диоксане добавляли (2R)-2-(трет-бутоксикарбониламино)-3-[6-(трифторметил)-3-пиридил]пропановую кислоту (1,4 г, 4,0 ммоль), и смесь перемешивали 1 час. Смесь упаривали, и остаток сушили в высоком вакууме, получая целевое соединение в виде прозрачного масла. Выход: 1,1 г (количественный). MS (CI) m/z: (M+H)+ 235.

(2R)-2-гидрокси-3-[6-(трифторметил)-3-пиридил]пропановая кислота. В перемешиваемую смесь (2R)-2-амино-3-[6-(трифторметил)-3-пиридил]пропановой кислоты гидрохлорида (1,1 г, 4,0 ммоль) в 16 мл 0,5M раствора серной кислоты (8,0 ммоль), охлажденную до 00C, добавляли по каплям раствор нитрита натрия (1,7 г, 24 ммоль) в 6 мл воды, и смесь перемешивали 1 час. Смесь разбавляли добавлением 50 мл воды и экстрагировали 75 мл этилацетата. Органический слой промывали насыщенным раствором хлорида натрия, сушили над сульфатом натрия, ильтровали и упаривали, получая целевое соединение в виде желтого твердого вещества. Выход (0,90 г, 94%). MS (CI, m/z): 236 (M+H);1H ЯМР (CDCl3):
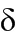

бензил (2R)-2-гидрокси-3-[6-(трифторметил)-3-пиридил]пропаноат (M49). В перемешиваемый раствор (2R)-2-гидрокси-3-[6-(трифторметил)-3-пиридил]пропановой кислоты (0,90 г, 3,8 ммоль) в 10 мл ДМФА добавляли карбонат цезия (1,2 г, 3,8 ммоль), и смесь перемешивали 30 минут. В смесь затем добавляли бензилбромид (0,65 г, 3,8 ммоль) и перемешивали в течение ночи. Смесь разбавляли 60 мл воды и экстрагировали 75 мл этилацетата. Органический слой промывали 50 мл 20%-ного раствора LiCl, промывали насыщенным раствором хлорида натрия, сушили над сульфатом натрия, фильтровали, упаривали, и остаток очищали на колонке с силикагелем, элюируя смесью этилацетат/гептан, получая целевое соединение в виде прозрачного масла. Выход: 0,57 г, 46%. MS (CI m/z): 326 (M+H);1H ЯМР (CDCl3):
В Примерах Синтеза 28-82, приведенных ниже, показано как получать различные димерные соединения из определенных описанных выше мономеров M1 - M49, которые применяли для получения соединений по настояему иобретению.
Пример синтеза 28. Получение димера D1.
Димер D1 получали по приведенной ниже реакции.

(2R)-1-(бензилокси)-1-оксо-3-[4-(трифторметил)фенил]пропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентаноат (D1). В 100-миллилитровую круглодонную колбу помещали (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентановую кислоту (200 мг, 0,82 ммоль, 1,00 экв.), бензил (2R)-2-гидрокси-3-[4-(трифторметил)фенил]пропаноат (152 мг, 0,47 ммоль, 1,00 экв.), дихлорметан (10 мл). Затем добавляли DCC (140 мг, 0,68 ммоль, 1,10 экв.), 4-диметиламинопиридин (83 мг, 0,68 ммоль, 1,10 экв.) и HOBT (116 мг, 0,86 ммоль, 1,10 экв.), соответственно, порциями при перемешивании при 0oC. Полученный раствор перемешивали в течение ночи при комнатной температуре. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/ петролейный эфир (1:20). В результате получали 159,3 мг (35%) (2R)1-(бензилокси)-1-оксо-3-[4-(трифторметил)фенил]пропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентаноата в виде светло-желтого твердого вещества. MS (ES, m/z): 552 (M+H);1H ЯМР (300 МГц, CDCl3): δ 7,52-7,47 (м, 2H), 7,36-7,34 (м, 3H), 7,26-7,24 (м, 4H), 5,32 -5,28 (м, 1H), 4,18-4,99 (м, 2H), 4,97-4,67 (м, 1H), 3,26-3,13 (м, 2H), 2,62 (д, J=21,9 Гц, 3H), 1,60-1,14 (м, 12H), 0,93 (д, J=12,0 Гц, 6H).
Пример синтеза 29. Получение димера D2.
Димер D2 получали по приведенной ниже реакции.

(2R)-1-(бензилокси)-1-оксо-3-[4-(трифторметил)фенил]пропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноат (D2). В 1000-миллилитровую 3-горлую круглодонную колбу в инертной атмосфере азота помещали раствор (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентановой кислоты (15 г, 56,97 ммоль, 1,00 экв.) в дихлорметане (400 мл), бензил (2R)2-гидрокси-3-[4-(трифторметил)фенил]пропаноат (12 г, 37,00 ммоль, 1,00 экв.). Затем добавляли HOBT (7,5 г, 55,51 ммоль, 1,20 экв.), DCC (11 г, 53,31 ммоль, 1,20 экв.) и 4-диметиламинопиридин (6,8 г, 55,66 ммоль, 1,20 экв.) порциями при перемешивании при 0oC. Полученный раствор перемешивали в течение ночи при комнатной температуре. Полученную смесь упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:10). В результате получали 21 г (65%) (2R)-1-(бензилокси)-1-оксо-3-[4-(трифторметил)фенил]пропан-2-ил (2S)-2-[[(трет-бутокси)карбонил](метил) амино]-4-фтор-4-метилпентаноата в виде красного масла. MS (ES, m/z): 570 (M+H).
Пример синтеза 30. Получение димера D3.
Димер D3 получали по приведенной ниже реакции.
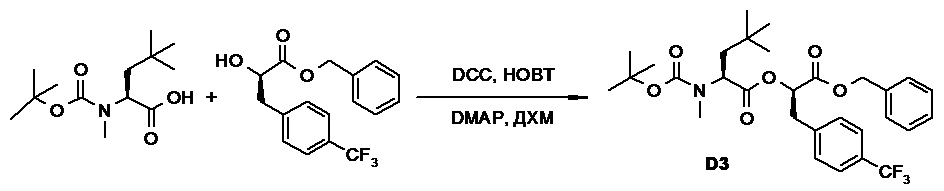
(2R)-1-(бензилокси)-1-оксо-3-[4-(трифторметил)фенил]пропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4,4-диметилпентаноат (D3). В 50-миллилитровую 3-горлую круглодонную колбу помещали (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4,4-диметилпентановую кислоту (4 г, 15,42 ммоль, 1,00 экв.), бензил (2R)-2-гидрокси-3-[4-(трифторметил)фенил]пропаноат (5 г, 15,42 ммоль, 1,00 экв.), дихлорметан (40 мл). После этого добавляли DCC (4,1 г, 1,30 экв.), HOBT (2,7 г, 1,30 экв.) и 4-диметиламинопиридин (2,5 г, 1,30 экв.) порциями при перемешивании при 0oC. Полученный раствор перемешивали в течение 14 часов при комнатной температуре. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:50). В результате получали 6 г (69%) (2R)-1-(бензилокси)-1-оксо-3-[4-(трифторметил)фенил]пропан-2-ил-(2S)-2-[[(трет-бутокси) карбонил](метил)амино]-4,4-диметилпентаноата в виде белого твердого вещества. MS (ES, m/z): 566 (M+H);1H ЯМР (300 МГц, ДМСО): δ 7,61-7,59 (м, 2H), 7,45-7,42 (м, 2H), 7,37-7,35 (м, 3H), 7,29 (ушир, 2H), 5,41-5,35 (м, 1H), 5,13 (с, 2H), 4,90-4,85 (м, 0,5H), 4,59 (ушир, 0,5H), 3,32-3,15 (м, 2H), 2,55-2,50 (м, 3H), 1,51-1,46 (м, 2H), 1,37 (д, J=21,0 Гц, 9H), 0,83 (с, 9H).
Пример синтеза 31. Получение димера D4.
Димер D4 получали по реакции, приведенной ниже.

(2R)-1-(бензилокси)-3-(4-фторфенил)-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси) карбонил](метил)амино]-4-метилпентаноат (D4). В 250-миллилитровую 3-горлую круглодонную колбу помещали бензил (2R)3-(4-фторфенил)-2-гидроксипропаноат (1,5 г, 5,47 ммоль, 1,00 экв.), (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентановую кислоту (1,5 г, 6,11 ммоль, 1,10 экв.), дихлорметан (80 мл). Затем добавляли DCC (1,2 г, 5,82 ммоль, 1,10 экв.), HOBT (0,8 г, 1,10 экв.) и 4-диметиламинопиридин (0,7 г, 1,10 экв.) порциями при перемешивании при 0oC. Полученный раствор перемешивали в течение 13 часов при комнатной температуре. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:10). В результате получали 1,5 г (55%) (2R)-1-(бензилокси)-3-(4-фторфенил)-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентаноата в виде белого твердого вещества. MS (ES, m/z): 502 (M+H);1H ЯМР (300 МГц, ДМСО): δ 7,41-7,21 (м, 7H), 7,09-7,03 (м, 2H), 5,31-5,29 (м, 1H), 5,13 (с, 2H), 4,82-4,78 (м, 0,5H), 4,58-4,54 (м, 0,5H), 3,19-3,05 (м, 2H), 2,56 (с, 3H), 1,52-1,23 (м, 12H), 0,90-0,79 (ушир, 6H).
Пример синтеза 32. Получение димера D5.
Димер D5 получали по реакции, приведенной ниже.

(2R)-1-(бензилокси)-3-(4-фторфенил)-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси) карбонил] (метил)амино]-4-фтор-4-метилпентаноат (D5). В 100-миллилитровую 3-горлую круглодонную колбу в инертной атмосфере азота помещали дихлорметан (60 мл), (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентановую кислоту (2,8 г, 10,63 ммоль, 1,00 экв.), бензил (2R)3-(4-фторфенил)-2-гидроксипропаноат (2,9 г, 10,57 ммоль, 1,00 экв.). Затем добавляли DCC (2,4 г, 88,75 ммоль, 1,10 экв.), 4-диметиламинопиридин (1,4 г, 11,46 ммоль, 1,10 экв.) и HOBT (1,58 г, 49,62 ммоль, 1,10 экв.) порциями при 0oC. Полученный раствор перемешивали в течение ночи при комнатной температуре. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/ петролейный эфир (1:100-1:50). В результате получали 3,8 г (сырой продукт) (2R)-1-(бензилокси)-3-(4-фторфенил)-1-оксопропан-2-ил (2S)-2-[[(трет-бутокси)карбонил](метил) амино]-4-фтор-4-метилпентаноата в виде желтого твердого вещества. MS (ES, m/z): 520 (M+H).
Пример синтеза 33. Получение димера D6.
Димер D6 получали по реакции, приведенной ниже.

(2R)-1-(бензилокси)-3-(4-фторфенил)-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси) карбонил](метил)амино]-4,4-диметилпентаноат (D6). В 100-миллилитровую круглодонную колбу помещали дихлорметан (20 мл), бензил (2R)3-(4-фторфенил)-2-гидроксипропаноат (2 г, 7,29 ммоль, 1,00 экв.), (2S)-2-[[(трет-бутокси)карбонил] (метил)амино]-4,4-диметилпентановую кислоту (2 г, 7,71 ммоль, 1,06 экв.). Затем добавляли DCC (4,6 г, 22,29 ммоль, 3,06 экв.), 4-диметиламинопиридин (2,2 г, 18,01 ммоль, 2,47 экв.) и HOBT (2,4 г, 17,76 ммоль, 2,44 экв.) порциями при перемешивании при 0oC. Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Полученную смесь упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:5). В результате получали 2,6 г (69%) (2R)-1-(бензилокси)-3-(4-фторфенил)-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил) амино]-4,4-диметилпентаноата в виде бесцветного масла. MS (ES, m/z): 416 (M+H - Boc).
Пример синтеза 34. Получение димера D7.
Димер D7 получали по реакции, приведенной ниже.
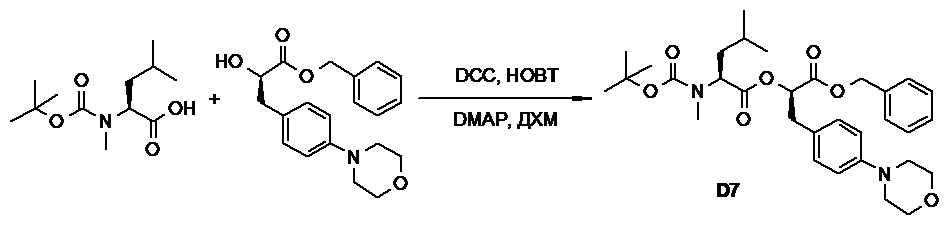
(2R)-1-(бензилокси)-3-[4-(морфолин-4-ил)фенил]-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентаноат (D7). В 250-миллилитровую 3-горлую круглодонную колбу помещали бензил (2R)2-гидрокси-3-[4-(морфолин-4-ил)фенил] пропаноат (10 г, 29,29 ммоль, 1,00 экв.), (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентановую кислоту (7,9 г, 32,20 ммоль, 1,10 экв.), дихлорметан (180 мл). Затем добавляли DCC (6,6 г, 31,99 ммоль, 1,10 экв.), 4-диметиламинопиридин (3,9 г, 31,92 ммоль, 1,10 экв.) и HOBT (4,3 г, 31,82 ммоль, 11,10 экв.) порциями при перемешивании при 0oC. Полученный раствор перемешивали в течение ночи при комнатной температуре. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:10). В результате получали 14 г (84%) (2R)1-(бензилокси)-3-[4-(морфолин-4-ил)фенил]-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентаноата в виде белого твердого вещества. MS (ES, m/z): 569 (M+H); 1H ЯМР (300 МГц, CDCl3): δ 7,41-7,36 (м, 3H), 7,33-7,29 (м, 2H), 7,10 (д, J=8,1 Гц, 2H), 6,85 (ушир, 2H), 5,26-5,23 (м, 1H), 5,19-5,11 (м, 2H), 5,08-4,99 (м, 0,5H), 4,77-4,72 (м, 0,5H), 3,89 (ушир, 4H), 3,16-3,03 (м, 6H), 2,67 (д, J=8,4 Гц, 3H), 1,65-1,56 (м, 3H), 1,49 (д, J=15,9 Гц, 9H), 0,92 (д, J=6,0 Гц, 6H).
Пример синтеза 35. Получение димера D8.
Димер D8 получали по реакции, приведенной ниже.

(2R)-1-(бензилокси)-3-[4-(морфолин-4-ил)фенил]-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноат (D8). В 100-миллилитровую 3-горлую круглодонную колбу в инертной атмосфере азота помещали дихлорметан (10 мл, 1,10 экв.), бензил (2R)-2-гидрокси-3-[4-(морфолин-4-ил)фенил]пропаноат (130 мг, 0,38 ммоль, 1,00 экв.), (2S)-2-[(трет-бутокси)карбонил](метил)амино-4-фтор-4-метилпентановую кислоту (100 мг, 0,38 ммоль, 1,00 экв.). Затем добавляли HOBT (57 мг, 0,42 ммоль, 1,10 экв.), DCC (86 мг, 0,42 ммоль, 1,10 экв.) и 4-диметиламинопиридин (51 мг, 0,42 ммоль, 1,10 экв.) порциями при перемешивании при 0oC. Полученный раствор перемешивали в течение ночи при комнатной температуре. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:10). В результате получали 180 мг (80,5%) (2R)-1-(бензилокси)-3-[4-(морфолин-4-ил)фенил]-1-оксопропан-2-ил (2S)-2-[[(трет-бутокси) карбонил](метил)амино]-4-фтор-4-метилпентаноата в виде светло-желтого твердого вещества. MS (ES, m/z): 587 (M+H);1H ЯМР (300 МГц, CDCl3): δ 7,38-7,36 (м, 4H), 7,29-7,25 (м, 1H), 7,20-6,99 (м, 4H), 5,27-5,18 (м, 1H), 5,18-5,09 (м, 2H), 5,08-4,83 (м, 1H), 4,01 (ушир, 4H), 3,23 (ушир, 4H), 3,15-3,05 (м, 2H), 2,68 (с, 3H), 2,28-1,91 (м, 2H), 1,51-1,28 (м, 15H).
Пример синтеза 36. Получение димера D9.
Димер D9 получали по реакции, приведенной ниже.

(2R)-1-(бензилокси)-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил) амино]-4-метилпентаноат (D9). В 2-литровую круглодонную колбу в инертной атмосфере азота помещали тетрагидрофуран (1,5 л), (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентановую кислоту (50 г, 203,82 ммоль, 1,00 экв.), бензил (2S)-2-гидроксипропаноат (36,7 г, 203,66 ммоль, 1,00 экв.), трифенилфосфин (85 г, 324,07 ммоль, 1,50 экв.). Затем добавляли DEAD (56,5 г, 324,43 ммоль, 1,20 экв.) по каплям при перемешивании при 0oC. Полученный раствор перемешивали в течение ночи при комнатной температуре. Полученную смесь упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:50-1:10). В результате получали 82 г (99%) (2R)1-(бензилокси)-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил) амино]-4-метилпентаноата в виде розового масла. MS (ES, m/z): 408 (M+H);1H ЯМР (300 МГц, CDCl3): δ 7,41-7,31 (м, 5H), 5,31-5,10 (м, 3H), 5,01-4,73 (м, 1H), 2,77-2,74 (м, 3H), 1,72-1,65 (м, 2H), 1,60-1,58 (м, 1H), 1,52-1,50 (м, 3H), 1,47 (с, 9H), 0,96-0,94 (м, 6H).
Пример синтеза 37. Получение димера D10.
Димер D10 получали по реакции, приведенной ниже.
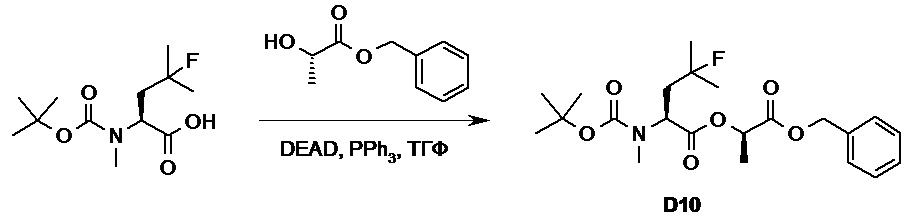
(2R)-1-(бензилокси)-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил) амино]-4-фтор-4-метилпентаноат (D10). В 50-миллилитровую 3-горлую круглодонную колбу в инертной атмосфере азота помещали тетрагидрофуран (10 мл), (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентановую кислоту (100 мг, 0,38 ммоль, 1,00 экв.), бензил (2S)-2-гидроксипропаноат (69 мг, 0,38 ммоль, 1,00 экв.), трифенилфосфин (150 мг, 0,57 ммоль, 1,50 экв.). Затем добавляли DEAD (99 мг, 0,57 ммоль, 1,50 экв.). Полученный раствор перемешивали в течение ночи при комнатной температуре. Полученную смесь упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:100-1:50). В результате получали 106 мг (66%) (2R)1-(бензилокси)-1-оксопропан-2-ил (2S)-2-[[(трет-бутокси)карбонил] (метил)амино]-4-фтор-4-метилпентаноата в виде не совсем белого масла. MS (ES, m/z): 426 (M+H);1H ЯМР (300 МГц, CDCl3): δ 7,41-7,32 (м, 5H), 5,23-5,10 (м, 3H), 5,09-4,82 (м, 1H), 2,80-2,77 (м, 3H), 2,31-2,06 (м, 2H), 1,54-1,27 (м, 18H).
Пример синтеза 38. Получение димера D11.
Димер D11 получали по реакции, приведенной ниже.

(2R)-1-(бензилокси)-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил) амино]-4,4-диметилпентаноат (D11). В 1000-миллилитровую 3-горлую круглодонную колбу в инертной атмосфере азота помещали раствор (2S)-2-[[(трет-бутокси) карбонил](метил)амино]-4,4-диметилпентановой кислоты (18 г, 69,41 ммоль, 1,00 экв.) в тетрагидрофуране (500 мл), бензил (2S)-2-гидроксипропаноат (12,5 г, 69,37 ммоль, 1,00 экв.), PPh3 (22 г, 83,88 ммоль, 1,20 экв.). Затем добавляли DEAD (14,5 г, 83,26 ммоль, 1,20 экв.) по каплям при перемешивании при 0oC. Полученный раствор перемешивали в течение 2 часов при комнатной температуре в бане лед/соль. Полученную смесь упаривали в вакууме. Полученный раствор разбавляли 1000 мл этилацетата. Полученную смесь промывали 2x1000 мл насыщенного раствора хлорида натрия. Органический слой собирали и сушили над безводным сульфатом натрия. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:20~1:10). В результате получали 25,3 г (86%) (2R)-1-(бензилокси)-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4,4-диметилпентаноата в виде желтого масла. MS (ES, m/z): 422 (M+H);1H ЯМР (300 МГц, CDCl3): δ 7,40-7,33 (м, 5H), 5,23-4,79 (м, 4H), 2,75 (д, J=8,4 Гц, 3H), 1,85-1,61 (м, 2H), 1,59-1,52 (м, 3H), 1,47 (с, 9H), 0,95 (с, 9H).
Пример синтеза 39. Получение димера D12.
Димер D12 получали по реакции, приведенной ниже.

(2R)-1-(бензилокси)-1-оксо-3-фенилпропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил] (метил)амино]-4-фтор-4-метилпентаноат (D12). В 250-миллилитровую 3-горлую круглодонную колбу в инертной атмосфере азота помещали раствор (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентановой кислоты (1,2 г, 4,56 ммоль, 1,00 экв.) в дихлорметане (100 мл), бензил (2R)-2-гидрокси-3-фенилпропаноат (1,17 г, 4,57 ммоль, 1,00 экв.). Затем добавляли DCC (1,13 г, 5,48 ммоль, 1,20 экв.), HOBT (740 мг, 5,48 ммоль, 1,20 экв.) и 4-диметиламинопиридин (670 мг, 5,48 ммоль, 1,20 экв.) порциями при перемешивании при 0oC. Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Полученную смесь упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:10). В результате получали 1,52 г (66%) (2R)1-(бензилокси)-1-оксо-3-фенилпропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноата в виде бесцветного масла. MS (ES, m/z): 502 (M+H).
Пример синтеза 40. Получение димера D13.
Димер D13 получали по реакции, приведенной ниже.

(2R)-1-(бензилокси)-3-[4-(морфолин-4-ил)фенил]-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4,4-диметилпентаноат (D13). В 250-миллилитровую 3-горлую круглодонную колбу помещали (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4,4-диметилпентановую кислоту (3,8 г, 14,65 ммоль, 1,00 экв.), бензил (2R)2-гидрокси-3-[4-(морфолин-4-ил)фенил]пропаноат (5 г, 14,65 ммоль, 1,00 экв.), дихлорметан (20 мл). Затем добавляли DCC (3,3 г, 1,10 экв.), HOBT (2 г, 1,10 экв.) и 4-диметиламинопиридин (2,2 г, 1,10 экв.) порциями при перемешивании при 0oC. Полученный раствор перемешивали в течение 14 часов при комнатной температуре. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:10). В результате получали 6,5 г (76%) (2R)1-(бензилокси)-3-[4-(морфолин-4-ил)фенил]-1-оксопропан-2-ил (2S)-2-[[(трет-бутокси) карбонил](метил)амино]-4,4-диметилпентаноата в виде белого твердого вещества. MS (ES, m/z): 583 (M+H).
Пример синтеза 41. Получение димера D14.
Димер D14 получали по реакции, приведенной ниже.

(2R)-1-(бензилокси)-3-[4-(3,6-дигидро-2H-пиран-4-ил)фенил]-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентаноат (D14). В 1000-миллилитровую круглодонную колбу помещали дихлорметан (200 мл), бензил (2R)-3-[4-(3,6-дигидро-2H-пиран-4-ил)фенил]-2-гидроксипропаноат (12 г, 35,46 ммоль, 1,00 экв.), (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентановую кислоту (10,6 г, 43,21 ммоль, 1,22 экв.), HOBT (6 г, 44,40 ммоль, 1,25 экв.), DCC (9 г, 43,62 ммоль, 1,23 экв.), 4-диметиламинопиридин (6 г, 49,11 ммоль, 1,38 экв.). Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. Фильтрат наносили на колонку с силикагелем, элюируя смесью этилацетат/петролейный эфир (1:5). В результате получали 18,0 г (90%) (2R)-1-(бензилокси)-3-[4-(3,6-дигидро-2H-пиран-4-ил)фенил]-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси) карбонил](метил)амино]-4-метилпентаноата в виде светло-желтого масла. MS (ES, m/z): 566 (M+H)
Пример синтеза 42. Получение димера D15.
Димер D15 получали по реакции, приведенной ниже.
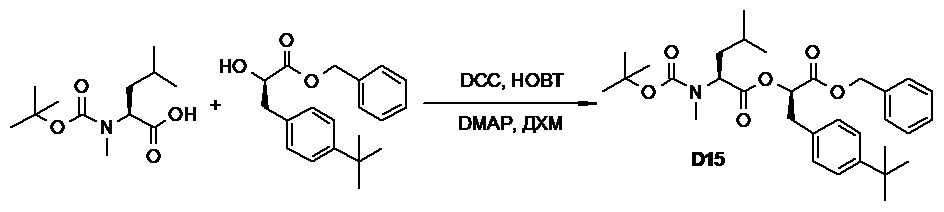
(2R)-1-(бензилокси)-3-(4-трет-бутилфенил)-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси) карбонил](метил)амино]-4-метилпентаноат (D15). В 250-миллилитровую круглодонную колбу помещали раствор бензил (2R)-3-(4-трет-бутилфенил)-2-гидроксипропаноата (5,3 г, 16,97 ммоль, 1,00 экв.) в дихлорметане (90 мл), (2S)-2-[[(трет-бутокси)карбонил] (метил)амино]-4-метилпентановую кислоту (4,2 г, 17,12 ммоль, 1,00 экв.). Затем добавляли DCC (3,85 г, 18,66 ммоль, 1,10 экв.), HOBT (2,52 г, 18,65 ммоль, 1,10 экв.) и 4-диметиламинопиридин (2,28 г, 18,66 ммоль, 1,10 экв.) порциями при перемешивании при 0oC. Полученный раствор перемешивали в течение ночи при комнатной температуре. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:8). В результате получали 10 г (сырой продукт) (2R)1-(бензилокси)-3-(4-трет-бутилфенил)-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентаноата в виде светло-желтого масла. MS (ES, m/z): 562 (M+Na).
Пример синтеза 43. Получение димера D16.
Димер D16 получали по реакции, приведенной ниже.
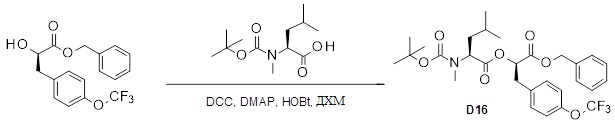
(2R)-1-(бензилокси)-1-оксо-3-[4-(трифторметокси)фенил]пропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентаноат (D16). В 250-миллилитровую 3-горлую круглодонную колбу помещали бензил (2R)-2-гидрокси-3-[4-(трифторметокси) фенил]пропаноат (4,0 г, 11,75 ммоль, 1,00 экв.), (2S)-2-[[(трет-бутокси)карбонил](метил) амино]-4-метилпентановую кислоту (2,94 г, 11,98 ммоль, 1,00 экв.), дихлорметан (100 мл). Затем добавляли DCC (2,72 г, 13,18 ммоль, 1,10 экв.), 4-диметиламинопиридин (1,61 г, 13,18 ммоль, 1,10 экв.) и HOBt (1,78 г, 13,17 ммоль, 1,10 экв.) порциями при перемешивании при 0oC. Полученный раствор перемешивали в течение ночи при комнатной температуре. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:30). В результате получали 4,5 г (67%) (2R)-1-(бензилокси)-1-оксо-3-[4-(трифторметокси)фенил]пропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил] (метил)амино]-4-метилпентаноата в виде желтого масла. MS (ES, m/z): 568 (M+H).
Пример синтеза 44. Получение димера D17.
Димер D17 получали по реакции, приведенной ниже.

(2R)-1-(бензилокси)-3-[6-(морфолин-4-ил)пиридин-3-ил]-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентаноат (D17). В 100-миллилитровую круглодонную колбу помещали раствор бензил (2R)-2-гидрокси-3-[6-(морфолин-4-ил)пиридин-3-ил]пропаноата (1,36 г, 3,97 ммоль, 1,00 экв.), (2S)-2-[(трет-бутокси)карбонил](метил)амино-4-метилпентановой кислоты (980 мг, 3,99 ммоль, 1,00 экв.) в дихлорметане (40 мл). Затем добавляли DCC (900 мг, 4,36 ммоль, 1,10 экв.), 4-диметиламинопиридин (540 мг, 4,42 ммоль, 1,10 экв.) и HOBT (740 мг, 5,48 ммоль, 1,10 экв.) порциями при перемешивании при 0oC. Полученный раствор перемешивали в течение ночи при комнатной температуре. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:5). В результате получали 1,2572 г (56%) (2R)-1-(бензилокси)-3-[6-(морфолин-4-ил)пиридин-3-ил]-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси) карбонил](метил)амино]-4-метилпентаноата в виде не совсем белого твердого вещества. MS (ES, m/z): 570 (M+H);1H ЯМР (300 МГц, CDCl3): δ 8,01 (с, 1H), 7,39-7,33 (м, 4H), 7,30-7,28 (м, 2H), 6,59-6,56 (м, 1H), 5,23-5,19 (м, 1H), 5,14 (с, 2H), 5,05-4,99 (м, 0,5H), 4,78-4,73 (м, 0,5H), 3,85-3,82 (м, 4H), 3,49 (ушир, 4H), 3,10-2,95 (м, 2H), 2,68 (д, J=10,8 Гц, 3H), 1,64-1,57 (м, 3H), 1,48 (д, J=12,9 Гц, 9H), 0,97-0,91 (м, 6H).
Пример синтеза 45. Получение димера D18.
Димер D18 получали по реакции, приведенной ниже.

(2R)-1-(бензилокси)-3-(4-цианофенил)-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси) карбонил](метил)амино]-4-метилпентаноат (D18). В 100-миллилитровую 3-горлую круглодонную колбу помещали бензил (2R)-3-(4-цианофенил)-2-гидроксипропаноат (2 г, 7,11 ммоль, 1,00 экв.), (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентановую кислоту (2,3 г, 9,38 ммоль, 1,30 экв.), дихлорметан (40 мл). Затем добавляли DCC (1,6 г, 7,75 ммоль, 1,10 экв.), 4-диметиламинопиридин (960 мг, 7,86 ммоль, 1,10 экв.) и HOBT (1,1 г, 8,14 ммоль, 1,10 экв.) порциями при перемешивании при 0oC. Полученный раствор перемешивали в течение 17 часов при комнатной температуре. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:10). В результате получали 3,3 г (91%) (2R)-1-(бензилокси)-3-(4-цианофенил)-1-оксопропан-2-ил (2S)-2-[[(трет-бутокси)карбонил] (метил)амино]-4-метилпентаноата в виде белого твердого вещества. MS (ES, m/z): 509 (M+H).
Пример синтеза 46. Получение димера D19.
Димер D19 получали по реакции, приведенной ниже.

(2R)-1-(бензилокси)-3-[4-(3,6-дигидро-2H-пиран-4-ил)фенил]-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноат (D19). В 500-миллилитровую круглодонную колбу помещали дихлорметан (400 мл), (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентановую кислоту (20 г, 75,96 ммоль, 1,00 экв.), бензил (2R)-3-[4-(3,6-дигидро-2H-пиран-4-ил)фенил]-2-гидроксипропаноат (25,8 г, 76,24 ммоль, 1,00 экв.). Затем добавляли HOBT (12 г, 88,81 ммоль, 1,15 экв.), DCC (18 г, 87,24 ммоль, 1,15 экв.) и 4-диметиламинопиридин (10,7 г, 87,58 ммоль, 1,15 экв.) порциями при перемешивании при 0oC. Полученный раствор перемешивали в течение 4 часов при комнатной температуре. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:10-1:5). В результате получали 80 г (90%) (2R)-1-(бензилокси)-3-[4-(3,6-дигидро-2H-пиран-4-ил)фенил]-1-оксопропан-2-ил (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноата в виде бесцветного масла. MS (ES, m/z): 584 (M+H);1H ЯМР (300 МГц, CDCl3): δ 7,37-7,16 (м, 7H), 7,14 (д, J=8,4 Гц, 2H), 6,12 (с, 1H), 5,28-5,25 (м, 1H), 5,15-5,13 (м, 2H), 5,12-4,81 (м, 1H), 4,35-4,33 (м, 2H), 3,95 (т, J=8,7 Гц, 2H), 3,18-3,14 (м, 2H), 2,68 (д, J=12,9 Гц, 3H), 2,53-2,49 (м, 2H), 2,22-2,10 (м, 1H), 2,06-1,85 (м, 1H), 1,48 (д, J=16,8 Гц, 9H), 1,39 (с, 3H), 1,32 (с, 3H).
Пример синтеза 47. Получение димера D20.
Димер D20 получали способом, показанным на схеме 28 ниже.
Схема 28

Подробное описание эксперимента
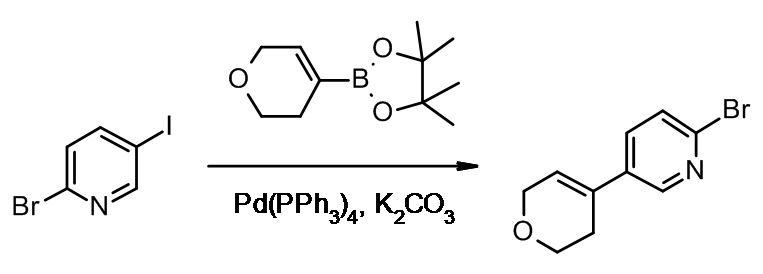
2-бром-5-(3,6-дигидро-2H-пиран-4-ил)пиридин. В 50-миллилитровую круглодонную колбу в инертной атмосфере азота помещали диоксан (2 мл), воду (1 мл), 2-бром-5-иодпиридин (100 мг, 0,35 ммоль, 1,00 экв.), 2-(3,6-дигидро-2H-пиран-4-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (104 мг, 0,50 ммоль, 1,30 экв.), карбонат калия (120 мг, 0,86 ммоль, 3,00 экв.), Pd(PPh3)4 (40 мг, 0,03 ммоль, 0,10 экв.). Полученный раствор перемешивали в течение ночи при 80oC на масляной бане. Реакционную смесь охлаждали и упаривали в вакууме. Остаток очищали методом препаративной ТСХ (EtOAc:петролейный эфир = 1:1). В результате получали 50 мг (59%) 2-бром-5-(3,6-дигидро-2H-пиран-4-ил)пиридина в виде бесцветного масла. MS (ES, m/z): 240 (M+H).

(2R)-1-(бензилокси)-3-[5-(3,6-дигидро-2H-пиран-4-ил)пиридин-2-ил]пропан-2-ол. В 250-миллилитровую 3-горлую круглодонную колбу помещали тетрагидрофуран (200 мл), 2-бром-5-(3,6-дигидро-2H-пиран-4-ил)пиридин (4 г, 16,66 ммоль, 1,00 экв.). Затем добавляли бутиллитий (8,7 мл, 1,30 экв.) по каплям при перемешивании при -78oC. Затем добавляли BF3.Et2O (2,8 мл, 1,00 экв.) при -78oC. В смесь добавляли раствор (2R)-2-[(бензилокси)метил]оксирана (3,6 г, 21,92 ммоль, 1,30 экв.) в тетрагидрофуране (10 мл) при -78oC. Полученный раствор перемешивали в течение 1,5 часов при -78oC. Затем реакцию гасили добавлением 100 мл NH4Cl (водн). Полученный раствор экстрагировали 3x100 мл этилацетата, и органические слои объединяли. Органический слой промывали 3x50 мл насыщенного раствора хлорида натрия. Органический слой собирали и сушили над безводным сульфатом натрия и упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:1). В результате получали 2 г (37%) (2R)-1-(бензилокси)-3-[5-(3,6-дигидро-2H-пиран-4-ил) пиридин-2-ил]пропан-2-ола в виде желтого твердого вещества. MS (ES, m/z): 326 (M+H).

(2R)-1-(бензилокси)-3-[5-(3,6-дигидро-2H-пиран-4-ил)пиридин-2-ил]пропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноат. В 100-миллилитровую круглодонную колбу в инертной атмосфере азота помещали дихлорметан (50 мл), (2R)-1-(бензилокси)-3-[5-(3,6-дигидро-2H-пиран-4-ил)пиридин-2-ил]пропан-2-ол (1,84 г, 5,65 ммоль, 1,00 экв.), (2S)-2-[(трет-бутокси)карбонил](метил)амино-4-фтор-4-метилпентановую кислоту (3,4 г, 12,91 ммоль, 2,50 экв.). Затем добавляли 4-диметиламинопиридин (1,4 г, 11,46 ммоль, 2,00 экв.), HOBT (1,5 г, 47,11 ммоль, 2,00 экв.) и DCC (2,3 г, 85,05 ммоль, 2,00 экв.) порциями при перемешивании при 0oC. Полученный раствор перемешивали в течение ночи при комнатной температуре. Полученную смесь упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:1). В результате получали 4,0 г (2R)-1-(бензилокси)-3-[5-(3,6-дигидро-2H-пиран-4-ил)пиридин-2-ил]пропан-2-ил (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноата в виде желтого твердого вещества. MS (ES, m/z): 571 (M+H).

(2R)-1-гидрокси-3-[5-(оксан-4-ил)пиридин-2-ил]пропан-2-ил-(2S)-2-[[(трет-бутокси) карбонил](метил)амино]-4-фтор-4-метилпентаноат. В 250-миллилитровую круглодонную колбу помещали Pd(OH)2/C (4 г), (2R)-1-(бензилокси)-3-[5-(3,6-дигидро-2H-пиран-4-ил) пиридин-2-ил]пропан-2-ил (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноат (4 г, 7,01 ммоль, 1,00 экв.). Затем добавляли этилацетат (100 мл). Подключали реакционную колбу к источнику водорода. Полученный раствор перемешивали в течение 8 часов при комнатной температуре. Осадок отфильтровывали. Фильтрат упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:1). В результате получали 800 мг (2R)-1-гидрокси-3-[5-(оксан-4-ил)пиридин-2-ил]пропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил] (метил)амино]-4-фтор-4-метилпентаноата в виде коричневого твердого вещества. MS (ES, m/z): 483 (M+H).

(2R)-2-[(2S)-2-[трет-бутоксикарбонил(метил)амино]-4-фтор-4-метил-пентаноил]окси-3-(5-тетрагидропиран-4-ил-2-пиридил)пропановая кислота. В 8-миллилитровую виалу помещали (2R)-1-гидрокси-3-[5-(оксан-4-ил)пиридин-2-ил]пропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноат (20 мг, 0,04 ммоль, 1,00 экв.), CH3CN (1 мл), хлороформ (1 мл), воду (2 мл), периодат натрия (44 мг, 0,21 ммоль, 5,00 экв.), трихлорид рутения (1 мг, 0,10 экв.). Полученный раствор перемешивали в течение 2 часов при комнатной температуре. MS (ES, m/z): 497 (M+H).
Пример синтеза 48. Получение димера D21.
Димер D21 получали по реакции, приведенной ниже.
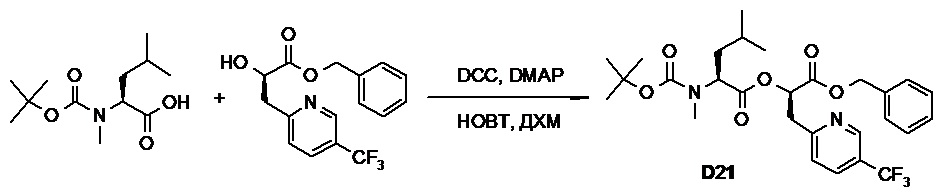
(2R)-1-(бензилокси)-1-оксо-3-[5-(трифторметил)пиридин-2-ил]пропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентаноат (D21). В 50-миллилитровую круглодонную колбу помещали бензил (2R)-2-гидрокси-3-[5-(трифторметил)пиридин-2-ил] пропаноат (500 мг, 1,54 ммоль, 1,00 экв.), (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентановую кислоту (489,9 мг, 2,00 ммоль, 1,30 экв.), 4-диметиламинопиридин (206,4 мг, 1,69 ммоль, 1,10 экв.), HOBT (230,1 мг, 1,70 ммоль, 1,11 экв.), дихлорметан (10 мл). Затем добавляли DCC (348,5 мг, 1,69 ммоль, 1,10 экв.) порциями при 0oC. Полученный раствор перемешивали в течение 12 часов при 0-25oC. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:5). Собранные фракции объединяли и упаривали в вакууме. В результате получали 281,2 мг (33%) (2R)-1-(бензилокси)-1-оксо-3-[5-(трифторметил)пиридин-2-ил]пропан-2-ил (2S)-2-[[(трет-бутокси)карбонил](метил) амино]-4-метилпентаноата в виде светло-желтого масла. MS (ES, m/z): 553 (M+H).
Пример синтеза 49. Получение димера D22.
Димер D22 получали по реакции, приведенной ниже.

(2R)-1-(бензилокси)-3-[6-(оксан-4-ил)пиридин-3-ил]-1-оксопропан-2-ил (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноат (D22). В 50-миллилитровую круглодонную колбу помещали тетрагидрофуран (5 мл), бензил (2S)-2-гидрокси-3-[6-(оксан-4-ил)пиридин-3-ил]пропаноат (900 мг, 2,64 ммоль, 1,00 экв.), (2S)-2-[(трет-бутокси) карбонил](метил)амино-4-фтор-4-метилпентановую кислоту (1,1 г, 4,18 ммоль, 1,58 экв.), PPh3 (1,7 г, 6,48 ммоль, 2,46 экв.), DEAD (1,3 г, 7,46 ммоль, 2,83 экв.). Полученный раствор перемешивали в течение 3 часов при комнатной температуре. Полученную смесь упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:1). В результате получали 1,7 г (2R)-1-(бензилокси)-3-[6-(оксан-4-ил)пиридин-3-ил]-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил) амино]-4-фтор-4-метилпентаноата в виде белого твердого вещества. MS (ES, m/z): 587 (M+H);1H ЯМР (300 МГц, CDCl3): δ 8,38 (с, 1H), 7,50-7,49 (ушир, 1H), 7,37-7,31 (м, 5H), 7,12 (ушир, 1H), 5,32-5,12 (м, 3H), 4,92-4,63 (м, 1H), 4,13-4,09 (м, 2H), 3,61-3,56 (м, 2H), 3,17-3,16 (м, 2H), 2,98 (ушир, 1H), 2,74-2,66 (м, 3H), 2,29-1,96 (м, 2H), 1,87-1,85 (4H), 1,51-1,27 (м, 15H).
Пример синтеза 50. Получение димера D23.
Димер D23 получали по реакции, приведенной ниже.
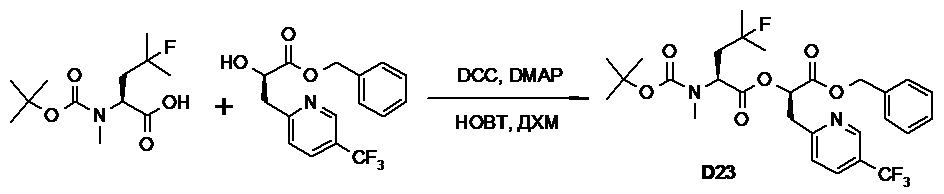
(2R)-1-(бензилокси)-1-оксо-3-[5-(трифторметил)пиридин-2-ил]пропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноат (D23). В 50-миллилитровую круглодонную колбу помещали (2S)-2-[[(трет-бутокси)карбонил] (метил)амино]-4-фтор-4-метилпентановую кислоту (526 мг, 2,00 ммоль, 1,30 экв.), бензил (2R)-2-гидрокси-3-[5-(трифторметил)пиридин-2-ил]пропаноат (500 мг, 1,54 ммоль, 1,00 экв.), дихлорметан (10 мл). Затем добавляли 4-диметиламинопиридин (206,4 мг, 1,69 ммоль, 1,10 экв.), HOBT (230,1 мг, 1,70 ммоль, 1,10 экв.) и DCC (348,6 мг, 1,69 ммоль, 1,10 экв.) в несколько приемов при 0oC. Полученный раствор перемешивали в течение 12 часов при 25oC. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:5). Собранные фракции объединяли и упаривали в вакууме. В результате получали 305 мг (27%) (2R)-1-(бензилокси)-1-оксо-3-[5-(трифторметил)пиридин-2-ил]пропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноата в виде светло-желтого масла. MS (ES, m/z): 571 (M+H);1H ЯМР (300 МГц, CDCl3): δ 8,75 (с, 1H), 7,86-7,82 (м, 1H), 7,38-7,28 (м, 6H), 5,63 -5,58 (м, 1H), 5,31-5,17 (м, 2H), 5,12-4,71 (м, 1H), 3,48-3,45 (м, 2H), 2,69 (д, J=11,7 Гц, 2H), 2,29-1,83 (м, 2H), 1,45-1,27 (м, 15H).
Пример синтеза 51. Получение димера D24.
Димер D24 получали по реакции, приведенной ниже.

(2R)-1-(бензилокси)-1-оксо-3-[5-(трифторметил)пиридин-2-ил]пропан-2-ил (2S)-2-[[(трет-(2R)-1-(бензилокси)-3-(4-цианофенил)-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноат (D24). В 100-миллилитровую 3-горлую круглодонную колбу помещали (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентановую кислоту (5,2 г, 19,75 ммоль, 1,00 экв.), бензил (2R)-3-(4-цианофенил)-2-гидроксипропаноат (4,25 г, 15,11 ммоль, 1,30 экв.), дихлорметан (40 мл). Затем добавляли DCC (3,4 г, 16,48 ммоль, 1,10 экв.), 4-диметиламинопиридин (2 г, 16,37 ммоль, 1,10 экв.) и HOBt (2,2 г, 16,28 ммоль, 1,10 экв.) порциями при перемешивании при 0oC. Полученный раствор перемешивали в течение 17 часов при комнатной температуре. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:10). В результате получали 3,2 г (31%) (2R)-1-(бензилокси)-3-(4-цианофенил)-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноата в виде белого твердого вещества. MS (ES, m/z): 527 (M+H).
Пример синтеза 52. Получение димера D25.
Димер D25 получали по реакции, приведенной ниже.
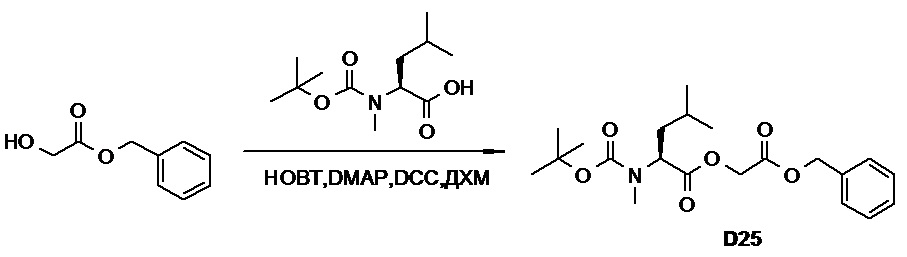
2-(Бензилокси)-2-оксоэтил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метил пентаноат (D25). В 250-миллилитровую 3-горлую круглодонную колбу в инертной атмосфере азота помещали бензил 2-гидроксиацетат (3,5 г, 21,06 ммоль, 1,00 экв.), дихлорметан (100 мл), (2S)-2-[(трет-бутокси)карбонил](метил)амино-4-метилпентановую кислоту (5,2 г, 21,20 ммоль, 1,00 экв.). Затем добавляли DCC (5,21 г, 25,25 ммоль, 1,20 экв.), HOBT (3,42 г, 25,31 ммоль, 1,20 экв.) и 4-диметиламинопиридин (3,1 г, 25,37 ммоль, 1,20 экв.) порциями при перемешивании при 0oC. Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Полученную смесь упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:20-1:5). В результате получали 5,3 г (64%) 2-(бензилокси)-2-оксоэтил (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентаноата в виде бесцветного масла. MS (ES, m/z): 394 (M+H).
Пример синтеза 53. Получение димера D26.
Димер D26 получали по реакции, приведенной ниже.

(2R)-1-(бензилокси)-3-[3-фтор-4-(оксан-4-ил)фенил]-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентаноат (D26). В 250-миллилитровую круглодонную колбу помещали (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентановую кислоту (900 мг, 3,67 ммоль, 1,00 экв.), дихлорметан (30 мл), бензил (2S)-3-[3-фтор-4-(оксан-4-ил)фенил]-2-гидроксипропаноат (620 мг, 1,73 ммоль, 1,00 экв.). Затем добавляли DCC (570 мг, 2,76 ммоль, 1,10 экв.), HOBT (373 мг, 2,76 ммоль, 1,10 экв.) и 4-диметиламинопиридин (340 мг, 2,78 ммоль, 1,10 экв.) порциями при перемешивании при 0oC. Полученный раствор перемешивали в течение ночи при комнатной температуре. Полученную смесь упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:5). В результате получали 1,2 г (56%) (2R)1-(бензилокси)-3-[3-фтор-4-(оксан-4-ил)фенил]-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентаноата в виде бесцветного масла. MS (ES, m/z): 586 (M+H).
Пример синтеза 54. Получение димера D27.
Димер D27 получали по реакции, приведенной ниже.

(2R)-1-(бензилокси)-3-[4-(3,3-дифторпирролидин-1-ил)фенил]-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентаноат. В 250-миллилитровую 3-горлую круглодонную колбу помещали бензил (2R)-3-[4-(3,3-дифторпирролидин-1-ил)фенил]-2-гидроксипропаноат (1,5 г, 4,15 ммоль, 1,00 экв.), (2S)-2-[[(трет-бутокси) карбонил](метил)амино]-4-метилпентановую кислоту (1 г, 4,08 ммоль, 1,00 экв.), дихлорметан (80 мл). Затем добавляли DCC (1,1 г, 5,33 ммоль, 1,20 экв.), 4-диметиламинопиридин (600 мг, 4,91 ммоль, 1,20 экв.) и HOBT (700 мг, 5,18 ммоль, 1,20 экв.) порциями при перемешивании при 0oC. Полученный раствор перемешивали в течение ночи при комнатной температуре. Полученную смесь упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:15). В результате получали 1,7 г (70%) (2R)-1-(бензилокси)-3-[4-(3,3-дифторпирролидин-1-ил)фенил]-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентаноата в виде желтого масла. MS (ES, m/z): 589 (M+H).
Пример синтеза 55. Получение димера D28.
Димер D28 получали по реакции, приведенной ниже.
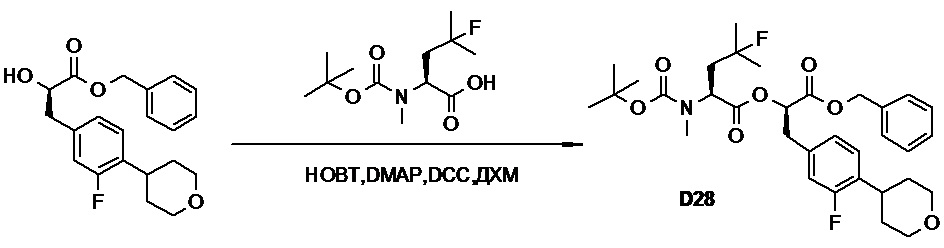
(2R)-1-(бензилокси)-3-[3-фтор-4-(оксан-4-ил)фенил]-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноат (D28). В 100-миллилитровую круглодонную колбу помещали (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентановую кислоту (700 мг, 2,66 ммоль, 1,00 экв.), ДХМ (30 мл), бензил (2S)-3-[3-фтор-4-(оксан-4-ил)фенил]-2-гидроксипропаноат (513 мг, 1,43 ммоль, 1,00 экв.). Затем добавляли HOBT (262 мг, 1,94 ммоль, 1,10 экв.), DCC (442 мг, 2,14 ммоль, 1,10 экв.) и 4-диметиламинопиридин (290 мг, 2,37 ммоль, 1,10 экв.) порциями при перемешивании при 0oC. Полученный раствор перемешивали в течение ночи при комнатной температуре. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:5). В результате получали 850 мг (53%) (2R)-1-(бензилокси)-3-[3-фтор-4-(оксан-4-ил)фенил]-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси) карбонил](метил)амино]-4-фтор-4-метилпентаноата в виде бесцветного масла. MS (ES, m/z): 604 (M+H).
Пример синтеза 56. Получение димера D29.
Димер D29 получали по реакции, приведенной ниже.
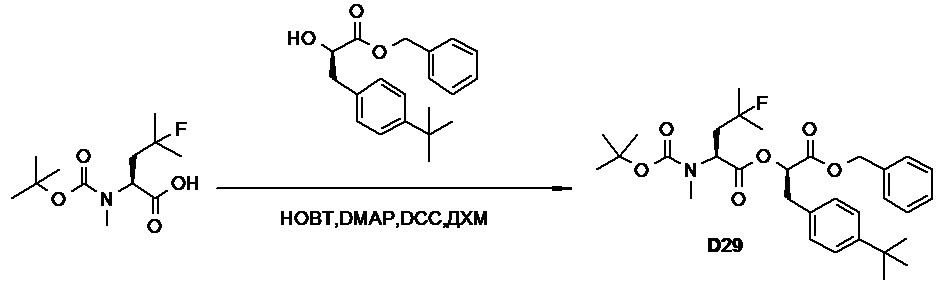
(2R)-1-(бензилокси)-3-(4-трет-бутилфенил)-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси) карбонил](метил)амино]-4-фтор-4-метилпентаноат (D29). В 1000-миллилитровую 3-горлую круглодонную колбу помещали раствор (2S)-2-[[(трет-бутокси) карбонил](метил)амино]-4-фтор-4-метилпентановой кислоты (25 г, 94,95 ммоль, 1,00 экв.) в дихлорметане (1000 мл), бензил (2R)-3-(4-трет-бутилфенил)-2-гидроксипропаноат (30 г, 96,03 ммоль, 1,00 экв.), DCC (40 г, 193,86 ммоль, 2,00 экв.), HOBT (26 г, 192,42 ммоль, 2,00 экв.), 4-диметиламинопиридин (23,5 г, 192,35 ммоль, 2,00 экв.). Полученный раствор перемешивали в течение 2 часов при комнатной температуре в бане лед/соль. Полученную смесь упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:50~1:10). В результате получали 50г (94%) (2R)-1-(бензилокси)-3-(4-трет-бутилфенил)-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноата в виде бесцветного масла. MS (ES, m/z): 558 (M+H);1H ЯМР (300 МГц, CDCl3): δ 7,35-7,27 (м, 7H), 7,12-7,09 (м, 2H), 5,27-4,62 (м, 4H), 3,15-3,09 (м, 2H), 2,69-2,61 (м, 3H), 2,20-1,82 (м, 2H), 1,61-1,31 (м, 24H).
Пример синтеза 57. Получение димера D30.
Димер D30 получали по реакции, приведенной ниже.
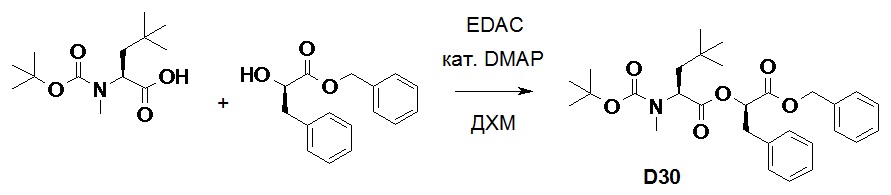
[(1R)-1-бензил-2-бензилокси-2-оксо-этил]-(2S)-2-[трет-бутоксикарбонил(метил)амино]-4,4-диметил-пентаноат (D30). В перемешиваемый раствор N-трет-бутоксикарбонил-N-метил-гамма-метил-L-лейцина (0,8 г, 3,1 ммоль), бензил R-2-гидрокси-3-фенилпропионата (0,8 г, 3,1 ммоль) и DMAP (кат.) в 8 мл ДХМ, охлажденный до 00C, добавляли EDAC (1,0 г, 4,6 ммоль), и смесь перемешивали в течение ночи при постепенном нагревании до комнатной температуры. Смесь разбавляли 70 мл ДХМ, промывали 70 мл воды, сушили над сульфатом натрия, фильтровали, упаривали, и остаток очищали на колонке с силикагелем, элюируя смесью этилацетат/гептан, получая целевое соединение в виде белого твердого вещества. Выход: 1,46 г, 95%.1H ЯМР (ДМСО-d6):
Пример синтеза 58. Получение димера D31.
Димер D31 получали по реакции, приведенной ниже.

(2R)-1-(бензилокси)-3-[4-(морфолин-4-ил)фенил]-1-оксопропан-2-ил-(2S)-2-[[(9H-флуорен-9-илметокси)карбонил](метил)амино]-5,5,5-трифтор-4-(трифторметил) пентаноат (D31). В 8-миллилитровую круглодонную колбу помещали дихлорметан (4 мл), (2S)-2-[[(9H-флуорен-9-илметокси)карбонил](метил)амино]-5,5,5-трифтор-4-(трифторметил) пентановую кислоту (200 мг, 0,42 ммоль, 1,00 экв.), бензил (2R)-2-гидрокси-3-[4-(морфолин-4-ил)фенил]пропаноат (173 мг, 0,51 ммоль, 1,20 экв.). Затем добавляли HOBT (70 мг, 0,52 ммоль, 1,20 экв.), DCC (104 мг, 0,50 ммоль, 1,20 экв.) и 4-диметиламинопиридин (62 мг, 0,51 ммоль, 1,20 экв.) порциями при перемешивании при 0oC. Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Полученную смесь упаривали в вакууме. Остаток очищали методом препаративной ТСХ (EtOAc:петролейный эфир = 1:3). В результате получали 177 мг (53%) (2R)-1-(бензилокси)-3-[4-(морфолин-4-ил)фенил]-1-оксопропан-2-ил-(2S)-2-[[(9H-флуорен-9-илметокси)карбонил](метил)амино]-5,5,5-трифтор-4-(трифторметил)пентаноата в виде не совсем белого твердого вещества. MS (ES, m/z): 799 (M+H);1H ЯМР (300 МГц, CDCl3): δ 7,81-7,78 (м, 2H), 7,65-7,60 (м, 2H), 7,48-7,28 (м, 11H), 7,10-7,00 (м, 2H), 5,29-5,26 (м, 1H), 5,21-5,17 (м, 2H), 5,13-4,94 (м, 1H), 4,60-4,50 (м, 3H), 4,32-4,18 (м, 1H), 4,01 (ушир, 4H), 3,20-3,07 (м, 6H), 2,70 (с, 3H), 2,45-2,33 (м, 1H), 2,14-1,96 (м, 1H).
Пример синтеза 59. Получение димера D32.
Димер D32 получали по реакции, приведенной ниже.

(2R)-1-(бензилокси)-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино] пропаноат (D32). В 250-миллилитровую круглодонную колбу в инертной атмосфере азота помещали тетрагидрофуран (100 мл), (2S)-2-[[(трет-бутокси)карбонил](метил) амино]пропановую кислоту (5 г, 24,60 ммоль, 1,00 экв.), бензил (2S)-2-гидроксипропаноат (4,43 г, 24,58 ммоль, 1,00 экв.), PPh3 (8,4 г, 32,03 ммоль, 1,30 экв.). Затем добавляли DEAD (5,6 г, 32,16 ммоль, 1,30 экв.) по каплям при перемешивании при 0oC. Полученный раствор перемешивали в течение ночи при комнатной температуре. Полученную смесь упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:30-1:15). В результате получали 9 г (100%) (2R)-1-(бензилокси)-1-оксопропан-2-ил (2S)-2-[[(трет-бутокси)карбонил](метил)амино]пропаноата в виде бесцветного масла. MS (ES, m/z): 366 (M+H);1H ЯМР (300 МГц, CDCl3): δ 7,42-7,32 (м, 5H), 5,24-5,12 (м, 3H), 5,03-4,69 (м, 1H), 2,83-2,79 (м, 3H), 1,53-1,39 (м, 15H).
Пример синтеза 60. Получение димера D33.
Димер D33 получали по реакции, приведенной ниже.

(2R)-1-(бензилокси)-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил) амино]-3-метилбутаноат (D33). В 250-миллилитровую 3-горлую круглодонную колбу в инертной атмосфере азота помещали (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-3-метилбутановую кислоту (2 г, 8,65 ммоль, 1,00 экв.), тетрагидрофуран (80 мл), бензил (2S)-2-гидроксипропаноат (1,6 г, 8,88 ммоль, 1,00 экв.), PPh3 (4,6 г, 17,54 ммоль, 2,00 экв.). Затем добавляли DEAD (3 г, 17,23 ммоль, 2,00 экв.) по каплям при перемешивании при 0oC. Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Полученную смесь упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1/9). В результате получали 3,3 г (97%) (2R)-1-(бензилокси)-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси) карбонил](метил)амино]-3-метилбутаноата в виде розовой жидкости. MS (ES, m/z): 394 (M+H).
Пример синтеза 61. Получение димера D34.
Димер D34 получали по реакции, приведенной ниже.

2-(Бензилокси)-2-оксоэтил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4,4-диметил пентаноат (D34). В 100-миллилитровую круглодонную колбу помещали (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4,4-диметилпентановую кислоту (1 г, 3,86 ммоль, 1,00 экв.), бензил 2-гидроксиацетат (770 мг, 4,63 ммоль, 1,20 экв.), дихлорметан (25 мл). Затем добавляли DCC (950 мг, 4,60 ммоль, 1,20 экв.), HOBt (630 мг, 4,66 ммоль, 1,20 экв.) и 4-диметиламинопиридин (570 мг, 4,67 ммоль, 1,20 экв.) порциями при перемешивании при 0oC. Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:9). В результате получали 1,15 г (73%) 2-(бензилокси)-2-оксоэтил-(2S)-2-[[(трет-бутокси) карбонил](метил)амино]-4,4-диметил пентаноата в виде бесцветного масла. MS (ES, m/z): 408 (M+H);1H ЯМР (300 МГц, CDCl3): δ 7,40-7,34 (м, 5H), 5,20 (с, 2H), 5,09-4,71 (м, 1H), 4,70-4,68 (м, 2H), 2,81-2,79 (м, 3H), 1,93-1,88 (м, 1H), 1,71-1,66 (м, 1H), 1,47 (с, 9H), 0,94 (с, 9H).
Пример синтеза 62. Получение димера D36.
Димер D36 получали по реакции, приведенной ниже.
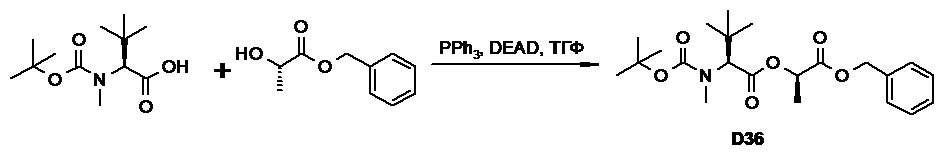
(2R)-1-(бензилокси)-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил) амино]-3,3-диметилбутаноат (D36). В 100-миллилитровую круглодонную колбу в инертной атмосфере азота помещали (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-3,3-диметилбутановую кислоту (1,5 г, 6,11 ммоль, 1,00 экв.), тетрагидрофуран (40 мл), бензил (2S)-2-гидроксипропаноат (1,1 г, 6,10 ммоль, 1,00 экв.), PPh3 (1,92 г, 7,32 ммоль, 1,20 экв.). Затем добавляли DEAD (1,27 г, 7,29 ммоль, 1,20 экв.) по каплям при перемешивании при 0oC. Полученный раствор перемешивали в течение ночи при комнатной температуре. Полученную смесь упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:10). В результате получали 2 г (80%) (2R)-1-(бензилокси)-1-оксопропан-2-ил (2S)-2-[[(трет-бутокси)карбонил](метил) амино]-3,3-диметилбутаноата в виде светло-желтого масла. MS (ES, m/z): 408 (M+H).
Пример синтеза 63. Получение димера D37.
Димер D37 получали по реакции, приведенной ниже.

(2R)-1-(бензилокси)-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино] пентаноат (D37). В 100-миллилитровую 3-горлую круглодонную колбу в инертной атмосфере азота помещали (2S)-2-[[(трет-бутокси)карбонил](метил)амино]пентановую кислоту (800 мг, 3,46 ммоль, 1,00 экв.), тетрагидрофуран (60 мл), бензил (2S)-2-гидроксипропаноат (623 мг, 3,46 ммоль, 1,00 экв.), PPh3 (1,8 г, 6,86 ммоль, 1,99 экв.). Затем добавляли DEAD (1,20 г, 6,89 ммоль, 2,00 экв.) по каплям при перемешивании при 0oC. Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Полученную смесь упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1/9). В результате получали 1,05 г (77%) (2R)-1-(бензилокси)-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси) карбонил](метил)амино]пентаноата в виде бесцветной жидкости. MS (ES, m/z): 394 (M+H).
Пример синтеза 64. Получение димера D38.
Димер D38 получали по реакции, приведенной ниже.

(2R)-1-(бензилокси)-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил) амино]-3-метилпентаноат (D38). В 250-миллилитровую 3-горлую круглодонную колбу в инертной атмосфере азота помещали (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-3-метилпентановую кислоту (4 г, 16,31 ммоль, 1,00 экв.), бензил (2S)-2-гидроксипропаноат (3,2 г, 17,76 ммоль, 1,09 экв.), тетрагидрофуран (100 мл), PPh3 (5,3 г, 20,21 ммоль, 1,24 экв.). Затем добавляли DEAD (4,1 г, 23,54 ммоль, 1,44 экв.) по каплям при перемешивании при 0oC. Полученный раствор перемешивали в течение 4 часов при комнатной температуре. Полученную смесь упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:5). В результате получали 4,2 г (63%) (2R)-1-(бензилокси)-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси) карбонил](метил)амино]-3-метилпентаноата в виде желтого масла. MS (ES, m/z): 408 (M+H).
Пример синтеза 65. Получение димера D40.
Димер D40 получали по реакции, приведенной ниже.

(2R)-1-(бензилокси)-3-[4-(4-фторфенил)фенил]-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноат (D40). В 100-миллилитровую круглодонную колбу помещали раствор (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентановой кислоты (1,2 г, 4,56 ммоль, 1,00 экв.), дихлорметан (30 мл), бензил (2R)3-[4-(4-фторфенил)фенил]-2-гидроксипропаноат (900 мг, 2,57 ммоль, 1,00 экв.). Затем добавляли 4-диметиламинопиридин (500 мг, 4,09 ммоль, 1,10 экв.), DCC (780 мг, 3,78 ммоль, 1,10 экв.) и HOBT (510 мг, 3,77 ммоль, 1,10 экв.) порциями при 0oC. Полученный раствор перемешивали в течение ночи при комнатной температуре. Полученную смесь упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:10). В результате получали 2 г (74%) (2R)-1-(бензилокси)-3-[4-(4-фторфенил)фенил]-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноата в виде бесцветного масла. MS (ES, m/z): 596 (M+H).
Пример синтеза 66. Получение димера D41.
Димер D41 получали по реакции, приведенной ниже.

(2R)-1-(бензилокси)-3-[4-(4,4-диметилциклогекс-1-ен-1-ил)фенил]-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноат (D41). В 100-миллилитровую 3-горлую круглодонную колбу помещали (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентановую кислоту (542 мг, 2,06 ммоль, 1,00 экв.), бензил (2R)3-[4-(4,4-диметилциклогекс-1-ен-1-ил)фенил]-2-гидроксипропаноат (750 мг, 2,06 ммоль, 1,00 экв.), дихлорметан (60 мл). Затем добавляли DCC (467 мг, 2,26 ммоль, 1,10 экв.), 4-диметиламинопиридин (276 мг, 2,26 ммоль, 1,10 экв.) и HOBt (306 мг, 2,26 ммоль, 1,10 экв.) порциями при 0oC. Полученный раствор перемешивали в течение ночи при комнатной температуре. Полученную смесь упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:20). В результате получали 850 мг (68%) (2R)-1-(бензилокси)-3-[4-(4,4-диметилциклогекс-1-ен-1-ил)фенил]-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноата в виде желтого масла. MS (ES, m/z): 610 (M+H).
Пример синтеза 67. Получение димера D42.
Димер D42 получали по реакции, приведенной ниже.

(2R)-1-(бензилокси)-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил) амино]-3-(4-трет-бутилфенил)пропаноат (D42). В 50-миллилитровую круглодонную колбу помещали тетрагидрофуран (20 мл), (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-3-(4-трет-бутилфенил)пропановую кислоту (1 г, 2,98 ммоль, 1,00 экв.), бензил (2S)-2-гидроксипропаноат (530 мг, 2,94 ммоль, 1,00 экв.), PPh3 (1 г, 3,81 ммоль, 1,30 экв.). Затем добавляли DEAD (670 мг, 3,85 ммоль, 1,30 экв.) по каплям при перемешивании при 0oC. Полученный раствор перемешивали в течение ночи при комнатной температуре. Полученную смесь упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:5). В результате получали 1,4 г (94%) (2R)-1-(бензилокси)-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил) амино]-3-(4-трет-бутилфенил)пропаноата в виде бесцветного масла. MS (ES, m/z): 498 (M+H).
Пример синтеза 68. Получение димера D43.
Димер D43 получали по реакции, приведенной ниже.

(2R)-1-(бензилокси)-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил) амино]-3-(4-фенилфенил)пропаноат (D43). В 50-миллилитровую круглодонную колбу помещали тетрагидрофуран (10 мл), бензил (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-3-(4-фенилфенил)пропаноат (1 г, 2,24 ммоль, 1,00 экв.), бензил-(2S)-2-гидроксипропаноат (760 мг, 4,22 ммоль, 1,88 экв.), PPh3 (1,5 г, 5,72 ммоль, 2,55 экв.). Затем добавляли DEAD (960 мг, 5,51 ммоль, 2,46 экв.) по каплям при перемешивании при 0oC. Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Полученную смесь упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:5). В результате получали 1,1 г (91%) (2R)-1-(бензилокси)-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-3-(4-фенилфенил) пропаноата в виде бесцветного масла. MS (ES, m/z): 518 (M+H);1H ЯМР (300 МГц, CDCl3): δ 7,58-7,30 (м, 14H), 5,27-5,15 (м, 3H), 4,96-4,91 (м, 1H), 3,36-3,30 (м, 1H), 3,06-2,82 (м, 1H), 2,78-2,71 (м, 3H), 1,55-1,52 (м, 3H), 1,46-1,22 (м, 12H).
Пример синтеза 69. Получение димера D44.
Димер D44 получали по реакции, приведенной ниже.

(2R)-1-(бензилокси)-3-[4-(морфолин-4-ил)нафталин-1-ил]-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноат (D44). В 100-миллилитровую круглодонную колбу помещали бензил (2R)-2-гидрокси-3-[4-(морфолин-4-ил)нафталин-1-ил]пропаноат (600 мг, 1,53 ммоль, 1,00 экв.), (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентановую кислоту (600 мг, 2,28 ммоль, 1,49 экв.), дихлорметан (20 мл). Затем добавляли HOBt (410 мг, 3,03 ммоль, 1,98 экв.), 4-диметиламинопиридин (370 мг, 3,03 ммоль, 1,98 экв.) и DCC (470 мг, 2,28 ммоль, 1,49 экв.) порциями при перемешивании при 0oC. Полученный раствор перемешивали в течение ночи при комнатной температуре. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:10). В результате получали 600 мг (61%) (2R)-1-(бензилокси)-3-[4-(морфолин-4-ил)нафталин-1-ил]-1-оксопропан-2-ил (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноата в виде бесцветного масла. MS (ES, m/z): 637 (M+H).
Пример синтеза 70. Получение димера D45.
Димер D45 получали по реакции, приведенной ниже.

(2R)-1-(бензилокси)-3-[4-(циклогекс-1-ен-1-ил)-3-фторфенил]-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноат (D45). В 100-миллилитровую 3-горлую круглодонную колбу в инертной атмосфере азота помещали тетрагидрофуран (25 мл), бензил (2S)-3-[4-(циклогекс-1-ен-1-ил)-3-фторфенил]-2-гидроксипропаноат (710 мг, 2,00 ммоль, 1,00 экв.), (2S)-2-[(трет-бутокси)карбонил] (метил)амино-4-фтор-4-метилпентановую кислоту (527 мг, 2,00 ммоль, 1,00 экв.), PPh3 (790 мг, 3,01 ммоль, 1,50 экв.). Затем добавляли DEAD (517 мг, 2,97 ммоль, 1,50 экв.) по каплям при перемешивании при 0oC. Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Полученную смесь упаривали в вакууме. Остаток очищали методом тонкослойной хроматографии, используя в качестве элюента смесь этилацетат/петролейный эфир (1/5). В результате получали 710 мг (59%) (2R)-1-(бензилокси)-3-[4-(циклогекс-1-ен-1-ил)-3-фторфенил]-1-оксопропан-2-ил (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноата в виде бесцветного масла. MS (ES, m/z): 600 (M+H).
Пример синтеза 71. Получение димера D46.
Димер D46 получали по реакции, приведенной ниже.

(2R)-1-(бензилокси)-3-[4-(4,4-дифторциклогекс-1-ен-1-ил)фенил]-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноат (D46). В 100-миллилитровую круглодонную колбу помещали дихлорметан (50 мл), бензил (2R)-3-[4-(4,4-дифторциклогекс-1-ен-1-ил)фенил]-2-гидроксипропаноат (2 г, 5,37 ммоль, 1,00 экв.), (2S)-2-[(трет-бутокси)карбонил](метил)амино-4-фтор-4-метилпентановую кислоту (1,42 г, 5,39 ммоль, 1,10 экв.). Затем порциями добавляли HOBT (870 мг, 6,44 ммоль, 1,20 экв.). Затем порциями добавляли DCC (1,33 г, 6,45 ммоль, 1,20 экв.). В смесь порциями добавляли 4-диметиламинопиридин (780 мг, 6,38 ммоль, 1,20 экв.). Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Полученную смесь упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:20-1:15). В результате получали 3,2 г (96%) (2R)-1-(бензилокси)-3-[4-(4,4-дифторциклогекс-1-ен-1-ил)фенил]-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноата в виде бесцветного масла. MS (ES, m/z): 618 (M+H);1H ЯМР (300 МГц, CDCl3): δ 7,36-7,34 (м, 5H), 7,26-7,25 (м, 2H), 7,14-7,11 (м, 2H), 5,89 (ушир, 1H), 5,29-5,23 (м, 1H), 5,18-5,06 (м, 2H), 4,89-4,78 (м, 1H), 3,17-3,10 (м, 2H), 2,77-2,65 (м, 7H), 2,23-1,97 (м, 2H), 1,59-1,15 (м, 17H).
Пример синтеза 72. Получение димера D47.
Димер D47 получали по реакции, приведенной ниже.

(2R)-1-(бензилокси)-1-оксо-3-[4-(трифторметокси)фенил]пропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноат (D47). В 250-миллилитровую 3-горлую круглодонную колбу помещали (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентановую кислоту (3,1 г, 11,77 ммоль, 1,00 экв.), бензил (2R)-2-гидрокси-3-[4-(трифторметокси)фенил]пропаноат (4 г, 11,75 ммоль, 1,00 экв.), дихлорметан (120 мл). Затем добавляли DCC (2,7 г, 13,09 ммоль, 1,10 экв.), 4-диметиламинопиридин (1,6 г, 13,10 ммоль, 1,10 экв.) и HOBt (1,7 г, 12,58 ммоль, 1,10 экв.) порциями при перемешивании при 0oC. Полученный раствор перемешивали в течение ночи при комнатной температуре. Полученную смесь упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:10). В результате получали 3,5 г (51%) (2R)-1-(бензилокси)-1-оксо-3-[4-(трифторметокси)фенил]пропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноата в виде желтого масла. MS (ES, m/z): 586 (M+H);1H ЯМР (300 МГц, CDCl3): δ 7,39-7,37 (м, 4H), 7,28-7,26 (м, 1H), 7,19-7,08 (м, 4H), 5,30-5,27 (м, 1H), 5,22-5,10 (м, 2H), 5,05-4,82 (м, 1H), 3,19-3,16 (м, 2H), 2,66 (д, J=22,5 Гц, 3H), 2,28-2,16 (м, 1H), 2,07-1,92 (м, 1H), 1,51-1,33 (м, 15H).
Пример синтеза 73. Получение димера D48.
Димер D48 получали по реакции, приведенной ниже.

(2R)-1-(бензилокси)-3-[4-(3,6-дигидро-2H-пиран-4-ил)-3-фторфенил]-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноат (D48). В 250-миллилитровую круглодонную колбу в инертной атмосфере азота помещали бензил (2S)-3-[4-(3,6-дигидро-2H-пиран-4-ил)-3-фторфенил]-2-гидроксипропаноат (700 мг, 1,96 ммоль, 1,00 экв.), (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентановую кислоту (776 мг, 2,95 ммоль, 1,50 экв.), PPh3 (1,03 г, 3,93 ммоль, 2,00 экв.), тетрагидрофуран (50 мл). Затем добавляли DEAD (684 мг, 3,93 ммоль, 2,00 экв.) по каплям при перемешивании при 0oC. Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Полученную смесь упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1/4). В результате получали 950 мг (80%) (2R)-1-(бензилокси)-3-[4-(3,6-дигидро-2H-пиран-4-ил)-3-фторфенил]-1-оксопропан-2-ил (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноата в виде светло-желтого масла. MS (ES, m/z): 602 (M+H);1H ЯМР (300 МГц, CD3OD): δ 7,36-7,28 (м, 5H), 7,14-7,12 (м, 1H), 6,97-6,93 (м, 2H), 6,03 (ушир, 1H), 5,33-5,31 (м, 1H), 5,17-5,12 (м, 2H), 4,93-4,90 (м, 0,5H), 4,73-4,56 (м, 0,5H), 4,34-4,23 (м, 2H), 3,88-3,83 (м, 2H), 3,15-3,12 (м, 2H), 2,75-2,71 (м, 3H), 2,50 (ушир, 2H), 2,31-1,97 (м, 2H), 1,47-1,23 (м, 15H).
Пример синтеза 74. Получение димера D49.
Димер D49 получали по реакции, приведенной ниже.

(2R)-1-(бензилокси)-3-[4-(циклогекс-1-ен-1-ил)-3-фторфенил]-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноат (D49). В 100-миллилитровую 3-горлую круглодонную колбу в инертной атмосфере азота помещали тетрагидрофуран (25 мл), бензил (2S)-3-[4-(циклогекс-1-ен-1-ил)-3-фторфенил]-2-гидроксипропаноат (710 мг, 2,00 ммоль, 1,00 экв.), (2S)-2-[(трет-бутокси) карбонил](метил)амино-4-фтор-4-метилпентановую кислоту (527 мг, 2,00 ммоль, 1,00 экв.), PPh3 (790 мг, 3,01 ммоль, 1,50 экв.). Затем добавляли DEAD (517 мг, 2,97 ммоль, 1,50 экв.) по каплям при перемешивании при 0oC. Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Полученную смесь упаривали в вакууме. Остаток очищали методом тонкослойной хроматографии, используя в качестве элюента смесь этилацетат/петролейный эфир (1/5). В результате получали 710 мг (59%) (2R)-1-(бензилокси)-3-[4-(циклогекс-1-ен-1-ил)-3-фторфенил]-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси) карбонил](метил)амино]-4-фтор-4-метилпентаноата в виде бесцветного масла. MS (ES, m/z): 600 (M+H);1H ЯМР (300 МГц, CDCl3): δ 7,35-7,27 (м, 5H), 7,15-7,11 (м, 1H), 6,87-6,82 (м, 2H), 5,91 (ушир, 1H), 5,30-5,06 (м, 3H), 4,94-4,65 (м, 1H), 3,14-3,10 (м, 2H), 2,74-2,68 (м, 3H),2,22-1,96 (м, 2H), 1,80-1,70 (м, 4H), 1,69-1,25 (м, 19H).
Пример синтеза 75. Получение димера D50.
Димер D50 получали способом, показанным на схеме 29 ниже.
Схема 29

Подробное описание эксперимента

(2S)-1-(бензилокси)-3-фторпропан-2-ол. В 250-миллилитровую круглодонную колбу помещали раствор (2R)-2-[(бензилокси)метил]оксирана (3 г, 18,27 ммоль, 1,00 экв.) в гептане (50 мл), TBABF (15 г, 3,00 экв.), KHF2 (3,2 г, 3,00 экв.). Полученный раствор перемешивали в течение 5 часов при 130oC. Затем реакцию гасили добавлением 200 мл смеси вода/лед. Полученный раствор экстрагировали 3x50 мл этилацетата, и органические слои объединяли и сушили над безводным сульфатом натрия и упаривали в вакууме. В результате получали 3,1 г (92%) (2S)-1-(бензилокси)-3-фторпропан-2-ола в виде бесцветного масла.1H ЯМР (300 МГц, CDCl3): δ 7,41-7,29 (м, 5H), 4,61 (с, 2H), 4,60-4,51 (м, 1H), 4,39-4,36 (м, 1H), 4,13-4,00 (м, 1H), 3,64-3,54 (м, 2H);19F ЯМР (300 МГц, CDCl3): δ 232,19.

(2S)-1-(бензилокси)-3-фторпропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил) амино]-4-метилпентаноат. В 500-миллилитровую круглодонную колбу помещали дихлорметан (200 мл), (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентановую кислоту (14,6 г, 59,52 ммоль, 1,10 экв.), (2S)-1-(бензилокси)-3-фторпропан-2-ол (10 г, 54,29 ммоль, 1,00 экв.), DCC (14 г, 67,85 ммоль, 1,25 экв.), 4-диметиламинопиридин (8 г, 65,48 ммоль, 1,21 экв.), HOBT (8,8 г, 65,13 ммоль, 1,20 экв.). Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:10). В результате получали 16 г (72%) (2S)-1-(бензилокси)-3-фторпропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентаноата в виде бесцветного масла. MS (ES, m/z): 412(M+H).

(2S)-1-фтор-3-гидроксипропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентаноат. В 100-миллилитровую круглодонную колбу помещали метанол (30 мл), (2S)-1-(бензилокси)-3-фторпропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метил пентаноат (7 г, 17,01 ммоль, 1,00 экв.) и палладий на угле (2 г). Подключали к колбе источник водорода. Полученный раствор перемешивали в течение ночи при комнатной температуре. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. В результате получали 5,3 г (97%) (2S)-1-фтор-3-гидроксипропан-2-ил-(2S)-2-[[(трет-бутокси) карбонил](метил)амино]-4-метилпентаноата в виде светло-желтого масла. MS (ES, m/z): 322(M+H).

(2S)-2-[[(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентаноил]окси]-3-фторпропановая кислота (D50). В 1000-миллилитровую круглодонную колбу помещали воду (100 мл), хлороформ (150 мл), ACN (150 мл), (2S)-1-фтор-3-гидроксипропан-2-ил (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентаноат (6 г, 18,67 ммоль, 1,00 экв.), RuCl3 (2,1 г), NaIO4 (20 г). Полученный раствор перемешивали в течение 3 часов при комнатной температуре. Твердый осадок отфильтровывали. Полученный раствор экстрагировали 3x50 мл этилацетата, и органические слои объединяли. Полученную смесь промывали 3x60 мл насыщенного раствора хлорида натрия. Смесь сушили над безводным сульфатом натрия и упаривали в вакууме. В результате получали 4,2 г (67%) (2S)-2-[[(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентаноил]окси]-3-фторпропановой кислоты в виде желтого масла. MS (ES, m/z): 236 (M+H - Boc);1H ЯМР (300 МГц, CDCl3): δ 5,42 (ушир, 1H), 4,92-4,63 (м, 3H), 2,85-2,82 (м, 3H), 1,83-1,53 (м, 3H), 1,46 (с, 9H), 1,02-0,86 (м, 6H).
Пример синтеза 76. Получение димера D51.
Димер D51 получали по реакции, приведенной ниже.

(2R)-1-(бензилокси)-3-[4-(3,3-дифторпирролидин-1-ил)фенил]-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентаноат (D51). В 250-миллилитровую 3-горлую круглодонную колбу помещали бензил (2R)-3-[4-(3,3-дифторпирролидин-1-ил)фенил]-2-гидроксипропаноат (1,5 г, 4,15 ммоль, 1,00 экв.), (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентановую кислоту (1 г, 4,08 ммоль, 1,00 экв.), дихлорметан (80 мл). Затем добавляли DCC (1,1 г, 5,33 ммоль, 1,20 экв.), 4-диметиламинопиридин (600 мг, 4,91 ммоль, 1,20 экв.) и HOBT (700 мг, 5,18 ммоль, 1,20 экв.) порциями при перемешивании при 0oC. Полученный раствор перемешивали в течение ночи при комнатной температуре. Полученную смесь упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:15). В результате получали 1,7 г (70%) (2R)-1-(бензилокси)-3-[4-(3,3-дифторпирролидин-1-ил)фенил]-1-оксопропан-2-ил (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентаноата в виде желтого масла. MS (ES, m/z): 589 (M+H).
Пример синтеза 77. Получение димера D52.
Димер D52 получали по реакции, приведенной ниже.

[(1R)-1-бензил-2-бензилокси-2-оксо-этил]-(2S)-2-[трет-бутоксикарбонил(метил)амино]-4,4-диметил-пентаноат (D52). В перемешиваемый раствор N-трет-бутоксикарбонил-N-метил-гама-метил-L-лейцина (0,8 г, 3,1 ммоль), бензил R-2-гидрокси-3-фенилпропионата (0,8 г, 3,1 ммоль) и DMAP (кат.) в 8 мл ДХМ, охлажденный до 00C, добавляли EDAC (1,0 г, 4,6 ммоль), и смесь перемешивали в течение ночи, оставляя ее нагреваться до комнатной температуры. Смесь разбавляли добавлением 70 мл ДХМ, промывали 70 мл воды, сушили над сульфатом натрия, фильтровали, упаривали, и остаток очищали на колонке с силикагелем, элюируя смесью этилацетат/гептан, получая целевое соединение в виде белого твердого вещества. Выход: 1,46 г, 95%.1H ЯМР (ДМСО-d6):
Пример синтеза 78. Получение димера D53.
Димер D53 получали по реакции, приведенной ниже.
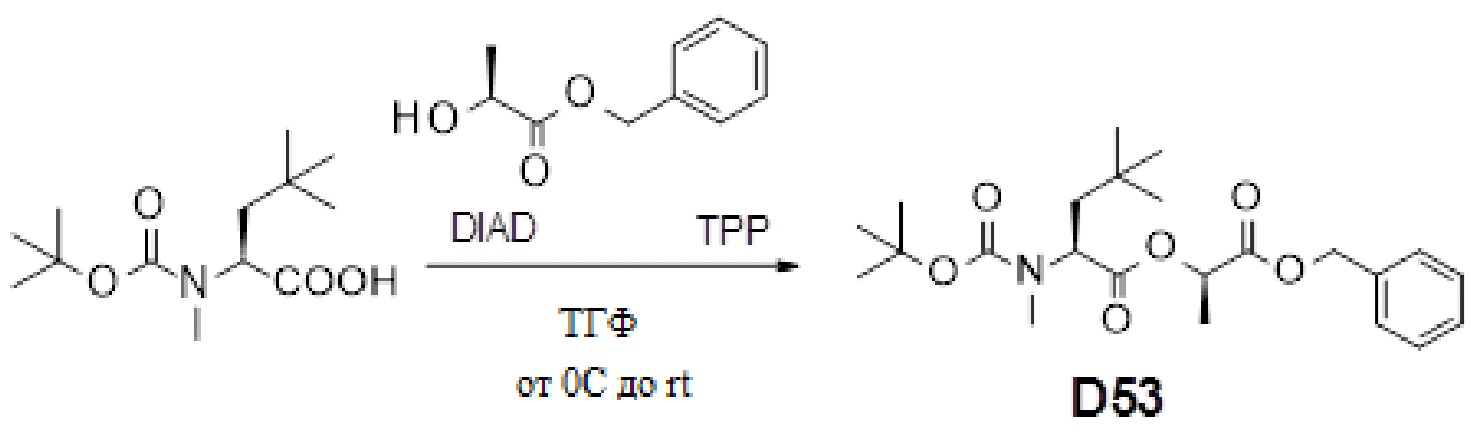
[(1R)-2-бензилокси-1-метил-2-оксо-этил]-(2S)-2-[трет-бутоксикарбонил(метил)амино]-4,4-диметил-пентаноат (D53). В перемешиваемый раствор N-трет-бутоксикарбонил-N-метил-гамма-метил-L-лейцина (0,8 г, 3,1 ммоль), бензил L-лактата (0,56 г, 3,1 ммоль) и трифенилфосфина (1,0 г, 3,7 ммоль) в 8 мл ТГФ, охлажденный до 00C, добавляли по каплям раствор диизобутилазодикарбоксилата (0,76 г, 3,7 ммоль) в 2 мл ТГФ, и смесь перемешивали в течение ночи, оставляя ее нагреваться до комнатной температуры. Смесь разбавляли 100 мл этилацетата, промывали 100 мл воды, насыщенным раствором хлорида натрия, сушили над сульфатом натрия и упаривали. Остаток очищали на колонке с силикагелем, элюируя этилацетатом и гептаном, получая целевое соединение в виде прозрачного масла. Выход: 1,3г (количественный).1H ЯМР (ДМСО-d6):
Пример синтеза 79. Получение димера D54.
Димер D54 получали по реакции, приведенной ниже.

[(1R)-2-бензилокси-1-[(6-морфолино-3-пиридил)метил]-2-оксо-этил]-(2S)-2-[трет-бутокси-карбонил(метил)амино]-4-фтор-4-метил-пентаноат (D54). В перемешиваемый раствор N-трет-бутоксикарбонил-N-метил-гамма-фтор-L-лейцина (0,31 г, 1,2 ммоль), бензил R-2-гидрокси-3-[2-(4-морфолино)-5-пиридил]пропионата (0,4 г, 1,2 ммоль) и DMAP (кат.) в 5 мл ДХМ, охлажденный до 00C, добавляли EDAC (0,34 г, 1,8 ммоль), и смесь перемешивали в течение ночи, оставляя ее нагреваться до комнатной температуры. Смесь разбавляли добавлением 50 мл ДХМ, промывали 50 мл воды, сушили над сульфатом натрия, фильтровали, упаривали, и остаток очищали на колонке с силикагелем, элюируя этилацетатом и гептаном, получая целевое соединение в виде прозрачного масла. Выход: 0,56г, 82%. MS (CI, m/z): 588 (M+H).
Пример синтеза 80. Получение димера D55.
Димер D55 получали по реакции, приведенной ниже.

[(1R)-2-бензилокси-2-оксо-1-[[6-(трифторметил)-3-пиридил]метил]этил]-(2S)-2-[трет-бутокси-карбонил(метил)амино]-4-фтор-4-метил-пентаноат (D55). В перемешиваемый раствор N-трет-бутокси-карбонил-N-метил-гамма-фтор-L-лейцина (0,46 г, 1,7 ммоль), бензил R-2-гидрокси-3-[2-(трифтор-метил)-5-пиридил]пропаноата (0,56 г, 1,7 ммоль) и DMAP (кат.) в 6 мл ДХМ, охлажденный до 00C, добавляли EDAC (0,51 г, 2,6 ммоль), и смесь перемешивали в течение ночи, оставляя ее нагреваться до комнатной температуры. Смесь разбавляли добавлением 50 мл ДХМ, промывали 50 мл воды, сушили над сульфатом натрия, фильтровали, упаривали, и остаток очищали на колонке с силикагелем, элюируя этилацетатом и гептаном, получая целевое соединение в виде прозрачного масла. Выход: 0,80г, 81%. MS (CI, m/z): 571 (M+H);1H ЯМР (CDCl3):
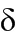
Пример синтеза 81. Получение димера D56.
Димер D56 получали по реакции, приведенной ниже.

[(1R)-2-бензилокси-2-оксо-1-[[6-(трифторметил)-3-пиридил]метил]этил]-(2S)-2-[трет-бутокси-карбонил(метил)амино]-4-метил-пентаноат (D56). В перемешиваемый раствор N-трет-бутоксикарбонил-N-метил-гамма-фтор-L-лейцина (0,46 г, 1,7 ммоль), бензил R-2-гидрокси-3-[2-(трифторметил)-5-пиридил]пропаноата (0,56 г, 1,7 ммоль) и DMAP (кат.) в 6мл ДХМ, охлажденный до 00C, добавляли EDAC (0,51 г, 2,6 ммоль), и смесь перемешивали в течение ночи, оставляя ее нагреваться до комнатной температуры. Смесь разбавляли добавлением 50 мл ДХМ, промывали 50 мл воды, сушили над сульфатом натрия, фильтровали, упаривали, и остаток очищали на колонке с силикагелем, элюируя этилацетатом и гептаном, получая целевое соединение в виде прозрачного масла. Выход: 0,80г, 81%. MS (CI, m/z): 553 (M+H).
Пример синтеза 82. Получение димера D57.
Димер D57 получали способом, показанным на схеме 30 ниже.
Схема 30

Подробное описание эксперимента

бензил (2S)-2-(трифторметилсульфонилокси)пропаноат. В раствор бензил (S)-лактата (3,5 г, 17,5 ммоль) и 2,6-лутидина (2,0 г, 18,4 ммоль) в 100 мл ДХМ, охлажденный до 00C, добавляли ангидрид трифторуксусной кислоты (5,3 г, 18,4 ммоль), и смесь перемешивали 1 час. Смесь упаривали, и остаток очищали на колонке с силикагелем, элюируя этилацетатом и гептаном, получая целевое соединение в виде светло-розового масла. Выход: 3,8 г, 70%.1H ЯМР (CD2Cl2):
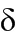
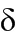

трет-бутил N-[(1S)-1-(гидроксиметил)-3-метил-бутил]-N-метил-карбамат. В раствор N-boc-N-метил-(L)-лейцина (4,0 г, 16 ммоль) в 20 мл ТГФ добавляли 18 мл 1M раствор комплекса боран-ТГФ в ТГФ, и смесь перемешивали 30 минут. Смесь гасили добавлением 10мл метанола и упаривали. Остаток растворяли в 150 мл этилацетата, промывали 100 мл воды, промывали насыщенным раствором хлорида натрия, сушили над сульфатом натрия, фильтровали и упаривали, получая целевое соединение в виде прозрачного масла. Выход: 3,5г, 93%.1H ЯМР (CD2Cl2):
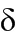

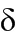
Пример синтеза 83. Получение соединения 4-18

4-18
Соединение 4-18 получали согласно схемам 31-33, изображенным ниже.
Схема 31

Схема 32
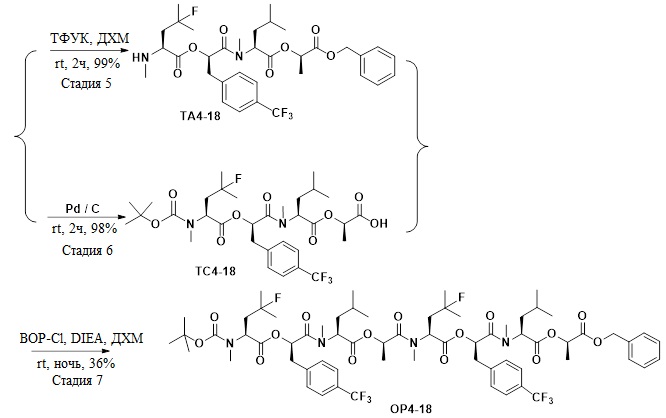
Схема 33

1. Получение интермедиата DC2

2. Получение интермедиата DA9

(2R)-1-(бензилокси)-1-оксопропан-2-ил-(2S)-4-метил-2- (метиламино)пентаноат. В 100-миллилитровую круглодонную колбу помещали дихлорметан (15 мл), (2R)-1-(бензилокси)-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентаноат (2,5 г, 6,13 ммоль, 1,00 экв.), трифторуксусную кислоту (4 мл, 20,00 экв.). Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Значение pH раствора доводили до 9 добавлением раствора бикарбоната натрия (2 моль/л). Полученный раствор экстрагировали 3x20 мл этилацетата, органические слои объединяли и сушили над безводным сульфатом натрия и упаривали в вакууме. В результате получали 2 г (95%) (2R)-1-(бензилокси)-1-оксопропан-2-ил (2S)-4-метил-2-(метиламино)пентаноата в виде бесцветного масла.
3. Получение интермедиата TP4-18

4. Синтез интермедиата TA4-18

5. Синтез интермедиата TC4-18

TC4-18. В 50-миллилитровую круглодонную колбу, продутую и заполненную водородом, помещали метанол (10 мл), TP4-18 (700 мг, 0,91 ммоль, 1,00 экв.), палладий на угле (70 мг, 0,40 экв.). Полученный раствор перемешивали в течение 1 часа при комнатной температуре. Твердый осадок отфильтровывали. Полученную смесь упаривали в вакууме, получая TC4-18 (610 мг, 98%) в виде белого твердого вещества.
6. Синтез OP4-18

OP4-18. В 100-миллилитровую круглодонную колбу помещали дихлорметан (20 мл), TC4-18 (700 мг, 1,03 ммоль, 1,00 экв.), TA4-18 (700 мг, 1,05 ммоль, 1,00 экв.), BOP-Cl (530 мг, 2,08 ммоль, 2,02 экв.), DIEA (270 мг, 2,09 ммоль, 2,03 экв.) при 0oC. Полученный раствор перемешивали в течение ночи при комнатной температуре. Твердый осадок отфильтровывали. Остаток упаривали в вакууме и наносили на колонку с силикагелем, элюируя смесью этилацетат/петролейный эфир (1:2), получая OP4-18 (500 мг, 36%) в виде светло-желтого масла.
7. Синтез интермедиата OA4-18

OA4-18. В 50-миллилитровую круглодонную колбу помещали дихлорметан (10 мл), интермедиат OP4-18 (600 мг, 0,45 ммоль, 1,00 экв.), трифторуксусную кислоту (4 мг, 0,04 ммоль, 20,00 экв.). Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Значение pH раствора доводили до 9 добавлением раствора бикарбоната натрия (2 моль/л). Полученный раствор экстрагировали 3x30 мл этилацетата. Органические слои объединяли и сушили над безводным сульфатом натрия и упаривали в вакууме. В результате получали 520 мг (94%) OA4-18 в виде светло-желтого масла.
Синтез интермедиата OAC4-18

OAC4-18. В 50-миллилитровую круглодонную колбу, продутую и заполненную водородом, помещали метанол (15 мл), интермедиат 4-18-9 (400 мг, 0,33 ммоль, 1,00 экв.), палладий на угле (100 мг, 0,60 экв.). Полученный раствор перемешивали в течение 1 часа при комнатной температуре. Твердый осадок отфильтровывали. Полученную смесь упаривали в вакууме. В результате получали 340 мг (92%) OAC4-18 в виде бесцветного твердого вещества.
9. Получение соединения 4-18
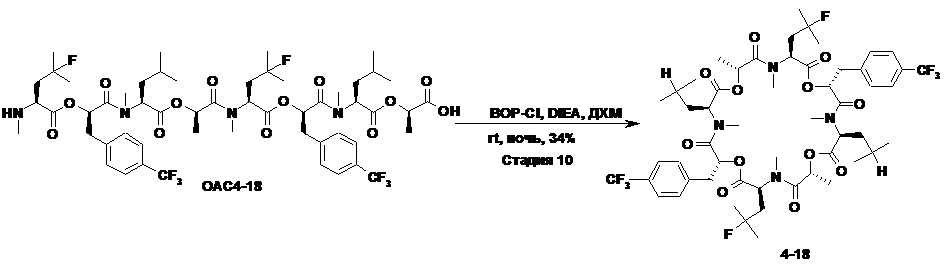
1H ЯМР (300 МГц, CDCl3): δ 7,58 - 7,56 (м, 4H), 7,39 -7,28 (м, 4H), 5,76 - 5,70 (м, 2H), 5,42 -5,15 (м, 5H), 4,51 (м, 1H), 3,2 - 3,07 (м, 4H), 3,01 (м, 2H), 2,88 - 2,76 (м, 10H), 2,21 - 1,91 (м, 4H), 1,70 - 1,66 (м, 2H), 1,52-1,27 (м, 19H), 1,17-0,80 (м, 15H). [α]= -50,08o (T=27,2oC, c 0,86г/100мл в MeOH).
Пример синтеза 84. Получение соединения 6-18

6-18
Соединение 6-18 получали аналогично соединению 4-18 согласно схемам 34-36, изображенным ниже.
Схема 34

Схема 35

Схема 36

1. Синтез D8

(2R)-1-(бензилокси)-3-[4-(морфолин-4-ил)фенил]-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноат. В 250-миллилитровую круглодонную колбу в инертной атмосфере азота при 0oC помещали дихлорметан (50 мл), бензил (2R)-2-гидрокси-3-[4-(морфолин-4-ил)фенил]пропаноат (2,72г, 7,97 ммоль, 1,00 экв.), (2S)-2-[(трет-бутокси)карбонил](метил)амино-4-фтор-4-метилпентановую кислоту (2,1 г, 7,98 ммоль, 1,00 экв.), HOBT (1,2 г, 8,89 ммоль, 1,10 экв.), DCC (1,8 г, 8,74 ммоль, 1,10 экв.), 4-диметиламинопиридин (1,1 г, 9,00 ммоль, 1,10 экв.). Полученный раствор перемешивали в течение ночи при комнатной температуре. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:10-1:5). В результате получали 3,5 г (75%) (2R)-1-(бензилокси)-3-[4-(морфолин-4-ил)фенил]-1-оксопропан-2-ил (2S)-2-[[(трет-бутокси) карбонил](метил)амино]-4-фтор-4-метилпентаноата в виде бесцветного масла.
2. Синтез DC8

(2R)-2-[[(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноил] окси]-3-[4-(морфолин-4-ил)фенил]пропановая кислота. В 50-миллилитровую круглодонную колбу, продутую и заполненную водородом, помещали этилацетат (10 мл), Pd/C (130 мг), (2R)-1-(бензилокси)-3-[4-(морфолин-4-ил)фенил]-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил] (метил)амино]-4-фтор-4-метилпентаноат (650 мг, 1,11 ммоль, 1,00 экв.). Полученный раствор перемешивали в течение 1,5 часов при комнатной температуре. Твердый осадок отфильтровывали. Полученную смесь упаривали в вакууме. В результате получали 540 мг (98%) (2R)-2-[[(2S)-2-[[(трет-бутокси) карбонил](метил)амино]-4-фтор-4-метилпентаноил]окси]-3-[4-(морфолин-4-ил)фенил] пропановой кислоты в виде белого твердого вещества.
3. Синтез DA9

(2R)-1-(бензилокси)-1-оксопропан-2-ил-(2S)-4-метил-2-(метиламино)пентаноат. В 50-миллилитровую круглодонную колбу помещали диоксан/HCl (10 мл), (2R)-1-(бензилокси)-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентаноат (460 мг, 1,13 ммоль, 1,00 экв.). Полученный раствор перемешивали в течение 1,5 часов при комнатной температуре. Затем реакцию гасили добавлением 10 мл NaHCO3 (водный раствор). Полученный раствор экстрагировали 3x20 мл дихлорметана, и органические слои объединяли. Полученную смесь промывали 3x5 мл насыщенного раствора хлорида натрия. Смесь сушили над безводным сульфатом натрия и упаривали в вакууме. В результате получали 340 мг (98%) (2R)-1-(бензилокси)-1-оксопропан-2-ил-(2S)-4-метил-2-(метиламино)пентаноата (DA9) в виде бесцветного масла.
4. Синтез TP6-18

TP6-18. В 50-миллилитровую круглодонную колбу помещали дихлорметан (10 мл), (2R)-2-[[(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноил]окси]-3-[4-(морфолин-4-ил)фенил]пропановую кислоту (540 мг, 1,09 ммоль, 1,00 экв.), (2R)-1-(бензилокси)-1-оксопропан-2-ил-(2S)-4-метил-2-(метиламино)пентаноат (DC8, 340 мг, 1,11 ммоль, 1,00 экв.), BOP-Cl (554 мг, 2,18 ммоль, 2,00 экв.). Затем добавляли DIEA (280 мг, 2,17 ммоль, 2,00 экв.) по каплям при перемешивании при 0oC. Полученный раствор перемешивали в течение ночи при комнатной температуре. Полученную смесь упаривали в вакууме. Остаток очищали методом препаративной ТСХ (EA: PE= 1:2). В результате получали 510 мг (60%) TP6-18 в виде бесцветного масла.
5. Синтез TC6-18

TC6-18. В 50-миллилитровую круглодонную колбу, продутую и заполненную водородом, помещали этилацетат (10 мл), Pd/C (52 мг), TP6-18 (260 мг, 0,33 ммоль, 1,00 экв.). Полученный раствор перемешивали в течение 1,5 часов при комнатной температуре. Твердый осадок отфильтровывали. Полученную смесь упаривали в вакууме. В результате получали 230 мг (100%) TC6-18 в виде белого твердого вещества.
6. Синтез TA6-18

TA6-18. В 50-миллилитровую круглодонную колбу помещали диоксан/HCl (10 мл), TP6-18 (250 мг, 0,32 ммоль, 1,00 экв.). Полученный раствор перемешивали в течение 1,5 часов при комнатной температуре. Затем реакцию гасили добавлением 10 мл NaHCO3(водный раствор). Полученный раствор экстрагировали 3x20 мл дихлорметана, и органические слои объединяли. Полученную смесь промывали 3x5 мл насыщенного раствора хлорида натрия. Смесь сушили над безводным сульфатом натрия и упаривали в вакууме. В результате получали 215 мг (99%) TA6-18 в виде бесцветного масла.
7. Синтез OP6-18

OP6-18. В 50-миллилитровую круглодонную колбу помещали дихлорметан (10 мл), TC6-18 (218 мг, 0,31 ммоль, 1,00 экв.), TA6-18 (215 мг, 0,31 ммоль, 1,00 экв.), BOP-Cl (159 мг, 0,62 ммоль, 2,00 экв.). Затем добавляли DIEA (80 мг, 0,62 ммоль, 2,00 экв.) по каплям при перемешивании при 0oC. Полученный раствор перемешивали в течение 3 часов при комнатной температуре. Полученную смесь упаривали в вакууме. Остаток очищали методом препаративной ТСХ (EA:петролейный эфир = 1:1). В результате получали 280 мг (66%) OP6-18 в виде белого твердого вещества.
8. Синтез OA6-18
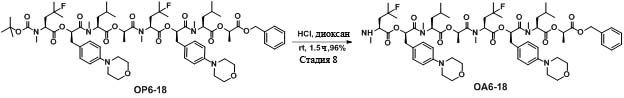
OA6-18. В 50-миллилитровую круглодонную колбу помещали диоксан/HCl (10 мл), OP6-18 (280 мг, 0,21 ммоль, 1,00 экв.). Полученный раствор перемешивали в течение 1 часа при комнатной температуре. Затем реакцию гасили добавлением 10 мл NaHCO3 (aq). Полученный раствор экстрагировали 3x20 мл дихлорметана, и органические слои объединяли. Полученную смесь промывали 3x5 мл насыщенного раствора хлорида натрия. Дихлорметановую фазу сушили над безводным сульфатом натрия и упаривали в вакууме. В результате получали 250 мг (96%) OA6-18 в виде бесцветного масла.
9. Синтез OAC6-18

OAC6-18. В 50-миллилитровую круглодонную колбу помещали этилацетат (10 мл), Pd/C (50 мг), OA6-18 (250 мг, 0,20 ммоль, 1,00 экв.), колбу откачивали и заполняли три раза водородом, после чего продували водородом. Полученный раствор перемешивали в течение 1,5 часов при комнатной температуре в атмосфере водорода. Твердый осадок отфильтровывали. Полученную смесь упаривали в вакууме. В результате получали 200 мг (86%) OAC6-18 в виде белого твердого вещества.
10. Синтез 6-18

6-18. В 250-миллилитровую круглодонную колбу помещали дихлорметан (100 мл), OAC6-18 (200 мг, 0,17 ммоль, 1,00 экв.), BOP-Cl (86 мг, 0,34 ммоль, 2,00 экв.). Затем добавляли DIEA (44 мг, 0,34 ммоль, 2,00 экв.) по каплям при перемешивании при 0oC. Полученный раствор перемешивали в течение ночи при комнатной температуре. Полученную смесь упаривали в вакууме. Сырой продукт очищали методом Преп-ВЭЖХ в следующих условиях: Колонка: SunFire Prep C18 5мкм 19*150мм; подвижная фаза: вода (содержит 0,1% мураьвиной кислоты и CH3CN; Градиент: от 15% до 25% за 4 минуты, от 25% до 60% за 6 минут; Скорость потока: 15 мл/мин; Детектор УФ: 254 нм. В результате получали 45,6 мг (23%) 6-18 в виде белого твердого вещества. (ES, m/z): 1154,6 (вычислено, M), 1156,0 (найдено, M+H).1H ЯМР: (300 МГц, CD3OD): δ7,21-7,16 (м, 4H), 6,95-6,91 (м, 4H), 5,83-5,10 (м, 7H), 4,97-4,90 (м, 1H), 3,91-9,79 (м, 8H), 3,18-2,81 (м, 24H), 2,41-2,02 (м, 4H), 1,83-1,31 (м, 21H), 1,2-0,75 (м, 15H), [α]= -62o (T=27,2oC, c 0,528г/100мл в MeOH).
Пример синтеза 85. Получение соединения 7-27:

7-27
Соединение 7-27 получали согласно схемам 37-39, приведенным ниже:
Схема 37
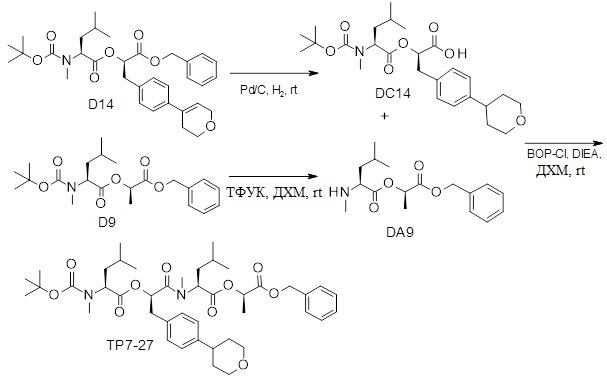
Схема 38

Схема 39

Подробное описание эксперимента

(2R)-2-[[(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентаноил]окси]-3-[4-(оксан-4-ил)фенил]пропановая кислота. В 500-миллилитровую круглодонную колбу, продутую и заполненную водородом, помещали метанол (50 мл), (2R)-1-(бензилокси)-3-[4-(3,6-дигидро-2H-пиран-4-ил)фенил]-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил] (метил)амино]-4-метил пентаноат (7 г, 12,37 ммоль, 1,00 экв.), палладий на угле (2 г, 0,60 экв.). Полученный раствор перемешивали в течение 1 часа при комнатной температуре. Твердый осадок отфильтровывали. Полученную смесь упаривали в вакууме. В результате получали 5 г (85%) (2R)-2-[[(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентаноил]окси]-3-[4-(оксан-4-ил)фенил]пропановой кислоты в виде светло-желтого масла, MS (ES, m/z): 478 (M+H).

(2R)-1-(бензилокси)-1-оксопропан-2-ил-(2S)-4-метил-2- (метиламино)пентаноат. В 250-миллилитровую круглодонную колбу помещали дихлорметан (25 мл), (2R)-1-(бензилокси)-1-оксопропан-2-ил (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентаноат (5,0 г, 12,27 ммоль, 1,00 экв.), трифторуксусную кислоту (6 мл, 20,00 экв.). Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Значение pH раствора доводили до 9 добавлением раствора бикарбоната натрия (2 моль/л). Полученный раствор экстрагировали 3x20 мл дихлорметана, органические слои объединяли и сушили над безводным сульфатом натрия и упаривали в вакууме. В результате получали 3,6г (95%) (2R)-1-(бензилокси)-1-оксопропан-2-ил (2S)-4-метил-2-(метиламино)пентаноата в виде желтого масла, MS (ES, m/z): 308 (M+H).
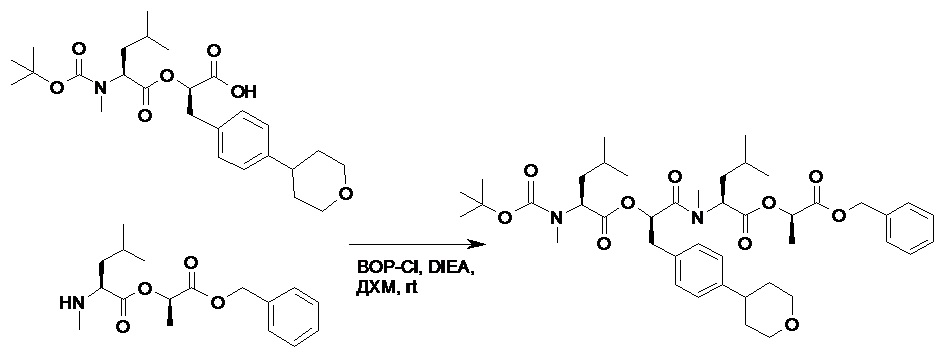
TP7-27. В 250-миллилитровую круглодонную колбу помещали (2R)-2-[[(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентаноил]окси]-3-[4-(оксан-4-ил)фенил] пропановую кислоту (6 г, 12,56 ммоль, 1,00 экв.), (2R)-1-(бензилокси)-1-оксопропан-2-ил-(2S)-4-метил-2-(метиламино)пентаноат (5 г, 16,27 ммоль, 1,00 экв.), BOP-Cl (6,4 г, 25,14 ммоль, 2,00 экв.), DIEA (3,2 г, 24,76 ммоль, 1,97 экв.). Полученный раствор перемешивали в течение ночи при комнатной температуре. Твердый осадок отфильтровывали. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:10). В результате получали 4,5 г (47%) TP7-27 в виде желтого масла, MS (ES, m/z): 767 (M+H).

TC7-27. В 100-миллилитровую круглодонную колбу, продутую и заполненную водородом, помещали TP7-27 (4,6 г, 6,00 ммоль, 1,00 экв.), палладий на угле (2 г, 0,50 экв.). Полученный раствор перемешивали в течение 1 часа при комнатной температуре. Твердый осадок отфильтровывали. Полученную смесь упаривали в вакууме. В результате получали 4,0 г (99%) TC7-27 в виде твердого вещества, MS (ES, m/z): 677 (M+H).

TA7-27. В 100-миллилитровую круглодонную колбу помещали TP7-27 (4,8 г, 6,26 ммоль, 1,00 экв.), трифторуксусную кислоту (5 мл, 20,00 экв.). Полученный раствор перемешивали в течение 1 часа при комнатной температуре. Значение pH раствора доводили до 9 добавлением раствора бикарбоната натрия (2 моль/л). Полученный раствор экстрагировали 3x30 мл дихлорметана, органические слои объединяли и сушили над безводным сульфатом натрия и упаривали в вакууме. В результате получали 4,0 г (96%) TA7-27 в виде светло-желтого масла, MS (ES, m/z): 677 (M+H).

OP7-27. В 100-миллилитровую круглодонную колбу помещали TA7-27 (4,2 г, 6,30 ммоль, 1,00 экв.), TC7-27 (4,0 г, 5,91 ммоль, 1,00 экв.), BOP-Cl (3,1 г, 12,18 ммоль, 1,93 экв.), DIEA (1,7 г, 13,15 ммоль, 2,09 экв.). Полученный раствор перемешивали в течение 3 часов при комнатной температуре. Твердый осадок отфильтровывали. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:10). В результате получали 3,5 г (42%) OP7-27 в виде белого твердого вещества, MS (ES, m/z): 1326 (M+H).

OA7-27. В 100-миллилитровую круглодонную колбу помещали OP7-27 (3,5 г, 2,64 ммоль, 1,00 экв.), трифторуксусную кислоту (5 мл, 20,00 экв.). Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Значение pH раствора доводили до 9 добавлением раствора бикарбоната натрия (2 моль/л). Полученную смесь промывали 3x30 мл ДХМ. Смесь сушили над безводным сульфатом натрия и упаривали в вакууме. В результате получали 3,1 г (96%) OA7-27 в виде белого твердого вещества, MS (ES, m/z): 1226 (M+H).

OAC7-27. В 100-миллилитровую круглодонную колбу, продутую и заполненную водородом, помещали OC7-27 (3,1 г, 2,53 ммоль, 1,00 экв.), палладий на угле (1,5 г, 0,50 экв.). Полученный раствор перемешивали в течение 1 часа при комнатной температуре. Твердый осадок отфильтровывали. Полученную смесь упаривали в вакууме. В результате получали 2,7г (94%) OAC7-27 в виде белого твердого вещества, MS (ES, m/z): 1136 (M+H).

7-27. В 500-миллилитровую круглодонную колбу помещали OAC7-27 (2,7 г, 2,38 ммоль, 1,00 экв.), BOP-Cl (2 г, 7,86 ммоль, 2,00 экв.), DIEA (1 г, 7,74 ммоль, 3,25 экв.). Полученный раствор перемешивали в течение 3 часов при комнатной температуре. Твердый осадок отфильтровывали. Сырой продукт очищали методом Преп-ВЭЖХ в следующих условиях: SunFire Prep C18 5мкм 19*150мм; подвижная фаза, вода (содержит 0,05% трифторуксусной кислоты) и CH3CN; Градиент: от 87% до 90% за 8 минут; Скорость потока: 20 мл/мин; Детектор УФ: 254 нм. В результате получали 350,1 мг (13%) 7-27 в виде белого твердого вещества. MS (ES, m/z): 1116,7 (вычислено, M), 1118,0 (найдено, M+H);1H ЯМР (300 МГц, CD3OD): δ 7,26 - 7,24 (м, 8H),5,81 - 5,73 (м, 2H), 5,55 - 5,43 (м, 5H), 4,88 (м, 1H), 4,06 - 4,03 (м, 4H), 3,56- 3,53 (м, 4H), 3,35 - 3,08 (м, 4H), 2,95 - 2,93 (м, 7H), 2,87 -2,80 (м, 7H), 1,81 - 1,37 (м, 22H), 1,07 - 0,81 (м, 28H).
Пример синтеза 86. Получение соединения 18-19

Соединение 18-19 получали согласно схемам 40-42
Схема 40

Схема 41

Схема 42

Подробное описание эксперимента

(2R)-2-[[(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентаноил]окси]-3-(4-трет-бутилфенил)пропановая кислота. В 100-миллилитровую круглодонную колбу помещали (2R)-1-(бензилокси)-3-(4-трет-бутилфенил)-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентаноат (1 г, 1,85 ммоль, 1,00 экв.), палладий на угле (200 мг), метанол (30 мл). Подключали колбу к источнику водорода. Полученную смесь перемешивали в течение 1 часа при комнатной температуре. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. В результате получали 830 мг (100%) (2R)-2-[[(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентаноил]окси]-3-(4-трет-бутилфенил)пропановой кислоты в виде белого твердого вещества. MS (ES, m/z): 450 (M+H).

(2R)-2-[[(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентаноил]окси]-3-(4-трет-бутилфенил)пропановая кислота. В 100-миллилитровую круглодонную колбу помещали (2R)-1-(бензилокси)-3-(4-трет-бутилфенил)-1-оксопропан-2-ил (2S)-2-[[(трет-бутокси)карбонил](метил) амино]-4-метилпентаноат (1 г, 1,85 ммоль, 1,00 экв.), палладий на угле (200 мг), метанол (30 мл). Подключали колбу к источнику водорода. Полученную смесь перемешивали в течение 1 часа при комнатной температуре. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. В результате получали 830 мг (100%) (2R)-2-[[(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентаноил]окси]-3-(4-трет-бутилфенил)пропановой кислоты в виде белого твердого вещества. MS (ES, m/z): 450 (M+H).

TP18-19. В 250-миллилитровую 3-горлую круглодонную колбу помещали (2R)2-[[(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентаноил]окси]-3-(4-трет-бутилфенил) пропановую кислоту (1 г, 2,22 ммоль, 1,00 экв.), (2R)1-(бензилокси)-1-оксопропан-2-ил (2S)-4-фтор-4-метил-2-(метиламино)пентаноат (760 мг, 2,34 ммоль, 1,00 экв.), дихлорметан (100 мл). Затем добавляли BOP-Cl (1,2 г, 4,71 ммоль, 2,00 экв.) порциями и DIEA (603 мг, 4,67 ммоль, 2,00 экв.) по каплям при перемешивании при 0oC. Полученный раствор перемешивали в течение ночи при комнатной температуре. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. Остаток наносили на колонку с силикагелем, элюируя смесью этилацетат/петролейный эфир (1:5). В результате получали 900 мг (53%) TP18-19 в виде желтого масла. MS (ES, m/z): 757 (M+H).
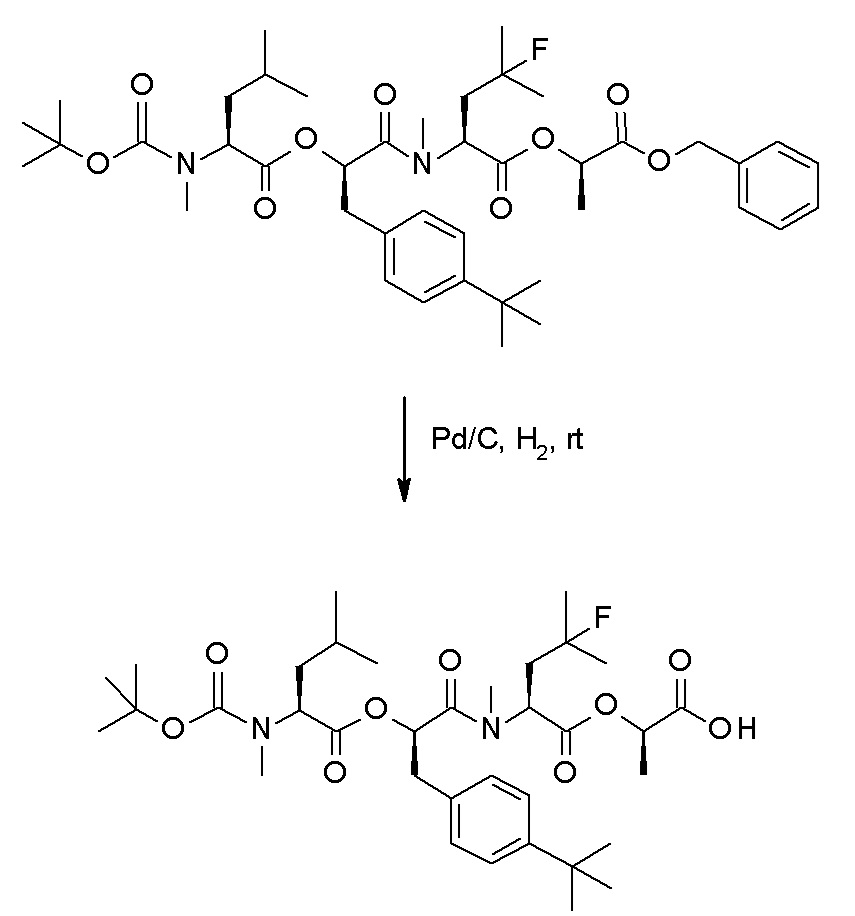
TC18-19. В 100-миллилитровую круглодонную колбу помещали TP18-19 (450 мг, 0,59 ммоль, 1,00 экв.), палладий на угле (200 мг) и метанол (40 мл). Подключали колбу к источнику водорода. Полученную смесь перемешивали в течение 1 часа при комнатной температуре. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. В результате получали 420 мг (сырой продукт) TC18-19 в виде белого твердого вещества. MS (ES, m/z): 667 (M+H).
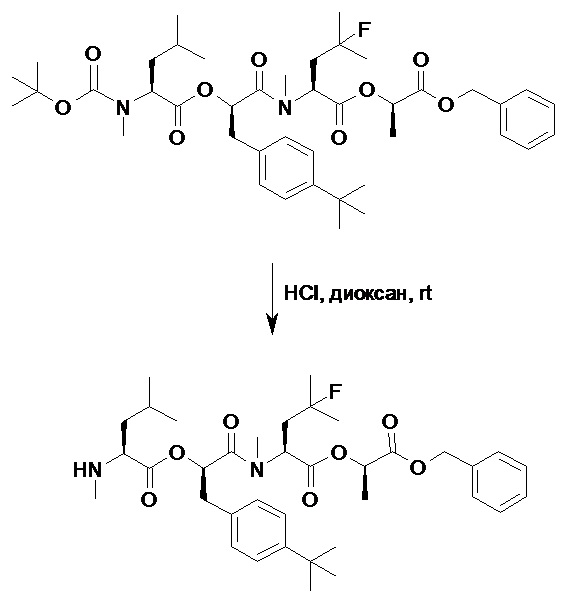
TA18-19. В 100-миллилитровую 3-горлую круглодонную колбу помещали TP18-19 (450 мг, 0,59 ммоль, 1,00 экв.), диоксан (16 мл). Заполняли колбу газообразным HCl. Полученный раствор перемешивали в течение 1 часа при комнатной температуре. Значение pH раствора доводили до 8 добавлением раствора бикарбоната натрия (насыщ.). Полученный раствор экстрагировали 3x15 мл дихлорметана, и органические слои объединяли и промывали 3x20 мл насыщенного раствора хлорида натрия. Органическую фазу собирали, сушили над безводным сульфатом натрия и упаривали в вакууме. В результате получали 400 мг (сырой продукт) TA18-19 в виде желтого масла. MS (ES, m/z): 657 (M+H).

OP18-19. В 100-миллилитровую 3-горлую круглодонную колбу помещали TC18-19 (406 мг, 0,61 ммоль, 1,00 экв.), TA18-19 (400 мг, 0,61 ммоль, 1,00 экв.), дихлорметан (25 мл). Затем добавляли BOP-Cl (311 мг, 2,00 экв.) порциями и DIEA (157,4 мг, 1,22 ммоль, 2,00 экв.) по каплям при перемешивании при 0oC. Полученный раствор перемешивали в течение ночи при комнатной температуре. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:3). В результате получали 460 мг (58%) OP18-19 в виде желтого масла. MS (ES, m/z): 1306 (M+H).

OA18-19. В 100-миллилитровую 3-горлую круглодонную колбу помещали OP18-19 (460 мг, 0,35 ммоль, 1,00 экв.), диоксан (15 мл). Заполняли колбу газообразным HCl. Полученный раствор перемешивали в течение 1 часа при комнатной температуре. Значение pH раствора доводили до 8 добавлением раствора бикарбоната натрия (насыщ.). Полученный раствор экстрагировали 3x20 мл дихлорметана, и органические слои объединяли и промывали 3x30 мл насыщенного раствора хлорида натрия. Органическую фазу собирали, сушили над безводным сульфатом натрия и упаривали в вакууме. В результате получали 350 мг (82%) OA18-19 в виде желтого масла. MS (ES, m/z): 1206 (M+H).

OAC18-19. В 100-миллилитровую круглодонную колбу помещали OC18-19 (350 мг, 0,29 ммоль, 1,00 экв.), палладий на угле (300 мг) и метанол (30 мл). Подключали колбу к источнику водорода. Полученный раствор перемешивали в течение 1 часа при комнатной температуре. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. В результате получали 300 мг (93%) OAC18-19 в виде белого твердого вещества. MS (ES, m/z): 1116 (M+H).

18-19. В 500-миллилитровую 3-горлую круглодонную колбу помещали OAC18-19 (300 мг, 0,27 ммоль, 1,00 экв.), дихлорметан (300 мл). Затем добавляли BOP-Cl (137,2 мг, 0,54 ммоль, 2,00 экв.) порциями и DIEA (69,4 мг, 0,54 ммоль, 3,00 экв.) по каплям при перемешивании при 0oC. Полученный раствор перемешивали в течение ночи при комнатной температуре. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. Сырой продукт очищали методом Преп-ВЭЖХ в следующих условиях: Колонка, SunFire Prep C18 5мкм 19*150мм; подвижная фаза, вода и CH3CN; градиент: от 90% до 95% за 20 мин; Детектор, 220 нм. В результате получали 37,4 мг (13%) 18-19 в виде белого твердого вещества. MS (ES, m/z): 1096,7 (вычислено, M), 1098,0 (найдено, M+H);1H-ЯМР (CD3OD, 300 МГц) δ: 7,50-7,30 (м, 4H), 7,30-7,21 (м, 4H), 5,90-5,10 (м, 7H), 4,87-4,70 (м, 1H), 3,34-2,80 (м, 16H), 2,50-1,92 (м, 4H), 1,71-1,20 (м, 40H), 1,10-0,80 (м, 14H); [α] = -45,82o(T=27,2oC, C=0,625 г/100мл в MeOH).
Пример синтеза 87. Получение соединения 7-18

Соединение 7-18 получали согласно схемам 43-45, приведенным ниже:
Схема 43

Схема 44
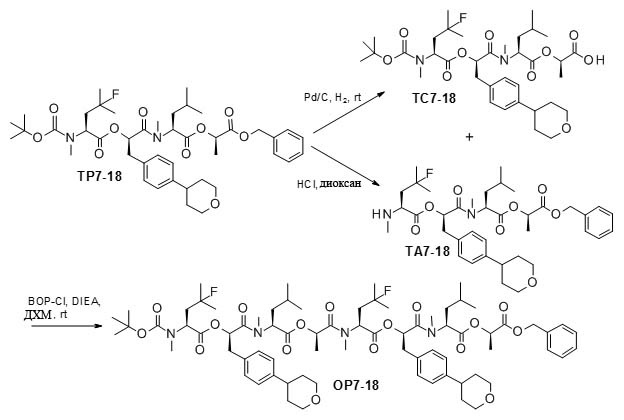
Схема 45

Подробное описание эксперимента
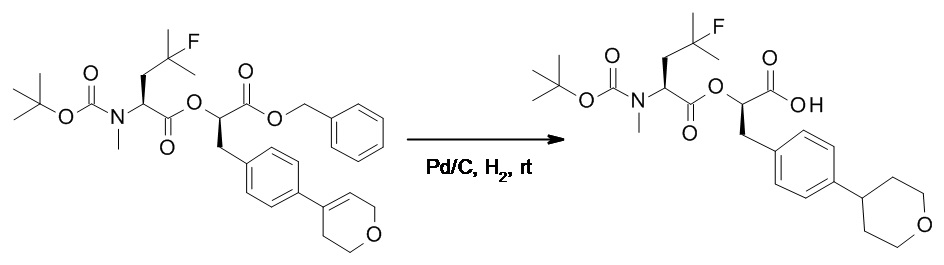
(2R)-2-[[(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноил] окси]-3-[4-(оксан-4-ил)фенил]пропановая кислота. В 250-миллилитровую круглодонную колбу помещали палладий на угле (1,8 г), этилацетат (150 мл), (2R)-1-(бензилокси)-3-[4-(3,6-дигидро-2H-пиран-4-ил)фенил]-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил) амино]-4-фтор-4-метилпентаноат (8,8 г, 15,08 ммоль, 1,00 экв.). Колбу три раза вакуумировали и заполняли азотом, затем продували водородом. Смесь перемешивали 2 часа при комнатной температуре в атмосфере водорода при комнатной температуре. Твердый осадок отфильтровывали. Полученную смесь упаривали в вакууме. В результате получали 7 г (сырой продукт) (2R)-2-[[(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноил]окси]-3-[4-(оксан-4-ил)фенил]пропановой кислоты в виде белого твердого вещества. MS (ES, m/z): 496 (M+H).

(2R)-1-(бензилокси)-1-оксопропан-2-ил-(2S)-4-метил-2-(метиламино)пентаноат. В 50-миллилитровую круглодонную колбу помещали диоксан/HCl (10 мл), (2R)-1-(бензилокси)-1-оксопропан-2-ил (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-метилпентаноат (460 мг, 1,13 ммоль, 1,00 экв.). Полученный раствор перемешивали в течение 1,5 часов при комнатной температуре. Затем реакцию гасили добавлением 10 мл NaHCO3 (водный раствор). Полученный раствор экстрагировали 3x20 мл дихлорметана, и органические слои объединяли. Полученную смесь промывали 3x5 мл насыщенного раствора хлорида натрия. Смесь сушили над безводным сульфатом натрия и упаривали в вакууме. В результате получали 340 мг (98%) (2R)-1-(бензилокси)-1-оксопропан-2-ил (2S)-4-метил-2-(метиламино) пентаноата в виде бесцветного масла. MS (ES,m/z): 308 (M+H).

TP7-18. В 8-миллилитровую круглодонную колбу помещали дихлорметан (80 мл), (2R)-2-[[(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноил]окси]-3-[4-(оксан-4-ил)фенил]пропановую кислоту (3,8 г, 7,67 ммоль, 1,00 экв.), (2R)-1-(бензилокси)-1-оксопропан-2-ил (2S)-4-метил-2-(метиламино)пентаноат (2,8 г, 9,11 ммоль, 1,20 экв.). Затем добавляли BOP-Cl (3,9 г, 15,32 ммоль, 2,00 экв.) порциями при 0oC. Затем добавляли DIEA (3г, 23,22 ммоль, 3,00 экв.) по каплям при перемешивании при 0oC. Полученный раствор перемешивали в течение ночи при комнатной температуре. Полученный раствор разводили в 200 мл ДХМ и промывали насыщенным раствораомхлорида натрия 50 мл x 3. Органические слои объединяли и сушили над безводным сульфатом натрия. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:10-1:3). В результате получали 4,5 г (75%) TP7-18 в виде белого твердого вещества. MS (ES, m/z): 785 (M+H).
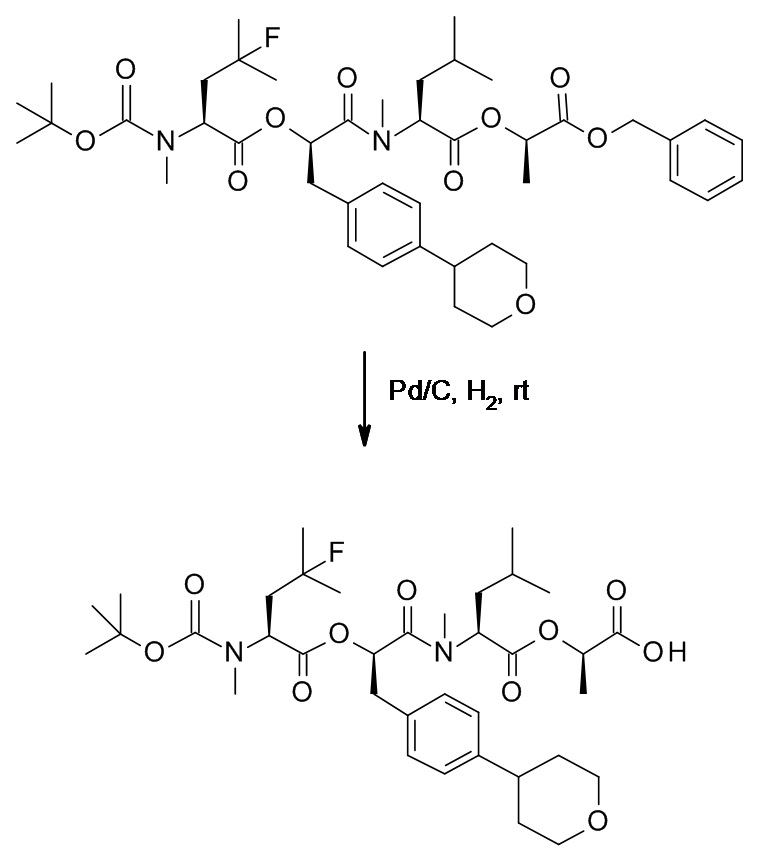
TC7-18. В раствор TP7-18 (1 г, 1,27 ммоль, 1,00 экв.) в этилацетате (10 мл) добавляли палладий на угле (200 мг). Колбу три раза вакуумировали и заполняли азотом, затем продували водородом. Смесь перемешивали 1,5 часа при комнатной температуре в атмосфере водорода. Твердый осадок отфильтровывали. Полученную смесь упаривали в вакууме. В результате получали 880 мг (сырой продукт) TC7-18 в виде белого твердого вещества. MS (ES, m/z): 695 (M+H).

TA7-18. В 50-миллилитровую круглодонную колбу помещали раствор хлороводорода в диоксане (10 мл), TP7-18 (500 мг, 0,64 ммоль, 1,00 экв.). Полученный раствор перемешивали в течение 1,5 часов при комнатной температуре. Полученную смесь упаривали в вакууме. В результате получали 470 мг (сырой продукт) TA7-18 в виде бесцветного масла. MS (ES, m/z): 685 (M+H).

OP7-18. В раствор TC7-18 (440 мг, 0,63 ммоль, 1,00 экв.), TA7-18 (433 мг, 0,63 ммоль, 1,00 экв.) в дихлорметане (8 мл) помещали BOP-Cl (403 мг, 1,58 ммоль, 2,00 экв.) порциями при 0oC. Затем добавляли DIEA (408 мг, 3,16 ммоль, 4,00 экв.) по каплям при перемешивании при 0oC. Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Полученный раствор разводили в 50 мл ДХМ и промывали насыщенным раствором хлорида натрия 10 мл x 3. Органические слои объединяли и сушили над безводным сульфатом натрия. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:5-1:1). В результате получали 760 мг (88%) OP7-18 в виде белого твердого вещества. MS (ES, m/z): 1384( M+Na).

OC7-18. В раствор OP7-18 (760 мг, 0,56 ммоль, 1,00 экв.) в этилацетате (10 мл) добавляли палладий на угле (150 мг). Колбу три раза вакуумировали и заполняли азотом, затем продували водородом. Смесь перемешивали 1,5 часов при комнатной температуре в атмосфере водорода. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. В результате получали 710 мг (100%) OC7-18 в виде белого твердого вещества. MS (ES, m/z): 1262 (Ms+H - Boc).
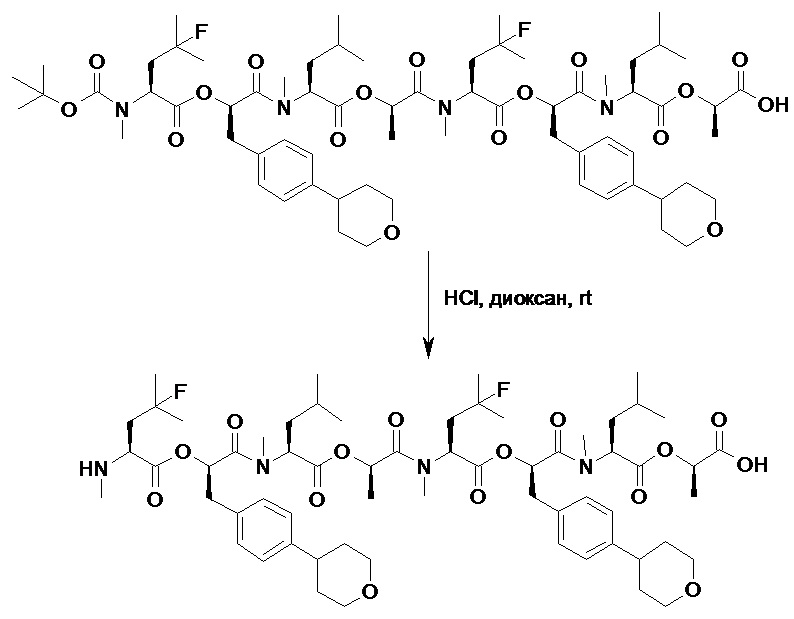
OAC7-18. В 50-миллилитровую круглодонную колбу помещали раствор хлороводород/диоксан (10 мл), OC7-18 (710 мг, 0,56 ммоль, 1,00 экв.). Полученный раствор перемешивали в течение 1,5 часов при комнатной температуре. Полученную смесь упаривали в вакууме. В результате получали 678 мг (сырой продукт) OAC7-18 в виде белого твердого вещества. MS (ES, m/z): 1172 (M+H).

7-18. В раствор OAC7-18 (500 мг, 0,43 ммоль, 1,00 экв.) в дихлорметане (40 мл) добавляли BOP-Cl (217 мг, 0,85 ммоль, 2,00 экв.) порциями при 0oC. Затем добавляли DIEA (275 мг, 2,125 ммоль, 5,00 экв.) по каплям при перемешивании при 0oC. Полученный раствор разводили в 50 мл ДХМ и промывали насыщенным раствором хлорида натрия 10 мл x 3. Органические слои объединяли и сушили над безводным сульфатом натрия. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. Сырой продукт очищали методом препаративной флэш-ВЭЖХ в следующих условиях (IntelFlash-1): Колонка, C18; подвижная фаза, CH3CN/H2O = 50%, с увеличением до CH3CN/H2O = 80% в течение 20 мин; Детектор, УФ 254 нм. В результате получали 294 мг (60%) 7-18 в виде белого твердого вещества. MS (ES, m/z): 1152,6 (вычислено, M), 1154,0 (найдено, M+H);1H ЯМР (300 МГц,CD3OD3): δ 7,28-7,22 (м, 8H), 5,73-5,24 (м, 7H), 4,88 (м, 1H), 4,06-4,02 (д, J = 11,1 Гц, 4H), 3,60-3,52 (м, 4H), 3,33-3,31 (м, 4H), 3,11-2,80 (м, 14H), 2,30-1,91 (м, 4H), 1,80-1,63 (м, 12H), 1,51-1,29 (м, 17H), 0,97-0,82 (м, 15H); [α]= -61,3o (T = 24,7oC, c = 0,82 г/100 мл в MeOH).
Пример синтеза 88. Получение соединения 7-32:

Соединение 7-32 получали согласно схемам 46-48 ниже.
Схема 46

Схема 47

Схема 48
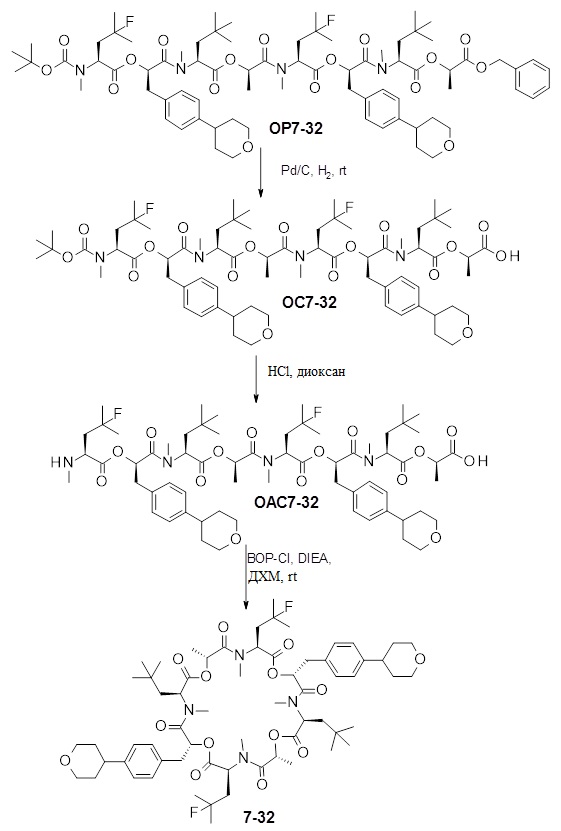
Подробное описание эксперимента

(2R)-1-(бензилокси)-1-оксопропан-2-ил (2S)-4,4-диметил-2-(метиламино)пентаноат. В 500-миллилитровую круглодонную колбу помещали раствор хлороводорода в диоксане (200 мл), (2R)-1-(бензилокси)-1-оксопропан-2-ил (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4,4-диметил пентаноат (23 г, 54,56 ммоль, 1,00 экв.). Полученный раствор перемешивали в течение 3 часов при комнатной температуре. Полученную смесь упаривали в вакууме. В результате получали 26 г (сырой продукт) (2R)-1-(бензилокси)-1-оксопропан-2-ил (2S)-4,4-диметил-2-(метиламино)пентаноата в виде белого твердого вещества. MS (ES, m/z): 322 (M+H).

TP7-32. В 500-миллилитровую 3-горлую круглодонную колбу помещали дихлорметан (400 мл), (2R)-1-(бензилокси)-1-оксопропан-2-ил-(2S)-4,4-диметил-2-(метиламино)пентаноат (14 г, 43,56 ммоль, 1,00 экв.), (2R)-2-[[(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноил]окси]-3-[4-(оксан-4-ил)фенил]пропановую кислоту (21,58 г, 43,54 ммоль, 1,00 экв.). Затем добавляли BOP-Cl (22 г, 86,42 ммоль, 2,00 экв.) порциями при 0oC. Затем добавляли DIEA (22 г, 170,23 ммоль, 4,00 экв.) по каплям при перемешивании при 0oC. Полученный раствор перемешивали в течение ночи при комнатной температуре. Полученную смесь упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:10-1:5). В результате получали 32 г (92%) TP7-32 в виде бесцветного масла. MS (ES, m/z): 799 (M+H).
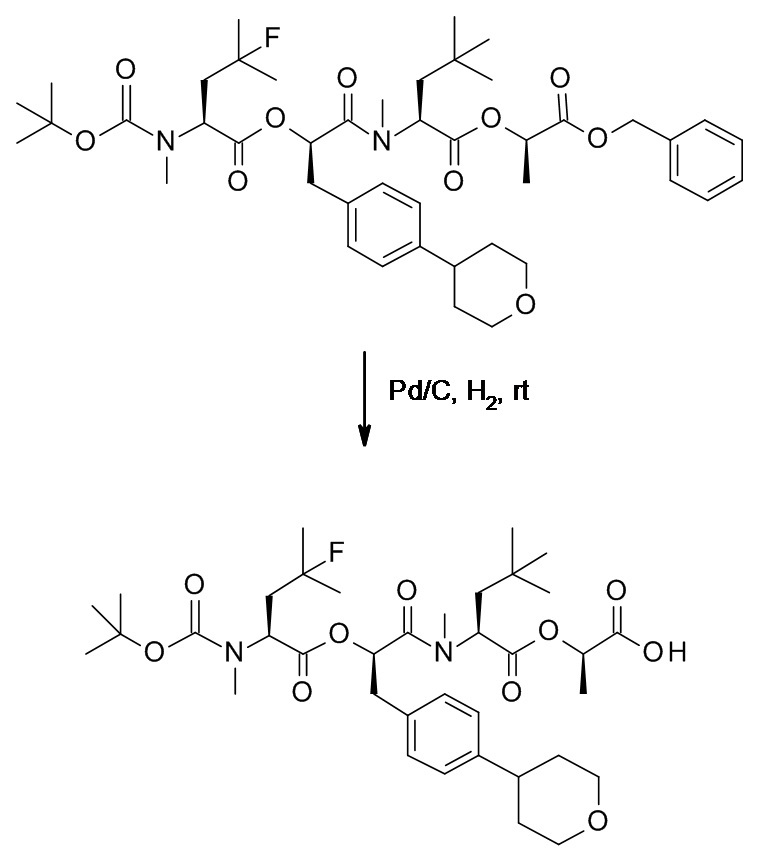
TC7-32. В 500-миллилитровую круглодонную колбу помещали палладий на угле (3,2 г), этилацетат (300 мл), TP7-32 (16 г, 20,03 ммоль, 1,00 экв.). Колбу три раза вакуумировали и заполняли азотом, затем продували водородом. Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. В результате получали 14 г (99%) TC7-32 в виде белого твердого вещества. MS (ES, m/z): 709 (M+H).

TA7-32. В 500-миллилитровую круглодонную колбу помещали раствор хлороводорода в диоксане (300 мл), TP7-32 (16 г, 20,03 ммоль, 1,00 экв.). Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Полученную смесь упаривали в вакууме. В результате получали 15 г (сырой продукт) TA7-32 в виде белого твердого вещества. MS (ES, m/z): 699 (M+H).

OP7-32. В 500-миллилитровую круглодонную колбу помещали дихлорметан (400 мл), TA7-32 (14 г, 20,03 ммоль, 1,00 экв.), TC7-32 (13,8 г, 19,47 ммоль, 1,00 экв.). Затем добавляли BOP-Cl (10 г, 39,28 ммоль, 2,00 экв.) порциями при 0oC. Затем добавляли DIEA (10 г, 77,38 ммоль, 4,00 экв.) по каплям при перемешивании при 0oC. Полученный раствор перемешивали в течение 3 часов при комнатной температуре. Полученную смесь упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:10-1:2). В результате получали 26,7 г (96%) OP7-32 в виде не совсем белого масла. MS (ES, m/z): 1412 (M+Na).

OC7-32. В 1-литровую круглодонную колбу помещали палладий на угле (5 г), этилацетат (500 мл), OP7-32 (26,7 г, 19,22 ммоль, 1,00 экв.). Колбу три раза вакуумировали и заполняли азотом, затем продували водородом. Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Твердый осадок отфильтровывали. Полученную смесь упаривали в вакууме. В результате получали 24,8 г (99%) OC7-32 в виде белого твердого вещества. MS (ES, m/z): 1300 (M+H).

OAC7-32. В 1-литровую круглодонную колбу помещали раствор хлороводород/диоксан (500 мл), OC7-32 (24,8 г, 19,09 ммоль, 1,00 экв.). Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Полученную смесь упаривали в вакууме. В результате получали 24 г (сырой продукт) OAC7-32 в виде белого твердого вещества. MS (ES, m/z): 1200 (M+H).

7-32. В 1-литровую круглодонную колбу помещали дихлорметан (800 мл), OAC7-32 (24 г, 20,02 ммоль, 1,00 экв.). Затем добавляли BOP-Cl (10 г, 39,28 ммоль, 2,00 экв.) порциями при 0oC. Затем добавляли DIEA (10 г, 77,38 ммоль, 4,00 экв.) по каплям при перемешивании при 0oC. Полученный раствор перемешивали в течение ночи при комнатной температуре. Полученную смесь упаривали в вакууме. Сырой продукт очищали методом препаративной флэш-ВЭЖХ в следующих условиях (IntelFlash-1): Колонка, C18 силикагель; подвижная фаза, CH3CN/H2O = 60% с увеличением до CH3CN/H2O = 90% в течение 20 мин; Детектор, УФ 220 нм. В результате получали 14,5 г (61%) 7-32 в виде белого твердого вещества. MS (ES, m/z): 1180,7 (вычислено, M), 1182,0 (найдено, M+H);1H ЯМР: (300 МГц, CDCl3, м.д.): δ 7,22-7,09 (м, 8H), 5,77-5,31 (м, 8H), 4,75-4,65 (м, 1H), 4,11-4,07 (м, 4H), 3,57-3,50 (м, 4H), 3,18-3,0 (м, 6H), 2,83-2,72 (м, 12H), 2,4-1,7 (м, 15H), 1,52-0,78 (м, 40H); [α]= -53,26o (T=27,2oC, c= 0,52г/100мл в MeOH).
Пример синтеза 89. Получение соединения 5-32
Соединение 5-32 получали согласно способу, показанному на схемах 49-51 ниже.
Схема 49

Схема 50

Схема 51

Подробное описание эксперимента

(2R)-2-[[(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноил] окси]-3-[4-(трифторметокси)фенил]пропановая кислота. В 250-миллилитровую круглодонную колбу помещали (2R)-1-(бензилокси)-3-[4-(трифторметокси)фенил]пропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноат (3 г, 5,25 ммоль, 1,00 экв.), Pd/C (500 мг), метанол (80 мл). Подключали колбу к источнику водорода. Полученный раствор перемешивали в течение 1,5 часов при комнатной температуре. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. В результате получали 2 г (77%) (2R)-2-[[(2S)-2-[[(трет-бутокси) карбонил](метил)амино]-4-фтор-4-метилпентаноил] окси]-3-[4-(трифторметокси)фенил]пропановой кислоты в виде белого твердого вещества. MS (ES, m/z): 496 (M+H).
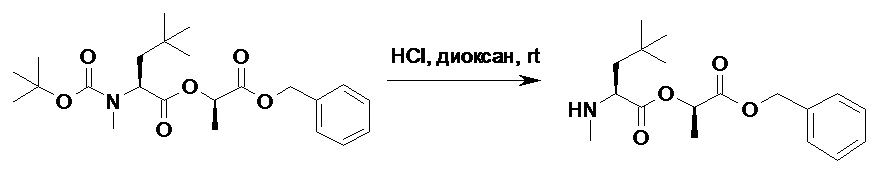
(2R)-1-(бензилокси)-1-оксопропан-2-ил-(2S)-4,4-диметил-2-(метиламино)пентаноат. В 250-миллилитровую круглодонную колбу помещали (2R)-1-(бензилокси)-1-оксопропан-2-ил-(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4,4-диметилпентаноат (3 г, 7,12 ммоль, 1,00 экв.), дихлорметан (80 мл). Заполняли колбу газообразным HCl. Полученный раствор перемешивали в течение 1,5 часов при комнатной температуре. Значение pH раствора доводили до 8 добавлением раствора бикарбоната натрия (насыщ.). Полученный раствор экстрагировали 3x70 мл дихлорметана, и органические слои объединяли и промывали 3x100 мл насыщенного раствора хлорида натрия. Органическую фазу собирали, сушили над безводным сульфатом натрия и упаривали в вакууме. В результате получали 2,1 г (92%) (2R)-1-(бензилокси)-1-оксопропан-2-ил-(2S)-4,4-диметил-2-(метиламино)пентаноата в виде желтого масла. MS (ES, m/z): 322 (M+H).

TP5-32. В 250-миллилитровую 3-горлую круглодонную колбу помещали (2R)-2-[[(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноил]окси]-3-[4-(трифторметокси)фенил]пропановую кислоту (2 г, 4,04 ммоль, 1,00 экв.), (2R)-1-(бензилокси)-1-оксопропан-2-ил (2S)-4,4-диметил-2-(метиламино)пентаноат (1,3 г, 4,04 ммоль, 1,00 экв.), дихлорметан (100 мл). Затем добавляли BOP-Cl (2,1 г, 8,25 ммоль, 2,00 экв.) при перемешивании при 0oC порциями. Затем добавляли DIEA (1,1 г, 8,51 ммоль, 2,00 экв.) по каплям при перемешивании при 0oC. Полученный раствор перемешивали в течение ночи при комнатной температуре. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. Остаток наносили на колонку с силикагелем, элюируя смесью этилацетат/ петролейный эфир (1:5). В результате получали 1,4 г (43%) TP5-32 в виде желтого масла. MS (ES, m/z): 799 (M+H).
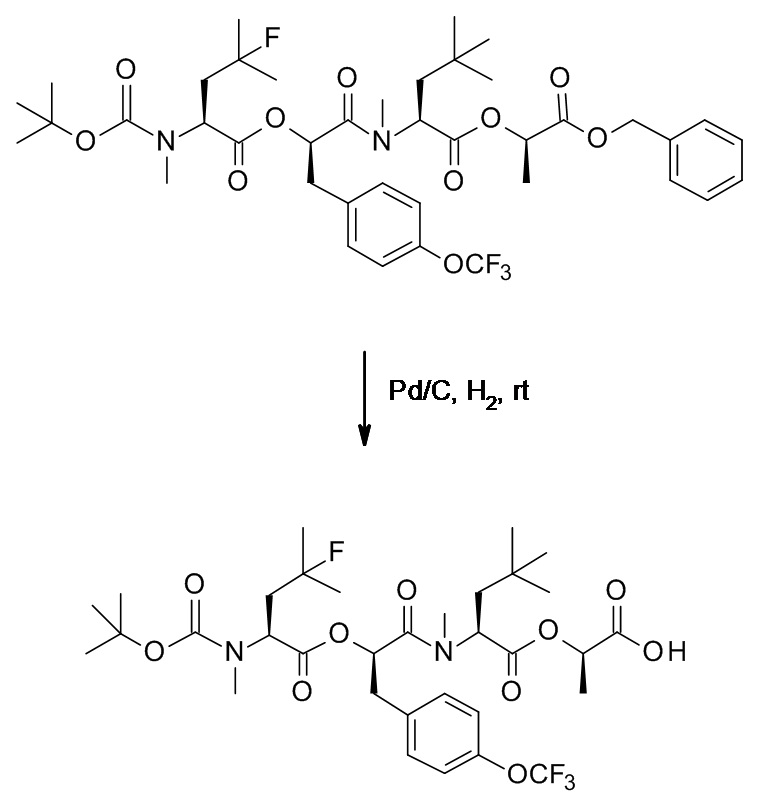
TC5-32. В 100-миллилитровую круглодонную колбу помещали TP5-32 (700 мг, 0,88 ммоль, 1,00 экв.), палладий на угле (120 мг), метанол (30 мл). Подключали колбу к источнику водорода. Полученный раствор перемешивали в течение 1,5 часов при комнатной температуре. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. Полученную смесь упаривали в вакууме. В результате получали 610 мг (98%) TC5-32 в виде белого твердого вещества. MS (ES, m/z): 709 (M+H).

TA5-32. В 100-миллилитровую круглодонную колбу помещали TP5-32 (700 мг, 0,88 ммоль, 1,00 экв.), дихлорметан (35 мл). Заполняли колбу газообразным HCl. Полученный раствор перемешивали в течение 1,5 часов при комнатной температуре. Значение pH раствора доводили до 8 добавлением раствора бикарбоната натрия (насыщ.). Полученный раствор экстрагировали 3x30 мл дихлорметана, органические слои объединяли и промывали 3x30 мл насыщенного раствора хлорида натрия. Органическую фазу собирали, сушили над безводным сульфатом натрия и упаривали в вакууме. В результате получали 600 мг (98%) TA5-32 в виде желтого масла. MS (ES, m/z): 699 (M+H).

OP5-32. В 250-миллилитровую 3-горлую круглодонную колбу помещали TA5-32 (600 мг, 0,86 ммоль, 1,00 экв.), TC5-32 (609 мг, 0,86 ммоль, 1,00 экв.), дихлорметан (80 мл). Затем добавляли BOP-Cl (439 мг, 1,72 ммоль, 2,00 экв.) при перемешивании при 0oC порциями. Затем добавляли DIEA (222 мг, 1,72 ммоль, 2,00 экв.) по каплям при перемешивании при 0oC. Полученный раствор перемешивали в течение ночи при комнатной температуре. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:2). В результате получали 830 мг (70%) OP5-32 в виде желтого масла. MS (ES, m/z): 1390 (M+H).
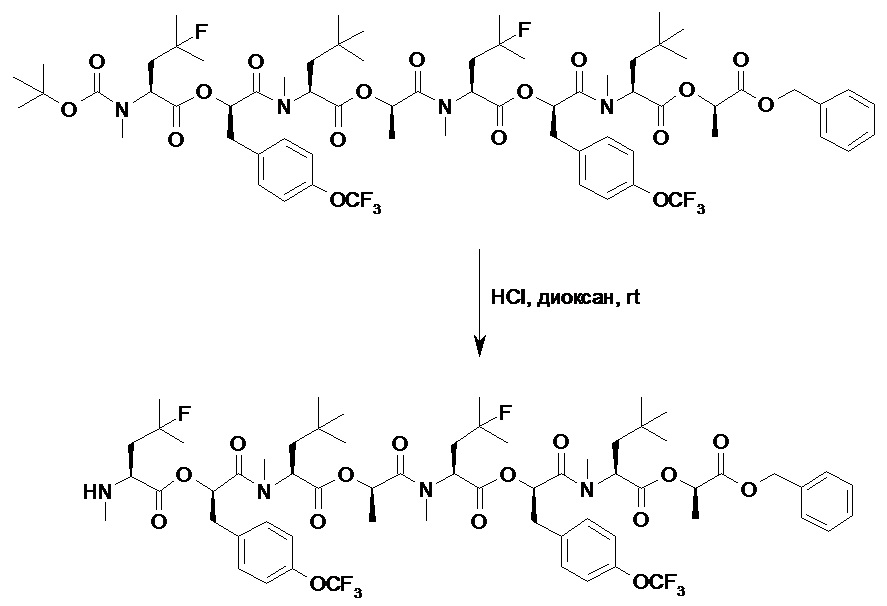
OA5-32. В 100-миллилитровую круглодонную колбу помещали OP5-32 (830 мг, 0,60 ммоль, 1,00 экв.), дихлорметан (50 мл). Заполняли колбу газообразным H2. Полученный раствор перемешивали в течение 1,5 часов при комнатной температуре. Значение pH раствора доводили до 8 добавлением раствора бикарбоната натрия (насыщ.). Полученный раствор экстрагировали 3x30 мл дихлорметана, и органические слои объединяли. Органическую фазу промывали 3x30 мл насыщенного раствора хлорида натрия, сушили над безводным сульфатом натрия и упаривали в вакууме. В результате получали 700 мг (91%) OA5-32 в виде желтого масла. MS (ES, m/z): 1290 (M+H).

OAC5-32. В 100-миллилитровую круглодонную колбу помещали OA5-32 (700 мг, 0,54 ммоль, 1,00 экв.), палладий на угле (150 мг), метанол (40 мл). Заполняли колбу газообразным H2. Полученный раствор перемешивали в течение 1,5 часов при комнатной температуре. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. В результате получали 600 мг (92%) OAC5-32 в виде белого твердого вещества. MS (ES, m/z): 1200 (M+H).

5-32. В 250-миллилитровую 3-горлую круглодонную колбу помещали продукт OAC5-32 (600 мг, 0,50 ммоль, 1,00 экв.), дихлорметан (120 мл). Затем порциями добавляли BOP-Cl (255 мг, 1,00 ммоль, 2,00 экв.) при перемешивании при 0oC. Затем добавляли DIEA (129 мг, 1,00 ммоль, 2,00 экв.) по каплям при перемешивании при 0oC. Полученный раствор перемешивали в течение ночи при комнатной температуре. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. Сырой продукт очищали методом Преп-ВЭЖХ в следующих условиях: Колонка, SunFire Prep C18 5мкм 19*150мм; подвижная фаза, вода и CH3CN; Градиент: от 90% до 95% за 20 мин; Детектор, 220 нм. В результате получали 350 мг (59%) 5-32 в виде белого твердого вещества. MS (ES, m/z): 1180,5 (вычислено, M), 1181,5 (найдено, M+H);1H ЯМР (300 МГц,CD3OD): δ 7,48-7,40 (м, 4H), 7,29-7,22 (м, 4H), 5,68-4,89 (м, 8H), 3,34- 2,82 (м, 16H), 2,30-1,70 (м, 8H), 1,60-1,10 (м, 18H), 1,05 - 1,02 (м, 2H), 0,99-0,80 (м, 16H); [α]= -34,64o, T=27,2oC, c=1,085г/100 мл в MeOH.
Пример синтеза 90. Соединение 18-32
Соединение 18-32 получали согласно способу, описанному на схемах 52-54 ниже.
Схема 52

Схема 53

Схема 54

Подробное описание эксперимента

(2R)-2-[[(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноил] окси]-3-(4-трет-бутилфенил)пропановая кислота. В раствор (2R)-1-(бензилокси)-3-(4-трет-бутилфенил)-1-оксопропан-2-ил (2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноата (15 г, 26,90 ммоль, 1,00 экв.) в метаноле (150 мл) добавляли палладий на угле (1,5 г, 0,10 экв.). Колбу три раза вакуумировали и заполняли азотом, затем продували водородом. Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. В результате получали 12,0 г (95%) (2R)-2-[[(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноил]окси]-3-(4-трет-бутилфенил)пропановой кислоты в виде белого твердого вещества. MS (ES, m/z): 488 (M+H).

TP18-32. В 500-миллилитровую 3-горлую круглодонную колбу в инертной атмосфере азота помещали раствор (2R)-2-[[(2S)-2-[[(трет-бутокси)карбонил](метил)амино]-4-фтор-4-метилпентаноил]окси]-3-(4-трет-бутилфенил) пропановой кислоты (12 г, 25,66 ммоль, 1,00 экв.) в дихлорметане (150 мл), (2R)-1-(бензилокси)-1-оксопропан-2-ил (2S)-4,4-диметил-2-(метиламино)пентаноат гидрохлорид (9,13 г, 25,51 ммоль, 1,00 экв.), BOP-Cl (13,0 г, 51,07 ммоль, 2,00 экв.), DIEA (6,6 г, 51,07 ммоль, 2,00 экв.) при 0oC. Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Полученную смесь упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:100~1:10). В результате получали 17,14 г (87%) TP18-32 в виде белого твердого вещества. MS (ES, m/z): 771 (M+H).
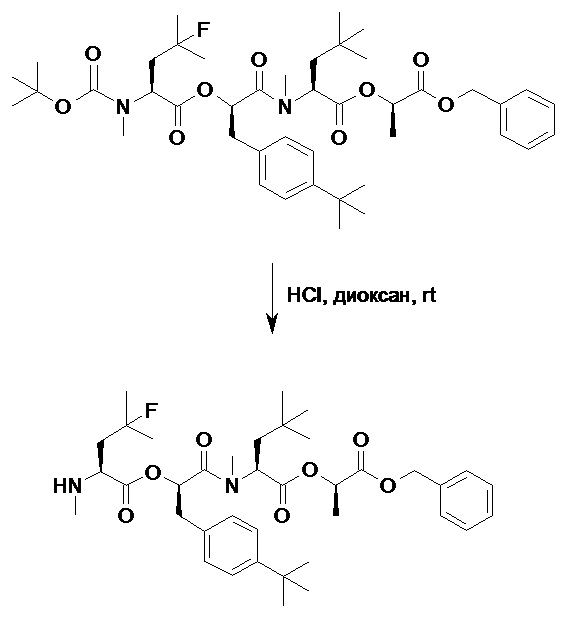
TA18-32. В 500-миллилитровую 3-горлую круглодонную колбу помещали раствор TP18-32 (9,57 г, 12,41 ммоль, 1,00 экв.) в смеси хлороводорода (газ) и диоксана (200 мл). Полученный раствор перемешивали в течение 30 минут при комнатной температуре. Полученную смесь упаривали в вакууме. В результате получали 9,22 г (сырой продукт) TA18-32 в виде белого твердого вещества. MS (ES, m/z): 671 (M+H).

TC18-32. To раствор TP18-32 (9,57 г, 12,41 ммоль, 1,00 экв.) в метаноле (100 мл) добавляли палладий на угле (957 мг, 0,10 экв.). Колбу три раза вакуумировали и заполняли азотом, затем продували водородом. Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Твердый осадок отфильтровывали. Фильтрат упаривали в вакууме. В результате получали 8,33 г (99%) TC18-32 в виде белого твердого вещества. MS (ES, m/z): 681 (M+H).

OP18-32. В 500-миллилитровую 3-горлую круглодонную колбу в инертной атмосфере азота помещали раствор TA18-32 (8,54 г, 12,07 ммоль, 1,00 экв.) в дихлорметане (150 мл), TC18-32 (8,23 г, 12,09 ммоль, 1,00 экв.), BOP-Cl (6,15 г, 24,16 ммоль, 2,00 экв.), DIEA (3,12 г, 24,14 ммоль, 2,00 экв.) at 0oC. Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Полученную смесь упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:50~1:10). В результате получали 13,0 г (81%) OP18-32 в виде белого твердого вещества. MS (ES, m/z): 1356 (M+Na).
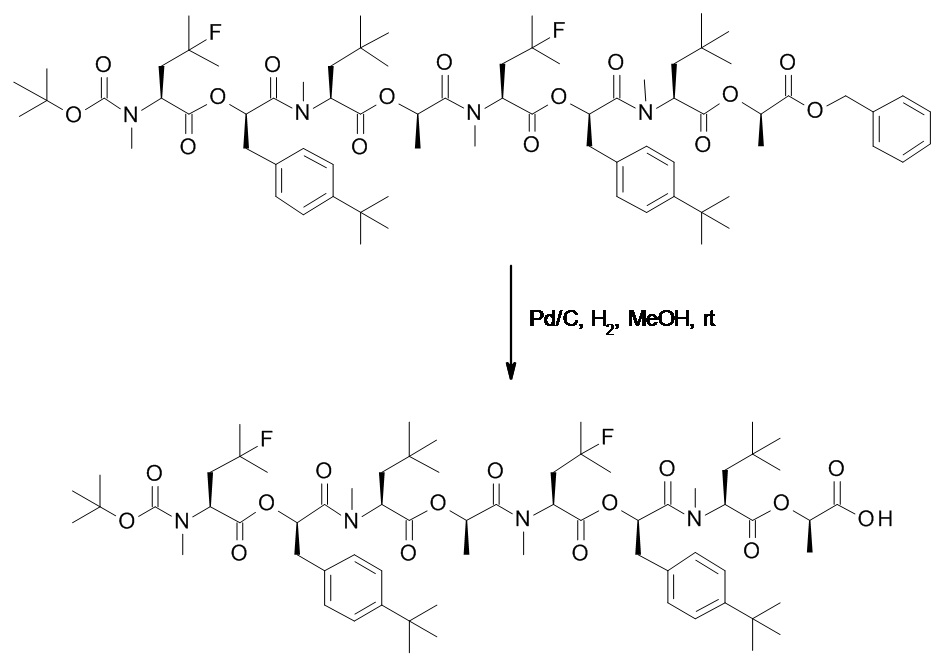
OC18-32. В раствор OP18-32 (13 г, 9,75 ммоль, 1,00 экв.) в метаноле (150 мл) добавляли палладий на угле (1,3 г, 0,10 экв.). Колбу три раза вакуумировали и заполняли азотом, затем продували водородом. Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Твердый осадок отделяли фильтрованием. Полученную смесь упаривали в вакууме. В результате получали 11,52 г (95%) OC18-32 в виде белого твердого вещества. MS (ES, m/z): 1266 (M+Na).
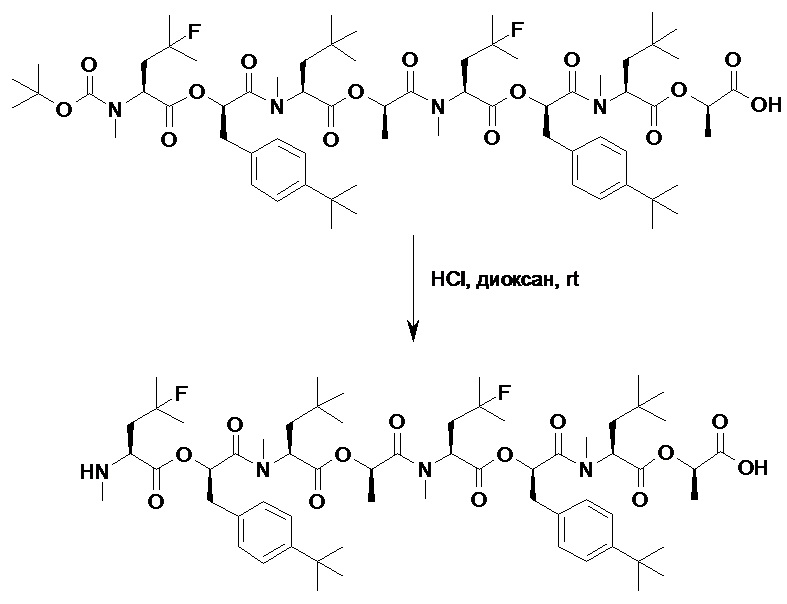
OAC18-32. В раствор OC18-32 (11,52 г, 9,27 ммоль, 1,00 экв.) в дихлорметане (150 мл) добавляли раствор хлороводорода в диоксане. Полученный раствор перемешивали в течение 30 минут при комнатной температуре. Полученную смесь упаривали в вакууме. В результате получали 10,1 г (95%) OAC18-32 в виде белого твердого вещества. MS (ES, m/z): 1144 (M+H).

18-32
18-32. В 500-миллилитровую 3-горлую круглодонную колбу в инертной атмосфере азота помещали раствор OAC18-32 (10,1 г, 8,84 ммоль, 1,00 экв.) в дихлорметане (150 мл), BOP-Cl (4,5 г, 17,68 ммоль, 2,00 экв.), DIEA (2,3 г, 17,80 ммоль, 2,00 экв.) при 0oC. Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Полученную смесь упаривали в вакууме. Остаток наносили на колонку с силикагелем, используя в качестве элюента смесь этилацетат/петролейный эфир (1:100~1:20). В результате получали 5,452 г (55%) 18-32 в виде белого твердого вещества. MS (ES, m/z): 1124,7 (вычислено, M), 1126,0 (найдено, M+H);1H ЯМР (300 МГц, CDCl3): δ 7,33-7,27 (м, 4H), 7,18-7,14 (м, 4H), 5,80-5,75 (м, 1H), 5,70-5,55 (м, 1H), 5,49-5,29 (м, 5H), 5,20-5,10 (м, 1H), 4,72-4,60 (м, 1H), 3,16-3,03 (м, 6H), 2,98-2,60 (м, 10H), 2,26-2,15 (м, 2H), 1,95-1,87 (м, 4H), 1,51-0,70 (м, 56H); [α]= -37o (T = 27,2oC, c = 1,0 г/100 мл в MeOH).
Помимо депсипептидных соединений по настоящему изобретению, описанных в примерах 83-90, были получены дополнительные пронумерованные соединения, приведенные ниже в таблице 113 (которые описаны выше в таблицах 2-112, где R’, R’’, R’’’ и R’’’’ каждый представляют собой метил), согласно методикам синтеза, описанным в примерах, за исключением того, что были выбраны димерные соединения (например, димеры от D1 до D57), имеющие целевую функциональность, для получения целевых депсипептидных соединений. Выбранные димеры были в свою очередь получены из необходимых мономерных соединений (например, из мономерных соединений M1 - M49). Квалифицированным специалистам в данной области будет понятно, что при использовании этой методологии можно получить дополнительные депсипептидные соединения по настоящему изобретению с применением других мономерных и димерных компонентов.
Таблица 113. Полученные дополнительные соединения, имеющие формулу (I)
Данные LCMS, приведенные выше в таблице 113, были получены на нескольких приборах, и для анализа применялись различные программы. Поэтому некоторые из данных были автоматически округлены для отражения моноизотопного состава, и в некоторых данных присутствует дефект массы.
Примеры биологической активности
Метод A. Метод скрининга для теста активности соединений в отношении Haemonchus contortus
Двадцать L1 личинок Haemonchus contortus помещали в лунки микропланшета, содержащие питательную среду и тестируемое соединение в ДМСО. Анализ проводили на 4-й день для определения степени развития личинок. Личинки, подвергавшиеся обработке только ДМСО, использовали в качестве контроля. Активность соединений оценивали в формате MIC90 и/или EC50. Соединения 2-3, 2-4, 2-15, 3-20, 3-26, 3-27, 3-31, 4-20, 4-27, 6-3, 6-7, 6-24, 6-26, 6-33, 6-39, 7-38, 7-49, 7-50, 10-18, 11-18, 15-27, 16-27, 18-19 и 23-27 показали медианные значения MIC90 между 1,0 и 10 мкM, соединения 2-16, 2-20, 33-18, 4-26, 4-31, 5-27, 6-20, 6-32, 7-42, 26-27, 27-27, 35-27 и 36-18 показали медианные значения MIC90 между 0,1 мкM и 1,0 мкM, и соединения 2-18, 30-18, и 30-27 показали медианные значения MIC90 меньше 0,1 мкM при оценке через 4 дня. Для сравнения, PF1022A и эмодепсид показали медианные значения MIC90 между 1 мкM и 0,1 мкM в данном анализе. Соединения 6-16, 6-42, 6-45, 7-18, 7-27, 7-40, 7-45, 18-18, 18-32, 32-27, 35-32 и 37-18 показали медианные значения EC50 между 1,0 и 10 мкM, соединения 3-18, 4-18, 5-32, 6-18, 6-44, 7-31, 7-37 и 30-32 показали медианные значения EC50 между 0,1 мкM и 1,0 мкM, и соединения 7-32, 7-44, 31-18, 31-27 и 35-18 показали медианные значения EC50 меньше 0,1 мкM при оценке через 4 дня. Для сравнения, эмодепсид показал медианное значение EC50 между 1 мкM и 0,1 мкM в данном анализе.
Метод B. Метод скрининга для теста активности соединений в отношении микрофилярий Dirofilaria immitis
Микрофилярии Dirofilaria immitis помещали в лунки микропланшета, содержащие буферный раствор и тестируемое соединение в ДМСО. Анализ проводили через 72 часа, оценивая выживаемость микрофилярий. Микрофилярии подвергавшиеся обработке только ДМСО, использовали в качестве контроля. Соединения 3-6, 3-7, 3-19, 3-26, 6-18, 6-19, 6-26, 6-36, 6-37, 6-38, 6-40, 6-41, 6-43, 6-45, 6-46, 7-41, -19, 9-27, 10-27, 13-18, 14-27, 18-6, 19-18, 19-27, 21-27, 24-18, 24-27 и 32-32 показали медианные значения EC50 между 1 мкМ и 10 мкМ, соединения 2-10, 3-8, 4-19, 4-32, 5-32, 6-3, 6-6, 6-7, 6-8, 6-20, 6-24, 6-33, 6-39, 6-42, 7-38, 7-46, 7-49, 7-50, 9-6, 9-18, 10-18, 11-27, 20-27, 22-27, 25-8, 28-27, 32-27, 35-32, 37-18 и 38-18 показали медианные значения EC50 между 0,1 мкМ и 1,0 мкМ, и соединения 2-3, 2-4, 2-6, 2-8, 2-15, 2-16, 2-18, 2-20, 3-18, 3-20, 3-27, 3-31, 4-18, 4-20, 4-26, 4-27, 4-31, 5-27, 6-16, 6-18, 6-32, 6-44 7-18, 7-27, 7-31, 7-32, 7-37, 7-40, 7-42, 7-44, 7-45, 11-18, 15-27, 16-27, 18-18, 18-19, 18-32, 23-27, 25-6, 26-27, 27-27, 30-18, 30-27, 30-32, 31-18, 31-27, 32-18, 35-18 и 36-18 показали медианные значения EC50 меньше 0,1 мкМ. Для сравнения, эмодепсид показал медианное значение EC50 между 1 мкМ и 0,1 мкМ в данном анализе, и PF1022A показал медианное значение EC50 меньше 0,1 мкМ.
Метод C. Метод скрининга для теста активности соединений в отношении блох после проглатывания
В цилиндрический контейнер для проведения теста помещали 10 взрослых особей Ctenocephalides felis. Цилиндрическую ячейку закрывали с одного конца самогерметизирующейся эластичной пленкой и помещали на контейнер для проведения теста таким образом, чтобы блохи могли протыкать пленку и питаться содержимым цилиндра. Затем раствор тестируемого соединения прикапывали пипеткой в бычью кровь и добавляли в ячейку. Часть контейнера, в которой находились Ctenocephalides felis, поддерживали при 20-22°C и 40-60% относительной влажности, в то время как часть с ячейкой, содержащей обработанную кровь, поддерживали при 37°C и 40-60% относительной влажности. Оценку проводили через 72 часа после начала, в сравнении с необработанным контролем. Соединения 6-7, 6-8, 6-16, 6-19, 6-20, 7-27, 7-32 и 7-42 все показали средние EC50 значения 10-50 м.д.. Соединения 3-18, 4-26, 5-27, 6-32, 6-39, 6-41, 27-27, 30-27 и 36-18 все показали средние EC50 значения 50-200 м.д.. Для сравнения, эмодепсид показал среднее EC50 значение 10-50 м.д..
Метод D. Метод скрининга для теста активности соединений в отношении Dirofilaria immits in vivo
Собак породы бигль тестировали на микрофиллярии и антиген сердечного гельминта и проводили их полное физическое обследование перед включением в эксперимент. Каждой собаке инокулировали 50 инвазионных личинок 3-й стадии D. immitis в День -30 или День -29 (используя изоляты либо с пониженной сензитивностью к макроциклическим лактонам, включая ивермектин (R), либо сензитивные к макроциклическим лактонам в стандартной дозировке (S) в тестах 1 или 2, соответственно). Тестирование на антиген проводили для крови, взятой в День 90, при подтверждении, что животные не контактировали с D. immitis до намеренного инфицирования.
В тесте 1, формировалось пять блоков по четыре собаки в каждой, по результатам снижения веса тела с Дня -14 до Дня -7. В каждом блоке собак случайным образом распределяли в одну из пяти групп посредством жребия и вводили перорально пять раз с интервалом в один месяц пероральный раствор ивермектина и соединения по настоящему изобретению с интервалами дозирования согласно приведенной далее таблице 114.
В тесте 2, формировалось два блока по четыре собаки в каждой, по результатам снижения веса тела с Дня -3 до Дня 0. В каждом блоке собак случайным образом распределяли в одну из двух групп посредством жребия и вводили пероральный раствор соединения по настоящему изобретению в двух дозировках и с двумя разными интервалами дозирования: либо 3 дозировки с интервалом в месяц плюс одна доза за 1 день до вскрытия, либо 5 дозировок с интервалом в месяц, как описано в приведенной далее таблице 41.
Таблица 114. Эффективность против D. immitis у биглей
Всех животных гуманно умерщвляли в День 150 или День 155 (тесты 1 и 2, соответственно), и проводили некропсию, выявляя число живых паразитов D. Immitis для каждой отдельной собаки. Проценты эффективности по группам приведены в таблице 114.
В тесте 1, соединения по настоящему изобретению (в дозировке 1,0 или 2,5 мг/кг), вводимые перорально (в растворе) в комбинации с ивермектином (в дозировке 6 мкг/кг) в виде пяти доз с интервалом в месяц, обеспечили 100% эффективность против индуцированных инфекций R изолятом Dirofilaria immitis. Эмодепсид обеспечил 98,8% эффективность при таком же введении (в растворе в дозировке 2,5 мг/кг с 6 мкг/кг ивермектина).
В тесте 2, соединение 7-18 по настоящему изобретению (в дозировке 2,5 или 0,5 мг/кг) вводимое перорально (в растворе) в виде пяти или четырех доз, соответственно, обеспечило 100% эффективность против индуцированных инфекций S изолятом Dirofilaria immitis.
* * *
Хотя выше были подробно описаны предпочтительные варианты осуществления настоящего изобретения, следует понимать, что настоящее изобретение, описанное выше, не ограничивается частными деталями, указанными в приведенном выше описании, поскольку возможно много очевидных вариаций без выхода за рамки сути и объема настоящего изобретения.
Реферат
Изобретение относится к циклическим депсипептидным соединениям формулы (I), где Cy, Cy, R-R, R'-R'''', R-Rуказаны в формуле изобретения, и композициям, содержащим указанные соединения, которые можно применять для борьбы с паразитами в организмах млекопитающих и птиц или на их покровах. В настоящем изобретении описаны также улучшенные способы избавления, борьбы и предотвращения заражения паразитами птиц и млекопитающих. 7 н. и 39 з.п. ф-лы, 40 табл., 90 пр.
Формула
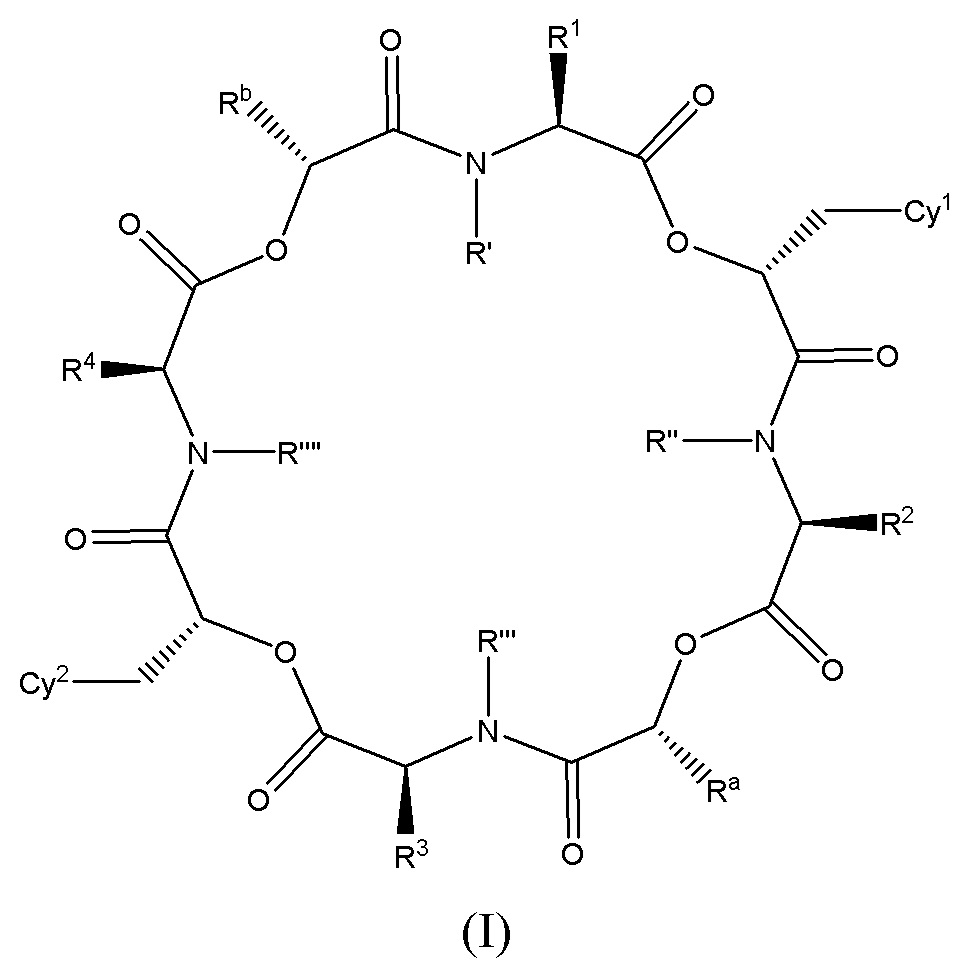





Документы, цитированные в отчёте о поиске
Эндопаразитицидные средства











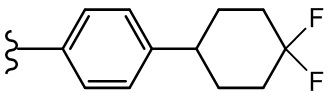





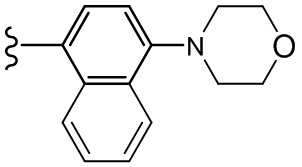

Комментарии